Кристаллические соли эффективного ингибитора вируса гепатита с
Формула / Реферат
1. Кристаллическая соль соединения формулы (1) и трометамина:
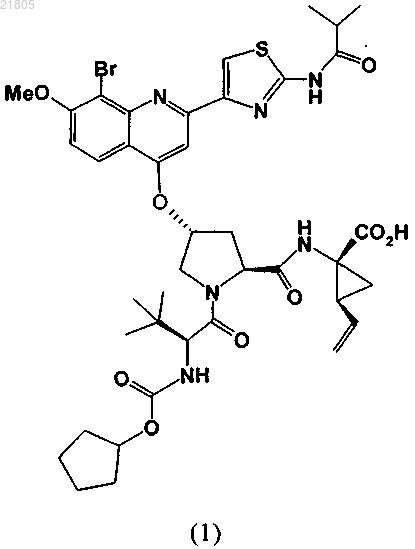
2. Кристаллическая соль по п.1, на порошковой рентгеновской дифрактограмме которой наблюдается пик при 5,9° 2θ (±0,2° 2θ) при измерении с использованием излучения CuKα.
3. Кристаллическая соль по п.1, на спектре 13С твердотельного ЯМР которой наблюдаются пики с химическими сдвигами при 178,3, 138,1 и 27,1 м.д. (±0,2 м.д.).
4. Кристаллическая соль по п.1, на порошковой рентгеновской дифрактограмме которой наблюдается пик при 5,9° 2θ (±0,2° 2θ) при измерении с использованием излучения CuKα, a на спектре 13С твердотельного ЯМР которой наблюдаются пики с химическими сдвигами при 178,3, 138,1 и 27,1 м.д. (±0,2 м.д.).
5. Кристаллическая соль соединения формулы (1) и холина:
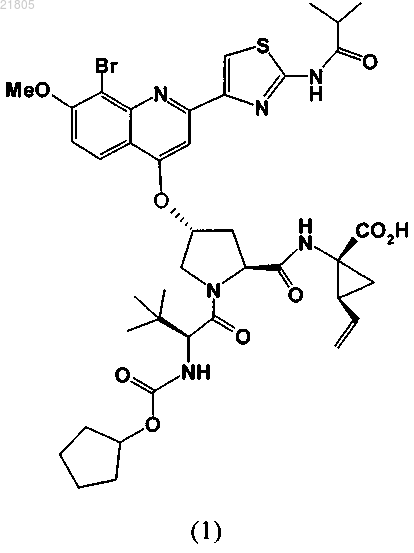
6. Кристаллическая соль по п.5, на порошковой рентгеновской дифрактограмме которой наблюдается пик при 7,5° 2θ (±0,2° 2θ) при измерении с использованием излучения CuKα.
7. Кристаллическая соль по п.5, на спектре 13С твердотельного ЯМР которой наблюдаются пики с химическими сдвигами при 175,1, 137,6 и 27,2 м.д. (±0,2 м.д.).
8. Кристаллическая соль по п.5, на порошковой рентгеновской дифрактограмме которой наблюдается пик при 7,5° 2θ (±0,2° 2θ) при измерении с использованием излучения CuKα, a на спектре 13С твердотельного ЯМР которой наблюдаются пики с химическими сдвигами при 175,1, 137,6 и 27,2 м.д. (±0,2 м.д.).
9. Кристаллическая соль соединения формулы (1) и N-метил-D-глюкамина:
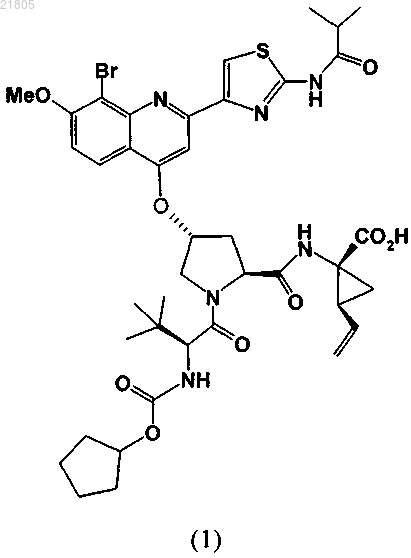
10. Кристаллическая соль по п.9, на порошковой рентгеновской дифрактограмме которой наблюдается пик при 4,4° 2θ (±0,2° 2θ) при измерении с использованием излучения CuKα.
11. Кристаллическая соль по п.9, на спектре 13С твердотельного ЯМР которой наблюдаются пики с химическими сдвигами при 178,4, 138,0 и 27,0 м.д. (±0,2 м.д.).
12. Кристаллическая соль по п.9, на порошковой рентгеновской дифрактограмме которой наблюдается пик при 4,4° 2θ (±0,2° 2θ) при измерении с использованием излучения CuKα, a на спектре 13С твердотельного ЯМР которой наблюдаются пики с химическими сдвигами при 178,4, 138,0 и 27,0 м.д. (±0,2 м.д.).
13. Фармацевтическая композиция, предназначенная для лечения инфекционного заболевания, вызванного вирусом гепатита С, включающая соль по любому из предшествующих пунктов и по крайней мере один фармацевтически приемлемый носитель или разбавитель.
Текст
КРИСТАЛЛИЧЕСКИЕ СОЛИ ЭФФЕКТИВНОГО ИНГИБИТОРА ВИРУСА ГЕПАТИТА С Изобретение относится к новым солевым формам соединения (1) трис-(гидроксиметил)аминометана, холина, N-метил-D-глюкамина и к способам их получения, а также к их применению для лечения инфекционного заболевания, вызванного вирусом гепатита С:(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) Область изобретения Настоящее изобретение относится к новым кристаллическим солям соединения (1), как описано в данном контексте, способам их получения, фармацевтическим композициям и их применению для лечения инфекционного заболевания, вызванного вирусом гепатита С (ВГС). Предшествующий уровень техники Соединение формулы (1) является известным селективным и эффективным ингибитором серинпротеазы NS3 ВГС. Соединение (1) относится к классу ациклических пептидов, которые являются ингибиторами ВГС и описаны в патентах US6323180, 7514557 и 7585845. Соединение (1) описано в качестве соединения 1055 в патенте US7585845 и в качестве соединения 1008 в патенте US7514557. Соединение (1) можно получать по стандартным методикам, описанным в цитированных выше документах, которые включены в настоящее описание в качестве ссылок. Соединение (1) можно также представить в виде следующей альтернативной химической структуры, которая является эквивалентной описанной выше структуре:. При синтезе по стандартным методикам, изложенным в приведенных выше ссылках, соединения (1) получают в виде аморфного твердого вещества, которое обычно менее пригодно для крупномасштабного фармацевтического производства. Таким образом, существует необходимость в получении соединения(1) в кристаллической форме для получения составов, соответствующих фармацевтическим требованиям и спецификациям. Более того, способ получения соединения (1) должен являться процессом, пригодным для масштабирования. Кроме того, предпочтительным является получение продукта в форме, пригодной для фильтрования и высушивания простым способом. Наконец, экономически целесообразным является получение стабильного продукта для его хранения в течение длительного периода времени при отсутствии необходимости обеспечения специальных условий хранения. В заявке US12/559927, поданной 15 сентября 2009 г., описана кристаллическая форма соединения (I), тип А, и кристаллическая натриевая соль соединения (I) с улучшенными фармацевтическими свойствами по сравнению с аморфным соединением. Однако кристаллическая натриевая соль образует гидрат переменного состава, который может вызвать проблемы при производстве, например проблемы при характеризации полученных составов, получении (например, сложности при высушивании) и обработке состава. Соли с улучшенными свойствами по сравнению с кристаллической формой А соединения(I) и кристаллической натриевой солью, например несольватированная кристаллическая форма, являются предпочтительнее для крупномасштабного производства и для переработки в фармацевтические составы. Краткое изложение сущности изобретения Авторы изобретения впервые неожиданно установили, что соединение (1) можно получить в виде кристаллической соли трис-(гидроксиметил)аминометана (трометамина), а также в форме кристаллической соли холина и кристаллической соли N-метил-D-глюкамина. Таким образом, в настоящем изобретении предлагается соединение (1) в виде новых кристаллических солевых форм, которые в одном варианте осуществления настоящего изобретения являются новой кристаллической солью трометамина, а в дополнительных вариантах включают кристаллическую соль холина и кристаллическую соль N-метилD-глюкамина. При использовании этих новых кристаллических форм можно исключить проблемы при фармацевтической обработке, связанные с аморфной формой, а также прежде всего следует отметить,что соли трометамина и холина обладают другими свойствами, что обеспечивает их исключительное преимущество по сравнению с кристаллической формой типа А и формой натриевой соли при их переработке в фармацевтические составы, как будет подробно описано ниже. Указанные новые кристаллические формы соединения (1) можно характеризовать и идентифицировать с использованием различных методов, в том числе порошковой рентгеновской дифрактометрией(ПРД) и твердотельного ЯМР (ттЯМР). В одном варианте осуществления настоящего изобретения предлагается соединение (1) в кристаллической форме соли трометамина (ТН). В другом варианте настоящего изобретения предлагается кристаллическая соль холина и соединения (1) (НЕА). Еще один вариант относится к кристаллической соли N-метил-D-глюкамина и соединения (1) (MU). В дополнительных вариантах предлагается каждая из солей ТН, НЕА и MU, охарактеризованная методами ПРД или ттЯМР или ПРД и ттЯМР. В еще одном варианте предлагается фармацевтическая композиция, включающая соль ТН, соль НЕА или соль MU или их смеси, и по крайней мере один фармацевтически приемлемый носитель или разбавитель. В другом варианте предлагается способ лечения инфекционного заболевания, вызванного ВГС, у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества соли ТН, НЕА или MU или их смеси. Краткое описание фигур На фиг. 1 представлена типичная порошковая рентгеновская дифрактограмма (ПРД) кристаллической соли ТН. На фиг. 2 представлен типичный твердотельный спектр 13 С ЯМР (ттЯМР) кристаллической соли ТН. На фиг. 3 представлена типичная ПРД кристаллической соли НЕА. На фиг. 4 представлен типичный спектр 13 С ттЯМР кристаллической соли НЕА. На фиг. 5 представлена типичная ПРД кристаллической соли MU. На фиг. 6 представлен типичный спектр 13 С ттЯМР кристаллической соли MU. Подробное описание изобретения Определения. Не определенные в данном контексте термины имеют значения, известные специалистам в данной области техники с точки зрения настоящего описания и контекста. Приведенные ниже термины, использованные в данном контексте, имеют следующие значения, если не указано иное. Термин "ТН" обозначает кристаллическую соль трометамина и соединения (1). Термин "НЕА" обозначает кристаллическую соль холина и соединения (1). Термин "MU" обозначает кристаллическую соль N-метил-D-глюкамина и соединения (1). Термин "приблизительно" обозначает отклонение на 5% и более предпочтительно отклонение на 1% от данной величины или диапазона. Например, "приблизительно 3,7%" обозначает величину от 3,5 до 3,9%, предпочтительно от 3,66 до 3,74%. Если термин "приблизительно" относится к диапазону величин,например "приблизительно от Х до Y%", то термин "приблизительно" относится к обоим нижнему (X и верхнему (Y) значению указанного диапазона. Например, "приблизительно от 20 до 40%" эквивалентен термину "приблизительно от 20 до приблизительно 40%". Термин "фармацевтически приемлемый" по отношению к веществу, используемый в данном контексте, обозначает, что вещество, по результатам тщательной медицинской оценки, является пригодным для использования при контактировании с тканями человека и низших животных без избыточной токсичности, раздражения, аллергической реакции и т.п., соответствует оптимальному соотношению польза/риск и является эффективным для использования по назначению, если данное вещество используют в составе фармацевтической композиции. Термин "лечение" в отношении лечения патологического состояния у пациента включает(I) подавление или снижение интенсивности симптомов патологического состояния у пациента, например приостановку или замедление его развития; или(II) ослабление патологического состояния у пациента, т.е. ремиссию или излечение патологического состояния. В случае гепатита С лечение включает снижение вирусной нагрузки у пациентов. Кристаллическая соль ТН. Соединение (1) выделяют в виде кристаллической соли трометамина в полиморфной форме (в данном контексте ТН) и характеризуют с использованием рентгеновской порошковой дифрактометрии(ПРД), дифференциальной сканирующей калориметрии (ДСК) и твердотельного ЯМР (ттЯМР). В основном на ПРД соли ТН наблюдаются характеристические интенсивные пики при 5,9, 9,8, 10,0,16,4, 16,7, 20,3, 20,9 и 22,6 2 (0,2 2). ПРД соли ТН показана на фиг. 1. Положения характеристических пиков и относительные интенсивности пиков на ПРД (фиг. 1) представлены в табл. 1 (включая пики с более высокой и более низкой интенсивностью). Таблица 1 Данные, полученные с использованием дифференциальной сканирующей калориметрии (ДСК) для кристаллов соли ТН, свидетельствуют о наличии эндотермического плавления/разложения при температуре 201C. Термогравиметрический анализ (ТГА) указывает на потерю массы 0,15% вплоть до 165C. Эти данные указывают на то, что соль ТН находится в несольватированной кристаллической форме твердого вещества. Кристаллы ТН поглощают менее 4% влаги при 85% относительной влажности и 25C по данным динамической сорбции паров (ДСП), указывающих на негигроскопичные или незначительно гигроскопичные свойства в условиях, используемых при анализе. В одном общем варианте осуществления настоящего изобретения предлагается кристаллическая соль трометамина и соединения (1) (ТН). Другой, более подробный вариант относится к кристаллической ТН, на ПРД которой наблюдается по крайней мере пик при 5,9 2 (0,2 2) при измерении с использованием излучения CuK. Еще один вариант относится к кристаллической ТН, на ПРД которой наблюдается пик при 5,9 2(0,2 2), как описано выше, и дополнительные пики при 10,0 и 20,9 2 (0,2 2) при измерении с использованием излучения CuK. Другой вариант относится к кристаллической ТН, на ПРД которой наблюдается пик при 5,9 2(0,2 2), как описано выше, и дополнительные пики при 10,0, 16,7, 20,3 и 20,9 2 (0,2 2) при измерении с использованием излучения CuK. Еще один вариант относится к кристаллической ТН, на ПРД которой наблюдается пик при 5,9 2(0,2 2), как описано выше, и дополнительные пики при 9,8, 10,0, 16,4, 16,7, 20,3, 20,9 и 22,6 2 (0,2 2) при измерении с использованием излучения CuK. Другой вариант относится к кристаллической ТН, на ПРД которой наблюдаются практически аналогичные пики, как показано на фиг. 1. Соль ТН характеризуется твердотельным спектром (ттЯМР), на котором наблюдаются следующие химические сдвиги 13 С (включая пики с более высокой и более низкой интенсивностью), как показано в табл. 2. Все химические сдвиги, указанные в данном контексте и в формуле изобретения, представлены с точностью 0,2 м.д., если не указано иное. Типичный пример спектра 13 С ттЯМР ТН показан на фиг. 2. Один общий вариант относится к кристаллической соли трометамина и соединения (1), на спектре 13 С ттЯМР которой наблюдаются пики с химическими сдвигами при 178,3, 138,1 и 27,1 м.д. (0,2 м.д.). Указанные пики с химическими сдвигами являются достаточными для характеризации и отличия соли ТН и соединения (1) от других кристаллических форм. Другой вариант относится к кристаллической соли трометамина и соединения (1), на спектре 13 С ттЯМР которой наблюдаются пики с химическими сдвигами при 178,3, 173,9, 173,1, 150,2, 147,9,138,1 и 27,1 (для всех пиков 0,2 м.д.). Еще один вариант относится к кристаллической соли трометамина и соединения (1), на спектре 13 С ттЯМР которой наблюдаются пики с химическими сдвигами при 178,3, 176,0, 173,9, 173,1, 150,2,147,9, 138,1, 36,7, 27,1, 22,8 и 18,6 м.д. (для всех пиков 0,2 м.д.). Еще один вариант относится к кристаллической соли трометамина и соединения (1), спектр 13 С ттЯМР которой аналогичен показанному на фиг. 2. Другой вариант относится к кристаллической соли трометамина и соединения (1), на ПРД и спектре 13 С ттЯМР которой наблюдаются пики, соответствующие любой комбинации пиков, представленных на вышеупомянутых ПРД и спектрах 13 С ттЯМР. Например, на ПРД кристаллической соли трометамина наблюдается пик при 5,9 2 (0,2 2) при измерении с использованием излучения CuK, a на спектре 13 С ттЯМР наблюдаются пики с химическими сдвигами при 178,3, 138,1 и 27,1 м.д. (0,2 м.д.). Настоящее изобретение относится к способу получения соли ТН, который включает кристаллизацию ТН в условиях, описанных ниже. Точные условия, при которых образуется ТН, можно подбирать эмпирически и только при условии, что эти условия можно использовать на практике. Было установлено, что соль ТН можно получать способом, включающим следующие стадии, при этом указанный способ также является вариантом осуществления настоящего изобретения:(ii) нагревание смеси приблизительно до 50C и перемешивание при указанной температуре в течение 3-5 ч;(iii) охлаждение суспензии приблизительно до 20C;(iv) фильтрование суспензии и промывка полученного твердого вещества пригодным растворителем;(v) высушивание твердого вещества при температуре приблизительно 70C в вакууме. Пригодные растворители включают ацетон и ацетонитрил. Предпочтительным растворителем является ацетон. Полученные кристаллы соли ТН можно выделить и высушить с помощью любых стандартных способов, известных в данной области техники. На заключительных стадиях (iv) и (v) твердое вещество, полученное на стадии (iii), можно выделить и высушить при высокой температуре с использованием стандартных способов выделения и высушивания, например при фильтровании и использовании вакуум-сушильного шкафа. В одном предпочтительном варианте соединение (1) и 1 экв. трис-(гидроксиметил)аминометана смешивают в ацетоне в соотношении 10 мл ацетона на 1 г соединения (1) на стадии (i), нагревают до приблизительно 50C и перемешивают в течение 4 ч на стадии (ii) и промывают ацетоном на стадии (iv). В другом варианте на стадии (iii) суспензию перемешивают при охлаждении в течение приблизительно 4-12 ч. В еще одном варианте зародышевые кристаллы ТН, полученные предварительно, добавляют на стадии (ii). В другом варианте твердое вещество высушивают в течение приблизительно от 4 до 12 ч на стадии(v). Можно увеличить эффективность стадий процесса с использованием стандартных методов встряхивания, например перемешивания, и других стандартных методов для упрощения процесса. Кристаллическая соль НЕА. Соединение (1) выделяют в виде кристаллической соли холина в полиморфной форме (НЕА). В основном на ПРД соли НЕА наблюдаются характеристические пики с более высокой интенсивностью при 7,5, 14,2, 14,9, 17,5, 21,8, 22,1, 22,7 и 24,3 (0,2 2). ПРД соли НЕА показана на фиг. 3. Положения характеристических пиков и относительные интенсивности пиков на ПРД (фиг. 3) указаны в табл. 3 (в том числе пики с более высокой и низкой интенсивностью). Таблица 3 Данные ДСК для кристаллов соли НЕА свидетельствуют о наличии эндотермического плавления/разложения при 264C. Данные ТГА свидетельствуют о потере массы 0,045% вплоть до 230 С. Эти данные показывают, что НЕА находится в несольватированной кристаллической форме твердого вещества. Кристаллы НЕА поглощают менее 2,5% влаги при 85% относительной влажности при 25C по данным ДСП, что указывает на негигроскопичные свойства в условиях, используемых при анализе. В одном варианте настоящего изобретения предлагается кристаллическая соль холина и соединения(1) (НЕА). Другой, более подробный вариант относится к кристаллической соли НЕА, на ПРД которой наблюдается по крайней мере пик при 7,5 2 (0,2 2) при измерении с использованием излучения CuK. Другой вариант относится к кристаллической соли НЕА, на ПРД которой наблюдается пик при 7,5 2 (0,2 2), как описано выше, и дополнительные пики при 14,9 и 17,5 2 (0,2 2) при измерении с помощью излучения CuK. Еще один вариант относится к кристаллической соли НЕА, на ПРД которой наблюдается пик при 7,5 2 (0,2 2), как описано выше, и дополнительные пики при 14,9, 17,5, 22,1 и 24,3 2 (0,2 2) при измерении с помощью излучения CuK. Другой вариант относится к кристаллической соли НЕА, на ПРД которой наблюдается пик при 7,5 2 (0,2 2), как описано выше, и дополнительные пики при 14,2, 14,9, 17,5, 21,8, 22,1, 22,7 и 24,3 2(0,2 2) при измерении с использованием излучения CuK. Еще один вариант относится к кристаллической соли НЕА, на ПРД которой наблюдается практически аналогичные пики, как показано на фиг. 3. Соль НЕА характеризуется спектром 13 С ттЯМР, на котором наблюдаются следующие химические сдвиги (включая пики с более высокой и более низкой интенсивностью), как показано в табл. 4. Все химические сдвиги, приведенные в данном контексте и в формуле изобретения, указаны с точностью 0,2 м.д., если не указано иное. Типичный пример спектра 13 С ттЯМР кристаллической соли НЕА представлен на фиг. 4. Один вариант относится к кристаллической соли холина и соединения (1), на спектре 13 С ттЯМР которой наблюдаются пики с химическими сдвигами при 175,1, 137,6 и 27,2 м.д. (0,2 м.д.). Наличие пиков указанных химических сдвигов является достаточным для отличия соли ТН и соединения (1) от других кристаллических форм. Другой вариант относится к кристаллической соли холина и соединения (1), на спектре 13 С ттЯМР которой наблюдаются пики с химическими сдвигами при 175,1, 172,6, 172,2, 147,8, 147,1, 137,6 и 27,2(все 0,2 м.д.). Еще один вариант относится к кристаллической соли холина и соединения (1), на спектре 13 С ттЯМР которой наблюдаются пики с химическими сдвигами при 175,1, 172,6, 172,2, 170,2, 154,9,149,5, 147,8, 147,1, 137,6, 27,2 и 15,7 м.д. (для всех пиков 0,2 м.д.). Другой вариант относится к кристаллической соли холина и соединения (1), на спектре 13 С ттЯМР наблюдаются практически аналогичные пики, как представлено на фиг. 4. Еще один вариант относится к кристаллической соли холина и соединения (1), на ПРД и спектре 13 С ттЯМР которой наблюдаются пики, соответствующие любой комбинации вышеупомянутых вариантов. Например, такой вариант относится к кристаллической соли холина, на ПРД которой наблюдается пик при 7,5 2 (0,2 2) при измерении с использованием излучения CuK, a на спектре 13 С ттЯМР которой наблюдаются пики с химическими сдвигами при 175,1, 137,6 и 27,2 м.д. (0,2 м.д.). Настоящее изобретение относится к способу получения соли НЕА, который включает кристаллизацию НЕА в условиях, описанных ниже. Точные условия, при которых образуется НЕА, можно подбирать эмпирически и только при условии, что эти условия можно использовать на практике. Было установлено, что соль НЕА можно получать способом, включающим следующие стадии, при этом указанный способ также является вариантом осуществления настоящего изобретения:(i) смешивание соединения (1) с пригодным растворителем и нагревание приблизительно до 60C;(ii) добавление приблизительно 1,1 экв. исходного раствора гидроксида холина в пригодном растворителе;(iii) охлаждение раствора приблизительно до 5C;(iv) фильтрование суспензии и промывка полученного твердого вещества пригодным растворителем;(v) высушивание твердого вещества при температуре приблизительно 70C в вакууме. Предпочтительные растворители включают ацетонитрил и ацетон. Наиболее предпочтительным растворителем является ацетонитрил. Пригодные исходные растворы гидроксида холина включают растворы в метаноле или водные растворы, необязательно разбавленные ацетонитрилом. Предпочтительным исходным раствором является 45 мас.% раствор в метаноле, разбавленный ацетонитрилом. Полученные кристаллы НЕА можно выделить стандартными способами, известными в данной области техники. На заключительных стадиях (iv) и (v) твердое вещество, полученное на стадии (iii), можно выделить и высушить при высокой температуре с использованием стандартных способов выделения и высушивания, например, при фильтровании и использовании вакуум-сушильного шкафа. В одном предпочтительном варианте соединение (1) смешивают с ацетонитрилом в соотношении 10 мл ацетонитрила на 1 г соединения (1) на стадии (i) и исходный раствор гидроксида холина, использованный на стадии (ii), получают при разбавлении 45 мас.% раствора гидроксида холина в метаноле ацетонитрилом в 5 раз (по сравнению с исходным объемом). В другом варианте зародышевые кристаллы НЕА, полученные предварительно, добавляют на стадии (ii) после добавления гидроксида холина. В еще одном варианте на стадии (iii) охлаждение проводят в течение приблизительно 4 ч при перемешивании. В другом варианте твердое вещество высушивают в течение приблизительно 4-12 ч на стадии (v). Можно увеличить эффективность стадий процесса с использованием стандартных методов встряхивания, например перемешивания, и других стандартных методов для упрощения процесса. Кристаллическая соль MU. Соединение (1) выделяли в виде кристаллической соли N-метил-D-глюкамина в полиморфной форме (MU). В основном на ПРД соли MU наблюдаются характеристические пики с более высокой интенсивностью при 2,5, 4,4, 5,1, 11,7, 15,5, 15,9 и 20,9 (0,2 2). ПРД соли MU показана на фиг. 5. Положения характеристических пиков и относительные интенсивности пиков на ПРД (фиг. 5) приведены в табл. 5 (включая пики с более высокими и более низкими интенсивностями). Таблица 5 По данным ДСК кристаллы соли MU характеризуются двумя широкими эндотермическими переходами, один от 20 до 69C и второй от 155 до 187C. Данные ТГФ свидетельствуют о потере массы 3,13%,что связано с первым эндотермическим переходом (от 20 до 69C) и указывает на наличие полупентагидрата MU. В одном общем варианте настоящего изобретения предлагается кристаллическая сольN-метил-D-глюкамина и соединения (1) (MU). Другой более подробный вариант относится к кристаллической соли MU, на ПРД которой наблюдается по крайней мере пик при 4,4 2 (0,2 2) при измерении с использованием излучения CuK. Еще один вариант относится к кристаллической соли MU, на ПРД которой наблюдается пик при 4,4 2 (0,2 2), как описано выше, и дополнительные пики при 2,5 и 5,1 2 (0,2 2) при измерении с использованием излучения CuK. Другой вариант относится к кристаллической соли MU, на ПРД которой наблюдается пик при 4,4 2 (0,2 2), как описано выше, и дополнительные пики при 2,5, 5,1, 11,7 и 15,9 2 (0,2 2) при измерении с использованием излучения CuK. Другой вариант относится к кристаллической соли MU, на ПРД которой наблюдается пик при 4,4 2 (0,2 2), как описано выше, и дополнительные пики при 2,5, 5,1, 11,7, 15,5, 15,9 и 20,9 2 (0,2 2) при измерении с использованием излучения CuK. Еще один вариант относится к кристаллической соли MU, на ПРД которой наблюдаются аналогичные пики, как показано на фиг. 5. На спектре 13 С ттЯМР соли MU наблюдаются химические сдвиги (включая пики с более высокой и более низкой интенсивностью), как показано в табл. 6. Все химические сдвиги, приведенные в данном контексте и в формуле изобретения, указаны с точностью 0,2 м.д., если не указано иное. Типичный пример спектра 13 С ттЯМР MU показан на фиг. 6. Один общий вариант относится к кристаллической соли N-метил-D-глюкамина и соединения (1), на спектре 13 С ттЯМР которой наблюдаются пики с химическими сдвигами при 178,4, 138,0 и 27,0 м.д.(0,2 м.д.). Наличие пиков химических сдвигов является достаточным для характеризации и отличия соли ТН и соединения (1) от других кристаллических форм. Другой вариант относится к кристаллической соли N-метил-D-глюкамина и соединения (1), на спектре 13 С ЯМР которой наблюдаются пики с химическими сдвигами при 178,4, 175,6, 159,8, 154,2,151,2, 138,0 и 27,0 м.д. (для всех пиков 0,2 м.д.). Еще один вариант относится к кристаллической соли N-метил-D-глюкамина и соединения (1), на спектре 13 С ттЯМР которой наблюдаются пики с химическими сдвигами при 178,4, 175,6, 173,4, 172,3,159,8, 154,2, 151,2, 138,0, 27,0, 24,7 и 20,8 м.д. (все 0,2 м.д.). Другой вариант относится к кристаллической соли N-метил-D-глюкамина и соединения (1), на спектре 13 С ттЯМР которой наблюдаются практически аналогичные пики, как показано на фиг. 6. Еще один вариант относится к кристаллической соли N-метил-D-глюкамина и соединения (1), на ПРД и спектре 13 С ттЯМР которой наблюдаются пики, которые соответствуют любой комбинации вышеупомянутых вариантов. Например, кристаллическая соль N-метил-D-глюкамина, на которой наблюдается пик при 4,4 2 (0,2 2) при измерении с использованием излучения CuK, a на спектре 13 С ЯМР которой наблюдаются пики с химическими сдвигами при 178,4, 138,0 и 27,0 м.д. (0,2 м.д.). Настоящее изобретение относится к способу получения соли MU, который включает кристаллизацию в условиях, описанных ниже. Точные условия, при которых образуется MU, можно подбирать эмпирически и только при условии, что эти условия можно использовать на практике. Было установлено, что соль MU можно получать способом, включающим следующие стадии, при этом указанный способ также является вариантом осуществления настоящего изобретения:(ii) нагревание смеси приблизительно до 503C;(iii) добавление пригодного растворителя для уменьшения растворимости MU в течение 4 ч;(iv) охлаждение суспензии приблизительно до 20C в течение 3 ч;(v) фильтрование суспензии и промывка полученного твердого вещества пригодным растворителем или смесью растворителей;(vi) высушивание твердого вещества при температуре приблизительно 30C в вакууме. Пригодные растворители включают метилацетат (MeOAc)/H2O или изопропиловый спирт(IPA)/H2O. Предпочтительным растворителем является MeOAc/H2O. Полученные кристаллы MU можно выделить любыми стандартными способами, известными в данной области техники. В одном предпочтительном варианте соединение (1) и 1 экв. N-метил-D-глюкамина смешивают вMeOAc/H2O (9,2 мас.%) в соотношении 4,68 г MeOAc/H2O на 1 г соединения (1) на стадии (i), нагревают приблизительно до 50C и добавляют 7,13 г MeOAc на 1 г соединения (1) в течение 4 ч на стадии (iii) и промывают смесью MeOAc/H2O (1,75 г MeOAc+0,035 г H2O на 1 г соединения (1 на стадии (v). В другом варианте зародышевые кристаллы соли MU, полученные предварительно, добавляют на стадии (iii). Можно увеличить эффективность стадий процесса с использованием стандартных методах встряхивания, например перемешивания, и других стандартных методов для упрощения процесса. Характеризация солей. Неожиданно было установлено, что соль трометамина ТН и соль холина НЕА характеризуются уникальными свойствами, что обеспечивает их преимущества при применении в фармацевтической промышленности. Прежде всего, соли ТН и НЕА обладают определенными свойствами, которые значительно упрощают их характеристику, обработку и использование в процессе производства. Во-первых, было неожиданно установлено, что соль ТН существует в несольватированной и негигроскопичной или незначительно гигроскопичной кристаллической форме (при температуре окружающей среды и ОВ вплоть 85%). Было установлено также, что соль НЕА существует в не-сольватированной и негигроскопичной кристаллической форме (при температуре окружающей среды и ОВ вплоть до 85%). Указанные свойства нельзя предсказать. Например, было установлено, что натриевая соль (NA) может существовать в виде различных гидратов, что создает проблемы при характеризации полученных составов, обработке (проблемы при высушивании) и применении. Кроме того, было неожиданно обнаружено, что скорость растворения соли ТН при pH 6,8 более чем в 10 раз превышает скорости растворения натриевой соли или соли НЕА, как показано в табл. 7. Скорость растворения НЕА и скорость растворения натриевой соли сопоставимы. Увеличение скорости растворения может представлять преимущества для абсорбции и биодоступности. Таблица 7 Методы, используемые для получения указанных результатов, описаны ниже в разделе "Методы характеризации". Приведенные выше результаты, полученные для различных кристаллических солей соединения (1),являются неожиданными, поскольку, как правило, невозможно предсказать такие различия в гигроскопичности, форме сольвата или растворимости различных форм солей соединения, и, прежде всего, для соединения (1), даже если такие формы были успешно получены. Фармацевтические композиции и способы. Вышеупомянутые формы соединения (1), в том числе солевые формы ТН, НЕА и MU, являются пригодными в качестве противовирусных агентов для лечения заболевания, вызванного ВГС, в связи с доказанной ингибирующей активностью соединения (1) в отношении сериновой протеазы NS3 ВГС. Следовательно, эти формы можно использовать для лечения инфекционного ВГС у млекопитающих и для получения фармацевтической композиции, предназначенной для лечения ВГС или снижения интенсивности одного или более симптомов указанного заболевания у пациента. Соответствующее число доз и курсы лечения для конкретного пациента можно определить по известным методикам, как описано в патентах US6323180 и 7585845. Как правило, для лечения инфекционного ВГС млекопитающему вводят терапевтически эффективное количество. В одном варианте взрослому человеку вводят приблизительно от 50 до 1000 мг, более предпочтительно приблизительно от 120 до 480 мг в сутки в виде однократной дозы или разделенных доз. Конкретные оптимальные дозировки и курсы лечения для каждого конкретного пациента зависят от ряда факторов, включая возраст, массу тела, общее состояние здоровья, пол, диету, время введения, скорость выведения, комбинацию лекарственных средств, тяжесть и течение инфекционного заболевания,предрасположенность пациента к инфекции и заключение лечащего врача. В основном соединение наиболее предпочтительно вводить при концентрации, которая обычно обеспечивает эффективное противовирусное действие, не вызывая никаких вредных или отрицательных эффектов. Кристаллические солевые формы ТН, НЕА и MU и соединения (1) обычно вводят пациенту на уровне выбранных доз в виде фармацевтической композиции (см., например, описания патентовUS 6323180 и 7585845 для различных типов композиций, которые можно использовать в настоящем изобретении). Фармацевтическую композицию можно вводить перорально, парентерально или в виде имплантированного резервуара. Термин "парентеральный", используемый в настоящем контексте, включает подкожный, внутрикожный, внутривенный, внутримышечный, внутрисуставный, интрасиновиальный,внутригрудинный, интратекальный и внутриочаговый способы введения с использованием инъекции или вливания. Предпочтительными являются пероральное введение или введение инъекцией. Фармацевтические композиции по настоящему изобретению могут включать любые стандартные нетоксичные фармацевтически приемлемые носители, разбавители, адъюванты, эксципиенты или наполнители. В некоторых случаях величину pH композиции можно доводить при добавлении фармацевтически приемлемых кислот, оснований или буферных веществ для повышения стабильности соединения или формы для его доставки. Фармацевтические композиции можно использовать в форме стерильного состава для инъекций,например в виде стерильной суспензии в воде или масле для инъекций. Указанную суспензию можно получать по методикам, известным в данной области техники с использованием пригодных диспергирующих или увлажняющих агентов (таких как, например, Твин 80) и суспендирующих агентов. Фармацевтические композиции можно использовать также в форме пероральной фармацевтической композиции, содержащей соли ТН, НЕА или MU соединения (1) или их смеси и по крайней мере один фармацевтически приемлемый носитель или разбавитель. Пероральные фармацевтические композиции можно вводить перорально в виде любой пригодной лекарственной формы для перорального введения,включая, но не ограничиваясь только ими, таблетки, капсулы (например, твердые или мягкие желатиновые капсулы), в том числе капсулы, наполненные жидкостью, и водные суспензии и растворы. В случае таблеток для перорального применения обычно используют носители, которые включают лактозу и кукурузный крахмал. Кроме того, добавляют смазывающие вещества, такие как стеарат магния. Для перорального введения в форме капсул пригодные разбавители включают лактозу и сухой кукурузный крахмал. Примеры мягких желатиновых капсул, которые можно использовать, включают описанные вEP 649651 В 1 и патенте US 5985321. Если водные суспензии вводят перорально, то активный ингредиент смешивают с эмульгаторами и суспендирующими агентами. При необходимости можно добавлять определенные подсластители, и/или ароматизаторы, и/или красители. Другие пригодные носители или наполнители для применения в описанных выше составах и композициях перечислены в стандартных фармацевтических справочниках, например в справочнике"Remington's Pharmaceutical Sciences", 19-е изд., Mack Publishing Company, Easton, Пенсильвания, 1995. Ясно, что при использовании кристаллических солей ТН, НЕА или MU в комбинации с жидким носителем, например в виде жидкого раствора или суспензии для перрорального введения или введения инъекцией, в том числе, например, в виде заполненных жидкостью капсул, соль теряет свою кристаллическую структуру. Тем не менее, конечная фармацевтическая композиция на основе жидкости содержит новые соли ТН, НЕА или MU и соединения (1) и поэтому их следует рассматривать в качестве отдельного варианта осуществления настоящего изобретения. Методы характеризации. 1. Порошковая рентгеновская дифракция (ПРД). Анализ с использованием ПРД проводили на рентгеновском порошковом дифрактометре BrukerAXS, модель D8 Discover фирмы Bruker AXS, Inc. Медисон, WI, при использовании излучения CuK. Шаги сканирования проводили в интервале углов 2 от 2 до 35, 0,05 на шаг и 4 с на шаг. Кварцевый стандарт сравнения использовали для калибровки прибора. Образцами для анализа заполняли силиконовый держатель с нулевым фоном. 2. Анализ ДСК. Для анализа ДСК использовали прибор ТА Q1000. Примерно 5 мг образца взвешивали в открытой герметичной алюминиевой чаше. Стандартный режим разгона использовали в интервале от 20 до 300C со скоростью нагрева 10C/мин. Ячейку ДСК в процессе работы прибора продували азотом со скоростью 50 мл/мин. 3. Анализ ТГА. Для анализа ТГА использовали прибор ТА Q500. Приблизительно 10 мг образца помещали в тарированную платиновую чашу для ТГА. Образец сканировали при температуре в интервале от 25 до 300C со скоростью нагрева 10 С/мин. Печь ТГА продували азотом со скоростью 60 мл/мин, а весы продували азотом со скоростью 40 мл/мин. 4. Динамическая сорбция паров (ДСП). Анализ методом динамической сорбции воды проводили с использованием поверхностных измерительных систем DVS и DVS-HT или VTI SGA-100. Использовали образцы массой от 4 до 13 мг. Три цикла сорбции/десорбции воды проводили при 25C при изменении относительной влажности от 5 до 95% с шагом 5-10%. Критерием шага являлось изменение массы 0,002% или менее или максимальное время 3 ч. 5. Твердотельный ЯМР. Спектры твердотельного ЯМР (ттЯМР) регистрировали на ЯМР спектрометре Bruker Avance III(Bruker BioSpin, Inc, Billerica, MA) при 9.4 Т (1H = 400,46 МГц, 13 С = 100,70 МГц). Образцы помещали в циркониевые роторы диаметром 4 мм, снабженные комплектом для пробоподготовки Kel-F. Для сбора данных и вращения образца под магическим углом (54,74) использовали датчик фирмы Bruker, модель 4BL СР ВВ WVT. При регистрации спектра образца использовали скорость вращения 12 кГц. Стандартную последовательность импульсов кросс-поляризации использовали в соответствии с условиями Харт- 10021805 мана-Хана (возрастающие импульсы) при нагревании протонного канала при комнатной температуре и давлении. Использовали следующую последовательность импульсов: контактный импульс 5 мс и задержка перед следующим импульсом 2 с. В последовательности импульсов использовали также двухимпульсное фазовое модулированное (tppm) расщепление. Перед преобразованием Фурье спада свободной индукции не использовали экспоненциальное уширение линии. Химические сдвиги указаны с использованием вторичного стандарта адамантана, при этом резонанс, направленный в сторону сильного поля,был установлен на уровне 29,5 м.д. Магический угол устанавливали с использованием сигнала 79Br от порошкообразного KBr при скорости вращения 5 кГц. 6. Исследование растворения. Характеристические скорости растворения оценивали с использованием прибора для определения растворимости Van Kel VK7000 и ванны для растворения объемом 400 мл при вращении 100 об/мин при 37C. Образцы получали с использованием приблизительно 50 мг фармацевтически активного агента(API) в форме Вуда диаметром 6 мм и пресса Карвера, сила сжатия составляла 3 кН, а время присутствия образца в прессе 15 с. Испытания проводили в объеме 400 мл при pH 6,8 (20 мМ фосфат натрия). Образцы отбирали через 2, 5, 10, 15, 20, 25 и 30 мин и собранные образцы использовали в нефильтрованном виде или фильтровали через фильтр PDVF с диаметром пор 0,2 мкм. Концентрации лекарственного средства определяли методом ЖХВР (изократный режим, флуоресцентный детектор). Ниже приведены примеры для более полного понимания сущности настоящего изобретения. Эти примеры предназначены для иллюстрации вариантов осуществления данного изобретения и не ограничивают его объем. Исходный материал, использованный в примерах, соединение (1), можно получать,как описано в патентах US6323180, 7514557 и 7585845. Примеры Пример 1. Получение соли трометамина и соединения (1). Соединение (1) (5 г) и трис-(гидроксиметил)аминометан (0,696 г) смешивали в 50 мл ацетона. Смесь перемешивали, нагревали до 50C и перемешивали при указанной температуре в течение 4 ч. Полученную суспензию медленно охлаждали до 20C при перемешивании. Охлажденную смесь перемешивали в общей сложности в течение 12 ч. Полученную смесь фильтровали в вакууме и полученное твердое вещество промывали ацетоном (210 мл). Твердое вещество высушивали при 70C в вакууме в течение 12 ч, при этом получали соль трометамина и соединения (1) (ТН). ПРД соли ТН показана на фиг. 1, а спектр 13 С ттЯМР соли ТН представлен на фиг. 2. Пример 2. Получение соли холина и соединения (1). Соединение (1) (5 г) смешивали с 50 мл ацетонитрила и нагревали до 60C. 4,52 мл исходного раствора гидроксида холина, предварительно полученного при разбавлении 5 мл 45 мас.% раствора гидроксида холина в метаноле ацетонитрилом до общего объема 25 мл, медленно добавляли в течение 6 ч при перемешивании при 60C. Смесь перемешивали и медленно охлаждали до 5C в течение 4 ч. Затем суспензию фильтровали и полученное твердое вещество промывали ацетонитрилом (210 мл). Твердое вещество высушивали при температуре 70C в вакууме в течение 12 ч, при этом получали соль холина и соединения (1) (НЕА). ПРД соли НЕА показана на фиг. 3, а спектр 13 С ттЯМР соли НЕА представлен на фиг. 4. Пример 3. Получение соли N-метил-D-глюкамина и соединения (1). Соединение (1) (20 г) и N-метил-D-глюкамин (4,49 г) смешивали с 8,63 г H2O и 85 г метилацетата(MeOAc). Смесь перемешивали и нагревали до 50C. 142,5 г MeOAc добавляли в полученную смесь в течение 4 ч (до добавления MeOAc предпочтительно, но не обязательно, добавляли зародышевые кристаллы). Полученную суспензию охлаждали до 20C в течение 3 ч при перемешивании. Полученную смесь фильтровали и полученное твердое вещество промывали смесью MeOAc/H2O (35,15 г MeOAc + 0,717 г H2O). Твердое вещество высушивали при 30C в вакууме в течение 12 ч, при этом получали соль N-метил-D-глюкамина и соединения (1) (MU). ПРД соли MU показана на фиг. 5 и спектр 13 С ттЯМР соли MU представлен на фиг. 6. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллическая соль соединения формулы (1) и трометамина: 2. Кристаллическая соль по п.1, на порошковой рентгеновской дифрактограмме которой наблюдается пик при 5,9 2 (0,2 2) при измерении с использованием излучения CuK. 3. Кристаллическая соль по п.1, на спектре 13 С твердотельного ЯМР которой наблюдаются пики с химическими сдвигами при 178,3, 138,1 и 27,1 м.д. (0,2 м.д.). 4. Кристаллическая соль по п.1, на порошковой рентгеновской дифрактограмме которой наблюдается пик при 5,9 2 (0,2 2) при измерении с использованием излучения CuK, a на спектре 13 С твердотельного ЯМР которой наблюдаются пики с химическими сдвигами при 178,3, 138,1 и 27,1 м.д. (0,2 м.д.). 5. Кристаллическая соль соединения формулы (1) и холина: 6. Кристаллическая соль по п.5, на порошковой рентгеновской дифрактограмме которой наблюдается пик при 7,5 2 (0,2 2) при измерении с использованием излучения CuK. 7. Кристаллическая соль по п.5, на спектре 13 С твердотельного ЯМР которой наблюдаются пики с химическими сдвигами при 175,1, 137,6 и 27,2 м.д. (0,2 м.д.). 8. Кристаллическая соль по п.5, на порошковой рентгеновской дифрактограмме которой наблюдается пик при 7,5 2 (0,2 2) при измерении с использованием излучения CuK, a на спектре 13 С твердотельного ЯМР которой наблюдаются пики с химическими сдвигами при 175,1, 137,6 и 27,2 м.д. (0,2 м.д.). 9. Кристаллическая соль соединения формулы (1) и N-метил-D-глюкамина: 10. Кристаллическая соль по п.9, на порошковой рентгеновской дифрактограмме которой наблюдается пик при 4,4 2 (0,2 2) при измерении с использованием излучения CuK. 11. Кристаллическая соль по п.9, на спектре 13 С твердотельного ЯМР которой наблюдаются пики с химическими сдвигами при 178,4, 138,0 и 27,0 м.д. (0,2 м.д.). 12. Кристаллическая соль по п.9, на порошковой рентгеновской дифрактограмме которой наблюдается пик при 4,4 2 (0,2 2) при измерении с использованием излучения CuK, a на спектре 13 С твердотельного ЯМР которой наблюдаются пики с химическими сдвигами при 178,4, 138,0 и 27,0 м.д. (0,2 м.д.). 13. Фармацевтическая композиция, предназначенная для лечения инфекционного заболевания, вызванного вирусом гепатита С, включающая соль по любому из предшествующих пунктов и по крайней мере один фармацевтически приемлемый носитель или разбавитель.
МПК / Метки
МПК: A61P 31/18, A61K 31/427, C07D 417/14
Метки: вируса, соли, гепатита, кристаллические, эффективного, ингибитора
Код ссылки
<a href="https://eas.patents.su/17-21805-kristallicheskie-soli-effektivnogo-ingibitora-virusa-gepatita-s.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллические соли эффективного ингибитора вируса гепатита с</a>
Предыдущий патент: Способ и система диагностики глубинно-насосной установки нефтяной скважины
Следующий патент: Способ и установка для переработки экстракционного подсолнечного шрота
Случайный патент: Способ получения сухой питательной смеси на зерновой основе












