Производные ксантина
Формула / Реферат
1. Соединение, представляющее собой 8-хлор-3-пентил-3,7-дигидро-1Н-пурин-2,6-дион трис-(гидроксиметил)аминометан формулы (IA)
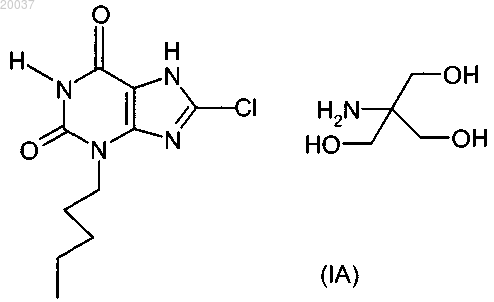
2. Соединение по п.1, которое представляет собой безводный 8-хлор-3-пентил-3,7-дигидро-1Н-пурин-2,6-дион и трис-(гидроксиметил)аминометан.
3. Соединение по п.1 или 2, которое является кристаллическим.
4. Соединение по любому из пп.1-3, где кристаллическая форма соединения характеризуется порошковой рентгенограммой, содержащей следующие пики
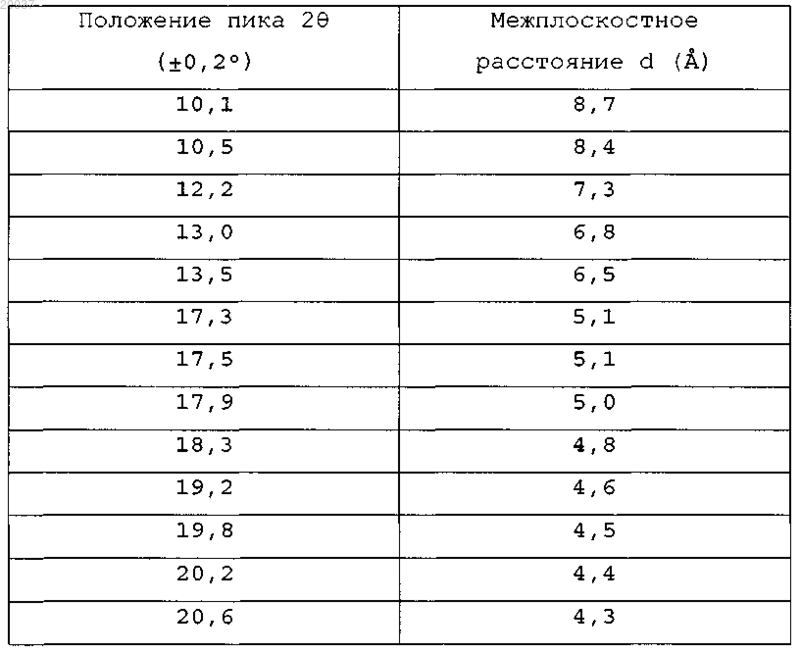

5. Соединение по любому из пп.1-4, где кристаллическая форма соединения характеризуется порошковой рентгенограммой, приведенной на фиг. 2.
6. Соединение по любому из пп.1-5, где кристаллическая форма соединения характеризуется эндотермическим плавлением с температурой начала плавления 212±2°С на термограмме ДСК.
7. Соединение по любому из пп.1-6, где кристаллическая форма соединения характеризуется следующими максимумами поглощения в спектре ИК МНПВО твердого продукта: 3370, 3041, 2946, 2858, 1680, 1656, 1528, 1266, 1243, 1078, 1068, 1049±1 см-1.
8. Соединение по любому из пп.1-7, где кристаллическая форма соединения характеризуется спектром ИК МНПВО, приведенным на фиг. 6.
9. Комбинация для лечения состояния, вызванного недостаточной активацией рецептора НМ74А, или состояния, для которого целесообразна активация рецептора НМ74А, включающая а) соединение по любому из пп.1-8 и b) одно или несколько терапевтически активных агентов.
10. Комбинация для лечения состояния, вызванного недостаточной активацией рецептора НМ74А, или состояния, для которого целесообразна активации рецептора НМ74А, включающая а) соединение по любому из пп.1-8 и b) ниацин или аторвастатин натрия.
11. Применение соединения по любому из пп.1-8 в лечении смешанной дислипидемии, диабетической дислипидемии или гиперлипопротеинемии.
12. Применение соединения по любому из пп.1-8 в лечении сахарного диабета типа II.
13. Применение соединения по любому из пп.1-8 в лечении диабетической дислипидемии, смешанной дислипидемии, сердечной недостаточности, гиперхолестеринемии, сердечно-сосудистых заболеваний, атеросклероза, артериосклероза, гипертриглицеридемии, сахарного диабета типа II, диабета типа I, резистентности к инсулину, гиперлипидемии, нервной анорексии, ожирения, заболевания коронарных артерий, тромбоза, стенокардии, хронической почечной недостаточности, периферического сосудистого заболевания или инсульта.
14. Применение соединения по любому из пп.1-8 в производстве лекарственного средства, применяемого для лечения смешанной дислипидемии, диабетической дислипидемии или гиперлипопротеинемии.
15. Применение соединения по любому из пп.1-8 в производстве лекарственного средства для лечения сахарного диабета типа II.
16. Применение соединения по любому из пп.1-8 в производстве лекарственного средства для лечения диабетической дислипидемии, смешанной дислипидемии, сердечной недостаточности, гиперхолестеринемии, сердечно-сосудистых заболеваний, атеросклероза, артериосклероза, гипертриглицеридемии, сахарного диабета типа II, диабета типа I, резистентности к инсулину, гиперлипидемии, нервной анорексии, ожирения, заболевания коронарных артерий, тромбоза, стенокардии, хронической почечной недостаточности, периферического сосудистого заболевания или инсульта.
17. Способ лечения пациента в состоянии, вызванном недостаточной активацией рецептора НМ74А, или в случае целесообразности активации рецептора НМ74А, включающий введение данному пациенту эффективного количества соединения по любому из пп.1-8.
18. Способ по п.17, где пациент страдает диабетической дислипидемией, смешанной дислипидемией или гиперлипопротеинемией.
19. Способ по п.17, где пациент страдает сахарным диабетом типа II.
20. Фармацевтическая композиция для лечения состояния, вызванного недостаточной активацией рецептора НМ74А, или состояния, для которого целесообразна активация рецептора НМ74А, содержащая а) соединение по любому из пп.1-8 и b) один или несколько фармацевтически приемлемых носителей.
Текст
(А), соответствующим способам получения, фармацевтическим композициям, содержащим указанное соединение, и их применению в терапии, в частности для лечения заболеваний, которые вызваны недостаточной активацией рецептора НМ 74 А, или в случае целесообразности активации данного рецептора. Эскен Холли, Нортон Бет Адамс (US) Медведев В.Н. (RU) Область техники, к которой относится изобретение Настоящее изобретение относится к конкретной новой соли 8-хлор-3-пентил-3,7-дигидро-1 Нпурин-2,6-диона. В частности, настоящее изобретение относится к трис-(гидроксиметил)аминометановой (трис)соли 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин-2,6-диона, которую также определяют как 8-хлор-3-пентил-3,7 дигидро-1 Н-пурин-2,6-дион трис-(гидроксиметил)аминометан (т.е. в CAS) или 8-хлор-3-пентил-3,7 дигидро-1 Н-пурин-2,6-дион 2-амино-2-(гидроксиметил)-1,3-пропандиол (т.е. в IUPAC), далее именуется"соединение формулы (IA)", фармацевтическим композициям, содержащим указанное соединение, а также его способам получения и применения. Предшествующий уровень техники изобретения В международной патентной публикации РСТ WO 2005/077950 (SmithKline Beecham Corporation) описаны терапевтически активные производные ксантина формулы (I) соответствующие способы получения указанных соединений, фармацевтические композиции, содержащие указанные активные соединения, и их терапевтическое применение, в частности, в лечении заболеваний, которые вызваны недостаточной активацией рецептора НМ 74 А, или в случае целесообразности активации данного рецептора. Соединение 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин-2,6-дион (т.е. свободная кислота), которое описано в примере 12 как соединение (А), приведено в международной патентной публикации РСТWO 2005/077950: Публикация WO 2005/077950 полностью включается посредством ссылки. В настоящем изобретении описана новая трис-соль 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин-2,6 диона (А), также известная как 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин-2,6-дион трис-(гидроксиметил)аминометан (CAS) или 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин-2,6-дион-2-амино-2-(гидроксиметил)-1,3 пропандиол (IUPAC) (т.е. термин "трис" означает сокращенное название органического соединения, известного как трис-(гидроксиметил)аминометан формулы (НОСН 2)3CNH2). трис-Соль 8-хлор-3-пентил 3,7-дигидро-1 Н-пурин-2,6-диона формулы (А) далее именуется "соединение формулы (IA)" трис-Соль (IA) превосходит указанную выше свободную кислоту (А). В частности, показано, что трис-соль отличается повышенной химической устойчивостью, особенно по сравнению со свободной кислотой. Термин "повышенная химическая устойчивость" означает, что трис-соль сохраняется в исходном виде и не так легко переходит (или переходит частично) в другую форму при гидратировании в процессе производства. Напротив, показано, что свободная кислота легко переходит в гидратированную форму на стадиях переработки с применением воды, например в процессе влажного гранулирования. Кроме того, трис-соль имеет более высокую растворимость, чем свободная кислота, а также повышенную Cmax и пониженную Tmax, что указывает на ускоренную абсорбцию. Сущность изобретения В одном из аспектов данное изобретение относится к трис-соли 8-хлор-3-пентил-3,7-дигидро-1 Нпурин-2,6-диона (IA), также известной как 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин-2,6-дион трис(гидроксиметил)аминометан (CAS) или 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин-2,6-дион-2-амино-2(гидроксиметил)-1,3-пропандиол (IUPAC). В другом аспекте соединение (IA) - ангидрат. В данном контексте термин "ангидрат" означает отсутствие воды в кристаллической структуре. Соединение (IA) может быть аморфным или кристаллическим. В одном из аспектов соединение(IA) кристаллическое. В одном из аспектов безводное кристаллическое соединение (IA) характеризуется порошковой рентгенограммой (РФА), включающей следующие пики. В другом аспекте безводное кристаллическое соединение (IA) характеризуется порошковой рентгенограммой, включающей следующие пики. В другом аспекте безводное кристаллическое соединение (IA) характеризуется порошковой рентгенограммой, приведенной на фиг. 2. В одном из аспектов безводное кристаллическое соединение (IA) характеризуется эндотермическим плавлением, которое начинается при температуре 2122C, как определено методом дифференциальной сканирующей калориметрии (ДСК). Для этого удобно использовать слегка гофрированную негерметичную алюминиевую кювету при скорости нагревания 10C/мин. В одном из аспектов безводное кристаллическое соединение (IA) характеризуется следующими максимумами поглощения в инфракрасном спектре многократно нарушенного полного отражения(ИК МНПВО) твердого продукта: 3370, 3041, 2946, 2858, 1680, 1656, 1528, 1266, 1243, 1078, 1068,10491 см-1. В другом аспекте безводное кристаллическое соединение (IA) характеризуется спектром ИК МНПВО, приведенным на фиг. 6. Как обсуждается и иллюстрируется в тексте, настоящее изобретение относится к определенным кристаллическим формам твердого состояния. Существует несколько способов описания данных форм, и настоящее изобретение не ограничено выбранными способами или использованными приборами для описания рассматриваемых в нем соединений. Например, что касается порошковых рентгенограмм, интенсивности дифракционных пиков могут изменяться, как известно из литературы, главным образом,вследствие предпочтительной ориентации (неслучайной ориентации) кристаллов в приготовленном образце. Поэтому предмет настоящего изобретения следует рассматривать в свете изменчивости характеристик, которая понятна специалистам в данной области. В одном из аспектов настоящее изобретение относится к фармацевтическим композициям, содержащим соединение (IA). В одном из аспектов настоящее изобретение относится к применению соединения (IA) в терапии. В другом аспекте настоящее изобретение относится к соединению (IA) для применения в лечении заболеваний, которые вызваны недостаточной активацией рецептора НМ 74 А, или в случае целесообразности активации данного рецептора, в частности, для лечения дислипидемии, гиперлипопротеинемии,диабетической дислипидемии, смешанной дислипидемии, сердечной недостаточности, гиперхолестеринемии, сердечно-сосудистых заболеваний, атеросклероза, артериосклероза, гипертриглицеридемии, сахарного диабета типа II, диабета типа I, резистентности к инсулину, гиперлипидемии, нервной анорексии, ожирения, заболевания коронарных артерий, тромбоза, стенокардии, хронической почечной недостаточности, периферического сосудистого заболевания или инсульта. В другом аспекте настоящее изобретение относится к применению соединения (IA) в производстве лекарственного средства, используемого в случае заболеваний, которые вызваны недостаточной активацией рецептора НМ 74 А, или в случае целесообразности активации данного рецептора для лечения, в частности, для лечения дислипидемии, гиперлипопротеинемии, диабетической дислипидемии, смешанной дислипидемии, сердечной недостаточности, гиперхолестеринемии, сердечно-сосудистых заболеваний, атеросклероза, артериосклероза, гипертриглицеридемии, сахарного диабета типа II, диабета типа I,резистентности к инсулину, гиперлипидемии, нервной анорексии, ожирения, заболевания коронарных артерий, тромбоза, стенокардии, хронической почечной недостаточности, периферического сосудистого заболевания или инсульта. В другом аспекте настоящее изобретение относится к способам лечения заболеваний, которые вызваны недостаточной активацией рецептора НМ 74 А, или в случае целесообразности активации данного рецептора, в частности, для лечения дислипидемии, гиперлипопротеинемии, диабетической дислипидемии, смешанной дислипидемии, сердечной недостаточности, гиперхолестеринемии, сердечнососудистых заболеваний, атеросклероза, артериосклероза, гипертриглицеридемии, сахарного диабета типа II, диабета типа I, резистентности к инсулину, гиперлипидемии, нервной анорексии, ожирения, заболевания коронарных артерий, тромбоза, стенокардии, хронической почечной недостаточности, периферического сосудистого заболевания или инсульта, включающим введение терапевтически эффективного количества соединения (IA). Краткое описание чертежей На фиг. 1 приведен ИК-спектр безводной трис-соли 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин-2,6 диона (IA). На фиг. 2 приведена порошковая рентгенограмма безводной трис-соли 8-хлор-3-пентил-3,7 дигидро-1 Н-пурин-2,6-диона (IA). На фиг. 3 приведен спектр ЯМР 1 Н безводной трис-соли 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин 2,6-диона (IA). На фиг. 4 приведен спектр ЯМР 13 С безводной трис-соли 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин 2,6-диона (IA). На фиг. 5 приведен спектр электрораспылительной ионизации безводной трис-соли 8-хлор-3 пентил-3,7-дигидро-1 Н-пурин-2,6-диона (IA). На фиг. 6 приведен инфракрасный спектр многократно нарушенного полного отражения (ИК МНПВО) безводной трис-соли 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин-2,6-диона (IA). Подробное описание изобретения В тексте настоящего изобретения и сопровождающей его формулы изобретения слово "содержат" и его производные, например "содержит", "включающий", истолковываются включительно. То есть следует понимать, что могут быть включены другие элементы или составляющие, не упомянутые особо,если это позволяет контекст. При использовании в настоящем изобретении термин "терапевтически эффективное количество" означает, что данное количество лекарственного средства или фармацевтического агента вызовет биологическую или медицинскую реакцию ткани или системы животного или человека, которое предполагает,например, исследователь или врач. Кроме того, термин "терапевтически эффективное количество" означает любое количество, которое по сравнению со случаем его отсутствия приводит к улучшению лечения, выздоровлению, профилактике или ослаблению заболевания, расстройства или побочного эффекта или к снижению степени развития заболевания или расстройства. В рамки данного термина также входят количества, которые эффективно улучшают нормальную физиологическую функцию. При использовании в настоящем изобретении термин "фармацевтически приемлемый" означает соединение, которое пригодно для фармацевтического применения. Сольватами соединения (IA), которые пригодны для использования в медицине, являются те, которые содержат фармацевтически приемлемый противоион или связанный растворитель. При использовании в настоящем изобретении термины "лечение" или "терапия" означают ослабление симптомов и/или замедление развития заболевания и могут включать подавление возникновения симптомов у бессимптомного пациента. Ссылка на соединение (IA) включает сольваты (например, гидраты) трис-соединения. Специалисты в области органической химии понимают, что многие органические соединения могут образовывать комплексы с растворителями, в которых они реагируют или из которых их осаждают или кристаллизуют. Сольваты соединения (IA) входят в объем настоящего изобретения. При использовании в настоящем изобретении термин "сольват" означает комплекс переменного состава, образуемый растворенным веществом (соединение (IA и растворителем. Такие растворители в целях настоящего изобретения не должны влиять на биологическую активность растворенного вещества. Примеры пригодных растворителей включают, но не ограничиваются этим, воду, метанол, этанол, уксусную кислоту и т.п. В одном из аспектов растворитель (растворители), пригодный для использования в настоящем изобретении, является фармацевтически приемлемым растворителем. Примеры пригодных фармацевтически приемлемых растворителей включают, без ограничения, воду, этанол, уксусную кислоту и т.п. При использовании в настоящем изобретении термин "гидрат" означает комплекс переменного состава, который образуется с участием или в присутствии воды. В одном из аспектов настоящего изобретения в качестве растворителя используют воду. Вследствие своего возможного применения в медицине в одном из аспектов трис-соль 8-хлор-3 пентил-3,7-дигидро-1 Н-пурин-2,6-диона (IA) будет фармацевтически приемлемой. Предмет настоящего изобретения включает все возможные стехиометрические и нестехиометрические формы соединения(IA). В одном из аспектов настоящее изобретение относится к трис-соли 8-хлор-3-пентил-3,7-дигидро 1 Н-пурин-2,6-диона (IA), включая ее сольваты или гидраты. Еще один аспект настоящего изобретения предусматривает применение соединения (IA) в производстве лекарственного средства, используемого для лечения дислипидемии, гиперлипопротеинемии,диабетической дислипидемии, смешанной дислипидемии, сердечной недостаточности, гиперхолестеринемии, сердечно-сосудистых заболеваний, атеросклероза, артериосклероза, гипертриглицеридемии, сахарного диабета типа II, диабета типа I, резистентности к инсулину, гиперлипидемии, нервной анорексии и ожирения. Предусмотрено также применение данных соединений для лечения заболевания коронарных артерий, тромбоза, стенокардии, хронической почечной недостаточности, периферического сосудистого заболевания или инсульта. Кроме того, настоящее изобретение предусматривает применение соединения (IA) в производстве лекарственного средства, используемого для лечения воспалительных заболеваний или состояний суставов, в частности артрита (например, ревматоидный артрит, остеоартрит, неисправность суставного протеза), или желудочно-кишечного тракта (например, неспецифический язвенный колит, гранулематозная болезнь (болезнь Крона) и другие воспалительные кишечные и желудочно-кишечные заболевания, гастрит и воспаление слизистых оболочек в результате инфекции, энтеропатия, вызванная нестероидными противовоспалительными препаратами), легкого (например, респираторный дистресс-синдром взрослых,астма, муковисцидоз или хроническое обструктивное заболевание легких), сердца (например, миокардит), нервной ткани (например, рассеянный склероз), поджелудочной железы (например, воспаление,связанное с сахарным диабетом и его осложнениями), почки (например, гломерулонефрит), кожи (например, дерматит, псориаз, экзема, крапивница, ожоговое повреждение), глаза (например, глаукома), а также пересаженных органов (например, отторжение) и заболевания многих органов (например, системная красная волчанка, сепсис) и воспалительное осложнение вирусных или бактериальных инфекций и воспалительных состояний, связанных с атеросклерозом и после гипоксических или ишемических инсультов (с реперфузией или без нее), например, в мозге или при ишемической болезни сердца. Другой или альтернативный аспект предусматривает способ лечения пациента в состоянии, которое вызвано недостаточной активацией рецептора НМ 74 А, или в случае целесообразности активации данного рецептора, причем данный способ включает введение указанному пациенту эффективного количества соединения (IA). В частности, настоящее изобретение предлагает способ лечения дислипидемии, гиперлипопротеинемии, диабетической дислипидемии, смешанной дислипидемии, сердечной недостаточности, гиперхолестеринемии, сердечно-сосудистых заболеваний, атеросклероза, артериосклероза, гипертриглицеридемии, сахарного диабета типа II, диабета типа I, резистентности к инсулину, гиперлипидемии, нервной анорексии или ожирения у пациента, причем данный способ включает введение указанному пациенту терапевтически эффективного количества соединения (IA). В данном качестве указанные соединения могут также найти применение в способах лечения заболевания коронарных артерий, тромбоза, стенокардии, хронической почечной недостаточности, периферического сосудистого заболевания или инсульта, причем данные способы включают введение указанному пациенту терапевтически эффективного количества соединения (IA). Количество соединения (IA), которое необходимо для достижения желательного биологического эффекта, зависит от ряда факторов, например способа введения и точного клинического состояния пациента. Как правило, суточная доза составляет от 1 до 500 мг, обыкновенно от 5 до 250 мг или от 5 до 200 мг. Например, 7,35, 36,75, 73,5 или 147 мг (эквивалент 5, 25, 50 и 100 мг свободной кислоты). Внутривенная доза может, например, составлять от 0,01 мг до 0,1 г, обыкновенно от 0,01 до 10 мг, чтобы ее можно было удобно вводить путем вливания от 0,1 мкг до 1 мг в минуту. Пригодный для этой цели раствор для вливания может содержать, например, от 0,01 мкг до 0,1 мг в 1 мл. Единичные дозы могут содержать, например, от 0,01 мкг до 1 г трис-соли. Таким образом, ампулы для инъекций могут содержать,например, от 0,01 мкг до 0,1 г, а единичная доза пероральных лекарственных средств, например таблеток или капсул, может содержать, например, от 0,1 мг до 1 г. При применении соединения по настоящему изобретению в вышеуказанных дозах не обнаружены и не ожидаются никакие токсикологические эффекты. Фармацевтические композиции. Насколько это возможно для применения в способах по настоящему изобретению, соединение (IA) можно вводить в виде чистого вещества, но предпочтительно как активный ингредиент фармацевтической композиции, например, в которой содержится добавка по меньшей мере одного фармацевтически приемлемого носителя, выбранного в соответствии с используемым способом введения и стандартной фармацевтической практикой. Таким образом, настоящее изобретение предлагает фармацевтическую композицию, содержащую соединение (IA) в сочетании с одним или несколькими фармацевтически приемлемыми носителями, разбавителями и/или эксципиентами. Носитель, разбавитель и/или эксципиент должен быть "приемлемым" в смысле совместимости с другими ингредиентами данной композиции и не должен наносить вреда пациенту. Соответственно, настоящее изобретение предлагает фармацевтическую композицию, содержащую а) соединение (IA) и b) один или несколько фармацевтически приемлемых носителей. Термин "носитель" означает разбавители, эксципиент и/или среду, в которых вводят активное вещество. Фармацевтические композиции по настоящему изобретению могут содержать комбинации нескольких носителей. Указанные фармацевтические носители могут включать стерильные жидкости, например воду, солевые растворы, водные растворы декстрозы, водные растворы глицерина, а также масла,в том числе нефтяного, животного, растительного или синтетического происхождения, например арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. Воду или водные солевые растворы и водные растворы декстрозы и растворы глицерина предпочтительно использовать как носители, в частности, в растворах для инъекций. Пригодные фармацевтические носители описаны в книге Remington's Pharmaceutical Sciences (Фармацевтические науки от Ремингтона), автор E.W. Martin, 18-е изд. Фармацевтический носитель выбирают на основании предполагаемого способа введения и стандартной фармацевтической практики. Фармацевтические композиции могут содержать, помимо носителя, любые пригодные связующие агенты, лубриканты, суспендирующие агенты, агенты для покрытия и/или солюбилизирующие агенты. Фармацевтические композиции включают средства, предназначенные для перорального, ректального, местного, трансбуккального (подъязычного) и парентерального (например, подкожного, внутримышечного, внутрикожного или внутривенного) введения. Самая предпочтительная форма введения - пероральная. Фармацевтические композиции, пригодные для перорального применения, могут находиться в виде отдельных единиц, например капсул, пакетиков, пастилок или таблеток, каждая из которых содержит определенное количество соединения (IA); в виде порошка или гранул; в виде раствора или суспензии в воде или неводной жидкости или в виде масляной эмульсии. Как правило, фармацевтические компози-5 020037 ции получают путем тщательного перемешивания до однородного состояния активного вещества (IA) с жидким и/или мелкодисперсным твердым носителем с последующим формованием продукта, если это необходимо. Например, таблетку можно изготовить путем прессования или формования порошка или гранул соединения (IA), возможно, с одним или несколькими дополнительными ингредиентами. Прессованные таблетки можно изготовить путем прессования в соответствующем устройстве данного соединения в сыпучей форме, например в виде порошка или гранул, возможно, с добавлением связующих, лубрикантов, инертных разбавителей и/или поверхностно-активных веществ/диспергаторов. Формованные таблетки можно изготовить путем формования в соответствующем устройстве порошка данного соединения, увлажненного инертным жидким разбавителем. Таблетки и капсулы для перорального введения могут содержать традиционные эксципиенты, в том числе связующие агенты, например сироп, гуммиарабик, желатин, сорбит, трагакант, клей из крахмала или поливинилпирролидона; наполнители, например лактозу, микрокристаллическую целлюлозу, сахар,кукурузный крахмал, фосфат кальция или сорбит; лубриканты, например стеарат магния, стеариновую кислоту, тальк, полиэтиленгликоль или силикагель; дезинтегранты, например картофельный крахмал,кроскармеллозу натрия или натрия крахмала гликолят; или смачивающие вещества, такие как лаурилсульфат натрия. Таблетки могут быть покрыты согласно способам, известным в уровне техники. Пероральные жидкие препараты могут быть в форме, например, водных или масляных суспензий, растворов,эмульсий, сиропов или эликсиров или могут быть представлены как сухой продукт для восстановления с водой или другой подходящей средой перед использованием. Такие жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты, например сироп сорбита, метилцеллюлозу, сироп глюкозы/сахара, желатин, гидроксиметилцеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия или гидрированные пищевые жиры; эмульгаторы, например лецитин, сорбитан моноолеат или гуммиарабик; неводные носители (которые могут включать пищевые масла), например миндальное масло,фракционированное кокосовое масло, масляные сложные эфиры, пропиленгликоль или этиловый спирт; или консерванты, например метил- или пропил-п-гидроксибензоаты или сорбиновую кислоту. Препараты могут также содержать буферные соли, ароматизаторы, красители и/или подсластители (например,маннит), в случае необходимости. Фармацевтические композиции, пригодные для буккального (подъязычного) введения, включают пастилки, содержащие соединение (IA) в ароматизированной основе, обычно сахарозе и гуммиарабике или трагаканте, и пастилки, содержащие соединение (IA) в инертной основе, такой как желатин и глицерин или сахароза и гуммиарабик. Фармацевтические композиции по настоящему изобретению, пригодные для парентерального введения, предпочтительно включают стерильные водные препараты соединения (IA), причем состав может быть изотоническим по отношению к крови предполагаемого реципиента. Эти препараты можно вводить внутривенно, хотя введение может также быть произведено посредством подкожной, внутримышечной или внутрикожной инъекции. Такие препараты можно получить путем смешивания соединения (IA) с водой и стерилизации полученного раствора и придания ему изотоничности по отношению к крови. Фармацевтические композиции для инъекций по настоящему изобретению обычно содержат от 0,1 до 5 мас.% соединения (IA). Таким образом, фармацевтические композиции по настоящему изобретению, пригодные для парентерального введения, включающие соединение по настоящему изобретению, можно изготовлять для парентерального введения путем болюсной инъекции или непрерывного вливания и могут быть представлены в виде единичных дозированных форм, например ампул, пузырьков, сосудов для вливания малых объемов или предварительно наполненных шприцев, или в контейнерах, содержащих множество доз с добавленным консервантом. Композиции можно выпускать в таких формах, как растворы, суспензии или эмульсии в водных или неводных носителях, причем они могут содержать вспомогательные средства,такие как антиоксиданты, буферы, противомикробные агенты и/или регуляторы токсичности. В качестве альтернативы, активный ингредиент может быть в порошковой форме для восстановления подходящей средой, например стерильной апирогенной водой, перед использованием. Сухую твердую форму можно получить путем асептического заполнения стерильного порошка в индивидуальные стерильные контейнеры или асептического заполнения стерильного раствора в каждый контейнер и сублимационной сушки. Фармацевтические композиции, пригодные для ректального введения, могут быть представлены как суппозитории, содержащие единичную дозу. Их можно получить путем смешивания соединения (IA) с одним или более обычных твердых носителей, например с маслом какао или глицеридами, с последующим формованием полученной смеси. Фармацевтические композиции, пригодные для местного нанесения на кожу, могут быть в виде мази, крема, лосьона, пасты, геля, спрея, аэрозоля или масла. Носители, которые можно использовать,включают вазелин, ланолин, полиэтиленгликоли, спирты и сочетания двух или более указанных веществ. Содержание соединения (IA) в композиции обычно составляет от 0,1 до 15 мас.%, например от 0,5 до 2%. Местное введение по настоящему изобретению означает введение вдуванием и ингаляцией. Примеры различных типов препаратов для местного введения включают мази, кремы, лосьоны, порошки, пес-6 020037 сарии, спреи, аэрозоли, капсулы или картриджи для использования в ингаляторе или инсуффляторе или капли (например, глазные капли или капли для носа). Мази и кремы можно составлять, например, на водной или масляной основе с добавлением подходящих загустителей, и/или гелеобразователей, и/или растворителей. Такие основы могут, таким образом,содержать, например, воду и/или масло, в том числе вазелиновое масло или растительное масло, например арахисовое масло или касторовое масло, или растворитель, например полиэтиленгликоль. Загустители, которые можно использовать, включают мягкий парафин, стеарат алюминия, цетостеариловый спирт,полиэтиленгликоли, микрокристаллический воск и пчелиный воск. Лосьоны можно составлять на водной или масляной основе, обычно они также содержат один или несколько эмульгаторов, стабилизаторов, диспергаторов, суспендирующих средств или загустителей. Порошки для наружного применения можно получить, используя любую подходящую порошковую основу, например тальк, лактозу или крахмал. Капли можно составить на водной или неводной основе,также включающей один или несколько диспергирующих, солюбилизирующих или суспендирующих средств. Спреи можно приготовить, например, в виде водных растворов или суспензий или в виде аэрозолей,заключенных в герметичные упаковки, с использованием подходящего пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, 1,1,1,2,3,3,3-гептафторпропана,1,1,1,2-тетрафторэтана, углекислого газа или другого подходящего газа. Капсулы и картриджи для использования в ингаляторе или инсуффляторе, например, из желатина могут содержать порошкообразную смесь соединения по изобретению и подходящей порошковой основы, такой как лактоза или крахмал. Фармацевтические композиции по настоящему изобретению можно также использовать в комбинации с другими терапевтически активными агентами, например в комбинации с другими классами дислипидемических лекарств (например, статинами, фибратами, смолами, связывающими желчную кислоту, или никотиновой кислотой). Соединение (IA) можно использовать в комбинации с одним или несколькими другими терапевтически активными агентами, например в комбинации с другими классами дислипидемических лекарств,например с ингибиторами 3-гидрокси-3-метилглутарил-коэнзим А редуктазы (статины), или фибратами,или смолами, связывающими желчную кислоту, или никотиновой кислотой. В одном из аспектов настоящее изобретение предлагает комбинаци, включающую:b) одно или несколько терапевтически активных агентов. Таким образом, настоящее изобретение в следующем аспекте предлагает применение такой комбинации для лечения заболеваний, где недостаточная активация рецептора НМ 74 А способствует развитию заболевания, или в случае целесообразности активации рецептора, а также применение соединения (IA) в производстве лекарственного средства для комбинированной терапии дислипидемии, гиперлипопротеинемии, диабетической дислипидемии и смешанной дислипидемии, сердечной недостаточности, гиперхолестеринемии, сердечно-сосудистого заболевания, атеросклероза, артериосклероза и гипертриглицеридемии, сахарного диабета типа II, диабета типа I, резистентности к инсулину, гиперлипидемии, нервной анорексии или ожирения. Когда соединения по настоящему изобретению используют в комбинации с другими терапевтическими агентами, соединения можно вводить последовательно или одновременно любым удобным путем. Комбинации, упомянутые выше, могут быть представлены для применения в форме фармацевтической композиции, и, таким образом, фармацевтические композиции, содержащие такие комбинации, оптимально вместе с фармацевтически приемлемым носителем или эксципиентом составляют следующий аспект изобретения. Индивидуальные компоненты таких комбинаций можно вводить последовательно или одновременно в отдельных или объединенных фармацевтических композициях. Следует понимать, что в случае их комбинации в одной и той же композиции эти два компонента должны быть устойчивыми и совместимыми друг с другом и другими компонентами композиции, предназначенной для введения. В случае раздельного введения их можно получить в виде любой подходящей композиции, таким образом, как известно для таких соединений в данной области. В случае комбинации со вторым терапевтическим агентом, действующим против того же самого заболевания, доза каждого компонента может отличаться от случая, когда соединение используется индивидуально. Подходящие дозы может легко определить специалист в данной области. Таким образом, следующий аспект настоящего изобретения относится к комбинации, включающей соединение (IA) вместе с другим терапевтически активным агентом, являющимся ниацином или аторвастатином натрия. Указанную выше комбинацию можно предложить для применения в форме фармацевтической композиции, и, таким образом, фармацевтические композиции, включающие данную комбинацию, вместе с фармацевтически приемлемым носителем представляют следующий аспект изобретения. Соединения настоящего изобретения имеют подходящую длительность действия. Способы получения Настоящее изобретение далее предлагает способ получения трис-соли 8-хлор-3-пентил-3,7 дигидро-1 Н-пурин-2,6-диона, как показано на схеме 1. Стадии 1-5 описаны в международной заявке WO 2005/077950, которая полностью включается в настоящий документ посредством ссылки. Стадия 1: алкилирование гуанозина аллилбромидом. Стадия 2: диазотирование нитритом натрия с последующим гидролизом для получения ксантина. Стадия 3: хлорирование. Стадия 4: алкилирование атома N3 и/или диалкилирование атомов N1 и N3. Стадия 5: катализируемое палладием удаление аллильной группы. В качестве альтернативы, стадию 5 можно также проводить путем снятия защиты диметилбарбитуровой кислотой. Заключительная стадия получения трис-соли - сочетание соединения (А) с трис-(гидроксиметил)аминометаном, как показано ниже. Приведенные ниже примеры иллюстрируют настоящее изобретение и не предназначены для ограничения его объема каким-либо образом. Примеры Пример 1. Получение соли 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин-2,6-диона и трис-(гидроксиметил)аминометана (также известно как 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин-2,6-дион 2-амино-2-гидроксиметил)-1,3-пропандиол (IUPAC). Получали суспензию, содержащую 1,0 г 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин-2,6-диона в 10 объемах ацетонитрила с добавлением 1,1 экв. трис-(гидроксиметил)аминометана в 1,2 объемах воды. Реакционную смесь нагревали с обратным холодильником приблизительно при 75-77C, что привело к растворению указанных выше компонентов. После первоначального растворения компонентов начиналось быстрое самопроизвольное образование кристаллов. Кристаллы соли 8-хлор-3-пентил-3,7-дигидро-1 Нпурин-2,6-диона и трис-(гидроксиметил)аминометана выделяли фильтрованием (выход продукта 94%). Пример 2. Получение соли 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин-2,6-диона и трис-(гидроксиметил)аминометана. К суспензии 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин-2,6-диона (22 кг, содержит приблизительно 16% воды) в ацетоне (125 л) добавляли раствор трис-(гидроксиметил)аминометана (9,3 кг) в воде(79,8 кг) при комнатной температуре. После нагревания с обратным холодильником почти до температуры кипения (55C) раствор фильтровали через фильтрующий картридж (1,2 мкм) при 55C и поддерживали температуру от 61 до 63C. После выдерживания в течение 30 мин раствор охлаждали до 53-57C и вносили кристаллы затравки (0,062 кг), которые получали таким же образом путем кристаллизации из водного раствора ацетона или по методике в приведенном выше примере 1 в виде суспензии в ацетоне(2 л). В данном процессе кристаллизация на затравках обеспечивала регулирование размера частиц и получение продукта в желательной форме. Смесь перемешивали при 53-57C в течение 1 ч. Затем полученную суспензию медленно охлаждали при перемешивании до 18-22C и добавляли ацетон (75 л) в течение 30 мин. После перемешивания при 18-22C в течение 30 мин полученную суспензию охлаждали до -5-0C, выдерживали в течение 18 ч, отфильтровали и промыли осадок предварительно охлажденным ацетоном (75 л). Полученную соль 8-хлор 3-пентил-3,7-дигидро-1 Н-пурин-2,6-диона и трис-(гидроксиметил)аминометана высушивали при 45-50C в вакууме. Выход: 18,2 кг (67% от теоретического). Пример 3. Получение соли 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин-2,6-диона и трис-(гидроксиметил)аминометана. Растворяли 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин-2,6-дион (29 кг) в ДМСО (40 л) при повышенной температуре около 90-100 С и фильтровали через 5-микронный фильтр, затем промывали ДМСО(13 л). трис-(Гидроксиметил)аминометан (15,1 кг) растворяли в воде (44 л) и фильтровали через 5-микронный фильтр в тот же сосуд, затем промывали водой (15 л). Содержимое сосуда затем нагревали приблизительно до 95C до получения прозрачного раствора. Раствор охлаждали до 88C и вносили кристаллы затравки, полученные таким же образом путем кристаллизации из водного раствора ацетона или по методике в приведенном выше примере 1. В данном процессе кристаллизация на затравках обеспечивала регулирование размера частиц и получение продукта в желательной форме. Затем полученную суспензию выдерживали около 30 мин и охлаждали до 0C. Продукт выделяли фильтрованием, промывали при -5C смесью ДМСО/вода (1:1, 58 л) и около 5 С ацетоном (258 л). Полученный продукт высушивали при 50C в вакууме. Выход: 35,4 кг (83% от теоретического). Пример 4. Получение фармацевтической композиции, содержащей соль 8-хлор-3-пентил-3,7 дигидро-1 Н-пурин-2,6-диона и трис-(гидроксиметил) аминометана. Количество 36,75, 73,50 или 147,00 мг трис-соли требуется для получения 25, 50 или 100 мг свободной кислоты соответственно согласно коэффициенту пересчета 1,47. Количество лекарственного вещества можно регулировать на основании чистоты образца. 2 Воду удаляют при обработке. 3 Растительный источник. трис-Соль, порошок маннита, повидон, кроссповидон и очищенную воду гранулировали с помощью гранулятора с псевдоожиженным слоем. Затем псевдоожиженный слой высушивали. Гранулы затем смешивали с микрокристаллической целлюлозой, кроссповидоном и стератом магния и прессовали на таблетировочном прессе. Затем полученные таблетки покрывали пленкой из водного раствора, содержащего Opadry. Повидон (поливинилпирролидон) - синтетический полимер, содержащий линейные 1-винил-2 пирролидоновые группы и имеющий среднюю молекулярную массу около 10000-700000, который поставляет фирма BASF Chemicals. Повидон используют как связующее в процессе гранулирования. Кроссповидонпоперечно сшитый повидон, используется как водонерастворимый дезинтегрант в концентрации от 2 до 5% для изготовления таблеток. Его поставляет фирма BASF Chemicals.Opadry White OY-S-9603 - патентованный материал для нанесения пленок, который поставляет фирма Colorcon. Регистрационный номер лекарственных средств фирмы 721 Colorcon для производства и контроля пленочных покрытий из водного раствора Opadry White OY-S-9603. Согласно настоящему изобретению различные формы соединений по настоящему изобретению (т.е. включая сольваты) отличаются друг от друга при использовании различных способов исследования и идентификации. В число данных способов входят твердофазный ядерный магнитный резонанс (ЯМР) 13 С, ЯМР 31 Р, инфракрасная (ИК) и рамановская спектроскопия комбинационного рассеяния (КР), рентгенофазовый анализ (РФА) и т.д. и/или другие способы, например дифференциальная сканирующая калориметрия (ДСК) (в которой измеряется количество энергии (тепла), поглощаемой иди выделяемой образцом при его нагревании, охлаждении или выдерживании при постоянной температуре). трис-Соль по настоящему изобретению определенно описывается данными, приведенными на фиг. 1-6. Следующие характеристики получены для трис-(гидроксиметил)аминометановой (трис)соли 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин-2,6-диона по настоящему изобретению (IA). Будет показано, что спектральные и дифракционные данные незначительно изменяются вследствие различных факторов, включая температуру, концентрацию и использованные приборы. Пример 5. Спектр поглощения в ультрафиолетовой/видимой области. Спектр поглощения в УФ/видимой области получен в смеси ацетонитрил/вода (95:5). Приготовленный образец, содержащий 0,02 мг/мл трис-соли, исследовали в кювете шириной 1 см. Спектры получали при скорости развертки 300 нм/мин на спектрометре Varian Cary 50. Пример 6. Определение температуры плавления методом дифференциальной сканирующей калориметрии. Температуру плавления или термическое поведение трис-соли по настоящему изобретению исследовали методом дифференциальной сканирующей калориметрии (ДСК). Начало плавления обычно наблюдают при 2122 С. Исследование методом ДСК проводили с помощью калориметра ТА Q1000. Образец взвешивали в алюминиевой кювете, которую закрывали крышкой и слегка гофрировали, не герметизируя кювету. Эксперимент проводили со скоростью нагревания 10 С/мин. Примеры 7 и 8. Спектры ядерного магнитного резонанса 1 Н и 13 С. Спектры 1 Н ЯМР записывали с помощью спектрометра Varian на частоте 400 МГц при 298 К. Образец растворяли в ДМСО-d6 и измеряли химические сдвиги в м.д. относительно сигнала тетраметилсилана(ТМС) при 0 м.д. Константы спин-спинового взаимодействия (J) измеряли в герцах (Гц). Расщепление сигналов описывали наблюдаемыми мультиплетами и обозначали буквами "с" (синглет), "д" (дублет), "т"(триплет), "к" (квадруплет), "дд" (двойной дублет), "дт" (двойной триплет), "м" (мультиплет), "ш" (широкий сигнал). Спектр 1 Н ЯМР (400 МГц, ДМСО-d6)м.д.: 10,07-5,41 (ш, 7 Н), 3,80 (т, 2 Н), 3,52 (с, 6 Н), 1,61 (м,2 Н), 1,29 (м, 1 Н), 1,28 (м, 2 Н), 0,86 (т, 3H). Спектры 13 С ЯМР записывали с помощью спектрометра Varian на частоте 100 МГц при 298 К. Образец растворяли в ДМСО-d6 и измеряли химические сдвиги в м.д. относительно сигнала тетраметилсилана (ТМС) при 0 м.д. Спектр 13 С ЯМР (100 МГц, ДМСО-d6, 25 мг/мл, 25 С)м.д.: 157,0, 151,0, 150,9, 142,8, 115,2, 61,0,59,4, 42,0, 28,4, 27,3, 22,0, 13,9. Пример 9. Масс-спектр электрораспылительной ионизации положительных ионов. Масс-спектры снимали на спектрометре Q-TOF Premier LC-MS. Образцы растворяли в смеси ацетонитрил/вода и ионизировали методом электрораспылительной ионизации. Температура десольватирующего газа составляла 350 С, а скорость потока десольватирующего газа - 600 л/ч. Напряжение распыления составляло 3,5 кВ, а поддерживаемая температура источника - 120 С. Скорость потока реагентного газа составляла 0,5 мл/мин. Точная измеренная масса протонированной молекулы 257,0804 Да. Вычисленная масса этого иона 257,0805 Да. Масс-спектр (m/z), Да: 257,0804 [М+Н+], 187, 170, 144 (данные измерения элементного состава данного иона с точностью 0,3 м.д.). Пример 10. Инфракрасный (ИК) спектр. Спектр ИК МНПВО, волновые числа пиков (см-1): 3370, 3041, 2946, 2858, 1680, 1656, 1528, 1266,1243, 1078, 1068, 1049. Спектр ИК МНПВО записывали после 128-кратного сканирования с разрешением 4 см-1 с помощью спектрометра SensIRTravel IR DATR. Пример 11. Порошковая рентгенограмма (РФА). трис-Соль 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин-2,6-диона по настоящему изобретению кристаллическая, согласно данным порошковой рентгенограммы (РФА), приведенной на фиг. 2. Порошковую рентгенограмму (РФА) на фиг. 2 снимали на порошковом дифрактометре PANalyticalX'Pert Pro с детектором X'Celerator и щелью с фиксированным проходным сечением. Условия съемки: излучение CuK, напряжение генератора 40 кВ, ток генератора 40 мА, начальный угол 2 2,0, конечный угол 2 40,0, длина шага 2 0,017. Во время съемки образец вращался. Характеристические углы РФА и межплоскостные расстояния d приведены в табл. 1. Таблица 1 Характеристические углы РФА и межплоскостные расстояния d. Опытному специалисту понятно, что на положение пиков РФА влияет различная высота образца. Таким образом, указанные положения пиков 2 могут изменяться на 0,2. Пример 12. Элементный анализ. Стехиометрию трис-(гидроксиметил)аминометановой (трис)соли подтверждают представленные данные элементного анализа, которые согласуются с теоретическими значениями для соответствующей молекулярной формулы (табл. 2). Следует понимать, что настоящее изобретение не ограничено вариантами осуществления, приведенными выше, и сохраняется право на проиллюстрированные варианты и все изменения в объеме следующей формулы изобретения. Различные ссылки на журналы, патенты и другие публикации, которые приведены в настоящем документе, описывают предыдущий уровень техники и включены в настоящий документ посредством ссылки, как если бы они были изложены в полном объеме. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представляющее собой 8-хлор-3-пентил-3,7-дигидро-1 Н-пурин-2,6-дион трис(гидроксиметил)аминометан формулы (IA) 2. Соединение по п.1, которое представляет собой безводный 8-хлор-3-пентил-3,7-дигидро-1 Нпурин-2,6-дион и трис-(гидроксиметил)аминометан. 3. Соединение по п.1 или 2, которое является кристаллическим. 4. Соединение по любому из пп.1-3, где кристаллическая форма соединения характеризуется порошковой рентгенограммой, содержащей следующие пики: 5. Соединение по любому из пп.1-4, где кристаллическая форма соединения характеризуется порошковой рентгенограммой, приведенной на фиг. 2. 6. Соединение по любому из пп.1-5, где кристаллическая форма соединения характеризуется эндотермическим плавлением с температурой начала плавления 2122 С на термограмме ДСК. 7. Соединение по любому из пп.1-6, где кристаллическая форма соединения характеризуется следующими максимумами поглощения в спектре ИК МНПВО твердого продукта: 3370, 3041, 2946, 2858,1680, 1656, 1528, 1266, 1243, 1078, 1068, 10491 см-1. 8. Соединение по любому из пп.1-7, где кристаллическая форма соединения характеризуется спектром ИК МНПВО, приведенным на фиг. 6. 9. Комбинация для лечения состояния, вызванного недостаточной активацией рецептора НМ 74 А,или состояния, для которого целесообразна активация рецептора НМ 74 А, включающая а) соединение по любому из пп.1-8 и b) одно или несколько терапевтически активных агентов. 10. Комбинация для лечения состояния, вызванного недостаточной активацией рецептора НМ 74 А,или состояния, для которого целесообразна активации рецептора НМ 74 А, включающая а) соединение по любому из пп.1-8 и b) ниацин или аторвастатин натрия. 11. Применение соединения по любому из пп.1-8 в лечении смешанной дислипидемии, диабетической дислипидемии или гиперлипопротеинемии. 12. Применение соединения по любому из пп.1-8 в лечении сахарного диабета типа II. 13. Применение соединения по любому из пп.1-8 в лечении диабетической дислипидемии, смешанной дислипидемии, сердечной недостаточности, гиперхолестеринемии, сердечно-сосудистых заболеваний, атеросклероза, артериосклероза, гипертриглицеридемии, сахарного диабета типа II, диабета типа I,резистентности к инсулину, гиперлипидемии, нервной анорексии, ожирения, заболевания коронарных артерий, тромбоза, стенокардии, хронической почечной недостаточности, периферического сосудистого заболевания или инсульта. 14. Применение соединения по любому из пп.1-8 в производстве лекарственного средства, применяемого для лечения смешанной дислипидемии, диабетической дислипидемии или гиперлипопротеинемии. 15. Применение соединения по любому из пп.1-8 в производстве лекарственного средства для лечения сахарного диабета типа II. 16. Применение соединения по любому из пп.1-8 в производстве лекарственного средства для лечения диабетической дислипидемии, смешанной дислипидемии, сердечной недостаточности, гиперхолестеринемии, сердечно-сосудистых заболеваний, атеросклероза, артериосклероза, гипертриглицеридемии,сахарного диабета типа II, диабета типа I, резистентности к инсулину, гиперлипидемии, нервной анорексии, ожирения, заболевания коронарных артерий, тромбоза, стенокардии, хронической почечной недостаточности, периферического сосудистого заболевания или инсульта. 17. Способ лечения пациента в состоянии, вызванном недостаточной активацией рецептора НМ 74 А, или в случае целесообразности активации рецептора НМ 74 А, включающий введение данному пациенту эффективного количества соединения по любому из пп.1-8. 18. Способ по п.17, где пациент страдает диабетической дислипидемией, смешанной дислипидемией или гиперлипопротеинемией. 19. Способ по п.17, где пациент страдает сахарным диабетом типа II. 20. Фармацевтическая композиция для лечения состояния, вызванного недостаточной активацией рецептора НМ 74 А, или состояния, для которого целесообразна активация рецептора НМ 74 А, содержащая а) соединение по любому из пп.1-8 и b) один или несколько фармацевтически приемлемых носителей.
МПК / Метки
МПК: A61P 3/04, A61K 31/52, A61P 3/10, A61P 9/04, C07D 473/00
Метки: производные, ксантина
Код ссылки
<a href="https://eas.patents.su/17-20037-proizvodnye-ksantina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные ксантина</a>
Предыдущий патент: Замороженное кондитерское изделие и способ его получения
Следующий патент: Способ и устройство для очистки метанола
Случайный патент: Система пересылки файлов












