Гидролизат казеина, способ его получения и применение
Номер патента: 11570
Опубликовано: 28.04.2009
Авторы: Нисимура Синго, Готоу Таканобу, Мизуно Сейити, Ямамото Наоюки, Мацуура Кейити, Синода Тадаси
Формула / Реферат
1. Гидролизат казеина, содержащий свободные аминокислоты и пептиды, полученный гидролизом животного молочного казеина до средней длины цепи не более 2,1, выраженной количеством аминокислотных остатков, в котором указанные пептиды содержат неперевариваемые in vivo пептиды, состоящие из дипептидов, имеющих последовательность Хаа-Pro, и трипептидов, имеющих последовательность Хаа-Pro-Pro, и в котором содержание дипептидов, имеющих последовательность Хаа-Pro, составляет не менее 5 мас.% от общего количества свободных аминокислот и пептидов в гидролизате, и содержание трипептидов, имеющих последовательность Хаа-Pro-Pro, составляет не менее 1 мас.% от общего количества свободных аминокислот и пептидов в гидролизате.
2. Применение гидролизата казеина по п.1 для получения пищевой добавки.
3. Гидролизат казеина по п.1, в котором дипептиды, имеющие последовательность Хаа-Pro, содержат Ile-Pro, Glu-Pro, Arg-Pro, Gln-Pro, Met-Pro и Tyr-Pro, и трипептиды, имеющие последовательность Хаа-Pro-Pro, содержат Ser-Pro-Pro, Ile-Pro-Pro и Val-Pro-Pro.
4. Способ получения гидролизата казеина по п.1, включающий стадию (А) гидролиза животного молочного казеина до средней длины цепи не более 2,1 с использованием группы ферментов, способных расщеплять животный молочный казеин до гидролизата казеина, имеющего среднюю длину цепи не более 2,1, выраженную количеством аминокислотных остатков, в котором группа ферментов включает пептидазы, способные расщеплять пептидную связь Pro-Хаа, по меньшей мере один фермент из числа нейтральной протеазы I, нейтральной протеазы II и лейцинаминопептидаз.
5. Способ по п.4, в котором группа ферментов представляет собой внеклеточные ферменты, полученные из Aspergillus oryzae.
6. Способ по п.4, в котором гидролиз осуществляют посредством одностадийного взаимодействия с группой ферментов.
7. Способ по п.4, в котором животный молочный казеин представляет собой казеин коровьего молока.
8. Способ по п.4, в котором группа ферментов дополнительно содержит по меньшей мере один фермент из числа металлопротеаз и серинпротеаз.
9. Способ по п.4, в котором пептидазы, способные расщеплять пептидную связь Pro-Хаа, представляют собой группу ферментов, имеющих изоэлектрические точки в кислой области.
10. Способ по п.4, в котором на стадии (А) концентрация казеина при гидролизе животного молочного казеина составляет от 1 до 19 мас.% и массовое соотношение группы ферментов и животного молочного казеина составляет не менее 1/100.
11. Применение гидролизата казеина по п.1 для получения агента, обладающего активностью по ингибированию ангиотензин-превращающего фермента.
12. Применение гидролизата казеина по п.1 для получения агента, обладающего гипотензивным эффектом.
Текст
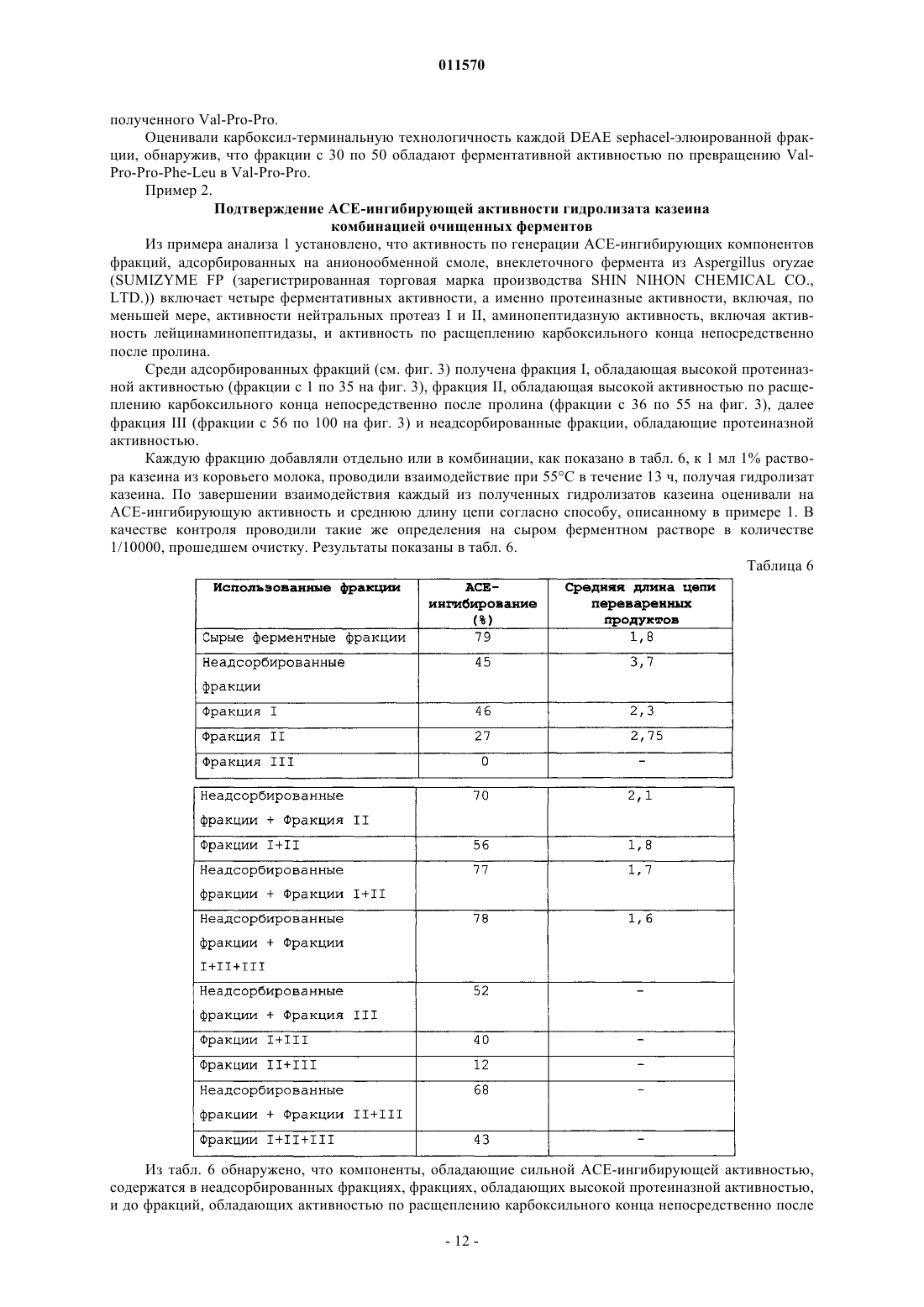
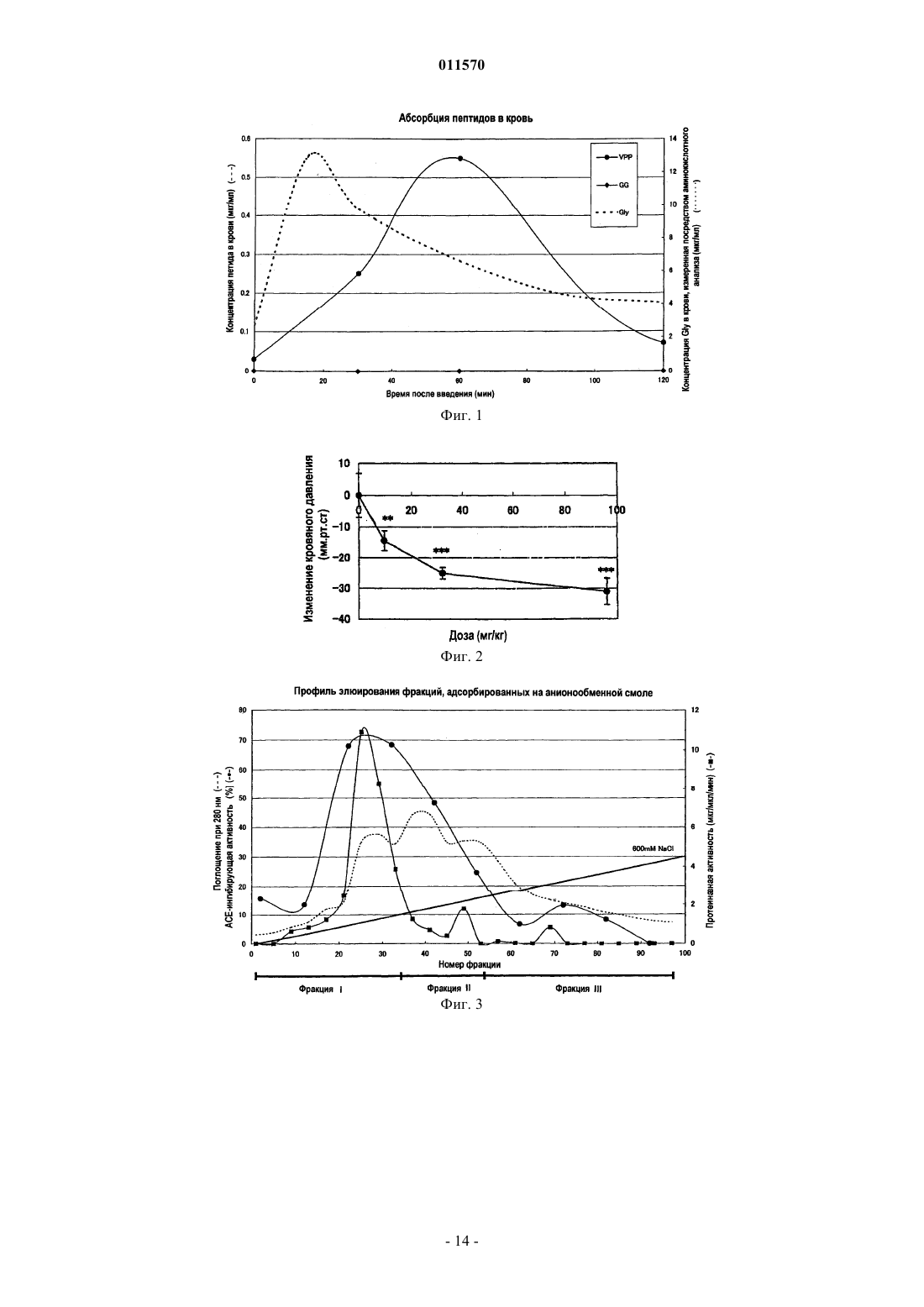
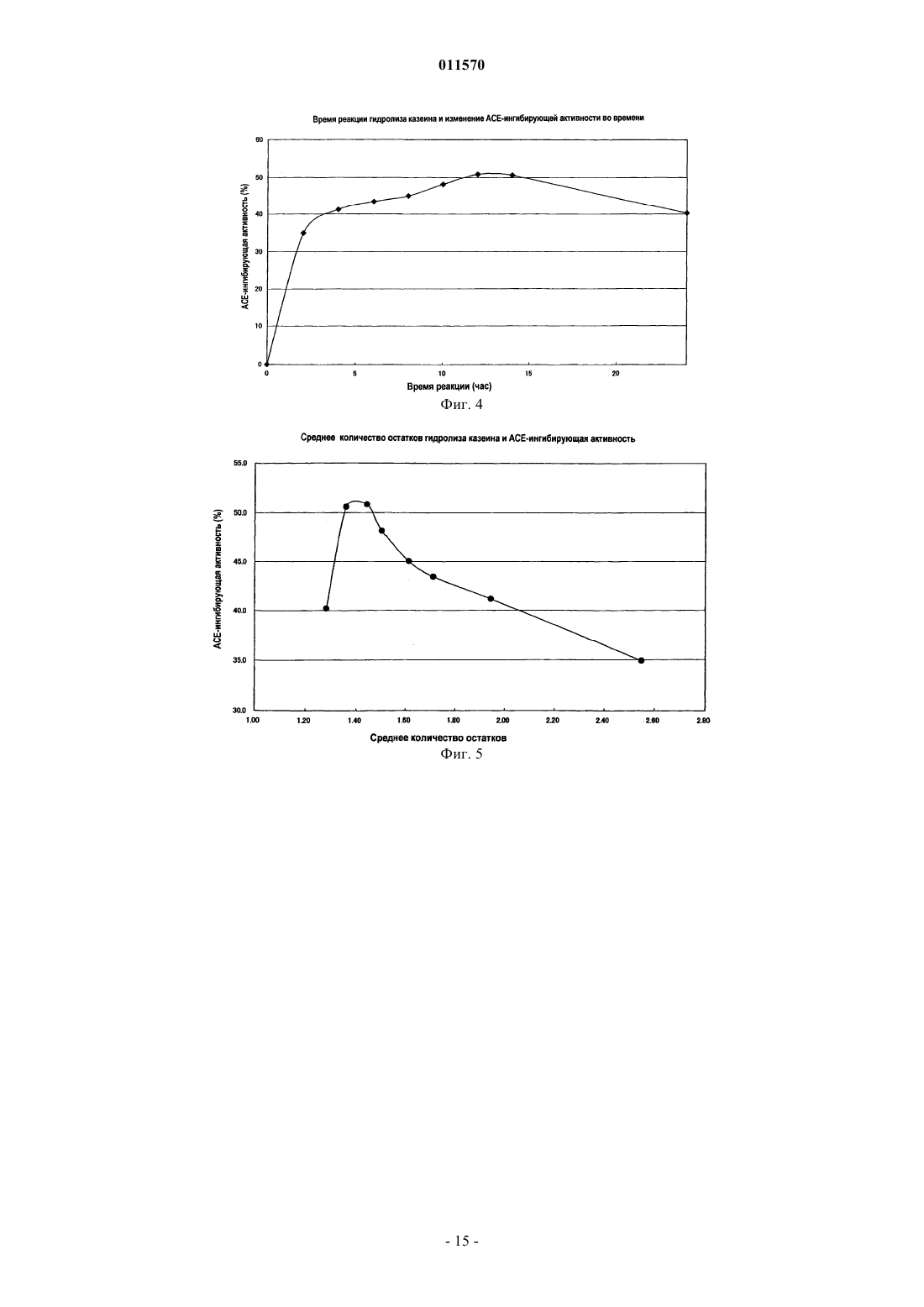
011570 Область изобретения Настоящее изобретение касается гидролизата казеина, который получают гидролизом животного молочного казеина и который, как ожидается, проявляет разнообразные функции, включая активность по ингибированию ангиотензин-конвертирующего фермента и гипотензивное действие, и пригоден для различных пищевых продуктов и лекарственных средств, а также способа получения такого гидролизата казеина и его применения. Предпосылки изобретения Сообщалось о множестве пептидов, имеющих разнообразные функции, такие как гипотензивный эффект, антибактериальная активность, кальцийрастворяющий эффект и иммуномодулирующий эффект,и эти пептиды используются в пищевых продуктах и лекарственных препаратах. Например, предлагаются гипотензивные пептиды, многие из которых обладают активностью по ингибированию ангиотензин-конвертирующего фермента (здесь ниже обозначен АСЕ). АСЕ конвертирует предшественник, ангиотензин I, в ангиотензин II, обладающий сосудосуживающей активностью в живом организме, повышая при этом кровяное давление. Таким образом, предполагается, что пептиды, обладающие АСЕ-ингибирующей активностью, демонстрируют гипотензивный эффект, подавляя производство ангиотензина II посредством ингибирования АСЕ в живом организме. При разработке гипотензивных пептидов исследования обычно направлены, в первую очередь, на пептиды, обладающие АСЕингибирующей активностью, так что признаком гипотензивного действия предлагаемых пептидов является, главным образом, АСЕ-ингибирующий эффект как показатель. К настоящему времени предложено и применяется для профилактики и лечения гипертонии большое количество агентов, оказывающих гипотензивное действие и оцененных по их АСЕ-ингибирующей активности как показателю. При получении функциональных пептидов, таких как пептиды, оказывающие гипотензивное действие, оцениваемое по АСЕ-ингибирующему эффекту, в частности, при получении функциональных пептидов посредством переваривания пищевого белка ферментами, после ферментативного переваривания обычно требуются сложные стадии, например концентрирование, очистка и выделение переваренных продуктов для лучшего проявления функциональных эффектов. Ожидается, что в качестве пептидов, которые абсорбируются в кровь в пищеварительном тракте,проявляя свои функции в живом организме, полезны in vivo неперевариваемые пептиды, которые имеют высокую абсорбционную способность и устойчивость к перевариванию относительно различных пищеварительных ферментов в живом организме. Однако точно известно, какие пептиды содействуют повышению in vivo устойчивости к перевариванию. Таким образом, требуется разработка продуктов ферментативного переваривания для пищевых или лекарственных препаратов и способов получения таких продуктов, которые имеют высокую in vivo устойчивость к перевариванию и могут эффективно проявлять свои желательные функции, не подвергаясь сложным способам обработки, таким как концентрирование,очистка или выделение после ферментативного переваривания. Например, патентная публикация 1 раскрывает способ получения смеси низкомолекулярных пептидов, состоящей, главным образом, из дипептидов и трипептидов, имеющих среднюю длину цепи не более 3 и превосходную кишечную абсорбционную способность. Смесь пептидов готовят из соевого белка при одновременном или последовательном действии двух или более ферментов, обладающих эндопротеазной активностью и, по существу, не обладающих экзопротеазной активностью, с образованием не более 5% свободных аминокислот. Патентная публикация 2 раскрывает функциональную пищу, использующую продукты переваривания соевого белка, и способы ее получения. Продукты переваривания содержат в качестве активных ингредиентов дипептид и трипептиды, включающие Ala-Tyr, Gly-Tyr-Tyr,Ala-Asp-Phe и Ser-Asp-Phe, полученные перевариванием термоденатурированного соевого белка с применением таких ферментов как протеазы, производные Aspergillus oryzae. Продукты переваривания предпочтительно имеют среднюю длину цепи пептида от 2 до 4 и содержат от 20 до 30 мас.% свободных аминокислот. Однако данные ферментативные продукты переваривания соевого белка имеют компоненты, которые полностью отличаются от компонентов продуктов ферментативного переваривания животного молочного казеина. Таким образом, указанные выше патентные публикации ничего не предлагают по поводу способов получения из животного молочного казеина как исходного материала, продуктов переваривания казеина и гидролизата казеина, которые имеют высокую концентрацию активных ингредиентов и превосходную абсорбционную способность в живом организме и могут использоваться без необходимой сложной обработки, такой как концентрирование, очистка и выделение. С другой стороны, патентные публикации 3 и 4 предлагают способы получения пептидов, имеющих различные функции, перевариванием животного молочного казеина с использованием ферментов, таких как протеазы и пептидазы, и конкретных функциональных пептидов, получаемых данными способами. Однако раскрытые в данных публикациях продукты ферментативного переваривания предназначены для получения конкретных пептидов как активных ингредиентов. Соответственно, в данных публикациях отсутствуют указания относительно гидролиза животного молочного казеина до средней длины цепи не более 2,1, конкретного способа гидролиза и эффективности гидролизата казеина, имеющего конкретную среднюю длину цепи.-1 011570 Патентная публикация 1: JP-5-252979-A. Патентная публикация 2: JP-2003-210138-A. Патентная публикация 3: JP-6-128287-A. Патентная публикация 4: JP-2001-136995-A. Краткое описание изобретения Целью настоящего изобретения является обеспечение гидролизата казеина, содержащего in vivo неперевариваемые пептиды и свободные аминокислоты, имеющего минимальную in vivo ферментную перевариваемость и, как ожидается, проявляющего функции, например гипотензивный эффект в живом организме. Другой целью настоящего изобретения является обеспечение способа получения указанного выше гидролизата казеина, который позволяет легко и эффективно получать указанный выше гидролизат казеина без необходимости включения сложных процессов. Еще одной целью настоящего изобретения является обеспечение агента, обладающего АСЕингибирующей активностью или гипотензивным эффектом, который содержит in vivo неперевариваемые пептиды и свободные аминокислоты, оказывает, как ожидается, превосходное гипотензивное действие в живом организме и применим для различных функциональных пищевых продуктов или лекарственных препаратов. Заявители настоящего изобретения провели интенсивные исследования для достижения указанных выше целей, обнаружив, что при гидролизе животного молочного казеина до средней длины цепи не более 2,1, выраженной количеством аминокислотных остатков, можно получить гидролизат казеина, содержащий свободные аминокислоты и низкомолекулярные пептиды, например трипептиды и дипептиды,в котором эффективно образуются свободные аминокислоты и молекулы in vivo неперевариваемых пептидов, имеющих остаток Pro. Заявители настоящего изобретения также обнаружили, что in vivo неперевариваемые пептиды,имеющие остаток Pro на карбоксильном конце, имеют, как ожидалось, высокую устойчивость к перевариванию относительно in vivo пептидаз, так что вполне вероятно для таких неперевариваемых пептидов полностью проявлять свои функции в живом организме, и что гидролизат казеина имеет высокое содержание пептидов с хорошей in vivo абсорбционной способностью, таких как дипептиды и трипептиды, так что гидролизат казеина способен полностью проявлять различные функции, например гипотензивный эффект, в живом организме, осуществляя, таким образом, настоящее изобретение. Кроме того, заявители настоящего изобретения выполнили исследования по поиску ферментов, которые эффективно продуцируют гидролизат казеина по настоящему изобретению, среди различных известных ферментов, обнаружив, что конкретный класс ферментов способен с высокой степенью эффективности продуцировать гидролизат казеина по настоящему изобретению. Согласно настоящему изобретению предложен гидролизат казеина, содержащий свободные аминокислоты и пептиды, полученный гидролизом животного молочного казеина и имеющий среднюю длину цепи не более 2,1, выраженную количеством аминокислотных остатков. Более конкретно, настоящее изобретение касается указанного выше гидролизата казеина, в котором пептиды содержат in vivo неперевариваемые пептиды, состоящие из дипептидов, имеющих последовательность Хаа-Pro, и трипептидов,имеющих последовательность Хаа-Pro-Pro, и в котором содержание дипептидов, имеющих последовательность Хаа-Pro, не ниже 5 мас.% от общего количества пептидов и свободных аминокислот в гидролизате и содержание трипептидов, имеющих последовательность Хаа-Pro-Pro, не ниже 1 мас.% от общего количества пептидов и свободных аминокислот в гидролизате. Используемое здесь обозначение Хаа может представлять любую аминокислоту. Согласно настоящему изобретению предложен также указанный выше способ получения гидролизата казеина, включающий стадию (А) гидролиза животного молочного казеина до средней длины цепи не более 2,1 посредством группы ферментов, способных переваривать животный молочный казеин в гидролизат казеина, имеющий среднюю длину цепи не более 2,1, выраженной количеством аминокислотных остатков. Согласно настоящему изобретению предложен также агент, обладающий АСЕ-ингибирующей активностью или гипотензивным эффектом, содержащий указанный выше гидролизат казеина в качестве активного ингредиента. Согласно настоящему изобретению предложено также применение указанного выше гидролизата казеина в производстве функциональных пищевых продуктов или лекарственных препаратов, обладающих АСЕ-ингибирующей активностью или гипотензивным эффектом. Гидролизат казеина по настоящему изобретению содержит свободные аминокислоты и низкомолекулярные пептиды, такие как in vivo неперевариваемые пептиды, получаемыегидролизом животного молочного казеина до средней длины цепи не более 2,1, выраженной количеством аминокислотных остатков. Таким образом, ожидается, что настоящий гидролизат казеина при пероральном приеме проявляет превосходную in vivo абсорбционную способность и различные функции в живом организме и применим для различных функциональных пищевых продуктов, лекарственных препаратов и пищевых добавок. Например, настоящий гидролизат казеина предполагается для использования в агенте, обладающем-2 011570 АСЕ-ингибирующей активностью или гипотензивным эффектом, содержащем настоящий гидролизат в качестве активного ингредиента. Настоящий способ включает стадию (А) гидролиза животного молочного казеина до средней длины цепи не более 2,1 с применением группы ферментов, способных переваривать животный молочный казеин в гидролизат казеина со средней длиной цепи не более 2,1, выраженной количеством аминокислотных остатков. Следовательно, способ допускает легкое и эффективное получение гидролизата казеина по настоящему изобретению. Таким образом, настоящий способ полезен в промышленном производстве гидролизата казеина по настоящему изобретению. Краткое описание чертежей На фиг. 1 представлен график, показывающий результаты оценки in vivo абсорбционной способности и устойчивости к перевариванию Хаа-Pro и Хаа-Pro-Pro, выполненной в примере 1; на фиг. 2 - график, показывающий результаты эксперимента по определению зависящего от дозы гипотензивного эффекта порошков гидролизата казеина, полученных в примере 1; на фиг. 3 - график, показывающий соотношение между схемой элюирования связанного белка с линейным градиентом от 0 до 0,6 М NaCl и протеолитической активностью в примере анализа 1; на фиг. 4 - график, показывающий соотношение между временем переваривания казеина с использованием группы ферментов и АСЕ-ингибирующей активностью гидролизата казеина, полученного в примере 3; на фиг. 5 - график, показывающий соотношение между средней длиной цепи и АСЕ-ингибирующей активностью гидролизата казеина, полученного гидролизом казеина с использованием группы ферментов в примере 3. Предпочтительные варианты изобретения Теперь настоящее изобретение будет объяснено подробно. Гидролизат казеина по настоящему изобретению содержит свободные аминокислоты и пептиды, полученные гидролизом животного молочного казеина до определенного диапазона величин средней длины цепи, выраженной количеством аминокислотных остатков. Количество свободных аминокислот и пептидов предпочтительно составляет не меньше 80 мас.%, более предпочтительно от 80 до 90 мас.% от общего количества гидролизата казеина. Особо предпочтительно, чтобы гидролизат имел точное содержание in vivo неперевариваемых пептидов, например пептидов, состоящих из дипептидов, имеющих последовательность Хаа-Pro, и трипептидов, имеющих последовательность Хаа-Pro-Pro. Пептиды могут представлять собой соли пептидов. Для целей данного изобретения среднюю длину цепи можно выразить как соотношение общего количества молей пептидов и свободных аминокислот, генерируемое гидролизом животного молочного казеина, по отношению к количеству молей всех аминокислот в кислотном гидролизате казеина той же массы. Здесь кислотный гидролизат казеина получают перевариванием казеинового белка до отдельных аминокислот. Среднюю длину цепи можно определить, например, оценивая молярные концентрации аминогрупп в гидролизатах методом ОРА, используя реагент ОРА (ортофталальдегид), который окрашивается при взаимодействии с аминогруппами, и выразить следующим образом: средняя длина цепи=(количество молей аминогрупп в кислотном гидролизате казеина)/(количество молей аминогрупп в ферментативном гидролизате казеина). Используемое здесь выражение in vivo неперевариваемые пептиды обозначает дипептиды ХааPro и трипептиды Хаа-Pro-Pro, имеющие Pro на карбоксильном конце, которые обладают высокой устойчивостью к перевариванию относительно in vivo пептидаз при абсорбции в кишечнике в живом организме. Согласно настоящему изобретению средняя длина цепи гидролизата, полученного гидролизом животного молочного казеина, составляет не более 2,1, предпочтительно от 1,1 до 2,1, более предпочтительно от 1,3 до 2,1, выраженная количеством аминокислотных остатков. При средней длине цепи более 2,1 содержание желательных дипептидов и трипептидов, а также свободных аминокислот является низким, и, следовательно, низким является содержание желательных in vivo абсорбируемых и in vivo неперевариваемых пептидов. Содержание дипептидов, имеющих последовательность Хаа-Рго, в гидролизате казеина по настоящему изобретению обычно составляет не менее 5 мас.%, предпочтительно от 5 до 25 мас.% от общего количества пептидов и свободных аминокислот в гидролизате. При содержании менее требуемых 5% invivo абсорбционная способность снижается, и проявление функций является недостаточным. Содержание трипептидов, имеющих последовательность Хаа-Pro-Pro, в гидролизате казеина по настоящему изобретению обычно составляет не менее 1 мас.%, предпочтительно от 1 до 5 мас.% от общего количества пептидов и свободных аминокислот в гидролизате. При содержании менее требуемого 1 мас.% in vivo абсорбционная способность снижается, и проявление функций является недостаточным. В казеиновом гидролизате по настоящему изобретению Хаа в дипептидах, имеющих последовательность Хаа-Pro, и в трипептидах, имеющих последовательность Хаа-Pro-Pro, может быть любой аминокислотой. Гидролизат казеина по настоящему изобретению может предпочтительно содержать Ile-Pro, Glu-3 011570Ser-Pro-Pro, Ile-Pro-Pro и Val-Pro-Pro в качестве трипептидов, имеющих последовательность Хаа-Pro-Pro. Гидролизат казеина по настоящему изобретению особенно эффективно демонстрирует АСЕингибирующую активность и гипотензивное действие, если содержит такие дипептиды и трипептиды. Гидролизат казеина по настоящему изобретению, кроме пептидов, содержит свободные аминокислоты. Содержание свободных аминокислот обычно составляет от 35 до 50 мас.%, предпочтительно от 40 до 45 мас.% от общего количества пептидов и свободных аминокислот в гидролизате. Гидролизат казеина по настоящему изобретению кроме пептидов и свободных аминокислот может необязательно содержать, например, липид, золу, углевод, пищевые волокна и воду, которые обычно содержатся в имеющемся в продаже животном молочном казеине в количестве примерно от 10 до 20 мас.%. Некоторые или все данные ингредиенты можно удалить, если требуется. Гидролизат казеина по настоящему изобретению можно, например, получить способом по настоящему изобретению, включающим стадию (А) гидролиза животного молочного казеина до средней длины цепи не более 2,1 с использованием группы ферментов, способных переваривать животный молочный казеин в гидролизат, имеющий среднюю длину цепи не более 2,1, выраженную количеством аминокислотных остатков. Животный молочный казеин является белком с высоким содержанием Pro и установленной безопасностью для применения в пищевых и подобных продуктах и может представлять собой, например,казеин из коровьего молока, лошадиного молока, козьего молока и овечьего молока, причем предпочтителен коровий молочный казеин. Концентрация казеина в гидролизующемся животном молочном казеине не имеет особых ограничений и для эффективного получения гидролизата по настоящему изобретению предпочтительно может составлять от 3 до 19 мас.%. Группа ферментов, используемых в способе по настоящему изобретению, может быть любой группой ферментов, в которой ферменты способны переваривать животный молочный казеин в гидролизат,имеющий среднюю длину цепи не более 2,1, выраженную количеством аминокислотных остатков, выбраны и комбинированы подходящим образом. Например, можно предпочтительно использовать группу ферментов (X), включающую пептидазы, способные расщеплять пептидную связь Pro-Хаа на карбоксильном конце Xaa-Pro-Хаа или Xaa-Pro-Pro-Хаа. Группа ферментов (X) может предпочтительно содержать серинпротеиназы, имеющие серии в активном центре, или металлопротеиназы, имеющие металл в активном центре. Металлопротеиназы могут представлять собой нейтральную протеазу I, нейтральную протеазу II или лейцинаминопептидазу. Используя по меньшей мере одну из данных металлопротеиназ, можно эффективно получить целевой гидролизат за короткое время и даже при одностадийном взаимодействии, что предпочтительно. Пептидазы,способные расщеплять пептидную связь Pro-Хаа, могут предпочтительно представлять собой ферменты,имеющие изоэлектрические точки в кислой области. Группа ферментов или группа ферментов (X) может представлять собой, например, группу внеклеточных ферментов, производных koji, например Aspergillus oryzae. Такая группа внеклеточных ферментов может представлять собой группу, полученную культивированием клеточного тела в подходящей среде и экстракцией водой ферментов, продуцируемых внеклеточно. Особо предпочтительной является группа внеклеточных ферментов, производных Aspergillus oryzae и имеющих изоэлектрические точки в кислой области. Группа внеклеточных ферментов, производных Aspergillus oryzae, может представлять собой коммерческий продукт, например SUMIZYME FP, LP или MP (все зарегистрированные торговые марки производства SHIN NIHON CHEMICAL CO., LTD.), UMAMIZYME (зарегистрированная торговая марка производства AMANO ENZYME, INC.), Sternzyme B11024 и PROHIDROXY AMPL (обе торговые марки производства HIGUCHI INC.), ORIENTASE ONS (зарегистрированная торговая марка производстваNAGASE SEIKAGAKU), причем особо предпочтителен SUMIZYME FP (зарегистрированная торговая марка производства SHIN NIHON CHEMICAL CO., LTD.). Такие имеющиеся в продаже ферменты обычно имеют специфические оптимальные условия. Условия, например количество используемых ферментов и время взаимодействия, можно подходящим образом отрегулировать в зависимости от группы используемых ферментов таким образом, чтобы можно было получить гидролизат казеина по настоящему изобретению. Для гидролиза можно, например, добавить группу ферментов к водному раствору животного молочного казеина при массовом соотношении группа ферментов/животный молочный казеин не ниже 1/1000, предпочтительно от 1/10 до 1/1000, более предпочтительно от 1/10 до 1/100, наиболее предпочтительно от 1/10 до 1/40. Условия реакции можно выбрать подходящим образом в зависимости от группы используемых ферментов таким образом, чтобы получить целевой гидролизат казеина. Обычно можно осуществлять взаимодействие при температуре от 25 до 60 С, предпочтительно от 45 до 55 С, рН от 3 до 10, предпочтительно от 5 до 9, более предпочтительно от 5 до 8. Время ферментативного взаимодействия обычно-4 011570 составляет от 2 до 48 ч, предпочтительно от 7 до 15 ч. Ферментативное взаимодействие можно прекратить, инактивируя ферменты. Как правило, для прекращения взаимодействия инактивируют ферменты при температуре от 60 до 110 С. После прекращения ферментативного взаимодействия полученный осадок можно предпочтительно удалить центрифугированием или при помощи различных фильтров по желанию. Кроме того, из полученного гидролизата можно удалить пептиды, имеющие горький вкус или запах, что можно осуществить, применяя активированный уголь, гидрофобную смолу или подобное. Например, можно добавить к гидролизату от 1 до 20 мас.% активированного угля относительно количества используемого казеина и проводить взаимодействие в течение 1-10 ч для удаления таких горьких и пахнущих компонентов. Использованный активированный уголь можно удалить обычным способом, например центрифугированием или мембранным фильтрованием. Содержащую гидролизат казеина реакционную жидкость, полученную на стадии (А), можно добавить, как есть, к жидким продуктам, например напиткам. Для повышения универсальности гидролизата казеина по настоящему изобретению реакционную жидкость можно предпочтительно концентрировать и высушить до порошков. Такие порошки можно использовать как различные функциональные пищевые продукты, добавки для них, лекарственные препараты и их активные ингредиенты. Порошки можно необязательно смешать с различными вспомогательными добавками для улучшения питательного баланса или вкуса. Примеры таких вспомогательных добавок могут включать различные углеводы, липиды, витамины, минералы,подслащающие вещества, вкусовые агенты, пигменты и агенты для улучшения текстуры. Порошки, содержащие гидролизат казеина по настоящему изобретению, можно использовать, добавляя, например, к напиткам, йогурту, жидким пищевым продуктам, желе, конфетам, стерилизуемым в автоклаве (retort) пищевым продуктам, таблетированным сладостям, печенью, бисквитам, хлебу, сухому печенью, шоколаду и подобному, или готовя препараты в виде капсул, таблеток и подобного. Так как гидролизат казеина по настоящему изобретению можно использовать указанным выше способом, настоящий гидролизат можно эффективно применять в производстве функциональных пищевых продуктов, таких как различные изотонические напитки, обычные напитки, обычные пищевые продукты,пищевые добавки, питательные функциональные пищевые продукты, приносящие заключенную в них пользу для здоровья, или в производстве лекарственных препаратов. В обсуждаемых далее примерах установлено, что гидролизат казеина по настоящему изобретению обладает АСЕ-ингибирующей активностью и гипотензивным эффектом, так что настоящий гидролизат можно использовать, например, как агент для производства функциональных пищевых продуктов, обладающих такой активностью и эффектом, или как агент для производства лекарственных препаратов. Если гидролизат казеина по настоящему изобретению используют в качестве агента, обладающего АСЕ-ингибирующей активностью или гипотензивным эффектом, предпочтительная доза данного агента для перорального введения человеку обычно такова, что допускает прием от 0,1 до 100 мг/кг, предпочтительно от 1 до 20 мг/кг пептидов и свободных аминокислот в гидролизате казеина на введение. Таким образом, количество гидролизата казеина по настоящему изобретению или агента, обладающего АСЕингибирующей активностью или гипотензивным эффектом, если его используют при добавлении в различные напитки, пищевые продукты или лекарственные препараты, можно выбрать подходящим образом, принимая во внимание указанную выше дозировку. Согласно способу по настоящему изобретению гидролизом животного молочного казеина при одностадийном взаимодействии с группой ферментов, включающей указанную выше группу ферментов(X), можно получить Хаа-Pro-Pro, содержащийся в животном молочном казеине, в частности Ile-Pro-Pro и/или Val-Pro-Pro, различные функции которых, включая гипотензивное и антистрессовое действие, установлены, с высоким выходом, близким к теоретическому получению, например не ниже 60%, предпочтительно не ниже 70% по сравнению с традиционными способами. Следовательно, данный способ является не только способом получения гидролизата казеина по настоящему изобретению, но также эффективным способом производства переваренных продуктов, содержащих значительное количество целевого Хаа-Pro-Pro, или очищенных продуктов из животного молочного казеина или пищевого белка, имеющего высокое содержание Хаа-Pro-Pro. Примеры Теперь настоящее изобретение будет объяснено более конкретно со ссылкой на примеры, пример анализа и сравнительные примеры, которые являются только иллюстративными и не предназначены для ограничения настоящего изобретения. Пример 1 и сравнительные примеры с 1 по 8. Добавляли 1 г казеина из коровьего молока (производства NIPPON NZMP) к 99 г дистиллированной воды примерно при 80 С и тщательно перемешивали. К смеси добавляли 1N раствор гидроксида натрия(производства WAKO PURE CHEMICAL INDUSTRIES, LTD.), доводя pH до 7,0. Для получения раствора субстрата доводили температуру до 20 С. К полученному таким образом раствору субстрата добавляли каждый из разнообразных ферментов,показанных в табл. 1, таким образом, чтобы массовое соотношение фермент/казеин составляло 1/25.-5 011570 Осуществляли взаимодействие смеси при 50 С в течение 14 ч и затем подвергали ее автоклавной обработке при 110 С в течение 10 мин для инактивации ферментов, получая при этом раствор продуктов ферментативного переваривания казеина. Полученный раствор продуктов ферментативного переваривания сушили распылением, получая порошки. Проводили анализ ингредиентов полученных таким образом порошков. Белок определяли методомKjeldahl и аминокислоты при помощи аминокислотного анализатора. Количество, полученное вычитанием количества аминокислот из количества белка, принимали за количество пептидов. Далее определяли количество липидов способом с применением кислотного гидролиза, золы прямым сжиганием и воды способом с использованием сушильного шкафа. Количество каждого ингредиента вычитали из 100%,итог принимали за количество углеводов. В результате определено, что порошки содержат 35,8 мас.% аминокислот, 45,7 мас.% пептидов, 6,6 мас.% воды, 0,2 мас.% липидов, 4,1 мас.% золы и 7,6 мас.% углеводов. Определение средней длины цепи Среднюю длину цепи аминокислот и пептидов, содержащихся в полученных порошках, устанавливали, определяя количество молей, использующих реагент ОРА, который взаимодействует с аминогруппами свободных аминокислот и пептидов в порошках, аналогично определяя количество молей кислотного гидролизата казеина и оценивая соотношение этих двух величин. Результаты показаны в табл. 1. Растворяли 40 мг ортофталальдегида (гарантированный реагент для флуоресцентного анализа, производимый NACALAI TESQUE, INC.) в 1 мл метанола и добавляли 100 мкл -меркаптоэтанола. Раствор ортофталальдегида разводили до 25 мл, используя 25 мл 100 мМ раствора тетрабората натрия, предварительно смешанного с 2,5 мл 20% додецилнатрийсульфата, и затем до 50 мл дистиллированной водой,получая реагент ОРА. Каждый образец порошка 1% ферментативного гидролизата казеина, полученный взаимодействием с каждым ферментом (табл. 1), растворяли в подходящем растворителе при подходящей концентрации и центрифугировали при 15000 об./мин в течение 10 мин. Отбирали 50 мкл супернатанта. Затем добавляли 1 мл полученного выше реагента ОРА, тщательно перемешивали и оставляли при комнатной температуре на 5 мин. Измеряли поглощение при 340 нм, используя абсорбциометр (торговая марка Ubest-35 производства JASCO CORPORATION). Получали 1% кислотный гидролизат казеина, разбавленный должным образом, и проводили на нем аналогичные измерения, получая калибровочную кривую, из которой определяли соотношение поглощения и молярной концентрации. Среднюю длину цепи рассчитывали согласно следующей формуле: средняя длина цепи=(молярная концентрация 1% кислотного гидролизата казеина)/(молярная концентрация каждого образца 1% ферментативного гидролизата казеина). Таблица 1-6 011570 Определение аминокислот, составляющих пептиды Порошки, полученные в примере 1, растворяли в подходящем количестве дистиллированной воды и анализировали, используя автоматический анализатор пептидов (торговая марка PPSQ-10 производстваSHIMADZU CORPORATION) для определения аминокислотных остатков от N-конца в порошках. Результаты показаны в табл. 2. Кстати, автоматический анализатор пептидов не детектирует свободные аминокислоты. Общее количество пятых аминокислотных остатков составляло 120 пмоль, и общее количество шестых аминокислотных остатков составляло 100 пмоль. Из данных результатов обнаружено, что большинство пептидов, содержащихся в порошках, представляют собой дипептиды и трипептиды. Обнаружено также, что процент пептидов, имеющих Pro в качестве второго остатка, составляет 49,5%, что очень много, и процент пептидов, имеющих Pro в качестве третьего остатка, составляет 29,8%, что также много. Таким образом, ожидается, что порошки содержат значительное количество Хаа-Pro и Хаа-Pro-Pro,которые имеют высокую устойчивость к ферментативному перевариванию in vivo протеазой, так что данные пептиды являются оптимальными для использования в качестве функциональных пептидов. Таблица 2 Оценка абсорбционной способности и устойчивости к перевариванию Хаа-Pro и Хаа-Pro-Pro в живом организме Для оценки абсорбционной способности и устойчивости к перевариванию в живом организме пептидов, имеющих последовательность Хаа-Pro или Хаа-Pro-Pro и содержащихся в порошках ферментативного гидролизата казеина, полученного в примере 1 и показанного в табл. 1, исследовали на крысах абсорбцию пептидов в кровь после перорального введения следующим образом. Двум двухнедельным крысам SD (Sprague Dawley) вводили перорально 500 мг/животное каждого из Val-Pro-Pro, например, Хаа-Pro-Pro и Gly-Gly как дипептида, не имеющего Pro. Отбирали образцы крови из воротной вены с интервалами и определяли абсорбцию каждого пептида в кровь. Результаты показаны на фиг. 1. Фиг. 1 подтверждает, что Gly-Gly легко переваривается in vivo, так что детектируется Gly, тогда какVal-Pro-Pro абсорбируется в кровь относительно стабильно. На основании данных результатов ожидается, что дипептиды и трипептиды, имеющие последовательности Хаа-Pro и Хаа-Pro-Pro соответственно,демонстрируют высокую абсорбционную способность и устойчивость к перевариванию в живом организме. Оценка гипотензивного эффекта Каждый из порошков гидролизата казеина, полученных в примере и сравнительных примерах, показанных в табл. 1, вводили перорально пяти 27-недельным спонтанно гипертензивным крысам (SHR)(самцам) при дозе 32 мг/кг массы тела. Измеряли кровяное давление до введения и через 5 ч после введения способом наложения манжеты на хвост при помощи Tail-cuff РВ-98 (производства SOFTRON),оценивая изменение кровяного давления. В качестве контроля вместо порошков вводили казеин и производили такую же оценку. Перед измерением кровяного давления крыс нагревали в предварительно нагретой камере (производства CSI JAPAN) при 45 С в течение 8 мин. Результаты показаны в табл. 3. Из табл. 3 обнаружено, что при использовании казеина в качестве контроля не наблюдали изменения кровяного давления, тогда как при введении порошков примера 1 наблюдали гипотензивное дейст-7 011570 вие. С другой стороны, не наблюдали изменения кровяного давления при использовании порошков сравнительных примеров. Таким образом, показано, что гидролизат казеина примера 1, содержащий конкретное количество Хаа-Pro и Хаа-Pro-Pro и имеющий среднюю длину цепи не более 2,1, оказывает превосходное гипотензивное действие. Кроме того, согласно описанному выше способу зависящее от дозы гипотензивное действие исследовали, используя порошки гидролизата казеина, полученные в примере 1. Результаты показаны в табл. 4 и на фиг. 2. Оценка АСЕ-ингибирующей активности АСЕ из бычьего легкого (производства WAKO PURE CHEMICAL INDUSTRIES, LTD.) растворяли в 0,1 М боратном буфере при рН 8,3 в количестве 0,1 Ед., получая раствор АСЕ. Вносили в пробирку 80 мкл разбавленного раствора ферментативного гидролизата, полученного 50-кратным разбавлением порошков каждого представленного в табл. 1 ферментативного гидролизата дистиллированной водой, 200 мкл 5 мМ раствора гиппурил-гистидил-лейцин (производства SIGMA) и 20 мкл полученного выше раствора АСЕ и проводили взаимодействие при 37 С в течение 30 мин. Потом взаимодействие прекращали,добавляя 250 мкл 1N соляной кислоты. Затем добавляли 1,7 мл этилацетата и перемешивали. Отбирали 1,4 мл этилацетатного слоя, помещали в другую пробирку и выпаривали при 120 С в течение примерно 60 мин, получая высушенный продукт. Высушенный продукт растворяли в 1 мл дистиллированной воды и определяли поглощение экстрагированной этилацетатом гиппуровой кислоты при 228 нм. В качестве контролей определяли поглощение раствора без разбавленного раствора ферментативного гидролизата и раствора без разбавленного раствора ферментативного гидролизата и раствора АСЕ. Из полученного поглощения рассчитывали АСЕ-ингибирующую активность согласно следующей формуле. Результаты показаны в табл. 3. АСЕ-ингибирующая активность (%) = [(А-В)/А]100 А - поглощение раствора без разбавленного раствора ферментативного гидролизата, но с раствором АСЕ) - (поглощение раствора без разбавленного раствора ферментативного гидролизата и раствора АСЕ) В - (поглощение раствора с разбавленным раствором ферментативного гидролизата и раствором и АСЕ) - (поглощение раствора с разбавленным раствором ферментативного гидролизата, но без раствора АСЕ) Таблица 3 Определение пептидов в ферментативном гидролизате Порошки ферментативного гидролизата примера 1, представленного в табл. 1, растворяли в дистиллированной воде при концентрации 10 мг/мл. С другой стороны, готовят растворы 25, 50 и 100 мкг/мл каждого химически синтезированного стандартного пептида, имеющего последовательность, показанную в табл. 5. Данные растворы анализировали способом ЖХ/МС в указанных ниже условиях. Среди пиков, показанных при анализе растворов порошков, идентифицированы пики, соответствующие молекулярным массам и временам удерживания, идентичным соответствующим величинам стандартных пептидов, которые представляют те же последовательности, что и стандартные пептиды. Пики раствора порошка сравнивали с пиками стандартных пептидов, определяя содержание каждого представленного в табл. 4 пептида в растворе порошка. Результаты показаны в табл. 5. Обнаружено, что количество пептидов и свободных аминокислот в растворе, приготовленном растворением порошков в дистиллированной воде, составляет 8,15 мг/мл, количество пептидов составляет 4,57 мг/мл и количество Хаа-Pro в пептидах составляет 514,5 мкг, так что процент Хаа-Pro относительно общего количества пептидов и свободных аминокислот в порошках составляет 6,3 мас.%. Кроме того,количество Хаа-Pro-Pro в пептидах составляет 116,5 мкг, так что процент Хаа-Pro-Pro относительно общего количества пептидов и свободных аминокислот в порошках составляет 1,4 мас.%. Используемая аппаратура Высокоэффективный жидкостной хроматограф-масс-спектрометр: LCMS-2010; системный регулятор: SCL-10Advp; автоматический инжектор: SIL-10Advp; насос для подачи растворителей: LC-10Advp2; печь колонного типа: CTO-10Avp; фотодиодный матричный детектор: SPD-M10AVP; системный дегазатор: DGU-14A (все торговые марки производства SHIMADZU CORPORATION); колонка: DevelosilC30-UG-3 (2,0 мм внутренний диаметр 150 мм длина) (производства NOMURA CHEMICAL CO.,LTD.). Условия для измерений Подвижная фаза А: водный раствор 0,1 мас.% муравьиной кислоты; подвижная фаза В: 100% раствор ацетонитрила; временная программа: 0% В (0 мин) - 7,5% В (30 мин) - 80% В (30,01 мин) - 100% В(35 мин) - 0% В (35,1 мин) - СТОП (45 мин); количество образца для введения: 5 мкл; температура колонки: 50 С; длина волны детектирования: от 200 до 300 нм; способ ионизации: ESI (+); скорость потока распыляемого газа: 4,5 л/мин; приложенное напряжение: +4,5 кВ; CDL температура: 250 С; температура нагревателя централизованного теплоснабжения: 200 С; CDL вольтаж: 0,0 В; Q-вольтаж (Q-array-9 011570 Пример анализа 1. Идентификация ферментов Среди внеклеточных ферментов, производных Aspergillus oryzae, используемых в примере 1, ферменты, необходимые для получения гидролизата казеина по настоящему изобретению, анализировали следующим способом. Кстати, все следующие операции проводили при 4 С, если не указано иное. Все использованные реагенты являются гарантированными реагентами производства WAKO PURECHEMICAL INDUSTRIES, LTD., если не указано иное. Влияние различных ингибирующих агентов на ферменты Растворяли 2000 мг SUMIZYME FP (зарегистрированная торговая марка производства SHINNIHONCHEMICAL CO., LTD.) в 10 мл 50 мМ фосфатного буфера при рН 7,2 и удаляли нерастворимые вещества при помощи целлюлозоацетатной мембраны (DISMIC-25cs, диаметр пор 0,45 мкм производстваADVANTEC), получая сырой ферментный раствор. Взаимодействие данного сырого ферментного раствора с 1% казеином проводили так же, как в примере 1. Затем добавляли к реакционной системе ингибитор металлопротеазы EDTA (этилендиаминтетрауксусную кислоту) или ингибитор серинпротеазы PMSF (фенилметансульфонилфторид), средняя длина цепи была больше, и нельзя было получить целевой гидролизат. Данный факт предполагает, что металлопротеаза или серинпротеаза играют важную роль в производстве гидролизата казеина по настоящему изобретению. Выделение при помощи ионообменной смолы Активировали 20 мл анионообменной смолы DEAE sephacel (производства AMERSHAMBIOSCIENCES K.K.), уравновешивали ее 50 мМ фосфатным буфером с рН 7,2 и набивали стеклянную колонку диаметром 1,512 см. Притом, что весь эффлюент собирали как неадсорбированный образец,сырой ферментный раствор адсорбировался при скорости потока 1,0 мл/мин. Затем колонку тщательно промывали 50 мМ фосфатным буфером с рН 7,2 при 10-кратном по объему количестве относительно геля и элюировали 200 мл 50 мМ фосфатного буфера с рН 7,2, содержащего линейный градиент NaCl (от 0 до 600 мМ). Элюат фракционировали на 100 фракций по 5 мл каждая. Для каждой фракции определяли поглощение при 280 нм, протеиназную активность и АСЕ-ингибирующую активность. Определение протеиназной активности Растворяли 25 мг флуоресцентно-меченного (флуоресцеинизотиоцианатом) казеина (FITC-казеин,производства SIGMA), в 5 мл 50 мМ фосфатного буфера при рН 7,2, получая раствор субстрата. Смешивали 10 мкл каждой фракции с 20 мкл раствора субстрата и проводили взаимодействие при 55 С в течение 10 мин. Взаимодействие прекращали, добавляя 120 мкл 5% раствора трихлорацетата, и полученную реакционную жидкость центрифугировали при 1500 об./мин. Отбирали 60 мкл супернатанта, смешивали с 3 мл 0,5 М трисгидрохлорида с рН 8,5 и проводили измерение, используя флуориметр (F-1300, производства HITACHI, LTD.), определяя длину волны возбуждения при 485 нм и длину волны флуоресценции при 525 нм. Из результатов определения поглощения при 280 нм каждой фракции DEAE sephacel-элюата установлено, что примерно 73% белка абсорбируется на анионной ионообменной смоле. На фиг. 3 показан характер элюирования связанного белка при линейном градиенте от 0 до 0,6 М NaCl и протеолитическая активность. Фракции с 21 по 60 содержат особенно большое количество элюированных белков. Кроме того,элюированный ферментный раствор каждой фракции оценивали на активность по генерации АСЕингибирующих компонентов при гидролизе казеина. В результате подтверждено, что фракции с 20 по 60 большей частью обладают активностью по генерации АСЕ-ингибирующих компонентов. С другой стороны, протеиназную активность, измеренную с использованием FITC-казеина в качестве субстрата, наблюдали, главным образом, во фракциях с 19 по 27 (при содержании NaCl от 0,1 до 0,2 М), этот факт указывает, что протеиназная активность выполняет важную функцию в генерации АСЕингибирующих компонентов. Из данных результатов обнаружено, что протеиназная активность играет важную роль в ферментативной активности, очищая АСЕ-ингибирующие компоненты от казеина. Идентификация содержащихся протеиназ Из DEAE sephacel-элюированных фракций собирали фракции с 21 по 35, обладающие протеиназной активностью, и проводили диализ относительно 5 л 5 мМ фосфатного буфера с рН 7,2. СуспендировалиSephacryl S-300 HR (производства AMERSHAM BIOSCIENCES K.K.) в 50 мМ фосфатном буфере с рН 7,2, содержащем 200 мМ NaCl, полностью дегазировали и набивали стеклянную колонку с диаметром 18100 см. Данную колонку полностью уравновешивали 50 мМ фосфатным буфером с рН 7,2, содержащим 200 мМ NaCl при постоянной скорости потока 2 мл/мин. Диализованный образец вносили в данную колонку и получали 100 фракций по 10 мл каждая. Для каждой фракции определяли поглощение при 280 нм и протеиназную активность, используя FITC-казеин в качестве субстрата. Электрофорез на полиакриламидном геле Отбирали 10 мкл каждой фракции, смешивали с 10 мкл буфера для образца, составленного из 0,125 М Трис-буфера с рН 6,8, 3% SDS, 5% -меркаптоэтанола, 10% глицерина и 0,01% бромфенолового- 10011570 синего, нагревали при 95 С в течение 5 мин и охлаждали при комнатной температуре. Полученный образец подвергали электрофорезу согласно способу Laemmli (Nature, 227, 680 (1970, используя минипластинки (производства АТТО CORPORATION) и полиакриламидный гель с намеченной концентрацией при условии 30 mA на гель. По завершении электрофореза гель погружали в раствор красителяCoomassie Brilliant Blue, составленный из 0,25% Coomassie Brilliant Blue R-250, 50% метанола и 7,5% уксусной кислоты, на 10 мин и пропускали через фильтр в обесцвечивающий препарат, составленный из 5% метанола и 7,5% уксусной кислоты, до полного обесцвечивания фона. Молекулярную массу получали посредством расчета из подвижности каждой полосы белка, используя маркеры молекулярной массы(производства AMERSHAM BIOSCIENCES K.K.). Фракции, адсорбированные на анионной ионообменной смоле и обладающие активностью по генерации АСЕ-ингибирующих компонентов, подвергали гель-фильтрации через смолу Sephacryl S-300 и наблюдали активность во фракциях, соответствующих молекулярной массе около 45 кДа. Данные фракции анализировали методом электрофореза на SDS-полиакриламидном геле в 12,5% геле, наблюдая, по существу, отдельные полосы при 44 и 40 кДа. Данные полосы вырезали и анализировали на Nтерминальные последовательности. Выявлено, что полоса при 44 кДа имеет последовательность, которая высокогомологична известной нейтральной протеазе I плесени koji (Aspergillus), и полоса при 40 кДа имеет последовательность, которая высоко гомологична известной нейтральной протеазе II плесени koji(Aspergillus). Из данных результатов определено, что протеиназы, адсорбированные на анионообменной смоле,которые генерируют АСЕ-ингибирующие компоненты для казеина, содержат по меньшей мере две протеиназы: нейтральную протеазу I и нейтральную протеазу II. Ввиду дальнейшего гидролиза компонентов, генерированных гидролизом казеина протеиназами,анализировали пептидазы, которые действуют на пептиды, следующим способом. Для идентификации ферментов по производству пептидов, имеющих высокое содержание Хаа-Pro и Хаа-Pro-Pro, которые являются отличительным признаком настоящего изобретения, синтезировали различные пептиды-предшественники для Val-Pro-Pro и оценивали возможность их превращения в ValPro-Pro. Очистка ферментов для обработки амино-концов Из DEAE sephacel-элюированных фракций собирали фракции с 21 по 37, обладающие активностью по генерации АСЕ-ингибирующих компонентов, и проводили диализ относительно 5 л 5 мМ фосфатного буфера с рН 7,2. Суспендировали гидроксиапатит (производства WAKO PURE CHEMICALINDUSTRIES, LTD.) в 5 мМ фосфатном буфере с рН 7,2, полностью дегазировали и набивали пластиковую колонку с диаметром 1,512 см. Данную колонку промывали 5 мМ фосфатным буфером с рН 7,2 в количестве не менее 10-кратного количества гидроксиапатита. Диализованные фракции, обладающие активностью по генерации АСЕ-ингибирующих компонентов, вносили в данною колонку с гидроксиапатитом и собирали все фракции, прошедшие через колонку. Определение аминопептидазной активности Аминопептидазную активность определяли следующим способом. Синтезированный пептид ValVal-Val-Pro-Pro растворяли в 50 мМ фосфатном буфере с рН 7,2 при концентрации 50 мкг/мл, получая раствор субстрата. Смешивали 45 мкл данного раствора субстрата с 5 мкл ферментной фракции и проводили взаимодействие в инкубаторе при 55 С в течение 30 мин. Взаимодействие прекращали посредством нагревания при 98 С в течение 5 мин. Отбирали подходящее количество данной реакционной жидкости и подвергали анализу на высокоэффективном жидкостном хроматографе-масс-спектрометре (производства SHIMADZU CORPORATION), оценивая количество генерированного Val-Pro-Pro. Фракции, адсорбированные на анионообменной смоле и обладающие активностью по генерации АСЕ-ингибирующих компонентов, подвергали электрофорезу на SDS-полиакриламидном геле в 10% геле и вырезали полосу при 32 кДа. Основной белок экстрагировали и очищали, получая, по существу,отдельный белок 32 кДа. Анализировали последовательность на N-конце данного белка, обнаружив, что последовательность до десятого остатка от N-конца гомологична последовательности известной лейцинаминопептидазы плесени koji Aspergillus). Сделан вывод, что фракции, обладающие установленной активностью по генерации АСЕ-ингибирующих компонентов, содержат лейцинаминопептидазу. Из данных результатов понятно, что фракции, адсорбированные на анионообменной смоле и обладающие активностью по генерации АСЕ-ингибирующих компонентов, содержат, по меньшей мере, лейцинаминопептидазу, обладающую аминопептидазной активностью, которая играет важную роль в активности по генерации АСЕ-ингибирующих компонентов. Определение карбоксил-терминальной технологичности ферментов Растворяли синтезированный пептид Val-Pro-Pro-Phe-Leu в 50 мМ фосфатном буфере с рН 7,2 при концентрации 45 мкг/мл, получая раствор субстрата. Смешивали 50 мкл данного раствора субстрата с 5 мкл раствора каждого фермента и проводили взаимодействие в инкубаторе при 55 С в течение 30 мин. Взаимодействие прекращали посредством нагревания при 98 С в течение 5 мин. Отбирали подходящее количество данной реакционной жидкости и анализировали на высокоэффективном жидкостном хроматографе-масс-спектрометре (производства SHIMADZU CORPORATION), оценивая концентрацию- 11011570 полученного Val-Pro-Pro. Оценивали карбоксил-терминальную технологичность каждой DEAE sephacel-элюированной фракции, обнаружив, что фракции с 30 по 50 обладают ферментативной активностью по превращению ValPro-Pro-Phe-Leu в Val-Pro-Pro. Пример 2. Подтверждение АСЕ-ингибирующей активности гидролизата казеина комбинацией очищенных ферментов Из примера анализа 1 установлено, что активность по генерации АСЕ-ингибирующих компонентов фракций, адсорбированных на анионообменной смоле, внеклеточного фермента из Aspergillus oryzae(SUMIZYME FP (зарегистрированная торговая марка производства SHIN NIHON CHEMICAL CO.,LTD. включает четыре ферментативных активности, а именно протеиназные активности, включая, по меньшей мере, активности нейтральных протеаз I и II, аминопептидазную активность, включая активность лейцинаминопептидазы, и активность по расщеплению карбоксильного конца непосредственно после пролина. Среди адсорбированных фракций (см. фиг. 3) получена фракция I, обладающая высокой протеиназной активностью (фракции с 1 по 35 на фиг. 3), фракция II, обладающая высокой активностью по расщеплению карбоксильного конца непосредственно после пролина (фракции с 36 по 55 на фиг. 3), далее фракция III (фракции с 56 по 100 на фиг. 3) и неадсорбированные фракции, обладающие протеиназной активностью. Каждую фракцию добавляли отдельно или в комбинации, как показано в табл. 6, к 1 мл 1% раствора казеина из коровьего молока, проводили взаимодействие при 55 С в течение 13 ч, получая гидролизат казеина. По завершении взаимодействия каждый из полученных гидролизатов казеина оценивали на АСЕ-ингибирующую активность и среднюю длину цепи согласно способу, описанному в примере 1. В качестве контроля проводили такие же определения на сыром ферментном растворе в количестве 1/10000, прошедшем очистку. Результаты показаны в табл. 6. Таблица 6 Из табл. 6 обнаружено, что компоненты, обладающие сильной АСЕ-ингибирующей активностью,содержатся в неадсорбированных фракциях, фракциях, обладающих высокой протеиназной активностью,и до фракций, обладающих активностью по расщеплению карбоксильного конца непосредственно после- 12011570 пролина. Обнаружено также, что группа ферментов, элюированных примерно при 300 мМ NaCl, генерирует АСЕ-ингибирующие компоненты таким образом, что фракция III не нужна. Определяли и сравнивали среднюю длину цепи гидролизата казеина, полученного гидролизом с использованием каждой фракции, демонстрирующей высокую активность по генерации АСЕингибирующих компонентов. Обнаружено, что средняя длина цепи для неадсорбированных фракций,фракции I и фракции II, составляет более 2,1, но объединяя данные фракции, получали гидролизат казеина со средней длиной цепи не более 2,1. Пример 3. Добавляли 15 г казеина из коровьего молока (производства NIPPON NZMP) к 85 г дистиллированной воды при температуре примерно 80 С и тщательно перемешивали. Добавляли к смеси 1N раствор гидроксида натрия, доводя рН до 7,0. Температуру доводили до 20 С, получая раствор субстрата. К полученному таким образом раствору субстрата добавляли в качестве группы ферментовSUMIZYME FP (зарегистрированная торговая марка производства SHIN NIHON CHEMICAL CO., LTD.),которая представляет собой внеклеточные ферменты, производные Aspergillus oryzae, так что массовое соотношение фермент/казеин составляло 1/25. Проводили взаимодействие данной смеси при 50 С в течение 20 ч, при этом отбирали с интервалами образцы реакционной жидкости для оценки АСЕингибирующей активности и средней длины цепи относительно времени, аналогично примеру 1. Результаты показаны на фиг. 4 и 5. Ферментативно переваренный раствор, отобранный через 12 ч взаимодействия, который демонстрировал максимальную АСЕ-ингибирующую активность, сушили распылением,получая порошки смеси пептидов. Из фиг. 4 и 5 установлено, что АСЕ-ингибирующая активность возрастает с увеличением времени взаимодействия и снижается после 12 ч взаимодействия. Из оценки количества пептидов также установлено, что АСЕ-ингибирующая активность возрастает при средней длине цепи примерно от 1,3 до 2,1. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Гидролизат казеина, содержащий свободные аминокислоты и пептиды, полученный гидролизом животного молочного казеина до средней длины цепи не более 2,1, выраженной количеством аминокислотных остатков, в котором указанные пептиды содержат неперевариваемые in vivo пептиды, состоящие из дипептидов, имеющих последовательность Хаа-Pro, и трипептидов, имеющих последовательность Хаа-Pro-Pro, и в котором содержание дипептидов, имеющих последовательность Хаа-Pro, составляет не менее 5 мас.% от общего количества свободных аминокислот и пептидов в гидролизате, и содержание трипептидов, имеющих последовательность Хаа-Pro-Pro, составляет не менее 1 мас.% от общего количества свободных аминокислот и пептидов в гидролизате. 2. Применение гидролизата казеина по п.1 для получения пищевой добавки. 3. Гидролизат казеина по п.1, в котором дипептиды, имеющие последовательность Хаа-Pro, содержат Ile-Pro, Glu-Pro, Arg-Pro, Gln-Pro, Met-Pro и Tyr-Pro, и трипептиды, имеющие последовательность Хаа-Pro-Pro, содержат Ser-Pro-Pro, Ile-Pro-Pro и Val-Pro-Pro. 4. Способ получения гидролизата казеина по п.1, включающий стадию (А) гидролиза животного молочного казеина до средней длины цепи не более 2,1 с использованием группы ферментов, способных расщеплять животный молочный казеин до гидролизата казеина, имеющего среднюю длину цепи не более 2,1, выраженную количеством аминокислотных остатков, в котором группа ферментов включает пептидазы, способные расщеплять пептидную связь Pro-Хаа, по меньшей мере один фермент из числа нейтральной протеазы I, нейтральной протеазы II и лейцинаминопептидаз. 5. Способ по п.4, в котором группа ферментов представляет собой внеклеточные ферменты, полученные из Aspergillus oryzae. 6. Способ по п.4, в котором гидролиз осуществляют посредством одностадийного взаимодействия с группой ферментов. 7. Способ по п.4, в котором животный молочный казеин представляет собой казеин коровьего молока. 8. Способ по п.4, в котором группа ферментов дополнительно содержит по меньшей мере один фермент из числа металлопротеаз и серинпротеаз. 9. Способ по п.4, в котором пептидазы, способные расщеплять пептидную связь Pro-Хаа, представляют собой группу ферментов, имеющих изоэлектрические точки в кислой области. 10. Способ по п.4, в котором на стадии (А) концентрация казеина при гидролизе животного молочного казеина составляет от 1 до 19 мас.% и массовое соотношение группы ферментов и животного молочного казеина составляет не менее 1/100. 11. Применение гидролизата казеина по п.1 для получения агента, обладающего активностью по ингибированию ангиотензин-превращающего фермента. 12. Применение гидролизата казеина по п.1 для получения агента, обладающего гипотензивным эффектом.
МПК / Метки
МПК: C12P 21/06, A61P 9/12, A61K 38/01, A61P 43/00
Метки: получения, казеина, применение, способ, гидролизат
Код ссылки
<a href="https://eas.patents.su/17-11570-gidrolizat-kazeina-sposob-ego-polucheniya-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Гидролизат казеина, способ его получения и применение</a>
Предыдущий патент: Таблетка с контролируемым высвобождением бетагистина
Следующий патент: Агрохимические композиции
Случайный патент: Система и способ для автоматического создания и/или обработки заказа на фотомаску с использованием системы профилирования сценариев