Способ получения прасугреля, промежуточное соединение в кристаллической форме и способ его получения
Номер патента: 23057
Опубликовано: 29.04.2016
Авторы: Мезеи Тибор, Дебрецени Йожеф, Мольнар Эникё, Баркоци Йожеф, Ньюлаши Балинт, Надь Калман, Грегор Тамаш, Порч-Маккаи Марта, Брода Юдит, Ружич Дьёрдь, Сент-Кирайи Жужанна, Пандур Ангела, Вольк Балаж
Формула / Реферат
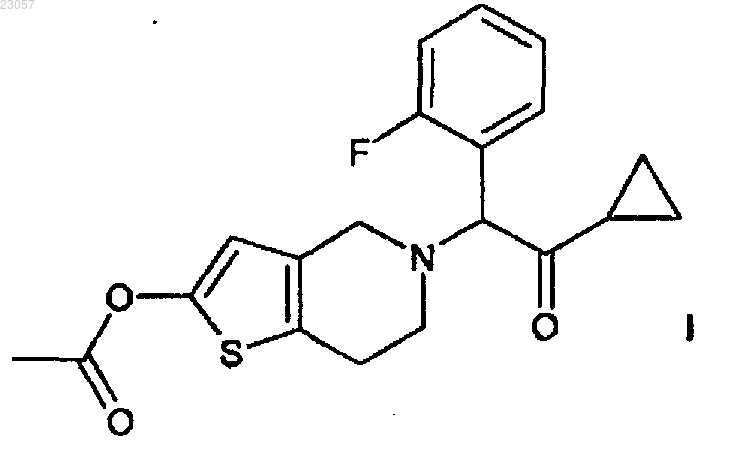
1. Способ получения 2-ацетокси-5-(2-фтор-α-циклопропилкарбонилбензил)-4,5,6,7-тетрагидро-4Н-тиено[3,2-c]пиридина (прасугреля) формулы I
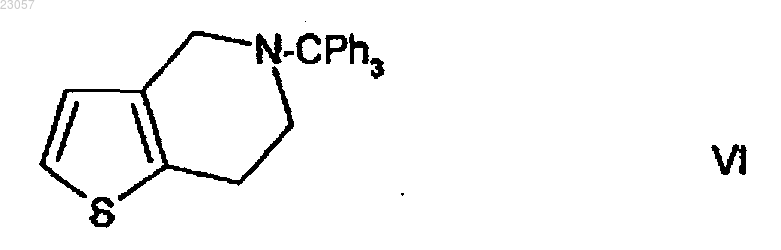
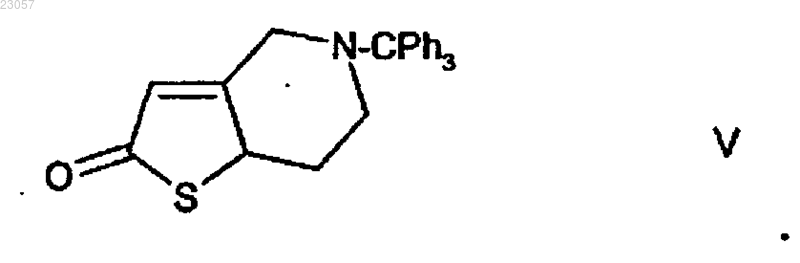
путем превращения 5-тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридина формулы VI
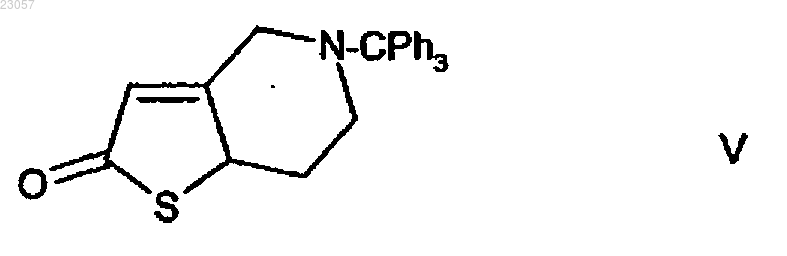
в тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-он формулы V
превращения полученного соединения в 5,6,7,7а-тетрагидро-4Н-тиено[3,2-с]пиридин-2-она пара-толуолсульфонат формулы II
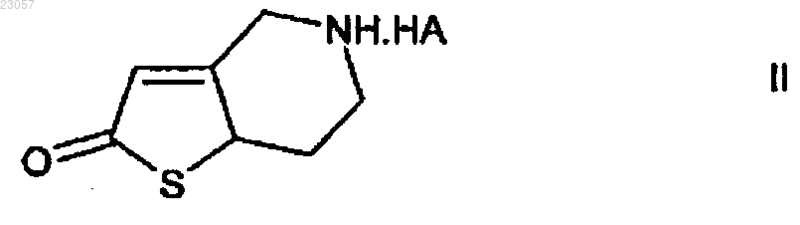
в которой НА представляет собой п-ТСК (паратолуолсульфоновая кислота) путем реакции соединения формулы V с паратолуолсульфоновой кислотой; дальнейшего превращения полученного таким образом соединения в соединение формулы IV
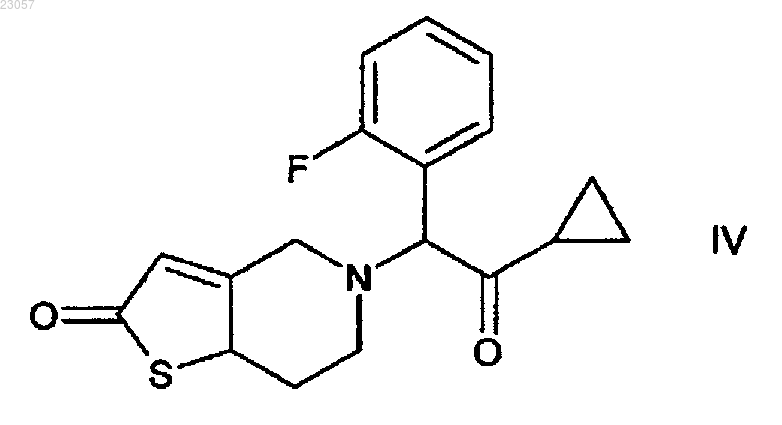
путем реакции с соединением формулы III
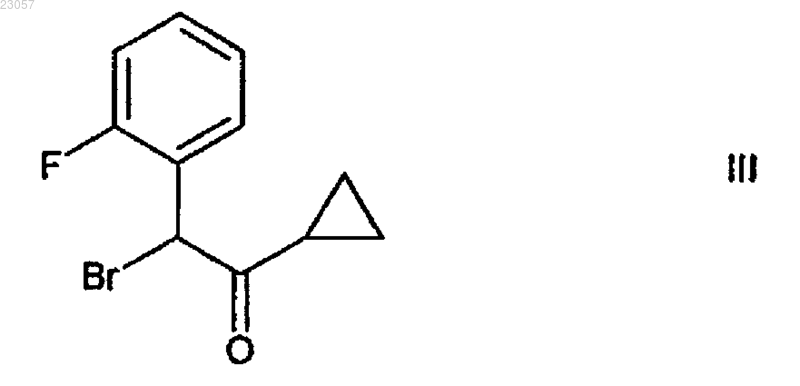
в органическом растворителе в присутствии основания; и превращение полученного соединения в прасугрель формулы I путем реакции с уксусным ангидридом в органическом растворителе, причем исходное соединение представляет собой 5-тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридин формулы VI в кристаллической форме I.
2. Способ по п.1, где исходное соединение 5-тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридин формулы VI в кристаллической форме I превращают в 5,6,7,7а-тетрагидро-4Н-тиено[3,2-c]пиридин-2-она паратолуолсульфонат формулы II без выделения 5-тритил-5,6,7,7а-тетрагидро-4Н-тиено[3,2-c]пиридин-2-она формулы V
3. Форма I 5-тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридина формулы VI, которая демонстрирует порошковую рентгеновскую дифрактограмму, имеющую характеристические пики при угле отражения 2θ (±0,2° 2θ) приблизительно 10,236; 11,938; 17,929; 19,527; 24,427.
4. Форма I 5-тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридина формулы VI по п.3, которая демонстрирует порошковую рентгеновскую дифрактограмму в соответствии со следующей таблицей (относительная интенсивность более 5%):

5. Способ получения формы I 5-тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридина формулы VI по п.3 или 4, где 4,5,6,7-тетрагидротиено[3,2-с]пиридина гидрохлорид приводят во взаимодействие с тритилхлоридом без выделения соответствующего основания формулы VIIa

в присутствии основания с применением органического растворителя, из которого кристаллический продукт осаждают без осаждения соли основания, применяемого в качестве вещества, связывающего кислоты.
6. Способ по п.5, где органическое основание применяют в качестве вещества, связывающего кислоты.
7. Способ по п.6, где органическое основание представляет собой третичный амин, предпочтительно N,N-диизопропилэтиламин, триэтиламин, азотсодержащее гетероциклическое соединение, предпочтительно пиридин.
8. Способ по п.5, где органический растворитель представляет собой ароматический углеводород, предпочтительно толуол; растворитель эфирного типа, предпочтительно тетрагидрофуран, диоксан или метил-трет-бутиловый эфир; растворитель типа кислотного амида, предпочтительно N,N-диметилформамид, N,N-диметилацетамид или N-метилпирролидон; растворитель нитрильного типа, предпочтительно ацетонитрил; или растворитель кетонового типа, предпочтительно метилэтилкетон.
Текст
в кристаллической форме I. Изобретение также относится к указанной новой кристаллической форме I соединения формулы VI и способу ее получения.(71)(73) Заявитель и патентовладелец: ЭГИШ ДЬДЬСЕРДЬЯР НЬИЛЬВАНОШАН МЮКЕДЕ РЕСВЕНЬТАРШАШАГ (HU) Область изобретения Настоящее изобретение относится к способу получения 2-ацетокси-5-(2-фторциклопропилкарбонилбензил)-4,5,6,7-тетрагидро-4 Н-тиено[3,2-c]пиридина (прасугреля) формулы который благоприятно и безопасно применим в промышленном масштабе. Настоящее изобретение дополнительно относится к улучшенным способам для отдельных стадий синтеза и кристаллическим полиморфам промежуточного соединения формулы(прасугрель) формулы (I) представляет собой важный представитель тетрагидротиенопиридиновых производных, которые используют в фармацевтической промышленности в качестве ингибиторов агрегации тромбоцитов. Уровень техники Известные пути синтеза для получения прасугреля формулы (I). Прасугрель и аналогичные соединения и способ их получения впервые описаны в US 5288726 В 1. Способ получения в соответствии с US 5288726 В 1 представлен на реакционной схеме 1. 5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-она гидрохлорид формулы где НА обозначает HCl,приводят во взаимодействие с 2-бром-1-циклопропил-2-(2-фторфенил)этаноном формулы в диметилформамиде при комнатной температуре в течение 5 ч в присутствии безводного карбоната калия (мольное отношение 1,0:1,0:2,2). Неочищенный продукт очищают путем колоночной хроматографии,выход составляет 32%. Продукт представляет собой коричневый и маслянистый 5-[2-циклопропил-1-(2 фторфенил)-2-оксоэтил]-5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-он формулы (IV), смешанный с соответствующим 2-гидрокситаутомером. Масляный продукт кристаллизуют из диизопропилового эфира, причем выход не указан. В качестве последней стадии синтеза гидрид натрия добавляют к смеси формулы (IV) и раствору диметилформамида и уксусного ангидрида. Реакционную смесь перемешивают в течение 3 ч при комнатной температуре перед обработкой. Неочищенный продукт очищают путем колоночной хроматографии. После упаривания масляный продукт кристаллизуют из диизопропилового эфира, и способ позволяет получить 65% основания прасугреля в расчете на промежуточное соединение формулы (IV), и очень малое, 21%, в расчете на соединение формулы (II). Получение исходного вещества 5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-с]пиридин-2-она гидрохлорида формулы (II), где НА обозначает HCl, не приведено в US 5288726 В 1, описание лишь цитирует известные способы без какой-либо подробной информации. Цитированные документы (M. Podesta et al., Eur. J.Med. Chem. - Chim. Ther. 9 (5), 487-490 (1974); и Japanese Patent Kokai Application No. Sho 61-246186) не раскрывают какой-либо способ получения ключевого промежуточного соединение формулы (II) (НА представляет собой Cl). Несколько дополнительных заявок на изобретения цитируют путь синтеза в соответствии с реакционной схемой 2. Недостаток способа, раскрытого в US 5288726 В 1, заключается в том, что соединение формулы (IV) и прасугрель формулы (I) получают из реакционной смеси путем колоночной хроматографии. Известно,что колоночная хроматография требует большого количества растворителя, таким образом, масштабирование затруднено, и в настоящем случае результаты представлены с низким выходом. Еще один недостаток вышеприведенного способа заключается в использовании гидрида натрия на стадии ацилирования при получении конечного продукта. Применение гидрида натрия в промышленных способах опасно и должно удовлетворять жестким требованиям безопасности. Еще один недостаток использования гидрида натрия заключается в обработке парафина, который используют в течение стадии суспендирования. Способ, раскрытый в ЕР 1098132 В 1, похож на способ, описанный в основном патенте. 5,6,7,7 аТетрагидро-4 Н-тиено[3,2-c]пиридин-2 -она гидрохлорид формулы (II) (НА представляет собой HCl) при-1 023057 водят во взаимодействие с 2-бром-1-циклопропил-2-(2-фторфенил)этаноном формулы (III) в диметилформамиде при комнатной температуре, но отличие от основного патента заключается в том, что в качестве основания используют гидрокарбонат калия, и также используют отличающееся мольное отношение(1,0:0,93:2,8). Реакционную смесь перемешивают в течение 2 ч при комнатной температуре, продукт распределяется между водой и этилацетатом, и после упаривания продукт очищают путем хроматографии. Его кристаллизуют из диизопропилового эфира. Таким образом, выход промежуточного соединения формулы (IV) составляет 35%. Ацетилирование похоже на описанное в основном патенте, но смесь толуола и этилацетата в отношении 3:1 используют вместо 100:3 для хроматографии в качестве элюента. Выход на последней стадии также составляет 65% и выход на двух стадиях вместе составляет только 23%. В W02007/115305 A1 описан способ, в основном идентичный способу, описанному в основном патенте. Раскрытые способы основаны на той же самой неблагоприятной стадии, как и в основном патенте,и приводят в результате к аналогичным низким выходам. В соответствии со способом, описанным в US 5874581 В 1, прасугрель формулы (I) получают, начиная с 5,6,7,7 а-тетрагидро-4 Н-тиено [3,2-c]пиридин-2-она толуол-4-сульфоната формулы (II) (НА представляет собой паратолуолсульфонат, п-ТСК), где карбонильная группа в позиции 2 силилирована, и защищенное промежуточное соединение формулы связано с соответствующим кетоновым галогенидом, и удаление защитной группы и О-ацетилирование образующегося in situ промежуточного оксосоединения формулы (IV) осуществляют в одну стадию. Способ представлен на реакционной схеме 3. Более подробно способ заключается в следующем: соль толуол-4-сульфонат формулы (II) приводят во взаимодействие с трет-бутилдиметилхлорсиланом в присутствии триэтиламина в дихлорметановом растворителе в течение 3 ч при комнатной температуре, и образуется 2-(трет-бутилдиметилсилилокси)4,5,6,7-тетрагидротиено[3,2-c]пиридинтолуол-4-сульфонат. Образованное соединение дополнительно приводят во взаимодействие с 2-хлор-1-циклопропил-2(2-фторфенил)этаноном формулы без выделения в присутствии йодида натрия путем дополнительного добавления триэтиламина при 45 С и перемешивания в течение 12 ч. После обработки реакционной смеси 2-(трет-бутилдиметилсилилокси)5-(-циклопропилкарбонил-2-фторбензил)-4,5,6,7-тетрагидротиено[3,2-c]пиридин формулы кристаллизуют из ацетонитрила. Выход составляет 73,3%. Полученное силильное производное десилилируют в ТГФ (тетрагидрофуране) в присутствии триэтиламина и 4-диметиламинопиридина и ацетилируют уксусным ангидридом при перемешивании в течение 4,5 ч при комнатной температуре без выделения промежуточного соединения. Выход основания прасугреля, рассчитанный по последней реакционной стадии, составляет 91%. Выход, рассчитанный по соли толуол-4-сульфонату формулы (II) (НА представляет собой п-ТСК), составляет 66,7%. В способе в соответствии с US 5874581 В 1 трет-бутилдиметилсилилокси группу успешно используют для защиты 2-оксогруппы для уменьшения образования побочных продуктов, замещенных по оксогруппе. Таким образом, выход, рассчитанный по соли толуол 4-сульфонату формулы (II) (НА представляет собой п-ТСК) , лучше, чем в использованном способе, описанном в основном патенте. Кроме того, предпочтительный и более простой способ, нежели чем колоночная хроматография, используют для получения продукта. Тем не менее, недостаток способа, описанного в US 5874581 В 1, заключается в введении в способ двух дополнительных стадий. Таким образом,синтез является дорогостоящим, и промышленная применимость затруднена вследствие применения чувствительного к воде трет-бутилдиметилсилана и токсичного 4-диметиламинопиридина.CN 101250192 A, CN 101245072 A, CN 101245073 А и CN 101250193 А (китайские заявки) описывают тот же самый новый способ синтеза прасугреля с отличающимися деталями некоторых промежуточных соединений.CN 101250192 А описывает получение основания прасугреля из промежуточного соединения формулы где оксогруппа защищена алкильной группой. Способ представлен на реакционной схеме 4. Защитную группу удаляют с использованием кислотной и мягкой реакционной среды. Преимущество способа заключается в том, что в нем не используют имеющие низкую температуру воспламенения или взрывоопасные реагенты, и способ приводит в результате к высокому выходу. В соответствии с CN 101245072 А путем бензилирования 4,5,6,7-тетрагидротиено[3,2-c]пиридина формулы выход промежуточного соединения формулы (XI) составляет 98,7%. 2-бром-N-бензильное промежуточное соединение формулы получают путем бромирования соединения формулы (IX) с выходом 97,8% в соответствии с реакционной схемой 5. Соединение формулы (XII) превращают в прасугрель формулы (I) в несколько дополнительных стадий.CN 101245073 А раскрывает улучшенный вариант способа, описанного в CN 101245072 А, где атом брома 2-бромного производного формулы (XII) заменяют на алкоксигруппу (предпочтительно метоксигруппу) с метилатом натрия, и выход составляет 82,2%. Полученное 2-алкилокси промежуточное соединение формулы превращают в прасугрель формулы (I) в несколько дополнительных стадий в соответствии с реакционной схемой 6. В CN 101250193 А 2-алкокси промежуточное соединение образуется путем связывания 2-алкокси 4,5,6,7-тетрагидротиено[3,2-c]пиридина формулы(реакционная схема 7.) Преимущество способа заключается в том, что в нем не используются имеющие низкую температуру воспламенения или взрывоопасные реагенты, и способ приводит в результате к высокому выходу. Недостатки способов, описанных в CN 101250192 A, CN 101245072 А, CN 101245073 А и CN 101250193 А, заключаются в том, что экономичная обработка на стадии деалкилирования алкоксигруппы(предпочтительно деметилирование метоксигруппы) затруднена. Дополнительно, недостаток заключается в том, что при каталитическом гидрировании защитной бензильной группы по атому азота образованное тиофеновое соединение способно действовать в качестве каталитического яда. В W02008/108291 раскрывается способ получения прасугреля гидрохлорида, включающего уменьшенное количество примеси 3-хлорпропила, которая образуется путем открывания кольца при хлорировании циклопропильного кольца прасугреля. 1-Циклопропил-2-(2-фторфенил)этанон формулы (XV) хлорируют в позиции 2 при низкой температуре, и полученное промежуточное соединение формулы(IIIa) при этом связано с 5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-оновым производным формулы(XIV, R=триалкилсилил) , который защищен по атому кислорода (реакционная схема 8.) ЕР 2003136 A1 описывает способ получения основания прасугреля высокой чистоты и его солей присоединения кислоты (предпочтительно гидрохлорида) с уменьшенным содержанием дезацетильной примеси формулы (IV) . Способ, раскрытый в WO 96/11203, используют для получения соли прасугреля и очистки основания. Путем связывания используют 2-хлор-1-циклопропил-2-(2-фторфенил)этанон фор-3 023057 мулы (IIIa) , который образуется путем галогенирования соответствующего кетона формулы (XV) газообразным хлором с выходом 80%. Основание прасугреля высокой чистоты перекристаллизуют. Несколько растворителей, предпочтительно ацетонитрил, упоминаются для перекристаллизации. Известны пути синтеза и промежуточные соединения, которые используются в способе. Недостаток способа по настоящему изобретению заключается в использовании газообразного хлора, который является ядовитым, сложен в обращении и в утилизации. вместо 2-бром-1-циклопропил-2-(2-фторфенил)этанона формулы (III). После получения промежуточных соединений формулы (IV) при помощи колоночной хроматографии выход составляет 23,7% в соответствии с одним из вариантов и 65,4% в соответствии с другим. Промежуточное соединение формулы (XVI) получают из 2-фторбензальдегида и триметилсилилцианида в несколько стадий с использованием дорогостоящих реагентов и выходом 38,5%. Неочищенное маслянистое соединение формулы (II) получают после ацилирования и последующей колоночной хроматографии, и кристаллическое соединение получают путем кристаллизации из диэтилового эфира, где выход составляет 29,2%. Способ не является экономичным, и конечный продукт получают в каждом варианте путем колоночной хроматографии. Описание не раскрывает каких-либо данных о профиле примесей в конечном продукте.WO 2009/062044 раскрывает два пути синтеза для получения прасугреля. Один из путей позволяет получить 4,6%, рассчитанные по 4,5,6,7-тетрагидротиено[3,2-c]пиридина гидрохлориду формулы (VII),или 3,7% с учетом также стадии перекристаллизации с использованием способа, описанного в основном патенте, с небольшой модификацией. Другой путь представлен на реакционной схеме 9. 5-Тритил-5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-он формулы ацетилируют, при этом образуется соединение формулы и защитную группу удаляют с атома азота. Получающееся таким образом производное формулы затем связывают с бромкетоном формулы (III). Выход составляет 4,1%, рассчитанный по 4,5,6,7 тетрагидротиено[3,2-c]пиридина гидрохлориду формулы (VII), или 3,1% с учетом также стадии перекристаллизации. Выход меньше, чем в предшествующем варианте способа.WO 2009/066326 описывает улучшенный и масштабируемый способ основного патента. Соль 5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-он формулы (II) и 2-бром-1-циклопропил-2-(2-фторфенил)этанон формулы (III) связывают в присутствии карбоната калия. Образованное соединение формулы (IV) получают в масляной форме и ацетилируют в присутствии вещества, связывающего кислоты,диизопропилэтиламина (ДИПЭА). Наибольший выход, рассчитанный по 4,5,6,7-тетрагидро-тиено[3,2c]пиридина гидрохлориду формулы (VII) , составляет 19,3 или 13%, если принимать во внимание конечную стадию очистки. Дополнительно недостатки способа, представляющие собой применение двух отличающихся оснований на двух стадиях и выделение промежуточных соединение формулы (VII), не являются необходимыми, таким образом экономя человеческий ресурс и затраты на растворители. Ранние стадии синтеза в соответствии с предшествующим уровнем техники. Получение 5-тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридина формулы (VI) впервые описано в FR 257 6901 В 1. Выход составляет 96%, и 4,5,6,7-тетрагидротиено[3,2-c]пиридин формулы (VIIa) приводят во взаимодействие с тритилхлоридом в присутствии триэтиламина в дихлорметановой среде при комнатной температуре в течение 20 ч. Реакционную смесь затем смешивают с водой. После разделения фаз органический слой сушат, упаривают и фильтруют с дихлорметаном на слое силикагеля. Получают пастообразное соединение формулы (VI) которое имеет температуру плавления 95 С. Качество продукта не раскрыто. Хотя выход продукта явля-4 023057 ется высоким, способ скорее не подходит для промышленного применения из-за галогенированного растворителя реакционной среды, а кроме того, качество продукта не определено. Это может объяснить выход 64% на следующей стадии, где соединение формулы (VI) превращают в 5-тритил-2,4,5,6,7,7 агексагидротиено[3,2-c]пиридин-2-он формулы (V). В WO 2009/062044 способ начинается с 4,5,6,7-тетрагидротиено[3,2-с]пиридина гидрохлорида формулы (VII). Основание высвобождают из гидрохлорида в дихлорметане при помощи аммонийгидроксида. Основание тритилируют в дихлорметане в присутствии триэтиламина, перемешивают в течение 1 ч при комнатной температуре. Выход тритильного промежуточного соединения составляет 74,8%, и чистота продукта составляет 89,16, измеренная при помощи ВЭЖХ (высокоэффективная жидкостная хроматография). В WO 2009/066326 способ начинается с 4,5,6,7-тетрагидротиено[3,2-с]пиридина формулы (VIIa). Соединение формулы (VII) тритилируют в дихлорметане в присутствии триэтиламина, перемешивают в течение 16 ч при 0-5 С. Соединение формулы (VI) фильтруют из циклогексана с выходом 87,5%. В US 2009/066326 способ начинается с 4,5,6,7-тетрагидротиено[3,2-с]пиридина формулы (VIIa), но используемые условия реакции отличаются. Свободное основание превращают в желто-коричневый твердый 5-тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридин формулы (VI) в присутствии гидрида натрия с использованием тритилхлорида в тетрагидрофурановой среде при 0 С в течение 1 ч путем флэшхроматографии. Выход продукта составляет 50%, и продукт характеризовали посредством 1H-NMR(ядерный магнитный резонанс) и масс-спектрометрией. Способ является быстрым, но недостатки являются следующими: низкий выход, гидрид натрия используют в качестве основания, и очистка при помощи флэш-хроматографии не является промышленно применимой. Еще один способ получения 5-тритил-4,5,6,7-тетрагидротиено [3,2-c]пиридина формулы (VI) описан в J. Am. Chem. Soc. 2007, 10, 2768, где соединение формулы (VI) превращают в 5-тритил-2,4,5,6,7,7 агексагидротиено[3,2-c]пиридин формулы путем окисления сульфурилхлоридом в дихлорметановом растворителе при 0 С. Оставшийся продукт очищают путем колоночной хроматографии; желтое твердое соединение формулы (VI) имеет температуру плавления 85-87 С, и способ позволяет получить 66%. Недостаток способа заключается в том, что исходное соединение труднодоступно; колоночная хроматография, используемая для масштабирования,является дорогостоящей и ограничена в применении. Путь синтеза представлен на реакционной схеме 10.FR 2576901 B1 раскрывает получение 5-тритил-5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-она формулы (V) из тритильного производного формулы (VI) , и он дополнительно раскрывает получение 5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-она гидрохлорида формулы (II) (где НА представляет собой HCl) , начиная с соединения формулы (V). 5-Тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридин формулы(VI) приводят во взаимодействие с бутиллитием, трибутилборатом и перекисью водорода в тетрагидрофурановой среде. Реакционную смесь обрабатывают, и образованный маслянистый продукт перекристаллизовывают из диизопропилового эфира. Выход составляет 64% соединения формулы (V) . Тритильную защитную группу удаляют из промежуточного соединения формулы (V) путем кипячения с 98 мас.% муравьиной кислоты при 90 С в течение 1 ч. После обработки реакционной смеси выход 5,6,7,7 атетрагидро-4 Н-тиено[3,2-c] пиридин-2-она гидрохлорида формулы (II) (где НА представляет собой HCl) составляет 81%, рассчитанный по соединению формулы (V). Краткое изложение сущности изобретения Цель настоящего изобретения заключается в том, чтобы предложить экономичный простой путь синтеза, который не требует колоночной хроматографии, применим в промышленном масштабе и обеспечивает высокий выход, начинается с 4,5,6,7-тетрагидротиено[3,2-c] пиридина гидрохлорида формулы(VII) и позволяет получить прасугрель формулы (I). Вышеприведенная цель достигается при помощи способа по настоящему изобретению. Задача настоящего изобретения представляет собой способ получения 2-ацетокси-5-(2-фтор-циклопропил-карбонил-бензил)-4,5,6,7-тетрагидро-4 Н-тиено[3,2-c]пиридина (прасугреля) формулы (I). Способ начинается с 5-тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридина формулы (VI) в кристаллической форме I по изобретению. Настоящее изобретение дополнительно относится к способу получения 5-тритил-4,5,6,7 тетрагидротиено[3,2-c]пиридина формулы (VI) в кристаллической форме I, начиная с 4,5,6,7-тетрагидротиено[3,2-c]пиридина гидрохлорида формулы (VII). Дополнительно, объектами настоящего изобретения является новая кристаллическая форма I 5 тритил-4,5,6,7-тетрагидротиено [3,2-c]пиридина формулы (VI). В способе получения прасугреля формулы (I) по изобретению используется 5-тритил-5,6,7,7 атетрагидро-4 Н-тиено[3,2-c]пиридин-2-она формулы (V) и 5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-5 023057 она формулы (II) в качестве промежуточных соединений. Подробное описание изобретения Цель настоящего изобретения заключается в том, чтобы предложить улучшенный способ, где тритилирование 4,5,6,7-тетрагидротиено[3,2-c]пиридина гидрохлорида формулы (VII) осуществляют при помощи способа, осуществляемого в единственной емкости и без выделения 4,5,6,7-тетрагидротиено[3,2-c]пиридина формулы (VIIa) в присутствии основания, которое подходит для высвобождения основания из соли гидрохлорида формулы (VII) и для связывания гидрохлорида, который образуется в реакции тритилирования. Изобретение относится к улучшенному способу получения 5-тритил-4,5,6,7-тетрагидротиено[3,2c]пиридина формулы (VI). Исходное соединение способа представляет собой 4,5,6,7-тетрагидротиено[3,2-c]пиридина гидрохлорид формулы (VII), который превращают в 5-тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридин формулы(VI) без выделения 4,5,6,7-тетрагидротиено[3,2-c]пиридина формулы (VIIa). Дополнительная цель заключалась в том, чтобы предложить способ, где применение дихлорметана не требуется в противоположность способу в соответствии с FR 2576901 В 1. Известно, что способы, в которых используют галогенированные растворители, не благоприятны для окружающей среды, таким образом, целесообразно избежать их применения. Одно из преимуществ настоящего изобретения заключается в том, что дихлорметан заменен на другой негалогенированный растворитель. Неожиданно обнаружено, что тритилирование соединения формулы (VII) может быть осуществлено в органических растворителях, отличающихся от дихлорметана. Подходящие растворители представляют собой ароматические углеводороды (например, толуол), эфирные растворители (например, тетрагидрофуран/ТГФ), диоксан, метил-трет-бутиловый эфир, растворители ацидамидного типа (напримерN,N-диметилформамид/ДМФ, N,N-диметилацетамид, N-метилпирролидон), растворители нитрильного типа (например, ацетонитрил) , растворители кетонового типа (например, метилеэтилкетон). Реакцию осуществляют в присутствии органического основания. Органическое основание может представлять собой, например, триэтиламин, N,N-диизопропилэтиламин, пиридин и т.д. Способ по настоящему изобретению осуществляется неожиданно в течение короткого времени (10-15 мин), тогда как время реакции в способе FR 2576901 В 1 составляет 20 ч. Предпочтительно используют растворители, из которых тритилированное кристаллическое соединение осаждается непосредственно или после разбавления реакционной смеси водой. Такие растворители могут представлять собой, например, ацетонитрил, ДМФ и т.д. Таким образом, тритилированный продукт может быть получен при помощи простого фильтрования. Требующая время и трудозатраты обработка реакционной смеси не требуется, и водная щелочь не образуется. Полученный таким образом продукт может быть использован в дальнейших стадиях синтеза без очистки. Дополнительным объектом настоящего изобретения является новая полиморфа 5-тритил-4,5,6,7 тетрагидротиено[3,2-c]пиридина формулы (VI). Неожиданно обнаружено, что полученный 5-тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридин формулы (VI) находится в кристаллической форме с высокой температурой плавления (169-170 С) в противоположность ранее известным формам с низкой температурой плавления (95 С) . Новая полиморфа представляет собой форму I и ее порошковая рентгеновская дифрактограмма представлена на фиг. 1. При осуществлении способа, раскрытого в FR 2576901 В 1, известное соединение с температурой плавления 92-97 С получают путем упаривания реакционной смеси, содержащей дихлорметан. Порошковая рентгеновская дифрактограмма полученного соединения представлена на фиг. 2, соединение является аморфным и содержит 5-25 мол.% дихлорметана. При хранении в течение нескольких месяцев или сушки в вакууме при 80 С аморфное соединение превращается в полиморфную форму, названную формаII. Порошковая рентгеновская дифрактограмма формы II представлена на фиг. 3, и форма II имеет температуру плавления 147-152 С. В фармацевтической промышленности существует значительная потребность в воспроизводимых способах, которые приводят в результате к чистым и морфологически однородным активным промежуточным соединениям. Морфологически однородный продукт также имеет техническую значимость, поскольку единичные полиморфы демонстрируют значительно отличающиеся свойства, которые влияют на обработку (растворимость, сушку и фильтрование). Дополнительное требование к воспроизводимому способу, который приводит в результате к чистому и морфологически однородному продукту, заключается в том, что способ должен быть экономичным и применимым в промышленном масштабе. Кристаллическую форму 5-тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридина формулы (VI) по настоящему изобретению получают с высокой чистотой, она не содержит каких-либо остаточных растворителей, обладает благоприятными физико-химическими свойствами и более стабильна по сравнению с аморфной формой формулы (VI), известной из предшествующего уровня техники. Кроме того, новая полиморфа формулы (VI) воспроизводима в промышленном масштабе. Объект настоящего изобретения представляет собой форму I 5-тритил-4,5,6,7-тетрагидротиено[3,2c]пиридина формулы (VI). Его порошковая рентгеновская дифрактограмма представлена на фиг. 1 и ха-6 023057 рактеристическая картина порошковой дифракции рентгеновских лучей, позиция пиков (форма I) и относительная интенсивность (более 5%) представлены в табл. 1. Таблица 1 Условия проведения порошковой рентгеновской кристаллографии: Аппарат: BRUKER D8 ADVANCE порошковый дифрактометр. Излучение: CuK1 (=1,54060 ) , CuK2 (=1,54439 ). Напряжение: 40 кВ. Анодный ток: 30 мА. Дополнительно: зеркало Гобеля, щель Соллера, пробоотборник, положение с пропусканием лучей. Детектор: LynxEye. Измерение представляло собой статическое / сканирование: 4-35 2. Величина шага: 0,02. Образец: не порошковый, измеряли и хранили при комнатной температуре. Позиции характеристических пиков порошковой дифракции рентгеновских лучей формы I являются следующими: 2 (0,2 2): 10236; 11938; 17929; 19527; 24427. Предпочтительно позиции характеристических пиков порошковой дифракции рентгеновских лучей формы I являются следующими: 2 (0,2 2): 5790; 10236; 10594; 11553; 11938; 13336; 17929; 19527; 20536; 24427. Дополнительное преимущество способа по настоящему изобретению заключается в том, что превращение формы (I) формулы (VI) в 5-тритил-5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-он формулы(V) приводит в результате к более высокому выходу по сравнению с известными способами превращения. Получение 5-тритил-5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-она формулы (V) осуществляют в соответствии со способом, описанным в FR 2576901 В 1, с некоторыми модификациями, которые приводили в результате к благоприятному для окружающей среды способу при более хорошем выходе. В соответствии с FR 2576901 В 1 во время обработки реакционной смеси, содержащей перекись водорода, к реакционной смеси добавляют воду и экстрагируют дихлорметаном. Полученный таким образом дихлорметантетрагидрофурановый растворитель упаривают в вакууме. Остаточный продукт представляет собой масло, из которого твердый конечный продукт получают с помощью диизопропилового эфира. Выход составляет 64%. Цель настоящего изобретения в способе заключалась в том, чтобы модифицировать количество и отношение ТГФ (который используют в качестве реакционной среды) и воды (которую добавляют к ТГФ в процессе реакции) таким образом, чтобы оказалось возможным разделение двух фаз, таким образом,отсутствует необходимость в дополнительной экстракции дихлорметаном или какими-либо другими органическими растворителями. Кристаллическую форму I формулы (VI), обладающую высокой температурой плавления, используют в качестве промежуточного соединения, таким образом, кристаллический продукт получают путем упаривания органической фазы, которая может быть отфильтрована от органических растворителей (например, ацетонитрила, толуола, гексана, гептана, петролейного эфира и т.д.),предпочтительно н-гептана. Выход 5-тритил-5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-она формулы(V) составляет 92%. В соответствии со способом, раскрытым в US 5874581 В 1, тритильную защитную группу удаляют из 5-тритил-5,6,7,7 а-тетрагидро-4 Н-тиено [3, 2-c] пиридин-2-она формулы (V) при помощи эквимолярного количества паратолуолсульфоновой кислоты в растворителе, содержащем ТГФ, перемешивают реакционную смесь в течение 2 ч при 50 С. Способ позволяет получить 93% 5,6,7,7 а-тетрагидро-4 Нтиено[3,2-c]пиридин-2-она паратолуолсульфоната формулы (II), где НА представляет собой п-ТСК. В улучшенном способе по настоящему изобретению реакция может быть осуществлена при комнатной температуре в течение 2 ч. Этот экономичный вариант способа не требует нагревания. Выход составляет 96%. В соответствии с еще одним вариантом способа по настоящему изобретению 5,6,7,7 а-тетрагидро 4 Н-тиено[3,2-c]пиридин-2-он формулы (II) получают простым и экономичным путем. Путем синтеза 5 тритил-5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-она формулы (V) кристаллическое промежуточное соединение формулы (V) не отделяют от органической фазы (ТГФ). Раствор ТГФ непосредственно используют для получения 5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-она паратолуолсульфоната формулы (II) на следующей стадии синтеза. Качество и выход полученного таким образом промежуточного соединения формулы (II) [рассчитанные по 5-тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридину формулы(VI)] являются такими же, как качество и выход промежуточного соединения формулы (II), полученного из кристаллического 5-тритил-5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-она формулы (V). Еще один объект настоящего изобретения представляет собой улучшенный способ получения 2 ацетокси-5-(2-фторциклопропилкарбонилбензил)-4,5,6,7-тетрагидро-4 Н-тиено[3,2-c]пиридина (прасугреля) формулы (I), начиная с новой формы I 5-тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридина формулы (VI), или использование его в качестве промежуточного соединения. Известные способы описывают двухстадийные способы получения прасугреля формулы (I) из 5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c] пиридин-2-она паратолуолсульфоната формулы (II), где получают 5[2-циклопропил-1-(2-фторфенил)-2-оксоэтил]-5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-он - промежуточное соединение формулы (IV). Известные способы используют два отличающихся основания на двух стадиях. Большинство из способов используют воспламеняющийся гидрид натрия в процессе ацилирования. Преимущество способа по настоящему изобретению заключается в том, что он может быть безопасно масштабирован путем замены гидроксида натрия на какой-либо другой органический растворитель. Неожиданно обнаружено, что две стадии могут быть осуществлены в одном и том же органическом растворителе (ДМФ) и в присутствии одного и того же органического основания, несмотря на то что использованные органические основания представляют собой значительно более слабые основания, чем гидроксид натрия. Какие-либо третичные амины (например, триэтиламин, N,N-диизопропилэтиламин,пиридин и т.д. ) могут быть предпочтительно использованы в качестве основания вместо ранее использовавшегося карбоната калия и гидрокарбоната (для реакции связывания) и гидрида натрия (для ацетилирования). Реакционная смесь разделяется между не смешивающимся с водой органическим растворителем и водой, и после выделения из органической фазы продукт получают в виде кристаллического соединения. Конечный продукт очищают путем перекристаллизации из органического растворителя без использования колоночной хроматографии. В соответствии со способом по настоящему изобретению 5,6,7,7 а-тетрагидро-4 Н-тиено[3,2c]пиридин-2-она паратолуолсульфонат (НА представляет собой п-ТСК) формулы (II) и 2-бром-1 циклопропил-2-(2-фторфенил)этанон формулы (III) перемешивают в органическом растворителе (предпочтительно в ДМФ, ТГФ, толуоле, ацетонитриле) путем добавления 1-3 моль эквивалентов, предпочтительно 2-2,5 моль эквивалентов амина при 20-50 С, предпочтительно 20-30 С в течение 1-3, предпочтительно 1-2 ч. Реакционная смесь затем разделяется между водой и этилацетатом, и органическую фазу сушат и упаривают. Остаточный продукт растворяют в органическом растворителе (предпочтительно в ДМФ, ТГФ, толуоле, ацетонитриле) без выделения кристаллического 5-[2-циклопропил-1-(2 фторфенил)-2-оксоэтил]-5,6,7,7 а-тетрагид ро-4 Н-тиено[3,2-c]пиридин-2-она формулы (IV). Затем 1-2 эквивалента, предпочтительно 1-1,5 эквивалента амина и 1-3 эквивалента, предпочтительно 1-2 эквивалента ангидрида уксусной кислоты добавляют к реакционной смеси, и ее дополнительно перемешивают при 20-50 С, предпочтительно 20-30 С в течение 1-3 ч, предпочтительно 1-2 ч. Реакционная смесь затем разделяется между водой и этилацетатом, и органическую фазу сушат и упаривают. Оставшийся продукт перекристаллизуют из подходящего органического растворителя (ацетонитрила, диизопропилового эфира, этанола), из смеси органического растворителя и воды, или из смеси подходящих органических растворителей (толуол-этилацетат, гексан-этилацетат). Способ по настоящему изобретению позволяет получить прасугрель формулы (I) с выходом 38,2%,рассчитанным по исходному соединению формулы (VII), и 46%, рассчитанным по промежуточному соединению формулы (II). Эти результаты демонстрируют, что способ по настоящему изобретению является значительно более продуктивным по сравнению с известными способами. Способ по настоящему изобретению прост при применении в промышленном масштабе и не требует специальных или экстремальных условий реакции и аппаратов. В способе по настоящему изобретению отсутствует необходимость в применении низких температур (-78 С), в использовании неблагоприятных для окружающей среды, ядовитых, высококоррозионных соединений или можно избежать большого количества растворителей или каких-либо способов, сложных для масштабирования (таких как колоночная хроматография). Изобретение дополнительно раскрывается при помощи следующих примеров, не ограничивающих объем защиты изобретения. Примеры Пример 1. Получение кристаллической формы I 5-тритил-4,5,6,7-тетрагидротиено[3,2-с]пиридина формулы (VI). Способ А. 530 см 3 ацетонитрила и 108,0 см 3 (81,8 г; 0,63 моль) N,N-диизопропилэтиламина добавляют к 52,7 г(0,312 моль) тритилхлорида добавляют к суспензии. Смесь перемешивают в течение 3 ч и осажденные кристаллы фильтруют. Полученное таким образом промежуточное соединение может быть использовано на дополнительных стадиях синтеза без какой-либо дополнительной очистки. Выход: 108,0 г (94%) бесцветный кристаллический продукт. Температура плавления (Тпл): 169-170 С, форма I, характеризующаяся порошковой рентгеновской дифрактограммой, представленной на фиг. 1.C-NMR (DMSO-d6, 125 МГц): 142,3; 134,6; 132,9; 128,9; 127,8; 126,3; 125,8; 123,0; 76,8; 47,5; 46,7; 25,9. Элементный анализ [расчет на основании формулы C26H23NS (M: 381, 54)]. Вычислено: С 81,85; H 6,08; N 3,67; S 8,40. Измерено: С 81,64; H 6,19; N 3, 65; S 8,31. Способ Б. 530 см 3 ДМФ и 108,0 см 3 (81,8 г; 0,63 моль) N,N-диизопропилэтиламина добавляют к 52,7 г (0,30 моль) 4,5,6,7-тетрагидротиено[3,2-с]пиридина гидрохлорида (VII). При перемешивании 87,0 г (0,312 моль) тритилхлорида добавляют к суспензии. Смесь перемешивают в течение 4 ч, и осажденные кристаллы фильтруют с ДМФ и промывают водой. Полученное таким образом промежуточное соединение может быть использовано на дополнительных стадиях синтеза без какой-либо дополнительной очистки. Выход: 96,5 г (84%) бесцветный кристаллический продукт. Тпл: 167-170 С, форма I, характеризующаяся порошковой рентгеновской дифрактограммой, представленной на фиг. 1. Пример 2. Получение 5-тритил-5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-она формулы (V). 750 см 3 тетрагидрофурана добавляют к 95,3 г (0,25 моль) 5-тритил-4,5,6,7- тетрагидротиено[3,2c]пиридина (VI). Раствор охлаждают до -40 С, и 150 см 3 (0,375 моль) 2,5M раствора гексан-бутил-лития добавляют по каплям при этой температуре в атмосфере аргона. Раствор затем нагревают до 10 С и перемешивают в течение 30 мин при этой температуре. Раствор затем охлаждают до -40 С и по каплям добавляют раствор 86,2 см 3 (0,375 моль) триизопропилбората и 200 см 3 ТГФ. Раствор затем вновь нагревают до 10 С и перемешивают в течение 1 ч при этой температуре. Раствор затем вновь охлаждают до 40 С и 53,75 см 3 35 мас.% раствора перекиси водорода медленно добавляют по каплям. Температуру раствора оставляют медленно увеличиваться до комнатной, и раствор перемешивают в течение 1 ч при этой температуре. 300 см 3 воды добавляют к раствору при перемешивании и охлаждении. Фазы разделяют, и органическую фазу сушат над MgSO4 и упаривают в вакууме. Остаточный твердый продукт смешивают с гептаном. Осажденные кристаллы фильтруют и промывают гексаном. Полученный таким образом продукт может быть использован на дополнительных стадиях синтеза без какой-либо дополнительной очистки. Выход: 91,4 г (92%) бесцветного кристаллического продукта. Тпл: 194-200 С.C-NMR (DMSO-d6, 125 МГц): 199,1; 169,8; 129,0; 127,8; 126,5; 125,7; 77,5; 51,6; 50,7; 47,6; 35,2. Элементный анализ [расчет на основании формулы C26H23NOS (M: 397,54)]. Вычислено: С 78,55; H 5,83; N 3,52; S 8,07. Измерено: С 78,15; H 5,50; N 3,31; S 7,70. Пример 3. Получение 5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-она-толуол-4-сульфоната формулы II (НА представляет собой п-ТСК). Способ А. 1300 см 3 тетрагидрофурана добавляют к 86,7 г (0,218 моль) 5-тритил-5,6,7,7 а-тетрагидро-4 Нтиено[3,2-c]пиридин-2-она (V) и при интенсивном перемешивании дополнительно добавляют 41,5 г(0,218 моль) толуол-4-сульфонатмоногидрата. Реакционную смесь перемешивают в течение 2 ч при комнатной температуре. Реакционную смесь охлаждают в бане лед-вода до 0-5 С, перемешивают в течение 3-4 ч, фильтруют и промывают тетрагидрофураном. Полученный таким образом продукт может быть использован на дополнительных стадиях синтеза без какой-либо дополнительной очистки. Выход: 68,2 г (96%) бесцветного кристаллического продукта. Тпл: 198-200 С.C-NMR (DMSO-d4 125 МГц): 197,4; 163,9; 144,9; 138,5; 129,3; 128,5; 125,6; 47,7; 44,0; 42,6; 30,8,21,0. Элементный анализ [расчет на основании формулы C14H17NO4S2 (M: 327,42)]. Вычислено: С 51,36; H 5,23; N 4,28; S 19,59. Измерено: С 51,17; H 5,25; N 4,13; S 19,63. Способ Б. 750 см 3 тетрагидрофурана добавляют к 95,3 г (0,25 моль) 5-тритил-4,5,6,7-тетрагидротиено[3,2c]пиридина (VI). Раствор охлаждают до -40 С и 150 см (0,375 моль) 2,5M раствора гексан-бутил-лития добавляют по каплям при этой температуре в атмосфере аргона. Раствор затем нагревают до 10 С и перемешивают в течение 30 мин при этой температуре. Раствор затем охлаждают до -40 С и по каплям добавляют 8 6,2 см 3 (0,37 5 моль) раствора триизопропилбората и 200 см 3 ТГФ. Раствор затем вновь нагревают до 10 С и перемешивают в течение 1 ч при этой температуре. Раствор затем вновь охлаждают до 40 С и 53,75 см 3 35 мас.% раствора перекиси водорода медленно добавляют по каплям. Температуре раствора дают возможность медленно увеличиваться до комнатной, и раствор перемешивают в течение 1 ч при этой температуре. 300 см 3 воды добавляют к раствору при перемешивании и охлаждении. Фазы разделяют, органический слой сушат над MgSO4 и 47,5 г (0,25 моль) толуол-4-сульфонатмоногидрата добавляют при интенсивном перемешивании. Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь охлаждают в бане лед-вода до 0-5 С, перемешивают в течение 3-4 ч, фильтруют и промывают тетрагидрофураном. Полученный таким образом продукт может быть использован на дополнительных стадиях синтеза без какой-либо дополнительной очистки. Выход: 73,8 г (90%) бесцветный кристаллический продукт. Тпл: 198-200 С. Пример 4. Получение 2-ацетокси-5-(2-фторциклопропилкарбонилбензил)-4,5,6,7-тетрагидро-4 Нтиено[3,2-c]пиридина (прасугрель, I). Стадия 1. 150 см 3 ДМФ добавляют к 65,5 г (0,2 моль) 5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-она паратолуолсульфоната (II, НА представляет собой п-ТСК). 75,3 см 3 (56,9 г; 0,44 моль) N,N-диизопропилэтиламина (ДИПЭА) добавляют в раствор, и 55,4 г 2-бром-1-циклопропил-2-(2-фторфенил)этанона (III)(с содержанием основного вещества 92,8%), растворенного в 94 см 3 (88,7 г) диметилформамида добавляют по каплям в течение приблизительно 30 мин при охлаждении в смеси лед-вода. Смесь перемешивают в течение 1 ч при комнатной температуре. Реакционную смесь выливают в смесь льда с водой и этилацетатом. Фазы разделяют, и водную фазу экстрагируют этилацетатом. Объединенные органические фазы сушат над MgSO4. Растворитель удаляют в вакууме. Стадия 2. 28,4 см 3 (30,6 г; 0,30 моль) уксусного ангидрида добавляют по каплям к смеси 70 мл ДМФ и 37,65 3 см (28,43 г; 0,22 моль) ДИПЭА при 15-20 С при интенсивном перемешивании. Раствор остаточного продукта стадии 1 и 120 мл ДМФ добавляют по каплям к реакционной смеси при интенсивном перемешивании при 20-25 С. Смесь перемешивают в течение 1 ч при комнатной температуре. Реакционную смесь выливают в смесь льда с водой и этилацетатом. Фазы разделяют, и водную фазу экстрагируют этилацетатом. Объединенные органические фазы сушат над MgSO4. Растворитель удаляют в вакууме, и этанол добавляют к остаточному продукту. После охлаждения до 0-5 С осажденные кристаллы фильтруют, промывают этанолом. Выход составляет 38,1 г (51%) неочищенного прасугреля. Неочищенный продукт перекристаллизуют из ацетонитрила. Выход: 34,4 г (46,0%) бесцветного кристаллического продукта. Выход для всего способа синтеза, рассчитанный по 4,5,6,7-тетрагидротиено[3,2-c]пиридина гидрохлориду формулы (VII), составляет 38,2%. Тпл: 120-121 С.C-NMR (CDCL3, 125 МГц): 207,4; 167,5; 161,1; 149,4; 130,4; 129,7; 129,3; 125,6; 124,2; 122,0; 115,6; 112,8; 71,5; 50,3; 48,3, 24,9; 20,4; 18,1, 11,8, 11,3. Элементный анализ [расчет на основании формулы C20H20FNO3S (M: 373,45)]. Вычислено: С 64,33;- 10023057 20 см 3 (0,079 моль) триэтиламина добавляют по каплям к раствору 10 г (0,072 моль) 4,5,6,7 тетрагидротиено[3,2-c]пиридина в 20 см 3 дихлорметана при комнатной температуре, и добавляют 20,02 г(0, 072 моль) трифенилметилхлорида. Реакционную смесь поддерживают при комнатной температуре в течение ночи и выливают в 200 см 3 воды. Фазы разделяют; органическую фазу сушат над сульфатом натрия и упаривают досуха. Остаточный продукт очищают путем хроматографии на силикагеле с использованием дихлорметана в качестве элюента. Выход: 28,9 г (96%) аморфного вещества. Рентгеновская дифрактограмма представлена на фиг. 2. Тпл: 92-97 С, бесцветное, пастообразное. 1 превращения полученного соединения в 5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-с]пиридин-2-она толуолсульфонат формулы II пара в которой НА представляет собой п-ТСК (паратолуолсульфоновая кислота) путем реакции соединения формулы V с паратолуолсульфоновой кислотой; дальнейшего превращения полученного таким образом соединения в соединение формулы IV в органическом растворителе в присутствии основания; и превращение полученного соединения в прасугрель формулы I путем реакции с уксусным ангидридом в органическом растворителе, причем исходное соединение представляет собой 5-тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридин формулы VI в кристаллической форме I. 2. Способ по п.1, где исходное соединение 5-тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридин формулы VI в кристаллической форме I превращают в 5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-она паратолуолсульфонат формулы II без выделения 5-тритил-5,6,7,7 а-тетрагидро-4 Н-тиено[3,2-c]пиридин-2-она формулы V 3. Форма I 5-тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридина формулы VI, которая демонстрирует порошковую рентгеновскую дифрактограмму, имеющую характеристические пики при угле отражения 2 (0,2 2) приблизительно 10,236; 11,938; 17,929; 19,527; 24,427. 4. Форма I 5-тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридина формулы VI по п.3, которая демонстрирует порошковую рентгеновскую дифрактограмму в соответствии со следующей таблицей (относительная интенсивность более 5%): 5. Способ получения формы I 5-тритил-4,5,6,7-тетрагидротиено[3,2-c]пиридина формулы VI по п.3 или 4, где 4,5,6,7-тетрагидротиено[3,2-с]пиридина гидрохлорид приводят во взаимодействие с тритилхлоридом без выделения соответствующего основания формулы VIIa в присутствии основания с применением органического растворителя, из которого кристаллический продукт осаждают без осаждения соли основания, применяемого в качестве вещества, связывающего кислоты. 6. Способ по п.5, где органическое основание применяют в качестве вещества, связывающего кислоты. 7. Способ по п.6, где органическое основание представляет собой третичный амин, предпочтительно N,N-диизопропилэтиламин, триэтиламин, азотсодержащее гетероциклическое соединение, предпочтительно пиридин. 8. Способ по п.5, где органический растворитель представляет собой ароматический углеводород,предпочтительно толуол; растворитель эфирного типа, предпочтительно тетрагидрофуран, диоксан или метил-трет-бутиловый эфир; растворитель типа кислотного амида, предпочтительно N,Nдиметилформамид, N,N-диметилацетамид или N-метилпирролидон; растворитель нитрильного типа,предпочтительно ацетонитрил; или растворитель кетонового типа, предпочтительно метилэтилкетон. Реакционная схема 11: Способ получения прасугреля в соответствии с настоящим изобретением
МПК / Метки
МПК: C07D 495/04
Метки: промежуточное, соединение, форме, прасугреля, кристаллической, способ, получения
Код ссылки
<a href="https://eas.patents.su/16-23057-sposob-polucheniya-prasugrelya-promezhutochnoe-soedinenie-v-kristallicheskojj-forme-i-sposob-ego-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения прасугреля, промежуточное соединение в кристаллической форме и способ его получения</a>
Предыдущий патент: Металлическое волокно с фаской на проходящей в продольном направлении волокна кромке
Следующий патент: Вакцинные векторы и способы усиления иммунных ответов
Случайный патент: Состав для уменьшения гидравлического сопротивления