Вакцинные векторы и способы усиления иммунных ответов
Номер патента: 23058
Опубликовано: 29.04.2016
Авторы: Боттдж Уолтер, Лейтон Шеррилл, Харджис Билли, Бергман Люк
Формула / Реферат
1. Вакцинный вектор, включающий антигенный полипептид и полипептид HMGB1, в котором по крайней мере часть антигенного полипептида и по крайней мере часть полипептида HMGB1 присутствуют на поверхности вакцинного вектора.
2. Вакцинный вектор по п.1, в котором антигенным полипептидом является специфичный для вируса гриппа полипептид.
3. Вакцинный вектор по п.2, в котором антигенным полипептидом является полипептид М2е, НА или NP вируса гриппа.
4. Вакцинный вектор по п.3, в котором антигенный полипептид выбирают из группы, состоящей из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9 и SEQ ID NO:10.
5. Вакцинный вектор по любому из пп.1-4, в котором полипептид HMGB1 выбирают из SEQ ID NO:18, SEQ ID NO:29, SEQ ID NO:30.
6. Вакцинный вектор по любому из пп.1-5, который является бактерией.
7. Вакцинный вектор по п.6, в случае которого бактерией является Bacillus spp.
8. Вакцинный вектор по любому из пп.1-7, в котором антигенный полипептид и/или полипептид HMGB1 включен в трансмембранный белок.
9. Вакцинный вектор по п.8, в котором антигенный полипептид и/или полипептид HMGB1 находятся в поверхностном петлевом участке трансмембранного белка.
10. Вакцинный вектор по п.8 или 9, в случае которого трансмембранным белком является cotB.
11. Вакцинный вектор по любому из пп.1-10, в котором антигенный полипептид и полипептид HMGB1 формируют часть гибридного белка.
12. Композиция, включающая вакцинный вектор по любому из пп.1-11 и фармацевтически приемлемый носитель.
13. Композиция по п.12, в которой фармацевтически приемлемый носитель является приемлемым для орального или интраназального введения.
14. Композиция по п.12 или 13, в которой вакцинный вектор не способен к репликации, является инактивированным или убитым.
15. Способ усиления иммунного ответа у субъекта, включающий введение субъекту вакцинного вектора по любому из пп.1-11 или композиции по любому из пп.12-14 в количестве, эффективном для усиления иммунного ответа у субъекта против антигенного полипептида.
16. Способ по п.15, в котором вакцинный вектор вводят орально или интраназально.
17. Способ по п.16, в котором иммунным ответом является продукция антител класса IgA против антигенного полипептида.
18. Способ по любому из пп.15-17, в котором вакцинный вектор не способен к репликации в организме субъекта или является инактивированным или убитым перед введением субъекту.
19. Вакцинный вектор Bacillus spp., включающий первую полинуклеотидную последовательность, кодирующую антигенный полипептид, присутствующий на поверхности вакцинного вектора, и вторую полинуклеотидную последовательность, кодирующую иммуностимулирующий полипептид, в котором антигенный полипептид и иммуностимулирующий полипептид присутствуют на поверхности вакцинного вектора, причем антигенным полипептидом является полипептид вируса гриппа, а иммуностимулирующим полипептидом является полипептид HMGB1.
20. Вакцинный вектор по п.19, в котором первый полинуклеотид и второй полинуклеотид встроены в третью полинуклеотидную последовательность, кодирующую поверхностную часть трансмембранного белка.
21. Вакцинный вектор по п.20, в случае которого трансмембранным белком является cotB.
22. Вакцинный вектор по любому из пп.19-21, в котором антигенным полипептидом является полипептид М2е вируса гриппа, полипептид НА вируса гриппа или полипептид NP вируса гриппа.
23. Вакцинный вектор по п.22, в котором антигенный полипептид выбирают из группы, состоящей из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9 и SEQ ID NO:10.
24. Вакцинный вектор по любому из пп.19-23, в котором полипептид HMGB1 выбирают из SEQ ID NO:18, SEQ ID NO:29, SEQ ID NO:30.
25. Способ усиления иммунного ответа у субъекта, включающий введение субъекту вакцинного вектора Bacillus spp. по любому из пп.19-24 в количестве, эффективном для усиления иммунного ответа у субъекта против антигенного полипептида.
26. Способ по п.25, в котором вакцинный вектор вводят орально или интраназально.
27. Способ по п.26, в котором иммунным ответом является продукция антител класса IgA против антигенного полипептида.
28. Способ по любому из пп.25-27, в котором вакцинный вектор не способен к репликации в организме субъекта или является инактивированным или убитым перед введением субъекту.
29. Способы снижения связанной с вирусом гриппа А заболеваемости у субъекта, включающий введение субъекту вакцинного вектора по любому из пп.2-11 или 19-24 или композиции по любому из пп.12-14 в количестве, эффективном для снижения связанной с вирусом гриппа А заболеваемости у субъекта.
Текст
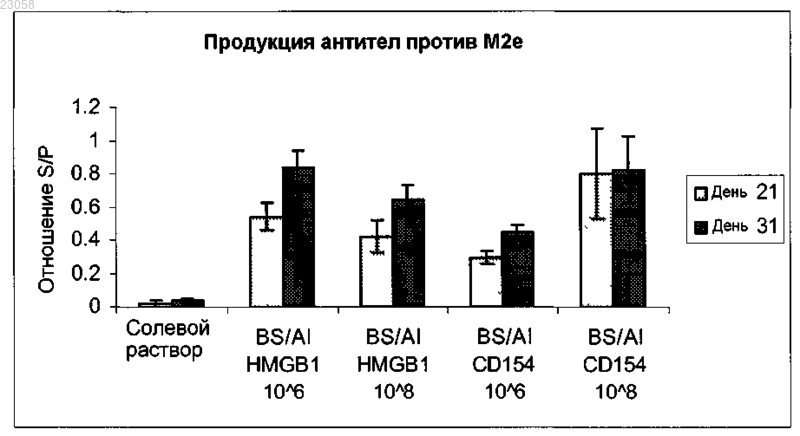
ВАКЦИННЫЕ ВЕКТОРЫ И СПОСОБЫ УСИЛЕНИЯ ИММУННЫХ ОТВЕТОВ В изобретении представлены вакцинные векторы, включающие антигенный полипептид и полипептид HMGB1, которые присутствуют на поверхности вакцинного вектора. Композиции,включающие вакцинные векторы, также представляются и включают фармацевтически приемлемый носитель, соответственно носитель для орального или интраназального введения. Также представлены способы усиления иммунных ответов, в частности гуморального иммунного ответа и соответственно продукции IgA, посредством введения субъекту вакцинных векторов или композиций, раскрытых в изобретении.(71)(73) Заявитель и патентовладелец: ДЗЕ БОРД ОФ ТРАСТИЗ ОФ ДЗЕ ЮНИВЕРСИТИ ОФ АРКАНЗАС; ДЗЕ ТЕКСАС Эй ЭНД Эм ЮНИВЕРСИТИ СИСТЕМ (US) Перекрестная ссылка на родственные заявки Эта заявка на патент притязает на приоритет предварительной заявки на патент США 61/297098,поданной 21 января 2010 г., которая включена сюда посредством ссылки в ее полном объеме. Введение Вакцины используются для вызова адаптивного иммунного ответа против антигенов, в частности антигенов патогенов, опухолевых клеток или т.п., для уменьшения интенсивности или предотвращения заболевания. Синтетические пептиды или вакцины на основе убитых или аттенуированных микроорганизмов являются часто эффективными в стимулировании сильного иммунного ответа, который является полностью протективным. В некоторых случаях эти вакцины не являются протективными или являются лишь частично протективными, и другие стратегии должны применяться для разработки протективных вакцин. Вакцины на основе аттенуированных микроорганизмов также связаны с рисками переноса генов или исправления мутаций и могут представлять риск для индивидуумов с ослабленным иммунитетом. Необходима разработка новых вакцин, которые являются безопасными и эффективными в стимулировании длительных протективных иммунных ответов. Инфицирование вирусом гриппа, в частности вирусом птичьего гриппа H5N1, представляет собой растущую проблему в области здравоохранения и экономики. Факты явно указывают на то, что H5N1 продолжает циркулировать между чувствительными птицами и свиньями в расширяющихся областях всего мира. Многие ученые полагают, что в случае оставления без сдерживания существующий сегодня вирус птичьего гриппа H5N1 мутирует с созданием возможности для передачи от человека к человеку и вызовом всемирной пандемии. При коэффициенте смертности, превышающем 50%, такое появление эпидемии будет ужасающим. Независимо от способности вируса к вызову заболевания у человека вирус птичьего гриппа H5N1 уже угрожает большим ударом по экономике вследствие уничтожения стай домашних птиц в пораженных областях. Поэтому необходима разработка вакцины для защиты людей, домашней птицы, свиней и других одомашненных животных от вируса гриппа H5N1. Вакцина против гриппа, которая способна защитить от H5N1, а также от других вирусов гриппа, таких как H1N1, будет оптимальной. Краткое изложение сущности изобретения Здесь предоставляются вакцинные векторы, способы стимулирования иммунного ответа и способы снижения заболеваемости, связанной с инфицированием вирусом гриппа. В одном аспекте предоставляется вакцинный вектор, включающий антигенный полипептид и полипептид HMGB1 или его функциональный фрагмент. По крайней мере часть антигенного полипептида и по крайней мере полипептидаHMGB1 присутствуют на поверхности вакцинного вектора. Вакцинный вектор может включать первый полинуклеотид, кодирующий антигенный полипептид, и второй полинуклеотид, кодирующий полипептид HMGB1. Полипептид HMGB1 и антигенный полипептид могут быть связаны, например, в гибридном белке. Как полипептид HMGB1, так и антигенный полипептид могут быть вставлены в поверхностный петлевой участок трансмембранного белка. В другом аспекте предоставляется композиция, включающая вакцинный вектор и фармацевтически приемлемый носитель. Фармацевтически приемлемый носитель может быть приемлемым для орального или интраназального применения. Вакцинный вектор может быть не способен к репликации. В еще одном аспекте предоставляется вакцинный вектор Bacillus spp. Вакцинный вектор включает первую полинуклеотидную последовательность, кодирующую антигенный полипептид, представляемый на поверхности вакцинного вектора, и вторую полинуклеотидную последовательность, кодирующую иммуностимулирующий полипептид, представляемый на поверхности вакцинного вектора. Антигенным полипептидом может быть полипептид М 2 е вируса гриппа, полипептид НА вируса гриппа или полипептид NP вируса гриппа или их комбинация. Иммуностимулирующим полипептидом может быть полипептид CD154 или полипептид HMGB1 или их комбинация. Иммуностимулирующий полипептид и антигенный полипептид могут быть связаны, например, в гибридном белке, и могут быть включены в поверхностный петлевой участок трансмембранного белка. Те не менее, в другом аспекте предоставляются способы усиления иммунного ответа у субъекта. В этом способе предоставляемые здесь вакцинные векторы или композиции вводят субъекту в количестве,эффективном для усиления иммунного ответа у субъекта против антигенного полипептида. Соответственно, когда вакцинный вектор вводят орально или интраназально. В дальнейшем аспекте предоставляются способы усиления иммунного ответа у субъекта посредством введения вакцинного вектора Bacillus spp., описываемого здесь. Вакцинный вектор включает первую полинуклеотидную последовательность, кодирующую антигенный полипептид, представляемый на поверхности вакцинного вектора, и вторую полинуклеотидную последовательность, кодирующую иммуностимулирующий полипептид, представляемый на поверхности вакцинного вектора. Антигенным полипептидом может быть полипептид М 2 е вируса гриппа, полипептид НА вируса гриппа, полипептид NP вируса гриппа или их комбинация. Иммуностимулирующим полипептидом может быть полипептидCD154, полипептид HMGB1 или их комбинация. Те не менее, в дальнейшем аспекте предоставляются способы снижения связанной с вирусом гриппа заболеваемости у субъекта. В этих способах введение раскрытых здесь вакцинных векторов или ком-1 023058 позиций снижает заболеваемость, связанную с последующим инфицированием вирусом гриппа. Краткое описание чертежей Фиг. 1 представляет собой диаграмму, на которой представлены отношения S/P (образца к положительному контролю), полученные в ELISA для продукции специфичных для М 2 е антител цыплятами после орального введения через зонд указанной дозы вакцинного вектора Bacillus subtilis, экспрессирующего эпитопы белков вируса гриппа А и либо HMGB1, либо CD154, по сравнению с цыплятами, вакцинированными солевым раствором. Фиг. 2 представляет собой диаграмму, на которой представлены отношения S/P, полученные в ELISA для продукции специфичных для HALB антител цыплятами после орального введения через зонд указанной дозы вакцинного вектора Bacillus subtilis, экспрессирующего эпитопы белков вируса гриппа А и либо HMGB1, либо CD154, по сравнению с цыплятами, вакцинированными солевым раствором. Фиг. 3 представляет собой диаграмму, на которой представлены отношения S/P, полученные в ELISA для продукции специфичных для HAUA антител цыплятами после орального введения через зонд указанной дозы вакцинного вектора Bacillus subtilis, экспрессирующего эпитопы белков вируса гриппа А и либо HMGB1, либо CD154, по сравнению с цыплятами, вакцинированными солевым раствором. Фиг. 4 представляет собой диаграмму, на которой представлены отношения S/P, полученные в ELISA для продукции специфичных для М 2 е антител цыплятами после орального введения через зонд указанной дозы живых или различных образом инактивированных вакцинных векторов Bacillus subtilis, экспрессирующих эпитопы белков вируса гриппа А и либо HMGB1, либо CD154, по сравнению с цыплятами, вакцинированными лишь Bacillus вектором (BSBB). Фиг. 5 представляет собой диаграмму, на которой представлены отношения S/P, полученные в ELISA для продукции специфичных для HALB антител цыплятами после орального введения через зонд указанной дозы живых или различных образом инактивированных вакцинных векторов Bacillus subtilis,экспрессирующих эпитопы белков вируса гриппа А и либо HMGB1, либо CD154, по сравнению с цыплятами, вакцинированными лишь Bacillus вектором (BSBB). Фиг. 6 представляет собой диаграмму, на которой представлены отношения S/P, полученные в ELISA для продукции специфичных для HAUA антител цыплятами после орального введения через зонд указанной дозы живых или различных образом инактивированных вакцинных векторов Bacillus subtilis,экспрессирующих эпитопы белков вируса гриппа А и либо HMGB1, либо CD154, по сравнению с цыплятами, вакцинированными лишь Bacillus вектором (BSBB). Фиг. 7 представляет собой диаграмму, на которой представлены отношения S/P, полученные в ELISA для продукции специфичных для М 2 е антител класса IgG цыплятами после орального введения через зонд либо 106 живых, либо различных указанных доз инактивированных формалином вакцинных векторов Bacillus subtilis, экспрессирующих эпитопы белков вируса гриппа А и HMGB1, по сравнению с цыплятами, вакцинированными лишь Bacillus вектором (BSBB). Фиг. 8 представляет собой диаграмму, на которой представлены отношения S/P, полученные в ELISA для продукции специфичных для М 2 е антител класса IgA цыплятами, вакцинированными либо орально, либо подкожно, 106 живых, инактивированных формалином или инактивированных формалином и лиофилизированных вакцинных векторов Bacillus subtilis, экспрессирующих эпитопы белков вируса гриппа А и HMGB1, по сравнению с цыплятами, вакцинированными лишь Bacillus вектором (BSBB). Фиг. 9 представляет собой диаграмму, на которой представлены отношения S/P, полученные в ELISA для продукции специфичных для М 2 е антител класса IgA цыплятами, вакцинированными либо орально, либо подкожно, 106 живых, инактивированных формалином или инактивированных формалином и лиофилизированных вакцинных векторов Bacillus subtilis, экспрессирующих эпитопы белков вируса гриппа А и HMGB1, по сравнению с цыплятами, вакцинированными лишь Bacillus вектором (BSBB). Подробное описание настоящего изобретения Технологии рекомбинантных ДНК обеспечивают возможность для относительно легкой манипуляции многими бактериальными и вирусными видами. Некоторые бактерии и вирусы либо являются по своей природе малопатогенными или непатогенными, но остаются способными к вызову сильного иммунного ответа, либо их можно подвергнуть отбору на такое свойство или создать такими. Эти бактерии и вирусы порождают привлекательные вакцинные векторы для вызова иммунного ответа против гетерологичных или чужеродных антигенов. Бактериальные или вирусные вакцинные векторы могут имитировать природную инфекцию и вызывать сильный и длительно сохраняемый иммунитет. Часто производство и введение вакцинных векторов являются относительно недорогими. Кроме того, такие векторы могут часто содержать более одного антигена и могут обеспечить защиту от множества инфекционных агентов. Вакцинные векторы в виде живых бактерий или вирусов могут, тем не менее, представлять риск для индивидуумов с ослабленным иммунитетом и в их случае требуется дополнительное регулятивное рассмотрение. Поэтому желательным является применение векторов, которые являются убитыми или инактивированными или квалифицируются как организмы, которые обычно считаются безопасными(GRAS), Управлением по контролю за продуктами и лекарствами (FDA). Проблемой является вызов сильного иммунного ответа, используя такие векторы. Как продемонстрировано в примерах, посредст-2 023058 вом размещения полипептидов HMGB1 (амфотеринов, белков В 1 из группы белков с высокой подвижностью) на поверхности вакцинного вектора авторы настоящего изобретения могут вызвать сильный иммунный ответ против антигенных полипептидов, используя вектор Bacillus spp. На самом деле, в примерах демонстрируется, что этот вектор можно подвергнуть инактивации, так что он не может реплицироваться, используя множество способов, и, тем не менее, может вызывать сильный иммунный ответ после введения. Здесь предоставляются вакцинные векторы, включающие антигенный полипептид и полипептидHMGB1 или его функциональный фрагмент. По крайней мере часть антигенного полипептида и по крайней мере часть полипептида HMGB1 или его функционального фрагмента присутствуют на поверхности вакцинного вектора. Вакцинный вектор может включать первый полинуклеотид, кодирующий антигенный полипептид, и второй полинуклеотид, кодирующий полипептид HMGB1. Полипептид HMGB1 и антигенный полипептид могут быть связаны, например, в гибридном белке, или могут экспрессироваться по отдельности. Как полипептид HMGB1, так и антигенный полипептид могут быть включены в поверхностный петлевой участок трансмембранного белка. Вакцинные векторы могут быть бактериальными, вирусными векторами или векторами на основе липосом. Потенциальные вакцинные векторы включают, но без ограничения, Bacillus (Bacillus subtilis),Salmonella (Salmonella enteritidis), Shigella, Escherichia (E. coli), Yersinia, Bordetella, Lactococcus, Streptococcus, Vibrio (Vibrio cholerae), Listeria, аденовирус, поксвирус, вирус герпеса, альфавирус и аденоассоциированный вирус. Соответственно, когда вакцинным вектором является GRAS организм, вакцинный вектор может быть инактивированным или убитым, так что он не способен к репликации. Способы инактивации или убивания бактериальных или вирусных вакцинных векторов известны квалифицированным в данной области техники специалистам и включают, но без ограничения, такие способы, как те, которые приведены в примерах, т.е. инактивацию формалином, основанную на антибиотиках инактивацию, термическую обработку и обработку этанолом. Антигенным полипептидом является полипептид, который может специфически распознать адаптивная иммунная система. Антигенный полипептид включает любой полипептид, который является иммуногенным. Антигенные полипептиды включают, но без ограничения, антигены, которые относятся к патогенам, относятся к аллергенам, опухолям или связаны с заболеванием. Патогены включают вирусные, паразитические, грибковые и бактериальные патогены, а также белки-патогены, такие как прионы. Антигенными полипептидами могут быть полноразмерные белки или их части. Хорошо известно, что распознавание иммунной системой многих белков основано на относительно небольшом числе аминокислот, часто называемом эпитопом. Эпитопы могут представлять собой лишь 8-10 аминокислот. Таким образом, описываемые здесь антигенные полипептиды могут представлять собой полноразмерные белки,эпитопы длиной 8 аминокислот или любой участок между этими пределами. В действительности, антигенные полипептиды могут включать более одного эпитопа одиночного патогена или белка. В вакцинный вектор могут быть включено множество копий одного и того же эпитопа или множество эпитопов различных белков. Предусматривается, что несколько эпитопов или антигенов, связанных с одним и тем же патогеном или заболеванием или различными патогенами или заболеваниями, могут вводиться вместе в одном вакцинном векторе для вызова усиленного иммунного ответа против множества антигенов. Рекомбинантные вакцинные векторы могут кодировать антигены множества патогенных микроорганизмов, вирусов или опухолевоспецифических антигенов. Введение вакцинных векторов, способных экспрессировать множество антигенов, способствует вызову иммунитета к двум или более заболеваниям в одно и то же время. Антигенным полипептидом может быть полипептид вируса гриппа соответственно, когда им является полипептид вируса гриппа штамма H5N1 или полипептид, ассоциируемый с множеством штаммов вируса гриппа, такой как полипептид белка М 2 вируса гриппа. Эктодомен белка М 2 вируса гриппа А,известный как М 2 е, выпячивается с поверхности вируса. М 2 е - часть белка М 2 содержит приблизительно 24 аминокислоты. Полипептид М 2 е незначительно варьируют от одного изолята к другому изоляту вируса гриппа. На самом деле, лишь несколько встречающихся в природе мутаций в М 2 е было обнаружено в изолятах от инфицированных людей с момента эпидемии гриппа в 1918. Кроме того, вирусы гриппы,выделенные из организмов-носителей, являющихся птицами и свиньями, имеют различные, однако консервативные, последовательности М 2 е. Для просмотра последовательностей полипептидов М 2 е, выделенных из организмов-носителей, являющихся людьми, птицами и свиньями, см. Liu et al., Microbes andInfection 7: 171-177 (2005) и Reid et al., J. Virol. 76: 10717-10723 (2002), каждый из которых включен сюда посредством ссылки в его полном объеме (см. также SEQ ID NO: 1-4. Соответственно, когда весь полипептид М 2 е включают в вакцинный вектор или может использоваться лишь часть, в примерах полипептид из восьми аминокислот (LM2, имеющий аминокислотную последовательность EVETPIRN, SEQ ID NO:5, или его вариант M2eA, имеющий аминокислотную последовательность EVETPTRN, SEQ ID NO:6) был включен в вакцинный вектор и, как показано, вызывал гуморальный иммунный ответ после введения цыплятам. Соответственно, когда часть полипептида М 2 е,включенная в вакцинный вектор, является иммуногенной, иммуногенным фрагментом является пептид или полипептид, способный к вызову клеточных или гуморальных иммунных ответов. Соответственно иммуногенным фрагментом М 2 е может быть полноразмерный полипептид М 2 е или соответственно он может представлять собой 20 или более аминокислот, 15 или более аминокислот, 10 или более аминокислот или 8 или более аминокислот полной последовательности. Другие эпитопы, подходящие для включения в вакцинный вектор против вируса гриппа А, включают, но без ограничения, полипептиды гемагглютинина (НА) или ядерного белка (NP) вируса гриппа А. Например, пептиды SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9 или SEQ ID NO:10 могут быть включены в вакцинный вектор. В примерах SEQ ID NO:7 (HAUA) и SEQ ID NO:8 (HALB) были включены в вакцинный вектор и, как показано, вызывали гуморальный иммунный ответ после введения цыплятам (см. фиг. 2, 3 и 5, 6. Кроме того, эпитопы NP - SEQ ID NO:9 (NP54) и SEQ ID NO:10 (NP147) были включены в вакцинный вектор в примерах. Квалифицированному в данной области техники специалисту будет понятно, что любая из этих последовательностей может использоваться в комбинации с любым другим эпитопом, в том числе с эпитопами, происходящими из других патогенов или антигенов. Белок HMGB1 (амфотерин, белок В 1 из группы белков с высокой подвижностью) был сначала идентифицирован как ДНК-связывающий белок, важный для структуры и стабильности ДНК. Он является повсеместно экспрессируемым ядерным белком, который связывается с ДНК без специфичности в отношении ее последовательности. Этот белок является высококонсервативным и обнаруживается в растениях вплоть до млекопитающих. Аминокислотные последовательности HMGB1 данио, цыпленка и человека представлены в SEQ ID N0:30, SEQ ID NO:18 и SEQ ID NO:29 соответственно. Последовательность для всех млекопитающих является высококонсервативной, при этом идентичность последовательностей составляет 98%, и аминокислотные замены являются консервативными. Поэтому белок HMGB1 одного вида может, вероятно, функционально замещать белок другого вида. Полноразмерный белокHMGB1 или его часть могут использоваться в качестве полипептида HMGB1 в описываемых здесь вакцинных векторах. HMGB1 имеет два ДНК-связывающий района, называемых блоком А, представленным в SEQ ID NO:23 и 24, и блоком В, представленным в SEQ ID NO:25 и 26 (см. Andersson and Tracey, Annu.Rev. Immunol. 2011, 29: 139-162, который включен сюда посредством ссылки в его полном объеме.HMGB1 является медиатором воспаления и выполняет функцию сигнала ядерного повреждения,например, от некротических клеток. HMGB1 может также активно секретироваться клетками моноцитарной/макрофагальной линии дифференцировки в ходе процесса, для которого необходимы ацетилирование белка, передвижение через ядро и секреция. Экстраклеточный HMGB1 функционирует в качестве сильного медиатора воспаления посредством передачи сигналов через рецептор для конечных продуктов усиленного гликозилирования (RAGE) и через члены семейства Toll-подобных рецепторов (TLR), в частности TLR4. Активность связывания с RAGE была идентифицирована, и для нее требуется полипептидSEQ ID NO: 27. Для связывания с TLR4 требуется цистеин в положении 106 SEQ ID NO:18, который обнаруживается в районе блока В HMGB1. Для воспалительных активностей HMGB1 не требуется полноразмерный белок, и были идентифицированы функциональные фрагменты. Установлено, что блок В достаточен, чтобы опосредовать провоспалительные эффекты HMGB1, и поэтому SEQ ID NO:25 и 26 являются полипептидами HMGB1 или его функциональными фрагментами в контексте настоящего изобретения. Кроме того, сайт связывания сRAGE и провоспалительная цитокиновая активность были картированы в SEQ ID NO:27 и SEQ ID NO:28 соответственно. Таким образом, эти полипептиды являются функциональными фрагментами полипептидов HMGB1 в контексте настоящего изобретения. Квалифицированные в данной области техники специалисты могут идентифицировать полипептиды HMGB1 и их фрагменты, способные к стимулированию провоспалительной цитокиновой активности,используя такие способы, как те, которые описаны в публикации международной заявки сWO02/092004, которая включена сюда посредством ссылки в ее полном объеме. Соответственно, когда полипептид HMGB1 включает RAGE-связывающий домен в положениях 150-183 аминокислот SEQ IDNO:18 (SEQ ID NO:27 или его гомолог) и домен провоспалительной цитокиновой активности между аминокислотами 89-109 SEQ ID NO:18 (SEQ ID NO:28 или его гомолог). В частности, полипептидыHMGB1 и их функциональные фрагменты или гомологи включают полипептиды, идентичные или идентичные на по крайней мере 99%, по крайней мере 98%, по крайней мере 95%, по крайней мере 90%, по крайней мере 85% или по крайней мере 80% полипептидам HMGB1 с SEQ ID NO:18 или 23-30. По крайней мере часть антигенного полипептида и по крайней мере часть полипептида HMGB1 присутствуют на поверхности вакцинного вектора. Присутствующие на поверхности вакцинного вектора полипептиды включают полипептиды, которые включены в трансмембранный белок, взаимодействуют,ковалентно или химически сшиты, с трансмембранным белком, мембранным липидом или прикрепленным к мембране углеводом. Полипептид можно включить в трансмембранный белок, связав аминокислоты, включающие полипептид, через пептидную связь с N-концом, С-концом трансмембранного белка или где-нибудь в нем (т.е. включив между двумя аминокислотами трансмембранного белка или вместо одной или более аминокислот трансмембранного белка (т.е. посредством делеции-вставки). Соответственно полипептиды можно включить в поверхностный петлевой участок трансмембранного белка. Подходящими трансмембранными белками являются cotB и lamB, но квалифицированным в данной области техники специалистам будет понятно, что в наличие имеется множество подходящих трансмембранных белков. Альтернативно, полипептиды можно ковалентно или химически связать с белками, липидами или углеводами в мембране, или капсидом в случае использования вирусного вектора, посредством способов,имеющихся в распоряжении квалифицированных в данной области техники специалистов. Например,дисульфидные связи или перекрестное сшивание биотина с авидином можно было бы использовать для представления антигенного полипептида и полипептида HMGB1 на поверхности вакцинного вектора. Соответственно, когда антигенный полипептид и полипептид HMGB1 являются частью гибридного белка. Два полипептида можно непосредственно соединить через пептидную связь, или они могут быть разделены линкером или районом третьего белка, в который их включают. Полинуклеотиды, кодирующие антигенный полипептид или полипептид HMGB1, можно ввести в вакцинный вектор и экспрессировать с созданием антигенного полипептида и полипептида HMGB1. Полинуклеотиды можно встроить в хромосому вакцинного вектора, или они могут кодироваться на плазмидах или другой экстрахромосомной ДНК. Соответственно полинуклеотиды, кодирующие антигенный полипептид и/или полипептид HMGB1, могут экспрессироваться независимо или они встроены в полинуклеотид вакцинного вектора, который экспрессируется. Соответственно, когда полинуклеотид вакцинного вектора кодирует полипептид, представляемый на поверхности вакцинного вектора, такой как трансмембранный белок, полинуклеотид, кодирующий антигенный полипептид и/или полипептидHMGB1, можно встроить в полинуклеотидную последовательность вакцинного вектора, чтобы сделать возможным представление антигенного полипептида и/или полипептида HMGB1 на поверхности вектора. Например, полинуклеотид, кодирующий антигенный полипептид и полипептид HMGB1, можно встроить в рамке считывания в бактериальный полинуклеотид в районе, кодирующем поверхностный петлевой участок трансмембранного белка, из условия, чтобы бактериальная полинуклеотидная последовательность оставалась в рамке считывания (см. пример 1). Альтернативно, полинуклеотид, кодирующий антигенный полипептид и/или полипептид HMGB1,можно встроить в полинуклеотид секретируемого полипептида, который представляется на поверхности вакцинного вектора благодаря связи с белком, липидом или углеводом на поверхности вакцинного вектора. Квалифицированным в данной области техники специалистам будет понятно, что полинуклеотид,кодирующий антигенный полипептид и/или полипептид HMGB1, можно было бы встроить в широкий ряд полинуклеотидов вакцинного вектора для обеспечения экспрессии и представления антигенного полипептида и/или полипептида HMGB1 на иммуноцитах субъекта, подвергаемого вакцинотерапии. В примерах несколько эпитопов белков вируса гриппа, включающих эпитоп М 2 е, эпитоп НА и эпитоп NP,были экспрессированы с плазмиды для экспрессии в вегетативных клетках в Bacillus subtilis. Результирующие рекомбинантные бактерии экспрессируют включенные эпитопы, что показано с помощью иммунного ответа, представленного на фиг. 1-6. В примерах вакцинные векторы содержат антигенные полипептиды (полипептиды М 2 е, НА и NP) и иммуностимулирующий полипептид (либо CD154, либо HMGB1), кодируемые одним и тем полинуклеотидом и в рамке считывания друг с другом. В альтернативных вариантах осуществления иммуностимулирующий полипептид и антигенный полипептид могут кодироваться отдельными полинуклеотидами. Квалифицированным в данной области техники специалистам будет понятно, что множество способов может использоваться для достижения представленности антигенного полипептида и полипептидаHMGB1 на поверхности вакцинного вектора. Такие способы известны квалифицированным в данной области техники специалистам. Также предоставляются композиции, включающие вакцинный вектор и фармацевтически приемлемый носитель. Фармацевтически приемлемым носителем является любой носитель, подходящий для invivo введения. Соответственно, когда фармацевтически приемлемый носитель является приемлемым для оральной, интраназальной доставки или доставки через слизистую оболочку, фармацевтически приемлемый носитель может включать воду, забуференные растворы, растворы глюкозы или жидкие среды для культивирования бактерий. Дополнительные компоненты композиций могут соответственно включать наполнители, такие как стабилизаторы, консерванты, разбавители, эмульгаторы и смазки. Примеры фармацевтически приемлемых носителей или разбавителей включают стабилизаторы, такие как углеводы (например, сорбит, маннит, крахмал, сахароза, глюкоза, декстран), белки, такие как альбумин или казеин, белоксодержащие агенты, такие как бычья сыворотка или снятое молоко, и буферы (например, фосфатный буфер). Особенно в случае добавления таких стабилизаторов к композициям композиция подходит для сушки сублимацией или сушки распылением. Вакцинный вектор в композициях может быть неспособен к репликации соответственно, когда вакцинный вектор инактивируют или убивают до добавления в композицию. Описываемые здесь композиции могут использоваться для усиления иммунного ответа, такого как продукция антител против антигенного полипептида. Композиции, содержащие полипептиды вируса гриппа, могут также использоваться для снижения заболеваемости, связанной с последующим инфицированием вирусом гриппа. Композиции могут предотвращать вызов вирусом гриппа заболевания или любой связанной заболеваемости у субъекта, которому введены композиции или вакцинные векторы,описываемые здесь. Описываемые здесь композиции и вакцинные векторы могут уменьшать тяжесть последующего заболевания в результате уменьшения продолжительности заболевания, снижения коэффициента заболеваемости или смертности, связанной с заболеванием, или уменьшения вероятности заражения. Заболеваемость и смертность, связанная с заболеванием, после введения описываемых здесь вакцинных векторов могут снизиться на 25, 30, 40, 50, 60, 70, 80, 90 или даже 100% по сравнению с подобными субъектами, которым не предоставлен вакцинный вектор. Также предоставляются способы усиления иммунных ответов у субъекта посредством введения вакцинного вектора. Вакцинный вектор может содержать полипептид HMGB1, способный к стимулированию иммунного ответа против вакцинного вектора и связанного с ним антигенного полипептида. Вакцинный вектор, включающий полипептид HMGB1, вводят субъекту в количестве, эффективном для усиления иммунного ответа у субъекта против вакцины, в частности антигенного полипептида. Соответственно, когда вакцинный вектор содержит полинуклеотид, кодирующий полипептид, включающий аминокислоты 150-183 и 89-109 полипептида HMGB1 (SEQ ID NO:18), или его гомолог, в примерах используется полипептид из 190 аминокислот HMGB1. Соответственно, когда полинуклеотид кодирует полипептид HMGB1 вида, одинакового с видом субъекта, гетерологичные комбинации полипептидов HMGB1 и субъектов (т.е. полипептид HMGB1 человека для применения в вакцине для цыплят) могут применяться в способах настоящего изобретения, поскольку HMGB1 является высококонсервативным для широкого ряда видов. Полипептид HMGB1 может использоваться для усиления иммунного ответа у субъекта,направленного на любой чужеродный антиген или антигенный полипептид, присутствующий в вакцинном векторе или на нем. Квалифицированному в данной области техники специалисту будет понятно,что полипептид HMGB1 мог бы использоваться для усиления иммунного ответа против более одного антигенного полипептида, присутствующего в вакцинном векторе. Полипептид из HMGB1 стимулирует иммунный ответ, по крайней мере, частично в результате активации дендритных клеток и макрофагов и,следовательно, стимулирования продукции цитокинов, таких как IL-1, IL-6, IFN-и TNF-. В примерах полипептид HMGB1 представлен на поверхности вакцинного вектора. Кроме того, раскрываются способы усиления иммунного ответа против вируса гриппа А и способы снижения заболеваемости, связанной с последующим инфицированием вирусом гриппа А. Вкратце, способы включают введение субъекту вакцинного вектора, включающего эпитоп белка вируса гриппа А(антигенный полипептид вируса гриппа), способный к вызову иммунного ответа, в количестве, эффективном для вызова иммунного ответа. Эпитопом белка вируса гриппа А может быть полипептид М 2 е,полипептид НА, или полипептид NP, или другой полипептид вируса гриппа, обсуждавшийся выше. Включение антигенных полипептидов в вакцинный вектор можно выполнить множеством способов, известных квалифицированным в данной области техники специалистам, включающих, но без ограничения, систему сайт-направленного мутагенеза, не оставляющего глубоких следов, описанную в публикации международной заявки на патент сWO 2008/036675. Можно также создать бактерию, которая экспрессирует полипептиды вируса гриппа, в сочетании с полинуклеотидами, способными к усилению иммунного ответа, обсуждавшимися выше. В частности, полипептид CD154 или HMGB1 может экспрессироваться вакцинным вектором для усиления иммунного ответа у субъекта против полипептидов вируса гриппа. В примерах демонстрируется вызов обильной продукции IgA и IgG на вакцинацию у цыплят. Авторы настоящего изобретения предполагают, что такой сильный ответ будет предохранять от заболеваемости, связанной с последующим инфицированием или заражением источником антигенного полипептида (вирусом гриппа в примерах), или по крайней мере снижать ее. Композиции можно вводить множеством способов, в том числе, но без ограничения, орально, интраназально или через слизистую оболочку. Например, доставку композиций или вакцинных векторов можно осуществить с использованием аэрозоля посредством распыления, посредством добавления в пищевые продукты или воду, посредством орального введения через зонд или через глазные капли. В некоторых вариантах осуществления композиции вводят посредством инъекции, например, внутрикожно,парентерально, подкожно, внутрибрюшинно, внутривенно, интракраниально или внутримышечно. В случае цыплят или другой домашней птицы композиции можно вводить в яйцо. Субъекты включают, но без ограничения, позвоночных, соответственно млекопитающих, соответственно человека, коров, кошек, собак, свиней, или птиц, соответственно домашнюю птицу, такую как цыплята. Могут также использоваться другие модели инфекционного заболевания на животных. Усиление иммунного ответа включает, но без ограничения, вызов терапевтического или профилактического эффекта, опосредуемого иммунной системой субъекта. В частности, усиление иммунного ответа может включать увеличенную продукцию антител, например, продемонстрированную на фиг. 1-3, увеличенное переключение класса - переключение синтеза тяжелых цепей антител, например, продукцию IgA, продемонстрированную на фиг. 8, созревание антигенпрезентирующих клеток, стимуляцию Т-клетокхелперов, стимуляцию цитолитических Т-клеток или индукцию Т- и В-клеточной иммунологической памяти. Дозы, применимые для ведения, будут варьировать в зависимости от возраста, веса и вида субъекта,способа и пути введения и типа патогена или заболевания, против которого требуется иммунный ответ. Композицию можно вводить в любой дозе вакцинного вектора, достаточной для вызова иммунного ответа. Предусматривается, что подходящими являются дозы в диапазоне от 103 до 1010 копий вектора (т.е.-6 023058 бляшкообразующих или колониеобразующих единиц), от 104 до 109 копий вектора или от 105 до 107 копий вектора. Композицию можно вводить только один раз или ее можно вводить два или более раз для увеличения иммунного ответа. Например, композицию можно вводить два или более раз с интервалами, составляющими одну неделю, две недели или три недели, один месяц, два месяца, три месяца, шесть месяцев или более. Бактерии могут быть жизнеспособными перед введением, но в некоторых вариантах осуществления бактерии могут быть убитыми или инактивированными перед введением. В некоторых вариантах осуществления бактерии могут быть способными к репликации в организме субъекта, в то время как в других вариантах осуществления бактерии могут быть неспособными к репликации в организме субъекта. Как продемонстрировано в примерах, бактериальные вакцинные векторы можно инактивировать до введения, используя формалин, этанол, нагревание или антибиотики. Квалифицированному в данной области техники специалисту будет понятно, что другие способы инактивации вакцинных векторов могли бы также использоваться. Здесь также предоставляется вакцинный вектор Bacillus spp. Bacillus вакцинный вектор включает первую полинуклеотидную последовательность, кодирующую антигенный полипептид, и вторую полинуклеотидную последовательность, кодирующую иммуностимулирующий полипептид. Антигенный полипептид и иммуностимулирующий полипептид присутствуют на поверхности Bacillus вакцинного вектора, описанного выше. Антигенным полипептидом является полипептид вируса гриппа, описанный выше, а иммуностимулирующим полипептидом является полипептид HMGB1, описанный выше, или полипептид CD154. Полинуклеотиды, кодирующие иммуностимулирующие полипептиды, которые гомологичны белкам субъекта и способны к стимулированию ответа иммунной системы на антигенный полипептид, могут быть также введены в вакцинный вектор. Как описано подробнее в примерах, вакцинный вектор может включать полипептид CD154, который способен к связыванию CD40 у субъекта и стимулированию ответа субъекта на вакцинный вектор и связанный с ним антигенный полипептид, подобно HMGB1, описанному выше. Bacillus вакцинный вектор может включать полипептид HMGB1, полипептид CD154 или их комбинацию. Как описано выше, полинуклеотиды, кодирующие эти полипептиды, могут быть встроены в хромосому вакцинного вектора или сохраняться вне хромосомы. Квалифицированному в данной области техники специалисту будет понятно, что эти полипептиды могут быть включены в ряд полипептидов вакцинного вектора и представлены в различных частях вакцинного вектора или могут секретироваться. Полинуклеотид, кодирующий иммуностимулирующий полипептид, способный к усилению иммунного ответа против антигенного полипептида, может также кодировать антигенный полипептид. Полинуклеотид, кодирующий иммуностимулирующий полипептид, может быть связан с полинуклеотидом,кодирующим антигенный полипептид, например, в вакцинном векторе иммуностимулирующий полипептид и антигенный полипептид кодируются одним и тем же полинуклеотидом. В примерах полинуклеотид, кодирующий полипептид CD154, который способен к связыванию CD40, или HMGB1, также кодирует эпитоп М 2 е, эпитоп НА и эпитоп NP вируса гриппа А (см. SEQ ID NO:19-22). В примерах как полинуклеотид, кодирующий эпитопы белков вируса гриппа, так и полинуклеотид, кодирующий иммуностимулирующий полипептид, экспрессируются с плазмиды для экспрессии в вегетативных клетках. В некоторых вариантах осуществления полинуклеотиды встроены в ген cotB или другой ген, кодирующий белок, представляемый на поверхности спор. Квалифицированным в данной области техники специалистам будет понятно, что бактериальные полинуклеотиды, кодирующие другие трансмембранные белки,могут также использоваться. Как обсуждалось выше, полинуклеотид, кодирующий иммуностимулирующий полипептид, гомологичный белку у субъекта, который способен к усилению иммунного ответа против эпитопа, может быть включен в вакцинный вектор. В примерах Bacillus вакцинный вектор, включающий полинуклеотид,кодирующий либо полипептид CD154, способный к связыванию с CD40, либо полипептид HMGB1, как показано, усиливал иммунный ответ против эпитопа М 2 е и два отличных эпитопа НА, что определено по увеличению продукции антител в ответ на вакцинацию. Соответственно, когда длина полипептида CD154 составляет менее 50 аминокислот, еще более соответственно менее 40, менее 30 или менее 20 аминокислот, длина полипептида может составлять от 10 до 15 аминокислот, от 10 до 20 аминокислот или от 10 до 25 аминокислот. Среди различных видов последовательность CD154 и CD40-связывающий район не являются в высокой степени консервативными. Последовательности CD154 курицы и человека представлены в SEQ ID NO:11 и SEQ ID NO:12 соответственно.CD40-связывающие районы CD154 были определены для ряда видов, в том числе человека, курицы,утки, мыши и крупного рогатого скота, и представлены в SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15,SEQ ID NO:16, SEQ ID NO:17 соответственно. Хотя существуют вариабельность последовательностей вCD40-связывающем районе между видами, в представленных ниже примерах показано, что полипептидCD154 человека способен к усилению иммунного ответа у цыплят. Следовательно, настоящее изобретение можно осуществить на практике, используя видоспецифичные полипептиды CD154 или гетероло-7 023058 гичный полипептид CD154. В частности, полипептиды CD154 и их функциональные фрагменты или гомологи включают полипептиды, идентичные или идентичные на по крайней мере 99%, по крайней мере 98%, по крайней мере 95%, по крайней мере 90%, по крайней мере 85% или по крайней мере 80% полипептидам CD154 с SEQ ID NO:11-17.Bacillus вакцинный вектор, описываемый здесь, может использоваться в способах усиления иммунного ответа и способах снижения заболеваемости гриппом у субъекта, описанных выше. Bacillus вакцинный вектор может использоваться для изготовления композиций для введения субъектам, таким как те,которые также описаны выше. Гетерологичные полинуклеотиды, кодирующие антигенные полипептиды, могут быть встроены в бактериальный геном в любом несущественном месте, или альтернативно, их можно переместить на плазмиду, используя хорошо известные в данной области техники способы. Одно место, подходящее для встраивания полинуклеотидов, находится внутри поверхностных частей трансмембранных белков или связано с последовательностями, которые ориентируют гетерологичный полинуклеотид на пути секреции. Примерами гена трансмембранного белка, подходящего для вставки полинуклеотидов, являются генcotB Bacillus и ген lamb Salmonella. Гетерологичные полинуклеотиды включают, но без ограничения, полинуклеотиды, кодирующие антигены, отбираемые из патогенных микроорганизмов или вирусов, отличных от вакцинного вектора. Такие полинуклеотиды могут происходить от патогенных вирусов, таких как вирус гриппа (например,М 2 е, гемагглютинин или нейраминидаза), вирусы герпеса (например, гены, колирующие структурные белки вирусов герпеса), ретровирусы (например, оболочечный белок gpl60), аденовирусы, парамиксовирусы, коронавирусы и т.п. Можно также получить гетерологичные полинуклеотиды из патогенных бактерий, например гены, кодирующие бактериальные белки, такие как токсины или белки наружной мембраны. Кроме того, гетерологичные полинуклеотиды из паразитов, таких как Eimeria, являются привлекательными кандидатами на применение в векторной вакцине. Дополнительные иммуностимулирующие полипептиды, вовлеченные в приведение в действие иммунной системы, могут быть также включены в вакцинные векторы, описываемые здесь. Полинуклеотиды могут кодировать молекулы иммунной системы, известные в отношении их стимулирующих эффектов, такие как интерлейкин, фактор некроза опухолей или интерферон, или другой полипептид, вовлеченных в иммунорегуляцию. Следующие примеры, как подразумевается, являются исключительно иллюстративными и не подразумеваются как ограничения объема настоящего изобретения или прилагаемой формулы изобретения. Примеры Пример 1. Конструирование HA/NP/M2e/cCD154 и HA/NP/M2e/HMGBl Bacillus векторов. Штаммы и условия культивирования. Все плазмиды сначала сохраняли в клетках Е. coli TOP10 (Invitrogen, Carlsbad, CA, США), кроме особо оговоренных случаев. Bacillus spp. использовали для введения мутаций (штамм Bacillus subtilis,Poultry Health Laboratory, названный NP122). Бактерии, содержащие плазмиду pDGIEF и рНТ 10, наращивали при 37 С. Среду Лурия-Бертани (LB) использовали для обычного наращивания клеток, а среду SOC (Invitrogen, Carlsbad, CA, США) использовали для фенотипического выражения после электропорации. По мере уместности в среду добавляли следующее: изопропилD-тиогалактопиранозид (IPTG) в концентрации 1 мМ, ампициллин (Amp) в концентрации 100 мкг/мл, спектиномицин (SP) в концентрации 100 мкг/мл и хлорамфеникол (Cm) в концентрации 5 мкг/мл. Плазмиды. Плазмиды pDGIEF (Bacillus Genetic Stock Center, Columbus, ОН) и рНТ 10, использованные в настоящем исследовании, были описаны ранее (Zhang et al., Nuc. Acids Research 2006, 34 (9): 1-8 и Nguyenet al., Curr. Micro. 2007, 55: 89-93). Плазмида pDGIEF выполняла функцию матрицы для амплификации гена mazF, который использовался в качестве промежуточного селектируемого маркера во время манипулирования хромосомой Bacillus. Плазмиду рНТ 10 использовали для кодирования и продуцирования гетерологичных последовательностей эпитопов белков вируса птичьего гриппа в Bacillus spp. Эта плазмида содержит ген устойчивости к СМ, ее индукцию осуществляют, добавляя 1 мМ IPTG, и ее сохраняют в Bacillus при 37 С. Продукция гетерологичных белков для экспрессии в вегетативных клетках: Плазмиду рНТ 10, купленную у MoBioTec/Boca Scientific, Boca Raton, FL (Nguyen et al., 2007), преобразовывали в сайт множественного клонирования при добавлении вставочной последовательности с оптимизацией частоты использования кодонов для Bacillus subtilis. Проводили секвенирование ДНК для подтверждения правильной вставки последовательности. По-новому модифицированную плазмиду затем трансформировали в Bacillus. Вкратце, культуры Bacillus наращивали в течение ночи при 37 С в средеMgSO4). Ночную культуру (1 мл) использовали для засева в 20 мл среды (среды Спицайзена, дополненной 0,5% глюкозы, 5 мкг/мл DL-триптофана, 5 мкг/мл урацила, 0,01% гидролизата казеина, 0,1% дрож-8 023058 жевого экстракта, 1 мМ MgSO4, 2,5 мМ MgCl2, 0,5 мМ CaCl2), и инкубацию проводили при встряхивании в течение 3-4 ч 30 С. К 1 мл результирующей культуры LS добавляли 10 мкл 0,1 М EGTA, и инкубацию проводили при комнатной температуре в течение 5 мин. Затем добавляли 1-2 мкг плазмидной ДНК, осуществляли встряхивание в течение 2 ч при 37 С, и осуществляли засев на чашки с LB с селективными антибиотиками. Эти трансформированные Bacillus spp теперь продуцируют гетерологичные последовательности эпитопов из AI после индукции 1 мМ IPTG. ПЦР. Все праймеры, использованные для ПЦР, перечислены в табл. 1. Типичные условия для ПЦР состояли из приблизительно 0,1 мкг очищенной геномной, плазмидной или образованной в ходе ПЦР ДНК(Qiagen, Valencia, СА, США), 1 буфера для полимеразы Pfu, 5 E полимеразы Pfu (Stratagene La Jolla, CA,США), 1 мМ dNTP (GE Healthcare Bio-Sciences Corp., Piscataway, NJ), 1,2 мкМ каждого праймера в общем объеме, равном 50 мкл. Термоциклер - прибор для амплификации ДНК (Bio-Rad, Hercules, CA,США) применяли со следующими условиями амплификации: 94 С в течение 2 мин; 30 циклов, каждый из которых состоял из 94 С в течение 30 с, 58 С в течение 60 с, 72 С в течение 90 с для каждой 1 т.о.; и 72 С в течение 10 мин для коечного удлинения. Каждый продукт ПЦР подвергали очистке из геля (Qiagen, Valencia, CA, США) и элюированию либо в 25 мкл буфера ЕВ для приготовления матриц, используемых в ПЦР с использованием перекрывания и удлинения, либо в 50 мкл буфера ЕВ, осаждали этанолом и суспендировали в 5 мкл ddH2O для электропорации в Bacillus spp. Таблица 1 Последовательности праймеров,использованные для создания вакцинного вектора В табл.1 выделенные курсивом нуклеотиды являются нуклеотидами, которые комплементарны той или другой стороне сайта вставки в ген CotB Bacillus subtilis. Электропорация. Вкратце, клетки засевали в 10 мл среды LB и наращивали при 37 С в течение ночи. Затем 100 мкл ночной культуры вновь засевали в 10 мл новой среды LB с инкубацией при 37 С в течение 3-4 ч. Клетки промывали пять раз водой ddH2O и ресуспендировали в 60 мкл 10% глицерина. Затем на клетки посылали импульсы при 2,4-2,45 кВ в течение 1-6 мс, их инкубировали в 0,5 мл SOC в течение 2-3 ч при 37 С и засевали на среду LB с соответствующими антибиотиками. Интеграция в хромосому гетерологичной ДНК для представления в оболочке споры. Рекомбинантные штаммы Bacillus, содержащие устойчиво интегрированные копии отобранных эпитопов М 2 е, НА и NP, конструировали, используя недавно опубликованные способы с модификацией. Вкратце, штаммы Bacillus трансформировали кассетой MazF (Zhang et al., 2006), которая порождала штамм, который был чувствительным к IPTG и устойчивым к спектомицину. Кассету MazF, фланкированную гомологичной ДНК размером приблизительно 300 п.о. с каждой стороны, вводили в ген CotB(Isticato et al., 2001) Bacillus вектора с помощью электропорации с последующим выращиванием в среде,содержащей спектомицин, для отбора положительных клонов, которые теперь содержат кассету MazF,которая является устойчивой к спектомицину. После подтверждения мутации MazF в CotB этот район замещали оптимизированной в отношении частоты использования кодонов последовательностью ДНК, кодирующей антигенные детерминанты AI,снова фланкированной гомологичной ДНК размером приблизительно 300 п.о. Это выполняли посредством создания продукта ПЦП, используя ПЦР с использованием перекрывания и удлинения, чтобы создать антигенные последовательности, фланкированные последовательностями размером приблизительно 300 п.о. с каждой стороны, гомологичными хромосоме Bacillus (Cox et al., 2007). Продукт ПЦР вводили вBacillus снова посредством электропорации и замещения кассеты MazF. Отбор трансформантов осуществляли на чашках, содержащих IPTG, положительные клоны должны теперь быть нереагирующими наIPTG и чувствительными к спектомицину. Правильную вставку последовательности в хромосому подтверждали посредством секвенирования ДНК. Пример 2. Исследование 1 и 2 вакцинации. Цыплят в день вылупления (день 0) получали с местной коммерческой инкубаторной станции и случайным образом разделяли на группы терапии (n=15/группу терапии в эксперименте 1 и n=20/группу терапии в эксперименте 2). Всех цыплят в каждой группе терапии снабжали ярлычками и занумеровывали. Цыплят орально инфицировали посредством введения через зонд 0,25 мл солевого раствора или 106108 КОЕ/мл различных Bacillus терапий, указанных в табл.2 для исследования 1 и в табл.3 для исследования 2. Таблица 2 Заражающая доза для каждой группы терапии в исследовании 1 вакцинации Таблица 3 Заражающая доза для каждой группы терапии в исследовании 2 вакцинации В исследовании 2 бактерии инактивировали несколькими различными способами для оценки, необходима ли репликация для вызова продукции антител, направленных против антигенных пептидов вируса гриппа. Использовали несколько способов инактивации, поскольку способы инактивации могли привести к разрушению эпитопа и привести к неверной интерпретации данных и подтверждению необходимости репликации или жизнеспособности Bacillus вектора. Бактерии инактивировали посредством инкубации в течение 10 мин в 0,022% формалине (инактивированные формалином); инкубации в течение 10 мин при 70 С (инактивированные нагреванием); инкубации в 5 мкг/мл гентамицина (подвергнутые основанной на антибиотиках инактивации) или инкубации в течение 10 мин в 70% этаноле (инактивированные этанолом). Каждую группу терапии размещали в отдельном напольном загоне на свежей сосновой подстилке и неограниченно предоставляли воду и пищу. В дни 11 и 21 после вылупления птицы получали бустервакцину той же терапии, которую они получали в день 0. Также в дни 21 и 31/32 от каждой снабженной ярлычком птицы получали кровь, и снимали сыворотку. Сыворотку, полученную от снабженных ярлычками птиц в каждой группе терапии, затем использовали в ELISA с захватом антител для определения продукции антител, специфичных для М 2 е, HAUA иHALB. Вкратце, индивидуальные лунки 96-луночного планшета покрывали 10 мкг/мл эпитопа М 2 е, эпитопа HAUA или эпитопа HALB, конъюгированного с BSA. Допускали прохождение адгезии антигенов в течение ночи при 4 С. Планшеты промывали PBS+0,05% Tween 20, блокировали PBS Superblock (PierceChemical Co.) в течение как минимум 2 ч и инкубировали в течение 2 ч с сывороткой, предварительно полученной от птиц в каждой из групп терапий, описанных выше, Планшеты промывали PBS+0,05%Tween 20 с последующей инкубацией с конъюгированным с пероксидазой козьим вторым антителом против IgY кур (в разведении 1:7500), полученным из Jackson ImmunoResearch Laboratories (West Grove,PA), в течение еще часа. После последующей промывки планшеты проявляли, используя набор с субстратом для пероксидазы, полученный от Fisher Scientific, и оптические плотности считывали на спектрофотометре при 450 и 405 нм. Образцы объединенных сывороток от групп, получающих векторные вакцины, использовали в качестве положительных контролей, а образцы объединенных сывороток от невакцинированных групп использовали в качестве отрицательных контролей в каждом планшете для замены сыворотки от групп терапий. Оптические плотности, полученные для положительного контроля, отрицательного контроля и экспериментальных образцов, использовали для расчета отношений образца к положительному контролю (отношений S/P), используя следующий расчет: Рассчитанные отношения S/P для каждого исследования представлены на фиг. 1-6. На фиг. 1-3 представлены суммарные титры антител против М 2 е, HALB и HAUA для исследования 1, соответственно в дни 21 и 31 после вылупления. Результаты доказывают, что сильные иммунные ответы против каждого из этих антигенов были вызваны после орального введения Bacillus, экспрессирующей каждый из этих эпитопов вместе либо с CD154, либо HMGB1 в качестве иммуностимулирующего пептида. На фиг. 4-6 представлены суммарные титры антител против М 2 е, HALB и HAUA для исследования 2, соответственно в дни 21 и 32 после вылупления. Результаты доказывают, что сильные иммунные ответы против каждого из этих эпитопов были вызваны после орального введения живой Bacillus, экспрессирующей эпитоп и иммуностимулирующий пептид. На фиг. 4-6 также показано, что сходные уровни специфических антител были также порождены, когда вектор (Bacillus) был инактивирован до введения. Пример 3. Исследование 3 вакцинации. Цыплят в день вылупления (день 0) получали с местной коммерческой инкубаторной станции и случайным образом разделяли на группы терапии (n=20/группу терапии). Всех цыплят в каждой группе терапии снабжали ярлычками и занумеровывали. Цыплят орально инфицировали посредством введения через зонд 0,25 мл солевого раствора или 105-108 КОЕ/мл Bacillus вектора (BSBB), Bacillus вектора, экспрессирующего эпитопы белков птичьего гриппа и HMGB1 (BS/AI/HMGB1), или различных количествBS/AI/HMGB1 вектора после инактивации формалином (как описано выше). В день 10 после вылупления птицы получали бустер-вакцину той же терапии, которую они получали в день 0. Также в дни 21 и 32 от каждой снабженной ярлычком птицы получали кровь, и снимали сыворотку. Уровни специфичных для М 2 е антител класса IgG в сыворотке определяли, используя описанный выше способ с использованием меченного пероксидазой второго антитела, специфичного для IgG кур (Jackson ImmunoResearch Laboratories, West Grove, PA). Представленные на фиг. 7 результаты доказывают, что так же как живые бактерии инактивированные формалином бактерии были способны к стимулированию продукции специфичных для М 2 е антител класса IgG. Этот результат был неожиданным, поскольку обычно полагают, что только живые бактерии могут стимулировать сильный иммунный ответ после орального введения. Пример 4. Исследование 4 вакцинации. Цыплят в день вылупления (день 0) получали с местной коммерческой инкубаторной станции и случайным образом разделяли на группы терапии (n=20-35/группу терапии). Всех цыплят в каждой группе терапии снабжали ярлычками и занумеровывали. Цыплят инфицировали посредством орального введения через зонд или подкожной инъекции 0,25 мл солевого раствора или 106 КОЕ/мл Bacillus вектора(BSBB), Bacillus вектора, экспрессирующего эпитопы белков птичьего гриппа и HMGB1 (BSAI), илиBSAI вектора после инактивации формалином (как описано выше) или после инактивации формалином с последующей лиофилизацией (воссоздаваемого с использованием солевого раствора непосредственно перед введением). В день 10 после вылупления некоторые птицы получали бустер-вакцину той же терапии, которую они получали в день 0. В дни 11, 14 и 21 от каждой снабженной ярлычком птицы получали кровь, и снимали сыворотку. Уровни специфичных для М 2 е антител классов IgA и IgG в сыворотке определяли, используя описанный выше способ с использованием меченного пероксидазой антитела против IgA кур (GenTex) или меченного пероксидазой второго антитела против IgG кур (Jackson ImmunoResearch Laboratories, West Grove, PA). Представленные на фиг. 8 результаты доказывают, что приблизительно так же как живые бактерий инактивированные формалином бактерии были способны к стимулированию продукции специфичных для М 2 е антител класса IgA после орального введения. Напротив, в случае подкожного введения инактивированный BSAI вектор не был настолько же эффективен в стимулировании продукции антител класса IgA, и лиофилизированные бактерии не стимулировали продукциюIgA. Представленные на фиг. 9 результаты доказывают, что каждый из протоколов введения BSAI поддерживал обильное образование IgG. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Вакцинный вектор, включающий антигенный полипептид и полипептид HMGB1, в котором по крайней мере часть антигенного полипептида и по крайней мере часть полипептида HMGB1 присутствуют на поверхности вакцинного вектора. 2. Вакцинный вектор по п.1, в котором антигенным полипептидом является специфичный для вируса гриппа полипептид. 3. Вакцинный вектор по п.2, в котором антигенным полипептидом является полипептид М 2 е, НА или NP вируса гриппа. 4. Вакцинный вектор по п.3, в котором антигенный полипептид выбирают из группы, состоящей из 5. Вакцинный вектор по любому из пп.1-4, в котором полипептид HMGB1 выбирают из SEQ IDNO:18, SEQ ID NO:29, SEQ ID NO:30. 6. Вакцинный вектор по любому из пп.1-5, который является бактерией. 7. Вакцинный вектор по п.6, в случае которого бактерией является Bacillus spp. 8. Вакцинный вектор по любому из пп.1-7, в котором антигенный полипептид и/или полипептидHMGB1 включен в трансмембранный белок. 9. Вакцинный вектор по п.8, в котором антигенный полипептид и/или полипептид HMGB1 находятся в поверхностном петлевом участке трансмембранного белка. 10. Вакцинный вектор по п.8 или 9, в случае которого трансмембранным белком является cotB. 11. Вакцинный вектор по любому из пп.1-10, в котором антигенный полипептид и полипептидHMGB1 формируют часть гибридного белка. 12. Композиция, включающая вакцинный вектор по любому из пп.1-11 и фармацевтически приемлемый носитель. 13. Композиция по п.12, в которой фармацевтически приемлемый носитель является приемлемым для орального или интраназального введения. 14. Композиция по п.12 или 13, в которой вакцинный вектор не способен к репликации, является инактивированным или убитым. 15. Способ усиления иммунного ответа у субъекта, включающий введение субъекту вакцинного вектора по любому из пп.1-11 или композиции по любому из пп.12-14 в количестве, эффективном для усиления иммунного ответа у субъекта против антигенного полипептида. 16. Способ по п.15, в котором вакцинный вектор вводят орально или интраназально. 17. Способ по п.16, в котором иммунным ответом является продукция антител класса IgA против антигенного полипептида. 18. Способ по любому из пп.15-17, в котором вакцинный вектор не способен к репликации в организме субъекта или является инактивированным или убитым перед введением субъекту. 19. Вакцинный вектор Bacillus spp., включающий первую полинуклеотидную последовательность,кодирующую антигенный полипептид, присутствующий на поверхности вакцинного вектора, и вторую полинуклеотидную последовательность, кодирующую иммуностимулирующий полипептид, в котором антигенный полипептид и иммуностимулирующий полипептид присутствуют на поверхности вакцинного вектора, причем антигенным полипептидом является полипептид вируса гриппа, а иммуностимулирующим полипептидом является полипептид HMGB1. 20. Вакцинный вектор по п.19, в котором первый полинуклеотид и второй полинуклеотид встроены в третью полинуклеотидную последовательность, кодирующую поверхностную часть трансмембранного белка. 21. Вакцинный вектор по п.20, в случае которого трансмембранным белком является cotB. 22. Вакцинный вектор по любому из пп.19-21, в котором антигенным полипептидом является полипептид М 2 е вируса гриппа, полипептид НА вируса гриппа или полипептид NP вируса гриппа. 23. Вакцинный вектор по п.22, в котором антигенный полипептид выбирают из группы, состоящей из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7,SEQ ID NO:8, SEQ ID NO:9 и SEQ ID NO:10. 24. Вакцинный вектор по любому из пп.19-23, в котором полипептид HMGB1 выбирают из SEQ IDNO:18, SEQ ID NO:29, SEQ ID NO:30. 25. Способ усиления иммунного ответа у субъекта, включающий введение субъекту вакцинного вектора Bacillus spp. по любому из пп.19-24 в количестве, эффективном для усиления иммунного ответа у субъекта против антигенного полипептида. 26. Способ по п.25, в котором вакцинный вектор вводят орально или интраназально. 27. Способ по п.26, в котором иммунным ответом является продукция антител класса IgA против антигенного полипептида. 28. Способ по любому из пп.25-27, в котором вакцинный вектор не способен к репликации в организме субъекта или является инактивированным или убитым перед введением субъекту. 29. Способы снижения связанной с вирусом гриппа А заболеваемости у субъекта, включающий введение субъекту вакцинного вектора по любому из пп.2-11 или 19-24 или композиции по любому из пп.12-14 в количестве, эффективном для снижения связанной с вирусом гриппа А заболеваемости у субъекта.
МПК / Метки
МПК: A61K 39/145
Метки: вакцинные, векторы, ответов, иммунных, способы, усиления
Код ссылки
<a href="https://eas.patents.su/25-23058-vakcinnye-vektory-i-sposoby-usileniya-immunnyh-otvetov.html" rel="bookmark" title="База патентов Евразийского Союза">Вакцинные векторы и способы усиления иммунных ответов</a>
Предыдущий патент: Способ получения прасугреля, промежуточное соединение в кристаллической форме и способ его получения
Следующий патент: Способ конъюгирования бактериальных полисахаридов с белками-носителями
Случайный патент: Состав для цементирования ствола скважины и способ его приготовления и использования












