Производные хиназолина и их использование при лечении тромбоцитемии
Формула / Реферат
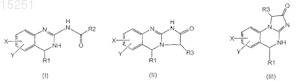
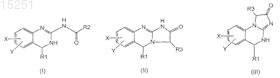
1. Соединение формул
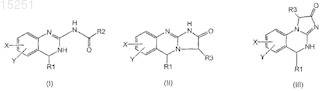
равновесная форма указанного соединения, фармацевтически приемлемая соль указанного соединения или фармацевтически приемлемая соль равновесной формы указанного соединения,
где R1 представляет собой H, C1-6алкил, C2-6алкенил, C2-6алкинил, C1-6алкокси или C6-10арил;
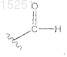
R2 представляет собой
R3 представляет собой OH, галоген, SH, O-C1-6алкил или NH2;
X и Y независимо друг от друга представляют собой H или галоген;
причем указанное соединение не является
и имеет чистоту по меньшей мере 80%.
2. Соединение по п.1, отличающееся тем, что указанное соединение имеет степень чистоты по меньшей мере 85%, более предпочтительно по меньшей мере 90%, еще более предпочтительно по меньшей мере 95% и наиболее предпочтительно 99%.
3. Соединение по п.1 или 2, отличающееся тем, что соединение имеет формулу
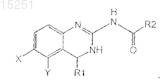
4. Соединение по п.3, отличающееся тем, что R2 представляет собой
5. Соединение по п.3, отличающееся тем, что R1 представляет собой H или C1-6алкил.
6. Соединение по п.3, отличающееся тем, что R1 представляет собой H.
7. Соединение по п.3, отличающееся тем, что X представляет собой H или галоген.
8. Соединение по п.3, отличающееся тем, что Y представляет собой H или Cl.
9. Соединение по п.3, отличающееся тем, что X представляет собой Cl.
10. Соединение по п.3, отличающееся тем, что Y представляет собой Cl.
11. Соединение по п.1 или 2, отличающееся тем, что соединение представляет собой

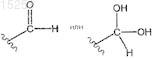
12. Способ лечения тромбоцитемии, включающий введение пациенту, нуждающемуся в соответствующем лечении, терапевтически эффективного количества соединения формул
равновесной формы указанного соединения, фармацевтически приемлемой соли указанного соединения или фармацевтически приемлемой соли равновесной формы указанного соединения,
где R1 представляет собой H, C1-6алкил, C2-6алкенил, C2-6алкинил, C1-6алкокси или C6-10арил;
R2 представляет собой
R3 представляет собой OH, галоген, SH, O-C1-6алкил или NH2;
X и Y независимо друг от друга представляют собой H или галоген.
13. Способ по п.12, отличающийся тем, что тромбоцитемия связана с первичной тромбоцитемией, хронической миелобластной лейкемией, истинной полицитемией, идиопатической миелоидной метаплазией или серповидно-клеточной анемией.
14. Способ лечения тромбоцитемии, включающий введение пациенту, нуждающемуся в соответствующем лечении, терапевтически эффективного количества соединения, определенного в п.10, или соединения
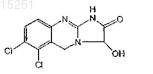
15. Способ по п.14, отличающийся тем, что тромбоцитемия связана с первичной тромбоцитемией, хронической миелобластной лейкемией, истинной полицитемией, идиопатической миелоидной метаплазией или серповидно-клеточной анемией.
16. Состав, содержащий по меньшей мере одно соединение формул
равновесную форму указанного соединения, фармацевтически приемлемую соль указанного соединения или фармацевтически приемлемую соль равновесной формы указанного соединения,
где R1 представляет собой H, C1-6алкил, C2-6алкенил, C2-6алкинил, C1-6алкокси или C6-10арил;
R2 представляет собой
R3 представляет собой OH, галоген, SH, O-C1-6алкил или NH2;
X и Y независимо друг от друга представляют собой H или галоген,
и по меньшей мере один терапевтический агент, выбранный из анагрелида, гидроксимочевины, P32, бусульфана, аспирина, клопидогреля, a-интерферона тиклопидина и дипиридамола.
Текст
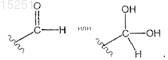
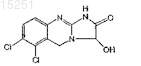
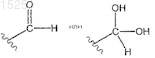
ПРОИЗВОДНЫЕ ХИНАЗОЛИНА И ИХ ИСПОЛЬЗОВАНИЕ ПРИ ЛЕЧЕНИИ ТРОМБОЦИТЕМИИ(71)(73) Заявитель и патентовладелец: ШИР ХОЛДИНГЗ ЭйДжи (CH) Предложен способ лечения тромбоцитемии у пациентов, включающий введение терапевтически эффективного количества соединений, имеющих формулу (I)-(III), или их равновесных форм 015251 Перекрестная ссылка на родственную заявку Заявка на данный патент испрашивает приоритет на основании 35 Свода законов США 119(е) согласно предварительной патентной заявке 60/598437 от 4 августа 2004 г. Содержание этой предварительной патентной заявки полностью включено в данное описание по ссылке. Область изобретения Настоящее изобретение относится к соединениям, которые используют для лечения тромбоцитемии. Данное изобретение относится также к соединениям, которые используют для снижения количества тромбоцитов. Предпосылки создания изобретения Тромбоцитемия является хроническим заболеванием, которое связано с увеличенной или аномальной выработкой тромбоцитов в крови. Поскольку тромбоциты принимают участие в свертывании крови,их патологическая выработка может привести к неадекватным образованиям сгустков крови или кровотечениям, что увеличивает риск последующего желудочно-кишечного кровотечения, сердечного приступа и инсульта у пациентов. Анагрелид представляет собой производное хиназолина, являющегося ингибитором фосфодиэстеразы, который используют для лечения первичной тромбоцитемии и различных других миелопролиферативных заболеваний. Анагрелид был одобрен и запущен в производство в США и Канаде в 1997 г. для лечения первичной тромбоцитемии. В декабре 1998 г. Управление по контролю за продуктами и лекарствами США (Food and Drug Administration, FDA) одобрило и расширило применение анагрелида, в частности для лечения пациентов с тромбоцитемией, вторичной по отношению к миелопролиферативным заболеваниям, включая истинную полицитемию (polycythemia vera, PV) и хроническую миелобластную лейкемию (chronic myelogenous leukemia, CML). Соединение, рассматриваемое в настоящем изобретении, представляет собой 3-гидроксианагрелид. Данное соединение является метаболитом анагрелида (см., например, патентную заявку США 10/762566, опубликованную как US20040209907). Различные метаболиты анагрелида были описаны в литературе: Erusalimsky et al. (2002). Is theplatelet lowering activity of anagrelide mediated by its major metabolite 2-amino-5,6-dichloro-3,4dihydroquinazoline (RL603) Exp. Hematol. 30:625-7; Lane et al. (2001). Anagrelide metabolite induces thrombocytopenia in mice by inhibiting megakaryocyte maturation without inducing platelet aggregation. Exp. Hematol. 29:1417-241; Gaver et al. (1981). Disposition of anagrelide, an inhibitor of platelet aggregation. Clin. Pharmacol. Ther. 29:381-6. Одной из задач настоящего изобретения является обеспечение соединений, относящихся к анагрелиду, которые можно использовать для лечения тромбоцитемии. Краткое описание изобретения В одном из вариантов реализации настоящее изобретение обеспечивает соединение, которое представляет собой его равновесную форму, его фармацевтически приемлемую соль или фармацевтически приемлемую соль его равновесной формы,где R1 представляет собой H, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C1-6 алкокси или C6-10 арил;R3 представляет собой OH, галоген, SH, O-C1-6 алкил или гидроксилоподобную группу;X и Y независимо друг от друга представляют собой H или галоген.-1 015251 Предпочтительные среди вышеуказанных соединений включают заместители X и Y в позициях 5 и 6 бензольного кольца. Соединения формул (I)-(III) используют в лечении тромбоцитемии и для снижения количества тромбоцитов. Соединения формул (I)-(III) можно использовать в комбинации по меньшей мере с одним другим терапевтическим агентом. Настоящее изобретение обеспечивает также фармацевтический состав, включающий соединение любой из формул (I)-(III) с фармацевтически приемлемым носителем или наполнителем. Еще в одном из вариантов реализации обеспечено использование соединений формулы (I)-(III) при производстве препарата для лечения тромбоцитемии. Краткое описание фигур На фиг. 1 представлен график доза-ответ, сравнивающий воздействие анагрелида и соединения 1 на индуцированное тиероидной пероксидазой мегакариоцитарное (megakaryocytic, MK) созревание, более полно описанное ниже в примере 3. На фиг. 2 представлен график, сравнивающий избирательное ингибирование мегакариоцитопоэза анагрелидом и соединением 1, более полно описанное ниже в примере 3. Подробное описание изобретения Если не указано другое, все технические и научные термины, используемые в настоящем изобретении, имеют те же значения, которые обычно понятны специалистам в данной области, к которой относится настоящее изобретение. Все публикации, патентные заявки, патенты и другие ссылки, упоминаемые в настоящем изобретении, полностью включены в настоящее изобретение в качестве ссылок. В случае противоречия, настоящее подробное описание, включая определения, является определяющим. Кроме того, материалы, способы и примеры являются только иллюстративными и не ограничивают объем изобретения. В одном из вариантов реализации настоящего изобретения соединения согласно данному патенту включают те, которые представлены в следующих вариантах как независимо друг от друга, так и в комбинации. В одном из вариантов настоящее изобретение обеспечивает соединение формул его равновесную форму, его фармацевтически приемлемую соль или фармацевтически приемлемую соль его равновесной формы, гдеR3 представляет собой OH, галоген, SH, O-C1-6 алкил или гидроксилоподобную группу;X и Y независимо друг от друга представляют собой H или галоген. Предпочтительные варианты включают заместители X и Y в позициях 5 и 6 бензольного кольца. Согласно одному из вариантов реализации R1 представляет собой H или C1-6 алкил. Согласно другому варианту R1 представляет собой H или CH3. В другом варианте R1 представляет собой H. В одном из вариантов реализации R3 представляет собой OH или O-C1-6 алкил. В другом варианте реализации R3 представляет собой OH или OCH3. Согласно другому варианту R3 представляет собойOH. Согласно одному из вариантов реализации настоящего изобретения X представляет собой H или галоген. Согласно другому варианту X представляет собой H. В другом варианте X представляет собой Cl.-2 015251 В другом варианте Y представляет собой H или Cl. В другом варианте Y представляет собой H. Согласно другому варианту реализации Y представляет собой Cl. Согласно одному из вариантов реализации подвергаемая лечению тромбоцитемия связана с миелопролиферативными заболеваниями крови. Согласно другому варианту реализации тромбоцитемия связана с первичной тромбоцитемией(essential thrombocythemia, ET), хронической миелобластной лейкемией (chronic myelogenous leukemia,CML), истинной полицитемией (polycythemia vera, PV), идиопатической миелоидной метаплазией (agnogenic myeloid metaplasia, AMM) или с серповидно-клеточной анемией (sickle cell anemia, SCA). Согласно еще одному варианту реализации тромбоцитемия была вызвана ЕТ, CML, PV, AMM илиSCA. Еще в одном варианте соединения формул (I)-(III) можно использовать для снижения количества тромбоцитов у пациента. Соединения в соответствии с настоящим изобретением включают соединение 5,которое представляет собой 6,7-дихлоро-1-гидрокси-3,5-дигидроимидазо[1,2-a]хиназолин-2-он. В соответствии с настоящим изобретением соединения представлены в основном в чистой форме. Используемый в настоящем изобретении термин "по существу, чистая форма" означает, что соединения имеют чистоту по меньшей мере 80%, предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90%, еще более предпочтительно по меньшей мере 95% и наиболее предпочтительно по меньшей мере 99%, что определяют с помощью стандартных аналитических способов.-3 015251 Не желая быть связанными какой-либо теорией (поскольку понимание механизма не является необходимым для практического применения, настоящее изобретение не ограничено каким-либо особым механизмом), изобретатели полагают, что соединения настоящего изобретения представляют собой равновесные формы. Равновесные формы соединений согласно настоящему изобретению определяют следующим образом: Используемый в настоящем изобретении термин "равновесная форма" включает таутомеры соединений формул (I)-(III). Равновесные формы соединений данного изобретения могут быть представлены следующим образом: Каждая из данных равновесных форм включена в область охвата настоящего изобретения. Специалистам в данной области должно быть понятно, что соединения формул (I)-(III) могут существовать в виде таутомеров или оптических изомеров. Все равновесные изомеры и таутомеры таких соединений включены в объем настоящего изобретения. Единичный оптический изомер или энантиомер может быть получен способами, хорошо известными специалистам в данной области, в частности с помощью хиральной высокоэффективной жидкостной хроматографии (ВЭЖХ), ферментативного анализа и хирального вспомогательного реагента, или могут быть синтезированы стереоселективно. Используемый в настоящем изобретении термин "гидроксиподобный" описывает химические функциональные группы, относящиеся к гидроксильной (-OH) группе. Данные группы представляют собой функциональные группы, которые могут выступать в качестве донора или акцептора в водородной связи. Неограничивающие примеры гидроксиподобных групп включают -NH2 и -SH. Обеспечены также фармацевтически приемлемые соли соединений настоящего изобретения. С помощью термина "фармацевтически приемлемые соли" соединений общей формулы (I)-(III) обозначают соли, полученные из фармацевтически приемлемых неорганических и органических кислот и оснований. Примеры подходящих кислот включают соляную, бромисто-водородную, серную, азотную, перхлорную,фумаровую, малеиновую, фосфорную, гликолевую, молочную, салициловую, янтарную, толуол-псульфоновую, винную, уксусную, лимонную, метансульфоновую, муравьиную, бензойную, малоновую,нафталин-2-сульфоновую и бензолсульфоновую кислоты. Другие кислоты, в частности щавелевая, сами по себе не являющиеся фармацевтически приемлемыми, могут быть использованы в качестве интермедиатов при получении соединений согласно данному изобретению и их фармацевтически приемлемых солей кислотного присоединения. Соли, полученные из соответствующих оснований, включают соли щелочных металлов (например,-4 015251 натрия), щелочно-земельных металлов (например, магния), аммония и NR4+ (где R представляет собойC1-4 алкил). Используемый в данном изобретении термин "алкил" представляет незамещенный или замещенный(галогеном, нитро, CONH2, COOH, O-C1-6 алкилом, О-C2-6 алкенилом, O-C2-6 алкинилом, гидроксилом,амино или COOQ, где Q представляет собой C1-6 алкил, C2-6 алкенил; C2-6 алкинил) неразветвленный, разветвленный или циклический углеводород (например, изопропил, этил, фторгексил или циклопропил). В термин "алкил" также включены алкилы, у которых один или более атомов водорода замещены галогеном, более предпочтительно галоген представляет собой фторо (например, -CF3 или -CH2CF3). Используемые в данном изобретении термины "алкенил" и "алкинил" представляют алкил (как определено выше), содержащий по меньшей мере одну ненасыщенную группу (например, аллил). В случае если присутствует атом серы, этот атом серы может находиться в разных степенях окисления: S, SO или SO2. Все степени окисления включены в объем настоящего изобретения. Галоген, согласно данному изобретению, означает фторо-, хлоро-, бромо- и иодо-. Глагол "лечить" или термин "лечение" состояния, расстройства или заболевания включает:(1) предупреждение или замедление проявления клинических симптомов состояния, расстройства или заболевания, развивающихся у млекопитающего, которое может быть болью или предрасположено к состоянию, расстройству или заболеванию, но еще не испытывает или не проявляет клинических или слабовыраженных симптомов состояния, расстройства или заболевания,(2) ингибирование состояния, расстройства или заболевания, т.е. приостановку, замедление или затягивание развития заболевания или его рецидива (в случае поддерживающего лечения) или по меньшей мере одного из его клинических или слабовыраженных симптомов, или(3) ослабление заболевания, т.е. регрессию состояния, расстройства или заболевания или по меньшей мере одного из его клинических или слабовыраженных симптомов. Термин "терапевтически эффективное количество" обозначает количество соединения, которое при введении пациенту для лечения состояния, расстройства или заболевания, является достаточным для осуществления такого лечения. "Терапевтически эффективное количество" варьирует в зависимости от соединения, заболевания и его серьезности, и от возраста, веса, физического состояния и восприимчивости пациента, проходящего лечение. Пациент, который нуждается в соответствующем лечении, является индивидуумом, например человеком или другим млекопитающим, которому помогает введение соединений согласно настоящему изобретению. Польза для пациента, проходящего лечение, является или статистически значимой, или, по меньшей мере, ощутимой для пациента или для врача. Следует понимать, что количество соединения согласно данному изобретению, требуемое для применения при лечении, меняется не только в связи с выбором определенного соединения, но также в связи со способом введения, природой заболевания, для которого требуется лечение, и с возрастом и состоянием пациента и, в конечном итоге, определяется лечащим врачом или ветеринаром. Однако в целом подходящая доза находится в диапазоне примерно от 0,001 до примерно 50 мг/кг веса тела в сутки, предпочтительно примерно от 0,001 до примерно 5 мг/кг веса тела в сутки, более предпочтительно примерно от 0,001 до примерно желательно 0,5 мг/кг веса тела в сутки или наиболее желательно примерно от 0,001 до примерно 0,1 мг/кг веса тела в сутки. В других вариантах реализации диапазон может быть примерно от 0,1 до примерно 750 мг/кг веса тела в день, в диапазоне от 0,5 до 60 мг/кг/сутки и в пределах от 1 до 20 мг/кг/сутки. Желаемая доза может представлять удобную единичную дозировку или разделенные дозы, принимаемые через соответствующие интервалы, например две, три, четыре или более дозировок в сутки. Если соединения вводят трансдермально или в виде формы с пролонгированным действием, соединения можно принимать раз в сутки или реже. Соединение удобно принимать в виде стандартной лекарственной дозы, например, содержащей от 0,1 до 50 мг, удобно от 0,1 до 5 мг или наиболее удобно от 0,1 до 5 мг активного ингредиента на стандартную лекарственную дозу. Согласно еще одному варианту реализации соединение удобно вводить в форме стандартной лекарственной дозы, содержащей, например, 10 до 1500 мг, предпочтительно 20 до 1000 мг или более предпочтительно 50 до 700 мг активного ингредиента на стандартную лекарственную дозу. В идеальном варианте активный ингредиент нужно вводить таким образом, чтобы достичь максимальной концентрации активного соединения в плазме примерно от 0,01 до примерно 5 мкмоль, примерно от 0,01 до примерно 1 мкмоль, примерно от 1 до примерно 75 мкмоль, примерно от 2 до 50 мкмоль или примерно от 3 до примерно 30 мкмоль. Этого можно достичь, например, с помощью внутривенных инъекций 0,1-5% раствора активного ингредиента, возможно в солевом растворе, или пероральном введении в виде пилюль, содержащих примерно от 0,1 до примерно 5 мг или примерно от 1 до примерно 500 мг активного ингредиента. Желаемый уровень в крови можно поддерживать с помощью постоянного вливания с обеспечением примерно от 0,0001 примерно до 1,0 мг/кг/ч или примерно от 0,0001 примерно до 0,5 мг/кг/ч или путем периодических вливаний, содержащих примерно от 0,001 примерно до 0,1 мг/кг-5 015251 активного ингредиента. Согласно еще одному варианту реализации настоящего изобретения желаемый уровень в крови можно поддерживать с помощью непрерывного вливания с обеспечением примерно от 0,01 примерно до 5,0 мг/кг/ч или путем периодических вливаний, содержащих примерно от 0,4 до примерно 15 мг/кг активного ингредиента. Хотя в терапии возможно использование соединения настоящего изобретения в виде неочищенного химического препарата, предпочтительно вводить активный ингредиент в виде фармацевтического состава. Соответственно согласно данному изобретению предложен фармацевтический состав, содержащий соединение формул (I)-(III) или их равновесные формы вместе с одним или более фармацевтически приемлемым носителем и, возможно, другими терапевтическими и/или профилактическими ингредиентами. Носитель(и) должен быть "приемлемым", что означает совместимость с другими ингредиентами состава и отсутствие вреда для реципиента. Фармацевтические составы включают такие составы, которые подходят для перорального, ректального, назального, местного (включая буккальное и подъязычное), трансдермального, вагинального или парентерального (включая внутримышечное, подкожное и внутривенное) введения, или составы в форме, подходящей для введения с помощью ингаляций или инсуффляций. Где это допустимо, составы могут быть легко представлены отдельными стандартными дозами и могут быть изготовлены любым из способов, хорошо известных в фармации. Все способы включают стадию объединения активного соединения с жидкими носителями или мелкодиспергированными твердыми носителями, или как с теми, так и с другими, а затем, если требуется, формование продукта желаемого состава. Фармацевтические составы, подходящие для перорального введения, могут быть для удобства представлены в виде отдельных стандартных доз, в частности капсул, пакетиков-саше или таблеток (каждая включает заранее установленную дозу активного ингредиента); порошка или гранул; или в виде раствора, суспензии или эмульсии. Активный ингредиент также может быть представлен в виде пилюль,электуария или пасты. Таблетки и капсулы для перорального введения могут содержать традиционные наполнители, в частности, связующие агенты, наполнители, скользящие вещества, разрыхлители или смачивающие вещества. Таблетки могут быть с покрытием, с использованием способов, хорошо известных в этой области. Пероральные жидкие препараты могут быть в форме, например, жидких или масляных суспензий, растворов, эмульсий, сиропов или эликсиров или могут представлять собой сухой продукт для соединения с водой или другим подходящим носителем перед применением. Такие жидкие препараты могут включать традиционные добавки, в частности суспендирующие вещества, эмульгаторы,неводные носители (которые могут включать пищевые масла) или консерванты. Соединения согласно настоящему изобретению могут также входить в составы для парентерального введения (например, с помощью инъекций, например, болюсной инъекции или непрерывного вливания) и могут быть представлены в форме стандартной лекарственной дозы в ампулах, заранее заполненных шприцев, вливаний с малым объемом или в упаковках лекарственных средств для многократного приема с дополнительным консервантом. Составы могут быть в таких формах, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать агенты состава, в частности, суспендирующие, стабилизирующие и/или диспергирующие вещества. В качестве альтернативы, активный ингредиент может быть в форме порошка, полученного путем асептического выделения стерильного твердого вещества или с помощью лиофилизации из раствора, для смешения с подходящим носителем, например стерильной, свободной от пирогена водой, перед применением. Для местного введения в кожу соединения данного изобретения могут входить в составы мазей,кремов, или примочек, или трансдермальных пластырей. Такие трансдермальные пластыри могут включать способствующие всасыванию вещества, в частности линалоол, карвакрол, тимол, цитраль, ментол или транс-анетол. Мази и кремы могут быть, например, на водной или масляной основе с добавлением подходящих загустителей и/или гелеобразующих агентов. Примочки могут быть на водной или масляной основе и в общем также содержать один или более эмульгаторов, стабилизирующих агентов, диспергирующих веществ, суспендирующих агентов, загустителей или красителей. Составы, подходящие для местного введения через рот, включают пастилки, содержащие активный ингредиент во вкусовой основе, обычно сахарозе и гуммиарабике или трагакантовой камеди; пастилки,содержащие активный ингредиент в инертной основе, в частности желатине и глицерине или сахарозе и гуммиарабике; и жидкости для полоскания рта, содержащие активный ингредиент в подходящем жидком носителе. Фармацевтические составы, подходящие для ректального введения, где носитель представляет собой твердое вещество, наиболее предпочтительно представляют собой свечи со стандартной лекарственной дозой. Подходящие носители включают масло какао и другие материалы, обычно используемые в данной области, и суппозитории можно легко изготовить путем смешивания активного соединения с размягченным или расплавленным носителем(ями), с последующим охлаждением и приданием формы. Составы, подходящие для вагинального введения, могут быть представлены в виде вагинальных суппозиториев, тампонов, кремов, гелей, паст, пен или аэрозолей, содержащих в дополнение к активному ингредиенту такие носители, которые известны в данной области как подходящие. Для интраназального введения соединения согласно настоящему изобретению можно использовать-6 015251 в виде жидких аэрозолей, или дисперсного порошка, или в форме капель. Капли могут быть на водной и масляной основе, включающей также один или более дисперсионных агентов, растворяющих агентов или суспендирующих агентов. Жидкие аэрозоли можно легко ввести из упаковок под давлением. Для введения соединения с помощью ингаляции согласно настоящему изобретению можно легко ввести из инсуффлятора, распылителя или упаковки под давлением или других удобных средств для введения аэрозольных спреев. Упаковки под давлением могут включать подходящий пропеллент, в частности дихлородифторометан, трихлорофторометан, дихлоротетрафтороэтан, двуокись углерода или другой подходящий газ. В случае аэрозоля под давлением стандартную лекарственную дозу можно определить с помощью клапана для введения дозированного количества. В качестве альтернативы, для введения путем вдыхания или вдувания соединения согласно данному изобретению можно вводить в форме состава из сухих порошков, например смеси порошка соединения и подходящего порошка основания, в частности лактозы или крахмала. Порошковый состав может быть представлен в виде стандартной лекарственной дозы, например капсул или ампул или, например,желатиновых или блистерных упаковок, из которых порошок можно вводить с помощью ингалятора или инсуффлятора. В случае если это желательно, вышеописанные лекарственные формы могут быть адаптированы для замедленного высвобождения активного ингредиента. Еще в одном варианте реализации обеспечен состав для лечения тромбоцитемии, включающий по меньшей мере одно соединение формулы (I)-(III) и по меньшей мере один дополнительный терапевтический агент, выбранный из анагрелида, гидроксимочевины, P32, бусульфана, аспирина, клопидогреля, интерферона, тиклопидина и дипиридамола. Еще в одном варианте реализации обеспечен состав для лечения тромбоцитемии, включающий по меньшей мере одно соединение формул (I)-(III) и по меньшей мере один дополнительный терапевтический агент, выбранный из анагрелида, гидроксимочевины, бусульфана и -интерферона. Составы, относящиеся к указанным выше, могут быть легко представлены для применения в форме фармацевтических составов; и, таким образом, фармацевтические формы, включающие составы, указанные выше, вместе с фармацевтически приемлемым носителем, относятся к еще одному варианту реализации настоящего изобретения. Индивидуальные компоненты таких составов можно вводить как последовательно, так и одновременно, по отдельности или в виде комбинированных фармацевтических составов. В случае если соединение формул (I)-(III) или его равновесную форму применяют в комбинации со вторым терапевтическим агентом, доза каждого соединения может быть такой же, как в случае, если применяют одно соединение, или отличной от нее. Специалист в данной области легко определит подходящую дозу. Специалисты в данной области легко установят соотношение между соединениями согласно данному изобретению и вторым терапевтическим агентом. Например, можно применять примерно от 1:5000 до примерно 1:500, примерно от 1:500 до примерно 1:100, примерно от 1: 1 до примерно 1:50, примерно от 1:1 до примерно 1:30, примерно от 1:1 до примерно 1:20, примерно от 1:1 до примерно 1:15, примерно от 1:1 до примерно 1:10, примерно от 1:1 до примерно 1:5 или примерно от 1:1 до примерно 1:3 соединений согласно настоящему изобретению:второго терапевтического агента. Если добавляют еще один терапевтический агент, то соотношения устанавливаются соответственно. Предварительная патентная заявка США 60/598432 (от 4 августа 2004 г.) и соответствующая ей непредварительная патентная заявка, относящиеся к соединениям настоящего изобретения для лечения заболеваний периферических артерий и ингибирования фосфодиэстеразы III, полностью включены в описание настоящего изобретения по ссылке. Следующие примеры приведены для иллюстрации различных вариантов реализации настоящего изобретения и не ограничивают область охвата данного изобретения. Пример 1. Получение соединения 1 настоящего изобретения. Синтезировали соединение 1, N-(5,6-дихлоро-3,4-дигидрохиназолин-2-ил)-2-оксоацетамид (1),имеющее m/z 271. Соединение 1 может также существовать в виде гидрата (2). Данный метод получения требуемого альдегида (1) включал реакцию 2-амино-5,6-дихлоро-3,4 дигидрохиназолина (A) с гидратом глиоксалевой кислоты (B) с использованием сочетания с дициклогексилкарбодиимидом (DCC). Сочетание (A) и глиоксалевой кислоты (B) проводили с использованием дициклогексилкарбодиимида (DCC), диметиламинопиридина (DMAP) в дихлорметане (DCM). Продукт (A) можно получить с помощью способов, известных в данной области, (см., например, патент США 6194420, от 27 февраля 2001 г.). Небольшое количество диметилформамида (DMF) добавили, чтобы способствовать растворимости продукта (A). Когда эти реагенты смешали в растворе дихлорметана, образовался осадок. Этот осадок отфильтровали и растворитель испарили. Неочищенную смесь проанализировали с помощью жидкостной хроматографии-масс-спектрометрии, показавшей наличие 90% исходного реагента и 7% вещества с массой 271. Данную реакцию проводили в расчете на 150 мг вещества. Образовавшийся в этой реакции осадок(170 мг) собрали и анализировали вместе с содержимым фильтрата. По данным анализа с помощью жидкостной хроматографии-масс-спектрометрии осадок состоял из двух основных компонентов: продукта(A) (25% по площади пика) и вещества с массой 271 (66% по площади пика); однако анализ с помощью ЯМР спектроскопии того же материала показал, что на самом деле основным компонентом являлась дициклогексилмочевина (DCU), образовавшаяся в результате реакции сочетания дициклогексилкарбодиимида (DCC). Предпринятые попытки по очистке этого вещества с помощью жидкостной хроматографии высокого разрешения (ВЭЖХ) привели к удалению DCU (как было установлено с помощью ЯМР), но привели к образованию смеси продукта (A) (18% по площади пика) и вещества с массой 271 (73% по площади пика). Тем не менее, в ЯМР спектре наблюдали только один ароматический пик продукта. Успешной очистки соединения 1 достигли с использованием обращенно-фазной хроматографии. Градиентное элюирование, начиная с воды до метанола, дало три четкие фракции: во-первых, (A), вовторых, вещество с массой 271, и, наконец, DCU (как определено с помощью методов ЯМР и ВЭЖХ). Как показано выше, соединение 1 представляет собой равновесную форму соединения 3 и соединения 4. Следовательно, как установлено выше, в условиях данных примеров, полагают, что соединения превращаются друг в друга и что соединение 3 и соединение 4 (оба известны как 3-гидроксианагрелид) также присутствуют. Пример 2. Альтернативный синтез соединения 1. Стадия 1. Схема 1 Исходное вещество (RL603)RL603 можно ацилировать с выходом от умеренного до хорошего при использовании 2,2 экв. гидрида натрия (NaH) и 1,1 экв. этил-2,3-изопропилиденглицерата с получением продукта B (схема 1). Анион RL603 получали путем нагревания с NaH в тетрагидрофуране (THF) при 50C в течение 30 мин в инертной атмосфере. Затем смесь охладили до комнатной температуры, добавили эфир и реакционную смесь перемешивали в течение 3 дней. Быстрая очистка и использование продуктов являются предпочтительными для того, чтобы избежать образования флуоресцентных окисленных примесей. Очистку проводили с помощью обычной водной экстракции и хроматографии на силикагеле (элюирование 40-50% этилацетата/60-50% бензина). Приготовили этил-2,3-изопропилиденглицерат. 1,2;5,6-Диизопропилиденманнитол обработали или периодатом натрия, или периодатом тетрабутиламмония с последующим добавлением перманганата калия, получив неочищенный изопропилиденглицерат калия, который можно очистить перекристаллизацией из этанола. Очищенный продукт обработали предпочтительно иодоэтаном или диэтилсульфатом (использование последнего затрудняет выделение продукта) в DMF, получив этиловый эфир (схема 2). Эфир затем, если необходимо, перегоняют. Стадия 2. Схема 3 Гидролиз соединения B до соединения C Обработка производного B ацеталь-ацилированного RL603 с помощью 0,1 М HCl в смеси 50:50 вода:THP в течение ночи привела к образованию смеси примерно равных количеств RL603 и желаемого диола (C) (схема 3). Использование 5:3 смеси вода:трифторуксусная кислота в течение 1 ч приводит к селективному получению чистого желаемого диола (C), не требующего никакой очистки, за исключением удаления растворителей. Стадия 3. Превращение соединения (C) в соединение 1 и ВЭЖХ. Превращение диола (C) в соединение 1 провели, используя периодат натрия в водном метаноле или ацетоне. Диол был плохо растворим. Наблюдали обратную реакцию гидролиза до RL603 и образование соединения, оказавшегося изомером соединения 1 (по-видимому, изосоединение 1 образуется при альтернативном способе замыкания кольца промежуточного альдегида, образованного при разложении периодатом диола (C. Изомеризация соединения 1 и изосоединения 1 (таутомер соединения 5) показана ниже изосоединение 1 Пример 3. Оценка соединения 1 в культурах дифференцированных мегакариоцитов, полученных из CD34+ клеток крови из пуповины. Материалы и способы Реагенты. Соединение 1 хранили при комнатной температуре. Основные растворы (10 ммоль) готовили в диметилсульфоксиде (DMSO) или фосфатном буферном растворе (PBS) pH 5.0, как указано. Исходные растворы разбавляли в культуральной среде сразу перед добавлением к клеточной суспензии. Клеточная культура и анализ мегакариоцитарной дифференцировки. Клеточная культура и режим приема лекарств. Клетки CD34+ Cord крови были приобретены уBiowhittacker (США) или выделены заново путем количественного иммунного отбора с использованием стандартных лабораторных методик. Клетки были высеяны в 24-луночных планшетах для культур тканей с плотностью 0,15106 клеток/мл и культивированы в течение 12-14 дней в Iscove's модифицированной среде Dulbecco, содержащей 40 нг/мл тиреоидной пероксидазы (как описано у Mathur A., Hong Y.,Martin J.F., Erusalimsky J.D. (2001). Megakaryocytic differentiation is accompanied by a reduction in cell migratory potential. Br. J. Haematol, 112:459) с помощью анагрелида, соединения 1 или носителя (DMSO).-9 015251 Подсчет клеток. Плотность клеток определяли, используя анализатор частиц Sysmex CDA-500. Анализ мегакариоцитарной дифференциации. Экспрессию CD61 (маркера мегакариоцитарной дифференциации) определяли с помощью метода проточной цитометрии с использованием антитела анти-GPilla. Диаметр клеток определяли, используя анализатор частиц Sysmex CDA-500. Результаты. Оценка соединения 1 для индуцированного тиреоидной пероксидазой мегакариоцитарного созревания кроветворных предшественников CD34. Влияние анагрелида и соединения 1 на мегакариоцитарное созревание клеток CD34+, выращенных с помощью тромбопоэтина (thrombopoietin, TPO) в питательной среде, содержащей плазму, оценивали путем регистрации процента GPIIIa позитивных клеток в культуре. Анагрелид и соединение 1 вызывали значительное замедление этого процесса при таких низких концентрациях, как 30 нмоль (28% и 20% замедление, P=0,004 и 0,005 для анагрелида и соединения 1 по отношению к контрольному соответственно). Тщательное сравнение активности анагрелида и соединения 1 в отношении созревания мегакариоцитов (фиг. 1) не выявили существенного различия между двумя соединениями, когда эффект дозы был значительным (P=0,38 по ANOVA для соединения 1 в сравнении с анагрелидом). На самом деле, два соединения оказались равносильны, обладая IC50 110-130 нмоль и максимальным эффектом при 1 мкмоль. На фиг. 1 параллельно показаны результаты, полученные от необработанного образца. Величины представляют среднее значениестандартная ошибка (SE) от 2-4 независимых экспериментов, как указано. Каждый эксперимент проводили с клетками, полученными от разных доноров. Общее воздействие соединения 2 на мегакариоцитопоэз in vitro. Таблица показывает, что анагрелид и соединение 1 обладали существенным и схожим замедляющим воздействием на некоторые параметры мегакариоцитарной дифференцировки, включая конечную плотность клеток, пропорцию GPIIIa позитивных клеток, относительный уровень экспрессии этого антигена и размер клеток (последний является функцией как цитоплазматического созревания, так и содержания ДНК). Чтобы оценить, являлась ли замедляющая активность анагрелида и соединения 1 в этих культурах селективной по отношению к мегакариоцитарной линии дифференцировки, оценивали влияние этих соединений на рост не мегакариоцитарных клеток. Через 12 дней контрольные культуры этих клеток(CD61-) составляли 20-30% от всей популяции. Как указано на фиг. 2, резко контрастируя со снижением конечного числа клеток, показывающих мегакариоцитарные признаки, ни ангрелид, ни соединение 1 не угнетали рост не мегакариоцитарных клеток. Влияние анагрелида и соединения 1 на рост мегакариоцитов и параметры дифференцировкиCD34+ клетки культивировали в течение 12 дней в питательной среде, содержащей плазму, дополненную TPO в присутствии или в отсутствие указанных соединений (10 мкмоль), как описано в разделе"Материалы и способы". Результаты, представленные на фиг. 2, выражены относительно необработанных образцов. Величины представляют среднее значениеSE в указанном количестве независимых экспериментов, выполненных с клетками, полученными от разных доноровP0,05,P0,01 сравнительный контроль.NaH, THF, 50C, 30 мин, затем rt, 48 ч, водная обработка и колоночная хроматография, выход 50%. Стадия (iii). CF3CO2H, вода, rt, 1 ч, испарение, сублимация и растирание в порошок с эфиром, выход 100%. Стадия (iv). NaIO4, pH 5,1 буфер, ацетон, 10C, 20 мин, испарение, сублимация и колоночная хроматография, выход 31 %. Очистка. Хроматографическое выделение продукта (отделение от изомера соединения 5 (6,7-дихлоро-1 гидрокси-3,5-дигидроимидазо[1,2-a]хиназолин-2-он проводили на силикагеле с нормальной фазой в стеклянной колонке под давлением сжатого воздуха, с градиентным элюированием 0-10% метанол/10090% этилацетат. Фракции анализировали с помощью тонкослойной хроматографии, элюируя тетрагидрофураном, содержащим несколько капель концентрированного аммиака. Аналитические данные. ЯМР. 1 равновесная форма указанного соединения, фармацевтически приемлемая соль указанного соединения или фармацевтически приемлемая соль равновесной формы указанного соединения,где R1 представляет собой H, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C1-6 алкокси или C6-10 арил;X и Y независимо друг от друга представляют собой H или галоген; причем указанное соединение не является и имеет чистоту по меньшей мере 80%. 2. Соединение по п.1, отличающееся тем, что указанное соединение имеет степень чистоты по меньшей мере 85%, более предпочтительно по меньшей мере 90%, еще более предпочтительно по меньшей мере 95% и наиболее предпочтительно 99%. 3. Соединение по п.1 или 2, отличающееся тем, что соединение имеет формулу 5. Соединение по п.3, отличающееся тем, что R1 представляет собой H или C1-6 алкил. 6. Соединение по п.3, отличающееся тем, что R1 представляет собой H. 7. Соединение по п.3, отличающееся тем, что X представляет собой H или галоген. 8. Соединение по п.3, отличающееся тем, что Y представляет собой H или Cl. 9. Соединение по п.3, отличающееся тем, что X представляет собой Cl. 10. Соединение по п.3, отличающееся тем, что Y представляет собой Cl. 11. Соединение по п.1 или 2, отличающееся тем, что соединение представляет собой 12. Способ лечения тромбоцитемии, включающий введение пациенту, нуждающемуся в соответствующем лечении, терапевтически эффективного количества соединения формул равновесной формы указанного соединения, фармацевтически приемлемой соли указанного соединения или фармацевтически приемлемой соли равновесной формы указанного соединения,где R1 представляет собой H, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C1-6 алкокси или C6-10 арил;X и Y независимо друг от друга представляют собой H или галоген. 13. Способ по п.12, отличающийся тем, что тромбоцитемия связана с первичной тромбоцитемией,хронической миелобластной лейкемией, истинной полицитемией, идиопатической миелоидной метаплазией или серповидно-клеточной анемией. 14. Способ лечения тромбоцитемии, включающий введение пациенту, нуждающемуся в соответствующем лечении, терапевтически эффективного количества соединения, определенного в п.10, или соединения 15. Способ по п.14, отличающийся тем, что тромбоцитемия связана с первичной тромбоцитемией,хронической миелобластной лейкемией, истинной полицитемией, идиопатической миелоидной метаплазией или серповидно-клеточной анемией. 16. Состав, содержащий по меньшей мере одно соединение формул равновесную форму указанного соединения, фармацевтически приемлемую соль указанного соединения или фармацевтически приемлемую соль равновесной формы указанного соединения,где R1 представляет собой H, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C1-6 алкокси или C6-10 арил;X и Y независимо друг от друга представляют собой H или галоген,и по меньшей мере один терапевтический агент, выбранный из анагрелида, гидроксимочевины, P32, бусульфана, аспирина, клопидогреля, -интерферона тиклопидина и дипиридамола.
МПК / Метки
МПК: C07D 403/00, C07D 239/00, C07D 487/00, A61K 31/522, C07D 491/00, C07D 471/00, A61K 31/505
Метки: использование, лечении, хиназолина, тромбоцитемии, производные
Код ссылки
<a href="https://eas.patents.su/15-15251-proizvodnye-hinazolina-i-ih-ispolzovanie-pri-lechenii-trombocitemii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хиназолина и их использование при лечении тромбоцитемии</a>
Предыдущий патент: Таблетка силденафила, обеспечивающая модифицированную фармакокинетику, и способ ее изготовления
Следующий патент: Способ модуляции стресс-активированной протеинкиназной системы
Случайный патент: Способ экспрессии инсулина в семенах растения, способ получения семян растений, содержащих инсулин, и растения, способные производить семена, содержащие инсулин












