Галогензамещенные тетрациклические производные тетрагидрофурана
Номер патента: 3698
Опубликовано: 28.08.2003
Авторы: Хиль-Лопетеги Пилар, Фернандес-Гадеа Франсиско Хавьер, Андрес-Хиль Хосе Игнасио, Диас-Мартинес Адольфо
Формула / Реферат
1. Соединение формулы
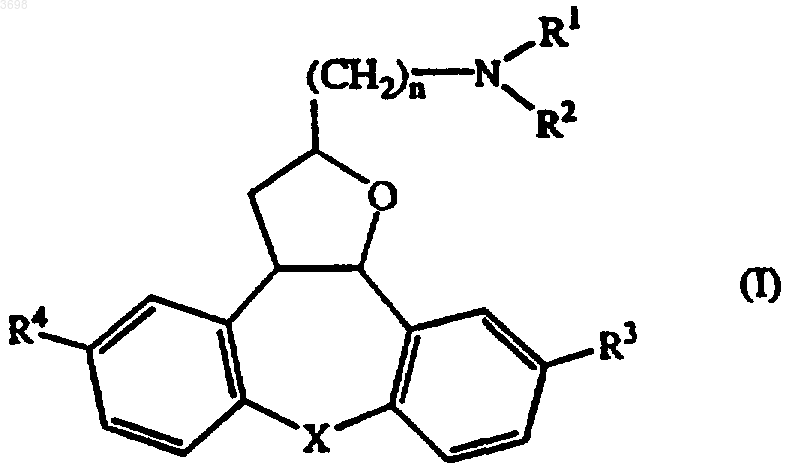
его N-оксидная форма, фармацевтически приемлемая соль присоединения или стереохимически изомерная форма,
где n представляет собой 0, 1, 2, 3, 4, 5 или 6;
X представляет собой CH2 или O;
R1 и R2, каждый независимо, представляют собой водород, C1-6алкил, C1-6алкилкарбонил, галогенметилкарбонил или C1-6алкил, замещенный гидрокси-, C1-6алкилоксигруппой, карбоксилом, C1-6алкилкарбонилоксигруппой, C1-6алкилоксикарбонилом или арилом;
или R1 и R2, взятые вместе с атомом азота, к которому они присоединены, могут образовывать морфолинильное кольцо или радикал формулы

где m представляет собой 0, 1, 2 или 3;
R13, R14, каждый независимо, представляют собой водород, C1-6алкил, арил или арилкарбонил;
R17 представляет собой водород, C1-6алкил, C1-6алкилкарбонил, галогенметилкарбонил, C1-6алкилоксикарбонил, арил, ди(арил)метил или C1-6алкил, замещенный гидрокси, C1-6алкилоксигруппой, карбоксилом, C1-6алкилкарбонилоксигруппой, C1-6алкилоксикарбонилом или арилом;
R3 и R4 оба являются галогеном; или
R3 является галогеном, а R4 является водородом; или
R3 является водородом, а R4 является галогеном и
арил представляет собой фенил или фенил, замещенный 1, 2 или 3 заместителями, выбранными из галогена, гидрокси, C1-6алкила и галогенметила.
2. Соединение по п.1, в котором X является CH2.
3. Соединение по п.1 или 2, в котором атомы водорода у атомов углерода 3a и 12b находятся на противоположных сторонах средней плоскости, определяемой тетрациклической кольцевой системой.
4. Соединение по любому из пп.1-3, в котором R3 является галогеном, а R4 является водородом.
5. Соединение по любому из пп.1-4, в котором n равен 1.
6. Соединение по любому из пп.1-5, в котором R1 и R2, каждый независимо, выбирают из водорода или C1-6алкила или когда взятые вместе с атомом азота, к которому они присоединены, образуют морфолинильное кольцо или радикал формулы (c) или (e).
7. Соединение по п.1, представляющее собой 11-фтор-3,3a,8,12b-тетрагидро-N,N-диметил-2H-дибензо-[3,4:6,7]циклогепта[1,2-b]фуран-2-метанамин, его стереохимически изомерную форму, или фармацевтически приемлемую соль присоединения, или его N-оксидную форму.
8. Композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-7.
9. Соединение по любому из пп.1-7 для применения в качестве лекарственного средства.
10. Применение соединения по любому из пп.1-7 для производства лекарственного средства при лечении тревоги, психоза, шизофрении, депрессии, мигрени, нарушений сна и привыкания к чрезмерному употреблению лекарственных средств.
11. Способ получения соединения по п.1, отличающийся тем, что
(a) промежуточное соединение формулы (II) N-алкилируют промежуточным соединением формулы (III)
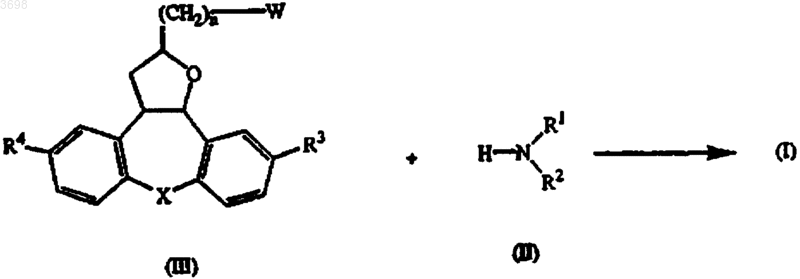
где в промежуточных соединениях (II) и (III) R1-R4, n и X определены как в п.1 и W представляет собой подходящую уходящую группу; в инертном по отношению к реакции растворителе и, необязательно, в присутствии подходящего основания;
b) превращают соединения формулы (I) друг в друга известными в данной области превращениями и дополнительно, если требуется, превращают соединения формулы (I) в терапевтически активную нетоксичную соль присоединения кислоты путем обработки кислотой, или в терапевтически активную нетоксичную соль присоединения основания путем обработки основанием, или наоборот, превращают соль присоединения кислоты в свободное основание путем обработки щелочью; или превращают соль присоединения основания в свободную кислоту путем обработки кислотой; и, если требуется, получают их стереохимически изомерные формы или их N-оксидные формы.
Текст
1 Данное изобретение относится к галогензамещенным тетрациклическим производным тетрагидрофурана,обладающим антипсихотической, сердечно-сосудистой и гастрокинетической активностью и к их получению; оно относится также к содержащим их композициям, а также к их применению в качестве лекарственного средства. В международной заявке WO 97/38991,опубликованной 23 октября 1997, раскрыты тетрациклические производные тетрагидрофурана. Как в WO 96/14320, так и в WO 96/14321 раскрыты тетрациклические производные, содержащие изоксазолидин, все из которых обладают антипсихотической, сердечно-сосудистой и гастрокинетической активностью. В статье Monkovic et al. (J. Med. Chem.(1973), 16(4), p. 403-407) описан синтез 3,3 а,8,12b-тетрагидро-N-метил-2 Н-дибензо[3,4: 6,7]-циклогепта-[1,2-b]фуран-2-метанамин щавелевой кислоты. Упомянутое соединение синтезировали в качестве потенциального антидепрессанта; однако, было найдено, что данное конкретное производное тетрагидрофурфуриламина было неактивным в качестве антидепрессанта при дозе 300 мг/кг. Настоящие соединения структурно отличаются от известных в данной области соединений их особым характером замещения дибензоазепинового кольца и наличием тетрагидрофуранового кольца вместо изоксазолидинового кольца и, кроме того, характеризуются ценными фармакологическими и физико-химическими свойствами. Данное изобретение относится к соединениям формулы (I) их N-оксидным формам, фармацевтически приемлемым солям присоединения и их стереохимически изомерным формам, в которыхR1 и R2 взяты вместе с атомом азота, к которому они присоединены, могут образовывать морфолинильное кольцо, или радикал формулыR15 и R16, взятые вместе, могут образовывать двухвалентный радикал С 4-5 алкандиил;R3 является галогеном, а R4 является водородом; или R3 является водородом, а R4 является галогеном; и арил представляет собой фенил или фенил, замещенный 1, 2 или 3 заместителями, выбранными из галогена, гидрокси, C1-6 алкила и галогенметила. В вышеприведенных определениях C1-6 алкил означает насыщенные углеводородные радикалы с прямой и разветвленной цепью,имеющие от 1 до 6 атомов углерода, например такие, как метил, этил, пропил, бутил, 1 метилпропил, 1,1-диметилэтил, пентил, гексил; С 4-5 алкандиил означает двухвалентные насыщенные углеводородные радикалы с прямой и разветвленной цепью, имеющие от 4 до 5 атомов углерода, например такие, как 1,4 бутандиил, 1,5-пентандиил; галоген является общим для фтора, хлора, брома и йода. Термин галогенметил означает, что он включает моно-,ди- и тригалогенметил. Примерами галогенметила являются фторметил, дифторметил и, особенно, трифторметил. Упомянутые выше фармацевтически приемлемые соли присоединения означают, что они включают терапевтически активные нетоксичные формы солей присоединения основания и кислоты, которые способны образовывать соединения формулы (I). Форму соли присоединения кислоты соединения формулы (I), которое существует в свободной форме в виде основания, можно получить путем обработки формы свободного основания соединения формулы (I) соответствующей кислотой, такой как неорганическая кислота, например, галогенводородная кислота, к примеру, хлористо-водородная кислота, или бромисто-водородная кислота, серная, азотная, фосфорная и тому подобные ки 3 слоты; или органическая кислота, например такая, как уксусная, гидроксиуксусная, пропановая, молочная, пировиноградная, щавелевая,малоновая, янтарная, малеиновая, фумаровая,яблочная, винная, лимонная, метансульфокислота, этансульфокислота, бензолсульфокислота,п-толуолсульфокислота, цикламовая, салициловая, п-аминосалициловая, памовая и тому подобные кислоты. Конкретные соли присоединения кислот включают хлористо-водородную кислоту и [R(R,R)]-2,3-дигидроксибутандионовую кислоту(другие названия представляют собой, например, винную кислоту, d-винную кислоту и Lвинную кислоту). Соединения формулы (I), содержащие кислотные протоны, можно превратить в их терапевтически активные нетоксичные основания,т.е. формы солей присоединения металла или амина путем обработки соответствующими органическими и неорганическими основаниями. Соответствующие формы солей основания включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например, лития, натрия, калия, магния, соли кальция и т.п., соли органических оснований, например,бензатин, N-метил-D-глюкамин, соли гидрабамина, и соли аминокислот, таких, например, как аргинин, лизин и т.п. Наоборот, упомянутые солевые формы могут быть конвертированы в свободные формы путем обработки соответствующим основанием или кислотой. Термин соль присоединения, использованный выше, включает также сольваты, которые способны образовать соединения формулы (I), а также их соли. Такими сольватами являются,например, гидраты, алкоголяты и т.п.(I) означают, что они включают те соединения формулы (I), в которых один или несколько атомов азота окислены в так называемые Nоксиды, в частности, такие N-оксиды, в которых азот, несущий R1 и R2 заместители, является Nокисленным. Термин "стереохимически изомерные формы", использованный ранее и далее, обозначает все возможные стереоизомерные формы, в которых могут существовать соединения формулы (I), таким образом, включая также энантиомеры, смеси энантиомеров и смеси диастереомеров. Если не упомянуто или не указано иначе, химическое обозначение соединений означает смесь, и, в частности, рацемическую смесь всех возможных стереохимически изомерных форм, причем упомянутые смеси включают все диастереомеры и энантиомеры основной молекулярной структуры. То же самое применимо к описанным здесь промежуточным соединениям, использованным для получения конечных продуктов формулы (I). Подразумевается, что стереохимически изомерные формы 4 соединений формулы (I) и смеси таких форм охватываются формулой (I). Чистые стереоизомерные формы упомянутых соединений и промежуточных соединений определены как изомеры, по существу, свободные от других энантиомерных или диастереомерных форм такой же основной молекулярной структуры упомянутых соединений или промежуточных соединений. В частности, термин"стереоизомерно чистые соединения или промежуточные соединения относится к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток, по меньшей мере, 80% (т.е. минимум 90% одного изомера и максимум 10% других возможных изомеров) вплоть до 100% стереоизомерного избытка (т.е. 100% одного изомера и никаких других), более конкретно, к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток, по меньшей мере, от 90: вплоть до 100%,еще более конкретно, имеющим стереоизомерный избыток от 94 вплоть до 100%, и наиболее конкретно, стереоизомерный избыток от 97 вплоть до 100%. Термины "энантиомерно чистый" и "диастереомерно чистый", или эквивалентные термины следует понимать аналогичным образом, но по отношению к энантиомерному избытку, соответственно диастереомерному избытку рассматриваемой смеси. Нумерация тетрациклической кольцевой системы, присутствующей в соединениях формулы (I), как определено номенклатурой Chemical Abstracts, представлена в формуле (I'). Соединения формулы (I) имеют, по меньшей мере, три асимметрических центра, а именно, атом углерода 2, атом углерода 3 а и атом углерода 12b. Атомы углерода 3 а и 12b являются частью аннелированной циклической системы. В том случае, когда в циклической системе присутствуют более 2 асимметрических атомов углерода, самый старший заместитель (согласно правилам ряда Cahn-Ingold-Prelog) у контрольного атома углерода, который определен как асимметрический атом углерода, имеющий наименьший номер в цикле, всегда находится условно в положении средней плоскости,определенной циклической системой. Положение самого старшего заместителя у других асимметрических атомов углерода относительно положения самого старшего заместителя у контрольного атома называется или . означает, что самый старший заместитель находится с той же стороны средней плоскости, определенной циклической системой, а означает, что самый старший заместитель находится 5 с другой стороны средней плоскости, определенной циклической системой. Абсолютную стереохимическую конфигурацию некоторых соединений формулы (I) и промежуточных соединений, используемых при их получении, экспериментально не определяли. В этих случаях стереохимически изомерную форму, которую выделили первой, обозначили"А", а вторую - "В", не ссылаясь в дальнейшем на истинную стереохимическую конфигурацию. Однако, упомянутые "А" и "В" изомерные формы можно однозначно охарактеризовать, например, их оптическим вращением в случае,если "А" и "В" имеют энантиомерную взаимосвязь. Специалист в данной области может определить абсолютную конфигурацию таких соединений с использованием известных в данной области методов, например, дифракцией рентгеновских лучей. Например, соединение 4 со стереохимическим обозначением А-(2,3a,12b) означает чистый энантиомер, имеющий либо (а) [2R(2,3 а,12b)] конфигурацию, посредством чего атом углерода 2 является контрольным атомом с R конфигурацией, a -CH2-N(СН 3)2 заместитель находится с -стороны средней плоскости, атом углерода 3 а имеет S конфигурацию,поскольку водородный заместитель расположен с другой стороны средней плоскости по отношению к -СН 2-N(СН 3)2 заместителю, а атом углерода 12b имеет R конфигурацию, поскольку водородный заместитель расположен с той же стороны средней плоскости по отношению к-СН 2-N(СН 3)2 заместителю, либо (b) [2S-(2,3 а,12b)] конфигурацию, посредством чего атом углерода 2 имеет S конфигурацию, атом углерода 3 а - R конфигурацию, а атом углерода 12b - S конфигурацию. Каждый раз при дальнейшем использовании термин "соединения формулы (I)" означает,что он включает также фармацевтически приемлемые соли присоединения, стереоизмерные формы и также N-оксидные формы. Особую группу соединений представляют те соединения формулы (I), в которых два атома водорода у атома углерода 3 а и 12b находятся на противоположных сторонах средней плоскости, определенной тетрациклической кольцевой системой. Интересными соединениями являются такие соединения формулы (I), в которых R1 и R2,каждый независимо, представляют собой водород или C1-6 алкил, или в которых R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют таким образом морфолинильное кольцо или радикал формулы (с) или(е); особенно интересны такие соединения формулы (I), в которых R1 и R2, каждый независимо, представляет собой водород, или метил; более конкретно, где и R1 и R2 являются метилами. 6 Другими интересными соединениями являются такие соединения формулы (I), в которых Х является СН 2. Следующими интересными соединениями являются такие соединения формулы (I), в которых n представляет собой 1, 2, или 3, более конкретно, n равен 1. Конкретными соединениями являются такие соединения формулы (I), в которых R3 представляет собой водород, а R4 является галогеном, более конкретно, фтором. Другими конкретными соединениями являются такие соединения формулы (I), в которых R3 и R4 оба являются галогенами, более конкретно, оба фторами. Предпочтительными соединениями являются такие соединения формулы (I), в которых два атома водорода у атома углерода 3 а и 12b находятся на противоположных сторонах средней плоскости, определенной кольцевой системой, n равен 1, a R1 и R2 являются метилами. Наиболее предпочтительны 11-фтор 3,3 а,8,12b-тетрагидро-N,N-диметил-2 Н-дибензо[3,4:6,7]циклогепта[1,2-b]фуран-2-метанамин; его стереохимически изомерные формы и фармацевтически приемлемые соли присоединения,и его N-оксидные формы, более конкретно, те стереоизомерные формы, в которых два атома водорода у атома углерода 3 а и 12b находятся на противоположных сторонах средней плоскости, определенной циклической системой, такие, например, как -(2,3 а,12b)-11-фтор 3,3 а,8,12b-тетрагидро-N,N-диметил-2 Н-дибензо[3,4:6,7]циклогепта[1,2-b]фуран-2-метанамин и[1,2-b]фуран-2-метанамин. Соединения формулы (I) обычно можно получить путем N-алкилирования промежуточного соединения формулы (II) промежуточным соединением формулы (III), в котором W представляет собой подходящую уходящую группу,такую как галоген. В промежуточных соединениях (II) и (III), R1-R4, n и Х имеют значения,определенные в соединениях формулы (I). Упомянутое N-алкилирование можно подходяще осуществить в инертном к реакции растворителе, таком, например, как метанол, тетрагидрофуран, метилизобутилкетон, N,N-диметилформамид, или диметилсульфоксид, и, необязательно, в присутствии подходящего основания. Перемешивание и повышенные температуры, например, температура флегмы, могут повысить скорость реакции. Альтернативно, упомянутоеN-алкилирование можно также осуществить с использованием методики, описанной Monkovicet al. (J. Med. Chem. (1973), 16(4), p. 403-407),включающей применение находящегося под давлением реакционного сосуда. Соединения формулы (I) могут быть также превращены друг в друга по известным в данной области реакциям превращения. Кроме того, соединения формулы (I) могут быть также превращены в соответствующие Nоксидные формы по известным в данной области методикам превращения трехвалентного азота в его N-оксидную форму. Как правило, упомянутые реакции N-окисления можно осуществить взаимодействием исходного вещества формулы (I) с соответствующей органической или неорганической перекисью. Соответствующие неорганические перекиси включают, например, перекись водорода, перекиси щелочных или щелочно-земельных металлов, например,перекись натрия, перекись калия; соответствующие органические перекиси могут включать надкислоты, например, такие как бензолнадкарбоновая или галогензамещенная бензолнадкарбоновая кислота, например 3-хлорбензолнадкарбоновая кислота, надалкановые кислоты,например, надуксусная кислота, алкилгидроперекиси, например, гидроперекись трет-бутила. Подходящими растворителями являются, например, вода, низшие спирты, например, этанол и т.п., углеводороды, например, толуол, кетоны,например 2-бутанон, галогензамещенные углеводороды, например дихлорметан, и смеси таких растворителей. Чистые стереохимически изомерные формы соединений формулы (I) можно получить при использовании известных в данной области методов. Диастереомеры можно разделить физическими методами, такими как селективная кристаллизация и хроматографическими методами, например противоточным распределением, жидкостной хроматографией и т.п. Соединения формулы (I), полученные описанными выше способами, как правило, представляют собой рацемические смеси энантиомеров, которые можно разделить один от другого известными в данной области методами разделения. Рацемические соединения формулы (I),которые являются достаточно основными или кислотными, могут быть превращены в формы соответствующих диастереомерных солей путем реакции с подходящей хиральной кислотой,соответственно, с подходящим хиральным основанием. Упомянутые формы диастереомерных солей затем разделяют, например, путем селективной или дробной кристаллизации и выделяют из них энантиомеры щелочью или кислотой. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной неподвижной фазы. Упомянутые чистые стереохимически изомер 003698 8 ные формы можно также получить из соответствующих чистых стереохимически изомерных форм соответствующих исходных веществ, при условии, что реакция протекает стереоспецифично. Предпочтительно, если желателен конкретный стереоизомер, упомянутое соединение синтезируют стереоспецифическими способами получения. В этих способах предпочтительно используют энантиомерно чистые исходные вещества. Упомянутые выше промежуточные соединения либо коммерчески доступны, либо их можно получить с использованием известных в данной области способов. Например, промежуточные соединения формулы (III) можно получить по методике, описанной Monkovic et al. (J.Med. Chem. (1973), 16(4), p. 403-407). Альтернативно, промежуточные соединения формулы (III), в которой n равен 1, упомянутые промежуточные соединения, представленные формулой (III-a), можно также получить путем взаимодействия эпоксидного производного формулы (IV) с реактивом Гриньяра формулы (V), в которой Y подходяще является галогеном, с образованием при этом промежуточного соединения формулы (VI), которое можно затем подвергнуть циклизации по известным в данной области способам, таким, как способ, описанный Monkovic et al. Эпоксиды формулы (IV) можно получить с использованием известных в данной области способов, таких как перокисление промежуточного соединения формулы (VII) подходящей перекисью, такой как м-хлорпербензойная кислота. Соединения настоящего изобретения проявляют сродство к 5-HT2 рецепторам, особенно к 5-HT2A и S-HT2C рецепторам (номенклатура,описанная D. Ноуеr в "Serotonin (5HT) in neurologic and psychiatric disorders", изданной М.В.Commission of the University of Leiden). Антагонистические свойства настоящих соединений по отношению к серотонину можно продемонстрировать их ингибирующим эффектом в "5hydroxytryptophan Test on Rats", который описан в Drug Dev. Res., 13, 237-244 (1988). Более того,соединения настоящего изобретения проявляют интересную фармакологическую активность вArch. Int. Pharmacodyn, 227, 238-253 (1977. Соединения настоящего изобретения имеют подходящие физико-химические свойства. Например, они являются химически стабильными соединениями, в частности, когда их сравнивают с соединениями, раскрытыми в WO 96/14320 и WO 96/14321. Соединения настоящего изобретения также обладают быстрым началом действия. Исходя из этих фармакологических и физико-химических свойств, соединения формулы(I) полезны в качестве терапевтических агентов при лечении или предупреждении расстройств центральной нервной системы, таких как тревога, депрессия и легкая степень депрессии, биполярные расстройства, нарушения сна и сексуальные расстройства, психоз, пограничный психоз, шизофрения, мигрень, изменения личности,или навязчиво-конпульсивные расстройства,социальная фобия, или приступы паники, органические психические расстройства, психические расстройства у детей, агрессия, нарушения памяти и нарушения положения у пожилых людей, привыкание к чрезмерному употреблению лекарств, ожирение, булимия и похожие расстройства. В частности, настоящие соединения можно использовать как транквилизаторы, антипсихотические препараты, антидепрессанты,средства против мигрени и как агенты, обладающие способностью пересиливать (отвергать) свойства привыкания к чрезмерному употреблению лекарств. Соединения формулы (I) можно использовать также в качестве терапевтических агентов при лечении двигательных нарушений. Может быть благоприятным использовать настоящие соединения в сочетании с классическими терапевтическими агентами для таких нарушений. Соединения формулы (I) могут также служить для лечения или предупреждения повреждений нервной системы, вызванных травмой,ударом, нейродегенеративными болезнями и т.п.; сердечно-сосудистых нарушений типа повышенного кровяного давления, тромбоза, удара и т.п.; и желудочно-кишечных расстройств типа дисфункции подвижности желудочнокишечной системы и т.п. В свете перечисленных выше применений соединений формулы (I) следует, что настоящее изобретение предлагает также способ лечения теплокровных животных, страдающих подобными заболеваниями, причем упомянутый способ включает в себя систематическое введение терапевтического количества соединения формулы (I), эффективного при лечении описанных выше расстройств, в частности, при лечении тревоги, психоза, шизофрении, депрессии, мигрени, нарушений сна и свойства привыкания к чрезмерному употреблению лекарств. 10 Таким образом, настоящее изобретение относится также к соединениям формулы (I),определенным выше, для применения в качестве лекарственного средства, в частности, соединения формулы (I) могут быть использованы для производства лекарственных средств для лечения тревоги, психоза, шизофрении, депрессии,мигрени, нарушений сна и свойств привыкания к чрезмерному употреблению лекарств. Специалисты в лечении подобных заболеваний могут определить эффективное терапевтическое суточное количество по результатам теста, представленным ниже. Эффективное терапевтическое суточное количество будет составлять от примерно 0,01 до примерно 10 мг/кг массы тела, более предпочтительно от примерно 0,05 до примерно 1 мг/кг массы тела. Для легкого введения рассматриваемые соединения можно составить в различные фармацевтические формы в целях введения. Для получения фармацевтических композиций данного изобретения терапевтически эффективное количество конкретного соединения, необязательно в виде соли присоединения, в качестве активного ингредиента объединяют в однородной смеси с фармацевтически приемлемым носителем, который может принимать самые разнообразные формы в зависимости от формы препарата, предназначенного для введения. Желательно, чтобы эти фармацевтические композиции находились в виде единичной дозы, подходящей, предпочтительно, для перорального,ректального введения, введения через кожу, или путем парентеральной инъекции. Например, при получении композиций в виде доз для перорального введения можно использовать любую обычную фармацевтическую среду, такую, например, как вода, гликоли, масла, спирты и т.п. в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие, дезинтеграторы и т.п. в случае порошков,пилюль, капсул и таблеток. Вследствие своей простоты при введении, таблетки и капсулы представляют собой наиболее предпочтительную форму пероральной единичной дозы, причем в этом случае, очевидно, используют твердые фармацевтические носители. Для парентеральных композиций носитель обычно будет содержать стерилизованную воду, по крайней мере, большей частью, хотя могут быть включены и другие ингредиенты, например, для облегчения растворимости. Можно получить, например, растворы для инъекций, в которых носитель включает солевой раствор, раствор глюкозы, или смесь солевого раствора и глюкозы. Растворы для инъекций, содержащие соединения формулы (I), можно составить в виде масла для пролонгированного действия. Подходящими маслами для этой цели являются, например,арахисовое масло, кунжутное масло, хлопковое 11 масло, кукурузное масло, соевое масло, синтетические сложные эфиры глицерина и жирных кислот с длинной цепью, и их смеси и других масел. Можно также получить суспензии для инъекций, в этом случае можно использовать соответствующие жидкие носители, суспендирующие агенты и т.п. В композициях, пригодных для введения через кожу, носитель необязательно содержит повышающий проникновение агент и/или подходящий увлажняющий агент,необязательно объединенный с подходящими добавками любой природы в незначительных количествах, которые не оказывают каких-либо значительных вредных воздействий на кожу. Упомянутые добавки могут облегчать введение через кожу и/или могут быть полезны для получения требуемых композиций. Эти композиции можно вводить различным образом, например, в виде накожного пластыря, в виде капель или мази. Благодаря своей повышенной водорастворимости по сравнению с соответствующей основной или кислотной формой, соли присоединения кислоты или основания соединений формулы (I) больше подходят для получения водных композиций. Для повышения растворимости и/или стабильности соединений формулы (I) в фармацевтических композициях может быть предпочтительным использование -, - или -циклодекстринов или их производных, в частности,гидроксиалкилзамещенных циклодекстринов,например, 2-гидроксипропилциклодекстрина. Кроме того, улучшить растворимость и/или стабильность соединений формулы (I) в фармацевтических композициях могут сорастворители,вспомогательные растворители, такие, как спирты. Другие обычные способы повышения растворимости соединений настоящего изобретения в фармацевтических композициях описаны в WO 97144014. Более конкретно, соединения настоящего изобретения можно составить в фармацевтическую композицию, содержащую терапевтически эффективное количество частиц, состоящих из твердой дисперсии, содержащей(b) один или более фармацевтически приемлемых водорастворимых полимеров. Термин "твердая дисперсия" означает систему в твердом состоянии (в противоположность жидкому или газообразному состоянию) , содержащую, по меньшей мере, два компонента, в которой один из компонентов диспергирован более или менее однородно в другом компоненте или компонентах. В случае, когда упомянутая дисперсия этих компонентов такова, что эта система химически и физически однородна или гомогенна по всему объему, или состоит из одной фазы, по определению термодинамики, такую твердую дисперсию называют "твердым раствором". Твердые 12 растворы являются предпочтительными физическими системами, поскольку их компоненты обычно легко биодоступны организмам, в которые их вводят. Термин "твердая дисперсия" включает в себя также дисперсии, которые менее гомогенны по всему объему, чем твердые растворы. Такие дисперсии не являются химически и физически однородными по всему объему или содержат более одной фазы. Водорастворимый полимер в частицах представляет собой полимер, имеющий при растворении в 2%-ном водном растворе при 20 С кажущуюся вязкость от 1 до 100 мПа.с. Предпочтительными водорастворимыми полимерами являются гидроксипропилметилцеллюлозы или ГПМЦ. ГПМЦ, имеющие степень замещения метоксигруппой от примерно 0,8 до примерно 2,5 и молярное замещение гидроксипропилом от примерно 0,05 до примерно 3,0, обычно являются водорастворимыми. Степень замещения метоксигруппой относится к среднему числу эфирных метильных групп,присутствующих в звене ангидроглюкозы в молекуле целлюлозы. Молярное замещение гидроксипропилом относится к среднему числу молей пропиленоксида, прореагировавшего с каждым звеном ангидроглюкозы в молекуле целлюлозы. Определенные выше частицы можно получить путем приготовления сначала твердой дисперсии компонентов, а затем необязательно дробления или измельчения этой дисперсии. Для получения твердых дисперсий существуют различные способы, включая экструзию из расплава, сушку распылением и выпаривание из раствора, причем предпочтительна экструзия из расплава. Особенно предпочтительно составлять упомянутые выше фармацевтические композиции в виде единичной дозы для простоты введения и равномерности дозировки. Форма единичной дозы, как использовано в описании и формуле изобретения, относится к физически дискретным единицам, пригодным в качестве единичных доз,причем каждая единица содержит заранее определенное количество активного ингредиента, рассчитанного для получения требуемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Примерами таких форм единичных доз являются таблетки (включая таблетки с отметкой или таблетки с покрытием) ,капсулы, пилюли, пакетики с порошком, облатки,растворы или суспензии для инъекций, чайные ложки, столовые ложки и т.п., и их комплексы. Следующие примеры предназначены для иллюстрации, а никоим образом не для ограничения объема настоящего изобретения. Экспериментальная часть А. Получение промежуточных соединений. Пример А.1. а) К суспензии А 1 С 13 (0,0718 моль) в тетрагидрофуране (75 мл), охлажденной на ледяной бане, и в атмосфере азота, добавляли по 13 каплям LiAlH4 (0,0686 моль). Смесь перемешивали в течение 10 мин при 0 С. Добавляют по каплям раствор 2-фтор-5 Н-дибензо[а,d]-циклогептен-5-она (0,0653 моль и полученный, как описано в DE 3644462) в тетрагидрофуране (75 мл) и оставляют полученную реакционную смесь нагреваться до комнатной температуры. После этого реакционную смесь перемешивали и нагревали с обратным холодильником в течение 2 ч. Смесь охладили на ледяной бане. Добавили воду и CH2Cl2. Органический слой промыли насыщенным водным раствором NаНСО 3,высушили, отфильтровали и выпарили растворитель, получив 13,16 г (96%) 2-фтор-5 Ндибензо[а,b]-циклогептена (промежуточное соединение 1).b) Метахлорпербензойную кислоту (0,0501 моль) растворили в СНСl3 (40 мл). Органический раствор высушили, отфильтровали, добавили фильтрат по каплям к раствору промежуточного соединения 1 (0,0417 моль) и 1,4 бензолдиола (0,26 г) в СНСl3 (70 мл), при перемешивании при 60 С. Реакционную смесь перемешивали 2,5 ч при 60 С, затем охладили на ледяной бане, промыли 10%-ным водным раствором Nа 2 СО 3 и рассолом, высушили, отфильтровали и выпарили фильтрат, получив 10,42 г 3-фтор-6,10b-дигидро-1aH-дибензо[3,4: 6,7]циклогепт(1,2-b]оксирена (промежуточное соединение 2).c) К раствору промежуточного соединения 2 (0,04956 моль) в тетрагидрофуране (120 мл) в атмосфере азота добавляли по каплям бром-2 пропилмагний (0,0542 моль). Реакционную смесь перемешивали в течение 30 мин при комнатной температуре, затем перемешивали и нагревали с обратным холодильником 2 ч. Реакционную смесь охладили на ледяной бане, погасили 20%-ным раствором NH4Cl и экстрагировали этилацетатом. Органический слой отделили, высушили, отфильтровали и выпарили растворитель. Остаток очистили и разделили на два региоизомера ВЭЖХ на силикагеле (элюент: гексан/этилацетат 9/1). Две группы чистых фракций собрали и выпарили из них растворитель, получив 4,79 г (36%) -транс-8-фтор 10,11-дигидро-11-(2-пропенил)-5 Н-дибензо[а,d] циклогептен-10-ола (промежуточное соединение 3) и 2,52 г (19%) (транс)-2-фтор-10,11 дигидро-11-(2-пропенил)-5 Н-дибензо[a,d]циклогептен-10-ола (промежуточное соединение 4).d) К раствору промежуточного соединения 3 (0,0175 моль) в СНСl3 (80 мл), охлажденному на ледяной бане, порциями добавили трибромид пиридиния (0,0175 моль). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Добавили воду. Перемешивали смесь 5 мин. Органический слой отделили, промыли водой, высушили, отфильтровали и выпарили растворитель. Остаток очищали хроматографией на короткой колонке с силикагелем 14 фракции собрали и выпарили растворитель, получив 5,02 г (83%) -[(2,3 а,12b)+(2,3 а,12b)]2-(бромметил)-11-фтор-3,3 а,8,12b-тетрагидро-2 Ндибензо-[3,4:6,7]-циклогепта[1,2-b]фурана (промежуточное соединение 5). По аналогии получили -[(2a,3 а,12b)+(2,3 а,12b)]-2-(бромметил)-5-фтор 3,3 а,8,12b-тетрагидро-2 Н-дибензо-[3,4:6,7]-циклогепта[1,2-b]фуран (промежуточное соединение 6). По аналогии с промежуточным соединением 6 были получены также следующие промежуточные соединения: (2,3 а,12b)-2-(бромметил)-5-фтор-3,3 а,8,12b-тетрагидро-2 Н-дибензо-[3,4: 6,7]циклогепта[1,2-b]фуран (промежуточное соединение 7); и [(2,3 а, 12b)+(2,3 а,12b)]-2-(бромметил)-5,11-дифтор-3,3 а,8,12b-тетрагидро-2 Н-дибензо-[3,4:6,7]-циклогепта[1,2-b]фуран (промежуточное соединение 8). В. Получение соединений формулы (I). Пример B.1. а) В смесь промежуточного соединения 5(100 мл) барботировали N,N-диметиламин (газ) в течение 8 мин. Реакционную смесь перемешивали в реакторе Парра 16 ч при 125 С. Смесь оставили охлаждаться до комнатной температуры. Твердое вещество отфильтровывали и выпаривали фильтрат. Остаток промыли насыщенным водным раствором NаНСО 3, затем экстрагировали СН 2 Сl3. Органический слой отделили,высушили, отфильтровали и выпарили растворитель. Остаток очищали хроматографией на открытой короткой колонке с силикагелем(элюент: CH2Cl2/(СН 3 ОН/NН 3) 98/2). Требуемые фракции собрали и выпарили растворитель, получивb) Соединение 1 растворили в диэтиловом эфире (20 мл) и конвертировали в соль хлористо-водородной кислоты (1:1) добавлением по каплям 6N HCl/2-пропанола. Растворитель выпарили. Остаток затирали в кипящем 2 пропаноне, отфильтровали и высушили, получив 2,17 г (43%) гидрохлорида -[(2,3 а,12b)]-11-фтор-3,3 а,8,12b-тетрагидро-N,Nдиметил-2 Н-дибензо[3,4:6,7]-циклогепта[1,2-b] фуран-2-метанамина (соединение 2; т.пл. 239,1 С).c) После повторения процедур стадии а) иb) с большим количеством исходного вещества растворитель маточного раствора (остающийся после фильтрования соединения 2) выпарили. Остаток очищали ВЭЖХ над RP-18 (элюент:(0,5% ацетат аммония в H2O)/СН 3 ОН/СН 3 СN элюирование с градиентом). Чистые фракции собирали и выпарили растворитель, получив 0,400 г -[(2,3a,12b)-11-фтор-3,3 а,8,12bтетрагидро-N,N-диметил-2 Н-дибензо-[3,4:6,7] 15 циклогепта[1,2-b]фуран-2-метанамина (соединение 3). Пример В.2. а) Соединение 2 (0,005 моль) конвертировали в свободное основание обработкой воднымNH4OH и экстракцией CH2Cl2. Отделенный органический слой высушили, отфильтровали и выпарили растворитель. Остаток свободного основания разделили на его энантиомеры колоночной хроматографией с хиральной фазой Chiralcel OJ (элюент: гексан/этанол 90/10). Две группы чистых фракций собрали и выпарили из них растворитель, получив 0,702 г (45%) А[(2,3 а,12b)]-11-фтор-3,3 а,8,12b-тетрагидро-n,Nдиметил-2 Н-дибензо[3,4:6,7]циклогепта[1,2-b]фуран-2-метанамина (соединение 4) и 0,670 г (43%) В[(2,3 а,12b)]-11-фтор-3,3 а,8,12b-тетрагидро-n,Nдиметил-2 Н-дибензо[3,4:6,7]циклогепта[1,2-b]фуран-2-метанамина (соединение 5). Аналогичным образом, соединение 3 разделили на А-[(2,3 а,12b)]-11-фтор-3,3 а,8,12bтетрагидро-N,N-диметил-2 Н-дибензо[3,4:6,7] циклогепта[1,2-b]фуран-2-метанамин (соединение 6) и B-[(2,3 а,12b)]-11-фтор-3,3 а,8,12bтетрагидро-N,N-диметил-2 Н-дибензо[3,4:6,7] циклогепта[1,2-b]фуран-2-метанамин (соединение 7).b) Соединение 5 (0,0584 моль) перемешивали в этаноле (280 мл) при комнатной температуре. При комнатной температуре добавили раствор L-винной кислоты (0,0584 моль) в этаноле(50 мл) (растворенную при нагревании) и перемешивали эту смесь 4 ч при комнатной температуре. Выпавший осадок отфильтровывали и высушили (вакуум, 40 С, 16 ч), получив 19,1 г(71%) [В-(2,3 а,12b)]-11-фтор-3,3 а,8,12b-тетрагидро-N,N-диметил-2 Н-дибензо[3,4:6,7]циклогепта[1,2-b]фуран-2-метанамина (+)-[(R-R,R)]-2,3-дигидроксибутандиоата (1:1) (соединение 11). Пример В.3. Смесь промежуточного соединения 5(0,0030 моль) и морфолина (0,0075 моль) перемешивали в течение 3 ч при 100 С, затем охладили до комнатной температуры и добавили еще морфолина (0,0075 моль) и перемешивали реакционную смесь 1 ч при 100 С, после чего охладили до комнатной температуры и добавили CH2Cl2. Выпавший осадок отфильтровали и выпарили фильтрат. Полученное масло очищали хроматографией на открытой короткой колонке с силикагелем (элюент: CH2Cl2/CH3OH 98/2). Чистые фракции собрали и выпарили растворитель. Остаток растворили в диэтиловом эфире и превратили в соль хлористо-водородной кислоты (1:1). Осадок отфильтровали и высушили,получив 0,82 г (70%) гидрохлорида [(2,3 а,12b)+(2,3 а,12b)]-11-фтор-3,3 а,8,12bтетрагидро-2-(4-морфолинилметил)-2 Н-дибензо[3,4:6,7]циклогепта[1,2-b]фурана (соединение 19; т.пл. 281,1 С). 16 В табл. 1 перечислены соединения формулы (I), которые получили аналогично одной из описанных выше методик. Таблица 1 В нижеследующей табл. 2 перечислены другие соединения формулы, полученные аналогично одной из описанных выше методик реакций. С. Фармакологический пример. Пример C.1. "мХФП тест на крысах". Крыс обработали тестируемым соединением при изменяющейся дозе в течение предтестового времени Т, составляющего 1 ч, и 1 мг/кг мХФП (метахлорфенилпиперазином), введенным путем внутривенной инъекции за 15 мин до теста. По истечении пред-тестового времени Т обработанных крыс подвергли "тесту на крысах в открытом поле", описанному в DrugDev. Rev. 18, 119-144 (1989), но с использовани 17 ем источника инфракрасного света вместо источника света KleverluxR (12V/20W). Дозу, при которой у 40% или более тестируемых крыс наблюдалось подавление вызванных мХФП эффектов, т.е. мХФП-антагонизм, определили как активную дозу. Соединения под номерами 2 и 816 были активны при тестовой дозе 2,5 мг/кг или меньше. Прочие соединения либо не тестировали, либо они были активны при более высокой дозе. Полный антагонизм вызванных мХФП эффектов, означающий, что у 100% тестированных крыс наблюдалось полное подавление вызванных мХФП эффектов, наблюдали для соединений под номерами 2 и 10 при дозе 2,5 мг/кг или меньше. В целях тестирования быстрого начала действия тестового соединения на обращение вызванных мХФП эффектов, повторили описанный выше эксперимент, в котором крыс обработали внутривенно мХФП при предтестовом времени Т 15 мин, и внутривенно тестовым соединением при меняющихся дозах при предтестовом времени Т 5 мин. Соединения под номерами 2, 8, 9, 10, 11 и 12 были активны апри тестовой дозе 2,5 мг/кг или ниже и, таким образом, было доказано, что они имеют быстрое начало действия. Пример С.2. "Aпоморфиновый, триптаминовый, норэпинефриновый (АТН) тест на крысах". Антипсихотическая активность рассматриваемых соединений доказана экспериментальными данными, полученными в объединенном тесте на крысах с апоморфином (АРО), триптамином (TRY) и норэпинефрином (NOR). Упомянутый объединенный тест с апоморфином,триптамином и норэпинефрином описан в Arch.Int. Pharmacodyn., 227, 238-253 (1977) и предоставляет эмпирическую оценку относительной специфичности, с которой лекарственные средства могут действовать на индивидуальные нейротрансмиттерные системы центрально (ЦНС),а также периферически. В частности, тест показал антагонистическую активность тестируемых соединений формулы (I) относительно допамина (путем предотвращения симптомов, вызванных агонистом допамина апоморфином, например, таких, как возбуждение и стереотипия),относительно серотонина (путем предотвращения центральных симптомов, вызванных агонистом серотонина тримтамином, например, таких, как двусторонние клонические судороги,дрожание и обратная локомоция, и периферических симптомов, например, таких, как цианоз),и относительно норэпинефрина (путем предотвращения или задержки гибели при введении агониста норэпинефрина). Полезное фармакологическое свойство настоящих соединений по сравнению с соединениями, особо раскрытыми в WO 97/38991, заключается в их способностиED50 в мг/кг (эффективной дозы, при которой вызванные симптомы антагонизируются у 50% тестируемых крыс) для настоящих соединений под номерами 9, 11, 12 и 13, и следующих соединений, раскрытых в WO 97/38991. Наблюдения для определения того, антагонизирует ли тестовое соединение центрально вызванные симптомы или нет, осуществили для антагонизма апоморфина в течение 30 мин, а для антагонизма триптамина в течение 90 мин,после подкожного введения тестового соединения. Таблица 3 Настоящее изобретениеWO 97/38991 Соед.ED50, мг/кг Соединение ED50, мг/кг Взаимодействие с апоморфином Антагонизм возбуждения и стереотипии 9 2,0 а 10 11 2,0d 2,7 Взаимодействие с триптамином Антагонизм двусторонних клонических судорог 9 0,7 а 10 11 0,4d 0,15 Антагонизм обратной локомоции 9 1,4"Активный ингредиент" (А.И.), используемый во всех этих примерах, относится к соединению формулы (I), его фармацевтически приемлемой соли присоединения, его стереохимически изомерной форме, или к его Nоксидной форме. Пример D.1. Pаствор для перорального введения. Метил 4-гидроксибензоат (9 г) и пропил 4 гидроксибензоат (1 г) растворили в кипящей очищенной воде (4 л). В 3 л этого раствора растворили сначала 2,3-дигидроксибутандионовую 19 кислоту (10 г), а затем А.И. (20 г). Последний раствор объединили с оставшейся частью первого раствора и добавили к нему 1,2,3 пропантриол (12 л) и 70%-ный раствор сорбита(50 мл) и добавили эссенции малины (2 мл) и крыжовника (2 мл). Последний раствор объединили с первым, добавили необходимое количество воды до объема 20 л, получив при этом раствор для перорального введения, содержащего 5 мг активного ингредиента на чайную ложку(5 мл). Полученным раствором заполнили подходящие емкости. Пример D.2. Покрытые пленкой таблетки. Получение ядра таблетки Смесь А.И. (100 г), лактозы (570 г) и крахмала (200 г) хорошо перемешивали и после этого увлажнили раствором додецилсульфата натрия (5 г) и поливинилпирролидона (10 г) в воде(200 мл) . Влажную порошковую смесь просеяли, высушили и снова просеяли. Затем к ней добавили микрокристаллическую целлюлозу(100 г) и гидрогенизированное растительное масло (15 г). Все это хорошо перемешали и спрессовали в таблетки, получая 10 000 таблеток, каждая из которых содержала 10 мг активного ингредиента. Покрытие К раствору метилцеллюлозы (10 г) в денатурированном этаноле (75 мл) добавили раствор этилцеллюлозы (5 г) в дихлорметане (150 мл). После этого туда добавили дихлорметан (75 мл) и 1,2,3-пропантриол (2,5 мл). Полиэтиленгликоль (10 г) расплавили и растворили в дихлорметане (75 мл). Последний раствор добавили к первому и затем туда добавили октадеканоат магния (2,5 г), поливинилпирролидон (5 г) и концентрированную цветную суспензию (30 мл) и все это гомогенизировали. Ядра таблеток покрыли полученной таким образом смесью в аппарате для нанесения покрытий. Пример D.3. Раствор для инъекций. Метил 4-гидроксибензоат (1,8 г) и пропил 4-гидроксибензоат (0,2 г) растворили в кипящей воде (500 мл) для инъекции. После охлаждения до приблизительно 50 С туда добавили при перемешивании молочную кислоту (4 г), пропиленгликоль (0,05 г) и А.И. (4 г). Этот раствор охладили до комнатной температуры и развели необходимым количеством воды для инъекций до 1000 мл, получив раствор, содержащий 4 мг/мл А.И. Раствор стерилизовали фильтрованием и заполнили им стерильные емкости. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы 20 его N-оксидная форма, фармацевтически приемлемая соль присоединения или стереохимически изомерная форма,где n представляет собой 0, 1, 2, 3, 4, 5 или 6;X представляет собой СН 2 или О;R1 и R2, каждый независимо, представляют собой водород, C1-6 алкил, C1-6 алкилкарбонил,галогенметилкарбонил или C1-6 алкил, замещенный гидрокси-, C1-6 алкилоксигруппой, карбоксилом, C1-6 алкилкарбонилоксигруппой, C1-6 алкилоксикарбонилом или арилом; или R1 и R2, взятые вместе с атомом азота,к которому они присоединены, могут образовывать морфолинильное кольцо или радикал формулыR3 является водородом, а R4 является галогеном и арил представляет собой фенил или фенил,замещенный 1, 2 или 3 заместителями, выбранными из галогена, гидрокси, C1-6 алкила и галогенметила. 2. Соединение по п.1, в котором Х является СН 2. 3. Соединение по п.1 или 2, в котором атомы водорода у атомов углерода 3 а и 12b находятся на противоположных сторонах средней плоскости, определяемой тетрациклической кольцевой системой. 4. Соединение по любому из пп.1-3, в котором R3 является галогеном, а R4 является водородом. 5. Соединение по любому из пп.1-4, в котором n равен 1. 6. Соединение по любому из пп.1-5, в котором R1 и R2, каждый независимо, выбирают из водорода или C1-6 алкила или когда взятые вместе с атомом азота, к которому они присоединены, образуют морфолинильное кольцо или радикал формулы (с) или (е). 7. Соединение по п.1, представляющее собой 11-фтор-3,3 а,8,12b-тетрагидро-N,N-диметил-2 Н-дибензо-[3,4:6,7]циклогепта[1,2-b]фуран-2-метанамин, его стереохимически изомер 21 ную форму, или фармацевтически приемлемую соль присоединения, или его N-оксидную форму. 8. Композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-7. 9. Соединение по любому из пп.1-7 для применения в качестве лекарственного средства. 10. Применение соединения по любому из пп.1-7 для производства лекарственного средства при лечении тревоги, психоза, шизофрении,депрессии, мигрени, нарушений сна и привыкания к чрезмерному употреблению лекарственных средств. 11. Способ получения соединения по п.1,отличающийся тем, что(II) N-алкилируют промежуточным соединением формулы (III) 22 где в промежуточных соединениях (II) и (III) R1R4, n и Х определены как в п.1 и W представляет собой подходящую уходящую группу; в инертном по отношению к реакции растворителе и,необязательно, в присутствии подходящего основания;b) превращают соединения формулы (I) друг в друга известными в данной области превращениями и дополнительно, если требуется,превращают соединения формулы (I) в терапевтически активную нетоксичную соль присоединения кислоты путем обработки кислотой, или в терапевтически активную нетоксичную соль присоединения основания путем обработки основанием, или наоборот, превращают соль присоединения кислоты в свободное основание путем обработки щелочью; или превращают соль присоединения основания в свободную кислоту путем обработки кислотой; и, если требуется,получают их стереохимически изомерные формы или их N-оксидные формы.
МПК / Метки
МПК: A61K 31/34, C07D 307/93
Метки: производные, тетрагидрофурана, тетрациклические, галогензамещенные
Код ссылки
<a href="https://eas.patents.su/12-3698-galogenzameshhennye-tetraciklicheskie-proizvodnye-tetragidrofurana.html" rel="bookmark" title="База патентов Евразийского Союза">Галогензамещенные тетрациклические производные тетрагидрофурана</a>












