Новые α-аминокислотные соединения, способ их получения и фармацевтические композиции их содержащие
Номер патента: 4865
Опубликовано: 26.08.2004
Авторы: Левен Нижель, Юссон-Робер Бернадетт, Ножан Оливье, Де Нантей Гийом, Портвен Бернар, Бенуа Ален, Буланже Мишель
Формула / Реферат
1. Соединение формулы (I)

в которой
 представляет собой 5-членный азотсодержащий гетероцикл, необязательно замещенный цианогруппой,
представляет собой 5-членный азотсодержащий гетероцикл, необязательно замещенный цианогруппой,
Ak представляет собой линейную или разветвленную (C1-C6)алкиленовую цепь,
X представляет собой одинарную связь или фениленовую группу,
R1 и R2, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (C1-C6)алкильную группу,
Y представляет собой NR4 или CH-NO2,
R4 представляет собой атом водорода, линейную или разветвленную (C1-C6)алкильную группу,
R3 представляет собой
группу, выбираемую из линейного или разветвленного (C1-C6)алкила, нитро и циано, если Y представляет собой CH-NO2, или
группу, выбираемую из нитро и циано, если Y представляет собой NR4,
его таутомеры, если они существуют, оптические изомеры и их аддитивные соли с фармацевтически приемлемой кислотой,
за исключением соединений, в которых одновременно  представляет собой
представляет собой
незамещенный 5-членный азотосодержащий гетероцикл, Ak представляет собой группу -(CH2)3-, X представляет собой одинарную связь, Y представляет собой NH и R3 представляет собой нитрогруппу, термин "5-членный азотосодержащий гетероцикл" понимают как обозначающий насыщенную, моноциклическую, 5-членную группу, содержащую 1, 2 или 3 гетероатома, один из этих гетероатомов представляет собой атом азота и присутствующие дополнительные гетероатомы выбирают из атомов кислорода, азота и серы.
2. Соединение формулы (I) по п.1, в которой  представляет собой 1-пирролидинильную группу, необязательно замещенную цианогруппой, или 1,3-тиазолидин-3-ильную группу, необязательно замещенную цианогруппой.
представляет собой 1-пирролидинильную группу, необязательно замещенную цианогруппой, или 1,3-тиазолидин-3-ильную группу, необязательно замещенную цианогруппой.
3. Соединения формулы (I) либо по п.1, либо по п.2, в которой конфигурация a амидной функции представляет собой (S).
4. Соединение формулы (I) по любому из пп. с 1 до 3, в которой Ak представляет собой группу (CH2)4.
5. Соединение формулы (I) по любому из пп. с 1 по 3, в которой 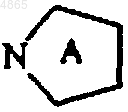 представляет собой 1-пирролидинильную группу, замещенную цианогруппой, или 1,3-тиазолидин-3-ильную группу, замещенную цианогруппой, и Ak представляет собой группу (CH2)3.
представляет собой 1-пирролидинильную группу, замещенную цианогруппой, или 1,3-тиазолидин-3-ильную группу, замещенную цианогруппой, и Ak представляет собой группу (CH2)3.
6. Соединение формулы (I) по любому из пп. с 1 по 5, в которой X переставляет собой одинарную связь.
7. Соединение формулы (I) по любому из пп. с 1 по 6, в которой Y представляет собой группу NR4, в которой R4 представляет собой атом водорода или линейную или разветвленную (C1-C6)алкильную группу.
8. Соединение формулы (I) по любому из пп. с 1 по 7, в которой R3 представляет собой нитрогруппу.
9. Соединение формулы (I) по п.1, которое представляет собой N-{(4S)-4-амино-5-[(2S)-2-циано-1-пирролидинил]-5-оксопентил}-N'-нитрогуанидин, и его оптические изомеры, его таутомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой.
10. Соединение формулы (I) по п.1, которое представляет собой N-{(5S)-5-амино-6-[(2S)-2-циано-1-пирролидинил]-6-оксогексил}-N'-нитрогуанидин, и его оптические изомеры, его таутомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой.
11. Соединение формулы (I) по п.1, которое представляет собой N-{(5S)-5-амино-6-(1,3-тиазолидин-3-ил)-6-оксогексил}-N'-нитрогуанидин, и его оптические изомеры, его таутомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой.
12. Способ синтеза соединений формулы (I) по п.1, который отличается тем, что соединение формулы (II)
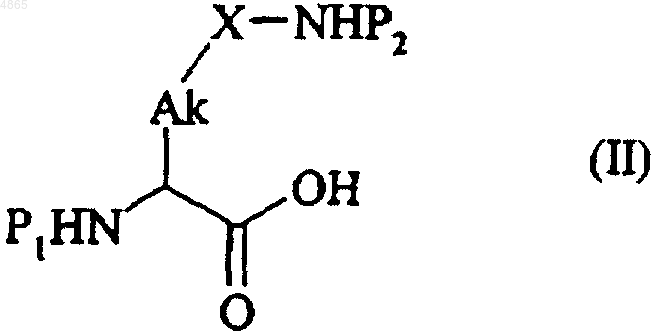
в которой Ak и X имеют значения, указанные для формулы (I), P1 представляет собой защитную группу для аминофункции и P2 представляет собой защитную группу для аминофункции, отличную от группы P1,
подвергают реакции с соединением формулы (III)

в которой  имеет значение, указанное для формулы (I),
имеет значение, указанное для формулы (I),
при обычных условиях пептидного связывания,
с получением после депротекции соединения формулы (IV)
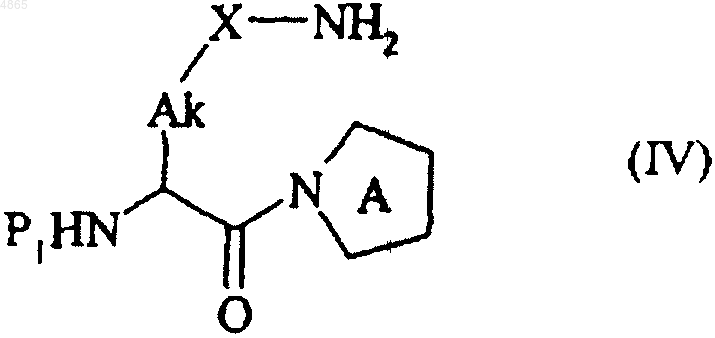
в которой 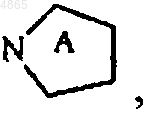 P1, Ak и X имеют значения, указанные здесь ранее,
P1, Ak и X имеют значения, указанные здесь ранее,
которое затем переводят при помощи традиционных в органической химии реакций после депротекции, где это необходимо, в соединение формулы (I),
которое очищают, при необходимости, по традиционной методике очистки, которое разделяют при желании на оптические изомеры по традиционной методике разделения и которое переводят при желании в его аддитивные соли с фармацевтически приемлемой кислотой.
13. Фармацевтическая композиция, включающая как активный ингредиент соединение по любому из пп. с 1 по 11, в комбинации с одним или более инертными, нетоксичными и фармацевтически приемлемыми носителями.
14. Фармацевтическая композиция по п.13 для применения в качестве лекарственного препарата как ингибитора дипептидилпептидазы IV для применения при лечении непереносимости глюкозы и расстройств, связанных с гипергликемией, таких как диабет типа II или ожирение.
15. Фармацевтическая композиция по п.14 для применения в качестве противодиабетного лекарственного препарата.
Текст
1 Данное изобретение относится к новым аминокислотным соединениям, к способу их получения, к фармацевтическим композициям,их содержащим, и к их применению в качестве ингибиторов дипептидилпептидазы IV (DPPIV). Дипептидилпептидаза IV является мембранной серинпротеазой, присутствующей в различных человеческих тканях, и вовлечена в различные патологии. В частности, оказалось, что DPP IV ответственнa за дезактивацию GLP-1 (глюкагонподобный пептид-1). GLP-1 является важным стимулятором секреции инсулина в поджелудочной железе и, соответственно, имеет прямое положительное влияние на уровень глюкозы в крови. Ингибирование DPP IV, соответственно,представляет собой очень обещающий подход при лечении непереносимости глюкозы и расстройств, связанных с гипергликемией, таких как, например, инсулиннезависимый диабет(диабет II типа) или ожирение. Ингибиторы DPP FV были описаны в литературе, в частности амидные соединения в патентной заявке ЕР 0 490 379 и в журнале Adv.Exp. Med. Biol. 1997, 421. 157-160, и карбаматные соединения в патентной заявке DE 19826972. Более того, -аминокислотные соединения, аналоги аргинина, были описаны в патентной заявке WO 96/27593, как ингибиторы NOсинтазы, для применения их в качестве таковых при лечении патологий центральной и периферийной нервных систем, патологий дисфункций желудочно-кишечной и мочевой систем, а также патологий, связанных с сердечно-сосудистой или бронхопульмональной системой. Соединения по изобретению имеют свойства ингибиторов дипептидилпептидазы IV, что делает их особенно полезными при лечении непереносимости глюкозы и расстройств, связанных с гипергликемией. Более конкретно, данное изобретение относится к соединениям формулы (I) 2 атом водорода или линейную или разветвленную (C1-С 6)алкильную группу,Y представляет собой NR4 или CH-NO2,R4 представляет собой атом водорода или линейную или разветвленную (C1-С 6)алкильную группу,R3 представляет собой группу, выбираемую из линейного или разветвленного (C1-С 6)алкила, нитро и циано,если Y представляет собой CH-NO2, или группу, выбираемую из нитро и циано, если Y представляет собой NR4,к их таутомерам, если они существуют, их оптическим изомерам и к их аддитивным солям с фармацевтически приемлемой кислотой,за исключением соединений, в которых одновременно представляет собой незамещенный 5-членный азотосодержащий гетероцикл, Ak представляет собой группу -(СН 2)3-, Х представляет собой одинарную связь, Y представляет собой NH и R3 представляет собой нитрогруппу. Среди фармацевтически приемлемых солей можно упомянуть, без внесения ограничений, соляную кислоту, бромоводородную кислоту, серную кислоту, фосфорную кислоту,уксусную кислоту, трифтороуксусную кислоту,молочную кислоту, пирувовую кислоту, малоновую кислоту, сукциновую кислоту, глутаровую кислоту, фумаровую кислоту, виннокаменную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, метансульфоновую кислоту, камфорную кислоту, оксалиловую кислоту, др. 5-членный азотосодержащий гетероцикл понимают, как обозначающий насыщенную,моноциклическую, 5-членную группу, содержащую 1, 2 или 3 гетероатома, один из этих гетероатомов представляет собой атом азота, и присутствующие дополнительные гетероатомы выбирают из атомов кислорода, азота и серы. Предпочтительными 5-членными азотсодержащими гетероциклами являются пирролидинильная и тиазолидинильная группы. Соединения формулы (I), в которой R2 представляет собой атом водорода, существуют в двух таутомерных формах, представленных формулами (Iа) и (Ib) в которой представляет собой 5-членный азотсодержащий гетероцикл, необязательно замещенный цианогруппой,Ak представляет собой линейную или разветвленную (С 1-С 6)алкиленовую цепь,Х представляет собой одинарную связь или фениленовую группу,R1 и R2, которые могут быть одинаковыми или различными, каждый представляет собой которые обe образуют общую часть изобретения. Соединения формулы (I), в которой R3 представляет собой атом водорода, существуют которые обе образуют общую часть изобретения. Предпочтительными соединениями формулы (I) являются те, в которых представляет собой 1-пирролидинильную группу, необязательно замещенную цианогруппой, или 1,3-тиазолидин-3-ильную группу, необязательно замещенную цианогруппой. Предпочтительными соединениями формулы (I) являются те, в которых конфигурация-амидной функции представляет собой (S). Преимущественный аспект изобретения относится к соединениям формулы (I), в которой Ak представляет собой группу (CH2)4. Другой преимущественный аспект изобретения относится к соединениям формулы (I), в представляет собой 1-пирроликоторой динильную группу, замещенную цианогруппой,или 1,3-тиазолидин-3-ильную группу, замещенную цианогруппой, а Ak представляет собой группу (CH2)3. Еще один преимущественный аспект изобретения относится к соединениям формулы (I),в которой Х представляет собой одинарную связь. Еще один преимущественный аспект изобретения относится к соединениям формулы (I),в которой Y представляет собой группу NR4, в которой R4 представляет собой атом водорода или линейную или разветвленную (C1-С 6)алкильную группу. Еще один преимущественный аспект изобретения относится к соединениям формулы (I),в которой R3 представляет собой нитрогруппу. Среди предпочтительных соединений по изобретению можно упомянуть более конкретноN-(4S)-4-амино-5-[(2S)-2-циано-1-пирролидинил]-5-оксопентил-N'-нитрогуанидин, его таутомеры, оптические изомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой,N-(5S)-5-амино-6-[(2S)-2-циано-1-пирролидинил]-6-оксогексил-N'-нитрогуанидин, его таутомеры, оптические изомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой, иN-(5S)-5-амино-6-(1,3-тиазолидин-3-ил)6-оксогексил-N'-нитрогуанидин, его таутомеры, оптические изомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой. 4 Изобретение относится к способу получения соединений формулы (I), который отличается тем, что соединение формулы (II) в которой Ak и Х имеют значения, указанные для формулы (I), P1 представляет собой защитную группу для аминофункции, и P2 представляет собой защитную группу для аминофункции, отличную от группы Р 1,подвергают реакции с соединением формулы (III) в которой имеет значение, указанное для формулы (I),при обычных условиях пептидного связывания,с получением после депротекции соединения формулы (IV)P1, Ak и X имеют значения,указанные здесь ранее,которое затем переводят при помощи традиционных в органической химии реакций после депротекции, где это необходимо, в соединение формулы (I),которое очищают, при необходимости, по традиционной методике очистки, которое разделяют при желании на оптические изомеры по традиционной методике разделения и которое переводят при желании в его аддитивные соли с фармацевтически приемлемой кислотой. Соединение формулы (Iе), частный случай соединения формулы (I), в которой, R1, Ak и Х имеют значения, указанные для формулы (I),также можно получать реакцией соединения формулы (V) в которой Р 1, Ak и Х имеют значения, указанные здесь ранее, 5 которое подвергают реакции с соединением формулы (III) при традиционных условиях пептидного связывания,с получением после депротекции, где это необходимо, соединения формулы (Iе), которое очищают, где это необходимо, по традиционной методике очистки, которое разделяют при желании на оптические изомеры по традиционной методике разделения и которое переводят при желании в его аддитивные соли с фармацевтически приемлемой кислотой. Кроме того, что они новы, соединения по настоящему изобретению имеют ценные фармакологические свойства. Они имеют дипептидилпептидазо IV-ингибирующие свойства, которые делают их полезными при лечении непереносимости глюкозы и расстройств, связанных с гипергликемией, таких как диабет типа II или ожирение. Изобретение также относится к фармацевтическим композициям, включающим в качестве активного ингредиента по меньшей мере одно соединение формулы (I) совместно с одним или более подходящими инертными, нетоксичными эксципиентами. Среди фармацевтических композиций по изобретению можно упомянуть более конкретно те, которые пригодны для орального, парентерального (внутривенного,внутримышечного или подкожного) или назального применения, таблетки или драже, подъязычные таблетки, желатиновые капсулы, пастилки, суппозитории, инъекционные препараты,питьевые суспензии, пр. Полезная дозировка может варьироваться в зависимости от природы и сложности расстройства, графика приема, а также возраста и веса пациента и каких-либо связанных лечений. Дозировка варьируется от 0,5 мг до 2 г на 24 ч за один или более приемов. Нижеследующие примеры иллюстрируют изобретение, но не ограничивают его никоим образом. Применяемые исходные материалы представляют собой известные соединения или получаются по известным способам. Структуры соединений, описанных в примерах, определяли согласно обычным спектрометрическим методикам (инфракрасный, ЯМР,масс-спектрометрия). Выражение "соединение конфигурации(2) или (2)" понимают как обозначающие соединение, выбираемое из соединений абсолютных конфигураций (2R) и (2S), что следует понимать, что если соединение (2) представляет собой соединение абсолютной конфигурации(2R), то соединение (2) представляет собой соединение (2S). Пример 1. Гидрохлорид N-(4S)-4-aмино-5[(2S)-2-циано-1-пирролидинил]-5-оксопентил-N'нитрогуанидина. 6 Стадия А. N-(4S)-4-[(терт-Бутилоксикарбонил)-амино]-5-[(2S)-2-циано-1-пирролидинил]5-оксопентил-N'-нитрогуанидин. 10 ммоль (2S)-2-цианопирролидина, 10 ммоль 1-гидроксибензотриазола и 10 ммоль дициклогексилкарбодиимида добавляют к 10 ммоль N2(терт-бутилоксикарбонил)-N5-[(имино)(нитроамино)метил]орнитина, растворенного в диметилформамиде. После перемешивания на протяжении ночи при комнатной температуре образовавшуюся дициклогексилмочевину отфильтровывают и затем диметилформамид удаляют при помощи выпаривания. Полученный остаток очищают при помощи хроматографии на кремнеземе (элюант: дихлорометан/этанол 95/5) с получением ожидаемого продукта. Стадия В. Гидрохлорид N-(4S)-4-aмино-5[(2S)-2-циано-1-пирролидинил]-5-оксопентил-N'нитрогуанидина. 4 Н раствор соляной кислоты в диоксане добавляют к 10 ммоль соединения, полученного на предыдущей cтадии, растворенного в диоксане. После перемешивания на протяжении 24 ч при комнатной температуре растворитель удаляют при помощи выпаривания, добавляют воду и раствор лиофилизируют с получением ожидаемого продукта. Элементарный микроанализ: С% Н%N -(тepт-бyтилoкcикapбoнил)орнитил]пирролидин. Ожидаемый продукт получают по способу,описанному для стадии А примера 1, исходя из(S)-N3-(бензилоксикарбонил)-N2-(терт-бутилоксикарбонил)орнитина и пирролидина. Стадия В. 1-[(S)-N2-(тepт-Бyтилокcикаpбoнил)opнитил]nиppoлидин. 10 ммоль соединения, полученного на предыдущей стадии, растворенного в этаноле,гидргенируют в присутствии 10% палладия-науглероде при комнатной температуре и температуре окружающей среды на протяжении 6 ч. Реакционную смесь затем фильтруют и выпаривают и затем, после добавления воды, лиофилизируют с получением ожидаемого продукта. Стадия С. N-(4S)-4-[(терт-Бутилоксикарбонил)амино]-5-(1-пирролидинил)-5-оксопентилN'-цианогуанидин. Ожидаемый продукт получают согласно способу, описанному в Synthesis 1975, 332, исходя из соединения, полученного на предыдущей cтадии, и NaN(CN)2. Стадия D. Cесквигидрохлорид N-[(4S)-4 аминo-5-(1-пирролидинил)-5-оксопентил]-N'-цианогуанидина. 7 Ожидаемый продукт получают по способу,описанному для cтадии В примера 1, исходя из соединения, полученного на предыдущей стадии. Элементарный микроанализ: С% Н%Cl% Расчетный 43,03 7,06 27,37 17,32 Обнаруженный 43,26 7,23 26,82 16,85 Пример 3. N-[(4S)-4-Амино-5-(1,3-тиазолидин-3-ил)-5-оксопентил]-N'-цианогуанидин. Стадия А. 3-(S)-N5-(тepт-Бyтилoкcикapбoнил)-N2-[(9H-флуopeн-9-ил-метокси)карбонил] орнитил-1,3-тиазолидин. Ожидаемый продукт получают согласно способу, описанному на стадии А примера 1,исходя из (S)-N5-(тepт-бyтилoкcикapбoнил)-N2[(9 Н-флyopeн-9-ил-мeтoкcи)карбонил]орнитин и 1,3-тиазолидина. Стадия В. Гидрохлорид 3-(S)-N2-[(9Hфлуорен-9-ил-мeтoкcи)кapбoнил]орнитил-1,3 тиазолидина. Ожидаемый продукт получают по способу,описанному для стадии В примера 1, исходя из соединения, полученного на предыдущей стадии. Стадия С. N-[(4S)-4-Амино-5-(1,3-тиазолидин-3-ил)-5-оксопентил]-N'-цианогуанидин. Ожидаемый продукт получают согласно способу, описанному в Synthesis 1975, 332, исходя из соединения, полученного на предыдущей cтадии, и NaN(CN)2. Элементарный микроанализ: С% Н%S% Расчетный 44,43 6,71 31,08 11,86 Обнаруженный 44,41 6,68 30,18 10,52 Пример 4. Гидрохлорид N-[(5S)-5-aмино-6-(1 пирролидинил)-6-оксогексил]-N'-цианогуанидина. Ожидаемый продукт получают согласно способу, описанному в примере 2, заменяя (S)N5-(бензилоксикарбонил)-N2-(терт-бутилоксикарбонил)орнитин на (S)-1N-(бензилоксикарбонил)N2-(терт-бутилоксикарбонил)лизин. Пример 5. Дигидрохлорид N'-[(4S)-4-aмино 5-(1-пирролидинил)-5-oкcoпeнтил]-N2-метил-2 нитpo-1,1-этилендиамина. Стадия А. 1-[(S)-N5-(Бeнзилoкcикapбoнил)2N -(тepт-бyтилoкcикapбoнил)орнитил]пирролидин. Ожидаемый продукт получают по способу,описанному для стадии А примера 1, исходя из(S)-N5-(бензилоксикарбонил)-N2-(терт-бутилоксикарбонил)орнитина и пирролидина. Стадия В. 1-[(S)-N-(терт-Бутилоксикарбонил)орнитил]пирролидин. 10 ммоль соединения, полученного на предыдущей стадии, растворенного в этаноле, гидрогенизируют в присутствии 10% палладия-науглероде при комнатной температуре и давлении окружающей среды на протяжении 6 ч. Реакционную смесь затем фильтруют и выпаривают и затем, после добавления воды, лиофилизируют с получением ожидаемого продукта. 8 Стадия С. N'-(4S)-4-[(терт-Бутилоксикарбонил)амино]-5-(1-пирролидинил)-5-оксопентилN2-метил-2-нитро-1,1-этилендиамин. Ожидаемый продукт получают согласно способу, описанному в Bioorg. Med. Chem. 1997,7 (23), 3045-3048, исходя из соединения, полученного на предыдущей стадии, и N-метил-1 метилтио-2-нитроэтиленамина. Стадия D. Дигидрохлорид N1-[(4S)-4-aмино 5-(1-пирролидинил)-5-оксопентил]-N2-метил-2 нитро-1,1-этилендиамина. Ожидаемый продукт получают по способу,описанному для стадии В примера 1, исходя из соединения, полученного на предыдущей стадии. Элементарный микроанализ: С% Н%N -(тepт-бyтилoкcикapбoнил)орнитил]пирролидин. Ожидаемый продукт получают по способу,описанному для стадии А примера 1, исходя из(S)-N5-(бензилоксикарбонил)-N2-(терт-бутилоксикарбонил)орнитина и пирролидина. Стадия В. 1-[(S)-N2-(терт-Бутилоксикарбонил)орнитил]пирролидин. 10 ммоль соединения, полученного на предыдущей стадии, растворенного в этаноле, гидрогенизируют в присутствии 10% палладия-науглероде при комнатной температуре и давлении окружающей среды на протяжении 6 ч. Реакционную смесь затем фильтруют и выпаривают и затем, после добавления воды, лиофилизируют с получением ожидаемого продукта. Стадия С. N-(4S)-4-[(терт-Бутилоксикарбонил)амино]-5-(1-пирролидинил)-5-оксопентилN"-циано-N'-метиллгуанидин. Ожидаемый продукт получают согласно способу, описанному в Сhеm. Pharm. Bull. 1997,45 (1), 53-61, исходя из соединения, полученного на предыдущей cтадии, N-цианоимидо-S,Sдиметилдитиокарбоната и метиламина. Стадия D. Гидрохлорид N-[(4S)-4-aмино-5(1-пирролидинил)-5-оксопентил]-N"-циано-N'метилгуанидина. Ожидаемый продукт получают по способу,описанному для cтадии В примера 1, исходя из соединения, полученного на предыдущей стадии. Масс-спектрометрия:[М+Cl]+=301; [М-Н]-=265. Пример 7. Гидрохлорид N-(4S)-4-aмино-5[(4R)-4-циано-1,3-тиазолидин-3-ил]-5-оксопентилN'-нитрогуанидина. Ожидаемый продукт получают согласно способу, описанному в примере 1, заменяя (2S)-2 цианопирролидин на (4R)-4-циано-1,3-тиазолидин. 9 Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 34,14 5,16 27,87 9,11 10,08 Обнаруженный 34,32 5,11 27,70 9,23 10,44 Пример 8. Гидрохлорид N-(4S)-4-амино 5-[(2 а)-2-циано-1,3-тиазолидин-3-ил]-5-оксопентил-N'-нитрогуанидина. Стадия А. Гидрохлорид N-(4S)-4-[(тертбутилоксикарбонил)амино]-5-[2-карбамоил-1,3 тиазолидин-3-ил]-5-оксопентил-N'-нитрогуанидина. Ожидаемый продукт получают по способу,описанному для стадии А примера 1, заменяя(2S)-2-цианопирролидин на -1,3-тиазолидин 2-карбоксамид. Стадия В. Гидрохлорид N-(4S)-4-[(тертбутилоксикарбонил)амино]-5-[(2)-2-карбамоил 1,3-тиазолидин-3-ил]-5-оксопентил-N'-нитрогуанидина. Смесь диастереоизомеров, полученную на предыдущей cтадии А, разделяют при помощи хроматографии на кремнеземе (элюант: дихлорометан/метанол/NН 4OН 90/10/0,5). Ожидаемый продукт является первым из изомеров, отделенных таким образом. Стадия С. N-(4S)-4-[(терт-Бутилоксикарбонил)амино]-5-[(2)-2-циано-1,3-тиазолидин 3-ил]-5-оксопентил-N'-нитрогуанидин. 20 ммоль имидазола добавляют к 10 ммоль соединения, полученного на предыдущей cтадии, растворенного в пиридине, и затем реакционную смесь охлаждают до -30 С и по каплям добавляют 40 ммоль РОСl3. Температуру затем в течение часа доводят до -20 С. Затем удаляют пиридин при помощи выпаривания, а остаток растворяют в этилацетате. Раствор промывают,сушат и выпаривают и полученный остаток очищают при помощи хроматографии на кремнеземе (элюант: дихлорометан/мета-нол/NН 4OН 95/5/0,5) с получением ожидаемого продукта. Стадия D. Гидрохлорид N-(4S)-4-аминo5-[(2)-2-циано-1,3-тиазолидин-3-ил]-5-оксопентил-N'-нитрогуанидина. Ожидаемый продукт получают по способу,описанному для cтадии В примера 1, исходя из соединения, полученного на предыдущей стадии С. Элeментарный микроaнaлиз: С% Н% N% S% Cl% Расчетный 34,14 5,16 27,87 9,11 10,08 Обнаруженный 34,41 4,93 27,67 9,35 9,71 Пример 9. Гидрохлорид N-(4S)-4-aмино-5[(2S)-2-циано-1,3-тиазолидин-3-ил]-5-оксопентилN'-нитрогуанидина. Ожидаемый продукт получают по способу,описанному для cтадий С и D примера 8, исходя из второго из диастереоизомеров, выделенного на стадии В примера 8. Масс-спектрометрия: LC/ESI/HR и MS/MS: 10 Пример 10. Гидрохлорид N-[(5S)-5-aмино-6-(1 пирролидинил)-6-оксогексил]-N'-нитрогуанидина. Ожидаемый продукт получают согласно способу, описанному в примере 1, исходя из N2 терт-бутилоксикарбонил)-N6-[(имино)(нитроамино)метил]лизина и пирролидина. Пример 11. Гидрохлорид N-(5S)-5-аминo6-[(2S)-2-циано-1-пирролидинил]-6-оксогексилN'-нитрогуанидина. Ожидаемый продукт получают согласно способу, описанному в примере 1, исходя из N2(терт-бутилоксикарбонил)-N6-[(имино)(нитроамино)метил]лизина и (2S)-2-цианопирролидина. Элементарный микроанализ: С% Н%Cl% Расчетный 41,44 6,38 28,19 10,19 Обнаруженный 41,66 6,31 27,78 10,18 Пример 12. Гидрохлорид N-[(5S)-5-aмино 6-(1,3-тиазолидин-3-ил)-6-оксогексил]-N'-нитрогуанидина. Ожидаемый продукт получают согласно способу, описанному в примере 1, исходя из N2(терт-бутилоксикарбонил)-N6-[(имино)(нитроамино)метил]лизина и 1,3-тиазолидина. Масс-спектрометрия: [М+H]+=305, [М-Н]-=303. Пример 13. Гидрохлорид N-(5S)-5-aмино-6[(4R)-4-циано-1,3-тиазолидин-3-ил]-6-оксогексилN'-нитрогуанидина. Ожидаемый продукт получают согласно способу, описанному в примере 1, исходя из N2(терт-бутилоксикарбонил)-N6-[(имино)(нитроамино)метил]лизина и (4R)-4-циано-1,3-тиазолидина. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 36,11 5,51 26,80 8,76 9,69 Обнаруженный 36,36 5,49 26,68 8,81 10,04 Пример 14. Гидрохлорид N-(5S)-5-aмино 6-[(2)-2-циано-1,3-тиазолидин-3-ил]-6-oкcoгeкcил-N'-нитpoгyaнидинa. Стадия А. Гидрохлорид N-(5S)-5-[(терт-бутилоксикарбонил)амино]-6-[2-карбамоил-1,3-тиазолидин-3-ил]-6-оксогексил-N'-нитрогуанидина. Ожидаемый продукт получают по способу,описанному для cтадии А примера 1, исходя изN2-(терт-бутилоксикарбонил)-N6-[(имино)(нитроамино)метил]лизина и -1,3-тиазолидин-2-карбоксамида. Стадия В. Гидрохлорид N-(5S)-5-[(тертбутилоксикарбонил)амино]-6-[(2)-2-карбамоил 1,3-тиазолидин-3-ил]-6-оксогексил-N'-нитрогуанидина. Смесь диастереоизомеров, полученную на предыдущей cтадии А, разделяют при помощи хроматографии на крeмнеземе (элюант: дихлорометан/метанол/NTLiOH 90/10/0,5). Ожидаемый продукт является первым из диастереоизомеров, выделенных таким образом. 11 Стадия С. Гидрохлорид N-(5S)-5-aмино-6[(2)-2-циано-1,3-тиазолидин-3-ил]-6-оксогексилN'-нитрогуанидина. Ожидаемый продукт получают по способу,описанному для cтадий С и D примера 8, исходя из соединения, полученного на предыдущей стадии. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 36,11 5,51 26,80 8,76 9,69 Обнаруженный 36,52 5,49 26,85 9,26 9,51 Пример 15. Гидрохлорид N-(5S)-5-амино 6-[(2)-2-цианo-1,3-тиазолидин-3-ил]-6-оксогексил-N'-нитрогуанидина. Ожидаемый продукт получают по способу,описанному для cтадий С и D примера 8, исходя из второго из диастереоизомеров, выделенных на стадии В примера 14. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 36,11 5,51 26,80 8,76 9,69 Обнаруженный 36,50 5,49 26,00 9,66 9,66 Пример 16. Сесквигидрохлорид N-(4S)-4aмино-5-[(2S)-2-циано-1-пирролидинил]-5-оксопентил-N'-цианогуанидина. Ожидаемый продукт получают согласно способу, описанному в примере 2, исходя из (S)N5-(бензилоксикарбонил)-N2-(терт-бутилоксикарбонил)орнитина и (2S)-2-цианопирролидина. Элементарный микроанализ: С% Н%Cl% Расчетный 43,03 7,06 27,37 17,32 Обнаруженный 43,26 7,23 26,82 16,85 Пример 17. Гидрохлорид N-(5S)-5-aмино 6-[(2S)-2-циано-1-пирролидинил]-6-оксогексилN'-цианогуанидина. Ожидаемый продукт получают согласно способу, описанному в примере 2, исходя из (S)N6-(бензилоксикарбонил)-N2-(терт-бутилоксикарбонил)лизина и (2S)-2-цианопирролидина. Масс-спектрометрия: [М+Н]+=292, [М-Н]-=290. Пример 18. Гидрохлорид N-[(5S)-5-aмино 6-(1,3-тиазолидин-3-ил)-6-оксогексил]-N'-цианогуанидина. Ожидаемый продукт получают согласно способу, описанному в примере 2, исходя из (S)N6-(бензилоксикарбонил)-N2-(терт-бутилоксикарбонил)лизина и 1,3-тиазолидина. Пример 19. Дигидрохлорид N1-[(4S)-4-aмино 5-(1,3-тиазолидин-3-ил)-5-оксопентил]-N2-метил 2-нитрo-1,1-этилендиамина. Ожидаемый продукт получают согласно способу, описанному в примере 5, исходя из (S)N5-(бензилоксикарбонил)-N2-(терт-бутилоксикарбонил)орнитина и 1,3-тиазолидина. Элементарный микроанализ: Пример 20. Дигидрохлорид N1-(5S)-5-aмино 6-(1-пирролидинил)-6-oкcoгeкcил]-N2-мeтил-2 нитpo-1,1-этилeндиaминa. Ожидаемый продукт получают согласно способу, описанному в примере 5, исходя из (S)N6-(бензилоксикарбонил)-N2-(терт-бутилоксикарбонил)лизина и пирролидина. Элементарный микроанализ: С% Н%Cl% Расчетный 41,94 7,31 18,81 19,05 Обнаруженный 41,87 7,26 18,34 19,75 Пример 21. Дигидрохлорид N1-(5S)-5 аминo-6-[(2S)-2-цианoпиppoлидинил]-6-oкcoгeкcил-N2-метил-2-нитpo-1,1-этилендиамина. Ожидаемый продукт получают по способу,описанному в примере 5, исходя из (S)-N6-(бензилоксикарбонил)-N2-(терт-бутилоксикарбонил) лизина и (2S)-2-цианопирролидина. Масс-спектрометрия: ESI/FIA/HR и MS/MS:[М+H]+=325; [М+Na]+=347. Пример 22. Дигидрохлорид N1-[(5S)-5 аминo-6-(1,3-тиазoлидин-3-ил)-6-oкcoгeксил]-N2 метил-2-нитрo-1,1-этилендиамина. Ожидаемый продукт получают согласно способу, описанному в примере 5, исходя из (S)N6-(бензилоксикарбонил)-N2-(терт-бутилоксикарбонил)лизина и 1,3-тиазолидина. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 36,93 6,46 17,94 8,22 18,17 Обнаруженный 37,08 6,49 17,17 8,11 18,63 Пример 23. Дигидрохлорид N-(4S)-4aмино-5-[(2S)-2-циано-1-пирролидинил]-5-оксопентил-N"-циано-N'-метилгуанидина. Ожидаемый продукт получают согласно способу, описанному в примере 6, исходя из (S)N5-(бензилоксикарбонил)-N2-(терт-бутилоксикарбонил)орнитина и (2S)-2-цианопирролидина. Пример 24. Гидрохлорид N-[(4S)-4-aмино 5-(1,3-тиазолидин-3-ил)-5-оксопентил]-N"-цианоN'-мeтилгyaнидинa. Ожидаемый продукт получают согласно способу, описанному в примере 6, исходя из (S)N5-(бензилоксикарбонил)-N2-(терт-бутилоксикарбонил)орнитина и 1,3-тиазолидина. Пример 25. Гидрохлорид N-[(5S)-5-aмино 6-(1-пирролидинил)-6-оксогексил]-N-циано-N'метилгуанидина. Ожидаемый продукт получают согласно способу, описанному в примере 6, исходя из (S)N6-(бeнзилoкcикapбoнил)-N2-(тepт-бyтилoкcикapбoнил)лизинa и пирролидина. Пример 26. Гидрохлорид N-(5S)-5-aмино 6-[(2S)-2-циано-1-пирролидинил]-6-оксогексилN"-циано-N'-метилгуанидина. 13 Ожидаемый продукт получают согласно способу, описанному в примере 6, исходя из (S)N6-(бензилоксикарбонил)-N2-(терт-бутилоксикарбонил)лизина и (2S)-2-цианопирролидина. Пример 27. Гидрохлорид N-[(5S)-5-aмино 6-(1,3-тиазолидин-3-ил)-6-оксогексил]-N"-цианоN'-метилгуанидина. Ожидаемый продукт получают согласно способу, описанному в примере 6, исходя из (S)N6-(бензилоксикарбонил)-N2-(терт-бутилоксикарбонил)лизина и 1,3-тиазолидина. Пример 28. Гидрохлорид N-4-[(2S)-2aмино-3-2S)-2-циано-1-пирролидинил)-3-оксопропил]фенил-N"-циано-N'-метилгуанидина. Ожидаемый продукт получают согласно способу, описанному в примере 6, исходя из (S)4-[(бензилоксикарбонил)амино]-N2-(терт-бутилоксикарбонил)фенилаланина и (2S)-2-цианопирролидина. Пример 29. Гидрохлорид N-4-[(2S)-2 амино-3-оксо-3-(1-пирролидинил)пропил]фенилN'-нитрогуанидина. Стадия А. 4-[(2S)-2-[(терт-Бутилоксикарбонил)амино]-3-оксо-3-(1-пирролидинил)пропил] анилин. Ожидаемый продукт получают по способу,описанному для стадии А примера 1, исходя из(2S)-2-[(терт-бутилоксикарбонил)амино]-3-(4-аминофенил)пропановой кислоты и пирролидина. Стадия В. N-4-[(2S)-2-[(терт-Бутилоксикарбонил)амино]-3-оксо-3-(1-пирролидинил)пропил]фенил-N'-нитрогуанидин. Ожидаемый продукт получают реакцией соединения, полученного на предыдущей cтадии с N-метил-N'-2-диоксогидразинкарбоксимидогидразид-2-оксидом, согласно способу, описанному в J. Am. Chem. Soc. 1949, 71, 1968-1970. Стадия С. Гидрохлорид N-4-[(2S)-2-амино 3-оксо-3-(1-пирролидинил)пропил]фенил-N'нитрогуанидина. Ожидаемый продукт получают по способу,описанному для стадии В примера 1, исходя из соединения, полученного на предыдущей стадии В. Элeмeнтaрный микроанализ: С% Н%Cl% Расчетный 47,13 5,93 23,55 9,94 Обнаруженный 48,06 5,77 23,60 10,00 Пример 30. Дигидрохлорид N-[(6S)-6aмино-7-(1,3-тиазолидин-3-ил)-7-оксогептил]-N'нитрогуанидина. Ожидаемый продукт получают согласно способу, описанному в примере 29, исходя из 14 Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 34,73 6,28 22,09 8,43 15,84 Обнаруженный 34,78 6,19 21,24 8,58 15,56 Пример 31. Гидрохлорид N-[(6S)-6-aмино 7-[(2S)-2-циано-1-пирролидинил]-7-оксогептил]N'-нитрогуанидина. Ожидаемый продукт получают согласно способу, описанному в примере 29, исходя изCl% Расчетный 43,15 6,69 27,10 9,80 Обнаруженный 43,75 6,59 26,93 9,94 Пример 32. Гидрохлорид N-4-[(2S)-2aмино-3-оксо-3-[(2S)-2-циано-1-пирролидинил] пропил]фенил-N'-нитрогуанидина. Ожидаемый продукт получают согласно способу, описанному в примере 29, исходя из(2S)-2-[(терт-бутилоксикарбонил)амино]-3-(4-аминофенил)пропановой кислоты и (2S)-2-цианопирролидина. Фармакологическое изучение соединений по изобретению Пример 33. Ингибирование дипептидилпептидазы IV in vitro. Влияние соединений на энзиматическую активность DPP IV in vitro оценивают, как описано ниже. Энзим, полученный из свиной почки,подвергают анализу при помощи хромогенного субстрата, 1,4 мМ глицилпролил-n-нитроанилида, который гидролизируют, чтобы высвободитьn-нитроанилин, который поглощается при 405 нм. Активность энзима определяли по поглощению, в присутствии различных концентраций оцениваемого соединения (в основном, от 10-4 до 10-9 М). Полученные данные позволяют определить эффективную дозу для 50% ингибирования контрольной активности (IС 50). Соединения по изобретению имеют IС 50 от 1 нМ до 10 М. Пример 34. Фармацевтическая композиция. Формула для приготовления 1000 таблеток, каждая из которых содержит по 10 мг активного ингредиента: Соединение по примеру 1 10 г Гидроксипропилцеллюлоза 2 г Пшеничный крахмал 10 г Лактоза 100 г Стеарат магния 3 г Тальк 3 г в которой представляет собой 5-членный азотсодержащий гетероцикл, необязательно замещенный цианогруппой,Ak представляет собой линейную или разветвленную (С 1-С 6)алкиленовую цепь,Х представляет собой одинарную связь или фениленовую группу,R1 и R2, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу,Y представляет собой NR4 или CH-NО 2,R4 представляет собой атом водорода, линейную или разветвленную (C1-С 6)алкильную группу,R3 представляет собой группу, выбираемую из линейного или разветвленного (С 1-С 6)алкила, нитро и циано,если Y представляет собой CH-NO2, или группу, выбираемую из нитро и циано, если Y представляет собой NR4,его таутомеры, если они существуют, оптические изомеры и их аддитивные соли с фармацевтически приемлемой кислотой,за исключением соединений, в которых одновременно представляет собой незамещенный 5-членный азотосодержащий гетероцикл, Ak представляет собой группу-(СН 2)3-, Х представляет собой одинарную связь, Y представляет собой NH и R3 представляет собой нитрогруппу, термин 5-членный азотосодержащий гетероцикл понимают как обозначающий насыщенную, моноциклическую, 5-членную группу, содержащую 1, 2 или 3 гетероатома, один из этих гетероатомов представляет собой атом азота и присутствующие дополнительные гетероатомы выбирают из атомов кислорода, азота и серы. 2. Соединение формулы (I) по п.1, в которой представляет собой 1-пирролидинильную группу, необязательно замещенную цианогруппой, или 1,3-тиазолидин-3-ильную группу,необязательно замещенную цианогруппой. 3. Соединения формулы (I) либо по п.1,либо по п.2, в которой конфигурацияамидной функции представляет собой (S). 4. Соединение формулы (I) по любому из пп. с 1 до 3, в которой Ak представляет собой группу (СН 2)4. 16 5. Соединение формулы (I) по любому из пп. с 1 по 3, в которой представляет собой 1-пирролидинильную группу, замещенную цианогруппой, или 1,3-тиазолидин-3-ильную группу, замещенную цианогруппой, и Ak представляет собой группу (СН 2)3. 6. Соединение формулы (I) по любому из пп. с 1 по 5, в которой Х переставляет собой одинарную связь. 7. Соединение формулы (I) по любому из пп. с 1 по 6, в которой Y представляет собой группу NR4, в которой R4 представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу. 8. Соединение формулы (I) по любому из пп. с 1 по 7, в которой R3 представляет собой нитрогруппу. 9. Соединение формулы (I) по п.1, которое представляет собой N-(4S)-4-амино-5-[(2S)-2 циано-1-пирролидинил]-5-оксопентил-N'-нитрогуанидин, и его оптические изомеры, его таутомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой. 10. Соединение формулы (I) по п.1, которое представляет собой N-(5S)-5-амино-6[(2S)-2-циано-1-пирролидинил]-6-оксогексилN'-нитрогуанидин, и его оптические изомеры,его таутомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой. 11. Соединение формулы (I) по п.1, которое представляет собой N-(5S)-5-амино-6-(1,3 тиазолидин-3-ил)-6-оксогексил-N'-нитрогуанидин, и его оптические изомеры, его таутомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой. 12. Способ синтеза соединений формулы(I) по п.1, который отличается тем, что соединение формулы (II) в которой Ak и Х имеют значения, указанные для формулы (I), Р 1 представляет собой защитную группу для аминофункции и Р 2 представляет собой защитную группу для аминофункции,отличную от группы P1,подвергают реакции с соединением формулы (III) в которой имеет значение, указанное для формулы (I),при обычных условиях пептидного связывания,с получением после депротекции соединения формулы (IV)P1, Ak и Х имеют значения, указанные здесь ранее,которое затем переводят при помощи традиционных в органической химии реакций после депротекции, где это необходимо, в соединение формулы (I),которое очищают, при необходимости, по традиционной методике очистки, которое разделяют при желании на оптические изомеры по традиционной методике разделения и которое 18 переводят при желании в его аддитивные соли с фармацевтически приемлемой кислотой. 13. Фармацевтическая композиция, включающая как активный ингредиент соединение по любому из пп. с 1 по 11, в комбинации с одним или более инертными, нетоксичными и фармацевтически приемлемыми носителями. 14. Фармацевтическая композиция по п.13 для применения в качестве лекарственного препарата как ингибитора дипептидилпептидазы IV для применения при лечении непереносимости глюкозы и расстройств, связанных с гипергликемией, таких как диабет типа II или ожирение. 15. Фармацевтическая композиция по п.14 для применения в качестве противодиабетного лекарственного препарата.
МПК / Метки
МПК: A61K 31/40, A61P 3/10, C07D 207/16
Метки: фармацевтические, получения, способ, содержащие, соединения, alpha;-аминокислотные, новые, композиции
Код ссылки
<a href="https://eas.patents.su/10-4865-novye-alpha-aminokislotnye-soedineniya-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-ih-soderzhashhie.html" rel="bookmark" title="База патентов Евразийского Союза">Новые α-аминокислотные соединения, способ их получения и фармацевтические композиции их содержащие</a>
Предыдущий патент: Аммоксидирование смеси кетонов в ацетонитрил и цианид водорода
Следующий патент: Метаболиты агониста/антагониста эстрогена
Случайный патент: Бытовое устройство для обработки текстильных изделий, оснащенное датчиком смещения














