Метаболиты агониста/антагониста эстрогена
Номер патента: 4866
Опубликовано: 26.08.2004
Авторы: Эгглер Джеймс Фредерик, Дэй Уэсли Уоррен, Джонсон Ким Энн, Пракаш Чандра Аггарвал
Формула / Реферат
1. Метаболит (-)-цис-6-фенил-5-[4-(2-пирролидин-1-илэтокси)фенил]-5,6,7,8-тетрагидронафталин-2-ола, который выбран из группы, состоящей из
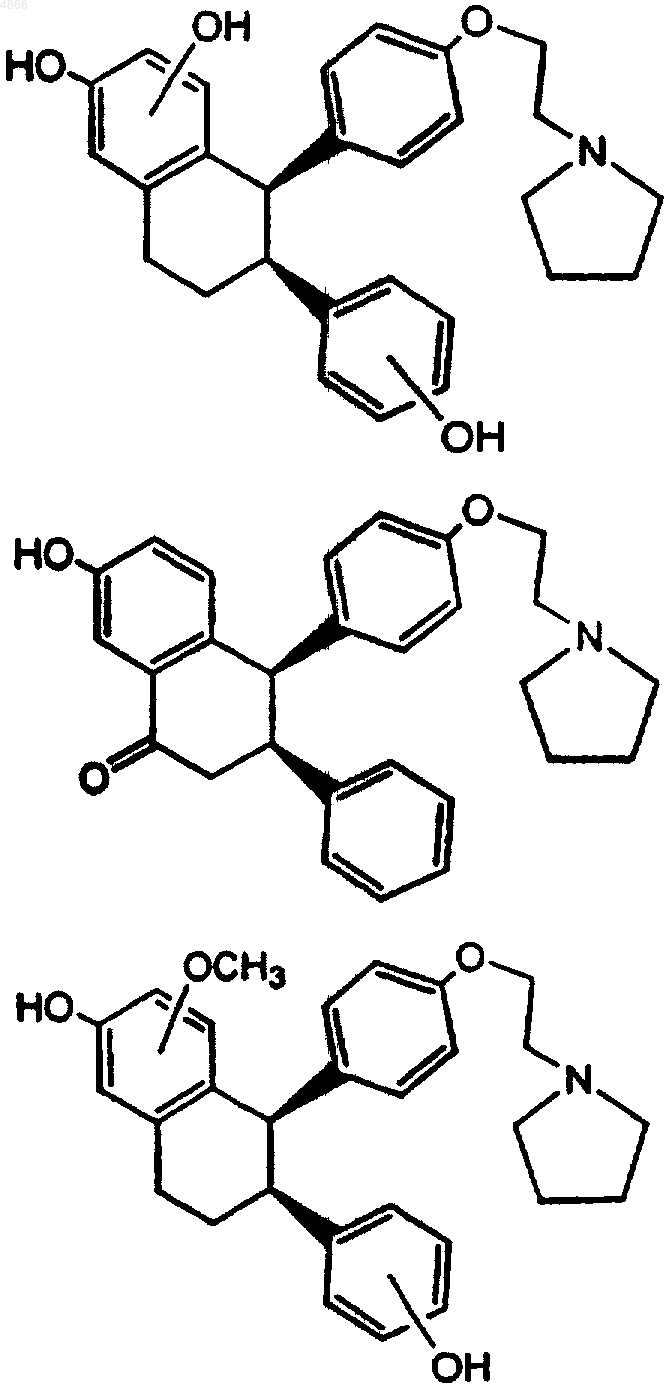
и его стереоизомеры, таутомеры, региоизомеры и конфигурационные изомеры и его фармацевтически приемлемые соли.
2. Способ лечения остеопороза, рака молочной железы, гиперлипидемии, атеросклероза, болезни Альцгеймера, катаракты, потери либидо, сексуальной дисфункции у мужчин, рака толстой кишки, кожных морщин, аутоиммунного заболевания, алопеции, угрей, сердечно-сосудистого заболевания, диабета, эндометриоза, сексуальной дисфункции у женщин, гипергликемии, ожирения, обсессивно-компульсивного расстройства, предменструального синдрома, карциномы простаты, доброкачественной гиперплазии простаты, легочной гипертензии, реперфузионного повреждения, ревматоидного артрита, остеоартрита, себореи, старческой гинекомастии, недостаточности тестостерона, синдрома Тернера, фиброза матки, атрофического вагинита, недержания, рака матки, гирсутизма, булимии, анорексии, снижения сексуальных желаний, расстройства полового возбуждения, диспареунии, вагинизма, пролапса, инфекций мочевых путей, удара, инфаркта миокарда, острой или хронической почечной недостаточности, окклюзионного поражения периферических артерий, синдрома Рейно, рака яичников, печени и поджелудочной железы, а также десмоидного рака, глиомы и карциномы клеток почек или стимуляции заживления ран, увеличения частоты оргазма, снижения вагинального pH, включающий введение субъекту, нуждающемуся в этом, эффективного количества метаболита (-)-цис-6-фенил-5-[4-(2-пирролидин-1-илэтокси)фенил]-5,6,7,8-тетрагидронафталин-2-ола, выбранного из группы, состоящей из
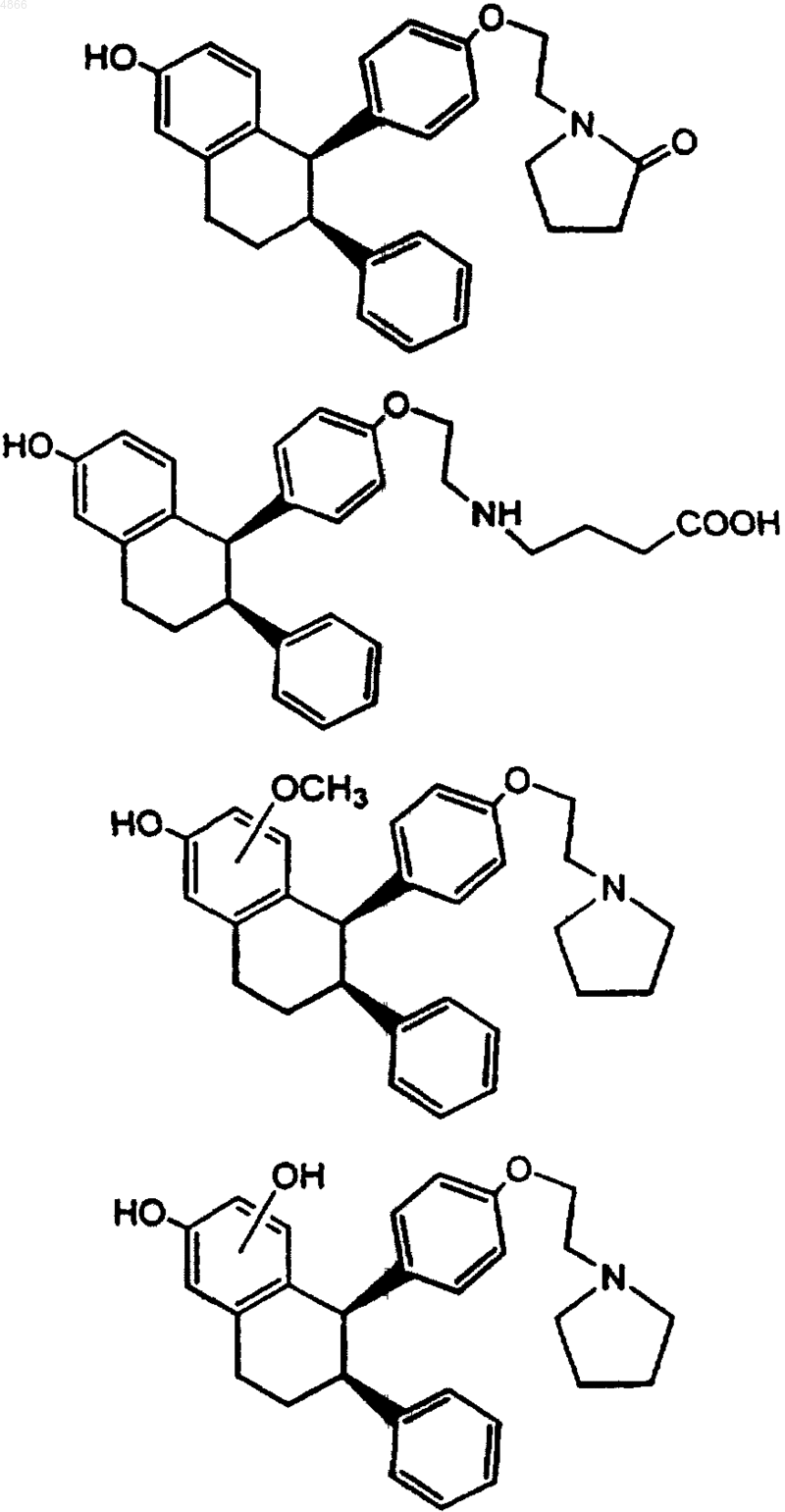
и его стереоизомеров, таутомеров, региоизомеров и конфигурационных изомеров; и его фармацевтически приемлемых солей.
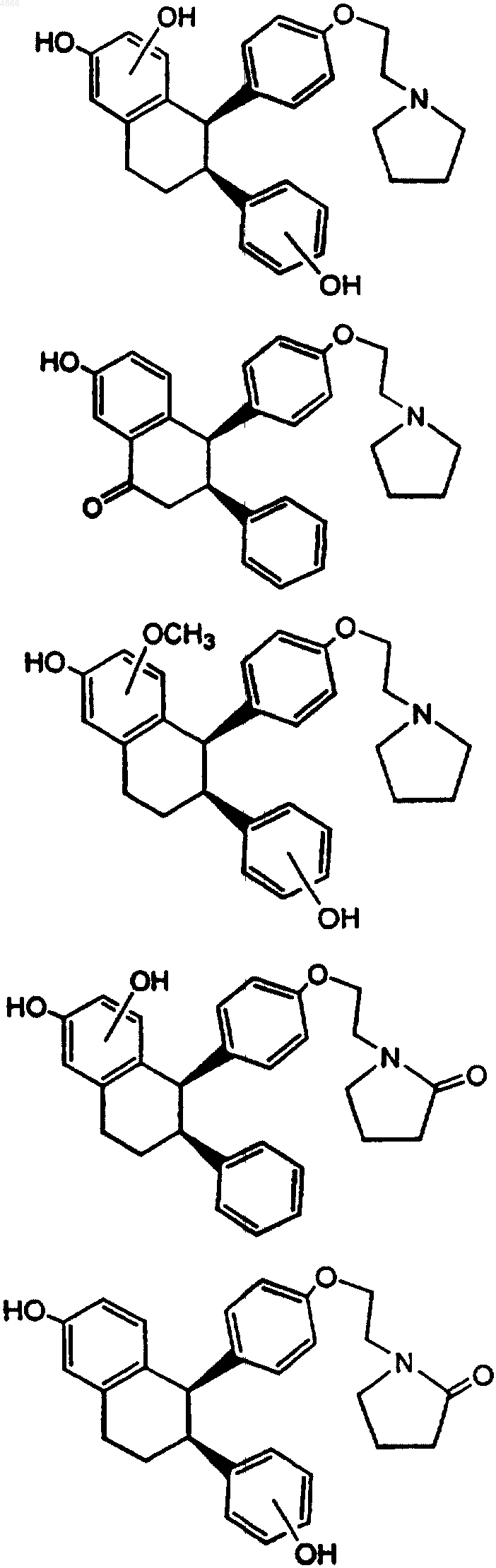
3. Фармацевтическая композиция, содержащая метаболит (-)-цис-6-фенил-5-[4-(2-пирролидин-1-илэтокси)фенил]-5,6,7,8-тетрагидронафталин-2-ола, как определено в п.2, и фармацевтически приемлемый носитель, наполнитель или разбавитель.
Текст
1 Область изобретения Данное изобретение относится к соединениям, которые являются метаболитами (-)-цис 6-фенил-5-[4-(2-пирролидин-1-илэтокси)фенил]5,6,7,8-тетрагидронафталин-2-ола, образующимися в организме млекопитающих. Соединения изобретения полезны как стандарты в аналитических исследованиях и как терапевтические агенты. Предпосылки к созданию изобретения Фармакологически (-)-цис-6-фенил-5-[4-(2 пирролидин-1-илэтокси)фенил]-5,6,7,8-тетрагидронафталин-2-ол (PPTN) является агонистом/антагонистом эстрогена, который описан в патенте США 5552412. Агонист/антагонист эстрогена представляет собой соединение, воздействующее на некоторые из тех же самых рецепторов, на которые оказывает влияние эстроген, но не обязательно на все, а в некоторых случаях указанное соединение действует как антагонист эстрогена или блокирует его. Соединение также известно как селективный модулятор рецептора эстрогена (SERM). Агонисты/антагонисты эстрогена также можно называть антиэстрогенами, хотя они проявляют некую эстрогенную активность в отношении некоторых рецепторов эстрогенов. Поэтому агонисты/антагонисты эстрогена не являются соединениями, которые обычно называют чистые антиэстрогены. Антиэстрогены, которые также могут действовать как агонисты, называют антиэстрогенами I типа. Антиэстрогены I типа активируют рецептор эстрогена для прочного связывания в ядре в течение продолжительного периода времени, но с замедленным пополнением рецепторами(Clark, et al., Steroids 1973; 22:707; Capony, et al.,Mol. Cell. Endocrinol., 1975; 3:233). Соединения данного изобретения являются метаболитами PPTN и, как полагают, обладают существенными фармакологическими активностями, подобными или идентичными активностям, которые проявляет исходное соединение, PPTN. Краткое описание фигур На фиг. 1 представлена характерная радиохроматограмма ВЭЖХ метаболитов PPTN из мочи мышей после перорального введения. На шкале вертикальной оси представлена радиоактивность-количество импульсов в минуту(СРМ). На шкале горизонтальной оси представлено время удерживания в минутах. На фиг. 2 представлена характерная радиохроматограмма ВЭЖХ метаболитов PPTN,полученных из фекалий мышей после перорального введения. На шкале вертикальной оси представлена радиоактивность-количество импульсов в минуту (СРМ). На шкале горизонтальной оси представлено время удерживания в минутах. На фиг. 3 представлена характерная радиохроматограмма ВЭЖХ циркулирующих метаболитов PPTN мышей после перорального 2 введения. На шкале вертикальной оси представлена радиоактивность-количество импульсов в минуту (СРМ). На шкале горизонтальной оси представлено время удерживания в минутах. На фиг. 4 представлены характер фрагментации и данные масс-спектрометрии метаболитаXI PPTN. На шкале вертикальной оси представлено относительное содержание. На шкале горизонтальной оси представлено соотношение массы к заряду, m/z. На фиг. 5 представлены характер фрагментации и данные масс-спектрометрии метаболитаXII PPTN. На шкале вертикальной оси представлено относительное содержание. На шкале горизонтальной оси представлено соотношение массы к заряду, m/z. На фиг. 6 представлены характер фрагментации и данные масс-спектрометрии метаболитаXXI PPTN. На шкале вертикальной оси представлено относительное содержание. На шкале горизонтальной оси представлено соотношение массы к заряду, m/z. На фиг. 7 представлены характер фрагментации и данные масс-спектрометрии метаболитаXIV PPTN. На шкале вертикальной оси представлено относительное содержание. На шкале горизонтальной оси представлено соотношение массы к заряду, m/z. На фиг. 8 представлены характер фрагментации и данные масс-спектрометрии метаболитаVI PPTN. На шкале вертикальной оси представлено относительное содержание. На шкале горизонтальной оси представлено соотношение массы к заряду, m/z. На фиг. 9 представлены характер фрагментации и данные масс-спектрометрии метаболитаII PPTN. На шкале вертикальной оси представлено относительное содержание. На шкале горизонтальной оси представлено соотношение массы к заряду, m/z. На фиг. 10 изображены характер фрагментации и данные масс-спектрометрии метаболитаXVI PPTN. На шкале вертикальной оси представлено относительное содержание. На шкале горизонтальной оси представлено соотношение массы к заряду, m/z. На фиг. 11 изображены характер фрагментации и данные масс-спектрометрии метаболита Х PPTN. На шкале вертикальной оси представлено относительное содержание. На шкале горизонтальной оси представлено соотношение массы к заряду, m/z. На фиг. 12 представлены характер фрагментации и данные масс-спектрометрии метаболита XVII PPTN. На шкале вертикальной оси представлено относительное содержание. На шкале горизонтальной оси представлено соотношение массы к заряду, m/z. На фиг. 13 представлены характер фрагментации и данные масс-спектрометрии метаболита IV PPTN. На шкале вертикальной оси представлено относительное содержание. На 3 шкале горизонтальной оси представлено соотношение массы к заряду, m/z. На фиг. 14 представлены характер фрагментации и данные масс-спектрометрии метаболита XV PPTN. На шкале вертикальной оси представлено относительное содержание. На шкале горизонтальной оси представлено соотношение массы к заряду, m/z. На фиг. 15 представлены характер фрагментации и данные масс-спектрометрии метаболита V PPTN. На шкале вертикальной оси представлено относительное содержание. На шкале горизонтальной оси представлено соотношение массы к заряду, m/z. На фиг. 16 представлены характер фрагментации и данные масс-спектрометрии метаболита XIII PPTN. На шкале вертикальной оси представлено относительное содержание. На шкале горизонтальной оси представлено соотношение массы к заряду, m/z. На фиг. 17 представлены характер фрагментации и данные масс-спектрометрии метаболита IX PPTN. На шкале вертикальной оси представлено относительное содержание. На шкале горизонтальной оси представлено соотношение массы к заряду, m/z. На фиг. 18 представлены характер фрагментации и данные масс-спектрометрии метаболита VIII PPTN. На шкале вертикальной оси представлено относительное содержание. На шкале горизонтальной оси представлено соотношение массы к заряду, m/z. Краткое изложение изобретения Данное изобретение относится к соединениям, которые являются метаболитами агониста/антагониста эстрогена, PPTN. Второй аспект изобретения относится к фармацевтическим композициям, содержащим метаболит PPTN или его оптический или геометрический изомер, или его фармацевтически приемлемую соль, N-оксид, сложный эфир, соль четвертичного аммония и фармацевтически приемлемый носитель, наполнитель или разбавитель. Третий аспект изобретения относится к способам лечения заболевания, включающим введение эффективного количества метаболитаPPTN, обладающего фармакологической активностью, или его фармацевтически приемлемой соли, N-оксида, сложного эфира, соли четвертичного аммония. Метаболиты PPTN оказываются эффективными, так как по существу снижают существующую возможность возникновения побочных эффектов, ассоциированных с применением эстрогена. Четвертый аспект данного изобретения заключается в обеспечении набором для использования потребителем для лечения заболевания. Набор содержит а) метаболит PPTN, образующийся в организме млекопитающего; и, необязательно, b) инструкции, описывающие способ применения метаболита PPTN для лечения за 004866 4 болевания. В инструкциях также может быть указано, что набор применяется для лечения заболевания, так как по существу снижает существующую вероятность возникновения побочных эффектов, связанных с введением эстрогена. Пятый аспект изобретения относится к наборам для применения в качестве аналитических стандартов для определения метаболитовPPTN или их фармацевтически приемлемых солей, N-оксидов, сложных эфиров и солей четвертичного аммония. Наборы содержат по существу чистую форму метаболита PPTN и контейнер для хранения метаболита. Как шестой аспект, в данном изобретении предусматривают применение метаболитовPPTN млекопитающего или их фармацевтически приемлемых солей, N-оксидов, сложных эфиров и солей четвертичного аммония для производства лекарственного средства. Подробное описание изобретения Данное изобретение относится к метаболитам PPTN. Метаболиты соответствуют соединениям, представленным формулой IR2, R3, R4 и R7 являются одинаковыми или различными и выбраны из Н и OR5; a(b) R2 означает ОН или ОСН 3 и R3 и R7 означают Н, или если R1 является таким, как определено выше в (а), и(c) R2 и R7 означают Н, а R3 соответствует ОН или ОСН 3,тогда R4 не является Н. Предпочтительные соединения формулы I включают соединения, в которыхR2, R3, R4 и R7 являются одинаковыми или различными и выбраны из Н и OR5; и(b) R2 означает ОН или ОСН 3 и R3 и R7 означают Н, или, если R1 является таким, как определено выше в (а), и(c) R2 и R7 соответствуют Н, а R3 означает ОН или ОСН 3,тогда R4 не является Н. Предпочтительные метаболитные соединения PPTN включают соединения, приведенные в качестве примеров в табл. 1. Таблица 1 Предпочтительные метаболиты PPTN 7 Наиболее предпочтительные метаболитные соединения PPTN включают соединения,приведенные в качестве примеров в табл. 2. Таблица 2 Предпочтительные метаболиты PPTN Другой аспект данного изобретения относится к по существу чистым метаболитам PPTN,которые описаны выше. Если не указано иначе, использованы следующие определения. Используемый в описании термин лечение включает предупредительное (например,профилактическое) и паллиативное лечение, а используемый термин обработка относится к действию, обеспечивающему предупредительное и/или паллиативное лечение. Субъект означает животное, включая человека, которое можно лечить соединениями, 004866 8 композициями, способами и наборами данного изобретения. Термин субъект или субъекты предназначен для обозначения субъектов как мужского, так и женского пола, если вид пола не указан иначе. Предпочтительными субъектами являются женщины в постклимактерическом периоде. Побочные эффекты, связанные с эстрогеном у женщин включает болезненность молочной железы, рак молочной железы, метеоризм,головную боль, повышенную свертываемость крови и сильное менструальное кровотечение. Отсутствие антиэстрогенной терапии увеличивает риск карциномы эндометрия. В случае продолжительной эстрогенной терапии, женщины могут подвергаться повышенному риску, который не устраняется действующим одновременно прогестином (N. Engl. J. Med. 1995; 332:1589). У мужчин побочные эффекты эстрогена включают повышенную свертываемость крови, гинекомастию, феминизацию и сниженное либидо. Термин женщины в постклимактерическом периоде, как определено, подразумевает не только женщин соответствующего возраста,у которых протекает менопауза, но также женщин, у которых была удалена матка или по какой-то другой причине подавлено продуцирование эстрогена, таких как женщин, которые продолжительное время применяли кортикостероиды, женщин, страдающие синдромом Кушинга или которые имеют гонадную дисгенезию. Рак молочной железы определен как злокачественная пролиферация эпителиальных клеток, выстилающих протоки или дольки молочной железы. Глюкуроновая кислота означает заместитель, который переносится на метаболит или на исходное соединение, чтобы образовать метаболит из фазы II сопряженной реакции глюкуронидации. Глюкуроновая кислота вступает в реакцию с фрагментом кислоты, или спирта,или фенола на метаболите или исходном соединении с образованием глюкуронида. В описании глюкуронидный заместитель обозначен какGlu или глюкуронид. Серная кислота означает заместитель,который переносится на метаболит или на исходное соединение для образования метаболита из фазы II сопряженной реакции сульфатирования. Серная кислота вступает в реакцию с фрагментом спирта или фенола на метаболите или исходном соединении с образованием сульфата. Совместное введение комбинации метаболита PPTN и дополнительного соединения или дополнительных соединений означает, что указанные компоненты могут быть введены вместе в виде композиции или как часть одной и той же стандартной дозированной формы. Совместное введение также включает введение метаболита PPTN и дополнительного соединения или дополнительных соединений раз 9 дельно, но как часть одной и той же программы или схемы терапевтического лечения. По существу, требуемые компоненты не должны быть введены обязательно в одно и то же время, хотя могут быть введены, если так желательно. Таким образом, например, совместное введение включает введение метаболита PPTN и дополнительного соединения в виде раздельных доз или дозированных форм, но в одно и то же время. Совместное введение также включает раздельное введение в разное время и в любом порядке. Например, когда уместно, пациент может принимать один или более компонентов терапии утром и один или более других компонентов вечером. Специалист химик определит, что некоторые соединения данного изобретения будут содержать один или более атомов, которые могут находиться в определенной стереохимической,таутомерной или геометрической конфигурации, приводя к появлению стереоизомеров, таутомеров, региоизомеров и конфигурационных изомеров. Все названные изомеры и их смеси включены в данное изобретение. Также включены гидраты и сольваты соединений данного изобретения. Представляемое изобретение среди других соединений, рассматриваемых в изобретении,также включает меченные изотопами соединения, которые идентичны соединениям, представленным формулами I-XXV, если бы не факт, что один или более атомов заменены атомом, отличающимся по атомной массе или массовому числу от атомной массы или массового числа, обычно встречающихся в природе. Примеры изотопов, которые могут быть введены в соединения изобретения, включают изотопы водорода, углерода, азота, кислорода, фосфора,серы, фтора и хлора, такие как 2H, 3 Н, 13 С, 14 С,15N, 18 О, 17 О, 31 Р, 32 Р, 35S, 18F и 36Cl, соответственно. Соединения данного изобретения, их пролекарства и фармацевтически приемлемые соли названных соединений или названных пролекарств, которые содержат указанные выше изотопы и/или другие изотопы других атомов,входят в объем данного изобретения. Некоторые меченные изотопами соединения данного изобретения, например соединения, в которые включены такие радиоактивные изотопы, как 3H и 14 С, полезны в исследованиях тканевого распределения лекарственного средства и/или субстрата. Тритиевый, то есть 3H, и углерод-14, то есть 14 С, изотопы являются особенно предпочтительными вследствие легкости их получения и определения. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, то есть 2H, может предоставить определенные терапевтические преимущества, проистекающие из большей метаболической стабильности, например увеличенного периода полураспада invivo или сниженной дозовой потребности и,следовательно, может быть предпочтительным 10 при некоторых обстоятельствах. Меченные изотопами соединения формул I-XXV данного изобретения и их пролекарства обычно можно получать в результате осуществления способов,которые приведены ниже как примеры, или способами, известными в данной области. 14CPPTN может быть получен согласно способам,описанным и приведенным в качестве примера в патенте США 5552412, замещением не меченного изотопом реагента на легко доступный,меченный изотопом реагент. Метаболиты PPTN, в их по существу чистой форме или в смесях известной композиции,можно использовать как аналитические стандарты для исследований метаболизма in vitro или in vivo или как промежуточные соединения для химического синтеза или биосинтеза новых химических веществ. Метаболиты могут быть выделены в виде твердых веществ или в растворах. Полагают, что соединения данного изобретения полезны для лечения заболевания. Примеры заболеваний или состояний, в отношении которых соединения могут оказаться эффективными, включают остеопороз, рак молочной железы, гиперлипидемию, атеросклероз, болезнь Альцгеймера, катаракты, потерю либидо, сексуальную дисфункцию у мужчин, рак толстой кишки, кожные морщины, аутоиммунное заболевание, алопецию, угри, сердечно-сосудистое заболевание, диабет, эндометриоз, сексуальную дисфункцию у женщин, гипергликeмию, ожирение, обсессивно-компульсивное расстройство,предменструальный синдром, карциному простаты, доброкачественную гиперплазию простаты, легочную гипертензию, реперфузионное повреждение, ревматоидный артрит, остеоартрит, себорею, старческую гинекомастию, недостаточность тестостерона и состояния, чувствительные к повышению тестостерона, синдром Тернера, фиброз матки, атрофический вагинит,недержание, рак матки, гирсутизм, булимию,анорексию, снижение сексуальных желаний,расстройство полового возбуждения, диспареунию, вагинизм и стимуляцию заживления ран. Соединения также могут быть эффективными для увеличения частоты оргазма, лечения пролапса, снижения вагинального рН, лечения инфекций мочевых путей, лечения или предупреждения удара, инфаркта миокарда, острой или хронической почечной недостаточности,окклюзионного поражения периферических артерий и синдрома Рейно и лечения рака яичников, печени и поджелудочной железы, а также десмоидного рака, глиомы и карциномы клеток почек. Способы лечения одного или более из указанных выше заболеваний или состояний включают введение эффективного количества метаболита PPTN. В соответствии со способами лечения данного изобретения метаболит может быть введен непосредственно субъекту, например, в таблетке, или метаболит может быть применен по 11 средством его образования в организме субъекта в результате метаболизма. Например, метаболит данного изобретения может быть эффективно применен для лечения заболевания или состояния введением субъекту некоторого количества PPTN, после введения которого требуемый метаболит образуется в организме субъекта в результате метаболизма. Кроме того,когда требуется, способ введения и дозированияPPTN может быть изменен, чтобы получить желаемые концентрации и скорости продуцирования метаболита in vivo. При применении для лечения одного или более указанных выше состояний метаболитыPPTN могут быть использованы (или совместно введены раздельно или в одной и той же фармацевтической композиции) в комбинации с PPTN и статинами, такими как симвастатин, описанный в патенте США 4444784; правастатин, описанный в патенте США 4346227; церивастатин,описанный в патенте США 5502199; мевастатин, описанный в патенте США 3983140; велостатин, описанный в патенте США 4448784 и патенте США 4450171; флувастатин, описанный в патенте США 4739073; компастин, описанный в патенте США 4804770; ловастатин, описанный в патенте США 4231938; дальвастатин,описанный в заявке на eвропейский патент 738510 А 2; флуиндостатин, описанный в заявке на eвропейский патент 363934 А 1; аторвастатин, описанный в патенте США 4681893; аторвастатин кальций, описанный в патенте США 5273995; дигидрокомпактин, описанный в патенте США 4450171; ZD-4522, описанный в патенте США 5260440; бервастатин, описанный в патенте США 5082859; и NK-104,описанный в патенте США 5102888. Метаболиты PPTN также можно использовать в комбинации с бисфосфонатными соединениями, такими как алендроновая кислота, алендронат,цимадронат, клодроновая кислота, клодронат, 1 гидрокси-3-(1-пирролидинил)пропилиден-1,1-бисфосфоновая кислота, этидроновая кислота,ибандронат, неридронат, олпадронат, памидронат, пиридронат, ризедронат, тилудронат и золендронат. Кроме того, метаболиты PPTN можно использовать в комбинации со стимуляторами циклического гуанозин-3',5'-монофосфата,такими как сильденафил (цитратная соль 1-3(6,7-дигидро-1-метил-7-оксо-3-пропил-1 Н-пиразоло[4,3-d]пиримидин-5-ил)-4-этоксифенил]сульфонил]-4-метилпиперазина). Фармацевтически приемлемые аддитивные соли кислот соединений данного изобретения могут быть образованы самим соединением или любым из его сложных эфиров и включают фармацевтически приемлемые соли, которые часто используются в фармацевтической химии. Например, соли могут быть образованы с неорганическими или органическими кислотами,такими как хлористо-водородная кислота, бромисто-водородная кислота, иодисто-водородная 12 кислота, сульфоновыми кислотам, включая такие агенты, как нафталинсульфоновая, метансульфоновая и толуолсульфоновая кислоты,серная кислота, азотная кислота, фосфорная кислота, винная кислота, пиросерная кислота,метафосфорная кислота, янтарная кислота, муравьиная кислота, фталевая кислота, молочная кислота и тому подобные, наиболее предпочтительные соли образованы хлористо-водорoдной кислотой, лимонной кислотой, бензойной кислотой, малеиновой кислотой, уксусной кислотой и пропионовой кислотой. Рассмотренные выше соединения данного изобретения можно вводить в виде фармацевтически приемлемых солей. Соли обычно получают, как принято в органической химии, в результате взаимодействия соединения данного изобретения, если основное, с подходящей кислотой, такой как было описано выше. Соли быстро образуются с высоким выходом при умеренных температурах, и их часто получают просто выделением соединения из соответствующей кислотной промывки как конечной стадии синтеза. Образующую соль кислоту растворяют в подходящем органическом растворителе или водном органическом растворителе, таком как спирт, кетон или сложный эфир. С другой стороны, если требуется соединение данного изобретения в виде свободного основания, его выделяют на стадии основной конечной промывки в соответствии с обычной практикой. Предпочтительный способ получения гидрохлоридов заключается в растворении свободного основания в подходящем растворителе и высушивании раствора до конца, как над молекулярными ситами, перед барботированием через него газообразного хлористого водорода. При использовании в качестве лекарственного средства, доза соединения данного изобретения, которую следует вводить человеку, в большой степени является переменной величиной и подлежит рассмотрению наблюдающим врачом. Следует заметить, что может оказаться необходимой корректировка дозы соединения,если его вводят в виде соли, такой как лаурат,образующий соль фрагмент которого имеет соответствующую молекулярную массу. Обычный диапазон эффективных вводимых доз соединений составляет приблизительно от 0,001 до 200 мг/день. Предпочтительный диапазон составляет приблизительно от 0,01 до 100 мг/день. Конечно, часто оказывается целесообразным вводить суточную дозу соединения по частям, в различное время дня. Однако, в любом случае,количество вводимого соединения будет зависеть от таких факторов, как растворимость активного компонента, используемой композиции и способа введения. Способ введения соединений данного изобретения не является существенным. Соединения могут всасываться из пищеварительного тракта, однако, соединения могут быть введены 13 чрескожно или, если требуется в определенном случае, в виде суппозиториев для всасывания в прямой кишке. Можно использовать все из обычных видов композиций, включая таблетки, жевательные таблетки, капсулы, растворы, парентеральные растворы, пастилки, суппозитории и суспензии. Композиции готовят так, чтобы они содержали суточную дозу или соответствующую часть суточной дозы в дозированной единице, которая может быть отдельной таблеткой,или капсулой, или удобным объемом жидкости. Вообще, все композиции получают согласно способам, обычно используемым в фармацевтической химии, и/или выделяют в результате реакций метаболизма in vivo или invitro, таких как реакции, приведенные в качестве примеров в описании. Исходное соединение,PPTN, получают по способам, которые описаны и/или приведены в качестве примера в патенте США 5552412. Метаболиты могут быть синтезированы непосредственно или могут быть образованы в результате ферментативных или метаболических реакций in vivo или in vitro, таких как реакции, описанные в примерах. Способы приготовления лекарственных средств хорошо известны в данной области и описаны, например, в Remington: The Scienceand Practice of Pharmacy, Mack Publishing Company, Easton, Pa., 19th Edition (1995). Фармацевтические композиции для применения согласно данному изобретению могут быть в виде стерильных, апирогенных жидких растворов или суспензий, покрытых капсул, суппозиториев,лиофилизированных порошков, трансдермальных пластырей или других форм, известных в данной области. Капсулы готовят смешиванием соединения с подходящим разбавителем и заполнением капсул надлежащим количеством смеси. Обычные разбавители включают инертные порошкообразные вещества, такие как крахмал многих различных видов, порошкообразную целлюлозу,главным образом, кристаллическую и микрокристаллическую целлюлозу, сахара, такие как фруктоза, маннит и сахароза, зерновую муку и подобные годные в пищу порошки. Таблетки получают в результате непосредственного прессования, влажного гранулирования или сухого гранулирования. Таблеточные композиции обычно включают разбавители,связующие вещества, смазки и дезинтеграторы,а также соединение. Обычные разбавители включают, например, различные типы крахмалов, лактозу, маннит, каолин, фосфат или сульфат кальция, неорганические соли, такие как хлорид натрия, и порошкообразный сахар. Также используются порошкообразные производные целлюлозы. Типичные связующие вещества таблеток представляют собой такие вещества,как крахмал, желатин и сахара, такие как лактоза, фруктоза, глюкоза и тому подобное. Также оказываются подходящими природные и синте 004866 14 тические смолы, включая аравийскую камедь,альгинаты, метилцеллюлозу, поливинилпирролидин и тому подобное. Также в качестве связующих веществ могут служить полиэтиленгликоль, этилцеллюлоза и воски. В таблеточной композиции может быть необходима смазка для предохранения таблетки и пресс-формы от прилипания к матрице. Смазку выбирают из таких скользких твердых веществ, как тальк, стеарат магния или кальция,стеариновая кислота и гидрогенизированное растительное масло. Таблеточные дезинтеграторы представляют собой вещества, которые способствуют распаду таблетки с высвобождением соединения,когда таблетка становится влажной. Дезинтеграторы включают крахмалы, глины, целлюлозы, альгины и смолы, точнее, кукурузный и картофельный крахмал, метилцеллюлозу, агар, бентонит, древесную целлюлозу, порошкообразную природную губку, катионообменные смолы,альгиновую кислоту, гуаровую камедь, мякоть цитруса и карбоксиметилцеллюлозу, например,также можно использовать лаурилсульфат натрия. Таблетки часто покрывают сахаром в качестве вкусового вещества и герметика или образующими пленку защитными агентами, чтобы модифицировать растворимость таблетки. Соединения также могут быть приготовлены в виде жевательных таблеток в результате использования в композиции больших количеств имеющих приятный вкус веществ, таких как маннит, которые в настоящее время хорошо известны в данной области. Если желательно вводить соединения в виде суппозиториев, можно применять обычные основы. Традиционной основой суппозиториев является масло какао, которое может быть модифицировано добавлением восков, чтобы немного повысить его точку плавления. Широко используются смешивающиеся с водой основы суппозиториев, включающие, в частности, полиэтиленгликоли с различными молекулярными массами. Действие соединений может быть замедленным или пролонгированным в результате соответствующего приготовления. Например,медленно растворимая гранула соединения может быть получена и введена в таблетку или капсулу. Способ можно улучшить созданием гранул с несколько отличающимися скоростями растворения и заполнением капсул смесью гранул. Таблетки и капсулы можно покрывать пленкой, которая препятствует растворению в течение установленного периода времени. Даже парентеральные препараты можно сделать препаратами длительного действия посредством растворения или суспендирования соединения в маслянистом или эмульгирующем наполнителе,которые позволяют ему очень медленно распределяться в сыворотке. 15 Термин пролекарство подразумевает соединения, которые трансформируются in vivo,чтобы образовать соединение данного изобретения. Трансформация может происходить посредством различных механизмов, таких как гидролиз в крови. Хорошее обсуждение применения пролекарств представлено Т. Higuchi andPergamon Press, 1987. Например, если соединение данного изобретения содержит функциональную группу карбоновой кислоты, пролекарство может включать сложный эфир, образованный замещением атома водорода кислотной группы на такую группу, как (C1-C8)алкил, (С 2-С 12)алканоилоксиметил, 1-(алканоилокси)этил, содержащие от 4 до 9 атомов углерода, 1-метил-1-(алканоил)этил,содержащий от 5 до 10 атомов углерода, алкоксикарбонилоксиметил, содержащий от 3 до 6 атомов углерода, 1-(алкоксикарбонилокси)этил,содержащий от 4 до 7 атомов углерода, 1-метил 1-(алкоксикарбонилокси)этил, содержащий от 5 до 8 атомов углерода, N-(алкоксикарбонил)аминометил, содержащий от 3 до 9 атомов углерода, 1-(N-(алкоксикарбонил)амино)этил, содержащий от 4 до 10 атомов углерода, 3-фталидил,4-кротонолактонил, гамма-бутиролактон-4-ил, диN,N-(C1-C2)алкиламино(С 2-С 3)алкил (такой как диметиламиноэтил), карбамоил(С 1-С 2)алкил, N,Nди(C1-C2)алкилкарбамоил(C1-C2)алкил и пиперидино-, пирролидино- или морфолино(C2-С 3)алкил. Аналогично, если соединение данного изобретения содержит функциональную группу спирта, пролекарство может быть образовано замещением атома водорода спиртовой группы на такую группу, как (C1-C6)алканоилоксиметил, 1-C1-C6)алканоилокси)этил, 1-метил-1C1-C6)алканоилокси)этил, (C1-C6)алкоксикарбонилоксиметил, N-(C1-C6)алкоксикарбониламинометил, сукциноил, (C1-C6)алканоил, -амино(C1C4)алканоил, арилацил и -аминоацил или аминоациламиноацил, в которых каждая группа -аминоацила независимо выбрана из природных L-аминокислот, Р(O)(ОН)2, -Р(O)(О)C1C6)алкил)2 или гликозила (радикал, полученный после удаления гидроксильной группы гемиацетальной формы углевода). Если соединение данного изобретения содержит функциональную группу амина, пролекарство может быть образовано замещением атома водорода в аминной группе такой группой, как Rx-карбонил, RxO-карбонил, NRxRx,карбонил, в которых Rx и Rx каждый независимо, означают (C1-C10) алкил, (C3-C7)циклоалкил,бензил, или Rx-кapбoнил означает природный аминоацил или природный -аминоацилприродный -аминоацил, -С(ОН)С(O)OYx, в котором (Yx означает Н, (C1-C6)алкил или бен 004866 16 зил), -С(ОYx0)Yx1, в котором Yx0 означает (C1C4)алкил и Yx1 означает (C1-C6)алкил, карбокси(C1-C6)алкил, амино(C1-C46)алкил или моноN- или ди-N,N-(C1-C6)алкиламиноалкил, -C(Yx2)Yx3,в котором Yx2 означает Н или метил и Yх 3 соответствует моно-N- или ди-N,N-(C1-C6)алкиламино, морфолино, пиперидин-1-ил или пирролидин-1-ил. Используемый в описании термин эффективное количество подразумевает количество соединения данного изобретения, которое способно лечить определенные заболевания и патологические состояния. Конкретная доза соединения, вводимая согласно данному изобретению, конечно будет определяется особыми обстоятельствами, сопровождающими заболевание, включающими, например, вводимое соединение, способ введения, состояние субъекта и тяжесть патологического состояния, которое лечат. Благоприятно, что данное изобретение также предусматривает наборы для использования потребителем для лечения заболевания. Наборы содержат а) фармацевтическую композицию, содержащую агонист/антагонист эстрогена и фармацевтически приемлемый носитель, наполнитель или разбавитель; и, необязательно,b) инструкции, описывающие способ применения фармацевтической композиции для лечения конкретного заболевания. Инструкции также могут указывать, что набор предназначен для лечения заболевания, так как значительно снижает существующую вероятность возникновения побочных эффектов, связанных с применением эстрогена. Набор, который используют для настоящего применения, включает контейнер, содержащий отдельные единичные дозированные формы, такие как отдельный флакон или отдельный пакет из фольги. Контейнер может быть любой общепринятой формы или вида,известных в данной области, который изготовлен из фармацевтически подходящего материала, например может быть бумажной или картонной коробкой, стеклянным или пластиковым флаконом или банкой, повторно закрываемым мешком (например, чтобы держать заправку таблеток для помещения в другой контейнер) или упаковкой блистеров с индивидуальными дозами, выдавливаемыми из упаковки в соответствии с терапевтической схемой. Используемый контейнер может зависеть от заключенной в нем точной дозированной формы, например обычную картонную коробку обычно не следует использовать для содержания жидкой суспензии. Вероятно, в одной упаковке можно использовать вместе более одного контейнера для продажи единичной дозированной формы. Например, таблетки можно поместить во флакон, который, в свою очередь, помещен в коробку. Примером такого набора является так называемая блистерная упаковка. Блистерные упа 17 ковки хорошо известны в упаковочной индустрии и широко используются для упаковки фармацевтических единичных дозированных форм(таблеток, капсул и тому подобное). Блистерные упаковки обычно состоят из полосок относительно жесткого материала, покрытого фольгой,предпочтительно из прозрачного гибкого материала. Во время процесса упаковки в гибкой фольге делают углубления. Углубления имеют размер и форму индивидуальных таблеток или капсул, которые следует упаковать, или могут иметь размер и форму для размещения многочисленных таблеток и/или капсул, которые надо упаковать. Затем таблетки или капсулы размещают в углублениях соответствующим образом и пластину из относительно жесткого материала закрывают гибкой фольгой, которую располагают напротив поверхности, в которой сделаны углубления. Как результат, таблетки или капсулы оказываются индивидуально или совокупно закрытыми, как необходимо, в углублениях между гибкой фольгой и пластиной. Предпочтительно, прочность пластины должна быть такой,чтобы таблетки или капсулы можно было удалить из блистерной упаковки, оказывая давление на углубления, вручную, в результате чего образуется отверстие в пластине на месте углубления. Затем таблетку или капсулу удаляют через образованное отверстие. Желательно предусмотреть письменное,памятное пособие, которое является типичным пособием, содержащим информацию и/или инструкции для врачей, фармацевтов или субъектов, например, в виде чисел рядом с таблетками или капсулами, причем числа соответствуют дням схемы приема, по которой указанные таблетки и капсулы следует принимать, или картой,которая содержит такого же рода информацию. Другим примером подобного памятного пособия является календарь, отпечатанный на карте,например, следующим образом: Первая неделя. Понедельник, Вторник,и так далее. Вторая неделя. Понедельник, Вторник,и так далее. Другие варианты памятных пособий легко выявляются. Суточная доза может составлять одну таблетку или капсулу или несколько таблеток или капсул, которые следует принимать в день. Другой особый аспект набора представляет собой распределительное приспособление,предназначенное для распределения суточной дозы по времени. Предпочтительно, распределительное устройство снабжено памяткой с тем,чтобы способствовать соответствию схеме приема лекарства. Примером такой памятки является механический счетчик, который указывает число суточных доз, которые распределены. Другим примером названной памятки является запоминающее устройство микрочипа,снабженного батареей, соединенной со считывающим жидкокристаллическим устройством,или звуковой сигнал напоминания, который, 004866 18 например, считывает данные, что последняя суточная доза принята, и/или напоминает, когда следует принять следующую дозу. На основании данного описания и формулы изобретения специалистам в данной области будут очевидны определенные модификации композиций и способов, представленных в описании. Полагают, что прилагаемая формула изобретения охватывает такие модификации. Все цитируемые в описании ссылки и патенты включены в него посредством ссылок. Примеры В описании использованы следующие сокращения. НОАс Уксусная кислотаTHN Тетрагидронафталин Пример 1. Связывание рецептора эстрогена. Сродство связывания эстрогена и метаболита PPTN измеряли по следующему протоколу. Клонирование кДНК ER человека. Кодирующую область ER человека клонировали с помощью RT-PCR (RT-ПЦР) из мРНК раковых клеток молочной железы человека, используя высокоточную систему PCRExpand в соответствии с инструкциями производителя (Boehringer-Mannheim, Indianapolis,IN). Продукты PCR клонировали с использованием клонирующего набора pCR2. 1 ТА (Invitrogen, Carlsbad, СА) и секвенировали. Каждую область, кодирующую рецептор, субклонировали в экспрессирующий вектор pcDNA3 млекопитающего (Invitrogen, Carlsbad, СА). Экспрессия клеток млекопитающего. Рецепторные белки сверхэкспрессируются в клетках 293 Т. Названные клетки, происходящие из клеток НЕК 293 (АТСС, Manassas, VA),были получены генно-инженерным способом для стабильной экспрессии большого Т антигена и поэтому могли реплицировать плазмиды,содержащие ориджин SV40 репликации с высоким числом копий. Клетки 293 Т трансфицировали или hER-pcDNA3, или hER-pcDNA3,используя липофектамин, как описано производителем (Gibco/BRL, Bethesda, MD). Клетки собирали в забуференный фосфатом физиологический раствор (PBS) с 0,5 мМ EDTA через 48 ч после трансфекции. Клеточные осадки промывали 1 раз PBS/EDTA. Цельные клеточные лизаты получали гомогенизированием в буфереTEG (50 мМ трис рН 7,4, 1,5 мМ EDTA, 50 мМNaCl, 10% глицерин, 5 мМ DTT, 5 мкг/мл апро 19 тинина, 10 мкг/мл лейпептина, 0,1 мг/мл Pefabloc (Pentapharm AG, Basel, Switzerland), используя гомогенизатор Даунса. Экстракты центрифугировали при 100000 х g в течение 2 ч при 4 С и собирали супернатанты. Определяли концентрации общего белка, используя реагентBioRad (BioRad, Hercules, CA). Исследование конкурентного связывания. Способность метаболитов PPTN ингибировать связывание [3 Н]-эстрадиола определяли посредством исследования конкурентного связывания, используя покрытый декстраном древесный уголь, как описано (Leake RE, Habib F 1987 Steroid hormone receptors: assay and characterization. In: B. Green and R.E. Leake (eds). Steroid Hormones a Practical Approach. IRL Press Ltd,Oxford. 67-92). Экстракты клеток 293 Т, экспрессирующие или hER, или hER, инкубировали в присутствии увеличивающихся концентраций метаболита PPTN и фиксированной концентрации [3 Н]-эстрадиола (141 мкKи/ммоль, NewEngland Nuclear, Boston, MA) в 50 мМ трис-НСl,рН 7,4, 1,5 мМ EDTA, 50 мМ NaCl, 10% глицерине, 5 мМ DTT, 0,5 мг/мл -лактоальбумина в конечном объеме 0,2 мл. Все метаболиты PPTN растворяли в диметилсульфоксиде или водном растворителе. Конечная концентрация рецептора составляла 50 пМ с 0,5 нМ [3 Н]-эстрадиола. Через 16 ч при 4 С добавляли покрытый декстраном древесный уголь (20 мкл). Через 15 мин при комнатной температуре древесный уголь удаляли центрифугированием и присутствие радиоактивного лиганда в супернатанте определяли сцинтилляционным счетчиком. Все реагенты получали от фирмы Sigma (ST. Louis,МО), если не указано иначе. Пример 2. Ингибирование роста клеток опухоли молочной железы человека in vitro.In vitro тестировали антипролиферативное действие метаболитов PPTN, используя два типа линий раковых клеток молочной железы человека: первая, клетки MCF-7, содержащие ER, а также рецепторы прогестерона (PgR), и вторая,клетки MDA-MB-231, в которых отсутствуютER и PgR и с помощью которых возможно определение эффекта, который не зависит от ERмеханизма. Влияние метаболитов PPTN на рост указанных разных клеточных линий определяли посредством инкубации клеток с различными концентрациями агониста/антагониста эстрогена в течение 6 дней. Затем антипролиферативное действие определяли прямым подсчетом клеток. Пример 3. Биосинтез метаболитов PPTN у мыши. Дозу 14C-PPTN готовили в виде суспензии в 0,5% метилцеллюлозе (об./об.) в концентрации приблизительно 0,898 мг/г. Содержащий определенную дозу раствор исследовали с повторами до и после введения дозы. Метаболиты 20 ной жидкостной хроматографии (HPLC; ВЭЖХ) с определением радиоактивности и идентифицировали с помощью жидкостной хроматографии с масс-спектрометрией/масс-спектрометрического анализа (ЖХ/МС/МС). Для приведенного примера группе мышейCD-1 (N=9/пол, 25-30 г) вводили дозу при пероральном кормлении через желудочный зонд и мышей содержали отдельно по группам из 3 животных на клетку (3/пол) в метаболических клетках Nalgene (Nalge Nunc International,Rochester, NY) для отдельного сбора мочи и фекалий. Трубку для кормления через зонд взвешивали до и после введения дозы, чтобы определить точную дозу, полученную каждым животным. Из каждой клетки мочу, фекалии и смывы из клеток количественно собирали в предварительно взвешенные опытные контейнеры в течение 7 дней в периоды 0-24, 24-48,48-72, 72-96, 96-120, 120-144 и 144-168 ч после введения дозы. Регистрировали вес мочи, фекалий и промыва клеток, полученных в различные временные точки. Образцы мочи и фекалий разделяли и хранили до исследования при -20 С в темноте. Для идентификации циркулирующих метаболитов второй группе животных (N=6/пол,25-30 г) давали дозу с помощью перорального кормления через желудочный зонд. Во второй указанной группе по 3 животных каждого пола умерщвляли через 1 и 4 ч после введения дозы препарата и собирали кровь в гепаринизированные пробирки. Мочу (приблизительно 3 мл из 0-48-часового пула) от каждой группы центрифугировали и супернатант переносили в чистые пробирки и концентрировали упариванием в атмосфере азота. Остаток растворяли приблизительно в 1 мл подвижной фазы ВЭЖХ и аликвоту (80-100 мкл) подвергали ВЭЖХ без дальнейшей очистки. Гомогенаты фекалий (2 г) от животных,полученные через 0-72 ч после введения дозы,объединяли на основании массы, собранной в каждый временной интервал, и объединенные образцы разбавляли ацетонитрилом (6 мл). Суспензию перемешивали в течение ночи на магнитной мешалке и центрифугировали. Супернатант удаляли, а экстракцию повторяли с метанолом (6 мл) и смесью метанол:вода (50:50, 6 мл). Все супернатанты объединяли и небольшие аликвоты подсчитывали. Органический растворитель выпаривали, используя испаритель модели Turbo Vap. Остаток растворяли приблизительно в 1 мл смеси метанол:ацетат аммония(1:1). Аликвоту (20-50 мкл) подвергали ВЭЖХ. Объединенную плазму (2 мл, 1 и 4 ч) разбавляли 4 мл ацетонитрила и осажденный белок удаляли центрифугированием. Осадок промывали дополнительными 2 мл ацетонитрила и оба супернатанта объединяли. Супернатанты концентрировали на испарителе, а остаток растворяли в 500 мкл смеси метанол:ацетат аммония (1:1). Аликвоту (100 мкл) подвергали ВЭЖХ. 21 ВЭЖХ проводили с использованием четырехходового насоса системы Hewlett Packard(Hewlett Packard, Palo Alto, California), снабженного детектором радиоактивности (-RAM,IN/US Systems, Inc., Tampa, FL). Хроматографию проводили на колонке С-18 Beckman Ultrasphere (4,6 мм х 250 мм, 5 мкм) (BeckmanCoulter, Inc., Fullerton, CA) с двухкомпонентной смесью: 10 мМ ацетат аммония (растворитель А) и метанол (растворитель В). Подвижная фаза первоначально состояла из смеси растворитель А/растворитель В (80:20), затем ее линейно перепрограммировали на смесь растворитель А/растворитель В (20:80) в течение 30 мин и потом перепрограммировали на смесь растворитель А/растворитель В (5:95) за 5 мин и поддерживали в течение 5 мин. Состав подвижной фазы возвращали к исходной смеси растворителей в течение 5 мин. Систему оставляли для уравновешивания приблизительно в течение 15 мин до осуществления следующего введения. Для всех анализов использовали скорость течения 1,0 мл/мин. Количественное определение метаболитов проводили посредством измерения радиоактивности индивидуальных пиков, которые разделены с помощью ВЭЖХ, используя детектор радиоактивности. Детектор радиоактивности давал интегрированную распечатку числа импульсов в минуту (СРМ) и процент радиоактивно меченого материала, а также изображение пика. Радиоактивный детектор действовал по способу подсчета в гомогенной сцинтилляционной жидкости с добавлением 3 мл/мин подвижная фазасовместимый сцинтилляционный коктейль к эфлюенту после УФ-детекции. Идентификацию метаболитов проводили на колонке Finnigan TSQ 7000 LC/MS/MS(Thermo Quest, San Jose, CA). Эфлюент с колонки ВЭЖХ делили на части и приблизительно 50 мкл/мин вводили в масс-спектрометрический источник ионизации при атмосферном давлении через пневматически включаемое приспособление электроспрея. Оставшийся эфлюент направляли в проточную кювету детектора радиоактивности. Ответ детектора радиоактивности регистрировали в режиме реального времени посредством системы обработки данных массспектрометра, которая обеспечивала одновременное выявление радиоактивности и данных масс-спектрометрии. Задержка ответа между двумя детекторами составляла 0,2 мин относительно зарегистрированного ранее массспектрометрического ответа. Приспособление электроспрея работало приблизительно при 4000 В и масс-спектрометр работал в позитивном моде. Исследование диссоциации, индуцированной соударением (CID), проводили, используя газ аргон при энергии соударения приблизительно 30-40 эВ и давлении газа соударения приблизительно 2,3 мтор.C-PPTN (тартрат) получали с удельной активностью приблизительно 1,93 мКи/ммоль. Для участия в исследовании отбирали нормальных здоровых мужчин в возрасте между 18 и 45 годами. Субъекты приходили в клиническую лабораторию приблизительно за 12 ч до введения препарата и оставались под медицинским наблюдением, по крайней мере, в течение 576 ч после приема препарата. Все субъекты постились, по крайней мере, в течение 12 ч до получения однократной дозы приблизительно 20 мг эквивалента свободного основания 14CPPTN (80 мKи/субъект). Дозу вводили любым способом утром. Стандартную пищу давали через 4 ч. Дозируемый препарат готовили суспендированием радиоактивно меченого PPTN в воде. Требовалось, чтобы субъекты воздерживались от лежания, принятия пищи или питья напитков, содержащих кофеин и карбонаты, в течение первых 4 ч после введения. После введения дозы вещества через 24 и 48 ч отбирали достаточное количество крови,чтобы получить 20 мл плазмы для идентификации метаболитов. Во все образцы вводили метку и немедленно замораживали. Образцы плазмы (20 мл), взятые от каждого субъекта через 24 и 48 ч после введения дозы вещества, смешивали с 40 мл ацетонитрила,встряхивали с вращением и подвергали обработке ультразвуком. Смеси центрифугировали и удаляли супернатанты. Осадки смешивали с 5 мл ацетонитрила, центрифугировали и два супернатанта объединяли. Супернатанты концентрировали до сухого состояния в атмосфере азота. Остаток растворяли в 300 мкл смеси метанол/вода (1:1), центрифугировали, чтобы удалить нерастворимые вещества, и 100 мкл аликвоты наносили на колонку ВЭЖХ. МетаболитыPPTN, экстрагированные из образцов плазмы,идентифицировали с помощью ВЭЖХ с обнаружением радиоактивности и посредством ЖХ/МС/МС, как описано выше в примере 3. Пример 5. Выделение и идентификация метаболитов PPTN мыши. Биосинтез метаболитов PPTN проводили на мышах по способам,описанным в примере 3. Мышам давали препарат в дозе 20 мг/кг. Мочу и фекалии собирали у одной группы мышей. Второй группе мышей вводили дозу препарата и брали кровь для выделения и идентификации циркулирующих метаболитов. Результаты исследования представлены на фиг. 1-18. На фиг. 1-3 представлены радиохроматограммы мочевых, фекальных и циркулирующих метаболитов соответственно. На фиг. 4-18 представлены характерные массспектральные данные вместе со структурным распределением метаболитов, выделенных с помощью ВЭЖХ. Пример 1. 1-2-[4-(6,7-Диметокси-3,4-дигидронафталин-1-ил)фенокси]этилпирролидин. Раствор 6,75 г (0,025 моль) 1-(2-(4-бромфенокси)этил)пирролидина в 250 мл простого эфира охлаждали до -78 С в атмосфере N2. Добавляли несколько мл ТГФ для сохранения прозрачного раствора. По каплям добавляли 16,7 мл 1,6 М н-бутиллития, поддерживая температуру ниже -70 С. После перемешивания при -78 С в течение 1 ч по каплям добавляли раствор 5 г-70 С. После перемешивания в течение 2,5 ч при -78 С реакцию гасили добавлением 100 мл 2N НСl. Реакционную смесь оставляли для нагревания до комнатной температуры и рН доводили до 7 добавлением 5N NaOH. Слой Et2O отделяли, а водный слой экстрагировали 2 разаEtOAc. Объединенные слои Et2O/EtOAc сушили над Na2SO4 и упаривали до получения 9 г неочищенного продукта, который очищали на 400 г силикагеля, элюируя смесью 95/5 CH2Cl2/MeOH,чтобы удалить исходный тетралон, и затем смесью 85/15 CH2Cl2/MeOH, с получением 3,3 г продукта. ЯМР (СDСl3) м.д.: (1,97, шир.c, 4 Н), (2,55,м, 2 Н), (2,84, т, 2 Н), (2,98, шир.с, 4 Н), (3,19, с,2 Н), (3,68, с, 3 Н), (3,84, с, 3 Н), (4,31, с, 2 Н),(5,93, т, 1 Н), (6,59, с, 1 Н), (6,73, с, 1 Н), (6,90, д,2 Н), (7,25, д, 2 Н). Масс-спектр: (исходный+1):379,8. Исходные вещества: 6,7-диметокси-1-тетралон (Aldrich, Milwaukee, WI); 1-[2-(4-бромфенокси)этил]пирролидин (Aldrich, Milwaukee, WI). Пример 2. 1-2-[4-(2-Бром-6,7-диметокси-3,4 дигидронафталин-1-ил)фенокси]этилпирролидин. К раствору 6 г (0,016 моль) 2-[4-(6,7-диметокси-3,4-дигидронафталин-1-ил)фенокси]этил пирролидина в 200 мл ДМФ в атмосфере N2 при комнатной температуре по каплям добавляли раствор 2,8 г (0,016 моль) N-бромсукцинимида в 20 мл ДМФ. Добавляли AIBN (100 мг) и реакционную смесь перемешивали в течение 1 ч,затем разбавляли водой и экстрагировалиEtOAc. Слой EtOAc сушили над Na2SO4 и упаривали, получая 7 г продукта, который использовали без очистки на следующей стадии. 24 ЯМР (ацетон-d6) м.д.: (1,73, м, 4 Н), (2,55,м, 4 Н), (2,80, м, 4 Н), (3,48, с, 3 Н), (3,80, с, 3 Н),(4,15, с, 3 Н), (6,24, с, 1 Н), (6,84, с, 1 Н), (7,00, д,2 Н), (7,13, д, 2 Н). Масс-спектр: (исходный+1):458. Пример 3. 1-2-[4-(6,7-Диметокси-2-фенил-3,4 дигидронафталин-1-ил)фенокси]этилпирролидин. Смесь 7 г (0,015 моль) 1-2-[4-(2-бром-6,7 диметокси-3,4-дигидронафталин-1-ил)фенокси] этилпирролидина, 5,6 г (0,047 моль) фенилбороновой кислоты, 620 мг (0,00054 моль) тетракис(трифенилфосфин)палладия и 7,6 г (0,072 моль) карбоната натрия в 500 мл EtOH нагревали в атмосфере азота в течение 10 ч. EtOH упаривали. Добавляли воду и EtOAc, а слой EtOAc отделяли, сушили над Nа 2SО 4 и упаривали, получая 9 г неочищенного продукта в виде масла. Масло очищали на 600 г силикагеля, элюируя смесью CH2Cl2/MeOH 9/1, с получением 3,6 г продукта. ЯМР (ацетон-d6) м.д.: (1,74, м, 4 Н), (2,60,шир.с, 2 Н), (2,71, м, 2 Н), (2,85, м, 6 Н), (3,48, с,3 Н), (3,82, с, 3 Н), (4,10, т, 2 Н), (6,35, с, 1 Н),(6,80-7,16, м, 10 Н). Масс-спектр: (исходный+1):456. Пример 4. 1-2-[4-(6,7-Диметокси-2-фенил 1,2,3,4-тетрагидронафталин-1-ил)фенокси]этил пирролидин. Раствор 3,6 г (0,0079 моль) 1-2-[4-(6,7 диметокси-2-фенил-3,4-дигидронафталин-1-ил) фенокси]этилпирролидина, 10 мл 2N НСl, 30 млH2O и 100 мл EtOH, содержащего 1,9 г гидроксида палладия на углероде, встряхивали в аппарате Парра (Parr) при 50 С в течение 15 ч в атмосфере H2, 30 psi (фунт/дюйм 2) (206843 паскаль). Реакционную смесь фильтровали, чтобы удалить катализатор, и EtOH упаривали и добавляли 5N NaOH, чтобы довести рН водной фазы до 8. Водную фазу экстрагировали EtOAc и слой EtOAc сушили и упаривали, получая 3,0 г продукта в виде желтого масла. ЯМР (ацетон-d6) м.д.: (1,65, м, 4 Н), (1,74,м, 1 Н), (1,90, д, 1 Н), (2,20, м, 1 Н), (2,53, шир.с,4 Н), (2,63, т, 2 Н), (3,00, м, 2 Н), (2,53, д, 1 Н),(3,60, с, 3 Н), (3,80, с, 3 Н), (3,93, т, 2 Н), (4,20, д,1 Н), (6,35, д, 2 Н), (6,45, с, 1 Н), (6,53, д, 2 Н),(6,68, с, 1 Н), (7,10, м, 3 Н). Масс-спектр: (исходный+1):458. Пример 5. 6-Фенил-5-[4-(2-пирролидин-1-илэтокси)фенил]-5,6,7,8-тетрагидронафталин-2,3-диол и смесь 3-метокси-7-фенил-8-[4-(2-пирролидин 1-илэтокси)фенил]-5,6,7,8-тетрагидронафталин-2 ола и 3-метокси-6-фенил-5-[4-(2-пирролидин-1 илэтокси)фенил]-5,6,7,8-тетрагидронафталин-2-ола. Раствор 2 г (0,0044 моль) 1-2-[4-(6,7-диметокси-2-фенил-1,2,3,4-тетрагидронафталин-1 ил)фенокси]этилпирролидина, 80 мл НОАс и 80 мл 48% водного НВr нагревали при 90 С в атмосфере N2 в течение 2 ч. Затем реакционную смесь охлаждали до 0 С на бане со льдом. Добавляли 30% водную NH4OH, чтобы довести рН до 10. Водную фазу экстрагировали EtOAc и 25 объединенные слои EtOAc сушили и упаривали,получая 1,6 г неочищенных продуктов. Полученный материал очищали на 120 г силикагеля,элюируя смесью CH2Cl2/MeOH 99/1, затем 90/5,затем 90/10 и, наконец, 85/15, с получением 520 мг смеси 3-метокси-7-фенил-8-[4-(2-пирролидин-1 илэтокси)фенил]-5,6,7,8-тетрагидронафталин-2 ола и 3-метокси-6-фенил-5-[4-(2-пирролидин-1 илэтокси)фенил]-5,6,7,8-тетрагидронафталин-2-ола,ЯМР (ацетон-d6) м.д.: (1,05, м, 1 Н), (1,24,д, 1 Н), (1,76, шир.с, 5 Н), (2,20, м, 1 Н), (3,00, м,4 Н), (3,31, д, 1 Н), (3,82, с, 3 Н), (4,05, т, 2 Н),(4,18, д, 1 Н), (6,34, м, 3 Н), (6,53, д, 2 Н), (6,78, с,1 Н), (7,85, д, 2 Н), (7,15, м, 3 Н), (8,20, шир.с,1 Н); Масс-спектр: (исходный+1):444,и затем 180 мг 6-фенил-5-[4-(2-пирролидин-1-илэтокси)фенил]-5,6,7,8-тетрагидронафталин-2,3-диола. ЯМР (ацетон-d6) м.д.: (1,65, м, 4 Н), (2,20,м, 1 Н), (2,50, м, 4 Н), (2,80, м, 4 Н), (2,95, м, 1 Н),(3,50, д, 1 Н), (3,95, т, 2 Н), (4,05, д, 1 Н), (6,33, м,2 Н), (6,60, д, 2 Н), (6,66, с, 1 Н), (6,84, д, 2 Н),(7,10, м, 3 Н), (7,55, с, 2 Н). Масс-спектр: (исходный+1):430. Точка плавления (т.пл.): 132-134 С. Схема 2 Пример 6. 7-Гидрокси-6-метокси-1-тетралон. Раствор 10 г (0,048 моль) 6,7-диметокси-1 тетралона в 100 мл НОАс и 100 мл 48% водного НВr нагревали при 95 С в течение 7 ч. Реакционную смесь охлаждали до комнатной температуры, и вливали в воду, и экстрагировали 26 тона нагревали при температуре кипения с обратным холодильником в течение ночи. Реакционную смесь охлаждали, вливали в воду и экстрагировали EtOAc. Слой EtOAc сушили надNa2SO4 и упаривали, получая 7 г неочищенного продукта. Кристаллизация с Et2O давала 4,13 г продукта в виде белого твердого вещества, т.пл. 110-111 С. ЯМР (СDСl3) м.д.: (2,09, м, 2 Н), (2,55, т,2 Н), (2,87, т, 2 Н), (3,90, с, 3 Н), (5,14, с, 2 Н),(6,65, с, 1 Н), (7,25-7,45, м, 5 Н), (7,58, с, 1 Н). Масс-спектр: (исходный+1):283. Пример 8. 1-2-[4-(7-Бензилокси-6-метокси-3,4 дигидронафталин-1-ил)фенокси]этилпирролидин. Используя способ, аналогичный способу примера 1, из 5,13 г (0,0182 моль) 7-бензилокси-6 метокси-3,4-дигидро-2 Н-нафталин-1-она, 13,63 мл 1,6 М н-бутиллития в гексане и 5,16 г (0,019 моль) 1-(2-(4-бромфенокси)этил)пирролидина получали 3,5 г указанного в заголовке продукта. ЯМР (СDСl3) м.д.: (2,05, шир.с, 4 Н), (2,30,м, 2 Н), (2,74, т, 2 Н), (3,10-3,40, м, 6 Н), (3,90, с,3 Н), (4,45, шир.с, 2 Н), (4,95, с, 2 Н), (5,90, т, 1 Н),(6,58, с, 1 Н), (6,74, с, 1 Н), (6,80, д, 2 Н), (7,10, д,2 Н), (7,25, м, 5 Н). Масс-спектр: (исходный+1):456. Пример 9. 1-2-[4-(7-Бензилокси-2-бром-6 метокси-3,4-дигидронафталин-1-ил)фенокси]этил пирролидин. Используя способ, аналогичный способу примера 2, из 2,47 г (0,0054 моль) 1-2-[4-(7 бензилокси-6-метокси-3,4-дигидронафталин-1-ил) фенокси]этилпирролидина, 965 мг (0,0054 моль)NBS и 90 мг AIBN в 50 мл ДМФ получали 2,37 г указанного в заголовке продукта. ЯМР (CDCl3) м.д.: (1,90, шир.с, 4 Н), (2,69,с, 4 Н), (2,88, шир.с, 4 Н), (3,10, т, 2 Н), (3,83, т,2 Н), (4,83, с, 2 Н), (6,20, с, 1 Н), (6,65, с, 1 Н),(6,90, д, 2 Н), (7,00, д, 2 Н), (7,21, м, 5 Н). Масс-спектр: (исходный+1):536. Пример 10. 1-2-[4-(7-Бензилокси-6-метокси-2-фенил-3,4-дигидронафталин-1-ил)фенокси] этилпирролидин. Используя способ, аналогичный способу примера 3, из 2,37 г (0,0044 моль) 1-2-[4-(7 бензилокси-2-бром-6-метокси-3,4-дигидронафталин-1-ил)фенокси]этилпирролидина, 1,35 мг(0,13 ммоль) тетракис(трифенилфосфин)палладия и 1,88 г (0,017 моль) Na2CO3 в 50 мл EtOH получали 1,38 г указанного в заголовке продукта. ЯМР (CDCl3) м.д.: (1,83, шир.c, 4 Н), (2,70,м, 6 Н), (2,86, м, 2 Н), (2,96, м, 2 Н), (3,90, с, 3 Н),(4,14, т, 2 Н), (6,37, с, 1 Н), (6,65-7,30, м, 15 Н). Масс-спектр: (исходный+1):532. Пример 11. 3-Метокси-7-фенил-5-[4-(2-пирролидин-1-илэтокси)фенил]-5,6,7,8-тетрагидронафталин-2-ол. Смесь 1,38 г (0,0026 моль) 1-2-[4-(7-бензилокси-6-метокси-2-фенил-3,4-дигидронафталин 1-ил)фенокси]этилпирролидина, 1,46 г гидроксида палладия на углероде, 4 мл 2N НСl, 15 млH2O и 100 мл EtOH встряхивали в аппарате Парра при 50 С в течение 36 ч в атмосфере Н 2,30 фунт/дюйм 2. Реакционную смесь фильтровали, чтобы удалить катализатор, и EtOH выпаривали. Добавляли 1N NaOH, чтобы довести рН до 8, а водную фазу экстрагировали EtOAc. СлойEtOAc сушили и упаривали, получая 640 мг указанного в заголовке продукта. ЯМР (CDCl3) м.д.: (1,80, д, 1 Н), (1,95,шир.с, 4 Н), (2,10, м, 1 Н), (2,85-3,20, м, 7 Н),(3,30, д, 1 Н), (3,88, с, 3 Н), (4,14, т, 2 Н), (6,30, д,2 Н), (6,43, с, 1 Н), (6,50, д, 2 Н), (6,68, с, 1 Н),(6,80, м, 2 Н), (7,18, м, 3 Н). Масс-спектр: (исходный+1):444. 2-ОМе, 1-ОН метаболит и 3-ОН, 2-ОМе метаболит могут быть синтезированы при использовании способов, представленных схематически на cхемах 3 и 4. Метаболит, 3-метокси-6-фенилтетрагидронафталин-2-ол, может быть синтезирован при использовании способа, представленного схематически на cхеме 5. Схема 3 Пример 12. 1-2-[4-(5,6-Диметокси-3,4-дигидронафталин-1-ил)фенокси]этилпирролидин. Используя способ, аналогичный способу примера 1, из 10 г (0,048 моль) 5,6-диметокси-1 тетралона, 33,4 мл 1,6 М н-бутиллития в гексане и 13,5 г 1-(2-(4-бромфенокси)этил)пирролидина получали 6,5 г указанного в заголовке продукта. ЯМР (CDCl3) м.д.: (1,90, шир.с, 4 Н), (2,31,м, 2 Н), (2,87, т, 2 Н), (2,90, шир.с, 4 Н), (3,10,шир.с, 2 Н), (3,78, с, 3 Н), (3,82, с, 3 Н), (4,28,шир.с, 2 Н), (5,90, с, 1 Н), (6,63, д, 1 Н), (6,70, д,1 Н), (6,90, д, 2 Н), (7,22, д, 2 Н). Масс-спектр: (исходный+1):379,8. Исходное вещество: 5,6-диметокси-1-тетралон; ссылка: Organic Process ResearchDevelopment, 1999, 3, 71-72. Пример 13. 1-2-[4-(2-Бром-5,6-диметокси-3,4 дигидронафталин-1-ил)фенокси]этилпирролидин. Используя способ, аналогичный способу примера 2, из 5,33 г (0,14 моль) 1-2-[4-(5,6 диметокси-3,4-дигидронафталин-1-ил)фенокси] этилпирролидина, 2,5 г (0,014 моль) NBS и 230 мгAIBN в 50 мл ДМФ получали 6,25 г указанного в заголовке продукта. 28 ЯМР (CDCl3) м.д.: (1,96, шир.с, 4 Н), (2,90,м, 6 Н), (3,05, т, 2 Н), (3,15, т, 2 Н), (3,80, c, 6 Н),(4,30, т, 2 Н), (6,35, д, 1 Н), (6,53, д, 1 Н), (6,95, д,2 Н), (7,10, д, 2 Н). Масс-спектр: (исходный+1):458. Пример 14. 1-2-[4-(5,6-Диметокси-2-фенил-3,4-дигидронафталин-1-ил)фенокси]этил пирролидин. Используя способ, аналогичный способу примера 3, из 6,25 г (0,0136 моль) 1-2-[4-(2 бром-5,6-диметокси-3,4-дигидронафталин-1-ил) фенокси]этилпирролидина, 4,16 г (0,034 моль) фенилбороновой кислоты, 472 мг (0,41 ммоль) тетракис(трифенилфосфин)палладия и 5,78 г(0,054 моль) Nа 2 СО 3 в 200 мл EtOH получали 6,3 г указанного в заголовке продукта. ЯМР (CDCl3) м.д.: (1,80, шир.с, 4 Н), (2,65,шир.с, 4 Н), (2,73, т, 2 Н), (2,90, т, 2 Н), (3,00, т,2 Н), (3,83, с, 6 Н), (4,08, т, 2 Н), (6,53, д, 1 Н),(6,60, д, 1 Н), (6,74, д, 2 Н), (6,95, д, 2 Н), (7,05, м,5 Н). Масс-спектр: (исходный+1):456. Пример 15. 1-2-[4-(5,6-Диметокси-2-фенил-1,2,3,4-тетрагидронафталин-1-ил)фенокси] этилпирролидин. Используя способ, аналогичный способу примера 4, из 6,3 г (0,0138 моль) 1-2-[4-(5,6 диметокси-2-фенил-3,4-дигидронафталин-1-ил) фенокси]этилпирролидина, 7,7 г (0,055 моль) гидроксида палладия на углероде, 5 мл 2N НСl и 10 мл H2O в 100 мл EtOH получали 5,06 г указанного в заголовке продукта. ЯМР (ацетон-d6) м.д.: (1,95, шир.с, 4 Н),(2,70, м, 1 Н), (2,85, шир.с, 4 Н), (2,95, м, 1 Н),(3,20, шир.с, 2 Н), (3,38, шир.с, 2 Н), (3,78, с, 3 Н),(3,82, с, 3 Н), (4,40, шир.с, 2 Н), (6,43, д, 1 Н),(6,74, д, 1 Н), (6,85-7,15, м, 7 Н). Масс-спектр: (исходный+1):458. Пример 16. 6-Фенил-5-[4-(2-пирролидин-1-илэтокси)фенил]-5,6,7,8-тетрагидронафталин-1,2-диол и смесь 2-метокси-6-фенил-5-[4-(2-пирролидин 1-илэтокси)фенил]-5,6,7,8-тетрагидронафталин-1 ола и 1-метокси-6-фенил-5-[4-(2-пирролидин-1 илэтокси)фенил]-5,6,7,8-тетрагидронафталин-2-ола. Используя способ, аналогичный способу примера 5, из 2,3 г (0,005 моль) 1-2-[4-(5,6-диметокси-2-фенил-1,2,3,4-тетрагидронафталин-1 ил)фенокси]этилпирролидина, 80 мл НОАс и 80 мл 48% водного НВr получали 650 мг смеси 2-метокси-6-фенил-5-[4-(2-пирролидин-1-илэтокси)фенил]-5,6,7,8-тетрагидронафталин-1-ола и 1 метокси-6-фенил-5-[4-(2-пирролидин-1-илэтокси) фенил]-5,6,7,8-тетрагидронафталин-2-ола,ЯМР (СDСl3) м.д.: (1,88, шир.с, 6 Н), (2,10,м, 1 Н), (2,84, шир.с, 4 Н), (3,00, шир.с, 2 Н), (3,25,дт, 1 Н), (3,35, д, 2 Н), (3,85, с, 3 Н), (4,10, шир.с,2 Н), (4,25, д, 1 Н), (6,25-6,88, м, 8 Н), (7,15, м, 3 Н); Масс-спектр: (исходный+1):444,и 140 мг 6-фенил-5-[4-(2-пирролидин-1 илэтокси)фенил]-5,6,7,8-тетрагидронафталин 1,2-диола. Масс-спектр: (исходный+1):430. Пример 17. 5-Гидрокси-6-метокси-1-тетралон. Используя способ, аналогичный способу примера 6, из 10 г (0,048 моль) 5,6-диметокси-1 тетралона, 100 мл НОАс и 100 мл 48% водного НВr получали 7 г указанного в заголовке продукта, т.пл. 163 С. ЯМР (CDCl3) м.д.: (2,09, м, 2 Н), (2,67, т,2 Н), (2,90, т, 2 Н), (3,92, с, 3 Н), (5,70, шир.с, 1 Н),(6,80, д, 1 Н), (7,68, д, 1 Н). Масс-спектр: (исходный+1):193. Исходное вещество: 5,6-диметокси-1-тетралон; ссылка: Organic Process Research and Development, 1999, 3, 71-72. Пример 18. 5-Бензилокси-6-метокси-3,4 дигидро-2 Н-нафталин-1-он. Используя способ, аналогичный способу примера 7, из 4,5 г (0,024 моль) 5-гидрокси-6 метокси-1-тетралона, 5,4 г (0,031 моль) бензилбромида и 10 г (0,072 моль) К 2 СО 3 в 100 мл ацетона кристаллизацией из простого эфира получали указанный в заголовке продукт (5,13 г) в виде белого твердого вещества, т.пл. 90 С. ЯМР (СDСl3) м.д.: (2,10, м, 2 Н), (2,55, т,2 Н), (2,88, т, 2 Н), (3,88, с, 3 Н), (5,11, с, 2 Н),(6,63, с, 1 Н), (7,20-7,45, м, 5 Н), (7,60, с, 1 Н). Масс-спектр: (исходный+1):283. Пример 19. 1-2-[4-(5-Бензилокси-6-метокси-3,4-дигидронафталин-1-ил)фенокси]этилпирролидин. Используя способ, аналогичный способу примера 1, из 10 г (0,3555 моль) 5-бензилокси-6 метокси-3,4-дигидро-2 Н-нафталин-1-она, 9,88 г(0,366 моль) 1-(2-(4-бромфенокси)этил)пирролидина и 13,63 мл 1,6 М н-бутиллития в гексане получали 4,3 г указанного в заголовке продукта. ЯМР (CDCI3) м.д.: (1,90, шир.с, 4 Н), (2,20,м, 2 Н), (2,78, т, 2 Н), (2,90, шир.с, 2 Н), (3,10,шир.с, 1 Н), (3,84, с, 3 Н), (4,26, т, 2 Н), (4,98, с,2 Н), (5,86, т, 1 Н), (6,65, д, 1 Н), (6,74, д, Н), (6,88,д, 2 Н), (7,25, д, 2 Н), (7,28-7,50, м, 5 Н). Пример 20. 1-2-[4-(5-Бензилокси-2-бром-6 метокси-3,4-дигидронафталин-1-ил)фенокси]этил пирролидин. Используя способ, аналогичный способу примера 2, из 4,3 г (0,0094 моль) 1-2-[4-(5-бензилокси-6-метокси-3,4-дигидронафталин-1-ил) феноксил]этилпирролидина, 1,68 г (0,0094 моль)NBS и 156 мг AIBN в 50 мл ДМФ получали 4 г указанного в заголовке продукта. ЯМР (CDCl3) м.д.: (1,95, шир.с, 4 Н), (2,75,т, 2 Н), (2,90, т, 2 Н), (3,00, шир.с, 4 Н), (3,10,шир.с, 2 Н), (3,80, с, 3 Н), (4,33, с, 2 Н), (6,35, д,1 Н), (6,57, д, 1 Н), (6,93, д, 2 Н), (7,15-7,30, м, 5 Н). Масс-спектр: (исходный+1):536. Пример 21. 1-2-[4-(5-Бензилокси-6-метокси-2-фенил-3,4-дигидронафталин-1-ил)фенокси] этилпирролидин. Используя способ, аналогичный способу примера 3, из 4,0 г (0,0075 моль) 1-2-[4-(5-бензилокси-2-бром-6-метокси-3,4-дигидронафталин-1 ил)фенокси]этилпирролидина, 2,28 г (0,186 моль) фенилбороновой кислоты, 259 мг (0,224 ммоль) тетракис(трифенилфосфин)палладия, 3,7 г (0,03 моль) Na2CO3 в 150 мл EtOH получали 3,2 г указанного в заголовке продукта. ЯМР (CDCl3) м.д.: (1,84, шир.с, 4 Н), (2,83,м, 2 Н), (2,74, м, 4 Н), (2,95, м, 4 Н), (3,84, с, 3 Н),(4,10, т, 2 Н), (5,03, с, 2 Н), (6,55, д, 1 Н), (6,65, д,1 Н), (6,75, д, 2 Н), (6,90-7,50, м, 12 Н). Масс-спектр: (исходный+1):532. Пример 22. 2-Метокси-6-фенил-5-[4-(2-пирролидин-1-илэтокси)фенил]-5,6,7,8-тетрагидронафталин-1-ол. Используя способ, аналогичный способу примера 11, из 3,2 г (0,007 моль) 1-2-[4-(5-бензилокси-6-метокси-2-фенил-3,4-дигидронафталин 1-ил)фенокси]этилпирролидина, 3,4 г гидроксида палладия на углероде, 10 мл 2N НСl, 30 мл Н 2 О и 100 мл EtOH получали 2,2 г продукта. Масс-спектр: (исходный+1):444. Метаболит, 1-метокси-6-фенилтетрагидронафталин-2-ол, может быть синтезирован, как показано на схеме 6. Схема 5 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Метаболит (-)-цис-6-фенил-5-[4-(2-пирролидин-1-илэтокси)фенил]-5,6,7,8-тетрагидронафталин-2-ола, который выбран из группы,состоящей из и его стереоизомеры, таутомеры, региоизомеры и конфигурационные изомеры; и его фармацевтически приемлемые соли. 2. Способ лечения остеопороза, рака молочной железы, гиперлипидемии, атеросклероза, болезни Альцгеймера, катаракты, потери либидо, сексуальной дисфункции у мужчин, рака толстой кишки, кожных морщин, аутоиммунного заболевания, алопеции, угрей, сердечнососудистого заболевания, диабета, эндометриоза, сексуальной дисфункции у женщин, гипергликемии, ожирения, обсессивно-компульсивного расстройства, предменструального синдрома,карциномы простаты, доброкачественной гиперплазии простаты, легочной гипертензии,реперфузионного повреждения, ревматоидного артрита, остеоартрита, себореи, старческой гинекомастии, недостаточности тестостерона, синдрома Тернера, фиброза матки, атрофического вагинита, недержания, рака матки, гирсутизма,булимии, анорексии, снижения сексуальных 32 желаний, расстройства полового возбуждения,диспареунии, вагинизма, пролапса, инфекций мочевых путей, удара, инфаркта миокарда, острой или хронической почечной недостаточности, окклюзионного поражения периферических артерий, синдрома Рейно, рака яичников, печени и поджелудочной железы, а также десмоидного рака, глиомы и карциномы клеток почек или стимуляции заживления ран, увеличения частоты оргазма, снижения вагинального рН,включающий введение субъекту, нуждающемуся в этом, эффективного количества метаболита 33 и его стереоизомеров, таутомеров, региоизомеров и конфигурационных изомеров; и его фармацевтически приемлемых солей. 3. Фармацевтическая композиция, содержащая метаболит (-)-цис-6-фенил-5-[4-(2-пирро 004866
МПК / Метки
МПК: C07D 295/08, C07C 229/12, A61K 31/40
Метки: метаболиты, эстрогена
Код ссылки
<a href="https://eas.patents.su/20-4866-metabolity-agonista-antagonista-estrogena.html" rel="bookmark" title="База патентов Евразийского Союза">Метаболиты агониста/антагониста эстрогена</a>
Предыдущий патент: Новые α-аминокислотные соединения, способ их получения и фармацевтические композиции их содержащие
Следующий патент: Замещенные пиримидиноновые соединения, композиция и способ лечения, ингибирования или предупреждения тромботических состояний у млекопитающих
Случайный патент: Устройство и мостик для подвешивания компонента












