Производные аминоиндана в качестве ингибиторов обратного захвата серотонина и захвата норэпинефрина
Номер патента: 7655
Опубликовано: 29.12.2006
Авторы: Бегесе Клаус Петер, Пюшль Аск, Брегнедаль Петер, Келер Ян
Формула / Реферат
1. Соединение аминоиндана, имеющее формулу I
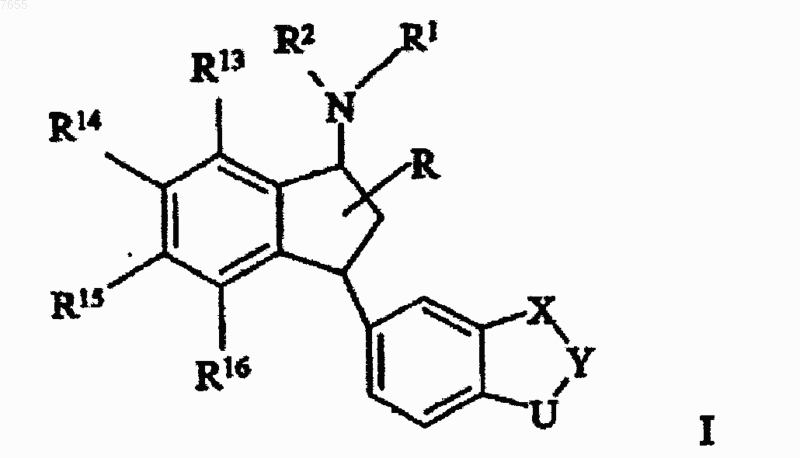
где X означает -O-, -S- или -CR4R5-;
Y означает -CR6R7-, -CR6R7-CR8R9- или -CR6=CR7-; или X и Y вместе образуют группу -CR4=CR5- или -CR4=CR5-CR6R7-; и
U означает -O-, -S- или -CR10R11 или
X означает -O-, -S- или -CR4R5-; и
Y и U вместе образуют группу -CR6=CR7-, -CR6=CR7-CR10R11- или -CR6R7-CR10=CR11-;
или X, и Y, и U вместе образуют -CR4=CR5-CR6=CR7-;
R1 и R2 независимо выбраны из водорода, C1-6-алкила, С2-6-алкенила, С2-6-алкинила, С3-8-циклоалкила или R1 и R2 вместе с азотом, к которому они присоединены, образуют 3-7-членное кольцо, необязательно содержащее один дополнительный гетероатом;
R13, R14, R15 и R16, каждый независимо, выбран из водорода, галогена, цианогруппы, нитрогруппы, C1-6-алкила, С2-6-алкенила, С2-6-алкинила и С3-8-циклоалкила;
R означает водород, C1-6-алкил или цианогруппу;
R4, R5, R6, R7, R8, R9, R10 и R11 независимо выбраны из водорода и C1-4-алкила;
или его аддитивная соль кислоты.
2. Соединение по п.1, где X и U выбраны из -О- и -S- и Y означает -CR6R7- или -CR6R7-CR8R9-.
3. Соединение по п.1, где X, и Y, и U вместе образуют -CR4=CR5-CR6=CR7-.
4. Соединение по п.1, которое является
транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламином,
цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламином,
транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диэтиламином,
цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диэтиламином,
транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)этиламином,
цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)этиламином,
транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)метиламином,
цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)метиламином,
(+)-транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламином,
(-)-транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламином,
(+)-цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламином,
(-)-цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламином,
транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)этилметиламином,
цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)этилметиламином,
цис-[3-(2,3-дигидробензо[1,4]диоксин-6-ил)индан-1-ил]диметиламином,
транс-[3-(2,3-дигидробензо[1,4]диоксин-6-ил)индан-1-ил]диметиламином,
цис-диметил-(3-нафталин-2-ил-индан-1-ил)амином,
транс-диметил-(3-нафталин-2-ил-индан-1-ил)амином,
цис-[3-(6-хлорбензо[1,3]диоксол-5-ил)индан-1-ил]диметиламином,
транс-[3-(6-хлорбензо[1,3]диоксол-5-ил)индан-1-ил]диметиламином,
цис-[3-(6-хлорбензо[1,3]диоксол-5-ил)индан-1-ил]метиламином,
транс-[3-(6-хлорбензо[1,3]диоксол-5-ил)индан-1-ил]метиламином,
цис-энантиомер-1-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)метиламином и
цис-энантиомер-2-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)метиламином
или их аддитивной солью кислоты.
5. Фармацевтическая композиция, содержащая соединение по любому из пп.1-4 или его фармацевтически приемлемую аддитивную соль кислоты и по меньшей мере один фармацевтически приемлемый носитель или разбавитель.
6. Применение соединения по любому из пп.1-4 или его фармацевтически приемлемой аддитивной соли кислоты для приготовления медикамента для лечения аффективных расстройств, таких как депрессия, тревожные расстройства, включая генерализованные тревожные расстройства, социальные тревожные расстройства, посттравматический стресс, навязчивое компульсивное расстройство, острые тревожные расстройства с реакцией паники, расстройства панического типа, специфические фобии, социальная фобия и боязнь открытого пространства.
7. Способ лечения аффективных расстройств, включая депрессию и тревожные расстройства, включая генерализованное тревожное расстройство, социальные тревожные расстройства, посттравматический стресс, навязчивое компульсивное расстройство, острые тревожные расстройства с реакцией паники, расстройства панического типа, специфические фобии, социальную фобию и боязнь открытого пространства, у высших животных, включая человека, включающий введение терапевтически эффективного количества соединения по любому из пп.1-4 или его фармацевтически приемлемой аддитивной соли кислоты.
Текст
007655 Изобретение относится к новым производным аминоиндана, которые применимы при лечении аффективных расстройств, таких как депрессия и тревожные расстройства. Предпосылки создания изобретения Комбинированное действие ингибирования обратного захвата серотонина и ингибирования захвата норэпинефрина на депрессию изучали в клинических исследованиях соединений, таких как дулоксетин(Wong D. T.: Duloxetine (LY-248686): Ингибитор захвата серотонина и норадреналина и кандидат на антидепрессивное лекарственное средство Expert Opinion on Investigational Drugs (1988) 7 10 1691-1699) и венлафаксин (Khan-A; Fabre-LF; Rudolph-R: венлафаксин при депрессии у амбулаторных пациентов, Psychopharmacology Bulletin (1991) 27, 141-144). Данное изобретение обеспечивает новые соединения, которые обладают комбинированным действием ингибирования обратного захвата серотонина и ингибирования захвата норэпинефрина для лечения аффективных расстройств, таких как депрессия, тревожные расстройства, включая генерализованное тревожное расстройство, социальное тревожное расстройство, посттравматический стресс, навязчивое компульсивное расстройство, острое тревожное состояние с реакцией паники, расстройства панического типа, специфические фобии, социальная фобия и боязнь открытого пространства. Краткое изложение сущности изобретения Данное изобретение относится к соединениям, имеющим формулу IY означает -CR6R7-, -CR6R7-CR8R9- или -CR6=CR7-; или X и Y вместе образуют группу -CR4=CR5 или -CR4=CR5-CR6R7-; иY и U вместе образуют группу CR6=CR7-, -CR6=CR7-CR10R11- или -CR6R7-CR10=CR11-; или X, Y и U вместе образуют -CR4=CR5-CR6=CR7-;R1 и R2 независимо выбраны из водорода, C1-6-алкила, С 2-6-алкенила, С 2-6-алкинила, С 3-8 циклоалкила или R1 и R2 вместе с азотом, к которому они присоединены, образуют 3-7-членное кольцо,необязательно содержащее один дополнительный гетероатом;R4, R5, R6, R7, R8, R9, R10 и R11 независимо выбраны из водорода и C1-4-алкила; или к их аддитивным солям кислот. Изобретение также обеспечивает фармацевтическую композицию, содержащую соединение формулы I или его фармацевтически приемлемую аддитивную соль кислоты и по меньшей мере один фармацевтически приемлемый носитель или разбавитель. Изобретение, кроме того, обеспечивает применение соединения формулы I или его фармацевтически приемлемой аддитивной соли кислоты для приготовления медикамента для лечения аффективных расстройств, таких как депрессия и тревожные расстройства, включая генерализованные тревожные расстройства, социальные тревожные расстройства, посттравматический стресс, навязчивое компульсивное расстройство, расстройство панического типа, острые тревожные состояния с реакцией паники, специфические фобии, социальная фобия и боязнь открытого пространства. Изобретение также обеспечивает способ лечения аффективного расстройства, как указано выше, у высших животных, включая человека, предусматривающий введение терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой аддитивной соли кислоты. Подробное описание изобретения Согласно одному специфическому варианту воплощения изобретения X и U выбраны из -О- и -S- иY означает -CR6R7- или -CR6R7-CR8R9-. Согласно другому специфическому варианту воплощения изобретения X, Y и U вместе образуют-CR4=CR5-CR6=CR7-. Предпочтительными соединениями согласно изобретению являются транс-(3-бензо[1, 3]диоксол-5-ил-индан-1-ил)диметиламин,цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламин,-1 007655 транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диэтиламин,цис-(3-бензо[1, 3]диоксол-5-ил-индан-1-ил)диэтиламин,транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)этиламин,цис-(3-бензо[1, 3]диоксол-5-ил-индан-1-ил)этиламин,транс-(3-бензо[1, 3]диоксол-5-ил-индан-1-ил)метиламин,цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)метиламин,(+)-транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламин,(-)-транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламин,(+)-цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламин,(-)-цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламин,транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)этилметиламин,цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)этилметиламин,цис-[3-(2, 3-дигидробензо[1, 4]диоксин-6-ил)индан-1-ил]диметиламин,транс-[3-(2,3-дигидробензо[1,4]диоксин-6-ил)индан-1-ил]диметиламин,цис-диметил-(3-нафталин-2-ил-индан-1-ил)амин,транс-диметил-(3-нафталин-2-ил-индан-1-ил)амин,цис-[3-(6-хлорбензо[1,3]диоксол-5-ил)индан-1-ил]диметиламин,транс-[3-(6-хлорбензо[1,3]диоксол-5-ил)индан-1-ил]диметиламин,цис-[3-(6-хлорбензо[1,3]диоксол-5-ил)индан-1-ил]метиламин,транс-[3-(6-хлорбензо[1,3]диоксол-5-ил)индан-1-ил]метиламин,цис-энантиомер-1- (3-бензо[1,3]диоксол-5-ил-индан-1-ил)метиламин и цис-энантиомер-2-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)метиламин или их аддитивные соли с кислотами. Как использовано здесь, галоген означает фтор, хлор, бром или иод. Термин C1-6-алкил относится к разветвленной или неразветвленной алкильной группе, имеющей от 1 до 6 атомов углерода включительно, такой как метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2 метил-2-пропил и 2-метил-1-пропил. Аналогично С 2-6-алкенил и С 2-6-алкинил, соответственно, означают такие группы, имеющие от 2 до 6 атомов углерода и включающие одну двойную связь и тройную связь соответственно, такие как этенил,пропенил, бутенил, этинил, пропинил и бутинил. Термин С 3-8-циклоалкил означает моноциклический или бициклический карбоцикл, имеющий от 3 до 8 С-атомов, такой как циклопропил, циклопентил, циклогексил, циклогептил и циклооктил.R1 и R2 вместе с атомом азота, к которому они присоединены, образуют 3-7-членное кольцо, необязательно содержащее один дополнительный гетероатом, такое как азиридинил, азетидинил, пирролидинил, пиперидинил, морфолинил, тиоморфолинил и пиперазинил. Примерами аддитивных солей органических кислот согласно изобретению являются (соли), образованные с малеиновой, фумаровой, бензойной, аскорбиновой, янтарной, щавелевой, бисметиленсалициловой, метансульфоновой, этандисульфоновой, уксусной, пропионовой, винной, салициловой, лимонной, глюконовой, молочной, яблочной, миндальной, коричной, цитраконовой, аспарагиновой, стеариновой, пальмитиновой, таконовой, гликолевой, пара-аминобензойной, глутаминовой, бензолсульфоновой и теофиллинуксусной кислотами, также как с 8-галогенотеофиллином, например 8 бромтеофиллином. Примерами аддитивных солей неорганических кислот согласно изобретению являются (соли), образованные с соляной, бромисто-водородной, серной, сульфаминовой, фосфорной и азотной кислотами. Аддитивные соли кислот изобретения предпочтительно являются фармацевтически приемлемыми солями, образованными с нетоксичными кислотами. Соединения данного изобретения могут существовать как в несольватированных, так и в сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и подобные. Сольватированные формы для целей данного изобретения рассматривают как эквивалентные несольватированным формам. Некоторые соединения данного изобретения содержат хиральные центры и такие соединения существуют в форме изомеров (например, энантиомеров или диастереомеров). Изобретение включает все такие изомеры и их любые смеси, в том числе рацемические смеси. Рацемические формы могут быть расщеплены на оптические антиподы известными способами, например, разделением их диастереомерных солей с оптически активными кислотами и высвобождением оптически активного амина путем обработки основанием. Рацемические соединения данного изобретения могут быть расщеплены на их оптические антиподы, например, фракционной кристаллизацией d- и lсолей (например, тартратов, манделатов или камфорсульфонатов). Другой способ расщепления рацематов на оптические антиподы основан на хроматографировании на оптически активной матрице. Соединения данного изобретения могут также быть расщеплены путем образования диастереомерных производных или путем ферментативного расщепления. Могут быть использованы дополнительные способы расщепления оптических изомеров, известные специалистам в данной области. Такие способы включают описанные J.Jaques, A.Collet и S.Wilen в "En-2 007655antiomers, Racemates and Resolutions", John Wiley and Sons, New York (1981). Оптически активные соединения также могут быть получены из оптически активных исходных веществ. Соединения изобретения могут быть получены путем 1) алкилирования амина формулы III алкилирующим реагентом формулы II где R, R1-R2, R13-16, X, Y и U имеют указанные выше значения и L означает уходящую группу, такую как галоген, мезилат или тозилат; 2) восстановительного алкилирования инданкетона формулы IV амином формулы III где R, R1-R2, R13-16, X, Y и U имеют указанные выше значения; 3) раскрытия цикла в эпоксиде формулы V амином формулы III где R, R1-R2, R13-16, X, Y и U имеют указанные выше значения. Алкилирование согласно способу 1) обычно ведут в органическом растворителе, таком как спирт или кетон с подходящей точкой кипения, предпочтительно в присутствии органического или неорганического основания (карбоната калия, диизопропилэтиламина или триэтиламина) при температуре флегмы. В качестве альтернативы, алкилирование может быть проведено при заданной температуре, которая отличается от точки кипения, в одном из вышеуказанных растворителей или в диметилформамиде(ДМФА), диметилсульфоксиде (ДМСО) или N-метилпирролидин-2-оне (NMP), предпочтительно в присутствии основания, такого, как указано выше. Алкилирующие производные формулы II описаны в литературе (например, Bogeso, K.P. J. Med. Chem. 26, 1983, 935-947; Bogeso, K.P. и др. J. Med. Chem. 28,1985, 1817-1828; Sommer, M.B. и др. J. Org. Chem. 55, 1990, 4822-2827 и в приведенных в них ссылках), а амины формулы III коммерчески доступны. Восстановительное алкилирование согласно способу 2) ведут по стандартным способам, описанным в литературе. Реакция может быть проведена в одну стадию в стандартных условиях восстановительного аминирования с применением, например, цианоборгидрида натрия, или в две стадии, например,конденсацией аминов формулы III с реагентом формулы IV с последующим восстановлением полученного имина цианоборгидридом натрия или боргидридом натрия. Кетоны формулы IV могут быть получены как описано в литературе (например, Bogeso,K.P. J. Med. Chem. 26, 1983, 935-947; Bogeso, K.P. и др.J. Med. Chem. 28, 1985, 1817-1828; Sommer, M.B. и др. J. Org. Chem. 55, 1990, 4822-2827 и в приведенных в них ссылках). Раскрытие цикла в эпоксиде согласно способу 3) обычно ведут в органическом растворителе, таком как спирт или кетон с подходящей точкой кипения, используя избыток амина формулы III, при температуре флегмы. Эпоксиды формулы IV могут быть получены способами, описанными в литературе (например, Ghosh, A.K. и др. Synthesis 5; 1997; 541-544; Palmer, M.J. и др.; J. Chem. Soc. Perkin Trans. 1, 2002, 416-427). Фармацевтические лекарственные препараты изобретения могут быть приготовлены обычными, из-3 007655 вестными из предшествующего уровня техники, способами. Например таблетки могут быть получены смешиванием активного ингредиента с обычными адьювантами и/или разбавителями с последующим прессованием смеси на обычной таблетировочной машине. Примерами адьювантов или разбавителей являются кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин, лактоза, камедь и т.п. Любые адьюванты или добавки, обычно используемые для таких целей, как окрашивание, изменение вкуса и запаха, консервирование и т.д., могут быть использованы при условии их совместимости с активными ингредиентами. Растворы для инъекций могут быть приготовлены растворением активного ингредиента и возможных добавок в части растворителя для инъекций, предпочтительно стерильной воды, доведением раствора до желаемого объема, стерилизацией раствора и заполнением им подходящих ампул или пузырьков. Могут быть добавлены любые обычно применяемые в данной области добавки, такие как тонизирующие агенты, консерванты, антиоксиданты и т.д. Фармацевтические композиции данного изобретения или полученные в соответствии с данным изобретением могут быть введены любым подходящим путем, например перорально в форме таблеток,капсул, порошков, сиропов и т.д., или парентерально в форме растворов для инъекций. Для получения указанных композиций могут быть использованы способы, хорошо известные в технике, и могут быть использованы любые фармацевтически приемлемые носители, разбавители, наполнители или другие добавки, обычно применяемые в данной области техники. Обычно соединения изобретения вводят в виде лекарственных форм, содержащих указанные соединения в количестве от примерно 0,01 до 100 мг. Общая дневная доза обычно находится в интервале примерно 0,05-500 мг, и, наиболее предпочтительно, примерно от 0,1 до 50 мг активного соединения изобретения. Экспериментальная часть Соединения изобретения, служащие примером в дальнейшем, охарактеризовывали, используя следующие способы. Точки плавления определяли на аппарате Buechi B-540 и не корректировали. Масс-спектры получали на системе Quattro MS-MS от VG Biotech, Fisons Instruments. Аналитические данные LC-MS получали на инструменте РЕ Sciex API 150EX, снабженном источником электростатического напыления и системой Shimadzu LC-8A/SLC-10A LC. Условия LC (50x4,6 мм, YMC ODS-A, размер частиц 5 мкм) имели линейный градиент элюирования от смеси (90:10:0,05) вода/ацетонитрил/трифторуксусная кислота до смеси (10:90:0,03) вода/ацетонитрил/трифторуксусная кислота в течение 7 мин при расходе 2 мл/мин. Чистоту определяли методом УФ-спектроскопии (254 нм). Время удерживания Rt выражали в минутах. Препаративное LC-MS-разделение осуществляли на тех же инструментах. Условия LC (50x20 мм, YMCODS-A, размер частиц 5 мкм) имели линейный градиент элюирования от смеси (80:20:0,05) вода/ацетонитрил/трифторуксусная кислота до смеси (5:95:0,03) вода/ацетонитрил/трифторуксусная кислота в течение 7 мин при расходе 22,7 мл/мин. Отбор фракций осуществляли путем определения потока в масс-спектрометре. Спектр 1 Н ЯМР регистрировали при 250,13 МГц на Bruker AC 250 или при 500,13 МГц на BrukerDRX 500. В качестве растворителей использовали дейтерированный хлороформ (99,8% D) или диметилсульфоксид (99,9% D). В качестве внутреннего стандарта использовали тетраметилсилан (TMS). Химические сдвиги выражали как значения м.д. Для мультиплетности сигналов ЯМР использовали следующие сокращения: s=синглет, d=дублет, t=триплет, q=квартет, qv=квинтет, h=гептет, dd=двойной дублет,dt=двойной триплет, dq=двойной квартет, tt=тройной триплет, m=мультиплет, b=ширина. Сигналами ЯМР, соответствующими кислотным протонам, до некоторой степени пренебрегали. Содержание воды в кристаллических соединениях определяли титрованием по Карлу Фишеру. Для колоночной хроматографии использовали силикагель типа Kieselgel 60, 40-60 меш ASTM. Для ионообменной хроматографии использовали следующие материалы: колонки SCX (1 г) от Varian Mega Bond Elut, Chrompack cat. No. 220776. Перед использованием SCX-колонки предварительно кондиционировали 10% раствором уксусной кислоты в метаноле (3 мл). Примеры Получение промежуточных продуктов А. Алкилирующие реагенты Метиловый эфир 3-амино-1- (бензо [1,3]диоксол-5-ил)-1-циано-1 Н-инден-2-карбоновой кислоты Смесь 2-хлорбензонитрила (12,3 г) и бензо[1,3]диоксол-5-ил-ацетонитрила (10 г) в диметилформамиде (25 мл) добавляли при перемешивании и охлаждении на ледяной бане к трет-бутоксиду калия (20,1 г), растворенному в диметилформамиде (50 мл) с такой скоростью, чтобы температура не превышала 25 С. После перемешивания (в течение) 0,5 ч добавляли в течение 10 мин метилхлорацетат (11,1 г). После перемешивания (в течение) 24 ч при комнатной температуре указанную смесь выливали в смесь 0,1 М НСl (200 мл), гептана (30 мл) и толуола (15 мл). Перемешиванием в течение 1 ч, фильтрованием и промыванием водой (2x50 мл), толуолом (2x10 мл) и гептаном (2x25 мл) получали 79% метилового эфира 3 амино-1-бензо[1,3]диоксол-5-ил-1-циано-1 Н-инден-2-карбоновой кислоты.-4 007655 3-(Бензо[1,3]диоксол-5-ил)-индан-1-он Смесь метилового эфира 3-амино-1-бензо[1,3]диоксол-5-ил-1-циано-1 Н-инден-2-карбоновой кислоты (10 г) и уксусной кислоты (30 мл) нагревали до 100 С; добавляли при перемешивании в течение 30 мин 60% водную серную кислоту (20 мл). Смесь нагревали до 110 С в течение 6 ч, охлаждали до комнатной температуры, экстрагировали толуолом (50+10 мл), промывали водой (3x100 мл), экстрагировали 0,1 М водным гидроксидом натрия (100+20 мл), подкисляли концентрированной соляной кислотой, экстрагировали толуолом (25+10 мл) и фильтровали через активированный уголь. Удаление толуола давало 80% 1-(бензо[1,3]диоксол-5-ил)-3-оксо-индан-1-карбоновой кислоты. Кислоту затем декарбоксилировали нагреванием до 100 С в N-метилпирролидоне (15 мл) в течение 1 ч. После охлаждения раствор выливали в воду (40 мл) при энергичном перемешивании. Фильтрование, промывание водой (5x20 мл), растворение в этилацетате (40 мл), фильтрование через активированный уголь и удаление этилацетата давало 80% 3-(бензо[1,3]диоксол-5-ил)индан-1-она. Цис-3-(бензо[1,3]диоксол-5-ил)индан-1-ол Боргидрид натрия (1,5 г) порциями добавляли при перемешивании при 10-15 С к раствору 3(бензо[1,3]диоксол-5-ил)индан-1-она (10 г) в смеси этанола (75 мл) и диметоксиэтана (75 мл). Смесь перемешивали при комнатной температуре в течение 1 ч и затем упаривали в вакууме. Полученное масло обрабатывали водой и диэтиловым эфиром и органическую фазу отделяли, промывали водой и 0,1 н. НСl, сушили (MgSO4) и упаривали в вакууме, получая цис-3-(бензо[1,3]диоксол-5-ил)индан-1-ол в виде коричневого масла (10 г). 5-(3-Клориндан-1-ил)бензо[1,3]диоксол Тионилхлорид (7 мл) добавляли при перемешивании и охлаждении до 15 С к раствору цис-3(бензо[1,3]диоксол-5-ил)индан-1-ола (10 г) в дихлорметане (300 мл). Смесь перемешивали при комнатной температуре в течение 40 мин. Смесь промывали дважды водой, сушили (MgSO4) и упаривали в вакууме, получая с количественным выходом 5-(3-хлориндан-1-ил)бензо[1,3]диоксол в виде масла, которое использовали на следующей стадии без дополнительной очистки. Получение соединений изобретения Пример 1. Транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламин (1) и цис-(3-бензо[1,3]диоксол-5-илиндан-1-ил)диметиламин (2) Смесь 5-(3-хлориндан-1-ил)-бензо[1,3]диоксола (11 г) и 70 мл 33% диметиламина в этаноле выдерживали при 100 С в стальном автоклаве в течение 16 ч. Смесь охлаждали и упаривали в вакууме. Остаток растворяли в диэтиловом эфире и промывали водой и 2 н. NaOH. Органическую фазу сушили (сульфат магния), упаривали в вакууме и остаток очищали флэш-хроматографией на силикагеле, используя градиент-элюент: 1) этилацетат/гептан (80:20) и 2) этилацетат/этанол/триэтиламин (90:10:4), получая сырые продукты в виде прозрачных масел. Транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламин (1) Медленно вымываемое соединение является транс-изомером (3 г). 1 Н ЯМР (CDCl3): 1,95-2,05(м, 1 Н); 2,30(с, 6 Н); 2,60-2,70(м, 1 Н); 4,40(м, 2 Н); 5,90 (с, 2 Н); 6,55(м, 1 Н),6,65 (м, 1 Н), 6,70(м, 1 Н), 6,95(м, 1 Н), 7,25(м, 1 Н), 7,45(м, 1 Н). Соединение может быть превращено в соль фумарата из этилацетата/этанола в виде белого кристаллического соединения. Цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламин (2) Быстро вымываемое соединение является цис-изомером (1 г). 1 Н ЯМР (CDCl3): 1,95-2,05(м, 1 Н); 2,30(с, 6 Н); 2,60-2,70(м, 1 Н); 4,10(м, 1 Н); 4,45(м, 1 Н), 5,90 (с, 2 Н); 6,55(м, 1 Н), 6,65(м, 1 Н), 6,70(м, 1 Н), 6,95(м, 1 Н), 7,25(м, 1 Н), 7,45(м, 1 Н). Соединение может быть превращено в соль фумарата из этилацетата/этанола в виде белого кристаллического соединения. Следующие соединения 3-14 получали аналогично, время удерживания ВЭЖХ и чистота описаны в табл. 1: транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диэтиламин (3),цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диэтиламин (4),транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)этиламин (5),цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)этиламин (6),ттранс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)метиламин (7),цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)метиламин (8),транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)этилметиламин (13),цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)этилметиламин (14),цис-[3-(2,3-дигидробензо[1,4]диоксин-6-ил)индан-1-ил]диметиламин (15),транс-[3-(2,3-дигидробензо[1,4]диоксин-6-ил)индан-1-ил]диметиламин (16),цис-диметил-(3-нафталин-2-ил-индан-1-ил)амин (17),транс-диметил-(3-нафталин-2-ил-индан-1-ил)амин (18),цис-[3-(6-хлорбензо[1,3]диоксол-5-ил)индан-1-ил]диметиламин (19),транс-[3-(6-хлорбензо[1,3]диоксол-5-ил)индан-1-ил]диметиламин (20,цис-[3-(6-хлорбензо[1,3]диоксол-5-ил)индан-1-ил]метиламин (21),транс-[3-(6-хлорбензо[1,3]диоксол-5-ил)индан-1-ил]метиламин (22),-5 007655 Таблица 1(-) -транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламин (10). Соединение 1, транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламин, подвергали расщеплению хиральной ВЭЖХ, используя систему надкритической жидкостной хроматографии Gilson SF3, снабженную колонками ChiralcelOD (4,6 ммх 25 см для анализа и 10 ммх 25 см для препаративной работы). Размер частиц в колонках был 10 мкм. Раствор соединения 1, транс-(3-бензо[1,3]диоксол-5-ил-индан-1 ил)диметиламина (1 г) в метаноле (1 мл) инжектировали порциями по 40 мкл в препаративную колонку. Колонку элюировали диоксидом углерода-модификатором (75:25). Модификатором был 2-пропанол с диэтиламином (0,5%) и трифторуксусной кислотой (0,5%). Скорость потока была 18,9 мл/мин при 20 МПа. Фракции собирали и проводили определение в области УФ (210 нМ). Фракции, содержащие отдельные продукты, отстаивали и упаривали в вакууме, получая энантиомеры 9 и 10.(+)-цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламин (11) и (-)-цис-(3-бензо[1,3]диоксол-5 ил-индан-1-ил)диметиламин (12) Соединение 2, цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламин подвергали расщеплению хиральной ВЭЖХ, используя систему надкритической жидкостной хроматографии Gilson SF3, снабженную колонками ChiralcelOD (4,6 ммх 25 см для анализа и 10 ммх 25 см для препаративной работы). Размер частиц в колонках был 10 мкм. Раствор соединения 2, цис-(3-бензо[1,3]диоксол-5-ил-индан-1 ил)диметиламина (1 г) в метаноле (1 мл) инжектировали порциями по 40 мкл в препаративную колонку. Колонку элюировали диоксидом углерода-модификатором (75:25). Модификатором был 2-пропанол с диэтиламином (0,5%) и трифторуксусной кислотой (0,5%). Скорость потока была 18,9 мл/мин при 20 МПа. Фракции собирали и проводили определение в области УФ (210 нМ). Фракции, содержащие отдельные продукты, отстаивали и упаривали в вакууме, получая энантиомеры 11 и 12.(-) -цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламин (12): =-4,4 (конц.=1% в метаноле) Аналогично получали следующие соединения:(-) -Цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)метиламин (24) Фармакологические испытания Соединения испытывали с помощью хорошо распознаваемых и надежных тестов. Тесты были следующими: Измерения захвата [3 Н]норадреналина кортикальными синаптосомами крыс. Свежую кору головного мозга мужских особей крыс Wistar (125-225 г) гомогенизировали в 0,32 М сахарозе, смягченной 1 мМ ниаламида, в стеклянно/тефлоновом гомогенизаторе. Гомогенат центрифугировали при 600 g в течение 10 мин при 4 С. Гранулы выгружали и надосадочную жидкость центрифугировали при 20000 х g в течение 55 мин. Конечные гранулы гомогенизировали (20 с) в указанной пробной буферной смеси (6 мг оригинальной ткани/мл = 4 мг/лунку). Испытуемые соединения (или буферные смеси) и 10 нМ [3 Н]-норадреналина добавляли в углубления 96-луночного планшета и кратковременно встряхивали. Композиция буферной смеси: 123 мМ NaCl, 4,82 мМ KCl, 0,973 мМ СаСl2, 1,12 мМ MgSO4,12,66 мМ Na2HPO4, 2,97 мМ NaH2PO4, 0,162 мМ EDTA, 10 мМ глюкозы и 1 мМ аскорбиновой кислоты. Буферную смесь окисляли 95% O2/5% С 02 в течение 10 мин при 37 С и доводили рН до 7,4. Инкубацию начинали добавлением ткани к конечному объему пробы 1 мл. Через 15 мин инкубации с радиолигандом при 37 С образцы отфильтровывали непосредственно на стеклянные волокнистые фильтры UnifilterGF/C (пропитанные в течение 1 ч в 0,1% полиэтиленимина) в вакууме и немедленно промывали 3x1 мл буферной смесью. Неспецифический захват определяли, используя талсупрам (конечная концентрация 10 мкМ). Во все опыты включали дулоксетин в качестве вещества сравнения для кривой зависимости доза-эффект. Измерения захвата [3 Н]-5-НТ кортикальными синатопропами крыс. Целый головной мозг мужских особей крыс Wistar (125-225 г), исключая мозжечок, гомогенизировали в 0,32 М сахарозы, смягченной 1 мМ ниаламида, в стеклянно/тефлоновом гомогенизаторе. Гомогенат центрифугировали при 600 хg в течение 10 мин при 4 С. Гранулы выгружали и надосадочную жидкость центрифугировали при 20000 хg в течение 55 мин. Конечные гранулы гомогенизировали (20 с) в указанной буферной смеси (0,5 мг оригинальной ткани/лунку). Испытуемые соединения (или буферные смеси) и 10 нМ [3 Н]-5-НТ добавляли в 96-луночный планшет и кратковременно встряхивали. Композиция буферной смеси: 123 мМ NaCl, 4,82 мМ KCl, 0,973 мМ СаСl2, 1,12 мМ MgSO4, 12,66 мМ Na2HPO4,2,97 мМ NaH2PO4, 0,162 мМ EDTA, 10 мМ глюкозы и 1 мМ аскорбиновой кислоты. Буферную смесь окисляли 95% О 2/5% СO2 в течение 10 мин при 37 С и доводили рН до 7,4. Культивирование начинали добавлением ткани к конечному объему пробы 0,2 мл. Через 15 мин культивирования с радиолигандом при 37 С образцы отфильтровывали непосредственно на стеклянные волокнистые фильтры UnifilterGF/C (пропитанные в течение 1 ч в 0,1% полиэтиленимина) в вакууме и немедленно промывали 3x0,2 мл пробной буферной смесью. Неспецифический захват определяли, используя циталопрам (конечная концентрация 10 мкМ). Во все опыты включали циталопрам в качестве вещества сравнения для кривой зависимости доза-эффект. Результаты экспериментов показали, что все соединения изобретения ингибируют захват норэпинефрина и серотонина с IC50 ниже 200 нМ. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение аминоиндана, имеющее формулу IY означает -CR6R7-, -CR6R7-CR8R9- или -CR6=CR7-; или X и Y вместе образуют группу -CR4=CR5 или -CR4=CR5-CR6R7-; иY и U вместе образуют группу -CR6=CR7-, -CR6=CR7-CR10R11- или -CR6R7-CR10=CR11-; или X, и Y, и U вместе образуют -CR4=CR5-CR6=CR7-;R1 и R2 независимо выбраны из водорода, C1-6-алкила, С 2-6-алкенила, С 2-6-алкинила, С 3-8 циклоалкила или R1 и R2 вместе с азотом, к которому они присоединены, образуют 3-7-членное кольцо,необязательно содержащее один дополнительный гетероатом;R4, R5, R6, R7, R8, R9, R10 и R11 независимо выбраны из водорода и C1-4-алкила; или его аддитивная соль кислоты. 2. Соединение по п.1, где X и U выбраны из -О- и -S- и Y означает -CR6R7- или -CR6R7-CR8R9-. 3. Соединение по п.1, где X, и Y, и U вместе образуют -CR4=CR5-CR6=CR7-. 4. Соединение по п.1, которое является транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламином,цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламином,транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диэтиламином,цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диэтиламином,транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)этиламином,цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)этиламином,транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)метиламином,цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)метиламином,(+)-транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламином,(-)-транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламином,(+)-цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламином,(-)-цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)диметиламином,транс-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)этилметиламином,цис-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)этилметиламином,цис-[3-(2,3-дигидробензо[1,4]диоксин-6-ил)индан-1-ил]диметиламином,транс-[3-(2,3-дигидробензо[1,4]диоксин-6-ил)индан-1-ил]диметиламином,цис-диметил-(3-нафталин-2-ил-индан-1-ил)амином,транс-диметил-(3-нафталин-2-ил-индан-1-ил)амином,цис-[3-(6-хлорбензо[1,3]диоксол-5-ил)индан-1-ил]диметиламином,транс-[3-(6-хлорбензо[1,3]диоксол-5-ил)индан-1-ил]диметиламином,цис-[3-(6-хлорбензо[1,3]диоксол-5-ил)индан-1-ил]метиламином,транс-[3-(6-хлорбензо[1,3]диоксол-5-ил)индан-1-ил]метиламином,цис-энантиомер-1-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)метиламином и цис-энантиомер-2-(3-бензо[1,3]диоксол-5-ил-индан-1-ил)метиламином или их аддитивной солью кислоты. 5. Фармацевтическая композиция, содержащая соединение по любому из пп.1-4 или его фармацевтически приемлемую аддитивную соль кислоты и по меньшей мере один фармацевтически приемлемый носитель или разбавитель. 6. Применение соединения по любому из пп.1-4 или его фармацевтически приемлемой аддитивной соли кислоты для приготовления медикамента для лечения аффективных расстройств, таких как депрессия, тревожные расстройства, включая генерализованные тревожные расстройства, социальные тревожные расстройства, посттравматический стресс, навязчивое компульсивное расстройство, острые тревожные расстройства с реакцией паники, расстройства панического типа, специфические фобии, социальная фобия и боязнь открытого пространства. 7. Способ лечения аффективных расстройств, включая депрессию и тревожные расстройства, включая генерализованное тревожное расстройство, социальные тревожные расстройства, посттравматический стресс, навязчивое компульсивное расстройство, острые тревожные расстройства с реакцией паники, расстройства панического типа, специфические фобии, социальную фобию и боязнь открытого пространства, у высших животных, включая человека, включающий введение терапевтически эффективного количества соединения по любому из пп.1-4 или его фармацевтически приемлемой аддитивной соли кислоты.
МПК / Метки
МПК: C07D 317/48, A61K 31/357, C07C 211/38, C07D 319/16, A61K 31/135, A61P 25/24, A61P 25/22
Метки: ингибиторов, захвата, производные, норэпинефрина, обратного, серотонина, аминоиндана, качестве
Код ссылки
<a href="https://eas.patents.su/9-7655-proizvodnye-aminoindana-v-kachestve-ingibitorov-obratnogo-zahvata-serotonina-i-zahvata-norepinefrina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные аминоиндана в качестве ингибиторов обратного захвата серотонина и захвата норэпинефрина</a>
Предыдущий патент: Способ лечения закупорки стационарного катетера с использованием фибринолитических металлопротеиназ
Следующий патент: Клонированный штамм вируса осповакцины, способ его получения и применение штамма в качестве вакцины
Случайный патент: Модуляторы рецепторов сфингозин-1-фосфата и их применение












