Производные бензо[3,4] циклобута [1,2-c] пиррола и их применение в качестве ингибиторов обратного захвата серотонина
Номер патента: 3302
Опубликовано: 24.04.2003
Авторы: Пеглион Жан-Луи, Декейн Анн, Риве Жан-Мишель, Дессанж Эме, Миллан Марк, Гумен Бертран
Формула / Реферат
1. Соединение формулы (I), имеющее цис-соединение колец
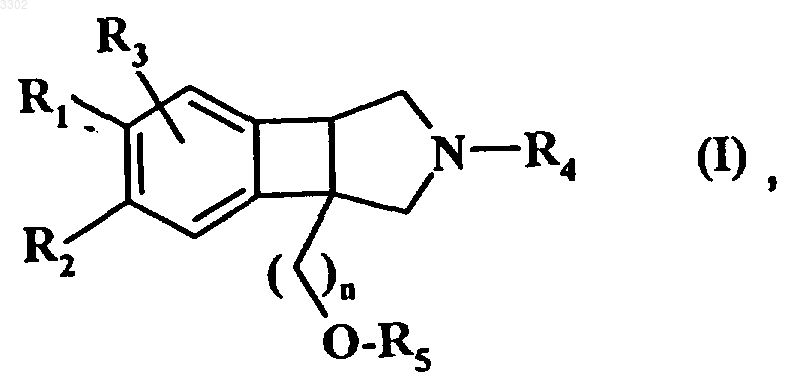
в которой
R1, R2 и R3, которые могут быть одинаковыми или различными, каждый независимо от других, представляет группу, выбранную из атома водорода, атома галогена, линейной или разветвленной (C1-C6)алкоксигруппы, линейной или разветвленной (C1-C6)тригалогеналкильной группы, или два из R1, R2 и R3 в смежных положениях представляют (C1-C2)алкилендиоксигруппу;
R4 представляет группу, выбранную из атома водорода, линейной или разветвленной (C1-C6)алкильной группы, арил-(C1-C6)алкильной группы, в которой алкильная часть является линейной или разветвленной;
R5 представляет арильную группу, необязательно замещенную арильную группу, гетероарильную группу или необязательно замещенную гетероарильную группу;
n представляет целое число от 1 до 2 включительно;
его изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием, причем имеется в виду, что циклоалкильная группа означает (C3-C8)моноциклическую насыщенную кольцевую систему, кроме того, арильная группа означает фенил или группу инданила, и необязательно замещенная арильная группа означает арильную группу, определенную ранее, необязательно замещенную одной или несколькими группами, которые могут быть одинаковыми или различными, и выбраны из линейного или разветвленного (C1-C6)алкила, линейного или разветвленного (C1-C6)алкокси, циклоалкила, адамантила, линейного или разветвленного (C1-C6)тригалогеналкила, оксо и (C1-C2)алкилендиокси, гетероарильная группа означает группу, выбранную из бензоксадиазолила, хроменила, тиохроманила и дигидробензофуранила, а необязательно замещенная гетероарильная группа означает гетероарильную группу, определенную ранее, необязательно замещенную одной или несколькими группами, которые могут быть одинаковыми или различными, определенными для замещения арильных групп.
2. Соединения формулы (I) по п.1, отличающиеся тем, что R5 представляет гетероарильную группу, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием.
3. Соединения формулы (I) по п.1, отличающиеся тем, что R5 представляет метилендиоксифенильную или этилендиоксифенильную группу, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием.
4. Соединения формулы (I) по п.1, отличающиеся тем, что n равно 1, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием.
5. Соединения формулы (I) по п.1, отличающиеся тем, что n равно 2, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием.
6. Соединения формулы (I) по п.1, отличающиеся тем, что R4 представляет атом водорода, линейную или разветвленную (C1-C6)алкильную группу или арил-(C1-C6)алкильную группу, в которой алкильная часть является линейной или разветвленной, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием.
7. Соединение формулы (I) по п.1, представляющее цис-3а-[(3,4-метилендиоксифенокси)метил]-2,3,3а,7b-тетрагидро-1H-бензо[3,4]циклобута[1,2-c]пиррол и его гидрохлорид.
8. Соединение формулы (I) по п.1, представляющее цис-2-бензил-5-метокси-3a-[(3,4-метилендиоксифенокси)метил]-2,3,3a,7b-тетрагидро-1H-бензо[3,4]циклобута[1,2-c]пиррол.
9. Соединение формулы (I) по п.1, представляющее цис-5-метокси-3a-[(3,4-метилендиоксифенокси)метил]-2,3,3a,7b-тетрагидро-1H-бензо[3,4]циклобута[1,2-c]пиррол и его гидрохлорид.
10. Соединение формулы (I) по п.1, представляющее цис-5-метокси-2-метил-3a-[(3,4-метилендиоксифенокси)метил]-2,3,3a,7b-тетрагидро-1H-бензо[3,4]циклобута[1,2-c]пиррол.
11. Соединение формулы (I) по п.1, представляющее цис-6-трифторметил-3a-[(3,4-метилендиоксифенокси)метил]-2,3,3a,7b-тетрагидро-1H-бензо[3,4]циклобута[1,2-c]пиррол и его гидрохлорид.
12. Соединение формулы (I) по п.1, представляющее цис-6-фтор-3a-[(3,4-метилендиоксифенокси)метил]-2,3,3a,7b-тетрагидро-1H-бензо[3,4]циклобута[1,2-c]пиррол и его гидрохлорид.
13. Фармацевтическая композиция, включающая в качестве активного ингредиента, по крайней мере, одно или более соединений формулы (I) по любому из пп.1-12 само по себе или в сочетании с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми эксципиентами или носителями.
14. Фармацевтическая композиция по п.13, включающая, по крайней мере, один активный ингредиент по любому из пп.1-12 для использования в качестве ингибитора обратного захвата серотонина при лечении депрессии, приступов паники, обсессивно-компульсивных расстройств, фобий, импульсивных болезненных состояний, злоупотребления лекарственными средствами и тревожных состояний.
Текст
1 Настоящее изобретение относится к новым соединениям бензо[3,4]циклобута[1,2-c]пиррола, к способу их получения и к содержащим их фармацевтическим композициям. Соединения по настоящему изобретению действуют как сильные ингибиторы обратного захвата серотонина. Как таковые, они могут использоваться в качестве терапевтических средств при лечении депрессии, приступов паники, обсессивнокомпульсивных расстройств (навязчивых состояний), фобий, импульсивных болезненных состояний, злоупотребления лекарственными средствами и тревожных состояний. Результаты экспериментов по микродиализу, осуществленные на коре лобных долей мозга, показывают ценность продуктов по настоящему изобретению при лечении различных патологий центральной нервной системы. Вследствие того, что они вызывают, в данной области,увеличение высвобождения серотонина, они полностью подходят для использования при патологиях, связанных с нарушением передачи данного нейротрансмиттера. Кроме того, испытания, проведенные на агрессивных мышах, позволили продемонстрировать противоимпульсивное и транквилизаторное действие продуктов по изобретению. Более конкретно, настоящее изобретение относится к соединениям формулы (I), имеющим цис-соединение колецR1, R2 и R3, которые могут быть одинаковыми или различными, каждый независимо друг от друга, представляет группу, выбранную из атома водорода, атома галогена, линейной или разветвленной (С 1-С 6)алкоксигруппы, линейной или разветвленной (С 1-С 6)тригалогеналкильной группы, или два из R1, R2 и R3 в смежных положениях представляют (С 1-С 2)алкилендиоксигруппу;R4 представляет группу, выбранную из атома водорода, линейной или разветвленной(С 1-С 6)алкильной группы, арил-(С 1-С 6)алкильной группы, в которой алкильная часть является линейной или разветвленной;R5 представляет арильную группу, необязательно замещенную арильную группу, гетероарильную группу или необязательно замещенную гетероарильную группу;n представляет целое число от 1 до 2 включительно,их изомерам и аддитивным солям с фармацевтически приемлемой кислотой или основанием, 003302 2 причем имеется в виду, что циклоалкильная группа означает (С 3-С 8)моноциклическую насыщенную кольцевую систему,кроме того, арильная группа означает фенил или группу инданила, и необязательно замещенная арильная группа означает арильную группу, определенную ранее, необязательно замещенную одной или несколькими группами,которые могут быть одинаковыми или различными, и выбраны из линейного или разветвленного (С 1-C6)алкила, линейного или разветвленного (С 1-C6)алкокси, циклоалкила, адамантила,линейного или разветвленного (С 1-C6)тригалоалкила, оксо и (С 1-С 2)алкилендиокси; гетероарильная группа означает группу,выбранную из бензоксадиазолила, хроменила,тиохроманила и дигидробензофуранила, а необязательно замещенная гетероарильная группа означает гетероарильную группу, определенную ранее, необязательно замещенную одной или несколькими группами, которые могут быть одинаковыми или различными, определенными для замещения арильных групп. Среди фармацевтически приемлемых кислот могут быть упомянуты, без каких-либо ограничений, хлористо-водородная кислота,бромисто-водородная, серная, фосфоновая, уксусная, трифторуксусная, молочная, пировиноградная, малоновая, глутаровая, янтарная, фумаровая, винная, малеиновая, лимонная, аскорбиновая, щавелевая, метансульфоновая, камфорная кислоты и так далее. Среди фармацевтически приемлемых оснований могут быть упомянуты, без каких-либо ограничений ими, гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и так далее. Предпочтительными заместителями R5 согласно изобретению являются гетероарильные группы. В соответствии с преимущественным вариантом осуществления изобретения предпочтительными группами R5 являются группы метилендиоксифенил и этилендиоксифенил. В соответствии с преимущественным вариантом воплощения изобретения n предпочтительно представляет целое число, равное 1. Согласно другому преимущественному варианту осуществления изобретения n предпочтительно представляет целое число, равное 2. Предпочтительными соединениями по данному изобретению являются цис-3 а-[(3,4-метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1 Н-бензо[3,4]циклобута[1,2-с]пиррол,цис-2-бензил-5-метокси-3 а-[(3,4-метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1 Нбензо[3,4]циклобута[1,2-c]пиррол,цис-5-метокси-3 а-[(3,4-метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1 Н-бензо[3,4]циклобута[1,2-с]пиррол, 3 цис-5-метокси-2-метил-3 а-[(3,4-метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1 Нбензо[3,4]циклобута[1,2-с]пиррол,цис-6-трифторметил-3 а-[(3,4-метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1 Нбензо[3,4]циклобута[1,2-с]пиррол, и цис-6-фтор-3 а-[(3,4-метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1 Н-бензо[3,4] циклобута[1,2-с]пиррол. Изомеры и аддитивные соли предпочтительных соединений с фармацевтически приемлемой кислотой или основанием образуют неотъемлемую часть изобретения. Соединения формулы (I) получают по способу, который характеризуется тем, что в качестве исходного вещества в нем используется соединение формулы (II) в которой R1, R2 и R3 имеют значения, определенные для формулы (I), и Hal представляет атом галогена, причем указанный атом галогена связан с любым из атомов углерода бензольного кольца,соединения формулы (II) подвергают действию амида натрия в жидком аммиаке, получая соединения формулы (III), имеющие циссоединение колец в которой R1, R2 и R3 имеют значения, определенные для формулы (I),соединения формулы (III) обрабатывают минеральным основанием в водной спиртовой среде, получая соединения формулы (IV),имеющие цис-соединение колец в которой R1, R2 и R3 имеют значения, определенные для формулы (I),соединения формулы (IV) превращают под действием ацеталя N,N-диметилформамида формулы (V)(V),(CH3)2NCH(OG)2 в которой G представляет линейный или разветвленный (С 1-С 6)алкил, бензил или циклoгeксильную группу, в сложный эфир формулы (VI), имеющий цис-соединение колец в которой R1, R2 и R3 и G имеют значения, определенные ранее,соединения формулы (VI) восстанавливают в обычных условиях органического синтеза в спирт формулы (VII), имеющий цис-соединение колец в которой R1, R2 и R3 имеют значения, определенные ранее,соединения формулы (VII),или обрабатывают в условиях реакции Мицунобу соединением формулы (VIII)(VIII),R5-OH в которой R5 имеет значения, определенные для формулы (I),с получением соединений формулы (I/a),имеющих цис-соединение колец, частный случай соединений формулы (I) в которой R1, R2 и R3 имеют значения, определенные ранее, соединения формулы (I/a) могут дебензилироваться одним из способов, обычно используемых в органическом синтезе, давая соединения формулы (I/b), имеющие циссоединение колец, частный случай соединений формулы (I) в которой R1, R2 и R3 и R5 имеют значения, определенные ранее, соединения формулы (I/b) могут или превращаться обработкой формальдегидом в присутствии цианоборгидрида натрия в соединения формулы (1/с), имеющие циссоединение колец, частный случай соединений формулы (I) в которой R1, R2 и R3 и R5 имеют значения, определенные ранее, 5 или обрабатываться в обычных условиях органического синтеза соединением формулы(IX),в которой R'4 имеет такое же значение, что и R4,за исключением водорода и бензила, и Z представляет уходящую группу, обычно используемую в органическом синтезе, давая соединения формулы (I/d), имеющие цис-соединение колец,частный случай соединений формулы (I) в которой R1, R2 и R3, R'4 и R5 имеют значения,определенные ранее,или превращаться с помощью последовательности обычных реакций в соединения формулы (X), имеющие цис-соединение колец в которой R1, R2 и R3 имеют значения, определенные ранее,соединения формулы (X) обрабатывают в условиях реакции Мицунобу соединением формулы (VIII)(VIII),R5-OH в которой R5 имеет значения, определенные ранее,с получением соединений формулы (I/е), имеющих цис-соединение колец, частный случай соединений формулы (I) в которой R1, R2 и R3 и R5 имеют значения, определенные ранее,соединения формулы (I/е) могут дебензилироваться одним из способов, обычно используемых в органическом синтезе, давая соединения формулы (I/f), имеющие цис-соединение колец, частный случай соединений формулы (I) в которой R1, R2 и R3 и R5 имеют значения, определенные ранее,соединения формулы (I/f) могут или превращаться обработкой формальдегидом в присутствии цианоборгидрида натрия в 6 соединения формулы (I/g), имеющие циссоединение колец, частный случай соединений формулы (I) в которой R1, R2 и R3 и R5 имеют значения, определенные ранее,или обрабатываться в обычных условиях органического синтеза соединением формулы(IX),R'4-Z в которой R'4 имеет такое же значение, что и R4,за исключением водорода и бензила, и Z представляет уходящую группу, обычно используемую в органическом синтезе,давая соединения формулы (I/h), имеющие цис-соединение колец, частный случай соединений формулы (I) в которой R1, R2 и R3, R'4 и R5 имеют значения,определенные ранее,или превращаться с помощью последовательности обычных реакций в соединения формулы (XI), имеющие цис-соединение колец в которой R1, R2 и R3 имеют значения, определенные ранее,соединения формулы (XI) могут быть также получены с помощью последовательности обычных реакций из соединений формулы (X),соединения формулы (XI) обрабатывают в соответствии с условиями реакции Мицунобу соединением формулы (VIII)(VIII),R5-OH в которой R5 имеет значения, определенные ранее,с получением соединений формулы (I/i),имеющих цис-соединение колец, частный случай соединений формулы (I) в которой R1, R2 и R3 и R5 имеют значения, определенные ранее, 7 соединения формулы (I/i) могут дебензилироваться одним из способов, обычно используемых в органическом синтезе, давая соединения формулы (I/j), имеющие цис-соединение колец, частный случай соединений формулы (I) в которой R1, R2 и R3 и R5 имеют значения, определенные ранее,соединения формулы (I/j) могут или превращаться обработкой формальдегидом в присутствии цианоборгидрида натрия в соединения формулы (I/k), имеющие циссоединение колец, частный случай соединений формулы (I) в которой R1, R2 и R3 и R5 имеют значения, определенные ранее,или обрабатываться в обычных условиях органического синтеза соединением формулы(IX),R'4-Z в которой R'4 имеет такое же значение, что и R4,за исключением водорода и бензила, и Z представляет уходящую группу, обычно используемую в органическом синтезе,давая соединения формулы (I/l), имеющие цис-соединение колец, частный случай соединений формулы (I) в которой R1, R2 и R3, R'4 и R5 имеют значения,определенные ранее,соединения (I/a)-(I/l) составляют общую совокупность соединений по данному изобретению, которые очищаются, если необходимо, в соответствии с обычными методами очистки,которые могут разделяться, при желании, на различные изомеры с помощью обычных методов разделения и которые превращают, когда это уместно, в их аддитивные соли с фармацевтически приемлемой кислотой или основанием. Соединения формулы (II) представляют продукты, получаемые из известных веществ в соответствии с известными способами, как это описано далее в получениях 1-9. Эти получения представлены здесь в качестве иллюстрации без каких-либо ограничений ими. 8 Соединения формул (V), (VIII) и (IX) являются или промышленно доступными соединениями или получаются в соответствии с обычными способами органического синтеза. Соединения по настоящему изобретению представляют ингибиторы обратного захвата серотонина и благодаря этому отличительному свойству могут использоваться при лечении депрессии, приступов паники, обсессивнокомпульсивных расстройств (навязчивых состояний), фобий, импульсивных болезненных состояний, злоупотребления лекарственными средствами и тревожных состояний. Соответственно, настоящее изобретение также относится к фармацевтическим композициям, содержащим в качестве активного ингредиента, по крайней мере, одно соединение формулы (I), его оптические изомеры или его аддитивную соль с фармацевтически приемлемой кислотой или основанием, одно или в сочетании с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми эксципиентами или носителями. Среди композиций согласно данному изобретению можно упомянуть более конкретно композиции, которые являются подходящими для перорального, парентерального (внутривенного, внутримышечного или подкожного) перили чрескожного, назального, ректального, перлингвального, глазного или респираторного введения, и особенно таблетки или драже, подъязычные таблетки, саше, желатиновые капсулы,пастилки, суппозитории, кремы, мази, кожные гели, инъекцируемые или питьевые препараты,аэрозоли, глазные капли, капли для носа и т.д. Используемая доза варьирует в зависимости от возраста и веса пациента, способа введения, природы и тяжести заболевания и любого сопутствующего лечения и составляет от 0,5 мг до 50 мг для однократного или более введений в сутки. Следующие далее примеры иллюстрируют изобретение, но не в коей мере не ограничивают его. Используемые исходные вещества представляют известные продукты или получаются в соответствии с известными процедурами или получениями, которые описаны (получения 1-9). Различные стадии синтеза дают промежуточные продукты синтеза, которые могут использоваться при получении соединений по изобретению. Структуры соединений, описанных в получениях, синтетических стадиях и примерах определялись с использованием обычных спектрофотометрических приемов (инфракрасная,ЯМР, масс спектрометрия). Температуры плавления определялись с использованием или горячей пластины Кофлера(К), или горячей пластины под микроскопом 9 Получение 1. 4-(2-Бромфенил)-3-циано-Nбензилпирролидин. Стадия 1. 3-Бензил-[2-(2-бромфенил)-2 оксоэтил]аминопропаннитрил. Раствор 97,5 г 2-бромбромацетофенона в 200 мл ацетона выливают по каплям при температуре окружающей среды в раствор 61,7 г Nбензил-2-цианоэтиламина и 67 мл диизопропилэтиламина в 200 мл ацетона. После перемешивания в течение 12 ч, реакционную смесь упаривают, берут в эфир, промывают дважды, каждый раз по 500 мл, водой и сушат. После упаривания при пониженном давлении получают 131,9 г ожидаемого продукта. Стадия 2. 3-Бензил-[2-(2-бромфенил)-2 гидроксиэтил]аминопропаннитрил. В 300 мл метанола растворяют 131,9 г продукта, полученного на стадии 1, и затем добавляют по каплям к 39,9 г боргидрида натрия в 300 мл метанола. Во время добавления температуру поддерживают равной 0 С; реакционную смесь затем оставляют на ночь при температуре окружающей среды и впоследствии упаривают досуха, берут в дихлорметан и промывают водой. После концентрирования при пониженном давлении хроматография на силикагеле (дихлорметан) дает 94 г ожидаемого продукта. Стадия 3. 3-Бензил-[2-(2-бромфенил)-2 хлорэтил]аминопропаннитрил. В 400 мл хлористого метилена растворяют 94 г продукта, полученного на стадии 2. При температуре окружающей среды в течение 1 ч приливают по каплям 90,5 мл тионилхлорида. После перемешивания в течение 12 ч при температуре окружающей среды реакционную смесь упаривают досуха и затем берут в диэтиловый эфир и фильтруют. Твердый продукт берут в 500 мл 10%-го водного раствора карбоната натрия и 1 л хлористого метилена. После отделения, сушки и упаривания при пониженном давлении получают 90,2 г ожидаемого продукта. Стадия 4. 4-(2-Бромфенил)-3-циано-Nбензилпирролидин. 90,2 г продукта, полученного на стадии 3,растворяют в тетрагидрофуране. Раствор охлаждают до -70 С и добавляют по каплям 143 мл 2 М раствора гексаметилдисилазида натрия. Спустя 1 ч нахождения при -70 С и затем 12 ч при температуре окружающей среды реакционную смесь выливают в 300 мл насыщенного водного раствора хлорида аммония и затем экстрагируют эфиром. Объединенные органические фазы промывают и сушат. После упаривания получают 78,5 г ожидаемого продукта в виде смеси диастереоизомеров. Получение 2. 4-(2-Бром-4-метоксифенил)3-циано-N-бензилпирролидин. РастворN-бутоксиметил-N-триметилсилилметилбензиламина в 50 мл дихлорметана добавляют по каплям в E/Z смесь (70%/30%) 2 бром-4-метоксициннамонитрила, растворенного в 200 мл дихлорметана в присутствии несколь 003302 10 ких капель трифторуксусной кислоты. Температура повышается до 40 С. Данную температуру поддерживают в течение 1 ч 30 мин. После возвращения до температуры окружающей среды добавляют 10 г К 2 СО 3 и затем оставляют взаимодействовать в течение 30 мин. После фильтрования и концентрирования при пониженном давлении хроматография на силикагеле (дихлорметан) позволяет выделить 26 г предполагаемого продукта в виде смеси диастереоизомеров в соотношении 70%/30%. Получение 3. 4-(2-Хлор-5-трифторметилфенил)-3-циано-N-бензилпирролидин. Продукт получают в соответствии с методикой, описанной в получении 2, при использовании в качестве субстрата 2-хлор-5 трифторметилциннамонитрила. Получение 4. 4-(2-Бром-5-фторфенил)-3 циано-N-бензилпирролидин. Продукт получают в соответствии с методикой, описанной в получении 2, при использовании в качестве субстрата 2-бром-5-фторциннамонитрила. Получение 5. 4-(2-Хлор-6-фторфенил-3 циано-N-бензилпирролидин. Продукт получают в соответствии с методикой, описанной в получении 2, при использовании в качестве субстрата 2-хлор-6-фторциннамонитрила. Получение 6. 4-(2-Хлор-4-фторфенил)-3 циано-N-бензилпирролидин. Продукт получают в соответствии с методикой, описанной в получении 2, при использовании в качестве субстрата 2-хлор-4-фторциннамонитрила. Получение 7. 4-(2-Бром-4,5-диметоксифенил)-3-циано-N-бензилпирролидин. Продукт получают в соответствии с методикой, описанной в получении 2, при использовании в качестве субстрата 2-бром-4,5 диметоксициннамонитрила. Получение 8. 4-(2-Хлор-4,5-метилендиоксифенил)-3-циано-N-бензилпирролидин. Продукт получают в соответствии с методикой, описанной в получении 2, при использовании в качестве субстрата 2-хлор-4,5 метилендиоксициннамонитрила. Получение 9. 4-(2-Хлор-5-метоксифенил)3-циано-N-бензилпирролидин. Продукт получают в соответствии с методикой, описанной в получении 2, при использовании в качестве субстрата 2-хлор-5-метоксициннамонитрила. Пример 1. цис-3 а-[(3,4-Метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1 Н-бензо[3,4]циклобута[1,2-c]пиррол и его гидрохлорид. Стадия А. цис-2-Бензил-2,3,3 а,7b-тетрагидро-1 Н-бензо[3,4]циклобута[1,2-c]пиррол-3 акарбоксимидамид и его нитрат. В амид натрия в 1,15 л жидкого аммиака вводят по каплям 78,4 г продукта получения 1,растворенного в 50 мл диэтилового эфира. По 11 сле 3 ч контакта к реакционной смеси добавляют 75 г нитрата аммония; аммиаку затем дают возможность испариться. После того как остаток берут в хлористый метилен и воду, две фазы разделяют, органическую фазу сушат над сульфатом магния и растворитель упаривают. После растирания с диэтиловым эфиром и затвердевания в этилацетате получают 42,2 г ожидаемого продукта в виде его нитрата. Температура плавления: 183-187 С (МК). Стадия В. цис-2-Бензил-2,3,3 а,7b-тетрагидро-1 Н-бензо[3,4]циклобута[1,2-c]пиррол-3 акарбоксамид. В 90 мл этанола суспендируют при температуре окружающей среды 10,2 г продукта, полученного на стадии А. Последовательно добавляют 30 мл 1 н. раствора гидроксида натрия и затем 30 мл воды. Смесь кипятят с обратным холодильником в течение 2 ч и затем упаривают досуха. Остаток берут в хлористый метилен,промывают 200 мл насыщенного водного раствора бикарбоната натрия и сушат над сульфатом магния. После упаривания получают 8,15 г ожидаемого продукта. Стадия С. цис-2-Бензил-3 а-метоксикарбонил-2,3,3 а,7b-тетрагидро-1 Н-бензо[3,4]циклобута[1,2-c]пиррол. В 90 мл метанола растворяют 8,10 г продукта, полученного на стадии В. Добавляют 11,6 мл диметилацеталя N,N-диметилформамида и смесь оставляют на ночь при перемешивании. Затем добавляют раствор хлористого водорода в этаноле и упаривают досуха. Остаток берут в воду и промывают этилацетатом. Водную фазу подщелачивают карбонатом натрия и затем экстрагируют хлористым метиленом. После сушки и упаривания получают 8,1 г ожидаемого продукта. Стадия D. цис-2-Бензил-3 а-гидроксиметил 2,3,3 а,7b-тетрагидро-1 Н-бензо[3,4]циклобута[1,2-c]пиррол. Раствор 4 г соединения, полученного на стадии С, в 50 мл тетрагидрофурана добавляют по каплям к суспензии 1,03 г LiAlH4 в 15 мл тетрагидрофурана. Смесь оставляют на ночь при температуре окружающей среды. После гидролиза и отфильтровывания солей смесь упаривают досуха, получая 3,5 г ожидаемого продукта. Стадия Е. цис-2-Бензил-3 а-[(3,4-Метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1 Нбензо[3,4]циклобута[1,2-c]пиррол. В трехгорлой колбе смешивают 3,5 г соединения, полученного на стадии D, 2 г 3,4 метилендиоксифенола и 3,8 г трифенилфосфина в 40 мл тетрагидрофурана. Смесь охлаждают до 0 С и добавляют по каплям 2,4 мл диэтилазодикарбоксилата в течение 20 мин. После реакции в течение 4 дней при температуре окружающей среды реакционную смесь концентрируют при пониженном давлении. Хроматография на силикагеле (CH2Cl2/AcOEt: 95/5) позволяет выделить 4,4 г ожидаемого продукта.[3,4]циклобута[1,2-c]пиррол и его гидрохлорид. К 4,4 г продукта, полученного на стадии Е,растворенного в 30 мл дихлорэтана, добавляют 2,5 мл 1-хлорэтилхлорформиата и смесь нагревают с обратным холодильником в течение 3 ч. Смесь выпаривают досуха, берут в 30 мл метанола и кипятят с обратным холодильником в течение ночи. После упаривания хроматография на силикагеле позволяет выделить 1,45 г ожидаемого продукта, из которого получают гидрохлорид. Температура плавления (гидрохлорид): 208-213 С (МК). Пример 2. цис-2-Бензил-5-метокси-3 а[(3,4-метилендиоксифенокси)метил]-2,3,3 а,7bтетрагидро-1 Н-бензо[3,4]циклобута[1,2-с] пиррол. Процедура такая же, как в примере 1, стадии А-Е, с использованием на стадии А в качестве субстрата продукта получения 2. Температура плавления: 107-109 С (МК). Пример 3. цис-5-Метокси-3 а-[(3,4-метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро 1 Н-бензо[3,4]циклобута[1,2-c]пиррол и его гидрохлорид. Процедура такая же, как на стадии F примера 1, исходят из продукта, полученного в примере 2. Температура плавления (гидрохлорид): 218-223 С (МК). Пример 4. цис-5-Метокси-2-метил-3 а-[(3,4 метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1 Н-бензо[3,4]циклобута[1,2-с]пиррол. 0,75 г продукта, полученного в примере 3,в виде свободного основания, растворяют в 25 мл метанола и добавляют 1,35 г уксусной кислоты, 0,6 мл 37%-го формальдегида в воде и затем 0,25 г цианоборгидрида натрия. После реакции в течение 2 дней при температуре окружающей среды реакционную смесь концентрируют, берут в воду, подщелачивают гидроксидом натрия, экстрагируют этилацетатом,промывают водой и рассолом, сушат и концентрируют. Перекристаллизация из этанола позволяет выделить 0,42 г ожидаемого продукта. Температура плавления : 94-96 С (МК). Пример 5. цис-6-Трифторметил-3 а-[(3,4 метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1 Н-бензо[3,4]циклобута[1,2-c]пиррол и его гидрохлорид. Процедура такая же, как в примере 1, стадии A-F с использованием в качестве субстрата на стадии А продукта получения 3. Температура плавления (гидрохлорид): 186-190 С (МК). Пример 6. цис-6-Фтор-3 а-[(3,4-метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1 Нбензо[3,4]циклобута[1,2-c]пиррол и его гидрохлорид. 13 Процедура такая же, как в примере 1, стадии A-F с использованием в качестве субстрата на стадии А продукта получения 4. Температура плавления (гидрохлорид): 248-252 С (МК). Пример 7. цис-6-Фтор-2-метил-3 а-[(3,4 метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1 Н-бензо[3,4]циклобута[1,2-c]пиррол и его гидрохлорид. Процедура такая же, как в примере 4, с использованием в качестве исходного вещества продукта примера 6. Температура плавления : 212-216 С. Данные элементного микроанализа% вычислено 62,72 5,26 3,85 9,74 Пример 8. цис-7-Фтор-3 а-[(3,4-метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1 Нбензо[3,4]циклобута[1,2-c]пиррол и его гидрохлорид. Процедура такая же, как в примере 1, стадии A-F, с использованием в качестве исходного вещества на стадии А продукта получения 5. Температура плавления (МК): 215-219 С. Данные элементного микроанализа% вычислено 61,81 4,90 4,00 10,14 Пример 9. цис-5-Фтор-3 а-[(3,4-метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1 Нбензо[3,4]циклобута[1,2-c]пиррол и его гидрохлорид. Процедура такая же, как в примере 1, стадии A-F, с использованием в качестве исходного вещества на стадии А продукта получения 6. Температура плавления (МК): 196-198 С. Данные элементного микроанализа% вычислено 61,81 4,90 4,00 10,14 Пример 10. цис-5,6-Диметокси-3 а-[(3,4 метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1 Н-бензо[3,4]циклобута[1,2-c]пиррол и его гидрохлорид. Процедура такая же, как в примере 1, стадии A-F, с использованием в качестве исходного вещества на стадии А продукта получения 7. Температура плавления (МК): 202-206 С. Данные элементного микроанализа 14 Процедура такая же, как в примере 1, стадии A-F, с использованиием в качестве исходного вещества на стадии А продукта получения 8. Температура плавления (МК): 212-214 С. Данные элементного микроанализа% вычислено 60,73 4,83 3,73 9,43 Пример 12. 6-Метокси-3 а-[(3,4-метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1 Нбензо[3,4]циклобута[1,2-c]пиррол и его гидрохлорид. Процедура такая же, как в примере 1, стадии A-F, с использованием в качестве исходного вещества на стадии А продукта получения 9. Температура плавления (МК): 162-164 С. Данные элементного микроанализа[1,2-c]пиррол. Смесь, состоящую из 5,3 г продукта, полученного на стадии D примера 1, 9 г четырехбромистого углерода и 7,2 г трифенилфосфина в 115 мл эфира, нагревают с обратным холодильником в течение 24 ч. После охлаждения, отфильтровывания осадка и концентрирования полученный остаток очищают хроматографией на силикагеле (дихлорметан/этанол: 95/5), что позволяет выделить ожидаемый продукт. Стадия В. цис-2-Бензил-3 а-цианометил 2,3,3 а,7b-тетрагидро-1 Н-бензо[3,4]циклобута[1,2-c]пиррол. 4,76 г продукта, полученного на предшествующей стадии А растворяют в 75 мл тетрагидрофурана и затем порциями добавляют 6,26 г цианида тетрабутиламмония. После нахождения в течение 12 ч при температуре окружающей среды смесь разбавляют 75 мл эфира и затем выливают в 25 мл насыщенного раствора бикарбоната натрия. После разделения, промывки 1 н. соляной кислотой и затем подщелачивания органические фазы, полученные экстракцией дихлорметаном, промывают, сушат, фильтруют и затем концентрируют при пониженном давлении, что позволяет выделить ожидаемый продукт. Стадия С. цис-(2-Бензил-2,3,3 а,7b-тетрагидро-1 Н-бензо[3,4]циклобута[1,2-c]пиррол-3 аил)уксусная кислота. Смесь, состоящую из 2,64 г соединения,полученного на стадии В, и 31 мл 20%-й соляной кислоты, нагревают с обратным холодильником в течение 4 ч, затем добавляют 31 мл 20%-й соляной кислоты и нагревание с обратным холодильником поддерживают в течение 6 ч 30 мин. Смесь упаривают, позволяя выделить ожидаемый продукт, который используют как таковой на следующей стадии. СтадияD. цис-(2-Бензил-2,3,3 а,7bтетрагидро-1 Н-бензо[3,4]циклобута[1,2-c] пиррол-3 а-ил)этанол. В суспензию 0,73 г литийалюминийгидрида в 53 мл тетрагидрофурана добавляют порциями 3,32 г продукта, полученного на стадии С. Через 2 ч при температуре окружающей среды, реакционную смесь гидролизуют в холодном состоянии и образующийся осадок отфильтровывают. После упаривания растворителя выделяют ожидаемый продукт. 17 Стадия Е. цис-2-Бензил-3 а-[2-(3,4-метилендиоксифенокси)этил]-2,3,3 а,7b-тетрагидро-1 Нбензо[3,4]циклобута[1,2-c]пиррол. Процедура такая же, как в стадии Е примера 1, с использованием в качестве исходного вещества полученного выше продукта стадии D. Стадия F. цис-3 а-[2-(3,4-Метилендиоксифенокси)этил]-2,3,3 а,7b-тетрагидро-1 Н-бензо[3,4]циклобута[1,2-c]пиррол и его гидрохлорид. Процедура такая же, как в стадии F примера 1, с использованием в качестве исходного вещества полученного выше продукта стадии Е. Температура плавления: 204-207 С. Данные элементного микроанализа 18 Температура плавления (МК): 230-232 С. Пример 27. цис-3 а-[(3,4-дигидро-2 Н-тиохромен-7-илокси)метил]-2,3,3 а,7b-тетрагидро 1 Н-бензо[3,4]циклобута[1,2-c]пиррол и его гидрохлорид. Процедура такая же, как в примере 1, стадии A-F, с использованием 7-тиохроманола вместо 3,4-метилендиоксифенола на стадии Е этого примера. Температура плавления (МК): 248-250 С. Фармакологическое исследование соединений изобретения А. Исследование in vitro. Пример 28. Определение аффинности к сайтам обратного захвата серотонина. Аффинность определяли конкурентными экспериментами с использованием [3 Н]пароксетина (NEN, Les Ulis, Франция). Мембраны получают из коры лобных долей мозга крысы и инкубируют трехкратно с 1,0 нМ [3 Н]пароксетина и холодного лиганда в конечном объеме 0,4 мл в течение 2 ч при 25 С. Инкубационный буфер содержит 50 нМ ТРИС-НСl (рН 7,4), 120 мМ NaCl и 5 мМ KСl. Неспецифическое связывание определяют с использованием 10 мкМ циталопрама. В конце инкубирования инкубационную среду фильтруют и промывают три раза 5 мл охлажденного буфера. Радиоактивность, оставшуюся на фильтре, определяют жидкостным сцинтилляционным счетчиком. Изотермы связывания анализируют с помощью нелинейной регрессии для определения значений IC50. Эти значения преобразовывают в константу диссоциации (Ki) с использованием уравнения Ченга-Прусова (Cheng-Prusoff)[3 Н]-пароксетина для сайта обратного захвата серотонина (0,13 нМ). Результаты выражают в pKi (-log Ki). Соединения настоящего изобретения демонстрируют очень хорошую аффинность к сайтам обратного захвата серотонина. Например, pKi соединения примера 1 составляет 7,9. В. Исследование in vivo. Пример 29. Эксперимент по микродиализу на крысах. Крыс анестезировали пентобарбиталом (60 мг/кг, внутрибрюшинно). Их помещали в стереотаксическое устройство Kopf и канюльную направляющую имплантировали в поясковую часть фронтальной области коры головного мозга в соответствии с координатами, описанными в атласе Paxinos и Watson (1982) следующим образом: АР = +2,2; L = 0,6; DV = -0,2. Крыс помещали в отдельные клетки и использовали для диализа пятью днями позже. В день диализа зонд медленно опускали и держали в заданном положении. Зонд перфузировали со скоростью 1 мкл/мин раствором 147,2 мМ NaCl, 19 4 мМ KСl и 2,3 мМ СаСl2, доведенным до рН 7,3 с помощью фосфатного буфера (0,1 М). Через 2 часа после имплантации через каждые 20 мин на протяжении 4 ч отбирали образцы. Три базовых образца были отобраны перед введением испытуемых продуктов. Крысы оставались в индивидуальных клетках на протяжении всего эксперимента. По окончании эксперимента крыс обезглавливали и мозг удаляли и замораживали в изопентане. Разрезали на секции толщиной 100 мкМ м окрашивали крезилом фиолетовым,что позволяло проверить расположение зондов. Одновременно проводили количественное определение допамина, норэпинефрина и серотонина следующим образом: 20 мкл диализного образца разбавляли 20 мкл подвижной фазы(NaH2PO4: 75 мМ; ЭДТК: 20 мкМ; 1 декансульфонат натрия: 1 мМ; метанол: 17,5%; триэтиламин: 0,01%; рН: 5,70) и 33 мкл анализировали с помощью ВЭЖХ на колонке с обращенной фазой, термостатически поддерживаемой при 45 С, и оценивали количественно с помощью колориметрического детектора. Потенциал первого электрода детектора устанавливали при -90 мВ (восстановление), а второго при +280 мВ (окисление). Подвижную фазу подавали насосом со скоростью потока 2 мл/мин. Пределы чувствительности для допамина, норэпинефрина и серотонина составляют 0,55 фмоль на образец. Все продукты изобретения инъецировали подкожно в объеме 1,0 мл/кг. Продукты растворяли в дистиллированной воде, к которой при необходимости добавляли несколько капель молочной кислоты. Результаты. В качестве примера и для иллюстрации активности продуктов изобретения, соединение примера 1, введенное подкожно в дозе 10 мг/кг,увеличивало уровни серотонина, допамина и норадреналина на+226,3%20,1; +54,8%6,4 и +96,4%7,8 соответственно (максимальный % действия в сравнении с уровнем основной линии, принятым за 0%). Пример 30. Тест на агрессивность на изолированных мышах. Это испытание позволяет оценить внутривидовую противоагрессивную активность продукта на мышах, которых содержали в изоляции в течение нескольких месяцев. Животные. В испытании используют самцов мышейCD (Charles River) весом от 22 до 25 г, когда они прибывали в виварий. По прибытии животных изолируют, помещая их в индивидуальные клетки, изготовленные из непрозрачного черного поликарбоната (231413 см), с решетчатой крышей и содержат в течение продолжительного периода (приблизительно шесть месяцев) в комнате для экспериментов. 20 Выбор пар мышей. Выбор агрессивных пар мышей, которые будут использоваться на протяжении длительного периода времени в исследовании, начинают после того, как животные пробыли в изоляции в течение одного месяца. Один или два раза в неделю мышь из другой клетки (захватчик) помещают в клетку (постоянно проживающей) мыши и наблюдают за этими двумя животными,чтобы выяснить, будут ли они нападать друг друга (сопение, погоня, ловля, укусы) во время испытания. В конце испытания (максимальная продолжительность 10 мин) каждую мышь снова изолируют в ее собственную клетку. Если нападение происходит, то эту же пару будут снова испытывать в следующем испытании,если нападение не произошло, то каждая мышь из этой пары будет помещаться к другой мыши в последующем испытании. Таким образом, в ходе последовательных испытаний, проводимых с периодичностью 1 или 2 раза в неделю, выбирают определенные пары мышей, которые будут использоваться в эксперименте. Выбор пар основан на стабильности воинственного характера животных от одного испытания до следующего,краткости латентного периода первого нападения и частоты и продолжительности нападений. Для выбранных таким образом пар эти параметры контролируют каждую неделю путем быстрого опыта без обработки за два дня до дня тестирования. Тестирование. Испытание проходит один раз в неделю. За 30 мин перед тем, как их помещают вместе, каждую из двух мышей пары одинаково обрабатывают (продукт или растворитель) и оставляют в изоляции в соответствующих клетках. В момент Т 0 мин мышь-захватчика помещают в клетку мыши-резидента на период 3 мин. Регистрируют латентный период (в секундах) первого нападения, число и общую продолжительность нападений (в с). Также отмечают любое изменение в доминировании одной мыши над другой (обычно, мышь-резидент является доминирующей мышью). В конце испытания мышь-захватчика возвращают в ее клетку; животные остаются в изоляции до следующего быстрого опыта и тестирования на следующей неделе. Ингибирующая доза 50 числа или продолжительности нападений является дозой продукта, которая снижает наполовину среднее каждого из этих значений в сравнении со значениями,полученными соответственно в контрольной группе. Результаты. В качестве примера и для иллюстрации активности продуктов изобретения ингибирующая доза 50 для соединения примера 1 составляет менее 5 мг/кг, внутрибрюшинно.R1, R2 и R3, которые могут быть одинаковыми или различными, каждый независимо от других, представляет группу, выбранную из атома водорода, атома галогена, линейной или разветвленной (С 1-С 6)алкоксигруппы, линейной или разветвленной (С 1-С 6)тригалогеналкильной группы, или два из R1, R2 и R3 в смежных положениях представляют (С 1-С 2)алкилендиоксигруппу;R4 представляет группу, выбранную из атома водорода, линейной или разветвленной(С 1-С 6)алкильной группы, арил-(С 1-С 6)алкильной группы, в которой алкильная часть является линейной или разветвленной;R5 представляет арильную группу, необязательно замещенную арильную группу, гетероарильную группу или необязательно замещенную гетероарильную группу;n представляет целое число от 1 до 2 включительно; его изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием,причем имеется в виду, что циклоалкильная группа означает (С 3-С 8)моноциклическую насыщенную кольцевую систему, кроме того,арильная группа означает фенил или группу инданила, и необязательно замещенная арильная группа означает арильную группу, определенную ранее, необязательно замещенную одной или несколькими группами, которые могут быть одинаковыми или различными, и выбраны из линейного или разветвленного (С 1-С 6)алкила,линейного или разветвленного (С 1-С 6)алкокси,циклоалкила, адамантила, линейного или разветвленного (C1-С 6)тригалогеналкила, оксо и(С 1-С 2)алкилендиокси, гетероарильная группа означает группу, выбранную из бензоксадиазолила, хроменила, тиохроманила и дигидробензофуранила, а необязательно замещенная гетероарильная группа означает гетероарильную группу, определенную ранее, необязательно замещенную одной или несколькими группами,которые могут быть одинаковыми или различными, определенными для замещения арильных групп. 2. Соединения формулы (I) по п.1, отличающиеся тем, что R5 представляет гетероарильную группу, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием. 22 3. Соединения формулы (I) по п.1, отличающиеся тем, что R5 представляет метилендиоксифенильную или этилендиоксифенильную группу, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы (I) по п.1, отличающиеся тем, что n равно 1, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы (I) по п.1, отличающиеся тем, что n равно 2, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием. 6. Соединения формулы (I) по п.1, отличающиеся тем, что R4 представляет атом водорода, линейную или разветвленную (С 1 С 6)алкильную группу или арил-(С 1-С 6)алкильную группу, в которой алкильная часть является линейной или разветвленной, их изомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием. 7. Соединение формулы (I) по п.1, представляющее цис-3 а-[(3,4-метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1 Н-бензо[3,4] циклобута[1,2-c]пиррол и его гидрохлорид. 8. Соединение формулы (I) по п.1, представляющее цис-2-бензил-5-метокси-3 а-[(3,4 метилендиоксифенокси)метил]-2,3,3 а,7bтетрагидро-1 Н-бензо[3,4]циклобута[1,2-с] пиррол. 9. Соединение формулы (I) по п.1, представляющее цис-5-метокси-3 а-[(3,4-метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1Hбензо[3,4]циклобута[1,2-с]пиррол и его гидрохлорид. 10. Соединение формулы (I) по п.1, представляющее цис-5-метокси-2-метил-3 а-[(3,4 метилендиоксифенокси)метил]-2,3,3a,7bтетрагидро-1 Н-бензо[3,4]циклобута[1,2-с] пиррол. 11. Соединение формулы (I) по п.1, представляющее цис-6-трифторметил-3 а-[(3,4-метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1 Н-бензо[3,4]циклобута[1,2-с]пиррол и его гидрохлорид. 12. Соединение формулы (I) по п.1, представляющее цис-6-фтор-3 а-[(3,4-метилендиоксифенокси)метил]-2,3,3 а,7b-тетрагидро-1 Нбензо[3,4]циклобута[1,2-с]пиррол и его гидрохлорид. 13. Фармацевтическая композиция, включающая в качестве активного ингредиента, по крайней мере, одно или более соединений формулы (I) по любому из пп.1-12 само по себе или в сочетании с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми эксципиентами или носителями. 14. Фармацевтическая композиция по п.13,включающая, по крайней мере, один активный ингредиент по любому из пп.1-12 для использования в качестве ингибитора обратного захвата серотонина при лечении депрессии, приступов паники,обсессивно-компульсивных расстройств, фобий, импульсивных болезненных 24 состояний, злоупотребления лекарственными средствами и тревожных состояний.
МПК / Метки
МПК: C07D 209/58, A61P 25/24, A61K 31/403
Метки: производные, качестве, 1,2-c, пиррола, бензо[3,4, ингибиторов, применение, серотонина, циклобута, обратного, захвата
Код ссылки
<a href="https://eas.patents.su/13-3302-proizvodnye-benzo34-ciklobuta-12-c-pirrola-i-ih-primenenie-v-kachestve-ingibitorov-obratnogo-zahvata-serotonina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные бензо[3,4] циклобута [1,2-c] пиррола и их применение в качестве ингибиторов обратного захвата серотонина</a>
Предыдущий патент: Способ получения лекарственного средства из ткани мозга эмбрионов животного и фармакологическая композиция на его основе
Следующий патент: Способ лечения диабета тиазолидиндионом и сульфонилмочевиной
Случайный патент: Способ и система для передачи данных в сетях низкого напряжения












