Способ очистки метил{4,6-диамино-2-[1-(2-фторбензил)-1н-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-ил}метилкарбамата и его производное в виде сульфинилдиметана
Номер патента: 22813
Опубликовано: 31.03.2016
Авторы: Майс Франц-Ёзеф, Йонтген Винфрид, Зигель Конрад, Резе Йоахим
Формула / Реферат
1. Способ очистки метил{4,6-диамино-2-[1-(2-фторбензил)-1Н-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-ил}метилкарбамата формулы
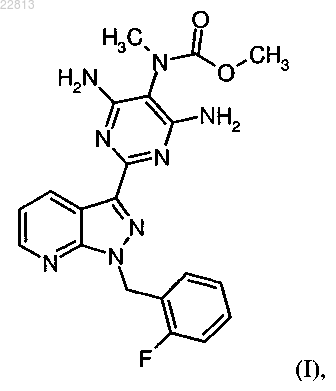
отличающийся тем, что исходный продукт соединения формулы (I) растворяют в диметилсульфоксиде и образованный при этом метил{4,6-диамино-2-[1-(2-фторбензил)-1Н-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-ил}метилкарбамат-сульфинилдиметан (1:1) формулы
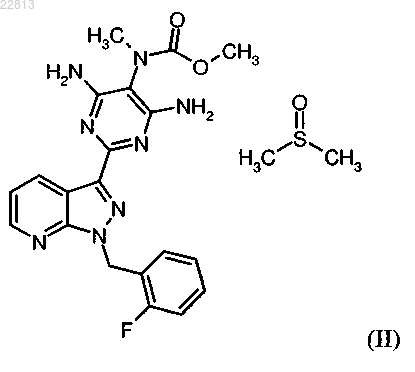
выделяют и затем удаляют диметилсульфоксид при вываривании в фармацевтически приемлемом растворителе.
2. Метил{4,6-диамино-2-[1-(2-фторбензил)-1Н-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-ил}метилкарбамат-сульфинилдиметан формулы
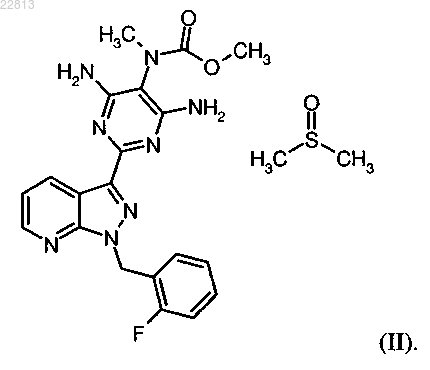
Текст
СПОСОБ ОЧИСТКИ МЕТИЛ 4,6-ДИАМИНО-2-[1-(2-ФТОРБЕНЗИЛ)-1 Н-ПИРАЗОЛО[3,4b]ПИРИДИН-3-ИЛ]ПИРИМИДИН-5-ИЛМЕТИЛКАРБАМАТА И ЕГО ПРОИЗВОДНОЕ В ВИДЕ СУЛЬФИНИЛДИМЕТАНА Изобретение касается способа очистки метил 4,6-диамино-2-[1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин 3-ил]пиримидин-5-илметилкарбамата формулы (I), заключающегося в том, что исходный продукт соединения формулы (I) растворяют в диметилсульфоксиде и образованный при этом метил 4,6-диамино-2[1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-илметилкарбамата-сульфинилдиметан(1:1) формулы (II) выделяют и затем удаляют диметилсульфоксид при вываривании в фармацевтически приемлемом растворителе. Описывается также метил 4,6-диамино-2-[1-(2-фторбензил)-1H-пиразоло[3,4b]пиридин-3-ил]пиримидин-5-илметилкарбамат-сульфинилдиметан.(71)(73) Заявитель и патентовладелец: АДВЕРИО ФАРМА ГМБХ (DE) Настоящее изобретение касается способа очистки метил 4,6-диамино-2-[1-(2-фторбензил)-1Hпиразоло[3,4-b]пиридин-3-ил]пиримидин-5-илметилкарбамата формулы (I) для применения в качестве фармацевтического активного вещества для очистки метил 4,6-диамино-2-[1(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-илметилкарбамат-сульфинилдиметана(1:1), т.е. в данном способе очистки соединение формулы (II) выделяют или получают в качестве промежуточной стадии, при необходимости в смеси. Соединение формулы (I) действует как стимулятор растворимой гуанилатциклазы и может применяться как в качестве средства профилактики и/или лечения сердечно-сосудистых заболеваний, как, например, для лечения повышенного кровяного давления и сердечной недостаточности, стабильной и нестабильной стенокардии, заболеваний периферических и кардиальных сосудов, аритмии, для лечения тромбоэмболических заболеваний и ишемии, как инфаркт миокарда, кровоизлияние в мозг, транзиторные ишемические атаки, периферические нарушения кровоснабжения, предотвращение развития рестеноза, как после тромболитической терапии, перкутанной транслюминальной ангиопластики (ПТА), перкутанной транслюминальной коронарной ангиопластики (ПТКА), шунтирования, а также для лечения артериосклероза, астматических заболеваний и болезней мочеполовой системы, как, например, гипертрофия предстательной железы, эректильной дисфункции, женской сексуальной дисфункции, остеопороза, глаукомы, пульмональной гипертонии, гастропареза и недержания. Получение соединения формулы (I) и его очистка, в принципе, известны. В WO 03/095451 описано получение соединения формулы (I) следующим образом: Причем сначала расщепляют 2-[1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]-5-[(Е)фенилдиазенил]пиримидин-4,6-диамин формулы (III) с помощью каталитического гидрирования и полученное соединение трисамин выделяют в качестве 2-[1-(2-фторбензил)-1 Н-пиразоло[3,4-b]пиридин-3 ил]-4,5,6-пиримидинтриамин тригидрохлорида формулы (IV). Затем этот тригидрохлорид превращают сложным метиловым эфиром хлормуравьиной кислоты формулы (V) в метил-4,6-диамино-2-[1-(2 фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]-5-пиримидинилкарбамат формулы (VI) в пиридине в качестве растворителя. Альтернативно, в Chem. Med. Chem. 2009, 4, 853-865 описывают, что соединение трис-амин выделяют в качестве тригидрохлорида, затем получают свободное основание HCl при экстрагировании водного NaHCO3-раствора и свободное основание превращают сложным метиловым эфиром хлормуравьиной кислоты формулы (V) в соединение формулы (VI) в пиридине в качестве растворителя. Затем соединение формулы (VI) превращают метилйодидом формулы (VII) в присутствии основания в исходный продукт соединения формулы (I). Очистку исходного продукта соединения формулы (I) осуществляют согласно экспериментального предписания примера 8 WO 03/095451 и сравнимого описанияChem. Med. Chem. 2009, 4, 853-865 с помощью вымешивания исходного продукта в дихлорметане/ТГФ,промежуточного выделения продукта, полученного при вымешивании дихлорметана/ТГФ, с помощью фильтрации, вываривания выделенного твердого вещества с метанолом, промежуточного выделения твердого вещества, полученного при вываривании с метанолом, с помощью фильтрации, растворения твердого вещества в смеси диоксана, дихлорметана и метанола в присутствии активного угля, фильтрации активного угля через кизельгур или диатомовую землю, сгущения фильтровального раствора до сухого состояния, вымешивания твердого вещества, сгущенного до сухого состояния, с метанолом, выделения твердого вещества, вымешанного метанолом, с помощью фильтрации и (не описанного вWO 03/0945451 в примере 8 или Chem. Med. Chem. 2009, 4, 853-865, но объективно необходимого) высушивания. Также очистку исходного вещества, сгущенного до сухого состояния, соединения формулы(I) можно осуществлять препаративной хроматографией (ОФ-ЖХВР) с низким выходом. Указанные синтез и очистки имеют ряд недостатков, которые являются очень неблагоприятными для технического выполнения в крупном масштабе. Прежде всего, это относится к выделению соединения трис-амин в качестве тригидрохлорида формулы (IV). Добавление соляной кислоты требует технической установки, устойчивой к воздействию кислот, и выход этапа составляет только 59,3% - теоретический выход продукта (что является недостаточным) (см., например, пример 8 А из WO 03/095451). Также замещение соединения трис-амин формулы (ГУ) или соответственного HCl-свободного основания в пиридине в качестве растворителя является невыгодным. Соединение формулы (VI) можно изолировать только полным выпариванием реакционной смеси (см., например, пример 5 WO 03/095451), которое также является технически невыгодным. Такие этапы, как правило, ведут к значительным проблемам в крупном масштабе, как, например, припекание или термическое разложение по причине большой термической нагрузке в крупном масштабе. Крайне невыгодной также является очистка продукта формулы(VI) согласно экспериментальному предписанию примера 5 из WO 03/095451 вывариванием в диэтилэфире. Также по причине легкой воспламеняемости диэтилэфира этот этап можно проводить только при повышенных технических затратах. Тем не менее, способы очистки исходного вещества формулы (I) являются невыгодными. Эффективная очистка крайне необходима для использования в качестве фармацевтического биологически активного вещества. Описанная очистка с помощью ОФ-ЖХВР, т.е. хроматографическая очистка, представляет собой очень трудоемкие в техническом масштабе лабораторные методы. Кроме того, указанный выход в 29% и очистка этапа синтеза исходного продукта формулы (I) являются очень низкими. Альтернативный метод получения и очистки является крайне затруднительным. В общем, он содержит 5 этапов отделения твердого вещества (2 сгущения до сухого состояния и 3 фильтрации), причем, как упоминалось ранее, сгущения до сухого состояния являются очень неблагоприятными в техническом масштабе. В целом, 5 этапов отделения твердого вещества для получения и очистки фармацевтического биологически активного вещества являются очень невыгодными в техническом масштабе для проведения химической ступени. Ранее задача заключалась в обнаружении упрощенного способа, который можно безопасно проводить в промышленном масштабе, в результате которого образуется биологически активное вещество с высоким выходом и фармацевтической чистотой приемлемого качества. Неожиданно был обнаружен способ очистки метил 4,6-диамино-2-[1-(2-фторбензил)-1Hпиразоло[3,4-b]пиридин-3-ил]пиримидин-5-илметилкарбамата формулы (I) для применения в качестве фармацевтического биологически активного вещества, в котором исходный продукт соединения формулы (I) растворяют в диметилсульфоксиде и образованный при этом метил 4,6-диамино-2-[1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5 илметилкарбамат-сульфинлдиметан (1:1) формулы выделяют и затем снова удаляют диметилсульфоксид при вываривании в фармацевтически приемлемом растворителе. Указанный новый способ очистки исходного вещества соединения формулы (I) отличается от ранее известных способов тем, что очистка исходного продукта формулы (I) для применения в качестве фармацевтического биологически активного вещества происходит через соединение метил-4,6-диамино-2[1-(2-фторбензил)-1 Н-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-илметилкарбамат-сульфинилдиметан(1:1), т.е. соединение формулы (II) получают как промежуточную стадию, полученную в смеси Это отличие делает возможным устранение недостатков ранее известных способов и получение биологически активного вещества с высоким выходом и высокой чистотой фармацевтически приемлемого качества. Далее подробно описан способ очистки согласно изобретению через промежуточный продукт формулы (II). Очистка исходного продукта соединения формулы (I) Исходный продукт формулы (I) очищают согласно изобретению для использования в качестве фармацевтического биологически активного вещества. Для этого сначала получают смесь, которая содержит соединение формулы (II) в качестве промежуточного продукта с высоким содержанием: Для этого исходный продукт формулы (I) растворяют в ДМСО (диметилсульфоксиде) при необходимости в присутствии фармацевтически приемлемых простых растворителей из класса кетонов, простых и сложных эфиров и спиртов. В качестве примеров таких растворителей должны быть названы: метанол, этанол, изопропанол, 1-бутанол, 2-бутанол, этилацетат, изопропил- или пропилацетат, бутилацетат, трет-бутилметиловый эфир, диизопропиловый эфир, ацетон, метилэтилкетон, метилизобутилкетон и т.д. Предпочтительными являются этанол, изопропанол, этилацетат, изопропилацетат, бутилацетат, метилэтилкетон, метилизобутилкетон, особенно предпочтительным является этилацетат. Также можно использовать смеси этих растворителей. ДМСО добавляют в количестве 100-750 мас.% на применяемое количество исходного продукта формулы (I), предпочтительно 150-500 мас.%. При необходимости к этой смеси можно добавлять активный уголь в количестве 0,25-35 мас.% на применяемое количество исходного продукта формулы (I), предпочтительно 0,5-20 мас.%. Для получения раствора смесь нагревают до 40-120 С, предпочтительно до 50-100 С. Для получения фармацевтически приемлемого продукта формулы (I) раствор должен быть отфильтрован. Фильтрацию следует проводить независимого от того, добавляют активный уголь или нет. Количество фармацевтически приемлемого растворителя, который применяют для растворения исходного продукта формулы (I), помимо ДМСО, т.е. перед фильтрацией, составляет 25-200 мас.% относительно ДМСО, предпочтительно 40-100 мас.%. Фильтрацию проводят при очень высоких температурах, 40-120 С, предпочтительно 50-100 С. После фильтрации при очень высоких температурах добавляют фармацевтически приемлемый растворитель, предпочтительно используют такие же растворители, как ранее. Вследствие этого продукт формулы (II) ведет к кристаллизации. Общее количество растворителя, добавляемого перед и после фильтрации, составляет 200-1500 мас.% относительно ДМСО, предпочтительно 400-1200 мас.%. Температура добавления составляет 30-110 С, предпочтительно 35-90 С. Перед изолированием твердое вещество, которое содержит соединение формулы (II) в большом количестве, охлаждают для улучшения выделения при температуре 0-35 С, предпочтительно при нормальном температуре, например 20-30 С. Выделение проводят в обычных изолирующих агрегатах, как нутч-фильтр или центрифуга. Для извлечения маточного раствора выделенный материал перед выделением промывают фармацевтически приемлемым растворителем, предпочтительно используют такой же растворитель, как ранее. Выделенный материал после повторного растворения ДМСО содержит продукт формулы (II) в большом количестве. Наряду с этим продукт формулы (I) может также обычно выпадать в осадок в небольших количествах без образования сольвата с ДМСО. Возможно также образование сольватов другой стехиометрии или образование аддуктов растворителя без точно установленной стехиометрии. Кроме этого, ДМСО также может находиться в несвязанной форме как остаток, свойственный растворителю. Содержание ДМСО в выделенном материале обычно составляет 10-25 мас.%, предпочтительно 12-17 мас.%. Особенно предпочтительным согласно изобретению является получение продукта формулы(II) в форме этой смеси и использование для изготовления очищенного продукта формулы (I). Полученный таким образом продукт формулы (II) можно высушить или также использовать во влажном состоянии с оставшейся частью растворителя, т.е. ДМСО и растворителем или растворителями,используемыми для превращения в очищенный продукт формулы (I). Соединение формулы (II) является новым. Оно, как описано в нижеследующих примерах выполнения, может быть получено в чистом виде и охарактеризовано аналитическим путем. Для фармацевтического применения из продукта формулы (II) или смеси, которая содержит соединение формулы (II) в большом количестве, необходимо извлечь ДМСО. Для этого продукт формулы (II) или выделенную смесь, которая содержит продукт формулы (II) в большом количестве, вываривают в фармацевтически приемлемом растворителе из класса кетонов, простых и сложных эфиров или спиртов. В качестве примеров таких растворителей должны быть названы: метанол, этанол, изопропанол, 1-бутанол, 2-бутанол, этилацетат, изопропил- или пропилацетат,бутилацетат, трет-бутилметиловый эфир, диизопропиловый эфир, ацетон, метилэтилкетоны, метилизобутилкетон и т.д. Предпочтительными являются этанол, изопропанол, этилацетат, изопропилацетат, бутилацетат, метилэтилкетон, метилизобутилкетон. Также можно использовать смеси этих растворителей. Особенно предпочтительным является этилацетат или смесь этилацетата с этанолом. Вываривание проводят при обратном потоке соответствующего растворителя или при необходимости при слегка повышенном давлении. Температура составляет 50-150 С, предпочтительно 80-120 С. Неожиданным было то, что очищение исходного продукта формулы (I) для фармацевтического применения осуществляют повторным растворением со смесью растворителей, содержащей ДМСО, и что при этом получают новое соединение формулы (II) при необходимости в качестве промежуточного этапа в смеси в большом количестве. На этом этапе отделяют все примеси до небольшого оставшегося количества, так что после удаления ДМСО простым вывариванием остается твердое вещество формулы(I) высокой степени очистки. Это твердое вещество, как правило, бесцветное до бледно-желтого, и аналитическая чистота (высокопроизводительная жидкостная хроматография) составляет значительно выше 98 мас.%, что очень благоприятно для фармацевтического применения. В техническом выполнении способ является надежным и подходит для производства в промышленном масштабе. Он может быстро приспосабливаться к производственным аппаратурным условиям. Особенно предпочитаемой формой выполнения является то, что при очистке исходного продукта формулы(I) проводят промежуточное изолирование продукта формулы (II) или смеси, которая содержит соединение формулы (II) в большом количестве, в нутч-сушилке. Нижеследующее удаление ДМСО из продукта формулы (II), который был промежуточно выделен в нутч-сушилке, осуществляют прямым добавлением растворителя в нутч-сушилку с или без промежуточного высушивания продукта формулы (II). Благодаря этому не допускают открытых манипуляций, проводимых с твердым веществом продукта формулы (II),из-за угрозы загрязнения. Экспериментальная часть Сокращения и аббревиатуры:EI - ионизация электронным ударом (при МС);HPLC жидкостная хроматография высокого давления, высокопроизводительная жидкостная хроматография;wssr. - водный, водный раствор. Дальнейшие примеры разъясняют изобретение, действуя без ограничений. Пример 1. Получение 2-[1-(2-фторбензил)-1 Н-пиразоло[3,4-b]пиридин-3-ил]-4,5,6-пиримидинтриамина (VIII). В конвертере превратили в суспензию 1100 г соединения формулы (III) в 5,4 л ДМФ. Добавили 44 г принятого в торговле влажного (около 50%) катализатора 5% Pd на угле и закрытый автоклав гидрировали азотом после создания атмосферы инертного газа при давлении водорода 65 бар около 18 ч и при внутренней температуре около 60 С. После охлаждения примерно на 25 С, понижении давления и инертизирования извлекли содержимое автоклава и промыли 650 мл диметилсульфоксида. Три аналогично полученные смеси объединили, отработавший катализатор отфильтровали, промыли 1,1 л ДМФ и фильтрат сгустили в вакууме приблизительно до третьей части его массы. В остаток около 6,5 кг по очереди добавили 8,25 л метанола и 8,25 л воды, суспензию охладили для улучшения кристаллизации до 5 С, твердое вещество отфильтровали и промыли метанолом/водой (1:1 объема). Продукт высушили при 50 С в вакууме. Навеска составила 2415 г, соответственно 91,8% теор. выхода. Содержание целевого продукта формулы (VIII) (свободное основание) составило 98% площади или 97 мас.%. Самыми большими примесями были ДМФ (около 0,8 мас.%) и вода (около 0,5 мас.%). Пример 2. Получение метил-4,6-диамино-2-[1-(2-фторбензил)-1 Н-пиразоло[3,4-b]пиридин-3-ил]-5 пиримидинилкарбамата (VI). В реакционный сосуд положили 3063 г соединения формулы (VIII) и 30,7 л технического изопропанола. К ним при помешивании добавили 1641 г диметилдикарбоната при 20-25 С и перемешивали 22 ч при этой температуре. Откачали продукт, выпавший в осадок, промыли техническим изопропанолом и высушили в вакууме при температуре 50 С. Получили навеску 3748 г, соответственно 105,9% теор. выхода. Кроме того, продукт формулы (I) содержал около 4,7% практически не удаляемого при сушке изопропанола (частично представлял собой сольват изопропанола) и аналитическое содержание составило 89,5 мас.% (высокопроизводительная жидкостная хроматография). Относительно этого количества выход составил 94,8% теор. выхода. Пример 3. Получение 2-[1-(2-фторбензил)-1 Н-пиразоло[3,4-b]пиридин-3-ил]-4,5,6-пиримидинтриамина (VIII). В конвертер положили 300 г соединения формулы (Ш), 1600 мл ДМФ и 60 г влажного никеля Ренея и после создания атмосферы инертного газа при внутренней температуре 60 С, давлении водорода 65 бар гидрировали около 18 ч. После охлаждения и понижения давления отфильтровали отработавший катализатор и промыли 100 мл ДМФ. Фильтрат сгустили в вакууме до 534,5 г и к остатку при температуре 3540 С добавили 750 мл метанола и затем после охлаждения при 0-5 С добавили 750 мл воды. Твердое вещество отфильтровали и высушили в вакууме при температуре 50 С. Навеска составила 219,7 г, соответственно 91,8% теор. выхода. Пример 4. Получение метил-4,6-диамино-2-[1-(2-фторбензил)-1 Н-пиразоло[3,4-b]пиридин-3-ил]-5 пиримидинилкарбамата (VI). В реакционный сосуд положили 1,50 кг соединения формулы (VIII) в 14,25 л изопропанола и нагрели до 35 С при помешивании. К нему равномерно, быстро, в течение 30 мин добавили 531 г сложного метилового эфира хлормуравьиной кислоты, промыли 750 мл изопропанола и перемешивали 16 ч при 35 С. Затем нагрели до 50 С, добавили 3,85 л метанола и 606 г триэтиламина при 50 С при помешивании и промыли 450 мл метанола. Затем перемешивали 1 ч при температуре 50 С, охладили до комнатной температуры и перемешивали при комнатной температуре 1 ч. Откачали твердое вещество в виде суспензии, дважды промыли 3,0 л изопропанола/метанола (4:1) и один раз 3,0 л изопропанола и откачали в сухом состоянии. Влажный продукт высушили при температуре 50 С в течение 1 ч и затем при 100 С в течение 22 ч в сушильном вакуумном шкафу. Получили навеску 1,793 кг, соответственно 103,3% теор. выхода. Продукт формулы (VI) содержал 6,45% практически не удаляемого при сушке изопропанола(частично представлял собой сольват изопропанола) и аналитическое содержание составило 87,9 мас.%(высокопроизводительная жидкостная хроматография). Относительно этого количества выход составил 90,8% теор. выхода.(Метилирование осуществляют обычным способом согласно WO 03/095451, пример 8 второй этап). 1630 г соединения формулы (VI) превратили в суспензию при температуре 20-25 С в 16,3 л ТГФ. Охладили от -6 до -4 С и добавили 3480 г 1 М раствора бис-(триметилсилил)натрийамида. Перемешали и добавили 596 г метилйодида, быстро перемешали и медленно подогрели до 5 С. Помешивали при этой температуре до окончания превращения (около 4 ч). Реакционную смесь промыли 4 раза 4,1 л 15%-ного раствора хлорида аммония. Выпарили органическую фазу примерно до 6,4 кг остатка и установили температурный режим около 25 С. Твердое вещество, выпавшее в осадок, отфильтровали, промыли 3 л ТГФ и высушили в вакууме при температуре 50 С. Получили 1112 г исходного продукта формулы (I). Это составило 75,2% теор. выхода. Пример 6. Получение смеси, состоящей из метил-4,6-диамино-2-[1-(2-фторбензил)-1 Н-пиразоло[3,4b]пиридин-3-ил]-5-пиримидинил(метил)карбамата (I) и метил-4,6-диамино-2-[1-(2-фторбензил)-1Hпиразоло[3,4-b]пиридин-3-ил]пиримидин-5-илметилкарбамат-сульфинилдиметана (II) с высоким содержанием продукта формулы (II). 9,0 г исходного продукта формулы (I), полученного сравнимым способом в сравнительном примере 5, растворили в 16 мл ДМСО при 100 С. (Осветление, которое было бы необходимо в этот момент для получения фармацевтически приемлемого качества продукта, в этом лабораторном испытании пропускают). Затем охлаждают до 75 С, добавляют 110 мл этилацетата и медленно охлаждают примерно до 25 С. Твердое вещество, выпавшее в осадок, отфильтровали, промыли 28 мл этилацетата и высушили в вакууме при 50 С. Навеска составила 9,6 г, соответственно 90% теор. выхода. Пример 7. Получение очищенного метил-4,6-диамино-2-[1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]5-пиримидинил(метил)карбамата (I). Общее количество полученного в вышеназванном примере 6 продукта формулы (II) перемешивали в 135 мл этилацетата 1 ч в обратном потоке (около 78 С) и охлаждали примерно до 25 С. Откачали твердое вещество, промыли 36 мл этилацетата и высушили в вакууме. Навеска составила 7,6 г, соответственно 93,8% теор. выхода. Содержание продукта оказалось значительно выше 98 мас.% (высокопроизводительная жидкостная хроматография). В качестве растворителя содержался этилацетат в количестве 0,2%. Содержание диметилсульфоксида оказалось менее 0,1%. Пример 8. Получение очищенного метил-4,6-диамино-2-[1-(2-фторбензил)-1 Н-пиразоло[3,4-b]пиридин-3-ил]5-пиримидинил(метил)карбамата (I) с промежуточным выделением смеси с высоким содержанием метил 4,6-диамино-2-[1-(2-фторбензил)-1 Н-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-илметилкарбаматсульфинилдиметана (II) в качестве влажного продукта. 193,5 г исходного продукта формулы (I), полученного сравнимым способом в сравнительном примере 5, растворили в 344 мл ДМСО и 172 мл этилацетата примерно при 96 С. Затем добавили 19,4 г активного угля и 172 мл этилацетата и перемешали при очень высокой температуре. Потом при этой же температуре активный уголь отфильтровали и промыли 172 мл этилацетата. Установили температуру для фильтрата в 78 С и медленно смешали с 1850 мл этилацетата. Смесь охлаждали примерно в течение 2-3 ч до 25 С, отфильтровали твердое вещество и промыли общим количеством 772 мл этилацетата. Влажный продукт, который содержал большое количество соединения формулы (II) в смеси, превратили в суспензию в 2900 мл этилацетата, нагрели 1 ч при обратном потоке и охладили примерно до 25 С. Откачали твердое вещество, промыли 774 мл этилацетата и высушили в вакууме при температуре 50 С. Получили 155,1 г навески, соответственно 80,2% прим. кол. Содержание продукта оказалось значительно выше 98 мас.% (высокопроизводительная жидкостная хроматография). В качестве растворителя содержался практически только этилацетат и диметилсульфоксид в небольшом количестве. Пример 9. Получение и аналитическая характеристика метил 4,6-диамино-2-[1-(2-фторбензил)-1 Нпиразоло[3,4-b]пиридин-3-ил]пиримидин-5-илметилкарбамат-сульфинилдиметана (II). 14,8 г исходного продукта формулы (I), полученного сравнимым способом в сравнительном примере 5, растворили в 28,9 г ДМСО и 11,85 г этилацетата примерно при 94 С. Затем добавили 1,5 г активного угля Norit A-Supra и затем 11,85 г этилацетата, перемешивали 1 ч при обратном потоке (88-90 С) и отфильтровали активный уголь в горячем состоянии. Уже частично выпавшее в осадок твердое вещество снова растворили при нагревании примерно до 78 С и затем раствор медленно остудили. Твердое вещество, выпавшее в осадок, отфильтровали при комнатной температуре, промыли 3 раза по 50 мл этилацетата и высушили в вакууме при 30 С в течение 18 ч в сушильном шкафу. Получили 9,2 г, соответственно 52,5% теор. выхода слегка желтоватого кристаллического порошка соединения формулы (II). ВЭЖХ: 99,90% жид. (не принимая во внимание ДМСО). ДМСО (Гц): 14,7 мас.% ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ очистки метил 4,6-диамино-2-[1-(2-фторбензил)-1 Н-пиразоло[3,4-b]пиридин-3 ил]пиримидин-5-илметилкарбамата формулы отличающийся тем, что исходный продукт соединения формулы (I) растворяют в диметилсульфоксиде и образованный при этом метил 4,6-диамино-2-[1-(2-фторбензил)-1 Н-пиразоло[3,4-b]пиридин-3 ил]пиримидин-5-илметилкарбамат-сульфинилдиметан (1:1) формулы выделяют и затем удаляют диметилсульфоксид при вываривании в фармацевтически приемлемом растворителе. 2. Метил 4,6-диамино-2-[1-(2-фторбензил)-1 Н-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5 илметилкарбамат-сульфинилдиметан формулы
МПК / Метки
МПК: C07D 471/04
Метки: виде, сульфинилдиметана, метил{4,6-диамино-2-[1-(2-фторбензил)-1н-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-ил}метилкарбамата, очистки, производное, способ
Код ссылки
<a href="https://eas.patents.su/9-22813-sposob-ochistki-metil46-diamino-2-1-2-ftorbenzil-1n-pirazolo34-bpiridin-3-ilpirimidin-5-ilmetilkarbamata-i-ego-proizvodnoe-v-vide-sulfinildimetana.html" rel="bookmark" title="База патентов Евразийского Союза">Способ очистки метил{4,6-диамино-2-[1-(2-фторбензил)-1н-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-ил}метилкарбамата и его производное в виде сульфинилдиметана</a>
Предыдущий патент: Тонкостенный холодноформованный легкий строительный профильный элемент и способ изготовления такого профильного элемента
Следующий патент: Датчик системы контроля занятости пути
Случайный патент: Синергетическая гербицидная композиция












