Способ получения пиразоло [4,3-d] пиримидин-7-онов и их промежуточные продукты
Формула / Реферат
1. Способ получения соединения формул (IA) и (IB)
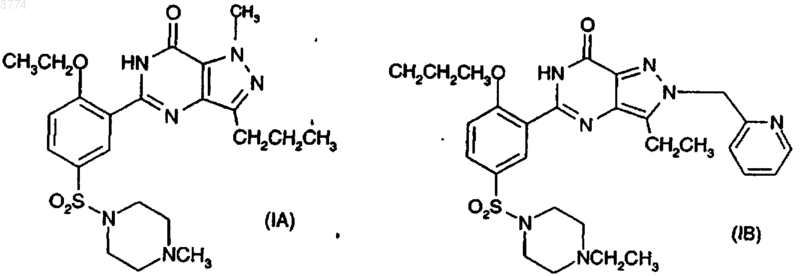
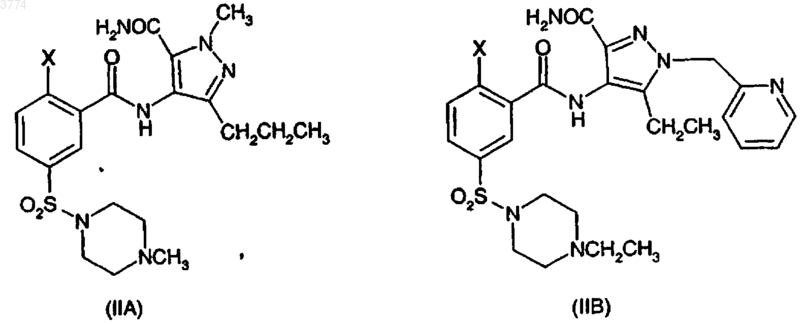
включающий реакцию соединения формулы (IIA) и (IIB) соответственно в присутствии -OR, где R, в случае образования (IA), представляет CH2CH3 и R, в случае образования соединения (IB), представляет CH2CH2CH3, где X представляет уходящую группу при условии, что X не является этокси
2. Способ по п.1, где X выбирают из группы, состоящей из арилсульфонилокси, C1-C4алкилсульфонилокси, нитро- или галогензамещенного бензолсульфонилокси, C1-C4перфторалкилсульфонилокси, ароилокси, C1-C4перфторалканоилокси, C1-C4алканоилокси; галогена; диазония; первичного и вторичного C1-C4алкокси (за исключением этокси), оксония, перхлорилокси, четвертичный аммоний C1-C4алкилсульфонилокси, галогенсульфонилокси, галония и диарилсульфониламино.
3. Способ по п.2, где X представляет галоген или метокси.
4. Способ по п.3, где X представляет фтор, хлор или метокси.
5. Способ по п.4, где X представляет фтор или хлор.
6. Способ по любому одному из предыдущих пунктов, где -OR присутствует со вспомогательным основанием.
7. Способ по п.6, где вспомогательное основание выбирают из группы, состоящей из стерически затрудненного основания, солей металлов 1-метилпиперазина (особенно для соединения IA), 1-этилпиперазина (особенно для соединения IB), морфолина, гидрида металла, оксида металла, карбоната металла и бикарбоната металла.
8. Способ по п.7, где стерически затрудненное основание представляет собой соль металла стерически затрудненного спирта или амина.
9. Способ по п.8, где соль металла стерически затрудненного спирта или амина, выбирают из группы, состоящей из вторичного или третичного C4-C12алканола, C3-C12циклоалканола и вторичного или третичного (C3-C8циклоалкил)C1-C6алканола, N-(вторичный или третичный C3-C6алкил)-N-(первичный, вторичный или третичный C3-C6алкил)амина, N-(C3-C8циклоалкил)-N-(первичный, вторичный или третичный C3-C6алкил)амина, ди(C3-C8циклоалкил)амина или гексаметилдисилазана, 1,5-диазабицикло[4,3,0]нон-5-ена, 1,8-диазабицикло[5,4,0]ундец-7-ена и третичных аминов, таких как триэтиламин.
10. Способ по п.9, где вспомогательное основание представляет собой соль металла третичного алканола.
11. Способ по любому одному из предыдущих пунктов, где реакцию проводят в инертном растворителе или ROH или смеси того и другого.
12. Способ по п.11, где растворитель выбирают из группы, состоящей из этанола (для IA), н-пропанола (для IB), вторичного или третичного C4-C12алканола, C3-C12циклоалканола, третичного C4-C12циклоалканола, вторичного или третичного (C3-C7циклоалкил)C2-C6алканола; C3-C9алканона, 1,2-диметоксиэтана, 1,2-диэтоксиэтана, диглима (диметиловый эфир диэтиленгликоля), тетрагидрофурана, 1,4-диоксана, толуола, ксилола, хлорбензола, 1,2-дихлорбензола, ацетонитрила, диметилсульфоксида, сульфолана, диметилформамида, N-метилпирролидин-2-она, пиридина и их смесей.
13. Способ по п.12, где растворитель выбирают из группы, состоящей из этанола (для IA), н-пропанола (для IB), третичного C4-C12алканола, третичного C4-C12циклоалканола, третичного (C3-C7циклоалкил)C2-C6алканола, C3-C9алканона, 1,2-диметоксиэтана, 1,2-диэтоксиэтана, диглима (диметиловый эфир диэтиленгликоля), тетрагидрофурана, 1,4-диоксана, толуола, ксилола, хлорбензола, 1,2-дихлорбензола, ацетонитрила, сульфолана, диметилформамида, N-метилпирролидин-2-она, пиридина и их смесей.
14. Способ по п.13, где растворитель представляет собой этанол (для IA) или пропанол (для IB).
15. Способ получения соединения формулы (IA) и (IB) по любому одному из предыдущих пунктов, включающий реакцию соединения формулы (IIA) и (IIB) соответственно с ZOR или с ROH и вспомогательным основанием, как определено здесь ранее, или с ZOR и вспомогательным основанием, где ZOR представляет соль OR и Z представляет катион.
16. Способ по п.15, где соединение (IA) получают реакцией соединения (IIA)
а) с этанолом и вспомогательным основанием, необязательно, в инертном растворителе; или
б) с ZOEt и вспомогательным основанием в этаноле или инертном растворителе или в том и другом; или
в) с ZOEt и этанолом или инертным растворителем или тем и другим.
17. Способ по п.15, где соединение (IB) получают реакцией соединения (IIB)
г) с пропанолом и вспомогательным основанием, необязательно, в инертном растворителе (как определено здесь ранее); или
д) с ZOPr и вспомогательным основанием в пропаноле или инертном растворителе или в том и другом; или
е) с ZOPr и пропанолом или инертным растворителем или тем и другим.
18. Способ по любому одному из предыдущих пунктов, где соединение формулы (IIA) получают сочетанием соединения формулы (VIIA)
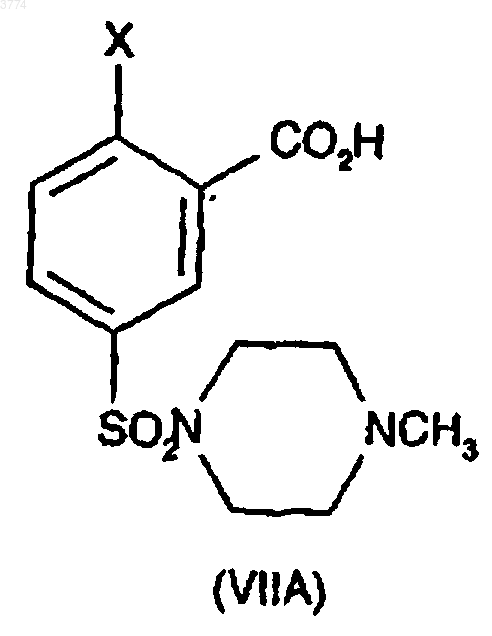
с соединением формулы (IXA)

и соединение формулы (IIB) получают сочетанием соединения формулы (VIIB)
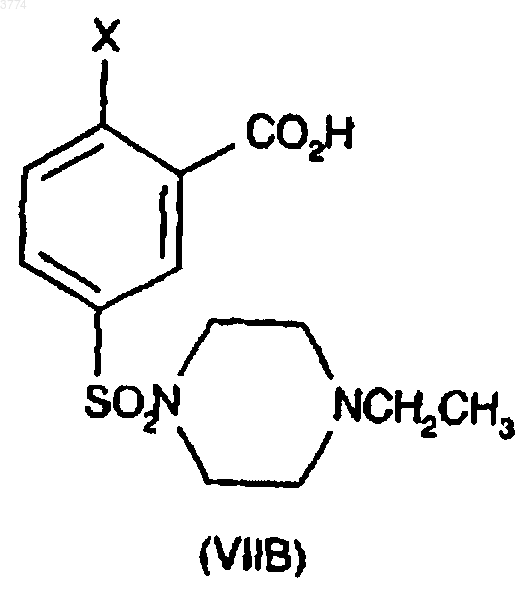
с соединением формулы (IXB)
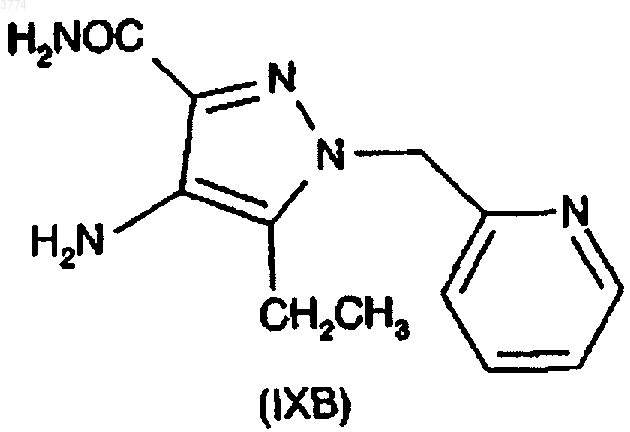
19. Способ по п.18, где соединение формулы (VIIA) получают сочетанием соединения формулы (VIA) с N-метилпиперазином
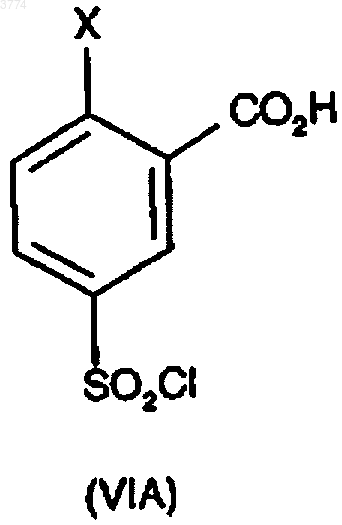
и соединение формулы (VIIB) получают сочетанием соединения формулы (VIA) с N-этилпиперазином.
20. Соединение формулы (IIA) и (IIB)

где X выбирают из галогена или метокси.
21. Соединение формулы (IIIA) и (IIIB)

где X выбирают из галогена или метокси.
22. Соединение формулы (VIIA) и (VIIB)

где X выбирают из галогена или метокси.
23. Соединение по любому одному из пп.20-22, где X выбирают из группы, состоящей из фтора, хлора и метокси.
24. Соединение по п.22, где X выбирают из фтора или хлора.
Текст
1 Это изобретение относится к способу получения 1-3-(6,7-дигидро-1-метил-7-оксо-3-пропил-1 Н-пиразоло[4,3-d]пиримидин-5-ил)-4-этоксифенил]сульфонил]-4-метилпиперазина (иначе известного как силденафил или виагра) и 1 этил-4-3-[3-этил-6,7-дигидро-7-оксо-2-(2-пиридилметил)-2 Н-пиразоло[4,3-d]пиримидин-5-ил]-4 пропоксифенилсульфонилпиперазина и их ключевым промежуточным продуктам. Было обнаружено, что 1-3-(6,7-дигидро-1 метил-7-оксо-3-пропил-1 Н-пиразоло[4,3-d]пиримидин-5-ил)-4-этоксифенил]сульфонил]-4-метилпиперазин (иначе известный как силденафил) особенно полезен при лечении, между прочим, дисфункции эрекции у мужчин (WO-A-94/28907), а способ его получения описывается в Европейском патенте ЕРА-0463756 (пример 12) и Drugs of the Future 1997,22(2): 138-143. Усовершенствованный способ получения силденафила (относительно способа ЕР 0463756) описывается в Европейском патенте ЕР-А-0812845 с характерной финальной стадией,включающей циклизацию в основных, нейтральных или кислотных условиях с образованием силденафила. Способ получения 1-этил-4-3-[3-этил 6,7-дигидро-7-оксо-2-(2-пиридилметил)-2 Н-пиразоло[4,3-d]пиримидин-5-ил)-4-пропоксифенилсульфонилпиперазина описывается в WO 98/49166(пример 5 В). Авторами данного изобретения обнаружен способ получения силденафила и 1-этил-4-3-[3 этил-6,7-дигидро-7-оксо-2-(2-пиридилметил)2 Н-пиразоло[4,3-d]пиримидин-5-ил]-4-пропоксифенилсульфонилпиперазина, который имеет преимущества по сравнению с вышеупомянутыми способами известного уровня техники. В соответствии с данным изобретением предлагается способ получения соединения формулы (IA) и (IB). 2 ния реакции замещения и замыкания цикла в одном резервуаре. Промежуточные продукты общей формулы (IIА) и (IIB) образуют следующий аспект изобретения (где Х выбирают из галогена или метокси). Ключевые промежуточные продукты общей формулы (IIIA) и (IIIB) (см. приведенные здесь ниже схемы 1 и 2) были идентифицированы в различных реакциях, показывая, что такие реакции, по меньшей мере, частично, проходят через путь циклизации, затем нуклеофильного замещения. В соответствии с этим промежуточные продукты общей формулы (IIIA) и (IIIB) образуют еще один аспект изобретения (где Х выбирают из галогена или метокси). Следующий основной промежуточный продукт формулы IVA и IVB также был идентифицирован, предполагая что до циклизации имеет место также нуклеофильное замещение. Таким образом, предполагаемые пути реакций образования соединений (IA) и (IB) следующие: Схема 1 Схема 2 включающий реакцию соединения формулыOR, где R, в случае образования (IA), представляет СН 2 СH3, и R, в случае образования соединения (IB), представляет СН 2 СН 2 СН 3, где Х представляет уходящую группу, при условии,что Х не является этокси Особым преимуществом способа данного изобретения по сравнению с вышеупомянутым способом известного уровня техники является исключение некоторых стадий путем проведе 3 Относительная пропорция образованных промежуточных продуктов частично зависит от природы Х (уходящая группа).X предпочтительно выбирают из группы,состоящей из арилсульфонилокси, предпочтительно фенилсульфонилокси, более предпочтительно, пара-замещенного арила(фенила), например, таким заместителем, как С 1-С 4 алкил,например п-толуолсульфонилокси; С 1-С 4 алкилсульфонилокси, например метансульфонилокси; нитро- или галогензамещенного бензолсульфонилокси, предпочтительно пара-замещенного,например п-бромбензолсульфонилокси или пнитробензолсульфонилокси; C1-С 4 перфторалкилсульфонилокси, например трифторметилсульфонилокси; ароилокси, такого как бензоилокси; C1-С 4 перфторалканоилокси, такого как трифторацетилокси; C1-С 4 алканоилокси, такого как ацетилокси; галогена; диазония; первичного и вторичного С 1-С 4 алкокси (за исключением этокси), такого как метокси; оксония; перхлорилокси; четвертичный аммонийС 1 С 4 алкилсульфонилокси; галогенсульфонилокси,например фторсульфонилокси и других фторированных уходящих групп; галогения и диарилсульфониламино, например, дитозилa (NTs2). Подходящий Х представляет галоген(фтор, хлор, бром или иод) и наиболее подходящий Х представляет фтор или хлор. Было обнаружено, что последний обеспечивает особенно хорошие выходы, и в этом случае можно легко использовать недорогие, коммерчески доступные исходные материалы (хлор- и фторбензойная кислота). Здесь -ОСН 2 СН 3 и -ОСН 2 СН 2 СН 3 (описаны в первом аспекте данного изобретения) обозначают для удобства как -OR. -OR может действовать как в качестве нуклеофила (для замены уходящей группы нуклеофильным замещением), так и в качестве основания (для осуществления циклизации).OR может генерироваться в растворе из соли ZOR (где Z представляет катион), такой как соль металла. Более конкретно соль щелочного (такого как, натрий или калий) или щелочно-земельного металла. -OR в подходящем растворителе будет давать -OR в растворе. Например, этоксид натрия (Na+ -OEt) в подходящем растворителе с промежуточным продуктом (IIА) может образовать силденафил. В другом осуществлении -OR образуется in situ из ROH плюс вспомогательного основания (т.е. основания,другого, чем -OR). Однако в другой системе можно было использовать ZOR со вспомогательным основанием. Предпочтительными осуществлениями этого изобретения являются 1. синтез соединения (IA) реакцией соединения (IIА): а) с этанолом и вспомогательным основанием, необязательно в инертном растворителе; 4 б) с ZOEt и вспомогательным основанием в этаноле или инертном растворителе или в том и другом; в) с ZOEt и этанолом или инертным растворителем или тем и другим; синтез соединения (IB) реакцией соединения (IIB); г) с пропанолом и вспомогательным основанием, необязательно в инертном растворителе; д) с ZOPr и вспомогательным основанием в пропаноле или инертном растворителе или в том и другом; е) с ZOPr и пропанолом или инертным растворителем или тем и другим. Как должно быть понятно, растворителем,в котором протекает эта реакция, может бытьROH или инертный растворитель (или смесь того и другого). Под термином инертный растворитель мы имеем в виду растворитель, который не будет образовывать нуклеофил в условиях реакции или, если нуклеофил образуется,он достаточно затруднен, так что, по существу,он не конкурирует в реакции замещения. КогдаROH используют в качестве источника -OR, то отдельный растворитель, по существу, не требуется, но (вспомогательный) инертный растворитель (т.е. растворитель, другой, чем ROH) можно использовать в реакции в качестве сорастворителя. Подходящими растворителями являются следующие растворители: этанол (для IA), пропанол (для IB) (н-пропанол), вторичный или третичный С 4-С 12 алканол, С 4-С 12 циклоалканол,третичный С 4-С 12 циклоилканол, вторичный или третичный (С 3-С 7 циклоалкил)C2-С 6 алканол, С 3 С 9 алканон, 1,2-диметоксиэтан, 1,2-диэтоксиэтан, диглим (диметиловый эфир диэтиленгликоля), тетрагидрофуран, 1,4-диоксан, толуол,ксилол, хлорбензол, 1,2-дихлорбензол, ацетонитрил, диметилсульфоксид, сульфолан, диметилформамид, N-метилпирролидин-2-он, пиридин и их смеси. В способе данного изобретения можно использовать широкий диапазон вспомогательных оснований. Типично, основания не должны конкурировать с -OR в нуклеофильном замещении Х (т.е. они не должны быть нуклеофильными) в результате того, что подходящим образом стерически затруднены. Предпочтительные основания в соответствии с данным изобретением выбирают из группы, состоящей из солей металлов стерически затрудненного спирта или амина, такого как вторичный или третичный С 4 С 12 алканол, С 3-С 12 циклоалканол и вторичный или третичный (С 3-С 8-циклоалкил)C1-С 6 алканол, N-(вторичный или третичный С 3 С 6 алкил)-N-(первичный, вторичный или третичный С 3-С 6 алкил)амин, N-(С 3-С 8 циклоалкил)-N(первичный, вторичный или третичный С 3 С 6 алкил)амин, ди-(С 3-С 8 циклоалкил)амин или гексаметилдисилазан; солей металлов 1 метилпиперазина (особенно для соединения IA), 5 1-этилпиперазина (особенно, для соединенияIB) и морфолина; 1,5-диазабицикло[4,3,0]нон-5-ена и 1,8 диазабицикло[5,4,0]-ундец-7-ена; третичных аминов, таких как триэтиламин; гидрида, оксида, карбоната и бикарбоната металла. Предпочтительно металл соли ZOR и вспомогательного основания независимо выбирают из щелочных металлов (лития, натрия,калия, рубидия, цезия) или щелочно-земельных металлов (бериллия, магния, кальция, стронция,бария). Более предпочтительно металлом является натрий или калий. Вспомогательное основание предпочтительно выбирают из группы, состоящей из солей металлов стерически затрудненного спирта или амина, такого как вторичный или третичный С 4-С 12 алканол, С 3-С 12 циклоалканол и вторичный или третичный (С 3-С 8 циклоалкил)C1 С 6 алканол, N-(вторичный или третичный С 3 С 6 алкил)-N-(первичный, вторичный или третичный С 3-С 6 алкил)амин, N-(С 3-С 8 циклоалкил)-N(первичный, вторичный или третичный С 3 С 6 алкил)амин, ди-(С 3-С 8 циклоалкил)амин или гексаметилдисилазан; 1,5-диазабицикло[4,3,0]нон-5-ена и 1,8 диазабицикло[5,4,0]-ундец-7-ена; гидрида, оксида, карбоната и бикарбоната металла. Однако более предпочтительное вспомогательное основание выбирают из стерически затрудненных оснований предыдущего параграфа(т.е. все основания из них, за исключением гидрида, оксида, карбоната и бикарбоната металла). Очень предпочтительным вспомогательным основанием является соль металла третичного C4-С 6 алканола, такие как соли щелочных или щелочно-земельных металлов (например,Na/K) трет-бутанола или трет-амилового спирта. Для максимизирования выходов далее предпочтительно, чтобы в соответствии с данным изобретением использовали, по меньшей мере, один молекулярный эквивалент (подходит полтора эквивалента) вспомогательного основания и -OR. ЕслиOR функционирует в качестве основания, то предпочтительно, чтобы присутствовало, по меньшей мере, два эквивалента (более предпочтительно три эквивалента) -OR. Так, например, в вышеуказанных предпочтительных осуществлениях от (а) до (е) предпочтительно присутствует, по меньшей мере, 2 эквивалента вспомогательного основания и, по меньшей мере, один эквивалент EtOH или РrOН (а и г соответственно), предпочтительно, по меньшей мере, 1 эквивалент вспомогательного основания и,по меньшей мере, 1 эквивалент ZOEt или ZOPr (б и д соответственно) и, предпочтительно, по меньшей мере, 2 эквивалента ZOEt или ZOPr (в и е соответственно). Эти эквиваленты указываются относительно молярных количеств IIА или IIB. Природа уходящей группы (X) может влиять на путь реакции. Например, что касается 6 схемы 1 для соединения (IA), когда X=F, реакция большей частью проходит через промежуточный продукт, показанный как (IVA), но когда Х=Сl, путь (реакции) смещается более в сторону промежуточного продукта (IIIA), и,когда Х=ОСН 3, имеется больше образованного промежуточного продукта типа формулы (IIIA),чем промежуточного продукта типа формулы(IVA). Однако образованию конечного соединения формул (IA) и (IB) из промежуточного продукта формул (IIIA) и (IIIB) соответственно можно способствовать путем использования более высокой температуры и большего времени реакции для образования конечного продукта. Обычную реакцию предпочтительно проводят при температуре от 50 до 170 С. Так, когда X=F, температура реакции могла быть всегда от около 50 С, предпочтительно 60 С и выше, и скорость образования конечного продукта могла быть очень хорошей. Для Х=Сl предпочтительная температура от 60 до 170 С, более подходящая, по меньшей мере, 80 С, такая как(от 80 до 110 С), может повышать скорость (реакции); и для Х=ОСН 3 предпочтительная температура, по меньшей мере, 80 С, более подходящая, по меньшей мере, 110 С (такая как от 110 до 140 С), может повышать скорость реакции образования конечного продукта. Соединения общей формулы (IIА) и (IIB) можно получить из легко доступных исходных материалов, например путем, показанным в следующих схемах реакций. Схема реакции 3 иллюстрируется для соединения (IA), и схема 4 иллюстрируется для соединения (IB). Со ссылкой на схему 3 промежуточный продукт формулы (VIA) образуется из производного замещенной (например, группой X) бензойной кислоты реакцией с хлорсульфоновой кислотой. Промежуточный продукт (VIA) затем взаимодействует с N-метилпиперазином в присутствии основания, такого как третичный амин, более конкретно, триэтиламин, и подходящего растворителя, такого как ацетон или вода, с образованием промежуточного продукта(IIА) образуется реакцией промежуточного продукта (VIIA) и 4-амино-1-метил-3-пропил 1 Н-пиразол-5-карбоксамида (соединение IXA) в присутствии сочетающего агента, такого как гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида, и, когда необходимо, также в присутствии основания и/или ускорителя (катализатора реакции). В одном примере системы сочетания функциональную группу карбоновой кислоты (VIIA), прежде всего, активируют с использованием около 5% избытка реагента,такого как N,N'-карбонилдиимидазол (в качестве сочетающего агента) в подходящем растворителе, например этилацетате, при температуре от около комнатной до около 80 С с последующей реакцией промежуточного имидазолида с(IXA) при температуре от около 20 до около 60 С. В другом примере промежуточный продукт (VIIA) можно было сочетать с пиразолом(IXA) в присутствии 1-гидроксибензотриазола,триэтиламина и гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида. Соединение (IXA) получают восстановлением 1-метил-4-нитро-3-пропил-1 Н-пиразол-5 карбоксамида (VIIA), например гидрированием в присутствии 5% палладия на угле. Соединение (IB) (схема 4) можно получить способом, аналогичным способу получения соединения (IA). Более конкретно, промежуточный продукт (VIIB) получают реакцией (VIA) с(IIB) получают сочетанием промежуточных соединений (VIIB) и (IXB). Схема 3 8 Промежуточные продукты общих формул(VIIA) и (VIIB) являются новыми и образуют следующий аспект изобретения (где Х представляет галоген или метокси). Изобретение теперь будет описано посредством примера только в отношении следующих примеров. Пример 1.(1a) 5-Хлорсульфонил-2-фторбензойная кислота (соединение (VIA, X=F). Коммерчески доступную 2-фторбензойную кислоту (75 г, 0,54 моль) добавляют к хлорсульфоновой кислоте (320 г) в течение 15 минут, перемешивают в течение 30 мин, затем нагревают до 90 С в течение 4,5 ч. После охлаждения реакционную смесь гасят выливанием на смесь лед/вода (1,5 кг/324 мл) и гранулируют в течение 1 ч. Осажденный продукт фильтруют,промывают водой и при 50 С в вакууме, получая указанное в заголовке соединение (99,7 г,78,1%) в виде белого твердого вещества.(22,04 г, 0,22 моль) и триэтиламина (24,29 г,0,24 моль) и реакционную смесь перемешивают при температуре окружающей среды в течение 3 ч. Смесь фильтруют, получаемую твердую часть перекристаллизовывают из воды, получая указанное в заголовке соединение (14,63 г, 24,2%) в виде белого твердого вещества.(ДМСО): 2,30(европейский патент ЕР-А-0463756; 237,7 г, 1,12 моль) и 5% палладий на угле (47,5 г) в этилацетате (2,02 л) гидрируют при 344,7 кПа (50 пси) и 50 С в течение 4 ч, когда завершается поглощение водорода. Холодную реакционную смесь фильтруют, затем фильтровальную подушку промывают этилацетатом, причем объединенные фильтрат и промывные жидкости, таким образом, представляют собой раствор указанного в заголовке соединения в этилацетате (Европейский патент ЕР-А-0463756), который был достаточно чистым для использования непосредственно в следующей стадии последовательности реакций. 9 ммоль), триэтиламина (0,70 г, 6,92 ммоль), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (1,33 г, 6,94 ммоль) и 1 гидроксибензотриазола (0,94 г, 6,96 ммоль) в смеси этилацетата (20 мл) и дихлорметана (20 мл). Реакционную смесь перемешивают в течение 12 ч при температуре окружающей среды. Реакционную смесь упаривают до масла и очищают с использованием колоночной хроматографии(флеш-диоксид кремния,метанол:этилацетат, 30:70). Указанное в заголовке соединение получения далее очищают растворением в дихлорметане и промыванием насыщенным раствором бикарбоната натрия. Органический раствор отпаривают в вакууме, получая твердый продукт, который сушат (40 С),получая указанное в заголовке соединение (2,1 г, 64,8%) в виде белого твердого продукта. Т.пл. 210-212 С. Найдено: С 51,15; Н 5,81;(1e) 1-3-(6,7-Дигидро-1-метил-7-оксо-3 пропил-1 Н-пиразоло[4,3-d]пиримидин-5-ил)-4 этоксифенил]сульфонил]-4-метилптеразин (соединение IA). трет-Бутоксид калия (0,74 г, 6,60 ммоль) добавляют к суспензии указанного в заголовке соединения примера (1d) (1,00 г, 2,20 ммоль) в этаноле (5 мл), и смесь нагревают при кипячении с обратным холодильником в течение 48 ч. Реакционную смесь отпаривают до масла и очищают растворением в дихлорметане и промыванием насыщенным раствором бикарбоната натрия. К органическому раствору в течение 10 мин добавляют гексан, осажденный твердый продукт фильтруют и сушат, получая указанное в заголовке соединение (1,1 г, 100%) в виде белого твердого продукта. Перекристаллизация соединения из этилацетата дает твердый продукт с т.пл. 184-186 С. Найдено: С 55,49; Н 6,35; N 17,72. С 22 Н 31FN6O4S требует С 55,58; Н 6,53; N 17,68.(ДМСО): 0,96 (3 Н, т), 1,30 (3 Н, т), 1,72 (2 Н, м),2,13 (3 Н, с), 2,36 (4 Н, м), 2,72 (2 Н, т), 2,90 (4 Н,м), 4,18 (5 Н, м), 7,32 (1 Н, д), 7,80 (2 Н, м). m/z 100%),(найдено: 475,214800([М+Н]+,С 22 Н 31N6O4S требует 475,212751). Реакция почти полностью проходит через образование промежуточного продукта IVA и завершается за время менее чем 48 ч. Пример 2.(2 а) 2-Хлор-5-хлорсульфонилбензойная кислота (соединение VIA, Х=Сl). Коммерчески доступную 2-хлорбензойную кислоту (80,0 г) (0,5 моль) добавляют по частям к хлорсульфоновой кислоте (320 г) с энергич 003774 10 ным перемешиванием. Реакционную смесь нагревают до 95 С в течение 6 ч, затем охлаждают в течение ночи до комнатной температуры. Раствор гасят выливанием на смесь лед/вода (1,5 кг/324 мл) и перемешивают в течение 15 мин. Осажденный продукт фильтруют, промывают водой и сушат при 50 С в вакууме, получая указанное в заголовке соединение (111, 1 г, 85,2%) в виде белого твердого вещества с т.пл. 140 С.VIIA, Х=Сl). Вышеуказанное соединение получают добавлением 2-хлор-5-хлорсульфонилбензойной кислоты к 1,25 мол. эквивалента N-этилпиперазина в воде (3 мл/г) в кислотных условиях. Указанное в заголовке соединение затем выделяют в виде твердого продукта (81,7%). Перекристаллизация указанного в заголовке соединения из смеси ацетон:вода дает твердый продукт с т.пл. 304-6 С и следующими характеристичными данными: Найдено: С 45,16; Н 4,71; N 8,64.(2 с) 4-[2-Хлор-5-(4-метил-1-пиперазинилсульфонил)бензамидо]-1-метил-3-пропил-1Hпиразол-5-карбоксамид (cоединение IIА, Х=Сl). 4-Амино-1-метил-3-пропил-1 Н-пиразол-5 карбоксамид (2,86 г, 15,68 ммоль) (пример 1 с) добавляют к суспензии 2-xлор-5-(4-метил-1 пиперазинилсульфонил)бензойной кислоты (5,0 г, 15,68 ммоль), триэтиламина (1,59 г, 15,68 ммоль), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (3,00 г, 15,68 ммоль) и 1-гидроксибензотриазола (2,12 г, 15,68 ммоль) в дихлорметане (50 мл). Реакционную смесь перемешивают в течение 48 ч при температуре окружающей среды, добавляют дополнительную порцию гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (1,00 г, 5,2 ммоль) и реакционную смесь перемешивают в течение дополнительных 48 ч при комнатной температуре. Реакционную смесь промывают насыщенным раствором бикарбоната натрия и к отделенному органическому раствору в течение 10 мин добавляют этилацетат. Смесь перемешивают в течение 10 мин и осажденный твердый продукт фильтруют и сушат, получая указанное в заголовке соединение (6,0 г, 81%), т. пл. 105107 С.(ДМСО) 0,90 (3 Н, т), 1,60 (2 Н, м), 2,13(соединение IA). трет-Бутоксид калия (1,43 г, 12,75 ммоль) добавляют к суспензии указанного в заголовке соединения примера 2(с) (2,00 г, 4,25 ммоль) в этаноле (20 мл) и смесь нагревают при кипячении с обратным холодильником в течение 48 ч. рН реакционной смеси устанавливают до 6 с использованием 1 н хлористо-водородной кислоты, осажденный твердый продукт фильтруют и сушат, получая указанное в заголовке соединение. Перекристаллизация указанного в заголовке соединения из метилизобутилкетона дает твердый продукт с т.пл. 188 С.(СDСl3) 1,01 (3 Н, т), 1,62 (3 Н, т), 1,88C22H31N6O4S требует 475,212751). Промежуточный продукт формулы IVA получают в соответствии с Европейским патентом ЕР-А 0812845 и промежуточный продукт формулы IIIA, Х=Сl получают в соответствии с нижеприведенным здесь примером 2(е). Эти промежуточные продукты затем используют в качестве внутренних стандартов для сравнения способом ВЭЖХ образцов, взятых из реакционной смеси во время стадии 2(d), чтобы установить путь реакции. Промежуточные продукты IIIA (Х=Сl) и(2 е) 1-[4-Хлор-3-(6,7-дигидро-1-метил-7 оксо-3-пропил-1 Н-пиразоло[4,3-d]пиримидин-5 ил)фенилсульфонил]-4-метилпиперазин (соединение IIIA, Х=Сl). трет-Бутоксид калия (0,24 г, 2,14 ммоль) добавляют к суспензии указанного в заголовке соединения примера 2(с) (1,00 г, 2,12 ммоль) в трет-бутаноле (5 мл) и смесь нагревают при кипячении с обратным холодильником в течение 120 ч. Реакционную смесь охлаждают и осажденный твердый продукт фильтруют и сушат,получая указанное в заголовке соединение (0,48 г, 50%) в виде белого твердого продукта, т.пл. 205-208 С.(ДМСО) 0,90 (3 Н, т), 1,70 (2 Н, м), 2,13(3 а) 5-Хлорсульфонил-2-метоксибензойная кислота (соединение VIA, Х=ОСН 3). Коммерчески доступную 2-метоксибензойную кислоту (15,2 г, 0,1 моль) добавляют порциями к хлорсульфоновой кислоте (52,43 г) в течение 30 мин при охлаждении льдом. Добавляют тионилхлорид (11,9 г, 0,1 моль) и реакционную смесь перемешивают в течение ночи. 12 Реакционную смесь гасят добавлением в смесь лед/вода (250 г/65 мл) и осажденный продукт гранулируют в течение 1 ч, фильтруют, промывают водой и сушат в сушильном шкафу, получая указанное в заголовке соединение (23,56 г,93,9%) в виде белого твердого продукта с т.пл. 138-140 С.(СDСl3): 4,18 (3 Н, с), 7,23 (1 Н, д),8,21 (1 Н, д), 8,78 (1 Н, с).(3b) 2-Метокси-5-(4-метил-1-пиперазинилсульфонил)бензойная кислота. Вышеуказанное соединение получают добавлением 5-хлорсульфонил-2-метоксибензойной кислоты к 1,1 мол. эквивалента Nметилпиперазина и 1,2 мол. эквивалента триэтиламина в ацетоне (5 мл/г). Указанное в заголовке соединение затем выделяют фильтрованием в виде твердого продукта (79,1%) со следующими характеристическими данными: Найдено: С 49,70; Н 5,76; N 8,75.(3 с) 4-[2-Метокси-5-(4-метил-1-пиперазинилсульфонил)бензамидо]-1-метил-3-пропил 1 Н-пиразол-5-карбоксамид (cоединение IIА,Х=ОСН 3). Смесь 2-метокси-5-(4-метил-1-пиперазинилсульфонил)бензойной кислоты (2,00 г, 6,36 ммоль) и карбонилдиимидазола (1,03 г, 6,35 ммоль) в дихлорметане (20 мл) перемешивают в течение 3 ч при 30 С. К реакционной смеси добавляют 4-амино-1-метил-3-пропил-1H-пиразол-5-карбоксамид (1,16 г, 6,37 ммоль) и триэтиламин (0,64 г, 6,32 ммоль) и смесь перемешивают в течение 48 ч при комнатной температуре. Реакционную смесь промывают насыщенным раствором бикарбоната натрия, отделенный органический раствор отпаривают в вакууме,получая твердый продукт, который сушат(40 С), получая указанное в заголовке соединение (2,74 г, 90%) в виде белого твердого продукта, т.пл. 182 С. Найдено: С 52,42; Н 6,36; N 17,31.(соединение IA). трет-Бутоксид калия (146 мг, 1,30 ммоль) добавляют к суспензии указанного в заголовке соединения примера 3 с (200 мг, 0,43 ммоль) в этаноле (4 мл) и смесь нагревают при кипячении 13 с обратным холодильником в течение 120 ч. Реакционную смесь охлаждают и рН реакционной смеси доводят до 6 с использованием разбавленной хлористо-водородной кислоты. Осажденный твердый продукт фильтруют и сушат,получая указанное в заголовке соединение (60 мг, 29%) в виде беловатого твердого продукта,т.пл. 187 С.(СDСl3), 1,00 (3 Н, т), 1,62 (3 Н, т), 1,90(найдено: 497,199635 [М+, 100%]. C22H30N6O4S требует 497,194695). Следующий промежуточный продукт 3(е) получают независимо и используют в качестве внутреннего стандарта для сравнения способом ВЭЖХ образцов, взятых из реакционной смеси во время стадии 3(d). Содержание промежуточного продукта примера 3(е) (IIIA, Х=ОСН 3) и промежуточного продукта IVA наблюдают по способу ВЭЖХ в отношении около 70:30, соответственно.(соединение IIIA, Х=ОСН 3). трет-Бутоксид калия (0,176 г, 1,57 ммоль) добавляют к суспензии указанного в заголовке соединения примера 3 с (0,75 г, 1,57 ммоль) в трет-бутаноле (5 мл) и смесь нагревают при кипячении с обратным холодильником в течение 96 ч. Реакционную смесь охлаждают в осажденный твердый продукт фильтруют и сушат, получая указанное в заголовке соединение (0,33 г,45,6%) в виде белого твердого продукта, т.пл. 182 С.(СDСl3) 1,02 (3 Н, т), 1,88 (2 Н, м), 2,30(4 а) Этил-3-этил-1 Н-пиразол-5-карбоксилат. Раствор этоксида натрия в этаноле (21 об./об.%; 143 мл, 0,39 моль) добавляют по каплям к перемешиваемому, охлаждаемому льдом раствору диэтилоксалата (59,8 мл, 0,44 моль) в абсолютном этаноле (200 мл) в атмосфере азота и получаемый раствор перемешивают в течение 15 мин. Затем по каплям добавляют бутан-2-он(39 мл, 0,44 моль), охлаждающую баню удаляют, реакционную смесь перемешивают в течение 18 ч при комнатной температуре и затем в течение 6 ч при 40 С, затем снова подводят охлаждающую баню. Затем по каплям добавляют ледяную уксусную кислоту (25 мл, 0,44 моль),получаемый раствор перемешивают в течение 30 мин при 0 С, по каплям добавляют гидразингидрат (20 мл, 0,44 моль), затем реакционную смесь оставляют для нагревания до комнатной температуры и выдерживают ее в течение пе 003774 14 риода 18 ч до испарения при пониженном давлении. Остаток распределяют между дихлорметаном (300 мл) и водой (100 мл), затем органическую фазу отделяют, промывают водой(2 х 100 мл), сушат (Na2SO4) и концентрируют при пониженном давлении, получая указанное в заголовке соединение (66,0 г).(СDСl3): 1,04 (3 Н, т), 1,16 (3 Н, т), 2,70(4b) 3-Этил-1 Н-пиразол-5-карбоновая кислота. Водный раствор гидроксида натрия (10 М; 100 мл, 1,0 моль) добавляют по каплям к перемешиваемой суспензии указанного в заголовке соединения примера (4 а) (66,0 г, 0,39 моль) в метаноле и получаемый раствор нагревают при кипячении с обратным холодильником в течение 4 ч. Холодную реакционную смесь концентрируют при пониженном давлении приблизительно до 200 мл, разбавляют водой (200 мл) и эту смесь промывают толуолом (3 х 100 мл). Получаемую водную фазу подкисляют концентрированной хлористо-водородной кислотой до рН 4 и белый осадок собирают и сушат отсасыванием, получая указанное в заголовке соединение (34,1 г).(ДМСОd6): 1,13 (3 Н, т), 2,56 (1 Н,к), 6,42 (1 Н, с).(4 с) 3-Этил-4-нитро-1 Н-пиразол-5-карбоновая кислота. Дымящую серную кислоту (17,8 мл) добавляют по каплям к перемешиваемой, охлаждаемой льдом дымящей азотной кислоте (16,0 мл), получаемый раствор нагревают до 50 С, в течение 30 мин по частям добавляют 3-этил-1 Нпиразол-5-карбоновую кислоту при поддержании температуры реакции ниже 60 С. Получаемый раствор нагревают в течение 18 ч при 60 С,оставляют для охлаждения, затем выливают на лед. Указанное в заголовке соединение получают в виде коричневого твердого продукта(4d) 3-Этил-4-нитро-1 Н-пиразол-5-карбоксамид. Раствор указанного в заголовке соединения примера (4 с) (15,4 г, 0,077 моль) в тионилхлориде (75 мл) нагревают при кипячении с обратным холодильником в течение 3 ч и затем холодную реакционную смесь выпаривают при пониженном давлении. Остаток подвергают азеотропной перегонке с тетрагидрофураном(2 х 50 мл) и затем суспендируют в тетрагидрофуране (50 мл), затем перемешиваемую суспензию охлаждают льдом и обрабатывают газообразным аммиаком в течение 1 ч. Добавляют воду (50 мл) и получаемую смесь испаряют при пониженном давлении, получая твердый продукт, который после растирания с водой и высушивания отсасыванием дает указанное в заго 15 ловке соединение в виде белого твердого продукта (90%).(ДМСОd6): 1,17 (3 Н, т), 2,87 (2 Н, м), 7,40(4 е) 5-Этил-4-нитро-1-(2-пиридилметил)1H-пиразол-3-карбоксамид (соединение VIIIB). Карбонат цезия (1,414 кг, 4,34 моль) добавляют к суспензии указанного в заголовке соединения примера (4d) (800 г, 4,34 моль) в ацетонитриле (51) и смесь нагревают до 60 С. Добавляют 2-хлорметилпиридин (664,7 г, 5,23 моль) и реакционную смесь нагревают при 70 С в течение 7 ч, затем добавляют воду (9,5 л) и реакционную смесь охлаждают до 10 С. Гранулирование этой смеси дает осадок, который фильтруют и сушат, получая 3-этил-4-нитро-1(пиридин-2-ил)метилпиразол-5-карбоксамид(367 г). К фильтрату добавляют хлорид натрия(4 х 1,75 л). Объединенные органические экстракты перегоняют для удаления приблизительно 10 л растворителя, к горячему (69-76 С) раствору в течение 35 мин добавляют толуол (5,6 л) и смесь оставляют для охлаждения. Получаемую суспензию гранулируют при 10 С в течение 30 мин, фильтруют, твердую часть промывают смесью этилацетат:толуол (50:50), 600 мл,и сушат (60 С), получая указанное в заголовке соединение (624 г, 52%) в виде бледнокоричневого твердого продукта.(ДМСОd6): 1,08 (3 Н, т), 3,02 (2 Н, к), 5,53(4f) 4-Амино-5-этил-1-(2-пиридилметил)1H-пиразол-3-карбоксамид (соединение IXB). Смесь катализатора Линдлара (2 г) и указанного в заголовке соединения примера (4 е)(20 г, 72,7 ммоль) в этаноле (160 мл) гидрируют в течение 48 ч при 345 кПа (50 пси) и 50 С, затем охлаждают и фильтруют. Фильтрат объединяют с промывной жидкостью (IMS) (50 мл) фильтровальной подушки и концентрируют при пониженном давлении до объема 100 мл. Оставшийся этанол удаляют перегонкой и заменяют этилацетатом до тех пор, пока не будет достигнута температура головной части 77 С. Охлажденную смесь гранулируют при 4 С, фильтруют и сушат, получая указанное в заголовке соединение (13,17 г, 73%) в виде бледнокоричневого твердого продукта.(ДМСОd6): 0,90 (3 Н, т), 2,54 (2 Н, к), 4,48(4g) 2-Хлор-5-(4-этил-1-пиперазинилсульфонил)бензойная кислота (соединение VIIB,Х=Сl). 2-Хлор-5-хлорсульфонилбензойную кислоту (51,02 г, 0,2 моль) из примера (2 а) в воде охлаждают до 5 С. рН реакционной смеси дово 003774 16 дят до 2,2 с использованием водного гидроксида натрия (5 М), добавляют N-этилпиперазин и продолжают доводить рН до 5,5. Реакционную смесь перемешивают в течение 12 ч при температуре окружающей среды. Осажденный твердый продукт фильтруют, получая указанное в заголовке соединение. Перекристаллизация указанного в заголовке соединения из смеси ацетон:вода дает твердый продукт с т.пл. 267269 С.(ДМСО): 1,00 (3 Н, с), 2,50 (2 Н, м), 2,60(2,22 г, 16,4 ммоль) в дихлорметане (50 мл). Реакционную смесь перемешивают в течение 48 ч при температуре окружающей среды. Реакционную смесь фильтруют и твердую часть сушат,получая указанное в заголовке соединение (2,26 г, 24,7%) в виде белого твердого продукта, т.пл. 185 С. Найдено: С 53,26; Н 5,38; N 17,13.(4i) 1-Этил-4-3-[3-этил-6,7-дигидро-7-оксо-2-(2-пиридилметил)-2 Н-пиразоло[4,3-d]пиримидин-5-ил]-4-пропоксифенилсульфонилпиперазин (соединение IB). трет-Бутоксид калия (0,90 г, 8,02 ммоль) добавляют к суспензии указанного в заголовке соединения примера 4(h) (1,5 г, 2,68 ммоль) в пропан-1-оле (10 мл) и смесь нагревают при кипячении с обратным холодильником в течение 48 ч. Реакционную смесь охлаждают и осажденный твердый продукт фильтруют и сушат,получая указанное в заголовке соединение (1,16 г, 80%). Перекристаллизация указанного в заголовке соединения из метилизобутилкетона дает твердый продукт с т.пл. 95 С.(СDСl3): 1,00 (3 Н, т), 1,12 (3 Н, т), 1,30 (3 Н,т), 2,02 (2 Н, м), 2,40 (2 Н, к), 2,50 (4 Н, м) , 3,10 (6 Н,м), 4,13 (2 Н, т), 5,70 (2 Н, с), 7,20 (3 Н, м), 7,60 (1 Н,м), 7,80 (1 Н, м), 8,55 (1 Н, м), 8,80 (1 Н, м), 10,60 (1 Н,с), m/z (найдено: 566,257068 ([М+Н]+, 100%). 17 Результат анализа образца реакционной смеси с использованием ВЭЖХ позволяет предположить, что путь реакции проходит, в основном, через образование промежуточного продукта IVB. Данное изобретение, таким образом, предлагает превосходный способ получения соединений формулы I, который безопасен (отпадает необходимость в использовании карциногенных алкилирующих реагентов), экономичен, использует легко доступные исходные материалы и который позволяет проводить новую объединенную реакцию замещения и замыкания цикла в одном реакционном сосуде. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формул включающий реакцию соединения формулы 2. Способ по п.1, где Х выбирают из группы, состоящей из арилсульфонилокси, С 1 С 4 алкилсульфонилокси, нитро- или галогензамещенного бензолсульфонилокси,С 1 С 4 перфторалкилсульфонилокси, ароилокси, С 1 С 4 перфторалканоилокси,С 1-С 4 алканоилокси; галогена; диазония; первичного и вторичного С 1-С 4 алкокси (за исключением этокси), оксония,перхлорилокси, четвертичный аммоний С 1 С 4 алкилсульфонилокси, галогенсульфонилокси,галония и диарилсульфониламино. 3. Способ по п.2, где Х представляет галоген или метокси. 4. Способ по п.3, где Х представляет фтор,хлор или метокси. 5. Способ по п.4, где Х представляет фтор или хлор. 6. Способ по любому одному из предыдущих пунктов, где -OR присутствует со вспомогательным основанием. 7. Способ по п.6, где вспомогательное основание выбирают из группы, состоящей из стерически затрудненного основания, солей ме 003774 18 таллов 1-метилпиперазина (особенно для соединения IA), 1-этилпиперазина (особенно для соединения IB), морфолина, гидрида металла, оксида металла, карбоната металла и бикарбоната металла. 8. Способ по п.7, где стерически затрудненное основание представляет собой соль металла стерически затрудненного спирта или амина. 9. Способ по п.8, где соль металла стерически затрудненного спирта или амина, выбирают из группы, состоящей из вторичного или третичного С 4-С 12 алканола, С 3-С 12 циклоалканола и вторичного или третичного (С 3 С 8 циклоалкил)C1-С 6 алканола,N-(вторичный или третичный С 3-С 6 алкил)-N-(первичный, вторичный или третичный С 3-С 6 алкил)амина, N(С 3-С 8 циклоалкил)-N-(первичный,вторичный или третичный С 3-С 6 алкил)амина, ди(С 3 С 8 циклоалкил)амина или гексаметилдисилазана,1,5-диазабицикло[4,3,0]нон-5-ена, 1,8-диазабицикло[5,4,0]ундец-7-ена и третичных аминов,таких как триэтиламин. 10. Способ по п.9, где вспомогательное основание представляет собой соль металла третичного алканола. 11. Способ по любому одному из предыдущих пунктов, где реакцию проводят в инертном растворителе или ROH или смеси того и другого. 12. Способ по п.11, где растворитель выбирают из группы, состоящей из этанола (дляIA), н-пропанола (для IB), вторичного или третичного С 4-С 12 алканола, С 3-С 12 циклоалканола,третичного С 4-С 12 циклоалканола, вторичного или третичного (С 3-С 7 циклоалкил)С 2-С 6 алканола; С 3-С 9 алканона, 1,2-диметоксиэтана, 1,2 диэтоксиэтана, диглима (диметиловый эфир диэтиленгликоля),тетрагидрофурана,1,4 диоксана, толуола, ксилола, хлорбензола, 1,2 дихлорбензола, ацетонитрила, диметилсульфоксида, сульфолана, диметилформамида, Nмeтилпиppoлидин-2-oнa, пиридина и их смесей. 13. Способ по п.12, где растворитель выбирают из группы, состоящей из этанола (для(С 3-С 7 циклоалкил)С 2-С 6 алканола,С 3-С 9 алканона,1,2-диметоксиэтана,1,2 диэтоксиэтана, диглима (диметиловый эфир диэтиленгликоля),тетрагидрофурана,1,4 диоксана, толуола, ксилола, хлорбензола, 1,2 дихлорбензола, ацетонитрила, сульфолана, диметилформамида,N-метилпирролидин-2-она,пиридина и их смесей. 14. Способ по п.13, где растворитель представляет собой этанол (для IA) или пропанол(для IB). 15. Способ получения соединения формулы (IA) и (IB) по любому одному из предыдущих пунктов, включающий реакцию соединения формулы (IIА) и (IIB) соответственно, с ZOR или с ROH и вспомогательным основанием, как определено здесь ранее, или с ZOR и вспомогательным основанием, где ZOR представляет соль OR и Z представляет катион. 16. Способ по п.15, где соединение (IA) получают реакцией соединения (IIА) а) с этанолом и вспомогательным основанием, необязательно в инертном растворителе; или б) с ZOEt и вспомогательным основанием в этаноле или инертном растворителе или в том и другом; или в) с ZOEt и этанолом или инертным растворителем или тем и другим. 17. Способ по п.15, где соединение (IB) получают реакцией соединения (IIB) г) с пропанолом и вспомогательным основанием, необязательно в инертном растворителе(как определено здесь ранее); или д) с ZOPr и вспомогательным основанием в пропаноле или инертном растворителе или в том и другом; или е) с ZOPr и пропанолом или инертным растворителем или тем и другим. 18. Способ по любому одному из предыдущих пунктов, где соединение формулы (IIА) получают сочетанием соединения формулы 19. Способ по п.18, где соединение формулы (VIIA) получают сочетанием соединения формулы (VIA) с N-метилпиперазином и соединение формулы (VIIB) получают сочетанием соединения формулы (VIA) с Nэтилпиперазином. 20. Соединение формулы (IIА) и (IIB) где Х выбирают из галогена или метокси. 21. Соединение формулы (IIIA) и (IIIB) где X выбирают из галогена или метокси. 22. Соединение формулы (VIIA) и (VIIB) и соединение формулы (IIB) получают сочетанием соединения формулы (VIIB) где Х выбирают из галогена или метокси. 23. Соединение по любому одному из пп.20-22, где X выбирают из группы, состоящей из фтора, хлора и метокси. 24. Соединение по п.22, где Х выбирают из фтора или хлора.
МПК / Метки
МПК: C07D 487/04
Метки: продукты, 4,3-d, способ, получения, пиримидин-7-онов, промежуточные, пиразоло
Код ссылки
<a href="https://eas.patents.su/11-3774-sposob-polucheniya-pirazolo-43-d-pirimidin-7-onov-i-ih-promezhutochnye-produkty.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения пиразоло [4,3-d] пиримидин-7-онов и их промежуточные продукты</a>
Следующий патент: Композиции с контролируемым высвобождением пароксетина
Случайный патент: Ортодонтическое устройство












