Способ получения эзетимиба и его производных
Номер патента: 17349
Опубликовано: 30.11.2012
Авторы: Плевник Миха, Стефан Мишель, Стимац Антон, Бевц Мойца, Кидемет Давор, Бенкиц Примоз, Мохар Барбара, Гартнер Андрей, Кросель Весна, Седмак Грегор, Зупет Рок, Смрколь Матей, Кляйиц Ален
Формула / Реферат
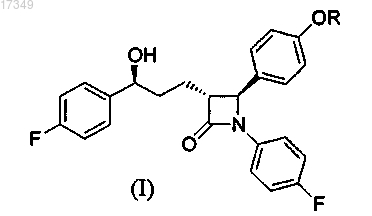
1. Способ получения соединения общей формулы
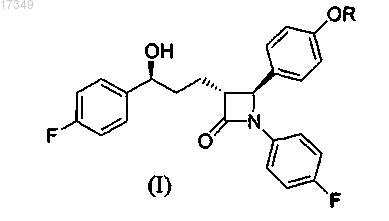
где R представляет собой атом водорода, защитную группу, выбранную из трехзамещенного силила, арилметила, тетрагидро-2Н-пиранила, моно- или двузамещенного арилметила с заместителями, которые выбраны из группы, состоящей из галогенов, метокси-, нитрогрупп, фенила, нафтила и их любых комбинаций,
включающий следующие стадии:
а) катализируемая металлами асимметрическая трансферная гидрогенизация парафторацетофенонов общей формулы (II)
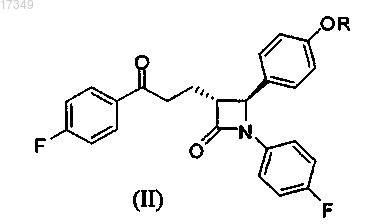
где R такие же, как указано выше,
с применением донора водорода в присутствии катализатора на основе комплексов рутения;
b) получение соединения, представленного общей формулой (I);
c) необязательно, очистка соединения, представленного общей формулой (I).
2. Способ по п.1, где R выбран из группы, состоящей из трет-бутилдиметилсилила, трет-бутилдифенилсилила, триизопропилсилила, тритила, бензила, парабромбензила, парахлорбензила, паранитробензила, ортонитробензила, парафенилбензила, параметоксибензила, тетрагидро-2Н-пиранила, отличающийся тем, что указанным способом получают соединение общей формулы (I) с диастереомерным отношением более чем 99:1.
3. Способ по п.1, где R выбран из группы, состоящей из парабромбензила, парахлорбензила, паранитробензила, параметоксибензила, тритила, трет-бутилдиметилсилила, тетрагидро-2Н-пиранила и бензила.
4. Способ по любому из пп.1-3, где металлокатализатор основан на рутениевых комплексах оптически активных N-сульфамоил-1,2-диаминовых лигандов общей формулы (VI)
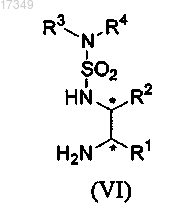
где С* представляет собой асимметрический атом углерода;
R1 и R2 независимо представляют собой атом водорода, фенил или циклоалкил либо
R1 и R2 связаны друг с другом, образуя циклогексановое кольцо;
R3 и R4 независимо представляют собой атом водорода, метил, изопропил или циклогексил либо
R3 и R4 связаны друг с другом, образуя с атомом азота пирролидил, пиперидил, морфолил или азепанил.
5. Способ по п.4, где оптически активный N-сульфамоил-1,2-диаминовый лиганд имеет энантиомерный избыток более 99%.
6. Способ по любому из пп.1-5, где металлокатализатор получают из рутениевого металлического предшественника и оптически активного N-сульфамоил-1,2-диаминового лиганда общей формулы (VI).
7. Способ по п.6, где предшественник рутениевого катализатора состоит из димеров галогенидов η6-арен-рутения (II) формулы [RuX2(η6-арен)]2, где η6-арен представляет собой арен, который выбран из группы, состоящей из бензола, парацимола, мезитилена, 1,3,5-триэтилбензола, гексаметилбензола и анизола; а X представляет собой галоген, который выбран из группы, состоящей из хлора, брома и йода.
8. Способ по любому из пп.1-7, где рутениевый комплекс представляет собой [(S,S)-N-(пиперидил-N-сульфонил)-1,2-дифенилэтилендиамин](η6-мезитилен)рутений.
9. Способ по любому из пп.1-8, где донор водорода основан на НСО2Н.
10. Способ по п.8, где донор водорода выбран из группы, состоящей из HCO2H-Et3N, HCO2H-изо-Pr2NEt, НСО2Н-бикарбонатов металлов и НСО2Н-карбонатов металлов, где металл выбран из группы, состоящей из Na, K, Cs, Mg и Са.
11. Способ по любому из пп.1-10, где катализируемую металлами асимметрическую трансферную гидрогенизацию проводят в растворителе, который выбран из группы, состоящей из дихлорэтана, ацетонитрила, N,N-диметилформамида, N,N-диметиацетамида, 1-метил-2-пирролидинона (NMP), 1,1,3,3-тетраметилмочевины, 1,3-диметил-2-имидазолидинона, N,N'-диметилпропиленмочевины и их смесей.
12. Способ по любому из пп.1-11, где соединение формулы (I) представляет собой эзетимиб.
13. Применение рутениевого катализатора [(S,S)-N-(пиперидил-N-сульфонил)-1,2-дифенилэтилендиамин](η6-мезитилен)рутения для получения соединения формулы (I)
путем асимметрической трансферной гидрогенизации парафторацетофенонов общей формулы (II)
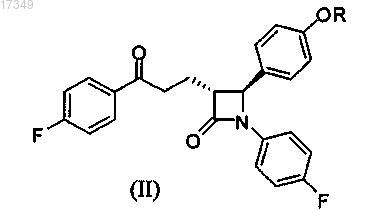
где R выбран из группы, состоящей из атома водорода, защитной группы, которая выбрана из группы, состоящей из трехзамещенного силила, арилметила, тетрагидро-2Н-пиранила, моно- или двузамещенного арилметила с заместителями, которые выбраны из группы, состоящей из галогенов, метокси-, нитрогрупп, фенила, нафтила и их любых комбинаций.
Текст
СПОСОБ ПОЛУЧЕНИЯ ЭЗЕТИМИБА И ЕГО ПРОИЗВОДНЫХ Изобретение относится к способу получения эзетимиба и его производных, а также к применению рутениевого катализатора для получения указанных веществ. 017349 Настоящее изобретение относится к улучшенному способу получения 1-(4-фторфенил)-3(R)-[3-(4 фторфенил)-3(S)-гидроксипропил]-4(S)-(4-гидроксифенил)-2-азетидинона, основанному на асимметрической трансферной гидрогенизации парафторацетофенонов с применением катализаторов рутенийR3R4NSO2-1,2-диамина. Указанные промежуточные соединения могут быть получены с высокими выходами и чистотой быстрым и экономичным способом. Гиперхолестеринемия и высокие уровни холестерина в крови или плазме в развитых странах являются распространнными заболеваниями. Гиперхолестеринемия сопутствует атеросклерозу, потере эластичности артерий, нарушениям функции сердца и является одним из тяжлых состояний, которые могут приводить к коронарным заболеваниям и заболеваниям артерий. Группа риска включает тучных людей,курильщиков, лиц с неправильной диетой (например, богатой насыщенными жирами), с неадекватной физической нагрузкой и испытывающих стресс. Для индивидов в группе риска, а также тех, у которых нашли чрезмерно высокий уровень холестерина, были предложены многообразные курсы лечения, например изменения в диете и образе жизни, увеличенную физическую нагрузку и т.д. Однако эти способы лечения не всегда просто ввести в действие, и в силу этого существует постоянная потребность в медицинских подходах к лечению, которые были бы действенными в уменьшении уровня холестерина в плазме. Статины (например, флувастатин, симвастатин, ловастатин, аторвастатин, розувастатин), и особенности симвастатин, широко применяют для лечения или предупреждения высоких уровней холестерина у индивидов. Также были предложены другие соединения, имеющие иной способ действия в отношении уменьшения уровней холестерина в крови. Среди них имеется хорошо известное лекарственное средство эзетимиб из семейства соединений, понижающих уровень липидов, селективно ингибирующих абсорбцию холестерина и родственных фитостеролов кишечником. Эзетимиб,имеющий химическое название 1-(4-фторфенил)-3(R)-[3-(4-фторфенил)-3(S)гидроксипропил]-4(S)-(4-гидроксифенил)-2-азетидин и описываемый структурной формулой (Ia), был описан в ЕР 0720599 Структурная формула эзетимиба Ia: R=Н. Механизм ингибирования абсорбции и резорбции холестерина эзетимибом включает увеличение экскреции с калом холестерина и его метаболитов, образующихся в кишечнике. Этот эффект обусловливает пониженные уровни холестерина в организме, увеличение синтеза холестерина и уменьшение синтеза триглицеридов. Первоначально увеличение синтеза холестерина поддерживает уровни холестерина в кровообращении, которые затем постепенно уменьшаются по мере продолжения ингибирования абсорбции и резорбции холестерина. Окончательным эффектом действия эзетимиба является понижение уровня холестерина в кровообращении и тканях тела. Также полагают, что эзетимиб уменьшает концентрации в плазме нехолестериновых стеролов ситостерола и кампестерола, что наводит на мысль о влиянии на абсорбцию также и этих соединений. В литературе описаны различные пути синтеза эзетимиба и его производных, в которых ключевая стадия основана на асимметрическом восстановлении промежуточных производных парафторацетофенона с функциональными группам в -положении общих формул (IIa), (IIb), (IIIb) или (IV)(IIIb): R=Bn. Согласно ЕР 0906278 и ЕР 0720599 эзетимиб (Ia) и его производное (Ib) (формула (I), где R=Bn) получали восстановлением боранами соответствующего кетона (IIa) и (IIb). Восстановление катализировали 10 мол.% (R)-тетрагидро-1-метил-3,3-дифенил-1H,3H-пиррол[1,2-c][1,3,2]оксазаборолидином при-20C с последующим дебензилированием (Ib). Этот же способ восстановления применяли к кетонам(IIIb) и (IV) (как описано в ЕР 0707567). Согласно этому литературному источнику спирты, получаемые восстановлением (IIa), (IIb) или (IV), были выделены с выходом 70-80% при отношении диастереомеров(dr) от 96:4 до 99:1. Восстановление соединения общей формулы (IIIb) привело к dr 88:12. При использо-1 017349 вании этих способов в виде отходов образовывались стехиометрические количества солей боратов. Альтернативным синтезом эзетимиба является микробиологическое восстановление кетона (IIa) при высоком разбавлении с образованием единственного диастереомера, описанное в ЕР 1169468. Однако этот способ является низкопроизводительным (выход 15%). Далее, промежуточный кетон (IIb), применяемый в вышеупомянутых литературных источниках,является сиропообразным и его можно получить в чистом виде только после утомительной хроматографической очистки. С другой стороны, альтернативные способы стереоселективного восстановления арилкетонов без применения боранов в стехиометрическом отношении были описаны Sterk et al. (Tetrahedron: Asymmetry 2002, 13, 2605-2608), выполнивших асимметрическую трансферную гидрогенизацию различных классов кетонов с применением смеси муравьиная кислота/триметиламин, катализируемое оптически чистыми комплексами рутения или родия N-(N,N-диалкилсульфамоил)-1,2-диаминовых лигандов. Катализаторы могут быть приготовлены in situ и не требуют каких-либо специальных манипуляций в инертном газе. Соответственно, на существующем уровне техники имеется потребность предложить альтернативный, в целом экономичный синтез эзитимиба, позволяющий производство указанного соединения с высокими выходами и высокой чистотой. Вышеупомянутая проблема была решена путм разработки модифицированной схемы реакций, позволяющей получать конечный продукт с более высокой оптической чистотой и более высоким выходом. Краткое изложение сущности изобретения Настоящее изобретение относится к способу получения соединения, представленного общей формулой где R представляет собой атом водорода, защитную группу, которая выбрана из группы, состоящей из трхзамещнного силила, арилметила, тетрагидро-2 Н-пиранила, моно- или двузамещнного арилметила с заметителями, которые выбраны из группы, состоящей из галогенов, метокси-, нитро-, фенильных,нафтильных групп и их любых комбинаций,включающему: а) катализируемую металлами асимметрическую трансферную гидрогенизацию парафторацетофенонов общей формулы (II) где R такие же, как приведено выше,с применением донора водорода в присутствии металлокатализаторов на основе комплексов рутения;c) необязательно, очистку соединения, представленного общей формулой (I). Схема синтеза для получения эзетимиба и его производных по настоящему изобретению представлена на схеме 1. В другом воплощении настоящее изобретение относится к применению рутениевого катализатора[(S,S-N-пиперидил-N-сульфонил)-1,2-дифенилэтилендиамин](6-мезитилен)рутения для получения соединения (I), как было определено выше. Подробное описание изобретения По предпочтительному воплощению настоящего изобретения предлагается способ получения соединения, представленного общей формулой где R представляет собой атом водорода, защитную группу, которая выбрана из группы, состоящей из трхзамещнного силила, арилметила, тетрагидро-2 Н-пиранила, моно- или двузамещнного арилметила с заместителями, которые выбраны из группы, состоящей из галогенов, метокси-, нитро-, фенильных, нафтильных групп и их любых комбинаций.-2 017349 Указанный способ (схема 6) включает а) катализируемую металлами асимметрическую трансферную гидрогенизацию парафторацетофенонов общей формулы (II) где R имеет вышеуказанное значение, т.е. R представляет собой атом водорода, защитную группу,которая выбрана из группы, состоящей из трхзамещнного силила, арилметила, тетрагидро-2 Нпиранила, моно- или двузамещнного арилметила с заметителями, которые выбраны из группы, состоящей из галогенов, метокси-, нитро-, фенильных, нафтильных групп и их любых комбинаций. Гидрирование с переносом протонов проводят, применяя донор водорода в присутствии металлокатализатора, на основе рутениевых комплексов; b) получение соединения, представленного общей формулой (I), предпочтительно с отношением диастереомеров (dr) более чем 99:1; и с) необязательно, очистку соединения, представленного общей формулой (I). По воплощению настоящего изобретения R выбран из группы, состоящей из третбутилдиметилсилила, трет-бутилдифенилсилила, триизопропилсилила, тритила, бензила, парабромбензила, парахлорбензила, паранитробензила, ортонитробензила, парафенилбензила, параметоксибензила,тетрагидро-2 Н-пиранила, отличающемуся тем, что указанным способом получают соединение, представленное общей формулой (I) с диастереомерным отношениием более чем 99:1. По ещ одному воплощению R выбран из группы, состоящей из парабромбензила, парахлорбензила, паранитробензила, параметоксибензила, тритила, трет-бутилдиметилсилила, тетрагидро-2 Н-пиранила и бензила. По настоящему изобретению способ основывается на применении донора водорода в присутствии металлокатализатора на основе рутениевых комплексов оптически активных лигандов N-сульфамоил 1,2-диамина (R3R4NSO2-1,2-диамина) общей формулы (VI) где С представляет собой асимметрический атом углерода;R1 и R2 независимо представляют атом водорода, фенил или циклоалкил либоR1 и R2 могут быть связаны друг с другом с образованием циклогексанового кольца;R3 и R4 независимо представляют атом водорода, метил, изопропил или циклогексил либоR3 и R4 могут быть связаны один с другим, образуя совместно с атомом азота пирролидил, пиперидил, морфолил или азепанил. По воплощению оптически активные N-сульфамоил-1,2-диаминовые лиганды имеют энантиомерный избыток более 99%. По воплощению R3 и/или R4 могут быть выбраны из группы, состоящей из метила, изопропила и циклогексила. По другому воплощению R3 и R4 связаны друг с другом с образованием кольца, которое выбрано из группы, состоящей из пирролидила, пиперидила, морфолила и азепанила. Предпочтительно рутениевый комплекс представляют формулой-3 017349 Вс ещ одним из воплощений настоящего изобретения является применение рутениевого комплекса [(S,S)-N-(пиперидил-N-сульфонил)-1,2-дифенилэтилендиамин](6-мезитилен)рутения для приготовления соединения формулы (I) путм асимметрической трансферной гидрогенизации парафторацетофенонов общей формулы (II) где R выбран из группы, состоящей из атома водорода, защитной группы, которая выбрана из группы, состоящей из трхзамещнного силила, арилметила, тетрагидро-2 Н-пиранила, моно- или двузамещнного арилметила с заместителями, которые выбраны из группы, состоящей из галогенов, метокси-,нитрогрупп, фенильных, нафтильных групп и их любых комбинаций. Оптически активный рутениевый комплекс получают из рутениевого металлического предшественника и оптически активного (предпочтительно энантиомерный избыток (ее) более 99%) N-сульфамоил 1,2-диаминового лиганда общей формулы (VI) (где R1, R2, R3 и R4 являются такими как определено выше) и применяют либо в изолированной форме, либо in situ. Рутениевый металлический предшественник состоит из димеров галогенидов 6-арилрутения (II) формулы [RuX2(6-арил)]2, где 6-арил представляет собой арен, который выбран из группы, состоящей из бензола, парацимола, мезитилена,1,3,5-триэтилбензола, гексаметилбензола, анизола, и где X представляет собой галоген, который выбран из группы, состоящей из хлорида, бромида и йодида. Рутениевый катализатор, применяемый по настоящему изобретению в катализируемой металлами асимметрической трансферной гидрогенизации, может быть получен из рутениевого комплекса в присутствии основания и/или донора водорода. Катализируемая металлами асимметрическая трансферная гидрогенизация по настоящему изобретению может проводиться в присутствии донора водорода, известного из литературы, например изPalmer et al. Tetrahedron: Asymmetry, 1999, 10, 2045-2061. Предпочтительно применяемыми являются производные НСО 2 Н, такие как, например, HCO2H-Et3N, НСО 2 Н-изо-Pr2NEt, НСО 2 Н-бикарбонаты металлов, НСО 2 Н-карбонаты металлов (металл выбран из группы, состоящей из Na, K, Cs, Mg, Ca) и т.п. Подходящие растворители для способа по настоящему изобретению включают, не ограничиваясь ими, такие растворители, как дихлорэтан, ацетонитрил, N,N-диметилформамид (DMF),N,N-диметилацетамид (DMA), 1-метил-2-пирролидинон (NMP), 1,1,3,3-тетраметилмочевина (TMU),1,3-диметил-2-имидазолидинон (DMEU) N,N'-диметилпропиленмочевина (DMPU) и их смеси. Катализируемая металлами асимметрическая трансферная гидрогенизация может проводиться при температурах реакции от около 15 до около 70C, предпочтительно от около 30 до около 40C. Авторы неожиданно обнаружили, что количества рутениевого катализатора, требуемые в способе по настоящему изобретению, малы по сравнению с количествами других катализаторов, применяемых в синтезе эзетимиба, известными из предыдущего уровня техники. Рутениевый катализатор можно применять в количествах, варьирующих от около 0,05 до около 10 мол.%, предпочтительно от около 0,1 до около 1,0 мол.%. По предпочтительному предпочтению соединением формулы (I) является эзетимиб. Исходным материалом, применяемым в способе по настоящему изобретению (схема 1), может являться соединение общей формулы (II). Указанные соединения восстанавливают по настоящему изобретению, как показано на схеме 1, с получением соединений общей формулы (Ib)-(Ik). Удаление защитной группы R с соединений общей формулы (Ib)-(Ik) можно проводить любым способом, известным специалистам в данной области техники, только таким образом, чтобы получался эзетимиб. В предпочтительном случае для удаления защитной группы R применяют гидрирование соединений общей формулы (Ib)-(Ih) в присутствии Pd/C или обработку кислотными реагентами соединений общей формулы (Ih)-(Ik). Эзетимиб, полученный по настоящему изобретению, по данным ВЭЖХ (высокоэффективная жидкостная хроматография) обладал чистотой не менее около 90%, более предпочтительно не менее около 95% и наиболее предпочтительно не менее около 99%. Эзетимиб, полученный способом по настоящему изобретению, может быть выделен/кристаллизован или дополнительно очищен способами, известными специалистам в данной области техники (как, например, WO 2004/099132, WO 2005/066120, WO 2006/060808, WO 2005/062897,WO 2005/009955, WO 2006/050634, IPCOM000131677, G.Y.S.K. Swamy at al., Acta Cryst. (2005). E61,o3608-o3610). Растворителями и/или реагентами, которые могут применяться, являются н-бутанол,н-пропанол, хлороформ, ТГФ, ацетон, бис-триметилсилилацетамид, диэтилкетон, этилацетат, метанол и т.п., в частности, например, изопропанол, метанол/вода, этанол/вода и т.д. Настоящее изобретение иллюстрируется следующими неограничивающими примерами. Примеры Пример для сравнения (ЕР 0720599, пример 6). Синтез эзетимиба из метил-3-(2S,3R)-2-[4(бензилокси)фенил]-1-(4-фторфенил)-4-оксоазетидин-3-ил-пропионата (Vb; Z = СО 2 Ме). Процедура 1. К раствору метил-3-(2S,3R)-2-[4-(бензилокси)фенил]-1-(4-фторфенил)-4-оксоазетидин-3 илпропионата (Vb; Z = СО 2 Ме) (1,6 г, 3,7 ммоль) в метаноле (3,5 мл) и воде (1,5 мл) добавляли гидроксид лития моногидрат (155 мг, 3,7 ммоль). Смесь перемешивали при комнатной температуре в течение 1,5 ч, затем добавляли дополнительное количество гидроксида лития моногидрата (54 мг, 1,3 ммоль) и перемешивание продолжали в течение 3 ч. Добавляли 1 М хлористо-водородную кислоту (5 мл) и этилацетат (15 мл), органический слой промывали водой 3 раза и сушили над сульфатом натрия. Путм концентрирования в вакууме получали кислоту (Vb; Z = СО 2 Н) (1,4 г, 89%) в виде пены янтарного цвета. Процедура 2. Стадия 1. К раствору метил-3-(2S,3R)-2-[4-(бензилокси)фенил]-1-(4-фторфенил)-4-оксоазетидин-3-илпропионата (Vb; Z = CO2Me) (32 г, 74 ммоль) в метаноле (70 мл) и воде (30 мл) добавляли гидроксид лития моногидрат (3,1 г, 74 ммоль). Смесь перемешивали при комнатной температуре в течение 1,5 ч, затем добавляли дополнительное количество гидроксида лития моногидрата (1,08 г, 26 ммоль) и перемешивание продолжали в течение 5,45 ч. Добавляли 1 М хлористо-водородную кислоту (100 мл) и этилацетат(110 мл), органический слой промывали водой 3 раза и сушили над сульфатом натрия. Путм концентрирования в вакууме получали кислоту (Vb; Z = СО 2 Н) (31,86 г, количественный выход 89%) в виде пены янтарного цвета. Стадия 2. К раствору 3-(2S,3R)-2-[4-(бензилокси)фенил]-1-(4-фторфенил)-4-оксоазетидин-3-илпропионовой кислоты (Vb; Z = СО 2 Н) (30 г, 71,5 ммоль) в дихлорметане (52 мл) добавляли 2 М раствор хлорангидрида щавелевой кислоты в дихлорметане (53 мл, 106 ммоль) и смесь перемешивали при комнатной температуре в течение 16,5 ч. Концентрирование в вакууме приводило к хлорангидриду кислоты (Vb; Z = COCl)(31,45 г, количественный выход) в виде вязкого масла янтарного цвета.-5 017349 Стадия 3. К раствору осушенного хлорида цинка (10,2 г, 73,4 ммоль) в тетрагидрофуране (66 мл) по каплям при перемешивании добавляли 1 М раствор бромида 4-фторфенилмагния (73 мл) в тетрагидрофуране при 4C. К образовавшейся суспензии хлорида 4-фторфенилцинка при 0C добавляли тетракис(трифенилфосфин)палладий (4,12 г, 3,6 ммоль) и затем раствор 3-(2S,3R)-2-[4-(бензилокси)фенил]-1-(4 фторфенил)-4-оксоазетидин-3-илпропионилхлорида (Vb; Z = COCl) (31,45 г, 71,5 ммоль) в тетрагидрофуране (69 мл), после чего убирали охлаждающую баню. После перемешивания в течение 4,5 ч добавляли 1 М хлористо-водородную кислоту (20,5 л) и этилацетат (200 мл), органический слой промывали водой (100 мл) и сушили над сульфатом натрия. Концентрирование приводило к маслу, которое было очищено повторной хроматографией на силикагеле в системе толуол/изопропанол (100/1). Получен (3R,4S)4-[4-(бензилокси)фенил]-1-(4-фторфенил-3-[3-(4-фторфенил)-3-оксопропил]азетидин-2-он (IIb) (13,2 г,37%) в виде масла, окрашенного в коричневый цвет. Стадия 4. Тетрагидрофурановый раствор (20,6 мл) (3R,4S)-4-[4-(бензилокси)фенил]-1-(4-фторфенил-3-[3-(4 фторфенил)-3-оксопропил]азетидин-2-она (IIb) (6,54 г, 13 ммоль) и (R)-1-метил-3,3-дифенилтетрагидро 1 Н,3H-пирроло[1,2-с][1,3,2]оксазаборола (2,9 мл, 1 М в толуоле) охлаждали до -20C, затем в течение 1,5 ч при -18C по каплям добавляли боран-диметилсульфидный комплекс (2 М в тетрагидрофуране; 5,85 мл, 11,7 ммоль). Перемешивание продолжали ещ в течение 1 ч при -19C, затем осторожно добавляли метанол (3,5 мл) и 1 М хлористо-водородную кислоту (27,5 мл). Смесь экстрагировали этилацетатом (41 мл), органический слой промывали водой (248 мл) и сушили над сульфатом натрия. Концентрирование приводило к неочищенному (3R,4S)-4-[4-(бензилокси)фенил]-1-(4-фторфенил)-3-[(S)-3-(4 фторфенил)-3-гидроксипропил]азетидин-2-ону (Ib) (5,625 г, 66,3%) в виде пены коричневого цвета с химической чистотой 77,1%. Стадия 5. К раствору(3R,4S)-4-[4-(бензилокси)фенил]-1-(4-фторфенил)-3-[(S)-3-(4-фторфенил)-3 гидроксипропил]азетидин-2-она (Ib) (0,828 г, 1,66 ммоль) в абсолютном этаноле (5,4 мл) добавляли 10% палладия на угле (62 мг, Heraeus). Реакционную смесь встряхивали в толстостенном сосуде под давлением газообразного водорода (400 кПа) в течение 40 ч. Затем добавляли дополнительное количество катализатора (62 мг) и продолжали гидрогенолиз, до его завершения, по данным анализа ТСХ (толуол/этилацетат = 9/1). Катализатор удаляли фильтрованием и промывали абсолютным этанолом (40 мл). Полученный раствор концентрировали в вакууме с образованием сырого эзетимиба (0,615 г, 90,7%) в виде коричневатого тврдого вещества. Анализ способом порошковой рентгеновской дифракции на порошке, проведнный непосредственно после синтеза, показал, что образец представляет собой смесь аморфных и кристаллических фаз (содержание гидратированной формы превышает содержание ангидроформы). Повторный анализ через 9 суток обнаружил немного меньшие количества аморфной фазы и превалирование безводной формы над гидратированной формой в кристаллической фазе. 0,438 г этого материала очищали путм перекристаллизации из системы этанол/вода (5/1, 3,7 мл). После перемешивания при комнатной температуре в течение приблизительно 80 мин и охлаждения на водяной бане в течение 15 мин кристаллы отфильтровывали и промывали холодной смесью этанол/вода (1/1, 6 мл) с образованием эзетимиба (0,276 г) в гидратированной форме Н по данным анализа способом порошковой рентгеновской дифракции на порошке с температурой плавления 159-161,5C. Пример 1. Гидрирование кетона (IIb) с переносом протона.(1S,2S)-N-пиперидилсульфамоил-1,2-дифенилэтилендиамина (17 мг, 48 мкмоль) путм нагрева в ацетонитриле (2 мл) при 80C в течение 30 мин. Затем раствор Ru-комплекса и HCO2H-Et3N (5:2, 2 мл) при перемешивании добавляли пятью порциями в течение 24 ч к (3R,4S)-4-(4-(бензилокси)фенил)-1-(4 фторфенил)-3-(3-(4-фторфенил)-3-оксопропил)азетидин-2-он (IIb) (2,50 г, 5,0 ммоль) в ацетонитриле(5 мл) при 40C. Смесь распределяли между этилацетатом (20 мл) и водой (20 мл), органический слой промывали насыщенным солевым раствором (20 мл), сушили над Na2SO4 и фильтровали через слой силикагеля. После концентрирования остаток перекристаллизовывали из изопропилового эфира, затем из этанола, получая 2,27 г (90,5%) спирта (Ib) с dr (отношением диастереомеров) = 94:6 (по данным 19F ЯМРRu-комплекс готовили из [RuCl2(мезитилен)]2 (2,1 мг, 7,2 мкм Ru атомн.) и (1S,2S)-Nпиперидилсульфамоил-1,2-дифенилэтилендиамина (3,2 мг, 8,9 мкмоль) путм нагрева в (CH2Cl)2 (0,5 мл) при 80C в течение 30 мин. Затем раствор Ru-комплекса и HCO2H-Et3N (5:2, 210 мкл) при перемешивании добавляли порциями к (IIa) (150 мг, 0,37 ммоль) в (CH2Cl)2 при 40C в течение 24 ч. Смесь распределяли между этилацетатом (5 мл) и водой (5 мл), органический слой промывали насыщенным солевым раствором (5 мл), сушили над Na2SO4 и фильтровали через слой силикагеля. После концентрирования остаток (134 мг) перекристаллизовывали из смеси этанол-вода (4:1), получая продукт (Ia) с dr более 99:1(2:1, 35 мл) гидрировали в течение 10 ч при давлении H2 206,8 кПа и затем фильтровали через броунмиллерит. После концентрирования остаток перекристаллизовывали из этанол-вода (4:1), получая 1,27 г(71%) продукта (Ia) с температурой плавления 160-163C с dr более 99:1 (по данным 19F ЯМР (CDCl3) с 1,5 мол.экв. Eu(hfc)3). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения общей формулы где R представляет собой атом водорода, защитную группу, выбранную из трхзамещнного силила, арилметила, тетрагидро-2 Н-пиранила, моно- или двузамещнного арилметила с заместителями, которые выбраны из группы, состоящей из галогенов, метокси-, нитрогрупп, фенила, нафтила и их любых комбинаций,включающий следующие стадии: а) катализируемая металлами асимметрическая трансферная гидрогенизация парафторацетофенонов общей формулы (II) где R такие же, как указано выше,с применением донора водорода в присутствии катализатора на основе комплексов рутения;b) получение соединения, представленного общей формулой (I);c) необязательно, очистка соединения, представленного общей формулой (I). 2. Способ по п.1, где R выбран из группы, состоящей из трет-бутилдиметилсилила, третбутилдифенилсилила, триизопропилсилила, тритила, бензила, парабромбензила, парахлорбензила, паранитробензила, ортонитробензила, парафенилбензила, параметоксибензила, тетрагидро-2 Н-пиранила, отличающийся тем, что указанным способом получают соединение общей формулы (I) с диастереомерным отношением более чем 99:1. 3. Способ по п.1, где R выбран из группы, состоящей из парабромбензила, парахлорбензила, паранитробензила, параметоксибензила, тритила, трет-бутилдиметилсилила, тетрагидро-2 Н-пиранила и бензила. 4. Способ по любому из пп.1-3, где металлокатализатор основан на рутениевых комплексах оптически активных N-сульфамоил-1,2-диаминовых лигандов общей формулы (VI) где С представляет собой асимметрический атом углерода;R1 и R2 независимо представляют собой атом водорода, фенил или циклоалкил либоR3 и R4 независимо представляют собой атом водорода, метил, изопропил или циклогексил либоR3 и R4 связаны друг с другом, образуя с атомом азота пирролидил, пиперидил, морфолил или азепанил. 5. Способ по п.4, где оптически активный N-сульфамоил-1,2-диаминовый лиганд имеет энантиомерный избыток более 99%. 6. Способ по любому из пп.1-5, где металлокатализатор получают из рутениевого металлического предшественника и оптически активного N-сульфамоил-1,2-диаминового лиганда общей формулы (VI). 7. Способ по п.6, где предшественник рутениевого катализатора состоит из димеров галогенидов 6-арен-рутения (II) формулы [RuX2(6-арен)]2, где 6-арен представляет собой арен, который выбран из группы, состоящей из бензола, парацимола, мезитилена, 1,3,5-триэтилбензола, гексаметилбензола и ани-7 017349 зола; а X представляет собой галоген, который выбран из группы, состоящей из хлора, брома и йода. 8. Способ по любому из пп.1-7, где рутениевый комплекс представляет собой [(S,S)-N-(пиперидилN-сульфонил)-1,2-дифенилэтилендиамин](6-мезитилен)рутений. 9. Способ по любому из пп.1-8, где донор водорода основан на НСО 2 Н. 10. Способ по п.8, где донор водорода выбран из группы, состоящей из HCO2H-Et3N, HCO2H-изоPr2NEt, НСО 2 Н-бикарбонатов металлов и НСО 2 Н-карбонатов металлов, где металл выбран из группы,состоящей из Na, K, Cs, Mg и Са. 11. Способ по любому из пп.1-10, где катализируемую металлами асимметрическую трансферную гидрогенизацию проводят в растворителе, который выбран из группы, состоящей из дихлорэтана, ацетонитрила, N,N-диметилформамида, N,N-диметиацетамида, 1-метил-2-пирролидинона (NMP), 1,1,3,3 тетраметилмочевины, 1,3-диметил-2-имидазолидинона, N,N'-диметилпропиленмочевины и их смесей. 12. Способ по любому из пп.1-11, где соединение формулы (I) представляет собой эзетимиб. 13. Применение рутениевого катализатора[(S,S)-N-(пиперидил-N-сульфонил)-1,2 дифенилэтилендиамин](6-мезитилен)рутения для получения соединения формулы (I) путм асимметрической трансферной гидрогенизации парафторацетофенонов общей формулы (II) где R выбран из группы, состоящей из атома водорода, защитной группы, которая выбрана из группы, состоящей из трхзамещнного силила, арилметила, тетрагидро-2 Н-пиранила, моно- или двузамещнного арилметила с заместителями, которые выбраны из группы, состоящей из галогенов, метокси-,нитрогрупп, фенила, нафтила и их любых комбинаций.
МПК / Метки
МПК: C07D 205/08, A61P 3/00, A61K 31/397
Метки: эзетимиба, способ, производных, получения
Код ссылки
<a href="https://eas.patents.su/9-17349-sposob-polucheniya-ezetimiba-i-ego-proizvodnyh.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения эзетимиба и его производных</a>
Предыдущий патент: Ингибиторы вируса гепатита с
Следующий патент: Способ и установка для изготовления слоя наночастиц или слоя нановолокон из растворов или расплавов полимеров
Случайный патент: Управляемый реактор трансформаторного типа













