Способ получения производных морфолина
Номер патента: 3468
Опубликовано: 26.06.2003
Авторы: Коттрелл Ян Фрэнк, Доллинг Ульф Х., Вилсон Роберт Дэррин, Хэндс Дэвид
Формула / Реферат
1. Способ получения соединения формулы (I)

где R2 и R3 независимо выбирают из группы, состоящей из
(1) водорода,
(2) C1-6алкила,
(3) C2-6алкенила и
(4) фенила;
R6, R7 и R8 независимо выбирают из группы, состоящей из
(1) водорода,
(2) C1-6алкила,
(3) фтора,
(4) хлора,
(5) брома,
(6) иода и
(7) -CF3;
R11, R12 и R13 независимо выбирают из группы, состоящей из
(1) водорода,
(2) C1-6алкила,
(3) фтора,
(4) хлора,
(5) брома,
(6) иода и
(7) -CF3; и
Z представляет C1-4алкил, включающий
(i) взаимодействие соединения формулы (II)
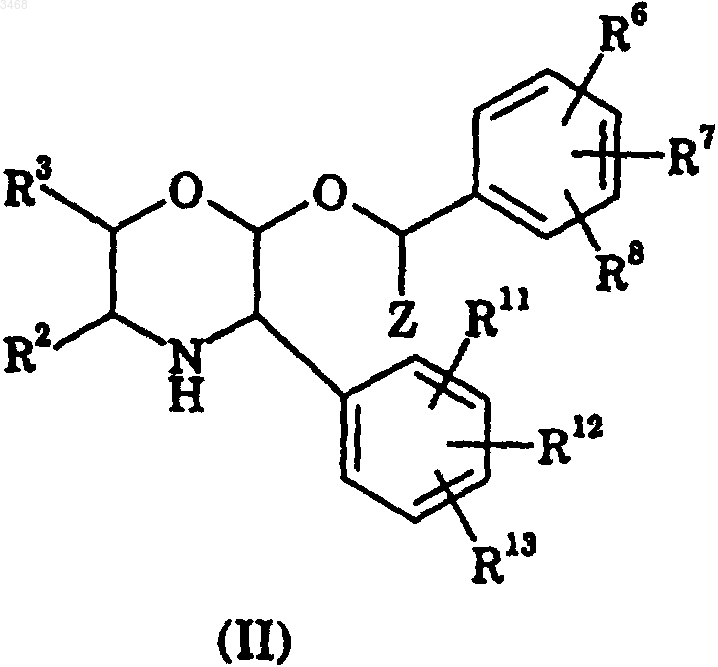
или его соли, где R2, R3, R6, R7, R8, R11, R12, R13 и Z являются такими, как определено ранее, с соединением формулы (III)
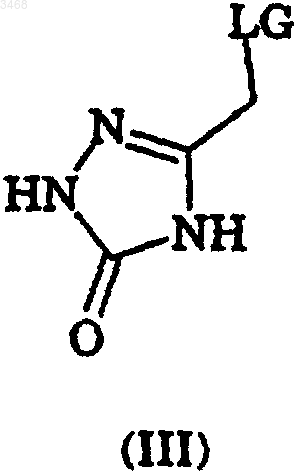
где LG представляет уходящую группу, выбранную из галогена (например, брома, хлора или иода) или алкил- или арилсульфонатной группы (например, мезилатной или тозилатной), в органическом растворителе и в присутствии основания; и
(ii) сбор полученного кристаллического соединения формулы (I).
2. Способ получения соединения 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фторфенил)-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина, включающий
(i) взаимодействие 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фторфенил)морфолина или его соли с соединением формулы (III)
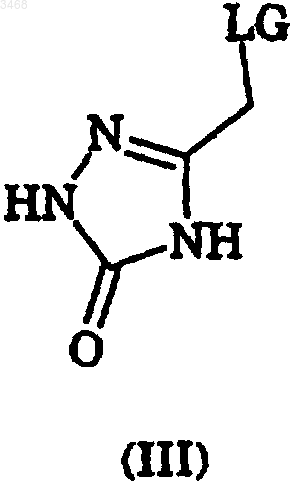
как определено в п.1, в органическом растворителе и в присутствии основания, и
(ii) сбор полученного кристаллического 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фторфенил)-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина.
3. Способ по п.1 или 2, где уходящая группа LG представляет собой хлор.
4. Способ по п.1 или 2, где основание является органическим основанием.
5. Способ по п.4, где органическое основание выбирают из диизопропилэтиламина или триэтиламина.
6. Способ по п.1 или 2, где основание является неорганическим основанием.
7. Способ по п.6, где неорганическое основание выбирают из гидрида натрия или карбоната калия.
8. Способ по любому из пп.1-5, где органический растворитель является ацетонитрилом.
9. Способ по любому из пп.1-3, 6 или 7, где органический растворитель является диметилформамидом.
10. Способ по п.1 или 2, где стадию (i) осуществляют в диметилформамиде в присутствии карбоната калия.
11. Способ по любому из пп.1-10, где реакцию осуществляют при комнатной температуре.
12. Способ по любому из пп.2-11, где 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фторфенил)морфолин, используемый на стадии (i), находится в форме его свободного основания, или его соли с (R)-камфорсульфоновой кислотой, или его соли с пара-толуолсульфоновой кислотой.
13. Способ получения 3-хлорметил-1,2,4-триазолин-5-она, включающий
(i) обработку гидрохлорида семикарбазида бензилоксиацетилхлоридом в условиях реакции Шоттена-Баумана с получением бензилоксиацетилсемикарбазида,
(ii) циклизацию продукта со стадии (i) в щелочных условиях с получением 3-бензилоксиметил-1,2,4-триазолин-5-она,
(iii) гидрирование продукта со стадии (ii) с получением 3-гидроксиметил-1,2,4-триазолин-5-она и
(iv) обработку продукта со стадии (iii) хлорирующим агентом с получением 3-хлорметил-1,2,4-триазолин-5-она.
14. Способ по п.13, где на стадии (i) условия реакции Шоттена-Баумана включают использование водной щелочи в простом эфире при пониженной температуре.
15. Способ по п.14, где водная щелочь является водным гидроксидом натрия.
16. Способ по п.14 или 15, где простой эфир представляет собой тетрагидрофуран.
17. Способ по любому из пп.14-16, где реакцию Шоттена-Баумана осуществляют при температуре между -10 и +10шC.
18. Способ по п.13, где на стадии (ii) циклизацию осуществляют в присутствии основания при повышенной температуре.
19. Способ по п.18, где основание является гидроксидом щелочного металла.
20. Способ по п.19, где гидроксид щелочного металла является гидроксидом натрия.
21. Способ по любому из пп.18-20, где реакцию осуществляют при кипячении.
22. Способ по п.13, где на стадии (iii) гидрирование осуществляют путем каталитического гидрирования с использованием водорода в органическом растворителе и в присутствии катализатора на основе благородного металла на носителе.
23. Способ по п.22, где органический растворитель является спиртом.
24. Способ по п.23, где спирт является метанолом.
25. Способ по любому из пп.22-24, где катализатором на основе благородного металла является палладий или платина или их оксиды.
26. Способ по любому из пп.22-25, где носителем является древесный уголь.
27. Способ по любому из пп.22-26, где реакцию осуществляют при комнатной температуре и давлении.
28. Способ по п.13, где на стадии (iii) гидрирование осуществляют путем гидрирования с переносом в органическом растворителе с использованием катализатора гидрирования в присутствии донора водорода.
29. Способ по п.28, где органический растворитель является спиртом.
30. Способ по п.29, где спирт является метанолом.
31. Способ по любому из пп.28-30, где катализатор гидрирования является палладием на древесном угле.
32. Способ по любому из пп.28-31, где донор водорода выбирают из гипофосфита натрия, формиата триэтиламмония, формиата калия, формиата аммония и циклогексена.
33. Способ по п.32, где донором водорода является формиат аммония в воде.
34. Способ по любому из пп.28-33, где гидрирование с переносом осуществляют при повышенной температуре.
35. Способ по п.34, где реакцию осуществляют при температуре между 50 и 70шC.
36. Способ по п.13, где на стадии (iv) хлорирующий агент является хлорангидридом неорганической кислоты.
37. Способ по п.36, где хлорангидрид неорганической кислоты выбирают из SOCl2, PCl5, PCl3 и POCl3.
38. Способ по п.36 или 37, где реакцию предпочтительно осуществляют в органическом растворителе.
39. Способ по п.38, где органический растворитель является ацетонитрилом.
40. Способ по любому из пп.36-39, где реакцию осуществляют при комнатной температуре и давлении.
Текст
1 Данное изобретение относится к способу получения морфолиновых производных и, в частности, к соединению 2-(R)-(1-(R)-(3,5-бисWO 95/16679 (опубликованной 22 июня 1995 г.),являются сильнодействующими и селективными антагонистами рецепторов вещества Р (или нейрокинина-1). где R2 и R3 независимо выбирают из группы,состоящей изR6, R7 и R8 независимо выбирают из группы, состоящей изR11, R12 и R13 независимо выбирают из группы, состоящей изZ представляет C1-4-алкил. В частности, как было показано, соединение 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил) этокси)-3-(S)-(4-фторфенил)-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолин обладает потенциалом при лечении рвоты, депрессии и состояния тревоги. Антагонисты вещества Р исследуются также в отношении других нейропсихиатрических заболеваний, включая биполярное нарушение и шизофрению, а также постгерпетическую невралгию и боль. В международном патентном описанииWO 95/16679 описано получение 2-(R)-(1-(R)(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4 фторфенил)-4-(3-(5-оксо-1 Н,4 Н-1,2,4-триазоло) метил)морфолина (далее называемое как соединение А), который имеет структуру двухстадийным способом, исходя из 2-(R)-(1(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)(4-фторфенил)морфолина. Со ссылкой на примеры 70 и 75 в WO 95/16679, соединение А получают следующим образом: Этот способ предшествующего уровня техники и, в частности, необходимость наличия в нем стадии высокотемпературной циклизации представляет ряд практических трудностей, которые делают его непригодным при иных попытках применения в относительно малом масштабе. Следовательно, существует необходимость в разработке способа, который легко может изменяться при увеличении масштаба и,следовательно, может практически применяться при промышленном производстве. Настоящее изобретение, соответственно,обеспечивает подходящий, эффективный способ, в котором используется одностадийное алкилирование 3-хлорметил-1,2,4-триазолин-5 оном при температуре окружающей среды, что дает соединения формулы (I), и в частности соединение А, с более высоким выходом, чем при двухстадийном синтезе уровня техники, и в котором исключается высокотемпературная циклизация. Новый способ данного изобретения является не только энергетически более эффективным (так как не требуется нагревания), но он также является более продуктивным, обеспечивая тем самым более короткий по времени цикл при большом масштабе и более высокие рабочие концентрации. Возможность осуществлять способ данного изобретения в одном реакционном сосуде, в котором требуемый продукт кристаллизуется из реакционной смеси при темпе 3 ратуре окружающей среды, является явным преимуществом по сравнению с синтезом уровня техники. Таким образом, в первом аспекте данного изобретения предлагается способ получения соединения формулы (I) где R2 и R3 независимо выбирают из группы, состоящей изR6, R7 и R8 независимо выбирают из группы, состоящей изR11, R12 и R13 независимо выбирают из группы, состоящей изZ представляет C1-4-алкил,включающий (i) взаимодействия соединения формулы (II) где LG представляет уходящую группу,выбранную из галогена (например, брома, хлора или иода) или алкил- или арилсульфонатной группы (например, мезилатной или тозилатной), 003468(ii) сбор полученного кристаллического соединения формулы (I). В особенно предпочтительном аспекте данного изобретения предлагается способ получения соединения 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фторфенил)-4-(3(5-оксо-1H,4 Н-1,2,4-триазоло)метил)морфолина,включающий:(трифторметил)фенил)этокси)-3-(S)-(4-фторфенил)морфолина или его соли с соединением формулы (III)(ii) сбор полученного кристаллического 2(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фторфенил)-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина. В соединениях формул (I) и (II), предпочтительно R2 и R3 оба независимо представляют собой водород. В соединениях формул (I) и (II), предпочтительно R6 и R7 независимо выбираются из фтора и -СF3. В частности, R6 и R7 оба независимо представляют собой -СF3. В соединениях формул (I) и (II), R8 предпочтительно является водородом. В соединениях формул (I) и (II), R11 предпочтительно представляет собой водород или фтор. В соединениях формул (I) и (II), R12 и R13 предпочтительно оба независимо представляют собой водород. В соединениях формул (I) и (II), Z предпочтительно представляет собой -СН 3. В соединении формулы (III) уходящая группа LG предпочтительно является хлором. Подходящие для использования в вышеприведенной реакции основания включают органические основания или, более предпочтительно, неорганические основания. Подходящие органические основания включают диизопропилэтиламин или триэтиламин. Подходящие неорганические основания включают гидрид натрия или карбонат калия. Подходящие для использования в вышеприведенной реакции органические растворители включают диметилформамид (особенно, когда используется неорганическое основание) и ацетонитрил (особенно, когда используется органическое основание). Наиболее предпочтительно, вышеприведенную реакцию осуществляют в диметилформамиде в присутствии карбоната калия. 5 Обычно, вышеприведенную реакцию осуществляют при комнатной температуре. Обычно, соединение формулы (II) и, в частности 2-(R)-(1-(R)-(3,5-бис(трифторметил) фенил)этокси)-3-(S)-(4-фторфенил)морфолин,используемое на стадии (i) вышеприведенной реакции находится в форме его свободного основания. Предпочтительно, соединение формулы (II) и, в частности, 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фторфенил)морфолин, используемое на стадии (i) вышеприведенной реакции, находится в форме его соли с (R)-камфорсульфоновой кислотой. Более предпочтительно, соединение формулы (II) и, в частности, 2-(R)-(1-(R)-(3,5-бис(трифторметил) фенил)этокси)-3-(S)-(4-фторфенил)морфолин,используемое на стадии (i) вышеприведенной реакции, находится в форме его соли с паратолуолсульфоновой кислотой. По дополнительному или альтернативному аспекту данного изобретения предлагается способ получения 3-хлорметил-1,2,4-триазолин-5 она, который включает:(i) обработку гидрохлорида семикарбазида бензилоксиацетилхлоридом в условиях Шоттена-Баумана с получением бензилоксиацетилсемикарбазида;(ii) циклизацию продукта со стадии (i) в щелочных условиях с получением 3-бензилоксиметил-1,2,4-триазолин-5-она;(iii) гидрирование продукта со стадии (ii) с получением 3-гидроксиметил-1,2,4-триазолин-5 она и(iv) обработку продукта со стадии (iii) хлорирующим агентом с получением 3-хлорметил 1,2,4-триазолин-5-она. В соответствии с еще одним дополнительным или альтернативным аспектом данного изобретения предлагается способ получения 3 гидроксиметил-1,2,4-триазол-5-она, включающий стадии (i)-(iii), как описано выше. На стадии (i) выше, условия ШоттенаБаумана предпочтительно включают использование водной щелочи в подходящем растворителе, таком как простой эфир, например тетрагидрофуран, при пониженной температуре, например, между -10 и +10 С, предпочтительно,0 С. Особенно подходящей водной щелочью является водный гидроксид натрия. На стадии (ii) выше, циклизацию предпочтительно осуществляют в присутствии основания, такого как гидроксид щелочного металла,например, гидроксид натрия, при повышенной температуре, обычно при температуре образования флегмы. На стадии (iii) выше, гидрирование может быть осуществлено каталитическим гидрированием с использованием водорода в подходящем органическом растворителе, таком как спирт,например, метанол, в присутствии катализатора на основе благородного металла, такого как палладий или платина, или их оксид, на носите 003468 6 ле, таком как древесный уголь, и обычно при комнатной температуре и давлении. Более предпочтительно, гидрирование осуществляют гидрированием с переносом в подходящем органическом растворителе, таком как спирт, например метанол, с использованием катализатора гидрирования, в частности, палладия на древесном угле, в присутствии донора водорода, такого как гипофосфит натрия, формиат триэтиламмония, формиат калия, формиат аммония или циклогексен. Особенно предпочтителен формиат аммония в воде. Гидрирование с переносом предпочтительно осуществляют при повышенной температуре, например, между 50 и 70 С и предпочтительно между 55 и 60 С. На стадии (iv) выше, хлорирующий агент представляет, например, хлорангидрид неорганической кислоты, такой как SOCl2, PCl5, РСl3 и(SOCl2). Реакцию предпочтительно осуществляют в органическом растворителе, таком как ацетонитрил, обычно при комнатной температуре и давлении. Следующие неограничивающие примеры иллюстрируют способы данного изобретения. Пример 1. Получение 2-(R)-(1-(R)-(3,5 бис(трифторметил)фенил)этокси)-3-(S)-(4-фторфенил)-4-(3-(5-оксо-1 Н,4 Н-1,2,4-триазоло)метил)морфолина. Раствор 3-хлорметил-1,2,4-триазолин-5 она (3,18 г) в ДМФ (30 мл) добавляют в течение 1 ч к суспензии соли 2-(R)-(1-(R)-(3,5-бис(100 мл) при 22 С. Реакционную смесь выдерживают при 22 С в течение 20 мин, затем добавляют воду (400 мл) в течение 30 мин. Кристаллизующуюся смесь охлаждают на ледяной бане, выдерживают в течение 30 мин и продукт собирают фильтрованием. Твердое целевое вещество соединение промывают водой (400 мл),сушат на воздухе и сушат в вакууме при 4550 С. Выход = 11,4 г; 98,1 вес.%, анализ ВЭЖХ; 93,2% выход по анализу: (97,1 А% профиль по ВЭЖХ). Пример 2. Стадии (i) и (ii). Получение 3 бензилоксиметил-1,2,4-триазолин-5-она. Гранулы гидроксида натрия (10,83 г) добавляют к холодному (0 С), энергично перемешиваемому раствору гидрохлорида семикарбазида (15,1 г) в воде (10 мл)/ТГФ (50 мл) в атмосфере азота. В течение пяти минут добавляют раствор бензилоксиацетилхлорида (25 г) в ТГФ(100 мл) и смесь выдерживают при 0 С в течение 2 ч (реакция завершается по ВЭЖХ). ТГФ удаляют при пониженном давлении,добавляют 2 М раствор гидроксида натрия (60 мл), и раствор нагревают до температуры образования флегмы в течение 5 ч. Реакционную смесь охлаждают до комнатной температуры и оставляют стоять на 18 ч. Раствор нейтрализуют 7 6 М соляной кислотой, и суспензию охлаждают на ледяной бане в течение 1 ч. Продукт, собирают фильтрованием, промывают холодной водой (10 мл) и сушат в вакууме. Получают 3 бензилоксиметил-1,2,4-триазолин-5-он (16,7 г) с 60% выходом в виде белого кристаллического твердого вещества. Т.пл.190-192 С; 1(31 г) и 10% палладий на древесном угле (3,1 г) суспендируют в метаноле (200 мл) в атмосфере азота. Добавляют раствор формиата аммония(47,7 г) в воде (20 мл), и смесь энергично перемешивают и нагревают до 55-60 С. Через 2 ч добавляют 10% палладий на древесном угле (3,1 г) и через 3 ч загружают катализатор (1,55 г) и формиат аммония (9,5 г) в воде (4 мл). Через 4 ч реакционную смесь охлаждают до комнатной температуры и оставляют стоять на ночь. Метанольный раствор выпаривают при пониженном давлении до небольшого объема и промывают непрерывным добавлением метанола (3 л) при 50-55 С для удаления избытка формиата аммония. Горячую смесь фильтруют через solka sloc(15 г), фильтрат концентрируют до небольшого объема и растворитель заменяют на ацетонитрил (2 х 400 мл). Суспензию концентрируют до примерно 100 мл, продукт собирают фильтрованием и затем сушат в вакууме. Получают 3 гидроксиметил-1,2,4-триазолин-5-он (17,1 г) в 98,3% выходом. Т.пл. 187-189 С (лит. = 187 С); 1(NHCONH) м.д.; масс-спектроскопия М+Н=116,M+NH4=133. Пример 3. Получение 3-хлорметил-1,2,4 триазолин-5-она. Тионилхлорид (19,9 г) добавляют в течение пяти минут к суспензии 3-гидроксиметил 1,2,4-триазолин-5-она (17 г) в ацетонитриле (170 мл) при 20 С в атмосфере азота. Реакционную смесь выдерживают в течение 18 ч при 20 С.[Примечание: через 30 мин весь исходный материал растворяется. Через 1 ч продукт начинает кристаллизоваться]. Анализ ТСХ (SiO2; этилацетат/метанол (9/1); I2) показывает, что реакция завершена. Одной порцией добавляют гексан(510 мл), реакционную смесь охлаждают на ледяной бане в течение 1 ч, и продукт собирают фильтрованием. Твердое вещество промывают гексаном (100 мл) и сушат в вакууме. 3 Хлорметил-1,2,4-триазолин-5-он (17,2 г) полу 003468 8 чают в виде белого твердого вещества с 87,4% выходом. Т.пл. 197-199 С; 1(трифторметил)фенил)этокси)-3-(S)-(4-фторфенил)морфолина и пара-толуолсульфоновой кислоты (12 г) и N,N-диизопропилэтиламина (5,15 г) в ДМФ (40 мл) при 21 С. Реакционную смесь выдерживают при 21-23 С в течение 30 мин,затем добавляют воду (120 мл) в течение 20 мин. Кристаллизующуюся смесь охлаждают на ледяной бане, выдерживают в течение 30 мин и продукт собирают фильтрованием. Твердое целевое соединение промывают водой (96 мл),сушат на воздухе и сушат в вакууме при 50 С. Выход = 96,5 г; 99,7% выход при выделении.(2) Альтернативный способ с использованием карбоната калия/ДМФ. Раствор 3-хлорметил-1,2,4-триазолин-5 она (1,40 г) в ДМФ (13,5 мл) добавляют в течение 1 ч к суспензии соли 2-(R)-(1-(R)-(3,5 бис(трифторметил)фенил)этокси)-3-(S)-(4-фторфенил)морфолина и пара-толуолсульфоновой кислоты (6,77 г) и карбоната калия (1,55 г) в ДМФ (27 мл) при 19 С. Реакционную смесь выдерживают при 19-21 С в течение 30 мин, затем добавляют воду (81 мл) в течение 20 мин. Кристаллизующуюся смесь охлаждают на ледяной бане, выдерживают в течение 30 мин и продукт собирают фильтрованием. Твердое целевое соединение промывают водой (54 мл), сушат на воздухе и сушат в вакууме при 50 С. Выход = 5,37 г; 98,0% количественное определение ВЭЖХ по весу; 96,4% выход по анализу. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы где R2 и R3 независимо выбирают из группы, состоящей изR6, R7 и R8 независимо выбирают из группы, состоящей изR11, R12 и R13 независимо выбирают из группы, состоящей из где LG представляет уходящую группу,выбранную из галогена (например, брома, хлора или иода) или алкил- или арилсульфонатной группы (например, мезилатной или тозилатной),в органическом растворителе и в присутствии основания; и(ii) сбор полученного кристаллического соединения формулы (I). 2. Способ получения соединения 2-(R)-(1(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)(4-фторфенил)-4-(3-(5-оксо-1 Н,4 Н-1,2,4 триазоло)метил)морфолина, включающий(i) взаимодействие 2-(R)-(1-(R)-(3,5 бис(трифторметил)фенил)этокси)-3-(S)-(4 фторфенил)морфолина или его соли с соединением формулы (III)(ii) сбор полученного кристаллического 2(R)-(1-(R)-(3,5 бис(трифторметил)фенил)этокси)-3-(S)-(4 фторфенил)-4-(3-(5-оксо-1 Н,4 Н-1,2,4 триазоло)метил)морфолина. 3. Способ по п.1 или 2, где уходящая группа LG представляет собой хлор. 4. Способ по п.1 или 2, где основание является органическим основанием. 5. Способ по п.4, где органическое основание выбирают из диизопропилэтиламина или триэтиламина. 6. Способ по п.1 или 2, где основание является неорганическим основанием. 7. Способ по п.6, где неорганическое основание выбирают из гидрида натрия или карбоната калия. 8. Способ по любому из пп.1-5, где органический растворитель является ацетонитрилом. 9. Способ по любому из пп.1-3, 6 или 7, где органический растворитель является диметилформамидом. 10. Способ по п.1 или 2, где стадию (i) осуществляют в диметилформамиде в присутствии карбоната калия. 11. Способ по любому из пп.1-10, где реакцию осуществляют при комнатной температуре. 12. Способ по любому из пп.2-11, где 2(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фторфенил)морфолин, используемый на стадии (i), находится в форме его свободного основания, или его соли с (R)-камфорсульфоновой кислотой, или его соли с паратолуолсульфоновой кислотой. 13. Способ получения 3-хлорметил-1,2,4 триазолин-5-она, включающий(i) обработку гидрохлорида семикарбазида бензилоксиацетилхлоридом в условиях реакции Шоттена-Баумана с получением бензилоксиацетилсемикарбазида,(ii) циклизацию продукта со стадии (i) в щелочных условиях с получением 3 бензилоксиметил-1,2,4-триазолин-5-она,(iii) гидрирование продукта со стадии (ii) с получением 3-гидроксиметил-1,2,4-триазолин-5 она и(iv) обработку продукта со стадии (iii) хлорирующим агентом с получением 3-хлорметил 1,2,4-триазолин-5-она. 14. Способ по п.13, где на стадии (i) условия реакции Шоттена-Баумана включают использование водной щелочи в простом эфире при пониженной температуре. 15. Способ по п.14, где водная щелочь является водным гидроксидом натрия. 16. Способ по п.14 или 15, где простой эфир представляет собой тетрагидрофуран. 17. Способ по любому из пп.14-16, где реакцию Шоттена-Баумана осуществляют при температуре между -10 и +10 С. 18. Способ по п.13, где на стадии (ii) циклизацию осуществляют в присутствии основания при повышенной температуре. 19. Способ по п.18, где основание является гидроксидом щелочного металла. 20. Способ по п.19, где гидроксид щелочного металла является гидроксидом натрия. 21. Способ по любому из пп.18-20, где реакцию осуществляют при кипячении. 22. Способ по п.13, где на стадии (iii) гидрирование осуществляют путем каталитического гидрирования с использованием водорода в органическом растворителе и в присутствии катализатора на основе благородного металла на носителе. 23. Способ по п.22, где органический растворитель является спиртом. 24. Способ по п.23, где спирт является метанолом. 25. Способ по любому из пп.22-24, где катализатором на основе благородного металла является палладий или платина или их оксиды. 26. Способ по любому из пп.22-25, где носителем является древесный уголь. 27. Способ по любому из пп.22-26, где реакцию осуществляют при комнатной температуре и давлении. 28. Способ по п.13, где на стадии (iii) гидрирование осуществляют путем гидрирования с переносом в органическом растворителе с использованием катализатора гидрирования в присутствии донора водорода. 12 29. Способ по п.28, где органический растворитель является спиртом. 30. Способ по п.29, где спирт является метанолом. 31. Способ по любому из пп.28-30, где катализатор гидрирования является палладием на древесном угле. 32. Способ по любому из пп.28-31, где донор водорода выбирают из гипофосфита натрия,формиата триэтиламмония, формиата калия,формиата аммония и циклогексена. 33. Способ по п.32, где донором водорода является формиат аммония в воде. 34. Способ по любому из пп.28-33, где гидрирование с переносом осуществляют при повышенной температуре. 35. Способ по п.34, где реакцию осуществляют при температуре между 50 и 70 С. 36. Способ по п.13, где на стадии (iv) хлорирующий агент является хлорангидридом неорганической кислоты. 37. Способ по п.36, где хлорангидрид неорганической кислоты выбирают из SOCl2, PCl5,РСl3 и РОСl3. 38. Способ по п.36 или 37, где реакцию предпочтительно осуществляют в органическом растворителе. 39. Способ по п.38, где органический растворитель является ацетонитрилом. 40. Способ по любому из пп.36-39, где реакцию осуществляют при комнатной температуре и давлении.
МПК / Метки
МПК: C07D 413/06
Метки: способ, морфолина, производных, получения
Код ссылки
<a href="https://eas.patents.su/7-3468-sposob-polucheniya-proizvodnyh-morfolina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения производных морфолина</a>
Предыдущий патент: Водный глифозатный концентрат и способ повреждения или уничтожения нежелательных растений
Следующий патент: Новые лекарственные комбинации ингибиторов повторного поглощения норадреналина (иппна), предпочтительно ребоксетина и пиндолола
Случайный патент: Способ получения циклогексанона и циклогексанола











