Стабильная полиморфная форма кристаллического моногидрата цитрата (2s,3s)-n-(2-метокси-5-трет-бутилфенил)метил-2-дифенилметил-1-азабицикло[2.2.2]октан-3-амина и фармацевтическая композиция на её основе
Номер патента: 3731
Опубликовано: 28.08.2003
Авторы: Уинт Льюин Теофилус, Касталди Майкл Джеймс, Куоллич Джордж Джозеф
Формула / Реферат
1. Стабильная полиморфная форма A кристаллического моногидрата цитрата (2S,3S)-N-(2-метокси-5-трет-бутилфенил)метил-2-дифенилметил-1-азабицикло[2.2.2]октан-3-амина формулы
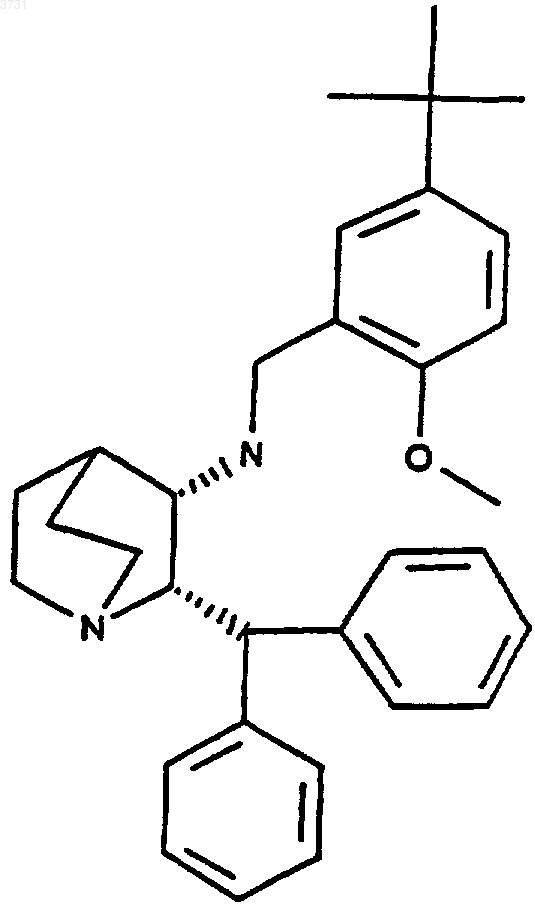
характеризующаяся следующей картиной порошковой дифракции рентгеновских лучей:
| Пик ь | Расстояние d |
| 1 | 13,28 |
| 2 | 7,70 |
| 3 | 7,45 |
| 4 | 6,34 |
| 5 | 5,33 |
| 6 | 5,06 |
| 7 | 4,40 |
2. Полиморфная форма моногидрата цитрата по п.1, где габитусы ее кристалла представляют собой пластинки.
3. Полиморфная форма моногидрата цитрата по п.1, где моногидрат цитрата является негигроскопичным.
4. Полиморфная форма моногидрата цитрата по п.1, где потеря воды происходит приблизительно при 116шC.
5. Полиморфная модификация моногидрата цитрата по п.1, где начало плавления происходит приблизительно при 152,7шC.
6. Фармацевтическая композиция, обладающая активностью активного антагониста рецепторов нейрокинина 1 (NK1) центральной нервной системы (ЦНС), содержащая полиморфную форму по п.1 в количестве, которое эффективно в лечении рвоты, и фармацевтически приемлемый носитель.
7. Способ лечения рвоты, при котором субъекту, нуждающемуся в лечении, вводят эффективное противорвотное количество полиморфной формы A соединения по п.1.
8. Способ получения кристаллической полиморфной формы соли моногидрата цитрата (2S,3S)-N-(2-метокси-5-трет-бутилфенил)метил-2-дифенилметил-1-азабицикло[2.2.2]октан-3-амина, при котором добавляют лимонную кислоту к раствору свободного основания в ацетоне; растворяют твердое вещество в течение приблизительно 2 ч; фильтруют и перемешивают прозрачный раствор в течение ночи; добавляют фильтрованный изопропиловый эфир с последующим добавлением фильтрованной воды; перемешивают полученную смесь при температуре окружающей среды до тех пор, пока не начнется кристаллизация, и гранулируют в течение приблизительно 16 ч и собирают образовавшуюся белую кристаллическую соль посредством фильтрации и сушат приблизительно при 45шC в вакууме с продувкой азотом в течение приблизительно 24 ч.
9. Способ по п.8, при котором суспендирование проводят в условиях окружающей среды в течение приблизительно от 1,5- до 72-часового периода гранулирования в изопропиловом эфире, изопропиловом спирте и воде.
10. Способ по п.8, где содержание воды в лимонной кислоте составляет менее 0,5%.
Текст
1 Предпосылки изобретения Это изобретение относится к соли моногидрату безводного цитрата (2S,3S)-N-(2-метокси-5 трет-бутилфенил)метил-2-дифенилметил-1-азабицикло[2.2.2]октан-3-амина, его единственной кристаллической полиморфной форме А и фармацевтической композиции, содержащей их. Это изобретение также относится к активному антагонисту рецепторов нейрокинина 1 (NK1) центральной нервной системы (ЦНС) для лечения рвоты у млекопитающего, включая людей. Лечение определено здесь как предупреждение и лечение. В патенте США 5393762 и заявке в США с порядковым номером 08/816016, которые включены путем ссылки, описаны фармацевтические композиции и лечение рвоты с использованием антагонистов рецепторов NK1. Моногидрат цитрата имеет значительно повышенную стабильность по сравнению с другими солевыми формами, такими как бензоат, который нестабилен даже при 5 С. Форма мезилат расплывается в поглощенной из воздуха влаге. Краткое изложение сущности изобретения Настоящее изобретение относится к моногидрату цитрата (2S,3S)-N-(метокси-5-третбутилфенил)метил-2-дифенилметил-1-азабицикло[2.2.2]октан-3-амина. В одном воплощении данного изобретения моногидрат цитрата является кристаллической стабильной негигроскопичной единственной формой. Габитусы кристалла представляют собой пластинки и характеризуются картиной дифракции рентгеновских лучей на порошке, приведенной ниже. Моногидрат цитрата Пик 1 2 3 4 5 6 7 Расстояние d 13,28 7,70 7,45 6,34 5,33 5,06 4,40 Кристаллическая соль моногидрат цитрата является негигроскопичной и характеризуется потерей воды (испарением) приблизительно при 116 С и началом плавления приблизительно при 152,7 С. Безводный цитрат превратили в моногидрат в воде. Фармацевтическая композиция, обладающая активностью активного антагониста рецепторов NK1 ЦНС, содержит полиморфную форму А в количестве, которое эффективно в лечении рвоты, и фармацевтически приемлемый носитель. Способ лечения рвоты, при котором субъекту, нуждающемуся в лечении, вводят такое количество полиморфной формы соединения, которое эффективно при рвоте. 2 Способ получения полиморфной формы А моногидрата цитрата (2S,3S)-N-(метокси-5-третбутилфенил)метил-2-дифенилметил-1-азабицикло[2.2.2]октан-3-амина включает в себя добавление лимонной кислоты к раствору свободного основания в ацетоне. Твердое вещество растворяют в течение приблизительно двух часов. Прозрачный раствор фильтруют и перемешивают в течение ночи. Фильтрованный изопропиловый эфир добавляют с последующим добавлением фильтрованной воды. Полученную смесь перемешивают при температуре окружающей среды до тех пор, пока не начнется кристаллизация, и гранулируют в течение приблизительно 16 ч. Белую кристаллическую форму собирают посредством фильтрации и сушат приблизительно при 45 С в вакууме с продувкой азотом в течение приблизительно 24 ч. Подробное описание изобретения Способ получения кристаллического моногидрата цитрата, полиморфной формы А,включает в себя добавление 353,9 г, 1,1 эквивалента, лимонной кислоты (безводной, 99,5+%) к раствору свободного основания, 785 г в ацетоне,7,85 л. После растворения твердого вещества в течение приблизительно 2 ч, прозрачный раствор фильтровали, перемешивали в течение ночи и добавили 7,85 л фильтрованного изопропилового эфира с последующим добавлением 334 мл фильтрованной воды. Полученную смесь перемешивали при температуре окружающей среды до тех пор, пока не началась кристаллизация, и гранулировали в течение дополнительных 16 ч. Образовавшуюся белую кристаллическую соль собирали посредством фильтрации и сушили при 45 С в вакууме с продувкой азотом в течение 24 ч с получением 992 г (выход 89,9%). Полученную соль моногидрат цитрата,полиморфную форму, характеризовали посредством поляризующей световой микроскопии,дифракции рентгеновских лучей на порошке,протонного магнитного резонанса, анализа по Карлу Фишеру, дифференциальной сканирующей калориметрии (ДСК) и элементарного анализа. По результатам дифракции рентгеновских лучей на порошке и поляризующей световой микроскопии установили, что она является кристаллической. Встречающийся габитус кристалла представлял собой пластинки. Наиболее интенсивные отражения, расстояния d, наблюдаемые посредством дифракции рентгеновских лучей на порошке, составили 13,280, 7,702,7,446, 6,337, 5,332, 5,057 и 4,398 . Кристаллы показали потерю воды (испарение) при 116 С и начало плавления при 152,7 С с разложением. Измерения гигроскопичности показали, что было абсорбировано 2,52 мас.% воды при относительной влажности 90%. Анализ по Карлу Фишеру показал присутствие 2,7% воды (2,66% теоретически), свидетельствуя о том, что синтезирован моногидрат. Элементарный анализ подтвердил чистоту синтезированной соли. Суспендирование безводного цитрата в воде приводит к получению кристаллического моногидрата, который не теряет воду в условиях сушки, например, при 45 С в вакууме. Эффективная дозировка моногидрата цитрата для фармацевтической композиции зависит от предполагаемого пути введения, индикатора,показания для лечения и других факторов, таких как возраст и масса субъекта. При следующих интервалах дозировки, термин "мг А" относится к миллиграммам моногидрата. Рекомендуемый интервал для перорального введения составляет 5-300 мг А/сутки, предпочтительно 40-200 мг А/сутки, более предпочтительно 40-80 мг А/сутки, в разовых или разделенных дозах. Рекомендуемый интервал для перорального введения в пероральных формах, таких как пилюли или таблетки, составляет от 2,5 мг А/сутки до 160 мг А/сутки и предпочтительно 5-80 мг А/сутки. Его также можно вводить внутривенно. Следующие примеры иллюстрируют способы и соединения по настоящему изобретению. Понятно, что изобретение не ограничено этими конкретными примерами. Пример 1. Получение кристаллического моногидрата цитрата. Порцию 47 г свободного основания суспендировали в 470 мл изопропилового эфира в условиях окружающей среды. К полученной тонкой белой суспензии при комнатной температуре добавили 21,42 г безводной лимонной кислоты. Эту суспензию затем использовали для превращения в моногидрат путем суспендирования в 150 мл воды в течение 18 ч. Суспензию фильтровали с получением белого кристаллического твердого вещества. По результатам рентгенографического анализа конфигурации установили, что соединение является моногидратом цитрата. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Стабильная полиморфная форма А кристаллического моногидрата цитрата (2S,3S)-N-(2 метокси-5-трет-бутилфенил)метил-2-дифенилметил-1-азабицикло[2.2.2]октан-3-амина формулы характеризующаяся следующей картиной порошковой дифракции рентгеновских лучей: 7 4,40 2. Полиморфная форма моногидрата цитрата по п.1, где габитусы ее кристалла представляют собой пластинки. 3. Полиморфная форма моногидрата цитрата по п.1, где моногидрат цитрата является негигроскопичным. 4. Полиморфная форма моногидрата цитрата по п.1, где потеря воды происходит приблизительно при 116 С. 5. Полиморфная модификация моногидрата цитрата по п.1, где начало плавления происходит приблизительно при 152,7 С. 6. Фармацевтическая композиция, обладающая активностью активного антагониста рецепторов нейрокинина 1 (NK1) центральной нервной системы (ЦНС), содержащая полиморфную форму по п.1 в количестве, которое эффективно в лечении рвоты, и фармацевтически приемлемый носитель. 7. Способ лечения рвоты, при котором субъекту, нуждающемуся в лечении, вводят эффективное противорвотное количество полиморфной формы А соединения по п.1. 8. Способ получения кристаллической полиморфной формы соли моногидрата цитрата(2S,3S)-N-(2-метокси-5-трет-бутилфенил)метил 2-дифенилметил-1-азабицикло[2.2.2]октан-3 амина, при котором добавляют лимонную кислоту к раствору свободного основания в ацетоне; растворяют твердое вещество в течение приблизительно 2 ч; фильтруют и перемешивают прозрачный раствор в течение ночи; добавляют фильтрованный изопропиловый эфир с последующим добавлением фильтрованной воды; перемешивают полученную смесь при температуре окружающей среды до тех пор, пока не начнется кристаллизация, и гранулируют в течение приблизительно 16 ч и собирают образовавшуюся белую кристаллическую соль посредством фильтрации и сушат приблизительно при 45 С в вакууме с продувкой азотом в течение приблизительно 24 ч. 9. Способ по п.8, при котором суспендирование проводят в условиях окружающей среды в течение приблизительно от 1,5- до 72-часового периода гранулирования в изопропиловом эфире, изопропиловом спирте и воде. 10. Способ по п.8, где содержание воды в лимонной кислоте составляет менее 0,5%.
МПК / Метки
МПК: A61K 31/439, A61P 1/08, C07D 453/02
Метки: форма, фармацевтическая, моногидрата, стабильная, 2s,3s)-n-(2-метокси-5-трет-бутилфенил)метил-2-дифенилметил-1-азабицикло[2.2.2]октан-3-амина, основе, полиморфная, композиция, кристаллического, цитрата
Код ссылки
<a href="https://eas.patents.su/3-3731-stabilnaya-polimorfnaya-forma-kristallicheskogo-monogidrata-citrata-2s3s-n-2-metoksi-5-tret-butilfenilmetil-2-difenilmetil-1-azabiciklo222oktan-3-amina-i-farmacevticheskaya-kompozi.html" rel="bookmark" title="База патентов Евразийского Союза">Стабильная полиморфная форма кристаллического моногидрата цитрата (2s,3s)-n-(2-метокси-5-трет-бутилфенил)метил-2-дифенилметил-1-азабицикло[2.2.2]октан-3-амина и фармацевтическая композиция на её основе</a>
Предыдущий патент: Способ производства гранул вспученной глины и гранулы, полученные этим способом
Следующий патент: Фармацевтические композиции, содержащие микронизированные бициклические лекарственные средства
Случайный патент: Способ инактивации семян бобовых культур и устройство для его осуществления







