Способ получения калиевой соли лосартана
Формула / Реферат
1. Способ получения лекарственного средства формулы III
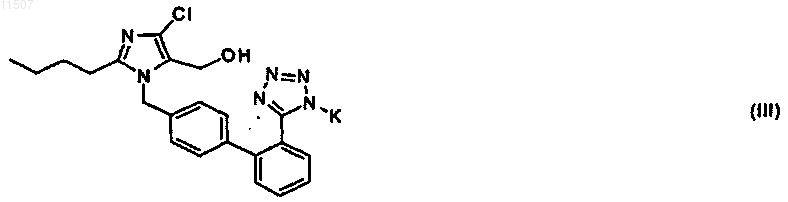
при котором проводят сольволиз соединения формулы IV

в безводном метаноле в нейтральной или слабощелочной среде и реакцию с эквивалентом вещества формулы MnB, где M представляет собой калий и n принимает значения 1 или 2, а B представляет собой CO32- или HCO3-.
2. Способ по п.1, при котором сольволиз проводят в слабощелочной среде, при этом карбонат или гидрокарбонат калия добавляют в начале реакции.
3. Способ по п.1 или 2, при котором продукт кристаллизуют из смеси спирта, предпочтительно изопропанола, и антирастворителя, в котором соединение формулы III нерастворимо, или с использованием другого растворителя, например ацетона.
Текст
011507 Область техники Изобретение относится к способу получения лекарственного средства формулы III при котором проводят сольволиз соединения формулы IV в безводном метаноле в нейтральной или слабощелочной среде и реакцию с эквивалентом вещества формулы MnB, где М представляет собой калий и n принимает значения 1 или 2, а В представляет собой СО 32- или НСО 3-. Предшествующий уровень техники Калиевую соль лосартана формулы III получают согласно опубликованным способам (WO 95/17396, ЕР 253310, US 5859258; J. Med.Chem. 1991, 34, 2525; J. Org. Chem. 1994, 59, 6391) несколькими методами, в которых используют тритил-лосартан формулы IV в качестве основного промежуточного соединения Согласно первым патентам тритил-лосартан формулы IV превращают путем кислотного гидролиза в 2-бутил-4-хлор-1-(2'-тетразол-5-ил)-1,1'-бифенил-4-ил]метил]-5-гидроксиметил-имидазол формулы V,далее лосартан в форме кислоты который выделяют, а затем превращают с помощью гидроксида калия в калиевую соль лосартана формулы III. При удалении тритильной защитной группы обычно используют сильно коррозионные кислоты. Необходимость выделения свободной кислоты лосартана и сложное удаление избытка минеральных кислот из продукта являются недостатками данного способа. Свободную кислоту, полученную таким образом, затем превращают с помощью водного гидроксида калия в калиевую соль, которую затем согласно вышеупомянутым патентам растворяют в изопропаноле, и продукт после азеотропной дистилляции кристаллизуют с циклогексаном. При этом особенно длительная азеотропная дистилляция является недостатком. На основании более недавних патентных заявок (WO 01/61336; WO 02/094816) тритильная защитная группа может быть также удалена под действием сильнощелочного гидроксида калия в первичных спиртах. Калиевая соль лосартана формулы III может быть получена этим способом, и последующую кристаллизацию проводят, добавляя растворитель, в котором калиевая соль лосартана нерастворима. Однако во время указанного щелочного детритилирования сильным основанием образуются некоторые не-1 011507 значительные примеси, и их трудно удалить из продукта. Кроме вышеупомянутых способов детритилирования для некоторых веществ сартанового типа также описано детритилирование, катализируемое безводными кислотами в безводных спиртах, предпочтительно в метаноле (US 5763619). Согласно указанному патенту преимущество этого способа состоит в том, что не происходит расщепления других гидролизуемых функциональных групп. В патенте US 5763619 данный способ не используют для детритилирования какого-либо промежуточного соединения, полезного для получения лосартана или, например, ирбесартана или вальсартана. По крайней мере в случае вальсартана, вероятно, будет происходить частичная переэтерификация и, возможно, частичное расщепление остатка валероила. Подобным образом, расщепление кольца дигидроимидазолона может также ожидаться в случае ирбесартана. Другими недостатками представляются непостоянство выходов (в примерах они меняются от 42 до 92%), коррозионная активность реакционной среды и необходимость применения воды при удалении избытка используемой кислоты, что частично исключает преимущества реакции в безводной среде. Кроме того, в случае лекарственных средств, применяемых в форме щелочных солей (например, лосартан), необходимо затем превращать выделенную кислоту в соответствующую соль. В свете того факта, что лучшей используемой кислотой является раствор безводного хлороводорода в безводном спирте, необходимость получения безводного раствора кислоты, используемой в соответствующем спирте, также является важным недостатком. Недостатки вышеупомянутых способов включают использование сильнокоррозионных кислот, а также необходимость подвергать реакционную смесь сложным экстракциям. Таким образом, подобное производство является экономически невыгодным. Сущность изобретения В задачу изобретения входит предложение усовершенствованного способа удаления трифенилметильной (тритильной) защитной группы из 1-трифенилметил-5-(4'-замещенный метил-1,1'-бифенил-2 ил)-1H-тетразолов и способ использования удаления данной защитной группы для получения калиевой соли 2-бутил-4-хлор-1-(2'-1H-тетразол-5-ил)-1,1'-бифенил-4-ил]метил]-5-гидроксиметилимидазола (лосартана) формулы III Указанное лекарственное средство, которое является терапевтически важным лечебным препаратом, применяемым для регуляции кровяного давления, принадлежит к группе лекарств, называемых антагонистами рецептора ангиотензина II. Данный способ основан на неожиданном открытии того, что удаление тритильной защитной группы из тритилового производного формулы IV можно осуществить сольволизом при кипячении с обратным холодильником в безводном C1-С 5 спирте, предпочтительно в безводном метаноле либо в смеси метанола со смешивающимся с ним растворителем без каких-либо кислотных или основных агентов. Затем лосартан в форме кислоты формулы V, полученный данным способом из тритил-лосартана формулы IV, превращают под действием слабых оснований, например гидрокарбоната калия или карбоната калия, в калиевую соль лосартана формулы III. Превращение тритил-лосартана формулы IV в калиевую соль лосартана формулы III можно также осуществить, добавляя указанное слабое основание в начале реакции. Подробное описание изобретения Детритилирование в одном метаноле без добавления какого-либо катализатора происходит при перемешивании соответствующего тритилированного промежуточного соединения с метанолом при температуре между 20 С и точкой кипения метанола, предпочтительно при кипячении с обратным холодильником, тогда данная реакция завершается в течение нескольких часов. Если поддерживать строго безводные условия, то в процессе реакции образуется метилтрифенилметиловый эфир формулы XIII который после завершения реакции легко удаляется фильтрованием после охлаждения метанольного раствора. Другие первичные спирты, например этанол, также можно использовать вместо метанола,но тогда реакция протекает существенно дольше. Реакцию можно также проводить в смеси метанола с другими растворителями, например с другими спиртами, предпочтительно с этанолом, галогенированными растворителями, предпочтительно с дихлорметаном и хлороформом, алифатическими кетонами,-2 011507 предпочтительно с ацетоном или 2-бутаноном, диалкиловыми эфирами, предпочтительно с диизопропиловым эфиром и метил-трет-бутиловым эфиром, и эфирами карбоновых кислот с алифатическими спиртами, предпочтительно с метилацетатом, этилацетатом, изопропилацетатом или этилпропионатом. В таком случае, после окончания реакции смесь выпаривают досуха, затем растворяют при высокой температуре в метаноле и после охлаждения смесь обрабатывают, как описано выше. Если тритил-лосартан формулы IV является исходным тритилированным промежуточным соединением, то раствор свободного лосартана в форме кислоты формулы V получают указанным способом и затем превращают в калиевую соль лосартана формулы III под действием карбоната калия, гидрокарбоната калия или гидроксида калия. Саму по себе кристаллизацию затем можно проводить из смесей спирта, предпочтительно изопропанола, и антирастворителя, в котором калиевая соль лосартана формулы III нерастворима, либо с использованием других растворителей, например ацетона. При использовании данного способа можно получить продукт очень высокой чистоты, не содержащий примесей, которые характерны для кислотного способа или для способа с использованием гидроксида калия. Удаление защиты можно также проводить без существенного ухудшения чистоты неочищенной калиевой соли лосартана формулы III непосредственно в присутствии слабого основания, предпочтительно карбоната или гидрокарбоната калия, где непосредственно продуктом является указанная калиевая соль лосартана формулы III. Более подробно изобретение объяснено в приведенных ниже примерах. Эти примеры, которые представляют усовершенствование способа по данному изобретению, являются только иллюстрацией и не ограничивают объем изобретения. Примеры Пример 1. 2-Бутил-4-хлор-1-(2'-тетразол-5-ил)-1,1'-бифенил-4-ил]метил]-5-гидроксиметилимидазол. Суспензию 2-бутил-4-хлор-1-(2'-1-тритил-1H-тетразол-5-ил)-1,1'-бифенил-4-ил]метил]-5-гидроксиметилимидазола (тритил-лосартана, IV) массой 10 г (0,015 моль) в 50 мл безводного метанола кипятили с обратным холодильником в течение 7 ч. Затем раствор охлаждали до -10 С и перемешивали при данной температуре в течение ночи, выпавшие в осадок кристаллы отсасывали и промывали с небольшим количеством ледяного метанола. Получали 3,7 г (90%) метилтрифенилметилового эфира (XIII). Объединенные маточные растворы выпаривали и кипятили с 50 мл гексана, смесь охлаждали и нерастворимую часть отсасывали, перемешивали при комнатной температуре с 50 мл циклогексана в течение 10 ч, нерастворимую часть отсасывали. Получали 6,2 г продукта (98%) с т.пл. 186-188 С. Спектр 1 Н ЯМР (ДМСО): 0.81 t, J=7.24, 3 Н; 1.27 m, 2 Н; 1.47 m, 2 Н; 2.47 t, J=7.57, 2H; 4.35 s, 2H; 5.26s, 2H; 7.03-7.12 m, 4H; 7.49-7.73 m, 4H. Пример 2. Калиевая соль 2-бутил-4-хлор-1-[(2'-1H-тетразол-5-ил)-1,1'-бифенил-4-ил]-5(гидроксиметил)имидазола (лосартана, III). Суспензию 2-бутил-4-хлор-1-[(2'-1-тритил-1H-тетразол-5-ил)-1,1'-бифенил-4-ил]-5-(гидроксиметил)имидазола (тритил-лосартана, IV) массой 10 г (0,015 моль) в 100 мл безводного метанола кипятили с обратным холодильником в течение 7 ч. Затем раствор концентрировали примерно до 1/5 его объема и выпавший в осадок после охлаждения метилтрифенилметиловый эфир (XIII) отсасывали и промывали с небольшим количеством ледяного метанола. Получали 3,71 г (90%) метилтрифенилметилового эфира(XIII). Фильтрат выпаривали и остаток после выпаривания растворяли в 100 мл метанола. Добавляли 1,50 г KHCO3 и смесь кипятили с обратным холодильником в течение 4 ч. Затем метанол выпаривали и образовавшийся после выпаривания остаток кристаллизовали после добавления ацетона. Кристаллы отсасывали и промывали с небольшим количеством ледяного ацетона. Получали 5,29 г (76,5%) калиевой соли 2 бутил-4-хлор-1-[(2'-трифенилметилтетразол-5-ил)-1,1'-бифенил-4-ил]-5-(гидроксиметил)имидазола (III). Т.пл. (ДСК) 229,7 С (изменение кристаллической формы) и 274,6 С. Спектр 1 Н ЯМР (ДМСО): 0.83 t, J=7.27, 3 Н; 1.26 m, 2H; 1.48 m, 2H; 2.51 t, J=7.53, 2H; 4.34 s, 2H; 5.23s, 2H; 6.93 d, J=8.36, 2 Н; 7.13 d, J=8.34, 2H; 7.32-7.39 m, 3 Н; 7.55 m, 1H. Пример 3. Калиевая соль 2-бутил-4-хлор-1-[(2'-1H-тетразол-5-ил)-1,1'-бифенил-4-ил]-5-(гидроксиметил)имидазола (лосартана, III). 2,10 г кальцинированного карбоната калия (0,0150 моль) добавляли к суспензии 2-бутил-4-хлор-1[(2'-1-тритил-1H-тетразол-5-ил)-1,1'-бифенил-4-ил]-5-(гидроксиметил)имидазола (тритил-лосартана, IV) массой 10 г (0,0150 моль) в 65 мл безводного метанола и смесь доводили до кипения. После 6 ч кипячения с обратным холодильником смесь перемешивали в течение ночи без нагревания. На следующий день раствор концентрировали до 1/3 его объема и выпавший в осадок после охлаждения метилтрифенилметиловый эфир (XIII) отсасывали. Фильтрат выпаривали и образовавшийся после выпаривания остаток кристаллизовали после добавления ацетона. Кристаллы отсасывали и промывали с небольшим количеством ледяного ацетона. Получали 4,98 г (72,0%) калиевой соли 2-бутил-4-хлор-1-[(2'-трифенилметилтетразол-5-ил)-1,1'-бифенил-4-ил]-5-(гидроксиметил)имидазола (III). Т.пл. (ДСК) 233,9 С (изменение кристаллической формы) и 273,5 С. Пример 4. Калиевая соль 2-бутил-4-хлор-1-[(2'-1H-тетразол-5-ил)-1,1'-бифенил-4-ил]-5-(гидроксиметил)имидазола (лосартана, III).-3 011507 2,10 г кальцинированного карбоната калия (0,0150 моль) добавляли к суспензии 2-бутил-4-хлор-1[(2'-1-тритил-1H-тетразол-5-ил)-1,1'-бифенил-4-ил]-5-(гидроксиметил)имидазола (тритил-лосартана, IV) массой 10 г (0,0150 моль) в 65 мл безводного метанола и смесь доводили до кипения. После 5 ч кипячения с обратным холодильником смесь перемешивали в течение ночи. На следующий день раствор концентрировали до 1/3 его объема и охлаждали, выпавший в осадок метилтрифенилметиловый эфир (XIII) отсасывали. Фильтрат выпаривали, образовавшийся после выпаривания остаток растворяли в 30 мл изопропилового спирта и к полученному раствору добавляли 70 мл циклогексана. Выпавшие в осадок кристаллы отсасывали и промывали с небольшим количеством ледяного ацетона. Получали 5,50 г (79,5%) калиевой соли 2-бутил-4-хлор-1-[(2'-трифенилметилтетразол-5-ил)-1,1'-бифенил-4-ил]-5-(гидроксиметил)имидазола (III). Т.пл. (ДСК) 232,7 С (изменение кристаллической формы) и 272,9 С. Пример 5. Калиевая соль 2-бутил-4-хлор-1-[(2'-1H-тетразол-5-ил)-1,1'-бифенил-4-ил]-5-(гидроксиметил)имидазола (лосартана, III). 1,05 г кальцинированного карбоната калия (0,0075 моль) добавляли к суспензии 2-бутил-4-хлор-1[(2'-1-тритил-1H-тетразол-5-ил)-1,1'-бифенил-4-ил]-5-(гидроксиметил)имидазола (тритил-лосартана, IV) массой 10 г (0,015 моль) в 65 мл безводного метанола и смесь доводили до кипения на масляной бане. Нагревание прекращали после 8 ч и смесь перемешивали в течение ночи. На следующий день расвор концентрировали до 1/3 его объема и охлаждали, выпавший в осадок метилтрифенилметиловый эфир(XIII) отсасывали. Фильтрат выпаривали и образовавшийся после выпаривания остаток кристаллизовали после добавления ацетона. Кристаллы отсасывали и промывали с небольшим количеством ледяного ацетона. Получали 4,98 г (72,0%) калиевой соли 2-бутил-4-хлор-1-[(2'-1H-тетразол-5-ил)-1,1'-бифенил-4-ил]5-(гидроксиметил)имидазола (III). Т. пл. (ДСК) 234,1 С (изменение кристаллической формы) и 275,2 С. Пример 6. Калиевая соль 2-бутил-4-хлор-1-[(2'-1H-тетразол-5-ил)-1,1'-бифенил-4-ил]-5-(гидроксиметил)имидазола (лосартана, III). 1,05 г кальцинированного карбоната калия (0,0075 моль) добавляли к суспензии 2-бутил-4-хлор-1[(2'-1-тритил-1H-тетразол-5-ил)-1,1'-бифенил-4-ил]-5-(гидроксиметил)имидазола (тритил-лосартана, IV) массой 10 г (0,015 моль) в 65 мл безводного метанола и смесь доводили до кипения на масляной бане. Нагревание прекращали после 8 ч и смесь перемешивали в течение ночи. На следующий день раствор концентрировали до 1/3 его объема и охлаждали, выпавший в осадок метилтрифенилметиловый эфир(XIII) отсасывали. Фильтрат выпаривали, образовавшийся после выпаривания остаток растворяли в 30 мл изопропилового спирта и добавляли 70 мл циклогексана. Выпавшие в осадок кристаллы отсасывали и промывали с небольшим количеством ледяного ацетона. Получали 6,12 г (88,5%) калиевой соли 2-бутил 4-хлор-1-[(2'-1H-тетразол-5-ил)-1,1'-бифенил-4-ил]-5-(гидроксиметил)имидазола (III). Т.пл. (ДСК) 229,1 С (изменение кристаллической формы) и 271,8 С. Пример 7. Калиевая соль 2-бутил-4-хлор-1-[(2'-1H-тетразол-5-ил)-1,1'-бифенил-4-ил]-5-(гидроксиметил)имидазола (лосартана, III). 1,52 г гидрокарбоната калия (0,0150 моль) добавляли к суспензии 2-бутил-4-хлор-1-[(2'-1-тритил 1H-тетразол-5-ил)-1,1'-бифенил-4-ил]-5-(гидроксиметил)имидазола (тритил-лосартана, IV) массой 10 г(0,015 моль) в 65 мл безводного метанола и смесь доводили до кипения. Нагревание прекращали после 6 ч кипячения с обратным холодильником и смесь перемешивали в течение ночи. На следующий день раствор концентрировали до 1/3 его объема и выпавший в осадок после охлаждения метилтрифенилметиловый эфир (XIII) отсасывали. Фильтрат выпаривали и образовавшийся после выпаривания остаток кристаллизовали после добавления ацетона. Кристаллы отсасывали и промывали с небольшим количеством ледяного ацетона. Получали 6,31 г (91,2%) калиевой соли 2-бутил-4-хлор-1-[(2'-1H-тетразол-5-ил)-1,1'бифенил-4-ил]-5-(гидроксиметил)имидазола (III). Т.пл. (ДСК) 229,9 С (изменение кристаллической формы) и 274,2 С. Пример 8. Калиевая соль 2-бутил-4-хлор-1-[(2'-1H-тетразол-5-ил)-1,1'-бифенил-4-ил]-5-(гидроксиметил)имидазола (лосартана, III). 1,52 г гидрокарбоната калия (0,0150 моль) добавляли к суспензии 2-бутил-4-хлор-1-[(2'-1-тритил 1H-тетразол-5-ил)-1,1'-бифенил-4-ил]-5-(гидроксиметил)имидазола (тритил-лосартана, IV) массой 10 г(0,015 моль) в 65 мл безводного метанола и смесь доводили до кипения. Нагревание прекращали после 6 ч кипячения с обратным холодильником и смесь перемешивали в течение ночи. На следующий день раствор концентрировали до 1/3 его объема и выпавший в осадок после охлаждения метилтрифенилметиловый эфир (XIII) отсасывали. Фильтрат выпаривали и образовавшийся после выпаривания остаток кристаллизовали после добавления ацетона. Кристаллы отсасывали и промывали с небольшим количеством ледяного ацетона. Получали 6,36 г (91,9%) калиевой соли 2-бутил-4-хлор-1-[(2'-1H-тетразол-5-ил)-1,1'бифенил-4-ил]-5-(гидроксиметил)имидазола (III). Т.пл. (ДСК) 232,9 С (изменение кристаллической формы) и 274,5 С. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения лекарственного средства формулы III при котором проводят сольволиз соединения формулы IV в безводном метаноле в нейтральной или слабощелочной среде и реакцию с эквивалентом вещества формулы MnB, где M представляет собой калий и n принимает значения 1 или 2, а B представляет собойCO32- или HCO3-. 2. Способ по п.1, при котором сольволиз проводят в слабощелочной среде, при этом карбонат или гидрокарбонат калия добавляют в начале реакции. 3. Способ по п.1 или 2, при котором продукт кристаллизуют из смеси спирта, предпочтительно изопропанола, и антирастворителя, в котором соединение формулы III нерастворимо, или с использованием другого растворителя, например ацетона.
МПК / Метки
МПК: C07D 403/10, C07D 257/04
Метки: получения, калиевой, способ, соли, лосартана
Код ссылки
<a href="https://eas.patents.su/6-11507-sposob-polucheniya-kalievojj-soli-losartana.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения калиевой соли лосартана</a>










