Новый способ синтеза соединений ( 2s, 3аs, 7as )-1-[ (s)-аланил]октагидро -1н-индол-2-карбоновой кислоты и их применение для синтеза периндоприла
Формула / Реферат
1. Способ синтеза соединений (I)
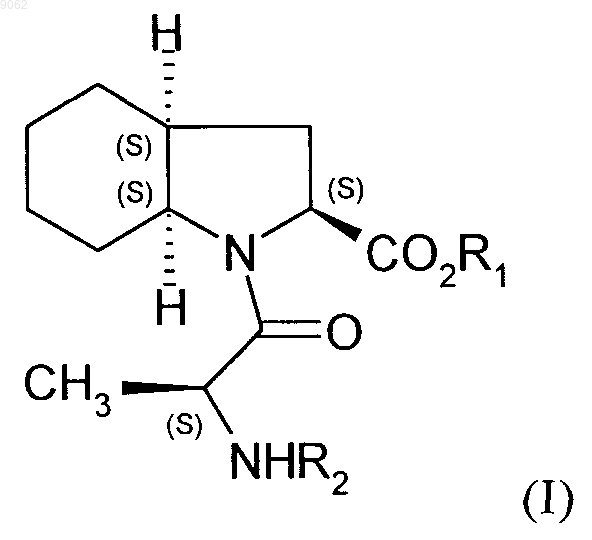
в которой R1 представляет собой атом водорода или бензильную группу, a R2 - это защитная группа для группы амина, представляющая собой трет-бутоксикарбонильную группу,
характеризующийся тем, что 1-(1-циклогексен-1-ил)пирролидин формулы (III)
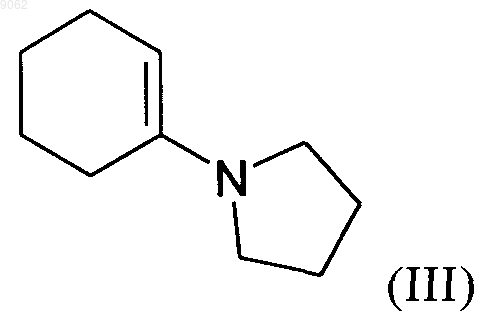
подвергают реакции с соединением серина формулы (IV)

в которой R1 является таким, как определено для формулы (I), a R3 - это защитная группа для группы амина, представляющая собой трет-бутоксикарбонильную группу,
с получением соединения формулы (V)
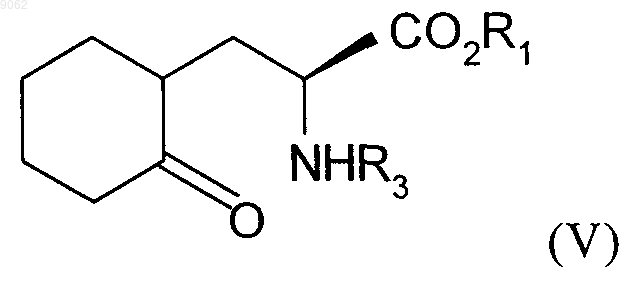
в которой R1 и R3 являются такими, как определено выше,
с группы амина которого снимается защита перед осуществлением циклизации, после чего осуществляют дегидратацию с получением соединения формулы (VI)
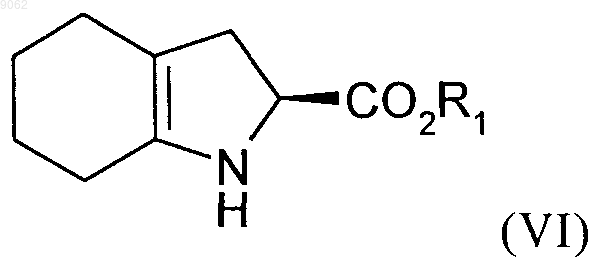
в которой R1 является таким, как определено выше,
которое подвергают реакции с соединением аланина формулы (VII)
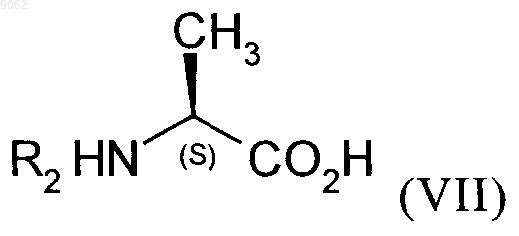
в которой R2 является таким, как определено для формулы (I),
в органическом растворителе, в присутствии количества дициклогексилкарбодиимида, которое составляет от 1 до 1,2 моль на моль используемого соединения формулы (V), и количества триэтиламина, которое составляет от 1 до 1,2 моль на моль используемого соединения формулы (V), и необязательно в присутствии 1-гидроксибензотриазола, при температуре от 20 до 50шС
с получением после изоляции и последующей перекристаллизации соединения формулы (VIII)
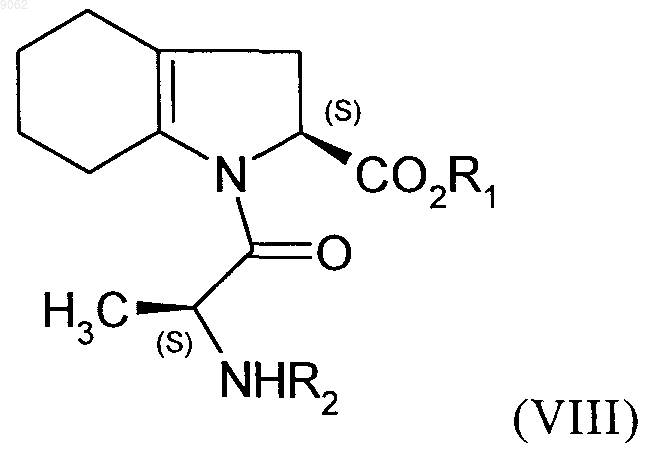
в которой R1 и R2 являются такими, как определено выше,
которое подвергают гидрированию в присутствии катализатора, под давлением водорода от 1 до 30 бар, с получением после необязательного снятия защиты или повторной защиты кислотной группы, соединения формулы (I).
2. Способ синтеза в соответствии с п.1, характеризующийся тем, что давление водорода в реакции гидрирования составляет от 1 до 10 бар.
3. Способ синтеза в соответствии с п.1, в котором катализатор является выбранным из палладия, платины, родия и никеля.
4. Способ синтеза периндоприла или его фармацевтически приемлемых солей, в котором соединение формулы (III) превращают в промежуточное соединение формулы (I), в соответствии со способом по п.1, а потом промежуточное соединение формулы (I), превращают в периндоприл или его фармацевтически приемлемую соль.
5. Соединение формулы (VIII)
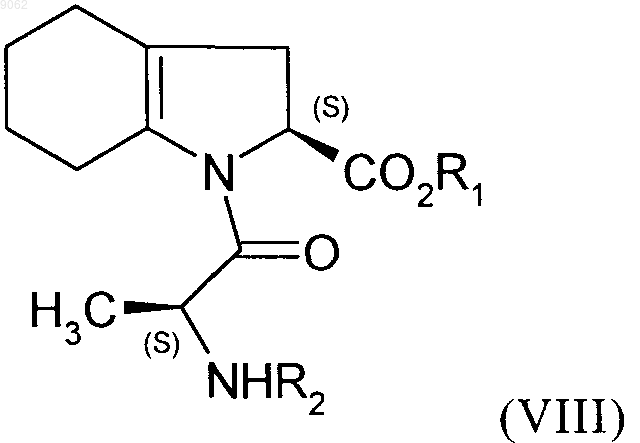
в которой R1 представляет собой атом водорода или бензильную группу, a R2 - это защитная группа для группы амина, представляющая собой трет-бутоксикарбонильную группу.
Текст
009062 Настоящее изобретение относится к способу синтеза соединений формулы (I) в которой R1 представляет собой атом водорода, линейную или разветвленную группу (С 1-С 6)алкила или бензильную группу, а R2 представляет собой защитную группу для группы амина,а также к их применению в синтезе периндоприла формулы (II) и его фармацевтически приемлемых солей. Периндоприл и его фармацевтически приемлемые соли, в частности его соль трет-бутиламина, обладают ценными фармакологическими свойствами. Их принципиальное свойство заключается в ингибировании фермента, превращающего ангиотензин I (или кининазы II), что, с одной стороны, предотвращает превращение декапептида ангиотензина I в октапептид ангиотензина II (вазоконстриктора), а, с другой стороны, предотвращает разложение брадикинина (вазодилятора) с образованием неактивного пептида. Эти два действия вносят свой вклад в благоприятные эффекты, проявляемые периндоприлом при кардиоваскулярных заболеваниях, в частности при артериальной гипертензии и сердечной недостаточности. Периндоприл, его получение и применение в терапевтических средствах были описаны в описании к европейскому патенту ЕР 0049658. С точки зрения фармацевтической ценности этого соединения, является важным получать его с помощью эффективного процесса синтеза, который приводит к получению периндоприла с хорошим выходом и с отличной чистотой, используя в качестве исходных материалов соединения с разумной ценой. В патентной заявке ЕР 1256590 был описан способ получения соединений формулы (I). Однако этот процесс имеет недостаток, который заключается в том, что в качестве исходного материала используют сложный эфир (2S)-дигидроиндол-2-карбоновой кислоты, который не является коммерчески доступным и получение которого требует осуществления нескольких этапов синтеза (включая этап разделения), при этом в качестве исходного соединения используют индол-2-карбоновую кислоту. Заявителем в настоящее время был разработан новый процесс для синтеза соединений формулы (I),который имеет то преимущество, что в качестве единственного источника хиральности используют аланин(природный и, таким образом, недорогой исходный материал) и соединение, легко получаемое из серина. В частности, настоящее изобретение относится к способу синтеза соединения формулы (I) в которой R1 представляет собой атом водорода или бензильную группу, a R2 - это защитная группа для группы амина, представляющая собой трет-бутоксикарбонильную группу,характеризующемуся тем, что 1-(1-циклогексен-1-ил)пирролидин формулы (III) в которой R1 является таким, как определено для формулы (I), a R3 - это защитная группа для группы амина, представляющая собой трет-бутоксикарбонильную группу,с получением соединения формулы (V) в которой R1 и R3 являются такими, как определено выше,с аминовой группы которого снимается защита перед осуществлением циклизации, после чего осуществляют дегидратацию с получением соединения формулы (VI) в которой R1 является таким, как определено выше,которое подвергают реакции с соединением аланина формулы (VII) в которой R2 является таким, как определено для формулы (I),в органическом растворителе, таком как, например, тетрагидрофуран или этилацетат, в присутствии количества дициклогексилкарбодиимида, которое составляет от 1 до 1,2 моль на моль используемого соединения формулы (V), и количества триэтиламина, которое составляет от 1 до 1,2 моль на моль используемого соединения формулы (V), и необязательно в присутствии 1-гидроксибензотриазола, при температуре от 20 до 50 С с получением после изоляции и последующей перекристаллизации соединения формулы (VIII) в которой R1 и R2 являются такими, как определено выше,которое подвергают гидрированию в присутствии катализатора, такого как, например, палладий, платина, родий или никель, под давлением водорода от 1 до 30 бар, предпочтительно от 1 до 10 бар с получением,после необязательного снятия защиты или повторной защиты кислотной группы, соединения формулы (I). Соединение формулы (I), полученное таким образом, в дальнейшем подвергают, если это является желательным, реакции снятия защиты с кислотной группы и группы амина, после чего осуществляют реакцию конденсации либо с этил-2-оксопентаноатом в условиях восстановительного аминирования,либо с соединением формулы (IX) в которой X представляет собой отходящую группу, выбранную из атома галогена, -O-SO2CH3, и с получением оптически чистого периндоприла, который превращают, если это является желательным, в фармацевтически приемлемую соль, такую как соль трет-бутиламина. Соединения формулы (VIII) представляют собой новые соединения, которые являются полезными в качестве промежуточных соединений для синтеза в химической или фармацевтической промышленности, в частности для синтеза соединения формулы (I), и как таковые они составляют неотъемлемую часть данного изобретения. Примеры, представленные ниже, иллюстрируют изобретение, но не ограничивают его каким-либо образом.-2 009062 Пример. (2S,3aS,7aS)-1-(2S)-2[(трет-Бутоксикарбонил)амино]пропионилоктагидро-1H-индол-2 карбоновая кислота. Этап А. Бензил (2S)-2-[(трет-бутоксикарбонил)амино]-3-(2-оксоциклогексил)пропаноат. Вводили 200 г 1-(1-циклогексен-1-ил)пирролидина, 535 г бензил (2S)-2-[(трет-бутоксикарбонил) амино]-3-иодпропаноата и 1,5 л ацетонитрила в реактор, оснащенный колонкой для кипячения с обратным холодильником. Кипятили в течение 1 ч, а потом охлаждали до комнатной температуры. После выпаривания растворителя прибавляли 2 л воды, а потом уксусную кислоту. Экстрагировали с помощью этилацетата и выпаривали до осушения. Бензил (2S)-2-[(трет-бутоксикарбонил)амино]-3-(2-оксоциклогексил)пропаноат получали, таким образом, с выходом 80%. Этап В. Бензил (2S)-2-амино-3-(2-оксоциклогексил)пропаноат. Вводили 200 г соединения, полученного на предыдущем этапе, 1,5 л дихлорметана и 60 г трифторуксусной кислоты в реактор. После перемешивания в течение 1 ч 30 мин при комнатной температуре прибавляли 2 л насыщенного раствора гидрокарбоната натрия. Экстрагировали при использовании дихлорметана и выпаривали до осушения. Бензил (2S)-2-амино-3-(2-оксоциклогексил)пропаноат получали, таким образом, с выходом 90%. Этап С. Бензил (2S)-2,3,4,5,6,7-гексагидро-1 Н-индол-2-карбоксилат. В реакторе подвергали кипячению 200 г соединения, полученного на предыдущем этапе, 13,8 г птолуолсульфоновой кислоты и 1 л толуола, образовавшуюся воду удаляли с помощью азеотропной дистилляции. Когда отделение воды прекращалось, выпаривали толуол. Бензил (2S)-2,3,4,5,6,7-гексагидро-1H-индол-2-карбоксилат получали, таким образом, с выходом сырьевого продукта 97%. Этап D. Бензил (2S)-1-(2S)-2-[(трет-бутоксикарбонил)амино]пропионил-2,3,4,5,6,7-гексагидро-1 Ниндол-2-карбоксилат. При перемешивании вводили 200 г соединения, полученного на предыдущем этапе, 65 г триэтиламина и 2 л тетрагидрофурана в реактор, а после перемешивания в течение 10 мин при комнатной температуре прибавляли 123 г N-[трет-бутоксикарбонил]-(S)-аланина и 130 г дициклогексилкарбодиимида. После этого гетерогенную смесь перемешивали при комнатной температуре в течение 6 ч и после этого ее охлаждали до температуры 0 С и фильтровали. Потом фильтрат промывали и перекристаллизовывали из смеси гексан/этилацетат 10/1 с получением предполагаемого продукта с выходом 81% и со степенью химической чистоты 98%. Этап Е. (2S,3aS,7aS)-1-(2S)-2-[(трет-Бутоксикарбонил)амино]пропионилоктагидро-1 Н-индол-2-карбоновая кислота. Вводили 200 г соединения, полученного на предыдущем этапе, растворенного в уксусной кислоте, а потом 5 г Pt/C 10% в устройство для гидрирования. Подвергали гидрированию под давлением 5 бар при комнатной температуре до тех пор, пока не было поглощено теоретическое количество водорода. Удаляли катализатор с помощью фильтрования, а потом охлаждали до температуры от 0 до 5 С, собирали полученное твердое вещество с помощью фильтрования. Промывали осадок на фильтре и высушивали его до постоянного веса.(2S,3aS,7aS)-1-(2S)-2[(трет-Бутоксикарбонил)амино]пропионилоктагидро-1H-индол-2-карбоновую кислоту получали, таким образом, с выходом 87% и со степенью энантиомерной чистоты 99%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ синтеза соединений (I) в которой R1 представляет собой атом водорода или бензильную группу, a R2 - это защитная группа для группы амина, представляющая собой трет-бутоксикарбонильную группу,характеризующийся тем, что 1-(1-циклогексен-1-ил)пирролидин формулы (III)-3 009062 подвергают реакции с соединением серина формулы (IV) в которой R1 является таким, как определено для формулы (I), a R3 - это защитная группа для группы амина, представляющая собой трет-бутоксикарбонильную группу,с получением соединения формулы (V) в которой R1 и R3 являются такими, как определено выше,с группы амина которого снимается защита перед осуществлением циклизации, после чего осуществляют дегидратацию с получением соединения формулы (VI) в которой R1 является таким, как определено выше,которое подвергают реакции с соединением аланина формулы (VII) в которой R2 является таким, как определено для формулы (I),в органическом растворителе, в присутствии количества дициклогексилкарбодиимида, которое составляет от 1 до 1,2 моль на моль используемого соединения формулы (V), и количества триэтиламина,которое составляет от 1 до 1,2 моль на моль используемого соединения формулы (V), и необязательно в присутствии 1-гидроксибензотриазола, при температуре от 20 до 50 С с получением после изоляции и последующей перекристаллизации соединения формулы (VIII) в которой R1 и R2 являются такими, как определено выше,которое подвергают гидрированию в присутствии катализатора, под давлением водорода от 1 до 30 бар,с получением после необязательного снятия защиты или повторной защиты кислотной группы, соединения формулы (I). 2. Способ синтеза в соответствии с п.1, характеризующийся тем, что давление водорода в реакции гидрирования составляет от 1 до 10 бар. 3. Способ синтеза в соответствии с п.1, в котором катализатор является выбранным из палладия,платины, родия и никеля. 4. Способ синтеза периндоприла или его фармацевтически приемлемых солей, в котором соединение формулы (III) превращают в промежуточное соединение формулы (I), в соответствии со способом по п.1, а потом промежуточное соединение формулы (I), превращают в периндоприл или его фармацевтически приемлемую соль. 5. Соединение формулы (VIII) в которой R1 представляет собой атом водорода или бензильную группу, a R2 - это защитная группа для группы амина, представляющая собой трет-бутоксикарбонильную группу. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6
МПК / Метки
МПК: C07K 5/02, C07K 5/06, C07D 209/42
Метки: 1, 1н-индол-2-карбоновой, применение, периндоприла, s)-аланил]октагидро, новый, синтеза, способ, кислоты, соединений, 3аs
Код ссылки
<a href="https://eas.patents.su/5-9062-novyjj-sposob-sinteza-soedinenijj-2s-3as-7as-1-s-alaniloktagidro-1n-indol-2-karbonovojj-kisloty-i-ih-primenenie-dlya-sinteza-perindoprila.html" rel="bookmark" title="База патентов Евразийского Союза">Новый способ синтеза соединений ( 2s, 3аs, 7as )-1-[ (s)-аланил]октагидро -1н-индол-2-карбоновой кислоты и их применение для синтеза периндоприла</a>
Предыдущий патент: Способ получения рацемического циталопрамдиола и/или s- или r- циталопрамдиолов и способ получения рацемического циталопрама, r-циталопрама и /или s-циталопрама
Следующий патент: Применение фунгицидных средств для протравливания семенного материала зерновых культур
Случайный патент: Способ защиты полезных растений или материала для размножения растений









