Способ получения замещенного пергидроизоиндола
Формула / Реферат
1. Способ получения замещенного перегидроизоиндола формулы (I)
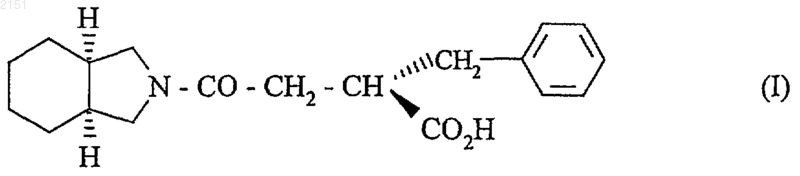
и его фармацевтически приемлемых солей, отличающийся тем, что диметилсукцинат подвергают взаимодействию с бензальдегидом в среде метанола с получением двухосновной кислоты формулы (II)
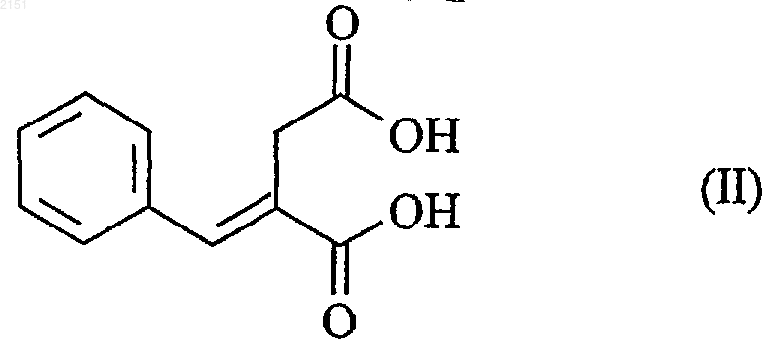
которая после нагревания в апротонном растворителе в присутствии уксусного ангидрида дает ангидрид формулы (III)
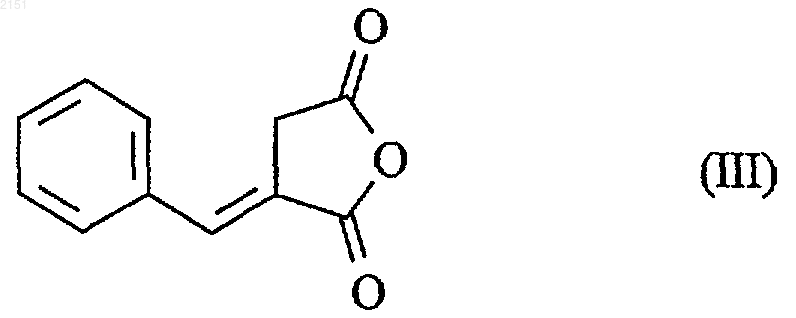
который подвергают взаимодействию с пергидроизоиндолом формулы (IV) в апротонном растворителе
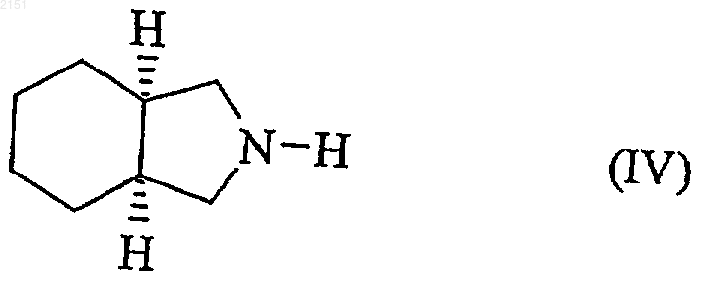
с получением соединения формулы (V)
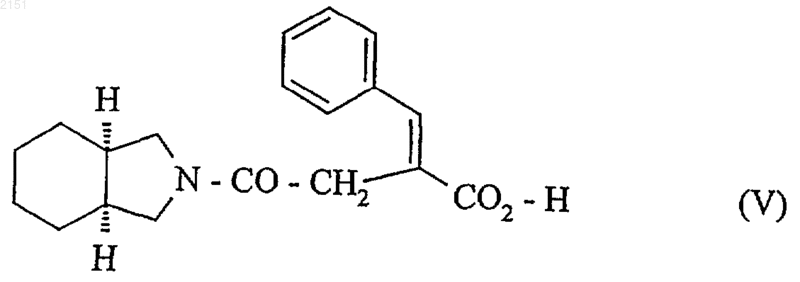
которое подвергают каталитическому гидрированию с использованием в качестве катализатора асимметрического гидрирования комплекса родий/(2S,4S)-N-бутоксикарбонил-4-дифенилфосфино-2-дифенилфосфинометилпирролидин или Rh/(S,S)BPPM в среде метанола или метиленхлорида с последующим превращением в соль в присутствии амина А с получением соединения формулы (VI)
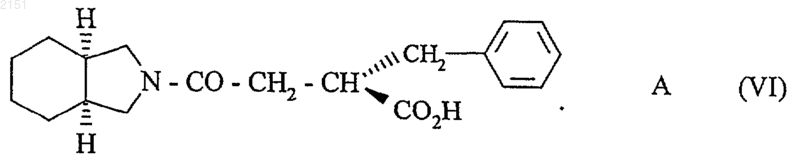
которое в основной среде в присутствии неорганической соли дает аддитивную соль соединения формулы (I), которую превращают при желании в соответствующую кислоту, или в кислой среде дает соединение формулы (I), которое при желании превращают в его фармацевтически приемлемую аддитивную соль.
2.Способ получения по п.1, отличающийся тем, что используемый амин А представляет (R)-1-фенилэтиламин.
3. Способ получения по п.1, отличающийся тем, что амин А представляет морфолин.
4. Способ по п.1, отличающийся тем, что амин А представляет N-метилморфолин.
5. Способ по п.1, отличающийся тем, что амин А представляет циклогексиламин.
6. Способ по п.1 получения кальциевой соли бис-2-(S)-бензил-4-оксо-4- (цис-пергидроизоиндол-2-ил)масляной кислоты.
7.Способ по п.1 получения дигидрата бис-2-(S)-бензил-4-оксо-4-(цис-пергидроизоиндол-2-ил)бутирата кальция.
Текст
Настоящее изобретение относится к способу промышленного синтеза замещенного пергидроизоиндола формулы (I) и его фармацевтически приемлемых солей. Соединение формулы (I) и его аддитивные соли обладают весьма ценными фармакологическими свойствами. Это соединение оказывает очень сильное влияние на выделение инсулина,что делает его полезным при лечении инсулиннезависимого диабета. Соединение формулы (I), его получение и терапевтическое применение описаны в описании к заявке на европейский патент ЕР 0507534. Однако для промышленного получения такого соединения, как соединение формулы (I), необходимы глубокое изучение всех стадий реакционного процесса, выбор исходных веществ, а также реагентов и растворителей, чтобы сделать возможным достижение оптимальных выходов продукта. Способ синтеза соединения формулы (I),описанный в заявке ЕР 0507534, не позволяет получать данное соединение с оптимальным выходом. В действительности при осуществлении описанного способа синтеза не достигается желаемая степень региоселективности получения изомера, представляющего интерес. Поэтому для того, чтобы получить изомер фармацевтической степени чистоты, необходим ряд дополнительных операций по очистке продукта. С учетом фармацевтической ценности данного соединения и при отсутствии способа,который дал бы возможность получать его с хорошим выходом, удовлетворительной степенью чистоты и, если возможно, из недорогих исходных веществ, которые промышленно доступны, было осуществлено более глубокое исследование, что в результате привело к разработке нового, представляющего особую ценность способа синтеза. Более конкретно изобретение относится к способу получения соединения формулы (I),характеризующемуся тем, что диметилсукцинат вводят во взаимодействие с бензальдегидом в среде метанола, с получением двухосновной кислоты формулы (II) которая после нагревания в апротонном растворителе, таком как тетрагидрофуран или изопропиловый эфир, в присутствии уксусного ангидрида, дает ангидрид формулы (III) который подвергают взаимодействию с пергидроизоиндолом формулы (IV) в апротонном растворителе таком, как толуол, ацетонитрил, этилацетат, метил-трет.бутиловый эфир или тетрагидрофуран, или в смеси тетрагидрофуран/толуол С получением соединения формулы (V) которое подвергают каталитическому гидрированию с использованием в качестве катализатора асимметрического гидрирования комплекса родий/(2S,4S)-N-бутоксикарбонил-4-дифенилфосфино-2-дифенилфосфинометилпирролидин или Rh/(S,S)BPPM, в среде метанола или метиленхлорида, с последующим превращением в соль в присутствии амина А с получением соединения формулы (VI) которое в основной (щелочной) среде в присутствии неорганической соли дает аддитивную соль соединения формулы (I), которую превращают,при желании, в соответствующую кислоту, или в кислой среде дает соединение формулы (I),которое, при желании, превращают в его фармацевтически приемлемую аддитивную соль. Среди фармацевтически приемлемых аддитивных солей можно упомянуть, в качестве неограничивающего примера, соли натрия и кальция в гидратированной или негидратированной форме. Предпочтительной аддитивной солью является соль кальция. Данный способ особенно ценен по следующим причинам. Размыкание цикла ангидрида формулы(III) пергидроизоиндолом формулы (IV) позволяет достичь очень высокой региоселективности процесса. В действительности соединение формулы (V) выделяют при региоселективности более чем 99,5%. Энантиоселективное восстановление соединения формулыRh/(S,S)ВРРМ обеспечивает энантиомерный избыток более чем 92%. Мольное соотношение комплекс/субстрат, используемое на этой ста 3 дии, составляет от 1/2000 до 1/10000 и предпочтительно от 1/2000 до 1/4000. Родиевый комплекс Rh/(S,S)BPPM известен из литературы как энантиоспецифичный катализатор гидрирования. Однако в метаноле или метиленхлориде(I/а) имеет тенденцию давать смесь региоизомеров (I/а)/(I/b) Изучение кинетики сделало возможным показать, что процентная доля региоизомера(I/b) быстро увеличивается в зависимости от времени и температуры. Было показано, что,когда соединение (I) находится в присутствии амина А, образование соединения формулы (I/b) значительно замедляется. Например, после 12-часовой выдержки при 65 С в растворе метанола процентное содержание соединения (I/b) составляет приблизительно 9%, когда это соединение находится в форме свободной кислоты, тогда как процентное содержание соединения (I/b) составляет приблизительно 1%, когда соединение находится в форме соли амина А. Это составляет значительное преимущество разработки данного промышленного процесса. Кроме того, кристаллизация полученной соли легко выполнима в промышленном масштабе и обеспечивает отличную энантиомерную и химическую очистку целевого продукта. Способ также дает возможность устранять все следы катализатора. Среди аминов А, которые могут использоваться на данной стадии реакции, могут быть упомянуты (R)-1-фенилэтиламин, морфолин, Nметилморфолин и циклогексиламин. Предпочтительными аминами являются(R)-1 фенилэтиламин и морфолин. Следующие примеры иллюстрируют изобретение, никоим образом не ограничивая его. Пример 1. Дигидрат-бис-2-(S)-бензил-4 оксо-4-(цис-пергидроизоиндол-2-ил)бутирата кальция. Стадия А. Бензилиденянтарная кислота. 700 ммоль диметилсукцината и затем 20 мл метанола добавляют к 290 ммоль метилата натрия, растворенного в 80 мл метанола. Смесь подвергают нагреванию с обратным холодильником и медленно добавляют к 236 ммоль бензальдегида, а затем 20 мл метанола. Смесь поддерживают при нагревании с обратным холодильником при перемешивании в течении часа,а затем отгоняют 100 мл метанола. К концентрированной реакционной смеси добавляют 120 мл воды и 120 мл 10 н раствора гидроксида натрия. Продолжают удаления метанола с помощью перегонки. Остаток разбавляют 150 мл воды. После добавления дихлорметана двухос 002151 4 новную кислоту осаждают медленным добавлением 12 н соляной кислоты. Двухосновную кислоту фильтруют и промывают дихлорметаном,а затем водой. Сушка дает ожидаемый продукт. Точка плавления: 199 С. Стадия В. Бензилиденянтарный ангидрид. 291 ммоль соединения, полученного на предыдущей стадии, суспендируют в 180 мл изопропилового эфира. Добавляют 320 мл уксусного ангидрида и суспензию нагревают с обратным холодильником в течение 3,5 ч. Охлаждают до 4 С, фильтрование полученного ангидрида и промывка изопропиловым эфиром дают желаемый продукт. Точка плавления: 168 С. Стадия С. [(Цис-пергидроизоиндол-2 ил)карбонилметил]-3-фенилакриловая кислота. Раствор 175 ммоль пергидроизоиндола в 32 мл толуола очень медленно добавляют к 167 ммоль ангидрида, полученного на предыдущей стадии, суспендированного в 250 мл толуола. Смесь охлаждают до -5 С. Образовавшийся осадок моноамида отфильтровывают и промывают ледяным толуолом. Сушка дает желаемый продукт. Точка плавления: 162 С. Стадия Д. 2-(S)-бензил-4-оксо-4-(циспергидроизоиндол-2-ил)-бутират I-(R)-фенилэтиламина 80 ммоль амида, полученного на предыдущей стадии, растворяют в 75 мл метанола. 40 микромолей (S,S)BPPM растворяют в 15 мл метанола и 20 микромолей [Rh(COD)Cl]2 растворяют в 15 мл метанола. Растворы дегазируют,помещают в реактор для гидрирования и гидрируют при 20 С под давлением 5 бар. 250 мл толуола и при 5 С добавляют раствор 82,5 ммоль(R)-I-фенилэтиламина в 100 мл толуола к метанольному раствору гидрирования. Метанол удаляют при пониженном давлении и комнатной температуре и добавляют 300 мл толуола. Выпавший осадок отфильтровывают при 20 С и дважды промывают каждый раз 20 миллилитрами толуола. После сушки полученную неочищенную соль перекристаллизовывают из ацетона, отфильтровывают и сушат, получая ожидаемый продукт. Точка плавления: 144 С. Стадия Е: Дигидрат бис-2-(S)-бензил-4 оксо-4-(цис-пергидроизоиндол-2-ил)бутирата кальция. 13 мл водного раствора, содержащего 9 ммоль дигидрата хлорида кальция, добавляют к 9 ммоль вышеописанной очищенной соли I-(R)фенилэтиламина, растворенной в 80 мл 1,8% водного раствора аммиака. Полученный осадок отфильтровывают, промывают водой и сушат с получением желаемого продукта. Точка плавления: 214 С. Пример 2. Дигидрат бис-2-(S)-бензил-4-оксо-4-(циспергидроизоиндол-2-ил)бутирата кальция. Стадии А, В, и С: Эти стадии идентичны стадиям А,В и С примера 1. Стадия Д: 2-(S)-бензил-4-оксо-4-(циспергидроизоиндол-2-ил)бутират морфолина. Проводят гидрирование так, как описано выше. 69 г морфолина добавляют к ледяному метанольному раствору гидрирования и осуществляют концентрирование в вакууме при температуре меньше 25 С для удаления метанола. Вес концентрата доводят до 115 г добавлением морфолина, а затем добавляют 250 мл метилтрет.бутилового эфира и смесь перемешивают при комнатной температуре в течение 20 ч. Соль амина, которая осаждается, отфильтровывают и промывают смесью метил-трет.бутилового эфира и морфолина, а затем метил-трет.бутиловым эфиром сушка дает желаемый продукт. Точка плавления: 110 С. Стадия Е: Дигидрат бис-2-(S)бензил-4 оксо-4-(цис-пергидроизоиндол-2-ил)бутирата кальция. 25 мл I н раствора гидроксида натрия и затем 28 мл водного раствора, содержащего 12,5 ммоль дигидрата хлорида кальция, добавляют к 25 ммоль очищенной соли морфолина, растворенной в 75 мл этанола и 30 мл воды. Получившийся осадок отфильтровывают, промывают и сушат с получением желаемого продукта. Точка плавления: 214 С.[а]36520 =+32,4 (с=5%,МеОН). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения замещенного пергидроизоиндола формулы (I) и его фармацевтически приемлемых солей, отличающийся тем, что диметилсукцинат подвергают взаимодействию с бензальдегидом в среде метанола с получением двухосновной кислоты формулы (II) который подвергают взаимодействию с пергидроизоиндолом формулы (IV) в апротонном растворителе с получением соединения формулы (V) которое подвергают каталитическому гидрированию с использованием в качестве катализатора асимметрического гидрирования комплекса родий/(2S,4S)-N-бутоксикарбонил-4-дифенилфосфино-2-дифенилфосфинометилпирролидин или Rh/(S,S)BPPM в среде метанола или метиленхлорида, с последующим превращением в соль в присутствии амина А с получением соединения формулы (VI) которое в основной среде в присутствии неорганической соли дает аддитивную соль соединения формулы (I), которую превращают при желании в соответствующую кислоту, или в кислой среде дает соединение формулы (I), которое при желании превращают в его фармацевтически приемлемую аддитивную соль. 2. Способ получения по п.1, отличающийся тем, что используемый амин А представляет(R)-1-фенилэтиламин. 3. Способ получения по п.1, отличающийся тем, что амин А представляет морфолин. 4. Способ по п.1, отличающийся тем, что амин А представляет N-метилморфолин. 5. Способ по п.1, отличающийся тем, что амин А представляет циклогексиламин. 6. Способ по п.1 получения кальциевой соли бис-2-(S)-бензил-4-оксо-4-(цис-пергидроизоиндол-2-ил)масляной кислоты. 7. Способ по п.1 получения дигидрата бис 2-(S)-бензил-4-оксо-4-(цис-пергидроизоиндол-2 ил)бутирата кальция. которая после нагревания в апротонном растворителе в присутствии уксусного ангидрида дает ангидрид формулы (III)
МПК / Метки
МПК: C07D 209/44
Метки: получения, способ, замещенного, пергидроизоиндола
Код ссылки
<a href="https://eas.patents.su/4-2151-sposob-polucheniya-zameshhennogo-pergidroizoindola.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения замещенного пергидроизоиндола</a>
Предыдущий патент: Фунгицидная смесь
Следующий патент: Синергическая гербицидная комбинация
Случайный патент: Способ, устройство и композиционный нетканый материал для упрочнения нетканого материала, изготовленного способом воздушной укладки








