Замещённые индолпиридиниевые соединения в качестве противоинфекционного средства
Номер патента: 9871
Опубликовано: 28.04.2008
Авторы: Ван Цзин, Вигеринк Пит Том Берт Поль, Кестелейн Барт Рудольф Романи, Де Фруй Вероник Корин Пол, Киндерманс Натали Мария Франциска, Канар Максим Франсис Жан-Мари Гилейн, Сюрлеро Доминик Луи Нестор Гислейн, Ван Де Фрейкен Вим, Йохманс Дирк Эдвард Дезире, Хертогс Курт, Тахри Абделла, Беттенс Эва
Формула / Реферат
1. Соединение формулы (I)
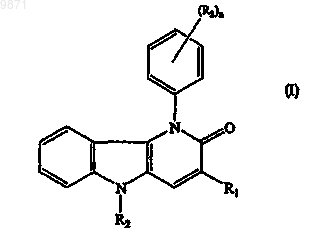
его N-оксид, соль, стереоизомерная форма, рацемическая смесь, пролекарство, сложный эфир или метаболит, где
n равно 1, 2 или 3;
R1 представляет собой атом водорода, цианогруппу, галоген, аминокарбонил, гидроксикарбонил,
C1-4-алкилоксикарбонил, C1-4-алкилкарбонил, моно- или ди(C1-4-алкил)аминокарбонил, ариламинокарбонил, N-(арил)-N-(C1-4-алкил)аминокарбонил, метанимидамидил, N-гидроксиметанимидамидил, моно- или ди(C1-4-алкил)метанимидамидил, Het1 или Het2;
R2 представляет собой атом водорода, C1-10-алкил, С2-10-алкенил, С3-7-циклоалкил, где указанные
C1-10-алкил, С2-10-алкенил и С3-7-циклоалкил, каждый отдельно и независимо друг от друга, может быть необязательно замещен заместителем, выбранным из группы, состоящей из цианогруппы, NR4aR4b, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(C1-4-алкил)пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила, 1,1-диоксотиоморфолинила, арила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, пиридила, пиримидинила, пиразинила, пиридазинила, триазинила, гидроксикарбонила, C1-4-алкилкарбонила, N(R4aR4b)карбонила, C1-4-алкилоксикарбонила, пирролидин-1-илкарбонила, пиперидин-1-илкарбонила, гомопиперидин-1-илкарбонила, пиперазин-1-илкарбонила, 4-(C1-4-алкил)пиперазин-1-илкарбонила, морфолин-1-илкарбонила, тиоморфолин-1-илкарбонила, 1-оксотиоморфолин-1-илкарбонила и 1,1-диоксотиоморфолин-1-илкарбонила;
R3 представляет собой нитро-, циано-, аминогруппу, галоген, гидроксигруппу, C1-4-алкилоксигруппу, гидроксикарбонил, аминокарбонил, C1-4-алкилоксикарбонил, моно- или ди(С1-4-алкил)аминокарбонил, C1-4-алкилкарбонил, метанимидамидил, моно- или ди(C1-4-алкил)метанимидамидил, N-гидроксиметанимидамидил или Het1;
R4a представляет собой атом водорода, C1-4-алкил или C1-4-алкил, замещенный заместителем, выбранным из группы, состоящей из амино-, моно- или ди(C1-4-алкил)аминогруппы, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(C1-4-алкил)пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила и 1,1-диоксотиоморфолинила;
R4b представляет собой атом водорода, C1-4-алкил или C1-4-алкил, замещенный заместителем, выбранным из группы, состоящей из амино-, моно- или ди(C1-4-алкил)аминогруппы, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(C1-4-алкил)пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила и 1,1-диоксотиоморфолинила;
арил представляет собой фенил, необязательно замещенный одним или несколькими заместителями, каждый из которых отдельно выбран из группы, состоящей из C1-6-алкила, C1-4-алкоксигруппы, галогена, гидрокси-, аминогруппы, трифторметила, циано-, нитрогруппы, гидрокси-С1-6-алкила, циано-C1-6-алкила, моно- или ди(C1-4-алкил)аминогруппы, амино-С1-4-алкила, моно- или ди(С1-4-алкил)амино-С1-4-алкила;
Het1 представляет собой 5-членную циклическую систему, где один, два, три или четыре элемента цикла представляют собой гетероатомы, каждый из которых отдельно и независимо друг от друга выбран из группы, состоящей из атома азота, кислорода и серы, и где остальные элементы цикла представляют собой атомы углерода; и, когда это возможно, любой атом азота как элемент цикла необязательно может быть замещен C1-4-алкилом; любой атом углерода как элемент цикла, каждый отдельно и независимо друг от друга, необязательно может быть замещен заместителем, выбранным из группы, состоящей из C1-4-алкила, С2-6-алкенила, С3-7-циклоалкила, гидроксигруппы, C1-4-алкоксигруппы, галогена, амино-, цианогруппы, трифторметила, гидрокси-С1-4-алкила, циано-С1-4-алкила, моно- или ди(С1-4-алкил)аминогруппы, амино-С1-4-алкила, моно- или ди(С1-4-алкил)амино-С1-4-алкила, арил-С1-4-алкила, амино-С2-6-алкенила, моно- или ди(С1-4-алкил)амино-С2-6-алкенила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, арила, гидроксикарбонила, аминокарбонила, С1-4-алкилоксикарбонила, моно- или ди(С1-4-алкил)аминокарбонила, С1-4-алкилкарбонила,оксо-, тиогруппы; и где любой названный выше фуранильный, тиенильный, пирролильный, оксазолильный, тиазолильный, имидазолильный, изоксазолильный, изотиазолильный, пиразолильный, оксадиазолильный, тиадиазолильный и триазолильный остаток может быть необязательно замещен С1-4-алкилом;
Het2 представляет собой пиридил, пиримидинил, пиразинил, пиридазинил или триазинил, где любой атом углерода как элемент цикла каждого из указанных 6-членных содержащих атом азота ароматических циклов может быть необязательно замещен заместителем, выбранным из группы, состоящей из С1-4-алкила;
при условии, что соединение отличается от
2,5-дигидро-1-(4-нитрофенил)-2-оксо-1Н-пиридо[3,2-b]индол-3-карбонитрила и
2,5-дигидро-5-метил-1-(4-нитрофенил)-2-оксо-1Н-пиридо[3,2-b]индол-3-карбонитрила.
2. Соединение по п.1, где n равно 1, заместитель R3 представляет собой нитрогруппу, заместитель R1 представляет собой цианогруппу, С1-4-алкилоксикарбонил или С1-4-алкиламинокарбонил; и заместитель R2 представляет собой атом водорода или C1-6-алкил.
3. Соединение по п.1 или 2, где n равно 1 или 2; R3 представляет собой нитро-, циано-, аминогруппу, галоген, гидроксигруппу, С1-4-алкилоксигруппу, гидроксикарбонил, аминокарбонил, аминотиокарбонил, C1-4-алкилоксикарбонил, C1-4-алкилкарбонил, моно- или ди(C1-4-алкил)метанимидамидил, N-гидроксиметанимидамидил или Het1.
4. Соединение по любому из пп.1-3, где
R1 представляет собой атом водорода, цианогруппу, галоген, аминокарбонил, гидроксикарбонил,
C1-4-алкилоксикарбонил, ариламинокарбонил, N-гидроксиметанимидамидил, моно- или ди(C1-4-алкил)метанимидамидил, Het1 или Het2; и
арил представляет собой фенил, необязательно замещенный одним или несколькими заместителями, каждый из которых отдельно выбран из группы, состоящей из C1-6-алкила, C1-4-алкоксигруппы, циано-, нитрогруппы; и
Het1 представляет собой 5-членную циклическую систему, где один, два, три или четыре элемента цикла представляют собой гетероатомы, каждый из которых отдельно и независимо друг от друга выбран из группы, состоящей из атома азота, кислорода и серы, и где остальные элементы цикла представляют собой атомы углерода; и, когда это возможно, любой атом азота как элемент цикла необязательно может быть замещен C1-4-алкилом; любой атом углерода как элемент цикла, каждый отдельно и независимо друг от друга необязательно может быть замещен заместителем, выбранным из группы, состоящей из C1-4-алкила, С3-7-циклоалкила, галогена, цианогруппы, трифторметила, циано-С1-4-алкила, моно- или ди(C1-4-алкил)аминогруппы, моно- или ди(C1-4-алкил)амино-С2-6-алкенила, изоксазолила, арила, гидроксикарбонила, C1-4-алкилоксикарбонила, оксо-, тиогруппы; и где названный выше изоксазолил может быть необязательно замещен C1-4-алкилом; и
Het2 представляет собой пиридил.
5. Соединение по любому из пп.1-4, где
R2 представляет собой атом водорода, C1-10-алкил, С2-10-алкенил, С3-7-циклоалкил или C1-10-алкил, замещенный заместителем, выбранным из группы, состоящей из цианогруппы, NR4aR4b, пирролидинила, пиперидинила, 4-(C1-4-алкил)пиперазинила, морфолинила, арила, имидазолила, пиридила, гидроксикарбонила, N(R4aR4b) карбонила, C1-4-алкилоксикарбонила или 4-(C1-4-алкил)пиперазин-1-илкарбонила;
R4a представляет собой C1-4-алкил;
R4b представляет собой C1-4-алкил или морфолинил, замещенный C1-4-алкилом.
6. Соединение по любому из пп.1-5, где
R2 представляет собой атом водорода, C1-10-алкил, С2-10-алкенил, С3-7-циклоалкил или C1-10-алкил, замещенный заместителем, выбранным из группы, состоящей из цианогруппы, NR4aR4b, плрролидинила, пиперидинила, 4-(C1-4-алкил)пиперазинила, морфолинила, арила, имидазолила, пиридила, гидроксикарбонила, N(R4aR4b)карбонила, C1-4-алкилоксикарбонила или 4-(C1-4-алкил)пиперазин-1-илкарбонила; и
арил представляет собой фенил, необязательно замещенный одним или несколькими заместителями, каждый из которых отдельно выбран из группы, состоящей из C1-6-алкила, C1-4-алкоксигруппы, циано-, нитрогруппы.
7. Соединение по любому из пп.1-6, где
R2 представляет собой атом водорода, C1-10-алкил, С2-10-алкенил, С3-7-циклоалкил или C1-10-алкил, замещенный заместителем, выбранным из группы, состоящей из цианогруппы, NR4aR4b, пирролидинила, пиперидинила, 4-(C1-4-алкил)пиперазинила, морфолинила, арила, имидазолила, пиридила, гидроксикарбонила, N(R4aR4b)карбонила, C1-4-алкилоксикарбонила или 4-(C1-4-алкил)пиперазин-1-илкарбонила; и
арил представляет собой фенил, необязательно замещенный одним или несколькими заместителями, каждый из которых отдельно выбран из группы, состоящей из C1-6-алкила, C1-4-алкоксигруппы, циано-, нитрогруппы; и
R4a представляет собой C1-4-алкил; и
R4b представляет собой C1-4-алкил или морфолинил, замещенный C1-4-алкилом.
8. Соединение по любому из пп.1-7, где
R3 представляет собой нитро-, циано-, аминогруппу, галоген, гидроксигруппу, C1-4-алкилоксигруппу, гидроксикарбонил, аминокарбонил, аминотиокарбонил, C1-4-алкилоксикарбонил, C1-4-алкилкарбонил, моно- или ди(C1-4-алкил)метанимидамидил, N-гидроксиметанимидамидил или Het1; и
Het1 представляет собой 5-членную циклическую систему, где один, два, три или четыре элемента цикла представляют собой гетероатомы, каждый из которых отдельно и независимо друг от друга выбран из группы, состоящей из атома азота, кислорода и серы, и где остальные элементы цикла представляют собой атомы углерода; и, когда это возможно, любой атом азота как элемент цикла необязательно может быть замещен C1-4-алкилом; любой атом углерода как элемент цикла, каждый отдельно и независимо друг от друга, необязательно может быть замещен заместителем, выбранным из группы, состоящей из C1-4-алкила, С3-7-циклоалкила, галогена, цианогруппы, трифторметила, циано-С1-4-алкила, моно- или ди(C1-4-алкил)аминогруппы, моно- или ди(C1-4-алкил)амино-С2-6-алкенила, изоксазолила, арила, гидроксикарбонила, C1-4-алкилоксикарбонила, оксо-, тиогруппы; и где названный выше изоксазолил может быть необязательно замещен С1-4-алкилом.
9. Соединение по любому из пп.1-8, где
n равно 1 или 2, более предпочтительно, где n равно 1; и
R1 представляет собой атом водорода, цианогруппу, галоген, аминокарбонил, гидроксикарбонил,
C1-4-алкилоксикарбонил, ариламинокарбонил, N-гидроксиметанимидамидил, моно- или ди(C1-4-алкил)метанимидамидил, Het1 или Het2; и
R2 представляет собой атом водорода, C1-10-алкил, С2-10-алкенил, С3-7-циклоалкил или C1-10-алкил, замещенный заместителем, выбранным из группы, состоящей из цианогруппы, NR4aR4b, пирролидинила, пиперидинила, 4-(C1-4-алкил)пиперазинила, морфолинила, арила, имидазолила, пиридила, гидроксикарбонила, N(R4aR4b)карбонила, С1-4-алкилоксикарбонила или 4-(C1-4-алкил)пиперазин-1-илкарбонила; и
R3 представляет собой нитро-, циано-, аминогруппу, галоген, гидроксигруппу, C1-4-алкилоксигруппу, гидроксикарбонил, аминокарбонил, аминотиокарбонил, C1-4-алкилоксикарбонил, C1-4-алкилкарбонил, моно- или ди(C1-4-алкил)метанимидамидил, N-гидроксиметанимидамидил или Het1.
10. Соединение по любому из пп.1-9, где соединение имеет формулу (II)
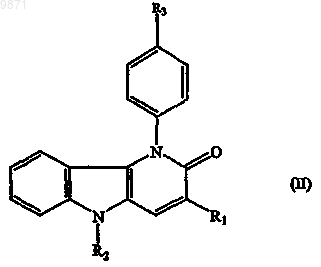
11. Соединение по любому из пп.1-10, где заместитель R3 представляет собой нитрогруппу.
12. Соединение по любому из пп.1-11, где заместитель R1 представляет собой цианогруппу.
13. Соединение по любому из пп.1-12, где заместитель R1 представляет собой C1-4-алкилоксикарбонил или C1-4-алкиламинокарбонил.
14. Соединение по любому из пп.1-13, где заместитель R2 представляет собой С2-6-алкил.
15. Соединение по любому из пп.1-14, где в соединении
n равно 1;
R1 представляет собой цианогруппу, галоген или оксадиазолил, необязательно замещенный заместителем, выбранным из группы, состоящей из C1-4-алкила, С2-6-алкенила, С3-7-циклоалкила, гидроксигруппы, C1-4-алкоксигруппы, амино-, цианогруппы, трифторметила, гидрокси-С1-4-алкила, циано-С1-4-алкила, моно- или ди(C1-4-алкил)аминогруппы, амино-С1-4-алкила, моно- или ди(C1-4-алкил)амино-С1-4-алкила, арил-С1-4-алкила, моно-С2-6-алкенила, моно- или ди(C1-4-алкил)амино-С2-6-алкенила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, сксадиазолила, тиадиазолила, триазолила, тетразолила, арила, гидроксикарбонила, аминокарбонила, C1-4-алкилоксикарбонила, моно- или ди(С1-4-алкил)аминокарбонила, C1-4-алкилкарбонила, оксо-, тиогруппы; и где любой названный выше фуранильный, тиенильный, пирролильный, оксазолильный, тиазолильный, имидазолильный, изоксазолильный, изотиазолильный, пиразолильный, оксадиазолильный, тиадиазолильный и триазолильный остаток может быть необязательно замещен C1-4-алкилом;
R2 представляет собой C1-6-алкил, атом водорода, С2-6-алкенил;
R3 представляет собой нитрогруппу, C1-6-алкил, необязательно замещенный пиперидинилом, пирролидинилом, N(R4aR4b), морфолинилом, пиридилом, цианогруппой, 4-(C1-4-алкил)пиперазин-1-илом.
16. Соединение по п.1, где соединение представляет собой
1-(4-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
5-метил-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
5-изобутил-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
5-аллил-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
5-бутил-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
5-этил-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитЁшы;
5-(2-морфолин-4-илэтил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
5-метил-1-(4-нитрофенил)-1,5-дигидропиридо[3,2-b]индол-2-он;
5-бут-3-енил-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
1-(4-нитрофенил)-2-оксо-5-(2-пирролидин-1-илэтил)-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
1-(4-нитрофенил)-2-оксо-5-(2-пиперидин-1-илэтил)-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
5-(3-диметиламинопропил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
3-бром-5-метил-1-(4-нитрофенил)-1,5-дигидропиридо[3,2-b]-индол-2-он;
5-метил-1-(3-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
1-(4-нитрофенил)-2-оксо-5-(3-пиперидин-1-илпропил)-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
5-(4-морфолин-4-илбутил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
1-(4-нитрофенил)-2-оксо-5-(4-пирролидин-1-илбутил)-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
5-[3-(4-метилпиперазин-1-ил)пропил]-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
5-цианометил-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
5-(3-морфолин-4-илпропил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
1-(4-нитрофенил)-2-оксо-5-(4-пиперидин-1-илбутил)-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
5-(4-диметиламинобутил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
1-(4-нитрофенил)-2-оксо-5-пиридин-4-илметил-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрил;
3-(5-трет-бутил-[1,2,4]оксадиазол-3-ил)-5-метил-1-(4-нитрофенил)-1,5-дигидропиридо[3,2-b]индол-2-он;
5-метил-1-(4-нитрофенил)-3-(5-трифторметил-[1,2,4]-оксадиазол-3-ил)-1,5-дигидропиридо[3,2-b]индол-2-он;
и его N-оксид, соль или стереоизомерную форму.
17. Лекарственное средство, обладающее противоинфекционными свойствами, включающее соединение формулы (I)

его N-оксид, соль, стереоизомерная форма, рацемическая смесь, пролекарство, сложный эфир и метаболит,
где n равно 1, 2 или 3;
R1 представляет собой атом водорода, цианогруппу, галоген, аминокарбонил, гидроксикарбонил,
C1-4-алкилоксикарбонил, C1-4-алкилкарбонил, моно- или ди(C1-4-алкил)аминокарбонил, ариламинокарбонил, N-(арил)-N-(C1-4-алкил)аминокарбонил, метанимидамидил, N-гидроксиметанимидамидил, моно- или ди(C1-4-алкил)метанимидамидил, Het1 или Het2;
R2 представляет собой атом водорода, C1-10-алкил, С2-10-алкенил, С3-7-циклоалкил, где указанные
C1-10-алкил, С2-10-алкенил и С3-7-циклоалкил, каждый отдельно и независимо друг от друга, может быть необязательно замещен заместителем, выбранным из группы, состоящей из цианогруппы, NR4aR4b, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(C1-4-алкил)пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила, 1,1-диоксотиоморфолинила, арила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, пиридила, пиримидинила, пиразинила, пиридазинила, триазинила, гидроксикарбонила, C1-4-алкилкарбонила, N(R4aR4b)карбонила, C1-4-алкилоксикарбонила, пирролидин-1-илкарбонила, пиперидин-1-илкарбонила, гомопиперидин-1-илкарбонила, пиперазин-1-илкарбонила, 4-(C1-4-алкил)пиперазин-1-илкарбонила, морфолин-1-илкарбонила, тиоморфолин-1-илкарбонила, 1-оксотиоморфолин-1-илкарбонила и 1,1-диоксотиоморфолин-1-илкарбонила;
R3 представляет собой нитро-, циано-, аминогруппу, галоген, гидроксигруппу, C1-4-алкилоксигруппу, гидроксикарбонил, аминокарбонил, C1-4-алкилоксикарбонил, моно- или ди(С1-4-алкил)аминокарбонил, C1-4-алкилкарбонил, метанимидамидил, моно- или ди(C1-4-алкил)метанимидамидил, N-гидроксиметанимидамидил или Het1;
R4a представляет собой атом водорода, C1-4-алкил или C1-4-алкил, замещенный заместителем, выбранным из группы, состоящей из амино-, моно- или ди(C1-4-алкил)аминогруппы, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(C1-4-алкил)пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила и 1,1-диоксотиоморфолинила;
R4b представляет собой атом водорода, C1-4-алкил или C1-4-алкил, замещенный заместителем, выбранным из группы, состоящей из амино-, моно- или ди(C1-4-алкил)аминогруппы, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(C1-4-алкил)пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила и 1,1-диоксотиоморфолинила;
арил представляет собой фенил, необязательно замещенный одним или несколькими заместителями, каждый из которых отдельно выбран из группы, состоящей из C1-6-алкила, C1-4-алкоксигруппы, галогена, гидрокси-, аминогруппы, трифторметила, циано-, нитрогруппы, гидрокси-С1-6-алкила, циано-С1-6-алкила, моно- или ди(C1-4-алкил)аминогруппы, амино-С1-4-алкила, моно- или ди(C1-4-алкил)амино-С1-4-алкила;
Het1 представляет собой 5-членную циклическую систему, где один, два, три или четыре элемента цикла представляют собой гетероатомы, каждый из которых отдельно и независимо друг от друга выбран из группы, состоящей из атома азота, кислорода и серы, и где остальные элементы цикла представляют собой атомы углерода; и, когда это возможно, любой атом азота как элемент цикла необязательно может быть замещен C1-4-алкилом; любой атом углерода как элемент цикла, каждый отдельно и независимо друг от друга необязательно может быть замещен заместителем, выбранным из группы, состоящей из C1-4-алкила, С2-6-алкенила, С3-7-циклоалкила, гидроксигруппы, C1-4-алкоксигруппы, галогена, амино-, цианогруппы, трифторметила, гидрокси-С1-4-алкила, циано-С1-4-алкила, моно- или ди(C1-4-алкил)аминогруппы, амино-С1-4-алкила, моно- или ди(C1-4-алкил)амино-С1-4-алкила, арил-С1-4-алкила, амино-С2-6-алкенила, моно- или ди(C1-4-алкил)амино-С2-6-алкенила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, арила, гидроксикарбонила, аминокарбонила, C1-4-алкилоксикарбонила, моно- или ди(С1-4-алкил)аминокарбонила, C1-4-алкилкарбонила, оксо-, тиогруппы; и где любой названный выше фуранильный, тиенильный, пирролильный, оксазолильный, тиазолильный, имидазолильный, изоксазолильный, изотиазолильный, пиразолильный, оксадиазолильный, тиадиазолильный и триазолильный остаток может быть необязательно замещен C1-4-алкилом;
Het2 представляет собой пиридил, пиримидинил, пиразинил, пиридазинил или триазинил, где любой атом углерода как элемент цикла каждого из указанных 6-членных содержащих атом азота ароматических циклов может быть необязательно замещен заместителем, выбранным из группы, состоящей из С1-4-алкила.
18. Лекарственное средство по п.17, где в соединении I заместитель R1 представляет собой цианогруппу,C1-4-алкилоксикарбонил или C1-4-алкиламинокарбонил; заместитель R2 представляет собой атом водорода или C1-6-алкил.
19. Лекарственное средство по п.17 или 18, где соединение имеет формулу (II)

20. Лекарственное средство по любому из пп.17-19, где заместитхыь R1 представляет собой цианогруппу, метилоксикарбонил, метиламинокарбонил, этиламинокарбонил, этилоксикарбонил.
21. Лекарственное средство по любому из пп.17-20, где заместитель R2 представляет собой атом водорода или метил.
22. Лекарственное средство по любому из пп.17-21, где заместитель R1 представляет собой цианогруппу, а заместитель R2 представляет собой атом водорода или метил.
23. Применение соединения формулы (I), описанное в любом из пп.17-22, для получения лекарственного средства для профилактики, или лечения, или борьбы с инфекцией или заболеванием, связанным с инфекцией вирусом ВИЧ.
24. Применение соединения формулы (I), описанное в любом из пп.17-22, для получения лекарственного средства для ингибирования репликации вируса ВИЧ.
25. Применение соединения формулы (I) по п.23 или 24, отличающееся тем, что обратная транскриптаза вируса ВИЧ является мутантом.
26. Фармацевтическая композиция, содержащая эффективное количество по меньшей мере одного соединения формулы (I) по любому из пп.1-16 или описанное в п.17 и фармацевтически приемлемый наполнитель.
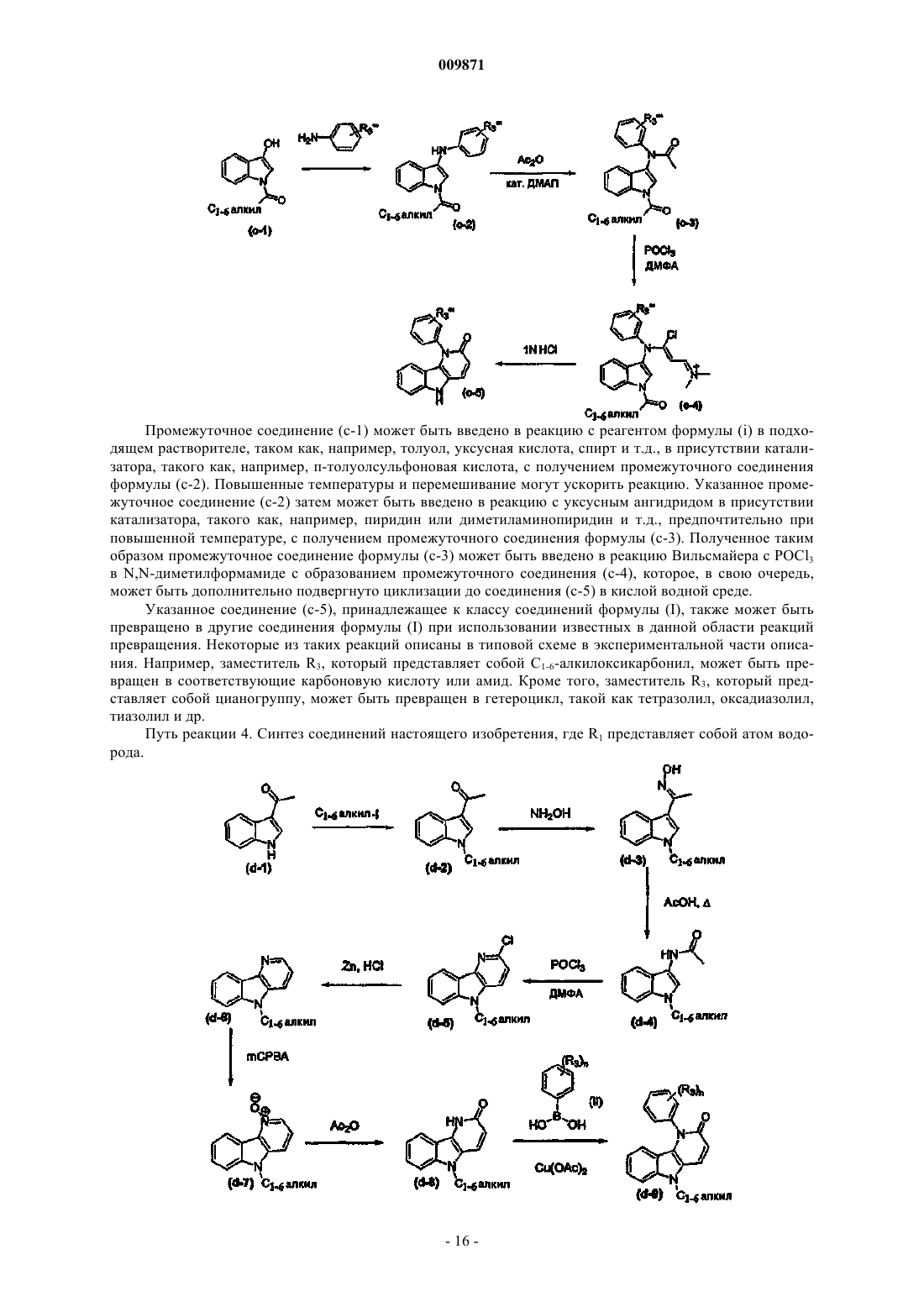
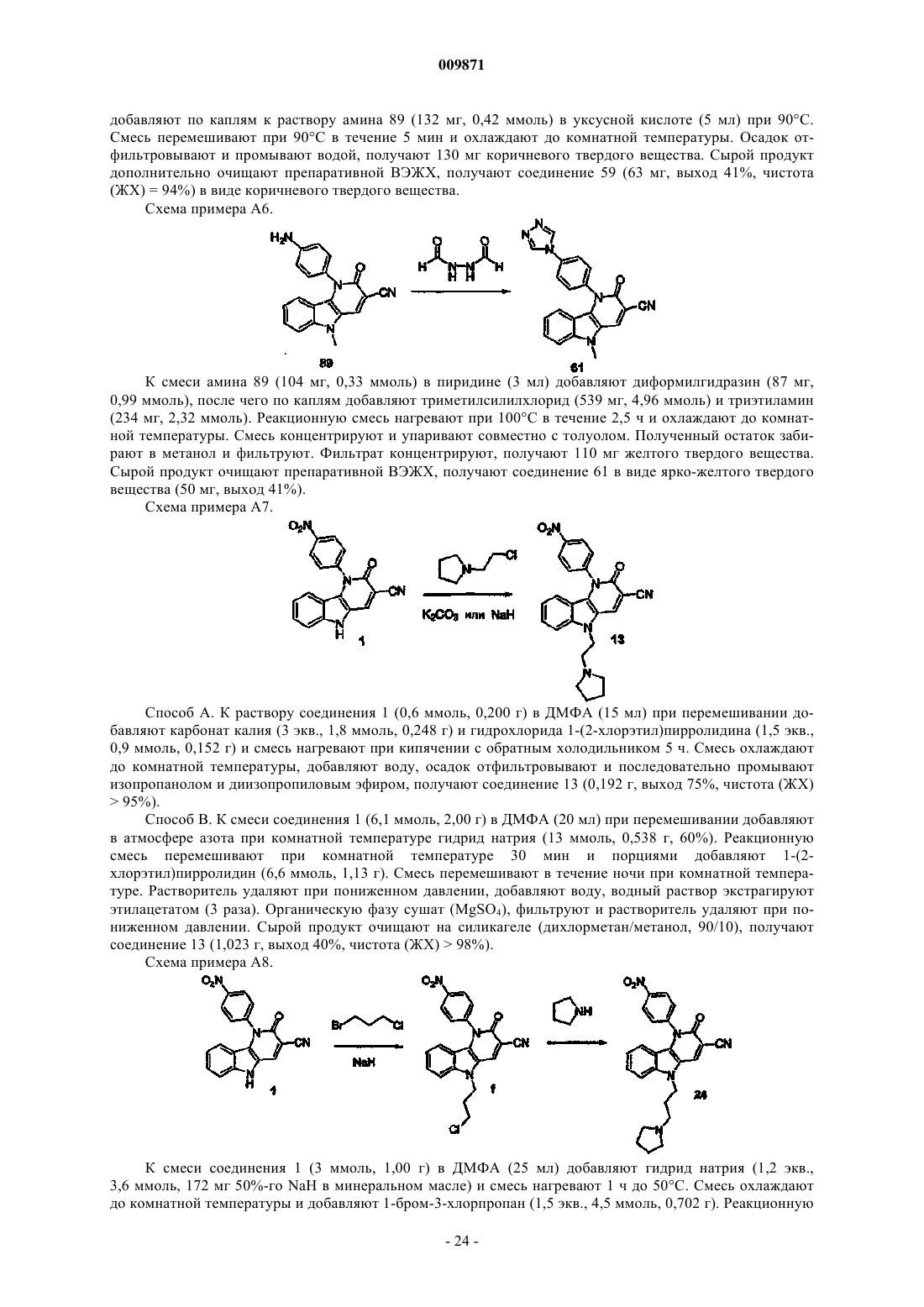
Текст
009871 Настоящее изобретение относится к применению замещенного индолпиридиния в качестве противоинфекционных соединений и к фармацевтическим композициям и содержащим их диагностическим наборам. Настоящее изобретение также относится к комбинациям замещенных индолпиридиниевых соединений настоящего изобретения с другим антиретровирусным агентом. Изобретение также относится к их применению при анализах в качестве эталонных соединений или в качестве реагентов. Вирус, вызывающий синдром приобретенного иммунодефицита (СПИД), известен под различными названиями, в том числе вирус Т-лимфоцитов (III) (HTLV-III), или связанный с лимфаденопатией вирус(LAV), или связанный со СПИД вирус (ARV) или вирус иммунодефицита человека (ВИЧ, HIV). До настоящего времени идентифицировано два разных семейства, т.е. ВИЧ-1 и ВИЧ-2. В дальнейшем сокращение ВИЧ будет использоваться для общего обозначения этих вирусов. Больных СПИДом в настоящее время лечат с помощью ингибиторов протеазы ВИЧ (PI), нуклеозидных ингибиторов обратной транскриптазы (NRTI), ненуклеозидных ингибиторов обратной транскриптазы(NNRTI) и нуклеотидных ингибиторов обратной транскриптазы (NtRTI). Названные соединения часто вводят в лекарственных коктейлях, содержащих два или несколько соединений из приведенных выше классов лекарственных средств. Несмотря на тот факт, что такие антиретровирусные агенты являются весьма полезными, они имеют общее ограничение, а именно ферменты-мишени в вирусе ВИЧ способны мутировать таким образом, что известные лекарства становятся менее эффективны или даже не эффективны против таких вирусов-мутантов ВИЧ. Или, другими словами, вирус ВИЧ обнаруживает все возрастающую устойчивость к доступным лекарственным средствам. Устойчивость ретровирусов и в особенности вируса ВИЧ к ингибиторам является основной причиной отсутствия успеха при лечении. Например, половина пациентов, получающих комбинированное лечение против ВИЧ, совершенно не реагирует на лечение, главным образом, из-за устойчивости вируса к одному или нескольким используемым лекарствам. Более того, показано, что устойчивость вируса переносится к вновь инфицированным индивидуумам, что приводит к жестко ограниченным выборам при лечении для таких не подвергавшихся воздействию лекарства больных. Таким образом, существует потребность в новых соединениях для ретровирусного лечения, и особенно для лечения СПИДа. Такая потребность особенно актуальна в случае соединений, которые активны не только на исходном типе вируса ВИЧ, но также на все более и более распространенных устойчивых вирусах ВИЧ. Известные антиретровирусные средства, часто вводимые в схемах комбинированного лечения, будут в конечном итоге вызывать устойчивость, как показано выше. Такое положение часто может заставлять врача повышать концентрации активных лекарств в плазме, чтобы указанные антиретровирусные средства сохранили эффективность против вирусов-мутантов ВИЧ. Следствием этого является весьма нежелательное повышение лекарственного бремени. Повышенные концентрации в плазме также могут привести к увеличению риска несоблюдения предписанного лечения. Используемые в настоящее время коммерчески доступные ингибиторы обратной транскриптазы ВИЧ принадлежат к трем различным классам: NRTI, такие как зидовудин, диданозин, зальцибатин, ставудин, абакавир и ламивудин, NtRTI, такие как тенофовир, и NNRTI, такие как невирапин, делавирдин и эфавиренз. NRTI и NtRTI являются основными аналогами, которые атакуют активный сайт обратной транскриптазы (RT) ВИЧ. Используемые в настоящее время NNRTI известны в случае быстрого проявления устойчивости из-за мутаций на аминокислотах, которые окружают участок связывания NNRTI(J AIDS 2001, 26, S25-S33). Таким образом, в медицине существует большая потребность в противоинфекционных соединениях, которые атакуют обратную транскриптазу ВИЧ, в особенности в антиретровирусных соединениях,которые способны задерживать появление устойчивости и которые можно использовать при борьбе с широким спектром вирусов-мутантов ВИЧ. В публикациях WO 02/055520 и WO 02/059123 описаны бензоилалкилиндолпиридиниевые соединения в качестве антивирусных соединений. Рябова с соавторами представила синтез некоторых бензоилалкилиндолпиридиниевых соединений (Russian Chem. Bull., 2001, 50(8), 1449-1456) (Chem. Heterocycl.Compd. (Engl. Translat.) 36, 3, 2000, 301-306; Химия гетероциклических соединений; RU, 3, 2000; 362367). В настоящее время установлено, что замещенные индолпиридиниевые соединения формулы (I)R1 представляет собой атом водорода, цианогруппу, галоген, аминокарбонил, гидроксикарбонил,С 1-4-алкилоксикарбонил, С 1-4-алкилкарбонил, моно- или ди(С 1-4-алкил)аминокарбонил, ариламинокарбонил, N-(арил)-N-(С 1-4-алкил)аминокарбонил, метанимидамидил, N-гидроксиметанимидамидил, моно- или ди(С 1-4-алкил)метанимидамидил, Het1 или Het2;R2 представляет собой атом водорода, C1-10-алкил, С 2-10-алкенил, С 3-7-циклоалкил, где указанныеC1-10-алкил, С 2-10-алкенил и С 3-7-циклоалкил каждый отдельно и независимо друг от друга может быть необязательно замещен заместителем, выбранным из группы, состоящей из цианогруппы, NR4aR4b, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(C1-4-алкил)пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила, 1,1-диоксотиоморфолинила, арила, фуранила, тиенила,пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, пиридила, пиримидинила, пиразинила, пиридазинила, триазинила, гидроксикарбонила, C1-4-алкилкарбонила, N(R4aR4b)карбонила, C1-4-алкилоксикарбонила, пирролидин-1-илкарбонила,пиперидин-1-илкарбонила,гомопиперидин-1-илкарбонила,пиперазин-1 илкарбонила, 4-(C1-4-алкил)пиперазин-1-илкарбонила, морфолин-1-илкарбонила, тиоморфолин-1 илкарбонила, 1-оксотиоморфолин-1-илкарбонила и 1,1-диоксотиоморфолин-1-илкарбонила;R4a представляет собой атом водорода, C1-4-алкил или C1-4-алкил, замещенный заместителем, выбранным из группы, состоящей из амино-, моно- или ди(C1-4-алкил)аминогруппы, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(C1-4-алкил)пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила и 1,1-диоксотиоморфолинила;R4b представляет собой атом водорода, C1-4-алкил или C1-4-алкил, замещенный заместителем, выбранным из группы, состоящей из амино-, моно- или ди(C1-4-алкил)аминогруппы, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(C1-4-алкил)пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила и 1,1-диоксотиоморфолинила; арил представляет собой фенил, необязательно замещенный одним или несколькими заместителями, каждый из которых отдельно выбран из группы, состоящей из C1-6-алкила, C1-4-алкоксигруппы, галогена, гидрокси-, аминогруппы, трифторметила, циано-, нитрогруппы, гидрокси-C1-6-алкила, циано-C1-6 алкила, моно- или ди(C1-4-алкил)аминогруппы, амино-C1-4-алкила, моно- или ди(C1-4-алкил)амино-C1-4 алкила;Het1 представляет собой 5-членную циклическую систему, где один, два, три или четыре элемента цикла представляют собой гетероатомы, каждый из которых отдельно и независимо друг от друга выбран из группы, состоящей из атома азота, кислорода и серы, и где остальные элементы цикла представляют собой атомы углерода; и, когда это возможно, любой атом азота как элемент цикла необязательно может быть замещен C1-4-алкилом; любой атом углерода как элемент цикла, каждый отдельно и независимо друг от друга необязательно может быть замещен заместителем, выбранным из группы, состоящей из C1-4-алкила, С 2-6-алкенила, С 3-7-циклоалкила, гидрокси-, C1-4-алкоксигруппы, галогена, амино-, цианогруппы, трифторметила, гидрокси-C1-4-алкила, циано-C1-4-алкила, моно- или ди(C1-4-алкил)аминогруппы,амино-C1-4-алкила, моно- или ди(C1-4-алкил)амино-C1-4-алкила, арил-C1-4-алкила, амино-С 2-6-алкенила,моно- или ди(C1-4-алкил)амино-С 2-6-алкенила, фуранила, тиенила, пирролила, оксазолила, тиазолила,имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, арила, гидроксикарбонила, аминокарбонила, C1-4-алкилоксикарбонила, моно- или ди(C1-4 алкил)аминокарбонила, C1-4-алкилкарбонила, оксо-, тиогруппы; и где любой названный выше фуранильный, тиенильный, пирролильный, оксазолильный, тиазолильный, имидазолильный, изоксазолильный,изотиазолильный, пиразолильный, оксадиазолильный, тиадиазолильный и триазолильный остаток может быть необязательно замещен C1-4-алкилом;Het2 представляет собой пиридил, пиримидинил, пиразинил, пиридазинил или триазинил, где любой атом углерода как элемент цикла каждого из указанных 6-членных содержащих атом азота ароматических циклов может быть необязательно замещен заместителем, выбранным из группы, состоящей изC1-4-алкила; ингибируют репликацию вируса ВИЧ. В одном из вариантов осуществления изобретение относится к ингибированию репликации вируса ВИЧ с помощью замещенных индолпиридиниевых соединений формулы (I), где R1 представляет собой цианогруппу, C1-4-алкиламинокарбонил или C1-4-алкилоксикарбонил; R2 представляет собой атом водорода или С 1-6-алкил; n равно 1 и R3 представляет собой нитрогруппу. Соединения формулы (I) активны против исходного типа вируса ВИЧ, а также против ряда вирусов-мутантов ВИЧ, включая вирусы-мутанты ВИЧ, проявляющие устойчивость к коммерчески доступным ингибиторам обратной транскриптазы (RT). Соединения формулы (I), таким образом, могут приме-2 009871 няться в качестве лекарственного средства, и, следовательно, также могут применяться при получении лекарственного средства, полезного для профилактики, лечения инфекции или заболевания или для борьбы с инфекцией или заболеванием, связанными с ВИЧ-инфекцией. Подгруппа соединений формулы (I) считается новой и включает соединения формулы (I), при условии, что они отличаются от 2,5-дигидро-1-(4-нитрофенил)-2-оксо-1 Н-пиридо[3,2-b]индол-3-карбонитрила и 2,5-дигидро-5-метил-1-(4-нитрофенил)-2-оксо-1 Н-пиридо[3,2-b]индол-3-карбонитрила. Таким образом, настоящее изобретение также относится к соединениям формулы (I), имеющим формулуR1 представляет собой атом водорода, цианогруппу, галоген, аминокарбонил, гидроксикарбонил,C1-4-алкилоксикарбонил, C1-4-алкилкарбонил, моно- или ди(C1-4-алкил)аминокарбонил, ариламинокарбонил, N-(арил)-N-(C1-4-алкил)аминокарбонил, метанимидамидил, N-гидроксиметанимидамидил, моно- или ди(C1-4-алкил)метанимидамидил, Het1 или Het2;R2 представляет собой атом водорода, C1-10-алкил, С 2-10-алкенил, С 3-7-циклоалкил, где указанныеC1-10-алкил, С 2-10-алкенил и С 3-7-циклоалкил каждый отдельно и независимо друг от друга может быть необязательно замещен заместителем, выбранным из группы, состоящей из цианогруппы, NR4aR4b, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(C1-4-алкил)пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила, 1,1-диоксотиоморфолинила, арила, фуранила, тиенила,пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, пиридила, пиримидинила, пиразинила, пиридазинила, триазинила, гидроксикарбонила, C1-4-алкилкарбонила, N(R4aR4b)карбонила, C1-4-алкилоксикарбонила, пирролидин-1-илкарбонила,пиперидин-1-илкарбонила,гомопиперидин-1-илкарбонила,пиперазин-1 илкарбонила, 4-(C1-4-алкил)пиперазин-1-илкарбонила, морфолин-1-илкарбонила, тиоморфолин-1 илкарбонила, 1-оксотиоморфолин-1-илкарбонила и 1,1-диоксотиоморфолин-1-илкарбонила;R4a представляет собой атом водорода, C1-4-алкил или C1-4-алкил, замещенный заместителем, выбранным из группы, состоящей из амино-, моно- или ди(C1-4-алкил)аминогруппы, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(C1-4-алкил)пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила и 1,1-диоксотиоморфолинила;R4b представляет собой атом водорода, C1-4-алкил или C1-4-алкил, замещенный заместителем, выбранным из группы, состоящей из амино-, моно- или ди(C1-4-алкил)аминогруппы, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(C1-4-алкил)пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила и 1,1-диоксотиоморфолинила; арил представляет собой фенил, необязательно замещенный одним или несколькими заместителями, каждый из которых отдельно выбран из группы, состоящей из C1-6-алкила, C1-4-алкоксигруппы, галогена, гидрокси-, аминогруппы, трифторметила, циано-, нитрогруппы, гидрокси-C1-6-алкила, циано-С 1-6 алкила, моно- или ди(C1-4-алкил)аминогруппы, амино-C1-4-алкила, моно- или ди(C1-4-алкил)амино-С 1-4 алкила;Het1 представляет собой 5-членную циклическую систему, где один, два, три или четыре элемента цикла представляют собой гетероатомы, каждый из которых отдельно и независимо друг от друга выбран из группы, состоящей из атома азота, кислорода и серы, и где остальные элементы цикла представляют собой атомы углерода; и, когда это возможно, любой атом азота как элемент цикла необязательно может быть замещен C1-4-алкилом; любой атом углерода как элемент цикла, каждый отдельно и независимо друг от друга необязательно может быть замещен заместителем, выбранным из группы, состоящей из C1-4-алкила, С 2-6-алкенила, С 3-7-циклоалкила, гидроксигруппы, C1-4-алкоксигруппы, галогена, амино-,-3 009871 цианогруппы, трифторметила, гидрокси-С 1-4-алкила, циано-С 1-4-алкила, моно- или ди(С 1-4 алкил)аминогруппы, амино-С 1-4-алкила, моно- или ди(С 1-4-алкил)амино-С 1-4-алкила, арил-С 1-4-алкила,амино-С 2-6-алкенила, моно- или ди(C1-4-алкил)амино-С 2-6-алкенила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила,триазолила, тетразолила, арила, гидроксикарбонила, аминокарбонила, C1-4-алкилоксикарбонила, моноили ди(С 1-4-алкил)аминокарбонила, C1-4-алкилкарбонила, оксо-, тиогруппы; и где любой названный выше фуранильный, тиенильный, пирролильный, оксазолильный, тиазолильный, имидазолильный, изоксазолильный, изотиазолильный, пиразолильный, оксадиазолильный, тиадиазолильный и триазолильный остаток может быть необязательно замещен C1-4-алкилом;Het2 представляет собой пиридил, пиримидинил, пиразинил, пиридазинил или триазинил, где любой атом углерода как элемент цикла каждого из указанных 6-членных содержащих атом азота ароматических циклов может быть необязательно замещен заместителем, выбранным из группы, состоящей изC1-4-алкила; при условии, что соединения отличаются от 2,5-дигидро-1-(4-нитрофенил)-2-оксо-1 Н-пиридо[3,2-b]индол-3-карбонитрила и 2,5-дигидро-5-метил-1-(4-нитрофенил)-2-оксо-1 Н-пиридо[3,2-b]индол-3-карбонитрила. В одном из вариантов осуществления изобретение относится к соединениям формулы (I), их Nоксидам, солям, стереоизомерным формам, рацемическим смесям, пролекарствам, сложным эфирам и метаболитам, где R1 представляет собой цианогруппу, C1-4-алкиламинокарбонил или C1-4 алкилоксикарбонил; R2 представляет собой атом водорода или C1-6-алкил; n равно 1 и R3 представляет собой нитрогруппу; при условии, что соединение отличается от 2,5-дигидро-1-(4-нитрофенил)-2-оксо 1 Н-пиридо[3,2-b]индол-3-карбонитрила и 2,5-дигидро-5-метил-1-(4-нитрофенил)-2-оксо-1 Н-пиридо[3,2b]индол-3-карбонитрила. Определение "C1-4-алкил" как группа или часть группы означает линейные и разветвленные насыщенные углеводородные радикалы, содержащие от 1 до 4 атомов углерода, такие как, например, метил,этил, пропил, бутил, 2-метилпропил и т.д. Определение "C1-6-алкил" как группа или часть группы означает линейные и разветвленные насыщенные углеводородные радикалы, содержащие от 1 до 6 атомов углерода, такие как, например, группы,определенные для C1-4-алкила, и пентил, гексил, 2-метилбутил, 3-метилпентил и т.д. Определение "С 2-6-алкил" как группа или часть группы означает линейные и разветвленные насыщенные углеводородные радикалы, содержащие от 2 до 6 атомов углерода, такие как, например, этил,пропил, бутил, 2-метилпропил, пентил, гексил, 2-метилбутил, 3-метилпентил и т.д. Определение "C1-10-алкил" как группа или часть группы означает линейные и разветвленные насыщенные углеводородные радикалы, содержащие от 1 до 10 атомов углерода, такие как, например, группы, определенные для C1-6-алкила, и гептил, октил, нонил, децил и т.д. Определение "С 2-6-алкенил" как группа или часть группы означает линейные и разветвленные углеводородные радикалы, содержащие насыщенные углерод-углеродные связи и по меньшей мере одну двойную связь, и содержащие от 2 до 6 атомов углерода, такие как, например, этенил, проп-1-енил, бут 1-енил, бут-2-енил, пент-1-енил, пент-2-енил, гекс-1-енил, гекс-2-енил, гекс-3-енил, 1-метилпент-2-енил и т.д. Определение "С 2-10-алкенил" как группа или часть группы означает линейные и разветвленные углеводородные радикалы, содержащие насыщенные углерод-углеродные связи и по меньшей мере одну двойную связь, и содержащие от 2 до 10 атомов углерода, такие как, например, группы, определенные для С 2-6-алкенила, и гепт-1-енил, гепт-2-енил, гепт-3-енил, окт-1-енил, окт-2-енил, окт-3-енил, нон-1 енил, нон-2-енил, нон-3-енил, нон-4-енил, дец-1-енил, дец-2-енил, дец-3-енил, дец-4-енил, 1-метилпент 2-енил и т.д. Определение "С 3-7-циклоалкил" является общим для циклопропила, циклобутила, циклопентила,циклогексила и циклогептила. Определение "галоген" является общим для фтора, хлора, брома и йода. Определение "метанимидамидил" представляет собой название радикала для H2N-CH=NH по номенклатуре Chemical Abstracts (CAS). Аналогично N-гидроксиметанимидамидил является названием радикала по CAS для H2N-CH=N-OH. Определение "С 6-14-арил" означает ароматический углеводородный цикл, содержащий от 6 до 14 элементов в цикле, такой как, например, фенил, нафталин, антрацен и фенантрен. Следует отметить, что различные изомеры разных циклов могут существовать в рамках определений, которые используются по всему описанию. Например, оксадиазолил может представлять собой 1,2,4-оксадиазолил, 1,3,4 оксадиазолил или 1,2,3-оксадиазолил; аналогично для тиадиазолила, который может представлять собой 1,2,4-тиадиазолил, 1,3,4-тиадиазолил или 1,2,3-тиадиазолил; и для пирролила, который может представлять собой 1 Н-пирролил или 2 Н-пирролил. Следует отметить, что положения радикалов на любом фрагменте молекулы, используемые в определениях, могут быть в любом месте на таком фрагменте, пока он является химически стабильным. Например, пиридил включает 2-пиридил, 3-пиридил и 4-пиридил; пентил включает 1-пентил, 2-пентил и 3 пентил.-4 009871 Когда любая переменная (например, галоген или C1-4-алкил) встречается более одного раза в любой составляющей, каждое определение является независимым. Определение "пролекарство", используемое по всему тексту, означает фармацевтически приемлемые производные, такие как сложные эфиры, амиды и фосфаты, так что полученный при биотрансформации in vivo этого производного продукт является активным лекарством, которое определено соединениями формулы (I). Таким образом, в качестве ссылки включена публикация Goodman and Cilman (ThePharmacological Basis of Therapeutics, 8-th ed., McGraw-Hill, Int. Ed. 1992, "Biotransformation of Drugs",p. 13-15), описывающая пролекарства в целом. Пролекарства соединения настоящего изобретения получены модификацией функциональных групп, присутствующих в соединении, таким образом, что модификации расщепляются до исходного соединения или с помощью рутинной манипуляции или in vivo. Пролекарства отличаются прекрасной растворимостью в воде, повышенной биодоступностью и легко метаболизируют in vivo до активных ингибиторов. В случае терапевтического применения соли соединений формулы (I) представляют собой соли, в которых противоион является фармацевтически или физиологически приемлемым. Однако соли, содержащие фармацевтически неприемлемый противоион, также могут найти применение, например, при получении или очистке фармацевтически приемлемого соединения формулы (I). Все соли, независимо от того, являются ли они фармацевтически приемлемыми или нет, входят в объем настоящего изобретения. Фармацевтически приемлемые или физиологически переносимые аддитивные солевые формы, которые соединения настоящего изобретения способны образовывать, могут быть легко получены с использованием подходящих кислот, таких как, например, неорганические кислоты, такие как галогенводородные кислоты, например, соляная кислота или бромисто-водородная кислота; серная, гемисерная,азотная, фосфорная кислота и другие подобные кислоты; или органические кислоты, такие как, например, уксусная, аспарагиновая, додецилсерная, гептановая, гексановая, никотиновая, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная, малеиновая, фумаровая, яблочная,винная,лимонная,метансульфоновая,этансульфоновая,бензолсульфоновая,птолуолсульфоновая, цикламиновая, салициловая, п-аминосалициловая, памовая кислота и другие подобные кислоты. И, наоборот, указанные кислотно-аддитивные солевые формы могут быть превращены путем обработки подходящим основанием в форму свободного основания. Соединения формулы (I), содержащие кислый протон, также могут быть превращены в их нетоксичную аддитивную солевую форму с металлом или амином путем обработки подходящими органическими и неорганическими основаниями. Подходящие основные солевые формы включают, например,аммониевые соли, соли щелочных и щелочно-земельных металлов, например, соли лития, натрия, калия,магния, кальция и т.д., соли с органическими основаниями, например, соли с бензатином, N-метил-Dглюкамином, гидрабаминные соли и соли с аминокислотами, такими как, например, аргинин, лизин и т.д. И, наоборот, указанные основно-аддитивные солевые формы могут быть превращены путем обработки подходящей кислотой в форму свободной кислоты. Определение "соль" также включает гидраты и аддитивные формы с растворителями, которые соединения настоящего изобретения способны образовывать. Примерами таких форм являются, например,гидраты, алкоголяты и т.д.N-Оксидные формы соединений настоящего изобретения, как подразумевается, включают соединения формулы (I), где один или несколько атомов азота окислены до так называемого N-оксида. Соединения настоящего изобретения также могут существовать в их таутомерных формах. Такие формы, хотя и не указаны в явном виде в приведенной выше формуле, входят в объем настоящего изобретения. Например, в рамках определения Het 5-членный ароматический гетероцикл, такой как, например, 1,2,4-оксадиазол, может быть замещен гидрокси- или тиогруппой в положении 5, находясь, таким образом, в равновесии со своей таутомерной формой, как это показано ниже. Определение "стереохимически изомерные формы" соединений настоящего изобретения, которое использовалось в описании ранее, определяет все возможные соединения, составленные из тех же самых атомов, связанных в той же последовательности связей, но имеющие различные трехмерные структуры,которые не являются взаимно заменяемыми и которые соединения настоящего изобретения могут иметь. Если не оговорено или не указано особо, химическое обозначение соединения охватывает смесь всех возможных стереохимически изомерных форм, которые могут иметь указанные соединения. Ука-5 009871 занная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Все стереохимически изомерные формы соединений настоящего изобретения как в чистой форме, так и в смеси друг с другом, как подразумевается, входят в объем настоящего изобретения. Чистые стереоизомерные формы соединений и промежуточных соединений, которые упоминаются в описании, определяют как изомеры, по существу, не содержащие других энантиомерных или диастереомерных форм той же самой основной молекулярной структуры указанных соединений или промежуточных соединений. В частности, определение "стереоизомерно чистое" относится к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток по меньшей мере от 80% (т.е. минимально 90% одного изомера и максимально 10% других возможных изомеров) и вплоть до стереоизомерного избытка 100% (т.е. 100% одного изомера и отсутствие других изомеров), более предпочтительно, соединения или промежуточные соединения, имеющие стереоизомерный избыток от 90% и вплоть до 100%, и даже более предпочтительно, имеющие стереоизомерный избыток от 94% и вплоть до 100%, и наиболее предпочтительно, имеющие стереоизомерный избыток от 97 до 100%. Определения "энантиомерно чистое" и "диастереомерно чистое" следует понимать аналогичным образом, но относительно энантиомерного избытка и соответственно диастереомерного избытка рассматриваемой смеси. Чистые стереоизомерные формы соединений и промежуточных соединений настоящего изобретения могут быть получены с помощью известных в данной области методик. Например, энантиомеры могут быть отделены друг от друга селективной кристаллизацией их диастереомерных солей с оптически активными кислотами или основаниями. Примерами таких реагентов являются винная кислота, дибензоилвинная кислота, дитолуилвинная кислота и камфорсульфоновая кислота. С другой стороны, энантиомеры могут быть разделены с помощью хроматографических методик с использованием хиральных стационарных фаз. Указанные чистые стереохимически изомерные формы также могут быть получены из соответствующих чистых стехиометрически изомерных форм подходящих исходных материалов, при условии, что реакция протекает стереоспецифично. Предпочтительно, если требуется конкретный стереоизомер, указанное соединение может быть синтезировано стереоспецифическими способами получения. В указанных способах преимущественно будут использоваться этантиомерно чистые исходные материалы. Диастереомерные рацематы формулы (I) могут быть получены отдельно с помощью обычных способов. Подходящими физическими способами разделения, которые могут быть успешно использованы,являются, например, селективная кристаллизация и хроматография, например, колоночная хроматография. Настоящее изобретение, как подразумевается, включает все изотопы атомов, присутствующих в рассматриваемых соединениях. Изотопы представляют собой атомы, имеющие тот же самый атомный номер, но различные массовые номера. Как общий пример и без ограничения, изотопы водорода включают тритий и дейтерий. Изотопами углерода являются С-13 и С-14. Везде по всему описанию определение "соединения формулы (I)", или "соединения настоящего изобретения", или аналогичное определение, как подразумевается, включает соединенияобщей формулы(I), их N-оксиды, соли, стереоизомерные формы, рацемические смеси, пролекарства, сложные эфиры и метаболиты, а также их аналоги с четвертичным атомом азота. Представляющую интерес подгруппу соединений формулы (I) или любой их подгруппы составляют N-оксиды, соли и все стереоизомерные формы соединений формулы (I). В одном из вариантов осуществления изобретения n равно 1 и группа R3 на фенильном кольце в соединении формулы (I) находится в пара-положении относительно атома азота в конденсированном пиридиновом фрагменте, как изображено ниже и далее везде для соединений формулы (II) Представляющую интерес подгруппу соединений формулы (II) составляют соединения формулы(II), далее называемые соединениями формулы (II-а), где заместитель R3 представляет собой нитрогруппу. Отдельную группу соединений составляют соединения формулы (I), где заместитель R1 представляет собой цианогруппу, метилоксикарбонил, метиламинокарбонил, этилоксикарбонил и этиламинокарбо-6 009871 нил, более предпочтительно, где заместитель R1 представляет собой цианогруппу, этилоксикарбонил и этиламинокарбонил, даже более предпочтительно, где заместитель R1 представляет собой цианогруппу. Другую отдельную группу соединений составляют соединения формулы (I), где заместитель R2 представляет собой атом водорода или C1-4-алкил, более предпочтительно, где заместитель R2 представляет собой атом водорода или метил, даже более предпочтительно, где заместитель R2 представляет собой метил. Еще одну отдельную группу соединений составляют соединения формулы (I), где заместитель R1 представляет собой цианогруппу и заместитель R2 представляет собой атом водорода или метил. Отдельную группу новых соединений составляют соединения формулы (I), где заместитель R1 представляет собой C1-4-алкиламинокарбонил или С 1-4-алкилоксикарбонил. Другую отдельную группу новых соединений составляют соединения формулы (I), где заместительR1 представляет собой C1-4-алкиламинокарбонил или C1-4-алкилоксикарбонил и заместитель R2 представляет собой атом водорода или метил. Другую отдельную группу новых соединений составляют соединения формулы (I), где заместительR1 представляет собой метилоксикарбонил, метиламинокарбонил, этилоксикарбонил или этиламинокарбонил и заместитель R2 представляет собой атом водорода или метил. Другую отдельную группу новых соединений составляют соединения формулы (I), где заместительR2 представляет собой С 2-6-алкил. Другую отдельную группу новых соединений составляют соединения формулы (I), где когда заместитель R1 представляет собой цианогруппу, заместитель R2 отличается от атома водорода или метила. Еще одну отдельную группу новых соединений составляют соединения формулы (I), где заместитель R2 представляет собой атом водорода или C1-4-алкил, и нитрогруппа на фенильном кольце находится в орто- или мета-положении относительно атома азота в конденсированном пиридиновом фрагменте. Подходящую группу соединений составляют соединения формулы (I) в виде соли, где соль выбрана из трифторацетата, фумарата, хлорацетата, метансульфоната, оксалата, ацетата и цитрата. Представляющую интерес подгруппу соединений формулы (I) составляют соединения формулы (I) или их подгрупп, где применима любая комбинация из приведенных ниже ограничений:R1 представляет собой атом водорода, цианогруппу, галоген, аминокарбонил, гидроксикарбонил,C1-4-алкилоксикарбонил, ариламинокарбонил, N-гидроксиметанимидамидил, моно- или ди(С 1-4 алкил)метанимидамидил, Het1 или Het2;R2 представляет собой атом водорода, C1-10-алкил, С 2-10-алкенил, С 3-7-циклоалкил или C1-10-алкил,замещенный заместителем, выбранным из группы, включающей цианогруппу, NR4aR4b, пирролидинил,пиперидинил, 4-(C1-4-алкил)пиперазинил, морфолинил, арил, имидазолил, пиридил, гидроксикарбонил,N(R4aR4b)карбонил, C1-4-алкилоксикарбонил или 4-(C1-4-алкил)пиперазин-1-илкарбонил;R4b представляет собой C1-4-алкил или морфолинил, замещенный C1-4-алкилом; арил представляет собой фенил, необязательно замещенный одним или несколькими заместителями, каждый из которых отдельно выбран из группы, состоящей из C1-6-алкила, C1-4-алкоксигруппы, циано-, нитрогруппы;Het1 представляет собой 5-членную циклическую систему, где один, два, три или четыре элемента цикла представляют собой гетероатомы, каждый из которых отдельно и независимо друг от друга выбран из группы, состоящей из атома азота, кислорода и серы, и где остальные элементы цикла представляют собой атомы углерода; и, когда это возможно, любой атом азота как элемент цикла необязательно может быть замещен C1-4-алкилом; любой атом углерода как элемент цикла, каждый отдельно и независимо друг от друга необязательно может быть замещен заместителем, выбранным из группы, состоящей из C1-4-алкила, С 3-7-циклоалкила, галогена, цианогруппы, трифторметила, циано-C1-4-алкила, моно- или ди(C1-4-алкил)аминогруппы, моно- или ди(C1-4-алкил)амино-С 2-6-алкенила, изоксазолила, арила, гидроксикарбонила, C1-4-алкилоксикарбонила, оксо-, тиогруппы; и где названный выше изоксазолил может быть необязательно замещен С 1-4-алкилом;Het2 представляет собой пиридил. Примерами таких комбинаций упомянутых выше ограничений являются, например, комбинация:R1 представляет собой атом водорода, цианогруппу, галоген, аминокарбонил, гидроксикарбонил,C1-4-алкилоксикарбонил, ариламинокарбонил, N-гидроксиметанимидамидил, моно- или ди(С 1-4-7 009871 алкил)метанимидамидил, Het1 или Het2; и арил представляет собой фенил, необязательно замещенный одним или несколькими заместителями, каждый из которых отдельно выбран из группы, состоящей из C1-6-алкила, C1-4-алкоксигруппы, циано-, нитрогруппы; иHet1 представляет собой 5-членную циклическую систему, где один, два, три или четыре элемента цикла представляют собой гетероатомы, каждый из которых отдельно и независимо друг от друга выбран из группы, состоящей из атома азота, кислорода и серы, и где остальные элементы цикла представляют собой атомы углерода; и, когда это возможно, любой атом азота как элемент цикла необязательно может быть замещен C1-4-алкилом; любой атом углерода как элемент цикла, каждый отдельно и независимо друг от друга необязательно может быть замещен заместителем, выбранным из группы, состоящей из C1-4-алкила, С 3-7-циклоалкила, галогена, цианогруппы, трифторметила, циано-C1-4-алкила, моно- или ди(C1-4-алкил)аминогруппы, моно- или ди(C1-4-алкил)амино-С 2-6-алкенила, изоксазолила, арила, гидроксикарбонила, C1-4-алкилоксикарбонила, оксо-, тиогруппы; и где названный выше изоксазолил может быть необязательно замещен С 1-4-алкилом;R2 представляет собой атом водорода, C1-10-алкил, С 2-10-алкенил, С 3-7-циклоалкил или C1-10-алкил,замещенный заместителем, выбранным из группы, состоящей из цианогруппы, NR4aR4b, пирролидинила,пиперидинила, 4-(C1-4-алкил)пиперазинила, морфолинила, арила, имидазолила, пиридила, гидроксикарбонила, N(R4aR4b)карбонила, C1-4-алкилоксикарбонила или 4-(C1-4-алкил)пиперазин-1-илкарбонила; иR2 представляет собой атом водорода, С 1-10-алкил, С 2-10-алкенил, С 3-7-циклоалкил или C1-10-алкил,замещенный заместителем, выбранным из группы, состоящей из цианогруппы, NR4aR4b, пирролидинила,пиперидинила, 4-(C1-4-алкил)пиперазинила, морфолинила, арила, имидазолила, пиридила, гидроксикарбонила, N(R4aR4b)карбонила, C1-4-алкилоксикарбонила или 4-(C1-4-алкил)пиперазин-1-илкарбонила; и арил представляет собой фенил, необязательно замещенный одним или несколькими заместителями, каждый из которых отдельно выбран из группы, состоящей из C1-6-алкила, C1-4-алкоксигруппы, циано-, нитрогруппы; или комбинация:R2 представляет собой атом водорода, C1-10-алкил, С 2-10-алкенил, С 3-7-циклоалкил или C1-10-алкил,замещенный заместителем, выбранным из группы, состоящей из цианогруппы, NR4aR4b, пирролидинила,пиперидинила, 4-(C1-4-алкил)пиперазинила, морфолинила, арила, имидазолила, пиридила, гидроксикарбонила, N(R4aR4b)карбонила, C1-4-алкилоксикарбонила или 4-(C1-4-алкил)пиперазин-1-илкарбонила; и арил представляет собой фенил, необязательно замещенный одним или несколькими заместителями, каждый из которых отдельно выбран из группы, состоящей из C1-6-алкила, C1-4-алкоксигруппы, циано-, нитрогруппы; иHet1 представляет собой 5-членную циклическую систему, где один, два, три или четыре элемента цикла представляют собой гетероатомы, каждый из которых отдельно и независимо друг от друга выбран из группы, состоящей из атома азота, кислорода и серы, и где остальные элементы цикла представляют собой атомы углерода; и, когда это возможно, любой атом азота как элемент цикла необязательно может быть замещен С 1-4-алкилом; любой атом углерода как элемент цикла, каждый отдельно и независимо друг от друга необязательно может быть замещен заместителем, выбранным из группы, состоящей из C1-4-алкила, С 3-7-циклоалкила, галогена, цианогруппы, трифторметила, циано-С 1-4-алкила, моно- или ди(C1-4-алкил)аминогруппы, моно- или ди(C1-4-алкил)амино-С 2-6-алкенила, изоксазолила, арила, гидроксикарбонила, C1-4-алкилоксикарбонила, оксо-, тиогруппы; и где названный выше изоксазолил может быть необязательно замещен C1-4-алкилом; или комбинация:R1 представляет собой атом водорода, цианогруппу, галоген, аминокарбонил, гидроксикарбонил,C1-4-алкилоксикарбонил, ариламинокарбонил, N-гидроксиметанимидамидил, моно- или ди(C1-4 алкил)метанимидамидил, Het1 или Het2; иR2 представляет собой атом водорода, C1-10-алкил, С 2-10-алкенил, С 3-7-циклоалкил или C1-10-алкил,замещенный заместителем, выбранным из группы, состоящей из цианогруппы, NR4aR4b, пирролидинила,пиперидинила, 4-(C1-4-алкил)пиперазинила, морфолинила, арила, имидазолила, пиридила, гидроксикар-8 009871 бонила, N(R4aR4b)карбонила, C1-4-алкилоксикарбонила или 4-(С 1-4-алкил)пиперазин-1-илкарбонила; иR3 представляет собой нитро-, циано-, аминогруппу, галоген, гидроксигруппу, C1-4 алкилоксигруппу, гидроксикарбонил, аминокарбонил, аминотиокарбонил, C1-4-алкилоксикарбонил, C1-4 алкилкарбонил, моно- или ди(C1-4-алкил)метанимидамидил, N-гидроксиметанимидамидил или Het1. В еще одном варианте осуществления изобретения заместитель R1 представляет собой атом водорода, цианогруппу, галоген, аминокарбонил, N-гидроксиметанимидамидил, Het1; предпочтительно заместитель R1 представляет собой атом водорода, цианогруппу, атом брома, тетразолил или оксадиазолил,необязательно замещенный заместителем, выбранным из группы, состоящей из C1-4-алкила, С 2-6 алкенила, С 3-7-циклоалкила, гидрокси-, C1-4-алкокси-, амино-, цианогруппы, трифторметила, гидроксиС 1-4-алкила, циано-С 1-4-алкила, моно- или ди(С 1-4-алкил)аминогруппы, амино-C1-4-алкила, моно- или ди(C1-4-алкил)амино-C1-4-алкила, арил-С 1-4-алкила, амино-С 2-6-алкенила, моно- или ди(С 1-4-алкил)аминоС 2-6-алкенила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, арила, гидроксикарбонила,аминокарбонила,C1-4-алкилоксикарбонила,моноили ди(C1-4-алкил)аминокарбонила,C1-4 алкилкарбонила, оксо-, тиогруппы. Подходящими соединениями являются соединения формулы (II), где заместитель R1 представляет собой атом водорода, цианогруппу, галоген, аминокарбонил, N-гидроксиметанимидамидил, Het1. Более подходящими соединениями являются соединения формулы (II), где заместитель R3 представляет собой нитрогруппу, заместитель R2 представляет собой C1-6-алкил и заместитель R1 представляет собой атом водорода, цианогруппу, атом брома, тетразолил или оксадиазолил, необязательно замещенный заместителем, выбранным из группы, состоящей из C1-4-алкила, С 2-6-алкенила, С 3-7-циклоалкила, гидрокси-, C1-4 алкокси-, амино-, цианогруппы, трифторметила, гидрокси-С 1-4-алкила, циано-С 1-4-алкила, моно- или ди(C1-4-алкил)аминогруппы, амино-C1-4-алкила, моно- или ди(C1-4-алкил)амино-С 1-4-алкила, арил-С 1-4 алкила, амино-С 2-6-алкенила, моно- или ди(С 1-4-алкил)амино-С 2-6-алкенила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, арила, гидроксикарбонила, аминокарбонила, C1-4-алкилоксикарбонила,моно- или ди(С 1-4-алкил)аминокарбонила, C1-4-алкилкарбонила, оксо-, тиогруппы. В другом варианте осуществления изобретения заместитель R2 представляет собой атом водорода,C1-10-алкил, С 2-10-алкенил, С 3-7-циклоалкил, где указанный C1-10-алкил может быть необязательно замещен заместителем, выбранным из группы, состоящей из цианогруппы, NR4aR4b, пирролидинила, пиперидинила, 4-(C1-4-алкил)пиперазинила, морфолинила, арила, имидазолила, пиридила, гидроксикарбонила,N(R4aR4b)карбонила, С 1-4-алкилоксикарбонила, 4-(C1-4-алкил)пиперазин-1-илкарбонила; предпочтительно заместитель R2 представляет собой атом водорода, C1-6-алкила, С 2-6-алкенила, циклопропила, циклопентила, где указанный C1-6-алкил может быть необязательно замещен заместителем, выбранным из группы,состоящей из цианогруппы, ди(C1-4-алкил)аминогруппы, пирролидинила, пиперидинила, 4(метил)пиперазинила, морфолинила, фенила, имидазолила, пиридила, гидроксикарбонила, N(R4aR4b)карбонила, C1-4-алкилоксикарбонила, 4-(метил)пиперазин-1-илкарбонила. Подходящими соединениями являются соединения формулы (II), где заместитель R3 представляет собой нитрогруппу, заместитель R1 представляет собой цианогруппу и заместитель R2 представляет собой C1-10-алкил, С 2-10-алкенил, С 3-7-циклоалкил, где указанный C1-10-алкил может быть необязательно замещен заместителем, выбранным из группы, состоящей из цианогруппы, NR4aR4b, пирролидинила, пиперидинила, 4-(C1-4-алкил)пиперазинила, морфолинила, арила, имидазолила, пиридила, гидроксикарбонила,N(R4aR4b)карбонила, C1-4-алкилоксикарбонила, 4-(C1-4-алкил)пиперазин-1-илкарбонила. В другом варианте осуществления изобретения заместитель R3 представляет собой нитро-, цианогруппу, галоген, C1-4-алкилоксигруппу, гидроксикарбонил, аминокарбонил, моно- или ди(С 1-4 алкил)метанимидамидил, N-гидроксиметанимидамидил или Het1; более предпочтительно заместитель R3 представляет собой нитро-, цианогруппу, галоген, C1-4-алкилоксигруппу, гидроксикарбонил, аминокарбонил, моно- или ди(C1-4-алкил)метанимидамидил, N-гидроксиметанимидамидил, оксадиазолил, тиенил,тиазолил, фуранил, изоксазолил, где каждый из указанных циклов оксадиазолил, тиенил, тиазолил, фуранил, изоксазолил может быть замещен заместителем, выбранным из группы, состоящей из C1-4-алкила,С 2-6-алкенила, С 3-7-циклоалкила, гидроксигруппы, C1-4-алкоксигруппы, амино-, цианогруппы, трифторметила, гидрокси-С 1-4-алкила, циано-С 1-4-алкила, моно- или ди(C1-4-алкил)аминогруппы, амино-C1-4-алкила,моно- или ди(C1-4-алкил)амино-С 1-4-алкила, арил-С 1-4-алкила, амино-С 2-6-алкенила, моно- или ди(C1-4 алкил)амино-С 2-6-алкенила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, арила, гидроксикарбонила, аминокарбонила, C1-4-алкилоксикарбонила, моно- или ди(C1-4-алкил)аминокарбонила,C1-4-алкилкарбонила, оксо-, тиогруппы; и где любой названный выше фуранильный, тиенильный, пирролильный, оксазолильный, тиазолильный, имидазолильный, изоксазолильный, изотиазолильный, пиразолильный, оксадиазолильный, тиадиазолильный и триазолильный остаток может быть необязательно замещен C1-4-алкилом. Подходящими соединениями являются соединения формулы (II), где заместитель R1 представляет собой цианогруппу и заместитель R3 представляет собой нитро-, цианогруппу, галоген, C1-4-9 009871 алкилоксигруппу, гидроксикарбонил, аминокарбонил, моно- или ди(C1-4-алкил)метанимидамидил, Nгидроксиметанимидамидил или Het1. Более подходящими соединениями являются соединения формулы(II), где заместитель R1 представляет собой цианогруппу, заместитель R2 представляет собой C1-6-алкил и заместитель R3 представляет собой нитрогруппу, цианогруппу, галоген, С 1-4-алкилоксигруппу, гидроксикарбонил, аминокарбонил, моно- или ди(C1-4-алкил)метанимидамидил, N-гидроксиметанимидамидил,оксадиазолил, тиенил, тиазолил, фуранил, изоксазолил, где каждый из указанных циклов оксадиазолил,тиенил, тиазолил, фуранил, изоксазолил может быть замещен заместителем, выбранным из группы, состоящей из С 1-4-алкила, С 2-6-алкенила, С 3-7-циклоалкила, гидроксигруппы, C1-4-алкоксигруппы, амино-,цианогруппы, трифторметила, гидрокси-C1-4-алкила, циано-С 1-4-алкила, моно- или ди(С 1-4 алкил)аминогруппы, амино-C1-4-алкила, моно- или ди(С 1-4-алкил)амино-С 1-4-алкила, арил-С 1-4-алкила,амино-С 2-6-алкенила, моно- или ди(С 1-4-алкил)амино-С 2-6-алкенила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила,триазолила, тетразолила, арила, гидроксикарбонила, аминокарбонила, С 1-4-алкилоксикарбонила, моноили ди(С 1-4-алкил)аминокарбонила, С 1-4-алкилкарбонила, оксо-, тиогруппы; и где любой названный выше фуранильный, тиенильный, пирролильный, оксазолильный, тиазолильный, имидазолильный, изоксазолильный, изотиазолильный, пиразолильный, оксадиазолильный, тиадиазолильный и триазолильный остаток может быть необязательно замещен С 1-4-алкилом. Другой вариант осуществления изобретения относится к соединениям формулы (I), гдеR1 представляет собой цианогруппу, галоген или оксадиазолил, необязательно замещенный заместителем, выбранным из группы, состоящей из C1-4-алкила, С 2-6-алкенила, С 3-7-циклоалкила, гидроксигруппы, С 1-4-алкоксигруппы, амино-, цианогруппы, трифторметила, гидрокси-С 1-4-алкила, циано-С 1-4 алкила, моно- или ди(С 1-4-алкил)аминогруппы, амино-C1-4-алкила, моно- или ди(С 1-4-алкил)амино-C1-4 алкила, арил-С 1-4-алкила, моно-С 2-6-алкенила, моно- или ди(С 1-4-алкил)амино-С 2-6-алкенила, фуранила,тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, арила, гидроксикарбонила, аминокарбонила, С 1-4 алкилоксикарбонила, моно- или ди(С 1-4-алкил)аминокарбонила, С 1-4-алкилкарбонила, оксо-, тиогруппы; и где любой названный выше фуранильный, тиенильный, пирролильный, оксазолильный, тиазолильный,имидазолильный, изоксазолильный, изотиазолильный, пиразолильный, оксадиазолильный, тиадиазолильный и триазолильный остаток может быть необязательно замещен C1-4-алкилом;R3 представляет собой нитрогруппу, C1-6-алкил, необязательно замещенный пиперидинилом, пирролидинилом, N(R4aR4b), морфолинилом, пиридилом, цианогруппой, 4-(С 1-4-алкил)пиперазин-1-илом. Еще один вариант осуществления изобретения относится к соединениям формулы (I), где Het1 представляет собой фуранил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, изоксазолил, изотиазолил, пиразолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, каждый из которых отдельно и независимо друг от друга может быть необязательно замещен заместителем, выбранным из группы, состоящей из C1-4-алкила, С 2-6-алкенила, С 3-7-циклоалкила, гидроксигруппы, C1-4-алкоксигруппы, галогена,амино-, цианогруппы, трифторметила, гидрокси-С 1-4-алкила, циано-C1-4-алкила, моно- или ди(С 1-4 алкил)аминогруппы, амино-С 1-4-алкила, моно- или ди(С 1-4-алкил)амино-C1-4-алкила, арил-C1-4-алкила,амино-С 2-6-алкенила, моно- или ди(С 1-4-алкил)амино-С 2-6-алкенила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила,триазолила, тетразолила, арила, гидроксикарбонила, аминокарбонила, C1-4-алкилоксикарбонила, моноили ди(С 1-4-алкил)аминокарбонила, С 1-4-алкилкарбонила, оксо-, тиогруппы; и где любой названный выше фуранильный, тиенильный, пирролильный, оксазолильный, тиазолильный, имидазолильный, изоксазолильный, изотиазолильный, пиразолильный, оксадиазолильный, тиадиазолильный и триазолильный остаток может быть необязательно замещен С 1-4-алкилом. Предпочтительными соединениями являются 1-(4-нитрофенил)-2-оксо-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3-карбонитрил; 5-метил-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3-карбонитрил; 5-изобутил-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3-карбонитрил; 5-аллил-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3-карбонитрил; 5-бутил-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3-карбонитрил; 5-этил-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3-карбонитрил; 5-(2-морфолин-4-илэтил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3 карбонитрил; 5-метил-1-(4-нитрофенил)-1,5-дигидропиридо[3,2-b]индол-2-он; 5-бут-3-енил-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3 -карбонитрил; 1-(4-нитрофенил)-2-оксо-5-(2-пирролидин-1-илэтил)-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3 карбонитрил; 1-(4-нитрофенил)-2-оксо-5-(2-пиперидин-1-илэтил)-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3 карбонитрил;- 10009871 5-(3-диметиламинопропил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3 карбонитрил; 3-бром-5-метил-1-(4-нитрофенил)-1,5-дигидропиридо[3,2-b]индол-2-он; 5-метил-1-(3-нитрофенил)-2-оксо-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3-карбонитрил; 1-(4-нитрофенил)-2-оксо-5-(3-пиперидин-1-илпропил)-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3 карбонитрил; 5-(4-морфолин-4-илбутил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3 карбонитрил; 1-(4-нитрофенил)-2-оксо-5-(4-пирролидин-1-илбутил)-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3 карбонитрил; 5-[3-(4-метилпиперазин-1-ил)пропил]-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1 Н-пиридо[3,2b]индол-3-карбонитрил; 5-цианометил-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3-карбонитрил; 5-(3-морфолин-4-илпропил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3 карбонитрил; 1-(4-нитрофенил)-2-оксо-5-(4-пиперидин-1-илбутил)-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3 карбонитрил; 5-(4-диметиламинобутил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3 карбонитрил; 1-(4-нитрофенил)-2-оксо-5-пиридин-4-илметил-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3-карбонитрил; 3-(5-трет-бутил-[1,2,4]оксадиазол-3-ил)-5-метил-1-(4-нитрофенил)-1,5-дигидропиридо[3,2-b]индол 2-он; 5-метил-1-(4-нитрофенил)-3-(5-трифторметил-[1,2,4]-оксадиазол-3-ил)-1,5-дигидропиридо[3,2b]индол-2-он; и их N-оксиды, соли и стереоизомеры. Наиболее предпочтительными соединениями являются 5-метил-1-(4-нитрофенил)-2-оксо-2,5 дигидро-1 Н-пиридо[3,2-b]индол-3-карбонитрил; 5-(2-морфолин-4-илэтил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3 карбонитрил; 1-(4-нитрофенил)-2-оксо-5-(2-пиперидин-1-илэтил)-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3 карбонитрил; 1-(4-нитрофенил)-2-оксо-5-(2-пирролидин-1-илэтил)-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3 карбонитрил; или их N-оксиды, соли и стереоизомеры. Соединения настоящего изобретения ингибируют обратную транскриптазу ВИЧ, а также могут ингибировать обратные транскриптазы, обладающие сходством с обратной транскриптазой ВИЧ. Такое сходство может быть определено с использованием программ, известных в данной области, включаяBLAST. В одном из вариантов осуществления изобретения сходство на аминокислотном уровне составляет по меньшей мере 25%, интерес представляет сходство по меньшей мере 50%, больший интерес представляет сходство по меньшей мере 75%. В другом варианте осуществления изобретения сходство на аминокислотном уровне на связывающем кармане в случае соединений настоящего изобретения составляет по меньшей мере 75%, особенно по меньшей мере 90%, в сравнении с обратной транскриптазой ВИЧ. Соединения настоящего изобретения помимо ВИЧ-1 испытаны в других лентивирусах (lentivirusses), таких как, например, SIV и ВИЧ-2. Соединения настоящего изобретения обладают хорошей селективностью, которую измеряют с помощью соотношения между ЕС 50 и CC50, как это описано и представлено в примере анализа на антивирусную активность. Соединения настоящего изобретения также обладают благоприятной специфичностью. Существует большое отличие между активностью на лентивирусах в сравнении с другими ретровирусами, такими как MLV, и в сравнении с невирусными патогенами. Например, соединение 2 имеет значение EC50 более чем 32 мкМ для Mycobacterium b., Plasmodium f., Trypanosoma b. и Trypanosoma с.,тогда как значение ЕС 50 в случае исходного типа ВИЧ имеет значение намного ниже 100 нМ. Стандарт "чувствительность" или, другими словами, "устойчивость" фермента обратной транскриптазы ВИЧ к лекарству устанавливают с помощью коммерчески доступных ингибиторов обратной транскриптазы ВИЧ. Существующие коммерческие ингибиторы обратной транскриптазы ВИЧ, в том числе эфавиренз, невирапин и делавирдин, со временем могут терять свою эффективность против популяции вируса ВИЧ у пациента. Причина состоит в том, что в условиях присутствия конкретного ингибитора обратной транскриптазы ВИЧ существующая популяция вируса ВИЧ, обычно преимущественно фермент обратной транскриптазы исходного типа ВИЧ, подвергается мутации в различные мутанты, которые значительно менее чувствительны к тому же самому ингибитору обратной транскриптазы ВИЧ. Если такое явление имеет место, говорят об устойчивых мутантах. Если такие мутанты являются не только устойчивыми к такому одному конкретному ингибитору обратной транскриптазы ВИЧ, а также к множеству других коммерчески доступных ингибиторов обратной транскриптазы ВИЧ, говорят об обратной- 11009871 транскриптазе ВИЧ, устойчивой к множеству лекарств. Одним из способов выражения устойчивости мутанта к конкретному ингибитору обратной транскриптазы ВИЧ является установление соотношения между ЕС 50 указанного ингибитора обратной транскриптазы ВИЧ против обратной транскриптазы мутанта ВИЧ и EC50 указанного ингибитора обратной транскриптазы ВИЧ против обратной транскриптазы ВИЧ исходного типа. Указанное соотношение также называют кратностью изменения в устойчивости(FR, fold resistance). Значение ЕС 50 представляет собой количество соединения, требуемое для защиты 50% клеток от цитопатогенного влияния вируса. Большое число мутантов, обнаруженных в клинических условиях, имеет кратную устойчивость 100 или более относительно коммерчески доступных ингибиторов обратной транскриптазы ВИЧ, типа невирапина, эфавиренза, делавирдина. Клинически близкие мутанты фермента обратной транскриптазы ВИЧ могут быть охарактеризованы мутацией в положении кодона 100, 103 и 181. Как используется в данном случае, положение кодона означает аминокислоту в белковой последовательности. Мутации в положениях 100, 103 и 181 относятся к ненуклеозидным ингибиторам RT (D'Aquila et al., Topics in HIV medicine,2002, 10, 11-15). Примеры таких клинически близких обратных транскриптаз мутантов ВИЧ перечислены в табл. 1. Таблица 1 Перечень мутаций, присутствующих в обратной транскриптазе используемых линий ВИЧ Представляющую интерес группу соединений составляют соединения формулы (I), имеющие кратную устойчивость в интервале от 0,01 до 100 относительно, по меньшей мере, обратной транскриптазы одного мутанта ВИЧ, предпочтительно в интервале от 0,1 до 100, более предпочтительно в интервале от 0,1 до 50, и даже более предпочтительно в интервале от 0,1 до 30. Особый интерес представляют соединения формулы (I), проявляющие кратную устойчивость относительно, по меньшей мере, обратной транскриптазы одного мутанта ВИЧ в интервале от 0,1 до 20, и даже еще больший интерес представляют соединения формулы (I), проявляющие кратную устойчивость относительно, по меньшей мере, обратной транскриптазы одного мутанта ВИЧ в интервале от 0,1 до 10. Представляющую интерес группу соединений составляют соединения формулы (I), имеющие кратную устойчивость при определении описанными в работе способами, в интервале от 0,01 до 100 относительно образцов ВИЧ, имеющих по меньшей мере одну мутацию в аминокислотной последовательности обратной транскриптазы ВИЧ, в сравнении с исходным типом последовательности (внесенной в банк генетических данных, например, М 38432, K03455, gi327742) в положении, выбранном из положений 100,103 и 181; в особенности по меньшей мере две мутации, выбранные из положений 100, 103 и 181. Даже еще больший интерес представляют соединения в пределах указанной представляющей интерес группы соединений, имеющие кратную устойчивость в интервале от 0,1 до 100, в особенности в интервале от 0,1 до 50, более предпочтительно в интервале от 0,1 до 30. Наибольший интерес представляют соединения в рамках указанной представляющий интерес группы соединений, имеющие кратную устойчивость в интервале от 0,1 до 20, в особенности в интервале от 0,1 до 10. В одном из вариантов соединения настоящего изобретения проявляют кратную устойчивость в интервалах, упомянутых выше, относительно по меньшей мере одной из обратных транскриптаз клинически близких мутантов ВИЧ. Отдельную группу соединений составляют соединения формулы (I), имеющие IC50 1 мкМ или ниже, предпочтительно IC50 составляет 100 нМ или ниже, относительно исходного типа вируса при проверке in vitro в соответствии со способами, описанными в работе.- 12009871 Способность соединений настоящего изобретения ингибировать вирусы ВИЧ-1, ВИЧ-2, SIV и вирусы ВИЧ с ферментами обратной транскриптазы (RT), которые подверглись мутации под воздействием известных в настоящее время ингибиторов RT, наряду с отсутствием перекрестной устойчивости с известными в настоящее время ингибиторами RT, показывает, что рассматриваемые соединения поразному связываются с ферментом RT, если сравнивать с известными NNRTI и NRTI. Что касается перекрестной устойчивости, то исследование на более чем 8000 вирусах показало, что рассчитанный коэффициент корреляции между рассматриваемым соединением 2 и известными NRTI, такими как, например,3 ТС, абакавир, AZT, D4T, DDC, DDI, во всех случаях составляет менее чем 0,28, за исключением 3 ТС,когда коэффициент корреляции составлял приблизительно 0,63. Коэффициент корреляции между соединением 2 настоящего изобретения и известными NNRTI, такими как, например, каправирин, делавирдин,невирапин и эфавиренз, во всех случаях составляет приблизительно 0,13 или меньше. Соединения настоящего изобретения проявляют антиретровирусные свойства, в особенности против вируса иммунодефицита человека (ВИЧ), который является этиологическим агентом синдрома приобретенного иммунодефицита (СПИД) у человека. Вирус ВИЧ преимущественно инфицирует рецепторCD4, содержащий клетки, такие как Т 4-клетки человека, и разрушает их или меняет их нормальное функционирование, в особенности координацию иммунной системы. В результате инфицированный больной имеет постоянно уменьшающееся число Т 4-клеток, которые все больше и больше ведут себя аномально. Следовательно, система иммунологической защиты не способна сопротивляться инфекциям и/или новообразованиям, и инфицированный ВИЧ организм обычно умирает от оппортунистических инфекций, таких как пневмония, или от раковых заболеваний. Другими заболеваниями, которыми сопровождается ВИЧ-инфекция, являются тромбоцитопатия, саркома Капоши и инфекция центральной нервной системы, отличающаяся прогрессирующей демиелинизацией, что приводит к слабоумию и таким симптомам, как прогрессирующая дисартрия, атаксия и дезориентация. ВИЧ-инфекция также связана с периферической невропатией, прогрессирующей генерализованной лимфаденопатией (PGL) и СПИДзависимым комплексом (ARS). Вирус ВИЧ также инфицирует клетки, содержащие CD8-рецептор. Другими клетками-мишенями для вируса ВИЧ являются микроглия, дендритические клетки, В-клетки и макрофаги. Благодаря своим подходящим фармакологическим свойствам, в особенности их активности против ферментов обратной транскриптазы ВИЧ, соединения настоящего изобретения или любая подгруппа этих соединений могут быть использованы в качестве медицинского средства против упомянутых выше заболеваний или при их профилактике. Указанное применение в качестве медикамента или способ лечения включают систематическое введение ВИЧ-инфицированному субъекту количества, эффективного для борьбы с состояниями, связанными с ВИЧ. В одном из вариантов осуществления настоящее изобретение относится к применению соединения формулы (I) или любой подгруппы при производстве медикамента, применимого для профилактики или лечения инфекции или заболевания или для борьбы с инфекцией или заболеванием, связанными с ВИЧинфекцией. В другом варианте осуществления настоящее изобретение относится к применению соединения формулы (I) или любой подгруппы при производстве медикамента, применимого для ингибирования репликации вируса ВИЧ, в особенности вируса ВИЧ, имеющего мутантную обратную транскриптазу ВИЧ, более предпочтительно мутантную обратную транскриптазу ВИЧ, устойчивую к множеству лекарств. В еще одном варианте осуществления настоящее изобретение относится к применению соединения формулы (I) или любой подгруппы при производстве медикамента, применимого для профилактики или лечения заболевания или для борьбы с заболеванием, сопровождающим вирусную инфекцию ВИЧ, где обратная транскриптаза вируса ВИЧ является мутантом, в особенности мутантной обратной транскриптазой ВИЧ, устойчивой ко многим лекарствам. Соединения формулы (I) или любой из подгрупп также могут быть использованы в способе профилактики или лечения инфекции или заболевания или борьбы с инфекцией или заболеванием, связанными с ВИЧ-инфекцией у млекопитающих, включающем введение указанному млекопитающему эффективного количества соединения формулы (I) или любой подгруппы. В другом аспекте изобретения соединения формулы (I) или любой из его подгрупп могут быть использованы в способе профилактики или лечения инфекции или заболевания или для борьбы с инфекцией или заболеванием, связанными с инфицированием млекопитающих вирусом-мутантом ВИЧ, включающем введение указанному млекопитающему эффективного количества соединения формулы (I) или любой подгруппы. В другом аспекте изобретения соединения формулы (I) или любой подгруппы могут быть использованы в способе профилактики или лечения инфекции или заболевания или для борьбы с инфекцией или заболеванием, связанными с инфицированием млекопитающих устойчивым ко многим лекарствам вирусом ВИЧ, включающем введение указанному млекопитающему эффективного количества соединения формулы (I) или любой подгруппы. В еще одном аспекте изобретения соединения формулы (I) или любой подгруппы могут быть ис- 13009871 пользованы в способе ингибирования репликации вируса ВИЧ, в особенности вируса ВИЧ, имеющего мутантную обратную транскриптазу ВИЧ, более предпочтительно устойчивую ко многим лекарствам мутантную обратную транскриптазу ВИЧ, включающем введение млекопитающему, нуждающемуся в этом, эффективного количества соединения формулы (I) или любой подгруппы. Наибольший интерес представляет вариант, когда в способе настоящего изобретения упомянутым выше млекопитающим является человек. Соединения настоящего изобретения также могут найти применение при ингибировании ex vivo образцов, содержащих ВИЧ, или, как ожидается, доступны для воздействия ВИЧ. Следовательно, рассматриваемые соединения могут быть использованы для ингибирования ВИЧ, присутствующего в образце крови, которая содержит или, как предполагается, доступна для воздействия ВИЧ. Конкретные реакционные методики получения соединений настоящего изобретения описаны ниже. В методиках получения, описанных ниже, продукты реакции могут быть выделены из среды и, если это необходимо, дополнительно очищены в соответствии с методологией, в целом известной в данной области, например, экстракцией, кристаллизацией, растиранием и хроматографией. Путь реакции 1. Синтез соединений настоящего изобретения, где R3 представляет собой нитро-,цианогруппу (R3'). Синтез соединений (а-6) и (а-7) удобно начинать с 1-C1-6-алкилкарбонил-3-гидроксииндола (а-1). Конденсация (а-1) с нитроанилином при повышенных температурах и в подходящем растворителе, таком как уксусная кислота, толуол, бензол, спирт и т.д., дает 3-нитрофенил)амино)индол (а-2). В одном из вариантов осуществления изобретения нитроанилин представляет собой пара-нитроанилин. Промежуточное соединение (а-2) затем может быть деацилировано с помощью основания, такого как, например,триэтиламин, гидроксид натрия, ацетат натрия, ацетат калия или карбонат калия и т.д., в подходящем растворителе, таком как, например, метанол или этанол, и при повышенной температуре, с получением промежуточного соединения (а-3). Формилирование промежуточного соединения (а-3) приводит к индолкарбальдегиду (а-4) и может быть осуществлено при использовании, например, реакции Вильсмайера. Конденсация промежуточного соединения (а-4) приводит к промежуточному соединению (а-5). В одном из вариантов осуществления указанная конденсация может быть осуществлена с использованием основания, такого как, например, триэтиламин, ацетат натрия, ацетат калия, пиперидин и т.д., в широком спектре растворителей, и с помощью оксикарбонилметиленового реагента формулы CHR1P2-C(=O)-OP1,где P1 представляет собой С 1-6-алкил, С 6-14-арил или С 6-14-арил-С 1-6-алкил и P2 представляет собой атом водорода, эфир карбоновой кислоты, фосфониевую соль или фосфонат (сложный эфир). Предпочтительно, реагент имеет формулу CH2R1-C(=O)-OP1, где P1 представляет собой C1-6-алкил. Последующая внутримолекулярная циклизация промежуточного соединения (а-5) при повышенной температуре и в растворителе типа этиленгликоля, диоксана, N,N-диметилформамида, диметилсульфоксида, глима, диглима и т.д., дает соединение (а-6), которое может быть превращено в соединение формулы (а-7) с использованием реакции N-алкилирования с помощью промежуточного соединения формулы R2-X, где X является уходящей группой. Примерами таких уходящих групп являются сульфонаты, такие как тозилат, мезилат,- 14009871 ацетаты, галогениды, такие как бромид, йодид, хлорид и фторид. Другие превращения из соединений формулы (а-6) и (а-7) могут быть осуществлены с использованием известных методик превращения. Например, соединения формул (а-6) или (а-7), где R3 представляет собой нитрогруппу, могут быть восстановлены до соединений с заместителем R3, который является аминогруппой, и затем могут быть подвергнуты дополнительной дериватизации. Другие примеры реакций превращения приведены в схемах примеров от А 2 до А 15 в экспериментальной части. Порядок упомянутых стадий в приведенном способе схемы А может быть различным. Например,формилирование может быть проведено до деацилирования. Оксикарбонилметиленовые реагенты формулы CHR1P2-C(=O)-OP1, где P2 представляет собой эфир карбоновой кислоты, представляют собой, например, сложные эфиры дикарбоновой кислоты формулыP1O-C(=O)-CHP2-C(=O)-OP1. Оксикарбонилметиленовые реагенты формулы CHR1P2-C(=O)-OP1, где Р 2 представляет собой фосфониевую соль, могут, например, иметь формулу (P1)3P=CR1-C(=O)-OP1. Оксикарбонилметиленовые реагенты формулы CHR1P2-C(=O)-OP1, где Р 2 представляет собой (P1O)2 Р(=O)-,могут, например, иметь формулу (P1O)2 Р(=O)-CHR1-C(=O)-OP1. Путь реакции 2. Синтез соединений настоящего изобретения, где R3 представляет собой атом галогена или С 1-6-алкилоксигруппу (R3). Промежуточное соединение (b-1) может быть введено в реакцию с реагентом формулы (i) в подходящем растворителе, таком как, например, толуол, уксусная кислота, спирт и т.д., в присутствии катализатора, такого как, например, п-толуолсульфоновая кислота, с получением промежуточного соединения формулы (b-2). Повышенные температуры и перемешивание могут ускорить реакцию. Указанное промежуточное соединение (b-2) затем может быть введено в реакцию с хлорацетилхлоридом или его функциональным производным, предпочтительно при повышенной температуре, с получением промежуточного соединения формулы (b-3). Указанное промежуточное соединение формулы (b-3) может быть депротонировано с использованием подходящего основания, такого как триэтиламин, ацетат натрия, ацетат калия, гидроксид натрия, гидроксид калия, карбонат калия и т.д., в растворителе, таком как метанол или этанол. Перемешивание и нагревание могут ускорить реакцию. Полученное таким образом промежуточное соединение формулы (b-4) может быть подвергнуто циклизации вначале с использованием цианида калия или цианида тетрабутиламмония с последующим формилированием промежуточного соединения по Вильсмайеру с использованием POCl3 в N,N-диметилформамиде с образованием соединения (b-5),которое принадлежит к классу соединений формулы (I). Указанное соединение (b-5) дополнительно может быть превращено в другие соединения формулы(I) при использовании известных в данной области реакций превращения. Некоторые из таких реакций описаны в типовой схеме в экспериментальной части описания. Например, когда заместитель R3 представляет собой Br, Br может быть превращен в гетероциклическое кольцо с использованием гетероциклических боратов и палладия. Путь реакции 3. Синтез соединений настоящего изобретения, где R3 представляет собой циано-,нитрогруппу или C1-6-алкилоксикарбонил (R3" '). Промежуточное соединение (с-1) может быть введено в реакцию с реагентом формулы (i) в подходящем растворителе, таком как, например, толуол, уксусная кислота, спирт и т.д., в присутствии катализатора, такого как, например, п-толуолсульфоновая кислота, с получением промежуточного соединения формулы (с-2). Повышенные температуры и перемешивание могут ускорить реакцию. Указанное промежуточное соединение (с-2) затем может быть введено в реакцию с уксусным ангидридом в присутствии катализатора, такого как, например, пиридин или диметиламинопиридин и т.д., предпочтительно при повышенной температуре, с получением промежуточного соединения формулы (с-3). Полученное таким образом промежуточное соединение формулы (с-3) может быть введено в реакцию Вильсмайера с POCl3 в N,N-диметилформамиде с образованием промежуточного соединения (с-4), которое, в свою очередь,может быть дополнительно подвергнуто циклизации до соединения (с-5) в кислой водной среде. Указанное соединение (с-5), принадлежащее к классу соединений формулы (I), также может быть превращено в другие соединения формулы (I) при использовании известных в данной области реакций превращения. Некоторые из таких реакций описаны в типовой схеме в экспериментальной части описания. Например, заместитель R3, который представляет собой C1-6-алкилоксикарбонил, может быть превращен в соответствующие карбоновую кислоту или амид. Кроме того, заместитель R3, который представляет собой цианогруппу, может быть превращен в гетероцикл, такой как тетразолил, оксадиазолил,тиазолил и др. Путь реакции 4. Синтез соединений настоящего изобретения, где R1 представляет собой атом водорода.- 16009871 Промежуточное соединение формулы (d-1) может быть введено в реакцию с C1-6-алкилйодидом илиC1-6-алкилсульфатом в присутствии основания, такого как, например, карбонат калия, гидроксид калия,гидроксид натрия и т.д., в реакционно-инертном растворителе, таком как, например, N,Nдиметилформамид, ацетонитрил, ацетон, этанол, вода и т.д. Перемешивание может увеличить скорость реакции. Полученное таким образом промежуточное соединение формулы (d-2) затем может быть введено в реакцию с гидроксиламином в растворителе, таком как вода, этанол или их смесь, и в присутствии основания, такого как ацетат натрия, ацетат калия, карбонат калия, ацетат натрия и т.д., с образованием промежуточного соединения формулы (d-3). При нагревании и перенесении промежуточного соединения формулы (d-3) в кислую водную среду образуется промежуточное соединение формулы (d-4). Указанное соединение может быть подвергнуто внутримолекулярной циклизации в присутствии POCl3 в N,Nдиметилформамиде. Может быть полезно охлаждать реакционную смесь. Полученное таким образом промежуточное соединение формулы (d-5) может быть обработано цинком в кислой водной среде, такой как HCl, с образованием промежуточного соединения формулы (d-6). N-Оксид может быть получен при использовании мета-хлорнадбензойной кислоты, водной перекиси, трет-бутилгидропероксида и т.д., или их функциональных эквивалентов, в растворителе, таком как, например, дихлорметан, хлороформ, спирт,толуол и др., и при использовании повышенных температур. Указанный N-оксид формулы (d-7) также может быть введен в реакцию, предпочтительно при повышенной температуре, с уксусным ангидридом,с получением промежуточного соединения формулы (d-8). И, наконец, бороновая кислота формулы (ii) может быть использована для получения соединения формулы (I), эквивалентного формуле (d-9). Указанная реакционная стадия включает использование ацетата меди(II) или его эквивалента в растворителе,таком как, например, N,N-диметилформамид, дихлорметан, толуол, спирт, хлороформ и т.д. Подходящая закалочная среда типа пиридина может быть добавлена к реакционной смеси. Повышение температуры может ускорить реакцию. Путь реакции 5. Синтез соединений настоящего изобретения с различными R2. Соединения формулы (I), где заместитель R2 представляет собой атом водорода, могут быть превращены в соединения формулы (I), где заместитель R2 отличается от атома водорода. Для этих целей реагенты типа R2-Cl, где Cl представляет собой уходящую группу, могут быть использованы в присутствии основания, такого как гидрид натрия или карбонат натрия, гидроксид калия, гидроксид натрия и др. Также могут быть использованы другие подходящие уходящие группы, такие как, например, сульфонаты, такие как толизат, мезилат, ацетаты, галогены, такие как бромид, йодид, хлорид и фторид. Указанная реакционная методика может быть использована для введения, например, таких групп, как метил, этил, циклопропил, бутил, изобутил, изопентил, циклопентил; аллил, гомоаллил, бензил; 4-пиридинилметил, 3-пиридинилметил, 2-пиридинилметил; 4-имидазолилэтил; диметиламино (-этил, -пропил, -бутил), пиперидино (-этил, -пропил, -бутил), пирролидино (-этил,-пропил, -бутил), N-метилпиперазино (-этил, -пропил, -бутил), пирролидино (-этил, -пропил, -бутил); цианометил, цианоэтил; алкилирование этилбромацетатом и последующее превращение сложного эфира в карбоновую кислоту и амиды. Также могут быть осуществлены другие реакции превращения, в прямой форме не упомянутые выше. Некоторые примеры упоминаются в типовых схемах в экспериментальной части описания. Соединения формулы (I) также могут быть превращены в соответствующие N-оксидные формы,следуя известным в данной области методикам превращения трехвалентного атома азота в его Nоксидную форму. Указанную реакцию N-окисления обычно можно провести при взаимодействии исходного материала формулы (I) с подходящим органическим или неорганическим пероксидом. Соответствующими неорганическими пероксидами являются, например, перекись водорода, пероксиды щелочного металла или щелочно-земельного металла, например, пероксид натрия, пероксид калия; соответствующими органическими пероксидами могут быть надкислоты, такие как, например, бензолкарбопероксоновая кислота или галогензамещенная бензолкарбопероксоновая кислота,например,3 хлорбензолкарбопероксоновая кислота, пероксоалкановые кислоты, например, пероксоуксусная кислота,алкилгидропероксиды, например, трет-бутилгидропероксид. Подходящими растворителями являются, например, вода, низшие спирты, например, этанол и т.д.,углеводороды, например, толуол, кетоны, например, 2-бутанон, галогенированные углеводороды, на- 17009871 пример, дихлорметан, а также смеси таких растворителей. Основный атом азота, присутствующий в соединениях настоящего изобретения, может быть кватеринизован с помощью любого агента, известного специалисту в данной области, включая, например,низшие алкилгалогениды, диалкилсульфаты, длинноцепочечные галогениды и аралкилгалогениды, по известным в данной области методикам. Соединения настоящего изобретения могут быть использованы в животных, предпочтительно млекопитающих, и особенно в человеке, в качестве фармацевтических средств так, как они есть, в смесях с одним другим средством или в форме фармацевтических препаратов. Таким образом, настоящее изобретение относится к фармацевтическим препаратам, которые в качестве активных составляющих содержат эффективную дозу по меньшей мере одного соединения формулы (I) в смеси с обычными фармацевтически безвредными наполнителями и вспомогательными веществами. Фармацевтические препараты обычно содержат от 0,1 до 90 мас.%, соединения формулы (I). Фармацевтические препараты могут быть получены способом, которые сами по себе известны специалистам в данной области. Для этих целей по меньшей мере одно соединение формулы (I) вместе с одним или несколькими твердыми или жидкими фармацевтическим наполнителями и/или вспомогательными веществами и, если это желательно, с другими фармацевтически активными соединениями, переводят в подходящую для введения форму или дозированную лекарственную форму, которая затем может быть использована в качестве фармацевтического средства при лечении человека или в ветеринарии. Фармацевтические средства, которые содержат соединение в соответствии с настоящим изобретением, могут быть введены перорально, парентерально, например, внутривенно, ректально, путем ингаляции или локально, причем предпочтительное введение лекарства зависит от отдельного случая, например, конкретного течения заболевания, которое подвергается лечению. Предпочтительным является пероральное введение. Специалист, квалифицированный в данной области, исходя из своих знаний по вспомогательным веществам, знает, что является приемлемым для желаемой фармацевтической рецептуры. Кроме растворителей также могут быть использованы гель-образующие агенты, основы для свечей, вспомогательные вещества для таблеток и другие носители для активных соединений, антиоксиданты, дисперсанты,эмульгаторы, пеногасители, вещества, корригирующие вкус и запах, консерванты, солюбилизаторы,агенты для достижения эффекта депо, буферные вещества или красители. Кроме того, в качестве медикамента может быть использована комбинация антиретровирусного соединения и соединения настоящего изобретения. Таким образом, настоящее изобретение также относится к продукту, содержащему (а) соединение настоящего изобретения, и (b) другое антиретровирусное соединение, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения при лечении ретровирусных инфекций, таких как ВИЧ-инфекция, в особенности при лечении инфекций ретровирусами с множественной лекарственной устойчивостью. Таким образом,для профилактики, борьбы или лечения ВИЧ-инфекций и заболевания, связанного с ВИЧ-инфекциями,такого как синдром приобретенного иммунодефицита (СПИД) или СПИД-зависимый комплекс (ARC),соединения настоящего изобретения могут быть введены совместно в комбинации, например, с ингибиторами связывания, такими как, например, декстрансульфат, сурамин, полианионы, растворимый CD4,PRO-542, BMS-806; ингибиторами слияния, такими как, например, Т 20, Т 1249, RPR103611, YK-FH312,IC9564, 5-геликс, D-пептид ADS-J1; ингибиторами связывания сорецепторов, такими как, например,AMD-3100, AMD-3465, AMD-7049, AMD-3451 (Бицикламы), ТАК 779, Т-22, ALX40-4C; SHCC(SCH351125), SHC-D, PRO-140, RPR103611; ингибиторами RT, такими как, например, фоскарнет и пролекарства; нуклеозидными RTI, такими как, например, AZT, 3 ТС, DDC, DDI, D4T, Абакавир, FTC,DAPD (Амдоксовир), dOTC (BCH-10652), фозивудин, DPC 817; нуклеотидными RTI, такими как, например, РМЕА, РМРА (тенофовир); NNRTI, такими как, например, невирапин, делавирдин, эфавиренз, 8 и 9Cl TIBO (тивирапин), ловирид, ТМС-125, дапивирин, MKC-442, UC 781, UC 782, каправирин, QM96521,GW420867X, DPC961, DPC963, DPC082, DPC083, каланолид A, SJ-3366, TSAO, 4"-деаминированныйTSAO, MV150, MV026048, PNU-142721; ингибиторами RNAse H, такими как, например, SP1093V,PD126338; ингибиторами ТАТ, такими как, например, RO-5-3335, K12, K37; ингибиторами интегразы,такими как, например, L 708906, L 731988, S-1360; ингибиторами протеазы, такими как, например, ампренавир и фосампренавир, ритонавир, нелфинавир, саквинавир, индинавир, лопинавир, палинавир,BMS 186316, атазанавир, DPC 681, DPC 684, типранавир, AG1776, мозенавир, DMP-323, GS3333, KNI413, KNI-272, L754394, L756425, LG-71350, PD161374, PD173606, PD177298, PD178390, PD178392, PNU 140135, ТМС-114, маслиновая кислота, U-140690; ингибиторами гликозилирования, такими как, например, кастаноспермин, деоксинойиримицин; ингибиторами ввода CGP64222. Указанная комбинация может обеспечить синергетический эффект, в результате чего вирусная инфективность и связанные с ней симптомы могут быть предупреждены, значительно уменьшены или полностью исключены. Соединения настоящего изобретения также могут быть введены в комбинации с иммуномодуляторами (например, бропиримином, антителом против альфа-интерферона человека, IL-2, энкефалином ме- 18009871 тионина, альфа-интерфероном и налтрексоном), с антибиотиками (например, изотиоратом пентамидина),цитокинами (например, Th2), модуляторами цитокинов, хемокинами или модуляторами хемокинов, рецепторами хемокинов (например, CCR5, CXCR4), модуляторами рецепторов хемокинов или гормонами(например, гормоном роста), для облегчения, борьбы или ликвидации ВИЧ-инфекции и ее симптомов. Такая комбинированная терапия в различных рецептурах может быть проведена одновременно, последовательно или независимо друг от друга. С другой стороны, такая комбинация может быть введена в одной рецептуре, посредством которой активные ингредиенты высвобождаются из рецептуры одновременно или отдельно. Соединения настоящего изобретения также могут быть введены в комбинации с модуляторами метаболизации после применения лекарства индивидуумом. Такие модуляторы включают соединения, которые вмешиваются в метаболизацию на цитохромах, таких как цитохром Р 450. Известно, что существует несколько изоферментов цитохрома Р 450, один из которых представляет собой цитохром Р 450 3 А 4. Ритонавир представляет собой пример модулятора метаболизации через цитохром Р 450. Такая комбинированная терапия в различных рецептурах может быть проведена одновременно, последовательно или независимо одна от другой. С другой стороны, такая комбинация может быть введена в одной рецептуре,посредством которой активные ингредиенты высвобождаются из рецептуры одновременно или отдельно. Такой модулятор может быть введен при том же или при разном отношении, как и соединение настоящего изобретения. Предпочтительно массовое отношение такого модулятора к соединению настоящего изобретения (модулятор:соединение настоящего изобретения) составляет 1:1 или менее, более предпочтительно отношение составляет 1:3 или менее, более предпочтительно отношение составляет 1:10 или менее, более предпочтительно отношение составляет 1:30 или менее. В случае формы для перорального введения соединения настоящего изобретения смешивают с подходящими вспомогательными добавками, такими как наполнители, стабилизаторы или инертные разбавители, и переводят с помощью обычных способов в подходящие для введения формы, такие как таблетки, таблетки с покрытием, твердые капсулы, водные, спиртовые или масляные растворы. Примерами подходящих инертных носителей являются камедь, магнезия, карбонат магния, фосфат калия, лактоза,глюкоза или крахмал, в особенности кукурузный крахмал. В этом случае препарат может быть получен как в виде сухих, так и в виде влажных гранул. Подходящими масляными наполнителями или растворителями являются растительные или животные масла, такие как подсолнечное масло или рыбий жир. Подходящими растворителями для водных или спиртовых растворов являются вода, этанол, растворы сахаров или их смеси. Полиэтиленгликоли и полипропиленгликоли также могут быть использованы в качестве дополнительных вспомогательных веществ для других форм введения. В случае подкожного или внутривенного введения активные соединения, если желательно, с обычными для этого веществами, такими как солюбилизаторы, эмульгаторы или дополнительные вспомогательные вещества, переводят в раствор, суспензию или эмульсию. Соединения формулы (I) также могут быть лиофилизированы, а полученные лиофилизаты использованы, например, для приготовления препаратов для инъекций или вливаний. Подходящими растворителями являются, например, вода, физиологический раствор или спирты, например, этанол, пропанол, глицерин, вместе с растворами сахаров, такими как растворы глюкозы или маннита, или, с другой стороны, смеси различных упомянутых растворителей. Подходящими фармацевтическими рецептурами для введения в форме аэрозолей или спреев являются, например, растворы, суспензии или эмульсии соединений формулы (I) или их физиологически переносимых солей в фармацевтически приемлемом растворителе, таком как этанол или вода, или смеси таких растворителей. Если требуется, то рецептура также может содержать другие фармацевтические вспомогательные вещества, такие как поверхностно-активные вещества, эмульгаторы и стабилизаторы, а также пропеллант. Такой препарат обычно содержит активное соединение в концентрации приблизительно от 0,1 до 50%, в особенности приблизительно от 0,3 до 3 мас.%. Для повышения растворимости и/или стабильности соединений формулы (I) в фармацевтических композициях можно с успехом использовать -, - или -циклодекстрины или их производные. Кроме того, сорастворители, такие как спирты, могут улучшать растворимость и/или стабильность соединений формулы (I) в фармацевтических композициях. При приготовлении водных композиций аддитивные соли рассматриваемых соединений очевидно являются более приемлемыми вследствие их повышенной растворимости в воде. Подходящими циклодекстринами являются -, - или -циклодекстрины (ЦД) или простые эфиры и смешанные простые эфиры, где одна или несколько гидроксильных групп ангидроглюкозных звеньев циклодекстрина замещены C1-6-алкилом, предпочтительно метилом, этилом или изопропилом, например,случайным образом метилированный -ЦД; гидрокси-С 1-6-алкилом, предпочтительно гидроксиэтилом,гидроксипропилом или гидроксибутилом; карбокси-С 1-6-алкилом, предпочтительно карбоксиметилом или карбоксиэтилом; С 1-6-алкилкарбонилом, предпочтительно ацетилом; С 1-6-алкилоксикарбонил-С 1-6 алкилом или карбокси-С 1-6-алкилокси-С 1-6-алкилом, предпочтительно карбоксиметоксипропилом или карбоксиэтоксипропилом; С 1-6-алкилкарбонилокси-С 1-6-алкилом, предпочтительно 2-ацетилоксипропилом. Особенно заслуживают внимания в качестве комплексообразующих соединений и/или солю- 19009871 билизаторов -ЦД, случайным образом метилированный -ЦД, 2,6-диметилЦД, 2-гидроксиэтилЦД,2-гидроксиэтилЦД, 2-гидроксипропилЦД и (2-карбоксиметокси)пропилЦД, и особенно 2 гидроксипропилЦД (2-ГПЦД). Определение "смешанные простые эфиры" относится к производным циклодекстрина, в которых по меньшей мере две гидроксильные группы циклодекстрина этерифицированы различными группами, такими как, например, гидроксипропил и гидроксиэтил. Представляющий интерес способ получения рецептур соединений настоящего изобретения с циклодекстрином или его производными описан в публикации ЕР-А-721331. Хотя рецептуры, описанные в указанной публикации, являются рецептурами с активными противогрибковыми ингредиентами, они в равной степени представляют интерес для получения рецептур соединений настоящего изобретения. Рецептуры, описанные в публикации, особенно подходят для перорального введения и содержат противогрибковое средство в качестве активного ингредиента, достаточное количество циклодекстрина или его производного в качестве солюбилизатора, кислую водную среду в качестве объемного водного носителя и спиртовой сорастворитель, что значительно упрощает приготовление композиции. Указанные рецептуры также могут обеспечивать большую переносимость за счет добавления фармацевтически приемлемых подслащивающих веществ и/или корригирующих вкус и запах веществ. Другие удобные пути усиления растворимости соединений настоящего изобретения в фармацевтических композициях описаны в публикациях WO 94/05263, WO 98/42318, ЕР-А-499299 и WO 97/44014,которые все включены в данное описание в качестве ссылки. Более предпочтительно соединения настоящего изобретения могут быть приготовлены в фармацевтической композиции, содержащей терапевтически эффективное количество частиц, содержащих твердую дисперсию, содержащую (а) соединение формулы (I) и (b) один или несколько фармацевтически приемлемых растворимых в воде полимеров. Определение "твердая дисперсия" означает систему в твердом состоянии (в отличие от жидкого или газообразного состояния), содержащую по меньшей мере два компонента, где один компонент распределен более или менее равномерно по всему другому компоненту или компонентам. Когда указанная дисперсия компонентов такова, что система химически и физически однородна или гомогенна повсюду или содержит одну фазу, как это определено в термодинамике, то такую твердую дисперсию называют"твердым раствором". Твердые растворы являются предпочтительными физическими системами, так как компоненты в них обычно легко биодоступны для организмов, которым они введены. Определение "твердая дисперсия" также включает дисперсии, которые менее гомогенны, чем твердые растворы. Такие дисперсии не являются химически и физически однородными повсюду или содержат более чем одну фазу. Растворимый в воде полимер в частицах обычно представляет собой полимер, который имеет кажущуюся вязкость от 1 до 100 мПас в 2%-м водном растворе при температуре раствора 20 С. Предпочтительными растворимыми в воде полимерами являются гидроксипропилметилцеллюлозы или ГПМЦ. ГПМЦ, имеющие степень замещения метоксигруппами приблизительно от 0,8 до 2,5 и гидроксипропильное молярное замещение приблизительно от 0,05 до 3,0, обычно растворимы в воде. Степень замещения метоксигруппами относится к среднему числу групп метилового эфира, присутствующих в одном ангидроглюкозном звене молекулы целлюлозы. Гидроксипропильное молярное замещение относится к среднему числу молей пропиленоксида, которое прореагировало с каждым ангидроглюкозным звеном в молекуле целлюлозы. Частицы, которые определены выше, могут быть приготовлены путем получения вначале твердой дисперсии компонентов, и затем необязательно измельчением или помолом такой дисперсии. Для приготовления твердых дисперсий существует множество методик, в том числе экструзия из расплава, распылительная сушка и упаривание раствора, причем экструзия из расплава является предпочтительной. Также может быть удобно получать рецептуры соединений настоящего изобретения в форме наночастиц, которые имеют модификатор поверхности, адсорбированный на их поверхности в количестве,достаточном для сохранения эффективного среднего размера частиц менее чем 1000 нм. Подходящими модификаторами поверхности, как полагают, являются модификаторы, которые физически прикрепляются к поверхности антиретровирусного агента, но химически не связаны с антиретровирусным агентом. Подходящие модификаторы поверхности предпочтительно могут быть выбраны из известных органических и неорганических фармацевтических наполнителей. Такими наполнителями являются различные полимеры, низкомолекулярные олигомеры, природные продукты и поверхностно-активные вещества. Предпочтительными модификаторами поверхности являются анионные поверхностно-активные вещества. Еще один представляющий интерес способ получения рецептур соединений настоящего изобретения предлагает фармацевтическую композицию, посредством которой соединения настоящего изобретения вводят в гидрофильные полимеры, и нанесение полученной смеси в виде покрывающей пленки на очень маленькие шарики, обеспечивая таким образом композицию с хорошей биодоступностью, которая может быть удобно изготовлена и которая подходит для приготовления фармацевтических дозированных- 20009871 форм для перорального введения. Указанные шарики содержат (а) центральное, округлое или сферическое ядро, (b) покрывающую пленку из гидрофильного полимера и антиретровирусного агента и (с) закрепляющий покрывающий полимерный слой. Материалы, приемлемые для использования в качестве ядра шариков, разнообразны, при условии,что указанные материалы являются фармацевтически приемлемыми и имеют подходящие размеры и твердость. Примерами таких материалов являются полимеры, неорганические вещества, органические вещества и сахариды и их производные. Способ введения может зависеть от состояния субъекта, сопутствующего лечения и т.д. Другой аспект настоящего изобретения относится к набору или контейнеру, содержащему соединение формулы (I) в количестве, эффективном для использования в качестве стандарта или реагента в тесте или анализе для определения способности потенциального фармацевтического средства ингибировать обратную транскриптазу ВИЧ, развитие ВИЧ, или и то, и другое. Указанный аспект настоящего изобретения может найти применение в исследовательских фармацевтических программах. Соединения настоящего изобретения могут быть использованы в мониторинговых оценках фенотипической устойчивости, таких как известные рекомбинантные анализы, при клиническом лечении развивающих устойчивость заболеваний, таких как ВИЧ. Особенно полезной системой мониторинга устойчивости является рекомбинантный анализ, известный как Antivirogram.Antivirogram представляет собой высокоавтоматизированный, высокопроизводительный, второго поколения, рекомбинантный анализ, который позволяет измерять чувствительность, особенно вирусную чувствительность, к соединениям настоящего изобретения (Hertogs K. et al., Antimicrob Agents Chemother, 1998; 42(2), 269-276, включено в качестве ссылки). Представляет интерес то, что соединения настоящего изобретения могут содержать химически реакционноспособные остатки, способные образовывать ковалентные связи с локализованными сайтами,так что указанные соединения имеют повышенное удерживание тканями и увеличенные периоды полувыведения. Определение "химически реакционноспособные группы", используемое в данном случае,относится к химическим группам, способным образовывать ковалентные связи. Реакционноспособные группы обычно стабильны в водной среде и обычно представляют собой карбоксильную, фосфорильную или обычную ацильную группу, или в виде сложного эфира или смешанного ангидрида, или имидата,или имидата малеиновой кислоты, в результате чего способны образовывать ковалентную связь с такими функциональностями, как амино-, гидрокси- или тиольная группа на сайте-мишени, например, на компонентах крови, таких как альбумин. Соединения настоящего изобретения могут быть связаны с имидом малеиновой кислоты или его производными с образованием конъюгатов. Доза соединений настоящего изобретения или его физиологически переносимой(ых) соли(ей), которая должна быть введена, зависит от каждого конкретного случая, и обычно она должна быть адаптирована к состояниям отдельного случая для достижения оптимального эффекта. Таким образом, доза зависит, естественно, от частоты введения и эффективности и продолжительности действия соединения,используемого в каждом случае для лечения или профилактики, а также от природы и серьезности инфекции и симптомов, и от пола, возраста, массы, сопутствующего лекарства и индивидуальной реакции человека или животного, которые подвергаются лечению, а также от того, является ли лечение неотложным или профилактическим. Обычно ежедневная доза соединения формулы (I) при введении больному весом приблизительно 75 кг составляет от 1 мг до 3 г, предпочтительно от 3 мг до 1 г, более предпочтительно от 5 мг до 0,5 г. Доза может быть введена в форме отдельной дозы или поделенной на несколько,например две, три или четыре, отдельные дозы. Надписи на чертежах Фиг. 1: Эксперимент по времени добавления. Ось Y: нормализованная популяция вируса в %. Ось X: время добавления исследуемого соединения, в часах, после инфицирования клетками с ВИЧ-LAI. Фиг. 2: Ингибирование in vitro обратной транскриптазы. Ось Y: процент ингибирования обратной транскриптазы ВИЧ в сравнении с контролем. Ось X: количество соединения, добавленного в лунки, в микромолях.- 21009871 Экспериментальная часть. Получение соединений формулы (I) и их промежуточных соединений. Схема примера А 1. В синтезе соединений (f) и (g) используют коммерчески доступный 1-ацетил-3-гидроксииндол (а). Конденсация промежуточного соединения (а) с 4-нитроанилином при кипячении с обратным холодильником в уксусной кислоте дает 3-4-нитрофенил)амино)индол (b) (Valzheva et al., Chem. Heterocycl.Copmd. (Engl. Tranel.); 14, 1978, 757, 759, 760; Химия гетероциклических соединений; 14, 1978, 939). Деацилирование промежуточного соединения (b) с помощью триэтиламина при кипячении с обратным холодильником в метаноле и формилирование промежуточного соединения (с) с использованием оксихлорида фосфора в диметилформамиде приводит к промежуточному соединению (d) [Ryabova S.Yu., Tugusheva N.Z., Alekseeva L.M., Granik V.G., Pharm. Chem, J.; (Engl.Transl.), EN 30, 7; 1996, 472-477, Khim.Farm. Zh.; RU (Россия), 30, 7, 1996, 42-46]. Конденсация Кневенагеля промежуточного соединения (d) с этилцианоацетатом в присутствии каталитического количества триэтиламина и последующая внутримолекулярная циклизация промежуточного соединения (е) при кипячении с обратным холодильником в 1,2 этандиоле дают соединение (1) (1-(4-нитрофенил)-2-оксо-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3 карбонитрил) [Ryabova S.Yu., Alekseeva L.M., Granik B.G., Chem. Heterocycl. Compd., (Engl. Translat.), 36,3, 2000, 36, 301-306; Химия гетероциклических соединений, RU (Россия), 3, 2000, 362-367]. Nметилирование с использованием метилйодида приводит к соединению (2) (5-метил-1-(4-нитрофенил)-2 оксо-2,5-дигидро-1 Н-пиридо[3,2-b]индол-3-карбонитрил). Более конкретно, к смеси N-ацетил-3-гидроксииндола (а) (0,114 моль, 20 г) в уксусной кислоте(150 мл) добавляют 4-нитроанилин (1,5 экв., 0,171 моль, 23,65 г). Смесь нагревают при кипячении с обратным холодильником 5 ч и охлаждают до комнатной температуры. Оранжевый осадок отфильтровывают и промывают изопропанолом и диизопропиловым эфиром, получают промежуточное соединение b[S.Yu. Ryabova, N.Z. Tugusheva, L.M. Alekseeva, V.G. Granik, Pharmaceutical Chemistry Journal, 1996, 30,472-477]. (20,71 г, выход 62%, чистота (ЖХ)98%). Промежуточное соединение b (0,070 моль, 20,71 г) смешивают с метанолом (200 мл) и триэтиламином (3 экв., 0,210 моль, 21,27 г) и смесь нагревают при кипячении с обратным холодильником 4 ч, охлаждают до комнатной температуры и упаривают при пониженном давлении до сухого порошка. Сырой продукт с [S.Yu. Ryabova, N.Z. Tugusheva, L.M. Alekseeva, V.G. Granik, Pharmaceutical Chemistry Journal,1996, 30, 472-477] (чистота (ЖХ)95%) используют так, как он есть, на следующей стадии. К охлажденному льдом N,N-диметилформамиду (далее ДМФА) (50 мл) добавляют по каплям оксихлорид фосфора (3 экв., 0,210 моль, 32,22 г), поддерживая внутреннюю температуру 10 С, и охлажденную смесь перемешивают 1 ч. Затем добавляют по каплям раствор с в ДМФА (100 мл), поддерживая во время добавления реакционную температуру 10 С. Баню со льдом убирают и реакционную смесь перемешивают при комнатной температуре 1,5 ч. Смесь выливают в смесь лед-вода (1 л) и затем нагревают в течение ночи при 60 С и охлаждают до комнатной температуры. Осадок отфильтровывают, промывают последовательно водой, изопропанолом и диизопропиловым эфиром, получают промежуточное соединение d [S.Yu. Ryabova, N.Z. Tugusheva, L.M. Alekseeva, V.G. Granik, Pharmaceutical Chemistry Journal, 1996,- 22009871 30, 472-477]. (15,93 г, выход 81%, чистота (ЖХ)95%). К смеси d (0,056 моль, 15,93 г) в изопропаноле (150 мл) добавляют триэтиламин (1,5 экв.,0,085 моль, 8,59 г) и этилцианоацетат (0,068 моль, 7,69 г). Смесь нагревают при кипячении с обратным холодильником 2 ч, охлаждают до комнатной температуры, фильтруют, и остаток последовательно промывают изопропанолом и диизопропиловым эфиром, получают промежуточное соединение е [S.Yu. Ryabova, L.M. Alekseeva, B.G. Granik, Chemistry of Heterocyclic Compounds, 2000, 36, 301-306]. (16,42 г, выход 78%, чистота (ЖХ)95%). Суспензию d (0,043 моль, 16,42 г) в этиленгликоле (200 мл) при перемешивании нагревают при кипячении с обратным холодильником 2 ч и охлаждают до комнатной температуры. Осадок отфильтровывают и последовательно промывают изопропанолом и диизопропиловым эфиром. Сырое соединение 1 кристаллизуют из смеси ДМФА/вода следующим образом: сырой осадок растворяют в теплом ДМФА(250 мл). К теплому раствору добавляют воду (100 мл) и охлаждают до комнатной температуры, что приводит к осаждению соединения 1. Осадок отфильтровывают и последовательно промывают изопропанолом и диизопропиловым эфиром, получают соединение 1 (10,52 г, выход 73%, чистота (ЖХ)98%). 1 Н ЯМР (, ДМСО-D6): 6,11 (1 Н, д, J8 Гц), 6,86 (1 Н, т, J8 Гц), 7,38 (1 Н, т, J8 Гц), 7,54 (1 Н, д,J8 Гц), 7,91 (2 Н, д, J=8,6 Гц), 8,55 (2 Н, д, J=8,6 Гц), 8,70 (1 Н, с), 12,00 (1 Н, ушир.с). К смеси соединения 1 (6,05 ммоль, 2,0 г) в ДМФА (20 мл) добавляют карбонат калия (2 экв.,12,11 ммоль, 1,674 г) и метилйодид (1,5 экв., 9,08 ммоль, 1,289 г) и смесь нагревают при кипячении с обратным холодильником 2 ч. Теплую суспензию дополнительно разбавляют ДМФА (40 мл). К теплому раствору по каплям добавляют воду (40 мл) и смесь охлаждают до комнатной температуры, что приводит к кристаллизации соединения 2. Осадок отфильтровывают и последовательно промывают изопропанолом и диизопропиловым эфиром, получают соединение 2 (2,085 г, выход 91%, чистота (ЖХ)98%). 1 Н ЯМР (, ДМСО-D6): 3,93 (3 Н, с), 6,12 (1 Н, д, J8 Гц), 6,89 (1 Н, т, J8 Гц), 7,45 (1 Н, т, J8 Гц),7,64 (1 Н, д, J8 Гц), 7,89 (2 Н, д, J=8,5 Гц), 8,54 (2 Н, д, J=8,5 Гц), 8,99 (1 Н, с). Схема примера А 2. Раствор дигидрата хлорида олова(II) (10 экв., 0,060 моль, 13,54 г) в концентрированной соляной кислоте (20 мл) добавляют по каплям к охлажденному раствору (0 С) соединения 1 (0,006 моль, 2 г) в этаноле (50 мл). Смесь нагревают при 60 С в течение 4 ч. Раствор охлаждают до комнатной температуры и добавляют насыщенный водный раствор бикарбоната натрия до pH7. Соединение 54 отфильтровывают и промывают последовательно изопропанолом и диизопропиловым эфиром (1,23 г, выход 68%, чистота(ЖХ)98%). К смеси соединения 54 (0,333 ммоль, 100 мг) в ДМФА (1 мл) добавляют диметилацеталь N,Nдиметилформамида (10 экв., 3,33 ммоль, 396 мг). Реакционную смесь нагревают при кипячении с обратным холодильником 1 ч. После охлаждения реакционную смесь охлаждают до комнатной температуры,раствор разбавляют диизопропиловым эфиром и перемешивают 1/2 ч. Осадок отфильтровывают и промывают диизопропиловым эфиром, получают соединение 40 (103 мг, выход 84%, чистота (ЖХ) = 96%). Схема примера А 4. К раствору соединения 7 (0,312 ммоль, 107 мг) в этаноле (1 мл) при перемешивании добавляют раствор дигидрата хлорида олова(II) (3,5 экв., 1,09 ммоль, 245 мг) в концентрированной соляной кислоте(0,4 мл) и реакционную смесь перемешивают при 60 С в течение 2 ч. Реакционную смесь разбавляют водой и добавляют бикарбонат натрия до pH7. Осадок отфильтровывают. Осадок промывают изопропанолом и диизопропиловым эфиром, получают сырое соединение 89, которое используют так, как оно есть, на следующей стадии. Раствор 2,5-диметокситетрагидрофурана (160 мг, 1,21 ммоль, 2,9 экв.) в уксусной кислоте (2,5 мл)- 23009871 добавляют по каплям к раствору амина 89 (132 мг, 0,42 ммоль) в уксусной кислоте (5 мл) при 90 С. Смесь перемешивают при 90 С в течение 5 мин и охлаждают до комнатной температуры. Осадок отфильтровывают и промывают водой, получают 130 мг коричневого твердого вещества. Сырой продукт дополнительно очищают препаративной ВЭЖХ, получают соединение 59 (63 мг, выход 41%, чистота(ЖХ) = 94%) в виде коричневого твердого вещества. Схема примера А 6. К смеси амина 89 (104 мг, 0,33 ммоль) в пиридине (3 мл) добавляют диформилгидразин (87 мг,0,99 ммоль), после чего по каплям добавляют триметилсилилхлорид (539 мг, 4,96 ммоль) и триэтиламин(234 мг, 2,32 ммоль). Реакционную смесь нагревают при 100 С в течение 2,5 ч и охлаждают до комнатной температуры. Смесь концентрируют и упаривают совместно с толуолом. Полученный остаток забирают в метанол и фильтруют. Фильтрат концентрируют, получают 110 мг желтого твердого вещества. Сырой продукт очищают препаративной ВЭЖХ, получают соединение 61 в виде ярко-желтого твердого вещества (50 мг, выход 41%). Схема примера А 7. Способ А. К раствору соединения 1 (0,6 ммоль, 0,200 г) в ДМФА (15 мл) при перемешивании добавляют карбонат калия (3 экв., 1,8 ммоль, 0,248 г) и гидрохлорида 1-(2-хлорэтил)пирролидина (1,5 экв.,0,9 ммоль, 0,152 г) и смесь нагревают при кипячении с обратным холодильником 5 ч. Смесь охлаждают до комнатной температуры, добавляют воду, осадок отфильтровывают и последовательно промывают изопропанолом и диизопропиловым эфиром, получают соединение 13 (0,192 г, выход 75%, чистота (ЖХ)95%). Способ В. К смеси соединения 1 (6,1 ммоль, 2,00 г) в ДМФА (20 мл) при перемешивании добавляют в атмосфере азота при комнатной температуре гидрид натрия (13 ммоль, 0,538 г, 60%). Реакционную смесь перемешивают при комнатной температуре 30 мин и порциями добавляют 1-(2 хлорэтил)пирролидин (6,6 ммоль, 1,13 г). Смесь перемешивают в течение ночи при комнатной температуре. Растворитель удаляют при пониженном давлении, добавляют воду, водный раствор экстрагируют этилацетатом (3 раза). Органическую фазу сушат (MgSO4), фильтруют и растворитель удаляют при пониженном давлении. Сырой продукт очищают на силикагеле (дихлорметан/метанол, 90/10), получают соединение 13 (1,023 г, выход 40%, чистота (ЖХ)98%). Схема примера А 8. К смеси соединения 1 (3 ммоль, 1,00 г) в ДМФА (25 мл) добавляют гидрид натрия (1,2 экв.,3,6 ммоль, 172 мг 50%-го NaH в минеральном масле) и смесь нагревают 1 ч до 50 С. Смесь охлаждают до комнатной температуры и добавляют 1-бром-3-хлорпропан (1,5 экв., 4,5 ммоль, 0,702 г). Реакционную- 24009871 смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь, содержащую промежуточное соединение f, используют, так как она есть на следующей стадии. К 5 мл реакционной смеси с предыдущей стадии, содержащей промежуточное соединение f(0,606 ммоль), добавляют пирролидин (1,5 экв., 0,909 ммоль, 0,065 г) и смесь нагревают в течение 5 ч при 70 С. Реакционную смесь охлаждают до комнатной температуры, осаждают водой и последовательно промывают изопропанолом и диизопропиловым эфиром. Очистка препаративной ВЭЖХ дает соединение 24 (0,040 г, выход 15%, чистота (ЖХ)95%). Схема примера А 9. К смеси соединения 1 (2 ммоль, 0,660 г) в ДМФА (7,5 мл) при перемешивании добавляют карбонат калия (6 ммоль, 0,828 г) и трет-бутил-2-бромацетат (2 экв., 4 ммоль, 0,776 г) и смесь нагревают при кипячении с обратным холодильником 1 ч. Соединение 125 не выделяют, а используют на следующей стадии так, как оно есть. К сырой реакционной смеси соединения 18 добавляют 12 н. соляную кислоту до pH 0-1. Смесь нагревают при кипячении с обратным холодильником 1 ч, охлаждают до комнатной температуры и осаждают водой. Осадок отфильтровывают и последовательно промывают водой, изопропанолом и диизопропиловым эфиром, получают соединение 19 (0,495 г, выход 64%, чистота 98%). К смеси соединения 19 (0,13 ммоль, 0,0050 г) в ДМФА (4 мл) добавляют 1,1'-карбонилдиимидазол и смесь перемешивают при комнатной температуре 2 ч. Добавляют 1-метилпиперазин и смесь перемешивают в течение ночи при комнатной температуре. Соединение 20 осаждают добавлением воды и продукт отфильтровывают. Осадок последовательно промывают изопропанолом и диизопропиловым эфиром,получают соединение 20 (0,039 г, выход 63%, чистота (ЖХ)95%). Схема примера А 10. К смеси соединения 2 (2,90 ммоль, 1,00 г) в этаноле (20 мл) добавляют гидрохлорид гидроксиламина (5 экв., 14,52 ммоль, 1,01 г) и карбонат калия (6 экв., 17,43 ммоль, 2,408 г). Смесь нагревают при кипячении с обратным холодильником 24 ч, охлаждают до комнатной температуры и осадок отфильтровывают, последовательно промывают водой, изопропанолом и диизопропиловым эфиром, получают соединение 70 (0,933 г, выход 81%, чистота (ЖХ) = 94%). К смеси соединения 70 (0,265 ммоль, 0,100 г) в пиридине (15 мл) добавляют трифторуксусный ангидрид (1,2 экв., 0,318 ммоль, 0,038 г) и триэтиламин (1,5 экв., 0,400 ммоль, 0,040 г) и смесь нагревают при кипячении с обратным холодильником 12 ч. Растворитель удаляют в вакууме, и остаток очищают хроматографией на силикагеле смесью дихлорметан/метанол (95/5), получают соединение 72 (0,044 г,выход 33%, чистота (ЖХ) = 91%). К смеси соединения 70 (0,265 ммоль, 0,100 г) в ацетонитриле (15 мл) при перемешивании добавляют 1,1'-карбонилдиимидазол (0,318 ммоль, 0,052 г) и смесь нагревают при кипячении с обратным холодильником в течение ночи. Смесь охлаждают до комнатной температуры, добавляют воду и экстрагируют дихлорметаном (330 мл). После упаривания водного слоя получают соединение 63 (0,058 г, выход 54%, чистота = 83%). Схема примера А 12. К смеси соединения 70 (0,265 ммоль, 0,100 г) в ацетонитриле (15 мл) при перемешивании добавляют 1,1'-тиокарбонилдиимидазол (0,318 ммоль, 0,057 г) и 1,8-диазобицикло[5.4.0]ундецен-7-ен(0,318 ммоль, 0,048 г) и смесь нагревают при 80 С в течение 1 ч. Растворитель удаляют при пониженном давлении, добавляют воду и смесь подкисляют 1 н. соляной кислотой до pH 1. Осадок отфильтровывают и последовательно промывают водой, изопропанолом и диизопропиловым эфиром. Осадок повторно кристаллизуют смесью ДМФА/вода и кристаллы отфильтровывают и последовательно промывают водой, изопропанолом и диизопропиловым эфиром, получают соединение 73 (0,063 г, выход 54%, чистота К смеси промежуточного соединения d (7,43 ммоль, 2,091 г) в метаноле (50 мл) добавляют диметилмалонат (1,2 экв., 8,92 ммоль, 1,179 г) и пиперидин (каталитическое количество) и смесь нагревают при кипячении с обратным холодильником 5 ч. Осадок отфильтровывают и последовательно промывают изопропанолом и диизопропиловым эфиром, получают соединение 74 (1,53 г, выход 54%, чистота (ЖХ)= 95%). К смеси соединения 74 (3,48 ммоль, 1,265 г) в ДМФА (35 мл) добавляют метилйодид (1,5 экв.,5,22 ммоль, 0,741 г) и карбонат калия (2 экв., 6,963 ммоль, 0,962 г). Смесь нагревают до 100 С в течение 2 ч, охлаждают до комнатной температуры и при добавлении воды получают осадок. Осадок отфильтровывают и последовательно промывают изопропанолом и диизопропиловым эфиром, получают соединение 75 (1,213 г, выход 92%, чистота (ЖХ) = 98%). К смеси соединения 75 (0,53 ммоль, 0,200 г) в ДМФА (5 мл) добавляют метоксид натрия (2 экв.,1,06 ммоль, 0,057 г), растворенный в метаноле (2 мл) и формамид (10 экв., 5,30 ммоль, 0,239 г) и смесь- 26009871 нагревают до 100 С в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры и при добавлении воды получают осадок. Осадок отфильтровывают и последовательно промывают изопропанолом и диизопропиловым эфиром, получают соединение 76 (0,150 г, выход 78%, чистота (ЖХ) = 97%). Раствор гидроксида калия (1,10 ммоль, 0,062 г) в воде (3 мл) добавляют при перемешивании к раствору соединения 74 в метаноле (7 мл) и смесь нагревают при кипячении с обратным холодильником 2 ч. Смесь охлаждают до комнатной температуры и подкисляют 2 н. соляной кислотой до осаждения продукта. Осадок отфильтровывают и сушат в течение ночи в вакуумной печи при 50 С, получают соединение 77 (0,110 г, выход 40%, чистота (ЖХ)98%). Схема примера А 14. Соединение 1 (0,303 ммоль, 100 мг) растворяют в ДМФА (2 мл). Равными порциями в течение 6 дней добавляют азид натрия (15 экв., 4,545 ммоль, 294 мг) и хлорид аммония (15 экв., 4,545 ммоль,240 мг), при этом реакционную смесь перемешивают при 125 С. Реакционную смесь охлаждают до комнатной температуры, выливают в воду (30 мл) и перемешивают при комнатной температуре 1/2 ч. Осадок отфильтровывают. Осадок промывают водой. Перекристаллизация из смеси ацетонитрил/ацетон дает соединение 69 (23 мг, выход 20%, чистота (ЖХ)95%). Схема примера А 15. К смеси промежуточного соединения d (1,00 ммоль, 0,281 г) в ТГФ (10 мл) добавляют третбутоксид калия (1,10 экв., 1,10 ммоль, 0,123 г) и этил-3-пиридилацетат (1,00 экв., 1,00 ммоль, 0,165 г). Смесь перемешивают и нагревают при 90 С в течение ночи. Реакционную смесь концентрируют. Остаток растворяют в этилацетате и промывают водой. Органическую фазу сушат над сульфатом магния,фильтруют и упаривают досуха. Остаток очищают препаративной ВЭЖХ, получают соединение 64 (0,008 г, выход 2%, чистота К смеси N-ацетил-3-гидроксииндола (0,057 моль, 10,00 г) в толуоле (100 мл) добавляют 4-бром- 27009871 анилин (1,1 экв., 0,063 моль, 10,80 г) и каталитическое количество п-толуолсульфоновой кислоты. Реакционную смесь нагревают при кипячении с обратным холодильником 4 ч с азеотропной отгонкой воды. При охлаждении до комнатной температуры кристаллизуется промежуточное соединение g. Осадок отфильтровывают и промывают толуолом, получают промежуточное соединение g (9,60 г, выход 51%, чистота (ЖХ)95%). Смесь соединения g (0,056 моль, 18,53 г) в хлорацетилхлориде (85 мл) нагревают при кипячении с обратным холодильником 15 мин. Реакционную смесь концентрируют при пониженном давлении. К остатку добавляют изопропанол (50 мл) и реакционную смесь нагревают при кипячении с обратным холодильником 10 мин. Реакционную смесь охлаждают, осадок фильтруют и промывают изопропанолом,получают промежуточное соединение h (17,00 г, выход 74%, чистота (ЖХ) = 95%). К смеси промежуточного соединения h (0,0419 моль, 17,00 г) в метаноле (170 мл) добавляют триэтиламин (1,2 экв., 0,0503 моль, 5,09 г). Реакционную смесь нагревают при кипячении с обратным холодильником 1 ч. Охлажденную реакционную смесь фильтруют. Осадок промывают диэтиловым эфиром,получают промежуточное соединение i (13,41 г, выход 88%, чистота (ЖХ) = 95%). В первом реакционном сосуде к раствору промежуточного соединения i (0,0386 моль, 14,03 г) в ДМФА (140 мл) добавляют цианид калия (2,50 экв., 0,0965 моль, 6,28 г). Реакционную смесь нагревают при кипячении с обратным холодильником 3 ч и охлаждают до комнатной температуры. Во втором реакционном сосуде охлаждают до 0 С сухой ДМФА (45 мл). По каплям добавляют оксихлорид фосфора(2,5 экв., 0,0965 моль, 14,8 г), поддерживая внутреннюю температуру 10 С, и реакционную смесь перемешивают при 0 С еще 1/2 ч. Затем содержимое первого реакционного сосуда добавляют по каплям при перемешивании к комплексу POCl3-ДМФА во втором реакционном сосуде, поддерживая температуру 10 С. Реакционную смесь перемешивают в течение ночи при комнатной температуре, выливают в воду(860 мл) и перемешивают при 70 С в течение 6 ч. Охлажденную реакционную смесь фильтруют. Осадок промывают изопропанолом и диизопропиловым эфиром, получают соединение 38 (12,18 г, выход 87%,чистота (ЖХ)95%). К раствору соединения 38 (0,0233 моль, 8,49 г) в ДМФА (85 мл) добавляют диметилацеталь N,Nдиметилформамида (10 экв., 0,233 моль, 27,72 г). Реакционную смесь нагревают при кипячении с обратным холодильником 1 ч. Реакционную смесь охлаждают до комнатной температуры, выливают в воду К раствору три(трет-бутил)фосфина в толуоле (0,24 экв., 0,0635 ммоль, 0,4 М, 159 мкл) в герметичной пробирке добавляют трис(дибензилиденацетон)палладий(0) (0,1 экв., 0,026 ммоль, 24 мг). Добавляют сухой ТГФ (3 мл) и реакционную смесь перемешивают в атмосфере азота при комнатной температуре 10 мин. Во второй герметичной пробирке смешивают соединение 39 (0,264 ммоль, 100 мг), 3 фурилбороновую кислоту (2 экв., 0,53 ммоль, 59 мг) и фторид калия (3,3 экв., 0,87 ммоль, 51 мг) и к полученной суспензии при перемешивании с помощью шприца добавляют раствор из первой герметичной пробирки. Реакционную смесь перемешивают в атмосфере азота при комнатной температуре 2 дня. Реакционную смесь фильтруют через декалит и декалит промывают дихлорметаном (100 мл). Объединенные фильтраты концентрируют в вакууме, получают темно-коричневое масло. Полученный остаток растворяют в ДМФА (2 мл), выливают в воду (20 мл) и перемешивают при комнатной температуре 1/2 ч. Осадок отфильтровывают, промывают водой, изопропанолом и диизопропиловым эфиром и дополнительно очищают препаративной ВЭЖХ, получают соединение 58 (25 мг, выход 26%, чистота (ЖХ) 95%). К смеси N-ацетил-3-гидроксииндола а (85,624 ммоль, 15 г) в уксусной кислоте (150 мл) добавляют 4-аминобензонитрил (1,5 экв., 0,128 моль, 15,17 г) и смесь нагревают при кипячении с обратным холодильником 4 ч. Реакционную смесь охлаждают льдом 1 ч, что приводит к кристаллизации продукта реакции. Осадок отфильтровывают, промывают последовательно изопропанолом и диизопропиловым эфиром, получают промежуточное соединение j в виде белого порошка (9,24 г, выход 58%, чистота (ЖХ) 98%). К смеси промежуточного соединения j (0,053 моль, 14,7 г) в уксусном ангидриде (150 мл) добавляют каталитическое количество диметиламинопиридина и смесь нагревают при кипячении с обратным холодильником в течение ночи. Растворитель удаляют при пониженном давлении, получают черную смолу, содержащую промежуточное соединение k. Сырой продукт реакции используют так, как он есть,на следующей стадии. Сырую смесь промежуточного соединения k растворяют в ДМФА (200 мл) и охлаждают на ледяной бане. К полученной реакционной смеси при перемешивании по каплям добавляют предварительно смешанный раствор (при использовании охлаждения) оксихлорида фосфора (5 экв., 0,31 моль, 30 мл) и ДМФА (50 мл) и продолжают перемешивание при 0 С еще несколько часов. Затем содержимое реакционной смеси выливают на смесь лед-вода (1,5 л) и нагревают при кипячении с обратным холодильником в течение ночи. Смеси дают охладиться до комнатной температуры, фильтруют и осадок промывают последовательно водой, изопропанолом и диизопропиловым эфиром, получают соединение 93 в виде черных кристаллов (12,4 г, выход 81% (по двум стадиям), чистота (ЖХ)98%). К смеси соединения 93 (0,043 моль, 12,4 г) в ДМФА (120 мл) добавляют диметилацеталь N,Nдиметилформамида (5 экв., 0,217 моль, 29 мл) и смесь нагревают при кипячении с обратным холодильником. Через 3 ч добавляют другую часть диметилацеталя N,N-диметилформамида (5 экв., 0,217 моль,29 мл) и смесь нагревают при кипячении с обратным холодильником в течение ночи. Реакционную смесь выливают в смесь воды (800 мл) и уксусной кислоты (10 мл) и перемешивают 1 ч, получают черный осадок. Осадок фильтруют и последовательно промывают водой, изопропанолом и диизопропиловым эфиром, получают соединение 96 в виде черного порошка (8,20 г, выход 63%, чистота (ЖХ)98%). 1 Н ЯМР (, ДМСО-D6): 3,90 (3 Н, с), 6,06 (1 Н, д, J8 Гц), 6,61 (1 Н, д, J=9,60 Гц), 6,85 (1 Н, т, J8 Гц),7,31 (1 Н, т, J8 Гц), 7,58 (1 Н, д, J8 Гц), 7,72 (2 Н, д, J=8,3 Гц), 8,15-8,19 (3 Н, м). Схема примера С 2. К раствору соединения 96 (40,758 ммоль, 12,2 г) в этаноле (130 мл) при перемешивании добавляют гидрохлорид гидроксиламина (5 экв., 0,143 моль, 9,91 г) и карбонат калия (6 экв., 0,171 моль, 23,6 г) и смесь нагревают при 70 С в течение ночи. Растворитель удаляют при пониженном давлении. Остаток забирают в дихлорметан (250 мл) и воду (1 л) и интенсивно перемешивают 1 ч. Смесь фильтруют и осадок промывают водой, изопропанолом и диизопропиловым эфиром, получают соединение 97 в виде чер- 29009871 ного порошка (5,68 г, выход 60%, чистота (ЖХ) = 90%). К раствору соединения 97 (0,0003 моль, 100 мг) в пиридине (2 мл) при перемешивании добавляют ацетилхлорид (1,2 экв., 0,00036 моль, 28 мг) и реакционную смесь нагревают при кипячении с обратным холодильником в течение ночи. Растворитель удаляют при пониженном давлении, остаток забирают в дихлорметан (25 мл) и промывают рассолом. Органический слой сушат над сульфатом магния, фильтруют и растворитель удаляют при пониженном давлении. Продукт очищают быстрой хроматографией К смеси соединения 97 (0,3 ммоль, 100 мг) в ацетонитриле (5 мл) добавляют 1,1'карбонилдиимидазол (1,2 экв., 0,36 ммоль, 0,060 г) и перемешивают при нагревании (80 С) 6 ч. Растворитель удаляют при пониженном давлении, остаток забирают в дихлорметан (25 мл) и рассол (25 мл) и интенсивно перемешивают 30 мин. Фильтрование реакционной смеси дает соединение 83 (0,067 г, выход 62%, чистота (ЖХ)98%). Колбу, содержащую соединение 83 (0,1 г, 0,279 ммоль), снабжают трубкой с CaCl2. Добавляют по каплям оксихлорид фосфора (3 мл) и нагревают при кипячении с обратным холодильником в течение ночи. Реакционную смесь выливают в смесь лед-вода (150 мл) и перемешивают 1 ч. Смесь фильтруют и промывают водой, изопропанолом и диизопропиловым эфиром, получают соединение 126 (0,080 г, выход 71%, чистота (ЖХ) = 93%). К раствору соединения 126 (0,090 г, 0,239 ммоль) в ацетонитриле (4 мл) при перемешивании добавляют метиламин, 40%-й раствор в воде (10 экв., 2,390 ммоль, 269 мг) и реакционную смесь перемешивают при комнатной температуре 2 ч. Растворитель удаляют при пониженном давлении, получают соединение 120 (0,091 г, выход 99%, чистота 95%). Схема примера С 4. К смеси соединения 83 (0,279 ммоль, 0,100 г) и карбоната калия (2 экв., 0,519 ммоль, 0,071 г) в ДМФА (5 мл) по каплям добавляют метилйодид (2 экв., 0,519 ммоль, 0,074 г) в ДМФА (5 мл). Реакционную смесь перемешивают при комнатной температуре 5 ч. Растворитель удаляют при пониженном давлении, остаток смешивают с водой (100 мл) и интенсивно перемешивают 1 ч. Осадок отфильтровывают и промывают водой, изопропанолом и диизопропиловым эфиром, получают соединение 117 (0,072 г, выход 74%, чистота (ЖХ) = 90%).
МПК / Метки
МПК: C07D 221/00, C07D 471/00, A61P 31/12, C07D 209/00, A61K 31/437
Метки: индолпиридиниевые, качестве, противоинфекционного, соединения, средства, замещённые
Код ссылки
<a href="https://eas.patents.su/30-9871-zameshhyonnye-indolpiridinievye-soedineniya-v-kachestve-protivoinfekcionnogo-sredstva.html" rel="bookmark" title="База патентов Евразийского Союза">Замещённые индолпиридиниевые соединения в качестве противоинфекционного средства</a>
Предыдущий патент: Замещённый 2-аминотетралин для лечения депрессии
Следующий патент: Анти-aβ антитела
Случайный патент: Лечебное средство