Сульфонамидные производные для лечения заболеваний
Номер патента: 9735
Опубликовано: 28.02.2008
Авторы: Браун Алан Дэниел, Моузес Айан Брайан, Лейн Шарлотта Элис Луиза, Томсон Николас Марри, Джеймс Ким
Формула / Реферат
1. Соединение общей формулы (1)
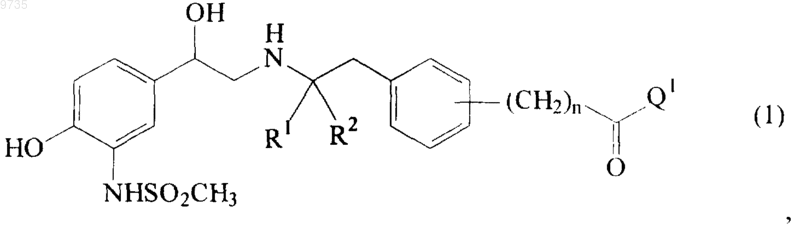
где группа (CH2)n-C(=O)Q1 находится в мета- или пара-положении, R1 и R2 независимо выбраны из Н и С1-С4алкила, n равен 0, 1 или 2 и Q1 представляет собой группу, выбранную из
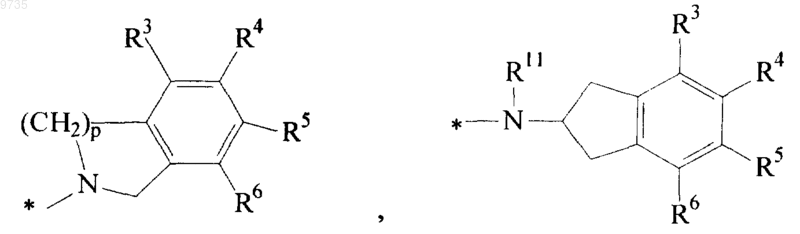
и группы *-NR11-Q2-А, где р равен 1 или 2, Q2 представляет собой С1-С4алкилен, R11 представляет собой Н или С1-С4алкил и А представляет собой пиридил, С3-С10циклоалкил, причем указанный циклоалкил возможно имеет мостик из одного или более атомов углерода, тетрагидропиранил, пиперидинил, возможно замещенный бензилом, тетрагидротиопиранил или группу
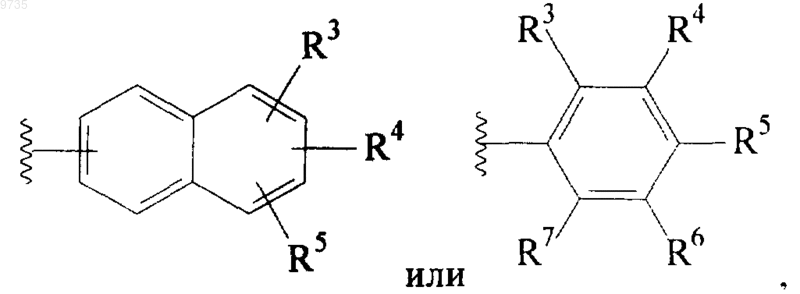
где R3, R4, R5, R6 и R7 являются одинаковыми или разными и выбраны из Н, С1-С4алкила, OR8, SR9, галогено, CN, CF3, OCF3, COOR9, SO2NR9R10, CONR9R10, NR9R10, NHCOR10 и фенила;
где R8 представляет собой С1-С4алкил и R9 и R10 являются одинаковыми или разными и выбраны из Н или С1-С4алкила, а * представляет собой точку присоединения к карбонильной группе;
или, если целесообразно, его фармацевтически приемлемые соли и/или их изомеры, таутомеры, сольваты или изотопные варианты.
2. Соединение по п.1, где Q1 представляет собой NH-Q2-A, где Q2 представляет собой СН2 и А представляет собой циклогексил, тетрагидротиопиранил, пиперидинил, возможно замещенный бензилом, или нафтил.
3. Соединение по п.1, где Q1 представляет собой

где R3, R4, R5 и R6 представляют собой Н.
4. Соединение по п.1, где Q1 представляет собой группу *-NH-Q2-A, где Q2 представляет собой С1-С4алкилен и А представляет собой группу
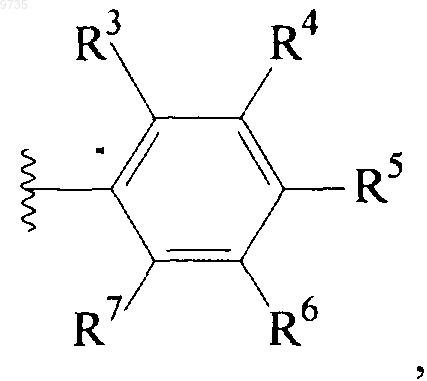
где R3, R4, R5, R6 и R7 являются одинаковыми или разными и выбраны из Н, С1-С4алкила, OR8, SR9, CN, галогено, CF3, OCF3, SO2NR9R10, CONR9R10, NR9R10, NHCOR10 и фенила, при условии, что по меньшей мере 2 из радикалов R3-R7 представляют собой Н;
где R8 представляет собой С1-С4алкил и R9 и R10 являются одинаковыми или разными и выбраны из Н или-С1-С4алкила.
5. Соединение по п.4, где Q представляет собой -CH2-, -(СН2)2- или -(CH2)3-.
6. Соединение по п.5, где Q2 представляет собой -СН2-.
7. Соединение по любому из пп.4-6, где А представляет собой группу

где R3, R4, R5, R6 и R7 являются одинаковыми или разными и выбраны из Н, СН3, ОСН2-СН3, SCH3, галогено, CF3, OCF3, фенила, диметиламино, CN, трет-бутила, при условии, что по меньшей мере 2 из радикалов R3-R7 представляют собой Н.
8. Соединение по п.7, где R3, R4, R5, R6 и R7 являются одинаковыми или разными и выбраны из Н, СН3, Cl, F, CF3, при условии, что по меньшей мере 2 из радикалов R3-R7 представляют собой Н.
9. Соединение по любому из пп.1-8, где R1 представляет собой Н или С1-С4алкил и R2 представляет собой С1-С4алкил.
10. Соединение по п.9, где R1 представляет собой Н или СН3 и R2 представляет собой СН3.
11. Соединение по п.10, где n равен 1.
12. (R,R)-Стереоизомер соединения по любому из пп.1-11.
13. Соединение по любому из пп.1-11, где группа (CH2)n-C(=O)Q1 находится в мета-положении.
14. Соединение по п.1, выбранное из группы, состоящей из
N-бензил-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)ацетамида,
2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)-N-(4-метоксибензил)ацетамида,
2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)-N-(2-метоксибензил)ацетамида,
N-(2-этоксибензил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил} этил)амино]-2-метилпропил}фенил)ацетамида,
2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)-N-(3-метоксибензил)ацетамида,
2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)-N-(4-метилбензил)ацетамида,
2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)-N-(2-метилбензил)ацетамида,
2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)-N-(3-метилбензил)ацетамида,
N-(3,4-диметоксибензил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)ацетамида,
N-(2,4-диметоксибензил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)ацетамида.
N-(3,5-диметоксибензил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)ацетамида,
N-(4-хлорбензил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил} этил)амино]-2-метилпропил}фенил)ацетамида,
N-(2-хлорбензил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил} этил)амино]-2-метилпропил}фенил)ацетамида,
N-(3-хлорбензил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил} этил)амино]-2-метилпропил}фенил)ацетамида,
N-(4-фторбензил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил} этил)амино]-2-метилпропил}фенил)ацетамида,
N-(2,4-дихлорбензил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил} этил)амино]-2-метилпропил}фенил)ацетамида,
N-(3,4-дихлорбензил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил} этил)амино]-2-метилпропил}фенил)ацетамида,
N-(4-трет-бутилбензил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино] фенил}этил)амино]-2-метилпропил}фенил)ацетамида,
N-(2-хлор-6-фторбензил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)ацетамида,
N-(2,3-диметилбензил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)ацетамида,
N-(3,5-дихлорбензил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил} этил)амино]-2-метилпропил}фенил)ацетамида,
N-[3,5-бис(трифторметил)бензил]-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил) амино]фенил}этил)амино]-2-метилпропил}фенил)ацетамида,
N-(3,4-диметилбензил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил} этил)амино]-2-метилпропил}фенил)ацетамида,
N-(2,5-дихлорбензил)-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино] фенил}этил)амино]пропил}фенил)ацетамида,
2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)-N-(2-фенилэтил)ацетамида,
2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)-N-(3-фенилпропил)ацетамида,
N-(2,3-дихлорбензил)-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино] фенил}этил)амино]пропил}фенил)ацетамида,
N-(2,4-дихлор-6-метилбензил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино] фенил}этил)амино]-2-метилпропил}фенил)ацетамида,
N-(циклогексилметил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил} этил)амино]-2-метилпропил}фенил)ацетамида,
N-(2-хлор-6-метилбензил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)ацетамида,
N-(2-этоксибензил)-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)ацетамида,
N-(3,4-диметилбензил)-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино] фенил}этил)амино]пропил}фенил)ацетамида,
N-(3,4-дихлорбензил)-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино] фенил}этил)амино]пропил}фенил)ацетамида,
2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)-N-(3-фенилпропил)ацетамида,
N-(циклогексилметил)-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино] фенил}этил)амино]пропил}фенил)ацетамида,
N-(2-хлор-6-фторбензил)-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино] фенил}этил)амино]пропил}фенил)ацетамида,
N-(2-хлор-4-фторбензил)-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино] фенил}этил)амино]пропил}фенил)ацетамида,
N-(3,5-дихлорбензил)-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино] фенил}этил)амино]пропил}фенил)ацетамида,
2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)-N-[4-(трифторметил)бензил]ацетамида,
N-(2,5-дихлорбензил)-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино] фенил}этил)амино]пропил}фенил)ацетамида,
N-[4-фтор-2-(трифторметил)бензил]-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)ацетамида,
N-[4-фтор-3-(трифторметил)бензил]-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)ацетамида,
N-[2-фтор-4-(трифторметил)бензил]-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)ацетамида,
N-(2,4-дихлор-6-метилбензил)-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил) амино]фенил}этил)амино]пропил}фенил)ацетамида,
N-[4-хлор-3-(трифторметил)бензил]-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)ацетамида,
N-[2-хлор-5-(трифторметил)бензил]-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)ацетамида,
N-[3,5-бис(трифторметил)бензил]-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)ацетамида,
N-[3-фтор-5-(трифторметил)бензил]-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)ацетамида,
N-(3,4-дихлорбензил)-2-(4-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил} этил)амино]-2-метилпропил}фенил)ацетамида,
N-[2-хлор-5-(трифторметил)бензил]-2-(4-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил) амино]фенил}этил)амино]-2-метилпропил}фенил)ацетамида,
N-[4-хлор-3-(трифторметил)бензил]-2-(4-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил) амино]фенил}этил)амино]-2-метилпропил}фенил)ацетамида,
N-[3,5-бис(трифторметил)бензил]-2-(4-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил) амино]фенил}этил)амино]-2-метилпропил}фенил)ацетамида,
N-[3-фтор-5-(трифторметил)бензил]-2-(4-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил) амино]фенил}этил)амино]-2-метилпропил}фенил)ацетамида,
N-[2-фтор-5-(трифторметил)бензил]-2-(4-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил) амино]фенил}этил)амино]-2-метилпропил}фенил)ацетамида,
N-[4-фтор-2-(трифторметил)бензил]-2-(4-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил) амино]фенил}этил)амино]-2-метилпропил}фенил)ацетамида,
N-[4-фтор-3-(трифторметил)бензил]-2-(4-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил) амино]фенил}этил)амино]-2-метилпропил}фенил)ацетамида,
2-(4-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)-N-(2-метоксиибензил)ацетамида,
N-(2-этоксибензил)-2-(4-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)ацетамида,
N-бензил-2-(4-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил) амино]пропил}фенил)ацетамида,
2-(4-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)-N-(3-фенилпропил)ацетамида,
N-(2,3-дигидро-1Н-инден-2-ил)-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил) амино]фенил}этил)амино]пропил}фенил)ацетамида,
2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)-N-(2-метоксибензил)ацетамида,
N-бензил-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил) амино]пропил}фенил)ацетамида,
2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)-N-(2-фенилэтил)ацетамида,
2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)-N-(мезитилметил)ацетамида,
2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)-N-(2,3,6-трихлорбензил)ацетамида,
2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)-N-[3-(трифторметил)бензил]ацетамида,
N-(2,3-дихлорбензил)-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино] фенил}этил)амино]пропил}фенил)ацетамида,
N-(3-хлор-4-метилбензил)-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)ацетамида,
2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)-N-[2-(метилтио)бензил]ацетамида,
2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)-N-[4-(метилтио)бензил]ацетамида,
2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)-N-(тетрагидро-2H-тиопиран-4-ил)ацетамида,
N-(бифенил-2-илметил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)ацетамида,
2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)-N-(1-нафтилметил)ацетамида,
2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)-N-(пиридин-2-илметил)ацетамида,
2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)-N-[4-(трифторметокси)бензил]ацетамида,
N-(4-цианобензил)-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)ацетамида,
N-[4-(диметиламино)бензил]-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил) амино]фенил}этил)амино]пропил}фенил)ацетамида,
2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]пропил}фенил)-N-фенилацетамида,
N-(1-бензилпиперидин-4-ил)-2-(3-{(2R)-2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил) амино]фенил}этил)амино]пропил}фенил)ацетамшфр и
2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)-N-(мезитилметил)ацетамида.
15. N-Бензил-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил) амино]-2-метилпропил}фенил)ацетамид.
16. 2-(3-{2-[((2R)-2-Гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)-N-(4-метоксибензил)ацетамид.
17. 2-(3-{2-[((2R)-2-Гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)-N-(4-метилбензил)ацетамид.
18. N-(4-Хлорбензил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил} этил)амино]-2-метилпропил}фенил)ацетамид.
19. N-(3,4-Дихлорбензил)-2-(3-{2-[((2R)-2-гидрокси-2-{4-гидрокси-3-[(метилсульфонил)амино]фенил}этил)амино]-2-метилпропил}фенил)ацетамид.
20. Фармацевтическая композиция, обладающая активностью b2-агониста, включающая соединение формулы (1), как оно описано в любом из пп.1-19, или его фармацевтически приемлемую соль, или производную форму вместе с обычными фармацевтически безвредными эксципиентами и/или добавками.
21. Способ получения соединения формулы (1) по любому из пп.1-19, включающий следующие стадии:
(а) сочетание кислоты формулы (2)
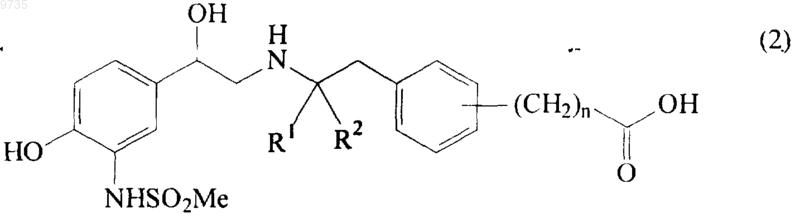
где R1, R2 и n такие, как они определены в п.1, с амином формулы NH2-Q2-A (3),
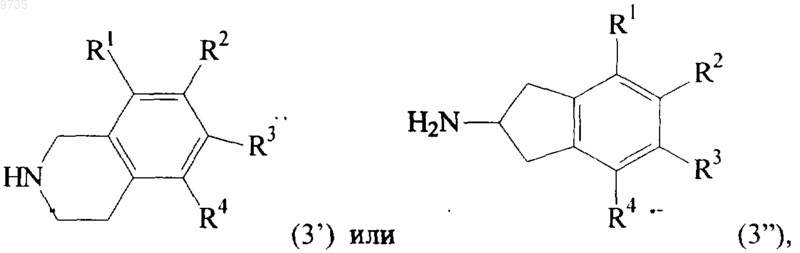
где радикалы R3-R6, Q2 и А такие, как они определены в п.1,
(б) выделение указанного соединения формулы (1).
22. Комбинация обладающего активностью b2-агониста соединения по любому из пп.1-19 с другим(и) терапевтическим(и) агентом(ами), выбранным(и) из
(а) ингибиторов 5-липоксигеназы (5-LO) или антагонистов 5-липоксигеназаактивирующего белка (FLAP),
(б) антагонистов лейкотриена (LTRA), включая антагонистов LTB4, LTC4, LTD4 и LTE4,
(в) антагонистов гистаминового рецептора, включая H1- и Н3-антагонистов,
(г) агонистических по отношению к a1- и a2-адренорецепторам сосудосуживающих симпатомиметических агентов для использования в качестве противозастойных средств,
(д) антагонистов мускаринового М3-рецептора или антихолинергических агентов,
(е) ингибиторов PDE (фосфодиэстераза), например ингибиторов PDE3, PDE4 и PDE5,
(ж) теофиллина,
(з) кромогликата натрия,
(и) ингибиторов СОХ (циклооксигеназа) как неселективных, так и селективных ингибиторов СОХ-1 или COX-2 (NSAID (нестероидные противовоспалительные лекарства),
(к) пероральных и ингалируемых глюкокортикостероидов, таких как DAGR (диссоциированные агонисты кортикоидного рецептора),
(л) моноклональных антител, активных против эндогенных воспалительных объектов,
(м) агентов против фактора некроза опухоли (анти-TNF-a),
(н) ингибиторов молекул адгезии, включая антагонистов VLA-4 (очень поздний антиген-4),
(о) антагонистов кинин-B1- и -В2-рецепторов,
(п) иммуносупрессивных агентов,
(р) ингибиторов матриксных металлопротеиназ (ММР),
(с) антагонистов тахикининовых NK1-, NK2- и NK3-рецепторов,
(т) ингибиторов эластазы,
(у) агонистов аденозинового А2а-рецептора,
(ф) ингибиторов урокиназы,
(х) соединений, воздействующих на допаминовые рецепторы, например D2-агонистов,
(ц) модуляторов NFkb-пути, например ингибиторов IKK (IkB киназа),
(ш) модуляторов цитокиновых сигнальных путей, таких как р38 МАР-киназа (митогенактивируемая протеинкиназа), syk-киназа или ингибитор JAK-киназы (Янус-киназа),
(щ) агентов, которые можно классифицировать как муколитические или противокашлевые средства, и
(э) антибиотиков.
23. Соединение формулы (2) или его соль
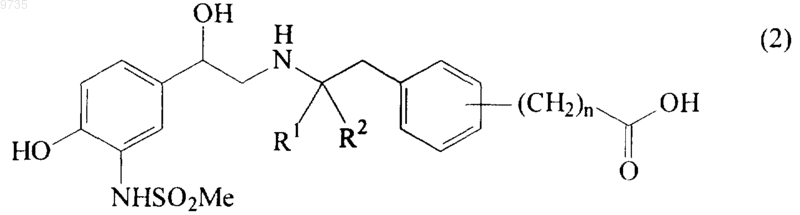
где R1, R2 и n такие, как определено в п.1.
Текст
009735 Данное изобретение относится к 2-агонистам общей формулы: где R1, R2, n и Q1 имеют указанные ниже значения,и к способам получения таких производных, композициям, содержащим такие производные, и применениям таких производных. Адренергические рецепторы являются членами большого суперсемейства G-белок-связанных рецепторов. Само подсемейство адренергических рецепторов делится на - и -подсемейства, причем подсемейство состоит по меньшей мере из 3-х рецепторных подтипов: 1, 2 и 3. Эти рецепторы демонстрируют различный характер экспрессии в тканях разнообразных систем и органов млекопитающих. 2-адренергические (2) рецепторы главным образом экспрессируются в клетках гладких мышц (например гладких мышц сосудов, бронхов, матки или кишечника), в то время как 3-адренергические рецепторы главным образом экспрессируются в жировых тканях (следовательно, 3-агонисты могли бы быть потенциально полезными в лечении ожирения и диабета), а 1-адренергические рецепторы главным образом экспрессируются в сердечных тканях (следовательно, 1-агонисты главным образом полезны в качестве сердечных стимуляторов). В литературе представлен широкий обзор по патофизиологии и способам лечения заболеваний дыхательных путей (в качестве ссылки смотри Barres, P.J. Chest, 1997, 111:2, pp. 17S-26S и Bryan, S.A. et al,Expert Opinion on investigational drugs, 2000, 9:1, pp. 25-42), и поэтому в данное описание изобретения будет включено краткое изложение с целью представления некоторой информации о предшествующем уровне техники. Глюкокортикостероиды, антилейкотриены, теофиллин, кромоны, антихолинергические средства и 2-агонисты составляют классы лекарственных средств, которые в настоящее время используют для лечения аллергических и неаллергических заболеваний дыхательных путей, таких как астма и хроническая обструктивная болезнь легких (ХОБЛ). Терапевтические рекомендации для этих заболеваний включают ингалируемые 2-агонисты как короткого, так и длительного действия. 2-Агонисты короткого действия с быстрым началом действия используются для спасательной бронходилатации, в то время как формы длительного действия обеспечивают длительнее облегчение и используются в качестве поддерживающей терапии. Бронходилатация опосредуется через агонизм 2-адренергического рецептора, экспессируемого клетками гладких мышц дыхательных путей, что приводит к релаксации и, следовательно, к бронходилатации. Таким образом, как функциональные антагонисты 2-агонисты могут предупреждать и реверсировать эффекты всех вызывающих бронхостеноз веществ, включая лейкотриен D4 (LTD4), ацетилхолин,брадикинин, простагландины, гистамин и эндотелины. Поскольку 2-рецепторы весьма широко распространены по дыхательному пути, 2-агонисты также могут воздействовать на другие типы клеток, которые играют роль в астме. Например, сообщалось о том, что 2-агонисты могут стабилизировать тучные клетки. Ингибирование высвобождения вызывающих бронхостеноз веществ может осуществляться как блокирование 2-агонистами бронхостеноза, индуцируемого аллергенами, физической нагрузкой и холодным воздухом. Кроме того, 2-агонисты ингибируют холинергическую нейротрансмиссию в дыхательных путях человека, что может приводить к снижению холинергического рефлекторного бронхостеноза. Кроме того, было установлено, что в дополнение к дыхательным путям (2-адренергические рецепторы экспрессируются в других органах и тканях и поэтому такие 2-агонисты, как, например, описанные в настоящем изобретении, могут находить применение в лечении других заболеваний, таких как заболевания нервной системы, преждевременные роды, застойная сердечная недостаточность, депрессия. воспалительные и аллергические кожные заболевания, псориаз, пролиферативные кожные заболевания,глаукома, но ими не ограничиваться, и при состояниях, где преимущество заключается в понижении кислотности желудка, в особенности при язве желудка и пептической язве. Однако применение многих 2-агонистов ограничено их низкой селективностью или неблагоприятными побочными эффектами, имеющими место вследствие значительного системного воздействия и главным образом опосредованными действием на 2-адренергические рецепторы, экспрессируемые вне дыхательных путей (мышечный тремор, тахикардия, учащенное сердцебиение, беспокойство). Следовательно, имеется необходимость в улучшенных агентах этого класса. Согласно этому все еще имеется необходимость в новых 2-агонистах, которые могли бы иметь соответствующий фармакологический профиль, например, в терминах эффективности, фармакокинетики-1 009735 или продолжительности действия. В этом контексте настоящее изобретение относится к новым 2 агонистам. Различные сульфонамидные производные уже были описаны. Например, в WO 02066250 описаны соединения, активные как 3-агонисты, селективные в отношении 2, имеющие формулу где m может быть равно 2, R1 может представлять собой Н, ОН или NR5SO2R5 (при этом R5 представляет собой Н или C1-С 6 алкил), Z может представлять собой связь, R2 может представлять собой Н или C1-С 6 алкил, R4 может представлять собой C1-С 6 алкил, В может быть фенилом, Y представляет собой где R1 может представлять собой фенил, замещенный гидрокси и алкилсульфониламино, X1 может представлять собой связь, R2 может представлять собой водород, R3 представляет собой водород или гидроксиалкил, Х 2 может представлять собой CH2, Х 3 представляет собой связь, О или NH, и R4 представляет собой циклическую группу. Кроме того, в патенте США 5776983 описаны другие сульфонамидные производные как 3 агонисты. Более конкретно они представлены формулой где R1 может представлять собой СН 3, R2 может представлять собой ОН, R6 может представлять собой Н, R3 может представлять собой Н или алкил, R4 может представлять собой Н, алкил, R5 может представлять собой Н, R5 может представлять собой C(O)NR6R6', где R6 и R6' могут представлять собой Н или низший алкил. Тем не менее ни одно из вышеупомянутых сульфонамидных производных не показало селективной 2-агонистической активности, что позволило бы использовать их в качестве эффективных лекарственных средств в лечении 2-опосредованных заболеваний и/или состояний, в особенности аллергических и неаллергических заболеваний дыхательных путей или других заболеваний, таких как перечисленные ранее заболевания. Данное изобретение относится к соединениям общей формулы (1) где группа (CH2)n-C(=O)Q1 находится в мета- или пара-положении, R1 и R2 независимо выбраны из Н и С 1-С 4 алкила, n равен 0, 1 или 2, и Q1 представляет собой группу, выбранную из и группы -NR11-Q2-A, где р равен 1 или 2, Q2 представляет собой С 1-С 4 алкилен, R11 представляет собой Н или С 1-С 4 алкил, и А представляет собой пиридил, С 3-С 10 циклоалкил, причем указанный циклоалкил возможно имеет мостик из одного или более, предпочтительно 1, 2, 3 или 4, атомов углерода, тетрагидропиранил, пиперидинил, возможно замещенный бензилом, тетрагидротиопиранил либо группу-2 009735 где R3, R4, R5, R6 и R7 являются одинаковыми или разными и выбраны из Н, C1-С 4 алкила, OR8, SR9,галогено, CN, CF3, OCF3, COOR9, SO2NR9R10, CONR9R10, NR9R10, NHCOR10 и фенила; где R8 представляет собой С 1-С 4 алкил, и R9 и R10 являются одинаковыми или разными и выбраны из Н или С 1-С 4 алкила, ипредставляет собой точку присоединения к карбонильной группе; или, если целесообразно, их фармацевтически приемлемым солям и/или их изомерам, таутомерам,сольватам или изотопным вариантам. Соединения формулы (1) являются агонистами 2-рецепторов, особенно полезными для лечения 2-опосредованных заболеваний и/или состояний и показывающими хорошую эффективность, в особенности при введении посредством ингаляции. В приведенной выше в данном описании изобретения общей формуле (1) C1-С 4 алкил и С 1 С 4 алкилен обозначают прямую или разветвленную группу, содержащую 1, 2, 3 или 4 атома углерода. Это также применимо, если они несут заместители или являются заместителями других радикалов, например,в O-(С 1-С 4)алкильных радикалах, S-(С 1-С 4)алкильных радикалах и так далее. Примерами подходящих(С 1-С 4)алкильных радикалов являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил,трет-бутил. Примерами подходящих O-(С 1-С 4)алкильных радикалов являются метокси, этокси, нпропилокси, изопропилокси, н-бутилокси, изобутилокси, втор-бутилокси и трет-бутилокси. С 3-С 10 циклоалкил, где 2 атома углерода или более возможно соединены мостиковой связью посредством одного или более атомов углерода, включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил, адамантил, бицикло[3.1.1]гептан, бицикло[2.2.1]гептан, бицикло[2.2.2]октан. Предпочтительными циклоалкильными группами являются циклогексил и адамантил. Наконец, галогено означает атом галогена, выбранный из группы, состоящей из фторо, хлоро, бромо и иодо, в особенности фторо или хлоро. Далее свободная связь на фенильной группе, как, например, на структуре ниже, означает, что фенил может быть замещен по мета- или параположению. Соединения формулы (1) могут быть получены с использованием традиционных методик, как например путем следующих иллюстративных способов, в которых R1, R2, Q1 и n такие, как они определены ранее для соединений формулы (1), если не оговорено особо. Амидные производные формулы (1) могут быть получены путем сочетания кислоты формулы (2) или ее соли: с амином формулы NHR11-Q2-A (3), В общем случае реакцию сочетания проводят в избытке указанного амина как рецептора кислоты с использованием традиционного агента сочетания (например, 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорида или N,N'-дициклогексилкарбодиимида) возможно в присутствии катализатора (например, 1-гидроксибензотриазола гидрата или 1-гидрокси-7-азабензотриазола) и возможно в присутствии основания - третичного амина (например, N-метилморфолина, триэтиламина или диизопропилэтиламина). Реакция может быть проведена в подходящем растворителе, таком как пиридин, диметилформамид, тетрагидрофуран, диметилсульфоксид, дихлорметан или этилацетат, и при температуре от 10 до 40 С (комнатная температура) в течение периода времени 1-24 ч. Указанный амин (3), (3') или (3") либо имеется в продаже, либо может быть получен традиционными способами, хорошо известными специалисту в данной области техники (например, восстановление,-3 009735 окисление, алкилирование, опосредованное переходным металлом сочетание, введение защиты, снятие защиты и так далее), из имеющегося в продаже материала. Кислота формулы (2) может быть получена из соответствующего сложного эфира формулы (4): где Ra представляет собой подходящую защитную группу кислоты, предпочтительно (С 1-С 4) алкильную группу, которая включает метил и этил, но этим не ограничивается, согласно любому способу,хорошо известному специалисту в данной области техники для получения кислоты из сложного эфира,без изменения остальной части молекулы. Например, сложный эфир может быть гидролизован путем обработки водной кислотой или основанием (например, хлористым водородом, гидроксидом калия, гидроксидом натрия или гидроксидом лития), возможно в присутствии растворителя или смеси растворителей (например, воды, пропионитрила, 1,4-диоксана, смеси тетрагидрофуран/вода) при температуре от 20 до 100 С в течение периода времени от 1 до 40 ч. Сложный эфир формулы (4) может быть получен путем взаимодействия амина формулы (5): где Ra и n такие, как они определены ранее, с бромидом формулы (6): В типичной методике амин формулы (5) приводят во взаимодействие с бромидом формулы (6) возможно в присутствии растворителя или смеси растворителей (например, диметилсульфоксида, толуола,N,N-диметилформамида, пропионитрила, ацетонитрила), возможно в присутствии подходящего основания (например триэтиламина, диизопропилэтиламина, карбоната калия, гидрокарбоната калия) при температуре от 80 до 120 С в течение 12-48 ч. Бромид формулы (6) может быть получен согласно способу из WO 02/06258 (с. 36, пример 14 а). Амин формулы (5), где R1 представляет собой Me, и R2 представляет собой Н, может быть получен в виде либо (R)-, либо (S)-энантиомера из соответствующего защищенного амина формулы (7) где Ra и n такие, как они определены ранее, и Rb и Rc представляют собой любые подходящие заместители, так что HNRbRc представляет собой хиральный амин (например, Rb может быть водородом,и Rc может быть -метилбензилом) при условии, что связи между N и Rb и N и Rc могут легко расщепляться с получением свободного амина формулы (5) при использовании стандартной методологии отщепления защитных групп для азота, таких как группы, которые можно найти в руководстве T.W. GREENE,Protective Groups in Organic Synthesis, A. Wiley-Interscience Publication, 1981. Амин формулы (7) может быть получен в виде единичного диастереомера путем взаимодействия амина формулы HNRbRc с кетоном формулы (8): где Ra, Rb, Rc и n такие, как они определены ранее. В типичной методике взаимодействие кетона формулы (8) с амином формулы HNRbRc приводит к получению хирального промежуточного соединения, которое, в свою очередь, восстанавливают с использованием подходящего восстанавливающего агента (например, цианборгидрида натрия формулыNaCNBH3 или триацетоксиборгидрида натрия формулы Na(OAc)3BH) возможно в присутствии высушивающего агента (например, молекулярных сит, сульфата магния) и возможно в присутствии кислотного катализатора (например, уксусной кислоты) с получением амина формулы (7) в виде смеси диастереомеров. Реакцию обычно проводят в растворителе, таком как тетрагидрофуран или дихлорметан, при температуре от 20 до 80 С в течение 3-72 ч. Полученный продукт затем превращают в соль гидрохлорид и из-4 009735 бирательно кристаллизуют из подходящего растворителя или смеси растворителей (например, изопропанола, этанола, метанола, диизопропилового эфира или смеси диизопропиловый эфир/метанол) с получением (7) в виде единичного диастереомера. Кетон формулы (8), где n=1, может быть получен путем опосредованного палладием сочетания арилгалогенида формулы (9): где Ra такой, как он определен ранее, и Hal представляет собой атом галогена, включающий бромо и иодо, но ими не ограничивающийся, с енолятом или эквивалентом енолята. В типичной методике арилгалогенид формулы (9) приводят во взаимодействие с енолятом олова,образованным in situ путем обработки изопренилацетата метилатом три-н-бутилолова формулыBu3SnOMe в присутствии подходящего палладиевого катализатора (ацетат палладия/три-орто-толилфосфин формулы Pd(ОАс)2/Р(о-Tol)3) в неполярном растворителе (например, толуоле, бензоле, гексане). Предпочтительно реакцию проводят при температуре от 80 до 110 С в течение 6-16 ч. Арилгалогенид формулы (9) может быть получен путем этерификации соответствующей кислоты формулы (10) где Hal такой, как он определен ранее, согласно любому способу, хорошо известному специалисту в данной области техники для получения сложного эфира из кислоты без изменения остальной части молекулы. В типичной методике кислоту формулы (10) приводят во взаимодействие со спиртовым растворителем формулы RaOH, где Ra такой, как он определен ранее, в присутствии кислоты, такой как хлористый водород, при температуре от 10 до 40 С (комнатная температура) в течение 8-16 ч. Кислота формулы (10) имеется в продаже. Амин формулы (5), где R1 = R2 = алкил, может быть получен согласно следующей схеме: Схема 1 где R1, R2 и Ra такие, как они определены ранее. В типичной методике сложный эфир формулы (11) приводят во взаимодействие с активированным алкилом (органометаллическим алкилом, таким как R2MgBr, R2MgCl или R2Li) с получением соответствующего третичного спирта формулы (12), используя описанный выше способ. Указанный третичный спирт формулы (12) далее обрабатывают алкилнитрилом (например, ацетонитрилом, хлорацетонитрилом) в присутствии кислоты (например, серной кислоты, уксусной кислоты) с получением защищенного промежуточного производного, которое, в свою очередь, подвергают расщеплению, используя стандартную методологию для отщепления защитной группы азота, такой как группы,упомянутой в справочной литературе. Полученную аминокислоту затем этерифицируют, используя изложенный в данном описании изобретения способ, с получением амина формулы (5). Альтернативно амин формулы (5), где R1 = R2 = С 1-С 4 алкил, и n=0, может быть получен согласно следующей схеме: Схема 2-5 009735 где R1, R2 и Ra такие, как они определены ранее. В типичной методике сложный эфир формулы (13) приводят во взаимодействие с активированным алкилом (органометаллическим алкилом, таким как R2MgBr, R2MgCl или R2Li) с получением соответствующего третичного спирта формулы (14), используя описанный выше способ. Указанный третичный спирт формулы (14) далее обрабатывают алкилнитрилом (например, ацетонитрилом, хлорацетонитрилом) в присутствии кислоты (например, серной кислоты, уксусной кислоты) с получением защищенного промежуточного производного, которое, в свою очередь, подвергают расщеплению, используя стандартную методологию для отщепления защитной группы азота, такой как группы,упомянутой в справочной литературе, с получением бромамина (15). Полученный бромамин (15) обрабатывают подходящим палладиевым катализатором (например,[1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II в атмосфере монооксида углерода, используяRaOH в качестве растворителя (например, МеОН, EtOН), при повышенных температуре (100 С) и давлении (100 ф/кв. дюйм (690 кПа) с получением сложного эфира формулы (5). Кетон формулы (8), где n=2, может быть получен путем восстановления алкена формулы (16): В типичной методике раствор олефина формулы (16) в подходящем растворителе (например, метаноле, этаноле, этилацетате) обрабатывают палладиевым катализатором (например, 10% палладием на угле) и перемешивают в атмосфере водорода, возможно при повышенном давлении (например, 60 ф/кв,дюйм (413,7 кПа, при температуре от комнатной температуры до 60 С в течение 8-24 ч. Алкен формулы (16) может быть получен путем опосредованного палладием сочетания активированного олефина с арилгалогенидом формулы (17): В типичной методике осуществляют сочетание арилгалогенида (17) с виниловым сложным эфиром(например, метилакрилатом) в присутствии подходящего палладиевого катализатора (например, тетракис(трифенилфосфин)палладий(0) формулы Pd(PPh3)4, ацетат палладия/три-орто-толилфосфин формулыPd(OAc)2/P(o-tol)3 или хлорид (дифенилфосфино)ферроценилпалладий формулы dppfPdCl2) в подходящем растворителе (например, ацетонитриле, N,N-диметилформамиде, толуоле), возможно в присутствии основания, такого как триэтиламин, при температуре от 40 до 110 С в течение 8-24 ч. Кетон формулы (17) имеется в продаже. Амин формулы (5), где R1 и R2 оба представляют собой Н, может быть получен согласно следующей схеме: Схема 3 где R1, R2 и Ra такие, как они определены ранее. В типичной методике кислоту формулы (18) предпочтительно восстанавливают до соответствующего спирта (19) в присутствии сложного эфира. Это может быть осуществлено путем образования ацилимидазола или смешанного ангидрида и последующего восстановления с использованием боргидрида натрия или другого подходящего восстанавливающего агента. Указанный первичный спирт формулы (19) затем превращают в уходящую группу, как например мезилат, тозилат, бромид или иодид, и заменяют соответствующим аминным нуклеофилом. Предпочтительным нуклеофилом является азид-ион, который можно затем восстановить до первичного амина посредством гидрирования или с использованием трифенилфосфина. Альтернативно нуклеофилы могут включать аммиак или алкиламины, такие как бензиламин или аллиламин, с последующим отщеплением алкильной группы с получением амина. В типичной методике соединения формулы (1), где R1 и R2 оба представляют собой метил, и n равен 1, могут быть получены путем взаимодействия соединения формулы (21) где Х представляет собой Н, Li, K или Na и органическое аминное основание или другой металл, с подходящим амином формулы NHR8-Q2-A (3), в присутствии традиционного агента сочетания, такого как 1-(3-диметиламинопропил)-3 этилкарбодиимид гидрохлорид или дициклогексилкарбодиимид, в подходящем растворителе, таком как пиридин, диметилформамид и диметилацетамид, возможно в присутствии органического основания (такого как основание Хюнига) и добавки (такой как 1-гидроксибензотриазол), с получением соединения формулы (I) где R1 и R2 представляют собой метил, и n равен 1. Указанное соединение формулы (21) может быть получено путем гидрирования соединения формулы (22) где Х представляет собой Н, Na, Li или K и возможно органический амин или другие металлы, в присутствии подходящего растворителя, такого как метанол, IPA, THF и вода, и в присутствии подходящего катализатора, такого как гидроксид палладия на углероде или палладий на углероде. Указанное соединение формулы (22) может быть получено путем взаимодействия соединения формулы (23) с М-ОН, где М выбран из Li, Na или К, возможно в присутствии подходящего растворителя, такого как пропионитрил, тетрагидрофуран или диоксан, предпочтительно пропионитрил. Указанное соединение формулы (23) может быть получено путем снятия защиты с соединения формулы (24) с использованием агента снятия защиты, такого как фторид тетрабутиламмония, HF или тригидрофторид триэтиламина, в присутствии подходящего растворителя, такого как пропионитрил. Указанное соединение формулы (24) может быть получено путем взаимодействия соединения формулы в присутствии подходящего растворителя, такого как пропионитрил, THF, толуол, этилацетат, ацетонитрил, пропионитрил, диоксан, DMF, DMSO, и возможно в присутствии основания, такого как гидрокарбонат натрия, гидрокарбонат калия, основание Хюнига или триэтиламин, при температуре от 50 до 150 С в течение 12-36 ч. Для некоторых стадий изложенного выше в данном описании изобретения способа получения соединений формулы (1) могут оказаться необходимыми защита потенциальных реакционноспособных функциональных групп, участие которых в реакции нежелательно, и последующее отщепление указанных защитных групп. В таком случае может быть использован любой совместимый защитный радикал. В частности, могут быть использованы такие способы введения и снятия защиты, как способы, описанныеT.W. GREENE (Protective Groups in Organic Synthesis, A. Wiley-Interscience Publication, 1981) или P.J. Kocienski (Protecting groups, Georg Thieme Verlag, 1994). Все вышеупомянутые взаимодействия и реакции получения новых исходных материалов, используемых в предшествующих способах, являются традиционными, и соответствующие реагенты и условия реакций для их осуществления или получения, равно как и методики выделения желаемых продуктов,хорошо известны специалистам в данной области техники со ссылкой на литературные прецеденты и примеры и приведенные там способы получения. Кроме того, соединения формулы (1), а также промежуточные соединения для их получения, могут быть очищены в соответствии с различными хорошо известными способами, такими как, например, кристаллизация или хроматография. Предпочтительно Q1 представляет собой группу -NH-Q2-A, где Q2 представляет собой CH2, и А представляет собой циклогексил, тетрагидротиопиранил, пиперидинил, возможно замещенный бензилом, или нафтил. Предпочтительно Q1 представляет собой где R3, R4, R5 и R6 представляют собой Н. Предпочтительно Q1 представляет собой группу -NH-Q2-A, где Q2 представляет собой С 1 С 4 алкилен, и А представляет собой группу где R3, R4, R5, R6 и R7 являются одинаковыми или разными и выбраны из Н, С 1-С 4 алкила, OR8, SR9,CN, галогено, CF3, OCF3, SO2NR9R10, CONR9R10, NR9R10, NHCOR10 и фенила, при условии, что по меньшей мере 2 из радикалов от R3 до R7 являются Н; где R8 представляет собой С 1-С 4 алкил, и R9 и R10 являются одинаковыми или разными и выбраны из Н или С 1-С 4 алкила. Более предпочтительно Q1 представляет собой группу -NH-Q2-A, где Q2 представляет собой -СН 2-,-(CH2)2-, -(СН 2)3-, предпочтительно -СН 2-, и А представляет собой группу где R3, R4, R5, R6 и R7 являются одинаковыми или разными и выбраны из Н, СН 3, ОСН 2-СН 3, SCH3,галогено, CF3, OCF3, фенила, диметиламино, CN, трет-бутила, при условии, что по меньшей мере 2 из радикалов от R3 до R7 являются Н. Более предпочтительно Q1 представляет собой группу -NH-Q2-A, где Q2 представляет собой -СН 2-,-(CH2)2-, -(СН 2)3-, предпочтительно -СН 2-, и А представляет собой группу где R3, R4, R5, R6 и R7 являются одинаковыми или разными и выбраны из Н, СН 3, Cl, F, CF3, при условии, что по меньшей мере 2 из радикалов от R3 до R7 являются Н. В приведенных выше группах соединений особенно предпочтительны следующие заместители.R2 представляет собой СН 3.R1 представляет собой Н и R2 представляет собой СН 3, а n равен 1.R1 представляет собой СН 3, R2 представляет собой СН 3, а n равен 1. Особенно предпочтительными являются соединения формулы (1), которые изложены далее в разделе примеры, то естьN-[4-фтор-2-(трифторметил)бензил]-2-(4-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил) амино]фенилэтил)амино]-2-метилпропилфенил)ацетамид,N-[4-фтор-3-(трифторметил)бензил]-2-(4-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил) амино]фенилэтил)амино]-2-метилпропилфенил)ацетамид,2-(4-(2R)-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэтил)амино]пропилфенил)-N-(2-метоксибензил)ацетамид,N-(2-этоксибензил)-2-(4-(2R)-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэтил)амино]пропилфенил)ацетамид,N-бензил-2-(4-(2R)-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэтил) амино]пропилфенил)ацетамид,2-(4-(2R)-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]-фенилэтил)амино]пропилфенил)-N-(3-фенилпропил)ацетамид,N-(2,3-дигидро-1 Н-инден-2-ил)-2-(3-(2R)-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил) амино]фенилэтил)амино]пропилфенил)ацетамид,2-(3-(2R)-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэтил)амино]пропилфенил)-N-(2-метоксибензил)ацетамид,N-бензил-2-(3-(2R)-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэтил) амино]пропилфенил)ацетамид,2-(3-(2R)-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэтил)амино]пропилфенил)-N-(2-фенилэтил)ацетамид,2-(3-(2R)-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэтил)амино]пропилфенил)-N-(мезитилметил)ацетамид,2-(3-(2R)-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэтил)амино]пропилфенил)-N-(2,3,6-трихлорбензил)ацетамид,2-(3-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэтил)амино]-2 метилпропилфенил)-N-[3-(трифторметил)бензил]ацетамид,N-(2,3-дихлорбензил)-2-(3-(2R)-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино] фенилэтил)амино]пропилфенил)ацетамид,N-(3-хлор-4-метилбензил)-2-(3-(2R)-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэтил)амино]пропилфенил)ацетамид,2-(3-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэтил)амино]-2-метилпропилфенил)-N-[2-(метилтио)бензил]ацетамид,2-(3-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэтил)амино]-2-метилпропилфенил)-N-[4-(метилтио)бензил]ацетамид,2-(3-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэгил)амино]-2-метилпропилфенил)-N-(тетрагидро-2 Н-тиопиран-4-ил)ацетамид,N-(бифенил-2-илметил)-2-(3-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэтил)амино]-2-метилпропилфенил)ацетамид,2-(3-(2R)-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэтил)амино]пропилфенил)-N-(1-нафтилметил)ацетамид,2-(3-(2R)-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэтил)амино]пропилфенил)-N-(пиридин-2-илметил)ацетамид,2-(3-(2R)-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэтил)амино]пропилфенил)-N-[4-(трифторметокси)бензил]ацетамид,N-(4-цианобензил)-2-(3-(2R)-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэтил)амино]пропилфенил)ацетамид,N-[4-(диметиламино)бензил]-2-(3-(2R)-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил) амино]фенилэтил)амино]пропилфенил)ацетамид,2-(3-(2R)-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэтил)амино] пропилфенил)-N-фенилацетамид,N-(1-бензилпиперидин-4-ил)-2-(3-(2R)-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил) амино]фенилэтил)амино]пропилфенил)ацетамид и 2-(3-2-[2R)-2-гидрокси-2-4-гидрокси-3-[(метилсульфонил)амино]фенилэтил)амино]-2 метилпропилфенил)-N-(мезитилметил)ацетамид. Согласно одному аспекту настоящего изобретения в общем случае предпочтительны соединения формулы (1), где группа (CH2)n-C(=O)Q1 находится в мета-положении. Фармацевтически приемлемые соли соединений формулы (1) включают их соли присоединения кислот и соли с основаниями. Подходящие соли присоединения кислот образованы из кислот, которые образуют нетоксичные соли. Примеры включают следующие соли: ацетат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камзилат, цитрат, эдизилат, эзилат, формиат, фумарат, глюцептат, глюконат,глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидроиодид/иодид,- 11009735 изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат, никотинат,нитрат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, сахарат, стеарат, сукцинат, тартрат, тозилат, трифторацетат и ксинафоат. Подходящие соли с основаниями образованы из оснований, которые образуют нетоксичные соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина,глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. Кроме того, могут быть образованы гемисоли кислот и оснований, например гемисульфатная и гемикальциевая соли. Обзор подходящих солей смотри в Stahl and Wermuth, Handbook of Pharmaceutical Salts: Properties,Selection, and Use, Wiley-VCH, Weinheim, Germany (2002). Фармацевтически приемлемые соли соединений формулы (1) могут быть получены одним или более чем одним из трех способов:(1) путем взаимодействия соединения формулы (1) с желаемыми кислотой или основанием;(2) путем удаления кислото- или щелочно-лабильной защитной группы из подходящего предшественника соединения формулы (1) или путем раскрытия кольца подходящего циклического предшественника, например лактона или лактама, с использованием желаемых кислоты или основания; или(3) путем превращения одной соли соединения формулы (1) в другую посредством взаимодействия с соответствующими кислотой или основанием, либо посредством использования подходящей ионообменной колонки. Все три взаимодействия обычно проводят в растворе. Полученную соль можно осадить и собрать фильтрованием или можно извлечь выпариванием растворителя. Степень ионизации полученной соли может изменяться от полностью ионизированного до почти неионизированного. Соединения по изобретению могут существовать как в несольватированной, так и в сольватированной формах. Термин сольват используется в данном описании изобретения для описания молекулярного комплекса, содержащего соединение по изобретению и стехиометрическое количество молекул одного или более чем одного фармацевтически приемлемого растворителя, например этанола. Термин гидрат используется, когда указанным растворителем является вода. В пределы объема изобретения включены такие комплексы, как клатраты, комплексы включения лекарственное средство-хозяин, где в противоположность вышеупомянутым сольватам лекарственное средство и хозяин присутствуют в стехиометрических или нестехиометрических количествах. Кроме тоги, включены комплексы лекарственного средства, содержащие два или более органических и/или неорганических компонентов, которые могут быть в стехиометрических или нестехиометрических количествах. Полученные комплексы могут быть ионизированы, частично ионизированы или неионизированы. Обзор таких комплексов смотри в Haleblian, J. Pharm. Sci., 64(8), 1269-1288 (August 1975). Далее все ссылки на соединения формулы (1) включают ссылки на их соли, сольваты и комплексы и на сольваты и комплексы их солей. Соединения по изобретению включают соединения формулы (1), которые определены в данном описании изобретения ранее, в том числе все их полиморфы и кристаллические формы, их пролекарства и изомеры (включая оптические, геометрические и таутомерные изомеры), которые определены далее, и меченные изотопом соединения формулы (1). Как указано, так называемые пролекарства соединений формулы (1) также находятся в пределах объема изобретения. Так, некоторые производные соединений формулы (1), которые как таковые могут иметь незначительную фармакологическую активность или не иметь никакой активности, могут при введении внутрь организма или на его поверхность превращаться в соединения формулы (1), имеющие желаемую активность, например в результате гидролитического расщепления. Такие производные обозначаются как пролекарства. Дополнительная информация по использованию пролекарств может быть найдена в Pro-drugs as Novel Delivery Systems, Vol. 14, ACS Symposium Series (T. Higuchi and W. Stella) и Bioreversible Carriers in Drug Design, Pergamon Press, 1987 (ed. E. B. Roche, American PharmaceuticalAssociation). Пролекарства по изобретению могут быть получены, например, путем замены соответствующих функциональных групп, присутствующих в соединениях формулы (1), определенными группировками,известными специалистам в данной области техники в качестве прогруппировок, как описано, например, в Н. Bundgaard, Design of Prodrugs (Elsevier, 1985). Некоторые примеры пролекарств по изобретению включают:(1) когда соединение формулы (1) содержит функциональную группу карбоновой кислоты(-СООН), его сложный эфир, например соединение, где водород функциональной группы карбоновой кислоты соединения формулы (1) заменен (C1-С 8)алкилом;(2) когда соединение формулы (1) содержит спиртовую функциональную группу (-ОН), его простой эфир, например соединение, где водород спиртовой функциональной группы соединения формулы (1) заменен (C1-С 6)алканоилоксиметилом; и(3) когда соединение формулы (1) содержит функциональную группу первичного или вторичного амина (-NH2 или -NHR, где R не является Н), его амид, например соединение, где в качестве примера- 12009735 один или оба водорода аминофункциональной группы соединения формулы (1) заменен/заменены (C1 С 10)алканоилом. Дополнительные примеры замещающих групп в соответствии с изложенными выше примерами и примеры других типов пролекарств типов могут быть найдены в вышеупомянутых ссылках. Более того некоторые соединения формулы (1) сами по себе могут действовать как пролекарства других соединений формулы (1). Кроме того, в пределы объема изобретения включены метаболиты соединений формулы (1), то есть соединения, образуемые in vivo после введения лекарственного средства. Примеры метаболитов по изобретению включают:(1) когда соединение формулы (1) содержит метильную группу, его гидроксиметильное производное (-СН 3-CH2OH);(2) когда соединение формулы (1) содержит алкоксигруппу, его гидроксипроизводное (-OR(3) когда соединение формулы (1) содержит третичную аминогруппу, его производное в виде вторичного амина (-NR1R2-NHR1 или -NHR2);(4) когда соединение формулы (1) содержит вторичную аминогруппу, его производное в виде первичного амина (-NHR1-NH2);(5) когда соединение формулы (1) содержит фенильную группировку, его фенольное производное (Ph-PhOH); и(6) когда соединение формулы (1) содержит амидную группу, его производное в виде карбоновой кислоты (-CONH2-СООН). Соединения формулы (1), содержащие один или более асимметрических атомов углерода, могут существовать в виде двух или более стереоизомеров. Если соединение формулы (1) содержит алкенильную или алкениленовую группу, возможны геометрические цис/транс (или Z/E) изомеры. Если структурные изомеры являются взаимопревращаемыми с низким энергетическим барьером, может иметь место таутомерная изомерия (таутомерия). Она может принимать форму протонной таутомерии в соединениях формулы (1), содержащих, например, группу имино, кето или оксим, либо так называемой валентной таутомерии в соединениях, которые содержат ароматическую группировку. Следовательно, одно соединение может демонстрировать более одного типа изомерии. В пределы объема настоящего изобретения включены все стереоизомеры, геометрические изомеры и таутомерные формы соединений формулы (1), в том числе соединения, демонстрирующие более одного типа изомерии, и смеси одного или более чем одного из них. Кроме того, включены соли присоединения кислот или оснований, где противоион является оптически активным, например d-лактат или lлизин, либо рацемическим, например dl-тартрат или dl-аргинин. Цис/транс-изомеры можно разделить традиционными методами, хорошо известными специалистам в данной области техники, например хроматографией и фракционной кристаллизацией. Традиционные методики получения/выделения индивидуальных энантиомеров включают хиральный синтез из подходящего оптически чистого предшественника или разделение рацемата (или рацемата соли или производного) с использованием, например, хиральной жидкостной хроматографии высокого давления (ЖХВД). Альтернативно рацемат (или рацемический предшественник) можно привести во взаимодействие с подходящим оптически активным соединением, например спиртом либо, в случае, когда соединение формулы (1) содержит кислотную или основную группировку, кислотой или основанием, такими как винная кислота или l-фенилэтиламин. Полученную диастереомерную смесь можно разделить хроматографией и/или фракционной кристаллизацией, а один или оба диастереоизомера превратить в соответствующий чистый энантиомер(ы) способами, хорошо известными специалисту. Хиральные соединения по изобретению (и их хиральные предшественники) можно получить в энантитомерно-обогащенной форме, используя хроматографию, обычно ЖХВД, на асимметрической смоле с подвижной фазой, состоящей из углеводорода, обычно гептана или гексана, содержащего 0-50% по объему изопропанола, обычно 2-20%, и 0-5% по объему алкиламина, обычно 0,1% диэтиламина. Концентрирование элюата позволяет получить обогащенную смесь. Стереоизомерные конгломераты можно разделить традиционными методами, известными специалистам в данной области техники, смотри, например, Е. L. Eliel Stereochemistry of Organic Compounds(Wiley, New York, 1994). Согласно одному аспекту настоящего изобретения в общем случае предпочтителен (R,R)стереоизомер представленной ниже формулы, где R1 представляет собой водород, и R2 представляет собой С 1-С 4 алкил, предпочтительно метил, и n и Q1 такие, как они определены выше:- 13009735 Настоящее изобретение включает все фармацевтически приемлемые меченные изотопами соединения формулы (1), где один или более чем один атом заменен атомом, имеющим тот же атомный номер,атомная масса или массовое число которого отличается от атомной массы или массового числа, преобладающего в природе. Примеры изотопов, подходящих для введения в соединения по изобретению, включают изотопы водорода, такие как 2H и 3 Н, углерода, такие как 11C, 13 С и 14 С, хлора, такие как 36Cl, фтора, такие как 18F,иода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15 О, 17O и 18 О, фосфора, такие как 32 Р, и серы, такие как 35S. Некоторые меченные изотопами соединения формулы (1), например соединения, содержащие радиоактивный изотоп, полезны в исследованиях по распределению лекарственного средства и/или субстрата в тканях. Радиоактивные изотопы тритий, то есть 3 Н, и углерод-14, то есть 14 С, особенно полезны для этой цели по причине легкости их введения и простых средств детектирования. Замещение более тяжелыми изотопами, такими как дейтерий, то есть 2H, может дать некоторые терапевтические преимущества, вытекающие из более высокой метаболической стабильности, например увеличение времени полувыведения in vivo и понижение требований по дозировке, и, следовательно,может быть предпочтительно в некоторых случаях. Замещение излучающими позитроны изотопами, такими как 11 С, 18F, 15O и 13N, может быть полезно в исследованиях с использованием позитронной эмиссионной томографии (PET) для изучения степени занятости рецепторов субстратом. В общем случае меченные изотопами соединения формулы (1) могут быть получены с использованием традиционных методик, известных специалистам в данной области техники, или методов, аналогичных описанным с сопроводительных Примерах и Подготовительных примерах, с использованием меченных соответствующим изотопом реагентов вместо ранее применяемых немеченых реагентов. Фармацевтически приемлемые сольваты по изобретению включают сольваты, где растворитель для кристаллизации может быть изотопно замещенным, например D2O, d6-ацетон, d6-DMSO. Соединения формулы (1), их фармацевтически приемлемые соли и/или их производные формы являются ценными фармацевтически активными соединениями, подходящими для терапии и профилактики многочисленных расстройств, в которые вовлечен 2-рецептор, или при которых агонизация этого рецептора может оказывать целебный эффект, в частности аллергических и неаллергических заболеваний дыхательных путей, а также в лечении других заболеваний, таких как заболевания нервной системы,преждевременные роды, застойная сердечная недостаточность, депрессия, воспалительные и аллергические кожные заболевания, псориаз, пролиферативные кожные заболевания, глаукома, но этим не ограничиваться, и при состояниях, где преимущество заключается в понижении кислотности желудка, в особенности при язве желудка и пептической язве. Соединения по изобретению, предназначенные для фармацевтического применения, могут быть введены в виде кристаллических или аморфных продуктов. Они могут быть приготовлены, например, в виде твердых масс, порошков или пленок такими способами, как осаждение, кристаллизация, сушка вымораживанием, распылением или выпариванием. Микроволновая сушка или сушка с применением радиочастот могут быть использованы для этой цели. Они могут быть введены сами по себе или в комбинации с одним или более чем одним другим соединением по изобретению либо в комбинации с одним или более чем одним другим лекарственным средством (или в виде любой их комбинации). В общем случае их вводят в виде препарата вместе с одним или более чем одним фармацевтически приемлемым эксципиентом. Термин эксципиент используется в данном описании изобретения для описания любого ингредиента, отличного от соединения(й) по изобретению. Выбор эксципиента будет в значительной степени зависеть от таких факторов, как конкретный способ введения, влияние эксципиента на растворимость и стабильность и природа лекарственной формы. Фармацевтические композиции, подходящие для доставки соединений по настоящему изобретению, и способы их приготовления будут легко понятны специалистам в данной области техники. Такие композиции и способы их приготовления можно найти, например, в Remington's Pharmaceutical Sciences, 19th Edition (Mack Publishing Company, 1995). Соединения по изобретению могут быть также введены непосредственно в кровоток, в мышцу или во внутренний орган. Подходящие способы для парентерального введения включают внутривенный,внутриартериальный, внутрибрюшинный, интратекальный, интравентрикулярный, интрауретральный,интрастернальный, интракраниальный, внутримышечный и подкожный. Подходящие устройства для парентерального введения включают игольные (в том числе микроигольные) инжекторы, безыгольные инжекторы и оборудование для инфузии. Парентеральные композиции в типичном случае представляют собой водные растворы, которые могут содержать такие эксципиенты, как соли, углеводы и забуферивающие агенты (предпочтительно до рН от 3 до 9), но для некоторых применений они могут быть изготовлены более подходящим способом в виде стерильного неводного раствора или в виде высушенной формы, которую следует использовать вместе с подходящим разбавителем, таким как стерильная апирогенная вода.- 14009735 Изготовление парентеральных композиций в стерильных условиях, например лиофилизацией, легко может быть выполнено с использованием стандартных фармацевтических методик, хорошо известных специалистам в данной области техники. Растворимость соединений формулы (1), используемых в приготовлении парентеральных растворов, может быть увеличена посредством использования соответствующих методик изготовления композиций, таких как введение улучшающих растворимость агентов. Композиции для парентерального введения могут быть изготовлены для их немедленного и/или модифицированного высвобождения. Композиции модифицированного высвобождения включают задержанное, непрерывное, пульсирующее, контролируемое, целевое и программируемое высвобождение. Так соединения по изобретению могут быть изготовлены в виде твердого вещества, полутвердого вещества или тиксотропной жидкости для введения в качестве имплантированного депо, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких композиций включают покрытые лекарственным средством стенты и микросферы из поли(dl-молочной-когликолевой)кислоты(PGLA). Соединения по изобретению могут также быть введены местно на кожу или слизистую оболочку, то есть дермально или трансдермально. Типичные композиции для этой цели включают гели, гидрогели,лосьоны, растворы, кремы, мази, присыпки, повязки, пенки, пленки, накожные пластыри, облатки, имплантаты, губки, волокна, бандажи и микроэмульсии. Также могут быть использованы липосомы. Типичные носители включают спирт, воду, минеральное масло, жидкий вазелин, белый вазелин, глицерин,полиэтиленгликоль и пропиленгликоль. Могут быть введены вещества, усиливающие проникновение,смотри, например, Finnin and Morgan, J. Pharm. Sci., 88 (10), 955-958 (October 1999). Другие способы местного введения включают доставку посредством электропорации, ионофореза,фонофореза, сонофореза и микроигольной или безыгольной (например Powderject, Bioject и так далее) инъекции. Композиции для местного введения могут быть изготовлены для немедленного и/или модифицированного высвобождения. Композиции модифицированного высвобождения включают задержанное, непрерывное, пульсирующее, контролируемое, целевое и программируемое высвобождение. Кроме того, соединения по изобретению могут быть введены интраназально или посредством ингаляции, в типичном случае в виде сухого порошка (либо сами по себе, в виде смеси, например в виде сухой смеси с лактозой, либо в виде многокомпонентной частицы, например, в смеси с фосфолипидами,таким как фосфатидилхолин) из ингалятора сухого порошка или в виде аэрозольного спрея из находящегося под давлением контейнера, насоса, распылителя, атомайзера (предпочтительно атомайзера, использующего электрогидродинамический принцип для получения высокодисперсного аэрозоля) или небулайзера с использованием или без использования подходящего пропеллента, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан. Для интраназального использования порошок может содержать биоадгезивный агент, например хитозан или циклодекстрин. Находящийся под давлением контейнер, насос, распылитель, атомайзер или небулайзер содержат раствор или суспензию соединения(й) по изобретению, содержащие, например, этанол, водный раствор этанола или подходящий альтернативный агент для диспергирования, солюбилизации или пространственного высвобождения активного начала, пропеллент(ы) в качестве растворителя и возможно поверхностно-активное вещество, такое как триоолеат сорбитана, олеиновая кислота или олигомолочная кислота. Перед использованием в композиции в виде сухого порошка или в виде суспензии лекарственный продукт микронизируют до размера, подходящего для доставки посредством ингаляции (в типичном случае менее 5 мкм). Это может быть достигнуто любым соответствующим способом измельчения, таким как размалывание на спиральной струйной мельнице, размалывание на струйной мельнице с кипящим слоем, обработка суперкритичной текучей средой с образованием наночастиц, гомогенизация при высоком давлении или распылительная сушка. Капсулы (изготовленные, например, из желатина или гидроксипропилметилцеллюлозы), блистеры и картриджи для использования в ингаляторе или инсуффляторе могут быть изготовлены так, чтобы они содержали порошковую смесь соединения по изобретению, подходящей порошковой основы, такой как лактоза или крахмал, и модификатора эксплуатационных характеристик, такого как l-лейцин, маннит или стеарат магния. Лактоза может быть безводной или в форме моногидрата, последнее предпочтительно. Другие подходящие эксципиенты включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу. Подходящая композиция в виде раствора для использования в атомайзере с применением электрогидродинамического принципа для получения высокодисперсного аэрозоля может содержать от 1 мкг до 20 мг соединения по изобретению на акт действия, и объем акта действия может изменяться от 1 до 100 мкл. Типичная композиция может содержать соединение формулы (1), пропиленгликоль, стерильную воду, этанол и хлорид натрия. Альтернативные растворители, которые могут быть использованы вместо пропиленгликоля, включают глицерин и полиэтиленгликоль.- 15009735 В такие композиции по изобретению, предназначенные для введения посредством ингаляции/интраназального введения, могут быть добавлены подходящие корригенты, такие как ментол и левоментол,или подсластители, такие как сахарин или натриевая соль сахарина. Композиции для введения посредством ингаляции/интраназального введения могут быть изготовлены для немедленного и/или модифицированного высвобождения с использованием, например, PGLA. Композиции модифицированного высвобождения включают задержанное, непрерывное, пульсирующее,контролируемое, целевое и программируемое высвобождение. В случае ингаляторов сухого порошка и аэрозолей единица дозирования определяется посредством клапана, который доставляет отмеренное количество. Единицы дозирования согласно изобретению в типичном случае устанавливаются для введения отмеренной дозы или пшика, содержащей от 0,001 до 10 мг соединения формулы (1). Суммарная суточная доза в типичном случае будет находиться в интервале от 0,001 до 40 мг, которые могут быть введены в разовой дозе или, в более типичном случае, в разделенных дозах в продолжении суток. Соединения формулы (1) особенно подходят для введения посредством ингаляции. Соединения по изобретению могут быть введены ректально или вагинально, например в форме суппозитория, пессария или клизмы. Масло какао является традиционной основой для суппозиториев,однако, если целесообразно, могут быть использованы различные альтернативы. Композиции для ректального/вагинального введения могут быть изготовлены для немедленного и/или модифицированного высвобождения. Композиции модифицированного высвобождения включают задержанное, непрерывное, пульсирующее, контролируемое, целевое и программируемое высвобождение. Кроме того, соединения по изобретению могут быть введены непосредственно в глаз или ухо, в типичном случае в форме капель микронизированной суспензии или раствора в изотоническом, с подведенным значением рН, стерильном физиологическом растворе. Другие композиции, подходящие для глазного и ушного введения, включают мази, биоразлагаемые (например, гемостатические губки, коллаген) и небиоразлагаемые (например, силикон) имплантаты, облатки, линзы и системы на основе частиц или везикул, таких как ниосомы или липосомы. Такие полимеры, как перекрестно-сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, либо гетерополисахаридный полимер, например гелановая смола, могут быть инкорпорированы совместно с консервантом, таким как бензалконийхлорид. Такие композиции также могут быть доставлены посредством ионофореза. Композиции для глазного/ушного введения могут быть изготовлены для немедленного и/или модифицированного высвобождения. Композиции модифицированного высвобождения включают задержанное, непрерывное, пульсирующее, контролируемое, целевое или программируемое высвобождение. Соединения по изобретению могут быть скомбинированы с растворимыми макромолекулярными структурами, такими как циклодекстрин и его подходящие производные или полиэтиленгликольсодержащие полимеры, с целью улучшения их растворимости, скорости растворения, маскировки вкуса,биодоступности и/или стабильности для использования в любом из вышеупомянутых способов введения. Обнаружено, например, что комплексы лекарственное средство-циклодекстрин, как правило, оказываются полезными для большинства лекарственных форм и путей введения. Могут быть использованы как комплексы включения, так и комплексы, не являющиеся таковыми. Как альтернатива непосредственному образованию комплекса с лекарственным средством, циклодекстрин может быть использован в качестве вспомогательной добавки, то есть в качестве носителя, разбавителя или солюбилизатора. Наиболее часто используемыми для этих целей являются альфа-, бета- и гамма-циклодекстрины, примеры которых могут быть обнаружены в международных заявках на патентWO 91/11172, WO 94/02518 иWO 98/55148. Поскольку может оказаться желательным вводить комбинацию активных соединений, например, с целью лечения конкретного заболевания или состояния, в пределах объема настоящего изобретения находится возможность того, что две или более фармацевтических композиций, по меньшей мере одна из которых содержит соединение по изобретению, удобным образом могут быть скомбинированы в форме набора, подходящего для совместного введения композиций. Так набор по изобретению содержит две или более отдельных фармацевтических композиций, по меньшей мере одна из которых содержит соединение формулы (1) по изобретению, и средства для раздельного сохранения указанных композиций, такие как контейнер, разделенный на части флакон или разделенный на части пакет из фольги. Примером такого набора является известная блистерная упаковка, используемая для упаковки таблеток, капсул и тому подобного. Набор по изобретению особенно подходит для введения различных лекарственных форм, например парентеральных, для введения отдельных композиций с различными интервалами дозирования или для титрования отдельных композиций относительно друг друга. Для помощи в соблюдении схемы лечения набор в типичном случае содержит инструкции для введения и может быть снабжен так называемой памяткой.- 16009735 Для введения пациентам - людям суммарная суточная доза соединений по изобретению обычно лежит в интервале от 0,001 до 5000 мг в зависимости, несомненно, от способа введения. Например, потребность во внутривенной суточной дозе может составлять только от 0,001 до 40 мг. Суммарная суточная доза может быть введена в разовой или разделенных дозах и по усмотрению врача может попасть за пределы представленного в данном описании изобретения типичного интервала. Эти дозировки рассчитаны на субъекта - среднего человека, имеющего массу приблизительно от 65 до 70 кг. Врач будет способен с легкостью определить дозы для субъектов, чей вес попадает за пределы этого интервала, таких как дети и пожилые люди. Во избежание сомнения ссылки в данном описании на лечение включают ссылки на куративное,паллиативное и профилактическое лечение. Согласно другому воплощению настоящего изобретения соединения формулы (1) или фармацевтически приемлемые соли, их производные формы или композиции также могут быть использованы в виде комбинации с одним или более чем одним дополнительным терапевтическим агентом для совместного введения пациенту с целью получения некоторого конкретно желаемого терапевтического конечного результата, такого как лечение патофизиологически релевантных болезненных процессов, включая (1) бронхостеноз, (2) воспаление, (3) аллергию, (4) разрушение ткани, (5) признаки болезни и симптомы,такие как одышка, кашель, но этим не ограничиваясь. Второй и последующие дополнительные терапевтические агенты также могут представлять собой соединение формулы (1) или фармацевтически приемлемую соль, их производные формы или композиции, или один или более 2-агонистов, известных в данной области техники. В более типичном случае второй и последующие терапевтические агенты будут выбраны из другого класса терапевтических агентов. Как они использованы в данном описании изобретения, термины совместное введение, совместно вводимый и в комбинации с, относящиеся к соединениям формулы (1) и одному или более чем одному другому терапевтическому агенту, предназначены для обозначения следующего и относятся к следующему, и включают следующее: одновременное введение такой комбинации соединения(й) формулы (1) и терапевтического(их) агента(ов) пациенту, нуждающемуся в лечении, когда такие компоненты представлены совместно в разовой лекарственной форме, которая высвобождает указанные компоненты по существу в одно и то же время в организме указанного пациента; по существу одновременное введение такой кобинации соединения(й) формулы (1) и терапевтического(их) агента(ов) пациенту, нуждающемуся в лечении, когда такие компоненты представлены отдельно друг от друга в отдельных лекарственных формах, которые принимаются указанным пациентом по существу в одно и то же время, посредством чего указанные компоненты высвобождаются по существу в одно и то же время в организме указанного пациента; последовательное введение такой кобинации соединения(й) формулы (1) и терапевтического(их) агента(ов) пациенту, нуждающемуся в лечении, когда такие компоненты представлены отдельно друг от друга в отдельных лекарственных формах, которые принимаются указанным пациентом последовательно со значительным временным интервалом между каждым введением, в результате чего указанные компоненты высвобождаются по существу в разные моменты времени в организме указанного пациента; и последовательное введение такой комбинации соединения(й) формулы (1) и терапевтического(их) агента(ов) пациенту, нуждающемуся в лечении, когда такие компоненты представлены совместно в разовой лекарственной форме, которая высвобождает указанные компоненты контролируемым образом, так что они вводятся одновременно, последовательно и/или с перекрыванием в одно и то же и/или в разные моменты времени в организме указанного пациента; при этом каждая часть может быть введена либо одним и тем же, либо другим способом. Подходящие примеры других терапевтических агентов, которые могут быть использованы в комбинации с соединением(ями) формулы (1) или его фармацевтически приемлемыми солями, их производными формами или композициями, включают, но никоим образом этим не ограничиваются:(FLAP),(б) антагонисты лейкотриена (LTRA), включая антагонисты LTB4, LTC4, LTD4 и LTE4,(в) антагонисты гистаминового рецептора, включая H1- и H3-антагонисты,(г) агонистические по отношению к 1- и 2-адренорецепторам сосудосуживающие симпатомиметические агенты для использования в качестве противозастойного средства,(д) антагонисты мускаринового M3-рецептора или антихолинергические агенты,(е) ингибиторы PDE (фосфодиэстераза), например ингибиторы PDE3, PDE4 и PDE5,(ж) теофиллин,(з) кромогликат натрия,(и) ингибиторы СОХ (циклооксигеназа), как неселективные, так и селективные ингибиторы СОХ-1 или COX-2 (NSAID (нестероидные противовоспалительные лекарства,(к) пероральные и ингалируемые глюкокортикостероиды, такие как DAGR (диссоциированные агонисты кортикоидного рецептора),(л) моноклональные антитела, активные против эндогенных воспалительных объектов,(м) агенты против фактора некроза опухоли (анти-TNF-),(н) ингибиторы молекул адгезии, включая антагонисты VLA-4 (очень поздний антиген-4),(о) антагонисты кинин-B1- и В 2-рецептора,(п) иммуносупрессивные агенты,(р) ингибиторы матриксных металлопротеиназ (ММР),(с) антагонисты тахикининовых NK1-, NK2- и NK3-рецепторов,(т) ингибиторы эластазы,(у) агонисты аденозинового А 2 а-рецептора,(ф) ингибиторы урокиназы,(х) соединения, воздействующие на дофаминовые рецепторы, например D2-агонисты,(ц) модуляторы NF-пути, например ингибиторы IKK (IkB киназа),(ш) модуляторы цитокиновых сигнальных путей, такие как р 38 МАР-киназа (митогенактивируемая протеинкиназа), syk-киназа или ингибитор JAK-киназы,(щ) агенты, которые можно классифицировать как муколитические или противокашлевые средства,и (э)антибиотики. Согласно настоящему изобретению комбинация соединений формулы (1) с:- Н 3-антагонистами,- антагонистами мускаринового М 3-рецептора,- PDE4-ингибиторами,- глюкокортикостероидами,- агонистами аденозинового А 2 а-рецептора,- модуляторами цитокиновых сигнальных путей, такими как р 38 МАР-киназа или syk-киназа, или- лейкотриеновыми антагонистами (LTRA), включая антагонисты LTB4, LTC4, LTD4 и LTE4, является более предпочтительной. Согласно настоящему изобретению комбинация соединений формулы (1) с: глюкокортикостероидами, в особенности с ингалируемыми глюкокорткостероидами со сниженными системными побочными эффектами, включая преднизон, преднизолон, флунизолид, триамцинолона ацетонид, беклометазона дипропионат, будесонид, флутиказона пропионат, циклесонид и мометазона фуроат, или антагонистами мускаринового M3-рецептора или антихолинергическими агентами, включая,в особенности, ипратропиевые соли, а именно бромид, тиотропиевые соли, а именно бромид, окситропиевые соли, а именно бромид, перензепин и телензепин, также является более предпочтительной. Следует понимать, что все приведенные в данном описании ссылки на лечение включают куративное, паллиативное и профилактическое лечение. Изложение, которое следует далее, относится к терапевтическим применениям, для которых могут быть предложены соединения формулы (1). Соединения формулы (1) обладают способностью взаимодействовать в 2-рецептором и тем самым имеют широкий спектр терапевтических применений, как описано далее ниже, вследствие существенной роли, которую играет 2-рецептор в физиологии всех млекопитающих. Следовательно, следующий аспект настоящего изобретения относится к соединениям формулы (1) или их фармацевтически приемлемым солям, их производным формам или композициям для применения в лечении заболеваний, расстройств и состояний, в которые вовлечен 2-рецептор. Более конкретно настоящее изобретение также относится к соединениям формулы (1) или их фармацевтически приемлемым солям, их производным формам или композициям для применения в лечении заболеваний, расстройств и состояний, выбранных из группы, состоящей из следующего: астма любого типа, этиологии или патогенеза, в особенности астма, которая выбрана из группы, состоящей из атопической астмы, неатопической астмы, аллергической астмы, атопической бронхиальнойIgE-опосредованной астмы, бронхиальной астмы, эссенциальной астмы, истинной астмы, наследственной астмы, вызванной патофизиологическими нарушениями, приобретенной астмы, вызванной факторами окружающей среды, эссенциальной астмы неизвестной или скрытой причины, неатопической астмы,бронхиальной астмы, эмфизематозной астмы, астмы, индуцированной физической нагрузкой, астмы,индуцированной аллергеном, астмы, индуцированной холодным воздухом, профессиональной астмы,инфекционной астмы, вызванной бактериальной, грибковой, протозойной или вирусной инфекцией, неаллергической астмы, начальной стадии астмы, синдрома стерторозного дыхания у детей и бронхиолита; хронический или острый бронхостеноз, хронический бронхит, обструкция малых дыхательных путей и эмфизема; обструктивные или воспалительные заболевания дыхательных путей любого типа, этиологии или патогенеза, в особенности обструктивное или воспалительное заболевание дыхательных путей, которое выбрано из группы, состоящей из хронической эозинофильной пневмонии, хронической обструктивной болезни легких (ХОБЛ), ХОБЛ, которая включает хронический бронхит, легочной эмфиземы или одышки, ассоциированной или неассоциированной с ХОБЛ, ХОБЛ, которая характеризуется необратимой,- 18009735 прогрессирующей обструкцией дыхательных путей, респираторного дистресс-синдрома взрослых(ARDS), обострения гиперреактивности дыхательных путей после другой лекарственной терапии и заболевание дыхательных путей, которое ассоциировано с легочной гипертензией; бронхит любого типа, этиологии или патогенеза, в особенности бронхит, который выбран из группы, состоящей из острого бронхита, острого ларинготрахеального бронхита, арахидного бронхита, катарального бронхита, крупозного бронхита, сухого бронхита, инфекционного астматического бронхита,продуктивного бронхита, стафилококкового или стрептококкового бронхита и везикулярного бронхита,острое поражение легких; бронхоэктаз любого типа, этиологии или патогенеза, в особенности бронхоэктаз, который выбран из группы, состоящей из цилиндрического бронхоэктаза, мешотчатого бронхоэктаза, веретенообразного бронхоэктаза, капиллярного бронхоэктаза, кистозного бронхоэктаза, сухого бронхоэктаза и фолликулярного бронхоэктаза. Еще один аспект настоящего изобретения также относится к применению соединений формулы (1) или их фармацевтически приемлемых солей, их производных форм или композиций для изготовления лекарства, обладающего 2-агонистической активностью. В особенности настоящее изобретение относится к применению соединений формулы (1) или их фармацевтически приемлемых солей, их производных форм или композиций для изготовления лекарства для лечения 2-опосредованных заболеваний и/или состояний, в особенности заболеваний и/или состояний, приведенных выше. Как следствие, согласно настоящему изобретению предложен представляющий особый интерес способ лечения млекопитающего, в том числе человека, эффективным количеством соединения формулы(1) или его фармацевтически приемлемой соли, его производной формы или композиции. Более точно,согласно настоящему изобретению предложен представляющий особый интерес способ лечения 2 опосредованных заболеваний и/или состояний у млекопитающего, в том числе человека, в особенности приведенных выше заболеваний и/или состояний, включающий введение указанному млекопитающему эффективного количества соединения формулы (1), его фармацевтически приемлемых солей и/или производных форм. Следующие далее примеры иллюстрируют получение соединений формулы (1). Подготовительный пример 1. Метил-[3-(2-оксопропил)фенил]ацетат Метилат трибутилолова (28,3 мл; 98 ммоль), метил-(3-бромфенил)ацетат (WO 95/27692, страница 16, например 5 а) (15,0 г; 65,0 ммоль), изопропенилацетат (10,8 мл; 98,0 ммоль), ацетат палладия(II) (750 мг; 3,30 ммоль) и три-орто-толилфосфин (2,0 г; 6,5 ммоль) перемешивали совместно в толуоле (75 мл) при 100 С в атмосфере азота в течение 5 ч. После охлаждения реакционную смесь разбавляли этилацетатом (150 мл) и 4 М водным раствором фторида калия (90 мл) и перемешивали в течение 15 мин. Смесь фильтровали через Arbocel, органическую фазу отделяли и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, элюируя смесью диэтиловый эфир:пентан (от 0:100 до 25:75 и далее с заменой на дихлорметан), получая указанное в заголовке соединение в виде масла бледно-желтой окраски (12,6 г). 1 Н ЯМР (CDCl3, 400 МГц) : 2.15 (s, 3H), 3.61 (s, 2H), 3.69 (s, 5H), 7.10-7.13 (m, 2 Н), 7.19 (d, 1H),7.30 (t, 1H) млн-1. Раствор кетона из подготовительного примера 1 (8,5 г; 41,2 ммоль), (R)метилбензиламина (4,8 мл; 37,2 ммоль), триацетоксиборгидрида натрия (11,6 г; 56 ммоль) и уксусной кислоты (2,2 мл; 38 ммоль) в дихлорметане (400 мл) перемешивали при комнатной температуре в течение 48 ч. Реакционную смесь гасили добавлением насыщенного водного бикарбоната натрия (200 мл) и оставляли перемешиваться до окончания выделения пузырьков газа. Органическую фазу отделяли и водную фазу экстрагировали дихлорметаном (100 мл). Объединенные органические экстракты сушили (сульфат магния) и концентрировали в вакууме. Очисткой колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:метанол:0,880 аммиак (с изменением от 99:1:0,1 до 95:5:0,5) получали смесь 4:1 диастереомеров (R,R основной) в виде масла бледно-желтой окраски (8,71 г). Обработкой 1 М раствором хлористого водорода в метаноле (40 мл, 40 ммоль) с последующими тремя кристаллизациями из смеси диизопропиловый эфир:метанол получали указанное в заголовке соединение в виде бесцветного кристаллического твердого вещества (5,68 г). Раствор амина из подготовительного примера 2 (7,69 г; 22 ммоль) и формиата аммония (6,94 г; 110 ммоль) в метаноле (50 мл) нагревали до 75 С в присутствии 20% гидроксида палладия на угле (2,00 г). Через 90 мин реакционную смесь охлаждали до комнатной температуры, фильтровали через Arbocel и фильтрат концентрировали в вакууме. Остаток распределяли между дихлорметаном (100 мл) и 0,880 аммиаком (100 мл) и органическую фазу отделяли. Водную фазу экстрагировали дихлорметаном (100 мл),объединенные органические экстракты сушили (сульфат магния) и концентрировали в вакууме, получая указанное в заголовке соединение в виде бесцветного масла (4,78 г). 1 Н ЯМР (CD3OD, 400 МГц) : 1.06 (d, 3H), 2.57-2.67 (m, 2H), 3.05-3.12 (m, 1H), 3.63 (s, 2H), 3.67 (s,3H), 7.09-7.13 (m, 3H), 7.23-7.27 (t, 1H) млн-1. Раствор (1R)-1-[3-амино-4-(бензилокси)фенил]-2-бромэтанола (Org. Process Research and Development, 1998, 2, 96) (30,8 г, 95,6 ммоль) в дихлорметане (300 мл) обрабатывали пиридином (9,3 мл; 115 ммоль). Полученный раствор охлаждали до 5 С и по каплям добавляли раствор метансульфонилхлорида(7,8 мл; 100,7 ммоль) в дихлорметане (10 мл). Смесь перемешивали при 5 С в течение следующих 30 мин и затем оставляли постепенно нагреваться до комнатной температуры в течение периода времени 16 ч. Реакционную смесь промывали 2 н. соляной кислотой (110 мл) и органическую фазу отделяли, сушили(сульфат магния) и растворитель удаляли в вакууме, получая оранжевое масло. Остаток кристаллизовали из горячего толуола (100 мл), получая указанное в заголовке соединение в виде твердого вещества бледно-розовой окраски (33,7 г). 1 Н ЯМР (DMSO d6, 400 МГц) : 2.93 (s, 3H), 3.52-3.66 (m, 2H), 4.74 (m, 1H), 5.19 (s, 2H), 7.11 (d, 1H),7.19-7.22 (m, 1H), 7.33-7.36 (m, 2H), 7.40-7.43 (m, 2H), 7.56 (d, 2H), 8.95 (s, 1 Н) млн-1. Раствор бромида из подготовительного примера 4 (21,5 г; 53,7 ммоль) в N,N-диметилформамиде(125 мл) обрабатывали имидазолом (4,16 г; 75,2 ммоль) и трет-бутил(диметил)силилхлоридом (9,73 г; 64,5 ммоль) и полученный раствор оставляли перемешиваться при комнатной температуре в течение 16 ч. Реакционную смесь разбавляли этилацетатом (200 мл) и промывали водой (2 х 100 мл). Водные фазы объединяли и экстрагировали этилацетатом (100 мл). Объединенные органические экстракты промывали 2 н. соляной кислотой (100 мл), сушили (сульфат магния) и упаривали в вакууме. Остаток суспендировали в смеси пентан:этилацетат (200 мл; 1:1 по объему) и растворитель выпаривали. Остаток растирали с дополнительным количеством смеси пентан:этилацетат (200 мл; 1:1 по объему), полученное твердое вещество отфильтровывали и сушили в вакууме, получая указанное в заголовке соединение в виде бесцветного твердого вещества (23,7 г). 1 Н ЯМР (CDCl3, 400 МГц) : -0.07 (s, 3H), 0.11 (s, 3H), 0.89 (s, 9H), 2.91 (s, 3H), 4.80-4.83 (m, 1H),6.80 (bs, 1H), 6.98 (d, 1H), 7.12 (d, 1H), 7.36-7.44 (m, 5H), 7.52-7.54 (m, 1 Н) млн-1. Альтернативный способ получения подготовительного примера 5. Раствор бромида из подготовительного примера 4 (10 г; 24,98 ммоль) растворяли в DCM (20 мл, 2 мл/г), затем добавляли имидазол (4,58 г; 37,47 ммоль; 1,5 экв.) с последующим добавлением TBDMSiCl(5,27 г; 34,97 ммоль; 1,4 экв.). Реакционную смесь нагревали до температуры дефлегмации в течение 1 ч и затем оставляли охлаждаться до 30 С. Смесь разбавляли изопропилацетатом (80 мл, 8 мл/г), затем гасили 2 М HCl (50 мл; 5 мл/г) и энергично перемешивали в течение 10 мин. Фазы разделяли и органическую фазу промывали водой (50 мл; 5 мл/г). Органическую фазу затем уменьшали в объеме до 25-30 мл- 20009735 при пониженном давлении при 45 С. Раствор далее охлаждали до комнатной температуры, происходило быстрое образование суспензии, и ее перемешивали при комнатной температуре в течение 30 мин. Затем в течение 10 мин добавляли гептан (20 мл, 2 мл/г) и суспензию охлаждали до 5-10 С и перемешивали в течение 1 ч. Далее суспензию фильтровали и промывали на фильтровальной бумаге гептаном (2x10 мл). Полученный осадок на фильтре сушили в вакуумном шкафу при 50 С в течение 12 ч, получая указанное в заголовке соединение в виде твердого вещества белого цвета (11,05 г; 86%-ный выход). 1 Н ЯМР (CDCl3, 400 МГц) : -0.07 (s, 3H), 0.11 (s, 3H), 0.89 (s, 9H), 2.91 (s, 3H), 4.80-4.83 (m, 1H),6.80 (bs, 1H), 6.98 (d, 1H), 7.12 (d, 1H), 7.36-7.44 (m, 5H), 7.52-7.54 (m, 1 Н) млн-1. Подготовительный пример 6. Метил-(3-(2R)-2-[2R)-2-4-(бензилокси)-3-[(метилсульфонил)амино]фенил-2-[трет-бутил(диметил)силил]оксиэтил)амино]пропилфенил)ацетат Амин из подготовительного примера 3 (4,2 г; 20,2 ммоль) растворяли в дихлорметане (20 мл), обрабатывали бромидом из подготовительного примера 5 (8,0 г; 15,6 ммоль) и реакционную смесь нагревали до 90 С в течение 16 ч (позволяя растворителю выпариваться). Реакционную смесь разбавляли этилацетатом (200 мл), промывали 1 М водным гидроксидом натрия (30 мл), сушили (сульфат магния) и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле с элюированием смесью этилацетат:пентан (с изменением от 1:1 до 3:2), получая указанный в заголовке продукт (5,8 г). 1 Н ЯМР (CD3OD, 400 МГц) : -0.18 (s, 3H), -0.01 (s, 3H), 0.82 (s, 9H), 1.05 (d, 3H), 2.54-2.66 (m, 3H),2.83 (s, 3H), 2.85-2.93 (m, 2H), 3.59 (s, 2H), 3.66 (s, 3H), 4.69-4.72 (m, 1H), 5.18 (s, 2H), 6.97-7.07 (m. 5H),7.14-7.18 (m, 1H), 7.30-7.40 (m, 4H), 7.48 (d, 2H) млн-1. Указанное в заголовке соединение получали способом, аналогичным описанному в подготовительном примере 2, используя метил-4-(оксопропил)-фенилацетат (WO 97/24331, с. 68, например 24D). 1 Н ЯМР (CD3OD, 400 МГц) : 1.18 (d, 3H), 1.70 (d. 3H), 2.62 (dd, 1H), 3.18 (m, 1H), 3.30 (m, 1H), 3.62 Указанное в заголовке соединение получали способом, аналогичным описанному в подготовительном примере 3, используя амин из подготовительного примера 7. 1 Бромид из подготовительного примера 5 (2,0 г; 4,11 ммоль), амин из подготовительного примера 6(6 мл) и реакционную смесь нагревали до 90 С в течение 16 ч. Реакционную смесь разбавляли этилацетатом (100 мл), промывали насыщенным водным хлоридом натрия (4 х 50 мл), сушили (сульфат магния) и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:метанол (с изменением от 100:0 до 95:5), получая указанный в заголовке продукт (520 мг). 2,2'-(1,4-Фенилен)диуксусную кислоту (10,0 г; 51 ммоль) растворяли в этаноле (100 мл) и раствор обрабатывали, добавляя по каплям, каталитическим количеством ацетилхлорида (2,5 мл). Реакционную смесь перемешивали при температуре дефлегмации в течение 18 ч, оставляли охлаждаться и концентрировали в вакууме. Остаток переводили в этилацетат (100 мл) и экстрагировали раствором бикарбоната натрия (3 х 50 мл) и соляным раствором (3 х 50 мл). Органическую фазу затем сушили (сульфат магния) и концентрировали в вакууме. Остаток растирали с пентаном, получая указанный в заголовке продукт Раствор сложного диэфира из подготовительного примера 9 (11,8 г; 47,0 ммоль) и 2,2'-(1,4-фенилен) диуксусной кислоты (15.73 г; 81,0 ммоль) в этаноле (6,14 мл) и диоксане (75 мл) обрабатывали, добавляя по каплям 12 М соляную кислоту (1,57 мл; 18,8 ммоль). Реакционную смесь перемешивали при температуре дефлегмации в течение 18 ч перед тем, как оставить охлаждаться, и концентрировали до небольшого объема. Реакционную смесь разбавляли толуолом (125 мл) и полученную взвесь фильтровали. Фильтрат концентрировали в вакууме и остаток переводили в воду и подщелачивали бикарбонатом натрия до нейтрального значения рН. Смесь разбавляли этилацетатом (200 мл), органический слой отделяли и промывали раствором бикарбоната натрия (5 х 30 мл) и насыщенным водным хлоридом натрия (50 мл). Объединенные водные экстракты подкисляли до рН 3 6 М соляной кислотой и экстрагировали эфиром (3 х 30 мл). Органические фазы объединяли, сушили (сульфат магния) и концентрировали в вакууме. Остаток растирали с пентаном, получая указанное в заголовке соединение в виде бесцветного твердого вещества Карбоновую кислоту из подготовительного примера 11 (18,26 г; 82,0 ммоль) растворяли в тетрагидрофуране (450 мл), раствор охлаждали до 0 С и обрабатывали, по каплям добавляя раствор хлорида метилмагния в тетрагидрофуране (82 мл; 246 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и оставляли стоять в течение 18 ч. Реакционную смесь медленно разбавляли водой(80 мл), затем 2 М соляной кислотой (120 мл; 240 ммоль). Смесь экстрагировали этилацетатом (3 х 100 мл), органические экстракты объединяли и промывали соляным раствором (3 х 50 мл). Этилацетатную фазу сушили (сульфат магния) и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметан:метанол:уксусная кислота (с изменением от 99,6:0:0,4 до 94,6:5:0,4), получая указанный в заголовке продукт в виде бесцветного твердого вещества. 1 Указанный в заголовке продукт получали способом, аналогичным описанному в подготовительном примере 19, используя спирт из подготовительного примера 12. 1 Н ЯМР (CD3OD, 400 МГц) : 1.30 (s, 6H), 3.02 (s, 2H), 3.55 (s, 2H), 3.90 (s, 2H), 7.10 (d, 2H), 7.20 (d. 2H), 7.55 (m, 1H) млн-1. Амид из подготовительного примера 13 (500 мг; 1,77 ммоль) растворяли в уксусной кислоте (10 мл), раствор обрабатывали тиомочевиной (160 мг; 2,10 ммоль) и перемешивали при 95 С в течение 2 ч. Реакционную смесь оставляли охлаждаться до комнатной температуры и концентрировали в вакууме. Остаток переводили в метанол (40 мл), обрабатывали метанольной соляной кислотой (10 мл) и нагревали до температуры дефлегмации в течение 18 ч. Реакционную смесь оставляли охлаждаться до комнатной температуры и затем концентрировали в вакууме. Остаток переводили в воду и экстрагировали эфиром(3 х 20 мл). Водную фазу подщелачивали до рН 11 раствором карбоната натрия и экстрагировали этилацетатом (3 х 30 мл). Объединенные этилацетатные экстракты сушили (сульфат магния) и концентрировали в вакууме. Затем полученное масло упаривали из эфира (х 5), получая указанный в заголовке продукт (280 мг). 1 Бромид из подготовительного примера 5 (2.00 г; 3,90 ммоль) и амин из подготовительного примера 12 совместно нагревали в виде расплава при 95 С в атмосфере азота в течение 44 ч и затем оставляли охлаждаться до комнатной температуры. Реакционную смесь суспендировали в смеси дихлорметан:0,880 аммиак (99,8:0,2) и очищали колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:метанол:0,880 аммиак (от 99,8:0:0,2 до 97,8:2:0,2 и до 80:20:5). Неочищенный продукт упаривали из эфира (х 3), получая указанный в заголовке продукт (1,76 г). 1MS (APCI) (масс-спектрометрия с химической ионизацией при атмосферном давлении): m/z 655 2,2'-(1,3-Фенилен)диуксусную кислоту (10,0 г; 51 ммоль) растворяли в этаноле (100 мл) и раствор обрабатывали, добавляя по каплям, каталитическим количеством ацетилхлорида (2,5 мл). Реакционную смесь перемешивали при температуре дефлегмации в течение 18 ч перед тем, как оставить охлаждаться,и концентрировали в вакууме. Остаток переводили в этилацетат (100 мл) и экстрагировали раствором бикарбоната натрия (3 х 50 мл) и соляным раствором (3 х 50 мл). Органическую фазу затем сушили (сульфат магния) и концентрировали в вакууме. Остаток растирали с пентаном, получая указанный в заголовке продукт (11,8 г). 1 Раствор сложного диэфира из подготовительного примера 16 (44,3 г; 177 ммоль) и 2,2'-(1,3 фенилен)диуксусной кислоты (59,2 г; 308 ммоль) в этаноле (24 мл) и диоксане (290 мл) обрабатывали, по каплям добавляя 12 М соляную кислоту (4,9 мл; 58,8 ммоль). Реакционную смесь перемешивали при температуре дефлегмации в течение 18 ч перед тем, как оставить охлаждаться, и концентрировали до небольшого объема. Реакционную смесь разбавляли толуолом (125 мл) и полученную взвесь фильтровали. Фильтрат концентрировали в вакууме и остаток переводили в воду и подщелачивали бикарбонатом натрия до нейтрального значения рН. Смесь разбавляли этилацетатом (200 мл), органический слой отделя- 23009735 ли и промывали раствором бикарбоната натрия (5 х 30 мл) и соляным раствором (50 мл). Объединенные водные экстракты подкисляли до рН 3 6 М соляной кислотой и экстрагировали эфиром (3 х 30 мл). Органические фазы объединяли, сушили (сульфат магния) и концентрировали в вакууме. Остаток растирали с пентаном, получая указанное в заголовке соединение в виде бесцветного твердого вещества (10,8 г). 1 Хлорид метилмагния (51 мл 3 М раствора в тетрагидрофуране; 153 ммоль) по каплям добавляли к перемешиваемому раствору соединения из подготовительного примера 17 (11,6 г; 51 ммоль) (International Journal of Peptide and Protein Research, 1987, 29(3), 331) в тетрагидрофуране (300 мл) при 0 С в атмосфере азота. Реакционную смесь оставляли нагреваться до комнатной температуры в течение ночи с образованием густого белого осадка и затем осторожно добавляли воду (50 мл) и 2 н. соляную кислоту(80 мл). Водную фазу экстрагировали этилацетатом (2 х 300 мл) и объединенные органические фазы промывали соляным раствором (50 мл), сушили (сульфат натрия) и растворитель удаляли в вакууме, получая указанное в заголовке соединение в виде золотистого масла (11,2 г). 1 2-Хлорацетонитрил (8,8 мл; 140 ммоль) добавляли к раствору спирта из подготовительного примера 18 (16,0 г; 70 ммоль) в уксусной кислоте (33 мл). Полученный раствор охлаждали до 0 С, обрабатывали концентрированной серной кислотой (33 мл) и реакционную смесь оставляли постепенно нагреваться до комнатной температуры. Через 4 ч реакционную смесь выливали на лед и подщелачивали твердым карбонатом натрия. Раствор экстрагировали этилацетатом (2 х 500 мл) и объединенные органические экстракты сушили (сульфат магния) и концентрировали в вакууме, получая указанное в заголовке соединение в виде бесцветного твердого вещества (19,0 г). 1 Н ЯМР (CDCl3, 400 МГц) : 1.36 (s, 6H), 3.02 (s, 2H), 3.62 (s, 2H), 3.95 (s, 2H), 6.19 (m, 1H), 7.067.31 (m, 4H) млн-1. Раствор амида из подготовительного примера 19 (5,1 г; 18 ммоль), тиомочевины (1,6 г; 21 ммоль) и уксусной кислоты (18 мл) в этаноле (80 мл) нагревали до температуры дефлегмации в атмосфере азота в течение 16 ч. Реакционную смесь оставляли охлаждаться до комнатной температуры и фильтровали. Фильтрат концентрировали в вакууме, остаток растворяли в этаноле (150 мл), насыщали газообразным хлористым водородом и полученный раствор нагревали до температуры дефлегмации в течение 16 ч. Смесь концентрировали в вакууме и остаток распределяли между этилацетатом (200 мл) и 5%-ным водным раствором карбоната натрия (200 мл). Органическую фазу промывали соляным раствором (100 мл),сушили (сульфат магния) и концентрировали в вакууме. Остаток очищали на сильной катионообменной смоле, элюируя метанолом, затем 2 М раствором аммиака в метаноле для элюирования продукта. Элюент концентрировали в вакууме, получая указанное в заголовке соединение в виде желтого масла (2,68 г). 1(36,0 г; 153 ммоль) нагревали при 85 С в течение 72 ч. Реакционную смесь охлаждали до комнатной температуры и очищали колоночной хроматографией на силикагеле с элюированием смесью пентан:этилацетат (50:50 по объему), получая указанный в заголовке продукт в виде бледно-желтого масла Бензил-защищенный продукт из подготовительного примера 9 (520 мг; 0,813 ммоль) добавляли к раствору 10% Pd/C (100 мг) в метаноле (25 мл) и реакционную смесь перемешивали при комнатной температуре под давлением водорода 60 ф/кв. дюйм (413,7 кПа) в течение 8 ч. Реакционную смесь фильтровали через Arbocel и фильтрат концентрировали в вакууме, получая указанный в заголовке продукт. 1 Сложный эфир из подготовительного примера 22 (844 мг; 1,53 ммоль) добавляли к раствору гидроксида лития (71 мг; 1,69 ммоль) в смеси 10:1 тетрагидрофуран:вода (11 мл) и реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Добавляли дополнительное количество гидроксида лития (142 мг; 3,38 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение следующих 18 ч. Реакционную смесь разбавляли 4 М раствором соляной кислоты в диоксане (1,27 мл; 5,0 ммоль) и концентрировали в вакууме. Остаток переводили в воду (20 мл) и этилацетат (20 мл), органическую фазу отделяли, сушили (сульфат магния) и концентрировали в вакууме, получая указанный в заголовке продукт (748 мг). 1 Н ЯМР (CD3OD, 400 МГц) : -0.19 (s, 3H), -0.01 (s, 3H), 0.79 (s, 9H), 1.13 (d, 3H), 2.66 (m, 1H), 2.82- 25009735 Бензилзащищенный спирт из подготовительного примера 15 (1,72 г; 2,60 ммоль) растворяли в метаноле (40 мл) и раствор обрабатывали 10% Pd/C (200 мг) и помещали на 18 ч при комнатной температуре под давление водорода 60 ф/кв. дюйм (413,7 кПа). Реакционную смесь фильтровали через Arbocel и фильтрат концентрировали до небольшого объема в вакууме. Раствор обрабатывали 10% Pd/C (250 мг) и помещали на 72 ч при комнатной температуре под давление водорода 60 ф/кв. дюйм (413,7 кПа). Реакционную смесь фильтровали через Arbocel и фильтрат концентрировали в вакууме. Полученное масло упаривали из эфира (х 3), получая указанный в заголовке продукт (1,43 г). 1 Сложный эфир из подготовительного примера 24 (1,41 г; 2,50 ммоль) растворяли в диоксане (16 мл) и воде (2 мл) и раствор обрабатывали, добавляя по каплям 5 М раствор гидроксида натрия (3,49 мл; 17,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч и затем концентрировали в вакууме. Остаток переводили в воду и охлаждали перед тем, как обработать 2 М соляной кислотой (8,78 мл; 17,6 ммоль). Раствор разбавляли этилацетатом и концентрировали в вакууме ввиду отсутствия разделения. Остаток упаривали из этилацетата (х 3), получая указанный в заголовке продукт Сложный эфир из подготовительного примера 6 (2,90 г; 4,5 ммоль) растворяли в растворе гидроксида лития (216 мг; 9,0 ммоль) в воде (30 мл) и тетрагидрофуране (60 мл) и реакционную смесь перемешивали при комнатной температуре в течение 48 ч. Реакционную смесь подкисляли до рН 6 2 М соляной кислотой и концентрировали до небольшого объема в вакууме. Смесь экстрагировали этилацетатом(х 2), органические фазы объединяли и промывали соляным раствором сушили (сульфат магния) и концентрировали в вакууме, получая указанный в заголовке продукт. 1 Бензил-защищенный продукт из подготовительного примера 26 (250 мг; 0,40 ммоль) добавляли к смеси 20% Pd/C (30 мг) и формиата аммония (126 мг; 2,0 ммоль) в этаноле (15 мл) и реакционную смесь кипятили с обратным холодильником в течение 3 ч. Реакционную смесь оставляли стоять при комнатной температуре в течение 18 ч и затем концентрировали в вакууме. Остаток, содержащий катализатор, очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметан:метанол:0,880 аммиак Раствор бензил-защищенного спирта из подготовительного примера 21 (36,8 г; 56 ммоль) в этаноле(550 мл) обрабатывали формиатом аммония (16,0 г; 254 ммоль) и 20% гидроксидом палладия на углероде(1,5 г). Полученную суспензию нагревали до 80 С в течение 2 ч. Через 2 ч добавляли дополнительное количество 20% гидроксида палладия на углероде (1,0 г) и нагревание продолжали в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры, фильтровали и растворитель удаляли в вакууме. Остаток распределяли между этилацетатом (500 мл) и 2 н. водным аммиаком (100 мл). Органическую фазу отделяли, сушили (сульфат магния) и растворитель удаляли в вакууме. Остаток очищали колоночной хроматографией на силикагеле с элюированием смесью дихлорметан:метанол:0,88 аммиак (95:5:0,5 по объему), получая указанный в заголовке продукт в виде бледно-желтого масла (20,6 г). 1 Сложный эфир из подготовительного примера 28 (20,6 г; 36 ммоль) растворяли в тетрагидрофуране(150 мл) и раствор обрабатывали, добавляя по каплям 1 М водный гидроксид лития (72 мл; 72 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 72 ч. Реакционную смесь нейтрализовали добавлением 1 М соляной кислоты (72 мл; 72 ммоль) и концентрировали до небольшого объема. Водную фазу декантировали и остаток промывали водой (2 х 50 мл). Остаток повторно растворяли в тетрагидрофуране (50 мл) и толуоле (50 мл) и растворитель удаляли в вакууме, получая указанное в заголовке соединение в виде бледно-коричневой пены (20,17 г). 1 Смесь амида из подготовительного примера 19 (151,4 г; 534 ммоль), тиомочевины (48,7 г; 640 ммоль) и уксусной кислоты (303 мл) в этаноле (1,5 л) нагревали до температуры дефлегмации в атмосфере азота в течение 5 ч. Реакционную смесь оставляли охлаждаться до комнатной температуры и суспензию концентрировали в вакууме. Остатки подвергали азеотропной перегонке с толуолом (2 х 900 мл), затем обрабатывали этанолом (1,5 л) и перемешивали в течение 1 ч. Твердый осадок удаляли фильтрованием, фильтрат охлаждали на ледяной бане, обрабатывали 98%-ной серной кислотой (227 мл) и перемешивали в течение 1 ч при температуре окружающей среды. Раствор концентрировали в вакууме для удаления большей части этанола и подводили до рН 9, используя водный бикарбонат натрия. Твердый осадок удаляли фильтрованием и промывали водой (300 мл), затем этилацетатом (1,0 л). Слои объединенного двухфазного фильтрата и промывок разделяли и водный слой повторно экстрагировали этилацетатом(1,0 л + 500 мл). Объединенные этилацетатные экстракты сушили над сульфатом магния, фильтровали и- 27009735 концентрировали в вакууме, получая указанное в заголовке соединение в виде коричневого масла (89,5 г). 1 Раствор амина из подготовительного примера 20 а (124,9 г; 531 ммоль) в ацетонитриле (1,0 л) обрабатывали раствором ди-n-толуоил-L-винной кислоты (194,8 г; 504 ммоль) в ацетонитриле (750 мл). Полученную суспензию перемешивали в течение 3 ч, твердый осадок выделяли фильтрованием и промывали ацетонитрилом (2 х 250 мл), получая указанное в заголовке соединение в виде твердого вещества беловатой окраски (210 г). 1 Раствор карбоната калия (37,90 г; 274,22 ммоль) в воде (213 мл) добавляли к суспензии соединения из подготовительного примера 20 б (42,62 г; 68,56 ммоль) в пропионитриле (213 мл) и перемешивали до тех пор, пока не растворился весь твердый материал. Затем разделяли фазы и пропионитриловую фазу промывали водой (107 мл). Объем раствора уменьшали при пониженном давлении приблизительно до 30 мл, получая указанное в заголовке соединение в виде раствора в пропионитриле. Извлекали образец и концентрировали досуха с получением массы для весового анализа, и выход, как установлено, составлял 81%. 1 Н ЯМР (d6-DMSO, 400 МГц) : 0.99 (s, 6H), 1.16 (t, 3H), 2.59 (s, 2H), 3.61 (s, 2H), 4.06 (q, 2H), 7.06N-[2-(Бензилокси)-5-1R)-2-бром-1-[трет-бутил(диметил)силил]оксиэтил)фенил]метансульфонамид (14,34 г; 27,88 ммоль) добавляли к раствору соединения из подготовительного примера 20 в (13,12 г; 55,75 ммоль) в пропионитриле (15 мл). Смесь далее кипятили с обратным холодильником в течение 3 суток. Раствор разбавляли пропионитрилом (55 мл) и охлаждали до 20-25 С. Раствор промывали 1 М HCl(водн.) (70 мл), затем водой (35 мл) и этот раствор переносили непосредственно на следующую стадию,подразумевая 100%-ный выход. Подготовительный пример 28 а. Этил-(R)-2-(3-2-[2-гидрокси-2-(4-бензилокси-3-метансульфонамидофенил)этиламино]-2-метилпропилфенил)ацетат Триэтиламина тригидрофторид (9,1 мл; 8,99 г; 55,76 ммоль) добавляли к раствору соединения из подготовительного примера 21 а (18,64 г; 27,88 ммоль) в пропионитриле (72 мл). Раствор перемешивали при 20-25 С в течение 3 ч. Раствор затем гасили 5 М NH3 (водн.) (72 мл), перемешивали в течение 10 мин и производили разделение фаз. Раствор в пропионитриле далее промывали водой (72 мл) и данный раствор переносили непосредственно на следующую стадию, подразумевая 100%-ный выход. Подготовительный пример 29 а. (R)-2-(3-2-[2-Гидрокси-2-(4-бензилокси-3-метансульфонамидофенил)этиламино]-2-метилпропилфенил)уксусная кислота. Раствор гидроксида натрия (6,69 г; 167,28 ммоль) в воде (72 мл) добавляли к раствору соединения из подготовительного примера 28 а (15,47 г; 27,88 ммоль) в пропионитриле (72 мл). Двухфазную смесь затем энергично перемешивали в течение 3 ч. Смесь оставляли для разделения фаз., водную фазу промывали свежим пропионитрилом (72 мл), затем разбавляли 1,4-диоксаном (72 мл). Далее рН раствора подводили до 6-7 добавлением 37%-ной (об./об.) HCl (водн.) и полученную суспензию перемешивали в течение 1 ч. Суспензию далее фильтровали и промывали водой на фильтровальной бумаге, затем сушили,получая указанное в заголовке соединение в виде твердого вещества беловатой окраски (13,55 г; 92%ный выход за три стадии). 1 Раствор гидроксида натрия (1,40 г; 35,05 ммоль) в воде (100 мл) добавляли к суспензии соединения из подготовительного примера 29 а (18,46 г; 35,05 ммоль) в метаноле (600 мл). Смесь гидрировали над 20 мас.% гидроксидом палладия на углероде при 150 ф/кв. дюйм (1034 кПа) и 60 С в течение 5 ч. Смесь фильтровали для удаления остатков катализатора и затем объем смеси уменьшали до 100 мл при пониженном давлении. Смесь отгоняли при пониженном давлении, заменяя растворитель на ацетонитрил, при постоянном объеме. Полученную суспензию фильтровали и промывали на бумаге ацетонитрилом, затем сушили, получая указанное в заголовке соединение в виде твердого вещества беловатой окраски (15,34 г; 95%). 1H ЯМР (400 МГц, CD3OD) : 1.07 (s, 3H), 1.09 (s, 3H), 2.70 (s, 2H), 2.73-2.81 (m, 2H), 2.87 (s, 3H),3.44 (s, 2H), 4.60-4.63 (m, 1H), 6.84 (d, 1H), 6.92 (d, 1H), 7.04 (d, 1H), 7.11 (s, 1H), 7.14 (d, 1H), 7.15 (t, 1H),7.34 (s, 1H) млн-1. Указанные соединения формулы 29 б далее могут быть приведены во взаимодействие с подходящим амином формулы NHR8-Q2-A (3) в присутствии традиционного агента сочетания, такого как 1-(3-диметиламинопропил)-3 этилкарбодиимида гидрохлорид или дициклогексилкарбодиимид, в подходящем растворителе, таком как пиридин, диметилформамид или диметилацетамид, с получением соединения формулы (1): где R1 и R2 представляют собой метил, и n равен 1. Подготовительные примеры 30-106. Соответствующую карбоновую кислоту из подготовительного примера 23, 25, 27 или 29 (0,15 ммоль) растворяли в растворе 1-гидроксибензотриазола гидрата (22 мг; 0,16 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорида (34 мг; 0,18 ммоль) и N-этилдиизопропиламина (130 мкл; 0,73 ммоль) в N,N-диметилформамиде (2 мл). Раствор обрабатывали соответствующим амином (0.23 ммоль) и реакционную смесь встряхивали при комнатной температуре в течение 18 ч. Реакционную смесь концентрировали в вакууме и остаток распределяли между дихлорметаном (3 мл) и водой (1 мл). Фазы разделяли и органический слой промывали соляным раствором (1 мл), сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, элюи- 29009735 руя смесью дихлорметан:метанол:0,88 аммиак (от 98:2:0 до 96:4:0,5 и до 94:6:0,5), получая желаемый продукт. Альтернативно для синтеза соединений подготовительных примеров 30-106 может быть использован следующий способ. Раствор соответствующей кислоты из подготовительного примера 23, 25, 27 или 29 (36 ммоль) вN,N-диметилформамиде (200 мл) обрабатывают 1-гидроксибензотриазолом гидратом (5,26 г; 39 ммоль),соответствующим амином (43 ммоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимидом гидрохлоридом (7,5 г; 39 ммоль). Полученную суспензию оставляют перемешиваться при комнатной температуре в течение 18 ч. Растворитель удаляют в вакууме и остаток распределяют между дихлорметаном (400 мл) и водой (100 мл). Органическую фазу отделяют, промывают насыщенным водным хлоридом натрия (100 мл), сушат (сульфат магния) и растворитель удаляют в вакууме. Остаток очищают колоночной хроматографией на силикагеле, элюируя смесью дихлорметан:метанол:этилацетат:0,88 аммиак (с изменением от 95:5:0:0,5 до 0:5:95:0, по объему), получая желаемый продукт.
МПК / Метки
МПК: C07C 311/08, A61P 11/00
Метки: сульфонамидные, производные, лечения, заболеваний
Код ссылки
<a href="https://eas.patents.su/30-9735-sulfonamidnye-proizvodnye-dlya-lecheniya-zabolevanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Сульфонамидные производные для лечения заболеваний</a>












