Арилсульфонамидные соединения и их применение для лечения ожирения, диабета типа ii
Номер патента: 9647
Опубликовано: 28.02.2008
Авторы: Сутин Лори, Мотт Эндрю, Йоханссон Гари, Йенсен Анника, Тейбрант Ян, Кальдирола Патриция, Бремберг Ульф
Формула / Реферат
1. Соединение формулы (I)
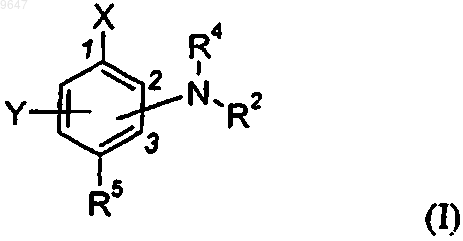
или его фармацевтически приемлемая соль, где
X означает
R1 и R3 независимо означают:
(a) Н;
(b) C1-6алкил;
(c) C1-6алкокси;
(d) C1-6гидроксиалкил с прямой или разветвленной цепью;
(e) C1-6алкилгалогениды с прямой или разветвленной цепью или
(f) группу Ar;
Ar означает:
(a) фенил;
(b) 1-нафтил;
(c) 2-нафтил;
(d) 5-7-членное, частично или полностью насыщенное, гетероциклическое кольцо, содержащее 1-4 гетероатома, выбираемых из кислорода, азота и серы; или
(e) бициклическую кольцевую систему, состоящую из двух гетероциклических колец, указанных в пункте (d), или бициклическую кольцевую систему, включающую одно бензольное кольцо и одно гетероциклическое кольцо, указанное в пункте (d);
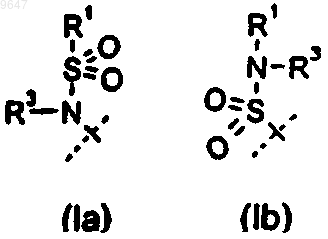
альтернативно, R1 и R3 связаны друг с другом с образованием группы (CH2)2O, (CH2)4O или (CH2)3-5 в формуле (Ib);
группа Ar может быть необязательно замещена:
(a) Y или
(b) 5-7-членным, частично или полностью насыщенным, гетероциклическим кольцом, содержащим 1-4 гетероатома, выбираемых из кислорода, азота или серы;
Y означает:
(a) Н;
(b) галоген;
(c) C1-6алкил;
(d) CF3;
(e) C1-6алкокси;
(f) С1-4алкенил;
(g) фенил;
(h) OCF3;
(i) CN;
(j) C1-6гидроксиалкил с прямой или разветвленной цепью;
(k) C1-6алкилгалогениды с прямой или разветвленной цепью;
(l) NH2;
(m) NHR6;
(n) NR6R7;
(о) NO2;
(p) NR6COR7;
(r) S(O)nR6, где n равно 0, 1, 2 или 3;
R2 и R4 независимо означают:
(a) -SO2R1;
(b) H;
(c) C1-6алкил;
(d) Ar, имеющий значения, указанные выше для R1;
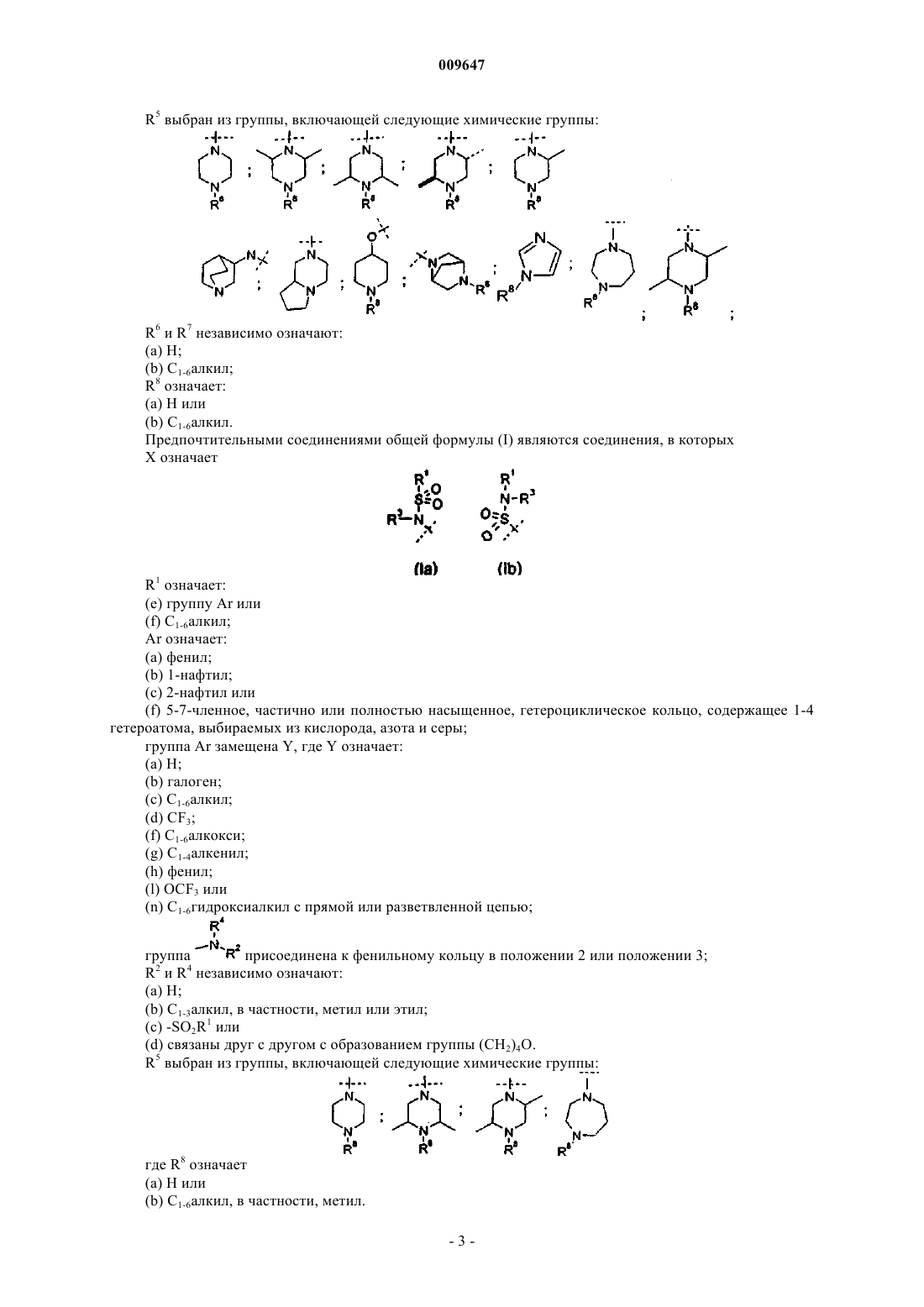
R5 выбран из группы, включающей следующие химические группы:
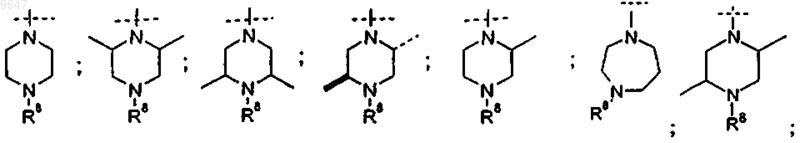
R6 и R7 независимо означают:
(а) Н или
(b) C1-6алкил;
R8 означает:
(а) Н или
(b) C1-6алкил.
2. Соединение по п.1, где
R1 означает группу Ar;
Ar означает:
(a) фенил;
(b) 1-нафтил;
(c) 2-нафтил или
(d) 5-7-членное, частично или полностью насыщенное, гетероциклическое кольцо, содержащее 1-4 гетероатома, выбираемых из кислорода, азота и серы;
группа Ar замещена Y, где Y означает:
(a) Н;
(b) галоген;
(c) C1-6алкил;
(d) CF3;
(f) C1-6алкокси;
(g) С1-4алкенил;
(h) фенил;
(l) OCF3 или
(n) C1-6гидроксиалкил с прямой или разветвленной цепью.
3. Соединение по п.1 или 2, где группа 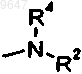 присоединена к фенильному кольцу в положении 2 или положении 3.
присоединена к фенильному кольцу в положении 2 или положении 3.
4. Соединение по любому из пп.1-3, где R2 означает -SO2R1.
5. Соединение по любому из пп.1-4, где R3 и R4 независимо означают Н, метил или этил.
6. Соединение по любому из пп.1-5, где R5 выбран из группы, включающей следующие химические группы:
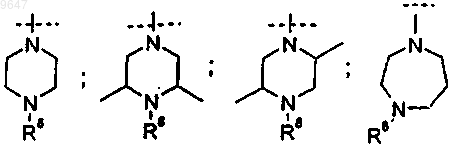
где R8 означает Н или метил.
7. Соединение по любому из пп.1-6, где R6 и R7 независимо означают:
(а) Н или
(b) C1-6алкил.
8. Соединение по п.1, которое представляет собой
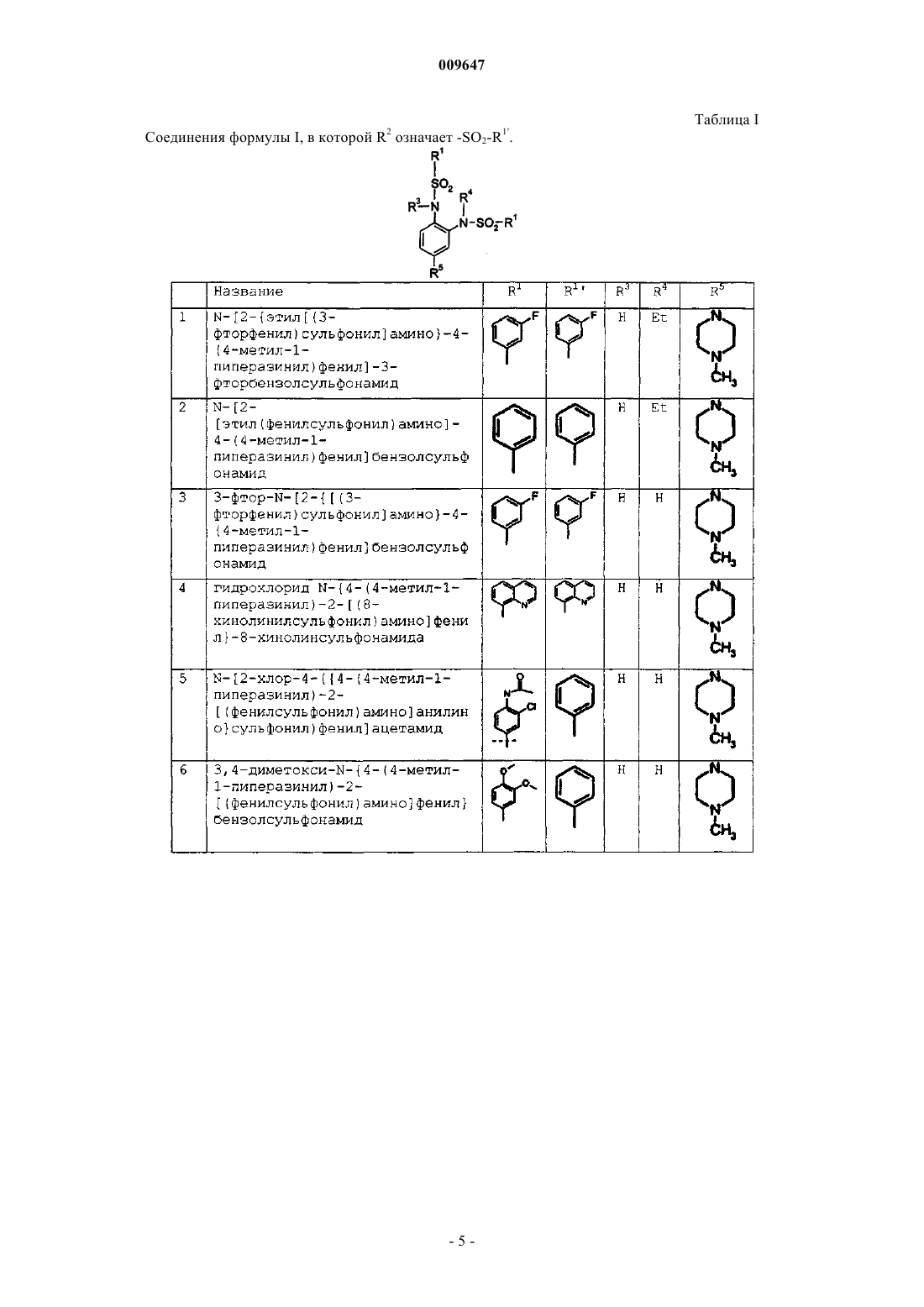
N-[2-{этил[(3-фторфенил)сульфонил]амино}-4-(4-метил-1-пиперазинил)фенил]-3-фторбензолсульфонамид;
N-[2-[этил(фенилсульфонил)амино]-4-(4-метил-1-пиперазинил)фенил]бензолсульфонамид;
3-фтор-N-[2-{[(3-фторфенил)сульфонил]амино}-4-(4-метил-1-пиперазинил)фенил]бензолсульфонамид;
N-{5-(4-метил-1-пиперазинил)-2-[(8-хинолинилсульфонил)амино]фенил}-7-хинолинсульфонамид;
N-[2-хлор-4-({4-(4-метил-1-пиперазинил)-2-[(фенилсульфонил)амино]анилино}сульфонил)фенил]ацетамид;
3,4-диметокси-N-{4-(4-метил-1-пиперазинил)-2-[(фенилсульфонил)амино]фенил}бензолсульфонамид;
3-метокси-4-метил-N-{4-(4-метил-1-пиперазинил)-2-[(фенилсульфонил)амино]фенил}бензолсульфонамид;
4-метил-N-{4-(4-метил-1-пиперазинил)-2-[(метилсульфонил)амино]фенил}бензолсульфонамид;
3,4-диметокси-N-{4-(4-метил-1-пиперазинил)-2-[(метилсульфонил)амино]фенил}бензолсульфонамид;
3-циано-N-{4-(4-метил-1-пиперазинил)-2-[(метилсульфонил)амино]фенил}бензолсульфонамид;
N-{4-(1-пиперазинил)-2-[(фенилсульфонил)амино]фенил}-1-нафталинсульфонамид;
5-(диметиламино)-N-{4-(1-пиперазинил)-2-[(фенилсульфонил)амино]фенил}-1-нафталинсульфонамид;
N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]-8-хинолинсульфонамид;
2,4,6-триметил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид;
4-метил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид;
N-[2-({[(Е)-2-фенилэтенил]сульфонил}амино)-5-(1-пиперазинил)фенил]бензолсульфонамид;
2,5-диметокси-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид;
2-метил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид;
2,4-дифтор-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид;
4-бутокси-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид;
3,5-диметил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]-4-изоксазолсульфонамид;
5-фтор-2-метил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид;
4-(метилсульфонил)-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид;
2-(метилсульфонил)-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид;
2-метокси-4-метил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид;
4-метокси-2-метил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид;
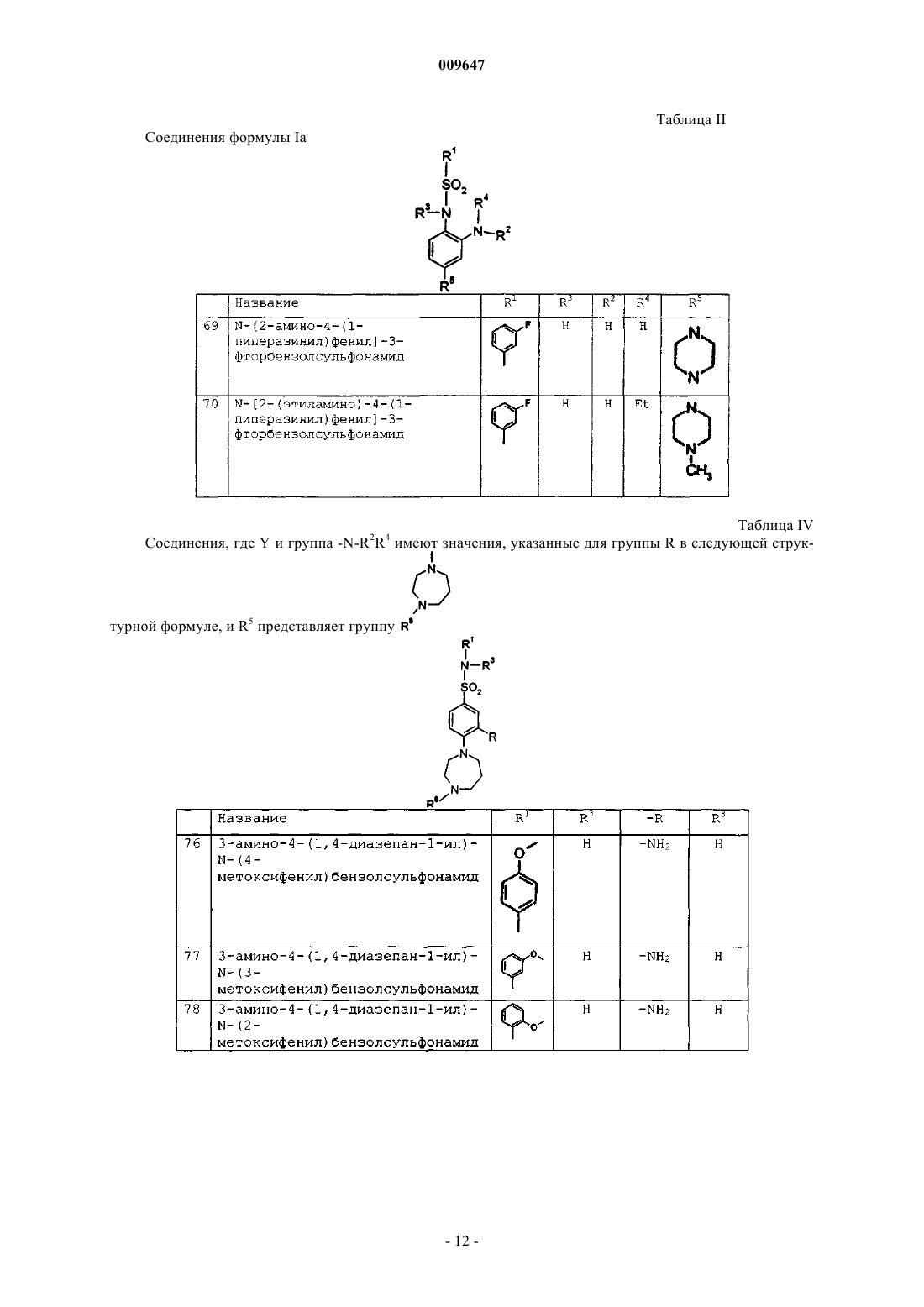
N-[2-амино-4-(1-пиперазинил)фенил]-3-фторбензолсульфонамид;
N-[2-(этиламино)-4-(1-пиперазинил)фенил]-3-фторбензолсульфонамид;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(фенилсульфонил)амино]фенил}бензолсульфонамида;
гидрохлорид N-(4-(1,4-диазепан-1-ил)-2-{[(3-фторфенил)сульфонил]амино}фенил)-3-фторбензолсульфонамида;
гидрохлорид N-{5-(1,4-диазепан-1-ил)-2-[(фенилсульфонил)амино]фенил}-N-этилбензолсульфонамида;
гидрохлорид N-{5-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил}бензолсульфонамида;
гидрохлорид N-{5-(1,4-диазепан-1-ил)-2-[(этилсульфонил)амино]фенил}бензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(фенилсульфонил)амино]фенил}[1,1'-бифенил]-4-сульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(фенилсульфонил)амино]фенил}-2,1,3-бензоксадиазол-4-сульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(фенилсульфонил)амино]фенил}-2-нафталинсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил}бензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[метил(метилсульфонил)амино]фенил}бензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил}-N-метилбензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[метил(фенилсульфонил)амино]фенил}бензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил}-1-нафталинсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил}-2-нафталинсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил}-4-фторбензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил}-4-нитробензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил}-3-(трифторметил)бензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил}-2-метилбензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил}-4-(трифторметокси)бензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил}-3,5-диметил-4-изоксазолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил}-3-метоксибензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил}-4-метилбензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[этил(метилсульфонил)амино]фенил}-4-метилбензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[этил(метилсульфонил)амино]фенил}-3,4-диметоксибензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[этил(метилсульфонил)амино]фенил}-7-хинолинсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[метил(метилсульфонил)амино]фенил}-4-метилбензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[метил(метилсульфонил)амино]фенил}-1-нафталинсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[метил(метилсульфонил)амино]фенил}-5-(2-пиридинил)-2-тиофенсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(фенилсульфонил)амино]фенил}-1-нафталинсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(фенилсульфонил)амино]фенил}-5-(диметиламино)-1-нафталинсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(фенилсульфонил)амино]фенил}-8-хинолинсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(фенилсульфонил)амино]фенил}-2,4,6-триметилбензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(фенилсульфонил)амино]фенил}-4-метилбензолсульфонамида;
гидрохлорид N-[5-(1,4-диазепан-1-ил)-2-({[(Е)-2-фенилэтенил]сульфонил}амино)фенил]бензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(фенилсульфонил)амино]фенил}-2,5-диметоксибензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(фенилсульфонил)амино]фенил}-2-метилбензолсульфонамида;
гидрохлорид 4-бутокси-N-{4-(1,4-диазепан-1-ил)-2-[(фенилсульфонил)амино]фенил}бензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(фенилсульфонил)амино]фенил}-3,5-диметил-4-изоксазолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(фенилсульфонил)амино]фенил}-5-фтор-2-метилбензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(фенилсульфонил)амино]фенил}-4-(метилсульфонил)бензолсульфонамида;
гидрохлорид N-{4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил}-N-метилбензолсульфонамида;
гидрохлорид N-{5-(1,4-диазепан-1-ил)-2-[метил(фенилсульфонил)амино]фенил}-4-метилбензолсульфонамида;
гидрохлорид 3-амино-4-(1,4-диазепан-1-ил)-N-(4-метоксифенил)бензолсульфонамида;
гидрохлорид 3-амино-4-(1,4-диазепан-1-ил)-N-(3-метоксифенил)бензолсульфонамида;
гидрохлорид 3-амино-4-(1,4-диазепан-1-ил)-N-(2-метоксифенил)бензолсульфонамида;
гидрохлорид 3-амино-4-(1,4-диазепан-1-ил)-N-(3-фторфенил)бензолсульфонамида;
гидрохлорид 3-амино-4-(1,4-диазепан-1-ил)-N-метил-N-фенилбензолсульфонамида;
гидрохлорид 3-амино-4-(1,4-диазепан-1-ил)-N-(4-изопропилфенил)бензолсульфонамида;
гидрохлорид 3-амино-4-(1,4-диазепан-1-ил)-N-(4-метилфенил)бензолсульфонамида;
гидрохлорид 3-амино-4-(1,4-диазепан-1-ил)-N-(2,5-диметилфенил)бензолсульфонамида;
гидрохлорид 3-амино-N-(3-хлорфенил)-4-(1,4-диазепан-1-ил)бензолсульфонамида;
гидрохлорид 3-амино-N-(2-хлорфенил)-4-(1,4-диазепан-1-ил)бензолсульфонамида;
гидрохлорид 3-амино-N-(2,4-дихлорфенил)-4-(1,4-диазепан-1-ил)бензолсульфонамида;
гидрохлорид 3-амино-N-(2-метил-5-хлорфенил)-4-(1,4-диазепан-1-ил)бензолсульфонамида;
гидрохлорид 3-амино-N-(2-метил-3-хлорфенил)-4-(1,4-диазепан-1-ил)бензолсульфонамида;
гидрохлорид 3-амино-N-(4-трифторфенил)-4-(1,4-диазепан-1-ил)бензолсульфонамида;
гидрохлорид 3-амино-N-(4-фторфенил)-4-(1,4-диазепан-1-ил)бензолсульфонамида;
гидрохлорид 3-амино-N-(2-фторфенил)-4-(1,4-диазепан-1-ил)бензолсульфонамида;
гидрохлорид 3-амино-4-(4-метил-1,4-диазепан-1-ил)-N-фенилбензолсульфонамида;
гидрохлорид 3-амино-4-(1,4-диазепан-1-ил)-N-фенилбензолсульфонамида;
гидрохлорид 2-(1,4-диазепан-1-ил)-5-(4-морфолинилсульфонил)фениламина;
гидрохлорид 4-(1,4-диазепан-1-ил)-N-фенил-3-[(фенилсульфонил)амино]бензолсульфонамида;
гидрохлорид 4-(1,4-диазепан-1-ил)-N-фенил-3-[(метилсульфонил)амино]бензолсульфонамида;
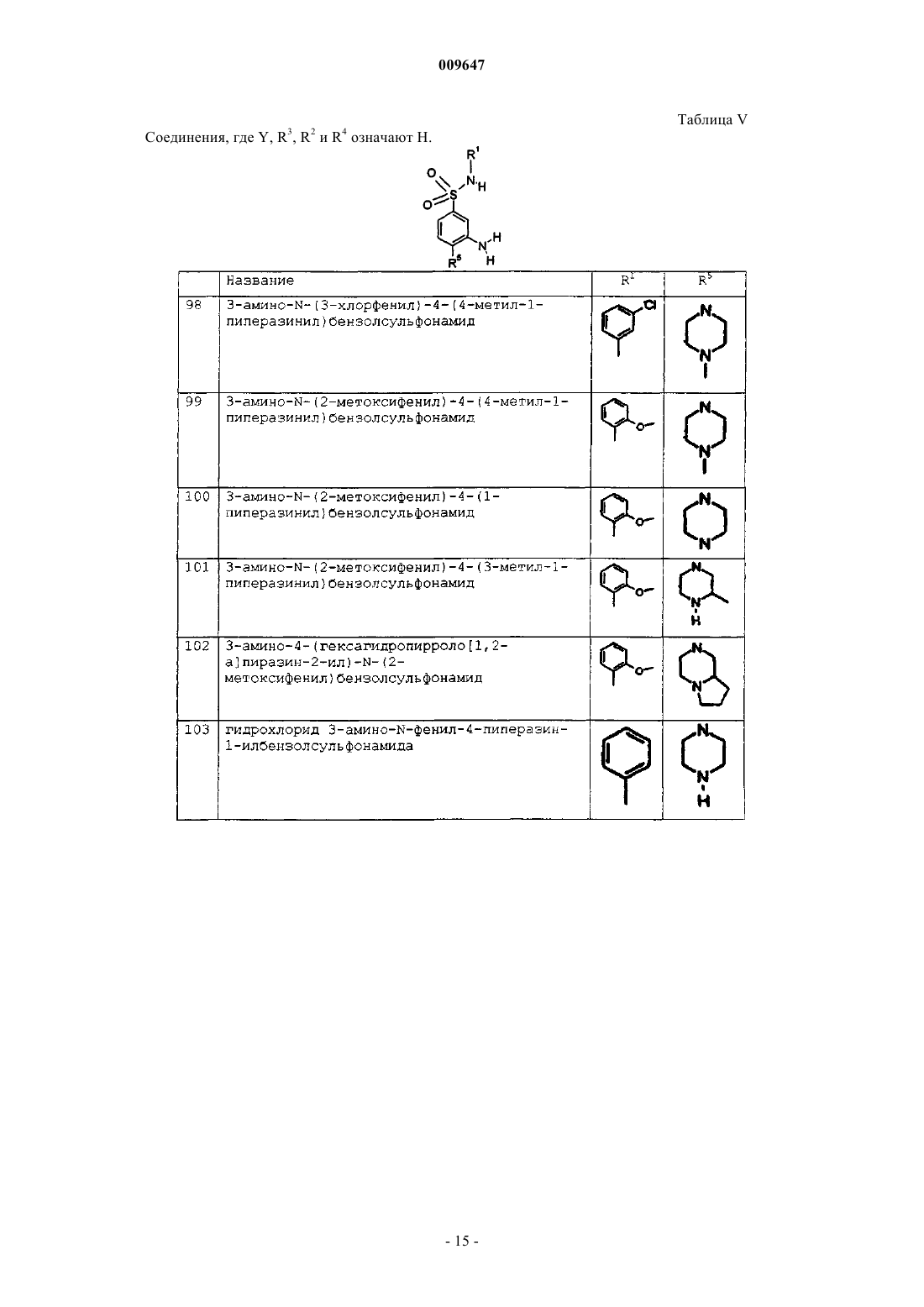
гидрохлорид 3-амино-N-(3-хлорфенил)-4-(4-метил-1-пиперазинил)бензолсульфонамида;
гидрохлорид 3-амино-N-(2-метоксифенил)-4-(4-метил-1-пиперазинил)бензолсульфонамида;
гидрохлорид 3-амино-N-(2-метоксифенил)-4-(1-пиперазинил)бензолсульфонамида;
гидрохлорид 3-амино-N-(2-метоксифенил)-4-(3-метил-1-пиперазинил)бензолсульфонамида;
гидрохлорид 3-амино-4-(гексагидропирроло[1,2-а]пиразин-2-ил)-N-(2-метоксифенил)бензолсульфонамида;
гидрохлорид 3-амино-N-фенил-4-пиперазин-1-илбензолсульфонамида;
гидрохлорид 3-амино-4-(3-метилпиперазин-1-ил)-N-фенилбензолсульфонамида;
гидрохлорид 3-амино-4-(4-этилпиперазин-1-ил)-N-фенилбензолсульфонамида;
гидрохлорид 3-амино-4-(гексагидропирроло[1,2-а]пиразин-2-ил)-N-фенилбензолсульфонамида;
гидрохлорид 3-амино-4-(5-метил-2,5-диазабицикло[2.2.1]гепт-2-ил)-N-фенилбензолсульфонамида;
гидрохлорид 3-амино-4-(транс-2,5-диметилпиперазин-1-ил)-N-(2-метоксифенил)бензолсульфонамида;
2-(3-амино-4-[1,4]диазепан-1-илбензолсульфонил)бензамидодиуксусная кислота;
4-[4-(3-фтор-2-метоксифенилсульфамоил)-2-аминофенил]-[1,4]диазепандитрифторуксусная кислота;
дигидрохлорид 2-[1,4]диазепан-1-ил-5-(3,4-дигидро-1Н-изохинолин-2-сульфонил)анилина;
4-[4-(3,4-дигидро-2Н-хинолин-1-сульфонил)-2-аминофенил]-[1,4]диазепандитрифторуксусная кислота;
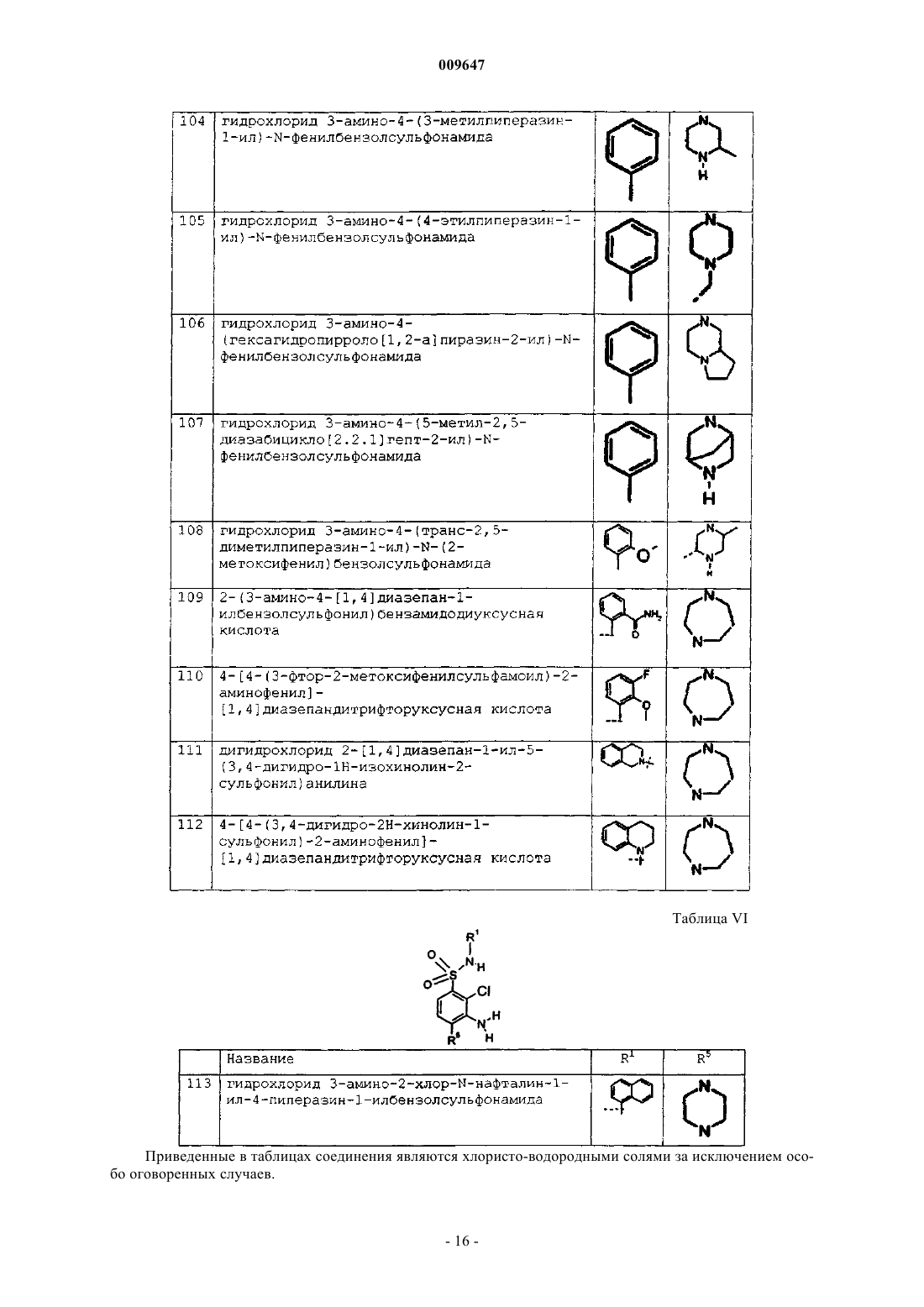
гидрохлорид 3-амино-2-хлор-N-нафталин-1-ил-4-пиперазин-1-илбензолсульфонамида.
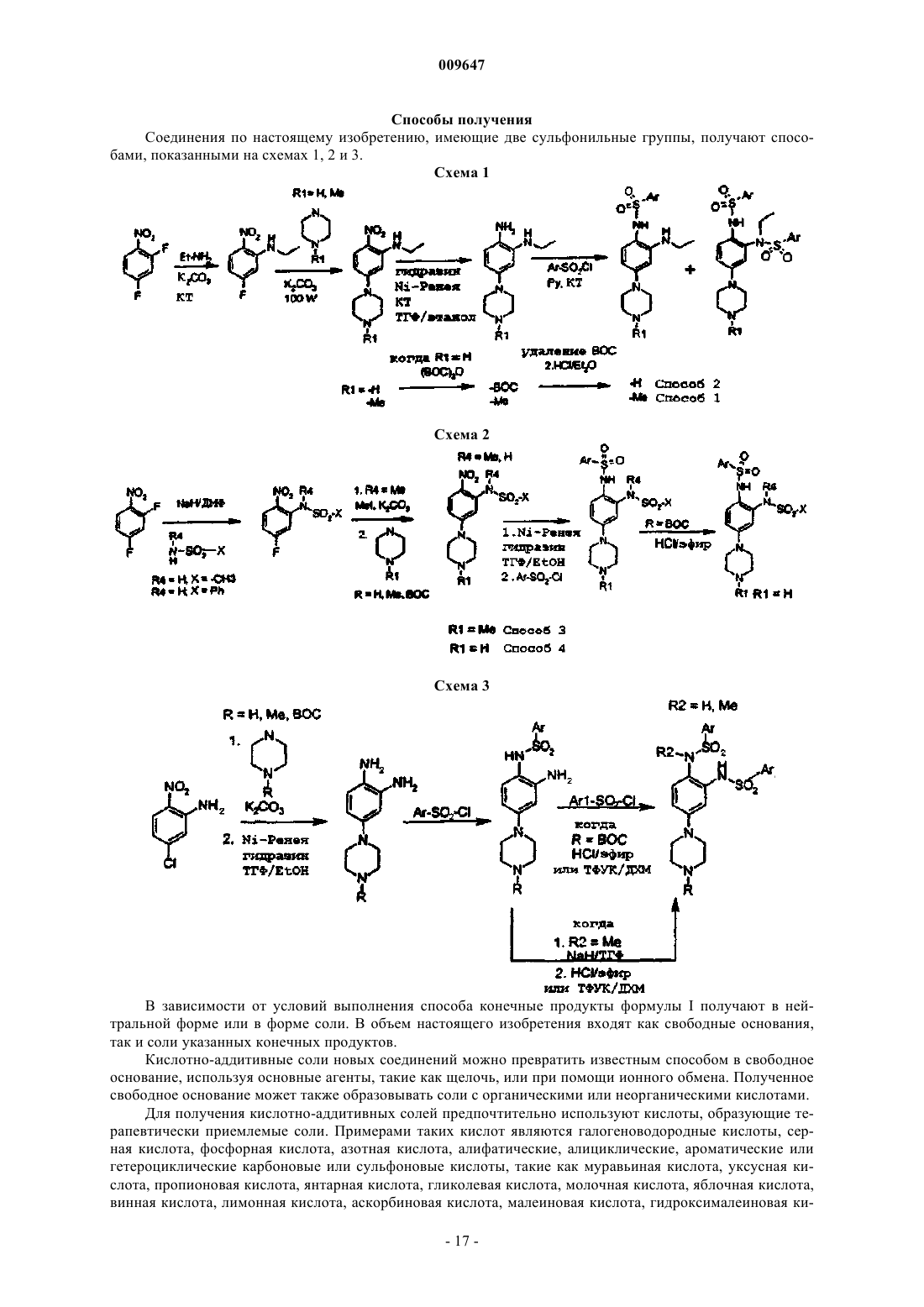
9. Способ получения соединения по любому из пп.1-8, который включает:
(a) введение циклического диамина в бензол, замещенный галогеном и нитрогруппой, в мягких условиях в основной среде;
(b) восстановление нитрогруппы в соответствующий амин;
(c) симметричное или асимметричное сульфонилирование амина сульфонилхлоридом;
(d) введение групп R3 и R4 алкилированием в основной среде.
10. Фармацевтическая композиция для лечения или профилактики ожирения или диабета типа II, содержащая соединение по любому из пп.1-8 в качестве активного ингредиента в сочетании с фармацевтически приемлемым разбавителем или носителем.
11. Способ лечения или профилактики ожирения или диабета типа II, который включает введение нуждающемуся млекопитающему эффективного количества соединения по любому из пп.1-8.
12. Способ модуляции активности рецептора 5-НТ6 для лечения или профилактики ожирения или диабета типа II, который включает введение нуждающемуся млекопитающему эффективного количества соединения по любому из пп.1-8.
13. Соединение по любому из пп.1-8, предназначенное для лечения или профилактики ожирения и/или диабета типа II.
14. Применение соединения по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения или профилактики ожирения и/или диабета типа II.
Текст
009647 Родственные заявки По заявке на данное изобретение испрашивается приоритет на основании заявки на патент Швеции 0101660-9, поданной 11 мая 2001 г., предварительной заявки на патент США 60/294102, поданной 29 мая 2001 г., и предварительной заявки на патент США 60/294132, поданной 29 мая 2001 г., которые включены в данное описание изобретения в качестве ссылки. Область техники Настоящее изобретение относится к замещенным бис-арилсульфонамидным и арилсульфонамидным соединениям, фармацевтическим композициям, содержащим такие соединения, и применению указанных соединений для профилактики и лечения ожирения, диабета типа II и/или нарушений центральной нервной системы. Предпосылки изобретения Ожирение - это заболевание, характеризующееся увеличением содержания жира в организме, что ведет к избыточной массе тела по сравнению с общепринятыми нормами. Ожирение является наиболее распространенным нарушением, обусловленным неправильным питанием, в западном мире и представляет важную проблему здравоохранения во всех промышленно развитых странах. Указанное нарушение вызывает увеличение смертности от сердечно-сосудистых, желудочно-кишечных, респираторных и раковых заболеваний, а также диабета типа II. В течение многих десятилетий ведется поиск соединений,уменьшающих массу тела. Одним из направлений поиска является активация серотонергических систем путем прямой активации рецепторов серотонина разных подтипов или ингибирования повторного поглощения серотонина. Однако до сих пор неизвестен точный профиль подтипов указанных рецепторов. Серотонин (5-гидрокситриптамин или 5-НТ), который является главным передатчиком сигналов в периферической и центральной нервной системе, модулирует многие физиологические и патологические функции, включая беспокойство, сон, агрессию, питание и депрессию. Идентифицированы и клонированы рецепторы серотонина разных подтипов. Один из указанных рецепторов 5-HT6 клонирован несколькими научно-исследовательскими группами в 1993 г. (Ruat, M. et al. (1993) Biochem. Biophys. Res. Commun. 193:268-276; Sebben, M. et al., (1994) NeuroReport 5:2553-2557). Данный рецептор положительно связывается с аденилилциклазой и обладает сродством к антидепрессантам, таким как клозапин. В научной литературе недавно появилось сообщение о воздействии антагониста 5-НТ 6 и антисмысловых олигонуклеотидов 5-НТ 6 на уменьшение потребления корма у крыс (Bentley, J.C. et al. (1999) Br. J. Pharmac.Suppl. 126, P66; Bentley, J.C. et al. (1997) J. Psychopharmacol. Suppl. A64, 255). Идентифицированы соединения с повышенным сродством и избирательностью в отношении рецептора 5-НТ 6, которые описаны, например, в заявке на патент WO 00/34242 и публикации Isaac, M. et al.as novel, potent and selective 5-HT6 receptor antagonists. BioorganicMedicinal Chemistry Letters 10:17191721. Описание изобретения Установлено, что соединения формулы (I) и (II) обладают сродством к рецептору 5-НТ 6 в качестве антагонистов в нижнем наномолярном диапазоне концентраций. Соединения по данному изобретению и их фармацевтически приемлемые соли являются антагонистами рецептора 5-НТ 6 и, как считается, могут быть использованы для лечения или профилактики ожирения и диабета типа II, а также для лечения или профилактики нарушений центральной нервной системы, таких как состояние беспокойства, депрессия,паническое состояние, расстройства памяти, нарушения сна, нарушения, обусловленные чрезмерным потреблением пищи и алкогольных напитков, мигрень, анорексия, булимия, навязчиво-компульсивное состояние, психоз, болезнь Альцгеймера, болезнь Паркинсона, хорея Гентингтона и/или шизофрения,злоупотребление лекарственными средствами, повышенная активность с нарушением внимания (ADHD). Определения За исключением особо оговоренных случаев следующие определения использованы как в описании изобретения, так и в прилагаемой формуле изобретения. Термин "C1-6 алкил" означает алкильную группу с прямой или разветвленной цепью, имеющую от 1 до 6 атомов углерода. Примерами указанных низших алкильных групп являются метил, этил, н-пропил,изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, а также пентил и гексил с прямой и разветвленной цепью. Термин "C1-6 алкокси" означает алкоксигруппу с прямой или разветвленной цепью, имеющей от 1 до 6 атомов углерода. Примерами указанных низших алкоксигрупп являются метокси, этокси, н-пропокси,изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, а также пентокси и гексокси с прямой и разветвленной цепью. Термин "галоген" означает фтор, хлор, бром или йод. Термин "С 4-6 циклоалкил" и "С 3-7 циклоалкил" означают циклическую алкильную группу, имеющую кольцо соответственно от С 4 до С 6 или от С 3 до С 7. Примеры указанного циклоалкила включают циклопропил, циклобутил, циклопентил, циклогексил, метилциклогексил и циклогептил. Соединения формулы I. Первым объектом данного изобретения является соединение общей формулы (I) или его фармацевтически приемлемая соль, где(d) C1-6 гидроксиалкил с прямой или разветвленной цепью;(e) C1-6 алкилгалогениды с прямой или разветвленной цепью или(f) 5-7-членное, частично или полностью насыщенное, гетероциклическое кольцо, содержащее 1-4 гетероатома, выбираемых из кислорода, азота и серы; или(g) бициклическую кольцевую систему, состоящую из двух гетероциклических колец, указанных в пункте (f), или бициклическую кольцевую систему, включающую одно бензольное кольцо и одно гетероциклическое кольцо, указанное в пункте (f); альтернативно, R1 и R3 связаны друг с другом с образованием группы (СН 2)2 О, (СН 2)4 О или (СН 2)3-5 в формуле (Ib); группа Ar может быть необязательно замещена:(b) 5-7-членным, частично или полностью насыщенным, гетероциклическим кольцом, содержащим 1-4 гетероатома, выбираемых из кислорода, азота или серы;(n) C1-6 гидроксиалкил с прямой или разветвленной цепью;(о) C1-6 алкилгалогениды с прямой или разветвленной цепью;R5 выбран из группы, включающей следующие химические группы:(b) C1-6 алкил. Предпочтительными соединениями общей формулы (I) являются соединения, в которых(f) 5-7-членное, частично или полностью насыщенное, гетероциклическое кольцо, содержащее 1-4 гетероатома, выбираемых из кислорода, азота и серы; группа Аr замещена Y, где Y означает:(n) C1-6 гидроксиалкил с прямой или разветвленной цепью; группа присоединена к фенильному кольцу в положении 2 или положении 3;R5 выбран из группы, включающей следующие химические группы: Таблица IV Соединения, где Y и группа -N-R2R4 имеют значения, указанные для группы R в следующей струк турной формуле, и R5 представляет группу Приведенные в таблицах соединения являются хлористо-водородными солями за исключением особо оговоренных случаев.- 16009647 Способы получения Соединения по настоящему изобретению, имеющие две сульфонильные группы, получают способами, показанными на схемах 1, 2 и 3. Схема 1 В зависимости от условий выполнения способа конечные продукты формулы I получают в нейтральной форме или в форме соли. В объем настоящего изобретения входят как свободные основания,так и соли указанных конечных продуктов. Кислотно-аддитивные соли новых соединений можно превратить известным способом в свободное основание, используя основные агенты, такие как щелочь, или при помощи ионного обмена. Полученное свободное основание может также образовывать соли с органическими или неорганическими кислотами. Для получения кислотно-аддитивных солей предпочтительно используют кислоты, образующие терапевтически приемлемые соли. Примерами таких кислот являются галогеноводородные кислоты, серная кислота, фосфорная кислота, азотная кислота, алифатические, алициклические, ароматические или гетероциклические карбоновые или сульфоновые кислоты, такие как муравьиная кислота, уксусная кислота, пропионовая кислота, янтарная кислота, гликолевая кислота, молочная кислота, яблочная кислота,винная кислота, лимонная кислота, аскорбиновая кислота, малеиновая кислота, гидроксималеиновая ки- 17009647 слота, пировиноградная кислота, парагидроксибензойная кислота, эмбоновая кислота, метансульфоновая кислота, этансульфоновая кислота, гидроксиэтансульфоновая кислота, галогенбензолсульфоновая кислота, толуолсульфоновая кислота, миндальная кислота или нафталинсульфоновая кислота. В описании изобретения и прилагаемой формуле изобретения приведенные химические формулы или названия включают все стерео- и оптические изомеры и рацематы указанных соединений, если такие изомеры существуют. Все возможные диастереомерные формы (чистые энантиомеры, таутомеры, рацемические смеси и неравные смеси двух энантиомеров) входят в объем данного изобретения. Такие соединения также могут существовать в форме цис- или транс-, Е- или Z-изомеров с двойной связью. Все изомерные формы входят в объем изобретения. Фармацевтические композиции Фармацевтические композиции обычно получают, смешивая активное вещество или его фармацевтически приемлемую соль с обычными фармацевтическими эксципиентами. Указанные композиции можно далее получить известными методами, такими как гранулирование, прессование, микроинкапсулирование, нанесение покрытия распылением и т.д. Данное изобретение относится к способу лечения ожирения или диабета типа II. Указанный способ включает введение нуждающемуся млекопитающему (например, человеку) эффективного количества одного или нескольких соединений приведенной выше формулы (I) или формулы (II). В объем настоящего изобретения входит также способ модуляции (например, ингибирования) активности рецептора 5-НТ 6. Указанный способ включает введение нуждающемуся млекопитающему эффективного количества соединения приведенной выше формулы (I) или формулы (II). Термин "эффективное количество" означает такое количество соединения, которое оказывает терапевтическое воздействие на подвергаемый лечению субъект. Терапевтическое воздействие может быть объективным (то есть измеряемым при помощи какого-либо испытания или маркера) или субъективным(то есть субъект доводит до сведения врача или чувствует оказываемое действие). Соединения по данному изобретению, предназначенные для применения в клинических условиях, используют для получения фармацевтических композиций для перорального, ректального, парентерального или другого способа введения. Количество активных соединений обычно составляет 0,1-95 мас.% препарата, предпочтительно 0,2-20 мас.% в препаратах для парентерального введения и предпочтительно 1-50 мас.% в препаратах для перорального введения. Типичная суточная доза активного вещества изменяется в широких пределах и зависит от разных факторов, таких как, например, индивидуальная потребность пациента и способ введения. Дозы для перорального и парентерального введения обычно составляют от 5 до 1000 мг/сутки активного вещества,предпочтительно 50-150 мг/сутки. Следующие конкретные примеры являются чисто иллюстративными и никоим образом не ограничивают объем изобретения. Следует отметить, что специалист в данной области может без особого труда на основании приведенного описания в полной мере осуществить настоящее изобретение. Все приведенные публикации включены в данное описание изобретения в качестве ссылки во всей своей полноте. Примеры Структуры соединений, полученных в нижеследующих примерах, подтверждены стандартными спектроскопическими методами, элементным анализом и/или масс-спектроскопией высокого разрешения. Данные ЯМР получены при помощи спектрометра JNM-EX 270 фирмы JEOL, 400 DPX фирмыBruker или DRX 500 фирмы Bruker. ИК-спектры получены при помощи инфракрасного спектрометра 1000 FT SPECTRUM фирмы Perkin Elmer. Масс-спектры высокого разрешения получены при помощи спектрометра LCT фирмы Micromass. Элементный анализ выполнен в Швеции фирмой Mikro Kemi ABUppsala. Температуры плавления в тех случаях, когда они указаны, измерены при помощи прибора для определения точки плавления фирмы Buchi или Gallenkamp и не скорректированы. Синтез по схеме 1, способ 2 (R=Boc). Промежуточное соединение 1. Синтез N-этил-5-фтор-2-нитроанилина. Суспензию 2,4-дифтор-1-нитробензола (0,50 г, 0,003 ммоль), гидрохлорида этиламина (0,49 г, 0,006 ммоль), K2CO3 (1,66 г, 0,012 ммоль) в ацетонитриле (30 мл) перемешивают при комнатной температуре в течение 16 ч и фильтруют. Фильтрат концентрируют и растворяют в небольшом количестве CHCl3. Продукт очищают хроматографией на колонке с силикагелем, используя в качестве элюента пентан/диэтиловый эфир (95:5), и получают 0,45 г желтого твердого вещества. 1 Н ЯМР (CDCl3)8,23-8,18 (м, 1 Н), 8,08 (шс, 1 Н), 6,49-6,45 (м, 1H), 6,38-6,32 (м, 1 Н), 3,34-3,27 (м,2 Н), 1,38 (тр, J=7,22 Гц, 3 Н); 13 С ЯМР (CDCl3)167,55 (д, JCF=255,6 Гц), 147,4 (д, JCF=12,9 Гц), 129,91 (д, JCF=12,9 Гц), 128,71- 18009647 Суспензию N-этил-5-фтор-2-нитроанилина (1,5 г, 8,12 ммоль), пиперазина (0,979 г, 11,37 ммоль),K2CO3 (3,36 г, 24,3 ммоль) в ДМФ (40 мл) нагревают в микроволновой печи в течение 1 мин при мощности нагрева 100 Вт. Реакционную смесь оставляют охлаждаться и затем нагревают еще 1 мин при мощности нагрева 100 Вт. Указанную операцию повторяют 5 раз. Суспензию фильтруют и концентрируют. Неочищенное масло очищают флэш-хроматографией на силикагеле, используя в качестве элюентаCHCl3/MeOH/NH3 (9:1:0,4%), и получают 1,53 г (75%) желтого твердого вещества. 1 Н ЯМР (CDCl3)8,30 (шс, 1 Н), 8,08-8,04 (м, 1H), 6,25-6,20 (м, 1H), 5,88-5,86 (м, 1 Н), 3,39-3,28 (м,6 Н), 3,03-2,97 (м, 4 Н), 1,37 (тр, J=7,2 Гц, 3 Н); 13 С ЯМР(CDCl3)156,27, 147,74, 128,96, 124,13, 104,28, 93,34, 48,22, 45,99, 37,73, 14,15; МС (положит.EO) m/z=250 (М+); МС (положит.ESI) m/z=найдено: 250,1429, вычислено: 250,1430. Элементный анализ (C12H18N4O2) C, H, O. Промежуточное соединение 3. Синтез трет-бутил 4-[3-(этиламино)-4-нитрофенил]-1 пиперазинкарбоксилата. К раствору N-этил-2-нитро-5-(1-пиперазинил)анилина (1,020 г, 4,075 ммоль) и NaOH (0,39 г, 2,45 ммоль) в ТГФ:Н 2 О (64 мл, 1:1) добавляют раствор ди-трет-бутилдикарбоната (2,67 г, 12,2 ммоль) в 5 мл ТГФ. Раствор перемешивают при комнатной температуре в течение 16 ч. Смесь нейтрализуют 1 н. раствором HCl. Летучие вещества удаляют в вакууме, получая при этом 1,4 г неочищенного вещества (98%). 1 Н ЯМР (CDCl3)8,28 (шс, 1 Н), 8,13-8,09 (м, 1 Н), 6,27-6,22 (м, 1 Н), 6,05-6,02 (м, 1 Н), 3,67-3,61 (м,4 Н), 3,45-3,38 (м, 4 Н), 3,35-3,27 (м, 2 Н), 1,50 (с, 9 Н); МС (положит. ESI) m/z=найдено: 350,1951, вычислено: 350,1954. Промежуточное соединение 4. Синтез трет-бутил 4-[4-амино-3-(этиламино)фенил]-1 пиперазинкарбоксилата. К раствору трет-бутил 4-[3-(этиламино)-4-нитрофенил]-1-пиперазинкарбоксилата (1,028 г, 2,93 ммоль) в 40 мл системы растворителей EtOH:ТГФ (4:1) добавляют Ni-Ренея (1 мл суспензии в EtOH) и гидразингидрат (0,734 г, 14,67 ммоль). Смесь интенсивно перемешивают в течение 3 ч и фильтруют через подушку целита, предварительно обработанного водой. Фильтрат концентрируют и очищают хроматографией на колонке с силикагелем, используя в качестве элюента CHCl3/MeOH/NH3 (9:1:0,4%), и получают 0,877 г (93%) красного масла. Полученное масло сразу же используют на следующей стадии. Чистота после выполнения ВЭЖХ 90%; MC (положит.EI) m/z=320 (M+). Способ 1, схема 1: общие условия сульфонилирования (R1=Me). Промежуточное соединение 5. Синтез N-этил-5-(4-метил-1-пиперазинил)-2-нитроанилина (способ 1, схема 1).N-Этил-5-(4-метил-1-пиперазинил)-2-нитроанилин получают из 2,4-дифтор-1-нитробензола и метилпиперазина способом, описанным для N-этил-2-нитро-5-(1-пиперазинил)анилина в виде желтого твердого вещества (99%). 1 Н ЯМР (CDCl3)8,30 (шс, 1 Н), 8,08-8,04 (м, 1 Н), 6,25-6,20 (м, 1 Н), 5,89-5,86 (м, 1 Н), 3,45-3,39 (м,4 Н), 3,35-3,25 (м, 2 Н), 2,56-2,50 (м, 4 Н), 2,35 (с, 3 Н), 1,37 (тр, J=7,2 Гц, 3 Н); 13 С ЯМР (CDCl3)155,92, 147,72, 128,99, 124,19, 104,30, 94,37, 54,78, 47,05, 46,25, 37,73, 14,43; МС (положит.ESI) m/z=найдено: 264,1575, вычислено: 264,1586. Элементный анализ (C13H20N4O20,5 Н 2 О) С, Н, О. Промежуточное соединение 6. Синтез N-2-этил-4-(4-метил-1-пиперазинил)-1,2-бензолдиаминаN-Этил-5-(4-метил-1-пиперазинил)-2-нитроанилин восстанавливают над Ni-Ренея, как описано выше для синтеза трет-бутил 4-[4-амино-3-(этиламино)фенил]-1-пиперазинкарбоксилата, и получают N-2 этил-4-(4-метил-1-пиперазинил)-1,2-бензолдиамин (выход 90%) в виде красного масла. Продукт очень чувствителен к окислению, поэтому его сразу же используют на следующей стадии. Чистота после выполнения ВЭЖХ 90%; МС (положит.EI) m/z=234 (M+). Пример 1. ГидрохлоридN-[2-этил[(3-фторфенил)сульфонил]амино-4-(4-метил-1 пиперазинил)фенил]-3-фторбензолсульфонамида (способ 1, схема 1). К раствору N-2-этил-4-(4-метил-1-пиперазинил)-1,2-бензолдиамина (0,200 г, 0,853 ммоль) и пиридина (0,48 мл, 5,97 ммоль) в CH2Cl2 (8 мл) добавляют раствор 3-фторбензолсульфонилхлорида (249 мг,1,28 ммоль) в CH2Cl2 (2 мл). Смесь перемешивают при комнатной температуре в течение 16 ч. Добавляют CH2Cl2 (10 мл) и смесь промывают насыщенным водным раствором NaHCO3. Органический слой сушат над Na2SO4, фильтруют и концентрируют. Продукт очищают хроматографией на колонке (Al2O3,EtOAc/MeOH, 9,5:0,5), получая при этом две фракции. Первая фракция содержит 110 мг гидрохлорида N[2-этил[(3-фторфенил)сульфонил]амино-4-(4-метил-1-пиперазинил)фенил]-3-фторбензолсульфонамида. Вторая фракция содержит 100 мг гидрохлорида N-[2-(этиламино)-4-(4-метил-1-пиперазинил)фенил]3-фторбензолсульфонамида. Оба продукта превращают в хлористо-водородные соли. ГидрохлоридH ЯМР (ДМСО-d6)11,14 (шс, 1 Н), 9,27 (с, 1 Н), 7,75-7,35 (м, 8 Н), 7,18-7,15 (м, 1 Н), 6,95-6,90 (м,1 Н), 6,07-6,04 (м, 1 Н), 3,47-3,30 (м, 4 Н), 3,05-2,85 (м, 4 Н), 2,73 (д, J=4,7 Гц), 0,72 (тр, J=7,2 Гц); 13 С ЯМР (CD3OD)162,65 (д, JCF=5,5 Гц), 160,68 (д, JCF=4,6 Гц), 146,61, 142,52 (д, JCF=7,4 Гц),139,04 (д, JCF=6,4 Гц), 131,58, 131,63, 131,28, 128,67, 124,25, 123,14, 122,89, 120,56 (д, JCF=21 Гц), 120,05 (д,JCF=21 Гц), 116,52, 115,64, 114,80 (д, JCF=25 Гц), 113,97 (д, JCF=25 Гц), 51,88, 45,82, 44,84, 41,79, 12,31; МС (положит.ES-FIA) m/z=551 (M+H). Пример 2. Гидрохлорид N-[2-[этил(фенилсульфонил)амино]-4-(4-метил-1-пиперазинил)фенил]бензолсульфонамида (схема 1, способ 1). Гидрохлорид N-[2-[этил(фенилсульфонил)амино]-4-(4-метил-1-пиперазинил)фенил]бензолсульфонамида получают в соответствии со схемой 1. Сульфонилирование N-2-этил-4-(4-метил-1-пиперазинил)1,2-бензолдиамина и фенилсульфонилхлорида осуществляют аналогично способу 1. Продукт очищают хроматографией (SiO2, хлороформ:метанол:NH3, 9:1:0,4%) с последующим растиранием с MeOH, получая при этом 68 мг (выход 15%) свободного основания, которое превращают в его хлористо-водородную соль. МС (положит.ES-FIA) m/z=найдено: 514,1700, вычислено: 514,1708. Элементный анализ (C25H30N4O4S22HCl) С, H, N. Пример 3. Гидрохлорид 3-фтор-N-[2-[(3-фторфенил)сульфонил]амино-4-(4-метил-1 пиперазинил)фенил]бензолсульфонамида (схема 3). Синтез 2-амино-5-(4-метил-1-пиперазинил)анилина. Смесь 2-нитро-3-хлоранилина (4,47 г, 25,9 ммоль), метилпиперазина (3,1 г, 31 ммоль) и K2CO3 (5,41 г, 39 ммоль) в ацетонитриле перемешивают при 70 С в течение 48 ч. Смесь фильтруют и очищают хроматографией на колонке (SiO2, CH2Cl2/MeOH/гептан/NH3, 4:1:50,2%), получая при этом 1,6 г продуктаH-ЯМР 7,66-7,45 (м, 5 Н), 6,78 (д, 1 Н), 6,62 (д, 1 Н), 6,50 (дд, 1 Н), 3,39-3,35 (м, 4 Н), 3,02-2,99 (м,4 Н); МС (положит.ES-FIA) m/z=333,0 (МН). Продукт (1,06 г, 4,49 ммоль) растворяют в EtOH:ТГФ (4:1). Добавляют Ni-Ренея и гидразин (1,12 мл, 22 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 ч до исчезновения желтого окрашивания. Продукт фильтруют через влажную подушку целита с последующим удалением растворителя, получая при этом 0,802 г 2-амино-5(4-метил-1-пиперазинил)анилина, который используют на следующей стадии без очистки. 3-Фторбензолсульфонилхлорид (0,133 г, 0,68 ммоль) добавляют к раствору 2-амино-5-(4-метил-1 пиперазинил)анилина (0,141 г, 0,68 ммоль) и пиридина (514 мл, 6,39 ммоль) в CH2Cl2. Через 1 ч смесь промывают водным раствором NaHCO3 (10%), сушат (MgSO4) и удаляют растворитель. Продукт очищают хроматографией (SiO2, CH2Cl2/метанол/гептан, 4:1:5), получая при этом 3-фторN-[2-амино-4-(4-метил-1-пиперазинил)фенил]бензолсульфонамид (0,140 г, 57%). МС (положит.ES-FIA) m/z=найдено: 365,2, вычислено: 364,14. Элементный анализ (C17H22ClFN4O2S3 Н 2 О) С, Н, N, S. В результате выполнения указанной реакции образуется небольшое количество биссульфонилированного соединения 3-фтор-N-[2-[(3-фторфенил)сульфонил]амино-4-(4-метил-1 пиперазинил)фенил]бензолсульфонамида (0,010 г, 3%). Продукты превращают в их хлористоводородные соли до выполнения анализа. МС (положит.ES-FIA) m/z=найдено: 523,5, вычислено: 522,12. Элементный анализ (C23H25ClF2N4O4S2) С, Н, N, S. Пример 4. Гидрохлорид N-4-(4-метил-1-пиперазинил)-2-[(8-хинолинилсульфонил)амино]фенил 8-хинолинсульфонамида (схема 3). 8-Хинолинсульфонилхлорид (0,185 г, 0,81 ммоль) добавляют к раствору 2-амино-5-(4-метил-1 пиперазинил)анилина (0,168 г, 0,81 ммоль) и пиридина (514 мл, 6,39 ммоль) в CH2Cl2. Смесь выдерживают при комнатной температуре в течение 1 ч, промывают водным раствором NaHCO3 (10%), сушат(MgSO4) и удаляют растворитель. Продукт очищают хроматографией (SiO2, CH2Cl2/MeOH/гептан, 4:1:5),получая при этом N-2-амино-4-(4-метил-1-пиперазинил)фенил-8-хинолинсульфонамид (0,110 г, 35%)(C19H22ClN5O2S3 Н 2 О) С, Н, N, S) и небольшое количество бис-сульфонилированного N-4-(4-метил-1 пиперазинил)-2-[(8-хинолинилсульфонил)амино]фенил-8-хинолинсульфонамида (0,070 г, 15%). Продукт превращают в хлористо-водородную соль до выполнения анализа. МС (положит.ES-FIA) m/z=найдено: 589,6, вычислено: 588,16. Элементный анализ (C29H29ClN6O4S22 Н 2 О) С, Н, N. Синтез по схеме 2. Схема 2, способ 3: общее условие R1=Me. Промежуточное соединение 7. Синтез N-(5-фтор-2-нитрофенил)бензолсульфонамида (схема 2,- 20009647 способ 3). Бензолсульфонамид (3,14 г, 20 ммоль) растворяют в ДМФ (100 мл) и добавляют NaH (60% суспензия в масле, 40 ммоль, 1,60 г). Реакционную смесь перемешивают до прекращения выделения газа. Добавляют 2,4-дифторнитробензол (18 ммоль, 2,9 г, 2 мл) и реакционную смесь перемешивают в течение ночи при 35 С. Реакционную смесь выливают в HCl (1M водный раствор, 100 мл) и экстрагируют толуолом (25 мл 5). Органическую фазу сушат (MgSO4), концентрируют и перекристаллизовывают из EtOH,получая при этом первую фракцию, содержащую 3,75 г желтого твердого вещества. Вторую фракцию в количестве 0,20 г получают из остальной части EtOH. Выход 3,95 г, 13,3 ммоль (74%). МС (положит.ES-FIA) m/z=найдено: 296, вычислено: 296,0. Промежуточное соединение 8. Синтез N-[5-(4-метил-1-пиперазинил)-2-нитрофенил]бензолсульфонамида (схема 2, способ 3).N-(5-Фтор-2-нитрофенил)бензолсульфонамид (20,50 г, 1,688 ммоль) обрабатывают Nметилпиперазином (24,65 г, 45,6 ммоль), переносят в две пробирки из стекла пирекс и закупоривают. Обе пробирки помещают в микроволновую печь MW-10 фирмы LabWell на 2 мин при мощности нагрева 50 Вт. Реакционные смеси объединяют, выливают в 0,5 М раствор NaOH (водный), экстрагируют CH2Cl2,сушат (MgSO4) и концентрируют, получая при этом 0,99 г (2,63 ммоль) продукта с выходом 78% в виде желтого твердого вещества. Элементный анализ (C17H20N4O4S) С, Н, N, S. МС (положит. ES-FIA) m/z=найдено: 377,4, вычислено: 376,12. Пример 5. Гидрохлорид N-[2-хлор-4-(4-(4-метил-1-пиперазинил)-2-[(фенилсульфонил)амино]анилиносульфонил)фенил]ацетамида (схема 2, способ 3).N-[5-(4-Метил-1-пиперазинил)-2-нитрофенил]бензолсульфонамид (0,600 г, 1,59 ммоль) растворяют в ТГФ (20 мл) и добавляют Ni-Ренея (0,322 г, в этаноле) и гидразингидрат (0,100 г, 2,0 ммоль). Реакционную смесь перемешивают в течение 1 ч, фильтруют через целит и концентрируют. Остаток растворяют в пиридине (12 мл) и делят на 12 равных частей. К одной части добавляют 3-хлор-4-Nацетамидобензолсульфонилхлорид (52 мг, 0,20 ммоль). Реакционную смесь перемешивают в течение ночи, выливают в петролейный эфир с образованием осадка, который собирают центрифугированием. Осадок очищают хроматографией на колонке (SiO2, CH2Cl2/MeOH, от 95:5 до 9:1). Чистый продукт растворяют в MeOH и обрабатывают смесью HCl/диэтиловый эфир, получая при этом 9,6 мг (выход 12%). МС (положит.ES-FIA) m/z=найдено: 578,4, вычислено: 577,12. Пример 6. Гидрохлорид 3,4-диметокси-N-4-(4-метил-1-пиперазинил)-2-[(фенилсульфонил)амино]фенилбензолсульфонамида (схема 2, способ 3).N-[5-(4-Метил-1-пиперазинил)-2-нитрофенил]бензолсульфонамид (0,600 г, 1,59 ммоль) растворяют в ТГФ (20 мл) и добавляют Ni-Ренея (0,322 г, в этаноле) и гидразингидрат (0,100 г, 2,0 ммоль). Реакционную смесь перемешивают в течение 1 ч, фильтруют через целит и концентрируют. Остаток растворяют в пиридине (12 мл) и делят на 12 равных частей. К одной части добавляют 3,4 диметоксибензолсульфонилхлорид (47 мг, 0,20 ммоль). Реакционную смесь перемешивают в течение ночи, выливают в петролейный эфир с образованием осадка, который собирают центрифугированием. Осадок очищают хроматографией на колонке (SiO2, CH2Cl2/MeOH, от 95:5 до 9:1). Чистый продукт растворяют в MeOH и обрабатывают смесью HCl/диэтиловый эфир, получая при этом 34,5 мг (выход 45%). МС (положит.ES-FIA) m/z=найдено: 547,4, вычислено: 546,16. Пример 7. Гидрохлорид 3-метокси-4-метил-N-4-(4-метил-1-пиперазинил)-2-[(фенилсульфонил)амино]фенилбензолсульфонамида (схема 2, способ 3).N-[5-(4-Метил-1-пиперазинил)-2-нитрофенил]бензолсульфонамид (0,600 г, 1,59 ммоль) растворяют в ТГФ (20 мл) и добавляют Ni-Ренея (0,322 г, в этаноле) и гидразингидрат (0,100 г, 2,0 ммоль). Реакционную смесь перемешивают в течение 1 ч, фильтруют через целит и концентрируют. Остаток растворяют в пиридине (12 мл) и делят на 12 равных частей. К одной части добавляют 2 метокси-4 метилбензолсульфонилхлорид (44 мг, 0,20 ммоль). Реакционную смесь перемешивают в течение ночи,выливают в петролейный эфир с образованием осадка, который собирают центрифугированием. Осадок очищают хроматографией на колонке (SiO2, CH2Cl2/MeOH, от 95:5 до 9:1). Чистый продукт растворяют вMeOH и обрабатывают смесью HCl/диэтиловый эфир, получая при этом 21 мг (выход 28%). МС (положит.ES-FIA) m/z=найдено: 530,1635, вычислено: 530,1658. Промежуточное соединение 9. Синтез N-(5-фтор-2-нитрофенил)метансульфонамида (схема 2, способ 3). Метилсульфонамид (2,421 г, 25,4 ммоль) растворяют в ДМФ (100 мл) и добавляют NaH (60% дисперсия в масле, 1,00 г, 25 ммоль). Реакционную смесь перемешивают в течение 1 ч и добавляют к перемешиваемому раствору 2,4-дифторнитробензола (4,372 г, 27,5 ммоль) в ДМФ (20 мл). Реакционную смесь перемешивают в течение 2 ч, выливают в смесь (1:1) насыщенного раствора соли и 1 М раствораHCl и экстрагируют толуолом. Органическую фазу сушат (MgSO4) и концентрируют, получая при этом твердое вещество, которое кристаллизуют из смеси толуол/петролейный эфир. Получают 1,32 г (5,64 ммоль) продукта с выходом 22% (часть вещества была потеряна из-за опрокидывания колбы).N-(5-Фтор-2-нитрофенил)метансульфонамид (1,33 г, 5,68 ммоль) растворяют в ДМФ (10 мл) и добавляют N-метилпиперазин (2,00 г, 20 ммоль). Реакционную смесь перемешивают при 20 С в течение 1 ч, затем нагревают феном в течение 5 мин до достижения температуры кипения ДМФ (150 С) и оставляют перемешиваться в течение еще 1 ч. Затем реакционную смесь выливают в насыщенный раствор соли и экстрагируют толуолом (10 мл 2), EtOAc (20 мл 2) и CH2Cl2 (20 мл 2), к водной фазе добавляютNaHCO3 и экстрагируют водную фазу CH2Cl2 (20 мл 2). Органические фазы объединяют, сушат (MgSO4) и концентрируют с получением полутвердого вещества. К реакционной смеси добавляют EtOH, оставляют на ночь и затем отфильтровывают, получая при этом 1,503 г (4,78 ммоль) продукта с выходом 84%. МС (положит.ES-FIA) m/z=найдено: 315, вычислено: 314,10. Элементный анализ (C12H18N4O4S) С, Н, N, S. Пример 8. Гидрохлорид 4-метил-N-4-(4-метил-1-пиперазинил)-2-[(метилсульфонил)амино]фенилбензолсульфонамида (схема 2, способ 3).N-[5-(4-Метил-1-пиперазинил)-2-нитрофенил]метансульфонамид (0,45 г, 1,43 ммоль) растворяют в ТГФ (10 мл) и добавляют Ni-Ренея (0,15 г в этаноле) и гидразингидрат (78 мг, 1,56 ммоль). Реакционную смесь перемешивают в течение 1 ч. К реакционной смеси добавляют еще одну аликвоту гидразингидрата(20 мкл) и перемешивают еще 1 ч, фильтруют через целит и концентрируют, получая 0,42 г продукта,который используют на следующей стадии без дальнейшей очистки. Полученное вещество растворяют в ДМФ (10 мл) и делят на 3 равные части. К одной части добавляют п-толуолсульфонилхлорид (0,095 г, 0,5 ммоль), реакционную смесь перемешивают в течение 1 ч и выливают в смесь петролейный эфир/ацетон(30 мл/10 мл) с образованием осадка. Дополнительный продукт получают из раствора и добавляют к осадку. Продукт выделяют хроматографией (SiO2, CH2Cl2/MeOH, 9:1), получая при этом 0,063 г (выход 28%). МС (положит.ES-FIA) m/z=найдено: 38,1393, вычислено: 438,1395. Пример 9. Гидрохлорид 3,4-диметокси-N-4-(4-метил-1-пиперазинил)-2-[(метилсульфонил)амино]фенилбензолсульфонамида (схема 2, способ 3).N-[5-(4-Метил-1-пиперазинил)-2-нитрофенил]метансульфонамид (0,45 г, 1,43 ммоль) растворяют в ТГФ (10 мл), добавляют Ni-Ренея (0,15 г в этаноле) и гидразингидрат (78 мг, 1,56 ммоль) и реакционную смесь перемешивают в течение 1 ч. К реакционной смеси добавляют дополнительное количество гидразингидрата (20 мкл) и перемешивают еще 1 ч, фильтруют через целит и концентрируют, получая 0,42 г продукта, который используют без дальнейшей очистки. Полученное вещество растворяют в ДМФ (10 мл) и делят на 3 равные части. К одной части добавляют 3,4-диметоксибензолсульфонилхлорид (0,118 г,0,5 ммоль), реакционную смесь перемешивают в течение 1 ч и выливают в смесь петролейный эфир/ацетон (30 мл/100 мл) с образованием осадка. Дополнительный продукт получают из раствора и добавляют к осадку. Продукт выделяют хроматографией (SiO2, CH2Cl2/MeOH, 9:1), получая при этом 0,064 г (выход 26%). МС (положит.ES-FIA) m/z=найдено: 484,1436, вычислено: 484,1450. Пример 10. Гидрохлорид 3-циано-N-4-(4-метил-1-пиперазинил)-2-[(метилсульфонил)амино]фенилбензолсульфонамида (схема 2, способ 3).N-[5-(4-Метил-1-пиперазинил)-2-нитрофенил]метансульфонамид (0,45 г, 1,43 ммоль) растворяют в ТГФ (10 мл), добавляют Ni-Ренея (0,15 г в этаноле) и гидразингидрат (78 мг, 1,56 ммоль) и реакционную смесь перемешивают в течение 1 ч. К реакционной смеси добавляют дополнительное количество гидразингидрата (20 мкл) и перемешивают еще 1 ч, фильтруют через целит и концентрируют, получая 0,42 г продукта, который используют без дальнейшей очистки. Полученное вещество растворяют в ДМФ (10 мл) и делят на 3 равные части. К одной части добавляют 3-цианобензолсульфонилхлорид (0,101 г, 0,5 ммоль), реакционную смесь перемешивают в течение 1 ч и выливают в смесь петролейный эфир/ацетон(30 мл/10 мл) с образованием осадка. Дополнительный продукт получают из раствора и объединяют с осадком. Продукт выделяют хроматографией (SiO2, CH2Cl2/MeOH, 9:1), получая при этом 0,0301 г (выход 13%). МС (положит.ES-FIA) m/z=найдено: 449,1177, вычислено: 449,1191. Схема 2, способ 4; общее условие R1=H.N-(2-амино-5-(4-BOC-1-пиперазинил)фенил)бензолсульфонамид. Смесь N-(2-нитро-3-фторфенил)бензолсульфонамида (4,68 г, 15,7 ммоль), ВОС-пиперазина (3,5 г,18,9 ммоль) и K2CO3 (3,8 г, 27,8 ммоль) в ДМФ перемешивают при 70 С в течение 24 ч. Смесь фильтруют и очищают хроматографией на колонке (SiO2, CH2Cl2/MeOH/гептан/NH3, 4:1:5:0,2%), получая при этом 2,0 г требуемого продукта. 1 Н-ЯМР 7,98 (д, 1 Н), 7,89-7,84 (м, 2 Н), 7,63-7,50 (м, 3 Н), 7,00 (д, 1H), 6,68 (дд, 1 Н), 3,59-3,45 (м,8 Н), 1,49 (с, 9 Н);- 22009647 МС (положит.ES-FIA) m/z=найдено: 485,0 (MNa+). Продукт (1,85 г, 4,00 ммоль) растворяют в EtOH:ТГФ (4:1) и добавляют Ni-Ренея и гидразин (1,0 мл, 20 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 ч до исчезновения желтого окрашивания. Затем реакционную смесь фильтруют через мокрый целит и удаляют растворитель, получая при этом 1,26 г N-(2-амино-5-(4-трет-бутоксикарбонил-1-пиперазинил)фенил)бензолсульфонамида, который используют без дальнейшей очистки. К раствору N-2-амино-5-(4-трет-бутилоксикарбонилпиперазинил)фенилбензолсульфонамида (79 мг, 0,184 ммоль) и пиридина (131 мкл, 1,6 ммоль) в CH2Cl2 (7 мл) добавляют другие сульфонилхлориды(0,239 ммоль). Смесь выдерживают при комнатной температуре в течение 2 ч и удаляют растворитель. Реакционную смесь очищают хроматографией (SiO2, CH2Cl2/MeOH/гептан, 4:1:15) и удаляют защитную ВОС-группу, растворяя остаток в небольшом количестве MeOH и добавляя HCl/эфир. Смесь выдерживают при комнатной температуре в течение 0,5 ч и удаляют растворитель. Реакционную смесь перекристаллизовывают (MeOH/эфир), получая при этом конечный продукт. Пример 11. Гидрохлорид N-4-(1-пиперазинил)-2-[(фенилсульфонил)амино]фенил-1-нафталинсульфонамида (схема 2, способ 4).N-2-амино-5-(4-трет-бутилоксикарбонилпиперазинил)фенилбензолсульфонамида и 1-нафталинсульфонилхлорида (54 мг, 0,239 ммоль) по общему способу 3, получая при этом 40 мг пурпурного твердого вещества. МС (положит.ES-FIA) m/z=найдено: 523,2, вычислено: 523,14. 1 Н ЯМР 8,83-8,59 (м, 1 Н), 8,10 (д, 1 Н), 8,02-7,97 (м, 1 Н), 7,90 (д, 1 Н), 7,74-7,38 (м, 8 Н), 6,69-6,65N-2-амино-5-(4-трет-бутилоксикарбонилпиперазинил)фенилбензолсульфонамида и данзилхлорида (64 мг, 0,239 ммоль) по общему способу 3, получая при этом 60 мг пурпурного твердого вещества. МС (положит.ES-FIA) m/z=найдено: 566,3, вычислено: 566,18. 1 Н ЯМР 8,84 (д, 1H), 8,60 (д, 1H), 8,08 (д, 2 Н), 7,84-7,47 (м, 7 Н), 6,70 (д, 1 Н), 6,56-6,53 (м, 1 Н),6,41-6,37 (м, 1 Н), 3,46 (с, 6 Н), 3,25-3,12 (м, 9 Н). Пример 13. ГидрохлоридN-2-амино-5-(4-трет-бутилоксикарбонилпиперазинил)фенилбензолсульфонамида и 8-хинолинсульфонилхлорида (54 мг, 0,239 ммоль) по общему способу 3, получая при этом 50 мг пурпурного твердого вещества. МС (положит.ES-FIA) m/z=найдено: 524,2, вычислено: 524,13. 1 Н ЯМР 9,34 (дд, 1 Н), 8,79 (дд, 1H), 8,37 (дд, 1 Н), 8,25 (дд, 1 Н), 7,92 (дд, 1 Н), 7,73 (т, 1 Н), 7,577,40 (м, 5 Н), 7,17 (д, 1 Н), 6,71 (дд, 1 Н), 6,14 (д, 1 Н), 3,23-3,08 (м, 8 Н). Пример 14. Гидрохлорид 2,4,6-триметил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамида (схема 2, способ 4). 2,4,6-Триметил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид синтезируют из N-2-амино-5-(4-трет-бутилоксикарбонилпиперазинил)фенилбензолсульфонамида и 2 мезитиленсульфонилхлорида (52 мг, 0,239 ммоль) по общему способу 3, получая при этом 50 мг пурпурного твердого вещества. МС (положит.ES-FIA) m/z=найдено: 515,3, вычислено: 515,17. 1 Н-ЯМР 7,74 (д, 2 Н); 7,63-7,46 (м, 3 Н), 6,92 (с, 2 Н), 6,74-6,55 (м, 3 Н), 3,27-3,20 (м, 8 Н), 2,35 (с,6 Н), 2,25 (с, 3 Н). Пример 15. Гидрохлорид 4-метил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамида (схема 2, способ 4). 4-Метил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид синтезируют изN-2-амино-5-(4-трет-бутилоксикарбонилпиперазинил)фенилбензолсульфонамида и птолуолсульфонилхлорида (46 мг, 0,239 ммоль) по общему способу 3, получая при этом 70 мг пурпурного твердого вещества. МС (положит.ES-FIA) m/z=найдено: 487,2, вычислено: 487,14. 1 Н-ЯМР 7,73-7,45 (м, 7 Н), 7,26 (д, 2 Н), 6,74 (с, 1 Н), 6,62-6,60 (м, 2 Н), 3,69 (явный т, 2 Н), 3,39 (явный т, 2 Н), 3,29-3,74 (м, 4 Н), 2,38 (с, 3 Н). Пример 16. Гидрохлорид-стиролсульфонилхлорида (48 мг, 0,239 ммоль) по общему способу 3, получая при этом 160 мг пурпурного твердого вещества до удаления защитной ВОС-группы.MC (положит.ES-FIA) m/z=найдено: 499,2, вычислено: 499,14. 1 Н-ЯМР 8,26 (д, 1 Н), 8,04 (д, 1 Н), 7,75-7,38 (м, 8 Н), 7,22 (д, 1 Н, J=15,4 Гц), 7,16 (д, 1 Н), 6,97 (д, 1 Н,J=15,4 Гц), 6,78 (дд, 1 Н), 6,68 (д, 1 Н), 3,68 (явный т, 2 Н), 3,39 (явный т, 2 Н), 3,28-3,21 (м, 4 Н). Пример 17. Гидрохлорид 2,5-диметокси-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамида (схема 2, способ 4). 2,5-Диметокси-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид синтезируют из N-2-амино-5-(4-трет-бутилоксикарбонилпиперазинил)фенилбензолсульфонамида и 2,5 диметоксибензолсульфонилхлорида (57 мг, 0,239 ммоль) по общему способу 3, получая при этом 60 мг пурпурного твердого вещества. МС (положит.ES-FIA) m/z=найдено: 533,1, вычислено: 533,14. 1H-ЯМР 7,68-7,48 (м, 5 Н), 7,16-7,05 (м, 4 Н), 6,69 (дд, 1 Н), 6,42 (д, 1H), 4,03 (С, 3 Н), 3,69 (с, 3 Н),3,26-3,10 (м, 8 Н). Пример 18. Гидрохлорид 2-метил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамида (схема 2, способ 4). 2-Метил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид синтезируют из N-2-амино-5-(4-трет-бутилоксикарбонилпиперазинил)фенилбензолсульфонамида и о-толуолсульфонилхлорида (46 мг, 0,239 ммоль) по общему способу 3, получая при этом 160 мг пурпурного твердого вещества до удаления защитной ВОС-группы. МС (положит.ES-FIA) m/z=найдено: 487,1, вычислено: 487,14. 1 Н-ЯМР 7,74-7,16 (м, 8 Н), 6,78-6,52 (м, 4 Н), 3,27-3,16 (м, 9 Н), 2,58 (с, 3 Н). Пример 19. Гидрохлорид 2,4-дифтор-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамида (схема 2, способ 4). 2,4-Дифтор-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид синтезируют из N-2-амино-5-(4-трет-бутилоксикарбонилпиперазинил)фенилбензолсульфонамида и 2,4 дифторбензолсульфонилхлорида (94 мг, 0,455 ммоль) по общему способу 3, получая при этом 160 мг пурпурного твердого вещества до удаления защитной ВОС-группы. МС (положит.ES-FIA) m/z=найдено: 509,1, вычислено: 509,11. 1(м, 8 Н). Пример 20. Гидрохлорид 4-бутокси-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамида (схема 2, способ 4). 4-Бутокси-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид синтезируют из N-2-амино-5-(4-трет-бутилоксикарбонилпиперазинил)фенилбензолсульфонамида и 4-нбутоксибензолсульфонилхлорида (59 мг, 0,239 ммоль) по общему способу 3, получая при этом 70 мг пурпурного твердого вещества. МС (положит.ES-FIA) m/z=найдено: 545,2, вычислено: 545,18. 1H-ЯМР 7,73-7,45 (м, 7 Н), 6,95-6,91 (м, 2 Н), 6,72-6,70 (м, 1 Н), 4,00 (т, 2 Н), 3,29-3,24 (м, 8 Н), 1,791,70 (м, 2 Н), 1,55-1,43 (м, 2 Н), 0,97 (т, 3 Н). Пример 21. Гидрохлорид 3,5-диметил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]-4 изоксазолсульфонамида (схема 2, способ 4). 3,5-Диметил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]-4-изоксазолсульфонамид синтезируют из N-2-амино-5-(4-трет-бутоксикарбонилпиперазинил)фенилбензолсульфонамида и 3,5 диметилизоксазолсульфонилхлорида (47 мг, 0,239 ммоль) по общему способу 3, получая при этом 70 мг пурпурного твердого вещества.MC (положит.ES-FIA) m/z=найдено: 492,1, вычислено: 492,13. 1 Н-ЯМР 7,72-7,47 (м, 5 Н), 6,98 (д, 1 Н), 6,80 (дд, 1 Н), 6,50 (д, 1 Н), 3,28-3,22 (м, 8 Н), 2,22 (с, 3 Н),2,11 (с, 3 Н). Пример 22. 5-Фтор-2-метил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид (схема 2, способ 4). 5-Фтор-2-метил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид синтезируют из N-2-амино-5-(4-трет-бутоксикарбонилпиперазинил)фенилбензолсульфонамида и 5-фтор 2-метилбензолсульфонилхлорида (50 мг, 0,239 ммоль) по общему способу 3, получая при этом 60 мг пурпурного твердого вещества. МС (положит.ES-FIA) m/z=найдено: 505,2, вычислено: 505,13. 1 Н-ЯМР 7,73-7,17 (м, 8 Н), 6,83 (д, 1 Н), 6,68 (дд, 1 Н), 6,50 (дд, 1 Н), 3,27-3,17 (м, SH), 2,55 (с, 3 Н). Пример 23. Гидрохлорид 4-(метилсульфонил)-N-[2-[(фенилсульфонил)амино]-4-(1 пиперазинил)фенил]бензолсульфонамида (схема 2, способ 4). 4-(Метилсульфонил)-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид- 24009647 синтезируют из N-2-амино-5-(4-трет-бутоксикарбонилпиперазинил)фенилбензолсульфонамида и 4 метилсульфонилбензолсульфонилхлорида (61 мг, 0,455 ммоль) по общему способу 3, получая при этом 70 мг пурпурного твердого вещества. МС (положит.ES-FIA) m/z=найдено: 551,2, вычислено: 551,10. Пример 24. Гидрохлорид 2-(метилсульфонил)-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамида (схема 2, способ 4). 2-(Метилсульфонил)-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид синтезируют из N-2-амино-5-(4-трет-бутилоксикарбонилпиперазинил)фенилбензолсульфонамида и 2 метилсульфонилбензолсульфонилхлорида (61 мг, 0,239 ммоль) по общему способу 3, получая при этом 70 мг пурпурного твердого вещества. МС (положит.ES-FIA) m/z=найдено: 551,2, вычислено: 551,10. 1 Н-ЯМР 8,36-7,46 (м, 9 Н), 6,95 (д, 1 Н), 6,68 (дд, 1 Н), 6,46 (д, 1 Н), 3,47 (с, 3 Н), 3,28-3,17 (м, 8 Н). Пример 25. Гидрохлорид 2-метокси-4-метил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамида (схема 2, способ 4). 2-Метокси-4-метил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид синтезируют из N-2-амино-5-(4-трет-бутилоксикарбонилпиперазинил)фенилбензолсульфонамида и 2 метокси-4-метилбензолсульфонилхлорида (53 мг, 0,239 ммоль) по общему способу 3, получая при этом 80 мг пурпурного твердого вещества. МС (положит.ES-FIA) m/z=найдено: 517,2, вычислено: 517,15. 1 Н ЯМР 7,67-7,37 (м, 6 Н), 7,10-7,04 (м, 2 Н), 6,97-6,74 (м, 2 Н), 6,30 (д, 1 Н), 4,06 (с, 3 Н), 3,26-3,09(м, 8 Н), 2,37 (с, 3 Н). Пример 26. Гидрохлорид 4-метокси-2-метил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамида (схема 2, способ 4). 4-Метокси-2-метил-N-[2-[(фенилсульфонил)амино]-4-(1-пиперазинил)фенил]бензолсульфонамид синтезируют из N-2-амино-5-(4-трет-бутилоксикарбонилпиперазинил)фенилбензолсульфонамида и 2 метил-4-трифторметоксибензолсульфонилхлорида (53 мг, 0,455 ммоль) по общему способу 3, получая при этом 70 мг пурпурного твердого вещества до удаления защитной ВОС-группы. МС (положит.ES-FIA) m/z=найдено: 571,2, вычислено: 571,12. 1 Н ЯМР 7,73-7,09 (м, 8 Н), 6,86 (д, 1 Н), 6,69 (дд, 1 Н), 6,48(д, 1 Н), 3,29-3,17 (м, 8 Н), 2,62 (с, 3 Н). Пример 27. Гидрохлорид N-4-(гомопиперазинил)-2-[(фенилсульфонил)амино]фенилбензолсульфонамида (схема 1, способ 2). Бензолсульфонилхлорид (0,088 г, 0,50 ммоль) добавляют к раствору 2-амино-5-(4-третбутилоксикарбонилгомопиперазин-1-ил)анилина (0,153 г, 0,50 ммоль) и пиридина (514 мл, 6,39 ммоль) в ДХМ. Смесь выдерживают при комнатной температуре в течение 1 ч, промывают NaHCO3 (10%), сушат(MgSO4) и удаляют растворитель. Реакционную смесь очищают хроматографией на колонке(0,150 г, 86%). Защитную ВОС-группу удаляют, растворяя смесь в MeOH и добавляя HCl/эфир. Смесь выдерживают при комнатной температуре в течение 0,5 ч. Затем реакционную смесь очищают препаративной ВЭЖХ, получая при этом гидрохлорид N-4-(гомопиперазинил)-2-[(фенилсульфонил)амино]фенилбензолсульфонамида (элементный анализ (C23H27ClN4O4S2) С, Н, N, S; М+ 487,4; вычислено 486,14) и гидрохлорид N-4-(гомопиперазинил)-2-[(фенилсульфонил)амино]фенилбензолсульфонамида(элементный анализ (C17H23ClN4O2S) С, Н, N, S; М+ 347,5; вычислено 346,15). Пример 28. Гидрохлорид N-(4-(1,4-диазепан-1-ил)-2-[(3-фторфенил)сульфонил]аминофенил)-3 фторбензолсульфонамида (схема 1, способ 2). Указанное в заголовке соединение получают из 2-амино-5-(4-трет-бутилоксикарбонил-1 гомопиперазинил)анилина и 3-фторбензолсульфонилхлорида. Продукт очищают хроматографией на колонке (CH2Cl2/MeOH/гептан, 4:1:15), получая при этом смесь N-2-амино-4-[4-трет-бутилоксикарбонилгомопиперазин-1-ил]фенил-3-фторбензолсульфонамида и N-4-[4-трет-бутилоксикарбонилгомопиперазинил]-2-[(3-фторфенилсульфонил)амино]фенил-3-фторбензолсульфонамида (0,180 г, 73%). Защитную ВОС-группу удаляют, растворяя смесь в небольшом количестве MeOH и добавляя HCl/ эфир. Смесь выдерживают при комнатной температуре в течение 0,5 ч. Продукт очищают препаративной ВЭЖХ, получая при этом гидрохлорид N-(4-(1,4-диазепан-1-ил)-2-[(3-фторфенил)сульфонил]аминофенил)-3 фторбензолсульфонамида. Элементный анализ (C23H27ClN4O4S2) С, Н, N, S; М+ 524,4; вычислено 522,12. Пример 29. Гидрохлорид N-4-(1,4-диазепан-1-ил)-2-[этил(фенилсульфонил)амино]фенилбензолсульфонамида (схема 1, способ 2). Раствор бензолсульфонилхлорида (0,579 мл, 4,53 ммоль) в ДХМ (2,0 мл) добавляют к трет-бутил 4[4-амино-3-(этиламино)фенил]-1,4-диазепан-1-карбоксилату (0,605 г, 1,81 ммоль) и пиридину (1,02 мл,12,67 ммоль) в ДХМ (8,0 мл). Смесь перемешивают при комнатной температуре в течение 16 ч и концен- 25009647 трируют. Неочищенный промежуточный продукт очищают хроматографией на колонке с силикагелем,используя CHCl3/10% MeOH+0,4% NH3. После удаления защитной группы при помощи HCl-эфир/EtOAc получают 0,365 г неочищенного продукта в виде хлористо-водородной соли. Продукт очищают препаративной ВЭЖХ с обращенной фазой, получая при этом 94 мг продукта в виде соли уксусной кислоты,которую превращают в хлористо-водородную соль и перекристаллизовывают из смеси MeOH/эфир; выход 64 мг. 1H ЯМР (ДМСО-d6)9,05 (шс, 2 Н), 8,66 (с, 1 Н), 7,89-7,85 (м, 2 Н), 7,75-7,55 (м, 8 Н), 7,07 (явный д,J=9, 1 Гц, 1 Н), 6,71-6,66 (м, 1 Н), 5,70 (явный д, J=3,2 Гц, 1 Н), 3,50-3,32 (м, частичное наложение с сигналом HDO, 4 Н), 3,18-3,14 (м, 2 Н), 3,05-2,90 (м, 2 Н), 1,90-1,81 (м, 2 Н), 0,67 (тр, J=7,2 Гц, 3 Н); МС (положит.ES-FIA) m/z: 515 (М+Н). Способ 4 (схема 2). Разные сульфонилхлориды добавляют к раствору N-2-амино-5-(4-трет-бутилоксикарбонил-1,4 дазепан-1-ил)фенилбензолсульфонамида и пиридина (135 мкл, 1,7 ммоль) в ДХМ (7 мл). Смесь выдерживают при комнатной температуре в течение 1 ч и удаляют растворитель. Продукт очищают хроматографией на колонке (CH2Cl2/MeOH/гептан, 4:1:15) и удаляют защитную ВОС-группу, растворяя остаток в небольшом количестве MeOH и добавляя HCl/эфир. Смесь выдерживают при комнатной температуре в течение 0,5 ч и удаляют растворитель. В результате перекристаллизации (MeOH/эфир) получают конечный продукт. Пример 30. N-5-(1,4-Диазепан-1-ил)-2-[(метилсульфонил)амино]фенилбензолсульфонамид (схема 2, способ 4).N-2-амино-5-(4-трет-бутилоксикарбонил-1,4-диазепан-1-ил)фенилбензолсульфонамида (0,075 г, 0,16 ммоль) и метансульфонилхлорида (0,017 мл, 0,22 ммоль), получая при этом 41,6 мг светло-пурпурного твердого вещества. Элементный анализ (C24H27ClN4O3S1,3 Н 2 О) С, Н, N, S. М+ 425,4; вычислено 425,12. Пример 31. Гидрохлорид(0,085 г, 0,19 ммоль) и этансульфонилхлорида (0,032 мкл, 0,25 ммоль), получая при этом 29,1 мг светлопурпурного твердого вещества. Элементный анализ (C24H27ClN4O3S0,75 Н 2 О) С, Н, N, S. М+ 439,4; вычислено 439,14. Пример 32. Гидрохлорид N-4-(1,4-диазепан-1-ил)-2-[(фенилсульфонил)амино]фенил-[1,1'бифенил]-4-сульфонамида (схема 2, способ 4). ГидрохлоридN-2-амино-5-(4-трет-бутилоксикарбонил-1,4-диазепан-1 ил)фенилбензолсульфонамида (0,081 г, 0,18 ммоль) и 1,1'-бифенил-4-сульфонилхлорида (0,059 г, 0,24 ммоль), получая при этом 42,9 мг светло-пурпурного твердого вещества. Элементный анализ (C24H27ClN4O3S) С, Н, N, S. М+ 563,5; вычислено 563,17. Пример 33. Гидрохлорид(0,072 г, 0,21 ммоль), получая при этом 38,0 мг светло-пурпурного твердого вещества. М+1 537,2, вычислено 537,15. 1 Н ЯМР 8,21 (д, 1 Н), 7,80 (д, 1 Н), 7,68-7,46 (м, 6 Н), 6,92 (д, 1 Н), 6,49 (дд, 1 Н), 6,12 (д, 1 Н), 3,57(0,084 г, 0,19 ммоль) и 1,2-нафтилсульфонилхлорида (0,055 мл, 0,24 ммоль), получая при этом 67,8 мг светло-пурпурного твердого вещества. Элементный анализ (C24H27C1N4O3S) С, Н, N, S. М+ 529,2; вычислено 529,12. Пример 35. ГидрохлоридN-4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенилбензолсульфонамида (схема 2, способ 4). Бензолсульфонилхлорид (0,233 г, 1,8 ммоль) добавляют к раствору N-5-[(4-третбутилоксикарбонил-1,4-диазепан-1-ил)-2-амино]фенилметансульфонамида (0,540 г, 1,4 ммоль) и пиридина (0,995 мл, 12,6 ммоль) в ДХМ (40 мл). Смесь выдерживают при комнатной температуре в течение 2 ч и удаляют растворитель. Продукт очищают хроматографией на колонке (ДХМ/MeOH/гептан, 4:1:5),- 26009647 получая при этом 580 мг (79%) светло-пурпурного твердого вещества. Защитную ВОС-группу удаляют,растворяя полученное соединение в небольшом количестве MeOH и добавляя HCl/эфир. Растворитель удаляют и продукт перекристаллизовывают из смеси MeOH/эфир. М+1 425,2, вычислено 425,12. Пример 36. Гидрохлорид N-4-(1,4-диазепан-1-ил)-2-[метил(метилсульфонил)амино]фенилбензолсульфонамида (схема 2, способ 4).MeI (45 мкл, 0,72 ммоль) добавляют к смеси N-4-(4-трет-бутилоксикарбонил-1,4-диазепан-1-ил)-2[(метилсульфонил)амино]фенилбензолсульфонамида (0,189 г, 0,36 ммоль) и K2CO3 (0,124, 0,90 ммоль) в ацетоне (25 мл). Смесь перемешивают при комнатной температуре в течение 2 ч, фильтруют и удаляют растворитель. Продукт очищают хроматографией на колонке (ДХМ/MeOH/гептан, 4:1:15), получая при этом 110 мг N-4-(4-трет-бутилоксикарбонил-1,4-диазепан-1-ил)-2-[метил(метилсульфонил)амино]фенилбензолсульфонамида и 20 мгN-4-(4-трет-бутилоксикарбонил-1,4-диазепан-1-ил)-2[(метилсульфонил)амино]фенил-N-метилбензолсульфонамида. Защитную ВОС-группу удаляют, растворяя полученные соединения в небольшом количестве MeOH и добавляя HCl/эфир. Растворитель удаляют и продукты перекристаллизовывают из смеси MeOH/эфир. Гидрохлорид N-4-(1,4-диазепан-1-ил)2-[метил(метилсульфонил)амино]фенилбензолсульфонамида: М+1 439,2, вычислено 439,14. Пример 37. ГидрохлоридMeI (45 мкл, 0,72 ммоль) добавляют к смеси N-4-(4-трет-бутилоксикарбонил-1,4-диазепан-1-ил)-2[(метилсульфонил)амино]фенилбензолсульфонамида (0,189 г, 0,36 ммоль) и K2CO3 (0,124, 0,90 ммоль) в ацетоне (25 мл). Смесь перемешивают при комнатной температуре в течение 2 ч, фильтруют и удаляют растворитель. Продукт очищают хроматографией на колонке (ДХМ/MeOH/гептан, 4:1:15), получая при этом 110 мг N-4-(4-трет-бутилоксикарбонил-1,4-диазепан-1-ил)-2-[метил(метилсульфонил)амино]фенилбензолсульфонамида и 20 мгN-4-(4-трет-бутилоксикарбонил-1,4-диазепан-1-ил)-2[(метилсульфонил)амино]фенил-N-метилбензолсульфонамида. Защитную ВОС-группу удаляют, растворяя полученные соединения в небольшом количестве MeOH и добавляя HCl/эфир. Растворитель удаляют и продукты перекристаллизовывают из смеси MeOH/эфир. Гидрохлорид N-4-(1,4-диазепан-1-ил)2-[(метилсульфонил)амино]фенил-N-метилбензолсульфонамида: М+1 439,2, вычислено 439,14. Пример 38. Гидрохлорид N-4-(1,4-диазепан-1-ил)-2-[метил(фенилсульфонил)амино]фенилбензолсульфонамида (схема 2, способ 4).MeI (45 мкл, 0,72 ммоль) добавляют к смеси N-4-(4-трет-бутилоксикарбонил-1,4-диазепан-1-ил)-2[(фенилсульфонил)амино]фенилбензолсульфонамида (0,189 г, 0,36 ммоль) и K2CO3 (0,124, 0,90 ммоль) в ацетоне (25 мл). Смесь перемешивают при комнатной температуре в течение 2 ч, фильтруют и удаляют растворитель. Продукт очищают хроматографией на колонке (ДХМ/MeOH/гептан, 4:1:15), получая при этомN-4-(4-трет-бутилоксикарбонил-1,4-диазепан-1-ил)-2-[метил(фенилсульфонил)амино]фенилбензолсульфонамид в виде бесцветного масла. Защитную ВОС-группу удаляют, растворяя полученное соединение в небольшом количестве MeOH и добавляя HCl/эфир. Растворитель удаляют и остаток перекристаллизовывают из смеси MeOH/эфир, получая при этом 62,7 мг продукта. М+1 501,3, вычислено 501,16. Схема 3. К раствору N-2-амино-5-(4-трет-бутилоксикарбонил-1,4-диазепан-1-ил)фенилметансульфонамида(134 мг, 0,35 ммоль) и пиридина (250 мкл, 3,14 ммоль) в ДХМ (7 мл) добавляют сульфонилхлорид (0,455 ммоль). Смесь выдерживают в течение 2 ч при комнатной температуре и удаляют растворитель. Продукт очищают хроматографией на колонке (CH2Cl2/MeOH/гептан, 4:1:15) и удаляют защитную ВОС-группу,растворяя остаток в небольшом количестве MeOH и добавляя HCl/эфир. Смесь выдерживают при комнатной температуре в течение 0,5 ч и удаляют растворитель. В результате перекристаллизации (MeOH/эфир) получают конечный продукт. Пример 39. ГидрохлоридN-4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил-1 нафталинсульфонамида (схема 3). Указанное в заголовке соединение синтезируют из N-2-амино-5-(4-трет-бутилоксикарбонил-1,4 диазепан-1-ил)фенилметансульфонамида и 1-нафталинсульфонилхлорида (103 мг, 0,455 ммоль), получая при этом 150 мг пурпурного твердого вещества до удаления защитной ВОС-группы. М+1 475,1, вычислено 474,14. Пример 40. ГидрохлоридN-4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил-2 нафталинсульфонамида (схема 3). Указанное в заголовке соединение синтезируют из N-2-амино-5-(4-трет-бутилоксикарбонил-1,4 диазепан-1-ил)фенилметансульфонамида и 2-нафталинсульфонилхлорида (103 мг, 0,455 ммоль), получая при этом 120 мг пурпурного твердого вещества до удаления защитной ВОС-группы. М+1 475,1, вычислено 474,14. Пример 41. ГидрохлоридN-4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил-4 фторбензолсульфонамида (схема 3). Указанное в заголовке соединение синтезируют из N-2-амино-5-(4-трет-бутилоксикарбонил-1,4- 27009647 диазепан-1-ил)фенилметансульфонамида и 4-фторбензолсульфонилхлорида (89 мг, 0,455 ммоль), получая при этом 170 мг пурпурного твердого вещества до удаления защитной ВОС-группы. М+1 443,1, вычислено 443,11. Пример 42. ГидрохлоридN-4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил-4 нитробензолсульфонамида (схема 3). Указанное в заголовке соединение синтезируют из N-2-амино-5-(4-трет-бутилоксикарбонил-1,4 диазепан-1-ил)фенилметансульфонамида и 4-нитробензолсульфонилхлорида (101 мг, 0,455 ммоль) по общему способу 3, получая при этом 118 мг пурпурного твердого вещества до удаления защитной ВОСгруппы. М+1 470,1, вычислено 470,11. Пример 43. ГидрохлоридN-4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил-3(трифторметил)бензолсульфонамида (схема 3). Указанное в заголовке соединение синтезируют из N-2-амино-5-(4-трет-бутилоксикарбонил-1,4 диазепан-1-ил)фенилметансульфонамида и 3-трифторметилбензолсульфонилхлорида (111 мг, 0,455 ммоль), получая при этом 145 мг пурпурного твердого вещества до удаления защитной ВОС-группы. М+1 493,1, вычислено 493,11. Пример 44. ГидрохлоридN-4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил-2 метилбензолсульфонамида (схема 3). Указанное в заголовке соединение синтезируют из N-2-амино-5-(4-трет-бутилоксикарбонил-1,4 диазепан-1-ил)фенилметансульфонамида и о-толуолсульфонилхлорида (87 мг, 0,455 ммоль), получая при этом 175 мг пурпурного твердого вещества до удаления защитной ВОС-группы. М+1 439,2, вычислено 438,14. Пример 45. ГидрохлоридN-4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил-4(трифторметокси)бензолсульфонамида (схема 3). Указанное в заголовке соединение синтезируют из N-2-амино-5-(4-трет-бутилоксикарбонил-1,4 диазепан-1-ил)фенилметансульфонамида и 4-трифторметоксибензолсульфонилхлорида (119 мг, 0,455 ммоль), получая при этом 140 мг пурпурного твердого вещества. М+1 509,1, вычислено 509,11. Пример 46. Гидрохлорид N-4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил-3,5-диметил-4-изоксазолсульфонамида (схема 3). Указанное в заголовке соединение синтезируют из N-2-амино-5-(4-трет-бутилоксикарбонил-1,4 диазепан-1-ил)фенилметансульфонамида и 3,5-диметилизоксазол-4-сульфонилхлорида (89 мг, 0,455 ммоль), получая при этом 120 мг пурпурного твердого вещества. М+1 444,2, вычислено 444,13. Пример 47. ГидрохлоридN-4-(1,4-диазепан-1-ил)-2-[(метилсульфонил)амино]фенил-3 метоксибензолсульфонамида (схема 3). Указанное в заголовке соединение синтезируют из N-2-амино-5-(4-трет-бутилоксикарбонил-1,4 диазепан-1-ил)фенилметансульфонамида и 3-метоксибензолсульфонилхлорида (94 мг, 0,455 ммоль),получая при этом 160 мг пурпурного твердого вещества. М+1 455,2, вычислено 455,13. Промежуточное соединение 11. трет-Бутил 4-4-[(4-метилфенил)сульфонил]амино-3[(метилсульфонил)амино]фенил-1,4-диазепан-1-карбоксилат (схема 2, способ 4). трет-Бутил 4-4-нитро-3-[(метилсульфонил)амино]фенил-1,4-диазепан-1-карбоксилат (1 г, 2,4 ммоль) растворяют в ТГФ (20 мл) и метаноле (2 мл). Добавляют Ni-Ренея (0,2 г) и гидразингидрат (0,2 мл). Происходит выделение азота, и смесь перемешивают в течение 1 ч. Когда результаты ТСХ(СН 2 Сl2:MeOH, 9:1) свидетельствуют об окончании реакции, добавляют еще 0,1 мл гидразингидрата. Через 1 ч реакционную смесь поглощают слоем силикагеля и элюируют CH2Cl2:MeOH:NH4OH (9:1:0,01,150 мл). Растворитель выпаривают, добавляют толуол (100 мл) и смесь упаривают, чтобы удалить воду и гидразин. Неочищенный амин (0,9 г) растворяют в ацетонитриле (20 мл). В атмосфере азота к полученному раствору добавляют диметиламинопиридин (0,32 г) и толуолсульфонилхлорид (0,51 г) и смесь перемешивают в течение 3 ч. Раствор выливают в воду (100 мл) и экстрагируют этилацетатом (30 мл). Органический экстракт промывают водой, сушат над MgSO4 и упаривают, получая при этом 0,83 г неочищенного продукта, который очищают флэш-хроматографией (EtOAc:бензин, 1:1). Выход 0,53 г (41%). 1 Н ЯМР (400 МГц, CDCl3)1,38, 1,40 (2 с, 9 Н), 1,91 (м, J=6,11 Гц, 2 Н), 2,44 (с, 3 Н), 3,03, 3,05 (2 с,3 Н), 3,16-3,33 (м, 2 Н), 3,46-3,57 (м, 6 Н), 6,02 (с, 1 Н), 6,21 (ab, J=9,03 Гц, 1 Н), 6,30 (ab, J=9,03 Гц, 1 Н), 6,97(1 н. раствор, 25 мл) и смесь перемешивают в течение 2 ч. Затем добавляют эфир (200 мл) и смесь перемешивают в течение 3 ч до полного осаждения. Продукт отфильтровывают, промывают эфиром и сушат. Выход 0,43 г (98%). 1 Н ЯМР (400 МГц, ДМСО-d6)2,03 (м, 2 Н), 2,36 (с, 3 Н), 2,9 (с, 3 Н), 3,02-3,09 (шм, 2 Н), 3,11-3,19N-Этилметансульфонамид (Mijs et al., J. Chem. Soc. Chem. Com. 1972 p. 412) (5 г, 40,6 ммоль) добавляют к суспензии гидрида натрия (1,9 г, 55% суспензия в минеральном масле) в безводном ДМФ (100 мл) в атмосфере азота. Смесь нагревают до 55 С в течение 1 ч и по каплям добавляют 2,4 дифторнитробензол (4,4 мл). Реакционную смесь перемешивают при 60 С в течение ночи, выливают в воду (500 мл) и экстрагируют продукт в CH2Cl2 (5100 мл). Органические экстракты промывают водой,сушат над MgSO4 и упаривают с образованием маслянистого продукта. Оставшийся ДМФ удаляют, растирая продукт с бензином. Неочищенный продукт очищают флэш-хроматографией (этилацетат:бензин,1:1), получая при этом требуемый продукт, который перекристаллизовывают из этанола. Выход 3,5 гN-Этил-N-(5-фтор-2-нитрофенил)метансульфонамид (3,2 г, 12,2 ммоль), трет-бутил 1 гомопиперазинкарбоксилат (2,5 г) и карбонат калия (2 г) нагревают с ДМСО при 50 С в течение 5 ч. Раствор оставляют охлаждаться и выливают в 500 мл воды. Твердый продукт отфильтровывают, промывают водой и сушат. Продукт очищают флэш-хроматографией (этилацетат:бензин, 1:1). Выход 2,6 г (48%). 1(0,5 мл). Происходит выделение азота, и смесь перемешивают в течение 1 ч. Реакционную смесь поглощают слоем силикагеля и элюируют CH2Cl2:MeOH:NH4OH (9:1:0,01, 200 мл). Растворитель выпаривают,добавляют толуол (200 мл) и смесь упаривают, чтобы удалить воду и гидразин. Неочищенный амин (2,15 г) растворяют в ацетонитриле (50 мл) с диметиламинопиридином (0,8 г). Полученный раствор делят на три порции. К каждой порции добавляют сульфонилхлорид (2,2 ммоль) и смеси перемешивают в течение ночи при 40 С. Реакционные смеси добавляют к воде (150 мл), продукт экстрагируют в этилацетат, промывают водой, сушат над MgSO4 и упаривают. Все неочищенные продукты, защищенные ВОС-группой,очищают флэш-хроматографией (этилацетат:бензин, 1:1). Затем у продуктов удаляют защитную группу,для чего полученные соединения растворяют в метаноле (10 мл), добавляют раствор HCl в этилацетате (1 н. раствор, 50 мл) и перемешивают в течение 2 ч. Продукты осаждают эфиром (500 мл), отфильтровывают и сушат в вакууме. Получают следующие продукты. Пример 49. Гидрохлорид N-4-(1,4-диазепан-1-ил)-2-[этил(метилсульфонил)амино]фенил-4 метилбензолсульфонамида (схема 2, способ 4). Указанное в заголовке соединение получают из толуолсульфонилхлорида. Выход 0,36 г. 1MC (ESI + ) для C21H30N4O4S2 m/z 466,1722 М+ (Вычислено 466,1708). Пример 50. Гидрохлорид N-4-(1,4-диазепан-1-ил)-2-[этил(метилсульфонил)амино]фенил-3,4 диметоксибензолсульфонамида (схема 2, способ 4). Указанное в заголовке соединение получают из 3,4-диметоксибензолсульфонилхлорида. Выход 0,43 г. 1 Н ЯМР (400 МГц, ДМСО-d6)0,81 (т, J=7,08 Гц, 3 Н), 2,05 (м, 2 Н), 3,08 (с, 3 Н), 3,03-3,11 (ш, 2 Н),3,11-3,19 (ш, 2 Н), 3,45 (т, J=6,10 Гц, 2 Н), 3,52 (кв, J=7,08 Гц, 2 Н), 3,68 (шт, J=5,13 Гц, 2 Н), 3,77 (с, 3 Н),3,81 (с, 3 Н), 6,66-6,74 (м, 2 Н), 6,97 (д, J=8,79 Гц, 1 Н), 7,09 (д, J=8,55 Гц, 1 Н), 7,33-7,4 (м, 2 Н), 8,49 (с, 1 Н),9,3 (шс, 2 Н);- 29009647 Указанное в заголовке соединение получают из 8-хинолинсульфонилхлорида. Выход 0,46 г. Н ЯМР (400 МГц, ДМСО-d6)0,17 (т, J=7,08 Гц, 3 Н), 2,06 (м, 2 Н), 2,93 (с, 3 Н), 3,0-3,2 (м, 6 Н), 3,47MC (ESI + ) для C23H29N5O4S2 m/z 503,1667 М+ (Вычислено 503,1661). Промежуточное соединение 14. N-(5-фтор-2-нитрофенил)метансульфонамид (схема 2, способ 4). 2,4-Динитробензол (5,5 мл, 50 ммоль), метансульфонамид (4,75 г, 50 ммоль) и карбонат калия (10 г) перемешивают в ДМСО (100 мл) при 80 С в течение ночи. К смеси добавляют воду (300 мл) и хлористоводородную кислоту (1 н. раствор, 300 мл). Твердый продукт отфильтровывают, промывают водой и сушат. Выход 9,57 г (82%). 1MC(ESI + ) для C7H7FN2O4S m/z 234 М+. Промежуточное соединение 15. N-(5-Фтор-2-нитрофенил)-N-метилметансульфонамид (схема 2,способ 4). Соединение N-(5-фтор-2-нитрофенил)метансульфонамида (5 г, 21 ммоль), метилйодид (3 мл) и карбонат калия (10 г) перемешивают в ДМСО (100 мл) при 80 С в течение ночи. Реакция не закончилась,поэтому добавляют еще 1 мл метилйодида. Смесь выдерживают в течение 24 ч при 80 С и добавляют воду (1000 мл). Раствор декантируют с небольшого количества вязкого остатка. Продукт кристаллизуют из водного раствора (48 ч), отфильтровывают, промывают водой и сушат. Выход 3,3 г (63%). 1 Н ЯМР (400 МГц, CDCl3)3,04 (с, 3 Н), 3,30 (с, 3H), 7,20 (м, 1 Н), 7,31 (дд, J=8,54, 2,68 Гц, 1 Н), 8,0N-(5-Фтор-2-нитрофенил)-N-метилметансульфонамид (3,1 г, 12,5 ммоль), трет-бутил 1 гомопиперазинкарбоксилат (2,5 г) и карбонат калия (2 г) нагревают в ДМСО (50 мл) при 80 С в течение ночи. Полученный раствор оставляют охлаждаться и выливают в 500 мл воды. Твердый продукт отфильтровывают, промывают водой и сушат. Выход 4,6 г (86%). 1MC (ESI+) для C18H28N4O6S m/z 428,1709 (М+) (вычислено 428,1730). Получение N-4-(1,4-диазепан-1-ил)-2-[метил(метилсульфонил)амино]фенилсульфонамидов. трет-Бутил 4-3-[метил(метилсульфонил)амино]-4-нитрофенил-1,4-диазепан-1-карбоксилат (2,5 г,5,7 ммоль) растворяют в ТГФ (50 мл) и метаноле (5 мл). К смеси добавляют Ni-Ренея (0,5 г) и гидразингидрат (0,5 мл). Происходит выделение азота, и смесь перемешивают в течение 1 ч. Реакционную смесь поглощают слоем силикагеля и элюируют CH2Cl2:MeOH:NH4OH (9:1:0,01, 200 мл). Раствор выпаривают,добавляют толуол (200 мл) и смесь упаривают, чтобы удалить воду и гидразин. Неочищенный амин (2,36 г) растворяют в ацетонитриле (50 мл) с диметиламинопиридином (0,8 г). Полученный раствор делят на шесть порций. К трем порциям добавляют сульфонилхлорид (1,1 ммоль) и смеси перемешивают в течение ночи при 40 С. К реакционным смесям добавляют этилацетат (50 мл), промывают насыщенным раствором соли и водой, сушат над MgSO4 и упаривают. Все неочищенные продукты, защищенные ВОСгруппой, очищают флэш-хроматографией (этилацетат:бензин, 2:1). У продуктов удаляют защитные группы, для чего полученные соединения растворяют в метаноле (10 мл), добавляют раствор HCl в этилацетате (1 н. раствор, 50 мл) и перемешивают в течение 2 ч. Продукты осаждают эфиром (500 мл), отфильтровывают и сушат в вакууме. Получают следующие продукты. Пример 52. Гидрохлорид N-4-(1,4-диазепан-1-ил)-2-[метил(метилсульфонил)амино]фенил-4 метилбензолсульфонамида (схема 2, способ 4). Указанное в заголовке соединение получают из толуолсульфонилхлорида. Выход 0,18 г. 1MC (ESI+) для C20H28N4O4S2 m/z 452,1545 M+ (Вычислено 452,1552). Пример 53. Гидрохлорид N-4-(1,4-диазепан-1-ил)-2-[метил(метилсульфонил)амино]фенилнафталин-2-сульфонамида (схема 2, способ 4). Указанное в заголовке соединение получают из 2-нафталинсульфонилхлорида. Выход 0,09 г. 1
МПК / Метки
МПК: C07D 243/08, C07D 295/04, C07D 487/04, C07D 211/46, C07D 215/36, C07D 453/02, A61K 31/551, C07D 241/04, C07D 233/56, C07D 487/08, A61K 31/495
Метки: соединения, арилсульфонамидные, типа, лечения, диабета, ожирения, применение
Код ссылки
<a href="https://eas.patents.su/30-9647-arilsulfonamidnye-soedineniya-i-ih-primenenie-dlya-lecheniya-ozhireniya-diabeta-tipa-ii.html" rel="bookmark" title="База патентов Евразийского Союза">Арилсульфонамидные соединения и их применение для лечения ожирения, диабета типа ii</a>
Предыдущий патент: Замещённые производные пиррола и их применение в качестве ингибиторов hmg-cоa
Следующий патент: Соединения пиперазина, способ их получения и фармацевтические композиции, которые их содержат
Случайный патент: Истирающая мельница