Производные фталазинона
Номер патента: 9469
Опубликовано: 28.12.2007
Авторы: Мартин Ниал Моррисон Бар, Ло Винсент М.Джуниор, Смит Граем Камерон Мюррей, Джексон Стефен Филипп, Эшворт Алан, Мэтьюз Иан Тимоти Вильямс, Коккрофт Ксиао-Лин Фан, Менеар Кейт Алан, Керриган Франк
Формула / Реферат
1. Соединение формулы (I)
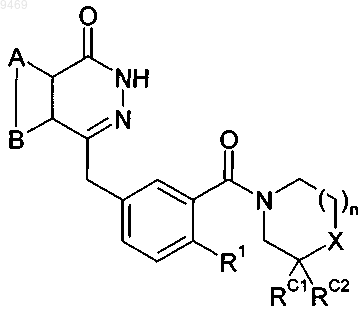
а также его изомеры, соли, сольваты, химически защищенные формы и пролекарства, где
А и В совместно представляют собой конденсированное бензольное ядро,
X может представлять собой NRX или CRXRY,
если X=NRX, то n представляет собой 1 или 2, а если X=CRXRY, то n представляет собой 1,
RX выбирают из группы, включающей H, C1-20алкил, C5-20арил, С3-7гетероциклил, -C(=O)NR'R",
-C(=S)NR'R", -C(=O)OR', -C(=O)R', -S(=O)2R',
где R' и R", каждый выбирают из H, C1-20алкила, C5-20арила, С3-7гетероциклила или, если R' и R" присоединены к атому азота, R' и R" совместно с атомом азота, к которому они присоединены, образуют гетероциклическую структуру;
RY выбирают из группы, включающей H, гидроксил, амин,
или RX и RY могут совместно образовывать спиро-С3-7циклоалкильную или гетероциклильную группу,
RC1 и RC2 представляют собой водород или, если X представляет собой CRXRY, RC1, RC2, RX и RY совместно с атомами углерода, к которым они присоединены, могут образовывать конденсированное бензольное ядро, которое может содержать замещение фрагментом формулы -O-(СН2)p-O -, где p равно 1, 2 или 3, и
R1 выбирают из группы, включающей H и галоген.
2. Соединение по п.1, отличающееся тем, что R1 выбирают из группы, включающей H, Cl и F.
3. Соединение по пп.1-2, отличающееся тем, что RC1 и RC2 представляют собой водород.
4. Соединение по пп.1-3, отличающееся тем, что n представляет собой 2, X представляет собой NRX, a RX выбирают из группы, включающей H, возможно замещенный С1-20алкил, возможно замещенный
C5-20арил, возможно замещенные сложные эфирные группы, возможно замещенные ацильные группы, возможно замещенные амидные группы, возможно замещенные тиоамидные группы и возможно замещенные сульфонильные группы.
5. Соединение по пп.1-4, отличающееся тем, что n представляет собой 1, X представляет собой NRX, a RX выбирают из группы, включающей H, возможно замещенный C1-20алкил, возможно замещенный
С5-20арил, возможно замещенный ацил, возможно замещенный сульфонил, возможно замещенный амид и возможно замещенные тиоамидные группы.
6. Соединение по п.5, отличающееся тем, что представляет собой соединение формулы (II)

где R выбран из
а)
![]()
б)
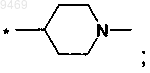
в)
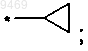
г)
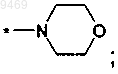
д)
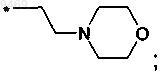
е)
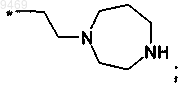
ж)
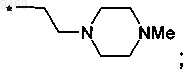
и
з)
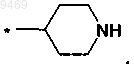
7. Соединение по пп.1-5, отличающееся тем, что n представляет собой 1, X представляет собой CRXRY, RY представляет собой H, a RX выбирают из группы, включающей H, возможно замещенный
C1-20алкил, возможно замещенный C5-20арил, возможно замещенный C3-20гетероциклил, возможно замещенный ацил, возможно замещенный амид и возможно замещенные сложные эфирные группы.
8. Промежуточное соединение формулы (1)
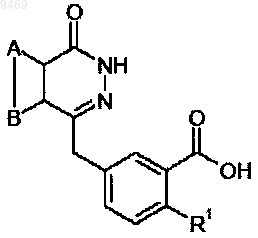
где А и В совместно представляют собой конденсированное бензольное ядро;
R1 выбирают из группы, включающей H и галоген.
9. Фармацевтический состав, содержащий соединение по пп.1-7 и фармацевтически допустимый носитель или разбавитель.
10. Применение соединения по пп.1-7 для получения медикамента для ингибирования активности ПАРП.
11. Применение соединения по пп.1-7 для получения медикамента для лечения сосудистого заболевания, септического шока, ишемического нарушения, нейротоксичности, геморрагического шока, вирусной инфекции или заболеваний, которые смягчаются ингибированием активности ПАРП.
12. Применение соединения по пп.1-8 для получения медикамента, предназначенного для использования в качестве вспомогательного средства в терапии рака или для усиления действия на опухолевые клетки ионизирующего излучения или химиотерапевтических агентов.
13. Применение соединения по пп.1-8 для получения медикамента, предназначенного для использования при лечении ракового заболевания у пациента, при этом указанное раковое заболевание вызывается недостатками пути зависимой от гомологичной рекомбинации репарации двухнитевых разрывов ДНК.
14. Применение по п.13, отличающееся тем, что указанное раковое заболевание включает одну или несколько раковых клеток, имеющих пониженную или полностью подавленную способность восстанавливать двухнитевые разрывы ДНК с помощью гомологичной рекомбинации по сравнению с нормальными клетками.
15. Применение по п.14, отличающееся тем, что указанные раковые клетки имеют дефектный фенотип BRCA1 или BRCA2.
16. Применение по п.15, отличающееся тем, что указанные раковые клетки являются дефектными в BRCA1 или BRCA2.
17. Применение по пп.13-16, отличающееся тем, что указанный пациент является гетерозиготным для мутации гена, кодирующего компонент пути зависимой от гомологичной рекомбинации репарации двухнитевых разрывов ДНК.
18. Применение по п.17, отличающееся тем, что указанный пациент является гетерозиготным для мутации BRCA1 и/или BRCA2.
19. Применение по пп.13-18, отличающееся тем, что указанное раковое заболевание представляет собой рак молочной железы, яичника, поджелудочной железы или простаты.
20. Применение по пп.13-19, отличающееся тем, что указанное лечение включает также применение ионизирующего излучения или химиотерапевтического агента.
Текст
009469 Настоящее изобретение относится к производным фталазинона и их применению в качестве фармацевтических продуктов. В частности, настоящее изобретение относится к применению этих соединений для подавления активности фермента поли(аденозиндифосфат(АДФ)-рибозо)полимеразы, известного также как поли-АДФ-рибозосинтаза и поли-АДФ-рибозилтрансфераза и обычно называемого ПАРП. Фермент млекопитающих ПАРП (многодоменный белок с молекулярной массой 113 кДа) участвует в системе сигнализации нарушения ДНК благодаря его способности распознавать и быстро связываться с разрывами одно- или двухцепочечной ДНК (D'Amours, et al., Biochem. J., 342, 249-268 (1999. Некоторые наблюдения привели к выводу о том, что ПАРП принимает участие во множестве функций, связанных с ДНК, включая генную амплификацию, клеточное деление, дифференциацию, апоптоз,эксцизионную репарацию основания ДНК, а также оказывает влияние на длину теломеров и устойчивость хромосом (d'Adda di Fagagna, et al., Nature Gen., 23 (1), 76-80 (1999. Исследования механизма, с помощью которого ПАРП модулирует репарацию ДНК и другие процессы,показывают его важность для образования цепей поли-АДФ-рибозы в клеточном ядре (Althaus, F.R. andRichter, С., ADP-Ribosylation of Proteins: Enzymology and Biological Significance, Springer-Verlag, Berlin (1987. Связанная с ДНК, активированная ПАРП использует NAD (Novel Antigenic Determinant - клеточная неодетерминанта) для синтеза поли-АДФ-рибозы в различных ядерных целевых белках, включая топоизомеразу, гистоны и непосредственно ПАРП (Rhun, et al., Biochem. Biophys. Res. Commun., 245, 1-10 (1998. Поли-АДФ-рибозиляция связывается также со злокачественной трансформацией. Так, например,активность ПАРП является более высокой в изолированных ядрах трансформированных фибробластовSV40, в то время, как лейкозные клетки и раковые клетки толстой кишки проявляют более высокую ферментную активность, чем эквивалентные нормальные лейкоциты и слизистая оболочка толстой кишки(Miwa, et al., Arch. Biochem. Biophys., 181, 313-321 (1977), Burzio, et al., Proc. Soc. Exp. Biol. Med., 149,933-938 (1975), and Hirai, et al., Cancer Res., 43, 3441-3446 (1983. Некоторые ингибиторы ПАРП с низкой молекулярной массой использовали для определения функциональной роли поли-АДФ-рибозиляции при репарации ДНК. В клетках, обработанных алкилирующими агентами, ингибирование ПАРП приводит к заметному увеличению разрыва цепи ДНК и поражению клеток (Durkacz, et al., Nature, 283, 593-596 (1980), Berger, N.A., Radiation Research, 101, 4-14 (1985. Дальнейшие исследования показали, что такие ингибиторы повышают интенсивность реакции на облучение за счет подавления репарации потенциально летального нарушения (Ben-Hur, et al., BritishJournal of Cancer, 49 (Suppl. VI), 34-42 (1984), Schlicker, et al., Int. J. Radial Biol., 75, 91-100 (1999. Имеются сообщения о том, что ингибиторы ПАРП являются эффективными для гипоксических опухолевых клеток, чувствительных к облучению (US 5032617, US 5215738 и US 5041653). Кроме того, животные, лишенные ПАРП (ПАРП -/-), проявляют геномную нестабильность реакции на алкилирующие агенты и -облучение (Wang, et al., Genes Dev., 9, 509-520 (1995), Menissier de Murcia,et al., Proc. Natl. Acad. Sci. USA, 94, 7303-7307 (1997. Показано также, что ПАРП играет определенную роль в некоторых сосудистых заболеваниях, при септическом шоке, ишемическом нарушении и нейротоксичности (Cantoni, et al., Biochim. Biophys. Acta,1014, 1-7 (1989), Szabo, et al., J. Clin. Invest, 100, 723-735 (1997. Исследования, проведенные с ингибиторами ПАРП, показали, что повреждение кислородного радикала ДНК, которое приводит к разрывам цепей ДНК, распознаваемым ПАРП, является основным составляющим фактором таких болезненных состояний (Cosi, et al., J. Neurosci. Res., 39, 38-46 (1994), Said, et al., Proc. Natl Acad. Sci. U.S.A., 93, 46884692 (1996. Позднее было показано, что ПАРП играет роль в патогенезе геморрагического шока (Liaudet,et al., Proc. Natl. Acad. Sci. U.S.A., 97 (3), 10203-10208 (2000. Показано также, что эффективное ретровирусное инфицирование клеток млекопитающих блокируется подавлением активности ПАРП. Такое подавление рекомбинантного ретровирусного векторного инфицирования имеет место в различных типах клеток (Gaken, et al., J. Virology, 70 (6), 3992-4000(1996. Поэтому были разработаны ингибиторы ПАРП для использования в антивирусной терапии и при лечении раковых заболеваний (WO 91/18591). Кроме того, предполагают, что ингибирование ПАРП задерживает появление признаков старения фибробластов человека (Rattan и Clark, Biochem. Biophys. Res. Comm., 201 (2), 665-672 (1994. Это может быть связано с той ролью, которую играет ПАРП при регулировании функции теломера (d'Adda di Fagagna,et al., Nature Gen., 23 (1), 76-80 (1999. Некоторые из авторов настоящего изобретения ранее описали (WO 02/36576) класс соединений 1(2 Н)фталазинона, которые действуют как ингибиторы ПАРП. Указанные соединения имеют общую формулу где А и В совместно представляют собой конденсированное ароматическое ядро, возможно содержащее замещение, a RC представляет собой -L-RL. Большое количество примеров имеет формулу где R представляет собой один или несколько возможных заместителей. Теперь авторы настоящего изобретения установили, что соединения, в которых R имеет определенную природу, обладают поразительно высоким уровнем ингибирования активности ПАРП и/или усилением действия радиотерапии и различных методов химиотерапии на опухолевые клетки. В соответствии с этим согласно первому аспекту настоящего изобретения предложено соединение формулы (I) а также его изомеры, соли, сольваты, химически защищенные формы и пролекарства, где А и В совместно представляют собой конденсированное ароматическое ядро, возможно содержащее замещение,X может представлять собой NRX или CRXRY, если X=NRX, то n представляет собой 1 или 2, а еслиX=CRXRY, то n представляет собой 1,RX выбирают из группы, включающей Н, возможно содержащий замещение С 1-20 алкил, С 5-20 арил,С 3-20 гетероциклил, амид, тиоамид, сложные эфирные группы, ацил и сульфонильные группы,RY выбирают из группы, включающей Н, гидроксил, амин,или RX и RY могут совместно образовывать спиро-С 3-7 циклоалкильную или гетероциклильную группу,RC1 и RC2 представляют собой водород, или если X представляет собой CRXRY, то RC1, RC2, RX и RY совместно с атомами углерода, к которым они присоединены, могут образовывать конденсированное ароматическое ядро, возможно содержащее замещение, иR1 выбирают из группы, включающей Н и галоген. Таким образом, если X представляет собой CRXRY, a n представляет собой 1, соединение имеет формулу (Ia) Если X представляет собой NRX, a n представляет собой 1, то соединение имеет формулу (lb): Если X представляет собой NRX, a n представляет собой 2, то соединение имеет формулу (Ic):-2 009469 Согласно второму аспекту настоящего изобретения предложен фармацевтический состав, содержащий соединение согласно первому аспекту, а также фармацевтически допустимый носитель или разбавитель. Согласно третьему аспекту настоящего изобретения предложено соединение согласно первому аспекту для применения в способе лечения человека или животного. Согласно четвертому аспекту настоящего изобретения предложено применение соединения согласно первому аспекту изобретения для получения медикамента для ингибирования активности ПАРП. Согласно еще одному аспекту изобретения предложено применение соединения согласно первому аспекту изобретения с целью получения медикамента для лечения сосудистого заболевания, септического шока, ишемического нарушения, нейротоксичности, геморрагического шока, вирусной инфекции или заболеваний, которые смягчаются ингибированием активности ПАРП. Согласно еще одному аспекту изобретения предложено применение соединения согласно первому аспекту изобретения с целью получения медикамента, предназначенного для использования в качестве вспомогательного средства в терапии рака или для усиления действия на опухолевые клетки ионизирующего излучения или химиотерапевтических агентов. Другие аспекты изобретения обеспечивают способ лечения заболевания, которое смягчается ингибированием ПАРП, включающий введение субъекту, который нуждается в таком лечении, терапевтически эффективной дозы соединения согласно первому аспекту изобретения, предпочтительно в форме фармецевтического состава, а также способ лечения рака, включающий введение субъекту, который нуждается в таком лечении, терапевтически эффективной дозы соединения согласно первому аспекту изобретения, предпочтительно в форме фармецевтического состава, одновременно или последовательно с ионизирующим излучением или химиотерпевтическими агентами. В других аспектах настоящего изобретения указанные соединения можно использовать с целью получения медикамента для лечения рака, вызванного недостаточной, зависимой от гомологичной рекомбинации (ГР) активностью репарации ДНР (двухнитевых разрывов - DSB, double strand break) ДНК, или для лечения пациента, страдающего раковым заболеванием, вызванным недостаточной, зависимой от ГР активностью репарации ДНР ДНК, при этом лечение включает введение указанному пациенту терапевтически эффективной дозы указанного соединения. Путь репарации ДНР ДНК, зависимый от ГР, обеспечивает восстановление двухнитевых разрывов(ДНР) в ДНК посредством гомологичных механизмов, чтобы вновь сформировать непрерывную спираль ДНК (K.K. Khanna and S.P. Jackson, Nat. Genet. 27 (3): 247-254 (2001. Компоненты пути репарации ДНР ДНК, зависимых от ГР, включают, в частности, но без ограничения, ATM (HM000051), RAD51(НМ 012415), BRCA1 (НМ 007295), BRCA2 (НМ 000059), RAD50 (НМ 005732), MRE11A (НМ 005590) и NBS1 (НМ 002485). Другие белки, участвующие в пути зависимой от ГР репарации ДНР ДНК, включают регуляторные факторы, в частности EMSY (Hughes-Davies, et al., Cell, 115, pp. 523-535). Компоненты ГР описаны также в работе Wood, et al., Science, 291, 1284-1289 (2001). Раковое заболевание, которое является недостатком зависимой от ГР репарации ДНР ДНК, может содержать или состоять из одной или нескольких раковых клеток, которые имеют пониженную или полностью подавленную способность к репарации ДНР указанным путем по сравнению с нормальными клетками, т. е. активность пути репарации ДНР ДНК, зависимой от ГР, может быть понижена или полностью подавлена в одной или нескольких раковых клетках. Активность одного или нескольких компонентов пути зависимой от ГР репарации ДНР ДНК может быть полностью подавлена в одной или нескольких раковых клеток пациента, страдающего раковым заболеванием, которое является недостатком зависимой от ГР репарации ДНР ДНК. Компоненты пути зависимой от ГР репарации ДНР ДНК хорошо известны специалистам (см., например, Wood, et al., Science,291, 1284-1289 (2001 и включают вышеперечисленные компоненты. В некоторых предпочтительных вариантах реализации изобретения раковые клетки могут иметь дефектный фенотип BRCA1 и/или BRCA2, т. е. активность BRCA1 и/или BRCA2 может быть понижена или полностью подавлена в раковых клетках. Раковые клетки с таким фенотипом могут иметь дефекты вBRCA1 и/или BRCA2, т. е. экспрессия и/или активность BRCA1 и/или BRCA2 может быть понижена или полностью подавлена в раковых клетках, например, посредством мутации или полиморфизма в кодирующей нуклеиновой кислоте или посредством амплификации, мутации или полиморфизма в гене, кодирующем регуляторный фактор, например в гене EMSY, который кодирует регуляторный факторBRCA1 и BRCA2 известны как опухолевые супрессоры, аллели дикого типа которых часто разрушаются в опухолях гетерозиготных носителей (Jasin M., Oncogene, 21 (58), 8981-93 (2002), Tutt, et al.,Trends Mol. Med., 8 (12), 571-6, (2002. Связь мутаций BRCA1 и/или BRCA2 с раком молочной железы подробно описана в литературе (Radice, P.J., Exp. Clin. Cancer Res., 21 (3 Suppl.), 9-12 (2002. Известно также, что амплификация гена EMSY, который кодирует связующий фактор BRCA2, связана с раком молочной железы и яичника. Носители мутаций в BRCA1 и/или BRCA2 также являются факторами повышенной опасности рака-3 009469 яичника, простаты и поджелудочной железы. В некоторых предпочтительных вариантах реализации изобретения индивидуум является гетерозиготным для одной или нескольких вариаций, в частности для мутаций или полиморфизмов, в BRCA1 и/или BRCA2 или их регуляторе. Способ обнаружения вариации в BRCA1 и BRCA2 хорошо известен специалистам и описан, например, в ЕР 699754, ЕР 705903, Neuhausen, S.L. and Ostrander, E.A., Genet.al., Neoplasma, 50 (4), 246-50 (2003), Jancarkova, N., Ceska Gynekol., 68 (1), 11-6 (2003). Определение амплификации связующего фактора EMSY BRCA2 описано в работе Hughes-Davies, et al., Cell, 115, 523-535. Мутации и полиморфизмы, связанные с раком, могут быть обнаружены на уровне нуклеиновой кислоты путем определения присутствия измененной последовательности нуклеиновой кислоты или на уровне белка путем определения присутствия измененного (т. е. мутантного или аллельного варианта) полипептида. Определения Термин "ароматическое ядро" используется в настоящем описании в общепринятом смысле и относится к циклической ароматической структуре, т.е. к циклической структуре, содержащей делокализованные -электронные орбитали. Ароматическое ядро, конденсированное с основным ядром, т. е. образующее структуру-А-В-, может содержать другие конденсированные ароматические ядра (образуя, например, нафтильные или антраценильные группы). Ароматические ядра могут содержать только атомы углерода или атомы углерода и один или несколько гетероатомов, включая, в частности, но без ограничения, атомы азота, кислорода и серы. Ароматические ядра предпочтительно содержат в кольце 5 или 6 атомов. Ароматические ядра могут содержать замещение. Если сам заместитель содержит арильную группу, то данная арильная группа не считается частью арильной группы, к которой он присоединен. Так,например, группа бифенила считается в этом случае фенильной группой (арильная группа, содержащая одно ароматическое ядро), содержащей замещение фенильной группой. Аналогично этому группа бензилфенила считается фенильной группой (арильная группа, содержащая одно ароматическое ядро), содержащей замещение бензильной группой. В одной группе предпочтительных вариантов реализации изобретения ароматическая группа содержит одно ароматическое ядро с 5 или 6 атомами в кольце, при этом атомы кольца выбирают из группы, включающей углерод, азот, кислород и серу, а ядро может содержать замещение. Примеры таких групп включают, в частности, но без ограничения, бензол, пиразин, пиррол, тиазол, изоксазол и оксазол. 2-Пирон также можно считать ароматическим ядром, однако, он является менее предпочтительным. Если ароматическое ядро содержит 6 атомов, то предпочтительно, чтобы по меньшей мере 4, или даже 5, или все атомы кольца представляли собой углерод. Другие атомы кольца выбирают из группы, включающей азот, кислород и серу, при этом азот и кислород являются предпочтительными. Пригодные группы включают кольцо без гетероатомов (бензол), с 1 атомом азота (пиридин), с 2 атомами азота (пиразин, пиримидин и пиридазин), с 1 атомом кислорода (пирон), а также с 1 атомом кислорода и 1 атомом азота (оксазин). Если ароматическое ядро содержит 5 атомов в кольце, то предпочтительно, чтобы по меньшей мере 3 атома кольца являлись атомами углерода. Остальные атомы кольца выбирают из группы, включающей азот, кислород и серу. Пригодные ядра включают кольцо, содержащее 1 атом азота (пиррол), 2 атома азота (имидазол, пиразол), 1 атом кислорода (фуран), 1 атом серы (тиофен), 1 атом азота и 1 атом серы(изотиазол, тиазол), а также 1 атом азота и 1 атом кислорода (изоксазол или оксазол). Ароматическое ядро может содержать одну или несколько замещающих групп в любой позиции кольца. Эти заместители выбирают из группы, включающей галоген, нитро, гидроксил, группы простого эфира, тиол, тиоэфир, амин, С 1-7 алкил, С 3-20 гетероциклил и С 5-20 арил. Ароматическое ядро может также содержать одну или несколько замещающих групп, которые совместно образуют кольцо. В частности,они могут иметь формулу -(СН 2)m- или -O-(СН 2)р-O-, где m равно 2, 3, 4 или 5, а р равно 1, 2 или 3. Алкил: термин "алкил", используемый в настоящем описании, относится к одновалентной группе,которую получают путем удаления атома водорода от атома углерода углеводородного соединения, содержащего от 1 до 20 атомов углерода (если не указано иного), при этом указанное соединение может быть алифатическим или алициклическим, насыщенным или ненасыщенным (например, частично ненасыщенным или полностью ненасыщенным). Таким образом, термин "алкил" включает подклассы алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкинила и т.д., рассмотренные ниже. В контексте алкильных групп индексы (например, С 1-4, C1-7, С 1-20, С 2-7, С 3-7 и т.д.) означают количество атомов углерода или пределы количества атомов углерода. Так, например, термин "С 1-4 алкил", используемый в настоящем описании, относится к алкильной группе, содержащей от 1 до 4 атомов углерода. Примеры алкильных групп включают C1-4 алкил ("низший алкил "), C1-7 алкил и С 1-20 алкил. Следует отметить, что первый индекс может изменяться согласно другим ограничениям, например для ненасыщенных алкильных групп первый индекс должен быть равен по меньшей мере 2, для циклических алкильных групп первый индекс должен быть равен по меньшей мере 3 и т.д. Примеры (не содержащих замещение) насыщенных алкильных групп включают, в частности, но без ограничения, метил (C1), этил (С 2), пропил (С 3), бутил (С 4), пентил (С 5), гексил (С 6), гептил (С 7), октил(C15) и эйкодецил (С 20). Примеры (не содержащих замещение) насыщенных линейных алкильных групп включают, в частности, но без ограничения, метил (С 1), этил (С 2), n-пропил (С 3), n-бутил (С 4), n-пентил (амил) (С 5), nгексил (С 6) и n-гептил (С 7). Примеры (не содержащих замещение) насыщенных разветвленных алкильных групп включают изопропил (С 3), изобутил (С 4), вторичный бутил (С 4), третичный бутил (С 4), изопентил (С 5) и неопентил (C5). Алкенил: термин "алкенил", используемый в настоящем описании, относится к алкильной группе,содержащей одну или несколько углерод-углеродных двойных связей. Примеры алкенильных групп включают С 2-4 алкенил, С 2-7 алкенил, С 2-20 алкенил. Примеры (не содержащих замещение) ненасыщенных алкенильных групп включают, в частности,но без ограничения, этенил (винил, -СН=СН 2), 1-пропенил (-СН=СН-СН 3), 2-пропенил (аллил, -СНСН=СН 2), изопропенил (1-метилвинил, -С(СН 3)=СН 2), бутенил (С 4), пентенил (С 5) и гексенил (С 6). Алкинил: термин "алкинил", используемый в настоящем описании, относится к алкильной группе,содержащей одну или несколько углерод-углеродных тройных связей. Примеры алкинильных групп включают С 2-4 алкинил, С 2-7 алкинил, С 2-20 алкинил. Примеры (не содержащих замещение) ненасыщенных алкинильных групп включают, в частности,но без ограничения, этинил (этинил, -ССН) и 2-пропинил (пропаргил, -СН 2-ССН). Циклоалкил: термин "циклоалкил", используемый в настоящем описании, относится к алкильной группе, которая является также циклильной группой, т.е. одновалентной группой, полученной удалением атома водорода от атома алициклического кольца карбоциклического ядра карбоциклического соединения,при этом указанное карбоциклическое ядро может быть насыщенным или ненасыщенным (например,частично ненасыщенным или полностью ненасыщенным), а указанная группа содержит от 3 до 20 атомов углерода (если не указано иного), включая от 3 до 20 атомов в кольце. Таким образом, термин "циклоалкил" включает подклассы циклоалкенилов и циклоалкинилов. Предпочтительно каждое ядро содержит от 3 до 7 атомов в кольце. Примеры циклоалкильных групп включают С 3-20 циклоалкил, С 3-15 циклоалкил,С 3-10 циклоалкил и С 3-7 циклоалкил. Примеры циклоалкильных групп включают, в частности, но без ограничения, производные насыщенных моноциклических углеводородных соединений: циклопропан (С 3), циклобутан (С 4),циклопентан (С 5), циклогексан (С 6), циклогептан (С 7), метилциклопропан (С 4), диметилциклопропан (С 5),метилциклобутан (С 5), диметилциклобутан (С 6), метилциклопентан (С 6), диметилциклопентан (С 7), метилциклогексан (С 7), диметилциклогексан (С 8), ментан (С 10); ненасыщенных моноциклических углеводородных соединений: циклопропен (С 3), циклобутен (С 4),циклопентен (С 5), циклогексен (С 6), метилциклопропен (С 4), диметилциклопропен (C5), метилциклобутен(C5), диметилциклобутен (С 6), метилциклопентен (С 6), диметилциклопентен (С 7), метилциклогексен (С 7),диметилциклогексен (С 8); насыщенных полициклических углеводородных соединений: туйан (С 10), каран (С 10), пинан (С 10), борнан (C10), норкаран (С 7), норпинан (С 7), норборнан (С 7), адамантан (C10), декалин (декагидронафталин) (C10); ненасыщенных полициклических углеводородных соединений: камфен (C10), лимонен (C10), пинен (C10); полициклических углеводородных соединений, содержащих ароматическое ядро: инден (С 9), индан(например, 2,3-дигидро-1 Н-инден) (С 9), тетралин (1,2,3,4-тетрагидронафталин) (C10), аценафтен (С 12),флуорен (C13), фенален (C13), ацефенантрен (C15), ацеантрен (С 16), холантрен (С 20). Гетероциклил: термин "гетероциклил", используемый в настоящем описании, относится к одновалентной группе, полученной путем удаления атома водорода из атома кольца гетероциклического соединения, при этом данная группа содержаит от 3 до 20 атомов в ядре (если не указано иного), из которых от 1 до 10 являются гетероатомами кольца. Предпочтительно каждое ядро содержит от 3 до 7 атомов в кольце, из которых от 1 до 4 являются гетероатомами кольца. В этом контексте индексы (например, С 3-20 С 3-7, С 5-6 и т.д.) означают количество атомов в кольце или диапазон количества атомов в кольце, будь то атомы углерода или гетероатомы. Например, термин"C5-6 гетероциклил", используемый в настоящем описании, относится к гетероциклильной группе, содержащей 5 или 6 атомов в кольце. Примеры гетероциклильних групп включают С 3-20 гетероциклил, С 5-20 гетероциклил, C3-15 гетероциклил, C5-15 гетероциклил, С 3-12 гетероциклил, C5-12 гетероциклил, С 3-10 гетероциклил, С 5-10 гетероциклил, С 3-7 гетероциклил, С 5-7 гетероциклил и С 5-6 гетероциклил. Примеры моноциклических гетероциклильных групп включают, в частности, но без ограничения,производныеN1O1S1: оксатиазин (С 6). Примеры содержащих замещение (не ароматических) моноциклических гетероциклильных групп включают производные сахаридов в циклической форме, например фуранозы (С 5), в частности арабинофуранозу, ликсофуранозу, рибофуранозу и ксилофуранозу, а также пиранозы (С 6), в частности аллопиранозу, алтропиранозу, глюкопиранозу, маннопиранозу, гулопиранозу, идопиранозу, галактопиранозу и талопиранозу. Спиро-С 3-7 циклоалкил или гетероциклил: термин "спиро-С 3-7 циклоалкил" или "гетероциклил", используемый в настоящем описании, относится к С 3-7 циклоалкильному или С 3-7 гетероциклильному ядру,соединенному с другим ядром 1 атомом, общим для обоих ядер. С 5-20 арил: термин "С 5-20 арил", используемый в настоящем описании, относится к одновалентной группе, полученной удалением атома водорода из атома ароматического ядра ароматического соединения С 5-20, при этом указанное соединение содержит одно, два или несколько ядер (например, конденсированных) с количеством от 5 до 20 атомов в кольце, и при этом по меньшей мере одно из указанных ядер является ароматическим ядром. Каждое ядро предпочтительно содержит от 5 до 7 атомов в кольце. Все атомы в кольце могут представлять собой атомы углерода, в этом случае образуются "карбоарильные группы", которые обычно называют "С 5-20 карбоарильными" группами. Примеры С 5-20 арильных групп, которые не содержат в кольце гетероатомов (т.е. С 5-20 карбоарильные группы), включают, в частности, но без ограничения, производные бензола (например, фенил) (С 6), нафталина (C10), антрацена (C14), фенантрена (С 14) и пирена (C16). Альтернативно, атомы кольца могут содержать один или несколько гетероатомов, включая, в частности, но без ограничения, кислород, азот, и серу, как в "гетероарильных группах". В этом случае группу могут называть "С 5-20 гетероарильной" группой, при этом "С 5-20" означает количество атомов в кольце,будь то атомы углерода или гетероатомы. Каждое ядро предпочтительно содержит от 5 до 7 атомов кольца, из которых от 0 до 4 являются гетероатомами. Примеры C5-20 гетероарильных групп включают, в частности, но без ограничения, С 5 гетероарильные группы: производные фурана (оксол), тиофена (тиол), пиррола (азол), имидазола (1,3-диазол), пиразола(1,2-диазол), триазола, оксазола, изоксазола, тиазола, изотиазола, оксадиазола, тетразола и оксатриазола; и С 6 гетероарильные группы: производные изоксазина, пиридина (азин), пиридазина (1,2-диазин), пиримидина (1,3-диазин, например, цитозин, тимин и урацил), пиразина (1,4-диазин) и триазина. Гетероарильная группа может быть присоединена посредством углеродного атома или гетероатома кольца. Примеры С 5-20 гетероарильных групп, которые содержат конденсированные ядра, включают, в частности, но без ограничения, С 9 гетероарильные группы: производные бензофурана, изобензофурана, бензотиофена, индола, изоиндола; С 10 гетероарильные группы: производные хинолина, изохинолина, бензодиазина, пиридопиридина; C14 гетероарильные группы: производные акридина и ксантена. Вышеуказанные алкильные, гетероциклильные и арильные группы, будучи отдельными или частью другого заместителя, сами могут содержать замещение в форме одной или нескольких групп, включающих эти указанные группы и другие заместители, перечисленные ниже. Галогены: -F, -Cl, -Br и -I. Гидроксил: -ОН. Простой эфир: -OR, где R представляет собой простой эфирный заместитель, например C1-7 алкильная группа (называемая также С 1-7 алкоксильной группой), С 3-20 гетероциклильная группа (называемая также С 3-20 гетероциклилоксигруппой) или С 5-20 арильная группа (называемая также С 5-20 арилоксигруппой), предпочтительной является C1-7 алкильная группа. Нитро: -NO2,Циано (нитрил, карбонитрил): -CN. Ацил (кето): -C(=O)R, где R представляет собой ацильный заместитель, например H, C1-7 алкильная группа (называемая также C1-7 алкилацилом или C1-7 алканоилом), С 3-20 гетероциклильная группа (называемая также С 3-20 гетероциклилацилом) или C5-20 арильная группа (называемая также С 5-20 арилацилом),предпочтительной является C1-7 алкильная группа. Примеры ацильной группы включают, в частности, но без ограничения, -С(=O)СН 3 (ацетил), -С(=O)СН 2 СН 3 (пропионил), -С(=O)С(СН 3)3 (бутирил) и -C(=O)Ph(бензоил, фенон). Карбоксил (карбоновая кислота): -СООН. Сложный эфир (карбоксилат, сложный эфир карбоновой кислоты, оксикарбонил): -C(=O)OR, где R-6 009469 представляет собой сложный эфирный заместитель, например C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительной является C1-7 алкильная группа. Примеры сложных эфирных групп включают, в частности, но без ограничения, -С(=O)ОСН 3, -С(=O)ОСН 2 СН 3, -С(=O)ОС(СН 3)3 и -C(=O)OPh. Амид (карбамоил, карбамил, аминокарбонил, карбоксамид): -C(=O)NR1R2, где R1 и R2 независимо представляют собой аминовые заместители, как указано для аминогрупп. Примеры амидогрупп включают, в частности, но без ограничения, -C(=O)NH2, -C(=O)NHCH3, -C(=O)N(CH3)2, -C(=O)NHCH2CH3 и-C(=O)N(CH2CH3)2, a также амидогруппы, в которых R1 и R2 совместно с атомом азота, к которому они присоединены, образуют гетероциклическую структуру, как, например, в пиперидинокарбониле, морфолинокарбониле, тиоморфолинокарбониле и пиперазинилкарбониле. Амин: -NR1R2, где R1 и R2 независимо представляют собой аминные заместители, например водород, C1-7 алкильную группу (называемую также C1-7 алкиламинной или ди-C1-7 алкиламинной), С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительными являются Н или C1-7 алкильная группа, или в случае "циклической" аминогруппы R1 и R2 совместно с атомом азота, к которому они присоединены, образуют гетероциклическое ядро, содержащее от 4 до 8 атомов в кольце. Примеры аминогрупп включают, в частности, но без ограничения, -NH2, -NHCH3, -NHCH(CH3)2, -N(CH3)2, -N(CH2CH3)2 и-NHPh. Примеры циклических аминогрупп включают, в частности, но без ограничения, азиридинил, азетидинил, пирролидинил, пиперидино, пиперазинил, пергидродиазепинил, морфолино и тиоморфолино. Циклические аминогруппы могут содержать в своем ядре какие-либо из указанных здесь заместителей,например карбоксил, карбоксилат и амид. Ациламид (ациламин): -NR1C(=O)R2, где R1 представляет собой амидный заместитель, например водород, C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительными являются Н или C1-7 алкильная группа, наиболее предпочтителен Н, a R2 представляет собой ацильный заместитель, например C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры ациламидных групп включают, в частности, но без ограничения, -NHC(=O)CH3, -NHC(=O)CH2CH3 и -NHC(=O)Ph. R1 и R2 могут совместно образовывать циклическую структуру, как, например, в сукцинимидиле, малеимидиле и фталимидиле: Уреид: -N(R1)CONR2R3, где R2 и R3 независимо представляют собой аминные заместители, как указано для аминогрупп, a R1 представляет собой уреидный заместитель, например водород, C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно водород или C1-7 алкильную группу. Примеры уреидной группы включают, в частности, но без ограничения, -NHCONH2,-NHCONHMe, -NHCONHEt, -NHCONMe2, -NHCONEt2, -NMeCONH2, -NMeCONHMe, -NMeCONHEt,-NMeCONMe2, -NMeCONEt2 и -NHC(=O)NHPh. Ацилоксил (обратный сложный эфир): -OC(=O)R, где R представляет собой ацилоксильный заместитель, например C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры ацилоксильных групп включают, в частности, но без ограничения,-ОС(=O)СН 3 (ацетоксил), -ОС(=O)СН 2 СН 3, -ОС(=O)С(СН 3)3, -OC(=O)Ph, -OC(=O)C6H4F и -OC(=O)CH2Ph. Тиол: -SH. Тиоэфир (сульфид): -SR, где R представляет собой тиоэфирный заместитель, например C1-7 алкильную группу (называемую также C1-7 алкилтиогруппой), С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры C1-7 алкилтиогруппы включают, в частности,но без ограничения, -SCH3 и -SCH2CH3. Сульфоксид (сульфинил): -S(=O)R, где R представляет собой сульфоксидный заместитель, например C1-7 алкильную группу, C3-20 гетероциклильную группу или C5-20 арильную группу, предпочтительноC1-7 алкильную группу. Примеры сульфоксидной группы включают, в частности, но без ограничения,-S(=O)CH3 и -S(=O)CH2CH3. Сульфонил (сульфон): -S(=O)2R, где R представляет собой сульфонный заместитель, например C1-7 алкильную группу, C3-20 гетероциклильную группу или C5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры сульфонной группы включают, в частности, но без ограничения, -S(=O)2CH3(метансульфонил, мезил), -S(=O)2CF3, -S(=O)2CH2CH3 и 4-метилфенилсульфонил (тозил). Тиоамид (тиокарбамил): -C(=S)NR1R2, где R1 и R2 независимо представляют собой аминные заместители, как указано для аминогрупп. Примеры амидогрупп включают, в частности, но без ограничения,-C(=S)NH2, -C(=S)NHCH3, -C(=S)N(CH3)2 и -C(=S)NHCH2CH3. Сульфонамин: -NR1S(=O)2R, где R1 представляет собой аминный заместитель, как указано для ами-7 009469 ногрупп, a R представляет собой сульфонаминный заместитель, например C1-7 алкильную группу, C3-20 гетероциклильную группу или C5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры сульфонаминных групп включают, в частности, но без ограничения, -NHS(=O)2CH3, -NHS(=O)2Ph и-N(CH3)S(=O)2C6H5. Как указано выше, группы, которые образуют вышеперечисленные замещающие группы, напримерC1-7 алкил, C3-20 гетероциклил и C5-20 арил, сами могут содержать замещения. Таким образом, вышеприведенные определения включают замещающие группы, содержащие замещения. Краткое описание фигур На фиг. 1 показаны кривые клоногенного выживания клеток под действием соединения (4) согласно настоящему изобретению. На фиг. 1 А показаны Brca1 дикого типа (11 СО: ), гетерозиготные (Cre6: ) и дефектные (Cre10:) клетки ES, подвергнутые непрерывному воздействию соединения 4. Ошибки представляют собой стандартные отклонения от средней величины. На фиг. 1 В показаны Brca2 дикого типа (D3: ), гетерозиготные (Cre6: ) и дефектные (Cre24: ) клетки ES, подвергнутые непрерывному воздействию соединения 4, Ошибки представляют собой стандартные отклонения от средней величины. На фиг. 2 показан анализ влияния соединения (4) согласно изобретению на клеточную линию с недостаточной функцией BRCA2 в сравнении с комплементарной линией BRCA2. Показанные данные представляют собой клоногенное выживание дефектных Brca2 (V-С 8: ) и комплементарных клеток (VC8 ВАС+: ) при непрерывном воздействии различных концентраций соединения 4. Дополнительные предпочтения Следующие предпочтительные варианты можно использовать при решении всех соответствующих задач настоящего изобретения. Согласно настоящему изобретению конденсированные ароматические ядра, образующие структуру-А-В-, предпочтительно содержат в кольце только атомы углерода и поэтому могут представлять собой бензол или нафталин, более предпочтительно бензол. Как указано выше, такие ядра могут содержать замещения, однако, в некоторых вариантах реализации изобретения они предпочтительно являются незамещенными. Если конденсированное ароматическое ядро, представленное структурой -А-В-, содержит замещающую группу, она предпочтительно присоединяется к атому, который, в свою очередь, соединяется с карбонильной группой центрального ядра в мета-позиции. Так, если конденсированное ароматическое ядро представляет собой бензольное кольцо, предпочтительная позиция для замещения обозначена в приведенной ниже формуле которую обычно называют 5 позицией группы фталазинона.R1 предпочтительно выбирают из группы, включающей Н, Cl и F, более предпочтительно F.RC1 и RC2 предпочтительно представляют собой водород. Если n равно 2, то X представляет собой NRX. В этих вариантах реализации изобретения RX предпочтительно выбирают из группы, включающей Н, возможно содержащий замещение С 1-20 алкил, возможно содержащий замещение C5-20 арил и возможно содержащие замещение сложные эфирные группы,при этом сложный эфирный заместитель предпочтительно представляет собой С 1-20 алкил, возможно содержащие замещение ацильные группы, возможно содержащие замещение амидные группы, возможно содержащее замещение тиоамидные группы и возможно содержащие замещение сульфонильные группы.RX более предпочтительно выбирают из группы, включающей Н, возможно содержащий замещение С 1-20 алкил, возможно содержащий замещение С 5-20 арил и возможно содержащие замещение сложные эфирные группы, при этом сложный эфирный заместитель предпочтительно представляет собой С 1-20 алкил. Если n равно 1, то X может представлять собой NRX или CRXCRY. В вариантах реализации изобретения, где X представляет собой NRX, RX предпочтительно выбирают из группы, включающей Н, возможно содержащий замещение С 1-20 алкил, возможно содержащий замещение C5-20 арил, возможно содержащий замещение ацил, возможно содержащий замещение сульфонил, возможно содержащий замещение амид и возможно содержащие замещение тиоамидные группы. В вариантах реализации изобретения, где X представляет собой CRXRY, RY предпочтительно представляет собой Н. RX предпочтительно выбирают из группы, включающей Н, возможно содержащий замещение C1-20 алкил, возможно содержащий замещение С 5-20 арил, возможно содержащий замещение C3-20 гетероциклил, возможно содержащий замещение ацил, при этом ацильный заместитель предпочтительно-8 009469 выбирают из группы, включающей C5-20 арил и C3-20 гетероциклил (например, пиперазинил), возможно содержащий замещение амид, при этом аминогруппы предпочтительно выбирают из группы, включающей Н и C1-20 алкил, или совместно с атомом азота образуют C5-20 гетероциклическую группу, а также возможно содержащие замещение сложные эфирные группы, при этом сложный эфирный заместитель предпочтительно выбирают из C1-20 алкильных групп. Особенно предпочтительные соединения включают 1, 2, 3, 4, 10, 21, 74, 97, 152, 153, 163, 167, 169,173, 185, 232, 233, 250, 251, 252, 260 и 263. В соответствующих случаях вышеуказанные предпочтительные варианты можно использовать в сочетании друг с другом. Включение других форм Вышеуказанные заместители включают хорошо известные ионные, солевые, сольватные и защищенные формы. Например, ссылка на карбоновую кислоту (-СООН) включает также анионную (карбоксилатную) форму (-СОО-), ее соль или сольват, а также обычные защищенные формы. Аналогично этому ссылка на аминогруппу включает протонированную форму (-N+HR1R2), соль или сольват аминогруппы,например гидрохлоридную соль, а также обычные защищенные формы аминогруппы. Ссылка на гидроксильную группу включает также анионную форму (-О-), ее соль или сольват, а также обычные защищенные формы гидроксильной группы. Изомеры, соли, сольваты, защищенные формы и пролекарства Некоторые соединения могут существовать в одной или нескольких особых геометрических, оптических, энантиомерных, диастериомерных, эпимерных, стереоизомерных, таутомерных, конформационных или аномерных формах, включая, в частности, но без ограничения, цис- и транс-формы, Е- и Z-формы, с-, t- и r-формы, эндо- и экзоформы, R-, S- и мезоформы, D- и L-формы, d- и l-формы, (+)- и (-)формы, кето-, энол- и энолат-формы, син- и антиформы, синклинальные и антиклинальные формы, - и-формы, осевые и экваториальные формы, конформации ванны, кресла, витка конверта и полукресла, а также их сочетания, обобщенно называемые "изомерами" (или "изомерными формами"). Если соединение находится в кристаллической форме, оно может существовать в нескольких различных полиморфных формах. Следует отметить, что, за исключением рассматриваемых ниже таутомерных форм, из термина"изомеры", используемого в настоящем описании, специально исключаются структурные (или конституциональные) изомеры (т.е. изомеры, которые отличаются соединениями между атомами, а не только расположением атомов в пространстве). Например, ссылка на метоксильную группу, -ОСН 3, не означает ссылки на ее структурный изомер, гидроксиметильную группу-СН 2 ОН. Аналогично этому ссылка на ортохлорфенил не означает ссылки на его структурный изомер метахлорфенил. Однако ссылка на класс структур вполне может включать структурные изомерные формы, входящие в этот класс (например, С 1-7 алкил включает n-пропил и изопропил, бутил включает n-, изо, вторичный и третичный бутил, метоксифенил включает орто-, мета- и параметоксифенил). Вышеуказанное исключение не относится к таутомерным формам, в частности к кето-, энол- и энолатформам, как, например, в случае следующих таутомерных пар: кето/энол, имин/энамин, амид/иминовый спирт, амидин/амидин, нитрозо/оксим, тиокетон/энетиол, N-нитрозо/гидроксиазо и нитро/ацинитро. В частности, к настоящему изобретению относится таутомерная пара, показанная ниже: Следует отметить, что термин "изомер", в частности, обозначает соединения с одним или несколькими изотопными заместителями. Например, Н может присутствовать в любой изотопной форме, включая 1 Н, 2 Н (D) и 3 Н (Т), С может присутствовать в любой изотопной форме, включая 12 С, 13 С и 14 С, О может присутствовать в любой изотопной форме, включая 16O и 18O и т.п. Если не указано иного, ссылка на конкретное соединение включает все указанные изомерные формы, в том числе (полностью или частично) рацемические и другие их смеси. Способы получения (например, асимметричный синтез) и разделения (например, фракционная кристаллизация и хроматографические способы) таких изомерных форм известны специалистам или легко получаются путем адаптации известным образом способов, изложенных в настоящем описании, или известных способов. Если не указано иного, ссылка на конкретное соединение включает также его ионные, солевые, сольватные и защищенные формы, как, например, показано ниже, а также его различные полиморфные формы. Может оказаться удобным или желательным получить, очистить и/или использовать соответствующую соль активного соединения, например фармацевтически допустимую соль. Примеры фармацевтически допустимых солей описаны в работе Berge, et al., "Pharamceutically Acceptable Salts", J. Pharm. Sci., 66, 1-19 (1977).-9 009469 Например, если соединение является анионным или содержит функциональную группу, которая может быть анионной (например, -СООН может стать -СОО-), то с соответствующим катионом может образовываться соль. Примеры пригодных неорганических катионов включают, в частности, но без ограничения, ионы щелочных металлов, в частности Na+ и K+, катионы щелочно-земельных металлов, в частности Са 2+ и Mg2+, и другие катионы, в частности Al3+. Примеры пригодных органических катионов включают, в частности, но без ограничения, ион аммония (т.е., NH4+) и содержащие замещение ионы аммония (например, NH3R+, NH2R2+, NHR3+ NR4+). Примерами некоторых пригодных ионов аммония, содержащих замещения, являются производные этиламина, диэтиламина, дициклогексиламина, триэтиламина,бутиламина, этилендиамина, этаноламина, диэтаноламина, пиперазина, бензиламина, фенилбензиламина,холина, меглумина и трометамина, а также аминокислот, в частности лизина и аргинина. Примером обычного четвертичного иона аммония является N(CH3)4+. Если соединение является катионным или содержит функциональную группу, которая может быть катионной (например, -NH2 может стать -NH3+), то с соответствующим анионом может образовываться соль. Примеры пригодных неорганических анионов включают, в частности, но без ограничения, производные следующих неорганических кислот: хлористо-водородной, бромисто-водородной, йодистоводородной, серной, сернистой, азотной, азотистой, фосфорной и фосфористой. Примеры пригодных органических анионов включают, в частности, но без ограничения, производные следующих органических кислот: уксусной, пропионовой, янтарной, гликолевой, стеариновой, пальмитиновой, молочной, яблочной,памовой, винной, лимонной, глюконовой, аскорбиновой, малеиновой, оксималеиновой, фенилуксусной,глугаминовой, аспарагиновой, бензойной, коричной, пировиноградной, салициловой, сульфаниловой, 2 уксусно-оксибензойной, фумаровой, толуолсульфоновой, метансульфоновой, этансульфоновой, этандисульфоновой, оксалиновой, изэтионовой, валериановой и глюконовой. Примеры пригодных полимерных анионов включают, в частности, но без ограничения производные следующих полимерных кислот: дубильной кислоты и карбоксиметилцеллюлозы. Может оказаться удобным или желательным получить, очистить и/или использовать соответствующий сольват активного соединения. Термин "сольват" используется в настоящем описании в общепринятом смысле и относится к комплексу, содержащему растворенное вещество (например, активное соединение или соль активного соединения) и растворитель. Если растворителем является вода, сольват обычно называют гидратом, например моногидратом, дигидратом, тригидратом и т.д. Может оказаться удобным или желательным получить, очистить и/или использовать активное соединение в химически защищенной форме. Термин "химически защищенная форма", используемый в настоящем описании, относится к соединению, в котором одна или несколько реактивных функциональных групп защищены от нежелательных химических реакций, т.е. находятся в форме защищенных или защитных групп (известных также как маскированные или маскирующие группы или как блокированные или блокирующие группы). При защите реактивной функциональной группы можно реализовать реакции с участием других незащищенных реактивных функциональных групп, не оказывая влияния на защищенную группу, при этом защищенную группу можно удалить, обычно на следующем этапе, не оказывая существенного влияния на остальную часть молекулы. См., например, "Protective Groups in OrganicSynthesis" (Т. Green and P. Wuts, 3rd Edition, John Wiley and Sons, 1999). Так, например, гидроксильная группа может быть защищена как простой эфир (-OR) или как сложный эфир (-OC(=O)R), в частности как простой t-бутиловый эфир, простой бензиловый, бензидриловый(дифенилметиловый) или тритиловый (трифенилметиловый) эфир, простой триметилсилиловый или tбутилдиметилсилиловый эфир или как сложный ацетиловый эфир (-ОС(=O)СН 3, -ОАс). Альдегидная или кетонная группа может быть защищена, например, как ацеталь или кеталь, соответственно, при этом карбонильная группа (С=O) превращается в простой эфир двухосновной кислоты(C(OR)2) в результате реакции, например, с первичным спиртом. Альдегидная или кетонная группа легко восстанавливается путем гидролиза с большим избытком воды в присутствии кислоты. Аминогруппа может быть защищена, например, как амид или уретан, в частности как метиламид(-NHCO-CH3), бензилоксиамид (-NHCO-OCH2C6H5, -NH-Cbz), t-бутоксиамид (-NHCO-OC(CH3)3, -NH-Boc),2-бифенил-2-пропоксиамид (-NHCO-ОС(СН 3)2 С 6 Н 4 С 6 Н 5, -NH-Bpoc), 9-флуоренилметоксиамид (-NH-Fmoc),6-нитровератрилоксиамид (-NH-Nvoc), 2-триметилсилилэтилоксиамид (-NH-Teoc), 2,2,2-трихлорэтилоксиамид (-NH-Troc), аллилоксиамид (-NH-Alloc), 2(-фенилсульфонил)этилоксиамид (-NH-Psec) или в соответствующих случаях как N-оксид (NO). Группа карбоновой кислоты может быть защищена, например, как сложный эфир, в частности как сложный C1-7 алкильный эфир (например, сложный метиловый эфир, сложный t-бутиловый эфир), сложный C1-7 галоалкильный сложный эфир (например, сложный C1-7 тригалоалкильный эфир), сложный триC1-7 алкилсилил-C1-7 алкильный эфир или сложный C5-20 арил-C1-7 алкильный эфир (например, сложный бензиловый эфир, сложный нитробензиловый эфир), или как амид, например как метиламид. Тиоловая группа может быть защищена как тиоэфир (-SR), например как бензиловый тиоэфир или простой ацетамидометиловый эфир (-S-CH2NHC(=O)CH3). Может оказаться удобным или желательным получить, очистить и/или использовать активное соединение в форме пролекарства. Термин "пролекарство", используемый в настоящем описании, относится к- 10009469 соединению, которое в результате метаболизма (например, в живом организме) образует желаемое активное соединение. Обычно пролекарство является неактивным или менее активным, чем активное соединение,однако, оно может обладать определенными достоинствами при обработке, введении или метаболизме. Так, например, некоторые пролекарства представляют собой сложные эфиры активного соединения (в частности, физиологически допустимый, метаболически лабильный сложный эфир). В процессе метаболизма группа сложного эфира (-C(=O)OR) расщепляется, образуя активное лекарство. Такие сложные эфиры можно получить способом эстерификации, например, каких-либо карбоновых кислотных групп (-С(=O)ОН) в исходном соединении, в соответствующих случаях с предварительной защитой других реактивных групп,присутствующих в исходном соединении, с последующим устранением защиты, если требуется. Примеры таких метаболически лабильных сложных эфиров включают сложные эфиры, в которых R представляет собой C1-20 алкил (например, -Me, -Et), C1-7 аминоалкил (например, аминоэтил, 2-(N,N-диэтиламино)этил, 2-(4 морфолино)этил, и ацилокси-C1-7 алкил (например, ацилоксиметил, ацилоксиэтил, например пивалоилоксиметил, ацетоксиметил, 1-ацетоксиэтил, 1-(1-метокси-1-метил)этилкарбоксилоксиэтил, 1-(бензоилокси)этил,изопропоксикарбонилоксиметил, 1-изопропоксикарбонилоксиэтил, циклогексилкарбонилоксиметил, 1-циклогексилкарбонилоксиэтил, циклогексилоксикарбонилоксиметил, 1-циклогексилоксикарбонилоксиэтил,(4-тетрагидропиранилокси)карбонилоксиметил, 1-(4-тетрагидропиранилокси)карбонилоксиэтил, (4-тетрагидропиранил)карбонилоксиметил и 1-(4-тетрагидропиранил)карбонилоксиэтил). Другие пригодные пролекарственные формы включают фосфонатные и гликолятные соли. В частности, гидроксильные группы (-ОН) можно получить в фосфонатных пролекарствах в результате реакции с хлордибензилфосфитом с последующей гидрогенизацией для образования фосфонатной группы-O-Р(=O)(ОН)2. Эту группу можно разблокировать ферментами фосфотазы в процессе метаболизма, чтобы получить активное лекарство с гидроксильной группой. Кроме того, некоторые пролекарства активируют ферментами, чтобы получить активное соединение или соединение, которое после дополнительной химической реакции образует активное соединение. Например, пролекарство может представлять собой производное сахара или другого гликозидного конъюагата или производное сложного эфира аминокислоты. Сокращения Для удобства многие химические группы представлены с помощью хорошо известных сокращений,в частности, но без ограничения, метил (Me), этил (Et), n-пропил (nPr), изопропил (iPr), n-бутил (nBu),третичный бутил (tBu), n-гексил (nHex), циклогексил (cHex), фенил (Ph), бифенил (biPh), бензил (Bn),нафтил (naph), метокси (МеО), этокси (EtO), бензоил (Bz) и ацетил (Ас). Для удобства многие химические соединения представлены с помощью хорошо известных сокращений, в частности, но без ограничения, метанол (МеОН), этанол (EtOH), изопропанол (i-PrOH), метилэтилкетон (MEK), эфир или простой диэтиловый эфир (Et2O), уксусная кислота (АсОН), дихлорметан(THF) и диметилсульфоксид (DMSO). Синтез В описанных ниже способах синтеза конденсированное ядро А-В показано для удобства как конденсированное бензольное ядро. Соединения, в которых ядро А-В отличается от бензола, могут быть синтезированы способами, аналогичными описанным ниже, с помощью соответствующих альтернативных исходных материалов. Соединения согласно настоящему изобретению могут быть синтезированы путем проведения реакции соединения формулы 1 в которой n, RC1, RC2 и X определены выше, в присутствии связующей реагентной системы, например 2(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония тетрафторобората, 2-(1H-бензотриазол-1-ил)-1,1,3,3 тетраметилурония гексафторофосфата или (диметиламинопропил)этилкарбодиимида гидрохлорида/гидроксибензотриазола, в присутствии основания, например диизопропилэтиламина, в растворителе, например диметилацетамиде или дихлорметане, при температуре в пределах от 0C до точки кипения применяемого растворителя. Альтернативно, соединения согласно настоящему изобретению могут быть синтезированы путем- 11009469 перевода соединения формулы 1 в активированную форму, например в кислый хлорид или актвированный сложный эфир, в частности N-оксисукцинимидный сложный эфир, с помощью хорошо известных способов и реакции активированной формы с соединением формулы 2. Соединения с формулой 1 могут быть синтезированы с помощью реакции соединения формулы 3 в которой R1 определено выше, или соединения формулы 4 в которой R1 определено выше, или смеси соединений с формулой 3 и соединений формулы 4 с источником гидразина, например с гидразингидратом, возможно в присутствии основания, например триэтиламина,возможно в присутствии растворителя, например промышленного метилированного спирта, при температуре в пределах от 0C до точки кипения применяемого растворителя. Соединения, имеющие формулу 3 или формулу 4, или их смеси могут быть синтезированы с помощью реакции соединения формулы 5 в которой R1 определено выше, с реагентом, способным гидролизовать нитрильную группу, например с гидроксидом натрия, в присутствии растворителя, например воды, при температуре в пределах от 0C до точки кипения применяемого растворителя. Соединения формулы 5 могут быть синтезированы с помощью реакции соединения формулы 6 в присутствии основания, например метоксида натрия, в растворителе, например в метаноле, возможно в присутствии поглотителя воды, например этилпропионата, при температуре в пределах от 0C до точки кипения применяемого растворителя. Соединения формулы 1 могут быть также синтезированы с помощью реакции соединения формулы 8 в которой R1 определено выше, с реагентом, способным гидролизовать нитрильную группу, например с гидроксидом натрия, в присутствии растворителя, например воды, при температуре в пределах от 0C до точки кипения применяемого растворителя, с последующей реакцией образующегося промежуточного соединения с источником гидразина, например гидразингидратом, при температуре в пределах от 0C до точки кипения применяемого растворителя. Соединения формулы 8 могут быть синтезированы с помощью реакции соединения формулы 9- 12009469 в которой Ra представляет собой С 1-4 алкильную группу, с соединением с формулой 6, в присутствии основания, например триэтиламина или гексаметилдисилазида лития, в присутствии растворителя, например тетрагидрофурана, при температуре в пределах от -80C до точки кипения применяемого растворителя. Соединения формулы 9 могут быть синтезированы способами, аналогичными описанным в WO 02/26576. Соединения формулы 1 могут быть также синтезированы способами, аналогичными описанным выше, в которых нитрильную группу во всех формулах заменяют другими группами, способными образовывать карбоновую кислоту, например сложными эфирными или карбоксамидными группами. Соединения формулы 2 доступны для приобретения или могут быть синтезированы способами,описанными в химической литературе. Соединения согласно настоящему изобретению, в которых X представляет собой CRXRY, где RX или RY являются амидной группой, и которые поэтому могут быть представлены формулой 10 где n, RC1, RC2, R1 и RX определены выше, a RN1 и RN2 отдельно выбирают из группы, включающей Н,возможно содержащий замещение С 1-20 алкил, C5-20 арил, С 3-20 гетероциклил, или могут совместно образовывать возможно содержащие замещение С 3-7 циклоалкильные или гетероциклильные группы, могут быть синтезированы с помощью реакции соединения формулы 11RN2 определены выше, в присутствии связующей реагентной системы, например 2-(1H-бензотриазол-1 ил)-1,1,3,3-тетраметилурония тетрафторобората, 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторофосфата или (диметиламинопропил)этилкарбодиимидгидрохлорид/гидроксибензотриазола, в присутствии основания, например диизопропилэтиламина, в растворителе, например диметилацетамиде или дихлорметане, при температуре в пределах от 0C до точки кипения применяемого растворителя. Альтернативно, соединения формулы 10 могут быть синтезированы путем перевода соединения формулы 11 в активированную форму, например в кислый хлорид или в активированный сложный эфир,в частности N-оксисукцинимидный сложный эфир, с помощью хорошо известных способов и реакции активированной формы с соединением с формулой HNRN1RN2. Соединения формулы 11 могут быть синтезированы путем устранения защиты защищенной формы соединения формулы 11, например соединения формулы 12 в которой n, RC1, RC2, R1 и RX определены выше, a RO1 представляет собой C1-4 алкильную группу, с помощью хорошо известных способов, например гидролизом, катализованным основанием, в присутствии источника гидроксида, например гидроксида натрия или лития, в присутствии растворителя, например воды и/или тетрагидрофурана, при температуре в пределах от 0C до точки кипения применяемого растворителя. Соединения формулы 12 могут быть синтезированы из соединений формулы 1 описанными выше способами. Соединения формулой HNRN1RN2 доступны для приобретения или могут быть синтезированы способами, описанными в химической литературе. Соединения согласно настоящему изобретению, в которых X представляет собой NH и которые поэтому могут быть представлены формулой 13 где n, RC1, RC2 и R1 определены выше, могут быть синтезированы путем устранения защиты защищенной формы соединения формулы 13, например соединения формулы 14 в которой n, RC1, RC2 и R1 определены выше, с помощью хорошо известных способов, например расщепления, катализованного кислотами, в присутствии кислоты, например трифторуксусной кислоты или соляной кислоты, в присутствии растворителя, например дихлорметана, или этанола, и/или воды, при температуре в пределах от 0C до точки кипения применяемого растворителя. Соединения формулы 14 могут быть синтезированы из соединений формулы 1 описанными выше способами. Соединения согласно настоящему изобретению, в которых X представляет собой NRX, где RX ацильная группа, и которые поэтому могут быть представлены формулой 15 где n, RC1, RC2 и R1 определены выше, a RC3 выбирают из группы, включающей возможно содержащий замещение С 1-20 алкил, C5-20 арил и C3-20 гетероциклил, могут быть синтезированы с помощью реакции соединения формулы 13 с соединением формулы RC3COX, в которой RC3 определено выше, а X представляет собой пригодную выбывающую группу, например галоген, в частности хлор, возможно в присутствии основания,например пиридина, триэтиламина или диизопропилэтиламина, возможно в присутствии растворителя,например дихлорметана, при температуре в пределах от 0C до точки кипения применяемого растворителя. Соединения с формулой RC3COX доступны для приобрететния или могут быть синтезированы способами, описанными в химической литературе. Соединения формулы 15 могут быть также синтезированы с помощью реакции соединения формулы 13 с соединением формулы RC3CO2H, в которой RC3 определено выше, в присутствии связующей реагентной системы, например 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония тетрафторобората, 2-(1Hбензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторофосфата или (диметиламинопропил)этилкарбодиимидгидрохлорида/гидроксибензотриазола, в присутствии основания, например диизопропилэтиламина,в растворителе, например диметилацетамиде или дихлорметане, при температуре в пределах от 0C до точки кипения применяемого растворителя. Соединения с формулой RC3CO2H доступны для приобретения или могут быть синтезированы способами, описанными в химической литературе. Соединения согласно настоящему изобретению, в которых X представляет собой NRX, где RX амидная или тиоамидная группа, и которые поэтому могут быть представлены формулой 16- 14009469 где n, RC1, RC2 и R1 определены выше, Y представляет собой О или S, a RN3 выбирают из группы, включающей возможно содержащий замещение C1-20 алкил, C5-20 арил и C3-20 гетероциклил, могут быть синтезированы с помощью реакции соединения с формулой 13 с соединением с формулой RN3NCY, где Y иRN3 определены выше, в присутствии растворителя, например дихлорметана, при температуре в пределах от 0C до точки кипения применяемого растворителя. Соединения формулы RN3NCY доступны для приобретения или могут быть синтезированы способами, описанными в химической литературе. Соединения согласно настоящему изобретению, в которых X представляет собой NRX, где RX сульфонильная группа, и которые поэтому могут быть представлены формулой 17 где n, RC1, RC2 и R1 определены выше, a RS1 выбирают из группы, включающей возможно содержащий замещение C1-20 алкил, C5-20 арил и C3-20 гетероциклил, могут быть синтезированы с помощью реакции соединения с формулой 13 с соединением с формулой RS1SO2Cl, в которой RS1 определено выше, возможно в присутствии основания, например пиридина, триэтиламина или диизопропилэтиламина, в присутствии растворителя, например дихлорметана, при температуре в пределах от 0C до точки кипения применяемого растворителя. Соединения формулы RS1SO2Cl доступны для приобретения или могут быть синтезированы способами, описанными в химической литературе. Соединения согласно настоящему изобретению, в которых X представляет собой NRX, где RX выбирают из группы, включающей возможно содержащий замещение С 1-20 алкил или С 3-20 гетероциклил, и которые поэтому могут быть представлены формулой 18 где n, RC1, RC2 и R1 определены выше, a RC4 и RC5 отдельно выбирают из группы, включающей Н, возможно содержащий замещение C1-20 алкил, C5-20 арил, C3-20 гетероциклил, или могут совместно образовывать возможно содержащую замещение С 3-7 циклоалкильную или гетероциклильную группу, могут быть синтезированы с помощью реакции соединения с формулой 13 с соединением с формулой RC4CORC5, в которой RC4 и RC5 определены выше, в присутствии восстанавливающего агента, например натрия цианоборогидрида или натрия триацетоксиборогидрида, в присутствии растворителя, например метанола,возможно в присутствии кислотного катализатора, например уксусной кислоты, при температуре в пределах от 0C до точки кипения применяемого растворителя. Соединения с формулой RC4CORC5 доступны для приобретения или могут быть синтезированы способами, описанными в химической литературе. Применение Настоящее изобретение обеспечивает активные соединения, в особенности активные в отношении подавления активности ПАРП. Термин "активный", используемый в настоящем описании, относится к соединениям, способным подавлять активность ПАРП, и включает, в частности, соединения с собственной активностью (лекарства), а также пролекарства таких соединений, при этом сами пролекарства могут проявлять небольшую собственную активность или вообще не проявлять собственной активности. Одна из методик анализа, которую удобно использовать для оценки ингибирования ПАРП конкретным соединением, описана в приведенных ниже примерах. Настоящее изобретение обеспечивает также способ ингибирования активности ПАРП в клетке,включающий контактирование указанной клетки с эффективной дозой активного соединения, предпочтительно в форме фармацевтически допустимого состава. Такой способ может быть реализован как в искусственных условиях, так и в живом организме. Например, можно вырастить образец клеток в искусственных условиях, создать контакт активного- 15009469 соединения с указанными клетками и наблюдать, как соединение влияет на эти клетки. В качестве меры"влияния" можно определить, например, величину репарации ДНК за определенное время. Если окажется, что активное соединение оказывает влияние на клетки, его можно использовать в качестве прогностического или диагностического маркера эффективности соединения в способах лечения пациента, который является носителем клеток такого же клеточного типа. Термин "лечение", используемый в настоящем описании в контексте лечения состояния, относится, в целом, к лечению и терапии человека или животного (например, в области ветеринарии), при котором достигается определенный желаемый терапевтический эффект, например подавление прогрессирования состояния, и включает снижение скорости прогрессирования, прекращение прогрессирования, облегчение состояния и излечение состояния. Сюда включается также лечение в качестве профилактической меры (т.е. профилактики). Термин "адъюнкт", используемый в настоящем описании, относится к применению активного соединения в сочетании с терапевтическими средствами. Такие средства включают препараты цитотоксического действия и/или ионизирующее излучение, используемые при лечении раковых заболеваний различного типа. Известно, в частности, что активные соединения усиливают действия ряда противораковых химиотерапевтических препаратов, которые включают яды класса топоизомеразы (например, топотекан, иринотекан, рубитекан), большинство известных алкилирующих агентов (например, DTIC, темозоламид) и препараты на основе платины (например, карбоплатин, цисплатин), применяемые при лечении рака. Активные соединения можно также использовать в качестве добавок к клеточным культурам для ингибирования ПАРП, например, с целью повышения чувствительности клеток к известным химиотерапевтическим агентам или к действию ионизирующего излучения в искусственных условиях. Активные соединения можно использовать также в качестве компонента для анализа в искусственных условиях, например, для определения потенциальной эффективности лечения соответствующим соединением кандидата-носителя. Введение Активное соединение или фармацевтический состав, содержащий активное соединение, можно вводить субъекту любым удобным способом, системно/периферийно или в область желаемого действия, в частности, но без ограничения, перорально (например, путем проглатывания), локально (в том числе,например, трансдермально, интраназально, окулярно, буккально и сублингвально), пульмонально (например, путем ингаляционной или инсуффляционной терапии, в частности, с помощью аэрозоля, например, через рот или нос), ректально, вагинально, парентерально, например, путем инъекции, в том числе подкожной, внутрикожной, внутримышечной, внутривенной, внутриартериальной, внутрисердечной,внутриободочной, внутрипозвоночной, внутрикапсульной, подкапсульной, подглазничной, внутрибрюшинной, внутритрахеальной, подкутикулярной, внутрисуставной, подпаутинной и подложечной, а также путем имплантации депо, например, подкожно или внутримышечно. Субъект может предствлять собой эукариот, животное, позвоночное животное, млекопитающее,грызуна (например, морскую свинку, хомяка, крысу, мышь), представителя семейства мышиных (например, мышь), представителя семейства псовых (например, собаку), представителя семейства кошачьих,(например, кошку), представителя семейства лошадиных (например, лошадь), примата, обезьяну (например, представителя семейства мартышкообразных или человекообразных), мартышкообразную обезьяну(например, мартышку или бабуина), человекообразную обезьяну (например, гориллу, шимпанзе, орангутанга, гиббона) или человека. Лекарственные препараты Активное соединение можно вводить отдельно, однако, предпочтительно применять его в виде фармацевтического состава (например, в виде лекарственного препарата), содержащего по меньшей мере одно активное соединение, как указано выше, совместно с одним или несколькими фармацевтически допустимыми носителями, адъювантами, наполнителями, разбавителями, присадками, буферами, стабилизаторами, консервантами, скользящими веществами или другими материалами, хорошо известными специалистам, и возможно с другими терапевтическими или профилактическими агентами. Кроме того, согласно настоящему изобретению предложены фармацевтические составы, как указано выше, и способы получения фармацевтического состава, включающие смешивание по меньшей мере одного активного соединения, как указано выше, с одним или несколькими фармацевтически допустимыми носителями, наполнителями, буферами, адъювантами, стабилизаторами или другими материалами согласно настоящему описанию. Термин "фармацевтически допустимый", используемый в настоящем описании, относится к соединениям, материалам, составам и/или лекарственным препаратам, которые в соответствии с объективным медицинским заключением являются пригодными для применения в контакте с тканями субъекта (например, человека) без чрезмерной токсичности, раздражения, аллергической реакции или других проблем или осложнений, соразмерно с разумным соотношением между пользой и риском. Все носители,наполнители и т.д. должны быть также "допустимыми" с точки зрения совместимости с другими ингредиентами состава. Пригодные носители, разбавители, наполнители и т.д. описаны в стандартной фармацевтическойedition, pub. Lippincott, WilliamsWilkins, 2000 и "Handbook of Pharmaceutical Excipients", 2nd edition,1994. Лекарственные препараты удобно поставлять в виде дозированных форм, которые можно получать любыми способами, хорошо известными специалистам в области фармацевтики. Такие способы включают операцию смешивания активного соединения с носителем, который состоит из одного или нескольких вспомогательных ингредиентов. Как правило, лекарственные препараты получают путем равномерного и тесного перемешивания активного соединения с жидкими носителями, или с тонкоизмельченными твердыми носителями, или с теми и другими, а затем, если требуется, формуют продукт. Лекарственные препараты могут иметь форму жидкостей, растворов, суспензий, эмульсий, эликсиров, сиропов, таблеток, пастилок, гранул, порошков, капсул, облаток, пилюль, ампул, свечей, пессариев,притираний, мазей, гелей, паст, кремов, спреев, распыляемых составов, лосьонов, масел, болюсов, электуариев или аэрозолей. Лекарственные препараты, пригодные для перорального введения (например, путем проглатывания), могут быть получены в форме дискретных элементов, в частности капсул, облаток или таблеток,каждая из которых содержит определенную дозу активного соединения, а также в форме порошка или гранул, раствора или суспензии в водной или неводной жидкости, жидкой эмульсии типа "масло в воде" или "вода в масле", болюса, электуария или пасты. Таблетку можно получить обычными способами, например прессованием или литьем, возможно с одним или несколькими дополнительными ингредиентами. Прессованные таблетки можно получить путем прессования в соответствующей машине активного соединения в сыпучей форме, в частности в форме порошка или гранул, возможно смешанных с одним или несколькими связующими (например, повидон, желатин, гуммиарабик, сорбит, трагакант, гидроксипропилметилцеллюлоза), наполнителями или разбавителями (например, лактоза, микрокристаллическая целлюлоза, гидрофосфат кальция), скользящими веществами (например, стеарат магния, тальк, кремнезем), дезинтеграторами (например, крахмальный гликолят натрия, сшитый повидон, сшитая натрийкарбоксиметилцеллюлоза), поверхностноактивными, диспергирующими или смачивающими агентами (например, натрийлаурилсульфат) и консервантами (например, метил-р-оксибензоат, пропил-р-гидроксибензоат, сорбиновая кислота). Литые таблетки можно получить путем литья в соответствующей машине смеси порошкообразного соединения,увлажненной инертным жидким разбавителем. Таблетки могут иметь покрытие или рифление, а также могут иметь состав, обеспечивающий медленное или контролируемое выделение активного соединения,например, с использованием гидроксипропилметилцеллюлозы в различных соотношениях, чтобы получить желаемый профиль выделения. На таблетки можно нанести энтеросолюбильную оболочку, которая обеспечивает выделение активного вещества в кишечнике, а не в желудке. Лекарственные препараты, пригодные для местного введения (например, трансдермального, интраназального, окулярного, буккального и сублингвального), могут быть получены в форме мази, крема,суспензии, лосьона, порошка, раствора, пасты, геля, спрея, аэрозоля или масла. Альтернативно, лекарственная форма может включать накладку или повязку, в частности бандаж или клейкий пластырь, пропитанный активными соединениями, и возможно одним или несколькими наполнителями или разбавителями. Лекарственные формы, пригодные для местного введения в рот, включают облатки, содержащие активное соединение во вкусовой основе, обычно в сахарозе и гуммиарабике или трагаканте, пастилки,содержащие активное соединение в инертной основе, в частности в желатине и глицерине или сахарозе и гуммиарабике, и растворы для полоскания полости рта, содержащие активное соединение в подходящем жидком носителе. Лекарственные формы, пригодные для местного введения в глаз, включают глазные капли, в которых активное соединение растворяют или диспергируют в пригодном носителе, в частности в водном растворителе активного соединения. Лекарственные формы с твердым носителем, пригодные для назального введения, включают крупный порошок, имеющий размер частиц, в частности, в пределах примерно от 20 до примерно 500 мкм,который вводят при вдыхании носом, т.е. путем быстрой ингаляции через носовой проход из контейнера с порошком, который держат близко к носу. Пригодные лекарственные формы для введения в нос с жидким носителем, в частности спрей, капли или аэрозоль, вводимый пульверизатором, содержат водные или масляные растворы активного соединения. Лекарственные формы, пригодные для введения путем ингаляции, включают аэрозольные спреи,вводимые из контейнера под давлением с помощью соответствующего газа-вытеснителя, в частности дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или других пригодных газов. Лекарственные формы, пригодные для местного введения через кожу, включают мази, кремы и эмульсии. При введении в мазь активное соединение можно использовать с парафиновой или смешивающейся с водой основой мази. Альтернативно, активные соединения можно вводить в крем с основой типа масло-в-воде. Если требуется, водная фаза кремовой основы может включать, например, по мень- 17009469 шей мере около 30 мас.% многоатомного спирта, т.е. спирта, содержащего две или более гидроксильные группы, в частности пропиленгликоля, бутан-1,3-диола, маннитола, сорбита, глицерина, полиэтиленгликоля и их смесей. Местные лекарственные формы могут включать соединения, которые усиливают абсорбцию или проникновение активного соединения через кожу или другие пораженные участки. Примеры таких дермальных усилителей проникновения включают диметилсульфоксид и его аналоги. В случае эмульсии для местного введения масляная фаза может содержать только один эмульгатор(иначе называемый эмульгентом) или смесь по меньшей мере одного эмульгатора с жиром или маслом или одновременно с жиром и маслом. Предпочтительно гидрофильный эмульгатор включают в состав совместно с липофильным эмульгатором, который действует как стабилизатор. Предпочтительно также включать в состав масло и жир. Эмульгаторы совместно со стабилизаторами или без них образуют так называемый эмульгирующий воск, который, в свою очередь, совместно с маслом и/или жиром образует так называемую эмульгирующую основу мази, создающую масляную дисперсную фазу кремового препарата. Пригодные эмульгаторы и стабилизаторы эмульсий включают Tween 60, Span 80, цетостеариловый спирт, миристиловый спирт, глицерилмоностеарат и натрийлаурилсульфат. Выбор пригодных масел или жиров для лекарственной формы зависит от желаемых косметических свойств, поскольку растворимость активного соединения в большинстве масел, используемых в эмульсиях для фармацевтических составов,может быть очень низкой. При этом крем предпочтительно должен быть не жирным, не образующим пятнистого покрытия и смываемым продуктом с пригодной консистенцией, чтобы исключить вытекание из тюбиков и других контейнеров. Для этого можно использовать одно- или двухосновные алкильные сложные эфиры с прямой или разветвленной цепью, в частности диизоадипат, изоцетилстеарат, пропиленгликолевый сложный эфир двухосновных жирных кокосовых кислот, изопропилмиристат, децилолеат, изопропилпальмитат, бутилстеарат, 2-этилгексилпальмитат или смесь сложных эфиров с разветвленной цепью, известных как Crodamol CAP, при этом три последних сложных эфира являются предпочтительными. Их можно использовать отдельно или в сочетании, в зависимости от требуемых свойств. Альтернативно, можно использовать липиды с высокой точкой плавления, в частности белый мягкий парафин и/или липидный парафин или другие минеральные масла. Лекарственные формы, пригодные для ректального введения, могут быть представлены свечой с пригодной основой, содержащей, например, масло какао или салицилат. Лекарственные формы, пригодные для вагинального введения, могут быть представлены пессариями, тампонами, кремами, гелями, пастами, пенами или спреями, которые кроме активного соединения содержат подходящие носители, известные специалистам. Лекарственные формы, пригодные для парентерального введения (например, путем инъекции,включая кожную, подкожную, внутримышечную, внутривенную и интрадермальную), включают водные и неводные изотонические непирогенные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, консерванты, стабилизаторы, бактериостаты и растворенные вещества, которые обеспечивают изотоничность состава с кровью преполагаемого реципиента, а также водные и неводные стерильные суспензии, которые могут содержать суспендирующие агенты и загустители, а также липосомы или другие системы микрочастиц, которые предназначены для введения соединения в компоненты крови или в один или несколько органов. Примеры изотонических носителей, пригодных для применения в таких лекарственных формах, включают раствор для инъекций хлорида натрия, раствор Рингера или лактат Рингера для инъекций. Типичная концентрация активного соединения в растворе составляет примерно от 1 нг/мл до примерно 10 мкг/мл, в частности примерно от 10 нг/мл до примерно 1 мкг/мл. Лекарственные формы в количестве одной или нескольких доз могут содержаться в герметичных контейнерах, например в ампулах и флаконах, и могут храниться в сублимированном (лиофилизованном) состоянии, требуя добавления только стерильного жидкого носителя, например воды для инъекций, непосредственно перед применением. Растворы для инъекции и суспензии, предназначенные для немедленного применения, можно приготовить из стерильных порошков, гранул и таблеток. Лекарственные препараты могут иметь форму липосом или других систем микрочастиц, которые предназначены для введения соединения в компоненты крови или в один или несколько органов. Дозирование Следует понимать, что соответствующее дозирование активных соединений и составов, содержащих активные соединения, может изменяться от пациента к пациенту. Определение оптимальной дозы в общем случае связано с уравновешиванием уровня терапевтической пользы и опасных или вредных побочных эффектов лечения согласно настоящему изобретению. Выбираемый уровень дозы зависит от множества факторов, включая, в частности, но без ограничения, активность конкретного соединения,способ введения, время введения, скорость выделения соединения, длительность лечения, другие лекарства, соединения и/или материалы, применяемые в сочетании, а также возраст, пол, вес, тяжесть заболевания, общее состояние здоровья и историю болезни пациента. Дозу соединения и способ введения, в конечном счете, определяет лечащий врач, однако, в общем случае дозирование должно создать такие локальные концентрации в зоне действия, которые обеспечат желаемый результат, не вызывая существенных вредных или опасных побочных эффектов.- 18009469 Во время курса лечения введение препарата в живой организм можно производить одноразовой дозой, непрерывно или прерывисто (например, отдельными дозами через соответствующие интервалы времени). Способы определения наиболее эффективных путей и доз введения хорошо известны специалистам и зависят от лекарственной формы, применяемой для терапии, цели терапии, целевой клетки, подлежащей воздействию, и субъекта, который подвергается лечению. Одно- или многоразовое введение препарата может выполняться с величиной дозы и в режиме, которые выбирает лечащий врач. В общем случае пригодная доза активного соединения лежит в пределах примерно от 100 мкг до примерно 250 мг на килограмм массы тела субъекта в сутки. Если активное соединение представляет собой соль, сложный эфир, пролекарство и т.п., вводимую дозу рассчитывают на основе исходного соединения, поэтому фактическую массу, подлежащую применению, увеличивают пропорционально. Данные синтеза Общие экспериментальные методы Препаративная высокоэффективная жидкостная хроматография (ВЭЖХ). Образцы очищали в системе массонаправленной очистки Waters с помощью насоса Waters 600 LC,колонки Waters Xterra C18 (5 мкм, 19 мм 50 мм) и масс-спектрометра Micromass ZQ, работающего в режиме электрораспылительной ионизации положительных ионов. Подвижные фазы А (0,1% муравьиной кислоты в воде) и В (0,1% муравьиной кислоты в ацетонитриле) использовали с градиентом 5% В до 100% в течение 7 мин, с выдержкой в течение 3 мин, при скорости потока 20 мл/мин. Аналитическая ВЭЖХ-МС (масс-спектроскопия). Аналитическую ВЭЖХ выполняли с помощью насоса Spectra System P4000 и колонки Jones GenesisC18 (4 мкм, 50 мм 4,6 мм). Подвижные фазы А (0,1 % муравьиной кислоты в воде) и В (ацетонитрил) использовали с градиентом 5% В в течение 1 мин с повышением до 98% В в течение 5 мин, с выдержкой в течение 3 мин при скорости потока 2 мл/мин. Определение производили с помощью детектора TSP UV 6000LP при 254 нм УФ и в диапазоне 210-600 нм PDA. Масс-спектрометр: Finnigan LCQ, работающий в режиме электрораспыления положительных ионов. Ядерный магнитный резонанс (ЯМР). ЯМР 1 Н и ЯМР 13 С записывали с помощью спектрометра Bruker DPX 300 при 300 и 75 МГц, соответственно. Химические сдивиги выражали в частях на миллион (ppm) по -шкале относительно тетраметилсиланового внутреннего стандарта. Если не указано иного, все образцы растворяли в DMSO-d6. Синтез ключевых промежуточных соединений. а. 3-(4-Оксо-3,4-дигидрофталазин-1-илметил)бензойная кислота (А). Смесь 27% раствора метоксида натрия в метаноле (400 г, 2 моль) и метанола (150 мл) добавили по каплям при температуре от комнатной до 30C в течение 15 мин в перемешанную смесь фталида (67 г,0,5 моль), 3-формилбензонитрила (65,5 г, 0,5 моль) и этилпропионата (250 мл), смесь перемешали при температуре окружающей среды в течение 40 мин и при температуре флегмы в течение 1 ч, а затем выдержали для охлаждения до температуры окружающей среды. Образовавшийся осадок красного цвета отделили фильтрацией, промыли этилацетатом (250 мл) и растворили в воде (1800 мл). Раствор подкислили добавлением уксусной кислоты (60 мл) и полученный осадок красного цвета отделили фильтрацией, промыли водой (2200 мл) и высушили в вакууме, получив 3-(1,3-диоксоиндан-2-ил)бензонитрил(83,2 г) в форме осадка темно-красного цвета с температурой плавления 179-182C, m/z (M+H)+ 248, который использовали без дальнейшей очистки. 3-(1,3-Диоксоиндан-2-ил)бензонитрил (74,18 г, 0,3 моль) добавили частями в раствор гидроксида натрия (36 г, 0,9 моль) в воде (580 мл), образовавшуюся суспензию темно-красного цвета перемешивали при температуре флегмы в течение 5 ч, затем охладили до температуры окружающей среды и промыли этилацетатом (3300 мл). Водный раствор подкислили добавлением по каплям концентрированной соляной кислоты (110 мл), смесь перемешали при температуре окружающей среды в течение 1 ч, затем обра- 19009469 зовавшийся осадок отделили фильтрацией, промыли водой (2200 мл) и высушили в вакууме, получив смесь 1:1 3-(1,3-диоксоиндан-2-ил)бензойной кислоты, (М+Н)+ 267, и 2-[2-(3-карбоксифенил)ацетил]бензойной кислоты, (М+Н)+ 285, (69.32 г), которую использовали без дальнейшей очистки. Смесь, полученную на предыдущей операции (52,8 г), добавили в раствор триэтиламина (37,55 г,0,372 моль) в промышленном метилированном спирте (500 мл) и образовавшийся мутный раствор профильтровали через фильтровальную подушку, получив прозрачный раствор. Гидразин моногидрат (9,3 г,0,186 моль) добавили в одну порцию при температуре окружающей среды, перемешанную смесь нагревали с обратным холодильником в течение 1 ч, затем ее сконцентрировали в вакууме примерно до 250 мл и добавили в раствор ацетата натрия (41 г, 0,5 моль) в воде (500 мл). Смесь довели до рН 7, добавляя по каплям концентрированную соляную кислоту, затем смесь перемешивали при температуре окружающей среды в течение 3 ч. Образовавшийся осадок отделили фильтрацией, промыли водой (50 мл) и высушили в вакууме, получив порошок белого цвета (15,62 г). Фильтрат, объединенный со смывками, подкислили до рН 6 добавлением соляной кислоты, затем смесь перемешали при температуре окружающей среды в течение 3 ч. Образовавшийся осадок отделили фильтрацией, промыли водой (50 мл) и высушили в вакууме, получив вторую порцию желтоватого порошка (17,57 г). Фильтрат, объединенный со смывками,из второй порции повторно откорректировали до рН 6 и обработали, как указано выше, получив третью порцию светло-оранжевого порошка (6,66 г). Три порции объединили, получив практически чистую 3-(4 оксо-3,4-дигидрофталазин-1-илметил)бензойную кислоту (А), (М+Н)+ 281, H 4,4 (2 Н, s), 7,2-7,4 (1 Н, m),7,5-7,6 (1 Н, m), 7,7-8,0 (5 Н, m), 8,1-8,2 (1 Н, m), 12,6 (1 Н, s). б. 2-Фтор-5-(4-оксо-3,4-дигидрофталазин-1-илметил)бензойная кислота (В). Диметилфосфит (22,0 г, 0,2 моль) добавили по каплям в раствор метоксида натрия (43,0 г) в метаноле (100 мл) при 0C. Затем в реакционную смесь добавили порциями 2-карбоксибензальдегид (21,0 г,0,1 моль) в форме суспензии в метаноле (40 мл), поддерживая температуру ниже 5C. Образовавшийся раствор светло-желтого цвета нагрели до 20C в течение 1 ч. Добавили в реакционную смесь по каплям метансульфоновую кислоту (21,2 г, 0,22 моль) и полученную суспензию белого цвета выпарили в вакууме. Осадок белого цвета залили водой и экстрагировали хлороформом (3100 мл). Объединенные органические экстракты промыли водой (2100 мл), осушили над MgSO4 и выпарили в вакууме, получив сложный диметиловый эфир (3-оксо-1,3-дигидроизобензофуран-1-ил)фосфоновой кислоты в форме порошка белого цвета (32,0 г, 95%, чистота 95%). Затем его использовали на следующей операции без дополнительной очистки. В смесь сложного диметилового эфира (3-оксо-1,3-дигидроизобензофуран-1-ил)фосфоновой кислоты (35,0 г, 0,14 моль) в тетрагидрофуране (200 мл) и 2-фтор-5-формилбензонитрила (20,9 г, 0,14 моль) в тетрагидрофуране (130 мл) добавили по каплям в течение 25 мин триэтиламин (14 мл, 0,14 моль), поддерживая температуру ниже 15C. Реакционную смесь медленно нагрели до 20C в течение 1 ч и сконцентрировали в вакууме. Осадок белого цвета перемешали в воде (250 мл) в течение 30 мин, профильтровали, промыли водой, гексаном и диэтиловым эфиром и высушили, получив 2-фтор-5-(3-оксо-3 Низобензофуран-1-илиденметил)бензонитрил в форме смеси 50:50 изомеров Е и Z (37,2 г, 96 %), m/z[M+1]+ 266 (чистота 98%). В суспензию 2-фтор-5-(3-оксо-3H-изобензофуран-1-илиденметил)бензонитрила в воде (200 мл) добавили водный раствор гидроксида натрия (26,1 г в 50 мл воды) и редакционную смесь нагрели в атмосфере азота до 90C в течение 30 мин. Реакционную смесь частично охладили до 70C, добавили гидразингидрат (100 мл) и перемешивали в течение 18 ч при 70C. Затем реакционную смесь охладили до комнатной температуры и подкислили 2 М HCl до рН 4. Смесь перемешали в течение 10 мин и профильтровали. Образовавшийся осадок промыли водой, гексаном, диэтиловым эфиром, этилацетатом и высушили,получив 2-фтор-5-(4-оксо-3,4-дигидрофталазин-1-илметил)бензойную кислоту в форме светло-розового порошка (30,0 г, 77%), m/z [M+1]+ 299 (чистота 96%), H 4,4 (2 Н, s), 7,2-7,3 (1 Н, m), 7,5-7,6 (1 Н, m), 7,88,0 (4 Н, m), 8,2-8,3 (1 Н, m), 12,6 (1H, s).(12,3 г, 0,32 моль) и N,N,-диизопропилэтиламин (10,0 мл, 0,55 моль) добавили в диметилацетамид (40 мл) и перемешивали в течение 18 ч. Добавили в реакционную смесь воду (100 мл) и экстрагировали продукт дихлорметаном (450 мл). Объединенные органические слои промыли водой (3100 мл), осушили над MgSO4,профильтровали и выпарили в вакууме, получив масло. В раствор масла в тетрагидрофуране (100 мл) добавили 10% водный раствор гидроксида натрия (20 мл) и перемешивали реакционную смесь в течение 18 ч. Затем сконцентрировали реакционную смесь, промыли этилацетатом (230 мл) и подкислили 2 МHCL до рН 2. Водный слой экстрагировали дихлорметаном (2100 мл), затем экстракты осушили надMgSO4, профильтровали и выпарили с получением 1-[3-(4-оксо-3,4-дигидрофталазин-1-илметил)бензоил]пиперидин-4-карбоновой кислоты (С) в форме порошка желтого цвета (7,0 г, 65%), m/z [М+1]+ 392(15 мл) и перемешивали в течение 18 ч. В реакционную смесь добавили воду (100 мл) и экстрагировали продукт дихлорметаном (450 мл). Объединенные органические слои профильтровали, промыли водой(3100 мл), осушили над MgSO4, профильтровали и выпарили в вакууме, получив масло оранжевого цвета. Масло очистили способом флэш-хроматографии (этилацетат), получив 1-[2-фтор-5-(4-оксо-3,4 дигидрофталазин-1-илметил)бензоил]пиперидин-4-карбоновую кислоту в форме сложного метилового эфира (1,5 г, 33%, чистота 96%). В раствор сложного метилового эфира в смеси тетрагидрофурана и воды(2:1, 40 мл) добавили гидроксид натрия (0,3 г, 0,075 моль) и перемешивали реакционную смесь в течение 18 ч. Затем реакционную смесь сконцентрировали, промыли этилацетатом (220 мл) и подкислили 2 МHCl до рН 2. Водный слой экстрагировали дихлорметаном (220 мл), объединенные экстракты осушили над MgSO4 и выпарили, получив 1-[3-(4-оксо-3,4-дигидрофталазин-1-илметил)бензоил]пиперидин-4 карбоновую кислоту (D) в форме порошка желтого цвета (0,6 г, 65 %), m/z [M+1]+ 392 (чистота 96%). Пример 1. Синтез ключевых соединений. а. Синтез 4-[3-(пиперазин-1-карбонил)бензил]-2 Н-фталазин-1-она (1). 3-(4-Оксо-3,4-дигидрофталазин-1-илметил)бензойную кислоту (А) (5,0 г, 0,17 моль), третичный бутил-1-пиперазинкарбоксилат (3,9 г, 0,21 моль), 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний гек- 21009469 сафторофосфат (HBTU) (8,6 г, 0,22 моль) и N,N-диизопропилэтиламин (6,7 мл, 0,38 моль) добавили в диметилацетамид (40 мл) и перемешивали в течение 18 ч. Добавили воду (100 мл) и реакционную смесь нагрели до 100C в течение 1 ч. Суспензию охладили до комнатной температуры, профильтровали и высушили, получив порошок белого цвета. Порошок растворили в растворе 6 М HCl и этанола (2:1, 50 мл) и перемешивали в течение 1 ч. Реакционную смесь сконцентрировали, добавили аммиак до рН 9 и экстрагировали продукт дихлорметаном (250 мл). Объединенные органические слои промыли водой (250 мл),осушили над MgSO4 и выпарили в вакууме, получив 4-[3-(пиперазин-1-карбонил)бензил]-2 Н-фталазин-1 он (1) в форме кристаллического порошка желтого цвета (4,0 г, 77%), m/z [М+1]+ 349 (чистота 97%), H 2,6-3,8 (8 Н, m), 4,4 (2 Н, s), 7,2-7,5 (4 Н, m), 7,7-8,0 (3H, m), 8,2-8,3 (1 Н, m), 12,6 (1H, s). б. Синтез 4-[4-фтор-3-(пиперазин-1-карбонил)бензил]-2 Н-фталазин-1-она (2). Синтез проводили способом, описанным выше в п.(а), с использованием 2-фтор-5-(4-оксо-3,4-дигидрофталазин-1-илметил)бензойной кислоты (В), получив 4-[4-фтор-3-(пиперазин-1-карбонил)бензил]2 Н-фталазин-1-он (2) в форме кристаллического порошка белого цвета (4,8 г, 76%), m/z [М+1]+ 367 (чистота 97%), H 2,6-3,8 (8 Н, m), 4,4 (2 Н, s), 7,2-7,5 (3H, m), 7,7-8,0 (3H, m), 8,2-8,3 (1 Н, m), 12,6 (1 Н, s). в. Синтез 4-[3-([1,4]диазепан-1-карбонил)бензил]-2 Н-фталазин-1-она (3). Синтез проводили способом, описанным выше в п.(а), с использованием 3-(4-оксо-3,4-дигидрофталазин-1-илметил)бензойной кислоты (А) и третичного бутил-1-гомопиперазинкарбоксилата, получив 4[3-([1,4]-диазепан-1-карбонил)бензил]-2 Н-фталазин-1-он (3) в форме кристаллического порошка серого цвета (5,3 г, 97%), m/z [М+1]+ 363 (чистота 97%), H 2,6-3,8 (10 Н, m), 4,4 (2 Н, s), 7,2-7,5 (4 Н, m), 7,7-8,0 Синтез проводили способом, описанным выше в п.(а), с использованием 2-фтор-5-(4-оксо-3,4 дигидрофталазин-1-илметил)бензойной кислоты (В) и третичного бутил-1-гомопиперазинкарбоксилата,получив 4-[3-([1,4]диазепан-1-карбонил)бензил]-2 Н-фталазин-1-он (4) в форме кристаллического порошка желтого цвета (5,3 г, 68 %), m/z [М+1]+ 381 (чистота 97%), H 2,6-3,8 (10 Н, m), 4,4 (2 Н, s), 7,2-7,5 (3H,m), 7,7-8,0 (3H, m), 8,2-8,3 (1 Н, m), 12,6 (1H, s). Пример 2. а. 4-3-[4-(6-Хлоробензотиазол-2-ил)-1,4-диазепан-1-илкарбонил]бензил-1(2 Н)-фталазинон.- 22009469 2-(1 Н-Бензотриазол-1-ил)-1,1,3,3-тетраметилуроний тетрафтороборат (150 мг, 0,47 ммоль), диизопропилэтиламин (102 мг, 0,8 ммоль) и 6-хлоро-2-(1,4-диазепан-1-ил)-1,3-бензотиазол (115 мг, 0,43 ммоль) последовательно добавили при температуре окружающей среды в перемешанный раствор 3-(4-оксо-3,4 дигидрофталазин-1-илметил)бензойной кислоты (А) (100 мг, 0,36 ммоль) в обезвоженном диметилацетамиде (1 мл), смесь перемешали при температуре окружающей среды в течение 1 ч и выдержали при температуре окружающей среды в течение 16 ч, а затем добавили ее по каплям в перемешиваемую холодную воду (10 мл). Через 30 мин образовавшийся осадок отделили фильтрацией, промыли водой (21 мл) и гексаном (1 мл), высушили в вакууме и очистили с помощью препаративной ВЭЖХ, получив желаемое соединение (5) (166 мг) в форме порошка серого цвета, чистота ВЭЖХ 90%, время удерживания (ВУ) ВЭЖХ 4,21 мин, m/z (М+Н)+ 530. б. Следующие соединения синтезировали способом, аналогичным описанному выше в п.(а), однако,использовали соответствующие альтернативные исходные аминные материалы. Примечание 1. Соединение 13 не требовало очистки с помощью препаративной ступенчатой ВЭЖХ продукт реакции был практически чистым. 2-(1 Н-Бензотриазол-1-ил)-1,1,3,3-тетраметилуроний тетрафтороборат (150 мг, 0,47 ммоль), диизопропилэтиламин (102 мг, 0,8 ммоль) и 1-(4-фторфенил)пиперазин (65 мг, 0,47 ммоль) добавили последовательно при температуре окружающей среды в перемешанный раствор 3-(4-оксо-3,4-дигидрофталазин 1-илметил)бензойной кислоты (А) (100 мг, 0,36 ммоль) в обезвоженном диметилацетамиде (1 мл), смесь перемешали при температуре окружающей среды в течение 4 ч и выдержали при температуре окружающей среды в течение 16 ч, затем добавили ее по каплям в перемешиваемую холодную воду (10 мл). Через 30 мин образовавшийся осадок отделили фильтрацией, промыли водой (21 мл) и гексаном (1 мл), высушили в вакууме и очистили с помощью препаративной ВЭЖХ, получив 4-3-[4-(4-фторфенил)пиперазин-1-илкарбонил]бензил-1(2 Н)-фталазинон (22) (76 мг) в форме порошка кремового цвета, m/z (M+H)+ 443, чистота ВЭЖХ 90%, время удерживания ВЭЖХ 4,00 мин. б. Следующие соединения синтезировали способом, аналогичным описаннму выше в п.(а), однако,использовали соответствующие альтернативные исходные аминные материалы. Примечание 2. Соединение 36 не требовало очистки с помощью препаративной ступенчатой ВЭЖХ продукт реакции был практически чистым. Пример 4. 1-[3-(4-Оксо-3,4-дигидрофталазин-1-илметил)бензоил]пиперидин-4-карбоновую кислоту (С) (0,24 ммоль) добавили в раствор соответствующего амина (0,2 ммоль) в диметилацетамиде (2 мл). Затем добавили 2(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторофосфат (0,3 ммоль) и основание Ханигса(диизопропилэтиламин) (0,4 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение 16 ч. После этого очистили реакционные смеси с помощью препаративной ВЭЖХ. Синтезированные соединения указаны ниже.(0,24 ммоль) добавили в раствор соответствующего амина (0,2 ммоль) в диметилацетамиде (2 мл). Затем добавили 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторофосфат (0,3 ммоль) и основание Ханигса (диизопропилэтиламин) (0,4 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение 16 ч. После этого очистили реакционные смеси с помощью препаративной ВЭЖХ. Синтезированные соединения указаны ниже.- 28009469 Пример 6. Соответствующий сульфонилхлорид (0,24 ммоль) добавили в раствор 4-[3-(пиперазин-1-карбонил) бензил]-2 Н-фталазин-1-она (1) (0,2 ммоль) в дихлорметане (2 мл). Затем добавили основание Ханигса(0,4 ммоль) и перемешивали реакционные смеси при комнатной температуре в течение 16 ч. После этого очистили реакционные смеси с помощью препаративной ВЭЖХ. Синтезированные соединения указаны ниже. Пример 7. Соответствующий сульфонилхлорид (0,24 ммоль) добавили в раствор 4-[3-([1,4]диазепан-1-карбонил)бензил]-2 Н-фталазин-1-она (3) (0,2 ммоль) в дихлорметане (2 мл). Затем добавили основание Ханигса (0,4 ммоль) и перемешивали реакционные смеси при комнатной температуре в течение 16 ч. После этого очистили реакционные смеси с помощью препаративной ВЭЖХ. Синтезированные соединения указаны ниже.- 29009469 Пример 8. Соответствующий кислый хлорид (0,24 ммоль) добавили в раствор 4-[3-(пиперазин-1-карбонил) бензил]-2 Н-фталазин-1-она (1) (0,2 ммоль) в дихлорметане (2 мл). Затем добавили основание Ханигса(0,4 ммоль) и перемешивали реакционные смеси при комнатной температуре в течение 16 ч. После этого очистили реакционные смеси с помощью препаративной ВЭЖХ. Синтезированные соединения указаны ниже.
МПК / Метки
МПК: C07D 401/12, C07D 237/32, C07D 409/12, C07D 407/12, C07D 413/12, C07D 417/12, A61P 31/20, A61K 31/502, C07D 403/12
Метки: фталазинона, производные
Код ссылки
<a href="https://eas.patents.su/30-9469-proizvodnye-ftalazinona.html" rel="bookmark" title="База патентов Евразийского Союза">Производные фталазинона</a>
Предыдущий патент: Производные пиперидинил- и пиперазинил- алкилкарбаматов, способы их получения и применение их в терапии
Следующий патент: Способ разработки нефтяных залежей
Случайный патент: Применение блок-сополимера простого полиэфира и полиамида в ротационном формовании или формовании полых изделий заливкой с медленным вращением формы