Производные фталазинона
Номер патента: 6300
Опубликовано: 27.10.2005
Авторы: Эверсли Пенни Джэйн, Смит Граем Камерон Мюрей, Вайт Чарлс Ричард, Дуглас Диана Джилиан, Вайл Джулия, Ньютон Роджер Франк, Мартин Найл Моррисон Бар
Формула / Реферат
1. Применение соединения формулы
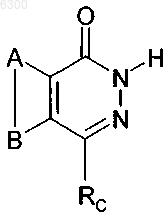
а также его изомеров, солей, сольватов, химически защищенных форм и предшественников, для получения медикамента, ингибирующего активность PARP,
где A и B совместно представляют возможно замещенное конденсированное бензольное кольцо,
Rc представляет собой -CH2-Rl, -CH2CH2-Rl, или -CH2SRl; а RL является возможно замещенной ариловой группой C6.
2. Применение соединения формулы
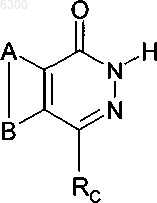
а также его изомеров, солей, сольватов, химически защищенных форм и предшественников, для получения медикамента, используемого в качестве адъюнкта в терапии рака,
где A и B совместно представляют возможно замещенное конденсированное бензольное кольцо,
Rc представляет собой -CH2-RL, -CH2CH2-RL или -CH2SRL; а
RL является возможно замещенной ариловой группой C6.
3. Применение по п.2, отличающееся тем, что адъюнкт предназначен для применения в сочетании с ионизирующим излучением.
4. Применение по п.2, отличающееся тем, что адъюнкт предназначен для применения в сочетании с химиотерапевтическими агентами.
5. Применение по любому из пп.1-4, отличающееся тем, что конденсированное бензольное кольцо является незамещенным.
6. Применение по любому из пп.1-5, отличающееся тем, что RL содержит один или несколько заместителей, которые выбраны из группы, включающей алкил C1-7, арил C5-20, гетероциклил C3-20, гало, гидрокси, эфир, нитро, циано, карбонильные группы, амино, ациламидо, ацилокси, тиол, тиоэфир, сульфоксид и сульфонгруппу.
7. Применение по п.6, отличающееся тем, что Rl содержит заместитель, который выбран из группы, включающей ациламидо, уреидо, сульфонамино и ацилоксигруппу.
8. Фармацевтический состав, содержащий соединение формулы
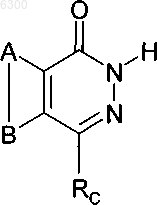
его изомеры, соли, сольваты, химически защищенные формы и предшественники,
где A и B совместно представляют возможно замещенное конденсированное бензольное кольцо,
Rc имеет формулу -CH2-RL, RL - возможно замещенный фенил, а также фармацевтически допустимый носитель или разбавитель.
9. Фармацевтический состав по п.8, отличающийся тем, что конденсированное бензольное кольцо является незамещенным.
10. Фармацевтический состав по пп.8-9, отличающийся тем, что RL содержит один или несколько заместителей, которые выбранны из группы, включающей алкил C1-7, арил C5-20, гетероциклил C3-20, гало-, гидрокси-, эфир, нитро-, циано-, карбонильные группы, амино-, ациламидо-, ацилокси-, тиол, тиоэфир, сульфоксид- и сульфонгруппу.
11. Фармацевтический состав по п.10, отличающийся тем, что RL содержит заместитель, который выбран из группы, включающей ациламидо-, уреидо-, сульфонамино- и ацилоксигруппу.
12. Соединение формулы
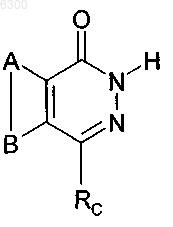
а также его изомеры, соль, сольват, химически защищенная форма и предшественники,
где A и B совместно представляют возможно замещенное конденсированное бензольное кольцо,
Rc имеет формулу -CH2-Rl,
RL - возможно замещенный фенил,
для применения в способе лечения человека или животного.
13. Соединение по п.12, отличающееся тем, что конденсированное бензольное кольцо является незамещенным.
14. Соединение по пп.12-13, отличающееся тем, что RL содержит один или несколько заместителей, которые выбраны из группы, включающей алкил C1-7, арил C5-20, гетероциклил C3-20, гало-, гидрокси-, эфир, нитро-, циано-, карбонильные группы, амино-, ациламидо-, ацилокси-, тиол-, тиоэфир-, сульфоксид- и сульфонгруппу.
15. Соединение по п.14, отличающееся тем, что RL содержит заместитель, который выбран из группы, включающей ациламидо-, уреидо-, сульфонамино- и ацилоксигруппу.
16. Соединение формулы
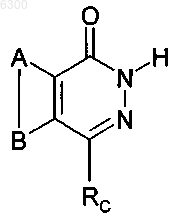
а также его изомеры, соль, сольват, химически защищенная форма и предшественники,
где A и B совместно представляют возможно замещенное конденсированное бензольное кольцо,
Rc имеет формулу -CH2-RL, Rl - фенил, замещенный заместителем, который выбран из группы, включающей гетероциклил C3-20, C5-20 арил, простой эфир, амидогруппу, циано группу, SO2R, где R представляет собой гетероциклил C3-20, C5-20 арил или C1-7 алкил, сложный тиоэфир, тиол, сульфоксид, уреидо, сульфонамино, ацилокси, и возможно содержащий другие заместители.
17. Соединение по п.16, отличающееся тем, что Rl имеет заместитель, выбранный из группы, включающей уреидо-, сульфонамидо- и ацилоксигруппу.
Текст
006300 Настоящее изобретение относится к производным фталазинона и их применению в качестве фармацевтических средств. В частности, настоящее изобретение относится к применению этих соединений для подавления активности фермента поли(ADP(adenosine diphosphate, аденозин дифосфат)рибозы) полимеразы, известной также как поли(АDР-рибоза)синтаза и поли ADP-рибосилтрансфераза и обычно называемой PARP (поли ADP рибоза полимераза). Фермент млекопитающих PARP (мультидоменный протеин с молекулярной массой 113 кДа) участвует в сигнализации нарушения ДНК, благодаря его способности распознавать и быстро присоединяться к обрывам одинарной или двойной цепи ДНК (D'Amours et al., 1999, Biochem. J. 342: 249-268). Некоторые наблюдения привели к заключению, что PARP участвует во множестве функций, связанных с ДНК, включая генную амплификацию, клеточное деление, дифференциацию, апоптоз, восстановление основного вырезания ДНК, а также оказывает влияние на длину теломеров и хромосомную устойчивость (d'Adda di Fagagna et al., 1999, Nature Gen., 23(1): 76-80). Исследования механизма, по которому PARP модулирует восстановление ДНК и другие процессы,показали ее важность для образования цепей поли(ADP-рибозы) в ядре клетки (Althaus, F.R. and Richter,С, 1987, ADP-Ribosylation of Proteins: Enzymology and Biological Significance, Springer-Verlag, Berlin). Связанная с ДНК активированная PARP использует NAD (никотинамиддинуклеотид) для синтеза поли(АDР-рибозы) на множестве ядерных белков-мишеней, включая топоизомеразу, гистоны и непосредственно PARP (Rhun et al., 1998, Biochem. Biophys. Res. Commun., 245:1-10). Поли-АDР-рибосиляцию также связывают со злокачественной трансформацией. Так, например, активность PARP выше в выделенных ядрах трансформированных фибробластов SV-40, в то время как лейкемические клетки и раковые клетки толстой кишки проявляют более высокую ферментную активность, чем эквивалентные нормальные лейкоциты и слизистая оболочка толстой кишки (Miwa et al.,1977, Arch. Biochem. Biophys. 181: 313-321; Burzio et al., 1975, Proc. Soc. Exp. Bioi. Med. 149: 933-938; andHirai et al., 1983, Cancer Res. 43: 3441-3446). Ряд ингибиторов PARP с низкой молекулярной массой использовали для выяснения роли полиАDР-рибозиляции при восстановлении ДНК. В клетках, обработанных алкилирующими агентами, ингибирование PARP приводит к заметному увеличению обрывов нитей ДНК и уничтожению клеток(Durkacz et al., 1980, Nature 283: 593-596; Berger, N.A., 1985, Radiation Research, 101: 4-14). В результате такие ингибиторы показали усиление реакции на облучение, вызывающей подавление восстановления потенциально летального нарушения (Ben-Hur et al., 1984, British Journal of Cancer, 49(Suppl. VI): 34-42; Schlicker et al., 1999, Int. J. Radiat. Bioi., 75: 91-100). Сообщается об эффективности ингибиторов PARP в повышении чувствительности к радиоактивному облучению гипоксических опухолевых клеток (US 5,032,617; US 5,215,738 и US 5,041,653). Кроме того, животные, лишенные PARP (PARP -/-), проявляют геномную неустойчивость по отношению к алкилирующим агентам и -излучению (Wang et al., 1995, Genes Dev., 9: 509-520; Menissier deMurcia et al., 1997, Proc. Natl. Acad. Sci. USA, 94: 7303-7307). Показана также роль PARP в определенных сосудистых заболеваниях, септическом шоке, ишемической болезни и нейротоксичности (Cantoni et al., 1989, Biochim. Biophys. Acta, 1014: 1-7; Szabo, et al.,1997, J. Clin.lnvest., 100: 723-735). Повреждение кислородных радикалов ДНК, которое приводит к обрывам цепей ДНК, распознаваемым PARP, вносит основной вклад в эти болезненные состояния, как показали исследования с применением ингибиторов PARP (Cosi et al., 1994, J. Neurosci. Res., 39: 38-46; Said etal., 1996, Proc. Natl. Acad. Sci. U.S.A., 93: 4688-4692). Позднее было показано, что PARP играет определенную роль в патогенезе геморрагического коллапса (Liaudet et al., 2000, Proc. Natl. Acad. Sci. U.S.A.,97(3): 10203-10208). Продемонстрировано также, что эффективная ретровирусная инфекция клеток млекопитающих блокируется подавлением активности PARP. Было показано, что такое подавление рекомбинантных ретровирусных векторных инфекций происходит в различных типах разных клеток (Gaken et al., 1996, J.Virology, 70(6): 3992-4000). Поэтому были разработаны ингибиторы PARP для применения в антивирусной терапии и при лечении рака (WO 91/18591). Кроме того, высказывались предположения о том, что ингибирование PARP задерживает появление характеристик старения фибропластов человека (Rattan and Clark, 1994, Biochem. Biophys. Res. Comm.,201 (2): 665-672). Это можно объяснить ролью PARP в регулировании функции теломеров (d'Adda di Fagagna et al., 1999, Nature Gen., 23(1): 76-80). Патент US 5,874,444 описывает ряд ингибиторов PARP, среди которых имеется 1(2 Н)-фталазинон Авторы настоящего изобретения установили, что определенные производные 1(2H)-фталазинона и родственные им соединения ингибируют активность PARP.-1 006300 В соответствии с этим согласно первому аспекту изобретения предложено применение соединений формулы а также их изомеров, солей, сольватов, химически защищенных форм и пролекарств для получения медикамента, ингибирующего активность PARP, где А и В совместно представляют, возможно замещенное, конденсированное ароматическое кольцо,Rc представляет собой -L-RL, где L имеет формулу-(СН 2)n1 -Оn2-(СН 2)n3 где n1, n2 и n3, каждый независимо, выбран из 0, 1, 2 и 3; сумма n1, n2 и n3 равна 1, 2 или 3, a Q выбран из группы, включающей О, S, NH, С(=О) или -CR1R2-, где R1 и R2 выбраны независимо из группы, включающей водород, галоген или, возможно, замещенный алкил C1-7, или вместе с атомом углерода, к которому они присоединены, могут образовывать циклическую алкиловую группу С 3-7, которая может быть насыщенной (циклоалкиловая группа С 3-7) или ненасыщенной (циклоалкениловая группа С 3-7), или один из радикалов R1 и R2 может быть присоединен к одному из атомов в RL, образуя ненасыщенную циклоалкениловую группу С 3-7, содержащую атомы углерода, к которым присоединены R1 и R2 в Q, -(СН 2)n3(если присутствует) и часть RL,RL является возможно замещенным арилом С 5-20, аRN выбран из группы, включающей водород, возможно замещенный алкил C1-7) гетероциклил С 3-20,и арил С 5-20, гидроксил, эфир, нитро, амино, амидо, тиол, тиоэфир, сульфоксид и сульфон. Согласно второму аспекту настоящего изобретения, предложены соединения формулы а также их изомеры, соли, сольваты, химически защищенные формы и пролекарства, где А и В совместно представляют возможно замещенное конденсированное ароматическое кольцо,Rc представляет собой -CH2-RL;RN - водород. Третий аспект настоящего изобретения относится к фармацевтическому составу, содержащему соединение согласно второму аспекту, а также фармацевтически допустимый носитель или разбавитель. Четвертый аспект настоящего изобретения относится к применению соединения согласно второму аспекту в способе лечения человека или животного. Согласно другим аспектаам изобретения, предоложено применение соединений, определенных в первом аспекте изобретения, для получения медикамента, предназначенного для лечения сосудистых заболеваний, септического шока, ишемической болезни, нейротоксичности, геморрагического коллапса,вирусной инфекции или заболеваний, течение которых облегчается путем ингибирования активностиPARP. Согласно еще одному аспекту изобретения, предложено применение соединений, определенных в первом аспекте изобретения, для получения медикамента, предназначенного для использования в качестве адъюнкта в раковой терапии или для потенцирования опухолевых клеток при лечении ионизирующим излучением или химиотерапевтическими агентами. На фиг. 1-19 показаны соединения согласно настоящему изобретению. Определения Термин "ароматическое кольцо" используется в настоящем описании в обычном смысле и относится к циклической ароматической структуре, т.е. к циклической ароматической структуре, содержащей орбиты делокализованных тт-электронов. Ароматическое ядро, слитое с главным ядром, т.е. образованное -А-В-, может содержать другие конденсированные ароматические кольца (образуя, например, нафтиловые или антрацениловые группы). Ароматические кольца могут содержать только углеродные атомы или атомы углерода и один или несколько гетероатомов, включая без ограничения атомы азота, кислорода и серы. Ароматические кольца предпочтительно содержат пять или шесть атомов в кольце. Ароматические кольца могут быть замещенными. Если сам заместитель содержит ариловую группу, эта ариловая группа не считается частью ариловой группы, к которой он присоединен. Так, например,группа бифенила считается при этом фениловой группой (ариловой группой, содержащей одно ароматическое кольцо), замещенной фениловой группой. Аналогично этому группа бензилфенила считается фе-2 006300 ниловой группой (или ариловой группой, содержащей одно ароматическое кольцо), замещенной бензиловой группой. В одной группе предпочтительных вариантов реализации ароматическая группа содержит одно ароматическое кольцо, в котором имеется пять или шесть атомов, при этом указанные атомы кольца выбирают из группы включающей углерод, азот, кислород и серу, а указанное кольцо может быть замещенным. Примеры таких групп включают бензол, пиразин, пиррол, тиазол, изоксазол и оксазол. 2-Пирон также можно рассматривать как ароматическое кольцо, однако, он является менее предпочтительным. Если ароматическое кольцо содержит шесть атомов, то предпочтительно по меньшей мере четыре,или пять, или все шесть атомов кольца являются атомами углерода. Другие атомы кольца выбирают из группы, включающей азот, кислород и серу, при этом азот и кислород являются предпочтительными. Пригодные группы включают кольцо: без гетероатомов (бензол), с одним атомом азота (пиридин), с двумя атомами азота (пиразин, пиримидин и пиридазин), с одним атомом кислорода (пирон), а также с одним атомом кислорода и одним атомом азота (оксазин). Если ароматическое кольцо содержит пять атомов, то предпочтительно по меньшей мере три из них являются атомами углерода. Остальные атомы кольца выбирают из группы, включающей азот, кислород и серу. Пригодные кольца включают кольцо: с одним атомом азота (пиррол), с двумя атомами азота(имидазол, пиразол), с одним атомом кислорода (фуран), с одним атомом серы (тиофен), с одним атомом азота и одним атомом серы (тиазол), а также с одним атомом азота и одним атомом кислорода (изоксазол или оксазол). Ароматическое кольцо может содержать одну или несколько замещающих групп в любой позиции кольца. Такие заместители выбирают из группы, включающей гало, нитро, гидрокси, эфир, тиол, тиоэфир, амино алкил C1-7, гетероциклил С 3-20 и арил С 5-20. Ароматическое кольцо может также содержать одну или несколько замещающих групп, которые совместно образуют кольцо. В частности, они могут иметь формулу -(CH2)m- or -О-(СН 2)р-О-, где m равно 2, 3, 4 или 5, а р равно 1, 2 или 3. Алкил C1-7: термин "аклилС 1-7", используемый в настоящем описании относится к одновалентной группе, полученный путем удаления водорода из углеводородного соединения C1-7, содержащего от 1 до 7 атомов углерода, которое может быть алифатическим или алициклическим или представлять собой их сочетание, а также может быть насыщенным, частично ненасыщенным или полностью ненасыщенным. Примеры (не содержащих замещения) насыщенных линейных алкиловых групп C1-7 включают без ограничения метил, этил, н-пропил, н-бутил и н-пентил (амил). Примеры (не содержащих замещения) насыщенных разветвленных алкиловых групп C1-7 включают без ограничения изопропил, изобутил, сек-бутил, терт-бутил и неопентил. Примеры насыщенных алициклических (карбоциклических) алкиловых групп C1-7 (которые называют также "циклоалкиловыми" группами С 3-7) включают без ограничения группы, не содержащие замещения, в частности, циклопропил, циклобутил, циклопентил и циклогексил, а также группы, содержащие замещение (например, группы, содержащие указанные группы), в частности, метилциклопропил,диметилциклопропил, метилциклобутил, диметилциклобутил, метилциклопентил, диметилциклопентил,метилциклогексил, диметилциклогексил, циклопропилметил и циклогексилметил Примеры (не содержащих замещения) ненасыщенных алкиловых групп C1-7, которые содержат одну или несколько углерод-углеродных двойных связей (называемые также "алкениловыми" группами С 2-7) включают без ограничения этенил (винил, -СН=СН 2), 2-пропенил (аллил, -СН 2-СН=СН 2), изопропенил (-С(СН 3)=СН 2), бутенил, пентенил и гексенил. Примеры (не содержащих замещения) ненасыщенных алкиловых групп C1-7, которые содержат одну или несколько углерод-углеродных тройных связей (называемые также "алкиниловыми" группами С 2-7) включают без ограничения этинил и 2-пропинил (пропаргил). Примеры ненасыщенных алициклических (карбоциклических) алкиловых групп C1-7, которые содержат одну или несколько углерод-углеродных двойных связей (называемые также "циклоалкениловыми" группами С 3-7), включают без ограничения не содержащие замещения группы, в частности, циклопропенил, циклобутенил, циклопентинил и циклогексенил, а также группы, содержащие замещения (например, группы, содержащие указанные группы), в частности, циклопропенилметил и циклогексенилметил. Гетероциклил С 3-20: термин "гетероциклил С 3-20", используемый в данном описании, относится к одновалентной группе, полученной путем удаления атома водорода из атомов кольца неароматического гетероциклического соединения С 3-20, при этом указанное соединение содержит одно, два или более колец (соединенных, например, одним общим атомом, мостиком или конденсированных), содержащих от 3 до 20 атомов в кольце, из которых от 1 до 10 являются гетероатомами, и при этом по меньшей мере одно из указанных колец является гетероциклическим. Предпочтительно каждое кольцо содержит от 3 до 7 атомов, из которых от 1 до 4 являются гетероатомами. "С 3-20" относится ко всем атомам кольца, будь то атомы углерода или гетероатомы. Примеры групп гетероциклилов С 3-20, содержащих в кольце один атом азота, включают без ограничения производные группы азиридина, ацетидина, ацетина, пирролидина, пирролина, пиперидина, дигидропиридина, тетрагидропиридина и дигидропиррола (азолина).-3 006300 Примеры групп гетероциклилов С 3-20, содержащих в кольце один атом кислорода, включают без ограничения производные группы оксирана, оксетана, оксолана (тетрагидрофурана), оксола (дигидрофурана), окcана (тетрагидропирана), дигидропирана и пирана. Примеры групп гетероциклилов С 3-20, содержащих замещения включают, сахара в циклической форме, например фуранозы и пиранозы, в том числе,например, рибозу, ликсозу, ксилозу, галактозу, сахарозу, фруктозу и арабинозу. Примеры групп гетероциклилов С 3-20, содержащих в кольце один атом серы, включают без ограничения производные группы тиолана (тетрагидротиофена, тиана) и тетрагидротиопирана. Примеры групп гетероциклилов С 3-20, содержащих в кольце два атома кислорода, включают без ограничения производные группы диоксана, например 1,3-диоксан и 1,4-диоксан. Примеры групп гетероциклилов С 3-20, содержащих в кольце два атома азота, включают без ограничения производные группы диазолидина (пиразолидина), пиразолина, имидазолидина, имидазолина и пиперазина. Примеры групп гетероциклилов С 3-20, содержащих в кольце один атом азота и один атом кислорода,включают без ограничения производные группы тетрагидрооксазола, дигидрооксазола, тетрагидроизооксазола, дигидроизооксазола, морфолина, тетрагидрооксазина, дигидрооксазина и оксазина. Примеры групп гетероциклилов С 3-20, содержащих в кольце один атом кислорода и один атом серы,включают без ограничения производные группы оксатиолана и оксатиана. Примеры групп гетероциклилов С 3-20, содержащих в кольце один атом азота и один атом серы,включают без ограничения производные группы тиазолина, тиазолидина и тиоморфолина. Другие примеры групп гетероциклилов С 3-20 включают без ограничения оксадиазин. Если гетероциклил С 3-20 содержит замещение, то заместители находятся в позиции атомов углерода или азота (если таковые присутствуют). Арил С 5-20: термин " арил С 5-20", используемый в данном описании, относится к одновалентной группе, полученной путем удаления атома водорода из атомов кольца ароматического соединения С 5-20,при этом указанное соединение содержит одно, два или более колец (например, конденсированных), содержащих от 5 до 20 атомов в кольце, и по меньшей мере одно из указанных колец является ароматическим. Каждое кольцо содержит предпочтительно от 5 до 7 атомов. Все атомы кольца могут быть атомами углерода, как в "карбоариловых группах", в этом случае группу обычной называют "карбоариловой группой С 5-20". Примеры ариловых групп С 5-20, которые не содержат в кольце гетероатоамов (т.е. карбоариловых групп С 5-20), включают без ограничения производные группы бензола (т.е. фенила) (С 6), нафталина (С 10),антрацена (C14), фенантрена (С 14) и пирена (C16). Альтернативно атомы кольца могут включать один или несколько гетероатомов, включая без ограничения кислород, азот и серу, как в "гетероариловых группах". При этом группу обычно называют "гетероариловой группой С 5-20", в этом случае "С 5-20" означает все атомы кольца, будь то атомы углерода или гетероатомы. Каждое кольцо содержит предпочтительно от 5 до 7 атомов, из которых от 0 до 4 атомов являются гетероатомами. Примеры гетероариловых групп С 5-20 включают без ограничения гетероариловые группы С 5, производные фурана (оксола), тиофена (тиола), пиррола (азола), имидазола (1,3-диазола), пиразола (1,2 диазола), триазола, оксазола, изоксазола, тиазола, изотиазола, оксадиазола и оксатриазола, и гетероариловые группы С 6, производные изоксазина, пиридина (азина), пиридазина (1,2-диазина), пиримидина(1,3-диазина, например цитозина, тимина, урацила), пиразина (1,4-диазина), триазина, тетразола и оксадиазола (фуразана). Гетероариловая группа может быть присоединена посредством атома углерода или гетероатома кольца. Примеры гетероариловых групп С 5-20, которые содержат конденсированные кольца, включают без ограничения гетероариловые группы С 9, производные бензофурана, изобензофуран, бензотиофена, индола и изоиндола; гетероариловые группы С 10, производные хинолина, изохинолина, бензодиазина и пиридопиридина, а также гетероариловые группы С 14, производные акридина и ксантена. Вышеуказанные алкиловые группы C1-7, гетероциклиловые группы С 3-20, и ариловые группы С 5-20,отдельно или будучи частью заместителя, сами могут содержать замещения из одной или нескольких групп, выбранных из них самих и дополнительных заместителей, перечисленных ниже. Гало: -F, -Cl, -Вr и -I. Гидрокси: -ОН. Эфир: -OR, где R - заместитель эфира, например, алкиловая группа C1-7 (называемая также алкоксигруппой C1-7), гетероциклиловая группа С 3-20 (называемая также гетероциклилокси-группой С 3-20), или ариловая группа С 5-20 (называемая также арилоксигруппой С 5-20), предпочтительно алкиловая группаC1-7. Нитро: -NO2. Циано (нитрил, карбонитрил): -CN. Ацил (кето): -C(=O)R, где R - ациловый заместитель, например, алкиловая группа C1-7 (называемая также алкилацилом C1-7 или алканоилом C1-7), гетероциклиловая группа С 3-20 (называемая также гетероциклилацилом С 3-20) или ариловая группа С 5-20 (называемая также арилацилом C5-20), предпочтительно-4 006300 алкиловая группа C1-7. Примеры ациловых групп включают без ограничения -С(=О)СН 3 (ацетил),-С(=О)СН 2 СН 3 (пропионил), -С(=О)С(СН 3)3 (бутирил) и -C(=O)Ph (бензоил, фенон). Карбокси (карбоновая кислота): -СООН. Эфир (карбоксилат, эфир карбоновой кислоты, оксикарбонил): -C(=O)OR, где R - заместитель эфира, например, алкиловая группа C1-7, гетероциклиловая группа С 3-20 или ариловая группа C5-20, предпочтительно алкиловая группа C1-7. Примеры эфирных групп включают без ограничения -С(=О)ОСН 3,-С(=О)ОСН 2 СН 3, -С(=О)ОС(СН 3)3 и -C(=O)OPh. Амидо (карбамоил, карбамил, аминокарбонил, карбоксамид): -C(=O)NR1R2, где R1 и R2 независимо являются заместителями аминов согласно определению для аминогрупп. Примеры амидогрупп включают без ограничения -C(=O)NH2, -C(=O)NHCH3, -C(=O)N(CH3)2, -C(=O)NHCH2CH3 и -С(=О)N(СН 2 СН 3)2, а также амидогруппы, в которых R1 и R2 вместе с атомом азота, к которому они присоединены, образуют гетероциклическую структуру, как, например, в пиперидинокарбониле, морфолинокарбониле, тиоморфолинокарбониле, и пиперазинокарбониле. Амино: -NR1R2, где R1 и R2 независимо являются заместителями аминов, например, водородом, алкиловой группой C1-7 (называемой также C1-7 алкиламином или ди-C1-7 алкиламином), гетероциклиловой группой С 3-20 или ариловой группой C5-20, предпочтительно Н или алкиловая группа C1-7, или в случае"циклической" аминогруппы R1 и R2 вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо, содержащее от 4 до 8 атомов. Примеры аминогрупп включают без ограничения -NH2, -NHCH3, -NHCH(CH3)2, -N(CH3)2, -N(CH2CH3)2 и -NHPh. Примеры циклических аминогрупп включают без ограничения азиридиновые, ацетидиновые, пирролидиновые, пиперидиновые, пиперазиновые, пергидродиазипиновые, морфолиновые и тиоморфолиновые группы. Циклические аминогруппы могут содержать замещения в их кольце каким-либо из указанных здесь заместителей, например, карбокси-, карбоксилатной или амидогруппой. В особой форме аминогруппы одна из групп R1 и R2 является сульфоном (-S(=O)2R), где R -заместитель сульфона, и эту группу можно назвать сульфонамидной группой. Примеры сульфонамидных групп включают без ограничения -NHS(=O)2CH3, -NHS(=O)2Ph и-NHS(=O)2C6H4F. Ациламидо (ациламино): -NR1C(=O)R2, где R1 - амидный заместитель, например, водород, алкиловая группа C1-7, гетероциклиловая группа С 3-20 или ариловая группа С 5-20, предпочтительно Н или алкиловая группа C1-7, наиболее предпочтительно Н, a R2 - ациловый заместитель, например, алкиловая группа C1-7, гетероцикл иловая группа С 3-20, или ариловая группа С 5-20, предпочтительно алкиловая группаC1-7. Примеры ациламидных групп включают без ограничения -NHC(=O)CH3, -NHC(=O)CH2CH3 и-NHC(=O)Ph. В особой форме ациламидной группы R2 является аминогруппой (-NR3R4), где R3 и R4 независимо представляют собой аминовые заместители, поэтому данную группу можно назвать уреидогруппой. Примеры уреидогрупп включают без ограничения -NHC(=O)NHCH3, -NHC(=O)NHCH2CH3 иC1-7, гетероциклиловая группа С 3-20 или ариловая группа С 5-20, предпочтительно алкиловая группа C1-7. Примеры ацилокси-групп включают без ограничения -ОС(=О)СН 3 (ацетокси), -ОС(=О)СН 2 СН 3,-ОС(=О)С(СН 3)3, -OC(=O)Ph, -OC(=O)C6H4F и -OC(=O)CH2Ph. Тиол : -SH. Тиоэфир (сульфид): -SR, где R - тиоэфирный заместитель, например, алкиловая группа C1-7 (называемая также алкилтиогруппой), гетероциклиловая группа С 3-20 или ариловая группа С 5-20, предпочтительно алкиловая группа C1-7. Примеры алкилтиогрупп C1-7 включают без ограничения -SCH3 и-SCH2CH3. Сульфоксид (сульфинил): -S(=O)R, где R - сульфоксидный заместитель, например, алкиловая группа C1-7, гетероциклиловая группа С 3-20 или ариловая группа С 5-20, предпочтительно алкиловая группаC1-7. Примеры сульфоксидных групп включают без ограничения -S(=O)CH3 и -S(=O)CH2CH3. Сульфон (сульфонил): -S(=O)2R, где R - сульфоновый заместитель, например, алкиловая группа С 1-7, гетероциклиловая группа С 3-20 или ариловая группа С 5-20, предпочтительно алкиловая группа C1-7. Примеры сульфоновых групп включают без ограничения -S(=O)2CH3 (метансулфонил, мезил),-S(=O)2CF3, -S(=O)2CH2CH3 и 4-метилфенилсульфонил (тозил). Как указано ранее, группы, которые образуют вышеперечисленные группы-заместители, например,алкил C1-7, гетероциклил С 3-20 и арил С 5-20, сами могут быть замещены. Таким образом, приведенные выше определения включают замещенные группы-заместители. Образование кольца заместителями Возможны случаи, когда заместитель в кольце, которое образует часть RC, и заместитель в конденсированном ароматическом кольце (представленном как -А-В-) могут совместно образовывать внутрикольцевую связь, создавая таким образом дополнительную циклическую структуру в соединении. Заместитель в ароматическом кольце, который образует внутрикольцевую связь, предпочтительно находится в позиции атома, соседнего с центральной группой (т.е. в -позиции). Заместитель в RC, который образует внутрикольцевую связь, предпочтительно находится в позиции атома, соседнего с атомом, связанным с центральной группой.-5 006300 Связь между двумя кольцами может быть одинарной связью или описываться формулой-(CH2)n1'-Q'n2'-(CH2)n3'где каждый из коэффициентов n1', n2' и n3' выбран из группы, включающей 0, 1, 2 и 3, а сумма n1' n2' иn3' меньше или равна 3, Q' может представлять собой О, S, NH или С(=О). Другие предпочтительные варианты Следующие предпочтительные варианты исполнения могут относиться ко всем соответствующим задачам изобретения. В настоящем изобретении конденсированные ароматические кольца, которые можно представить как -А-В-, предпочтительно содержат только углеродные атомы кольца и поэтому могут быть бензолом,нафталином, более предпочтительно бензолом. Как описано выше, эти кольца могут быть замещены,однако, в некоторых вариантах реализации являются предпочтительно незамещенными.RN предпочтительно выбирают из группы, включающей водород и амидогруппу. В одном из вариантов реализации RN предпочтительно является амидогруппой, в которой один из амидных заместителей представляет собой фенил, возможно, замещенный фтором, предпочтительно в парапозиции. В другом варианте реализации RN предпочтительно представляет собой Н. Для L предпочтительно, чтобы каждое из Q (если n2 больше 1) было выбрано из группы, включающей О, S, NH или С(=О).-(CH2)n1-Qn2-,где n1 выбирают из группы, включающей 0, 1, 2 и 3, а n2 выбирают из группы, включающей 0 и 1 (при этом сумма n1 и n2 равна 1, 2 или 3), более предпочтительно n2 равно 0, n1 предпочтительно равно 1 или 2, более предпочтительно 1. В наиболее предпочтительном варианте L представляет собой -СН 2-. Если Q в L представляет собой -CR1R2-, то n2 предпочтительно равно 1. В одном из вариантов реализации R1 может быть замещено алкилом C1-7, a R2 является водородом. Более предпочтительно R1 может быть замещенным алкилом C1-4, а наиболее предпочтительно незамещенным алкилом С 1-4. В другом варианте реализации R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют насыщенную циклическую алкиловую группу С 3-7, более предпочтительно циклическую алкиловую группу С 5-7. В следующем варианте реализации R1 присоединяют к одному из атомов в RL, получая ненасыщенную циклоалкениловую группу С 3-7, более предпочтительно циклоалкениловую группу С 5-7, содержащую атомы углерода, к которым R1 и R2 присоединены в Q, -(СН 2)n3- (при ее наличии) и часть RL, a R2 является водородом.RL - предпочтительно представляет собой бензольное кольцо, нафталин, пиридин или 1,3 бензодиоксол, а более предпочтительно бензольное кольцо. Если RL является бензольным кольцом, оно предпочтительно содержит замещения. Один или несколько заместителей можно выбрать из группы, включающей алкил C1-7, более предпочтительно метил,CF3; арил C5-20; гетероциклил С 3-20; галоген, более предпочтительно фтор; гидроксил; эфир, более предпочтительно метокси, фенокси, бензилокси и циклопентокси; нитро; циано; карбонильные группы, в частности карбокси, эфир и амидо; амино (включая сульфонамидо), более предпочтительно -NH2, -NHPh и циклоаминовые группы, в частности морфолино; ациламидо, включая уреидные группы, при этом ациловый или аминовый заместитель предпочтительно представляет собой фенил, который в свою очередь может быть фторирован; ацилокси; тиол; тиоэфир; сульфоксид; сульфон. В одной группе вариантов реализации фтор является особенно предпочтительным заместителем наряду с заместителями, содержащими фениловый или фторированный фениловый компонент. В том случае, когда RL является фенилом, предпочтительные заместители бензольного кольца включают 1) ациламид, в котором амидный заместитель выбирают из группы, содержащей алкил C1-7, гетероциклил С 3-20 и арил С 5-20, более предпочтительно алкил C1-7 и арил C5-20, при этом указанные группы в свою очередь могут содержать замещения. Возможные заместители можно выбрать из всех перечисленных выше, однако, особый интерес представляют алкиловые группы C1-7 и ариловые группы С 5-20, галоидные, эфирные, тиоэфирные и сульфоновые группы; 2) уреид, в котором один амин предпочтительно замещен водородом, а другой - выбран из группы,включающей алкил C1-7, гетероциклил С 3-20 и арил С 5-20, более предпочтительно алкил C1-7 и арил С 5-20,при этом указанные группы в свою очередь могут содержать замещения. Возможные заместители можно выбрать из всех перечисленных выше, однако, особый интерес представляют алкиловые группы C1-7,гетероциклиловые группы С 3-20 и ариловые группы С 5-20, галоидные и эфирные группы; 3) сульфонамин, в котором аминовым заместителем предпочтительно является водород, а сульфоновый заместитель выбирают из группы, включающей алкил C1-7, гетероциклил С 3-20 и арил С 5-20, более предпочтительно алкил C1-7 и арил С 5-20, при этом указанные группы в свою очередь могут содержать замещения. Возможные заместители можно выбрать из всех перечисленных выше, однако, особый интерес представляют ариловые группы С 5-20 и ациламидные группы; 4) ацилокси, в котором заместитель ацилокси выбирают из группы, включающей алкил C1-7, гетеро-6 006300 циклил С 3-20 и арил С 5-20, более предпочтительно алкил C1-7 и арил С 5-20, при этом указанные группы в свою очередь могут содержать замещения. Возможные заместители можно выбрать из всех перечисленных выше, однако, особый интерес представляют алкиловые группы C1-7 и ариловые группы С 5-20, галоидные, эфирные, тиоэфирные, сульфоновые и нитрогруппы. Если А и В совместно представляют собой конденсированное ароматическое кольцо, предпочтительно, чтобы заместитель не образовывал внутрикольцевой связи с заместителем в кольце, который является частью Rc. Особенно предпочтительны заместители в пятой позиции. В соответствующих случаях указанные выше предпочтительные варианты исполнения можно использовать в сочетании друг с другом. Включение других форм Вышеуказанное включает хорошо известные ионные, солевые, сольватные и защищенные формы этих заместителей. Так, например, ссылка на карбоновоую кислоту (-СООН) включает также анионную(карбоксильную) форму (-СОО-), ее соль или сольват, а также обычные защищенные формы. Аналогично этому ссылка на аминогруппу включает также протонированную форму (-N+HR1R2), соль или сольват аминогруппы, например гидрохлоридную соль, а также обычные защищенные формы аминогруппы. Аналогично этому ссылка на гидроксильную группу включает также анионную форму (-O-), ее соль или сольват, а также обычные защищенные формы гидроксильной группы. Определенные соединения могут существовать в одной или нескольких особых геометрических,оптических, энантиомерных, диастериомерных, эпимерных, стереоизомерных, таутомерных, конформационных или аномерных формах, включая без ограничения формы цис- и транс-; формы Е- и Z-; формы с-, t- и r-; формы эндо- и экзо-; формы R-, S-, и мезо-; формы D- и L-; формы d- и I-; формы (+) и (-); формы кето-, энол- и энолат-; формы син- и анти-; синклинальные и антисинклинальные формы; формы - и-; аксиальные и экваториальные формы; формы лодки, кресла, спирали, конверта и полукресла, а также их комбинации, которые собирательно называются далее "изомерами" (или "изомерными формами"). Если соединение находится в кристаллической форме, оно может существовать в нескольких различных полиморфных формах. Следует отметить, из термина "изомеры", используемого в данном описании, исключены структурные изомеры (или изомеры строения) (т. е. изомеры, которые различаются соединениями между атомами, а не только положением атомов в пространстве) кроме таутомерных форм, как указано ниже. Так,например, ссылку на метоксигруппу -ОСН 3 не следует понимать как ссылку на ее структурный изомер,гидроксиметиловую группу -СН 2 ОН. Аналогично этому ссылку на ортохлорфенил не следует понимать как ссылку на его структурный изомер метахлорфенил. Однако ссылка на класс структур может включать структурно изомерные формы, входящие в этот класс (например, алкил C1-7 включает н-пропил и изопропил; бутил включает н-,изо-, сек- и тepет-бутил; метоксифенил включает орто-, мета- и параметоксифенил). Указанное выше исключение не касается таутомерных форм, например, кето-, энольных и энолатных форм, как, например, в следующих таутомерных парах: кето/энол, имин/энамин, амид/иминовый спирт, амидин/амидин, нитрозо/оксим, тиокетон/энетиол, N-нитрозо/гидроксиазо и нитро/ацинитро. Особенно важной для настоящего изобретения является таутомерная пара, которая существует, когда RN представляет собой Н, как показано ниже Следует отметить, что термин "изомер" охватывает, в частности, соединения с одним или несколькими изотопными заместителями. Так, например, Н может быть в любой изотопной форме, в том числе 1 Н, 2 Н (D) и 3 Н (Т), С может быть в любой изотопной форме, в том числе 12 С, 13 С и 14 С, О может быть в любой изотопной форме, в том числе 16 О и 18 О и т.п. Если не указано иного, ссылка на конкретное соединение включает все изомерные формы, в том числе (полностью или частично) их рацемические и другие смеси. Способы получения (например, асимметрический синтез) и разделения (например, дробная кристаллизация и хроматографические средства) таких изомерных форм известны специалистам или легко получаются из адаптации описанных здесь способов или известных способов известным образом. Если не указано иного, ссылка на конкретное соединение включает также его ионные, солевые,сольватные и защищенные формы, например, как описано ниже, а также различные полиморфные формы. Может оказаться удобным или желательным получить, очистить и/или использовать соответствующую соль активного соединения, например фармацевтически допустимую соль. Примеры фармацевтически допустимых солей приведены в литературе, см. Berge et al., 1977, "Pharmaceutically Acceptable-7 006300 В частности, если соединение является анионным или имеет функциональную группу, которая может быть анионной (например, -СООН может быть -СОО-), то соль может быть образована соответствующим катионом. Примеры пригодных неорганических катионов включают без ограничения ионы щелочных металлов, в частности Na+ и K+, щелочноземельные катионы, в частности Са 2+ и Мg2+, и другие катионы, в частности Al3+. Примеры пригодных органических катионов включают без ограничения ион аммония (т.е. NH4+) и замещенные ионы аммония (например, NH3R+, NH2R2+, NHR3+, NR4+). Примеры некоторых пригодных замещенных ионов аммония являются производными этиламина, диэтиламина,дициклогексиламина, триэтиламина, бутиамина, этилендиамина, этаноламина, диэтаноламина, пиперазина, бензиламина, фенилбензиламина, холина, меглумина и трометамина, а также аминокислот, в частности лизина и аргинина. Примером обычного четвертичного аммониевого иона является N(CH3)4+. Если соединение является катионным или содержит функциональную группу, которая может быть катионной, (например, -NH2 может быть -NH3+), то соль может быть образована соответствующим анионом. Примеры пригодных неорганических анионов включают без ограничения производные следующих неорганических кислот: хлористо-водородной, бромисто-водородной, иодисто-водородной, серной, сернистой, азотной, азотистой, фосфорной и фосфористой. Примеры пригодных органических анионов включают без ограничения производные следующих органических кислот: уксусной, пропионовой, янтарной, гликолевой, стеариновой, пальмитиновой, молочной, яблочной, pamoic, винной, лимонной, глюконовой, аскорбиновой, малеиновой, оксималеиновой, фенилуксусной, глутаминовой, аспарагиновой,бензойной, коричной, пировиноградной, салициловой, сульфаниловой, 2-ацетилоксибензойной, фумаровой, толуолсульфоновой, метансульфоновой, этансульфоновой, этандисульфоновой, щавелевой, изэтионовой, валериановой и глюконовой. Примеры пригодных полимерных анионов включают без ограничения производные следующих полимерных кислот: дубильной кислоты и карбоксиметилцеллюлозы. Может оказаться удобным или желательным получить, очистить и/или использовать соответствующий сольват активного соединения. Термин "сольват" используется в настоящем описании в общепринятом смысле по отношению к комплексу растворенного вещества (например, активного соединения,соли активного соединения) и растворителя. Если растворителем является вода, сольват обычно называют гидратом, например моногидрат, дигидрат, тригидрат и т.д. Может оказаться удобным или желательным получить, очистить и/или использовать активное соединение в химически защищенной форме. Термин "химически защищенная форма", используемый в данном описании, относится к соединению, в котором одна или несколько реактивных функциональных групп защищены от нежелательных химических реакций, т. е. находятся в форме защищенной или защитной группы (известны также как маскированная или маскирующая группа или блокированная или блокирующая группа). Защитив реактивную функциональную группу, можно провести реакции с другими незащищенными реактивными функциональными группами, не оказывая действия на защищенную группу. Защитную группу можно удалить, обычно на следующем этапе, без существенного воздействия на остаток молекулы. См., например, Protective Groups in Organic Synthesis (Т. Green and P. Wuts, Wiley,1991). Так, например, гидроксильную группу можно защитить как простой эфир (-OR) или как сложный эфир (-OC(=O)R), в частности, как простой m-бутиловый эфир, простой бензиловый, бензгидриловый(дифенилметиловый) или тритиловый (трифенилметиловый) эфир, простой триметилсилиловый или mбутилдиметилсилиловый эфир или сложный ацетиловый эфир (-ОС(=О)СН 3, -ОАс). Альдегидную или кетоновую группу можно защитить, например, как ацеталь или кеталь, соответственно, где карбонильная группа (С=О) превращена в двойной эфир (C(OR)2) с помощью реакции,например, с первичным спиртом. Альдегидную или кетоновую группу легко регенерировать путем гидролиза, используя большой избыток воды в присутствии кислоты. Аминовую группу можно защитить, например, как амид или уретан, в частности как метиламид(-NH-Fmoc), 6-нитровератрилоксиамид (-NH-Nvoc), 2-триметилсилилэтилоксиамид (-NH-Teoc), 2,2,2 трихлорэтилоксиамид (-NH-Troc), аллиоксиамид (-NH-Alloc), 2(-фенилсульфонил)этилоксиамид (-NHPsec), или в соответствующих случаях как N-оксид (NOS). Группу карбоновой кислоты можно защитить, например, как сложный эфир, в частности сложный алкиловый эфир C1-7(например, сложный метиловый эфир, сложный m-бутиловый эфир), сложный галоалкиловый эфир C1-7(например, сложный тригалоалкиловый эфир C1-7), сложный триС 1-7 алкилсилил-C1-7 алкиловый эфир или сложный С 5-20 арил-C1-7 алкиловый эфир (например, сложный бензиловый эфир,сложный нитробензиловый эфир) или как амид, например метиламид. Тиоловую группу можно защитить, например, как тиоэфир (-SR), в частности как бензиловый тиоэфир, ацетамидометиловый эфир (-S-CH2NHC(=O)CH3). Может оказаться удобным или желательным получить, очистить и/или использовать активное соединение в форме пролекарства. Термин "пролекарство", используемый в данном описании, относится к соединению, которое, будучи трансформировано в процессе метаболизма (например, в живом организме), образует желаемое активное соединение. Обычно пролекарство является неактивным или менее ак-8 006300 тивным, чем активное соединение, однако, может обеспечивать удобное обращение, введение или выгодные метаболические свойства. Так, например, некоторые пролекарства являются сложными эфирами активного соединения (например, физиологически допустимый, метаболически лабильный сложный эфир). В процессе метаболизма эфирная группа (-C(=O)OR) расщепляется, образуя активное лекарство. Такие сложные эфиры можно получать путем этерификации, например, любой группы карбоновых кислот (-С(=О)ОН) в исходном соединении, если требуется, с предварительной защитой других реактивных групп, присутствующих в этом исходном соединении, и с последующим устранением защиты в случае необходимости. Примеры таких метаболически лабильных сложных эфиров включают сложные эфиры, в которых R является алкилом C1-7 (например, -Me, -Et), аминоалкилом C1-7 (например, аминоэтил, 2-(N,N-диэтиламино)этил, 2(4-морфолино)этил) и ацилокси-С 1-7 алкил (например, ацилоксиметил, ацилоксиэтил, например, пивалоилоксиметил, ацетоксиметил, 1-ацетоксиэтил, 1-(1-метокси-1-метил)этилкарбоксилоксиэтил, 1-(бензоилокси)этил, изопропоксикарбонилоксиметил, 1-изопропоксикарбонилоксиэтил, циклогексилкарбонилоксиметил, 1-циклогексилкарбонилоксиэтил, циклогексилоксикарбонилоксиметил, 1-циклогексилоксикарбонилоксиэтил, (4-тетрагидропиранилокси)карбонилоксиметил, 1-(4-тетрагидропиранилокси)карбонилоксиэтил, (4-тетрагидропиранил)карбонилоксиметил и 1-(4-тетрагидропиранил)карбонилоксиэтил. Другие пригодные формы пролекарства включают фосфанатные и глюколятные соли. В частности,гидроксильные группы (-ОН) можно вводить в фосфанатные пролекарства путем реакции с хлордибензилфосфитом с последующим гидрированием для получения фосфанатной группы -О-Р(=О)(ОН)2. Такую группу можно очистить ферментами фосфотазы в процессе метаболизма, чтобы получить активное лекарство с гидроксильной группой. Кроме того, некоторые пролекарства активируются ферментами для получения активного соединения или соединения, которое образует активное соединение в результате последующей химической реакции. Так, например, пролекарство может быть производным сахара или иного глюкозидного конъюгата или производным сложного эфира аминокислоты. Акронимы Для удобства многие химические радикалы представлены с помощью хорошо известных аббревиатур, включая без ограничения метил (Me), этил (Et), н-пропил (пРr), изопропил (iPr), н-бутил (nBu), третбутил (tBu), н-гексил (nНех), циклогексил (сНех), фенил (Ph), бифенил (biPh), бензил (Вn), нафтил (naph),метокси (МеО), этокси (ЕtO), бензоил (Bz) и ацетил (Ас). Для удобства многие химические соединения представлены с помощью хорошо известных аббревиатур, включая без ограничения метанол (МеОН), этанол (ЕtOН), изо-пропанол (i-PrOH), метилэтилкетон (МЕК), эфир или диэтиловый эфир (Et2O), уксусную кислоту (АсОН), дихлорметан (метиленхлорид,DCM), трифторуксусную кислоту (TFA), диметилформамид (DMF), тетрагидрофуран (THF) и диметилсульфоксид (DMSO). Синтез Соединения согласно изобретению можно синтезировать различными способами, примеры которых приведены ниже. Некоторые схемы синтеза описаны в литературе, см. Yamaguchi, et al., J. Med. Chem. 1993, 36, 4502-4068, которая указана здесь в качестве ссылки. В общем случае, ключевой стадией синтеза этих соединений является добавление/вставка гидразина, чтобы обеспечить наличие смежных атомов азота в кольце центральной группы. Такое добавление гидразина осуществляется, в частности, путем операции вставки в кольцо в соответствии со схемами,приведенными ниже в качестве примеров. Образованное ароматическое кольцо (представленное как -А-В-) обычно получали до того, как показанные ниже схемы и исходные материалы с желаемой структурой и расположением заместителей можно было приобрести на рынке или легко синтезировать. Схема 2 представляет собой пример стратегии в том случае, когда ароматическое кольцо уже содержит замещения в начале синтеза. Показанная схема приводит к образованию соединений, в которых RN представляет собой Н. Возможные заместители могут быть введены в эту позицию с помощью соответствующего электрофила при пригодных условиях реакции. Дальнейшее получение производных групп в RC можно выполнить с помощью множества обычных способов, некоторые из которых приведены в качестве иллюстрации в разделе "Дальнейшее получение производных соединений". Схема 1. Часть 1. Синтез 2-арилиндан-1,3-дионов. К охлажденному льдом раствору фталида или его эквивалента (13,41 г, 0,1 моль) и ароматического альдегида (0,1 моль) в смеси метанола (50 мл) и этилпропионата (50 мл) добавили раствор метоксида натрия в метаноле [натрий (9,20 г, 0,4 моль) в метаноле (50 мл)], поддерживая температуру ниже 10 С.-9 006300 Затем раствор плавно нагрели до кипения и кипятили с обратным холодильником в течение 3 ч, охладили до комнатной температуры и вылили в воду (500 мл). Смесь промыли эфиром (5 х 100 мл), подкислили водный слой уксусной кислотой и отфильтровали твердую фазу. Ее использовали в качестве исходного материала на следующем этапе. Часть 2. Реакция 2-арилиндан-1,3-онов с гидразингидратом. Суспензию 2-арилиндан-1,3-диона (20 ммоль) в гидразинмоногидрате (40 мл) нагрели до кипения и кипятили с обратным холодильником в течения 4 ч, а затем охладили и профильтровали продукт. Твердую фазу промыли этанолом. Схема 2 Пивалоилхлорид (120 г, 1 моль) добавили по каплям при температуре окружающей среды к перемешанному раствору 2-метоксианилина (123 г, 1 моль) и триэтиламина (111 г, 1.1 моль) в 1,4-диоксане(1200 мл), перемешали смесь при температуре окружающей среды в течение 2 ч, а затем вылили ее в воду (3000 мл). Продукт экстрагировали в этилацетат (3 х 300 мл), объединенные экстракты высушили(МgSО 4) а растворители удалили в вакууме, получив N-(2-метоксифенил)пиваламид (198 г, 96%) в форме порошка с низкой температурой плавления, который использовали без дальнейшей очистки. В атмосфере азота по каплям добавили при -10 С н-бутиллитий (раствор 1,6 М в гескане, 200 мл,0,32 моль) в перемешанный раствор N-(2-метоксифенил)пиваламида (27,6 г, 0,133 моль) в тетрагидрофуране (600 мл), выдержали смесь для нагревания до температуры окружающей среды, перемешали в течение следующих 2 ч, а затем добавили ее к большому избытку дробленого твердого диоксида углерода. Выдержали смесь для нагревания до температуры окружающей среды, добавили 3 М соляной кислоты(200 мл) и удалили тетрагидрофуран в вакууме. Образовавшуюся твердую фазу собрали фильтрацией и кристаллизовали из ацетонитрила, получив 3-метокси-2-пиваламидобензойную кислоту (21 г, 63%) в форме порошка с температурой плавления 117-120 С. Концентрация раствора позволила получить второй сбор (2,6 г, 8%). Перемешанную смесь 3-метокси-2-пиваламидобензойной кислоты (20 г, 0,08 моль) и 7 М соляной кислоты (280 мл) нагрели до кипения и кипятили с обратным холодильником в течение 2 ч, а затем охладили до 0 С. Раствор нитрита натрия (5,8 г, 0,09 моль) в воде (46 мл) добавили по каплям при температуре 5 С, перемешали смесь при температуре 0-5 С в течение 2 ч, а затем добавили по каплям раствор йодида калия (17,8 г, 0,11 моль) в воде (39 мл) при температуре 0-5 С. Перемешанную смесь нагрели при 70-80 С в течение 2 ч, а затем охладили на льду. Продукт экстрагировали в этилацетат (3 х 300 мл), объединенные экстракты промыли 20% водным раствором тиосульфата натрия (3 х 300 мл), а затем высушили (MgSO4) и удалили растворитель в вакууме, получив 2-йодо-3-метоксибензойную кислоту (13 г,58%) в форме порошка с температурой плавления 142-146 С. Перемешанную смесь 2-йодо-3-метоксибензойной кислоты (20 г, 0,07 моль, полученной аналогично тому, как описано выше), метанола (300 мл) и концентрированной серной кислоты (3,5 мл) нагрели до кипения и кипятили с обратным холодильником в течение 8 ч, охладили до температуры окружающей среды и добавили в воду (1500 мл). Продукт экстрагировали в дихлорметан (3 х 500 мл), объединенные экстракты промыли 5% водным раствором гидроксида натрия (3 х 500 мл), затем высушили (MgSO4) и удалили растворитель в вакууме, получив метил-2-йодо-3-метоксибензоат (18,5 г, 90%) в форме порошка- 10006300 с температурой плавления 58-61 С. Замещенный соответствующим образом фенилацетилен (0,063 моль) добавили при температуре окружающей среды в атмосфере азота к перемешанному раствору йодида меди (I) (0,1 г, 6,3 ммоль), дихлорида бис(трифенилфосфин)палладия (II) (0,43 г, 6,3 ммоль) и метил-2-йодо-3-метоксибензоата (18,5 г,0,063 моль) в триэтиламине (375 мл), смесь перемешали при температуре окружающей среды в течение 72 ч, а затем добавили ее в 5 М раствор соляной кислоты (1000 мл). Продукт экстрагировали в этилацетат(3 х 400 мл), объединенные экстракты высушили (MgSO4) и удалили растворитель в вакууме, получив метил-3-метокси-2-(замещенный фенилэтинил)бензоат, который использовали без очистки. Смесь неочищенного 3-метокси-2-(замещенного фенилэтинил)бензоата и 30% водного раствора гидроксида натрия (302 мл) перемешали и нагрели при обратном орошении в течение 4 ч, охладили до температуры окружающей среды и подкислили путем добавления концентрированной серной кислоты. Продукт экстрагировали в эфир (3 х 500 мл), объединенные экстракты промыли 10% водным раствором карбоната натрия (2000 мл), высушили (MgSO4) и удалили растворитель в вакууме, получив 4-метокси-3(замещенный бензилиден)фталид, который использовали без очистки. Смесь неочищенного 4-метокси-3-(замещенного бензилиден)фталида (14 г) и гидразингидрата (83 мл) нагрели при обратном орошении в течение 5 ч, а затем охладили до температуры окружающей среды. Полученную твердую фазу отфильтровали, хорошо промыли этанолом и высушили в вакууме, получив желаемое соединение. Замещение ароматического кольца в исходном материале может быть изменено соответствующим образом. Схема 3 Сначала диметилфосфит (11 г, 0,1 моль), а затем 2-формилбензойную кислоту (10,51 г, 0.07 моль) или ее эквивалент добавили по каплям при температуре 0 С в атмосфере азота в перемешанный раствор метоксида натрия [полученный из натрия (2,3 г) в метаноле (80 мл)], смесь перемешали при температуре окружающей среды в течение 30 мин, а затем охладили путем добавления метансульфоновой кислоты(10,6 г, 0,11 моль). Метанол удалили в вакууме, остаток распределили между дихлорметаном (200 мл) и водой (50 мл), а затем промыли дихлорметановый раствор водой (2 х 50 мл) и высушили (MgSO4). Растворитель удалили в вакууме, получив диметил-3-оксобензо[с]фуран-1-илфосфанат или его эквивалент. Гексаметилдисилазид лития (1 М раствор в гексане, 33 мл, 0,033 моль) добавили по каплям в атмосфере азота при температуре -78 С в перемешанный раствор диметил-3-оксобензо[с]фуран-1 илфосфаната или его эквивалента в тетрагидрофуране (8 г, 0,033 моль), затем перемешали смесь при температуре -78 С в течение 1 ч. Добавили соответствующий арилалкилкетон (0,03 моль), перемешали смесь при температуре -78 С в течение 1 ч, выдержали до нагревания до 0 С, а затем охладили добавлением избытка насыщенного водного раствора хлорида аммония. Водную фазу отделили и перемешали встряхиванием с дихлорметаном (100 мл), затем объединенные органические растворы высушили(MgSO4) и удалили растворители в вакууме. Осадок растерли с гексаном (50 мл), а затем твердую фазу отфильтровали и высушили на воздухе, получив 3-(-алкиларилиден)фталид или его эквивалент, который использовали без дальнейшей очистки. Смесь 3-(-алкиларилиден)фталида (0,019 моль) или его эквивалента и гидразингидрата (20 мл) нагрели при обратном орошении в течение 18 ч, а затем охладили до 0 С. Образовавшийся осадок отфильтровали, хорошо промыли этанолом и высушили на воздухе, получив желаемое соединение. Дальнейшее получение производных соединений В суспензию метоксибензилфталазинона или его эквивалента (0,7 г, 2,65 ммоль) в дихлорметане(5 мл) в атмосфере азота при комнатной температуре добавили раствор трибромида бора в дихлорметане(1 М, 6 мл, 6,0 ммоль). Смесь нагрели до обратного орошения в течение 24 ч, охладили и вылили в гидроксид натрия (10%,25 мл). Органический слой удалили, а водный слой подкислили (HCl) и отфильтровали твердую фазу. К перемешанному раствору аминобензилфталазинона или его эквивалента (0,6 г, 2,4 ммоль) и триэтиламина (0,24 г, 2,4 ммоль) в 1,4-диоксане (50 мл) по каплям добавили электрофил (2,4 ммоля). Смесь плавно нагрели до кипения и кипятили с обратным холодильником в течение 2 ч, охладили и вылили в воду (100 мл). Затем отфильтровали осадок и промыли его водой и этанолом перед сушкой в вакууме.(в) Ацилирование гидроксибензилфталазинонов. Ацилирование обычно производят путем добавления соответствующего кислого хлорида к гидроксибензилфталазинону при пригодных условиях. Примеры этого приведены ниже К перемешанному раствору гидроксибензилфталазинона или его эквивалента (например, 164) (0,7 г,2,79 ммоль) и триэтиламина (0,28 г, 2,79 ммоль) в 1,4-диоксане (40 мл) по каплям добавили ацетилхлорид (0,2 мл, 2,79 ммоль). Смесь плавно нагрели до кипения и кипятили с обратным холодильником в течение 2 ч, охладили и вылили в воду (100 мл). Полученную твердую фазу отфильтровали и промыли водой и этанолом перед сушкой в вакууме. Перемешанную суспензию гидроксибензилфталазинона (1,36 г, 5,41 ммоль), триэтиламина (0,61 г,6,00 ммоль) и 4-фторбензолхлорида (0,86 г, 5,41 ммоль) в сухом 1,4-диоксане (50 мл) плавно нагрели до кипения и кипятили с обратным холодильником с исключением образования влаги (CaCl2) в течение 2 ч и охладили до комнатной температуры. Затем реакционную смесь вылили в воду (250 мл) и отфильтровали твердую фазу. После этого неочищенную твердую фазу прокипятили в циклогексане (10 мл), охладили и отфильтровали. Перемешанную суспензию гидроксибензилфталазинона (0,70 г, 2,79 ммоль) или его эквивалента,триэтиламина (0,4 мл, 2,79 ммоль) и ацетилхлорида (0,2 мл, 2,79 ммоль) в сухом 1,4-диоксане (40 мл) плавно нагрели до кипения и кипятили с обратным холодильником с исключением образования влаги(CaCl2) в течение 2 ч и охладили до комнатной температуры. Затем реакционную смесь вылили в воду Соответствующий кислый хлорид (0,24 ммоль) добавили к перемешанному раствору 4-(3 гидроксибензил)фталазин-1(2 Н)-она (50 мг, 0,2 ммоль) или его эквивалента и триэтиламина (33 мкл) в 1,4-диоксане (0.5 мл), а смесь перемешали при температуре окружающей среды, контролируя протекание реакции с помощью tlc (тонкослойной хроматографии). В некоторых случаях оказалось необходимым использовать нагревание до кипения и кипячение с обратным холодильником, чтобы обеспечить полное протекание реакции. После окончания реакции смесь разбавили ледяной водой и экстрагировали продукт в этилацетат. Экстракт промыли насыщенным водным раствором хлорида натрия и высушили (MgSO4), а затем удалили растворитель в вакууме. Осадок очистили, получив требуемый сложный эфир. Очистку выполняли с помощью препаративной жидкостной хроматографии высокого разрешения на жидкостном хроматографе Gilson с применением колонки Jones Chromatography Genesis 4 C18, используя градиент элюирования между водным раствором трифторуксусной кислоты и ацетонитрилом, которые применяли в качестве растворителей для элюирования. К перемешанному раствору аминобензилфталазинона (160) (1,00 г, 40 ммоль) или его эквивалента в сухом 1,4-диоксане (25 мл) при 40 С добавили соответствующий изоцианат (40 ммоль). Смесь перемешали в течение последующих 2 ч, охладили до комнатной температуры и отфильтровали твердую фазу. К перемешанному раствору аминофталазинона (197) (1,00 г, 2,97 ммоль) или его эквивалента в ацетонитриле (25 мл) добавили дигликолевый ангидрид (0,35 г, 3,00 ммоль). Смесь перемешали при комнатной температуре в течение 1 ч и отфильтровали твердую фазу. Неочищенную твердую фазу растворили в NaOH (10%, 20 мл) и профильтровали через целит. После этого водную фазу подкислили, а твердую фазу отфильтровали. Соответствующий хлорангидрид кислоты (0,2 ммоль) добавили к перемешанному раствору аминобензилфталазинона 160 (0,05 г, 0,2 ммоль) или его эквивалента и триэтиламина (33 мкл) в 1,4-диоксане(0.5 мл), смесь перемешали при температуре окружающей среды в течение 18 ч, затем разбавили водой Смесь амидобензилфталазинона 160 (0,5 г, 2 ммоль) или его эквивалента и 1,4-диоксана перемешали при температуре окружающей среды до полного растворения твердой фазы (5-15 мин). Добавили соответствующий изоцианат (2 ммоль), перемешали смесь при температуре окружающей среды в течение 2 ч, а затем выдержали ее при температуре окружающей среды в течение 18 ч. Полученный осадок отфильтровали, хорошо промыли водой и высушили в вакууме, получив, требуемый уреидный продукт. Соответствующий сульфонильный хлорид (1 ммоль) добавили к раствору аминобензилфталазинона 160 (0,25 г, 1 ммоль) или его эквивалента в пиридине (10 мл), перемешанную смесь плавно нагрели до кипения и кипятили с обратным холодильником в течение 2 ч, затем ее разбавили водой (200 мл). Полученный осадок отфильтровали, хорошо промыли водой и высушили в вакууме, получив, требуемый сульфонамидный продукт. Соответствующий сульфонильный хлорид (1 ммоль) добавили к раствору аминобензилфталазинона 160 (0,25 г, 1 ммоль) или его эквивалента и триэтиламина (0,1 г, 1 ммоль) в 1,4-диоксане (10 мл), перемешанную смесь нагрели при обратном орошении в течение 2 ч, а затем разбавили ее водой (200 мл). Полученный осадок отфильтровали, хорошо промыли водой и высушили в вакууме, получив, требуемый сульфонамидный продукт.(50 мл) добавили триэтиламин (0,60 г, 5,97 ммоль) и аминобензоил-фталазинон (1,50 г, 5,97 ммоль) или его эквивалент. Смесь плавно нагрели до кипения и кипятили с обратным холодильником с обезвоживанием (СаСl2) в течение 2 часов и охладили до комнатной температуры. Затем вылили реакционную смесь в воду (250 мл) и отфильтровали твердую фазу. К перемешанной суспензии бензилоксиметокси-бензилфталазинона (187) (5,00 г, 13,0 ммоль) в дихлорметане (11,5 мл) в атмосфере азота добавили раствор трибромида бора в дихлорметане (1,0 М раствор, 4,4 мл, 4,40 ммоль). Затем реакционную смесь плавно нагрели до кипения и кипятили с обратным холодильником в течение 24 ч, охладили до комнатной температуры и вылили в смесь воды со льдом(250 мл). После этого повысили основность смеси, добавив твердый гидроксид натрия, и удалили органический слой. Промыли водный слой дихлорметаном (3 х 50 мл) и подкислили концентрированной HCl. Осадок отфильтровали, промыли водой и высушили на воздухе. Перемешанную суспензию исходного метоксисоединения (241) (1,50 г, 5,27 ммоль) в растворе трибромида бора в дихлорметане (1,0 М раствор, 12 мл, 12,00 ммоль) плавно нагрели до кипения и кипятили с обратным холодильником в течение 8 ч в атмосфере азота. Затем охладили реакционную смесь до комнатной температуры и вылили в смесь воды со льдом (250 мл). После этого повысили основность смеси, добавив твердый гидроксид натрия, и удалили органический слой. Промыли водный слой дихлорметаном (3 х 50 мл) и подкислили концентрированной НСl. Осадок отфильтровали, промыли водой и высушили на воздухе. Раствор карбоновой кислоты (276) (8 г, 0.028 моль) в дихлорметане (240 мл) добавили по каплям при температуре окружающей среды в перемешанную смесь дициклогексилкарбодиимида (5,8 г, 0,028 моль), 4-(диметиламино)пиридина (0,2 г, 0.0014 моль), метанола (0,92 г, 0.028 моль) и дихлорметана (40 мл), затем перемешали смесь при температуре окружающей среды в течение 18 ч и профильтровали. Осадок на фильтре промыли дихлорметаном (280 мл), объединили фильтрат и смывку и удалили растворитель в вакууме. Остаток разбавили диэтиловым эфиром (1000 мл), полученный осадок удалили фильтрацией, затем промыли эфирный фильтрат насыщенным водным раствором гидрокарбоната натрия (400 мл), 1,5 М соляной кислоты (400 мл), воды (400 мл) и насыщенным водным раствором хлорида натрия(400 мл). После этого высушили раствор (МgSO4) и удалили растворитель в вакууме, получив соединение 277. Раствор карбоновой кислоты (276) (3 г, 0,01 моль) в дихлорметане (90 мл) добавили по каплям при температуре окружающей среды в перемешанную смесь дициклогексилкарбодиимида (2,2 г, 0,01 моль),4-(диметиламино)пиридина (0,08 г, 0,5 ммоль), анилина (0,9 г, 0,01 моль) и дихлорметана (15 мл), затем перемешали смесь при температуре окружающей среды в течение 18 ч и профильтровали. Промыли осадок на фильтре дихлорметаном (105 мл), объединили фильтрат и смывку и удалили растворитель в вакууме. Остаток разбавили диэтиловым эфиром (375 мл), полученный осадок удалили фильтрацией, затем промыли эфирный фильтрат насыщенным водным раствором гидрокарбоната натрия (150 мл), 1,5 М соляной кислоты (150 мл), воды (150 мл) и насыщенным водным раствором хлорида натрия (150 мл). Раствор высушили (MgSO4) и удалили растворитель в вакууме, получив соединение 278.(к) Получения производного соединения 197. К перемешанному раствору соединения 197 (1 г, 3 ммоль) и триэтиламина (0,4 мл) в 1,4-диоксане(50 мл) добавили 3-хлорметилбензоилхлорид (0,56 г, 3 ммоль), затем перемешали смесь при температуре окружающей среды в течение 2 ч и разбавили ее водой (100 мл). Продукт экстрагировали в этилацетат (3 х 50 мл), объединенный экстракт высушили (MgSO4) и удалили растворитель в вакууме. Осадок растерли в порошок с горячим толуолом (50 мл), профильтровали (с целитом) горячий раствор, добавили циклогексан (50 мл) и выдержали смесь до охлаждения до температуры окружающей среды. Образовавшийся осадок отфильтровали и высушили в вакууме, получив 3-(хлорметил)-N-[2-морфолино-5-(1-оксофталазин-4-илметил)фенил]бензамид (1,32 г, 90%) в форме твердого вещества с температурой плавления 117-122 С. Смесь 3-(хлорметил)-N-[2-морфолино-5-(1-оксофталазин-4-морфолино-5-(1-оксофталазин-4-илметил)фенил]бензамида (0,66 г, 1,35 ммоль), соответствующего амина (27 ммоль) и 1,4-диоксана (50 мл) нагрели до кипения и кипятили с обратным холодильником в течение 2 ч, охладили до температуры окружающей среды и разбавили водой (100 мл), получив вязкий осадок. Водный слой удалили декантацией, а оставшийся осадок экстрагировали в этилацетат (3 х 50 мл). Объединенный экстракт промыли водой (50 мл), высушили (MgSO4), а затем удалили растворитель в вакууме. Осадок растерли в порошок с горячим толуолом (50 мл), горячий раствор отделили декантацией от нерастворимого материала, добавили циклогексан (50 мл) и выдержали смесь для охлаждения до температуры окружающей среды. Образовавшуюся твердую фазу отфильтровали, промыли циклогексаном (30 мл) и высушили в вакууме, получив желаемое соединение. 4-хлорбутирилхлорид (1,26 г, 8,9 ммоль) добавили к перемешанному раствору соединения 197 (3 г,8,9 ммоль) и триэтиламина (0,9 г, 8,9 ммоль) в 1,4-диоксане (50 мл), смесь перемешали при температуре окружающей среды в течение 2 ч, а затем разбавили водой, получив вязкий полутвердый осадок. Водную фазу удалили декантацией, а остаток растерли в порошок с горячим этилацетатом (100 мл). Горячий раствор отделили от нерастворимого осадка и удалили растворитель в вакууме. Остаток растерли в порошок с циклогексаном (50 мл), а образовавшуюся твердую фазу отфильтровали и высушили в вакууме, получив 4-хлор-N-[2-морфолино-5-(1-оксофталазин-4-илметил)фенил]бутирамид. Применение Согласно настоящему изобретению предложены активные соединения, в частности соединения, активные в отношении ингибирования активности PARP. Термин "активный" используемый в настоящем описании, относится к соединениям, способным ингибировать активность PARP и включает, в частности, как соединения с внутренней активностью (лекарства), так и пролекарства таких соединений, при этом указанные пролекарства сами могут проявлять небольшую или нулевую внутреннюю активность. Одна из проб, которую удобно использовать для оценки ингибирования PARP конкретным соединением, описана в приведенных ниже примерах. Настоящее изобретение обеспечивает также способ ингибирования активности PARP в клетке,- 16006300 включающий контактирование указанной клетки с эффективным количеством активного соединения,предпочтительно в форме фармацевтически допустимого состава. Такой способ можно практически реализовать как в лабораторных условиях, так и в живом организме. Так, например, можно вырастить образец клеток в лабораторных условиях, ввести активное соединение в контакт с указанными клетками и наблюдать эффект воздействия соединения на эти клетки. Для оценки такого эффекта можно, например, определить количество ДНК, восстанавливаемое за определенный промежуток времени. Если влияние активного соединения на клетки подтверждается, то это можно использовать в качестве прогностического или диагностического маркера эффективности соединения в способах лечения пациента, который является носителем клеток того же самого клеточного типа. Термин "лечение", используемый в настоящем описании в контексте лечения состояния, относится в целом к лечению и терапии человека или животного (например, для применения в ветеринарных целях), когда обеспечивается определенный желаемый терапевтический эффект, например, ингибирование прогрессирования состояния, и включает уменьшение скорости прогрессирования, прекращение прогрессирования, облегчение состояния и излечение состояния. Данный термин включает также лечение в качестве профилактической меры (т. е. профилактики). Термин "адъюнкт", используемый в настоящем описании, относится к применению активных соединений в сочетании с известными терапевтическими средствами. Такие средства включают цитотоксические схемы лекарственного лечения и/или ионизирующего излучения, применяемые для лечения различных раковых заболеваний. Активные соединения можно также использовать в качестве добавок к клеточной структуре для ингибирования PARP, например, с целью радиосенсибилизации клеток к известным способам лечения с помощью химиотерапии и ионизирующего излучения в лабораторных условиях. Активные соединения можно также частично использовать для лабораторного исследования, например, с целью определения вероятности положительного эффекта для кандидата-хозяина от лечения соответствующим соединением. Введение Активное соединение или фармацевтический состав, содержащий активное соединение, можно вводить субъекту любым известным способом, систематично/периферийно или на участке желаемого воздействия, включая без ограничения перорально (например, путем проглатывания), локально (в том числе, например, трансдермально, интраназально, трансокулярно, трансбуккально и сублингвально),пульмонально (например, путем ингаляции или инсуффляции при использовании, например, аэрозоля, в частности, при введении через рот или нос), ректально, вагинально, парентерально, например, с помощью инъекции, в том числе подкожно, интрадермально, внутримышечно, внутривенно, внутриартериально, интракардиально, внутриоболочечно, интраспинально, интракапсулярно, подкапусльно, интраорбитально, интраперитонеально, интратрахеально, субкутикулярно, интраартикулярно, субарахноидально и интрастернально, а также путем имплантации депо, например, подкожно или внутримышечно. Субъект может быть эукариотом, животным, позвоночным животным, млекопитающим, грызуном(например, морской свинкой, хомяком, крысой, мышью), членом семейства мышиных или крысиных(например, мышью), членом семейства псовых (например, собакой), членом семейства кошачьих (например, кошкой), лошадиных (например, лошадью), приматом, обезьяноподобным (например, обезьяной или человекообразной обезьяной), обезьяной (например, мартышкой, бабуином), человекообразной обезьяной (например, гориллой, шимпанзе, орангутаном, гиббоном) или человеком. Составы Активное соединение можно вводить отдельно, однако, предпочтительно, чтобы оно присутствовало в форме фармацевтического состава (например, лекарственной композиции), содержащего по меньшей мере одно активное соединение, как указано выше, совместно с одним или несколькими фармацевтически допустимыми носителями, адъювантами, связующими, разбавителями, наполнителями, буферами, стабилизаторами, консервантами, смазками или иными материалами, хорошо известными специалистам, а также, возможно, с другими терапевтическими или профилактическими агентами. Таким образом, настоящее изобретение обеспечивает также фармацевтические составы, как указано выше, и способы получения фармацевтического состава, содержащего примесь по меньшей мере одного активного соединения, как указано выше, совместно с одним или несколькими фармацевтически допустимыми носителями, наполнителями, буферами, адъювантами, стабилизаторами или другими материалами согласно настоящему описанию. Термин "фармацевтически допустимый", используемый в настоящем описании, относится к соединениям, материалам, составам и/или дозированным формам, которые согласно обоснованным медицинским заключениям являются пригодными для применения в контакте с тканями субъекта (например, человека) без чрезмерной токсичности, раздражения, аллергической реакции или иных проблем или осложнений с учетом разумного соотношения между пользой и риском. Каждый носитель, наполнитель и т.п. должен быть также допустимым с точки зрения совместимости с другими ингредиентами состава. Перечень пригодных носителей, наполнителей и т.д. можно найти в стандартных фармацевтических справочниках, например Remington's Pharmaceutical Sciences. 18th edition, Mack Publishing Company,- 17006300Easton, Pa., 1990. Составы можно представить в порционной дозированной форме и получить любыми способами,хорошо известными в фармацевтике. Такие способы включают операцию объединения активного соединения с носителем, который содержит один или несколько вспомогательных ингредиентов. В общем случае составы получают путем образования однородной смеси активного соединения с жидкими носителями, тонкодисперсными твердыми носителями или с обеими формами носителей, а затем в случае необходимости подвергают продукт формованию. Составы могут иметь форму жидкостей, растворов, суспензий, эмульсий, эликсиров, сиропов, таблеток, losenges, гранул, порошков, капсул, крахмальных облаток, пилюль, ампул, суппозиториев, пессариев, мазей, гелей, паст, кремов, спреев, распыляемых жидкостей, пен, лосьонов, масел, болюсов, электуариев или аэрозолей. Составы, пригодные для перорального введения (например, путем проглатывания), могут быть представлены в виде дискретных форм, в частности капсул, крахмальных облаток или таблеток, каждая из которых содержит предварительно определенное количество активного соединения, порошка или гранул, раствора или суспензии в водной или неводной жидкости, жидкой эмульсии типа "масло в воде" или"вода в масле", болюса, электуария или пасты. Таблетка может быть изготовлена обычными способами, например, прессованием или литьем, возможно, с одним или несколькими вспомогательными ингредиентами. Прессованные таблетки можно изготовить путем прессования на соответствующей машине активного соединения в сыпучей форме, в частности, в форме порошка или гранул, возможно, смешанного с одним или несколькими связующими(например, с повидоном, желатином, гуммиарабиком, сорбитолом, трагакантом, гидроксипропилметилцеллюлозой), наполнителями или разбавителями (например, с лактозой, микрокристаллической целлюлозой, гидрофосфатом кальция), смазывающими веществами (например, со стеаратом магния, тальком,кремнеземом), агентами, вызывающими распад лекарства (например, с крахмальным гликолятом натрия,повидоном с поперечными связями, карбоксиметилцеллюлозой натрия с поперечными связями), поверхностно-активными, диспергирующими или смачивающими агентами (например, с лаурилсульфатом натрия) и консервантами (например, с метил-п-гидроксибензоатом, пропил-п-гидроксибензоатом, сорбиновой кислотой). Литые таблетки можно получить с помощью соответствующей машины путем отливки смеси порошкообразного соединения, увлажненного инертным жидким разбавителем. На таблетки можно нанести покрытие или бороздки, а также выполнить их таким образом, чтобы обеспечить медленное или регулируемое выделение активного вещества при их приеме, используя, например, гидроксипропилметилцеллюлозу в различных соотношениях, чтобы получить желаемый профиль выделения. На таблетки можно нанести энтеросолюбильное покрытие, чтобы обеспечить выделение одних компонентов в кишечнике, а других - в желудке. Составы, пригодные для локального применения (например, трансдермального, интраназального,трансокулярного, трансбуккального, или сублингвального), можно получить в форме мази, крема, суспензии, лосьона, порошка, раствора, пасты, геля, спрея, аэрозоля или масла. В альтернативном исполнении средство может содержать дорожку или повязку, в частности, бандаж или клейкий пластырь, пропитанный активными соединениями и, возможно, одним или несколькими наполнителями или разбавителями. Составы, пригодные для локального введения в рот, включают леденцы, содержащие активное соединение на вкусовой основе, обычно на основе сахарозы и гуммиарабика или трагаканта, пастилки, содержащие активное соединение на инертной основе, в частности, на основе желатина и глицерина, или сахарозы и гуммиарабика, а также жидкости для полоскания рта, содержащие активное соединение в соответствующем жидком носителе. Составы, пригодные для локального введения в глаза, включают также глазные капли, в которых активное вещество растворено или взвешено в соответствующем носителе, в частности, в водном растворителе активного соединения. Составы, пригодные для назального введения, в которых носитель является твердой фазой, содержат крупнодисперсный порошок с размером частиц примерно от 20 до примерно 500 мкм, который вводят таким же образом, как нюхательный табак, т.е. быстрым вдыханием через носовой проход из контейнера с порошком, который держат вблизи носа. Пригодные для введения составы, в которых носитель является жидкостью, как, например, в случае назального спрея, капель в нос или аэрозоля, распыляемого пульверизатором, включают водные или масляные растворы активного соединения. Составы, пригодные для введения путем ингаляции, включают аэрозольный спрей, находящийся в баллоне под давлением в присутствии соответствующего газа-вытеснителя, в частности, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или других пригодных газов. Составы, пригодные для локального введения через кожу, включают мази, кремы и эмульсии. При приготовлении в форме мази активное соединение может использоваться с парафиновой или смешивающейся с водой основой мази. В альтернативном исполнении активные соединения можно получать в форме крема с эмульсионной основой типа "масло в воде". Если требуется, водная фаза кремовой основы может включать, например, по меньшей мере около 30 мас.% многоатомного спирта, т.е. спирта, имею- 18006300 щего две или несколько гидроксильных групп, в частности, пропиленгликоля, бутан-1,3-диола, маннитола, сорбитола, глицерина и полиэтиленгликоля, а также их смесей. Составы для локального нанесения при желании могут включать соединение, которое усиливает абсорбцию или способность активного вещества проникать через кожу или другие пораженные зоны. Примеры таких агентов, усиливающих трасндермальное проникновение, включают диметилсульфоксид и его родственные аналоги. В случае приготовления эмульсии для локального нанесения масляная фаза может содержать только один эмульгатор (называемый также эмульгентом) или смесь по меньшей мере одного эмульгатора с жиром или с маслом или совместно с жиром и маслом. Гидрофильный эмульгатор включают в состав предпочтительно вместе с липофильным эмульгатором, который действует в качестве стабилизатора. Предпочтительно также включать в состав как масло, так и жир. Эмульгаторы вместе со стабилизаторами или без них образуют, так называемый, эмульгирующий воск, а воск вместе с маслом и/или жиром в свою очередь составляет, так называемую, эмульгирующую основу мази, которая образует масляную дисперсную фазу кремовых составов. Пригодные эмульгенты и стабилизаторы эмульсии включают Tween 60, Span 80, цетостеариловый спирт, миристиловый спирт, моностеарат глицерина и сульфат лаурила натрия. Выбор пригодных масел или жиров для состава основан на обеспечении желательных косметических свойств, поскольку растворимость активного соединения в большинстве масел, обычно применяемых для фармацевтических эмульсионных составов, может быть очень низкой. Поэтому крем должен быть предпочтительно нежирным, не оставляющим пятен, смываемым продуктом и иметь соответствующую консистенцию, чтобы не вытекать из тюбиков или иных контейнеров. При этом можно использовать одно- и двухосновные сложные алкиловые эфиры с прямой или разветвленной цепью, в частности, диизоадипат, изоцетилстеарат,пропиленгликолевый эфир двухосновных жирных кокосовых кислот, изопропилмиристат, децилолеат,изопропилпальмитат, бутилстеарат, 2-этилгексилпальмитат или смесь сложных эфиров с разветвленной цепью, известную как Crodamol CAP, три последних сложных эфира являются предпочтительными. Их можно использовать по отдельности или в сочетании в зависимости от требуемых свойств. В альтернативном варианте исполнения можно использовать липиды с высокой температурой плавления, в частности, бесцветный мягкий парафин и/или жидкий парфин или другие минеральные масла. Составы, пригодные для ректального введения можно получить в форме суппозитория с пригодным основанием, содержащим, например, масло какао или салицилат. Составы, пригодные для вагинального введения, можно получить в форме пессариев, тампонов,кремов, гелей, паст, пен или других составов, содержащих кроме активного соединения соответствующие носители, известные специалистам. Составы, пригодные для парентерального введения (например, путем инъекции, включая кожную,подкожную, внутримышечную, внутривенную и интрадермальную инъекцию), включают водные и неводные изотонические беспирогенные, стерильные растворы для инъекции, которые могут содержать антиоксиданты, буферы, консерванты, стабилизаторы, бактериостаты и растворы, которые обеспечивают изотоничность состава с кровью предполагаемого реципиента, а также водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и сгущающие агенты, а также липосомы и другие системы микрочастиц, которые предназначены для того, чтобы направлять активное соединение в компоненты крови или в один или несколько органов. Примеры пригодных изотонических носителей для применения в таких составах включают инъекцию хлорида натрия, раствор Рингера или лактатную инъекцию Рингера. Типичная концентрация активного соединения в растворе составляет примерно от 1 нг/мл до 10 мкг/мл, в частности, примерно от 10 нг/мл до 1 мкг/мл. Составы могут быть расфасованы в порционные герметичные контейнеры с одной или несколькими дозами, например, в ампулы или флаконы и могут храниться в сублимированном (лиофилизованном) состоянии, при этом непосредственно перед употреблением требуется добавить только стерильный жидкий носитель, например, воду для инъекций. Растворы и суспензии для инъекций, предназначенные для непосредственного введения, можно получить из стерильных порошков, гранул и таблеток. Составы могут иметь форму липосом и других систем микрочастиц, которые предназначены для того, чтобы направлять активное соединение в компоненты крови или в один или несколько органов. Дозирование Следует понимать, что соответствующая система дозирования активных соединений и составов,содержащих активные соединения, может быть различной для разных пациентов. Определение оптимального дозирования обычно включает балансирование уровня терапевтической пользы по отношению к опасности или вредным побочным эффектам от лечения согласно настоящему изобретению. Выбранный уровень дозирования зависит от множества факторов, включая без ограничения активность конкретного соединения, способ введения, время введения, скорость выделения соединения, длительность лечения, другие препараты, соединения и/или материалы, используемые в сочетании, а также возраст, пол,массу, конкретное и общее состояние здоровья и историю болезни пациента. Количество соединения и способ введения в конечном счете определяет врач, однако, обычно дозирование должно обеспечивать достижение в месте воздействия локальных концентраций, которые создают желаемый эффект, не вызывая существенных вредных или опасных побочных эффектов.- 19006300 Введение препарата в организм можно произвести в форме одной дозы, непрерывно или в прерывистом режиме (например, разделив на дозы через соответствующие интервалы времени) в течение всего курса лечения. Способы определения наиболее эффективных средств и доз введения хорошо известны специалистам и зависят от состава, применяемого для лечения, назначения лечения, клетки-мишени, на которую оказывается воздействие и пациента, подвергаемого лечению. Одноразовое или многоразовое введение можно выполнять в соответствии с уровнем и режимом дозирования, выбранным лечащим врачом. В общем случае адекватная доза активного соединения лежит в пределах примерно от 100 мкг до примерно 250 мг на килограмм массы тела пациента в день. Если активное соединение представляет собой соль, сложный эфир, пролекарство и т.п., вводимое количество рассчитывают на основе исходного соединения, а фактическую массу пропорционально увеличивают. Синтез Соединения, структуры которых указаны в табл. 1, с номером, большим 100, синтезировали согласно вышеописанным схемам синтеза - характеристические данные приведены далее. Соединения в табл. 1 с номером, меньшим 100, поставляет компания Maybridge plc, Корнуолл, Великобритания. Схема 1(98% чистота). 284 (определена смесь пар диастреоизмеров 7:1); ArCORL1 = 2-метилинданон. Выход 46% более 2 стадий; температура плавления 204-206 С; 5 н 0.70 и 1.10 (3 Н, 2 х d), 2.5-3.4 (3 Н,m), 4.50 и 5.1 (1 Н, 2 х d), 6.8-7.3 (4 Н, m), 7.95 (3 Н, s), 8.3-8.5 (1 Н. m) и 12.5 (1 Н, br s); m/z (М+Н)+ 277(л) 265; Выход 46%; разлагается в процессе плавления при температуре 75 С; Н 1.9-2.2 (2 Н, m), 2.7-2.85(4 Н, m), 3.5-3.9 (, m), 4.20 (2 Н, s), 7.0 (1 Н, s), 7.7-8.2 (6 Н, m), 8.80 (1H,s) и 12.50 (1H,s). Биологическое исследование Для оценки подавляющего воздействия соединений согласно изобретению использовали следующее исследование, чтобы определить значения IC50.PARP млекопитающих, выделенную из экстракта ядер клеток Hela, инкубировали с Z-буфером (25 мМ Hepes (Sigma), 12.5 мМ MgCl2 (Sigma), 50 мМ KCl (Sigma), 1 мМ DTT (Sigma), 10% глицерина(Sigma) 0,001% NP-40 (Sigma), pH 7.4) в планшетах с 96 лунками FlashPlate (торговая марка) (NEN, Великобритания), изменяя концентрации указанных добавляемых ингибиторов. Все соединения разбавилиDMSO (диметилсульфоксидом) и получили конечные концентрации для анализа от 10 до 0,01 мкМ и конечную концентрацию DMSO 1% на лунку. Суммарный объем для анализа составил 40 мкл на одну лунку. Через 10 мин инкубации при 30 С инициировали реакцию путем добавления 10 мкл реакционной смеси, содержащей NAD (5 мкМ), 3H-NAD и 30-мерные олигомеры двухцепочечной ДНК. Отмеченные лунки с положительной и отрицательной реакцией скомбинировали с лунками соединения (неизвестная реакция), чтобы рассчитать % ферментной активности. Затем планшеты встряхивали в течение 2 мин и инкубировали при 30 С в течение 45 мин.- 26006300 После инкубации реакцию прервали, добавив в каждую лунку 50 мкл 30% уксусной кислоты. Затем планшеты встряхивали в течение 1 ч при комнатной температуре. Перенесли планшеты в TopCount NXT (торговая марка) (Packard, Великобритания) для подсчета сцинтилляций. Записанные значения представляют собой число импульсов в минуту (срm) после 30 секундного отсчета в каждой лунке. После этого рассчитали % ферментной активности для каждого соединения, используя следующее уравнение:% ингибирования = 100 - 100 х (срт лунок с неизвестной реакцией - средний срm лунок с отрицательной реакцией) : (средний срm лунок с положительной реакцией - средний срт лунок с отрицательной реакцией). Некоторые результаты представлены ниже в табл. 1 в форме значений IC50 (концентрация, при которой подавляется 50% ферментной активности), определенных в диапазоне различных концентраций,обычно от 10 до 0,01 мкМ. Эти значения IC50 используют как сравнительные величины для определения повышенной эффективности соединения. Для сравнения, IC50 для 100 (1(2 Н)-фталазинона с помощью вышеуказанного опыта определили равным 7,2 мкМ. Таблица 1 Провели испытание следующих соединений и получили значения IС 50, меньшие или равные 1 мкМ для 233, 278, 279, 294, 295, 601, 604, 624, 640-659, 667-678 и 680-706. Провели испытание следующих соединений и получили значения IC50, меньшие или равные 3 мкМ для 253, 254, 265 и 619. Провели испытание следующих соединений и получили значения IC50, меньшие или равные 5 мкМ для 266, 283, 284 и 285. Коэффициент усиления дозы (DEF) представляет собой отношение ингибирования роста клеток,вызываемого испытуемым соединением в присутствии блеомицина, по сравнению с воздействием одного лишь блеомицина. Испытуемые соединения использовали при фиксированной концентрации 25 мкМ. Концентрация используемого блеомицина составляла 0,5 мг/мл. DEF рассчитывали по формулеGrowth(bleo+TC) - рост клеток в присутствии блеомицина и испытуемого соединения. Рост клеток оценивали с помощью пробы сульфородамином В (SRB) (Skehan, P., et al., 1990, J. Natl.Cancer Inst, 82, 1107-1112). 2,000 клеток HeLa высевали в каждую лунку титрационного микропланшета с 96 лунками, имеющими плоское дно и объем 100 мкл, и инкубировали в течение 6 ч при 37 С. Клетки помещали либо в чистую среду, либо в среду, содержащую испытуемое соединение с конечной концентрацией 25 мкМ. Затем клетки выращивали в течение еще одного часа и добавляли блеомицин к необработанным клеткам или к клеткам, обработанным испытуемым соединением. В качестве контрольных использовали клетки, не обработанные ни блеомицином, ни испытуемым соединением. Клетки, обработанные только испытуемым соединением, использовали для оценки ингибирования роста испытуемым соединением. Затем клетки выдержали в течение 16 ч, заменили среду и выращивали их в течение последующих 72 ч при 37 С. После этого удалили среду и зафиксировали клетки 100 мкл охлажденной льдом трихлоруксусной кислотой с концентрацией 10% (мас./об.). Планшеты выдержали при 4 С в течение 20 мин, а затем четыре раза промыли водой. Каждую лунку с клетками окрасили, добавив 100 мкл 0,4% (мас./об.)SRB в 1% уксусной кислоте в течение 20 мин, а затем промыли четыре раза 1% уксусной кислотой. После этого высушили планшеты в течение 2 ч при комнатной температуре. Растворили краситель со всех окрашенных клеток путем добавления 100 мкл 10 мМ Tris Base в каждую лунку. Легко встряхнули планшеты и выдержали их при комнатной температуре в течение 30 мин, а затем измерили оптическую плот- 28006300 ность при 564 нм с помощью аппарата для чтения титрационных микропланшетов Microquant. Некоторые результаты представлены в табл. 2. Таблица 2 Провели испытание следующих соединений и получили значения DEF, большие 1: 233, 249, 254,265, 278, 279, 283, 284, 640, 645, 648-654, 655-658, 667, 671, 672, 678, 680, 683, 684 и 686-688. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения формулы а также его изомеров, солей, сольватов, химически защищенных форм и предшественников, для получения медикамента, ингибирующего активность PARP,где А и В совместно представляют возможно замещенное конденсированное бензольное кольцо,Rc представляет собой -CH2-RL, -CH2CH2-RL, или -CH2SRL; aRL является возможно замещенной ариловой группой С 6. 2. Применение соединения формулы а также его изомеров, солей, сольватов, химически защищенных форм и предшественников, для получения медикамента, используемого в качестве адъюнкта в терапии рака,где А и В совместно представляют возможно замещенное конденсированное бензольное кольцо,Rc представляет собой -CH2-RL, -CH2CH2-RL или -CH2SRL; aRL является возможно замещенной ариловой группой С 6. 3. Применение по п.2, отличающееся тем, что адъюнкт предназначен для применения в сочетании с ионизирующим излучением. 4. Применение по п.2, отличающееся тем, что адъюнкт предназначен для применения в сочетании с химиотерапевтическими агентами. 5. Применение по любому из пп.1-4, отличающееся тем, что конденсированное бензольное кольцо является незамещенным. 6. Применение по любому из пп.1-5, отличающееся тем, что RL содержит один или несколько заместителей, которые выбраны из группы, включающей алкил C1-7, арил С 5-20, гетероциклил С 3-20, гало,гидрокси, эфир, нитро, циано, карбонильные группы, амино, ациламидо, ацилокси, тиол, тиоэфир, сульфоксид и сульфонгруппу. 7. Применение по п.6, отличающееся тем, что RL содержит заместитель, который выбран из группы,включающей ациламидо, уреидо, сульфонамино и ацилоксигруппу. 8. Фармацевтический состав, содержащий соединение формулы его изомеры, соли, сольваты, химически защищенные формы и предшественники,где А и В совместно представляют возможно замещенное конденсированное бензольное кольцо,Rc имеет формулу -CH2-RL, RL - возможно замещенный фенил, а также фармацевтически допустимый носитель или разбавитель. 9. Фармацевтический состав по п.8, отличающийся тем, что конденсированное бензольное кольцо является незамещенным. 10. Фармацевтический состав по пп.8-9, отличающийся тем, что RL содержит один или несколько заместителей, которые выбранны из группы, включающей алкил C1-7, арил С 5-20, гетероциклил С 3-20,гало-, гидрокси-, эфир, нитро-, циано-, карбонильные группы, амино-, ациламидо-, ацилокси-, тиол, тиоэфир, сульфоксид- и сульфонгруппу. 11. Фармацевтический состав по п.10, отличающийся тем, что RL содержит заместитель, который выбран из группы, включающей ациламидо-, уреидо-, сульфонамино- и ацилоксигруппу. 12. Соединение формулы
МПК / Метки
МПК: A61P 31/20, A61K 31/502, C07D 237/32
Метки: фталазинона, производные
Код ссылки
<a href="https://eas.patents.su/30-6300-proizvodnye-ftalazinona.html" rel="bookmark" title="База патентов Евразийского Союза">Производные фталазинона</a>
Предыдущий патент: 8β-гидрокарбилзамещенные эстратриены в качестве эстрогенов избирательного действия
Следующий патент: Ацильные производные, используемые для лечения опосредованных vla-4 расстройств
Случайный патент: Способ извлечения золота












