Аналоги глюкагоноподобного пептида и их применение
Формула / Реферат
1. Аналог глюкагоноподобного пептида (GLP-1), включающий аминокислотную последовательность формулы I (SEQ ID NO: 1):
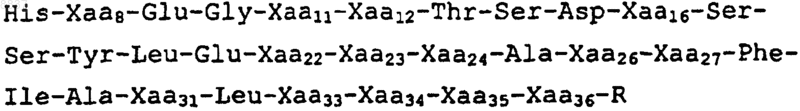
Формула I (SEQ ID NO: 1)
где
Xaa8 представляет собой Gly или Val;
Хаа11 представляет собой Asp, Glu, Arg, Thr, Ala, Lys или His;
Xaa12 представляет собой His, Trp, Phe или Tyr;
Xaa16 представляет собой Leu, Ser, Thr, Trp, His, Phe, Asp, Val, Tyr, Glu или Ala;
Хаа22 представляет собой Glu;
Хаа23 представляет собой His, Asp, Lys, Glu, Gln или Arg;
Xaa24 представляет собой Glu, Arg, Ala или Lys;
Хаа26 представляет собой Trp, Tyr, Phe, Asp, Lys, Glu или His;
Xaa27 представляет собой Ala, Glu, His, Phe, Tyr, Trp, Arg или Lys;
Хаа30 представляет собой Ala, Glu, Asp, Ser или His;
Хаа33 представляет собой Asp, Arg, Val, Lys, Ala, Gly или Glu;
Хаа34 представляет собой Glu, Lys или Asp;
Xaa35 представляет собой Thr, Ser, Lys, Arg, Trp, Tyr, Phe, Asp, Gly, Pro, His или Glu;
Хаа36 представляет собой Thr, Ser, Asp, Trp, Tyr, Phe, Arg, Glu или His;
R представляет собой Lys, Arg, Thr, Ser, Glu, Asp, Trp, Tyr, Phe, His, -NH2, Gly, Gly-Pro или Gly-Pro-NH2 или отсутствует.
2. Аналог глюкагоноподобного пептида (GLP-1), включающий аминокислотную последовательность формулы II (SEQ ID NO: 2):

Формула II (SEQ ID NO: 2)
где
Xaa8 представляет собой Gly или Val;
Xaa12 представляет собой His, Trp, Phe или Tyr;
Xaa16 представляет собой Leu, Ser, Thr, Trp, His, Phe, Asp, Val, Glu или Ala;
Xaa22 представляет собой Glu;
Хаа23 представляет собой His, Asp, Lys, Glu или Gln;
Хаа26 представляет собой Asp, Lys, Glu или His;
Хаа30 представляет собой Ala, Glu, Asp, Ser или His;
Xaa35 представляет собой Thr, Ser, Lys, Arg, Trp, Tyr, Phe, Asp, Gly, Pro, His или Glu;
R представляет собой Lys, Arg, Thr, Ser, Glu, Asp, Trp, Tyr, Phe, His, -NH2, Gly, Gly-Pro или Gly-Pro-NH2 или отсутствует.
3. Аналог глюкагоноподобного пептида (GLP-1), включающий аминокислотную последовательность формулы III (SEQ ID NO: 3):

Формула III (SEQ ID NO: 3)
где
Xaa8 представляет собой Gly или Val;
Xaa22 представляет собой Glu;
Хаа23 представляет собой His, Asp, Lys, Glu или Gln;
Xaa27 представляет собой Ala, Glu, His, Phe, Tyr, Trp, Arg или Lys;
Хаа30 представляет собой Ala, Glu, Asp, Ser или His;
R представляет собой Lys, Arg, Thr, Ser, Glu, Asp, Trp, Tyr, Phe, His, -NH2, Gly, Gly-Pro или Gly-Pro-NH2 или отсутствует.
4. Аналог GLP-1 по любому из пп.1-3, в котором не более чем 6 аминокислот отличаются от соответствующей аминокислоты в известном аналоге GLP-1(7-37)ОН или GLP-1(7-36)NH2.
5. Аналог GLP-1 по п.4, в котором не более чем 5 аминокислот отличаются от соответствующей аминокислоты в GLP-1(7-37)ОН или GLP-1(7-36)NH2.
6. Аналог GLP-1 по п.5, в котором не более чем 4 аминокислоты отличаются от соответствующей аминокислоты в известном аналоге GLP-1(7-37)ОН или GLP-1(7-36)NH2.
7. Аналог GLP-1 по п.6, в котором не более чем 3 аминокислоты отличаются от соответствующей аминокислоты в известном аналоге GLP-1(7-37)ОН или GLP-1(7-36)NH2.
8. Аналог GLP-1 по п.7, в котором не более чем 2 аминокислоты отличаются от соответствующей аминокислоты в известном аналоге GLP-1(7-37)ОН или GLP-1(7-36)NH2.
9. Аналог GLP-1 по любому из пп.4-7, где Хаа8 представляет собой глутаминовую кислоту.
10. Аналог GLP-1 по любому из пп.4-7, где R представляет собой гистидин, фенилаланин, тирозин, триптофан, аспарагиновую кислоту, глутаминовую кислоту, серин, треонин, аргинин или лизин.
11. Аналог GLP-1 по п.10, где R представляет собой гистидин.
12. Аналог GLP-1 по любому из пп.4-7, где Хаа23 представляет собой глутаминовую кислоту или лизин.
13. Аналог GLP-1 по любому из пп.4-7, где Хаа27 представляет собой аланин.
14. Применение аналога GLP-1 по любому из пп.1-13 для лечения инсулиннезависимого диабета.
15. Применение аналога GLP-1 по любому из пп.1-13 для профилактики инсулиннезависимого диабета.
16. Применение аналога GLP-1 по любому из пп.1-13 для лечения ожирения, инсульта, инфаркта миокарда, катаболических изменений после хирургической операции или синдрома раздраженного кишечника.
17. Применение соединения GLP-1 по любому из пп.1-13 для получения лекарственного средства для лечения инсулиннезависимого диабета.
18. Применение соединения GLP-1 по любому из пп.1-13 для получения лекарственного средства для лечения ожирения, инсульта, инфаркта миокарда, катаболических изменений после хирургической операции или синдрома раздраженного кишечника.
Текст
008837 По настоящей заявке испрашивается приоритет предварительной заявки США 60/212171, поданной 16 июня 2000 года, и предварительной заявки США номер 60/240349, поданной 13 октября 2000 года. Глюкагоноподобный пептид-1 (GLP-1) представляет собой пептид из 37 аминокислот, который секретируется L-клетками кишечника в ответ на проглатывание пищи. Было обнаружено, что он стимулирует секрецию инсулина (инсулинотропное действие), вызывая в результате этого захват глюкозы клетками и снижение уровня глюкозы в крови (смотри, например, Mojsov, S., Int. J. Peptide Protein Research, 40: 333-343 (1992. Однако GLP-1(1-37) является малоактивным, и внимание сосредотачивали на его укороченных аналогах, обозначаемых как соединения GLP, которые биологически намного более эффективны,чем GLP-1. Примеры включают GLP-1(7-37), GLP-1(7-36)NH2, Gly8-GLP-1(7-37)ОН и Ser34-GLP-1(7-37)ОН. Благодаря своей способности стимулировать секрецию инсулина аналоги GLP-1 являются многообещающими в качестве агентов для лечения диабета, ожирения и родственных им состояний. Аналоги GLP-1 могут существовать по меньшей мере в двух различных формах. Первая форма является физиологически активной и легко растворяется в водном растворе при физиологическом рН (7,4). В отличие от этого, вторая форма не обладает или обладает небольшой инсулинотропной активностью и,по существу, не растворима в воде при рН 7,4. К сожалению, неактивная форма с легкостью получается при перемешивании водных растворов GLP-1, их контакте с гидрофобными поверхностями или при больших поверхностях контакта воздух/вода. Тенденция к превращению в нерастворимую форму существенно осложняет получение промышленных количеств активных аналогов GLP-1; операции по смешиванию или продолжительное продвижение через насос являются обычными операциями в объемных промышленных процессах, и данные операции вызывают перемешивание, создают большие поверхности контакта воздух/вода и/или контакт с гидрофобными поверхностями, что ведет к образованию нерастворимой формы. Превращение в неактивную форму может также осуществляться при хранении или после введения больному, что дополнительно осложняет применение данных соединений в качестве лекарств. Следовательно, существует настоятельная необходимость в биологически активных аналогах GLP-1,которые превращаются в нерастворимую форму с меньшей легкостью, чем доступные в настоящее время соединения GLP-1. В настоящее время обнаружено, что ряд аналогов GLP-1 с модификациями в одном или более из следующих положений: 11, 12, 16, 22, 23, 24, 26, 27, 30, 33, 34, 35, 36 или 37, проявляют заметно пониженную склонность к агрегации по сравнению с GLP-1(7-37)ОН. Многие из данных аналогов сохраняют способность к активации рецепторов GLP-1, которая сравнима и в некоторых случаях выше, чем для известных соединений GLP-1, таких как GLP-1(7-37)ОН иVal8-GLP-1(7-37)ОН. Например, время агрегации Val8-Glu22-GLP-1(7-37)ОН является более чем в 20 раз большим и его активация рецепторов GLP-1 является приблизительно на 25% более высокой, чем GLP1(7-37)ОН. На основе данных находок здесь раскрываются новые аналоги GLP-1 и способы лечения с применением новых соединений GLP-1. В одном осуществлении настоящего изобретения представлен полипептид, имеющий аминокислотную последовательность формулы I (SEQ ID NO: 1):R представляет собой Lys, Arg, Thr, Ser, Glu, Asp, Trp, Tyr, Phe, His, -NH2, Gly, Gly-Pro или Gly-ProNH2 или отсутствует,при условии, что полипептид не имеет последовательности GLP-1(7-37)ОН или GLP-1(7-36)-NH2, и при условии, что полипептид не является Gly8-GLP-1(7-37)ОН, Gly8-GLP-1(7-36)NH2, Val8-GLP-1(7-37)ОН,Val8-GLP-1(7-36)NH2, Leu8-GLP-1(7-37)ОН, Leu8-GLP-1(7-36)NH2, Ile8-GLP-1(7-37)OH, Ile8-GLP-1(7-36)NH2,-1 008837Ser8-GLP-1(7-37)OH, Ser8-GLP-1(7-36)NH2, Thr8-GLP-1(7-37)ОН или Thr8-GLP-1(7-36)NH2, Ala11-GLP-1(7-37)OH,Ala11-GLP-1(7-36)NH2, Ala16-GLP-1(7-37)OH, Ala16-GLP-1(7-36)NH2, Ala27-GLP-1(7-37)OH, Ala27-GLP-1(736)NH2, Glu27-GLP-1(7-37)OH, Glu27-GLP-1(7-36)NH2, Ala33-GLP-1(7-37)ОН или Ala33-GLP-1(7-36)NH2. В другом осуществлении настоящего изобретения представлен полипептид, имеющий аминокислотную последовательность формулы II (SEQ ID NO: 2):R представляет собой Lys, Arg, Thr, Ser, Glu, Asp, Trp, Tyr, Phe, His, -NH2, Gly, Gly-Pro или Gly-ProNH2 или отсутствует,при условии, что полипептид не имеет последовательности GLP-1(7-37)ОН или GLP-1(7-36)-NH2, и при условии, что полипептид не является Gly8-GLP-1(7-37)ОН, Gly8-GLP-1(7-36)NH2, Val8-GLP-1(7-37)ОН,Val8-GLP-1(7-36)NH2, Leu8-GLP-1(7-37)OH, Leu8-GLP-1(7-36)NH2, Ile8-GLP-1(7-37)OH, Ile8-GLP-1(7-36)NH2,Ser8-GLP-1(7-37)OH, Ser8-GLP-1(7-36)NH2, Thr8-GLP-1(7-37)OH, Thr8-GLP-1(7-36)NH2, Ala16-GLP-1(737)OH или Ala16-GLP-1(7-36)NH2. В другом осуществлении настоящего изобретения представлен полипептид, имеющий аминокислотную последовательность формулы III (SEQ ID NO: 3):R представляет собой: Lys, Arg, Thr, Ser, Glu, Asp, Trp, Tyr, Phe, His, -NH2, Gly, Gly-Pro или Gly-ProNH2 или отсутствует,при условии, что полипептид не имеет последовательности GLP-1(7-37)ОН или GLP-1(7-36)-NH2, и при условии, что полипептид не является Gly8-GLP-1(7-37)ОН, Gly8-GLP-1(7-36)NH2, Val8-GLP-1(7-37)ОН,Val8-GLP-1(7-36)NH2, Leu8-GLP-1(7-37)ОН, Leu8-GLP-1(7-36)NH2, Ile8-GLP-1(7-37)OH, Ile8-GLP-1(7-36)NH2,Ser8-GLP-1(7-37)OH, Ser8-GLP-1(7-36)NH2, Thr8-GLP-1(7-37)OH, Thr8-GLP-1(7-36)NH2, Ala16-GLP-1(7-37)OH,Ala16-GLP-1(7-36)NH2, Glu27-GLP-1(7-37)OH или Glu27-GLP-1(7-36)NH2. В другом осуществлении настоящего изобретения представлен полипептид, имеющий аминокислотную последовательность формулы IV (SEQ ID NO: 4):Xaa8 представляет собой глицин, аланин, валин, лейцин, изолейцин, серин или треонин. Предпочтительно Xaa8 представляет собой глицин, валин, лейцин, изолейцин, серин или треонин; Хаа 22 представляет собой аспарагиновую кислоту, глутаминовую кислоту, глутамин, аспарагин, лизин, аргинин, цистеин или цистеиновую кислоту;-2 008837 В другом осуществлении настоящего изобретения представлен аналог глюкагоноподобного пептида-1 (GLP-1), имеющий в положении 8 аминокислоту, отличную от аланина, и в положении 22 аминокислоту, отличную от глицина. В другом осуществлении настоящего изобретения представлен способ стимуляции рецептора GLP1 у субъекта, нуждающегося в стимуляции рецептора GLP-1. Способ включает стадию введения субъекту эффективного количества описанных здесь аналогов GLP-1 или полипептида, имеющего аминокислотную последовательность SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4. Еще в одном осуществлении настоящего изобретения представлены описанные здесь аналоги GLP1 или полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1, SEQ ID NO: 2, SEQ IDNO: 3 или SEQ ID NO: 4, для применения для стимуляции рецептора GLP-1 у субъекта, нуждающегося в стимуляции рецептора GLP-1. Аналоги GLP-1 по настоящему изобретению сохраняют способность к активации рецептора GLP-1 и, кроме того, имеют пониженную склонность к агрегации по сравнению с другими аналогами GLP-1. В результате этого растворы данных соединений могут перемешиваться с минимальным превращением в нерастворимую неактивную форму. Это преимущество значительно упрощает производственный процесс. Кроме того, ожидается, что после введения больным агрегация in vivo будет небольшой или будет отсутствовать, результатом чего будет увеличение активности и сведение к минимуму возможности побочных реакций. Кроме того, данные аналоги GLP-1 устойчивы к деградации под действием диаминопептидазы IV, и связывают цинк, и, следовательно, как ожидается, обеспечат продолжительное по времени действие in vivo. На фиг. 1 представлены аминокислотные последовательности Val8-Glu22-GLP-1(7-37)OH (SEQ IDNO: 5), Val8-Asp22-GLP-1(7-37)ОН (SEQ ID NO: 6), Val8-Arg22-GLP-1(7-37)OH (SEQ ID NO: 7) и Val8Lys22-GLP-1(7-37)OH (SEQ ID NO: 8). На фиг. 2 представлены аминокислотные последовательности Gly8-Glu22-GLP-1(7-37)ОН (SEQ IDNO: 9), Gly8-Asp22-GLP-1(7-37)ОН (SEQ ID NO: 10), Gly8-Arg22-GLP-1(7-37)OH (SEQ ID NO: 11) и Gly8Lys22-GLP-1(7-37)OH (SEQ ID NO: 12). На фиг. 3 представлены аминокислотные последовательности Val8-Glu30-GLP-1(7-37)OH (SEQ IDNO: 13), Gly8-Glu30-GLP-1(7-37)OH (SEQ ID NO: 14), Val8-His37-GLP-1(7-37)OH (SEQ ID NO: 15) и Gly8His37-GLP-1(7-37)OH (SEQ ID NO: 16). На фиг. 4 представлены аминокислотные последовательности Val8-Glu22-Ala27-GLP-1(7-37)OH (SEQID NO: 17) и Val8-Lys22-Glu23-GLP-1(7-37)OH (SEQ ID NO: 18). Аналог GLP-1 представляет собой полипептид, имеющий от приблизительно 25 до приблизительно 39 встречающихся в природе или не встречающихся в природе аминокислот, и он характеризуется существенной гомологией с GLP-1(7-37)ОН, так что он проявляет инсулинотропную активность. Примеры не встречающихся в природе аминокислот включают -метиламинокислоты (например, -метилаланин), Dаминокислоты, гистидиноподобные аминокислоты (например, 2-аминогистидин, -гидроксигистидин,гомогистидин, -фторметилгистидин и -метилгистидин), аминокислоты, имеющие дополнительный метилен в боковой цепи ("гомо" аминокислоты) и аминокислоты, в которых функциональная группа карбоновой кислоты в боковой цепи замещена группой сульфокислоты (например, цистеиновая кислота). Предпочтительно, однако, чтобы соединения GLP-1 настоящего изобретения включали только природные аминокислоты, за исключением специально здесь оговоренного. Аналог GLP-1 обычно включает полипептид, имеющий аминокислотную последовательность GLP1(7-37)ОН, аналог GLP-1(7-37)ОН, фрагмент GLP-1(7-37)ОН или фрагмент аналога GLP-1(7-37)ОН.GLP-1(7-37)ОН имеет аминокислотную последовательность SEQ ID NO: 19:(SEQ ID NO: 19) По традиции в данной области техники аминоконец GLP-1(7-37)ОН был обозначен как номер остатка 7, а карбоксильный конец номером 37. Другие аминокислоты в полипептиде нумеруются последовательно, как показано в SEQ ID NO: 19. Для примера в положении 12 находится фенилаланин, в положении 22 находится глицин. Если это специально не оговорено, С-конец находится в обычной карбоксильной форме."Фрагмент GLP-1" представляет собой полипептид, полученный после удаления одной или более аминокислот с N-конца и/или С-конца GLP-1(7-37)ОН или аналога GLP-1(7-37)ОН. Номенклатура, применяемая для описания GLP-1(7-37)ОН, распространяется на фрагменты GLP-1. Например, GLP-1(9-36)ОН обозначает фрагмент GLP-1, полученный удалением двух аминокислот с N-конца и одной аминокислоты с С-конца. Аминокислоты во фрагменте обозначаются тем же номером, что и соответствующая аминокислота в GLP-1(7-37)ОН. Например, N-концевая глутаминовая кислота в GLP-1(9-36)ОН находится в положении 9; положение 12 занято фенилаланином; а положение 22 занято глицином, как и в GLP-1(7-37)ОН."Аналог GLP-1" также включает полипептиды, полученные добавлением одной или более аминокислот к N-концу и/или к С-концу GLP-1(7-37)ОН или его фрагментов. Аналоги GLP-1 данного типа содержат до приблизительно 39 аминокислот. Аминокислоты "удлиненного" аналога GLP-1 обозначают тем же номером, что и соответствующую аминокислоту в GLP-1(7-37)ОН. Например, N-концевая аминокислота аналога GLP-1, полученного добавлением двух аминокислот к N-концу GLP-1(7-37)ОН, находится в положении 5; а С-концевая аминокислота аналога GLP-1, полученного добавлением одной аминокислоты к С-концу GLP-1(7-37)ОН, находится в положении 38. Таким образом, положение 12 занято фенилаланином, а положение 22 занято глицином в обоих данных "удлиненных" аналогах GLP-1, как и вGLP-1(7-37)ОН. Аминокислоты 1-6 удлиненного аналога GLP-1 являются предпочтительно теми же или представляют собой консервативную замену аминокислоты в соответствующем положении GLP-1(1-37)ОН. Аминокислоты 38-45 удлиненного аналога GLP-1 являются предпочтительно теми же или представляют собой консервативную замену аминокислоты в соответствующем положении глюкагона или эксендина-4."Аналог GLP-1" обладает значительной гомологией с GLP-1(7-37)ОН или с фрагментом GLP-1(7-37)ОН,так что аналог обладает инсулинотропной активностью. Предпочтительно, чтобы аналог GLP-1 имел аминокислотную последовательность GLP-1(7-37)ОН или его фрагмента, модифицированную так, чтобы от одной, двух, трех, четырех или пяти аминокислот отличались от аминокислоты в соответствующем положении GLP-1(7-37)ОН или фрагмента GLP-1(7-37)ОН. В применяемой здесь номенклатуре для обозначения аналогов GLP-1 замещающая аминокислота и ее положение указываются перед структурой родительского соединения. Например, Glu22-GLP-1(7-37)ОН обозначает соединение GLP-1, в котором глицин, нормально находящийся в положении 22 GLP-1(7-37)ОН, был заменен глутаминовой кислотой;Val8-Glu22-GLP-1(7-37)ОН обозначает соединение GLP-1, в котором аланин, нормально находящийся в положении 8, и глицин, нормально находящийся в положении 22 GLP-1(7-37)ОН, были заменены валином и глутаминовой кислотой, соответственно.N-Конец аналога GLP-1 обычно является незамещенным, но может быть также алкилирован или ацилирован (предпочтительно С 1-С 20). С-Конец может быть незамещенным, как в случае с GLP-1(7-37)ОН,амидированным -NH2, -NHR или NRR' или этерифицированным -OR. R и R' независимо представляют собой алкильную или ацильную группы (предпочтительно С 1-С 20). R является алкилом (С 1-С 20).GLP-1(7-36)NH2 является примером "амидированного соединения" GLP. Предпочтительно, чтобы аналоги GLP-1 по настоящему изобретению имели С-конец, который не замещен или замещен -NH2. Предпочтительно, чтобы аналоги GLP-1 настоящего изобретения включали аналоги GLP-1 или фрагменты аналогов GLP-1, в которых скелет для таких аналогов или фрагментов содержал аминокислоту, отличную от аланина в положении 8 (аналоги по положению 8). Скелет может также включать Lгистидин, D-гистидин или модифицированные формы гистидина, такие как дезаминогистидин, 2-аминогистидин, -гидроксигистидин, гомогистидин, -фторметилгистидин или -метилгистидин в положении 7. Предпочтительно, чтобы данные аналоги по положению 8 содержали одно или более дополнительных изменений в положениях 11, 12, 16, 22, 23, 24, 26, 27, 30, 33, 34, 35, 36 и 37 по сравнению с соответствующей аминокислотой природного GLP-1(7-37)ОН. Более предпочтительно, чтобы данные аналоги по положению 8 содержали одно или более дополнительных изменений в положениях 12, 16, 22, 23, 26, 30,35 и 37 по сравнению с соответствующей аминокислотой природного GLP-1(7-37)ОН. Даже еще более предпочтительно, чтобы данные аналоги по положению 8 содержали одно или более дополнительных изменений в положениях 22, 23, 27, 30 и 37 по сравнению с соответствующей аминокислотой природного GLP-1(7-37)ОН. Также предпочтительно, чтобы данные аналоги содержали 6 или меньшее количество изменений по сравнению с соответствующими аминокислотами природного GLP-1(7-37)ОН. Более предпочтительные аналоги содержат 5 или менее изменений по сравнению с соответствующими аминокислотами природного GLP-1(7-37)ОН или содержат 4 или менее изменений по сравнению с соответствующими аминокислотами природного GLP-1(7-37)ОН. Даже более предпочтительно, чтобы данные аналоги содержали 3 или менее изменений по сравнению с соответствующими аминокислотами природного GLP-1(7-37)ОН. Наиболее предпочтительно, чтобы данные аналоги содержали 2 или менее изменений по сравнению с соответствующими аминокислотами природного GLP-1(7-37)ОН. Было обнаружено, что данные замены снижают склонность аналогов GLP-1 к агрегации и образованию нерастворимой формы. Аналоги GLP-1 настоящего изобретения, в целом, агрегируют по меньшей мере приблизительно в 5 раз медленнее, чем GLP-1(7-37)ОН, при оценке, например, с помощью теста агрегации, описанного в примере 3, предпочтительно по меньшей мере в 20 раз медленнее, более предпочтительно по меньшей мере в 40 раз медленнее, более предпочтительно по меньшей мере приблизительно в 50 раз медленнее, даже более предпочтительно приблизительно в 60 раз медленнее и даже более предпочтительно по меньшей мере приблизительно в 65 раз медленнее. Предпочтительно, чтобы описанные здесь аналоги GLP-1 были аналогами GLP-1(7-36)NH2 или GLP-1(7-36)ОН. В предпочтительном осуществлении аминокислота в положении 22 аналога GLP-1 настоящего изобретения содержит боковую цепь, которая включает по меньшей мере 2 атома углерода и полярную или заряженную функциональную группу. Сюда включается аспарагиновая кислота, которая содержит метилен и карбоксильный углерод. Более предпочтительно, чтобы боковая цепь аминокислоты в положении-4 008837 22 была алкильной группой с неразветвленной или разветвленной цепью с от 2 до 6 атомами углерода и заряженной функциональной группой, например группой карбоновой кислоты, аминогруппой, гуанидиногруппой или сульфокислотной группой. Таким образом, примеры предпочтительных аминокислот в положении 22 включают глутаминовую кислоту, аспарагиновую кислоту, аргинин и лизин. Когда в положении 22 находятся аспарагиновая кислота, глутаминовая кислота, аргинин или лизин, в положении 8 предпочтительно находятся глицин, валин, лейцин, изолейцин, серин, треонин или метионин, и более предпочтительно валин или глицин. Примером аминокислоты с сульфокислотной группой в боковой цепи является цистеиновая кислота (-NH-СН(CH2SO3)-CO-, обозначаемая как "Сyа"). Когда в положении 22 находится сульфокислота, такая как цистеиновая кислота, в положении 8 предпочтительно находятся глицин, валин, лейцин, изолейцин, серин, треонин или метионин, и более предпочтительно валин или глицин. В другом предпочтительном осуществлении аминокислота в положении 8 является предпочтительно глицином, валином, лейцином, изолейцином, серином, треонином или метионином, и более предпочтительно валином или глицином, а в положении 30 находятся глутаминовая кислота, аспарагиновая кислота, серин или гистидин, и более предпочтительно глутаминовая кислота. В другом предпочтительном осуществлении аминокислота в положении 8 является предпочтительно глицином, валином, лейцином, изолейцином, серином, треонином или метионином, и более предпочтительно валином или глицином, а в положении 37 находятся гистидин, лизин, аргинин, треонин, серин,глутаминовая кислота, аспарагиновая кислота, триптофан, тирозин, фенилаланин, и более предпочтительно гистидин. В другом предпочтительном осуществлении аминокислота в положении 8 является предпочтительно глицином, валином, лейцином, изолейцином, серином, треонином или метионином, и более предпочтительно валином или глицином, а в положении 22 находятся глутаминовая кислота, лизин, аспарагиновая кислота или аргинин, и более предпочтительно глутаминовая кислота или лизин, а в положении 23 находятся лизин, аргинин, глутаминовая кислота, аспарагиновая кислота и гистидин, и более предпочтительно лизин или глутаминовая кислота. В другом предпочтительном осуществлении аминокислота в положении 8 является предпочтительно глицином, валином, лейцином, изолейцином, серином, треонином или метионином, и более предпочтительно валином или глицином, а в положении 22 находятся глутаминовая кислота, лизин, аспарагиновая кислота или аргинин, и более предпочтительно глутаминовая кислота или лизин, а в положении 27 находятся аланин, лизин, аргинин, триптофан, тирозин, фенилаланин или гистидин, и более предпочтительно аланин. В другом предпочтительном осуществлении аналоги GLP-1 настоящего изобретения содержат аминокислоту в положении 8 и имеют одну, две или три аминокислоты, выбранные из группы, состоящей из положения 11, положения 12, положения 16, положения 22, положения 23, положения 24, положения 26,положения 27, положения 30, положения 33, положения 34, положения 35, положения 36 и положения 37, которые отличаются от аминокислоты в соответствующем положении природного GLP-1(7-37)ОН. В другом предпочтительном осуществлении аналоги GLP-1 настоящего изобретения содержат одну или две аминокислоты в дополнение к аминокислоте в положении 8, выбранных из группы, состоящей из положения 11, положения 12, положения 16, положения 22, положения 23, положения 24, положения 26,положения 27, положения 30, положения 33, положения 34, положения 35, положения 36 и положения 37, которые отличаются от аминокислоты в соответствующем положении природного GLP-1(7-37)ОН. Как описано выше, аналоги GLP-1 настоящего изобретения могут содержать аминокислоты в дополнение к таковым в положении 8, 11, 12, 16, 22, 23, 24, 26, 27, 30, 33, 34, 35, 36 и 37, которые отличаются от аминокислоты в соответствующем положении GLP-1(7-37) или фрагмента GLP-1(7-37). Аминокислоты в положениях 8, 11, 12, 16, 22, 23, 24, 26, 27, 30, 33, 34, 35, 36 и 37 в аналогах GLP, которые отличаются от аминокислоты в соответствующем положении GLP-1(7-37)ОН, являются предпочтительно консервативными заменами, и более предпочтительно являются высококонсервативными заменами. Предпочтительно, чтобы аналоги GLP-1 настоящего изобретения содержали ноль, одну, две или три аминокислоты в дополнение к аминокислотам в положениях 8 и 22, которые отличаются от аминокислоты в соответствующем положении GLP-1(7-37)ОН или фрагмента GLP-1(7-37)ОН. В одном примере одна или более аминокислот в положениях 7, 21 и 27 аналога GLP-1 отличаются от соответствующей аминокислоты в GLP-1(7-37)ОН или фрагменте GLP-1(7-37)ОН, в дополнение к аминокислотам в положениях 8 и 22. Предпочтительно, чтобы лишь положения 7, 8 и 22 отличались от аминокислоты в соответствующем положении GLP-1(7-37)ОН (или его фрагмента). Ожидается, что другие улучшенные аналоги GLP-1 со сниженной способностью к агрегации могут быть получены из известных биологически активных аналогов GLP-1 путем замены глицина в положении 22 и предпочтительно аланина в положении 8 данных аналогов подходящей аминокислотой, как здесь описано. Известные биологически активные аналоги GLP-1 раскрыты в патенте США 5977071, принадлежащем Hoffmann, et al., в патенте США 5545618, принадлежащем Buckley, et al., Adelhorst, et al., J. Biol. Chem. 269: 6275 (1994), полные указания которых включены здесь в качестве ссылки."Консервативная замена" представляет собой замену аминокислоты другой аминокислотой, имеющей тот же чистый электронный заряд и приблизительно тот же размер и форму. Аминокислоты с алифатическими или замещенными алифатическими боковыми цепями аминокислоты имеют приблизительно одинаковый размер в том случае, когда общее количество углеродных или гетероатомов в их боковых цепях отличается не более чем приблизительно на четыре. Они имеют приблизительно одинаковую форму, когда количество ветвей в их боковых цепях различается не более чем на одну. Аминокислоты с фенильными или замещенными фенильными группами в их боковых цепях рассматриваются как имеющие приблизительно одинаковые размер и форму. Ниже перечислены пять групп аминокислот. Замена аминокислоты в аналоге GLP-1 другой аминокислотой из той же группы приводит к консервативной замене. Группа I: глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистеин и неприродные аминокислоты с С 1-С 4 алифатическими или С 1-С 4 замещенными гидроксилом алифатическими боковыми цепями (с неразветвленными или одноразветвленными цепями). Группа II: глутаминовая кислота, аспарагиновая кислота и неприродные аминокислоты с замещенными карбоновой кислотой, С 1-С 4 алифатическими боковыми цепями (неразветвленными или с одной точкой ветвления). Группа III: лизин, орнитин, аргинин и неприродные аминокислоты с замещенными амином или гуанидино С 1-С 4 алифатическими боковыми цепями (неразветвленными или с одной точкой ветвления). Группа IV: глутамин, аспарагин и неприродные аминокислоты с замещенными амидом С 1-С 4 алифатическими боковыми цепями (неразветвленными или с одной точкой ветвления). Группа V: фенилаланин, фенилглицин, тирозин и триптофан. За исключением специально оговоренного здесь, консервативные замены предпочтительно производятся с применением природных аминокислот."Высококонсервативная замена" представляет собой замену аминокислоты другой аминокислотой,имеющей ту же функциональную группу в боковой цепи и почти тот же размер и форму. Аминокислоты с алифатическими или замещенными алифатическими боковыми цепями аминокислоты имеют почти тот же размер в том случае, когда общее количество углеродных и гетероатомов в их боковых цепях отличается не более чем на два. Они имеют почти одинаковую форму, когда они содержат одинаковое количество ветвей в их боковых цепях. Пример высококонсервативных замен включает валин вместо лейцина,треонин вместо серина, аспарагиновую кислоту вместо глутаминовой кислоты и фенилглицин вместо фенилаланина. Примеры замен, которые не являются высококонсервативными, включают аланин вместо валина, аланин вместо серина и аспарагиновую кислоту вместо серина. Один пример аналога GLP-1 настоящего изобретения представляет собой полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1. В предпочтительном примере аналог GLP-1 представляет собой GLP-1(7-37)ОН, за исключением того, что Xaa8 представляет собой Gly или Val, Хаа 22 представляет собой Glu или Lys, а Хаа 23 представляет собой Glu или Lys. В другом примере аналог GLP1 представляет собой GLP-1(7-37)ОН, за исключением того, что Xaa8 представляет собой Gly или Val, a Хаа 30 представляет собой Glu. Дополнительным примером является аналог GLP-1, который представляет собой GLP-1(7-37)ОН, за исключением того, что Xaa8 представляет собой Gly или Val, a Хаа 37 представляет собой His. Другой пример аналога GLP-1 по настоящему изобретению представляет собой полипептид,имеющий аминокислотную последовательность SEQ ID NO: 4. В предпочтительном примере в SEQ IDNO: 4 Хаа 7 представляет собой L-гистидин, D-гистидин, дезаминогистидин, 2-аминогистидин, -гидроксигистидин, гомогистидин, -фторметилгистидин или -метилгистидин, Xaa8 представляет собой глицин, аланин, валин, лейцин, изолейцин, серин или треонин, и предпочтительно глицин, валин, лейцин,изолейцин, серин или треонин, R представляет собой -NH2 или Gly(ОН), а Хаа 22 представляет собой лизин, глутаминовую кислоту, аспарагиновую кислоту или аргинин. В более предпочтительном примере Хаа 7 представляет собой L-гистидин, Хаа 8 представляет собой глицин или валин, Хаа 22 представляет собой лизин, глутаминовую кислоту, аспарагиновую кислоту или аргинин и R представляет собой Gly(OH). В противоположном варианте Хаа 7, Хаа 8 и R в SEQ ID NO: 4 представляют собой описанное выше и Хаа 22 представляет собой аминокислоту с боковой цепью, включающей группу сульфокислоты, например цистеиновую кислоту. В другом примере аналогов GLP-1 настоящего изобретения аминокислота в положении 8 не является D-аминокислотой и не имеет боковой цепи из глицина, серина, треонина, цистеина или бета-аланина,когда аминокислота в положении 22 имеет С 1-С 2 алкильную боковую цепь, С 1-С 2 гидроксилированную алкильную боковую цепь или С 1-С 2 тиолированную алкильную боковую цепь (например, цистеин). В предпочтительном примере аналогов GLP-1 настоящего изобретения аминокислота в положении 8 не является D-аминокислотой и не имеет боковой цепи из глицина, серина, треонина, цистеина или бетааланина, когда аминокислота в положении 22 имеет С 1-С 4 алкильную боковую цепь, С 1-С 4 гидроксилированную алкильную боковую цепь или С 1-С 4 тиолированную алкильную боковую цепь. В другом примере аналогов GLP-1 настоящего изобретения аминокислота в положении 8 представляет собой глицин, валин, лейцин, изолейцин, метионин, серин, треонин, цистеин, аспарагиновую кисло-6 008837 ту, глутаминовую кислоту, лизин, аргинин, аспарагин, глутамин, фенилаланин, тирозин, гистидин или триптофан; и аминокислота в положении 22 представляет собой аспарагиновую кислоту, глутаминовую кислоту, лизин, аргинин, аспарагин, глутамин или гистидин. Конкретные примеры аналогов GLP-1 настоящего изобретения включают Применяемый здесь термин "аналог GLP-1" также включает фармацевтически приемлемые соли описанных здесь соединений. Аналог GLP-1 данного изобретения может обладать достаточно кислотной,достаточно основной или обеими функциональными группами и, соответственно, реагировать с любым из ряда неорганических оснований и неорганических и органических кислот с образованием соли. Кислоты, обычно применяемые для образования кислотно-аддитивных солей, представляют собой неорганические кислоты, такие как соляная кислота, бромисто-водородная кислота, иодисто-водородная кислота, серная кислота, фосфорная кислота и т.п., органические кислоты, такие как п-толуолсульфокислота,метансульфокислота, щавелевая кислота, п-бромфенилсульфокислота, карбоновая кислота, янтарная кислота, лимонная кислота, бензойная кислота, уксусная кислота и т.п. Примеры таких солей включают сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, вторичный кислый фосфат, первичный кислый фосфат, метафосфат, пирофосфат, хлорид, бромид, иодид, ацетат, пропионат, деканоат, каприлат,акрилат, формиат, изобутират, капроат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат, себа-7 008837 цат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, сульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, гамма-гидроксибутират, гликолат, тартрат, метансульфонат,пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, манделат и т.п. Основно-аддитивные соли включают производные неорганических оснований, таких как гидроксиды аммония, щелочных или щелочно-земельных металлов, карбонаты, бикарбонаты и т.п. Такие основания, пригодные для получения солей данного изобретения, таким образом, включают гидроксид натрия,гидроксид калия, гидроксид аммония, карбонат калия и т.п. Аналоги GLP-1 можно применять для лечения субъектов с широким спектром заболеваний и состояний. Считается, что аналоги GLP-1, включая аналоги настоящего изобретения, проявляют свои биологические эффекты посредством действия на рецептор, обозначаемый как "рецептор GLP-1" (смотри патент США 5670360, принадлежащий Thorrens). Субъекты с заболеваниями и/или состояниями, которые благоприятно реагируют на стимуляцию рецептора GLP-1 или введение аналогов GLP-1, могут,следовательно, подвергаться лечению аналогами GLP-1 настоящего изобретения. Говорят, что данные субъекты "нуждаются в лечении аналогами GLP-1" или "нуждаются в стимуляции рецептора GLP-1". Включенными являются субъекты с инсулиннезависимым диабетом, инсулинзависимым диабетом, инсультом (смотри заявку WO 00/16797, принадлежащую Efendic), инфарктом миокарда (смотри заявкуWO 98/08531, принадлежащую Efendic), ожирением (смотри заявку WO 98/19698, принадлежащую Efendic),катаболическими изменениями после хирургической операции (смотри патент США 6006753, принадлежащий Efendic), функциональной диспепсией и синдромом воспаленного кишечника (смотри заявкуWO 99/64060, принадлежащую Efendic). Включаются также субъекты, требующие профилактического лечения аналогами GLP-1, например субъекты с риском развития инсулиннезависимого диабета (смотри заявку WO 00/07617). Субъекты с нарушенной толерантностью к глюкозе или с ухудшенным уровнем глюкозы натощак, субъекты, чья масса тела составляет приблизительно на 25% выше нормальной массы тела для субъектов их роста и конституции, субъекты с частичной панкреатектомией, субъекты, имеющие одного или более предков с инсулиннезависимым диабетом, субъекты, которые страдали диабетом беременных, и субъекты, которые страдали острым или хроническим панкреатитом, являются группами риска развития инсулиннезависимого диабета."Эффективное количество" аналога GLP-1 представляет собой количество, которое ведет к желаемому терапевтическому и/или профилактическому эффекту, не вызывая неприемлемых побочных эффектов при введении субъекту, нуждающемуся в стимуляции рецептора GLP-1. "Желаемый терапевтический эффект" включает одно или более из следующего: 1) ослабление симптома(ов), связанного(ых) с заболеванием или состоянием; 2) отсрочку проявления симптомов, связанных с заболеванием или состоянием; 3) увеличение продолжительности жизни по сравнению с наблюдаемой в отсутствие лечения; и 4) лучшее качество жизни по сравнению с наблюдаемым в отсутствие лечения. Например, "эффективное количество" аналога GLP-1 для лечения диабета представляет собой такое количество, которое должно приводить к лучшему контролю над концентрацией глюкозы в крови, чем в отсутствие лечения,в результате чего достигается отсрочка возникновения осложнений диабета, таких как ретинопатия, нейропатия или заболевание почек. "Эффективное количество" аналога GLP-1 для профилактики диабета представляет собой такое количество, которое должно отсрочить по сравнению с наблюдаемым в отсутствие лечения наступление такого увеличения уровня глюкозы в крови, которое требует лечения антигипогликемическими лекарствами, такими как сульфонилмочевина, тиазолидиндионы, инсулин и/или бисгуанидины."Эффективное количество" аналога GLP-1, вводимого субъекту, должно также зависеть от типа и тяжести заболевания и особенностей субъекта, таких как общее состояние здоровья, возраст, пол, масса тела и толерантность к лекарствам. Опытный специалист будет способен определить подходящие дозы в зависимости от данных и других факторов. Обычно терапевтически эффективное количество аналогаGLP-1 может варьировать от приблизительно 0,01 до приблизительно 1000 мг в день для взрослого. Предпочтительно, чтобы доза варьировала от приблизительно 0,1 до приблизительно 100 мг в день, более предпочтительно от приблизительно 1,0 до приблизительно 10 мг в день. Аналоги GLP-1 настоящего изобретения могут вводиться, например, перорально, интраназально,путем ингаляции или парентерально. Парентеральное введение может включать, например, системное введение, такое как внутримышечная, внутривенная, подкожная или внутрибрюшинная инъекция. Аналоги GLP-1 можно вводить субъекту в сочетании с приемлемым фармацевтическим носителем, разбавителем или наполнителем в качестве части фармацевтической композиции для лечения обсуждавшихся выше заболеваний. Фармацевтическая композиция может быть раствором или - при парентеральном введении - суспензией аналога GLP-1 или суспензией аналога GLP-1, комплексированного с катионом двухвалентного металла, как описано ниже. Подходящие фармацевтические носители могут содержать инертные ингредиенты, которые не взаимодействуют с пептидом или производным пептида. Могут быть применены стандартные технологии образования фармацевтического состава, такие как описанные вRemington's Pharmaceutical Sciences, Mack Publishing Company, Easton, PA. Подходящие фармацевтические носители для парентерального введения включают, например, стерильную воду, физиологический-8 008837 раствор, бактериостатический солевой раствор (солевой раствор, содержащий приблизительно 0,9% мг/мл бензилового спирта), забуференный фосфатом физиологический раствор, раствор Хенка, раствор Рингера с лактатом и т.п. Некоторые примеры подходящих наполнителей включают лактозу, декстрозу,сахарозу, трегалозу, сорбит и маннит."Субъектом" является млекопитающее, предпочтительно человек, но им может также быть и животное, например животные-компаньоны (например, собаки, кошки и т.п.), сельскохозяйственные животные (например, коровы, овцы, свиньи, лошади и т.п.) и лабораторные животные (например, крысы,мыши, морские свинки и т.п.). Аналоги GLP-1 настоящего изобретения могут быть комплексированы с подходящим катионом двухвалентного металла. Комплексы аналогов GLP-1 с двухвалентным металлом обычно нерастворимы в водном растворе в области физиологического рН. Таким образом, данные комплексы можно вводить подкожно в виде суспензий, и при этом наблюдается сниженная скорость высвобождения in vivo, благодаря чему продлевается время действия аналога. Примеры подходящих катионов двухвалентного металла включают Zn, Mn, Fe, Ca, Co, Cd, Ni и т.п. Предпочтительным является Zn. Для получения комплексов между аналогами GLP-1 по настоящему изобретению и катионом двухвалентного металла GLP-1 растворяют в подходящем буфере в присутствии соли металла. Смесь оставляют инкубироваться при комнатной температуре для преципитации комплекса. Подходящими буферами являются такие, которые поддерживают рН смеси в диапазоне от приблизительно 3,0 до приблизительно 9,0 и не влияют на реакцию комплексирования. Примеры включают фосфатные буферы, ацетатные буферы, цитратные буферы и буферы Goode, например HEPES, Трис и Трис-ацетат. Подходящими солями металла являются такие, в которых металл доступен для комплексирования. Примеры подходящих солей цинка включают хлористый цинк, ацетат цинка, оксид цинка и сульфат цинка. Предпочтительно, чтобы катионная соль двухвалентного металла, такая как хлористый цинк, вносилась в избытке для обеспечения молярного соотношения до приблизительно 50 молекул катиона двухвалентного металла на каждую молекулу аналога GLP-1."Инсулинотропная активность" относится к стимуляции секреции инсулина в ответ на повышенный уровень глюкозы, что тем самым увеличивает захват глюкозы клетками и снижает уровень глюкозы в крови. Инсулинотропная активность может быть оценена с помощью способов, известных в данной области техники, включая применение экспериментов in vivo и анализов in vitro, в которых измеряется связывающая активность рецептора GLP-1 или активация рецептора, например анализов с применением клеток островков поджелудочной железы или клеток инсулиномы, как описано в ЕР 619322, принадлежащем Gelfand, et al., и патенте США 5120712, соответственно. Полные указания данных ссылок включены здесь в качестве ссылок. Аналоги GLP-1 по настоящему изобретению могут быть получены с применением стандартных способов технологии твердофазного синтеза пептидов. Пептидные синтезаторы имеются в продаже, например, от Applied Biosystems, Foster City CA. Реактивы для твердофазного синтеза имеются в продаже,например, от Midwest Biotech (Fishers, IN). Твердофазные пептидные синтезаторы можно применять в соответствии с инструкциями производителя для блокирования интерферирующих групп, защиты реагирующей аминокислоты, присоединения, расщепления и кепирования непрореагировавших аминокислот. Обычно защищенную -N-карбамоилом аминокислоту и N-концевую аминокислоту на растущей полипептидной цепи на смоле соединяют при комнатной температуре в инертном растворителе, таком как диметилформамид, N-метилпирролидон или метиленхлорид, в присутствии агентов присоединения,таких как дициклогексилкарбодиимид и 1-гидроксибензотриазол, и основания, такого как диизопропилэтиламин. Защитную -N-карбамоильную группу удаляют из полученной пептидной смолы с помощью такого реагента, как трифторуксусная кислота или пиперидин, и реакцию присоединения повторяют со следующей желаемой N-защищенной аминокислотой, которая должна быть добавлена к пептидной цепи. Подходящие защитные группы для амина хорошо известны в технике и описаны, например, в Green andWuts, "Protecting Groups in Organic Synthesis", John Wiley and Sons, 1991, полные указания которой включены в качестве ссылки. Примеры включают трет-бутилоксикарбонил (t-Boc) и флуоренилметоксикарбонил (F-moc). Пептиды также синтезируют с применением протоколов стандартного автоматизированного твердофазного синтеза с применением трет-бутоксикарбонил- или фторенилметоксикарбонил-альфа-аминокислот при подходящей защите боковых групп. После завершения синтеза пептиды отщепляют от твердофазной подложки при одновременном снятии защиты боковых групп с помощью стандартных способов с применением фтористого водорода. Сырые пептиды затем дополнительно очищают с помощью хроматографии с обращенной фазой на колонках Vydac C18 с применением градиентов ацетонитрила в 0,1% трифторуксусной кислоте (ТФУ). Для удаления ацетонитрила пептиды лиофилизуют из раствора,содержащего 0,1% ТФУ, ацетонитрил и воду. Чистота может быть подтверждена с помощью аналитической хроматографии с обращенной фазой. Идентичность пептидов может быть проверена масс-спектрометрией. Пептиды можно растворять в водных буферах при нейтральном рН. Изобретение иллюстрируется следующими примерами, какое-либо ограничение которых не преду-9 008837 смотрено. Пример 1. Получение аналогов GLP-1 настоящего изобретения с помощью твердофазной химии с применением t-Boc. Приблизительно 0,5-0,6 г (0,38-0,45 ммоль) смолы Вос Gly-PAM помещали в стандартный 60-мл реакционный сосуд и производили двойные реакции присоединения с помощью синтезатора пептидовApplied Biosystems ABI430A. От Midwest Biotech (Fishers, IN) были получены и применены в синтезе следующие аминокислоты с защищенными боковыми цепями (картриджи по 2 ммоль Вос-аминокислот):Arg-тозил (TOS), Aspциклогексиловый эфир (CHXL), Gluциклогексиловый эфир (CHXL), His-бензилоксиметил (BOM), Lys-2-хлорбензилоксикарбонил (2Cl-Z), Met-сульфоксид (О), Ser-O-бензиловый эфир (OBzl), Thr-O-бензиловый эфир (OBzl), Trp-формил (СНО) и Tyr-2-бромбензилоксикарбонил (2BrZ) и смола Воc Gly РАМ. Трифторуксусную кислоту (ТФУ), диизопропилэтиламин (DIEA), 0,5 М гидроксибензотриазол (HOBt) в ДМФ и 0,5 М дициклогексилкарбодиимид (DCC) в дихлорметане были получены от PE-Applied Biosystems (Foster City, CA). Диметилформамид (ДМФ-Burdick and Jackson) и дихлорметан (ДХМ-Mallinkrodt) были получены от Mays Chemical Co. (Indianapolis, IN). Стандартные двойные реакции присоединения проводили с применением либо симметричного ангидрида, либо сложных эфиров HOBt, полученных с помощью DCC. Второй этап двойного присоединения (без снятия защиты ТФУ) проводили по Trp31, Thr13 и Thr11. После завершения синтеза N-концевую Воc группу удаляли и пептидильные смолы обрабатывали 20% пиперидином в ДМФ для деформилирования боковой цепи Trp. После промывки ДХМ смолу переносили в тефлоновый реакционный сосуд и сушили в вакууме. Для аналогов, содержащих Met, проводили восстановление на смоле с применением смеси ТФУ/10% диметилсульфид (DMS)/2% концентрированная НСl. Отщепление проводили путем подсоединения реакционных сосудов к аппарату с HF (фтористо-водородной кислотой) (Penninsula Laboratories). Добавляли 1 мл м-крезола на грамм смолы и в предварительно охлажденный сосуд конденсировали 10 млHF (полученной от AGA, Indianapolis, IN). Когда имелся метионин, добавляли 1 мл DMS на грамм смолы. Реакционные смеси перемешивали в течение 1 ч на ледяной бане и HF удаляли в вакууме. Остатки суспендировали в этиловом эфире и твердые вещества отфильтровывали и промывали эфиром. Каждый пептид экстрагировали в водную уксусную кислоту и либо лиофилизовали, либо прямо наносили на колонку с обращенной фазой. Очистку проводили на колонке 2,2 х 25 см VYDAC C18 в буфере А (0,1% трифторуксусная кислота в воде, В: 0,1% ТФУ в ацетонитриле). При ВЭЖХ (Waters) применяли градиент В от 20 до 90% в течение 120 мин при скорости 10 мл/мин и отслеживании в УФ при 280 нм (4,0 А) и сборе фракций каждую минуту. Подходящие фракции объединяли, замораживали и лиофилизовали. Высушенные продукты анализировали с помощью ВЭЖХ (0,46 х 15 см METASIL AQ C18) и масс-спектрометрии MALDI. Пример 2. Получение аналогов GLP-1 настоящего изобретения с помощью твердофазной химии с применением F-Moc. Приблизительно 114 мг (50 ммоль) смолы FMOC Gly WANG (полученной от NovaBiochem, LaJolla,CA) помещали в каждую из программируемых лунок 96-луночного реакционного блока и производили двойные реакции присоединения с помощью синтезатора пептидов Advanced ChemTech 396. Аналоги с С-концевым амидом получали с применением 75 мг (50 мкмоль) смолы Rink Amide AM (NovaBiochem,La Jolla, CA). Следующие FMOC аминокислоты были получены от Advanced ChemTech (Louisville, KY),NovaBiochem (La Jolla, CA) и Midwest BioTech (Fishers, IN): Arg-2,2,4,6,7-пентаметилдигидробензофуран-5-сульфонил (Pbf), Asn-тритил (Trt), Aspтрет-бутиловый эфир (tBu), Gluтрет-бутиловый эфир (tBu), Gln-тритил (Trt), His-тритил (Trt), Lys-трет-бутилоксикарбонил (Boc), Ser-трет-бутиловый эфир (OtBu), Thr-трет-бутиловый эфир (OtBu), Trp-трет-бутилоксикарбонил (Воc), Tyr-трет-бутиловый эфир (OtBu). Растворители диметилформамид (ДМФ-Burdick and Jackson), N-метилпирролидон (NMP-Burdickand Jackson), дихлорметан (ДХМ-Mallinkrodt) были получены от Mays Chemical Co. (Indianapolis, IN). Гидроксибензотризол (HOBt), диизопропилкарбодиимид (DIC), диизопропилэтиламин (DIEA) и пиперидин (Pip) были получены от Aldrich Chemical Co (Milwaukee, WI). Все аминокислоты растворяли в 0,45M HOBt в NMP и после 20-минутного снятия защиты с применением 20% Pip/ДМФ производили в течение 50 мин активированные DIC/HOBt реакции присоединения. После снятия защиты и реакции присоединения каждую смолу промывали ДМФ. После последней реакции присоединения и снятия защиты пептидильные смолы промывали DCM и сушили в вакууме в реакционном блоке. После установки блока реакции/расщепления на место в каждую лунку добавляли 2 мл реактива K и смесь реакции расщепления перемешивали в течение 2 ч (реактив K=0,75 г фенола, 0,5 мл тиоанизола,0,25 мл этандитиола, 0,5 мл воды на 10 мл трифторуксусной кислоты (ТФУ), все реактивы получены отAldrich Chemical Co., Milwaukee, WI). Фильтраты ТФУ добавляли к 40 мл этилового эфира и преципитаты центрифугировали 2 мин при 2000 об./мин. Надосадочные фракции декантировали, осадки ресуспен- 10008837 дировали в 40 мл эфира, повторно центрифугировали, вновь декантировали, сушили в атмосфере азота и затем в вакууме. 0,3-0,6 мг каждого продукта растворяли в 1 мл 0,1% ТФУ/ацетонитрила (ACN) и 20 мкл анализировали ВЭЖХ (0,46 х 15 см METASIL AQ C18, 1 мл/мин, 45 С, 214 нм (0,2 А), А=0,1% ТФУ, В=0,1% ТФУ/50% ACN. Градиент=от 50 до 90% В на протяжении 30 мин). Очистку проводили на колонке 2,2 х 25 см VYDAC C18 в буфере А (0,1% ТФУ в воде, В: 0,1% ТФУ в ацетонитриле). На колонку ВЭЖХ (Waters) наносили градиент от 20 до 90% В на протяжении 120 мин со скоростью 10 мл/мин с отслеживанием в УФ при 280 нм (4,0 А) и сбором фракций каждую 1 мин. Соответствующие фракции объединяли, замораживали и лиофилизовали. Высушенные продукты анализировали с помощью ВЭЖХ (0,46 х 15 см METASIL AQ C18) и масс-спектрометрии MALDI. Пример 3. Анализ агрегации GLP. Пептиды GLP данного изобретения анализировали в отношении их способности агрегировать в растворе. В целом, пептиды в растворе перемешивали при повышенной температуре в подходящем буфере и регистрировали мутность при 350 нм как функцию времени. Для количественной оценки способности данной молекулы GLP агрегировать при данных стрессовых условиях измеряли время наступления агрегации. Протокол. Аналог GLP-1 сначала растворяли в щелочных условиях (рН 10,5) в течение 30 мин для растворения любого предварительно агрегированного материала. После этого рН раствора доводили до 7,4 и производили фильтрацию. Конкретно, 4 мг лиофилизованного аналога GLP-1 растворяли в 3 мл 10 мМ фосфата/10 мМ цитрата. рН доводили до 10,0-10,5 и выдерживали в течение 30 мин. рН раствора доводили до 7,4 с помощью НСl и производили фильтрацию через подходящий фильтр, например шприцевый фильтр Millex GV (Millipore Corporation, Bedford, MA). Данный раствор затем разводили до конечного образца, содержащего 0,3 мг/мл белка в 10 мМ цитрате, 10 мМ фосфате, 150 мМ NaCl, и рН доводили до величины от 7,4 до 7,5. Образец инкубировали при 37 С в кварцевой кювете. Мутность раствора измеряли каждые 5 мин при 350 нм на спектрофотометре AVIV Model 14DS UV-VIS (Lakewood, NJ). В течение 30 с до измерения и во время измерения раствор перемешивали с помощью магнитной мешалки от StarnaCells, Inc. (Atascadero, CA). Повышение ОП при 350 нм указывает на агрегацию пептида GLP. Время до агрегации аппроксимировали по пересечению подобранных линейных графиков к фазе, предшествующей росту, и к фазе роста в соответствии со способом Drake (Arvinte Т., Cudd A., and Drake A.F. (1993) J.Bio. Chem. 268, 6415-6422). Между экспериментами кювету отмывали раствором едкого мыла (например, Contrad-70). Результаты для ряда аналогов GLP-1 по настоящему изобретению представлены в табл. 1 в виде времени в часах, необходимого для агрегации соединения. Как можно видеть, аналоги по настоящему изобретению проявляют значительно увеличенное время агрегации по сравнению с аналогами GLP-1,известными из предшествующего уровня техники. Пример 4. Активация рецептора GLP-1 аналогами GLP-1 настоящего изобретения. Способность аналогов GLP-1 по настоящему изобретению активировать рецептор GLP-1 оценивали с помощью тестов in vitro, таких как описанные в ЕР 619322, принадлежащем Gelfand, et al., и патенте США 5120712, соответственно. Полные указания данных ссылок включены здесь в качестве ссылки. Активность данных аналогов относительно активности GLP-1(7-37)ОН представлена в табл. 1. Как можно видеть из этих результатов, активность аналогов GLP-1 по настоящему изобретению, в целом, приблизительно такая же хорошая или лучше, чем активность GLP-1(7-37)ОН. Таблица 1 Соединение GLP-1 Агрегация: время, ч Активация рецептора GLP-1 Пример 5. Осаждение аналогов GLP-1 цинком. Отдельные аналоги GLP-1 получали, как описано в примерах 1 или 2. В 3 мл буфера 0,1 М HEPES с рН 10,5 растворяли 3 мг индивидуальных лиофилизованных молекул GLP. После этого рН полученного раствора доводили до величины между 10,0 и 10,5 с помощью 0,2 н. NaOH. Раствор перемешивали при комнатной температуре в течение 30 мин и после этого рН раствора доводили до 7,4 с помощью 0,2 н. НСl. Раствор фильтровали через подходящий фильтр для шприцев, например шприцевый фильтр MillexGV (Millipore Corporation, Bedford, MA), и концентрацию аналога GLP-1 устанавливали измерением поглощения при 280 нм на спектрофотометре, например Beckman DU640. Концентрацию белка затем доводили до 200 мкМ в HEPES с рН 7,4. Отфильтрованные растворы GLP-1 (100 мкл) разводили 100 мкл буфера 0,1 М HEPES с рН 7,4, содержащего различные количества хлористого цинка, в планшете для ИФА (например, Falcon Microtest 96), что давало 200 мкл раствора, содержащего различные количества хлористого цинка и 100 мкМ аналогов GLP-1. Данные растворы инкубировали при комнатной температуре (22 С) в течение 18 ч и затем центрифугировали, например, в центрифуге Jouan CR412 с адапторами для микропланшет. После центрифугирования 150 мкл надосадочных фракций переносили в ИФА-планшет для микротитрования, пригодный для снятия показаний в УФ (например, планшет Costar UV), и измеряли ОП при 280 нм на микропланшетном ридере (например, Molecular Devices SPECTRAmax PLUS, SOFTmax PRO). Результаты эксперимента показаны в табл. 2. Величины А 280 представляют собой результат двух независимых определений. Данные результаты показывают, что лишь небольшие количества цинка необходимы для комплексирования с различными аналогами GLP-1 и осаждения их значительной части из данных разбавленных растворов. Эквиваленты Хотя данное изобретение было конкретно показано и описано со ссылками на его предпочтительные осуществления, специалистам в данной области техники должно быть понятно, что внутри него могут быть сделаны различные изменения в форме и деталях без выхода за пределы сути и объема изобретения, как определено в прилагаемой формуле изобретения. Специалисты в данной области техники должны признать или должны быть способными убедиться не иначе, чем путем обычного экспериментирования, в том, что возможны многие эквиваленты конкретных осуществлений изобретения, описанных здесь конкретно. Такие эквиваленты предназначены для включения в объем формулы изобретения. Перечень последовательностей- 27008837 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Аналог глюкагоноподобного пептида (GLP-1), включающий аминокислотную последовательность формулы I (SEQ ID NO: 1):R представляет собой Lys, Arg, Thr, Ser, Glu, Asp, Trp, Tyr, Phe, His, -NH2, Gly, Gly-Pro или Gly-ProNH2 или отсутствует. 2. Аналог глюкагоноподобного пептида (GLP-1), включающий аминокислотную последовательность формулы II (SEQ ID NO: 2):R представляет собой Lys, Arg, Thr, Ser, Glu, Asp, Trp, Tyr, Phe, His, -NH2, Gly, Gly-Pro или Gly-ProNH2 или отсутствует. 3. Аналог глюкагоноподобного пептида (GLP-1), включающий аминокислотную последовательность формулы III (SEQ ID NO: 3):R представляет собой Lys, Arg, Thr, Ser, Glu, Asp, Trp, Tyr, Phe, His, -NH2, Gly, Gly-Pro или Gly-ProNH2 или отсутствует. 4. Аналог GLP-1 по любому из пп.1-3, в котором не более чем 6 аминокислот отличаются от соответствующей аминокислоты в известном аналоге GLP-1(7-37)ОН или GLP-1(7-36)NH2. 5. Аналог GLP-1 по п.4, в котором не более чем 5 аминокислот отличаются от соответствующей- 28008837 аминокислоты в GLP-1(7-37)ОН или GLP-1(7-36)NH2. 6. Аналог GLP-1 по п.5, в котором не более чем 4 аминокислоты отличаются от соответствующей аминокислоты в известном аналоге GLP-1(7-37)ОН или GLP-1(7-36)NH2. 7. Аналог GLP-1 по п.6, в котором не более чем 3 аминокислоты отличаются от соответствующей аминокислоты в известном аналоге GLP-1(7-37)ОН или GLP-1(7-36)NH2. 8. Аналог GLP-1 по п.7, в котором не более чем 2 аминокислоты отличаются от соответствующей аминокислоты в известном аналоге GLP-1(7-37)ОН или GLP-1(7-36)NH2. 9. Аналог GLP-1 по любому из пп.4-7, где Хаа 8 представляет собой глутаминовую кислоту. 10. Аналог GLP-1 по любому из пп.4-7, где R представляет собой гистидин, фенилаланин, тирозин,триптофан, аспарагиновую кислоту, глутаминовую кислоту, серин, треонин, аргинин или лизин. 11. Аналог GLP-1 по п.10, где R представляет собой гистидин. 12. Аналог GLP-1 по любому из пп.4-7, где Хаа 23 представляет собой глутаминовую кислоту или лизин. 13. Аналог GLP-1 по любому из пп.4-7, где Хаа 27 представляет собой аланин. 14. Применение аналога GLP-1 по любому из пп.1-13 для лечения инсулиннезависимого диабета. 15. Применение аналога GLP-1 по любому из пп.1-13 для профилактики инсулиннезависимого диабета. 16. Применение аналога GLP-1 по любому из пп.1-13 для лечения ожирения, инсульта, инфаркта миокарда, катаболических изменений после хирургической операции или синдрома раздраженного кишечника. 17. Применение соединения GLP-1 по любому из пп.1-13 для получения лекарственного средства для лечения инсулиннезависимого диабета. 18. Применение соединения GLP-1 по любому из пп.1-13 для получения лекарственного средства для лечения ожирения, инсульта, инфаркта миокарда, катаболических изменений после хирургической операции или синдрома раздраженного кишечника.
МПК / Метки
МПК: C07K 14/605, A61P 3/10, A61K 38/26
Метки: аналоги, пептида, глюкагоноподобного, применение
Код ссылки
<a href="https://eas.patents.su/30-8837-analogi-glyukagonopodobnogo-peptida-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Аналоги глюкагоноподобного пептида и их применение</a>
Предыдущий патент: Новый способ синтеза периндоприла и его фармацевтически приемлемых солей
Следующий патент: Машина для производства нетканого материала, способ ее регулирования и полученный нетканый материал
Случайный патент: Применение агомелатина в получении лекарственных средств, предназначенных для лечения генерализованного тревожного расстройства












