5,7-диаминопиразоло[4,3-d]пиримидины, полезные при лечении гипертензии
Номер патента: 8596
Опубликовано: 29.06.2007
Авторы: Марш Йан Роджер, Браун Дейвид Грэм, Уинслоу Кэрол Энн, Палмер Майкл Джон, Белл Эндрю Саймон, Морелл Эндрю Йан, Фокс Дейвид Нейтан Абрахам
Формула / Реферат
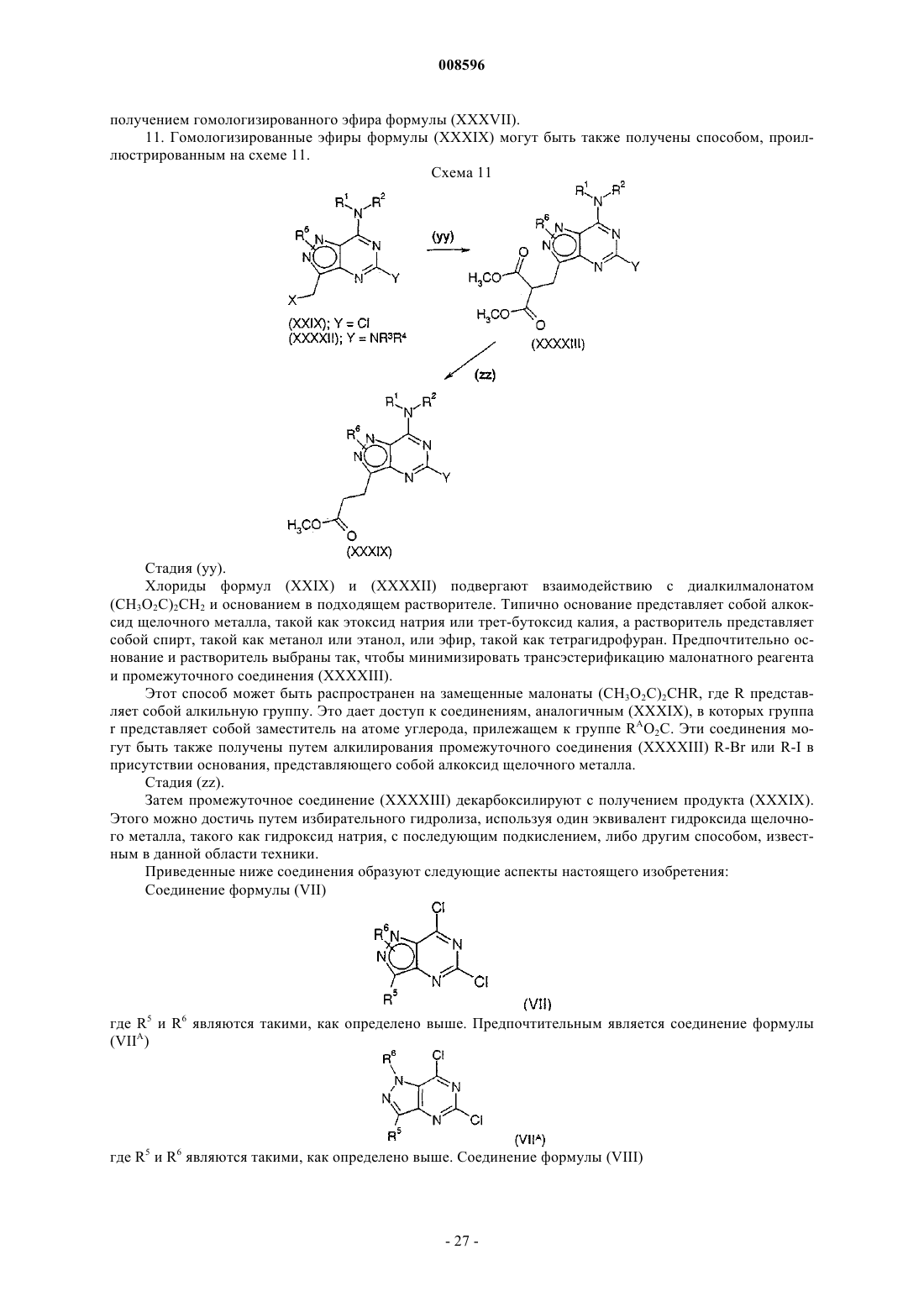
1. Соединение формулы (I)
где
R1 представляет собой циклическую группу, выбранную из RA, RB, RC и RD, каждый из которых возможно замещен одной или более чем одной группой R7;
R2 представляет собой водород или C1-С2алкил;
R3 и R4, каждый независимо, представляет собой C1-С8алкил, С2-С8алкенил, С2-С8алкинил или С3-С10циклоалкил, каждый из которых возможно замещен одной или более чем одной группой R8, либо RE, который возможно замещен одной или более чем одной группой R9, либо водород;
либо -NR3R4 образует RF, который возможно замещен одной или более чем одной группой R10;
R5 представляет собой С1-С6алкил, С1-С6галогеноалкил, С2-С6алкенил, С2-С6алкинил или С3-С7циклоалкил, каждый из которых возможно замещен одной или более чем одной группой, выбранной из гидрокси, С1-С6алкокси, С1-С6галогеноалкокси, С3-С7циклоалкил и С3-С7циклоалкокси, либо водород;
R6, который может быть присоединен по N1 или N2, представляет собой R6A;
R6A представляет собой С1-С6алкил, С1-С6галогеноалкил, С2-С6алкенил или С2-С6алкинил, каждый из которых возможно замещен С1-С6алкокси, (С3-С6циклоалкил)С1-С6алкокси, С1-С6галогеноалкокси или циклической группой, выбранной из RJ, RK, RL и RM, либо R6A представляет собой RN, С3-С7циклоалкил или С3-С7галогеноциклоалкил, каждый из которых возможно замещен С1-С6алкокси или С1-С6галогеноалкокси;
R7 представляет собой галогено, С1-С6алкил, С1-С6галогеноалкил, С2-С6алкенил, С2-С6алкинил, С3-С10циклоалкил, С3-С10галогеноциклоалкил, оксо, фенил, OR12, OC(O)R12, NO2, NR12R13, NR12C(O)R13, NR12CO2R14, C(O)R12, CO2R12, CONR12R13 или CN;
R8 представляет собой галогено, фенил, С1-С6алкоксифенил, OR12, OC(O)R12, NO2, NR12R13, NR12C(O)R13, NR12CO2R14, C(O)R12, CO2R12, CONR12R13, CN, С3-С6циклоалкил, RG или RH, последние два из которых возможно замещены одной или более чем одной группой R9;
R9 представляет собой С1-С6алкил, С1-С6галогеноалкил или CO2R12;
R10 представляет собой галогено, С3-С10циклоалкил, С3-С10галогеноциклоалкил, фенил, OR12, OC(O)R12, NO2, NR12R13, NR12C(O)R13, NR12CO2R14, C(O)R12, CO2R13, CONR12R13, CN, оксо, С1-С6алкил или С1-С6галогеноалкил, последние два из которых возможно замещены R11;
R11 представляет собой ОН, фенил, NR12R13 или NR12CO2R14;
R12 и R13, каждый независимо, представляет собой водород, С1-С6алкил или С1-С6галогеноалкил;
R14 представляет собой С1-С6алкил или С1-С6галогеноалкил;
RA и RJ, каждый независимо, представляет собой группу С3-С10циклоалкил или С3-С10циклоалкенил, каждая из которых может быть либо моноциклической, либо, когда имеется соответствующее число кольцевых атомов, полициклической, и которая может быть конденсирована либо
(а) с моноциклическим ароматическим кольцом, выбранным из бензольного кольца и 5- или 6-членного гетероароматического кольца, содержащего вплоть до трех гетероатомов, выбранных из азота, кислорода и серы, либо
(б) с 5-, 6- или 7-членным гетероалициклическим кольцом, содержащим вплоть до трех гетероатомов, выбранных из азота, кислорода и серы;
RB и RK, каждый независимо, представляет собой группу фенил или нафтил, каждая из которых может быть конденсирована
(а) с С5-С7циклоалкильным или С5-С7циклоалкенильным кольцом,
(б) с 5-, 6- или 7-членным гетероалициклическим кольцом, содержащим вплоть до трех гетероатомов, выбранных из азота, кислорода и серы, либо
(в) с 5- или 6-членным гетероароматическим кольцом, содержащим вплоть до трех гетероатомов, выбранных из азота, кислорода и серы;
RС, RL и RN, каждый независимо, представляет собой моноциклическую или, когда имеется соответствующее число кольцевых атомов, полициклическую насыщенную или частично ненасыщенную кольцевую систему, содержащую от 3 до 10 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы, причем это кольцо может быть конденсировано с С5-С7циклоалкильной или С5-С7циклоалкенильной группой или с моноциклическим ароматическим кольцом, выбранным из бензольного кольца и 5- или 6-членного гетероароматического кольца, содержащего вплоть до трех гетероатомов, выбранных из азота, кислорода и серы;
RD и RM, каждый независимо, представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее вплоть до трех гетероатомов, независимо выбранных из азота, кислорода и серы, причем это кольцо может быть дополнительно конденсировано
(а) со вторым 5- или 6-членным гетероароматическим кольцом, содержащим вплоть до трех гетероатомов, выбранных из азота, кислорода и серы;
(б) с С5-С7циклоалкильным или С5-С7циклоалкенильным кольцом;
(в) с 5-, 6- или 7-членным гетероалициклическим кольцом, содержащим вплоть до трех гетероатомов, выбранных из азота, кислорода и серы; либо
(г) с бензольным кольцом;
RE, RF и RG, каждый независимо, представляет собой моноциклическую или, когда имеется соответствующее число кольцевых атомов, полициклическую насыщенную кольцевую систему, содержащую от 3 до 10 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы; и
RH представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее вплоть до трех гетероатомов, независимо выбранных из азота, кислорода и серы,
его таутомер, либо фармацевтически приемлемая соль, сольват или полиморф указанного соединения или таутомера.
2. Соединение по п.1, где R6A представляет собой С1-С4алкил или С1-С4галогеноалкил, каждый из которых возможно замещен С1-С4алкокси, С1-С4галогеноалкокси, (С3-С6циклоалкил)метокси, циклопропилом, циклобутилом, тетрагидрофуранилюь, тетрагидропиранилом или пиридинилом, либо R6A представляет собой тетрагидропиранил.
3. Соединение по любому из п.1 или 2, где R1 представляет собой RD, который возможно замещен одной или более чем одной группой R7.
4. Соединение по п.3, где RD представляет собой 5-членное гетероароматическое кольцо, содержащее гетероатом, выбранный из азота, кислорода и серы, и возможно вплоть до двух дополнительных атомов азота в кольце, или 6-членное гетероароматическое кольцо, включающее 1, 2 или 3 атома азота, где RD возможно замещен одной или более чем одной группой R7.
5. Соединение по п.4, где RD представляет собой пиразолил, имидазолил, изоксазолил, оксазолил, оксадиазолил, пиридил, пиридазинил, пиримидил или пиразинил, где RD возможно замещен одной или более чем одной группой R7.
6. Соединение по любому из пп.1-5, где R7 представляет собой фторо, метил, этил, гидрокси, метокси, пропокси, трифторметил, оксо или -C(O)NHCH3.
7. Соединение по любому из пп.1-6, где R2 представляет собой водород.
8. Соединение по любому из пп.1-7, где R3 представляет собой водород, С1-С6алкил, который возможно замещен одной или более чем одной группой R8, или RE, который возможно замещен одной или более чем одной группой R9; и где RE представляет собой моноциклическую или, когда имеется соответствующее число кольцевых атомов, полициклическую насыщенную кольцевую систему, содержащую от 3 до 7 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы.
9. Соединение по любому из пп.1-8, где R4 представляет собой водород, метил или этил.
10. Соединение по любому из пп.1-7, где -NR3R4 образует RF, который возможно замещен одной или более чем одной группой R10, и где RF представляет собой моноциклическую или, когда имеется соответствующее число кольцевых атомов, полициклическую насыщенную кольцевую систему, содержащую от 3 до 10 кольцевых атомов, содержащую один или два атома азота и возможно один другой атом, выбранный из кислорода и серы.
11. Соединение по любому из пп.1-10, где R5 представляет собой метил, этил или пропил, каждый из которых возможно замещен гидрокси, метокси или этокси.
12. Соединение по любому из пп.1-11, где R6 присоединен по N1 пиразоло[4,3-d]пиримидиновой кольцевой системы.
13. Соединение по любому из пп.1-12, где R6A представляет собой метил, этил, изопропил, изобутил, метоксиэтил, метоксипропил, этоксиэтил, этоксипропил, н-пропоксиэтил, изопропоксиэтил, 2,2,2-трифторэтил, 2,2,2-трифторэтоксиэтил, тетрагидрофуранилметил, тетрагидропиранилметил, тетрагидропиранил или пиридинилметил.
14. Соединение по п.1, выбранное из
1-(2-этоксиэтил)-3-метил-5-[(3R)-3-метилпиперазин-1-ил]-N-пиримидин-4-ил-1Н-пиразоло[4,3-d] пиримидин-7-амина;
1-(2-этоксиэтил)-3-этил-5-[(3R)-3-метилпиперазин-1-ил]-N-пиримидин-4-ил-1Н-пиразоло[4,3-d]пиримидин-7-амина;
1-(2-этоксиэтил)-3-этил-N5-метил-N5-(1-метилпиперидин-4-ил)-N7-пиримидин-4-ил-1H-пиразоло [4,3-d]пиримидин-5,7-диамина;
3-метил-5-[(3R)-3-метилпиперазин-1-ил]-1-(2-н-пропоксиэтил)-N-пиримидин-4-ил-1Н-пиразоло[4,3-d]пиримидин-7-амина;
5-[(2R,5S)-2,5-диметилпиперазин-1-ил]-1-(2-этоксиэтил)-3-метил-N-пиримидин-4-ил-1H-пиразоло [4,3-d]пиримидин-7-амина;
5-[(2R,5S)-2,5-диметилпиперазин-1-ил]-1-(2-этоксиэтил)-3-этил-N-пиримидин-4-ил-1H-пиразоло [4,3-d]пиримидин-7-амина;
1-(2-этоксиэтил)-N5,3-диметил-N7-(4-метилпиридин-2-ил)-N5-[(3S)-1-метилпирролидин-3-ил]-1Н-пиразоло[4,3-d]пиримидин-5,7-диамина;
1-(2-этоксиэтил)-3-этил-N5-метил-N7-(4-метилпиридин-2-ил)-N5-[(3S)-1-метилпирролидин-3-ил]-1H-пиразоло[4,3-d]пиримидин-5,7-диамина;
1-(2-этоксиэтил)-3-(метоксиметил)-5-[(3R)-3-метилпиперазин-1-ил]-N-(4-метилпиридин-2-ил)-1H-пиразоло[4,3-d]пиримидин-7-амина;
1-(2-этоксиэтил)-3-(метоксиметил)-N5,N5-диметил-N7-(4-метилпиридин-2-ил)-1Н-пиразоло[4,3-d] пиримидин-5,7-диамина;
{1-(2-этоксиэтил)-5-[N-этил-N-метиламино]-7-[(4-метилпиридин-2-ил)амино]-1H-пиразоло[4,3-d] пиримидин-3-ил}метанола;
1-(2-изопропоксиэтил)-3-метил-5-[(3R)-3-метилпиперазин-1-ил]-N-пиримидин-4-ил-1H-пиразоло [4,3-d]пиримидин-7-амина;
1-(2-этоксиэтил)-N5,3-диметил-N5-[(3S)-1-метилпирролидин-3-ил]-N7-пиримидин-4-ил-1H-пиразоло [4,3-d]пиримидин-5,7-диамина;
1-(2-этоксиэтил)-3-этил-N5-метил-N7-(5-метилпиридин-2-ил)-N5-[(3S)-1-метилпирролидин-3-ил]-1Н-пиразоло[4,3-d]пиримидин-5,7-диамина;
1-метил-5-[(3R)-3-метилпиперазин-1-ил]-3-пропил-N-пиримидин-4-ил-1Н-пиразоло[4,3-d]пиримидин-7-амина;
N-[5-((1R,4R)-2,5-диазабицикло[2.2.1]гепт-2-ил)-1-(2-этоксиэтил)-3-этил-1H-пиразоло[4,3-d]пиримидин-7-ил]-4-метилпиридин-2-иламина;
N-[5-((1S,4S)-2,5-диазабицикло[2.2.1]гепт-2-ил)-1-(2-этоксиэтил)-3-этил-1Н-пиразоло[4,3-d]пиримидин-7-ил]-4-метилпиридин-2-иламина;
N-{1-(2-этоксиэтил)-3-метоксиметил-5-[(3R)-3-метилпиперазин-1-ил]-1Н-пиразоло[4,3-d]пиримидин-7-ил}-6-метилпиридин-2-иламина;
N-{3-метил-5-[(3R)-3-метилпиперазин-1-ил]-1-[2-(2,2,2-трифторэтокси)этил]-1Н-пиразоло[4,3-d]пиримидин-7-ил}пиримидин-4-иламина;
N-{5-(3,8-диазабицикло[3.2.1]окт-3-ил)-3-метил-1-[2-(2,2,2-трифторэтокси)этил]-1H-пиразоло[4,3-d] пиримидин-7-ил}-6-метилпиридин-2-иламина;
N-{3-этил-5-[(3R)-3-метилпиперазин-1-ил]-1-[2-(2,2,2-трифторэтокси)этил]-1Н-пиразоло[4,3-d]пиримидин-7-ил}пиримидин-4-иламина;
N-{3-метил-5-(пиперазин-1-ил)-1-[2-(2,2,2-трифторэтокси)этил]-1Н-пиразоло[4,3-d]пиримидин-7-ил}-6-метилпиридин-2-иламина;
1-{3-метил-7-(6-метилпиримидин-4-иламино)-1-[2-(2,2,2-трифторэтокси)этил]-1H-пиразоло[4,3-d] пиримидин-5-ил}пиперидин-4-карбоновой кислоты;
N-{3-этил-5-[(3R)-3-метилпиперазин-1-ил]-1-[2-(2,2,2-трифторэтокси)этил]-1Н-пиразоло[4,3-d]пиримидин-7-ил}пиридазин-4-иламина;
N-{3-этил-5-[(3R)-3-метилпиперазин-1-ил]-1-[2-(2,2,2-трифторэтокси)этил]-1Н-пиразоло[4,3-d]пиримидин-7-ил}-2-метилпиримидин-4-иламина;
3-этил-N5-метил-N5-(1-метилпиперидин-4-ил)-N7-(6-метилпиримидин-4-ил)-1-[2-(2,2,2-трифторэтокси)этил]-1H-пиразоло[4,3-d]пиримидин-5,7-диамина;
N-{3-метоксиметил-5-[(3R)-3-метилпиперазин-1-ил]-1-[2-(2,2,2-трифторэтокси)этил]-1H-пиразоло[4,3-d]пиримидин-7-ил}-6-метилпиридин-2-иламина;
N-{3-этоксиметил-5-[(3R)-3-метилпиперазин-1-ил]-1-[2-(2,2,2-трифторэтокси)этил]-1H-пиразоло[4,3-d]пиримидин-7-ил}-6-метилпиридин-2-иламина;
N-{3-метоксиметил-5-[(3R)-3-метилпиперазин-1-ил]-1-[2-(2,2,2-трифторэтокси)этил]-1H-пиразоло[4,3-d]пиримидин-7-ил}-4-метилпиридин-2-иламина;
1-{3-метил-7-(4-метилпиридин-2-иламино)-1-[2-(2,2,2-трифторэтокси)этил]-1H-пиразоло[4,3-d]пиримидин-5-ил}пиперидин-4-карбоновой кислоты;
N-{3-этоксиметил-5-[(3R)-3-метилпиперазин-1-ил]-1-[2-(2,2,2-трифторэтокси)этил]-1H-пиразоло [4,3-d]пиримидин-7-ил}-4-метилпиридин-2-иламина;
1-{3-этил-7-(6-метилпиримидин-4-иламино)-1-[2-(2,2,2-трифторэтокси)этил]-1Н-пиразоло[4,3-d] пиримидин-5-ил}пиперидин-4-карбоновой кислоты и
3,N5-диметил-N5-(1-метилпиперидин-4-ил)-N7-(6-метилпиримидин-4-ил)-1-[2-(2,2,2-трифторэтокси) этил]-1H-пиразоло[4,3-d]пиримидин-5,7-диамина,
а также их таутомеров и фармацевтически приемлемых солей, сольватов и полиморфов указанного соединения или таутомера.
15. Фармацевтическая композиция, содержащая соединение формулы (I) по любому из пп.1-14 или его фармацевтически приемлемые соли, сольваты или полиморфы и фармацевтически приемлемый разбавитель или носитель.
16. Применение соединения формулы (I) по любому из пп.1-14 или его фармацевтически приемлемой соли, сольвртр или полиморфа в качестве лекарства.
17. Применение соединения формулы (I) по любому из пп.1-14 или его фармацевтически приемлемой соли, сольвата или полиморфа в изготовлении лекарства для лечения расстройства или состояния у млекопитающего, при котором известно или может быть показано, что ингибирование PDE-5 оказывает полезный эффект, включающее введение указанному млекопитающему терапевтически эффективного количества указанных соединения, соли, сольвата или полиморфа.
18. Применение соединения формулы (I) по любому из пп.1-14 или его фармацевтически приемлемой соли, сольвата или полиморфа в производстве лекарства для лечения расстройства или состояния, при котором известно или может быть показано, что ингибирование PDE-5 оказывает полезный эффект.
19. Фармацевтическая композиция, содержащая соединение формулы (I) по любому из пп.1-14 или его фармацевтически приемлемые соли, сольваты или полиморфы и второй фармацевтически активный агент, выбранный из аспирина, антагонистов рецептора ангиотензина II (таких как лосартан, кандесартан, телмисартан, валсартан, ирбесартан и эпросартан), блокаторов кальциевых каналов (таких как амлодипин), бета-блокаторов (таких как антагонисты бета-адренергических рецепторов, такие как соталол, пропранолол, тимолол, атенолол, карведилол и метопролол), Сl1027, антагонистов рецепторов CCR5, имидазолинов, растворимых активаторов гуанилатциклазы, диуретиков (таких как гидрохлортиазид, торсемид, хлортиазид, хлорталидон и амилорид), альфа-адренергических антагонистов (таких как доксазозин), ингибиторов АПФ (ангиотензинпревращающего фермента) (таких как хинаприл, эналаприл, рамиприл и лизиноприл), антагонистов рецепторов альдостерона (таких как эплеренон и спиронолактон), ингибиторов нейтральных эндопептидаз, противодиабетических агентов (таких как инсулин, сульфонилмочевины (такие как глибурид, глипизид и глимепирид), глитазоны (такие как розиглитазон и пиоглитазон) и метформин), агентов, снижающих уровень холестерина (таких как аторвастатин, правастатин, ловастатин, симвастатин, клофибрат и розувастатин) и альфа-2-дельта-лигандов (таких как габапентин, прегабалин, [(1R,5R,6S)-6-(аминометил)бицикло[3.2.0]гепт-6-ил]уксусная кислота, 3-(1-(аминометил)циклогексилметил)-4H-[1,2,4]оксадиазол-5-он, С-[1-(1Н-тетразол-5-илметил)циклогептил]метиламин, (3S,4S)-(1-аминометил-3,4-диметилциклопентил)уксусная кислота, (1a,3a,5a)-(3-(аминометил)бицикло[3.2.0]гепт-3-ил)уксусная кислота, (3S,5S)-3-аминометил-5-метилоктановая кислота, (3S,5S)-3-амино-5-метил-гептановая кислота, (3S,5R)-3-амино-5-метилнонановая кислота и (3S,5R)-3-амино-5-метилоктановая кислота).
20. Применение соединения формулы (I) по любому из пп.1-14 или его фармацевтически приемлемой соли, сольвата или полиморфа в производстве лекарства в комбинации со вторым фармацевтически активным агентом, выбранным из аспирина, антагонистов рецептора ангиотензина II (таких как лосартан, кандесартан, телмисартан, валсартан, ирбесартан и эпросартан), блокаторов кальциевых каналов (таких как амлодипин), бета-блокаторов (таких как антагонисты бета-адренергических рецепторов, такие как соталол, пропранолол, тимолол, атенолол, карведилол и метопролол), Сl1027, антагонистов рецепторов CCR5, имидазолинов, растворимых активаторов аденилатциклазы, диуретиков (таких как гидрохлортиазид, торсемид, хлортиазид, хлорталидон и амилорид), альфа-адренергических антагонистов (таких как доксазозин), ингибиторов АПФ (ангиотензинпревращающего фермента) (таких как хинаприл, эналаприл, рамиприл и лизиноприл), антагонистов рецепторов альдостерона (таких как эплеренон и спиронолактон), ингибиторов нейтральных эндопептидаз, противодиабетических агентов (таких как инсулин, сульфонилмочевины (такие как глибурид, глипизид и глимепирид), глитазоны (такие как розиглитазон и пиоглитазон) и метформин), агентов, снижающих уровень холестерина (таких как аторвастатин, правастатин, ловастатин, симвастатин, клофибрат и розувастатин) и альфа-2-дельта-лигандов (таких как габапентин, прегабалин, [(1R,5R,6S)-6-(аминометил)бицикло[3.2.0]гепт-6-ил]уксусная кислота, 3-(1-(аминометил) циклогексилметил)-4H-[1,2,4]оксадиазол-5-он, С-[1-(1Н-тетразол-5-илметил)циклогептил]метиламин, (3S,4S)-(1-аминометил-3,4-диметилциклопентил)уксусная кислота, (1a,3a,5a)-(3-(аминометил)бицикло [3.2.0]гепт-3-ил)уксусная кислота, (3S,5R)-3-аминометил-5-метилоктановая кислота, (3S,5R)-3-амино-5-метилгептановая кислота, (3S,5R)-3-амино-5-метилнонановая кислота и (3S,5R)-3-амино-5-метилоктановая кислота), для лечения заболевания или состояния, при котором известно или может быть показано, что ингибирование PDE-5 оказывает полезный эффект.
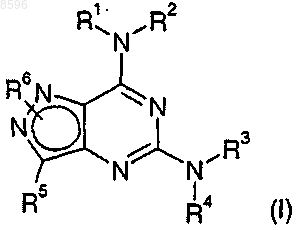
21. Соединение формулы (VII)
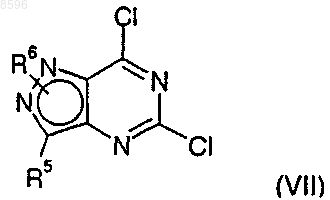
где R5 и R6 являются такими, как определено в п.1.
22. Соединение формулы (VIII)
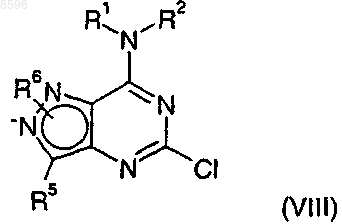
где R1, R2, R5 и R6 являются такими, как определено в п.1.
23. Способ получения соединения формулы (I), как оно определено в п.1, включающий стадию обработки соединения формулы (VII), как оно определено в п.22, соединением HNR3R4, где R3 и R4 являются такими, как определено в п.1.
24. Соединение по п.1, где
R1 представляет собой циклическую группу, выбранную из RA, RB, RC и RD, каждый из которых возможно замещен одной или более чем одной группой R7;
R2 представляет собой водород или С1-С2алкил;
R3 представляет собой водород, С1-С4алкил, который возможно замещен одной или более чем одной группой R8, либо RE, который возможно замещен одной или более чем одной группой R9;
R4 представляет собой водород, С1-С6алкил или С1-С6галогеналкил; либо -NR3R4 образует RF, который возможно замещен одной или более чем одной группой R10;
R5 представляет собой С1-С4алкил или С1-С4галогеноалкил, каждый из которых возможно замещен гидрокси, С1-С4алкокси или С1-С4галогеноалкокси;
R6 представляет собой R6A;
R6A представляет собой С1-С4алкил или С1-С4галогеноалкил, каждый из которых возможно замещен С1-С4алкокси, С1-С64галогеноалкокси или циклической группой, выбранной из RJ, RL и RM, либо R6A представляет собой RN;
R7 представляет собой галогено, С1-С6алкил, С1-С6галогеноалкил, оксо, OR12 или CONR12R13;
R8 представляет собой галогено, фенил, С1-С6алкоксифенил, OR12, NR12R13, NR12CO2R14, CO2R12, CONR12R13, RG или RH, последние два из которых возможно замещены одной или более чем одной группой R9;
R9 представляет собой С1-С6алкил, С1-С6галогеноалкил или CO2R12;
R10 представляет собой галогено, С3-С10циклоалкил, С3-С10галогеноциклоалкил, фенил, OR12, OC(O)R12, NO2, NR12R13, NR12C(O)R13, NR12CO2R14, C(O)R12, CO2R13, CONR12R13, CN, окёю, С1-С6алкил или С1-С6галогеноалкил, последние два из которых возможно замещены R11;
R11 представляет собой ОН, фенил, NR12R13 или NR12CO2R14;
R12 и R13, каждый независимо, представляет собой водород, С1-С6алкил или С1-С6галогеноалкил;
R14 представляет собой С1-С6алкил или С1-С6галогеноалкил;
RA представляет собой моноциклическую группу С5-С7циклоалкил;
RB представляет собой фенил;
RC представляет собой моноциклическую насыщенную кольцевую систему, содержащую от 5 до 7 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы;
RD представляет собой 5-членное гетероароматическое кольцо, содержащее гетероатом, выбранный из азота, кислорода и серы, и возможно вплоть до двух дополнительных атомов в кольце, или 6-членное гетероароматическое кольцо, включающее 1, 2 или 3 атома азота;
RE представляет собой моноциклическую насыщенную кольцевую систему, содержащую от 3 до 7 кольцевых атомов, включающую один атом азота;
RF представляет собой моноциклическую или, когда имеется соответствующее число кольцевых атомов, полициклическую насыщенную кольцевую систему, содержащую от 3 до 10 кольцевых атомов, включающую по меньшей мере один атом азота и возможно один другой атом, выбранный из кислорода и серы;
RG представляет собой моноциклическую насыщенную кольцевую систему, содержащую от 3 до 7 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы;
RH представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее вплоть до двух атомов азота;
RL и RN, каждый независимо, представляет собой моноциклическую насыщенную кольцевую систему, содержащую либо 5, либо 6 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы; и
RM представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее гетероатом, выбранный из азота, кислорода и серы;
его таутомер, либо фармацевтически приемлемая соль указанного соединения или таутомера.
25. Соединение по п.24, где R2 представляет собой водород.
26. Соединение по п.25, где R5 представляет собой С1-С4алкил, гидроксиметил или С1-С4алкокси-метил.
27. Соединение по п.25, где R5 представляет собой метил, этил, н-пропил, изопропил, гидроксиметил, метоксиметил или этоксиметил.
28. Соединение по п.27, где R6 присоединен по N1 пиразоло[4,3-d]пиримидиновой кольцевой системы.
29. Соединение по п.27, где R6A представляет собой метил, этил, изопропил, изобутил, метоксиэтил, метоксипропил, этоксиэтил, этоксипропил, н-пропоксиэтил, изопропоксиэтил, 2,2,2-трифторэтил, 2,2,2-трифторэтоксиэтил, тетрагидрофуранилметил, тетрагидропиранилметил, тетрагидропиранил или пиридинилметил.
30. Соединение по п.29, где
-NR3R4 образует RF, который возможно замещен одной или более чем одной группой R10;
RF выбран из азетидинила, пирролидинила, пиперидинила, пиперазинила, морфолинила, 3-азабицикло[3.1.0]гекс-3-ила, гомопиперазинила, 2,5-диазабицикло[2.2.1]гепт-2-ила, 2,5-диазабицикло [2.2.2]окт-2-ила, 2,5-диазабицикло[4.3.0]нон-2-ила, 3,8-диазабицикло[3.2.1]окт-3-ила, 3,8-диазабицикло [3.2.1]окт-8-ила, 1,4-диазабицикло[4.3.0]нон-4-ила и 1,4-диазабицикло[3.2.2]нон-4-ила; где
R10 представляет собой галогено, -OR12, -NR12R13, -NR12CO2R14, -CO2R13, оксо, С1-С6алкил или С1-С6 галогеноалкил, последние два из которых возможно замещены R11.
31. Соединение по п.29, где -NR3R4 образует пиперазиновое кольцо, которое возможно замещено одной или двумя метильными группами.
32. Соединение по п.29, где -NR3R4 образует циклическую группу RF, которая замещена одной группой R10, и R10 представляет собой -СО2Н.
33. Соединение по п.30, где RD представляет собой пиразолил, имидазолил, изоксазолил, оксазолил, оксадиазолил, пиридил, пиридазинил, пиримидил или пиразинил, который возможно замещен одной или более группами R7, где R7 представляет собой галогено, С1-С3алкил, С1-С3галогеноалкил, оксо, С1-С3алкокси, гидрокси или -СОNН(С1-С3алкил).
34. Соединение по п.33, где RD выбран из группы, состоящей из пиридила и пиримидила, возможно замещенного одной или более группами R7.
35. Соединение по п.1, которое представляет собой N-{3-этил-5-[(3R)-3-метилпиперазин-1-ил]-1-[2-(2,2,2,-трифторэтокси)этил]-1Н-пиразоло[4,3-d]пиримидин-7-ил}пиримидин-4-иламин;
его таутомер, либо фармацевтически приемлемая соль указанного соединения или таутомера.
36. Соединение формулы
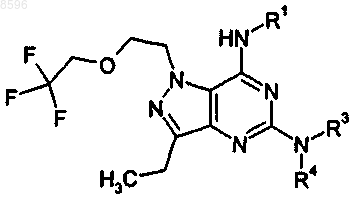
где
R1 представляет собой RD, каждый из которых возможно замещен одной или более чем одной группой R7;
-NR3R4 образует RF, который возможно замещен одной или более чем одной группой R10;
R7 представляет собой галогено, С1-С6алкил, С1-С6галогеноалкил, оксо, OR12 или CONR12R13;
R8 представляет собой галогено, фенил, С1-С6алкоксифенил, OR12, NR12R13, NR12CO2R14, CO2R12, CONR12R13, RG или RH, последние два из которых возможно замещены одной или более чем одной группой R9;
R9 представляет собой С1-С6алкил, С1-С6галогеноалкил или CO2R12;
R10 представляет собой галогено, С3-С10циклоалкил, С3-С10галогеноциклоалкил, фенил, OR12, OC(O)R12, NO2, NR12R13, NR12C(O)R13, NR12CO2R14, C(O)R12, CO2R13, CONR12R13, CN, оксо, С1-С6алкил или С1-С6галогеноалкил, последние два из которых возможно замещены R11;
R11 представляет собой ОН, фенил, NR12R13 или NR12CO2R14;
R12 и R13, каждый независимо, представляет собой водород, С1-С6алкил или С1-С6галогеноалкил;
R14 представляет собой С1-С6алкил или С1-С6галогеноалкил;
RD представляет собой 5-членное гетероароматическое кольцо, содержащее гетероатом, выбранный из азота, кислорода и серы, и возможно вплоть до двух дополнительных атомов азота в кольце, или 6-членное гетероароматическое кольцо, содержащее 1, 2 или 3 атома азота;
RE представляет собой моноциклическую насыщенную кольцевую систему, содержащую от 3 до 7 кольцевых атомов, включающую один атом азота;
RF представляет собой моноциклическую или, когда имеется соответствующее число кольцевых атомов, полициклическую насыщенную кольцевую систему, содержащую от 3 до 10 кольцевых атомов, содержащую по меньшей мере один атом азота и возможно один другой атом, выбранный из кислорода и серы;
RG представляет собой моноциклическую насыщенную кольцевую систему, содержащую от 3 до 7 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы;
RH представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее вплоть до двух атомов азота;
его таутомер, либо фармацевтически приемлемая соль указанного соединения или таутомера.
37. Соединение по п.36, где -NR3R4 образует RF, который возможно замещен одной или более чем одной группой R10, где RF выбран из азетидинила, пирролидинила, пиперидинила, пиперазинила, морфолинила, 3-азабицикло[3.1.0]гекс-3-ила, гомопиперазинила, 2,5-диазабицикло[2.2.1]гепт-2-ила, 2,5-диазабицикло[2.2.2]окт-2-ила, 2,5-диазабицикло[4.3.0]нон-2-ила, 3,8-диазабицикло[3.2.1]окт-3-ила, 3,8-диазабицикло[3.2.1]окт-8-ила, 1,4-диазабицикло[4.3.0]нон-4-ила и 1,4-диазабицикло[3.2.2]нон-4-ила.
38. Соединение по п.36, где -NR3R4 образует пиперазиновое кольцо, которое возможно замещено одной метильной группой.
39. Соединение по п.36, где RD представляет собой пиразолил, имидазолил, изоксазолил, оксазолил, оксадиазолил, пиридил, пиридазинил, пиримидил или пиразинил, возможно замещенный одной или более чем одной группой R7; где R7 представляет собой фторо, метил, этил, гидрокси, метокси, пропокси, трифторметокси, оксо или -CONHCH3.
40. Соединение по п.39, где RD представляет собой пиримидил, который возможно замещен одной или более чем одной группой R7.
41. Соединение по п.39, где RD представляет собой незамещенный пиримидил.
42. Фармацевтическая композиция, содержащая соединение формулы (I) по любому из пп.24-41 или его таутомер, либо фармацевтически приемлемую соль указанного соединения или таутомера.
43. Применение соединения формулы (I) по любому из пп.24-41 или его таутомера, либо фармацевтически приемлемой соли указанного соединения или таутомера в изготовлении лекарства для лечения гипертензии.
Текст
008596 Настоящее изобретение относится к ряду новых 5,7-диаминопиразоло[4,3-d]пиримидинов, которые являются ингибиторами фосфодиэстеразы типа 5, специфичной к циклическому гуанилатмонофосфату(цГМФ) (здесь называемые ингибиторами PDE-5), которые полезны при лечении гипертензии и других расстройств, к способам их получения, промежуточным соединениям, используемым при их получении,к композициям, содержащим их, и к применениям указанных соединений и композиций. 1) Гипертензия. Кровяное давление (КД) определяется рядом гемодинамических параметров, рассматриваемых по отдельности или в сочетании. Систолическое кровяное давление (СКД) представляет собой максимальное артериальное давление, достигаемое при сокращении сердца. Диастолическое кровяное давление представляет собой минимальное артериальное давление, достигаемое при расслаблении сердца. Разность между СКД и ДКД определяют как пульсовое давление (ПД). Гипертензию или повышенное КД определили как СКД по меньшей мере 140 мм Нg и/или ДКД по меньшей мере 90 мм Нg. По этому определению уровень распространения гипертензии в развитых странах составляет примерно 20% среди взрослого населения, повышаясь примерно до 60-70% среди людей в возрасте 60 лет или старше, хотя значительная доля этих гипертензивных субъектов имеет нормальное КД, когда его измеряют в не клинических условиях. Примерно 60% этого более пожилого гипертензивного населения имеет изолированную систолическую гипертензию (ИСГ), то есть они имеют повышенное СКД и нормальное ДКД. Гипертензия связана с повышенным риском удара, инфаркта миокарда,фибрилляции желудочка, сердечной недостаточности, заболевания периферических сосудов и дисфункции почек (Fagard, R.H.; Am. J. Geriatric Cardiology 11(1), 23-28, 2002; Brown, M.J. and Haycock, S; Drugs 59 (Suppl 2), 1-12, 2000). Патофизиология гипертензии является предметом непрекращающегося спора. Хотя все, как правило, согласны, что гипертензия является результатом дисбаланса между минутным сердечным выбросом и периферическим сопротивлением сосудов, и что большинство гипертензивных субъектов имеет аномальный минутный сердечный выброс и повышенное периферическое сопротивление сосудов, нет уверенности, какой из параметров меняется первым (Beevers, G. et al.; BMJ 322, 912-916, 2001). Несмотря на большое число лекарств, существующих в различных фармакологических категориях,включая диуретики, альфа-адренергические антагонисты, бета-адренергические антагонисты, блокаторы кальциевых каналов, ингибиторы ангиотензинпревращающего фермента (АПФ) и антагонисты рецепторов ангиотензина, потребность в эффективном лечении гипертензии еще не удовлетворена. 2) Ингибиторы PDE-5. Клетки эндотелия кровеносных сосудов секретируют оксид азота (NO). Он действует на гладкомышечные клетки кровеносных сосудов и приводит к активации гуанилатциклазы и накоплению циклического гуанозинмонофосфата (цГМФ). Накопление цГМФ вызывает расслабление мышц и расширение кровеносных сосудов. Это расширение уменьшает периферическое сопротивление сосудов и поэтому приводит к снижению кровяного давления. цГМФ инактивируется в результате гидролиза до гуанозин-5'-монофосфата (ГМФ) под действием цГМФ-специфичной фосфодиэстеразы. Одна из важных фосфодиэстераз идентифицирована как фосфодиэстераза типа 5 (PDE-5). Ингибиторы PDE-5 снижают скорость гидролиза цГМФ и, таким образом,потенцируют действия оксида азота. Ингибиторы PDE-5 описаны в нескольких химических классах, включая: пиразоло[4,3-d]пиримидин-7-оны (например, опубликованные Международные патентные заявки WO 93/06104, WO 98/49166,WO 99/54333, WO 00/24745, WO 01/27112 и WO 01/27113); пиразоло[3,4-d]пиримидин-4-оны (например,опубликованная Международная патентная заявка WO 93/07149); пиразоло[4,3-d]пиримидины (например, опубликованная Международная патентная заявка WO 01/18004); хиназолин-4-оны (например,опубликованная Международная патентная заявка WO 93/12095); пиридо[3,2-d]пиримидин-4-оны (например, опубликованная Международная патентная заявка WO 94/05661); пурин-6-оны (например, опубликованная Международная патентная заявка WO 94/00453); гексагидропиразино[2',1':6,1 ]пиридо[3,4-b] индол-1,4-дионы (например, опубликованная Международная патентная заявка WO 95/19978) и имидазо[5,1-f][1,2,4]триазиноны (например, опубликованная Международная патентная заявка WO 99/24433). Хотя ингибиторы PDE-5 предложены в качестве агентов для лечения родственных состояний, таких как стенокардия, они до сих пор не были приняты в качестве агентов для лечения гипертензии. Ингибиторы PDE-5 известны для лечения мужской эректильной дисфункции, например, силденафил, тадалафил и варденафил. Остается потребность в новых ингибиторах PDE-5, в частности, с улучшенными фармакокинетическими и фармакодинамическими свойствами. В WO 02/00660 и WO 01/18004 раскрыты пиразоло[4,3-d]пиримидины с ингибирующим эффектом в отношении PDE-5, которые могут применяться для лечения расстройств сердечно-сосудистой системы. Согласно первому аспекту в настоящем изобретении предложены соединения формулы (I)R1 представляет собой циклическую группу, выбранную из RA, RB, RС и RD, каждый из которых возможно замещен одной или более чем одной группой R7;R2 представляет собой водород или С 1-С 2 алкил;R3 и R4, каждый независимо, представляет собой С 1-С 8 алкил, С 2-С 8 алкенил, С 2-С 8 алкинил или С 3 С 10 циклоалкил, каждый из которых возможно замещен одной или более чем одной группой R8, либо RE,который возможно замещен одной или более чем одной группой R9, либо водород; либо -NR3R4 образует RF, который возможно замещен одной или более чем одной группой R10;R5 представляет собой C1-С 6 алкил, С 1-С 6 галогеноалкил, С 2-С 6 алкенил, С 2-С 6 алкинил или С 3-С 7 циклоалкил, каждый из которых возможно замещен одной или более чем одной группой, выбранной из гидрокси, C1-С 6 алкокси, С 1-С 6 галогеноалкокси, С 3-С 7 циклоалкил и С 3-С 7 циклоалкокси, либо водород;R6, который может быть присоединен по N1 или N2, представляет собой R6A или водород;R6A представляет собой С 1-С 6 алкил, C1-С 6 галогеноалкил, С 2-С 6 алкенил или С 2-С 6 алкинил, каждый из которых возможно замещен C1-С 6 алкокси, (С 3-С 6 циклоалкил)C1-С 6 алкокси, C1-С 6 галогеноалкокси или циклической группой, выбранной из RJ, RK, RL и RM, либо R6A представляет собой RN, C3-С 7 циклоалкил или С 3-С 7 галогеноциклоалкил, каждый из которых возможно замещен C1-С 6 алкокси или С 1-С 6 галогеноалкокси;NR C(O)R13, NR12CO2R14, C(O)R12, CO2R12, CONR12R13, CN, С 3-С 6 циклоалкил, RG или RH, последние два из которых возможно замещены одной или более чем одной группой R9;R10 представляет собой галогено, С 3-С 10 циклоалкил, С 3-Сюгалогеноциклоалкил, фенил, OR12,OC(O)R12, NO2, NR12R13, NR12C(O)R13, NR12CO2R14, C(O)R12, CO2R13, CONR12R13, CN, оксо, C1-С 6 алкил или С 1-С 6 галогеноалкил, последние два из которых возможно замещены R11;RA и RJ, каждый независимо, представляет собой группу С 3-С 10 циклоалкил или С 3-С 10 циклоалкенил,каждая из которых может быть либо моноциклической, либо, когда имеется соответствующее число кольцевых атомов, полициклической, и которая может быть конденсирована либо(а) с моноциклическим ароматическим кольцом, выбранным из бензольного кольца и 5- или 6 членного гетероароматического кольца, содержащего вплоть до трех гетероатомов, выбранных из азота,кислорода и серы, либо(б) с 5-, 6- или 7-членным гетероалициклическим кольцом, содержащим вплоть до трех гетероатомов, выбранных из азота, кислорода и серы;RB и RK, каждый независимо, представляет собой группу фенил или нафтил, каждая из которых может быть конденсирована либо(а) с С 5-С 7 циклоалкильным или С 5-С 7 циклоалкенильным кольцом,(б) с 5-, 6- или 7-членным гетероалициклическим кольцом, содержащим вплоть до трех гетероатомов, выбранных из азота, кислорода и серы, либо(в) с 5- или 6-членным гетероароматическим кольцом, содержащим вплоть до трех гетероатомов,выбранных из азота, кислорода и серы;RС, RL и RN, каждый независимо, представляет собой моноциклическую или, когда имеется соответствующее число кольцевых атомов, полициклическую насыщенную или частично ненасыщенную кольцевую систему, содержащую от 3 до 10 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы, причем это кольцо может быть конденсировано с С 5-С 7 циклоалкильной или С 5-С 7 циклоалкенильной группой или с моноциклическим ароматическим кольцом, выбранным из бензольного кольца и 5- или 6-членного гетероароматического кольца, содержащего вплоть до трех гетероатомов, выбранных из азота, кислорода и серы;RD и RM, каждый независимо, представляет собой 5- или 6-членное гетероароматическое кольцо,содержащее вплоть до трех гетероатомов, независимо выбранных из азота, кислорода и серы, причем это кольцо может быть дополнительно конденсировано(а) со вторым 5- или 6-членным гетероароматическим кольцом, содержащим вплоть до трех гете-2 008596 роатомов, выбранных из азота, кислорода и серы;(в) с 5-, 6- или 7-членным гетероалициклическим кольцом, содержащим вплоть до трех гетероатомов, выбранных из азота, кислорода и серы; либоRE, RF и RG, каждый независимо, представляет собой моноциклическую или, когда имеется соответствующее число кольцевых атомов, полициклическую насыщенную кольцевую систему, содержащую от 3 до 10 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы, иRH представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее вплоть до трех гетероатомов, независимо выбранных из азота, кислорода и серы,их таутомер, либо фармацевтически приемлемая соль, сольват или полиморф указанного соединения или таутомера. Если не указано иное, группа алкил или алкокси может быть нормальной или разветвленной и содержать от 1 до 8 атомов углерода, предпочтительно от 1 до 6 и, в частности, от 1 до 4 атомов углерода. Примеры алкила включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втop-бутил, пентил и гексил. Примеры алкокси включают метокси, этокси, изопропокси и н-бутокси. Если не указано иное, группа алкенил или алкинил может быть нормальной или разветвленной и содержать от 2 до 8 атомов углерода, предпочтительно от 2 до 6 и, в частности, от 2 до 4 атомов углерода и может содержать вплоть до 3 двойных или тройных связей, которые могут быть конъюгированы. Примеры алкенила и алкинила включают винил, аллил, бутадиенил и пропаргил. Если не указано иное, группа циклоалкил или циклоалкокси может содержать от 3 до 10 кольцевых атомов углерода, может быть либо моноциклической, либо, когда имеется соответствующее число атомов углерода, полициклической. Примерами циклоалкильных групп являются циклопропил, циклопентил, циклогексил и адамантил. Если не указано иное, группа циклоалкенил может содержать от 3 до 10 кольцевых атомов углерода, может быть либо моноциклической, либо, когда имеется соответствующее число атомов углерода,полициклической и может содержать вплоть до 3 двойных связей. Примерами циклоалкильных групп являются циклопентенил и циклогексенил. Арил включает фенил, нафтил, антраценил и фенантренил. Если не указано иное, группа гетероалициклил может содержать от 3 до 10 кольцевых атомов углерода, вплоть до 4 из которых могут представлять собой гетероатомы, такие как азот, кислород и сера, и может быть насыщенной или частично ненасыщенной. Примерами гетероалициклильных групп являются оксиранил, азетидинил, тетрагидрофуранил, тиоланил, пирролидинил, пирролинил, имидазолидинил,имидазолинил, сульфоланил, диоксоланил, дигидропиранил, тетрагидропиранил, пиперидинил, пиразолинил, пиразолидинил, диоксанил, морфолинил, дитианил, тиоморфолинил, пиперазинил, азепинил, оксазепинил, тиазепинил, тиазолинил и диазапанил. Если не указано иное, группа гетероарил может содержать от 3 до 10 кольцевых атомов углерода,вплоть до 4 из которых могут представлять собой гетероатомы, такие как азот, кислород и сера. Примерами гетероарильных групп являются фурил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, оксадиазолил, триазолил, тиадиазолил, пиридил, пиримидинил, пиразинил, пиридазинил, тетразолил, триазинил. Кроме того, термин гетероарил включает конденсированные гетероарильные группы, например, бензимидазолил, бензоксазолил, имидазопиридинил, бензоксазинил, бензотиазинил, оксазолопиридинил, бензофуранил, хинолинил, хиназолинил, хиноксалинил, бензотиазолил, фталимидо, бензофуранил, бензодиазепинил, индолил и изоиндолил. Во избежание сомнений оксозамещенные гетероароматические системы, такие как пиридинонил,пиранонил, имидазолонил и тому подобные, также считают гетероарильными группами. Галогено означает фторо, хлоро, бромо или йодо. Галогеноалкил включает моногалогеноалкил, полигалогеноалкил и пергалогеноалкил, такие как 2 бромэтил, 2,2,2-трифторэтил, хлордифторметил и трихлорметил. Галогеноалкокси включает моногалогеноалкокси, полигалогеноалкокси и пергалогеноалкокси, такие как 2-бромэтокси, 2,2,2-трифторэтокси,хлордифторметокси и трихлорметокси. Галогеноциклоалкил включает моногалогеноциклоалкил, полигалогеноциклоалкил и пергалогеноциклоалкил. Если не указано иное, термин замещенный означает замещенный одной или более чем одной определенной группой. В случае, где группы могут быть выбраны из ряда альтернативных групп, выбранные группы могут быть одинаковыми или разными. В одном предпочтительном воплощении R1 представляет собой RA, который возможно замещен одной или более чем одной группой R7, иRA представляет собой С 3-С 10 циклоалкильную группу, которая может быть либо моноциклической,либо, когда имеется соответствующее число атомов углерода, полициклической, которая может быть конденсирована либо(а) с моноциклическим ароматическим кольцом, выбранным из бензольного кольца и 5- или 6-3 008596 членного гетероароматического кольца, содержащего вплоть до трех гетероатомов, выбранных из азота,кислорода и серы, либо(б) с 5-, 6- или 7-членным гетероалициклическим кольцом, содержащим вплоть до трех гетероатомов, выбранных из азота, кислорода и серы. Предпочтительно RA представляет собой моноциклическую С 3-С 8 циклоалкильную группу. Более предпочтительно RA представляет собой моноциклическую С 5-С 7 циклоалкильную группу. Наиболее предпочтительно RA представляет собой циклопентил или циклогексил. В другом предпочтительном воплощении R1 представляет собой RB, который возможно замещен одной или более чем одной группой R7. Предпочтительно RB представляет собой фенил. В другом предпочтительном воплощении R1 представляет собой RС, который возможно замещен одной или более чем одной группой R7. Предпочтительно RС представляет собой моноциклическую насыщенную или частично ненасыщенную кольцевую систему, содержащую от 3 до 8 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы. Более предпочтительно RС представляет собой моноциклическую насыщенную или частично ненасыщенную кольцевую систему, содержащую от 5 до 7 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы. Более предпочтительно RС представляет собой моноциклическую насыщенную кольцевую систему,содержащую от 5 до 7 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы. Наиболее предпочтительно RС представляет собой пиперидинил. В другом предпочтительном воплощении R1 представляет собой RD, который возможно замещен одной или более чем одной группой R7. Предпочтительно RD представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее вплоть до трех гетероатомов, независимо выбранных из азота, кислорода и серы. Более предпочтительно RD представляет собой 5-членное гетероароматическое кольцо, содержащее гетероатом, выбранный из азота, кислорода и серы, и возможно вплоть до двух дополнительных атомов азота в кольце, или 6-членное гетероароматическое кольцо, включающее 1, 2 или 3 атома азота. Более предпочтительно RD представляет собой фуранил, тиенил, пирролил, пиразолил, имидазолил,изоксазолил, оксазолил, изотиазолил, тиазолил, оксадиазолил, пиридил, пиридазинил, пиримидил или пиразинил. Наиболее предпочтительно RD представляет собой пиразолил, имидазолил, изоксазолил, оксазолил,оксадиазолил, пиридил, пиридазинил, пиримидил или пиразинил. Предпочтительно R7 представляет собой галогено, С 1-С 6 алкил, С 1-С 6 галогеноалкил, оксо, OR12 илиCONR12R13. Более предпочтительно R7 представляет собой галогено, C1-С 3 алкил, С 1-С 3 галогеноалкил, оксо, С 1 С 3 алкокси, гидрокси или СОNН(С 1-С 3 алкил). Наиболее предпочтительно R7 представляет собой фторо, метил, этил, гидрокси, метокси, пропокси,трифторметил, оксо или CONHMe. Предпочтительно R2 представляет собой водород или метил. Более предпочтительно R2 представляет собой водород. Предпочтительно R3 представляет собой водород, C1-С 6 алкил, который возможно замещен одной или более чем одной группой R8, или RE, который возможно замещен одной или более чем одной группой R9; и где RE представляет собой моноциклическую или, когда имеется соответствующее число кольцевых атомов, полициклическую насыщенную кольцевую систему, содержащую от 3 до 7 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы. Более предпочтительно R3 представляет собой водород, C1-С 4 алкил, который возможно замещен одной или более чем одной группой R8, или RE, который возможно замещен одной или более чем одной группой R9; и где RE представляет собой моноциклическую насыщенную кольцевую систему, содержащую от 3 до 7 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы. В одном предпочтительном воплощении R3 представляет собой RE, который возможно замещен одной или более чем одной группой R9; и где RE представляет собой моноциклическую насыщенную кольцевую систему, содержащую от 3 до 7 кольцевых атомов, содержащую один атом азота. Более предпочтительно RE представляет собой азетидинил, пирролидинил или пиперидинил. В другом предпочтительном воплощении R3 представляет собой C1-С 4 алкил, который возможно замещен одной или более чем одной группой R8, и где R8 представляет собой галогено, фенил, C1-С 6 алкоксифенил, OR12, NR12R13, NR12CO2R14, CO2R12, CONR12R13, RG или RH, последние два из которых возможно замещены одной или более чем одной группой R9. Более предпочтительно R8 представляет собой гидрокси, метокси, метоксифенил, NH2, NHMe,-4 008596NMe2, NHCO2tBu, NMeCO2tBu, CO2H, CONHMe, RG или RH, последние два из которых возможно замещены одной или более чем одной группой R9. В одном предпочтительном воплощении R8 представляет собой RG, который возможно замещен одной или более чем одной группой R9, и где RG представляет собой моноциклическую насыщенную кольцевую систему, содержащую от 3 до 7 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы. Более предпочтительно RG представляет собой моноциклическую насыщенную кольцевую систему,содержащую от 3 до 7 кольцевых атомов, содержащую один атом азота и возможно один атом кислорода. Наиболее предпочтительно RG представляет собой пирролидинил, пиперидинил или морфолинил. В другом предпочтительном воплощении R8 представляет собой RH, который возможно замещен одной или более чем одной группой R9, и где RH представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее вплоть до двух атомов азота. Более предпочтительно RH представляет собой пиразолил. Предпочтительно R9 представляет собой метил или СО 2tВu. В другом предпочтительном воплощении R3 представляет собой водород или C1-С 4 алкил, который возможно замещен одной или более чем одной группой R8, либо R3 представляет собой азетидинил, пирролидинил или пиперидинил, каждый из которых возможно замещен одной или более чем одной группой R9, гдеR8 представляет собой гидрокси, метокси, метоксифенил, NH2, NHMe, NMe2, NHCO2tBu,NMeCO2tBu, CO2H, CONHMe, пирролидинил, пиперидинил, морфолинил или пиразолил, последние четыре из которых возможно замещены одной или более чем одной группой R9, и гдеR9 представляет собой метил или CO2tBu. В одном предпочтительном воплощении R4 представляет собой водород, С 1-С 6 алкил, C1-С 6 галогеноалкил, C2-С 6 алкенил или С 2-С 6 алкинил. Более предпочтительно R4 представляет собой водород, C1-С 6 алкил или C1-С 6 галогеноалкил. Наиболее предпочтительно R4 представляет собой водород, метил или этил. В другом предпочтительном воплощении -NR3R4 образует RF, который возможно замещен одной или более чем одной группой R10, и где RF представляет собой моноциклическую или, когда имеется соответствующее число кольцевых атомов, пол и циклическую насыщенную кольцевую систему, содержащую от 3 до 10 кольцевых атомов, содержащую по меньшей мере один атом азота и возможно один другой атом, выбранный из кислорода и серы. Более предпочтительно RF представляет собой моноциклическую или, когда имеется соответствующее число кольцевых атомов, полициклическую насыщенную кольцевую систему, содержащую от 3 до 10 кольцевых атомов, содержащую один или два атома азота и возможно один другой атом, выбранный из кислорода и серы. Наиболее предпочтительно RF выбран из азетидинила, пирролидинила, пиперидинила, пиперазинила, морфолинила, 3-азабицикло[3.1.0]гекс-3-ила, гомопиперазинила, 2,5-диазабицикло[2.2.1]гепт-2-ила,2,5-диазабицикло[2.2.2]окт-2-ила, 2,5-диазабицикло[4.3.0]нон-2-ила, 3,8-диазабицикло[3.2.1]окт-3-ила,3,8-диазабицикло[3.2.1]окт-8-ила, 1,4-диазабицикло[4.3.0]нон-4-ила и 1,4-диазабицикло[3.2.2]нон-4-ила. Предпочтительно R10 представляет собой галогено, OR12, NR12R13, NR12CO2R14, CO2R13, оксо, C1-С 6 алкил или C1-С 6 галогеноалкил, последние два из которых возможно замещены R11. Более предпочтительно R10 представляет собой галогено, метил, этил, изопропил, гидрокси, метокси, NH2, NHMe, NMe2, NHCO2tBu, СО 2 Н, СО 2tВu, оксо, бензил, -СН 2 ОН, -CH2NH2, -CH2NHMe, -CH2NMe2 или -CH2NMeCO2tBu. В особенно предпочтительном воплощении -NR3R4 образует пиперазиновое кольцо, которое возможно замещено одной или двумя метильными группами и/или связано мостиковой связью группой-СН 2- или -СН 2 СН 2-. Подходящие мостиковые пиперазины включают кольцевые системы 2,5 диазабицикло[2.2.1]гепт-2-ил, 2,5-диазабицикло[2.2.2]окт-2-ил, 3,8-диазабицикло[3.2.1]окт-3-ил и 3,8 диазабицикло[3.2.1]окт-8-ил. В другом предпочтительном воплощении R3 представляет собой С 1-С 6 алкил, который замещен одной группой R8, либо RE, который замещен одной группой R9; либо -NR3R4 образует циклическую группуRF, которая замещена одной группой R10, a R8, R9 и R10 все представляют собой СО 2 Н. Предпочтительно R5 представляет собой C1-С 4 алкил или С 1-С 4 галогеноалкил, каждый из которых возможно замещен гидрокси, C1-С 4 алкокси или C1-С 4 галогеноалкокси. В одном более предпочтительном воплощении R5 представляет собой C1-С 4 алкил, гидроксиметил или C1-С 4 алкоксиметил. В другом более предпочтительном воплощении R5 представляет собой метил, этил или пропил, каждый из которых возможно замещен гидрокси, метокси или этокси. Наиболее предпочтительно R5 представляет собой метил, этил, н-пропил, изопропил, гидроксиметил, метоксиметил или этоксиметил. Предпочтительно R6 представляет собой R6A.-5 008596 Когда R6 представляет собой водород, соединения формулы (I), где R6 присоединен по N1 и по N2,являются таутомерами. Эти таутомеры будут склонны к сосуществованию как в твердом состоянии, так и в растворе, и их будет нелегко разделить. Количества каждого таутомера, присутствующего в любой равновесной смеси, будут определяться относительными термодинамическими стабильностями этих двух форм. В большинстве случаев 1 Н-таутомер будет склонен составлять преобладающую форму. Когда R6 представляет собой R6A, два региоизомера соединений формулы (I) можно различить. В одном, предпочтительном, воплощении изобретения R6A расположен на N1 с образованием соединений формулы (IA) В альтернативном воплощении изобретения R6A расположен на N2 с образованием соединений формулы (IB) Предпочтительно R6A представляет собой C1-С 6 алкил или С 1-С 6 галогеноалкил, каждый из которых возможно замещен С 1-С 6 алкокси, С 1-С 6 галогеноалкокси, (C3-С 6 циклоалкил)C1-С 6 алкокси или циклической группой, выбранной из RJ, RL и RM, либо R6A представляет собой RN;RL и RN, каждый независимо, представляет собой моноциклическую насыщенную или частично ненасыщенную кольцевую систему, содержащую от 4 до 7 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы, иRM представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее вплоть до трех гетероатомов, независимо выбранных из азота, кислорода и серы. Более предпочтительно R6A представляет собой C1-С 4 алкил или С 1-С 4 галогеноалкил, каждый из которых возможно замещен C1-С 4 алкокси, С 1-С 4 галогеноалкокси, (С 3-С 6 циклоалкил)C1-С 4 алкокси или циклической группой, выбранной из RJ, RL и RM, либо R6A представляет собой RN;RJ представляет собой циклопропил или циклобутил;RL и RN, каждый независимо, представляет собой моноциклическую насыщенную кольцевую систему, содержащую 5 или 6 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы, иRM представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее гетероатом, выбранный из азота, кислорода и серы. Более предпочтительно R6A представляет собой C1-С 4 алкил или С 1-С 4 галогеноалкил, каждый из которых возможно замещен C1-С 4 алкокси, С 1-С 4 галогеноалкокси, (C3-С 6 циклоалкил)метокси или циклической группой, выбранной из RJ, RL и RM, либо R6A представляет собой RN;RJ представляет собой циклопропил или циклобутил;RL и RN, каждый независимо, представляет собой моноциклическую насыщенную кольцевую систему, содержащую 5 или 6 кольцевых атомов, содержащую один гетероатом, выбранный из азота, кислорода и серы, иRM представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее один атом азота. Более предпочтительно R6A представляет собой C1-С 4 алкил или С 1-С 4 галогеноалкил, каждый из которых возможно замещен C1-С 4 алкокси, C1-С 4 галогеноалкокси, (С 3-С 6 циклоалкил)метокси, циклопропилом, циклобутилом, тетрагидрофуранилом, тетрагидропиранилом или пиридинилом, либо R6A представляет собой тетрагидропиранил. Наиболее предпочтительно R6A представляет собой метил, этил, изопропил, изобутил, метоксиэтил,метоксипропил, этоксиэтил, этоксипропил, н-пропоксиэтил, изопропоксиэтил, 2,2,2-трифторэтил, 2,2,2 трифторэтоксиэтил, тетрагидрофуранилметил, тетрагидропиранилметил, тетрагидропиранил или пиридинилметил. Особенно предпочтительным воплощением является соединение формулы (I), где R6 представляет собой R6A, присоединенный по N1-положению, и R6A представляет собой 2-(2,2,2-трифторэтокси)этил. Предпочтительными воплощениями соединений формулы (I) являются те, которые включают два или более чем два из вышеописанных предпочтительных воплощений. Особенно предпочтительным воплощением является соединение формулы (I), где R1 представляет-6 008596 собой циклическую группу, выбранную из RA, RB, RC и RD, каждый из которых возможно замещен одной или более чем одной группой R7;R2 представляет собой водород или C1-С 2 алкил;R3 представляет собой водород, C1-С 4 алкил, который возможно замещен одной или более чем одной группой R8, либо RE, который возможно замещен одной или более чем одной группой R9;R4 представляет собой водород, C1-С 6 алкил или C1-С 6 галогеноалкил; либо -NR3R4 образует RF, который возможно замещен одной или более чем одной группой R10;R5 представляет собой C1-С 6 алкил, C1-С 6 галогеноалкил, C2-С 6 алкенил, С 2-С 6 алкинил или С 3-С 7 циклоалкил, каждый из которых возможно замещен одной или более чем одной группой, выбранной из гидрокси, C1-С 6 алкокси, C1-С 6 галогеноалкокси, С 3-С 7 циклоалкил и С 3-С 7 циклоалкокси, либо водород;R6A представляет собой C1-С 4 алкил или C1-С 4 галогеноалкил, каждый из которых возможно замещенC1-С 4 алкокси, C1-С 4 галогеноалкокси или циклической группой, выбранной из RJ, RL и RM, либо R6A представляет собой RN ;NR C(O)R13, NR12CO2R14, C(O)R12, CO2R12, CONR12R13, CN, RG или RH, последние два из которых возможно замещены одной или более чем одной группой R9;R10 представляет собой галогено, С 3-С 10 циклоалкил, С 3-С 10 галогеноциклоалкил, фенил, OR12,OC(O)R12, NO2, NR12R13, NR12C(O)R13, NR12CO2R14, C(O)R12, CO2R13, CONR12R13, CN, оксо, C1-С 6 алкил или C1-С 6 галогеноалкил, последние два из которых возможно замещены R11;RA представляет собой моноциклическую С 3-С 8 циклоалкильную группу;RС представляем собой моноциклическую насыщенную или частично ненасыщенную кольцевую систему, содержащую от 3 до 8 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы;RD представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее вплоть до трех гетероатомов, независимо выбранных из азота, кислорода и серы;RE представляет собой моноциклическую насыщенную кольцевую систему, содержащую от 3 до 7 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы;RF и RG, каждый независимо, представляет собой моноциклическую или, когда имеется соответствующее число кольцевых атомов, полициклическую насыщенную кольцевую систему, содержащую от 3 до 10 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы;RH представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее вплоть до трех гетероатомов, независимо выбранных из азота, кислорода и серы;RJ представляет собой циклопропил или циклобутил;RL и RN, каждый независимо, представляет собой моноциклическую насыщенную кольцевую систему, содержащую либо 5, либо 6 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы, иRM представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее гетероатом, выбранный из азота, кислорода и серы. Более предпочтительно R1 представляет собой циклическую группу, выбранную из RA, RB, RС и RD,каждый из которых возможно замещен одной или более чем одной группой R7;R2 представляет собой водород или C1-С 2 алкил;R3 представляет собой водород, C1-С 4 алкил, который возможно замещен одной или более чем одной группой R8, либо RE, который возможно замещен одной или более чем одной группой R9;R4 представляет собой водород, C1-С 6 алкил или C1-С 6 галогеноалкил; либо -NR3R4 образует RF, который возможно замещен одной или более чем одной группой R10;R5 представляет собой C1-С 4 алкил или C1-С 4 галогеноалкил, каждый из которых возможно замещен гидрокси, C1-С 4 алкокси или C1-С 4 галогеноалкокси;R6A представляет собой C1-С 4 алкил или C1-С 4 галогеноалкил, каждый из которых возможно замещенC1-С 4 алкокси, C1-С 4 галогеноалкокси или циклической группой, выбранной из RJ, RL и RM, либо R6A представляет собой RN ;R8 представляет собой галогено, фенил, C1-С 6 алкоксифенил, OR12, NR12R13, NR12CO2R14, CO2R12,CONR12R13, RG или RH, последние два из которых возможно замещены одной или более чем одной группой R9;R10 представляет собой галогено, С 3-С 10 циклоалкил, С 3-С 10 галогеноциклоалкил, фенил, OR12,OC(O)R12, NO2, NR12R13, NR12C(O)R13, NR12CO2R14, C(O)R12, CO2R13, CONR12R13, CN, оксо, С 1-С 6 алкил или С 1-С 6 галогеноалкил, последние два из которых возможно замещены R11;R12 и R13 каждый независимо представляет собой водород, С 1-С 6 алкил или С 1-С 6 галогеноалкил;RA представляет собой моноциклическую С 5-С 7 циклоалкильную группу;RC представляет собой моноциклическую насыщенную кольцевую систему, содержащую от 5 до 7 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы;RD представляет собой 5-членное гетероароматическое кольцо, содержащее гетероатом, выбранный из азота, кислорода и серы, и возможно вплоть до двух дополнительных атомов азота в кольце, или 6 членное гетероароматическое кольцо, включающее 1, 2 или 3 атома азота;RE представляет собой моноциклическую насыщенную кольцевую систему, содержащую от 3 до 7 кольцевых атомов, содержащую один атом азота;RF представляет собой моноциклическую или, когда имеется соответствующее число кольцевых атомов, полициклическую насыщенную кольцевую систему, содержащую от 3 до 10 кольцевых атомов,содержащую по меньшей мере один атом азота и возможно один другой атом, выбранный из кислорода и серы;RG представляет собой моноциклическую насыщенную кольцевую систему, содержащую от 3 до 7 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы;RH представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее вплоть до двух атомов азота;RL и RN, каждый независимо, представляет собой моноциклическую насыщенную кольцевую систему, содержащую либо 5, либо 6 кольцевых атомов, по меньшей мере один из которых представляет собой гетероатом, выбранный из азота, кислорода и серы, иRM представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее гетероатом, выбранный из азота, кислорода и серы. Наиболее предпочтительными соединениями являются: 1-(2-этоксиэтил)-3-метил-5-[(3R)-3-метилпиперазин-1-ил]-N-пиримидин-4-ил-1 Н-пиразоло[4,3-d] пиримидин-7-амин; 1-(2-этоксиэтил)-3-этил-5-[(3R)-3-метилпиперазин-1-ил]-N-пиримидин-4-ил-1 Н-пиразоло[4,3-d]пиримидин-7-амин; 1-(2-этоксиэтил)-3-этил-N5-метил-N5-(1-метилпиперидин-4-ил)-N7-пиримидин-4-ил-1 Н-пиразоло[4,3-d]пиримидин-7-ил-4-метилпиридин-2-иламин; 1-3-этил-7-(6-метилпиримидин-4-иламино)-1-[2-(2,2,2-трифторэтокси)этил]-1 Н-пиразоло[4,3-d] пиримидин-5-илпиперидин-4-карбоновая кислота и 3,N5-диметил-N5-(1-метилпиперидин-4-ил)-N7-(6-метилпиримидин-4-ил)-1-[2-(2,2,2-трифторэтокси) этил]-1 Н-пиразоло[4,3-d]пиримидин-5,7-диамин,а также их таутомеры и фармацевтически приемлемые соли, сольваты и полиморфы указанного соединения или таутомера. Фармацевтически приемлемые соли соединений формулы (I) включают их соли присоединения кислоты и основания (включая дисоли). Пригодные соли присоединения кислоты получают из кислот, которые образуют нетоксичные соли. Примеры включают соли ацетат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат, камсилат,цитрат, эдисилат, эсилат, фумарат, глуцептат, глюконат, глюкуронат, гибензат, гидрохлорид/хлорид,гидробромид/бромид, гидройодид/йодид, гидрофосфат, изетионат, D- и L-лактат, малат, малеат, малонат,мезилат, метилсульфат, 2-напсилат, никотинат, нитрат, оротат, памоат, фосфат, сахарат, стеарат, сукцинат, сульфат, D- и L-тартрат и тозилат. Пригодные соли присоединения основания получают из оснований, которые образуют нетоксичные соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. Обзор пригодных солей см. в Stahl and Wermuth, Handbook of Pharmaceutical Salts: Properties, Selection and Use, Wiley-VCH, Weinheim, Germany (2002). Фармацевтически приемлемую соль соединения формулы (I) можно легко получить путем смешивания вместе растворов соединения формулы (I) и желаемой кислоты или основания, как подходит. Соль можно осадить из раствора и собрать фильтрованием, либо ее можно выделить путем выпаривания растворителя. Фармацевтически приемлемые сольваты в соответствии с изобретением включают гидраты и сольваты, где растворитель кристаллизации может быть замещенным изотопом, например, D2O, ацетон-d6,ДMCO-d6.-9 008596 В пределах объема изобретения также находятся клатраты, комплексы включения лекарствоноситель, где, в противоположность вышеупомянутым сольватам, лекарство и носитель присутствуют в нестехиометрических количествах. Обзор таких комплексов смотри в статье Haleblian, J. Pharm. Sci., 64(8), 1269-1288 (August 1975). Здесь далее все ссылки на соединения формулы (I) включают ссылки на их соли и на сольваты и клатраты соединений формулы (I) и их солей. В изобретение включены все полиморфы соединений формулы (I), как определено здесь выше. В объем изобретения также включены так называемые пролекарства соединений формулы (I). Таким образом, некоторые производные соединений формулы (I), которые не обладают или обладают слабой фармакологической активностью сами по себе, могут при метаболизме после введения в организм или на организм, образовывать соединения формулы (I), обладающие желаемой активностью. Такие производные называют пролекарствами. Пролекарства в соответствии с изобретением могут быть получены, например, путем замещения соответствующих функциональных групп, присутствующих в соединениях формулы (I), определенными группировками, известными специалистам в данной области техники как прогруппировки, как описано, например, в Design of Prodrugs by H. Bundgaard (Elsevier, 1985). Наконец, некоторые соединения формулы (I) могут сами действовать в качестве пролекарств других соединений формулы (I). Соединения формулы (I), содержащие один или более чем один асимметрический атом углерода,могут существовать в виде двух или более чем двух оптических изомеров. Где соединение формулы (I) содержит группу алкенил или алкенилен, возможны геометрические цис/транс (или Z/E) изомеры, и где соединение формулы (I) содержит, например, группу кето или оксим, может встречаться таутомерная изомерия (таутомерия). Из этого следует, что одно соединение может проявлять более чем один тип изомерии. В объем настоящего изобретения включены все оптические изомеры, геометрические изомеры и таутомерные формы соединений формулы (I), включая соединения, проявляющие более чем один тип изомерии, и смеси одного или более чем одного из них. Цис/транс изомеры можно разделить с помощью общепринятых методик, хорошо известных специалистам в данной области техники, например, фракционной кристаллизацией и хроматографией. Общепринятые методики получения/выделения индивидуальных стереоизомеров включают превращение подходящего оптически чистого предшественника, разделение рацемата (или рацемата соли или производного), используя, например, хиральную ВЭЖХ или фракционную кристаллизацию диастереоизомерных солей, образованных путем взаимодействия рацемата с подходящими оптически активными кислотой или основанием, например, с винной кислотой. В настоящее изобретение также включены все фармацевтически приемлемые изотопные варианты соединения формулы (I). Изотопный вариант определяют как такой, где по меньшей мере атом заменен атомом, имеющим тот же атомный номер, но атомную массу, отличную от атомной массы, обычно обнаруживаемой в природе. Примеры изотопов, пригодных для включения в соединения по изобретению, включают изотопы водорода, такие как 2 Н и 3 Н, углерода, такие как 13 С и 14 С, азота, такой как 15N, кислорода, такие как 17 О и 18 О, фосфора, такой как 32 Р, серы, такой как 35S, фтора, такой как 18F, и хлора, такой как 35Cl. Замещение соединений по изобретению изотопами, такими как дейтерий, то есть 2 Н, может дать определенные терапевтические преимущества в результате более высокой метаболической стабильности, например, увеличенный период полураспада in vivo или пониженные потребности дозировки, и, следовательно, может быть предпочтительно при некоторых обстоятельствах. Некоторые изотопные варианты соединений формулы (I), например, те, в которые включен радиоактивный изотоп, полезны в анализах тканевого распределения лекарства и/или субстрата. Радиоактивные изотопы тритий, то есть 3 Н, и углерод-14, то есть 14 С, особенно полезны для этой цели по причине легкости их введения и простым способам их обнаружения. Изотопные варианты соединений формулы (I) в целом могут быть получены с помощью общепринятых методик, известных специалистам в данной области техники, или способами, аналогичными описанным в сопроводительных примерах и примерах получения, используя соответствующие изотопные варианты подходящих реагентов. Соединения формулы (I) можно подвергать сублимационной сушке, распылительной сушке или испарительной сушке с получением твердой массы, порошка или пленки кристаллического или аморфного вещества. Для этой цели можно использовать микроволновую или радиочастотную сушку. Соединения формулы (I) являются ингибиторами PDE-5. Соответственно, в следующем аспекте настоящего изобретения предложено применение соединения формулы (I) или его таутомера, соли или сольвата в качестве лекарственного средства и, в частности, в качестве лекарства для лечения заболевания или состояния, при котором известно или может быть показано, что ингибирование PDE-5 оказывает полезный эффект. Термин лечение включает паллиативное, терапевтическое или профилактическое лечение.- 10008596 Заболевания или состояния, подходящее для лечения соединениями по изобретению, включают гипертензию (включая гипертоническую болезнь, легочную гипертензию, вторичную гипертензию, изолированную систолическую гипертензию, гипертензию, связанную с диабетом, гипертензию, связанную с атеросклерозом, и почечно-сосудистую гипертензию), застойную сердечную недостаточность, стенокардию (включая стабильную, нестабильную и вариантную (Принцметала) стенокардию), удар, коронарную артериальную болезнь, застойную сердечную недостаточность, состояния, связанные с пониженной проходимостью кровеносных сосудов (такие как после чрескожной пластической операции на коронарных сосудах), периферическое сосудистое заболевание, атеросклероз, индуцированную нитратами толерантность, толерантность к нитратам, диабет, нарушенную толерантность к глюкозе, метаболический синдром, ожирение, половую дисфункцию (включая мужское эректильное расстройство, импотенцию, расстройство полового возбуждения женщин, литоральную дисфункцию, гипоактивное расстройство полового желания у женщин, болевое половое расстройство женщин, половую дисфункцию оргазма женщин и половую дисфункцию вследствие повреждения спинного мозга), преждевременные роды, преэклампсию, дисменорею, синдром поликистоза яичников, доброкачественную гиперплазию простаты, синдром инфравезикальной обструкции, недержание мочи, хроническую обструктивную болезнь легких,острую дыхательную недостаточность, бронхит, хроническую астму, аллергическую астму, аллергический ринит, расстройства перистальтики кишечника (включая синдром раздраженной кишки), синдром Кавасаки, рассеянный склероз, болезнь Альцгеймера, псориаз, некроз кожи, рубцевание, фиброз, боль (в частности, невропатическая боль), рак, метастаз, облысение, щелкающий пищевод, анальную трещину и геморрой. В следующем аспекте в настоящем изобретении предложено применение соединения формулы (I) или его таутомера, соли или сольвата для производства лекарства для лечения заболевания или состояния, при котором известно или может быть показано, что ингибирование PDE-5 оказывает полезный эффект, и, в частности, заболеваний и состояний, перечисленных в предыдущем параграфе. В предпочтительном воплощении заболевание или состояние представляет собой гипертензию. Более предпочтительно оно представляет собой гипертоническую болезнь, легочную гипертензию, вторичную гипертензию, изолированную систолическую гипертензию, гипертензию, связанную с диабетом,гипертензию, связанную с атеросклерозом, или почечно-сосудистую гипертензию. В следующем предпочтительном воплощении заболевание или состояние представляет собой диабет. В следующем аспекте в настоящем изобретении предложен способ лечения расстройства или состояния у млекопитающего, при котором известно или может быть показано, что ингибирование PDE-5 оказывает полезный эффект, при котором указанному млекопитающему вводят терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или полиморфа. В предпочтительном воплощении заболевание или состояние представляет собой гипертензию. Более предпочтительно оно представляет собой гипертоническую болезнь, легочную гипертензию, вторичную гипертензию, изолированную систолическую гипертензию, гипертензию, связанную с диабетом,гипертензию, связанную с атеросклерозом, или почечно-сосудистую гипертензию. В следующем предпочтительном воплощении заболевание или состояние представляет собой диабет. Соединения по настоящему изобретению можно применять одни или в комбинации с другими терапевтическими агентами. При использовании в комбинации с другим терапевтическим агентом введение двух агентов может быть одновременным или последовательным. Одновременное введение включает введение одной лекарственной формы, которая содержит оба агента, и введение двух агентов в отдельных лекарственных формах по существу в одно и то же время. Последовательное введение включает введение двух агентов в соответствии с различными режимами при условии, что существует перекрывание периодов, во время которых происходит лечение. Подходящие агенты, с которыми можно вводить совместно соединения формулы (I), включают аспирин, антагонисты рецептора ангиотензина II (такие как лосартан, кандесартан, телмисартан, валсартан, ирбесартан и эпросартан), блокаторы кальциевых каналов (такие как амлодипин), бета-блокаторы (то есть антагонисты бета-адренергических рецепторов,такие как соталол, пропранслол, тимолол, атенолол, карведилол и метопролол), Сl1027, антагонисты рецепторов CCR5, имидазолины, растворимые активаторы гуанилатциклазы, диуретики (такие как гидрохлортиазид, торсемид, хлортиазид, хлорталидон и амилорид), альфа-адренергические антагонисты (такие как доксазозин), ингибиторы АПФ (ангиотензинпревращающего фермента) (такие как хинаприл, эналаприл, рамиприл и лизиноприл), антагонисты рецепторов альдостерона (такие как эплеренон и спиронолактон), ингибиторы нейтральных эндопептидаз, противодиабетические агенты (такие как инсулин,сульфонилмочевины (такие как глибурид, глипизид и глимепирид), глитазоны (такие как розиглитазон и пиоглитазон) и метформин), агенты, снижающие уровень холестерина (такие как аторвастатин, правастатин, ловастатин, симвастатин, клофибрат и розувастатин) и альфа-2-дельта-лиганды (такие как габапентин, прегабалин, [(1R,5R,6S)-6-(аминометил)бицикло[3.2.0]гепт-6-ил]уксусная кислота, 3-(1-(аминометил)циклогексилметил)-4H-[1,2,4]оксадиазол-5-он,С-[1-(1H-тетразол-5-илметил)циклогептил]мети- 11008596 ламин, (3S,4S)-(1-аминометил-3,4-диметилциклопентил)уксусная кислота, (1,3,5)-(3-(аминометил) бицикло[3.2.0]гепт-3-ил)уксусная кислота, (3S,5R)-3-аминометил-5-метилоктановая кислота, (3S,5R)-3 амино-5-метилгептановая кислота, (3S,5R)-3-амино-5-метилнонановая кислота и (3S,5R)-3-амино-5 метилоктановая кислота). В следующем аспекте в настоящем изобретении предложена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль, сольват или полиморф и второй фармацевтически активный агент, выбранный из перечисленных в предыдущем параграфе. Соединения по настоящему изобретению можно вводить одни или в комбинации с другими лекарствами и, как правило, их будут вводить в виде препарата в сочетании с одним или более чем одним фармацевтически приемлемым эксципиентом. Термин эксципиент используют здесь для описания любого ингредиента, иного чем соединение по изобретению. Выбор эксципиента будет в значительной степени зависеть от конкретного пути введения. Соединения по настоящему изобретению можно вводить перорально. Пероральное введение может включать глотание, так что соединение поступает в желудочно-кишечный тракт, либо можно использовать трансбуккальное или подъязычное введение, посредством которого соединение поступает в кровоток непосредственно изо рта. Препараты, подходящие для перорального введения, включают твердые препараты, такие как таблетки, капсулы, содержащие частицы, жидкости или порошки, лепешки (включая заполненные жидкостью), жевательные резинки, мульти- и наночастицы, гели, пленки (включая мукоадгезивные), овулы,спреи и жидкие препараты. Жидкие препараты включают суспензии, растворы, сиропы и эликсиры. Такие препараты могут применяться в качестве наполнителей в мягких или твердых капсулах и типично содержат носитель, например, воду, этанол, пропиленгликоль, метилцеллюлозу или подходящее масло, и один или более чем один эмульгирующий агент и/или суспендирующий агент. Жидкие препараты можно также готовить путем восстановления твердого вещества, например, из пакетика. Соединения по изобретению можно также применять в быстрорастворимых, быстро разрыхляемых лекарственных формах, таких как описаны в статье Liang and Chen (2001) Expert Opinion in TherapeuticPatents, 11 (6), 981-986. Состав типичной таблетки в соответствии с изобретением может включать: Количество регулируют в соответствии с активностью лекарства. Типичную таблетку можно изготовить, используя стандартные способы, известные специалисту в области изготовления препаратов, например, путем прямого прессования, грануляции (сухой, влажной или расплава), сгущения расплава или экструзии. Препарат в виде таблетки может содержать один или более чем один слой и может быть покрытым оболочкой или непокрытым. Примеры эксципиентов, пригодных для перорального введения, включают носители, например целлюлозу, карбонат кальция, двухосновный фосфат кальция, маннит и цитрат натрия, связующие агенты грануляции, например поливинилпирролидон, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу и желатин, разрыхлители, например крахмал гликолят натрия и силикаты, смазывающие агенты,например стеарат магния и стеариновую кислоту, увлажняющие агенты, например лаурилсульфат натрия, консерванты, антиоксиданты, корригенты и красители. Твердые препараты для перорального введения можно готовить как препараты немедленного и/или модифицированного высвобождения. Препараты модифицированного высвобождения включают препараты замедленного, пролонгированного, импульсного, двойной регуляции, направленного или программированного высвобождения. Подробное описание пригодных технологий модифицированного высвобождения, таких как дисперсии высокой энергии, осмотические и покрытые оболочкой частицы, можно найти в статье Verma et al., Pharmaceutical Technology On-line, 25(2), 1-14 (2001). Другие препараты модифицированного высвобождения описаны в патенте США 6106864. Соединения по изобретению можно также вводить непосредственно в кровоток, в мышцу или во внутренний орган. Пригодные способы парентерального введения включают внутривенное, внутриартериальное, внутрибрюшинное, подоболочечное, внутрижелудочковое, интрауретральное, внутригрудинное, внутричерепное, внутримышечное и подкожное. Подходящие устройства для парентерального введения включают игольные (включая микроигольные) шприцы, безыгольные шприцы и инфузионные методики.- 12008596 Парентеральные препараты типично представляют собой водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и забуферивающие агенты (предпочтительно до рН от 3 до 9), но для некоторых применений их препараты более удобно готовить в виде стерильного неводного раствора или в виде высушенной формы, которую применяют в сочетании с подходящим носителем, таким как стерильная апирогенная вода. Изготовление парентеральных препаратов в стерильных условиях, например, путем лиофилизации,можно легко осуществить, используя стандартные фармацевтические методики, хорошо известные специалистам в данной области техники. Растворимость соединений формулы (I), используемых при изготовлении парентеральных растворов, можно повысить путем подходящей обработки, например, использования дисперсий высокой энергии, высушенных распылительной сушкой (см. WO 01/47495), и/или путем использования соответствующих методик изготовления препаратов, таких как использование агентов, улучшающих растворимость. Препараты для парентерального введения можно готовить как препараты немедленного и/или модифицированного высвобождения. Препараты модифицированного высвобождения включают препараты замедленного, пролонгированного, импульсного, двойной регуляции, направленного или программированного высвобождения. Соединения по настоящему изобретению можно также вводить местным путем на кожу или слизистую оболочку, либо дермальным, либо трансдермальным путем. Типичные препараты для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пенки, пленки, кожные пластыри, облатки, имплантаты, губки, волокна, бандажи и микроэмульсии. Можно также использовать липосомы. Типичные носители включают спирт, воду, минеральное масло, жидкий вазелин, белый вазелин, глицерин и пропиленгликоль. Можно включать усилители проницаемости, см., например, Finnin andMorgan, J Pharm Sci, 88 (10), 955-958 (October 1999). Другие способы местного введения включают доставку путем электрофореза, электропорации, фонофореза, сонофореза и безыгольную или микроигольную инъекцию. Препараты для местного введения можно готовить как препараты немедленного и/или модифицированного высвобождения. Препараты модифицированного высвобождения включают препараты замедленного, пролонгированного, импульсного, двойной регуляции, направленного или программированного высвобождения. Таким образом, препараты соединений по изобретению можно готовить в более твердой форме для введения в виде имплантированного депо, обеспечивающего длительное высвобождение активного соединения. Соединения по изобретению можно также вводить интраназально или путем ингаляции, типично в форме сухого порошка (либо одно, либо в виде смеси, например, в сухой смеси с лактозой или в виде смешанного компонента частиц, например, смешанного с фосфолипидами) из ингалятора сухого порошка, либо в виде аэрозольного спрея из герметичного контейнера под давлением, насоса, распылителя,установки для тончайшего измельчения (предпочтительно установки для тончайшего измельчения с использованием электрогидродинамики для получения тонкого тумана) или небулайзера с использованием или без использования подходящего пропеллента, такого как дихлорфторметан. Герметичный контейнер под давлением, насос, распылитель, установка для тончайшего измельчения или небулайзер содержит раствор или суспензию активного соединения, содержащую, например,этанол (возможно водный этанол) или подходящий альтернативный агент для диспергирования, солюбилизации или пролонгированного высвобождения активного вещества, пропеллент(ы) в качестве растворителя и возможный сурфактант, такой как триолеат сорбитана или олигомолочная кислота. Перед использованием в препарате в виде сухого порошка или суспензии лекарственный продукт измельчают до размера, пригодного для доставки путем ингаляции (типично менее чем 5 микрон). Этого можно достичь соответствующим способом измельчения, таким как размалывание в спиральной струйной мельнице, размалывание псевдоожиженного слоя в струйной мельнице, сверхкритическая жидкостная обработка с образованием наночастиц, гомогенизация высокого давления или распылительная сушка. Подходящий препарат в виде раствора для использования в установке для тончайшего измельчения с использованием электрогидродинамики для получения тонкого тумана содержит от 1 мкг до 10 мг соединения по изобретению на приведение в действие, и объем действия может варьировать от 1 до 100 мкл. Типичный препарат может содержать соединение формулы (I), пропиленгликоль, стерильную воду,этанол и хлорид натрия. Альтернативные растворители, которые можно использовать вместо пропиленгликоля, включают глицерин и полиэтиленгликоль. Препараты в виде капсул, блистеров и картриджей (изготовленных, например, из желатина или ГПМЦ) для применения в ингаляторе или инсуффляторе можно готовить таким образом, что они содержат порошкообразную смесь соединения по изобретению, подходящую порошкообразную основу, такую как лактоза или крахмал, и модификатор качества, такой как изолейцин, маннит или стеарат магния. В случае ингаляторов сухих порошков и аэрозолей стандартная доза определяется с помощью кла- 13008596 пана, который доставляет отмеренное количество. Устройства в соответствии с изобретением типично изготовлены таким образом, чтобы вводить отмеренную дозу или вдох, содержащий от 1 мкг до 20 мг соединения формулы (I). Суммарная суточная доза будет типично находиться в интервале от 1 мкг до 80 мг, которую можно вводить в однократной дозе или более обычно в разделенных дозах в течение суток. Препараты для ингаляционного/интраназального введения можно готовить как препараты немедленного и/или модифицированного высвобождения. Препараты модифицированного высвобождения включают препараты замедленного, пролонгированного, импульсного, двойной регуляции, направленного или программированного высвобождения. Соединения по изобретению можно вводить ректально или вагинально, например, в форме суппозитория, пессария или клизмы. Масло какао является традиционной основой суппозиториев, но, если пригодно, можно использовать различные альтернативы. Препараты для ректального/вагинального введения можно готовить как препараты немедленного и/или модифицированного высвобождения. Препараты модифицированного высвобождения включают препараты замедленного, пролонгированного,импульсного, двойной регуляции, направленного или программированного высвобождения. Соединения по изобретению можно также вводить непосредственно в глаз или в ухо, типично в форме капель тонко измельченной суспензии или раствора в изотоническом стерильном физиологическом растворе с отрегулированным рН. Другие препараты, пригодные для глазного и ушного введения,включают мази, биологически распадающиеся (например адсорбируемые гелеобразные губки, коллаген) и не распадающиеся биологически (например, силиконовые) имплантаты, облатки, линзы и содержащие частицы или везикулярные системы, такие как ниосомы или липосомы. Полимер, такой как поперечно сшитая акриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, либо гетерополисахаридный полимер, например, гелановая смола, можно включать вместе с консервантом, таким как бензалкония хлорид. Такие препараты можно также доставлять с помощью электрофореза. Препараты для глазного/ушного введения можно готовить как препараты немедленного и/или модифицированного высвобождения. Препараты модифицированного высвобождения включают препараты замедленного, пролонгированного, импульсного, двойной регуляции, направленного или программированного высвобождения. Соединения по изобретению можно комбинировать с растворимыми макромолекулярными частицами, такими как циклодекстрин или полиэтиленгликоль-содержащие полимеры, для улучшения их растворимости, скорости растворения, маскировки вкуса, биодоступности и/или стабильности. Например, обнаружено, что комплексы лекарство-циклодекстрин, как правило, полезны для большинства лекарственных форм и путей введения. Можно использовать как комплексы включения, так и комплексы не-включения. В качестве альтернативы прямому комплексообразованию циклодекстрин можно использовать в качестве вспомогательной добавки, то есть в качестве носителя, разбавителя или солюбилизирующего агента. Наиболее распространенно используют для таких целей альфа-, бета- и гамма-циклодекстрины, примеры которых можно найти в Международных патентных заявкахWO 91/11172, WO 94/02518 и WO 98/55148. Для введения пациентам-людям суммарная суточная доза соединений по изобретению типично находится в интервале от 0,1 до 500 мг в зависимости, конечно, от режима введения. Например, пероральное введение может потребовать суммарной суточной дозы от 0,1 до 500 мг, тогда как внутривенная доза может потребовать только от 0,01 до 50 мг. Суммарную суточную дозу можно вводить в однократной дозе или в разделенных дозах. Эти дозировки рассчитаны на основании среднего человеческого субъекта, имеющего массу тела от примерно 65 до 70 кг. Врач сможет легко определить дозы для субъектов, чья масса не попадает в этот интервал, таких как дети и пожилые люди. Соединения по изобретению могут быть получены, как известно, с помощью ряда путей. В приведенных ниже схемах реакций и здесь далее, если не указано иное, R1-R6 являются такими, как определено в первом аспекте. Эти способы образуют следующие аспекты изобретения. 1. На схеме 1 суммирован синтетический путь, который применим к синтезу соединений формулы(I) и, в частности, для тех соединений формулы (I), где R5 представляет собой водород, либо незамещенный алкил или циклоалкил. Исходные вещества представляют собой пиразолокарбоновые кислоты формулы (II). Некоторые соединения формулы (II) имеются в продаже, а другие известны из литературы. Где они не являются известными, они могут быть получены одним или более чем одним способом, которые доступны из уровня техники, такие как обсуждаются ниже в разделе 2. Стадия (а). Карбоновую кислоту формулы (II) превращают в соответствующий амид формулы (III) либо непосредственно, либо, предпочтительно, через промежуточное соединение хлорангидрид. Прямое превращение может быть достигнуто путем обработки раствора кислоты избытком аммиака в присутствии агента сочетания, такого как карбодиимид (например, дициклогексилкарбодиимид или 1-(3-диметиламинопропил)-3-этилкарбодиимид) и возможно гидрокситриазола, такого как НОВТ или НОАТ. Подходящие растворители включают дихлорметан и этилацетат. Непрямое превращение может быть достигнуто путем образования хлорангидрида обработкой оксалилхлоридом и N,N-диметилформамидом в подходящем растворителе, таком как дихлорметан, либо тионилхлоридом. Затем раствор хлорангидрида в подходящем растворителе, таком как дихлорметан, тетрагидрофуран или диоксан, обрабатывают газообразным аммиаком или водным аммиаком с получением амида формулы (III). Предпочтительно раствор кислоты формулы (II) в дихлорметане обрабатывают при комнатной температуре оксалилхлоридом и каталитическим количеством N,N-диметилформамида в течение 2 ч. Затем эту смесь охлаждают до -20 С, добавляют избыток аммиака, и смесь перемешивают в течение 2 ч при температуре между -20 С и комнатной температурой. Стадия (b). Когда R6 представляет собой R6A, эту группу можно ввести на стадии N-алкилирования. Соединение формулы (III) можно обработать основанием, таким как карбонат или бикарбонат щелочного металла, например, карбонат калия или карбонат цезия, либо третичный амин, например, триэтиламин, Nэтилдиизопропиламин или пиридин, и соответствующим хлоридом (R6A-Cl), бромидом (R6A-Br), йодидом(R6A-I), мезилатом (R6A-OSO2CH3) или тозилатом (R6A-OSO2Tol) в подходящем растворителе при температуре между -20 С и 100 С. Подходящие растворители включают эфиры, такие как тетрагидрофуран и диоксан, низшие спирты, такие как метанол, этанол и бутанол, кетоны, такие как ацетон и 2-бутанон, Nметилпирролидинон, N,N-диметилформамид и ацетонитрил. Альтернативно в качестве основания можно использовать гидроксид щелочного металла, такой как гидроксид натрия или гидроксид калия. Тогда подходящие растворители включают воду и смеси воды и смешиваемых с водой органических растворителей. Альтернативно в качестве основания можно использовать (С 1-С 4)алкоксид щелочного металла, такой как метоксид натрия или трет-бутоксид калия. Тогда подходящие растворители включают соответствующие низшие спирты (то есть метанол для метоксида натрия), эфиры, такие как тетрагидрофуран и- 15008596 диоксан, N-метилпирролидинон, N,N-диметилформамид и ацетонитрил. Можно также использовать более сильные основания, такие как гидрид натрия и гексаметилсилазид натрия или калия. Тогда подходящие растворители включают эфиры, такие как тетрагидрофуран и диоксан, N-метилпирролидинон и N,N-диметилформамид. Эту реакцию можно также проводить в условиях фазового перехода, используя водный гидроксид натрия или калия в качестве основания, дихлорметан или хлороформ в качестве органического растворителя и хлорид или гидроксид тетраалкиламмония в качестве катализатора фазового переноса. Альтернативно этого превращения можно достичь, используя реакцию Мицунобу (Organic Reactions 1992, 42), при которой раствор соединения формулы (III) и соответствующий спирт R6A-OH в подходящем растворителе обрабатывают трифенилфосфином и диалкилазодикарбоксилатом, таким как диэтилазодикарбоксилат или диизопропилазодикарбоксилат. Подходящие растворители включают тетрагидрофуран и диоксан. Эту реакцию предпочтительно проводят при температуре между -10 С и температурой окружающей среды. Предпочтительно соединения формулы (III) обрабатывают либо 1 эквивалентом R6A-Br и 1 эквивалентом карбоната калия в N,N-диметилформамиде при комнатной температуре в течение 18 ч, либо 1,2 эквивалента R6A-OH, 1,4 эквивалента диизопропилазодикарбоксилата и 1,4 эквивалента трифенилфосфина в тетрагидрофуране при температуре между 0 и 25 С в течение 2 ч. В зависимости от точного выбора реагентов и условий эта реакция может дать N1- или N2 алкилированный продукт или смесь этих двух продуктов. Если получена смесь, тогда индивидуальные компоненты можно разделить, используя общепринятые способы, такие как хроматография или фракционная кристаллизация. Стадия (с). Восстановление нитрогруппы соединений формулы (IV) с получением аминов формулы (V) может быть достигнуто путем, например, переносной или каталитической гидрогенизации, либо путем восстановления растворением металла. Для переносной гидрогенизации нитросоединение подвергают взаимодействию с подходящим донором водорода, таким как формиат аммония или циклогексен, в полярном растворителе, таком как тетрагидрофуран, метанол или этанол, в присутствии катализатора, представляющего собой переходный металл или соль переходного металла, такого как палладий или гидроксид палладия(II), возможно при повышенных значениях температуры и давления. Для каталитической гидрогенизации раствор нитросоединения в полярном растворителе, таком как тетрагидрофуран, метанол или этанол, перемешивают в атмосфере водорода в присутствии катализатора,представляющего собой переходный металл или соль переходного металла, такого как палладий или никель Ренея, возможно при повышенном давлении. Катализатор может находиться в растворе (гомогенный катализ) или в суспензии (гетерогенный катализ). Для восстановления растворением металла нитросоединение в этаноле обрабатывают подходящим реактивным металлом, таким как цинк или олово, в присутствии кислоты, такой как уксусная кислота или соляная кислота. Можно также использовать другие восстанавливающие агенты, такие как хлорид олова(II). Предпочтительно раствор соединения формулы (IV) в метаноле или этаноле обрабатывают 10%(масс/масс) 10% Pd(OH)2 на углероде и 5 эквивалентами формиата аммония, и смесь нагревают с обратным холодильником в течение периода времени между 2 и 18 ч. Стадия (d). Раствор пиразолкарбоксамида (V) и фосгена или его эквивалента, такого как 1,1'карбонилдиимидазол, трихлорметилхлорформиат или бис(трихлорметил)карбонат, в подходящем растворителе перемешивают при температуре между температурой окружающей среды и точкой кипения растворителя, возможно при повышенном давлении, в течение времени между 2 и 18 ч с получением соответствующего пиразолопиримидиндиона формулы (VI). Подходящие растворители включают ацетонитрил, дихлорметан и N,N-диметилформамид. Предпочтительно раствор диона и от 1 до 2 эквивалентов карбонилдиимидазола в ацетонитриле, N,N-диметилформамиде или дихлорметане нагревают при температуре между 50 и 80 С в течение 18 ч. Стадия (е). Дион формулы (VI) обрабатывают большим избытком подходящего хлорирующего реагента, такого как оксихлорид фосфора (РОСl3) или фенилфосфонилдихлорид (PhP(O)Cl2) в присутствии третичного амина, такого как N-этилдиизопропиламин, N-метилморфолин, триэтиламин или N,N-диметиланилин,при повышенной температуре в течение 8-48 ч с получением соответствующего дихлорпиразолопиримидина формулы (VII). N,N-Диметилформамид можно возможно добавлять в качестве катализатора. Альтернативно дион обрабатывают РОСl3 или PhP(O)Cl2 в подходящем растворителе в присутствии хлорида тетраалкиламмония, такого как хлорид тетраэтиламмония, при повышенной температуре. Подходящие растворители включают ацетонитрил и пропионитрил. Предпочтительно дион обрабатывают 10-30 эквивалентами РОСl3 и 3-5 эквивалентами хлорида тетраэтиламмония в пропионитриле при кипячении с обратным холодильником в течение 4-18 часов.- 16008596 Стадия (f). Раствор дихлорида формулы (VII), амин HNR1R2 и избыток третичного амина, такого как Nэтилдиизопропиламин, N-метилморфолин или триэтиламин, в подходящем растворителе перемешивают при температуре окружающей среды или при повышенной температуре в течение промежутка времени между 1 и 24 часами с получением соответствующего соединения формулы (VIII). Подходящие растворители включают дихлорметан, диметилсульфоксид, N,N-диметилформамид, тетрагидрофуран и Nметилпирролидинон. Альтернативно раствор амина HNR1R2 в подходящем растворителе обрабатывают бутиллитием или гексаметилдисилазидом натрия при низкой температуре и добавляют дихлорид к полученному в результате раствору. Подходящие растворители включают тетрагидрофуран, диоксан и N-метилпирролидинон. Предпочтительно либо дихлорид обрабатывают 3-5 эквивалентами амина HNR1R2 и возможно 3-5 эквивалентами N-этилдиизопропиламина в дихлорметане, диметилсульфоксиде или смеси диметилсульфоксида и N-метилпирролидинона при 20-90 С в течение 1-18 ч, либо раствор 2-4 эквивалентов HNR1R2 в тетрагидрофуране обрабатывают эквимолярным количеством бутиллития или гексаметилдисилазида натрия, добавляют 1 эквивалент дихлорида, и смесь перемешивают при температуре между 0 С и комнатной температурой в течение времени между 2 и 3 ч. Должно быть понятно, что любым функциональным группам, которые являются заместителями наR1, и, в частности, любым первичным или вторичным аминогруппам может быть необходима защита для возможности успешного протекания этой реакции. Подходящие защитные группы хорошо известны в данной области техники и описаны, например, в Protective Groups in Organic Synthesis, Greene, T. W.and Wutts, P. G. M., 3rd edition, John Wiley and Sons, Ltd, Chichester, 1999. Примеры защитных групп для первичных и вторичных аминов включают группы трет-бутоксикарбонил (ВОС), бензилоксикарбонил(CBZ или Z) и 9-флуоренилметилоксикарбонил (Fmoc). Карбоновые кислоты можно защитить в виде их метилового, этилового, бензилового или трет-бутилового эфира. Спирты можно защитить в виде эфира или эфирных производных. Стадия (g). Раствор монохлорида (VIII) и амина HNR3R4 в подходящем биполярном апротонном растворителе перемешивают при повышенной температуре в течение прмежутка времени между 1 и 24 ч с получением соответствующего соединения формулы (I). Подходящие растворители включают диметилсульфоксид,N,N-диметилформамид и N-метилпирролидинон. Возможно, можно включать избыток третичного амина, такого как N-этилдиизопропиламин, N-метилморфолин или триэтиламин и/или источник фторида,такой как фторид цезия или фторид тетраэтиламмония. Иногда необходимо проводить эту реакцию при повышенном давлении в закрытом сосуде, в частности, когда амин HNR3R4 или растворитель является летучим. Альтернативно эту реакцию можно проводить при микроволновом облучении. Предпочтительными условиями являются: монохлорид обрабатывают 3-5 эквивалентами амина HNR3R4 и возможно 3-5 эквивалентами Nэтилдиизопропиламина в диметилсульфоксиде или N-метилпирролидиноне, возможно в запаянном сосуде при 80-125 С в течение 12-18 часов; либо монохлорид обрабатывают 3-5 эквивалентами амина HNR3R4 и 1 эквивалентом фторида цезия в диметилсульфоксиде или N-метилпирролидиноне, возможно в запаянном сосуде при 100-120 С; либо монохлорид обрабатывают 3-5 эквивалентами амина HNR3R4 и возможно 3-5 эквивалентами Nэтилдиизопропиламина и/или возможно в присутствии фторида цезия или фторида тетраэтиламмония вN-метилпирролидиноне при микроволновом облучении в течение 40 мин. Должно быть понятно, что, как для стадии (f) выше, любым функциональным группам в -HNR3R4,и, в частности, любым первичным или вторичным аминогруппам может быть необходима защита, чтобы дать возможность успешного протекания этой реакции. В некоторых случаях возможно проводить превращения стадий (f) и (g) в виде операции одного сосуда, то есть без выделения монохлорида формулы (VIII). Соединение формулы (VIII) обрабатывают амином HNR1R2, как описано на стадии (f), затем к смеси добавляют амин HNR3R4, и реакцию проводят далее, как описано на стадии (g). Когда в ходе синтеза использована одна или более чем одна защитная группа, должен быть протокол конечного удаления защиты, чтобы удалить маскировку функциональных групп целевого соединения. Этот протокол может представлять собой одну операцию или может осуществляться в несколько стадий. Его можно также комбинировать с предшествующей синтетической манипуляцией. Удаление защиты хорошо известно в данной области техники и описано в Protective Groups in Organic Synthesis, Greene, T. W. and Wutts, P. G. M., 3rd edition, John Wiley and Sons, Ltd, Chichester, 1999. Например, защиту аминов, защищенных трет-бутоксикарбонилом, и трет-бутиловых эфиров карбоновых кислот можно удалить путем обработки кислотами, такими как трифторуксусная кислота или безводный хлорид водорода, в подходящем растворителе, защиту аминов, защищенных бензилоксикарбонилом, и бензиловых эфиров карбоновых кислот можно удалить путем каталитического гидрогенолиза, защиту аминов, защищенных 9-флуоренилметилоксикарбонилом, можно удалить путем обработки пипериди- 17008596 ном, и защиту метиловых и этиловых эфиров карбоновых кислот можно удалить путем обработки гидроксидом щелочного металла. Предпочтительно защитные группы mpem-бутоксикарбонил и трет-бутил удаляют путем обработки трифторуксусной кислотой в дихлорметане при комнатной температуре в течение промежутка времени между 1 и 18 ч, либо для защитных групп трет-бутоксикарбонил путем обработки избытком хлорида водорода в диоксане при комнатной температуре в течение 18 ч. Бензильные защитные группы предпочтительно удаляют путем гидрогенизации при 60 фунт/кв. дюйм (413, 686 кПа) в присутствии Pd(OH)2 в этанольном хлориде водорода при комнатной температуре в течение 18 ч. 2. На схеме 2 суммированы два способа, синтезы Кнорра и Пехмана, доступные для синтеза пиразолкарбоновых кислот формулы (II). Можно также использовать другие способы, известные в данной области техники. Схема 2 Стадия (h). 1,3-Дикетоны формулы (X), которые являются исходными веществами для синтеза пиразолов Кнорра, могут быть получены из соответствующих метилкетонов формулы (IX) с использованием межмолекулярной конденсации Клайзена. Метилкетон формулы (IX) подвергают взаимодействию с диметилоксалатом в подходящем растворителе в присутствии подходящего основания. Подходящие растворители включают эфиры, такие как тетрагидрофуран. Подходящие основания включают гидрид натрия,трет-бутоксид калия и диизопропиламид лития. Альтернативно метоксид натрия можно использовать в качестве оснозания и метанол в качестве растворителя. Стадия (i). 1,3-Дикетон формулы (X) можно подвергнуть взаимодействию с гидразином с получением пиразола формулы (XI), следуя хорошо известной методологии синтеза пиразолов Кнорра. Должно быть понятно, что замещенные гидразины R6ANHNH2 можно также использовать в синтезе пиразолов Кнорра с получением аналогов соединений формулы (XI), которые являются N-алкилированными. Обычно получается смесь N1- и N2-алкилированного продукта, и индивидуальные компоненты можно разделить, используя общепринятые способы, такие как хроматография или фракционная кристаллизация. Тогда гидролиз и нитрование согласно способам, описанным ниже для стадий (I) и (m), с последующим образованием амида согласно способу, описанному выше в части 1, стадия (а), дает соединения формулы (IV) без необходимости в реакции алкилирования части 1, стадия (b). Стадия (j). При данном варианте синтеза пиразолов Пехмана диазосоединение формулы (XII) подвергают взаимодействию с метилпропионатом с получением пиразола формулы (XI). Диазосоединения формулы(XII) могут быть получены известными способами, как например из соответствующего первичного амина R5CH2NH2 через N-арилсульфонил-N-нитрозопроизводное. Стадия (k). При данном альтернативном варианте синтеза пиразолов Пехмана ацетилен формулы (XIII) подвергают взаимодействию с метилдиазоацетатом с получением пиразола формулы (XI). Стадия (I). В таком случае гидролиз эфира соединений формулы (XI) дает соединения формулы (XIV). Это превращение можно удобно осуществить путем обработки соединения формулы (XI) гидроксидом щелочного металла, таким как гидроксид лития, гидроксид натрия или гидроксид калия, в подходящем растворителе при температуре между 10 С и точкой кипения растворителя. Подходящие растворители- 18008596 включают воду, метанол, этанол и смеси воды с метанолом, этанолом, тетрагидрофураном и диоксаном. Стадия (m). Нитрование пиразолов хорошо известно. Соединения формулы (XIV) обрабатывают нитрующим агентом, таким как азотная кислота или смесь азотной кислоты и серной кислоты, с получением соединений формулы (II). 3. На схеме 3 представлен вариант синтетического пути cхемы 1, который применим для синтеза соединений формулы (I), где R6 представляет собой R6A, в которые данную группу вводят на конечной стадии. Схема 3 Стадия (n). Соединения формулы (IC), то есть соединения формулы (I), где R6 представляет собой водород,можно превратить в N-алкилированные соединения формул (IA) и (IB), следуя способам, описанным выше в части 1, стадия (b). Когда эта реакция дает смесь двух продуктов (IA) и (IB), их можно разделить,используя стандартные методики. Использование более реактивных алкилирующих агентов способствовует образованию N2-замещенных соединений формулы (1 В). 4. Методология cхем 1 и 2 в целом применима к синтезу соединений формулы (I), где R5 представляет собой водород или незамещенный алкил или циклоалкил. Ее можно также применить к синтезу других соединений формулы (I) при условии, что любые функциональные группы R5 совместимы с вовлеченными химическими манипуляциями. Например, полифторалкильные и перфторалкильные группы,вероятно, являются совместимыми, как и эфирные функциональные группы, особенно если они удалены от пиразолопиримидинового ядра. В некоторых случаях, однако, может быть желательным или необходимым ввести или образовать R5 на промежуточной стадии общего синтеза. Репрезентативные способы описаны ниже на схемах 4-11. Должно быть понятно, что многие превращения можно осуществить в иные моменты общего синтеза, чем проиллюстрированные. На схеме 4 суммирован синтетический путь для синтеза соединений формулы (I), в которых группуR5 вводят на конечной стадии путем реакции межмолекулярного сочетания. Этот способ особенно пригоден для случаев, когда R5 является разветвленным или ненасыщенным в точке присоединения к пиразолопиримидиновому ядру. Насыщенные алкильные и циклоалкильные группы можно также получить,следуя данному способу, путем их введения в виде их алкенильных и циклоалкенильных аналогов, а затем восстановления нежелательной двойной связи на последующей стадии каталитической гидрогенизации. Стадия (о). Имеющуюся в продаже 4-нитро-(2 Н)-пиразол-3-карбоновую кислоту превращают в 4-нитро-(2H)пиразол-3-карбоксамид, следуя способам, описанным выше в части 1, стадия (а). Стадия (р). Соединения формулы (IVA), то есть соединения формулы (IV), где R5 представляет собой водород,получают, следуя способам, описанным выше в части 1, стадия (b). Стадия (q). Соединения формулы (VIA), то есть соединения формулы (VI), где R5 представляет собой водород,получают в две стадии, следуя способам, описанным выше в части 1, стадии (с) и (d). Стадия (r). Соединения формулы (VIA) можно бромировать с получением соответствующих соединений формулы (XV) путем обработки N-бромсукцинимидом в N,N-диметилформамиде при повышенной температуре или бромом и избытком ацетата натрия в уксусной кислоте при кипячении с обратным холодильником. Предпочтительно соединение формулы (VIA) обрабатывают N-бромсукцинимидом в N,N-диметилформамиде при 50 С в течение 18 ч. Стадия (s). Соединения формулы (XVI) получают, следуя способам, описанным выше в части 1, стадии (е), (f) и (g). Стадия (t). Соединения формулы (XVI) можно подвергать сочетанию с подходящим реагентом R5-M, где М представляет собой металл, производное металла или производное бора, таким как: литий (М = Li); галогеномагний, в частности, хлормагний, броммагний и йодмагний (М = ClMg, BrMg и IMg); галогеноцинк,в частности, хлорцинк, бромцинк и йодцинк (М = ClZn, BrZn и IZn); триалкилолово, например, три-нбутилолово (М = n-Bu3Sn); диалкилбор, например, диэтилбор (М = Et2B) и диалкоксибор, например, диметоксибор (М = (Н 3 СО)2 В). Эту реакцию, как правило, проводят в присутствии катализатора, представляющего собой переходный металл, такой как палладий или никель, или его производное, и она может дополнительно требовать использования основания, такого как карбонат калия, фторид цезия или триэтиламин. Репрезентативные способы сочетания включают протоколы Сузуки и Штилле, которые подробно описаны в "Metal-Catalysed Cross-Coupling Reactions", F. Diedrich (ed.), Wiley-VCH, 1998 (и ссылках, цитируемых там). 5. На схеме 5 суммированы синтетические пути, которые, в частности, применимы для получения соединений формулы (I), где R5 представляет собой гидроксиметил, алкоксиметил, галогеноксиметил или циклоалкоксиметил. На cхеме 5 X представляет собой уходящую группу, такую как атом хлора,брома или йода, либо группу алкил, арил или перфторалкилсульфонат (например, группу метансульфонат, толуолсульфонат или трифторметансульфонат), a Ra представляет собой группу алкил, циклоалкил или галогеноалкил. Стадия (u). Восстановление эфиров формулы (XVII) с получением первичных спиртов формулы (XVIII) может быть достигнуто с использованием реагента, представляющего собой гидрид металла, такой как алюмогидрид лития, боргидрид лития, триэтилборгидрид лития или гидрид диизобутилалюминия (DIBAL) в подходящем растворителе при температуре ниже 0 С. Подходящие растворители включают углеводороды, такие как пентан, гексан и толуол, эфиры, такие как тетрагидрофуран, и их смеси. Альтернативно эфир можно восстановить путем гидрогенизации над катализатором, представляющим собой хромит меди, при повышенных значениях температуры и давления. Предпочтительно эфир обрабатывают 8-10 эквивалентами DIBAL в тетрагидрофуране при температуре между -78 и -5 С в течение времени от 15 мин до 1 ч. Эфиры формулы (XVII) могут быть получены согласно способам, описанным ниже в части 6. Стадия (v). Соединения формулы (ID), то есть соединения формулы (I), где R5 представляет собой гидроксиметил, могут быть получены из спиртов формулы (XVIII), следуя способам части 1, стадия (g). Стадия (w). Соединения формулы (XIX), где X представляет собой Вr, могут быть получены из спиртов формулы (XVIII) путем обработки бромидом водорода или смесью трифенилфосфина и брома, тетрабромметана или N-бромсукцинимида, возможно в присутствии пиридина в подходящем растворителе, таком как диэтиловый эфир, дихлорметан или пропионитрил. Предпочтительно спирт обрабатывают трифенилфосфином и тетрабромметаном в дихлорметане при комнатной температуре в течение 1 ч. Соединения формулы (XIX), где X представляет собой Cl, могут быть получены из спиртов формулы (XVIII) путем обработки тионилхлоридом, трихлоридом фосфора или смесью трифенилфосфина и Nхлорсукцинимида в подходящем растворителе, таком как дихлорметан. Предпочтительно спирт обрабатывают избытком тионилхлорида в дихлорметане в течение 2-18 ч. Соединения формулы (XIX), где X представляет собой I, могут быть получены из соответствующего бромида или хлорида путем обработки йодидом натрия. Соединения формулы (XIX), где X представляет собой алкилсульфонат, арилсульфонат или перфторалкилсульфонат, могут быть получены из спиртов формулы (XVIII) путем обработки сульфонилхлоридом или ангидридом, таким как метансульфонилхлорид (мезилхлорид), толуолсульфонилхлорид(тозилхлорид) или трифторметансульфоновый ангидрид (трифловый ангидрид), в присутствии третичного амина, такого как триэтиламин, N-этилдиизопропиламин или N-метилморфолин, в подходящем растворителе, например, в дихлорметане. Альтернативно пиридин можно использовать в качестве растворителя, и в этом случае нет необходимости использовать третичный амин. Стадия (х).- 21008596 Соединения формулы (XX) могут быть получены путем обработки соответствующих соединений формулы (XIX) алкоксидом натрия или калия, NaORa или KORa. Альтернативно соединения формулы(XIX) можно обработать избытком спирта RaOH и катализатором, таким как тетрафторборат серебра(AgBF4). Подходящие растворители включают ацетонитрил, N-метилпирролидинон и N,Nдиметилформамид. Альтернативно спирт RaOH можно использовать в качестве растворителя при условии, что его можно легко удалить после реакции, например, выпариванием. Предпочтительно соединение формулы (XIX), где X представляет собой Cl или Вr, обрабатывают избытком NaORa в N,N-диметилформамиде или RaOH при комнатной температуре в течение времени между 30 мин и 72 ч. Стадия (у). Соединения формулы (XX) могут быть также получены из первичных спиртов формулы (XVIII) путем взаимодействия с алкилирующим реагентом Ra-X, используя способы, аналогичные описанным выше в стадии (у). Таким образом, раствор спирта формулы (XVIII) в подходящем растворителе, например в N,N-диметилформамиде или ацетонитриле, можно обработать сильным основанием, таким как гидрид натрия, с образованием алкоксида натрия, а затем алкилирующим реагентом Ra-X. Должно быть понятно, что данное превращение можно также осуществлять, используя первичные спирты формулы (ID) в качестве исходных веществ, причем это превращение приводит к получению соединений формулы (IЕ). Стадия (z). Соединения формулы (IЕ), то есть соединения формулы (I), где R5 представляет собой RaOCH2-, могут быть получены из спиртов формулы (XX), следуя способам части 1, стадия (g). 6. Эфиры формулы (XVIIA), то есть соединения формулы (XVII), где R6 присоединен при N7 положении, и формулы (XVIIB), то есть соединения формулы (XVII), где R6 присоединен при N2 положении, могут быть получены согласно способам, суммированным на схеме 6. Схема 6 Стадия (аа). Диметил-4-нитропиразол-3,5-дикарбоксилат, который легко получают согласно способу, описанному в опубликованной Международной патентной заявке WO 00/24745 (см. пример получения 2, с. 48),можно подвергнуть N-алкилированию согласно способам, описанным выше в части 1, стадия (b). Должно быть понятно, что чувствительность эфирных групп к гидролизу и транс-эстерификации подразумевает, что гидроксиды и алкоксиды (иные чем метоксиды) щелочных металлов нельзя использовать в качестве оснований, а воду и спирты (иные чем метанол) нельзя использовать в качестве растворителей или сорастворителей. Поскольку два атома азота пиразола эквивалентны, получается единственный продукт алкилирования.- 22008596 Стадия (bb). Избирательный гидролиз диэфиров формулы (XXI) одним эквивалентом гидроксида щелочного металла согласно способу Chambers et al. (J. Org. Chem. 50, 4736-4738, 1985) расщепляет эфир, соседний с замещенным атомом азота, с получением монокислот формулы (XXII). Предпочтительно диэфир обрабатывают 1 эквивалентом гидроксида калия в метаноле при комнатной температуре в течение 18 ч. Стадия (cc). Соединения формулы (XVIIA), то есть соединения формулы (XVII), где R6 присоединен при N1 положении пиразолопиримидина, могут быть получены из соединений формулы (XXII), следуя способам части 1, стадии (b)-(f). Введение группы -NR1R2 предпочтительно достигается путем обработки соответствующего дихлорида 3-5 эквивалентами HNR1R2 в диметилсульфоксиде при 30 С в течение 1 часа. Стадия (dd). Соединения формулы (XXIII) могут быть получены путем обработки монокислот формулы (XXII) трет-бутилацетатом или изобутеном в присутствии минеральной кислоты. Стадия (ее). Гидролиз метилового эфира соединений формулы (XXIII) согласно способам, описанным выше в части 2, стадия (I), с последующей обработкой полученной в результате монокислоты согласно способам части 1, стадии (а)-(d), выше, приводит к образованию N2-замещенных пиразолопиримидин-5,7-дионов формулы (XXIV). Стадия (ff). тpeт-Бутиловый эфир соединений формулы (XXIV) расщепляют путем обработки кислотой, такой как трифторуксусная кислота или раствор хлорида водорода, в подходящем растворителе, таком как диоксан. Полученную в результате карбоновую кислоту превращают в метиловый эфир, используя способы, хорошо известные в данной области техники, как например путем образования хлорангидрида с использованием оксалилхлорида или тионилхлорида с последующей обработкой метанолом или путем обработки метанолом и карбодиимидом. Затем этот метиловый эфир обрабатывают далее, как описано выше в части 1, стадии (е) и (f), с получением соединений формулы (XVIIB). 7. Синтетический путь, проиллюстрированный на схеме 6, может давать низкие выходы в случаях,где амин HNR1R2 является только слабо нуклеофильным, как в случае, когда R1 представляет собой пиримидиновое или пиразиновое кольцо. В этих случаях необходимо восстановить эфирную группу до введения группы -NR1R2, как проиллюстрировано на схеме 7. Схема 7 Стадия (gg). Соединения формулы (XXV) могут быть получены из соединений формулы (XXII), следуя способам части 1, стадии (b)-(е), выше. Стадия (hh). Соединения формулы (XXVI) могут быть получены из соединений формулы (XXV), следуя способам части 5, стадия (v), выше. Стадия (ii).- 23008596 Первичный спирт далее защищают с получением соединений формулы (XXVII), где PG представляет собой защитную группу спирта. Предпочтительной защитной группой является группа триалкилсилил, в частности, группа трет-бутилдиметилсилил. Предпочтительно спирт обрабатывают 1,1 эквивалента трет-бутилдиметилсилилхлорида и 1,1 эквивалента имидазола в дихлорметане при комнатной температуре в течение 18 ч. Стадия (jj). Соединения формулы (XXVIII) могут быть получены из соединений формулы (XXVII), следуя способам части 1, стадия (f), выше. Стадия (kk). Защиту соединений формулы (XXVIII) удаляют с получением первичных спиртов формулы(XVIII), используя соответствующие условия. Когда PG представляет собой группу триалкилсилил, ее можно удалить обработкой солью фторид, такой как фторид тетрабутиламмония, или хлоридом водорода в метаноле. Предпочтительно, когда PG представляет собой группу трет-бутилдиметилсилил, ее удаляют обработкой 2 эквивалентами фторида тетрабутиламмония в тетрагидрофуране при комнатной температуре в течение 18 ч или хлоридом водорода в метаноле при комнатной температуре в течение 18 ч. 8. Спирты формулы (XVIII) и (ID) могут быть окислены до соответствующих альдегидов формулы(XXIX), которые являются особенно многосторонними промежуточными соединениями при получении соединений формулы (I). Некоторые репрезентативные превращения показаны на cхеме 8. Если не указано иное, на схемах 8-11 Y представляет собой либо Cl, либо -NR3R4, и может предпочтительно представлять собой Cl. Схема 8 Стадия (II). Окисление спиртов формулы (XIX) может быть достигнуто с использованием реагента хромиум(VI) такого как хлорхромат пиридиния, реагента, представляющего собой активированный диметилсульфоксид, как в протоколе окисления Сверна, реагента, представляющего собой гипервалентный йод,такого как периодинан Десса-Мартина, или комбинации перрутената тетра-н-пропиламмония и Nметилморфолин-N-оксида в подходящем растворителе при температуре между 0 С и температурой окружающей среды. Подходящие растворители включают дихлорметан. Предпочтительным реагентом является периодинан Десса-Мартина. В принципе альдегиды формулы (XXIX) могут быть также получены из соответствующих эфиров путем восстановления DIBAL при низкой температуре, но на практике очень трудно остановить восстановление на стадии альдегида, и первичный спирт является, как правило, основным продуктом. Стадия (mm). Взаимодействие альдегидов формулы (XXIX) с реагентом Гриньяра RbMgHal, где Rb представляет- 24008596 собой группу алкил или циклоалкил, a Hal представляет собой Cl, Вr или I, или с литийорганическим реагентом RbLi дает вторичные спирты формулы (XXX). Соединения формулы (XXX), где Y представляет собой NR3R4, сами по себе являются соединениями формулы (I), где R5 представляет собой алкил, замещенный гидроксильной группой. Стадия (nn). Соединения формулы (XXX) можно обрабатывать далее, как обсуждалось выше в части 5 для аналогов первичного спирта. Например, их можно алкилировать с получением соединений формулы(XXXI), следуя способам, описанным выше в части 5, стадии (х) и (у), или в части 5, стадия (z). Другой возможностью, не проиллюстрированной на схеме 8, является окисление вторичного спирта с использованием способов стадии (II) с получением кетона, который можно обрабатывать далее аналогично альдегидам формулы (XXIX). Стадия (оо). Используя методологию реакции Виттига, альдегиды формулы (XXIX) можно обработать реагентом, представляющим собой фосфоран, Ph3P:C(Rc)Rd, где Rc и Rd представляют собой водород, алкил и циклоалкил, с получением соединений формулы (XXXII), в которых есть двойная связь, прилежащая к пиразолопиримидиновому ядру. Аналогичные соединения могут быть также получены из спиртов формулы (XXX), где Ra представляет собой CH(Rc)Rd, путем катализируемого кислотой дегидрирования или путем катализируемой основанием элиминации из соответствующего хлорида или мезилата. Стадия (рр). Если она не является необходимостью в конечном продукте, двойную связь в соединениях формулы (XXXII) можно удалить путем каталитической гидрогенизации. Стадия (qq). Использование (метоксиметилен)трифенилфосфорана в реакции Виттига стадии (оо) дает енольные эфиры формулы (XXXIV). Стадия (rr). Енольные эфиры формулы (XXXIV) можно подвергнуть гидролизу в растворе кислоты с получением альдегидов формулы (XXXV). Эти альдегиды можно затем обработать теми же путями, как обсуждались выше для альдегидов формулы (XXIX). 9. Альдегиды формулы (XXIX) можно также гомологизировать с получением эфиров, как проиллюстрировано на схеме 9. Эфиры, полученные таким образом, можно затем обрабатывать с получением соединений формулы (I) согласно способам, изложенным выше в частях 5 и 8. Схема 9(CH3SCH2S(O)CH3) и тритоном В в тетрагидрофуране с получением промежуточных соединений формулы (XXXVI). Стадия (tt). Промежуточные соединения формулы (XXXVI) обрабатывают метанолом и ацетилхлоридом с получением эфира формулы (XXXVII). Стадия (uu). Альдегиды формулы (XXIX) можно превратить в эфир акрилат формулы (XXXVIII) путем взаимодействия с фосфорным реагентом, следуя протоколам реакций Биттига, Хорнера или УодсвортаХорнера-Эммонса. Реагент получают путем обработки соли трифенилфосфония Рh3 Р+СН 2 СO2 СН 3.Х(Виттиг), оксида фосфина Рh2 Р(О)СН 2 СО 2 СН 3 (Хорнер) или фосфоната (ЕtO)2 Р(О)СН 2 СО 2 СН 3 (Уодсворт-Хорнер-Эммонс) основанием, таким как бутиллитий, диалкиламид лития или алкоксид щелочного металла, в подходящем растворителе, таком как тетрагидрофуран. Этот способ не ограничен получением -незамещенных эфиров акрилатов. Использование алкилзамещенного фосфорного реагента, такого как Ph3P+CH(R)CO2CH3.X-, либо эквивалентного оксида фосфина или фосфоната, где R представляет собой алкил, дает доступ к соответствующему производному алкилакрилата. Превращение альдегидов формулы (XXIX) в акрилатные эфиры формулы (XXXVIII) может быть также достигнуто взаимодействием с производным малоната, следуя способу конденсации Кневенагеля. Стадия (vv). Восстановление двойной связи углерод-углерод (XXXVIII) с получением соединений формулы(XXXIX) можно осуществить путем каталитической гидрогенизации, используя молекулярный водород в присутствии катализатора, представляющего собой переходный металл, такой как палладий, платина или никель. Акрилаты формулы (XXXVIII) можно также обработать алкилмедными реагентами с получением аналогов соединений формулы (XXXIX), в которых алкильный заместитель введен на атом углерода,прилежащий к пиразолопиримидиновой кольцевой системе, либо илидом сульфония, либо эквивалентом карбена с получением производного 2-(пиразолопиримидинил)-циклопропан-1-карбоксилата. 10. Гомологизированные эфиры формулы (XXXVII) могут быть также получены способом, проиллюстрированным на схеме 10. Схема 10 Стадия (ww). Метиловые эфиры формул (XVII) и (ХХХХ) можно подвергнуть гидролизу с получением кислот формулы (XXXXI), следуя способам части 2, стадия (n), выше. (Эфиры формулы (ХХХХ) могут быть получены из эфиров формулы (XVII), следуя способам части 1, стадия (g), выше). Стадия (хх). Кислоты формулы (XXXXI) можно гомологизировать, следуя способам реакции Арндта-Айстерта. Карбоновую кислоту превращают в реакционноспособное промежуточное соединение, такое как хлорангидрид (путем взаимодействия с оксалилхлоридом) или смешанный ангидрид (путем взаимодействия с изобутилхлорформиатом). Это промежуточное соединение подвергают взаимодействию с диазометаном с получением -диазокетона. Это соединение обрабатывают оксидом серебра в присутствии метанола с- 26008596 получением гомологизированного эфира формулы (XXXVII). 11. Гомологизированные эфиры формулы (XXXIX) могут быть также получены способом, проиллюстрированным на схеме 11. Схема 11(СН 3 О 2 С)2 СН 2 и основанием в подходящем растворителе. Типично основание представляет собой алкоксид щелочного металла, такой как этоксид натрия или трет-бутоксид калия, а растворитель представляет собой спирт, такой как метанол или этанол, или эфир, такой как тетрагидрофуран. Предпочтительно основание и растворитель выбраны так, чтобы минимизировать трансэстерификацию малонатного реагента и промежуточного соединения (XXXXIII). Этот способ может быть распространен на замещенные малонаты (CH3O2C)2CHR, где R представляет собой алкильную группу. Это дает доступ к соединениям, аналогичным (XXXIX), в которых группаr представляет собой заместитель на атоме углерода, прилежащем к группе RAO2C. Эти соединения могут быть также получены путем алкилирования промежуточного соединения (XXXXIII) R-Br или R-I в присутствии основания, представляющего собой алкоксид щелочного металла. Стадия (zz). Затем промежуточное соединение (XXXXIII) декарбоксилируют с получением продукта (XXXIX). Этого можно достичь путем избирательного гидролиза, используя один эквивалент гидроксида щелочного металла, такого как гидроксид натрия, с последующим подкислением, либо другим способом, известным в данной области техники. Приведенные ниже соединения образуют следующие аспекты настоящего изобретения: Соединение формулы (VII) где R5 и R6 являются такими, как определено выше. Предпочтительным является соединение формулы где R1, R2, R5 и R6 являются такими, как определено выше. Предпочтительным является соединение формулы (VIIIA) где R1, R2, R5 и R6 являются такими, как определено выше. Далее изобретение проиллюстрировано приведенными ниже неограничивающими примерами. Точки плавления определяли на аппарате Gallenkamp для измерения точек плавления, используя стеклянные капиллярные трубки, и эти точки не скорректированы. Если не указано иное, все реакции проводили в атмосфере азота, используя имеющиеся в продаже безводные растворители. Реакции, проводимые при микроволновом облучении, осуществляли, используя аппарат Emrys Creator (Personal Chemistry Ltd.) с выходной мощностью от 15 до 300 Вт при 2,45 ГГц. Аммиак 0,88 относится к имеющемуся в продаже водному раствору аммиака с удельным весом примерно 0,88. Тонкослойную хроматографию проводили на стеклянных пластинках, предварительно покрытых силикагелем Merck (60 F254), а колоночную хроматографию на силикагеле проводили, используя силикагель 40-63 мкм (силикагель Merck 60). Ионообменную хроматографию проводили, используя указанную ионообменную смолу, которая была предварительно промыта деионизованной водой. Протонные спектры ЯМР измеряли на спектрометре Varian Inova 300, Varian Inova 400 или Varian Mercury 400 в указанных растворителях. В спектрах ЯМР обозначены только не обмениваемые протоны, которые появлялись отдельно от пиков растворителя. Масс-спектры низкого разрешения записывали либо на Fisons Trio 1000, используя положительную ионизацию термораспылением, либо Finnigan Navigator, используя положительную или отрицательную ионизацию электрораспылением. Масс-спектры высокого разрешения записывали на Bruker Apex II FT-MS, используя положительную ионизацию электрораспылением, Анализы сжигания проводили с помощью Exeter Analytical UK Ltd., Uxbridge, Middlesex. Оптические вращения определяли при 25 С, используя поляриметрPerkin Elmer 341, используя указанные растворители и концентрации. Соединения примеров, обозначенные как (+) или (-) оптические изомеры, оценивали на основании знака оптического вращения при определении в подходящем растворителе. Сокращения и обозначенияArbocel - фильтрующий агент от J. RettenmaierSohne, Germany;APCI - химическая ионизация при атмосферном давлении; Атм - давление в атмосферах (1 атм = 760 Торр = 101,3 кПа);Biotage - хроматографию проводили, используя картридж силикагеля Flash 75 от Biotage, UK; ВОС - группа трет-бутоксикарбонил; Вr - широкий; С - концентрация, использованная для измерений оптического вращения, в г на 100 мл (1 мг/мл соответствует с 0,10) Кат - каталитический;Degussa101 - 10% мас./мас. палладий на активированном углероде, Degussa type E101 доступен отDevelosil - поставляется Phenomenex - производится Nomura Chemical; Колонка ВЭЖХ Co. типа Combi-RP С 30 - состоит из сферических частиц силикагеля (размер 3 или 5 мкм), которые имеют химически связанную поверхность цепей С 30. Эти частицы упакованы в колонки из нержавеющей стали размерами: внутренний диаметр 2 см и длина 25 см;Dowex - ионообменная смола от Aldrich Chemical Company; Эи - энантиомерный избыток;LRMS - масс-спектроскопия низкого разрешения (развертка положительной ионизации электрораспылением или термораспылением);m/z - пик масс-спектра; гель MCI - высокопористый полимер, СНР 20 Р 75-150 мкм от Mitsubishi Chemical Corporation; Колонка ВЭЖХ Luna C18 Phenomenex - поставляется Phenomenex. Состоит из сферических частиц силикагеля (размер 5 мкм или 10 мкм), которые имеют химически связанную поверхность цепей С 18. Эти частицы упакованы в колонки из нержавеющей стали размерами: внутренний диаметр 2,1 см и длина 25 см;Psi - фунт на квадратный дюйм (1 psi = 6,9 кПа);Rf - фактор удерживания на ТСХ;t - триплет; ТСХ - тонкослойная хроматография;- химический сдвиг. Если не указано иное, здесь: РуВОР означает бензотриазол-1-илокситрис(пирролидино)фосфония гексафторфосфат; РуВrОР означает бром-трис-пирролидино-фосфония гексафторфосфат;WSCDI означает гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида; Реагент Мукайяма означает йодид 2-хлор-1-метилпиридиния;DCC означает N,N'-дициклогексилкарбодиимид; НОАТ означает 1 -гидрокси-7-азабензотриазол; НОВТ означает гидрат 1-гидроксибензотриазола; Основание Хюнига означает N-этилдиизопропиламин;CBz означает бензилоксикарбонил; МеОН означает метанол, ЕtOН означает этанол и ЕtOАс означает этилацетат; ТГФ означает тетрагидрофуран, ДМСО означает диметилсульфоксид и ДХМ означает дихлорметан; ДМФ означает N,N-диметилформамид; АсОН означает уксусную кислоту, ТФУ означает трифторуксусную кислоту. Приведенные ниже примеры иллюстрируют получение соединений формулы (I). Примеры 1-28 Раствор необходимого монохлорида (см. примеры получения 68, 70-82, 85, 86 и 90) (1 экв.), необходимого амина HNR3R4 (5 экв.) и N-этилдиизопропиламина (5 экв.) в диметилсульфоксиде (3-4 мл на ммоль-1) нагревали в запаянном сосуде при 120 С в течение 18 ч. Реакционную смесь разбавляли водой,и продукт экстрагировали этилацетатом (х 3). Органические вещества объединяли, промывали водой,- 29008596 высушивали над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали, используя колоночную хроматографию на силикагеле, элюируя смесью дихлорметан:этилацетат, дихлорметан:метанол или пентан:этилацетат в качестве растворителей. Приведенные ниже соединения получили способом, описанным выше.
МПК / Метки
МПК: A61K 31/519, C07D 487/04, A61K 31/505
Метки: гипертензии, 5,7-диаминопиразоло[4,3-d]пиримидины, полезные, лечении
Код ссылки
<a href="https://eas.patents.su/30-8596-57-diaminopirazolo43-dpirimidiny-poleznye-pri-lechenii-gipertenzii.html" rel="bookmark" title="База патентов Евразийского Союза">5,7-диаминопиразоло[4,3-d]пиримидины, полезные при лечении гипертензии</a>
Предыдущий патент: Замещенные производные 2-(диазабициклоалкил)пиримидона
Следующий патент: Суспензия макрочастиц
Случайный патент: Теплообменник и способ его выполнения