N-(2-арилэтил)бензиламины в качестве антагонистов 5-ht6- рецептора
Номер патента: 7493
Опубликовано: 27.10.2006
Авторы: Шаус Джон Менерт, Маккоуэн Джефферсон Рэй, Фишер Мэттью Джозеф, Жиетлен Брюно, Джиллиг Джеймс Рональд, Кохен Майкл Филип, Чен Заоген, Миллер Шон Кристофер
Формула / Реферат
1. Соединение формулы
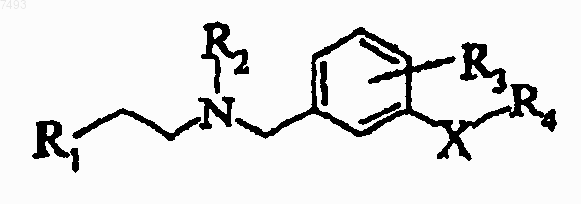
Формула I
где X выбран из группы, состоящей из -O-, -NH-, -S-, -SO2-, -СН2-, -CH(F)-, -СН(ОН)- и -С(O)-;
R1 выбран из группы, состоящей из
незамещенного фенила,
фенила, замещенного группами в количестве от 1 до 3, независимо выбранными из группы, состоящей из водорода, гидрокси, C1-C4алкила, C1-С4алкокси, галогена, бензилокси, карбокси, С1-С4алкоксикарбонила, амидо, N-(С1-С4алкил)амидо, сульфониламидо, циано, трифторметила, трифторметокси, нитро, незамещенного фенила и фенила, замещенного С1-С4алкилом, С1-С4алкокси, галогеном, циано или трифторметилом,
незамещенного нафтила,
нафтила, замещенного группами в количестве 1 или 2, независимо выбранными из группы, состоящей из водорода, C1-С4алкила, C1-С4алкокси, галогена, циано, трифторметила и нитро,
имидазолила и
радикала, выбранного из

где Q1 выбран из группы, состоящей из -O-, -S- и -NRg-, где Rg выбран из группы, состоящей из водорода и С1-С4алкила, и Q2 представляет -N=, Rd, каждый Re и Rf, каждый независимо, выбран из группы, состоящей из водорода, С1-С4алкила, С1-С4алкокси, галогена, циано и трифторметила, или Rd и Re (или один из Re), взятые вместе с атомами, к которым они присоединены, образуют незамещенное бензокольцо или бензокольцо, замещенное заместителями в количестве от 1 до 4, независимо выбранными из группы, состоящей из водорода, гидрокси, С1-С4алкила, С1-С4алкокси, трифторметокси, 2,2,2-трифторэтокси, трифторметила, галогена, карбокси, С1-С4алкоксикарбонила, амидо, N-(С1-С4алкил) амидо, амино, (C1-С4 алкил) амино, ациламино, где ацильная группа выбрана из группы, состоящей из C1-C4алкила и фенила; циано, нитро, сульфониламидо, незамещенного фенила, фенила, замещенного C1-С4алкилом, С1-С4алкокси, галогеном, циано и трифторметилом; фенокси, бензилокси, -NHS(O)2Rh, где Rh выбран из группы, состоящей из С1-С4алкила и фенила; и -S(O)pRi, где р равно 0, 1 или 2 и Ri выбран из группы, состоящей из С1-С4алкила, незамещенного фенила и фенила, замещенного С1-С4алкилом, C1-C4алкокси, галогеном, циано или трифторметилом; и Rf выбран из группы, состоящей из водорода, С1-С4алкила, С1-С4алкокси, трифторметила и галогена;
R2 выбран из группы, состоящей из водорода и C1-С3алкила;
R3 выбран из группы, состоящей из водорода, фтора и метила;
R4 выбран из группы, состоящей из водорода, аллила, С2-С4алкила, н-гексила, фторированного С2-С4алкила, незамещенного фенила, фенила, замещенного группами в количестве от 1 до 3, независимо выбранными из группы, состоящей из водорода, гидрокси, C1-C4алкила, С1-С4алкокси, галогена, бензилокси, карбокси, С1-С4алкоксикарбонила, амидо, N-(C1-C4алкил)амидо, сульфониламидо, циано, трифторметила, трифторметокси, нитро, незамещенного фенила и фенила, замещенного С1-С4алкилом, C1-С4алкокси, галогеном, циано и трифторметилом,
нафтила,
фенилсульфонила, в котором фенильная группа является незамещенной или замещена группами в количестве от 1 до 3, независимо выбранными из группы, состоящей из водорода, С1-С4алкила, С1-С4 алкокси, галогена, циано, трифторметила, нитро и фенила,
бензила, в котором фенильная группа является незамещенной или замещена группами в количестве от 1 до 3, независимо выбранными из группы, состоящей из водорода, С1-С4алкила, С1-С4алкокси, циано, нитро, трифторметила и галогена, и
радикала, выбранного из
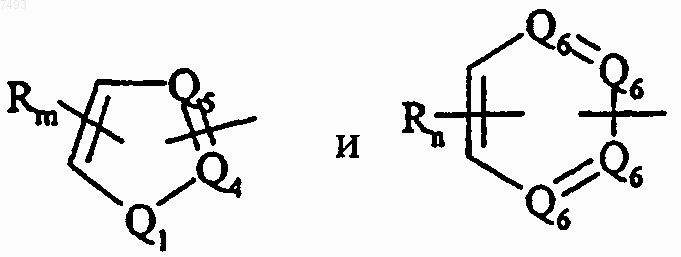
где Q3 выбран из группы, состоящей из -O-, -S- и -NRg-, где Rg выбран из группы, состоящей из водорода и С1-С4алкила, и Q4 и Q5 представляют -CRm-, где каждый Rm независимо выбран из группы, состоящей из водорода, C1-С4алкила, галогена и трифторметила, или один или оба из Q4 и Q5 представляют -N=, и где один или два из Q6 представляют -N=, тогда как другие представляют -CRn, где каждый Rn независимо выбран из группы, состоящей из водорода, C1-С4алкила, C1-С4алкокси, галогена, циано, нитро и трифторметила;
при условии, что R4 не является фенилсульфонилом в том случае, если X представляет -SO2-, -CH2-, -CH(F)-, -СН(ОН)- или -С(O)-, и
его фармацевтически приемлемые соли.
2. Соединение по п.1, где X выбран из группы, состоящей из -О- и -NH-.
3. Соединение по п.2, где X представляет -О-.
4. Соединение по п.3, где R3 представляет водород.
5. Соединение по п.4, где R4 выбран из группы, состоящей из фторированного С2-С4алкила, незамещенного фенила, фенила, замещенного группами в количестве от 1 до 3, независимо выбранными из группы, состоящей из водорода, гидрокси, C1-С4алкила, С1-С4алкокси, галогена, бензилокси, карбокси, С1-С4алкоксикарбонила, амидо, N-(С1-С4алкил) амидо, сульфониламидо, циано, трифторметила, трифторметокси, нитро, незамещенного фенила и фенила, замещенного С1-С4алкилом, C1-С4алкокси, галогеном, циано и трифторметилом.
6. Соединение по п.5, где R1 выбран из группы, состоящей из
незамещенного фенила, фенила, замещенного группами в количестве от 1 до 3, независимо выбранными из группы, состоящей из водорода, гидрокси, С1-С4алкила, C1-C4алкокси, галогена, бензилокси, карбокси, С1-С4алкоксикарбонила, амидо, N-(C1-С4алкил)амидо, сульфониламидо, циано, трифторметила, трифторметокси, нитро, незамещенного фенила и фенила, замещенного С1-С4алкилом, С1-С4алкокси, галогеном, циано и трифторметилом, и
радикала, выбранного из
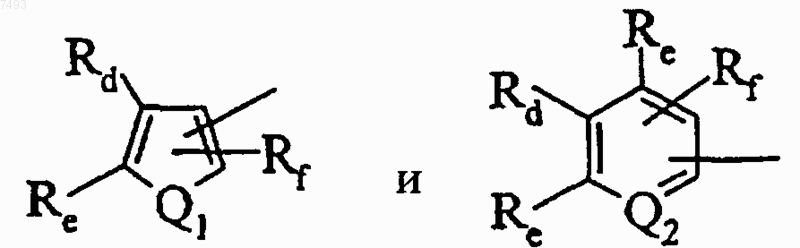
где Q1 выбран из группы, состоящей из -O-, -S- и -NRg-, где Rg выбран из группы, состоящей из водорода и С1-С4алкила, и Q2 представляет -N=, Rd, каждый Re и Rf, каждый независимо, выбран из группы, состоящей из водорода, С1-С4алкила, С1-С4алкокси, галогена, циано и трифторметила, или Rd и Re (или один из Re), взятые вместе с атомами, к которым они присоединены, образуют незамещенное бензокольцо или бензокольцо, замещенное заместителями в количестве от 1 до 4, независимо выбранными из группы, состоящей из водорода, гидрокси, С1-С4алкила, С1-С4алкокси, трифторметокси, 2,2,2-трифторэтокси, трифторметила, галогена, карбокси, C1-С4алкоксикарбониыр, амидо, N-(C1-С4алкил) амидо, амино, (C1-C4 алкил) амино, ациламино, где ацильная группа выбрана из группы, состоящей из С1-С4алкила и фенила; циано, нитро, сульфониламидо, незамещенного фенила, фенила, замещенного С1-С4алкилом, С1-С4алкокси, галогеном, циано и трифторметилом; фенокси, бензилокси, -NHS(O)2Rh, где Rh выбран из группы, состоящей из C1-С4алкила и фенила; и -S(O)pRi, где р равно 0, 1 или 2 и Ri выбран из группы, состоящей из С1-С4алкила и фенила, необязательно замещенного С1-С4алкилом, С1-С4алкокси, галогеном, циано и трифторметилом; и Rf выбран из группы, состоящей из водорода, С1-С4алкила, C1-С4алкокси, трифторметила и галогена.
7. Соединение по п.6, где R1 представляет незамещенный фенил или фенил, замещенный группами в количестве от 1 до 3, независимо выбранными из группы, состоящей из водорода, гидрокси, С1-С4алкила, C1-C4алкокси, галогена, бензилокси, карбокси, С1-С4алкоксикарбонила, амидо, N-(С1-С4алкил) амидо, сульфониламидо, циано, трифторметила, трифторметокси, нитро, незамещенного фенила и фенила, замещенного C1-С4алкилом, С1-С4алкокси, галогеном, циано и трифторметилом.
8. Соединение по п.6, где R1 представляет радикал, выбранный из
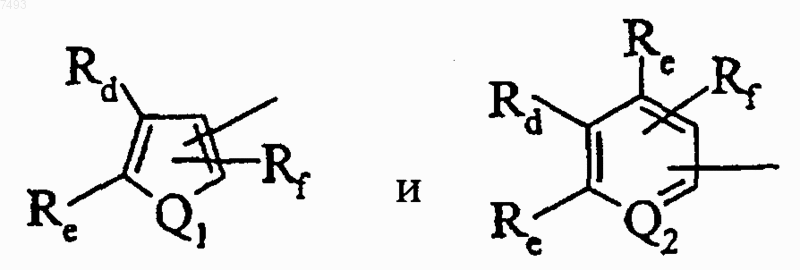
где Q1 выбран из группы, состоящей из -O-, -S- и -NRg-, где Rg выбран из группы, состоящей из водорода и C1-С4алкила, и Q2 представляет -N=, Rd, каждый Re и Rf, каждый независимо, выбран из группы, состоящей из водорода, С1-С4алкила, С1-С4алкокси, галогена, циано и трифторметила, или Rd и Re (или один из Re), взятые вместе с атомами, к которым они присоединены, образуют незамещенное бензокольцо или бензокольцо, замещенное заместителями в количестве от 1 до 4, независимо выбранными из группы, состоящей из водорода, гидрокси, С1-С4алкила, C1-C4алкокси, трифторметокси, 2,2,2-трифторэтокси, трифторметила, галогена, карбокси, C1-С4алкоксикарбонила, амидо, N-(С1-С4алкил) амидо, амино, (С1-С4 алкил)амино, ациламино, где ацильная группа выбрана из группы, состоящей из С1-С4алкила и фенила; циано, нитро, сульфониламидо, незамещенного фенила, фенила, замещенного С1-С4алкилом, C1-С4алкокси, галогеном, циано и трифторметилом; фенокси, бензилокси, -NHS(O)2Rh, где Rh выбран из группы, состоящей из С1-С4алкила и фенила; и -S(O)pRi, где р равно 0, 1 или 2 и Ri выбран из группы, состоящей из С1-С4алкила, незамещенного фенила и фенила, замещенного C1-С4алкилом, С1-С4алкокси, галогеном, циано и трифторметилом; и Rf выбран из группы, состоящей из водорода, С1-С4алкила, С1-С4алкокси, трифторметила и галогена.
9. Соединение по п.8, где R1 представляет незамещенный индол-3-ил или индол-3-ил, замещенный заместителями в количестве от 1 до 4, независимо выбранными из группы, состоящей из водорода, гидрокси, С1-С4алкила, С1-С4алкокси, трифторметокси, 2,2,2-трифторэтокси, трифторметила, галогена, карбокси, С1-С4алкоксикарбонила, амидо, N-(С1-С4алкил)амидо, амино, (С1-С4алкил)амино, ациламино, где ацильная группа выбрана из группы, состоящей из С1-С4алкила и фенила; циано, нитро, сульфониламидо, незамещенного фенила, фенила, замещенного С1-С4алкилом, C1-С4алкокси, галогеном, циано и трифторметилом; фенокси, бензилокси, -NHS(O)2Rh, где Rh выбран из группы, состоящей из C1-С4алкила и фенила; и -S(O)pRi, где р равно 0, 1 или 2 и Ri выбран из группы, состоящей из С1-С4алкила, незамещенного фенила и фенила, замещенного C1-С4алкилом, С1-С4алкокси, галогеном, циано и трифторметилом.
10. Соединение по любому одному из пп.7-9, где R4 представляет незамещенный фенил или фенил, замещенный группами в количестве от 1 до 3, независимо выбранными из группы, состоящей из водорода, гидрокси, C1-C4алкила, С1-С4алкокси, галогена, бензилокси, карбокси, C1-C4алкоксикарбонила, амидо, N-(C1-C4алкил)амидо, сульфониламидо, циано, трифторметила, трифторметокси, нитро, незамещенного фенила и фенила, замещенного C1-С4алкилом, С1-С4алкокси, галогеном, циано или трифторметилом.
11. Соединение по любому одному из пп.7-9, где R4 представляет фторированный С2-С4алкил.
12. Соединение по п.1, где соединение является N-(2-(6-фтор-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламином.
13. Соединение по п.1, где соединение является гидрохлоридом N-(2-(6-фтор-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина.
14. Соединение по п.1, выбранное из группы, состоящей из
N-(2-(5-метокси-6-фтор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтиламино)бензиламина,
N-(2-(5-метокси-6-фтор-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропиламино)бензиламина,
N-(2-(5-метокси-6-фтор-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-метокси-6-фтор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-хлор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-хлор-1Н-индол-3-ил)этил)-3-(3-фторпропокси)бензиламина,
N-(2-(5-хлор-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(5-хлор-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-циано-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-метилсульфонил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-циано-1Н-индол-3-ил)этил)-3-(3,3,3-трифторпропокси)бензиламина,
N-(2-(5-метилсульфонил-1Н-индол-3-ил)этил)-3-(3,3,3-трифторпропокси)бензиламина,
N-(2-(4-фтор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(4-фтор-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(4-фтор-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(7-фтор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(7-фтор-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(7-фтор-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-амидо-1Н-индол-3-ил)этил)-3-(3,3,3-трифторпропокси)бензиламина,
N-(2-(5-амидо-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-фенил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-метил-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(6-фенил-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(6-фенил-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-метил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-метил-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-этоксикарбонил-1Н-индол-3-ил)этил)-3-(2,2,2,3-тетрафторпропокси)бензиламина,
N-(2-(6-этоксикарбонил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-циано-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-циано-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-амидо-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-амидо-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-трифторметокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-трифторметокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(7-хлор-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(7-хлор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-трифторметил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-трифторметил-1Н-индол-3-ил)этил)-3-(3,3,3-трифторпропокси)бензиламина,
N-(2-(4-метокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-циано-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-циано-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(5-(4-фторфенил)-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-(4-фторфенил)-1H-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(5-фенил-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-фенил-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(5-(4-фторфенил)-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-фенил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(4-фенил-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(4-фенил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(4-фенил-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(7-фенил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(7-фенил-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-N-метил-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(4-метокси-1Н-индол-3-ил)этил)-N-метил-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(4-фтор-1Н-индол-3-ил)этил)-N-метил-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-фенил-1Н-индол-3-ил)этил)-N-метил-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-карбокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-карбокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-хлор-7-фтор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-хлор-7-фтор-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5,7-дифтор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5,7-дифтор-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6,7-дифтор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6,7-дифтор-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5,6,7-трифтор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5,6,7-трифтор-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(4,5,7-трифтор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(4,5,7-трифтор-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(7-циано-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(7-циано-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-фтор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-фтор-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-(3,3,3-трифторпропокси)бензиламина,
N-(2-(5-фтор-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(4-хлор-5-метокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(4-хлор-5-метокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(4-хлор-5-метокси-1Н-индол-3-ил)этил)-3-(3,3,3-трифторпропокси)бензиламина,
N-(2-(6-фтор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-фтор-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(6-хлор-5-метокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-хлор-5-метокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-фтор-1Н-индол-3-ил)этил)-3-(3,3,3-трифторпропокси)бензиламина,
N-(2-(5-трифторметокси-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(5-трифторметокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-трифторметокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-нитро-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-нитро-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-нитро-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-нитро-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-нитро-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(5-амино-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-амино-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-амино-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-амино-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-пропокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-н-пропиламидо-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-этоксикарбонил-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-фенокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(1H-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(1H-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(5-н-бутиламидо-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-гидрокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-бензилокси-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(6-бензилокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-бензилокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-бутилокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-бутилокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторэтокси)бензиламина,
N-(2-(6-этокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-фенилсульфонилокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-фенилсульфонилокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-бутилокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-гидрокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-гидрокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-гидрокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-гидрокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-карбокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-3-(3-фторпропокси)бензиламина,
N-(2-(6-фтор-1Н-индол-3-ил)этил)-3-(3-фторпропокси)бензиламина,
N-(2-(6-фтор-1Н-индол-3-ил)этил)-3-(2,2-дифторэтокси)бензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-3-(2,2-дифторэтокси)бензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(5-изопропил-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(5-изопропил-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-N-метил-3-(2,2-дифторэтокси)бензиламина,
N-(2-(6-фтор-1Н-индол-3-ил)этил)-N-метил-3-(3-фторпропокси)бензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-N-метил-3-(3-фторпропокси)бензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-N-изопропил-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-N-пропил-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-N-этил-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(6-хлор-5-метокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-хлор-5-метокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(4-хлор-5-метокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(4-хлор-5-метокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-(2-фторэтокси)бензиламина,
N-(2-(6-метокси-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пенафторпропокси)бензиламина,
N-(2-(4-хлор-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(4-метокси-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пенатафторпропокси)бензиламина,
N-(2-(5-метокси-2-метил-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(7-метокси-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(4-метокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-метокси-2-метил-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(7-метокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-метокси-1Н-индол-3-ил)этил)-3-(2-фторэтокси)бензиламина,
N-(2-(4-хлор-1Н-индол-3-ил)этил)-3-(2-фторэтокси)бензиламина,
N-(2-(4-метокси-1Н-индол-3-ил)этил)-3-(2-фторэтокси)бензиламина,
N-(2-(5-метокси-2-метил-1Н-индол-3-ил)этил)-3-(2-фторэтокси)бензиламина,
N-(2-(7-метокси-1Н-индол-3-ил)этил)-3-(2-фторэтокси)бензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-3-(2-фторэтокси)бензиламина,
N-(2-(6-метокси-1Н-индол-3-ил)этил)-3-(2,2-дифторэтокси)бензиламина,
N-(2-(6-фтор-1Н-индол-3-ил)этил)-3-(2-фторэтокси)бензиламина,
N-(2-(4,6-дихлор-5-метокси-1Н-индол-3-ил)этил)-3-(2,2-дифторэтокси)бензиламина,
N-(2-(4-хлор-1Н-индол-3-ил)этил)-3-(2,2-дифторэтокси)бензиламина,
N-(2-(4-метокси-1Н-индол-3-ил)этил)-3-(2,2-дифторэтокси)бензиламина,
N-(2-(5-метокси-2-метил-1Н-индол-3-ил)этил)-3-(2,2-дифторэтокси)бензиламина,
N-(2-(7-метокси-1Н-индол-3-ил)этил)-3-(2,2-дифторэтокси)бензиламина,
N-(2-(6-метокси-1Н-индол-3-ил)этил)-3-(3-фторпропокси)бензиламина,
N-(2-(4-хлор-1Н-индол-3-ил)этил)-3-(3-фторпропокси)бензиламина,
N-(2-(4-метокси-1Н-индол-3-ил)этил)-3-(3-фторпропокси)бензиламина,
N-(2-(5-метокси-2-метил-1Н-индол-3-ил)этил)-3-(3-фторпропокси)бензиламина,
N-(2-(7-метокси-1Н-индол-3-ил)этил)-3-(3-фторпропокси)бензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-3-(3-фторпропокси)бензиламина,
N-(2-(6-метокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(4-хлор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(4-метокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-метокси-2-метил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(7-метокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-метокси-1-метил-1Н-индол-3-ил)этил)-3-(2,2-дифторэтокси)бензиламина,
N-(2-(5-метокси-4,6-дифтор-1-метил-1Н-индол-3-ил)этил)-3-(3-фторпропокси)бензиламина,
N-(2-(5-метокси-4,6-дифтор-1-метил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-метокси-1-метил-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-метокси-1-метил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-трифторметил-1Н-индол-3-ил)этил)-3-(3,3,3-трифторпропокси)бензиламина,
N-(2-(5-фтор-6-хлор-1Н-индол-3-ил)этил)-3-(3,3,3-трифторпропокси)бензиламина,
N-(2-(5,6-дифтор-1Н-индол-3-ил)этил)-3-(3,3,3-трифторпропокси)бензиламина,
N-(2-(5-фтор-6-хлор-1Н-индол-3-ил)этил)-3-(2,2-дифторэтокси)бензиламина,
N-(2-(5,6-дифтор-1Н-индол-3-ил)этил)-3-(2,2-дифторэтокси)бензиламина,
N-(2-(6-трифторметил-1Н-индол-3-ил)этил)-3-(2,2-дифторэтокси)бензиламина,
N-(2-(6-трифторметил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-фтор-6-хлор-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(5,6-дифтор-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(6-трифторметил-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(5,6-дифтор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5,6-дифтор-1Н-индол-3-ил)этил)-3-(3-фторпропокси)бензиламина,
N-(2-(6-трифторметил-1Н-индол-3-ил)этил)-3-(3-фторпропокси)бензиламина,
N-(2-(6-фтор-1-метил-1H-индол-3-ил)этил)-3-(3,3,3-трифторпропокси)бензиламина,
N-(2-(6-фтор-1-метил-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(6-фтор-1-метил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-метил-1Н-индол-3-ил)этил)-3-(2-фторэтокси)бензиламина,
N-(2-(5-фтор-1Н-индол-3-ил)этил)-3-(2-фторэтокси)бензиламина,
N-(2-(5-метил-1Н-индол-3-ил)этил)-3-(2,2-дифторэтокси)бензиламина,
N-(2-(5-фтор-1Н-индол-3-ил)этил)-3-(2,2-дифторэтокси)бензиламина,
N-(2-(5-хлор-1Н-индол-3-ил)этил)-3-(2,2-дифторэтокси)бензиламина,
N-(2-(5-фтор-1Н-индол-3-ил)этил)-3-(4,4,4-трифторбутокси)бензиламина,
N-(2-(5-фтор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-хлор-1Н-индол-3-ил)этил)-3-(4,4,4-трифторбутокси)бензиламина,
N-(2-(5-фтор-1Н-индол-3-ил)этил)-3-(3-фторпропокси)бензиламина,
N-(2-(5-хлор-1Н-индол-3-ил)этил)-3-(3-фторпропокси)бензиламина,
N-(2-(5-метил-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-метил-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(5-метил-1Н-индол-3-ил)этил)-3-(3-фторпропокси)бензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-(4,4,4-трифторбутокси)бензиламина,
N-(2-(5-хлор-1Н-индол-3-ил)этил)-3-(2-фторэтокси)бензиламина,
N-(2-(4,7-дифтор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(4,5,6,7-тетрафтор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-бром-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-бром-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтил)бензиламина,
N-(2-(6-метансульфонил-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-метансульфонил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-бензолсульфонил-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-бензолсульфонил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(6-метокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(7-фтор-1Н-индол-3-ил)этил)-3-(3,3,3-трифторпропокси)бензиламина,
N-(2-(6-бром-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(6-бром-1Н-индол-3-ил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(6-метоксикарбонил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторпропокси)бензиламина,
N-(2-(5-бензамидо-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-бензамидо-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-метилсульфониламино-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-метилсульфониламино-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-изопропил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-изопропил-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-этокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-этокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-(2,2,2-трифторэтокси)-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-(2,2,2-трифторэтокси)-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторэтокси)бензиламина,
N-(2-(5-бутокси-1Н-индол-3-ил)этил)-3-(пирид-2-илокси)бензиламина,
N-(2-(5-бензолсульфонил-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-бензолсульфонил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-этоксикарбонил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-(N'-пропиламидо)-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-(N'-пропиламидо)-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-(N'-бутиламидо)-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(1H-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-бензилокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-бензилокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-фенокси-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-фенокси-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-(пирид-3-илокси)-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(5-(пирид-3-илокси)-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-метил-N-(2-(6-хлор-1Н-индол-3-ил)этил)-3-(2,2-дифторэтокси)бензиламина,
N-(2-(4,7-дифтор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(4,5,6,7-тетрафтор-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(4,7-дифтор-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(4,5,6,7-тетрафтор-1Н-индол-3-ил) этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(7-трифторметил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(7-трифторметил-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(7-нитро-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина и
N-(2-(7-нитро-1Н-индол-3-ил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина.
15. Соединение по п.1, выбранное из группы, состоящей из
N-(2-фенилфенилэтил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(4-фенилфенилэтил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(4-хлорфенил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(3-трифторметилфенил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(3-хлорфенил)этил)-3-(2,2,3,3,3-пентафторэтокси)бензиламина,
N-(2-(3-трифторметилфенил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(3-хлорфенил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(3-трифторметилфенил)этил)-3-(2,2,3,3-тетрафторпропокси)бензиламина,
N-(2-(3-трифторметилфенил)этил)-3-(3,3,3-трифторпропокси)бензиламина,
N-(2-(3-хлорфенил)этил)-3-(3,3,3-трифторпропокси)бензиламина,
N-(2-(3,5-диметоксифенил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(3-хлорфенил)этил)-3-(2-фторэтокси)бензиламина,
N-(2-(3-трифторметилфенил)этил)-3-(2-фторэтокси)бензиламина,
N-(2-(3,5-диметоксифенил)этил)-3-(2-фторэтокси)бензиламина,
N-(2-(3-трифторметил-4-фторфенил)этил)-3-(3,3,3-трифторпропокси)бензиламина,
N-(2-(3-трифторметил-4-фторфенил)этил)-3-(2,2-дифторэтокси)бензиламина,
N-(2-(3-трифторметил-4-фторфенил)этил)-3-(2,2,3,3,3-пентафторпропокси)бензиламина,
N-(2-(3-трифторметил-4-фторфенил)этил)-3-(2,2,2-трифторэтокси)бензиламина и
N-(2-(3-трифторметил-4-фторфенил)этил)-3-(3-фторпропокси)бензиламина.
16. Соединение по п.1, выбранное из группы, состоящей из
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-(3-фторфенокси)бензиламина,
N-(2-(1Н-индол-3-ил)этил)-3-(3-фторфенокси)бензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-(2-фторфенокси)бензиламина,
N-(2-(1H-индол-3-ил)этил)-3-(2-фторфенокси)бензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-(4-фторфенокси)бензиламина,
N-(2-(1H-индол-3-ил)этил)-3-(4-фторфенокси)бензиламина,
N-(2-(5-гидрокси-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-фенокси-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-п-толилокси-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-о-толилокси-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-м-толилокси-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(6-фтор-1Н-индол-3-ил)этил)-2-фтор-3-феноксибензиламина,
N-(2-(6-фтор-1Н-индол-3-ил)этил)-6-фтор-3-феноксибензиламина,
N-метил-N-(2-(5-м-толилокси-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-нитро-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-амино-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-пропокси-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-этоксикарбонил-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-фенил-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-(4-фторфенил)-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(6-фенил-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(6-трифторметил-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(6-фтор-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(6-хлор-5-метокси-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(4-хлор-5-метокси-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(4, 6-дихлор-5-метокси-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(6-метокси-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(4-хлор-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(4-метокси-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-метокси-2-метил-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(7-метокси-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-метокси-4,6-дифтор-1-метил-1Н-индол-3-ил)этил)-3-(2,2,2-трифторэтокси)бензиламина,
N-(2-(5-метил-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-хлор-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-(4-фторфенил)-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-метансульфонил-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-циано-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-метоксикарбонил-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-амидо-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-нитро-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-бутокси-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-бензамидо-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-метилсульфониламино-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-изопропил-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-этокси-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-(2,2,2-трифторэтокси)-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-бензолсульфонил-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-(N'-пропиламидо)-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-(N'-бутиламидо)-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-фенокси-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-метил-N-(2-(5-фенокси-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(6-фтор-1Н-индол-3-ил)этил)-4-фтор-3-феноксибензиламина,
N-(2-(6-фтор-1Н-индол-3-ил)этил)-3-феноксибензиламина,
N-(2-(5-бензилокси-1Н-индол-3-ил)этил)-3-феноксибензиламина и
N-(2-(5-бензилокси-1Н-индол-3-ил)этил)-N-метил-(3-феноксибензил)бензиламина.
17. Соединение по п.1, выбранное из группы, состоящей из
N-(2-(3-хлорфенил)этил)-3-феноксибензиламина,
N-(2-(3-трифторметилфенил)этил)-3-феноксибензиламина,
N-(2-(4-метоксифенил)этил)-3-феноксибензиламина,
N-(2-(3,4-диметоксифенил)этил)-3-феноксибензиламина,
N-(2-(3-метоксифенил)этил)-3-феноксибензиламина,
N-(2-(3,4-дихлорфенил)этил)-3-феноксибензиламина,
N-(2-(3-хлорфенил)этил)-3-(3-трифторметилфенокси)бензиламина,
N-(2-(3-хлорфенил)этил)-3-(4-трет-бутилфенокси)бензиламина,
N-(2-(3-хлорфенил)этил)-3-(4-хлорфенокси)бензиламина,
N-(2-(3-хлорфенил)этил)-3-(4-метоксифенокси)бензиламина,
N-(2-(3-хлорфенил)этил)-3-(4-метилфенокси)бензиламина,
N-(2-(3-хлорфенил)этил)-3-(3,5-дихлорфенокси)бензиламина,
N-(2-(3-хлорфенил)этил)-3-(3,4-дихлорфенокси)бензиламина,
N-(2-фенилэтил)-3-феноксибензиламина,
N-(2-(4-хлорфенил)этил)-3-феноксибензиламина,
N-(2-(3-хлорфенил)этил)-3-(4-фторфенокси)бензиламина,
N-(2-(3-трифторметилфенил)этил)-3-(4-фторфенокси)бензиламина,
N-(2-(3-хлорфенил)этил)-3-(2-фторфенокси)бензиламина,
N-(2-(3-трифторметилфенил)этил)-3-(2-фторфенокси)бензиламина,
N-(2-(3-хлорфенил)этил)-3-(3-фторфенокси)бензиламина,
N-(2-(3-трифторметилфенил)этил)-3-(3-фторфенокси)бензиламина,
N-(2-(2-хлорфенил)этил)-3-фенилоксибензиламина,
N-(2-(3,4-диметоксифенил)этил)-3-феноксибензиламина,
N-(2-(3-хлорфенил)этил)-N-метил-3-феноксибензиламина,
N-(2-(3-хлорфенил)этил)-N-этил-3-феноксибензиламина,
N-(2-(2-фторфенил)этил)-3-феноксибензиламина,
N-(2-(3-фторфенил)этил)-3-феноксибензиламина,
N-(2-(4-хлорфенил)этил)-3-феноксибензиламина,
N-(2-(4-гидроксифенил)этил)-3-феноксибензиламина,
N-(2-(2-метоксифенил)этил)-3-феноксибензиламина,
N-(2-(3-бром-3-метоксифенил)этил)-3-феноксибензиламина,
N-(2-(4-фторфенил)этил)-3-феноксибензиламина,
N-(2-(2-хлорфенил)этил)-3-феноксибензиламина,
N-(2-(4-бромфенил)этил)-3-феноксибензиламина,
N-(2-(4-метилфенил)этил)-3-феноксибензиламина,
N-(2-(3-метоксифенил)этил)-3-феноксибензиламина,
N-(2-(4-метоксифенил)этил)-3-феноксибензиламина,
N-(2-(2-этоксифенил)этил)-3-феноксибензиламина,
N-(2-(4-этоксифенил)этил)-3-феноксибензиламина,
N-(2-(4-феноксифенил)этил)-3-феноксибензиламина,
N-(2-(4-сульфонамидофенил)этил)-3-феноксибензиламина,
N-(2-(3,4-дихлорфенил)этил)-3-феноксибензиламина,
N-(2-(2,5-дихлорфенил)этил)-3-феноксибензиламина,
N-(2-(2,6-дихлорфенил)этил)-3-феноксибензиламина,
N-(2-(2,5-диметоксифенил)этил)-3-феноксибензиламина,
N-(2-(2,3-диметоксифенил)этил)-3-феноксибензиламина,
N-(2-(3,5-диметоксифенил)этил)-3-феноксибензиламина и
N-(2-(3-этокси-4-метоксифенил)этил)-3-феноксибензиламина.
18. Соединение по п.1, выбранное из группы, состоящей из
N-(2-пирид-4-илэтил)-3-феноксибензиламина,
N-(2-пирид-3-илэтил)-3-феноксибензиламина,
N-(2-пирид-3-илэтил)-3-феноксибензиламина,
N-(2-пирид-2-илэтил)-3-феноксибензиламина,
N-(2-имидазол-4-илэтил)-3-феноксибензиламина,
N-(2-нафт-2-илэтил)-3-феноксибензиламина,
N-(2-нафт-1-илэтил)-3-феноксибензиламина и
N-(2-тиен-2-илэтил)-3-феноксибензиламина.
19. Соединение по п.1, выбранное из группы, состоящей из
N-(2-(1Н-индол-3-ил)этил)-3-тиофеноксибензиламина,
N-(2-(1Н-индол-3-ил)этил)-3-фенилсульфонилбензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-тиофеноксибензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-фенилсульфонилбензиламина,
N-(2-(1Н-индол-3-ил)этил)-3-(4-метилтиофенокси)бензиламина,
N-(2-(1H-индол-3-ил)этил)-3-(4-метилфенилсульфонил)бензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-(a -фторбензил)бензиламина,
N-(2-(1Н-индол-3-ил)этил)-3-(a -фторбензил)бензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-(бензил)бензиламина,
N-(2-(1Н-индол-3-ил)этил)-3-(бензил)бензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-(a -гидроксибензил)бензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-(N-фениламино)бензиламина,
N-(2-(1Н-индол-3-ил)этил)-3-(N-фениламино)бензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-(N-бензиламино)бензиламина,
N-(2-(1H-индол-3-ил)этил)-3-(N-бензиламино)бензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-гидроксибензиламина,
N-(2-(1Н-индол-3-ил)этил)-3-гидроксибензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-нафт-1-илоксибензиламина,
N-(2-(1Н-индол-3-ил)этил)-3-нафт-1-илоксибензиламина,
N-(2-5-метокси-1Н-индол-3-ил)-3-нафт-2-илоксибензиламина,
N-(2-(1Н-индол-3-ил)этил)-3-нафт-2-илоксибензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-бензилоксибензиламина,
N-(2-(1Н-индол-3-ил)этил)-3-бензилоксибензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-пиримид-5-илоксибензиламина,
N-(2-(1Н-индол-3-ил)этил)-3-пиримид-5-илоксибензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-пирид-4-илоксибензиламина,
N-(2-(1Н-индол-3-ил)этил)-3-пирид-4-илоксибензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-3-пирид-4-илоксибензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-пирид-3-илоксибензиламина,
N-(2-(1H-индол-3-ил)этил)-3-пирид-3-илоксибензиламина,
N-(2-(5-фтор-1Н-индол-3-ил)этил)-3-пирид-3-илоксибензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-3-пирид-3-илоксибензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-пирид-2-илоксибензиламина,
N-(2-(1Н-индол-3-ил)этил)-3-пирид-2-илоксибензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-3-пирид-2-илоксибензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-тиазол-2-илоксибензиламина,
N-(2-(1Н-индол-3-ил)этил)-3-тиазол-2-илоксибензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-(2,6-дифторсульфонилокси)бензиламина,
N-(2-(1Н-индол-3-ил)этил)-3-(2,6-дифторсульфонилокси)бензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-(пирид-2-иламино)бензиламина,
N-(2-(1H-индол-3-ил)этил)-3-(пирид-2-иламино)бензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-3-(пирид-2-иламино)бензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-(пирид-3-иламино)бензиламина,
N-(2-(1H-индол-3-ил)этил)-3-(пирид-3-иламино)бензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-3-(пирид-3-иламино)бензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-(пирид-4-иламино)бензиламина,
N-(2-(1H-индол-3-ил)этил)-3-(пирид-4-иламино)бензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-3-(пирид-4-иламино)бензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-бензоилбензиламина,
N-(2-(1Н-индол-3-ил)этил)-3-бензоилбензиламина,
N-(2-(6-фтор-1Н-индол-3-ил)этил)-3-(пирид-4-илокси)бензиламина,
N-(2-(6-фтор-1Н-индол-3-ил)этил)-3-(пирид-3-илокси)бензиламина,
N-(2-(3-хлорфенил)этил)-3-тиофеноксибензиламина,
N-(2-(3-хлорфенил)этил)-3-сульфонилфенилбензиламина,
N-(2-фенилэтил)-3-тиофеноксибензиламина,
N-(2-фенилэтил)-3-сульфонилфенилбензиламина,
N-(2-(3-хлорфенил)этил)-3-(4-метилтиофенокси)бензиламина,
N-(2-(3-хлорфенил)этил)-3-сульфонил-4-метилфенилбензиламина,
N-(2-(3-хлорфенил)этил)-3-(N-бензиламино)бензиламина,
N-(2-(3-хлорфенил)этил)-3-(N-фениламино)бензиламина,
N-(2-(3-хлорфенил)этил)-3-(a-гидроксибензил)бензиламина,
N-(2-(3-хлорфенил)этил)-3-бензилбензиламина,
N-(2-(3-хлорфенил)этил)-3-(a-фторбензил)бензиламина,
N-(2-(3-хлорфенил)этил)-3-нафт-2-илоксибензиламина,
N-(2-(3-трифторметилфенил)этил)-3-нафт-2-илоксибензиламина,
N-(2-(3-хлорфенил)этил)-3-нафт-1-илоксибензиламина,
N-(2-(3-трифторметилфенил)этил)-3-нафт-1-илоксибензиламина,
N-(2-(3-хлорфенил)этил)-3-гидроксибензиламина,
N-(2-(3-трифторметилфенил)этил)-3-гидроксибензиламина,
N-(2-(3-трифторметилфенил)этил)-3-бензилоксибензиламина,
N-(2-(3-хлорфенил)этил)-3-(2,4-дифторфенилсульфонилокси)бензиламина,
N-(2-(3-трифторметилфенил)этил)-3-(2,4-дифторфенилсульфонилокси)бензиламина,
N-(2-(3-хлорфенил)этил)-3-тиазол-2-илоксибензиламина,
N-(2-(3-трифторметилфенил)этил)-3-тиазол-2-илоксибензиламина,
N-(2-(3-хлорфенил)этил)-3-пирид-3-илоксибензиламина,
N-(2-(3-трифторметилфенил)этил)-3-пирид-3-илоксибензиламина,
N-(2-(3-метоксифенил)этил)-3-пирид-2-илоксибензиламина,
N-(2-(3-трифторметилфенил)этил)-3-пирид-4-илоксибензиламина,
N-(2-(3-хлорфенил)этил)-3-пиримид-5-илоксибензиламина,
N-(2-(3-трифторметилфенил)этил)-3-пиримид-5-илоксибензиламина,
N-(2-(3-трифторметилфенил)этил)-3-пирид-2-илоксибензиламина,
N-(2-(3-хлорфенил)этил)-3-пирид-3-иламинобензиламина,
N-(2-(3-трифторметилфенил)этил)-3-пирид-3-иламинобензиламина,
N-(2-(3-хлорфенил)этил)-3-пирид-4-иламинобензиламина,
N-(2-(3-трифторметилфенил)этил)-3-пирид-4-иламинобензиламина,
N-(2-(3-хлорфенил)этил)-3-пирид-2-иламинобензиламина,
N-(2-(3-трифторметилфенил)этил)-3-пирид-2-иламинобензиламина,
N-(2-(3-хлорфенил)этил)-3-бензилоксибензиламина,
N-(2-(3-трифторметилфенил)этил)-3-(фениламино)бензиламина,
N-(2-(7-фтор-1Н-индол-3-ил)этил)-3-(пирид-4-илокси)бензиламина,
N-(2-(7-фтор-1Н-индол-3-ил)этил)-3-(пирид-3-илокси)бензиламина,
N-(2-(3-хлорфенил)этил)-3-(пирид-2-илметокси)бензиламина,
N-(2-(3-хлорфенил)этил)-3-(пирид-3-илметокси)бензиламина,
N-(2-(3-хлорфенил)этил)-3-(пирид-4-илметокси)бензиламина,
N-(2-(5-бутокси-1Н-индол-3-ил)этил)-3-(пирид-2-илокси)бензиламина и
N-(2-(6,7-дифтор-1Н-индол-3-ил)этил)-3-(пиридин-4-илокси)бензиламина.
20. Соединение по п.1, выбранное из группы, состоящей из
N-(2-(3-хлорфенил)этил)-3-этоксибензиламина,
N-(2-(3-хлорфенил)этил)-3-пропоксибензиламина,
N-(2-(3-трифторметилфенил)этил)-3-пропоксибензиламина,
N-(2-(3-трифторметилфенил)этил)-3-этоксибензиламина,
N-(2-(5-хлор-1Н-индол-3-ил)этил)-3-этоксибензиламина,
N-(2-(5-хлор-1Н-индол-3-ил)этил)-3-пропоксибензиламина,
N-(2-(5-фтор-1Н-индол-3-ил)этил)-3-пропоксибензиламина,
N-(2-(5-фтор-1Н-индол-3-ил)этил)-3-этоксибензиламина,
N-(2-(5-трифторметил-1Н-индол-3-ил)этил)-3-этоксибензиламина,
N-(2-(5-трифторметил-1Н-индол-3-ил)этил)-3-пропоксибензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-этоксибензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-пропоксибензиламина,
N-(2-(4-хлор-1Н-индол-3-ил)этил)-3-пропоксибензиламина,
N-(2-(4-метокси-1Н-индол-3-ил)этил)-3-пропоксибензиламина,
N-(2-(5-метокси-2-метил-1Н-индол-3-ил)этил)-3-пропоксибензиламина,
N-(2-(7-метокси-1Н-индол-3-ил)этил)-3-пропоксибензиламина,
N-(2-(6-хлор-1Н-индол-3-ил)этил)-3-пропоксибензиламина,
N-(2-(6-фтор-1-метил-1Н-индол-3-ил)этил)-N-метил-3-пропоксибензиламина,
N-(2-(3-трифторметил-4-фторфенил)этил)-3-пропокси-4-метилбензиламина,
N-(2-(5-фтор-6-хлор-1Н-индол-3-ил)этил)-3-пропокси-4-метилбензиламина,
N-(2-(6-фтор-1-метил-1Н-индол-3-ил)этил)-3-пропокси-4-метилбензиламина,
N-(2-(3-хлорфенил)этил)-3-пропоксибензиламина,
N-(2-(3-хлорфенил)этил)-3-бутоксибензиламина,
N-(2-(3-хлорфенил)этил)-3-гексоксибензиламина,
N-(2-(2-фторфенил)этил)-3-пропоксибензиламина,
N-(2-(3-фторфенил)этил)-3-пропоксибензиламина,
N-(2-(4-фторфенил)этил)-3-пропоксибензиламина,
N-(2-(2-хлорфенил)этил)-3-пропоксибензиламина,
N-(2-(4-хлорфенил)этил)-3-пропоксибензиламина,
N-(2-(4-бромфенил)этил)-3-пропоксибензиламина,
N-(2-(4-метилфенил)этил)-3-пропоксибензиламина,
N-(2-(4-гидроксифенил)этил)-3-пропоксибензиламина,
N-(2-(2-метоксифенил)этил)-3-пропоксибензиламина,
N-(2-(3-метоксифенил)этил)-3-пропоксибензиламина,
N-(2-(4-метоксифенил)этил)-3-пропоксибензиламина,
N-(2-(3-этоксифенил)этил)-3-пропоксибензиламина,
N-(2-(4-этоксифенил)этил)-3-пропоксибензиламина,
N-(2-(4-феноксифенил)этил)-3-пропоксибензиламина,
N-(2-(4-сульфонамидофенил)этил)-3-пропоксибензиламина,
N-(2-(3,4-дихлорфенил)этил)-3-пропоксибензиламина,
N-(2-(2,5-дихлорфенил)этил)-3-пропоксибензиламина,
N-(2-(2,6-дихлорфенил)этил)-3-пропоксибензиламина,
N-(2-(3,4-диметоксифенил)этил)-3-пропоксибензиламина,
N-(2-(2,5-диметоксифенил)этил)-3-пропоксибензиламина,
N-(2-(2,3-диметоксифенил)этил)-3-пропоксибензиламина,
N-(2-(3,5-диметоксифенил)этил)-3-пропоксибензиламина,
N-(2-(3-бром-4-метоксифенил)этил)-3-пропоксибензиламина,
N-(2-(3-метокси-4-этоксифенил)этил)-3-пропоксибензиламина,
N-(2-(3-этокси-4-метоксифенил)этил)-3-пропоксибензиламина,
N-(2-(пирид-2-ил)этил)-3-пропоксибензиламина,
N-(2-(пирид-3-ил)этил)-3-пропоксибензиламина,
N-(2-(пирид-4-ил)этил)-3-пропоксибензиламина,
N-(2-(7-метил-1Н-индол-3-ил)этил)-3-пропоксибензиламина,
N-(2-(6-метоки-1Н-индол-3-ил)этил)-3-пропоксибензиламина,
N-(2-(тиен-3-ил)этил)-3-пропоксибензиламина,
N-(2-(5-метил-1Н-индол-3-ил)этил)-3-пропоксибензиламина,
N-(2-(5-метокси-1Н-индол-3-ил)этил)-3-пропоксибензиламина,
N-(2-(3-бромфенил)этил)-3-пропоксибензиламина,
N-(2-(3-метоксикарбонилфенил)этил)-3-пропоксибензиламина и
N-(2-(3-(4-фторфенил)фенил)этил)-3-пропоксибензиламина.
21. Фармацевтическая композиция, включающая соединение по п.1 и фармацевтически приемлемый разбавитель.
22. Способ лечения нарушений, ассоциированных с 5-HT6-рецептором, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения по п.1.
23. Способ по п.22, где нарушение выбрано из группы, состоящей из познавательных нарушений, шизофрении, тревоги и болезни Альцгеймера, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения по п.1.
24. Способ лечения познавательных нарушений, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения по п.1.
25. Способ лечения нарушений памяти, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения по п.1.
26. Способ лечения психоза, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения по п.1.
27. Способ лечения шизофрении, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения по п.1.
28. Способ лечения тревоги, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения по п.1.
29. Применение соединения по п.1 в качестве фармацевтического средства.
30. Применение соединения по п.1 для изготовления лекарственного средства для лечения нарушений, ассоциированных с 5-HT6-рецептором.
31. Применение соединения по п.1 для изготовления лекарственного средства для лечения познавательных нарушений.
32. Применение соединения по п.1 для изготовления лекарственного средства для лечения нарушений памяти.
33. Применение соединения по п.1 для изготовления лекарственного средства для лечения психоза.
34. Применение соединения по п.1 для изготовления лекарственного средства для лечения шизофрении.
35. Применение соединения по п.1 для изготовления лекарственного средства для лечения тревоги.
Текст
007493 Настоящее изобретение относится к области фармацевтической и органической химии и касается соединений, которые являются антагонистами 5-HT6-рецептора. 5-HT6-рецептор является членом суперсемейства рецепторов серотонина, связанных с G-белком, и,подобно 5-НТ 4- и 5-НТ 7-рецепторам, он положительно связан с аденилатциклазой 1. 5-НТ 6-рецептор крысы был впервые клонирован в 19932,3, и сообщение о клонировании гомолога рецептора человека, идентичность последовательности которого с рецептором крысы составляет 89%, было в 19964. Локализацию 5-6 Н 6-рецепторов в мозге крыс изучали с использованием количественного определения мРНК Northernанализом и RT-PCR, иммуногистохимии и ауторадиографии 2,3,5,6,7,8. Данные способы согласованно обнаружили высокие уровни рецептора в обонятельных бугорках, гиппокампе, полосатом теле, ядре прилежания и кортикальных областях. 5-HT6-рецепторы либо отсутствуют, либо присутствуют при очень низких уровнях в периферических тканях 2,3. До сих пор не были известны имеющие высокую аффинность селективные агонисты 5-HT6 рецептора. Сам серотонин имеет только умеренную аффинность к 5-HT6-рецептору (Ki=65 нМ), и наиболее селективный агонист, известный до настоящего времени, N,N-диметил-2-этил-5-метокситриптамин,имеет Ki=81 нМ и только 3,5-кратную селективность по сравнению с 5-НТ 2A-рецептором 9. Большой интерес в последнее время к 5-HT6-рецептору обусловлен наблюдением того, что некоторые психотропные агенты являются антагонистами 5-HT6-рецептора человека 4,10 с высокой аффинностью. Данные соединения включают амитриптилин (Ki=65 нМ) и атипичные антипсихотические агенты клозапин (Ki=9,5 нМ), оланзапин (Ki=10 нМ) и куетиапин (33 нМ). Ни одно из этих соединений, однако,не является селективным. Первыми указанными селективными антагонистами 5-НТ 6-рецептора являютсяRo 04-6790 и Ro 63-0563. Их пригодность ограничивается их умеренной аффинностью (Ki=50 нМ и 12 нМ, соответственно) и слабой фармакокинетикой 11. Описана группа антагонистов 5-HT6-рецептора, достигающая наивысшей точки в SB-27104612. Это соединение имеет высокую аффинность (К=1,2 нМ) и селективность (более чем 200-кратную по сравнению более чем с 55 рецепторами, ферментами и ионными каналами) и имеет 80% биологическую доступность. Для связывания радиолиганда и ауторадиографических исследований 13,14 использовали селективный радиолиганд [125I]-SB-285585. Данные соединения являются полезными средствами для преклинических исследований по 5-HT6-рецептору. Рациональность использования селективных антагонистов 5-HT6-рецептора для лечения расстройства познавательной способности основана на трех типах аргументов: способности селективных антагонистов 5-HT6-рецептора модулировать холинергическую и глутаматергическую нейронную функцию,клинических исследованиях влияния атипичных антипсихотических средств, клозапина и оланзапина, на познавательную функцию, активности селективных антагонистов 5-HT6-рецептора при исследовании на животных моделях познавательной функции. Селективные антагонисты 5-HT6-рецептора модулируют холинергическую и глутаматергическую нейронную функцию. Холинергические и глутаматергические нейронные системы играют важные роли в познавательной функции. Известно, что холинергические нейронные пути являются важными для появления и укрепления памяти. Действие антихолинергических агентов на центральную нервную систему ослабляет познавательную функцию у животного и в клинических исследованиях, и потеря холинергических нейронов является одним из характерных признаков болезни Альцгеймера. И, наоборот, известно,что стимуляция холинергической функции улучшает познавательную способность, и только два агента, в настоящее время разрешенные для лечения познавательного дефицита при болезни Альцгеймера, такрин и донепезил, оба, являются ингибиторами ацетилхолинэстеразы. Известно также, что глутаматергическая система в префронтальной коре головного мозга принимает участие в познавательной функции 26,27. Показано, что блокирование функции 5-НТ 6-рецептора вызывает прохолинергические эффекты invivo. Введение (icv) крысам антисмысловых олигонуклеотидов, прицельно направленных на последовательность 5-HT6-рецептора, вызывало поведенческую реакцию зевоты и потягивания, которую блокировали холинергическим антагонистом атропином 15. Селективный антагонист 5-HT6-рецептора Ro 04-6790 вызывал поведенческую реакцию потягивания дозозависимым способом. Эту реакцию блокировали действующими на центральную нервную систему антихолинергическими агентами скополамином и атропином, но не метилскополамином, при дозах, которые, как известно, являются периферически селективными 16. Было известно также, что Ro 04-6790 блокирует вращательную поведенческую реакцию, индуцированную введением скополамина крысам с односторонними повреждениями эфферентной связи черного вещества с полосатым телом 6-OH-DA. Он не блокировал вращательную реакцию, вызванную L-DOPA или амфетамином 17. Ro 04-6790 реверсировал индуцированные скополамином дефициты действия в тесте узнавания объекта, модели познавательной функции. Другой селективный антагонист 5-HT6 рецептора, SB-271046, потенцировал поведенческую реакцию зевоты, индуцированную ингибитором холинэстеразы физостигмином 18. Данные исследования позволили предположить, что блокирование 5HT6-рецептора облегчает холинергическую передачу. При изучении микродиализа in vivo SB-271046 (10 мг/кг, sc) повышал высвобождение глутамата в префронтальной коре головного мозга посредством нейронного механизма 25. Проводили клинические исследования влияния атипичных антипсихотических агентов, клозапина и оланзапина, на познавательную функцию. Атипичные антипсихотические агенты клозапин и оланзапин-1 007493 являются, оба, имеющими высокую аффинность, хотя и не селективными, антагонистами 5-HT6 рецептора 6. С другой стороны, рисперидон и типичный антипсихолитический агент галоперидол не проявляют значительную аффинность к 5-HT6-рецептору. Клинические различия, обнаруживаемые с этими группами лекарственных средств, могут быть приписаны блокаде 5-HT6-рецептора. Goldberg et al. сообщили об отсутствии целебного познавательного действия при лечении клозапином в небольшом (N=15) исследовании устойчивых к лечению шизофреников 19. В противоположность этому, Meltzer et al.20 в обширном исследовании устойчивых к лечению шизофреников (N=36) наблюдали улучшения в некоторых областях нейропсихологической функции через шесть недель и шесть месяцев после начала лечения клозапином. У неустойчивых к лечению шизофреников клозапин был более эффективным, чем плацебо при улучшении познавательной функции при нескольких измерениях 21. Такое действие обнаружили через шесть месяцев, и оно сохранялось на всем протяжении изучения в течение 12 месяцев. Влияние оланзапина, рисперидона и галоперидола на познавательную функцию сравнивали в проводимом в нескольких центрах исследовании шизофреников двойным слепым способом 22. Оланзапиновая группа обнаружила статистически значимое улучшение познавательной функции по сравнению с лечением галоперидолом или рисперидоном. Такое действие было очевидным после 6 недель лечения и продолжалось на протяжении 54 недель исследования. Исследования на животных позволили предположить, что эти действия могут быть опосредованы через высвобождение ацетилхолина в префронтальной коре головного мозга 23. Активность селективных антагонистов 5-HT6-рецептора изучали на животной модели познавательной функции. Вместе с последней разработкой селективных антагонистов 5-HT6-рецептора Ro-04-6790 иSB-271046 появилось несколько сообщений по активности данных соединений на моделях познавательной функции. Селективный антагонист 5-HT6-рецептора SB-271046 улучшал поведение в водном лабиринте Морриса 24. Эти результаты согласуются с заключением, что постоянное введение icv антисмысловых олигонуклеотидов, направленных к последовательности 5-HT6-рецептора, приводит к улучшениям в некоторых аспектах поведения в водном лабиринте Морриса 16. Лечение SB-271046 также привело к улучшениям в испытании на поведение или ответ на пространственное чередование у старых крыс 24. Соединения настоящего изобретения являются селективными, имеющими высокую аффинность антагонистами 5-HT6 и, таким образом, обеспечивают ценное лечение заболеваний, опосредованных 5-HT6 рецептором. Ссылки предпосылок создания изобретения 1. Branchek, Т. A., et al. (2000). Annu Rev Pharmacol Toxicol 40: 319-34. 2. Monsma, F. J., Jr., et al. (1993). Mol Pharmacol 43(3): 320-7. 3. Ruat, M., et al. (1993). Biochem Biophys Res Commun 193(1): 268-76. 4. Kohen, R., et al. (1996). J Neurochem 66(1): 47-56. 5. Ward, R. P., et al. (1996). J Comp Neurol 370(3): 405-14. 6. Ward, R. P., et al. (1995). Neuroscience 64(4): 1105-11. 7. Gerard, C, et al. (1997). Brain Res 746(1-2): 207-19. 8. Gerard, C, et al. (1996). Synapse 23(3): 164-73. 9. Glennon, R. A., et al. (2000). J Med Chem 43(5): 1011-8. 10. Roth, B. L., et al. (1994). J Pharmacol Exp Ther 268(3): 1403-10. 11. Sleight, A. J., et al. (1998). Br J Pharmacol 124(3): 556-62. 12. Routledge, C., et al. (2000). Br. J. Pharmacol. 130(7): 1606. 13. Hirst, W. D., et al. (1999). Br. J. Pharmacol. Suppl.(in press). 14. Hirst, W. D., et al. (2000). Br. J. Pharmacol. 130: 1597. 15. Bourson, A., et al. (1995). J Pharmacol Exp Ther 274(1): 173-80. 16. Bentley, J. C., et al. (1999). Br J Pharmacol 126(7): 1537-42. 17. Bourson, A., et al. (1998). Br J Pharmacol 125(7); 1562-6. 18. Routledge, C., et al. (1999). Br. J. Pharmacol. 127(Suppl.): 21P. 19. Goldberg, T. E., et al. (1993). Br J Psychiatry 162: 43-8. 20. Hagger, C., et al. (1993). Biol Psychiatry 34(10): 702-12. 21. Lee, M. A., et al. (1994). J Clin Psychiatry 55 Suppl B: 82-7. 22. Purdon, S. E., et al. (2000). Arch Gen Psychiatry 57(3): 249-58. 23. Parada, M. A., et al. (1997). J Pharmacol Exp Ther 281 (1) : 582-8. 24. Rogers, D. C., et al. (1999). Br J Pharmacol 127(suppl.): 22P. 25. Dawson, L. A., et al. (2000). Br J Pharmacol 130(1): 23-6. 26. Dudkin, K. N., et al. (1996). Neurosci Behav Physiol 26(6); 545-51. 27. Koechlin, E., et al. (1999). Nature 399(6732): 148-51. Настоящее изобретение предлагает соединения формулы I:R1 выбран из группы, состоящей из незамещенного фенила,фенила, замещенного группами в количестве от 1 до 3, независимо выбранными из группы, состоящей из водорода, гидрокси, С 1-С 4 алкила, С 1-С 4 алкокси, галогена, бензилокси, карбокси, С 1 С 4 алкоксикарбонила, амидо, N-(С 1-С 4 алкил) амидо, сульфониламидо, циано, трифторметила, трифторметокси, нитро, незамещенного фенила и фенила, замещенного С 1-С 4 алкилом, С 1-С 4 алкокси, галогеном,циано или трифторметилом,незамещенного нафтила,нафтила, замещенного группами в количестве 1 или 2, независимо выбранными из группы, состоящей из водорода, C1-С 4 алкила, С 1-С 4 алкокси, галогена, циано, трифторметила и нитро,имидазолила, и радикала, выбранного из где Q1 выбран из группы, состоящей из -O-, -S- и -NRg-, где Rg выбран из группы, состоящей из водорода и С 1-С 4 алкила, и Q2 представляет -N=, Rd, каждый Re и Rf, каждый независимо, выбран из группы,состоящей из водорода, С 1-С 4 алкила, С 1-С 4 алкокси, галогена, циано и трифторметила, или Rd и Re (или один из Re), взятые вместе с атомами, к которым они присоединены, образуют незамещенное бензокольцо или бензокольцо, замещенное заместителями в количестве от 1 до 4, независимо выбранными из группы, состоящей из водорода, гидрокси, С 1-С 4 алкила, С 1-С 4 алкокси, трифторметокси, 2,2,2 трифторэтокси, трифторметила, галогена, карбокси, С 1-С 4 алкоксикарбонила, амидо, N-(С 1-С 4 алкил) амидо, амино, (С 1-С 4 алкил) амино, ациламино, где ацильная группа выбрана из группы, состоящей из С 1-С 4 алкила и фенила; циано, нитро, сульфониламидо, незамещенного фенила, фенила, замещенного С 1-С 4 алкилом, С 1-С 4 алкокси, галогеном, циано и трифторметилом; фенокси, бензилокси, -NHS(O)2Rh, где Rh выбран из группы, состоящей из С 1-С 4 алкила и фенила; и -S(O)pRi, где р равно 0, 1 или 2 и Ri выбран из группы, состоящей из С 1-С 4 алкила, незамещенного фенила и фенила, замещенного С 1-С 4 алкилом, С 1-С 4 алкокси, галогеном, циано или трифторметилом; и Rf выбран из группы, состоящей из водорода, С 1-С 4 алкила, С 1-С 4 алкокси, трифторметила и галогена;R2 выбран из группы, состоящей из водорода и C1-С 3 алкила;R4 выбран из группы, состоящей из водорода, аллила, С 2-С 4 алкила, н-гексила, фторированного С 2 С 4 алкила, незамещенного фенила, фенила, замещенного группами в количестве от 1 до 3, независимо выбранными из группы, состоящей из водорода, гидрокси, С 1-С 4 алкила, С 1-С 4 алкокси, галогена, бензилокси, карбокси, С 1-С 4 алкоксикарбонила, амидо, N-(С 1-С 4 алкил) амидо, сульфониламидо, циано, трифторметила, трифторметокси, нитро, незамещенного фенила и фенила, замещенного С 1-С 4 алкилом, C1-C4 алкокси, галогеном, циано и трифторметилом,нафтила,фенилсульфонила, в котором фенильная группа является незамещенной или замещена группами в количестве от 1 до 3, независимо выбранными из группы, состоящей из водорода, С 1-С 4 алкила, С 1-С 4 алкокси, галогена, циано, трифторметила, нитро и фенила,бензила, в котором фенильная группа является незамещенной или замещена группами в количестве от 1 до 3, независимо выбранными из группы, состоящей из водорода, C1-C4 алкила, С 1-С 4 алкокси, циано,нитро, трифторметила, и галогена, и радикала, выбранного из где Q3 выбран из группы, состоящей из -O-, -S- и -NRg-, где Rg выбран из группы, состоящей из водорода и C1-C4 алкила, и Q4 и Q5 представляют -CRm-, где каждый Rm независимо выбран из группы, состоящей из водорода, C1-C4 алкила, галогена и трифторметила, или один или оба из Q4 и Q5 представляют-N=, и где один или два из Q6 представляют -N=, тогда как другие представляют -CRn, где каждый Rn независимо выбран из группы, состоящей из водорода, С 1-С 4 алкила, С 1-С 4 алкокси, галогена, циано, нитро и трифторметила; при условии, что R4 не является фенилсульфонилом в том случае, если X представляет -SO2-, -СН 2-,-CH(F)-, -СН(ОН)- или -С(O)-, и его фармацевтически приемлемые соли. Предпочтительны соединения, в которых R4 выбран из группы, состоящей из-3 007493 фторированного С 2-С 4 алкила,незамещенного фенила,фенила, замещенного группами в количестве от 1 до 3, независимо выбранными из группы, состоящей из водорода, гидрокси, С 1-С 4 алкила, C1-C4 алкокси, галогена, бензилокси,карбокси, С 1-С 4 алкоксикарбонила, амидо, N-(С 1-С 4 алкил) амидо, сульфониламидо, циано, трифторметила, трифторметокси, нитро, незамещенного фенила и фенила, замещенного С 1-С 4 алкилом, С 1 С 4 алкокси, галогеном, циано и трифторметилом. Более предпочтительны соединения, в которых R1 выбран из группы, состоящей из незамещенного фенила,фенила, замещенного группами в количестве от 1 до 3, независимо выбранными из группы, состоящей из водорода, гидрокси, С 1-С 4 алкила, С 1-С 4 алкокси, галогена, бензилокси, карбокси, C1-C4 алкоксикарбонила, амидо, N-(С 1-С 4 алкил) амидо, сульфониламидо, циано, трифторметила, трифторметокси, нитро, незамещенного фенила и фенила, замещенного C1-C4 алкилом, С 1-С 4 алкокси, галогеном, циано и трифторметилом, и радикала, выбранного из где Q1 выбран из группы, состоящей из -O-, -S- и -NRg-, где Rg выбран из группы, состоящей из водорода и С 1-С 4 алкила, и Q2 представляет -N=, Rd, каждый Re и Rf, каждый независимо, выбран из группы,состоящей из водорода, С 1-С 4 алкила, C1-C4 алкокси, галогена, циано и трифторметила, или Rd и Re (или один из Re), взятые вместе с атомами, к которым они присоединены, образуют незамещенное бензокольцо или бензокольцо, замещенное заместителями в количестве от 1 до 4, независимо выбранными из группы, состоящей из водорода, гидрокси, С 1-С 4 алкила, С 1-С 4 алкокси, трифторметокси, 2,2,2 трифторэтокси, трифторметила, галогена, карбокси, С 1-С 4 алкоксикарбонила, амидо, N-(С 1-С 4 алкил) амидо, амино, (С 1-С 4 алкил) амино, ациламино, где ацильная группа выбрана из группы, состоящей из С 1-С 4 алкила и фенила; циано, нитро, сульфониламидо, незамещенного фенила, фенила, замещенного С 1-С 4 алкилом, С 1-С 4 алкокси, галогеном, циано и трифторметилом; фенокси, бензилокси, -NHS(O)2Rh, где Rh выбран из группы, состоящей из С 1-С 4 алкила и фенила; и -S(O)pRi, где р равно 0, 1 или 2 и Ri выбран из группы, состоящей из С 1-С 4 алкила и фенила, необязательно замещенного С 1-С 4 алкилом, С 1-С 4 алкокси,галогеном, циано и трифторметилом; и Rf выбран из группы, состоящей из водорода, С 1-С 4 алкила, С 1-С 4 алкокси, трифторметила и галогена. Еще более предпочтительны соединения, в которых R1 представляет незамещенный фенил или фенил, замещенный группами в количестве от 1 до 3, независимо выбранными из группы, состоящей из водорода, гидрокси, С 1-С 4 алкила, С 1-С 4 алкокси, галогена, бензилокси, карбокси, С 1-С 4 алкоксикарбонила,амидо, N-(C1-С 4 алкил)амидо, сульфониламидо, циано, трифторметила, трифторметокси, нитро, незамещенного фенила и фенила, замещенного С 1-С 4 алкилом, С 1-С 4 алкокси, галогеном, циано и трифторметилом; или соединения, в которых R1 представляет радикал, выбранный из где Q1 выбран из группы, состоящей из -O-, -S- и -NRg-, где Rg выбран из группы, состоящей из водорода и С 1-С 4 алкила, и Q2 представляет -N=, Rd, каждый Re и Rf, каждый независимо, выбран из группы,состоящей из водорода, С 1-С 4 алкила, С 1-С 4 алкокси, галогена, циано и трифторметила, или Rd и Re (или один из Re), взятые вместе с атомами, к которым они присоединены, образуют незамещенное бензокольцо или бензокольцо, замещенное заместителями в количестве от 1 до 4, независимо выбранными из группы, состоящей из водорода, гидрокси, С 1-С 4 алкила, С 1-С 4 алкокси, трифторметокси, 2,2,2-трифторэтокси, трифторметила, галогена, карбокси, С 1-С 4 алкоксикарбонила, амидо, N-(С 1-С 4 алкил) амидо, амино, (С 1-С 4 алкил) амино, ациламино, где ацильная группа выбрана из группы, состоящей из С 1-С 4 алкила и фенила; циано, нитро, сульфониламидо, незамещенного фенила, фенила, замещенного С 1-С 4 алкилом, С 1 С 4 алкокси, галогеном, циано и трифторметилом; фенокси, бензилокси, -NHS(O)2Rh, где Rh выбран из группы, состоящей из С 1-С 4 алкила и фенила; и -S(O)pRi, где р равно 0, 1 или 2 и Ri выбран из группы,состоящей из С 1-С 4 алкила, незамещенного фенила и фенила, замещенного С 1-С 4 алкилом, С 1-С 4 алкокси,галогеном, циано и трифторметилом; и Rf выбран из группы, состоящей из водорода, С 1-С 4 алкила, С 1 С 4 алкокси, трифторметила и галогена. Наиболее предпочтительны соединения, в которых R1 представляет незамещенный индол-3-ил или индол-3-ил, замещенный заместителями в количестве от 1 до 4, независимо выбранными из группы, со-4 007493 стоящей из водорода, гидрокси, С 1-С 4 алкила, С 1-С 4 алкокси, трифторметокси, 2,2,2-трифторэтокси, трифторметила, галогена, карбокси, С 1-С 4 алкоксикарбонила, амидо, N-(C1-С 4 алкил)амидо, амино, (С 1-С 4 алкил) амино, ациламино, где ацильная группа выбрана из группы, состоящей из C1-C4 алкила и фенила; циано, нитро, сульфониламидо, незамещенного фенила, фенила, замещенного С 1-С 4 алкилом, С 1-С 4 алкокси, галогеном, циано и трифторметилом; фенокси, бензилокси, -NHS(О)2Rh, где Rh выбран из группы,состоящей из С 1-С 4 алкила и фенила; и -S(O)pRi, где р равно 0, 1 или 2 и Ri выбран из группы, состоящей из С 1-С 4 алкила, незамещенного фенила и фенила, замещенного С 1-С 4 алкилом, С 1-С 4 алкокси, галогеном,циано и трифторметилом; или соединения, в которых R4 представляет незамещенный фенил или фенил, замещенный группами в количестве от 1 до 3, независимо выбранными из группы, состоящей из водорода, гидрокси, С 1-С 4 алкила,С 1-С 4 алкокси, галогена, бензилокси, карбокси, C1-C4 алкоксикарбонила, амидо, N-(C1-C4 алкил)амидо,сульфониламидо, циано, трифторметила, трифторметокси, нитро, незамещенного фенила и фенила, замещенного С 1-С 4 алкилом, С 1-С 4 алкокси, галогеном, циано или трифторметилом. Настоящее изобретение предлагает также новые фармацевтические композиции, включающие соединение формулы I и фармацевтически приемлемый разбавитель. Поскольку соединения формулы I являются антагонистами 5-HT6-рецептора, соединения формулы I являются полезными для лечения различных нарушений. Таким образом, в другом варианте осуществления настоящего изобретения предложены способы лечения нарушений, ассоциированных с 5-HT6, включающие введение пациенту, нуждающемуся в этом, эффективного количества соединения формулы I. То есть настоящее изобретение предлагает использовать соединение формулы I и его фармацевтических композиций для лечения нарушений, ассоциированных с 5-HT6. Более конкретно, настоящее изобретение предлагает способ лечения нарушений, выбранных из группы, состоящей из познавательных нарушений,связанного с возрастом познавательного нарушения, умеренной познавательной недостаточности, нарушений настроения (в том числе депрессии, мании, биполярных расстройств), психозов (особенно, шизофрении), тревоги (особенно включая генерализованное тревожное нарушение, паническое нарушение и навязчивое компульсивное нарушение), идиопатической и индуцированной лекарственным средством болезни Паркинсона, эпилепсии, судорог, мигрени (в том числе головной боли типа мигрени), синдрома отмены вещества (в том числе таких веществ, как опиаты, никотин, табачные продукты, алкоголь, бензодиазепины, кокаин, седативные средства, снотворные средства и т.д.), нарушений сна (в том числе нарколепсии), дефицита внимания/расстройства, выражающегося в гиперактивности, кондуктивного нарушения, нарушений способности к обучению, деменции (в том числе деменции, обусловленной болезнью Альцгеймера и СПИДом), хореи Хантингтона, познавательного нарушения после хирургической операции на сердце с шунтированием и трансплантацией, удара, церебральной ишемии, травмы спинного мозга, перинатальной гипоксии, остановки сердца и гипогликемического нейронного повреждения, васкулярной деменции, полиинфарктной деменции, бокового амиотрофического склероза и рассеянного склероза, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения формулы I. Кроме того, настоящее изобретение предлагает также способ получения соединений формулы I и их промежуточных продуктов. Используемые в данном описании следующие термины имеют указанные значения. Термин C1-С 3 алкил относится к неразветвленной или разветвленной алкильной цепи, имеющей от одного до трех атомов углерода, и включает метил, этил, пропил и изопропил. Термин необязательно замещенный фенил относится к радикалу формулы где Ra представляет от 1 до 3 групп, независимо выбранных из группы, состоящей из водорода, гидрокси, С 1-С 4 алкила, С 1-С 4 алкокси, галогена, бензилокси, карбокси, С 1-С 4 алкоксикарбонила, амидо, N(С 1-С 4 алкил) амидо, сульфониламидо, циано, трифторметила, трифторметокси, нитро и фенила, необязательно замещенного C1-C4 алкилом, C1-C4 алкокси, галогеном, циано и трифторметилом. Термин необязательно замещенный нафтил относится к радикалу формулы где Rc представляет 1 или 2 группы, независимо выбранные из группы, состоящей из водорода, С 1 С 4 алкила, C1-C4 алкокси, галогена, циано, трифторметила и нитро. Термин необязательно замещенный 5- или 6-членный моноциклический ароматический гетероцикл, имеющий один гетероатом, выбранный из группы, состоящей из азота, кислорода и серы, причем указанный 5- или 6-членный моноциклический ароматический гетероцикл необязательно является бензоконденсированным, относится к радикалам формулы где Q1 выбран из группы, состоящей из -O-, -S- и -NRg-, где Rg выбран из группы, состоящей из водорода и С 1-С 4 алкила, и Q2 представляет -N=, Rd, каждый Re и Rf, каждый независимо, выбран из группы,состоящей из водорода, С 1-С 4 алкила, С 1-С 4 алкокси, галогена, циано и трифторметила, или Rd и Re (или один из Re), взятые вместе с атомами, к которым они присоединены, образуют бензокольцо, которое необязательно замещено 1-4 заместителями, независимо выбранными из группы, состоящей из водорода,гидрокси, C1-C4 алкила, С 1-С 4 алкокси, трифторметокси, 2,2,2-трифторэтокси, трифторметила, галогена,карбокси, C1-С 4 алкоксикарбонила, амидо, N-(C1-С 4 алкил) амидо, амино, (C1-С 4 алкил) амино, ациламино,где ацильная группа выбрана из группы, состоящей из С 1-С 4 алкила и фенила; циано, нитро, сульфониламидо, фенила, необязательно замещенного С 1-С 4 алкилом, С 1-С 4 алкокси, галогеном, циано и трифторметилом; фенокси, бензилокси, -NHS(O)2Rh, где Rh выбран из группы, состоящей из С 1-С 4 алкила и фенила; и -S(O)pRi, где р равно 0, 1 или 2 и Ri выбран из группы, состоящей из C1-С 4 алкила и фенила, необязательно замещенного С 1-С 4 алкилом, C1-C4 алкокси, галогеном, циано и трифторметилом; и Rf выбран из группы, состоящей из водорода, C1-С 4 алкила, C1-C4 алкокси, трифторметила и галогена. Термин конкретно включает фурил, тиенил, пирролил, пиридил, бензофурил, бензотиенил, индолил и хинолинил; каждый из которых необязательно замещен, как описано выше. Термин фторированный С 1-С 4 алкил относится к неразветвленной или разветвленной алкильной цепи, имеющей от двух до четырех атомов углерода и замещенной одним или несколькими атомами фтора. Термин включает 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 3-фторпропил, 3,3-дифторпропил, 3,3,3-трифторпропил, 2,2,3,3,3-пентафторпропил, 2,2,3,3-тетрафторпропил, 4,4,4-трифторбутил,3,3,4,4,4-пентафторбутил и тому подобное. Термин необязательно замещенный фенилсульфонил относится к радикалу формулы где Rj представляет от 1 до 3 групп, независимо выбранных из группы, состоящей из водорода, С 1 С 4 алкила, С 1-С 4 алкокси, галогена, циано, трифторметила, нитро и фенила. Термин необязательно замещенный бензил относится к радикалу формулы где Rk представляет от 1 до 3 групп, независимо выбранных из группы, состоящей из водорода, С 1 С 4 алкила, С 1-С 4 алкокси, циано, нитро, трифторметила и галогена. Термин необязательно замещенный 5- или 6-членный моноциклический ароматический гетероцикл, имеющий один или два гетероатома, выбранных из группы, состоящей из азота, кислорода и серы, относится к радикалам формулы где Q3 выбран из группы, состоящей из -O-, -S- и -NRg-, где Rg выбран из группы, состоящей из водорода и С 1-С 4 алкила, и Q4 и Q5 представляют -CRm-, где каждый Rm независимо выбран из группы, состоящей из водорода, С 1-С 4 алкила, галогена и трифторметила, или один или оба из Q4 и Q5 представляют-N=, и где один или два из Q6 представляют -N=, тогда как другие представляют -CRn, где каждый Rn независимо выбран из группы, состоящей из водорода, C1-С 4 алкила, С 1-С 4 алкокси, галогена, циано, нитро и трифторметила. Термин конкретно включает фурил, тиенил, тиазолил, пиразолил, имидазолил,триазолил, оксазолил, тиазолил, изоксазолил, тиоизоксазолил, пиридил, пиримидил, пиридазинил и пиразидинил, каждый из которых необязательно замещен, как описано выше. Термин С 1-С 4 алкил относится к неразветвленной или разветвленной алкильной цепи, имеющей от одного до четырех атомов углерода, и включает метил, этил, пропил, изопропил, бутил, втор-бутил,изобутил и трет-бутил. Термин С 2 С 4 алкил относится к неразветвленной или разветвленной алкильной цепи, имеющей от двух до четырех атомов углерода, и включает этил, пропил, изопропил, бутил, втор-бутил, изобутил и трет-бутил. Термин C1-С 4 алкокси относится к неразветвленной или разветвленной алкильной цепи, имеющей от одного до четырех атомов углерода и присоединенной к атому кислорода, и включает метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси и трет-бутокси.-6 007493 Термин галоген относится к атому хлора, фтора, брома или иода. Термин фармацевтически приемлемая аддитивная соль относится к кислотно-аддитивной соли. Соединения формулы I или II и промежуточные соединения, описанные в настоящем изобретении,образуют фармацевтически приемлемые кислотно-аддитивные соли с большим числом органических и неорганических кислот и включают физиологически приемлемые соли, которые часто используют в фармацевтической химии. Такие соли также являются частью изобретения. Фармацевтически приемлемую аддитивную соль получают из фармацевтически приемлемой кислоты, которая хорошо известна в данной области. Такие соли включают фармацевтически приемлемые соли, перечисленные в Journal ofPharmaceutical Science, 66, 2-19 (1977), которые известны специалистам в данной области. Типичные неорганические кислоты, используемые для получения таких солей, включают хлористоводородную, бромистоводородную, иодистоводородную, азотную серную, фосфорную, гипофосфорную, метафосфорную,пирофосфорную и тому подобное. Можно также использовать соли, полученные из органических кислот,таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые и гидроксиалкандиовые кислоты, алифатические и ароматические сульфоновые кислоты. Такие фармацевтически приемлемые соли, таким образом, включают хлорид, бромид, иодид, нитрат,ацетат, фенилацетат, трифторацетат, акрилат, аскорбат, бензоат, хлорбензоат, динитробензоат, гидроксибензоат, метоксибензоат, метилбензоат, о-ацетоксибензоат, изобутират, фенилбутират, -гидроксибутират, бутилен-1,4-дикарбоксилат, гексин-1,4-дикарбоксилат, капрат, каприлат, циннамат, цитрат,формиат, фумарат, гликолят, гептаноат, гиппурат, лактат, малат, малеат, гидроксималеат, малонат, манделат, мезилат, никотинат, изоникотинат, оксалат, фталат, терефталат, пропиолат, пропионат, фенилпропионат, салицилат, себацат, сукцинат, суберат, бензолсульфонат, п-бромбензолсульфонат, хлорбензолсульфонат, этилсульфонат, 2-гидроксиэтилсульфонат, метилсульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, нафталин-1,5-дисульфонат, п-толуолсульфонат, ксилолсульфонат, тартрат и тому подобное. Как и в случае любой группы фармацевтически активных соединений, некоторые группы являются предпочтительными в их конечной возможности применения. Предпочтительные варианты осуществления настоящего изобретения приводятся для соединений формулы I ниже. Соединения, у которых X выбран из группы, состоящей из -O-, -NH- и -S-, являются предпочтительными, причем более предпочтительными являются соединения, у которых X представляет -O-. Соединения, у которых R1 представляет необязательно замещенный фенил или необязательно замещенный 5- или 6-членный моноциклический ароматический гетероцикл, имеющий один гетероатом,выбранный из группы, состоящей из азота, кислорода и серы, причем указанный 5- или 6-членный моноциклический ароматический гетероцикл необязательно бензоконденсирован, являются предпочтительными. Когда R1 представляет необязательно замещенный фенил, предпочтительными заместителями являются 1-3 группы, независимо выбранные из группы, состоящей из водорода, С 1-С 4 алкила, галогена,бензилокси, карбокси, C1-C4 алкоксикарбонила, амидо, N-(С 1-С 4 алкил)амидо, сульфониламидо, циано,трифторметила, трифторметокси, нитро и фенила, необязательно замещенного C1-C4 алкилом, С 1-С 4 алкокси, галогеном, циано и трифторметилом. Когда R1 представляет необязательно замещенный фенил, более предпочтительными заместителями являются 1-3 группы, независимо выбранные из группы, состоящей из водорода, С 1-С 4 алкила, галогена,циано и трифторметила. Соединения, у которых R3 представляет водород или фтор, являются предпочтительными. Среди соединений, у которых R1 представляет необязательно замещенный 5- или 6-членный моноциклический ароматический гетероцикл, имеющий один гетероатом, выбранный из группы, состоящей из азота, кислорода и серы, причем 5- или 6-членный моноциклический ароматический гетероцикл является необязательно бензоконденсированным, соединения, которые являются бензоконденсированными,являются предпочтительными, причем соединение с индолилом является предпочтительным и с индол-3 илом является еще более предпочтительным. Когда R1 представляет индол-3-ил, предпочтительные группы изображены как радикал ниже:a) R0 выбран из группы, состоящей из водорода и С 1-С 4 алкила, причем водород является более предпочтительным;b) Rp выбран из группы, состоящей из водорода и С 1-С 4 алкила, причем водород является более предпочтительным;c) Rq выбран из группы, состоящей из водорода, С 1-С 4 алкила, C1-C4 алкокси и галогена, причем водород является более предпочтительным;d) Rq' выбран из группы, состоящей из водорода, С 1-С 4 алкила, C1-C4 алкокси, трифторметокси, 2,2,2 трифторэтокси, трифторметила, галогена и -S(O)pRi, где р равно 2 и Ri представляет фенил, необязательно замещенный С 1-С 4 алкилом, С 1-С 4 алкокси, трифторметилом, причем более предпочтительным является галоген;e) Rq выбран из группы, состоящей из водорода, С 1-С 4 алкила, С 1-С 4 алкокси, галогена, нитро, циано,трифторметила и -S(O)pRi, где р равно 2 и Ri представляет фенил, необязательно замещенный С 1 С 4 алкилом, причем более предпочтительным является галоген; иf) Rq выбран из группы, состоящей из водорода, С 1-С 4 алкила, С 1-С 4 алкокси, галогена, трифторметила, циано и нитро, причем более предпочтительными являются водород и галоген. Предпочтительными являются соединения, у которых R4 выбран из группы, состоящей из С 2 С 4 алкила, фторированного С 2-С 4 алкила и необязательно замещенного фенила. Когда R4 представляет С 2-С 4 алкил, особенно предпочтительные группы включают пропил, изопропил и бутил. Когда R4 представляет фторированный С 2-С 4 алкил, предпочтительные группы включают 2,2-дифторэтил, 2,2,2-трифторэтил, 3-фторпропил, 3,3-дифторпропил, 3,3,3-трифторпропил, 2,2,3,3,3-пентафторпропил и 2,2,3,3-тетрафторпропил. Когда R4 представляет необязательно замещенный фенил, предпочтительные группы включают 1-3 группы, независимо выбранные из группы, состоящей из водорода, С 1-С 4 алкила, C1-С 4 алкокси, галогена,циано и трифторметила. Предпочтительные варианты осуществления настоящего изобретения приводятся для соединений формулы II ниже. Соединения, у которых R7 представляет необязательно замещенный фенил или необязательно замещенный 5- или 6-членный моноциклический ароматический гетероцикл, имеющий один гетероатом,выбранный из группы, состоящей из азота, кислорода и серы, причем 5- или 6-членный моноциклический ароматический гетероцикл является необязательно бензоконденсированным, являются предпочтительными. Когда R7 является необязательно замещенным фенилом, предпочтительными заместителями являются 1-3 группы, независимо выбранные из группы, состоящей из водорода, С 1-С 4 алкила, C1-C4 алкокси,галогена, циано, трифторметокси и трифторметила. Среди соединений, у которых R7 представляет необязательно замещенный 5- или 6-членный моноциклический ароматический гетероцикл, имеющий один гетероатом, выбранный из группы, состоящей из азота, кислорода и серы, причем 5- или 6-членный моноциклический ароматический гетероцикл является необязательно бензоконденсированным, соединения, которые являются бензоконденсированными,являются предпочтительными, причем индолил является предпочтительным и индол-3-ил является еще более предпочтительным, индол-3-ил, изображенный выше для формулы I, является более предпочтительным. Предпочтительные соединения формулы II, имеющие положения присоединения, показаны ниже: Хотя изображены только соединения формулы I, по указанным, приведенным ниже схемам А и В,получают соединения формул I и II. В приведенных ниже схемах все заместители, если не оговорено особо, имеют указанные выше значения, и все исходные вещества и реагенты являются хорошо известными и признанными в данной области и легко доступными или полученными описанными в данном описании способами. На приведенной ниже схеме видно, что можно использовать защитные группы, где это необходимо, для получения фрагмента соединений формул I или II. Выбор, использование и удаление подходящих защитных групп хорошо известны и принимаются во внимание в данной области (Protecting Groups in Organic Synthesis, Theodora Greene (Wiley-Interscience. На схеме А представлены альтернативные способы получения соединений формулы I восстановительным аминированием. В одном альтернативном варианте схемы А, стадия а, подходящее соединение формулы (I) контактирует с подходящим соединением формулы (2) в реакции восстановительного аминирования с получением соединения формулы I. Подходящим соединением формулы (1) является соединение, у которого R1 и R2 являются такими, как требуется в конечном продукте формулы I, или превращаются в группы, требуемые в конечном продукте формулы.I. Подходящим соединением формулы (2) является соединение, у которого X, R3 и R4 являются такими, как требуется в конечном продукте формулы I, или превращаются в группы, требуемые в конечном продукте формулы I. В другом альтернативном варианте схемы А, стадия а, подходящее соединение формулы (3) контактирует с подходящим соединением формулы (4) в реакции восстановительного аминирования с получением соединения формулы I. Подходящим соединением формулы (3) является соединение, у которогоR1 и R2 являются такими, как требуется в конечном продукте формулы I, или превращаются в группы,требуемые в конечном продукте формулы I. Подходящим соединением формулы (4) является соединение, у которого X, R3 и R4 являются такими, как требуется в конечном продукте формулы I, или превращаются в группы, требуемые в конечном продукте формулы I. Восстановительное аминирование, изображенное на схеме А, стадия а, можно проводить в различных условиях, например, гидрированием с использованием подходящего катализатора или с использованием подходящего восстанавливающего агента. Например, подходящий амин формулы (1) контактирует с подходящим альдегидом формулы (2)(или альтернативно, подходящий амин (4) с подходящим альдегидом формулы (3 и подходящим восстанавливающим агентом с получением соединения формулы I. Реакцию проводят в подходящем растворителе, таком как метанол, этанол, тетрагидрофуран или смесь метанола или этанола и тетрагидрофурана, дихлорметан и 1,2-дихлорэтан. Реакцию можно проводить в присутствии осушающего агента, такого как сульфат натрия, сульфат меди(II) или молекулярные сита. Реакцию проводят в присутствии приблизительно от 1 до 20 молярных эквивалентов подходящего восстанавливающего агента, такого как боргидрид натрия, цианоборгидрид натрия и триацетоксиборгидрид натрия. Может быть выгодно провести образование основания Шиффа перед добавлением подходящего восстанавливающего агента. Когда используют цианоборгидрид натрия, может быть выгодно контролировать и регулировать рН во время реакции, как это известно в данной области. Реакцию обычно проводят при температурах от 0 С до температуры дефлегмации. Обычно для реакций требуется от 1 до 72 ч. Продукт можно выделить и очистить способами, хорошо известными в данной области, такими как фильтрование, экстракция, растирание с растворителем, хроматография и перекристаллизация. По схеме А, необязательная стадия b, не показана, кислотно-аддитивную соль соединения формулыI получают с использованием фармацевтически приемлемой кислоты. Получение кислотно-аддитивной соли является хорошо известным и признанным в данной области. формула I На схеме В изображены альтернативные способы получения соединений формулы I образованием и восстановлением амида. В одном альтернативном варианте, схема В, стадия а, показано контактирование подходящего соединения формулы (1) с подходящим соединением формулы (5) по реакции образования амида с получением соединения формулы (6) . Подходящим соединением формулы (1) является соединение, описанное на схеме А. Подходящим соединением формулы (5) является соединение, у которого А представляет активирующую группу, имеющую форму галогенангидрида кислоты, активированного сложного эфира,активированного амида или ангидрида, и X, R3 и R4 являются такими, какие требуются в конечном продукте формулы I, или превращаются в группы, нужные в конечном продукте формулы I. В другом альтернативном варианте, схема В, стадия а, показано контактирование подходящего соединения формулы (7) с подходящим соединением формулы (4) в реакции образования амина с получением соединения формулы (8) . Подходящим соединением формулы (7) является соединение, у которого А представляет активирующую группу, как описано выше, и R1 имеет значение, которое требуется в конечном продукте формулы I. Подходящим соединением формулы (4) является соединение, описанное на схеме А. Подходящие соединения формул (4) и (7) обычно доступны из коммерческих источников, и их можно также получить способами, описанными в настоящем изобретении, и способами, описанными в данной области. Реакцию образования амида, показанную на схеме В, стадия а, выполняют несколькими способами,легко доступными для специалиста в данной области, в том числе способами, которые обычно проводят для синтеза пептидов. Такие способы реакций можно проводить для кислоты, галогенангидрида кислоты, активированных сложных эфиров, активированных амидов и ангидридов. Например, для облегчения образования амида можно использовать хорошо известные реагенты сочетания, такие как карбодиимиды, с использованием или без использования хорошо известных добавок,таких как N-гидроксисукцинимид, 1-гидроксибензотриазол и т.д. Для таких реакций сочетания обычно используют приблизительно от 1 до 1,5 молярного отношения кислоты, амина и реагента сочетания и реакции обычно проводят в инертном апротонном растворителе, таком как пиридин, диметилформамид,дихлорметан, хлороформ, 1,2-дихлорэтан, ацетонитрил, тетрагидрофуран и тому подобное. В таких реакциях сочетания может быть выгодно использовать подходящее основание, такое как триэтиламин илиN,N-диизопропилэтиламин. Реакцию, предпочтительно, проводят при температуре приблизительно от 0 С до приблизительно 60 С до завершения реакции, которая обычно протекает в пределах от 1 до приблизительно 48 ч. После завершения реакции продукт можно выделить и очистить способами, хорошо известными в данной области, такими как фильтрование, экстракция, выпаривание, растирание с растворителем, хроматография и перекристаллизация. Аальтернативно, в реакции можно использовать, например, галогенангидрид кислоты. Может быть выгодно использовать подходящее основание для улавливания кислоты, образующейся во время реакции, подходящие основания включают, например, триэтиламин, N,N-диизопропилэтиламин, Nметилморфолин, пиридин и тому подобное. В типичном случае используют приблизительно от 1 до 1,5 молярное отношение галогенангидрида кислоты и амина. Реакцию можно проводить в различных инертных апротонных растворителях, таких как пиридин, диметилформамид, дихлорметан, хлороформ, 1,2- 10007493 дихлорметан, ацетонитрил, тетрагидрофуран и тому подобное. Реакцию предпочтительно проводят при температуре приблизительно от 0 С до приблизительно 60 С до завершения реакции, которая обычно протекает в пределах от 1 до приблизительно 12 ч. После завершения реакции продукт можно выделить и очистить способами, хорошо известными в данной области, такими как фильтрование, экстракция, выпаривание, растирание с растворителем, хроматография и перекристаллизация. Альтернативно, в реакции можно использовать, например, ангидрид (либо симметричный, либо смешанный). Такие ангидриды получают различными способами, известными в данной области. В типичном случае используют приблизительно от 1 до 1,5 молярных эквивалентов ангидрида и амина. Может быть выгодно использовать подходящее основание для улавливания кислоты, образующейся во время реакции. Подходящие основания включают, например, триэтиламин, N,N-диизопропилэтиламин, Nметилморфолин, пиридин, карбонат натрия, карбонат калия, бикарбонат натрия и тому подобное. Реакцию можно проводить в различных растворителях. Реакцию, предпочтительно, проводят при температуре приблизительно от 0 С до приблизительно 60 С до завершения реакции, которая обычно протекает в пределах от 1 до приблизительно 12 ч. После завершения реакции продукт можно выделить и очистить способами, хорошо известными в данной области, такими как фильтрование, экстракция, выпаривание,растирание с растворителем, хроматография и перекристаллизация. На схеме В, стадия b, приведено восстановление соединения формулы (6) или (8) с получением соединения формулы I. Например, соединение формулы (6) или (8) контактирует с подходящим восстанавливающим агентом с получением соединения формулы I. Подходящими восстанавливающими агентами являются агенты, которые способны восстановить амид в амин, они включают борановые реагенты, такие как комплекс боран-диметилсульфид, реагенты гидридного переноса, такие как гидрид алюминия и литийалюминийгидрид и тому подобное. Реакцию проводят в растворителе, таком как тетрагидрофуран или диэтиловый эфир, в типичном случае с использованием от 1 до 10 эквивалентов восстанавливающего агента. Реакцию обычно проводят при температуре приблизительно от 0 С до температуры дефлегмации выбранного растворителя, в типичном случае она протекает в течение от 1 до приблизительно 48 ч. Продукт можно выделить и очистить способами, хорошо известными в данной области, такими как резкое охлаждение, фильтрование, экстракция, выпаривание, растирание с растворителем, хроматография и перекристаллизация. По схеме В, в качестве необязательной стадии, не показанной, получают кислотно-аддитивную соль соединения формулы I с использованием фармацевтически приемлемой кислоты. Получение кислотноаддитивных солей хорошо известно и принято в данной области. На схемах А и В, в качестве необязательной стадии, которая должна быть понятна специалисту в данной области, соединение формулы I, в которой R1 представляет водород, можно алкилировать с получением соединения, у которого R2 не является водородом. Способы алкилирования таких вторичных аминов хорошо известны в данной области и будут обсуждаться в приведенной ниже схеме С, стадия с. На схемах А и В, как должно быть понятно специалисту в данной области, соединения формулы II получают также способами, описанными на схемах А и В, с использованием приведенных ниже соединений формул (9) и (10): Подходящим соединением формулы (9) является соединение, у которого Y, R5 и R6 имеют значения, нужные для конечного продукта формулы II, и подходящим соединением формулы (10) является соединение, в котором А является активирующей группой, как описано выше, и Y, R5 и R6 имеют значения, нужные для конечного продукта формулы II. Исходное вещество для схем А и В получают, как указано на приведенных ниже схемах. На приведенных ниже схемах все заместители, если не оговорено особо, имеют указанные ранее значения, и все исходные материалы и реагенты хорошо известны и приняты в настоящей области. На схеме С описаны способы получения соединений формулы (1). На схеме С, стадия а, показана реакция подходящего альдегида формулы (24) и нитрометана с получением соединения формулы (25). Подходящий альдегид формулы (24) является альдегидом, в котором R1 имеет значения, которые нужны для конечного продукта формулы I. Реакция аниона нитрометана с альдегидами с получением нитроолефинов хорошо известна и принята в настоящей области. ModernSynthetic Reactions, H.O. House (2nd ed. The Benjamin/Cummings Publishing Company 1972). Например, подходящий альдегид формулы (24) конденсируют с нитрометаном с получением соединения формулы (25). В типичном случае реакцию проводят в присутствии избытка нитрометана. Реакцию проводят в подходящем растворителе, таком как тетрагидрофуран, нитрометан и диметилсульфоксид. Реакцию проводят с использованием приблизительно от 1,1 до приблизительно 3 молярных эквивалентов подходящего основания, такого как бис(триметилсилил)амид натрия, трет-бутоксид калия,гидрид натрия, ацетат натрия, триэтиламин, N,N-диизопропилэтиламин, солей аммония, таких как ацетат аммония. Реакцию проводят при температуре приблизительно от -20 С до температуры дефлегмации выбранного растворителя, для ее проведения обычно требуется от 6 ч до 48 ч. Продукт реакции сочетания можно выделить и очистить с использованием способов, известных в данной области, включая экстракцию, выпаривание, хроматографию и перекристаллизацию. На схеме С, стадия b, показано восстановление соединения формулы (25) с получением соединения формулы (1), в которой R2 представляет водород. Например, подходящее соединение формулы (25) гидрируют над подходящим катализатором, таким как никель Ренея или палладиевый катализатор. Когда используют никель Ренея, реакцию проводят в подходящем растворителе, таком как этанол, метанол, вода и их смеси. Может быть выгодно проводить гидрирование в кислой среде, например, с использованием хлористоводородной или серной кислоты. Когда используют палладиевый катализатор, предпочтительным является палладий на угле, и реакцию проводят в подходящем растворителе, таком как этанол, метанол, тетрагидрофуран, вода и их смеси. Может быть выгодно проводить гидрирование в кислой среде, например, с использованием хлористоводородной кислоты, трифторуксусной кислоты или серной кислоты. Реакцию обычно проводят при температурах от температуры окружающей среды до 70 С. Реакцию проводят с водородом при давлениях от 15 фунт/кв. дюйм до 120 (от 103 до 821 кПа) фунт/кв. дюйм в аппаратуре, предназначенной для проведения реакций под давлением, такой как аппарат Парра для гидрирования. Продукт можно выделить осторожным удалением катализатора фильтрованием и выпариванием. Продукт можно очистить экстракцией, выпариванием, растиранием с растворителем, хроматографией и перекристаллизацией. Альтернативно, например, подходящее соединение формулы (25) контактирует с подходящим восстанавливающим агентом. Подходящие восстанавливающие агенты включают реагенты гидридного переноса, такие как гидрид алюминия и литийалюминийгидрид и тому подобное. Реакцию проводят в растворителе, таком как тетрагидрофуран или диэтиловый эфир, в типичном случае с использованием от 1 до 10 эквивалентов восстанавливающего агента. Реакцию обычно проводят при температуре приблизительно от 0 С до температуры дефлегмации выбранного растворителя, в типичном случае ее проводят в течение от 1 до приблизительно 48 ч. Продукт можно выделить и очистить способами, хорошо известными в данном изобретении, такими как гашение, фильтрование, экстракция, выпаривание, растирание с растворителем, хроматография и перекристаллизация. Кроме того, подходящее соединение формулы (25) можно восстановить в две стадии в соединение формулы (1) . Например, винильную группу соединения формулы (25) можно восстановить с использованием реагентов, таких как боргидрид натрия. В типичном случае реакцию проводят с использованием избытка боргидрида в растворителе, таком как метанол, этанол, изопропанол, вода и тому подобное. Промежуточное 2-нитроэтилсоединение можно выделить и очистить способами, хорошо известными в данной области, такими как гашение, фильтрование, экстракция, выпаривание, растирание с растворителем, хроматография и перекристаллизация. Промежуточное 2-нитроэтилсоединение можно затем восстановить с использованием различных способов, таких как гидрирование и реагенты гидридного пере- 12007493 носа, как описано выше. Кроме того, промежуточное 2-нитроэтилсоединение можно восстановить с использованием металлов, таких как цинк, с получением требуемого амина формулы (I), в которой R2 представляет водород. На схеме С, стадия с, показано необязательное алкилирование соединения формулы (I), в которойR2 не является водородом. Например, соединение формулы (1), в которой R2 представляет водород, контактирует с подходящим алкилирующим агентом. Подходящим алкилирующим агентом является агент, который превращает группу R2 в группу, нужную для конечного продукта формулы I. Подходящие алкилирующие агенты включают C1-С 3 алкилгалогениды. Реакцию проводят в подходящем растворителе, таком как диоксан,тетрагидрофуран, смеси тетрагидрофуран/вода или ацетонитрил. Реакцию проводят в присутствии от 1,0 до 6,0 молярных эквивалентов подходящего основания, такого как карбонат натрия, бикарбонат натрия,карбонат калия, бикарбонат калия, триэтиламин или N,N-диизопропилэтиламин. Реакцию обычно проводят при температурах от 78 С до температуры дефлегмации растворителя. Для проведения реакции обычно требуется от 1 до 72 ч. Продукт можно выделить и очистить способами, хорошо известными в данной области, такими как экстракция, выпаривание, растирание с растворителем, хроматография и перекристаллизация. Альтернативно, например, соединение формулы (I), в которой R2 представляет водород, подвергают восстановительному аминированию с альдегидом или кетоном, которое дает соединение формулы (1), в которой R2 не является водородом. Подходящие альдегиды включают формальдегид, ацетальдегид, пропиональдегид и ацетон. Реакцию проводят, как описано на схеме А, стадия а. В другом альтернативном случае, например, соединение формулы (1), в которой R2 представляет водород, подвергают реакции образования амида или карбамата с последующим восстановлением с получением соединения формулы (1), в которой R2 не является водородом. Подходящие альдегиды включают формальдегид, ацетальдегид, пропиональдегид и ацетон. Реакцию проводят, как описано на схеме А, стадия а. На схеме С, стадии d и е, показан альтернативный подход к получению соединений формулы (1) через образование амида с использованием подходящего соединения формулы (7) и подходящего амина формулы (26) с последующим восстановлением полученного амида формулы (27) для получения соединения формулы (1). Подходящее соединение формулы (7) является таким, как описано на схеме В. Подходящим амином формулы (26) является амин, который дает R2, нужный в конечном соединении I. Специалист в данной области должен знать, что многие амиды формулы (27) являются коммерчески доступными и применяемыми в данной области. Образование амида и восстановление по схеме С проводят, как описано на схеме В. На схеме D описаны способы получения соединений формулы (I), в которой R1 представляет необязательно замещенный индол-3-ил. Схема D На схеме D, стадия а, показана двухстадийная реакция подходящего индола формулы (28) с оксалилхлоридом, затем с подходящим амином формулы (26) R2NH2 с получением соединения формулы (29). Подходящим индолом формулы (28) является индол, у которого Z' представляет необязательные заместители на индоле в положениях 2 и 4-7, как описано в конечном продукте формулы I. Подходящий амин формулы (26) является таким, как описано на приведенной выше схеме С. Например, подходящий индол формулы (28) контактирует приблизительно с 1-2 молярными эквивалентами оксалилхлорида с получением промежуточного хлорангидрида кетокислоты. Реакцию проводят в подходящем растворителе, таком как диэтиловый эфир или тетрагидрофуран. Реакцию обычно проводят при температурах от 0 до 40 С и время реакции обычно составляет от 6 до 48 ч. Промежуточный продукт, хлорангидрид кетокислоты, можно выделить и очистить с использованием способов, хорошо известных в данной области, включая экстракцию, выпаривание, хроматографию и перекристалли- 13007493 зацию. Промежуточный продукт, хлорангидрид кетокислоты, обычно используют сразу после выделения. Промежуточный продукт, хлорангидрид кетокислоты, контактирует с подходящим амином R2NH2,как указано выше, и с использованием методик, описанных выше. На схеме D, стадия b, показано восстановление соединения формулы (29) с образованием соединения формулы (1), в которой R1 представляет необязательно замещенный индол-3-ил. Например, соединение формулы (29) восстанавливают с использованием восстанавливающего реагента, такого как литийалюминийгидрид, получая соединение формулы (1), в которой R1 представляет необязательно замещенный индол-3-ил. Реакцию проводят в растворителе, таком как тетрагидрофуран или диэтиловый эфир, в типичном случае с использованием от 1 до 12 молярных эквивалентов восстанавливающего агента. Реакцию обычно проводят при температуре приблизительно от 0 С до температуры дефлегмации выбранного растворителя, реакцию в типичном случае проводят в течение от 12 до приблизительно 48 ч. Продукт можно выделить и очистить способами, хорошо известными в данной области, таких как быстрое охлаждение, фильтрование, экстракция, выпаривание, растирание с растворителем,хроматография и перекристаллизация. На схеме D, стадия с, подходящий индол формулы (28) формилируют, получая соединение формулы (30) . Подходящий индол формулы (28) является индолом, описанным на указанной выше стадии а. Например, подходящий индол формулы (28) подвергают взаимодействию с подходящим реагентом формильного переноса, таким как реагент Вильсмайера, полученным из диметилформамида. Обычно используют приблизительно 1 молярный эквивалент реагента формильного переноса. Взаимодействие проводят в подходящем растворителе, таком как бензол, диметилформамид, тетрагидрофуран или диэтиловый эфир. Взаимодействие проводят при температуре приблизительно от -70 С до приблизительно 20 С, для проведения взаимодействия обычно требуется от 1 до 6 ч. Продукт реакции можно выделить и очистить с использованием методик, хорошо известных в данной области. Эти методики включают экстракцию, выпаривание, хроматографию и перекристаллизацию. На схеме D, стадия d, подходящий индол формулы (28) контактирует с (СН 3)2N-CH=CH-NO2 с получением соединения формулы (30). Подходящий индол формулы (28) является индолом, описанным на приведенной выше стадии а. Например, подходящий индол формулы (28) подвергают взаимодействию с 1-диметиламино-2 нитроэтиленом. Обычно используют приблизительно эквимолярные количества реагентов. Взаимодействие проводят в подходящем растворителе, таком как трифторуксусная кислота или дихлорметан, содержащем приблизительно от 2 до 15 эквивалентов трифторуксусной кислоты. Взаимодействие проводят при температуре приблизительно от -70 С до приблизительно 20 С, обычно требуется от 1 до 24 ч. Продукт реакции можно выделить и очистить с использованием методик, хорошо известных в данной области. Эти методики включают экстракцию, выпаривание, хроматографию и перекристаллизацию. На схеме D, стадии е и f, показано взаимодействие альдегида формулы (30) с получением нитроолефина формулы (31) и восстановление нитроолефина с получением соединения формулы (1), в которой R1 представляет необязательно замещенный индол-3-ил. Указанные стадии можно проводить с использованием способов, описанных на схеме С. Как должно быть понятно специалисту в данной области, на не показанных стадиях азот индола соединения (1) можно заместить, как необходимо, используя подходящие аминозащитные группы, с получением соединений, у которых R1 представляет 1-замещенный индол-3-ил. Кроме того, как должно быть понятно специалисту в данной области, на стадиях, описанных схемой С, группы R2, которые не являются водородом, можно ввести различными способами. На схеме Е описаны способы получения соединений формулы (2), в которой X представляет -Оили -S-. Схема Е- 14007493 На схеме Е, стадия а, показано образование ацеталя подходящего соединения формулы (11) с получением соединения формулы (12). Подходящим соединением формулы (11) является соединение, в котором X и R3 имеют значения, нужные для конечного соединения формулы I. Такие реакции образования ацеталей легко выполняются способами, хорошо известными в данной области. (Protecting Groups in Organic Synthesis, Theodora Greene (Wiley-Interscience. Например, соединение формулы (11) контактирует при кислотном катализе с подходящим спиртом,HOR. Подходящий спирт является спиртом, который образует ацеталь, который является стабильным в реакции стадии b и который можно удалить на стадии с с получением соединения формулы (2). Подходящие спирты включают метанол, этанол, пропанол, 1,3-пропандиол, этиленгликоль и тому подобное. На схеме Е, стадия b, подходящее соединение формулы (11), (12) или (14) подвергают взаимодействию с реагентом переноса группы R4, как необходимо, получая соединение формулы (2), (13) или (15),соответственно. Подходящими соединениями формул (11), (12) и (14) являются соединения, у которых X и R3 имеют значения, нужные для конечного продукта формулы I. Различные реагенты, которые переносят R4, имеющий значения, нужные в конечном продукте, являются доступными и подходящими для взаимодействия, указанного на схеме Е. Такие реагенты включают галогенпиридины, галогенпиридин-Nоксиды, аллилгалогениды, С 2-С 4 алканолы, С 2-С 4 алкилгалогениды и -сульфонаты, фторированные С 2 С 4 алканолы, фторированные С 2-С 4 алкилгалогениды и -сульфонаты, необязательно замещенный фенил,имеющий, по меньшей мере, один атом фтора или хлора, необязательно замещенные фенилсульфонилгалогениды или ангидриды и необязательно замещенные бензилгалогениды. Например, когда подходящим реагентом переноса группы R4 является галогенид, сульфонат или ангидрид, подходящее соединение формулы (11), (12) или (14) сочетают в основной среде, получая соединение формулы (2), (13) или (15), соответственно. Взаимодействие проводят в подходящем растворителе,таком как ацетонитрил, диметилформамид, диметилацетамид, тетрагидрофуран, пиридин и диметилсульфоксид. Взаимодействие проводят в присутствии приблизительно от 1 до приблизительно 3 молярных эквивалентов подходящего основания, такого как гидрид калия, гидроксид натрия, гидрид натрия,карбонат натрия, карбонат калия, карбонат цезия, N,N-диизопропилэтиламин, триэтиламин и тому подобное. Взаимодействие проводят при температуре приблизительно от -30 С до приблизительно 110 С,для его проведения обычно требуется от 6 до 48 ч. Продукт реакции можно выделить и очистить с использованием методик, хорошо известных в данной области. Такие методики включают экстракцию,выпаривание, хроматографию и перекристаллизацию. Конечно, когда используют галогенпиридин-N-оксид, N-оксид удаляют восстановлением с образованием R4, имеющего значения, необходимые для конечного продукта формулы I. Такие восстановления легко выполняются специалистом в данной области, они включают каталитическое восстановление над палладиевыми катализаторами с использованием водорода или формиата аммония в подходящем растворителе, таком как метанол, этанол, вода и их смеси. Альтернативно, когда, например, подходящим реагентом переноса R4 является алканол, сочетание можно проводить в условиях реакции Мицунобу, которые хорошо известны в данной области. Взаимодействие проводят в подходящем растворителе, таком как тетрагидрофуран и диэтиловый эфир, с использованием фосфина, такого как триэтилфосфин или связанный со смолой фосфин, и диалкилазодикарбоксилата, такого как диэтилазодикарбоксилат, диизопропилазодикарбоксилат или ди-третбутилазодикарбоксилат. Взаимодействие обычно проводят при температурах от температуры окружающей среды до 60 С. Для проведения взаимодействия обычно требуется от 1 до 12 ч. Продукт можно выделить методиками, хорошо известными в данной области, такими как экстракция и выпаривание. Продукт можно затем очистить методиками, хорошо известными в данной области, такими как перегонка,хроматография или перекристаллизация. На схеме Е, стадия с, показано снятие защиты ацеталя формулы (13) с получением соединения (2) . Такие снятия защиты легко выполняют способами, хорошо известными в данной области. (ProtectingGroups in Organic Synthesis, Theodora Greene (Wiley-Interscience. Например, соединение формулы (13) контактирует с кислотой в водной среде с получением соединения формулы (2). На схеме Е, стадия d, бромсоединение формулы (15) формилируют с получением соединения формулы (2). Например, соединение формулы (15) металлируют обработкой реагентом металлирования, таким как бутиллитий. Взаимодействие проводят в подходящем растворителе, таком как гексан, бензол, толуол,тетрагидрофуран или диэтиловый эфир. Взаимодействие в типичном случае проводят в присутствии приблизительно от 1 до приблизительно 1,5 молярных эквивалентов металлирующего реагента. Реакцию металлирования проводят при температуре приблизительно от -70 С до приблизительно 20 С, для нее обычно требуется от 1 до 6 ч. Металлированные соединения затем обрабатывают реагентом формильного переноса, таким как диметилформамид или алкилхлорформиат, получая соединение формулы (2) или алкоксикарбонилсоединение, которое можно превратить в альдегид, как описано в настоящем изобретении. Продукт взаимодействия можно выделить и очистить с использованием методик, хорошо известных- 15007493 в данной области. Эти методики включают экстракцию, выпаривание, хроматографию и перекристаллизацию. На схеме F описаны способы получения соединений формулы (2) из многофункционального промежуточного продукта, соединения (17), которое легко получают образованием ацеталя, как описано выше. Схема F На схеме F, стадия а, показана реакция ароматического замещения подходящего соединения формулы (17) и подходящего спирта (R4OH) или подходящего тиола (R4SH) с получением соединения формулы (13), в которой X представляет -О- или -S-, как указано выше на схеме Е. Подходящим соединением формулы (17) является соединение, в котором R3 имеет значения, требуемые для конечного продукта формулы I. В подходящем спирте (R4OH) или подходящем тиоле (R4SH) R4 имеет значения, требуемые для конечного продукта формулы I, и включает С 2-С 4 алкиловые спирты и тиолы, фторированные С 2-С 4 алкиловые спирты и тиолы, необязательно замещенные фенолы и тиофенолы, необязательно замещенные бензиловые спирты и тиолы. Например, подходящее соединение формулы (17) и подходящий спирт (R4OH) или подходящий тиол (R4SH) сочетают, получая соединение формулы (13). Взаимодействие проводят в подходящем растворителе, таком как диметилформамид, диметилацетамид и диметилсульфоксид. Взаимодействие проводят с использованием приблизительно от 1,1 до приблизительно 3 молярных эквивалентов подходящего спирта или тиола. Взаимодействие проводят в присутствии приблизительно от 1 до приблизительно 6 молярных эквивалентов подходящего основания, такого как гидрид калия, гидроксид натрия, карбонат калия, карбонат натрия или гидрид натрия. Сочетание проводят с использованием подходящего катализатора, такого как соли меди. Для проведения взаимодействия обычно требуется от 6 до 48 ч. Продукт реакции сочетания можно выделить и очистить с использованием методик, хорошо известных в данной области. Такие методики включают экстракцию, выпаривание, хроматографию и перекристаллизацию. На схеме F, стадии b-е, показано большое число реакций подходящего соединения формулы (17),после металлирования, как описано на схеме Е, стадия d, с образованием соединений формул (18)-(21),соответственно. На данных стадиях подходящим соединением формулы (17) является соединение, у которого R3 имеет значения, требуемые для конечного продукта формулы I, и который не подвергается неблагоприятному воздействию условий реакции металлирования. Обычно такие реакции проводят в растворителе и при температуре, используемых для различных видов металлирования. Продукты таких реакций могут быть выделены и очищены с использованием методик, хорошо известных в данной области, включающих гашение, экстракцию, выпаривание, растирание с растворителем, хроматографию и перекристаллизацию.- 16007493 Например, по схеме F, стадия b, металлированное соединение формулы (17) контактирует с подходящим дисульфидом (R4S-)2 с получением соединения формулы (18). Подходящим дисульфидом является дисульфид, который дает R4, требуемый для конечного продукта формулы I, и образует соединения, у которых X представляет -S-. Подходящие дисульфиды включают С 1-С 4 алкилдисульфиды, необязательно замещенные фенилдисульфиды и необязательно замещенные бензилдисульфиды. Взаимодействие проводят с использованием приблизительно от 1 до приблизительно 2 молярных эквивалентов подходящего дисульфида. Взаимодействие в типичном случае проводят в таком же растворителе, который используют для металлирования, и при температурах приблизительно от -78 С до приблизительно 50 С. Для проведения взаимодействия обычно требуется от 12 ч до 48 ч. Например, на схеме F, стадия с, металлированное соединение формулы (17) контактирует с подходящим сульфонилфторидом (R4SO2F) с получением соединения формулы (19). Подходящим сульфонилфторидом является сульфонилфторид, который переносит R4, имеющий значения, требуемые для конечного продукта формулы I, и дает соединения, у которых X представляет -SO2-. Подходящие сульфонилфториды включают необязательно замещенный фенилсульфонилфторид. Взаимодействие проводят с использованием приблизительно от 1 до приблизительно 3 молярных эквивалентов подходящего сульфонилфторида. Взаимодействие в типичном случае проводят в таком же растворителе, который используют для металлирования, и при температурах приблизительно от -78 С до приблизительно 0 С. Для проведения взаимодействия обычно требуется от 2 до 12 ч. Например, по схеме F, стадия d, металлированное соединение формулы (17) контактирует с подходящим хлорангидридом кислоты (R4C(O)Cl) с получением соединения формулы (20). Подходящим хлорангидридом кислоты является хлорангидрид, который переносит R4, имеющий значения, требуемые для конечного продукта формулы I, и дает соединения, у которых X представляет -С(О)-. Подходящие хлорангидриды кислот включают хлорангидриды С 2-С 4 алкановых кислот, хлорангидриды фторированных С 2-С 4 алкановых кислот, хлорангидриды необязательно замещенных бензойных кислот, хлорангидриды необязательно замещенных бензиловых кислот и хлорангидриды необязательно замещенных 5- или 6 членных моноциклических ароматических гетероциклических кислот. Взаимодействие проводят с использованием приблизительно от 0,8 до приблизительно 1,2 молярных эквивалентов подходящего хлорангидрида кислоты. Взаимодействие в типичном случае проводят в таком же растворителе, который используют для металлирования, и при температуре приблизительно от-78 С до приблизительно 50 С. Для проведения взаимодействия обычно требуется от 1 до 12 ч. Например, по схеме F, стадия е, металлированное соединение формулы (17) контактирует с подходящим альдегидом (R4C(O)H) с получением соединения формулы (21). Подходящим альдегидом является альдегид, который переносит R4, имеющий значения, требуемые для конечного продукта формулы I, и дает соединения, у которых X представляет -СН(ОН)-. Подходящие альдегиды включают С 2-С 2 алкилальдегид, фторированный С 2-С 2 алкилальдегид, необязательно замещенный фенилальдегид, необязательно замещенный бензилальдегид и необязательно замещенный 5- или 6-членный моноциклический ароматический гетероциклический альдегид. Взаимодействие проводят с использованием приблизительно от 1 до приблизительно 3 молярных эквивалентов подходящего альдегида. Взаимодействие в типичном случае проводят в таком же растворителе, который используют для металлирования, и при температуре приблизительно от -50 С до приблизительно 50 С. Для проведения взаимодействия обычно требуется от 4 до 24 ч. Как должно быть понятно для специалиста в данной области, соединения формул (18)-(21) можно подвергнуть большому числу других превращений, которые показаны на схеме F, стадии f-i, с получением в конечном счете соединений формулы I, имеющих различные группы у X. Указанные превращения являются тривиальными и вполне находятся в компетенции специалиста в данной области. Данные превращения включают окисление сульфидов (стадия f), которое можно выполнить пероксидом, перкислотами и другими реагентами, известными в данной области; восстановление бензилового спирта (стадияg), которое можно выполнить различными реагентами, такими как триэтилсилан/трифторуксусная кислота; галогенирование бензилового спирта с получением фторпроизводного (стадия h) с использованием таких реагентов, как DAST и фторирующие реагенты; восстановление кетона (стадия i) с использованием различных реагентов гидридного переноса или окисление бензилового спирта (стадия i), которое можно выполнить диоксидом марганца или в условиях Сверна. По схеме F, стадия j, у соединений формулы (13) и (18)-(23) снимают защиту, получая альдегид формулы (2), как описано на схеме Е, стадия с. На схеме G описаны способы получения соединений формулы (5). На схеме G, стадия а, бромсоединение формулы (15) карбоксилируют, получая соединение формулы (5), в которой А представляет -ОН. Например, соединение формулы (15) металлируют, как описано на схеме Е, стадия d, и металлированные продукты затем обрабатывают диоксидом углерода, получая соединение формулы (5), в которой А представляет -ОН. Продукт взаимодействия можно выделить и очистить с использованием методик,хорошо известных в данной области. Такие методики включают экстракцию, выпаривание, хроматографию и перекристаллизацию. На схеме G, стадия b, бромсоединение формулы (15) алкоксиформилируют с использованием подходящего хлорформиата или карбоната, получая соединение формулы (32). Подходящим хлорформиатом или карбонатом является соединение, которое переносит группу RO(O)C-, в которой R представляет метил, этил или бензил. Например, соединение формулы (15) металлируют, как описано на схеме Е, стадия d, и металлированные продукты затем обрабатывают приблизительно 1-3 молярными эквивалентами подходящего хлорформиата или карбоната. Взаимодействие в типичном случае проводят в таком же растворителе,который используют для металлирования, и при температуре приблизительно от -78 С до приблизительно 50 С. Для проведения взаимодействия обычно требуется от 1 до 24 ч. Продукт взаимодействия можно выделить и очистить с использованием методик, хорошо известных в данной области. Такие методики включают экстракцию, выпаривание, хроматографию и перекристаллизацию. По схеме G, стадия с, подходящее соединение формулы (33) подвергают взаимодействию с реагентом переноса группы R4, имеющей значения, требуемые для получения соединения формулы (32). Подходящим соединением формулы (33) является соединение, у которого X и R3 имеют значения, требуемые для образования конечного продукта формулы I. Реагенты, которые переносят R4, являются такими, которые описаны для схемы Е. Например, когда подходящим реагентом переноса R4 является галогенангидрид или ангидрид, подходящее соединение формулы (34) сочетают в основной среде, получая соединение формулы (33). Взаимодействие проводят в подходящем растворителе, таком как диметилформамид, тетрагидрофуран или пиридин. Взаимодействие в типичном случае проводят в присутствии приблизительно от 1 до приблизительно 3 молярных эквивалентов подходящего основания, такого как карбонат натрия, карбонат калия,карбонат цезия, N,N-диизопропилэтиламин, триэтиламин и тому подобное. Взаимодействие проводят при температуре приблизительно от -30 С до приблизительно 100 С, для реакции обычно требуется от 6 до 48 ч. Продукт взаимодействия можно выделить и очистить с использованием методик, хорошо известных в данной области. Такие методики включают экстракцию, выпаривание, хроматографию и перекристаллизацию. Альтернативно, например, когда подходящим реагентом переноса группы R4 является алканол, сочетание можно проводить в условиях реакции Мицунобу, которые хорошо известны в данной области и описаны для схемы Е. По схеме G, стадия d, эфир формулы (32) подвергают снятию защиты, получая соединение формулы (5), в которой А представляет -ОН. Такое снятие защиты легко выполняют способами, хорошо известными в данной области (Protecting Groups in Organic Synthesis, Theodora Greene (Wiley-Interscience. По схеме G, стадия е, соединение формулы (5), в которой А представляет -ОН, превращают в соединение формулы (5), в которой А представляет активирующую группу, такую как галогенангидрид кислоты, активированный сложный эфир, активированный амид или ангидрид. Получение таких активированных промежуточных продуктов хорошо известно и принято в настоящей области.- 18007493 Например, галогенангидрид кислоты можно получить с использованием различных реагентов, таких как оксалилхлорид, оксалилбромид, тионилхлорид, тионилбромид, оксихлорид фосфора, трихлорид фосфора и пентахлорид фосфора; смешанный ангидрид замещенной фосфорной кислоты, такой как диалкилфосфорная кислота, дифенилфосфорная кислота, галогенфосфорная кислота; алифатическая карбоновая кислота, такая как муравьиная кислота, уксусная кислота, пропионовая кислота, масляная кислота,изомасляная кислота, пиваловая кислота, 2-этилмасляная кислота; активированный сложный эфир, такой как сложный эфир фенола, сложный эфир п-нитрофенола, сложный эфир N-гидроксисукцинимида,сложный эфир N-гидроксифталимида, сложный эфир 1-гидроксибензотриазола, или активированный амид, такой как имидазол, диметилпиразол, триазол, способом, который хорошо известен и принят в данной области. Такие активированные промежуточные продукты можно получить и использовать непосредственно или их получают и выделяют перед использованием по указанным выше схемам. На схеме Н описаны способы получения соединений формулы (4). Схема Н По схеме Н, стадия а, бромсоединение формулы (15) превращают в нитрил формулы (35). Например, соединение формулы (15) обрабатывают цианидом меди (I), получая соединение формулы (35). Взаимодействие проводят в подходящем растворителе, таком как диметилформамид. Взаимодействие в типичном случае проводят в присутствии приблизительно от 1 до приблизительно 3 молярных эквивалентов цианида меди(I). Взаимодействие проводят при температуре приблизительно от температуры окружающей среды до приблизительно 100 С, и для проведения взаимодействия обычно требуется от 6 до 48 ч. Продукт взаимодействия можно выделить и очистить с использованием методик, хорошо известных в данной области. Такие методики включают экстракцию, выпаривание,хроматографию и перекристаллизацию. По схеме Н, стадия b, нитрильное соединение формулы (35) восстанавливают, получая соединение формулы (4), в которой R2 представляет водород. Например, нитрильное соединение формулы (35) контактирует с боргидридом натрия в присутствии хлорида кобальта. Взаимодействие проводят в подходящем растворителе, таком как метанол или этанол. Взаимодействие обычно проводят при температуре от 0 С до 50 С. Для проведения взаимодействия требуется обычно от 1 до 72 ч. Продукт можно выделить и очистить методиками, хорошо известными в данной области, такими как экстракция водной кислотой, выпаривание, растирание с растворителем, хроматография и перекристаллизация. Альтернативно, например, нитрильное соединение формулы (35) гидрируют над подходящим катализатором, таким как никель Ренея. Взаимодействие проводят в подходящем растворителе, когда в качестве катализатора используют никель Ренея, подходящие растворители обычно содержат аммиак, такие как этанол/гидроксид аммония. Взаимодействие обычно проводят при температурах от температуры окружающей среды до 50 С. Взаимодействие проводят при давлении от 15 фунт/кв. дюйм (103 кПа) до 120 фунт/кв. дюйм (827 кПа) в аппарате, разработанном для проведения реакций под давлением, таком как аппарат Парра для гидрирования. Продукт можно выделить осторожным удалением катализатора фильт- 19007493 рованием и упариванием. Продукт можно очистить экстракцией, выпариванием, растиранием с растворителем, хроматографией и перекристаллизацией. По схеме Н, стадия с, нитрильное соединение (35) превращают в амид формулы (36). Например, соединение формулы (35) обрабатывают кислотой или основанием в условиях гидролиза с получением соединения формулы (36). Взаимодействие проводят в подходящем растворителе, таком как этанол, изопропанол, диметилсульфоксид, причем каждый из них содержит воду. Гидролиз ароматического нитрила до амида является хорошо известным и признанным в настоящей области. Продукт реакции можно выделить и очистить с использованием методик, хорошо известных в данной области Такие методики включают экстракцию, упаривание, хроматографию и перекристаллизацию. На схеме Н, стадия d, показано образование амида формулы (37) взаимодействием соединения формулы (5) и подходящего амина формулы H2NR2 в реакции образования амида. Подходящим амином формулы H2NR2 является амин, который дает R2, нужный для конечного продукта формулы I. Подходящие способы получения амидов хорошо известны в данной области и описаны на приведенной выше схеме В. По схеме Н, стадия е, амидное соединение формулы (36) или (37) восстанавливают в соединение формулы (4). Такое восстановление амидов легко проводят, как описано на приведенной выше схеме В и как известно в данной области. По схеме Н, стадия f, соединение формулы (2) и подходящий амин формулы H2NR2 подвергают восстановительному аминированию, получая соединение формулы (4). Такое восстановительное аминирование легко проводят, как описано на приведенной выше схеме В, и другими способами, известными в данной области. Как должно быть известно специалисту в данной области, соединения формулы II легко получают способами, аналогично способам, описанным выше. Настоящее изобретение далее иллюстрируется нижеследующими примерами и препаратами. Примеры и препараты являются только иллюстративными и никоим образом не предназначены для ограничения изобретения. Термины, используемые в примерах и препаратах, имеют свои обычные значения, если не оговорено особо. Например, С относится к градусам Цельсия, N относится к нормальному или нормальности, М относится в молярному или молярности, ммоль относится к миллимолю или миллимолям,г относится к грамму или граммам, мл относится к миллилитру или миллилитрам, т.пл. относится к температуре плавления, насыщенный раствор соли относится к насыщенному водному раствору хлорида натрия и т.д. В 1 Н ЯМР все химические сдвиги даются в , если не оговорено особо. Пример 1. 2-(3-(4-Фторфенокси)фенил)-(1,3)диоксолан. Смешивают 4-фторфенол (3,0 г, 227,8 ммоль), 2-(3-бромфенил)-1,3-диоксолан (5,0 мл, 33,3 ммоль),карбонат калия (безводный, 8,0 г, 55,6 ммоль) и безводный пиридин (50 мл). Смесь нагревают до 90 С и добавляют оксид меди (5,5 г, 69,5 ммоль). Смесь кипятят с обратным холодильником. Спустя 24 ч охлаждают до комнатной температуры, разбавляют дихлорметаном и фильтруют. Фильтрат концентрируют в вакууме, получая желтое масло. Хроматография масла на силикагеле при элюировании смесью 95:5 гексан:EtOAc дает указанное в заголовке соединение. По способу примера 1 получают следующие соединения:(20 мл) и смесь нагревают при 80 С. Спустя 18 ч охлаждают до комнатной температуры, разбавляют эфиром (40 мл), фильтруют и концентрируют, получая остаток. Хроматография остатка на силикагеле при элюировании смесью 9:1 гексан:EtOAc дает указанное в заголовке соединение. По способу примера 2 получают следующие соединения:d) (3-[1,3]диоксолан-2-илфенил)пиридин-2-иламин. Пример 3. 2-(3-Фенилсульфанилфенил)-[1,3]диоксолан. Смешивают 2-(3-бромфенил)-1,3-диоксолан (3,0 мл, 20,0 ммоль) и тетрагидрофуран (100 мл) и смесь охлаждают приблизительно до -78 С. Добавляют по каплям раствор н-бутиллития, 1,6 М раствор в- 20007493 гексане (13,4 мл, 21,0 ммоль). Спустя 10 мин добавляют фенилдисульфид (4,3 г, 20,0 ммоль) в виде раствора в тетрагидрофуране (50 мл). Спустя 1 ч смесь нагревают до комнатной температуры на протяжении 1 ч, затем гасят водой (150 мл) и экстрагируют эфиром. Объединенные органические слои экстрагируют последовательно дистиллированной водой и насыщенным раствором соли и затем сушат (Na2SO4),фильтруют и концентрируют до получения остатка. Хроматография остатка при элюировании смесью 9:1 гексан:EtOAc дает указанное в заголовке соединение. По способу примера 3 получают следующее соединение: a) 2-(3-п-толилсульфанилфенил)[1,3]диоксолан. Пример 4. 2-(3-Бензолсульфонилфенил)-[1,3]диоксолан. Смешивают 2-(3-фенилсульфанилфенил)-[1,3]диоксолан (1,0 мл, 3,6 ммоль) и дихлорметан (15 мл) и смесь охлаждают приблизительно до -78 С. Добавляют суспензию м-хлорпербензойной кислоты (2,3 г,7,2 ммоль) в дихлорметане (10 мл). Спустя 30 мин смесь нагревают до комнатной температуры, затем добавляют 1N раствор тиосульфата натрия (20 мл) . Через 15 мин добавляют насыщенный раствор бикарбоната натрия. Отделяют органический слой и водный слой экстрагируют дихлорметаном, органические слои объединяют и промывают последовательно дистиллированной водой и насыщенным раствором соли и затем сушат (Na2SO4), фильтруют и концентрируют, получая остаток. Хроматография остатка при элюировании EtOAc дает указанное в заголовке соединение. По способу примера 4 получают следующее соединение: a) 2-(3-(толуол-4-сульфонил)фенил)[1,3]диоксолан. Пример 5. (3-[1,3]Диоксолан-2-илфенил)фенилметанол. Смешивают 2-(3-бромфенил)-1,3-диоксолан (10,0 мл, 66,0 ммоль) и тетрагидрофуран (100 мл) и смесь охлаждают приблизительно до -7 8 С. Добавляют по каплям раствор н-бутиллития, 1,6 М раствор в гексане (44,0 мл, 66,0 ммоль). Спустя 10 мин через канюлю добавляют раствор бензальдегида (7,6 г, 66,0 ммоль) в тетрагидрофуране (50 мл). Спустя 1 ч смесь нагревают до комнатной температуры. Через 18 ч смесь гасят в воде и экстрагируют дихлорметаном. Объединенные органические слои экстрагируют последовательно дистиллированной водой и насыщенным раствором соли и затем сушат (Na2SO4), фильтруют и концентрируют, получая остаток. Хроматография остатка при элюировании смесью 7:3 гексан:EtOAc дает указанное в заголовке соединение. Пример 6. (3-[1,3]Диоксолан-2-илфенил)фенилметанон. Смешивают (3-[1,3]диоксолан-2-илфенил)фенилметанол (5,0 г, 18,5 ммоль) и 18-краун-6 (160 мг,0,6 ммоль) в дихлорметане. Добавляют перманганат калия (8,8 г, 55,5 ммоль). Смесь нагревают приблизительно до 40 С. Спустя 4 ч смесь охлаждают до комнатной температуры и добавляют воду и гидросульфит натрия (6,0 г) . Смесь делают основной 1N раствором гидроксида натрия (приблизительно 60 мл) и экстрагируют дихлорметаном. Органические слои объединяют и промывают последовательно дистиллированной водой и насыщенным раствором соли и затем сушат (Na2SO4), фильтруют и концентрируют, получая остаток. Хроматография остатка при элюировании EtOAc дает указанное в заголовке соединение. Пример 7. 3-Бензилбензальдегид. В ацетонитриле (25 мл) смешивают (3-[1,3]диоксолан-2-илфенил) фенилметанол (2,3 г, 8,7 ммоль) и иодид натрия (5,3 г, 35,0 ммоль). Через шприц добавляют дихлорметилсилан (2,1 мл, 17,4 ммоль). Спустя 10 мин смесь разбавляют EtOAc и промывают водой, насыщенным бикарбонатом натрия, 10% тиосульфатом натрия и затем насыщенным раствором соли. Органические слои сушат (Na2SO4), фильтруют и концентрируют, получая остаток. Хроматография остатка при элюировании смесью 9:1 гексан:EtOAc дает указанное в заголовке соединение. Пример 8. 2-(3-(-Фторбензил)фенил)-[1,3]диоксолан. Смешивают (3-[1,3]диоксолан-2-илфенил)фенилметанол (2,3 г, 8,9 ммоль) и дихлорметан (50 мл). Смесь охлаждают до -78 С. Добавляют по каплям раствор трифторида (диэтиламино)серы (1,7 мл, 12,9 ммоль). Через 10 мин смесь гасят водой и экстрагируют дихлорметаном. Органические слои объединяют и промывают последовательно дистиллированной водой и насыщенным раствором соли и затем сушат(Na2SO4), фильтруют и концентрируют, получая остаток. Хроматография остатка при элюировании смесью 7:3 гексан:EtOAc дает указанное в заголовке соединение. Пример 9. 3-Нитродибензофуран. Смешивают дибензофуран (20,0 г, 0,11 моль) и уксусную кислоту (80 мл) и нагревают до 65 С. Добавляют 98% азотную кислоту (20,0 г, 11,8 моль). Через 3 ч смесь охлаждают до комнатной температуры,получая твердое вещество. Твердое вещество отфильтровывают, промывают водой и сушат, получая указанное в заголовке соединение. Пример 10. N-Дибензофуран-3-иламин. Смешивают 3-нитродибензофуран (22,0 г, 0,1 ммоль) и никель Ренея (2,75 г) и этанол (365 мл) и гидрируют при комнатной температуре и 40 фунт/кв. дюйм (276 кПа). Через 18 ч смесь фильтруют и фильтрат концентрируют, получая остаток.- 21007493 Хроматография остатка при элюировании смесью 9:1 гексан:EtOAc дает указанное в заголовке соединение. Пример 11. 3-Бромдибензофуран. Смешивают N-дибензофуран-3-иламин (2,0 г, 10,8 ммоль), воду (20 мл) и конц. бромистоводородную кислоту (6 мл) и охлаждают до 0 С. Добавляют раствор нитрита натрия (0,7 г, 10,8 ммоль) в воде (16 мл). Через 15 мин полученную выше смесь добавляют к смеси бромида меди (1,7 г, 12,3 ммоль) в воде(9,2 мл) и бромистоводородной кислоты (4 мл). Смесь нагревают до температуры окружающей среды. Спустя 18 ч добавляют воду и экстрагируют дихлорметаном. Органические слои объединяют и промывают последовательно дистиллированной водой и насыщенным раствором соли и затем сушат (Na2SO4),фильтруют и концентрируют, получая остаток. Хроматография остатка при элюировании смесью 8:2 гексан:EtOAc дает указанное в заголовке соединение. Пример 12. Дибензофуран-3-карбальдегид. Смешивают 3-бромдибензофуран (0,5 г, 2,0 ммоль) и тетрагидрофуран (30 мл) и смесь охлаждают приблизительно до -78 С. Добавляют раствор трет-бутиллития, 1,6 М раствор в гексане (2,2 мл, 3,0 ммоль), затем нагревают приблизительно до 0 С в течение 10 мин. Смесь охлаждают приблизительно до-78 С и добавляют диметилформамид (0,5 мл, 5,9 ммоль). Смесь нагревают до комнатной температуры,гасят водой и экстрагируют дихлорметаном. Органические слои объединяют и промывают последовательно дистиллированной водой и насыщенным раствором соли и затем сушат (Na2SO4), фильтруют и концентрируют, получая остаток. Хроматография остатка при элюировании смесью 8:2 гексан:EtOAc дает указанное в заголовке соединение. Пример 13. 3-(Тиазол-2-илокси)бензальдегид. В запаянной трубке смешивают 2-бромтиазол (2,0 мл, 22,2 ммоль), 3-гидроксибензальдегид (1,8 г,15,0 ммоль) и карбонат калия (2,1 г, 15,0 ммоль) в диметилформамиде (20 мл) и нагревают до 100 С. Спустя 48 ч смесь охлаждают, выливают в воду (150 мл) и экстрагируют эфиром. Органические слои объединяют и промывают последовательно дистиллированной водой и насыщенным раствором соли и затем сушат (Na2SO4), фильтруют и концентрируют, получая остаток. Хроматография остатка при элюировании смесью 9:1 гексан:EtOAc дает указанное в заголовке соединение. Пример 14. 6-Бром-1H-индол. Смешивают бром-2-нитротолуол (5,0 г, 23,1 ммоль), диметилформамид (50 мл) и диметилацеталь ДМФ (9,0 мл, 69,4 ммоль) и пирролидин (2,0 мл, 23,1 ммоль) и смесь нагревают до 110 С. Спустя 3 ч смесь охлаждают до комнатной температуры, разбавляют эфиром и промывают водой. Органические слои объединяют и концентрируют, получая остаток. Остаток объединяют с 80% водной уксусной кислотой (120 мл) и нагревают при 75 С. Порциями добавляют цинковую пыль (13,1 г, 200,5 ммоль) и смесь нагревают до 85 С. Через 2 ч ее охлаждают и фильтруют. Фильтрат разбавляют эфиром, промывают водой, сушат (Na2SO4) и концентрируют, получая остаток. Хроматография остатка при элюировании смесью 9:1 гексан:EtOAc дает указанное в заголовке соединение. По способу примера 14 получают следующее соединение: 4-бром-1H-индол. Пример 15. 1H-Индол-6-карбальдегид. Смешивают промытый гексаном гидрид калия (1,3 г, 10,7 ммоль) и эфир (20 мл). Смесь охлаждают приблизительно до 0 С и добавляют раствор 6-бром-1 Н-индола (2,1 г, 10,7 ммоль) в эфире (5 мл). Через 15 мин смесь охлаждают приблизительно до -78 С и добавляют раствор трет-бутиллития, 1,4 М раствор в гексане (14,0 мл, 10,7 ммоль). Через 10 мин добавляют диметилформамид (1,7 мл, 20,0 ммоль) в эфире (5 мл). Смесь медленно нагревают до комнатной температуры и затем выливают в охлажденный льдом 1 М раствор фосфорной кислоты и экстрагируют EtOAc. Органические слои объединяют и промывают последовательно дистиллированной водой и насыщенным раствором соли и затем сушат (Na2SO4), фильтруют и концентрируют, получая остаток. Хроматография остатка при элюировании смесью 9:1 гексан:EtOAc дает указанное в заголовке соединение. По способу примера 15 получают следующее соединение: 1 Н-индол-4-карбальдегид. Пример 16. 1-Фенил-1H-индол-6-карбальдегид. В запаянной трубке смешивают 1 Н-индол-6-карбальдегид (0,9 г, 6,2 ммоль), комплекс трифторметансульфат меди(I) (0,2 г, 0,3 ммоль), фенантролин (1,3 г, 6,2 ммоль), транс-дибензилиденацетон (0,1 г,0,3 ммоль), карбонат цезия (2,6 г, 7,9 ммоль) и иодбензол (1,6 мл, 14,3 ммоль) в ксилоле (40 мл). Смесь нагревают приблизительно при 110 С. Спустя 24 ч реакционную смесь охлаждают до комнатной температуры, разбавляют дихлорметаном и насыщенным хлоридом аммония. Слои разделяют и водный слой экстрагируют дихлорметаном. Органические слои объединяют и промывают последовательно дистиллированной водой и насыщенным раствором соли и затем сушат (Na2SO4), фильтруют и концентрируют,получая остаток. Хроматография остатка при элюировании смесью 8:2 гексан:EtOAc дает указанное в заголовке соединение. По способу примера 16 получают следующее соединение: 1-фенил-1 Н-индол-4-карбальдегид. Пример 17. 3-Фенилсульфанилбензальдегид.- 22007493 Смешивают 2-(3-фенилсульфанилфенил)-[1,3]диоксолан (0,3 г, 1,1 ммоль) и ацетонитрил (8,0 ил) и к смеси добавляют раствор хлористоводородной кислоты (1N, 2,0 мл). Спустя 18 ч смесь концентрируют в вакууме для удаления большей части ацетонитрила, разбавляют водой и экстрагируют эфиром. Органические экстракты объединяют и промывают один раз насыщенным бикарбонатом натрия, затем насыщенным раствором соли. Органическую часть сушат (Na2SO4), фильтруют и концентрируют, получая указанное в заголовке соединение. По способу примера 17 получают следующие соединения:p) 3-(пиридин-2-илокси)бензальдегид. Пример 18. 2-Нафт-2-илэтиламин. Смешивают нафт-2-илацетонитрил (1,0 г, 6,0 ммоль) и гексагидрат хлорида никеля(II) (0,7 г, 3,0 ммоль) и тетрагидрофуран (30 мл). По каплям добавляют комплекс боран-тетрагидрофуран, 1 М раствор в тетрагидрофуране (24,0 мл, 24,0 ммоль). Спустя 1 ч смесь упаривают, получая остаток. Хроматография остатка на силикагеле при элюировании смесью 8:2 EtOAc:MeOH + 2% NH4OH дает указанное в заголовке соединение. По способу примера 18 получают следующее соединение: 2-нафт-1-илэтиламин. Пример 19. 5-Метансульфонилтриптамин. В 300 мл смеси метанол/вода (1:1) смешивают 2-(3-хлорпропил)-1,3-диоксолан (6,69 г, 44,5 ммоль),гидрохлорид (4-метансульфонилфенил)гидразина (9,92 г, 44,5 ммоль) и Na2HPO4 (1,58 г, 11,1 ммоль) и смесь кипятят с обратным холодильником. Спустя 4,5 ч смесь охлаждают до комнатной температуры,затем упаривают до получения остатка. Остаток растворяют в 1N NaOH и экстрагируют дихлорметаном. Органические экстракты объединяют, промывают насыщенным раствором соли, сушат (Na2SO4), фильтруют, затем концентрируют, получая остаток. Хроматография остатка на силикагеле при элюировании смесью дихлорметан/2N NH3 (метанол) (84/16) дает указанное в заголовке соединение в виде светлокоричневого твердого вещества: т.пл. 134-138 С, МС (ACPI): m/e 239,1 (M+l). Анализ для C11H14N2O2S: вычислено: С 55,44; Н 5,92; N 11,76; найдено: С 55,33; Н 5,97; N 11,48. Пример 20. N-трет-Бутоксикарбонил-2-(6-хлор-1 Н-индол-3-ил)этиламин. В диоксане (50 мл) смешивают ди-трет-бутилдикарбонат (1,2 г, 5,34 ммоль), 6-хлортриптамин(866,4 мг, 4,45 ммоль) и NaHCO3 (598,2 мг). Смесь перемешивают при температуре окружающей среды. Спустя 15 ч смесь упаривают, получая остаток. Остаток распределяют между водой и дихлорметаном. Слои разделяют и водный слой экстрагируют дихлорметаном. Органические экстракты объединяют,промывают насыщенным раствором соли, сушат (Na2SO4), фильтруют и затем упаривают, получая указанное в заголовке соединение в виде светло-желтого масла. Пример 21 А. N-Метил-2-(6-хлор-1 Н-индол-3-ил)этиламин. Смешивают N-трет-бутоксикарбонил-2-(6-хлор-1 Н-индол-3-ил) этиламин (1,3 г, 4,41 ммоль) и безводный ТГФ (20 мл), смесь добавляют по каплям к охлажденной на ледяной бане суспензии LiAlH4 (1,0 г, 26,5 ммоль) в безводном ТГФ (30 мл) и кипятят с обратным холодильником. Спустя 2 ч смесь охлаждают до комнатной температуры и перемешивают. Спустя 15 ч смесь гасят насыщенным Na2SO4 (100 мл/моль), перемешивают в течение 1 ч при температуре окружающей среды, затем фильтруют в вакууме. Осадок промывают ТГФ и фильтрат и промывную жидкость упаривают, получая остаток. Остаток хроматографируют на силикагеле при элюировании смесью дихлорметан/2N NH3 (метанол) (84/16), получая указанное в заголовке соединение: МС (ACPI): m/e 209,0 (M+l). Пример 21 В. 5-(4-Фторфенил)-1 Н-индол. В толуоле (510 мл) смешивают 5-броминдол (5,00 г, 25,50 ммоль) и Pd(Ph3P)4 (l,47 г, 1,28 ммоль). Через 30 мин добавляют раствор 4-фторбензолбороновой кислоты (5,35 г, 38,26 ммоль) в этаноле (153 мл), затем добавляют насыщенный NaHCO3 (255 мл). Смесь кипятят с обратным холодильником. Через 4 ч смесь охлаждают до температуры окружающей среды, выливают в насыщенный NaCl (250 мл) и органический слой отделяют. Водный слой экстрагируют этилацетатом. Органические экстракты объединя- 23007493 ют, промывают насыщенным раствором соли, сушат, затем упаривают до получения остатка. Хроматография остатка на силикагеле при элюировании смесью этилацетат/гексаны (10/90) дает указанное в заголовке соединение: т.пл. 84-89 С. МС (ACPI): m/e 212,0 (M+l). Анализ для C14H10FN: вычислено: С 79,60; Н 4,77; N 6,63; найдено: С 79,33; Н 4,92; N 6,64. По способу примера 21 получены следующие соединения: а) 5-фенил-1 Н-индол: т.пл. 71-74 С. МС (ACPI): m/e 194,0 (M+l). Анализ для C14H11N: вычислено: С 87,01; Н 5,74; N 7,25; найдено: С 86,67; Н 5,82; N 7,31.b) гидрохлорид 4-фенилфенетиламина: исключение способа: для получения конечного продукта проводили хроматографию остатка на силикагеле с использованием смеси дихлорметан/2N NH3 (метанол) (90:10). HCl соль получали в этилацетате: МС (ACPI): m/e 198,1 (М+1). Анализ для C14H16ClN: вычислено: С 71,94; Н 6,90; N 5,99; найдено: С 71,66; Н 6,90; N 5,94. Пример 22. 7-Циано-1H-индол. В 1-метил-2-пирролидине (40 мл) смешивают 7-броминдол (4,72 г, 24,0 ммоль) и цианид меди (4,30 г, 48,1 ммоль) и смесь нагревают до 200 С. Через 2,5 ч смесь охлаждают до комнатной температуры, добавляют смесь вода-этилацетат (200 мл, 1/1), получая твердое вещество. Смесь фильтруют через целит,фильтрат экстрагируют этилацетатом, органические слои объединяют, промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и упаривают в вакууме, получая остаток. Хроматография остатка на силикагеле при элюировании смесью гексаны:этилацетат (10:1) дает (1,87 г) указанного в заголовке соединения в виде желтого твердого вещества: 1H-ЯМР (300 МГц, ДМСО-d6) 6,64-6,66 (м, 1 Н), 7,17 (т,1 Н, J=7,6 Гц), 7,51-7,53 (м, 1 Н), 7,60-7,62 (м, 1 Н), 7,94 (д, 1 Н, J=8,0 Н), 12,03 (шир., 1 Н). Пример 23. 3-Формил-5-циано-1 Н-индол. Оксихлорид фосфора (11,76 г, 76,67 ммоль) добавляют по каплям к ДМФ (24,3 мл), поддерживая температуру ниже 10 С. Смесь нагревают до температуры окружающей среды и перемешивают в течение 15 мин при температуре окружающей среды. По каплям добавляют 5-цианоиндол (10,00 г, 70,34 ммоль) в виде раствора в ДМФ (30 мл), поддерживая температуру ниже 35 С. Через 1 ч реакционную смесь выливают в смесь лед/вода (300 мл) и затем при перемешивании добавляют 3N NaOH (54 мл). Медленно добавляют дополнительное количество 5N NaOH (19,7 мл) и затем смесь нагревают до 90 С в течение 1 мин и затем охлаждают до температуры окружающей среды, получая осадок. Осадок отфильтровывают, промывают водой и сушат, получая указанное в заголовке соединение: т.пл. 248-250 С. МС(ACPI): m/e 171,0 (M+l) . Анализ для C10H6N2O: вычислено: С 70,58; Н 3,55; N 16,46; найдено: С 70,41; Н 3,53; N 16,33. По способу примера 23 получают следующие соединения:h) 3-формил-7-фтор-1 Н-индол; т.пл. 211-214 С. МС (ACPI): m/e 163,9 (М+1). Анализ для C9H6FNO: вычислено: С 66,26; Н 3,71; N 8,59; найдено: С 66,12; Н 3,67; N 8,56. Пример 25. 3-(2-Нитровинил)-5-циано-1 Н-индол. Смешивают 3-формил-5-циано-1 Н-индол (10,60 г, 63,32 ммоль) и раствор ацетата аммония (10,60 г) в нитрометане (660 мл) и смесь нагревают до 90 С. Через 2 ч смесь охлаждают до температуры окружающей среды, получая осадок. Осадок отфильтровывают, промывают смесью 1:1 МеОН/вода (500 мл) и сушат, получая указанное в заголовке соединение: 247-251 С. МС (ACPI): m/e 214,0 (M+l). По способу примера 25 получают следующие соединения:C10H7FN2O2: вычислено: С 58,26; Н 3,42; N 13,59; найдено: С 58,01; Н 3,31; N 13,26. Пример 26. 3-(2-Нитроэтил)-5-циано-1 Н-индол. Боргидрид натрия (25,65 г, 678 ммоль) добавляют к охлажденному на ледяной бане раствору 3-(2 нитровинил)-5-циано-1 Н-индола (12,68 г, 59,5 ммоль) в смеси 1:1 МеОН/ДМФ (600 мл). Через 1,5 ч добавляют насыщенный раствор соли (600 мл), затем рН доводят до приблизительно 7, используя 5N HCl. Смесь упаривают при пониженном давлении для удаления метанола и затем экстрагируют дихлорметаном. Органические экстракты объединяют, промывают насыщенным раствором соли, сушат (Na2SO4),затем упаривают до получения остатка. Хроматография остатка на силикагеле при элюировании дихлорметаном дает, после упаривания, указанное в заголовке соединение в виде бесцветных призм: т.пл. 132136 С. МС (ACPI): m/e 215,0 (М+1). Анализ для C11H9N3O2: вычислено: С 61,39; Н 4,22; N 19,52; найдено: С 61,09; Н 4,10; N 19,16. По способу примера 26 получают следующее соединение: а) 3-(2-нитроэтил)-7-циано-1 Н-индол; 1 НЯМР (300 МГц, ДМСО-d6) 3,39 (т, 2 Н, J=6,9 Гц), 4,87 (т, 2 Н, J=7,0 Гц), 7,17 (т, 1 Н, J=7,4 Гц), 7,38 (м, 1 Н),7,63 (д, 1 Н, J=7,4 Гц), 7,99 (д, 1 Н, J=7,9 Гц), 11,96 (шир., 1 Н), МС (электрораспыление), m/e: 214,1 (М-1). Пример 27. 5-Цианотриптамин. Порошок цинка (16,22 г, 248,1 ммоль) четырьмя порциями добавляют к 2N HCl (300,0 мл). В виде раствора в метаноле (300,0 мл) добавляют 3-(2-нитроэтил)-5-циано-1 Н-индол (2,25 г, 10,5 ммоль) и смесь кипятят с обратным холодильником. Через 2,5 ч смесь охлаждают до температуры окружающей среды и рН доводят до 11, используя 5N NaOH, фильтруют через целит, промывают водой, затем фильтрат экстрагируют дихлорметаном. Органические экстракты объединяют, промывают насыщенным раствором соли, сушат (Na2SO4), затем упаривают, получая указанное в заголовке соединение: т.пл. 102-105 С, МС(ACPI): m/e 186,1 (М+1). Анализ для C11H11N3: вычислено: С 71,33; Н 5,99; N 22,69; найдено: С 71,03; H 5,91; N 22,64. По способу примера 27 получают следующее соединение: а) 3-(2-аминоэтил)-7-циано-1 Н-индол; 1 Н-ЯМР (300 МГц, ДМСО-d6) 2,76-2,82 (м, 4 Н), 7,15 (т, 1 Н, J=7,6 Гц), 7,31 (с, 1 Н), 7,58 (д, 1 Н, J=7,4 Гц),7,91-7,94 (м, 1 Н), 11,80 (шир., 1 Н); МС (электрораспыление), m/e: 186,1 (М+1), 184,1 (М-1). По способу примера 27 получают следующее соединение: а) 6-бромтриптамин; т.пл. 114-116 С. Анализ для C10H11BrN2: вычислено: С, 50,23; Н, 4,64; N, 11,72; найдено: С, 49,96; Н, 4,49; N, 11,47. Пример 28. N-трет-Бутоксикарбонил-2-(5-циано-1 Н-индол-3-ил)этиламин. Смешивают ди-трет-бутилдикарбонат и раствор 5-цианотриптамина (1,33 г, 7,15 ммоль) и 2N NaOH(4,2 мл) в ТГФ (60 мл). После выдерживания в течение 3 ч при температуре окружающей среды смесь упаривают до образования остатка. Остаток растворяют в воде и раствор экстрагируют дихлорметаном. Органические экстракты объединяют, промывают насыщенным раствором соли, сушат (Na2SO4) и выпаривают до образования остатка. Хроматография остатка на силикагеле при элюировании смесью дихлорметан/2N NH3 (метанол) (97/3) дает указанное в заголовке соединение: т.пл. 129-132 С. МС (ACPI) :m/e 286,2 (М+1). Анализ для C16H19N3O2: вычислено: С, 67,35; Н, 6,71; N, 14,73; найдено: С, 67,16; Н,6,68; N, 14,46. По способу примера 28 получают следующее соединение a) N-трет-бутоксикарбонил-2-(6-циано 1 Н-индол-3-ил)этиламин. Пример 29. N-трет-Бутоксикарбонил-2-(5-амидо-1 Н-индол-3-ил)этиламин. Смешивают воду (64,0 мл) и NaOH (8,53 г) и смесь охлаждают приблизительно до 5 С на ледяной бане. Затем к охлажденному раствору добавляют раствор N-трет-бутоксикарбонил-2-(5-циано-1 Н-индол 3-ил)этиламина (1,85 г, 6,50 ммоль) в этаноле (128,0 мл). При поддержании температуры ниже 5 С по каплям добавляют 30% пероксид (6,4 мл). Спустя 30 мин смесь нагревают до температуры окружающей среды. Спустя 22 ч избыточный пероксид разлагают добавлением 20% раствора бисульфита натрия (45,0 мл) при перемешивании. Через 30 мин смесь упаривают при пониженном давлении для удаления этанола и экстрагируют образовавшийся водный раствор этилацетатом. Органические экстракты объединяют, промывают насыщенным раствором соли, сушат(Na2SO4), затем упаривают, получая остаток. Хроматография остатка на силикагеле при элюировании смесью дихлорметан/2N NH3 (метанол) (96/4) дает после упаривания указанное в заголовке соединение: т.пл. 65-68 С. МС (ACPI): m/e 304,2 (M+l). Анализ для C16H21N3O3: вычислено: С 63,35; Н 6,98; N 13,85; найдено: С 63,26; Н 6,99; N 13,71.- 25007493 По способу примера 28 получают следующее соединение: a) N-трет-бутоксикарбонил-2-(6-амидо 1 Н-индол-3-ил)этиламин: МС (ACPI): m/e 302,3 (M-l). Пример 30. 5-Амидотриптамин.N-трет-Бутоксикарбонил-2-(5-амидо-1 Н-индол-3-ил)этиламин (1,83 г, 6,04 ммоль) растворяют в диоксане (25,0 мл). По каплям добавляют 4 М HCl в диоксане (7,5 мл). Через 18 ч твердое вещество отфильтровывают и промывают диэтиловым эфиром, получая после сушки указанное в заголовке соединение в виде гидрохлорида: т.пл. 192-195 С. МС (ACPI): m/e 202,0 (M+l). По способу примера 30 получают следующее соединение: а) 6-амидотриптамин: т.пл. 169-173 С. МС (ACPI): m/e 204,1 (M+l). Пример 32. 5-(4-Фторфенил)триптамин. Смешивают LiAlH4 (2,66 г, 70,17 ммоль) и безводный ТГФ (70,0 мл) и суспензию охлаждают на ледяной бане. По каплям добавляют 5-(4-фторфенил)-3-(2-нитровинил)-1H-индол (3,30 г, 11,69 ммоль) в безводном ТГФ (30,0 мл). Смесь кипятят с обратным холодильником. Через 1 ч смесь охлаждают до температуры окружающей среды и перемешивают. Спустя 15 ч гасят насыщенным Na2SO4 (100 мл/моль) и перемешивают при температуре окружающей среды. Через 1 ч фильтруют, осадок промывают ТГФ и фильтрат выпаривают до образования остатка. Хроматография остатка на силикагеле при элюировании смесью дихлорметан/2N NH3 (метанол) (80/20) дает указанное в заголовке соединение. Соль HCl получают в диэтиловом эфире: т.пл.250 С. МС (ACPI): m/e 255,0 (M+l). Анализ для C16H16ClFN2: вычислено: С 66,09; Н 5,55; N 9,53; найдено: С 65,78; Н 5,48; N 9,58. По способу примера 32 получают следующие соединения:d) 7-Фтортриптамин; МС (ACPI): m/e 179,0 (М+1). Анализ для C10H11FN2: вычислено: С 67,40; Н 6,22; N 15,72; найдено: С 67,06; Н 6,11; N 15,48. Пример 33. 6-Этоксикарбонил-1 Н-индол. 6-Карбокси-1 Н-индол смешивают с этанолом (110 мл) и охлаждают до 5 С. При поддержании температуры ниже 10 С по каплям добавляют концентрированную H2SO4 (96%, 11,08 мл). Смесь кипятят с обратным холодильником. Через 4 ч смесь охлаждают и выливают на смесь лед/вода, рН доводят до приблизительно 9 и экстрагируют этилацетатом. Органические экстракты объединяют, промывают насыщенным раствором соли, сушат (Na2SO4), затем концентрируют до образования остатка. Хроматография остатка на силикагеле при элюировании хлороформом дает, после упаривания, указанное в заголовке соединение: т.пл. 72-75 С. МС (ACPI): m/e 189,9 (М+1). Пример 34. 3-(2-Нитровинил)-6-этоксикарбонил-1 Н-индол. 1-Диметиламино-2-нитроэтилен (1,93 г, 16,58 ммоль) смешивают с ТФУ (10,0 мл) и перемешивают до растворения. Добавляют 6-этоксикарбонил-1 Н-индол (3,14 г, 16,58 ммоль) и перемешивают при температуре окружающей среды. Через 1 ч реакционную смесь выливают в смесь лед/вода, экстрагируют этилацетат, затем упаривают до образования остатка. Остаток перемешивают в нагретом этаноле, охлаждают до температуры окружающей среды, затем фильтруют и сушат, получая указанное в заголовке соединение в виде темно-желтого порошка: т.пл. 241 С. МС (ACPI): m/e 261,1 (M+l). Анализ дляC13H12N2O4: вычислено: С 60,00; Н 4,65; N 10,76; найдено: С 59,99; Н 4,63; N 10,59. Пример 35. 3-(2-Нитроэтил)-6-этоксикарбонил-1 Н-индол. В 100 мл смеси ТГФ/метанол (9:1) смешивают 3-(2-Нитровинил)-6-этоксикарбонил-1 Н-индол (4,0 г,15,37 ммоль) и NaBH4 (726,7 мг, 19,21 ммоль) и смесь перемешивают при температуре окружающей среды. Через 1,5 ч смесь концентрируют до образования остатка. Остаток распределяют между насыщенным раствором соли и этилацетатом, промывают насыщенным раствором соли, органические слои объединяют, сушат (Na2SO4), затем упаривают, получая указанное в заголовке соединение в виде желтого порошка: т.пл. 124-127 С. МС (ACPI): m/e 263,0 (М+1). Анализ для C13H14N2O4: вычислено: С 59,54; Н 5,38; N 10,68; найдено: С 59,40; Н 5,36; N 10,53. По способу примера 35 получают следующие соединения:d) 3-(2-нитроэтил)-6-бензолсульфонил-1 Н-индол (исключение в способе: использовали 75 мл ТГФ). Пример 36. 6-Этоксикарбонилтриптамин. Смешивают Pt2O (440 мг) и раствор 3-(2-нитроэтил)-6-этоксикарбонил-1 Н-индола (3,55 г, 13,54 ммоль) в этилацетате (100 мл). Гидрирование проводят при 60 фунт/кв. дюйм (410 кПа) при температуре окружающей среды. Через 4 ч смесь фильтруют через целит и фильтрат концентрируют до образования- 26007493 остатка. Хроматография остатка на силикагеле при элюировании смесью дихлорметан/2N NH3 (метанол)(85/15), дает, после упаривания, указанное в заголовке соединение в виде не совсем белого порошка: т.пл. 127-131 С. МС (ACPI): m/e 233,0 (M+l). Анализ для C13H16N2O2: вычислено: С 67,22; Н 6,94; N 12,06; найдено: С 66,87; Н 6,86; N 11,86. По способу примера 36 получают следующие соединения:c) 6-бензолсульфонилтриптамин: т.пл. 169-172 С. МС (ACPI): m/e 301,0 (М+1). Пример 38. 6-Трифторметокси-1 Н-индол. Смешивают 1-метил-4-трифторметоксибензол (5,44 г, 30,87 ммоль) и H2SO4 (96%, 30,9 мл). Смесь охлаждают приблизительно до 0 С. Добавляют по каплям дымящую HNO3 (2,06 г, 32,72 ммоль), поддерживая температуру ниже 10 С. Когда добавление завершено, смесь нагревают до температуры окружающей среды. Через 2,5 ч смесь выливают на смесь лед/вода, экстрагируют дихлорметаном. Органические экстракты объединяют, промывают насыщенным раствором соли, сушат (N2SO4), затем концентрируют до образования остатка. Хроматография остатка на силикагеле при элюировании смесью гексаны/этилацетат (75/25) дает, после упаривания, 1-метил-2-нитро-4-трифторметоксибензол: МС (ACPI):m/e 220,1 (М-1). Смешивают 1-метил-2-нитро-4-трифторметоксибензол (3,73 г, 16,86 ммоль), пирролидин (1,32 г,18,55 ммоль), диметилацеталь N,N-диметилформамида (6,03 г, 50,58 ммоль) и безводный ДМФ (35 мл). Смесь нагревают приблизительно до 105 С. Через 19 ч удаляют ДМФ при пониженном давлении, получая маслянистый остаток. Остаток смешивают с этилацетатом, промывают насыщенным раствором соли,сушат (Na2SO4), затем концентрируют, получая N,N-диметил-2-(2-нитро-4-трифторметоксифенил)виниламин. Смешивают N,N-диметил-2-(2-нитро-4-трифторметоксифенил)виниламин (4,64 г, 16,8 ммоль) и никель Ренея (900 мг) в этаноле (100 мл). Гидрирование проводят, при 60 фунт/кв. дюйм (410 кПа) и температуре окружающей среды. Спустя 18 ч смесь фильтруют через целит, фильтрат концентрируют до образования остатка и хроматографируют на силикагеле при элюировании смесью гексаны/этилацетат(30/70), получая, после упаривания, указанное в заголовке соединение в виде не совсем белого порошка: т.пл. 59 С. МС (ACPI): m/e 200,0 (M-l). Пример 39. 2-Фенилфенетиламин. Смешивают 2-фенилфенилацетонитрил (4,69 г, 24,26 ммоль) и диэтиловый эфир (10 мл) и по каплям добавляют к охлажденному (-10 С) раствору LiAlH4 (2,76 г, 72,81 ммоль) в диэтиловом эфире (100 мл). Смесь нагревают до температуры окружающей среды. Спустя 2 ч смесь гасят насыщенным сульфатом натрия (100 мл/моль). Фильтруют для удаления осадка, фильтрат сушат (Na2SO4), фильтруют и концентрируют до образования остатка. Остаток хроматографируют на силикагеле при элюировании смесью дихлорметан/2N NH3 (метанол) (95/5), получая указанное в заголовке соединение в виде желтого масла. Соль HCl получают в диэтиловом эфире: т.пл. 197-199 С. МС (ACPI): m/e 198,1 (М+1). Анализ дляC14H16ClN: вычислено: С 71,94; Н 6,90; N 5,99; найдено: С 72,15; Н 6,84; N 6,09. Пример 40. 7-Хлор-1 Н-индол. По способу J. Med. Chem. 1990, 33, 2777, 2-хлоранилин (5,8 г, 45,45 ммоль) в безводном толуоле (80 мл) добавляют по каплям к холодному 1 М раствору BCl3 (50 мл) в дихлорметане. После добавления реакционную смесь перемешивают при 0 С в течение 10 мин. Через 10 мин при 0 С добавляют хлорацетонитрил (13,72 г, 11,53 мл, 181,8 ммоль, 4 экв.) и трихлорид алюминия (6,67 г, 50 ммоль, 1,1 экв.) в виде 5 равных порций на протяжении 45 мин и затем смесь кипятят с обратным холодильником (65 С). Спустя 6 ч смесь охлаждают до комнатной температуры. Через 16 ч реакционную смесь охлаждают на ледяной бане и добавляют 2N HCl (61,4 мл) и затем реакционную смесь кипятят с обратным холодильником. Через 45 мин смесь охлаждают на ледяной бане, нейтрализуют кислоту 2N NaOH, поддерживая температуру реакционной смеси ниже 15 С, до тех пор, пока рН не установится приблизительно 5. Реакционную смесь переносят в делительную воронку и удаляют органический слой. Водный слой экстрагируют дихлорметаном (2 х 200 мл). Органические слои объединяют, сушат над MgSO4, фильтруют и растворитель удаляют в вакууме, получая 1-(2-амино-3-хлорфенил)-2-хлорэтанон, который можно использовать без дополнительной очистки. 1-(2-Амино-3-хлорфенил)-2-хлорэтанон (7,0 г, 34,30 ммоль) растворяют в 10% водном 1,4-диоксане(75 мл). Осторожно добавляют NaBH4 (2,6 г, 68,6 ммоль, 2 экв.) в виде твердого вещества. Смесь кипятят с обратным холодильником. Спустя 4 ч смесь охлаждают до комнатной температуры, разбавляют водой(300 мл) и экстрагируют дихлорметаном (2 х 200 мл). Органические слои объединяют, сушат над MgSO4,фильтруют и растворитель удаляют в вакууме, получая в колбе светло-коричневое масло. Очистка масла ВЭЖХ (силикагель, подвижная фаза: от 100% гексана до 50% EtOAc в гексанах в течение 50 мин), дает указанное в заголовке соединение в виде коричневого масла: 1 Н-ЯМР (300 МГц, d6-ДМСО-d6): 5,16 (м,1 Н), 5,39 (д, 1 Н), 5,70 (шир.с, 1 Н), 6,59 (т, 1 Н), 7,09 (м, 2 Н); МС (ES+): m/z 154, 152 (М+Н)+.- 27007493 По способу примера 40 получают следующее соединение: а) 5-бром-7-этил-1 Н-индол: 1H-ЯМР(300 МГц, d6-ДМСО-d6) : 1,25 (т, 3H), 2,85 (м, 2 Н), 6,41 (м, 1 Н), 7,02 (м, 1 Н), 7,36 (м, 1 Н), 7,55 (м, 1 Н),11,28 (шир.с, 1 Н); MC(ES+): m/z 224, 226 (М+Н)+ Анализ для С 10 Н 10BrN: вычислено: С 53,60; Н 4,50; N 6,25; найдено: С 53,50; Н 4,34; N 6,22. Пример 42. 6-Трифторметил-1 Н-индол. Смешивают 2-бром-5-трифторметилфениламин (27,06 г, 112,74 ммоль) и 200 мл пиридина. Смесь охлаждают на ледяной бане и добавляют этилхлорформиат (18,35 г, 169,11 мл, 1,5 экв.). После завершения добавления реакционной смеси дают возможность постепенно нагреться до комнатной температуры. Через 18 ч смесь упаривают в вакууме, получая остаток. Остаток растворяют в смеси Et2O/вода и переносят в делительную воронку. Слои разделяют и водный слой экстрагируют Et2O (2 х 300 мл), органические слои объединяют, сушат над MgSO4, фильтруют и упаривают в вакууме, получая этиловый эфир N(2-бром-5-трифторметилфенил)карбаминовой кислоты, который можно использовать без дальнейшей очистки. По методике, описанной в J. Org. Chem. 1997, 62, 6507, смешивают этиловый эфир N-(2-бром-5 трифторметилфенил)карбаминовой кислоты (34,33 г, 110 ммоль), триэтиламин (300 мл), дихлорбис(трифенилфосфин)палладий(II) (5,4 г, 7,7 ммоль) и иодид меди(I) (1,47 г, 7,7 ммоль). Из колбы с темным раствором откачивают воздух и два раза заполняют ее N2 и быстро добавляют (триметилсилил)ацетилен (16,21 г, 165 ммоль, 23,32 мл) при энергичном перемешивании. Смесь нагревают до 80 С. Когда ТСХ показывает отсутствие исходного вещества, добавляют воду и Et2O, смесь фильтруют через целит и фильтрат упаривают в вакууме, получая остаток. Остаток разбавляют водой и экстрагируютEt2O, органические слои объединяют и упаривают, получая темно-коричневое масло. Масло абсорбируют на силикагеле и загружают на короткую колонку силикагеля, уравновешенного 100% гексанами. Колонку промывают 100% гексанами (2 мл) и продукт элюируют 1% EtOAc в гексанах. Объединяют фракции, содержащие продукт, и удаляют растворитель, получая 5-трифторметил-2-триметилсиланилэтинилфениламин в виде красно-коричневого масла. МС (IS): m/z 330 (М+Н)+. Осторожно к EtOH (200 мл) добавляют NaH (10,83 г, 60% в масле, 270,8 ммоль, 4 экв.). После охлаждения добавляют раствор 5-трифторметил-2-триметилсиланилэтинилфениламина (22,3 г, 67,7 ммоль) в EtOH (400 мл) при энергичном перемешивании. Спустя 2 ч смесь кипятят с обратным холодильником. Спустя 4 ч смесь упаривают в вакууме для удаления EtOH и полученный остаток разбавляют водой и экстрагируют Et2O. Органические слои объединяют и промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и упаривают, получая темное- масло. Масло абсорбируют на силикагеле и загружают на короткую колонку силикагеля. Элюируют 20% EtOAc в гексанах. Фракции, содержащие продукт, объединяют и растворитель удаляют, получая темно-коричневое масло. Масло далее очищают ВЭЖХ (колонка с силикагелем) с использованием градиента от 1% Et2O в гексанах до 15% Et2O в гексанах. Фракции, содержащие продукт, объединяют и растворитель удаляют, получая указанное в заголовке соединение в виде оранжевого твердого вещества: 1 Н-ЯМР (300 МГц, d6-ДМСО-d6): 6,58 (м, 1 Н), 7,28 (м,1 Н), 7,61 (т, 1 Н), 7,74 (м, 2 Н), 11,51 (шир.с, 1 Н); MC(EI+): m/z 185 (М+). По способу примера 42 получают следующее соединение: а) 5-изопропил-1 Н-индол: МС (ES+): m/z 160 (М+Н)+; (ES-): m/z 158 (М-Н)-. Пример 44. 6-Фтор-5-метокси-1 Н-индол. Дымящую азотную кислоту (24 мл) растворяют в концентрированной H2SO4 в круглодонной колбе. При энергичном перемешивании с помощью пипетки по каплям добавляют 3,4-дифторбромбензол (20 г,104 ммоль). После добавления реакционную смесь перемешивают при комнатной температуре в течение 2 ч, выливают реакционную смесь в ледяную воду и экстрагируют Et2O (2 х 250 мл), органические слои объединяют, сушат над MgSO4, фильтруют и растворитель удаляют, получая 1-бром-4,5-дифтор-2 нитробензол в виде светло-желтого масла. 1-Бром-4,5-дифтор-2-нитробензол (24 г, 100 ммоль) добавляют к раствору метоксида натрия (1,2 экв.) в МеОН. После добавления реакционную смесь перемешивают при комнатной температуре в течение 2,5 ч. Растворитель удаляют в вакууме и остаток разбавляют водой и экстрагируют Et2O (2 х 250 мл). Органические слои объединяют, сушат над MgSO4, фильтруют и растворитель удаляют в вакууме, получая 1-бром-4-фтор-5-метокси-2-нитробензол в виде желтого твердого вещества: 1 Н-ЯМР (300 МГц,CDCl3): 3,99 (с, 3H), 7,26 (м, 1 Н), 7,83 (д, 1 Н); MC(FD+): m/z 249,251 (М+); Анализ для C7H5BrFNO3: вычислено: С 33,63; Н 2,02; N 5,60; найдено: С 33,79; Н 1,98; N 5,62. Смешивают 1-бром-4-фтор-5-метокси-2-нитробензол (20,5 г, 82 ммоль) с Pt на угле (сульфидированная) в ТГФ (600 мл) и гидрируют при 60 фунт/кв. дюйм (414 кПа) на протяжении 4 ч. Реакционную смесь фильтруют через целит для удаления катализатора и растворитель удаляют, получая 2-бром-5 фтор-4-метоксианилин в виде коричневого твердого вещества, которое можно использовать без дальнейшей очистки. С использованием 2-бром-5-фтор-4-метоксианилина по способу примера 42 получают этиловый эфир N-(2-бром-5-фтор-4-метоксифенил)карбаминовой кислоты в виде коричневого твердого вещества: 1- 28007493 кислоты в виде желтого твердого вещества: MC(ES+) m/z 310 (М+Н)+; (ES-): m/z 308 (М-Н)-; и указанное в заголовке соединение в виде твердого вещества: 1 Н-ЯМР (300 МГц, CDCl3) : 3,93 (с, 3H), 6,48 (м, 1 Н),7,15 (м, 3H), 8,11 (шир.с, 1 Н); MC(ES+): m/z 166 (М+Н)+; (ES-): m/z 164 (М-Н)-; Анализ для C9H8FNO: вычислено: С, 65,45; Н, 4,88; N, 8,48; найдено: С, 65,17; Н, 4,97; N, 8,70. Пример 45. 5,6-Дифтор-1 Н-индол. С использованием способа 42 получают 2-бром-4,5-дифторанилин, который дает этиловый эфир N(2-бром-4,5-дифторфенил)карбаминовой кислоты; который дает этиловый эфир (4,5-дифтор-2-триметилсиланилэтинилфенил)карбаминовой кислоты; который дает указанное в заголовке соединение в виде оранжевого твердого вещества: 1 Н-ЯМР (300 МГц, d6-ДМСО-d6): 6,43 (м, 1 Н), 7,38 (м, 2 Н), 7,50 (м, 1 Н),11,25 (шир.с, 1 Н); MC(ES-): m/z 152 (М-Н)-; Анализ для C8H5F2N: вычислено: С 62,75; Н 3,29; N 9,15; найдено: С 62,41; Н 3,12; N 8,98. Пример 46. 5-Трифторметокси-1 Н-индол. Используя способ примера 42 и 2-бром-4-(трифторметокси)анилин, получают этиловый эфир N-(2 бром-4-трифторметоксифенил)карбаминовой кислоты: 1 Н-ЯМР (300 МГц, CDCl3): 1,34 (т, 3H), 4,25 (м,2 Н), 7,19 (м, 1 Н), 7,41 (м, 1 Н), 8,20 (д, 1 Н); MC(ES-): m/z 326, 328 (М-Н)-; Анализ для C10H9BrF3NO3: вычислено: С 36,6096; Н 2,7650; N 4,2692; найдено: С 36,50; Н 2,67; N 3,97; который дает этиловый эфир N(4-трифторметокси-2-триметилсиланилэтинилфенил)карбаминовой кислоты; который дает указанное в заголовке соединение в виде желтого масла: МС (ES-): m/z (М-Н)-. Пример 47. 4-Фенил-1H-индол. С использованием способа Carrera and Sheppard, Synlett. 1994, 93-94 из 4-броминдола получают указанное в заголовке соединение: 1H-ЯМР (300 МГц, d6-ДМСО-d6): 6,56 (м, 1 Н), 7,08 (м, 1 Н), 7,17 (м, 1 Н),7,43 (м, 5 Н), 7,67 (м, 2 Н), 11,27 (шир.с, 1 Н); MC(ES+): m/z 194 (М+Н)+ (ES-): m/z 192 (М-Н)-. Пример 48. (2-Нитро-5-трифторметилфенил)ацетонитрил. По способу Liebigs Ann. Chem. 1988, 203-208 с использованием 4-нитробензотрифторида (15 г,78,49 ммоль) получают указанное в заголовке соединение: MC(ES-): m/z 229 (М-Н)-. Пример 49. 5-Трифторметил-1 Н-индол. По способу Liebigs Ann. Chem. 1988, 203-208 с использованием (2-нитро-5-трифторметилфенил) ацетонитрила получают указанное в заголовке соединение в виде белого твердого вещества: 1 Н-ЯМР(300 МГц, d6-ДМСО-d6): 6,60 (м, 1 Н), 7,36 (м, 1 Н), 7,53 (м, 1 Н), 7,57 (м, 1 Н), 7,94 (м, 1 Н), 11,51 (шир.с,1 Н); MC(ES-):m/z 184 (М-Н)-. Пример 50. 3-Формил-4-метокси-1 Н-индол. Оксихлорид фосфора (1,1 экв.) добавляют при энергичном перемешивании к ДМФ (охлажденному на ледяной бане). После завершения добавления смесь перемешивают на ледяной бане в течение 10 мин, затем добавляют раствор 4-метокси-1 Н-индол (5 г) в безводном ДМФ при энергичном перемешивании. Смесь оставляют для перемешивания при 0 С. Через 1 ч смесь нагревают до комнатной температуры. Спустя 16 ч осторожно добавляют 4 экв. 2N NaOH при энергичном перемешивании. Смесь нагревают приблизительно до 80 С и затем охлаждают. Реакционную смесь выливают в холодную воду при энергичном перемешивании, получая твердое вещество. Твердое вещество отфильтровывают и сушат в вакуумном шкафу при комнатной температуре, получая указанное в заголовке соединение. Фильтрат подкисляют и экстрагируют EtOAc. Органические слои объединяют и промывают 50% насыщенным раствором соли. Отделяют органический слой, сушат (MgSO4), фильтруют и удаляют растворитель, получая указанное в заголовке соединение в виде светло-красного твердого вещества. Общий выход указанного в заголовке соединения составляет 5,44 г: МС (ES+): m/z 175 (М+Н)+, 160 (М-СН 3)+; (ES-): m/z 174 (М-Н)-. По способу примера 50 получают следующие соединения:u) 3-формил-4,6-дифтор-1-метил-1 Н-индол, 1H-ЯMP (300 МГц, d6-ДМСО) : 3,87 (с, 3H), 7,10 (м, 1 Н),7,41 (м, 1 Н), 8,32 (с, 1 Н), 9,93 (д, 1 Н); MC(ES+): 196 (М+Н)+. Пример 51. 3-(2-Нитровинил)-4-метокси-1 Н-индол. Смешивают ацетат аммония (высушен после обработки толуолом и удаления толуола в вакууме) в виде твердого вещества (0,75 экв.), нитрометан (20 экв.) и 4-метокси-1 Н-индол-3-карбальдегид (5,4 г,30,82 ммоль). Смесь нагревают приблизительно до 65 С. После того как реакция завершается по данным ТСХ, добавляют силикагель и смесь упаривают в вакууме для удаления нитрометана. Загрузка силикагеля из реакционной смеси на верх короткой колонки с силикагелем и элюирование 25% ацетоном в гексанах дает, после упаривания, указанное в заголовке соединение, которое можно использовать на следующей стадии без дальнейшей очистки. По способу примера 51 получают следующие соединения:
МПК / Метки
МПК: A61K 31/4402, C07D 401/12, A61P 25/28, A61K 31/4409, C07C 217/54, A61K 31/506, A61K 31/4406, C07D 403/12, A61K 31/4045, A61P 25/18, C07D 209/16
Метки: рецептора, качестве, n-(2-арилэтил)бензиламины, антагонистов, 5-ht6
Код ссылки
<a href="https://eas.patents.su/30-7493-n-2-ariletilbenzilaminy-v-kachestve-antagonistov-5-ht6-receptora.html" rel="bookmark" title="База патентов Евразийского Союза">N-(2-арилэтил)бензиламины в качестве антагонистов 5-ht6- рецептора</a>
Предыдущий патент: Соединения бензотиазина и бензотиадиазина, способ их получения и фармацевтические композиции, которые их содержат
Следующий патент: Моноклональные антитела к растворимому рецептору лпнп человека, способы их получения и применения и гибридомы, продуцирующие указанные антитела
Случайный патент: Сосковая резинка с ударопоглощающими свойствами


































