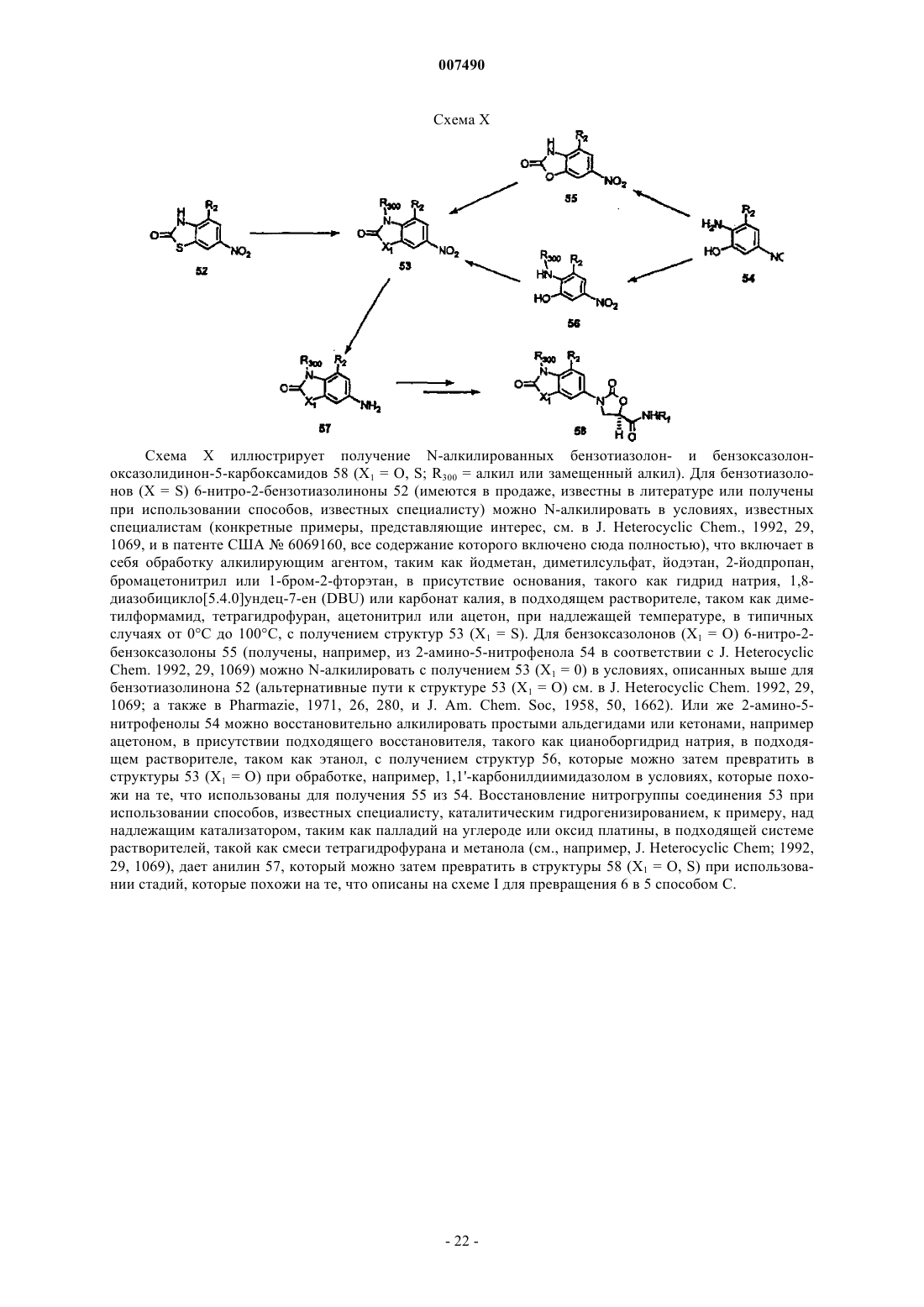
N-арил-2-оксазолидинон-5-карбоксамиды, их производные и их применение в качестве антибактериальных средств
Номер патента: 7490
Опубликовано: 27.10.2006
Авторы: Барбачин Михаил Р., Гордеев Михаил Ф., Томас Ричард К., Пол Тони-Джо, Сингх Апиндер, Ренсло Адам, Люр Гэри У.
Формула / Реферат
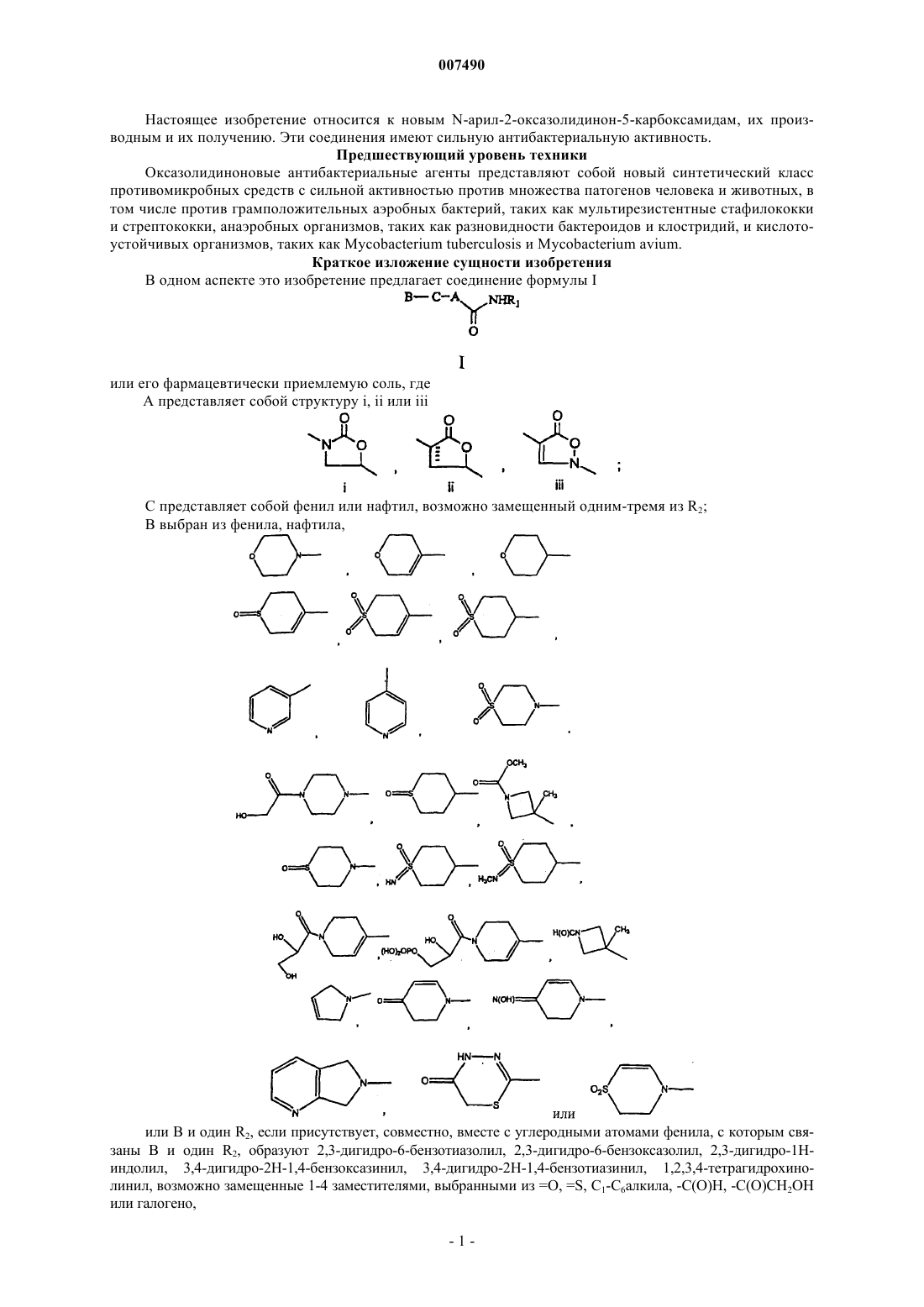
1. Соединение формулы I

или его фармацевтически приемлемая соль,
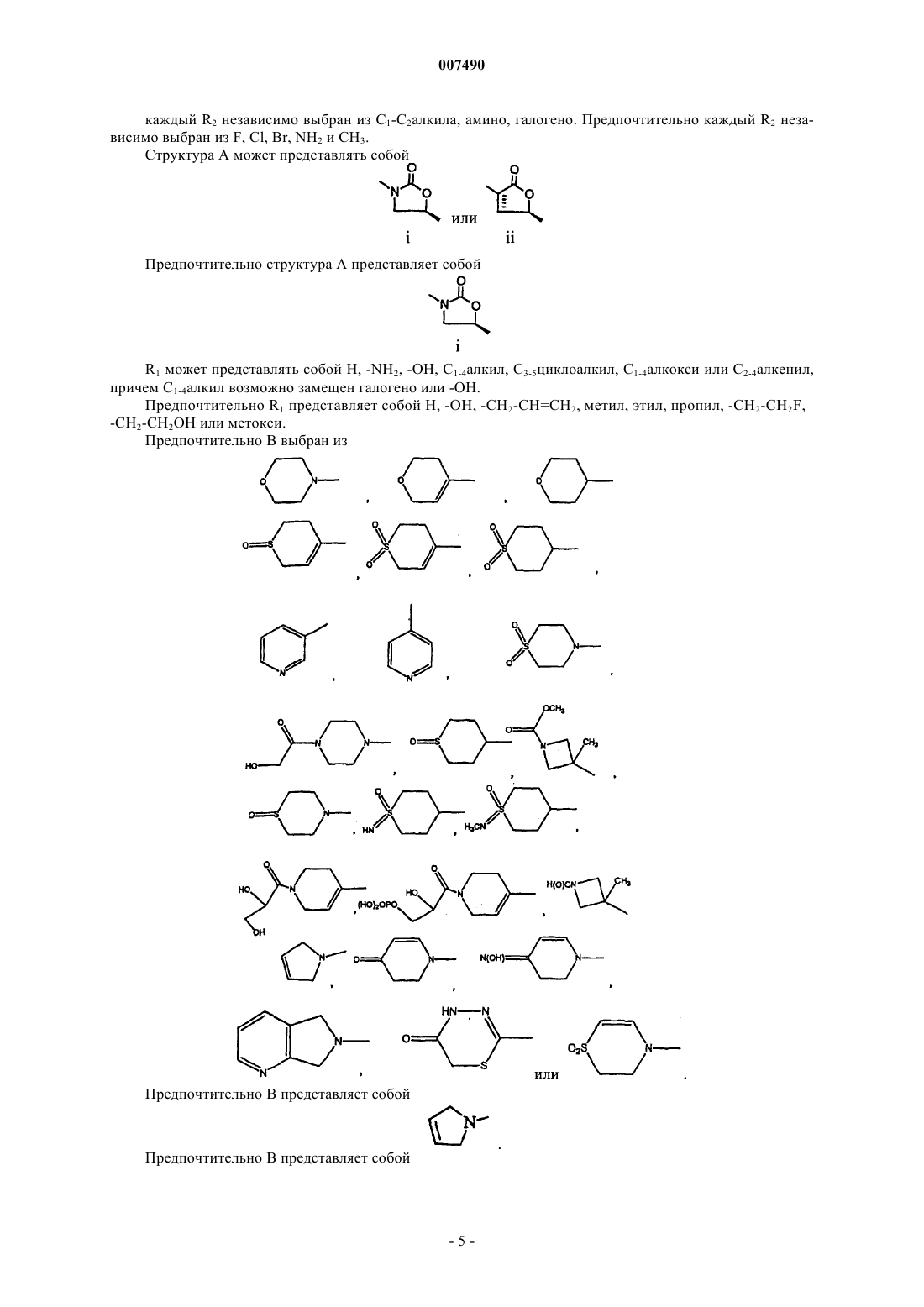
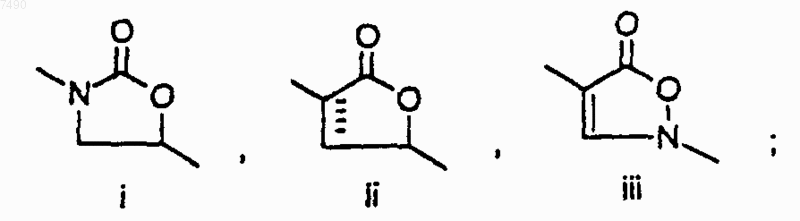
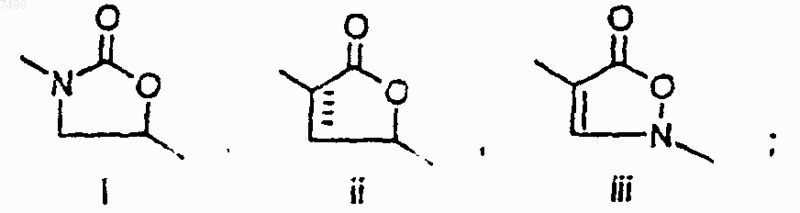
где А представляет собой структуру i, ii или iii
С представляет собой фенил или нафтил, возможно замещенный одним-тремя из R2;
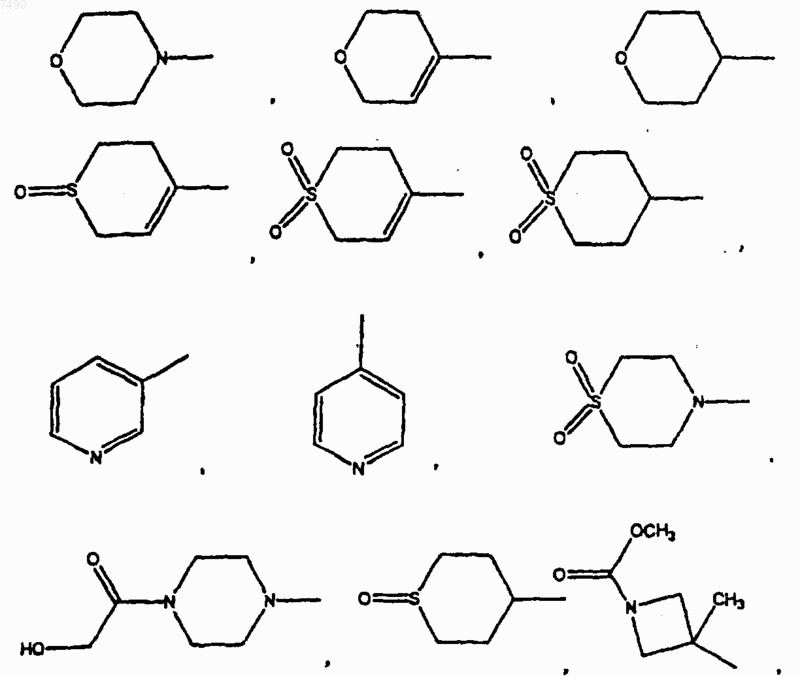
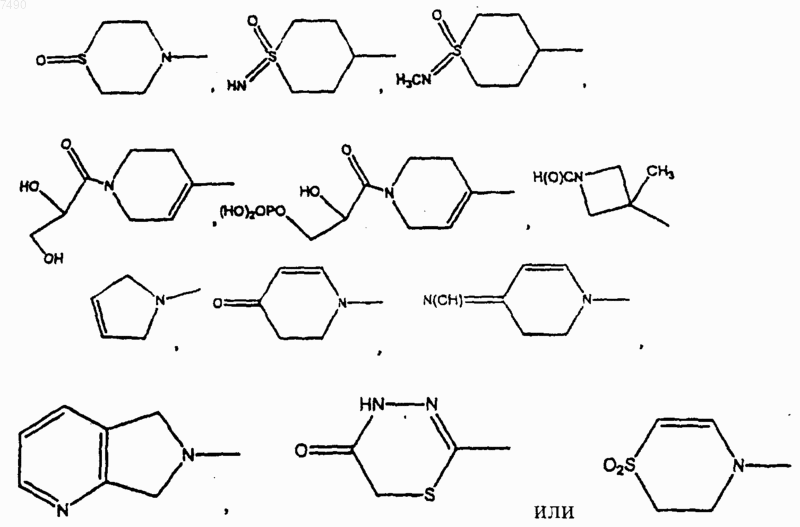
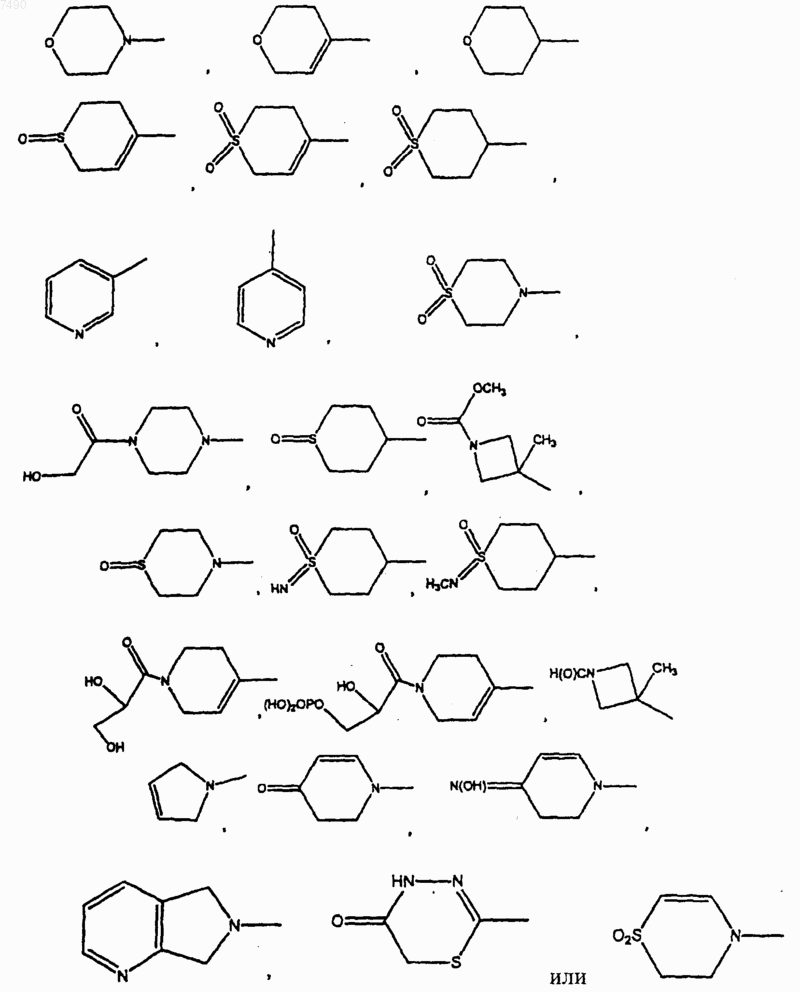
В выбран из фенила, нафтила
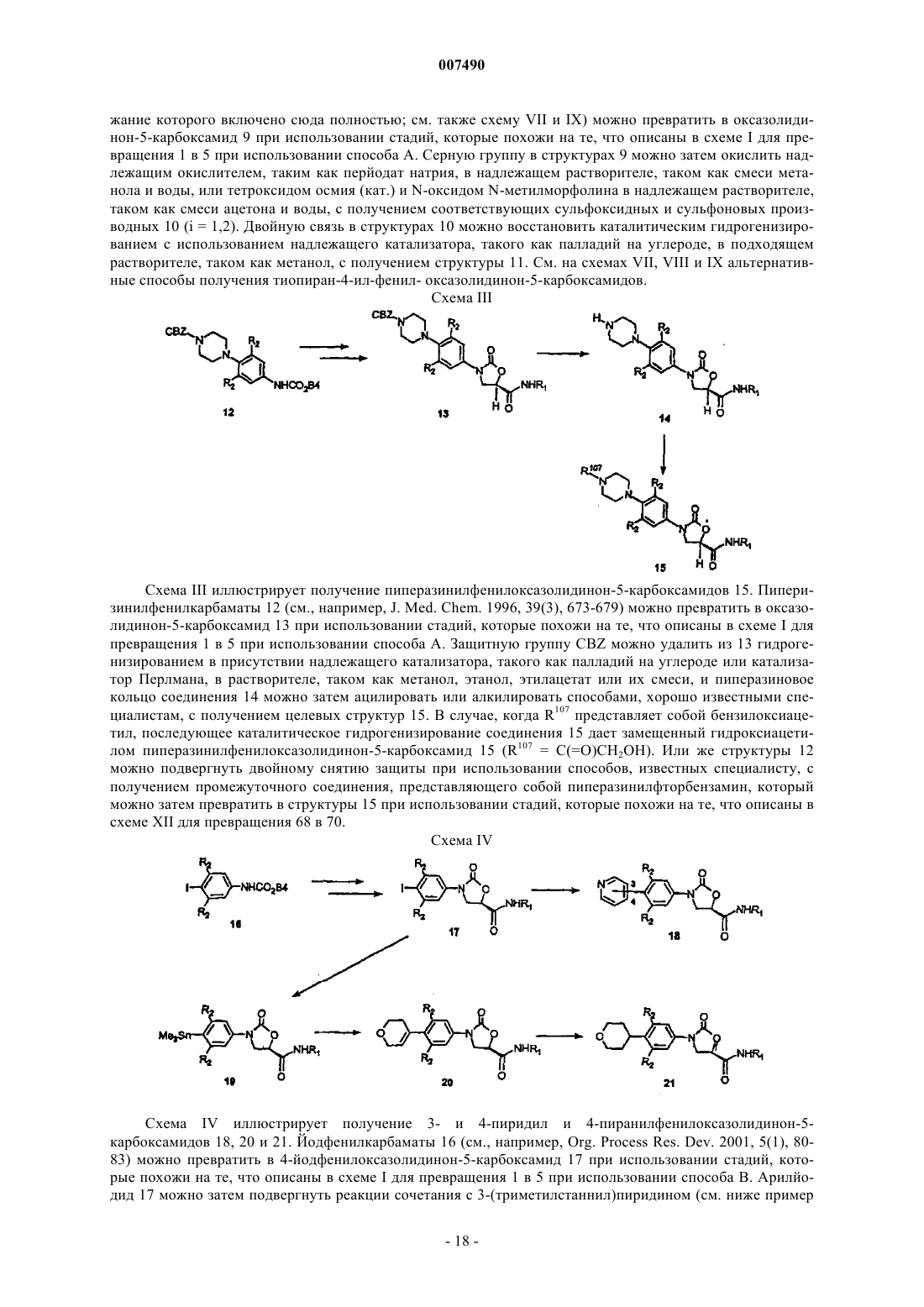
или В и один R2, если присутствует, совместно, вместе с углеродными атомами фенила, с которым связаны В и один R2, образуют 2,3-дигидро-6-бензотиазолил, 2,3-дигидро-6-бензоксазолил, 2,3-дигидро-1Н-индолил, 3,4-дигидро-2Н-1,4-бензоксазинил, 3,4-дигидро-2Н-1,4-бензотиазинил, 1,2,3,4-тетрагидрохинолинил, возможно замещенные 1-4 заместителями, выбранными из =O, =S, C1-С6алкила, -С(O)Н, -С(O)СН2ОН или галогено;
R1 выбран из Н, -ОН, C1-С6алкила, С3-С7циклоалкила, C1-С6алкокси, C2-С6алкенила, амино, C1-С6алкила, замещенного ОН или галогено;
каждый R2 независимо выбран из C1-С6алкила, амино, галогено.
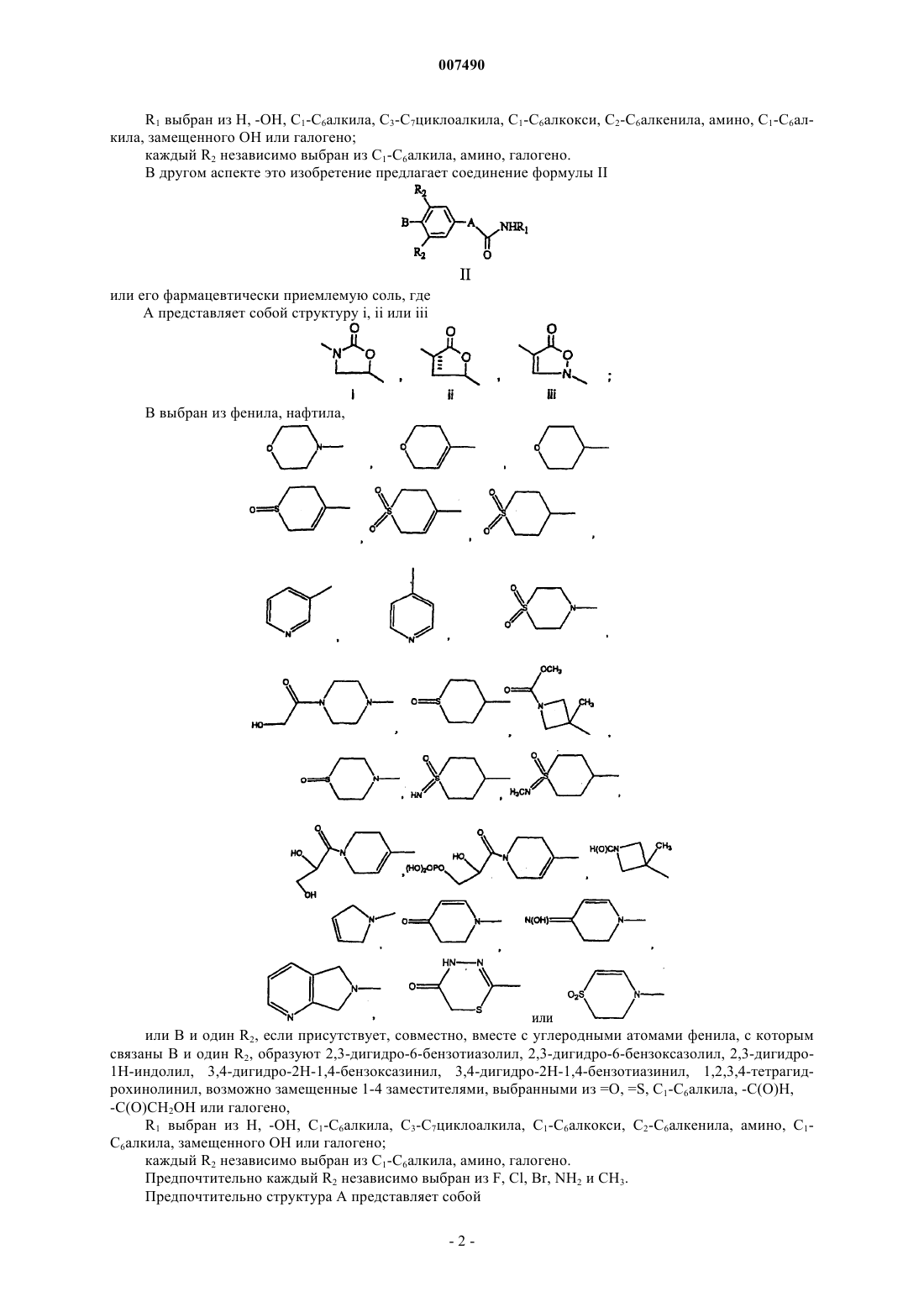
2. Соединение формулы II
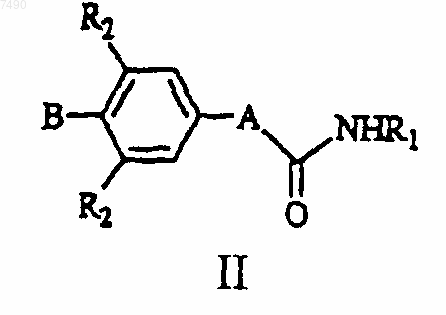
или его фармацевтически приемлемая соль,
где А представляет собой структуру i, ii или iii
В выбран из фенила, нафтила
или В и один R2, если присутствует, совместно, вместе с углеродными атомами фенила, с которым связаны В и один R2, образуют 2,3-дигидро-6-бензотиазолил, 2,3-дигидро-6-бензоксазолил, 2,3-дигидро-1Н-индолил, 3,4-дигидро-2Н-1,4-бензоксазинил, 3,4-дигидро-2Н-1,4-бензотиазинил, 1,2,3,4-тетрагидрохинолинил, возможно замещенные 1-4 заместителями, выбранными из =O, =S, C1-С6алкила, -С(O)Н, -С(O)СН2OН или галогено;
R1 выбран из Н, -ОН, C1-С6алкила, С3-С7циклоалкила, C1-С6алкокси, С2-С6алкенила, амино, C1-С6алкила, замещенного ОН или галогено;
каждый R2 независимо выбран из C1-С6алкила, амино, галогено.
3. Соединение по п.2, в котором каждый R2 независимо выбран из F, Cl, Br, NH2 и СН3.
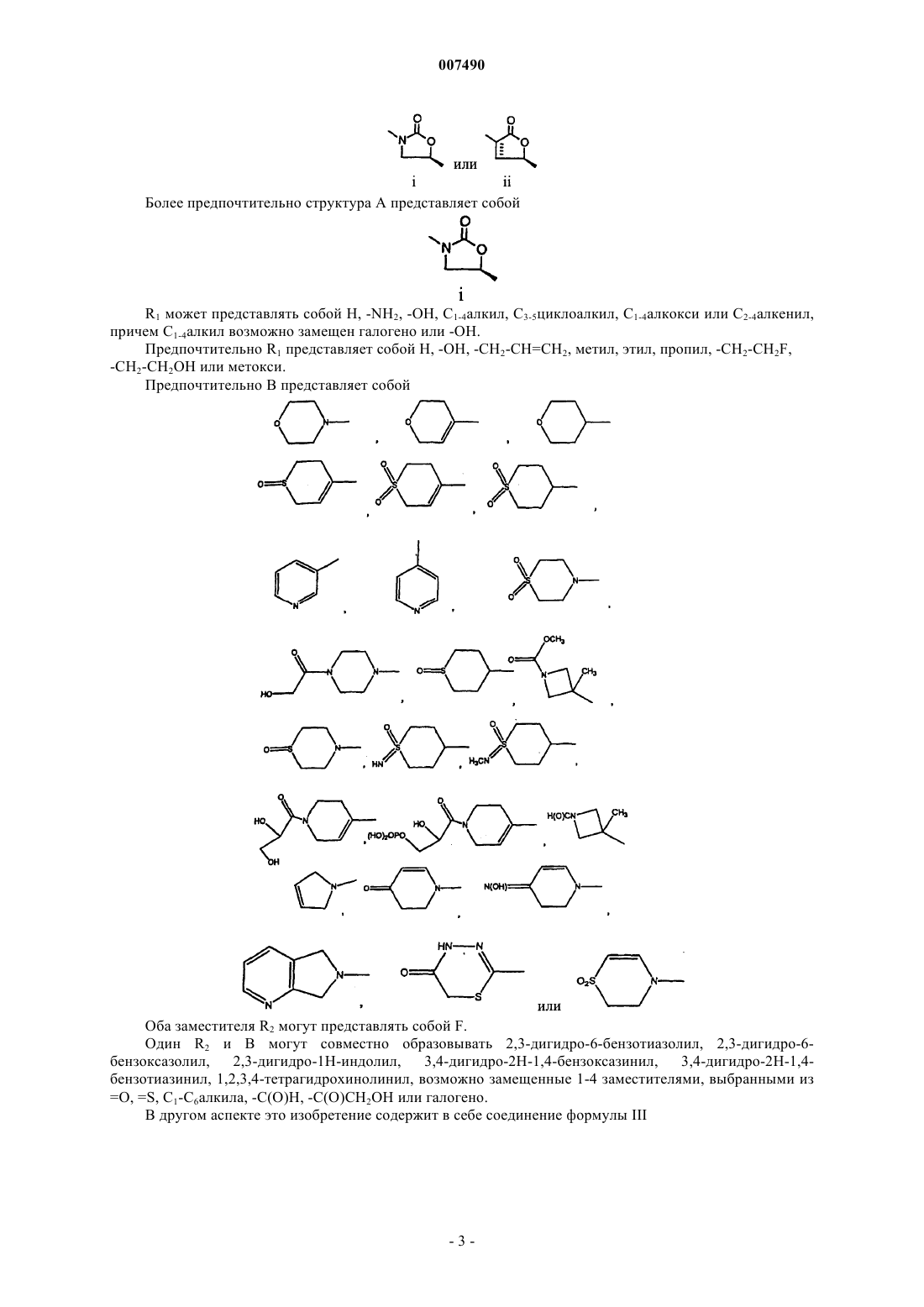
4. Соединение по п.2, в котором структура А представляет собой
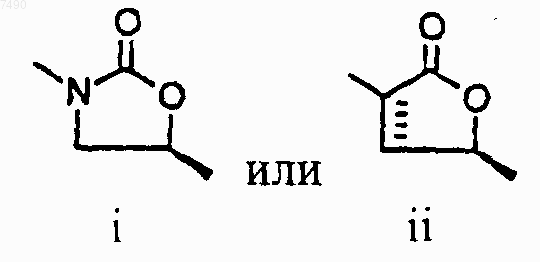
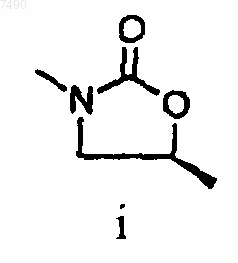
5. Соединение по п.3, в котором структура А представляет собой
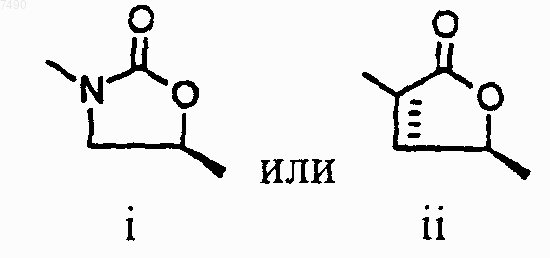
6. Соединение по п.5, в котором структура А представляет собой
7. Соединение по п.2, в котором R1 представляет собой Н, -NH2, -ОН, С1-4алкил, С3-5циклоалкил, С1-4алкокси или С2-4-алкенил, причем С1-4алкил возможно замещен галогено или -ОН.
8. Соединение по п.7, в котором R1 представляет собой Н, -ОН, -СН2-СН=СН2, метил, этил, пропил, -CH2-CH2F, -CH2-CH2OH или метокси.
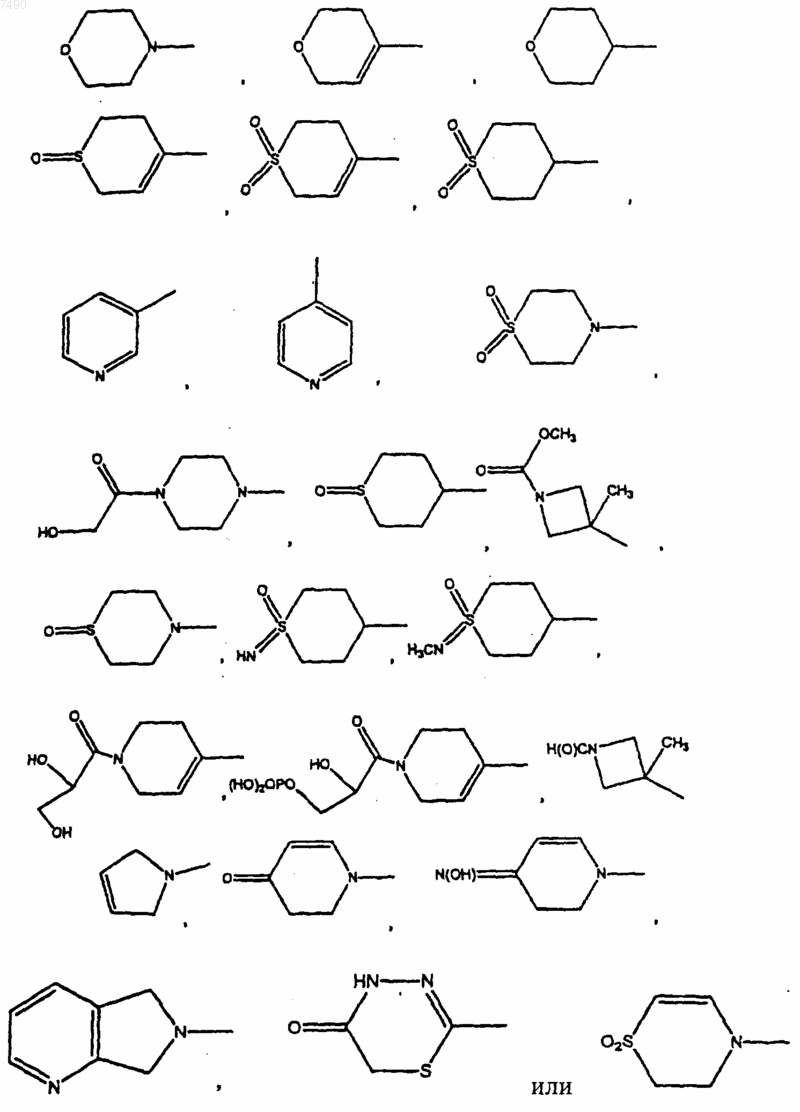
9. Соединение по п.2, в котором В представляет собой
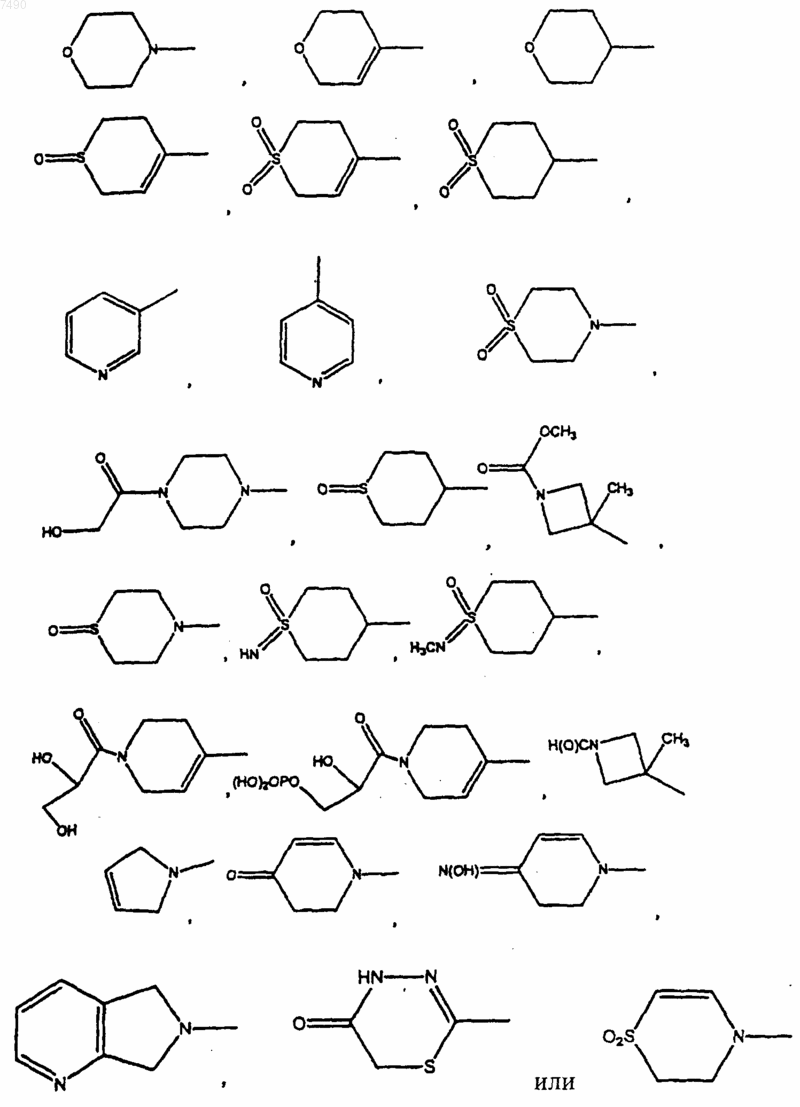
10. Соединение по п.8, в котором В представляет собой
11. Соединение по п.2, в котором оба заместителя R2 представляют собой F.
12. Соединение по п.2, в котором один R2 и В совместно образуют 2,3-дигидро-6-бензотиазолил, 2,3-дигидро-6-бензоксазолил, 2,3-дигидро-1Н-индолил, 3,4-дигидро-2Н-1,4-бензоксазинил, 3,4-дигидро-2Н-1,4-бензотиазинил, 1,2,3,4-тетрагидрохинолинил, возможно замещенные 1-4 заместителями, выбранными из =O, =S, C1-С6алкила, -С(O)Н, -С(O)СН2ОН или галогено.
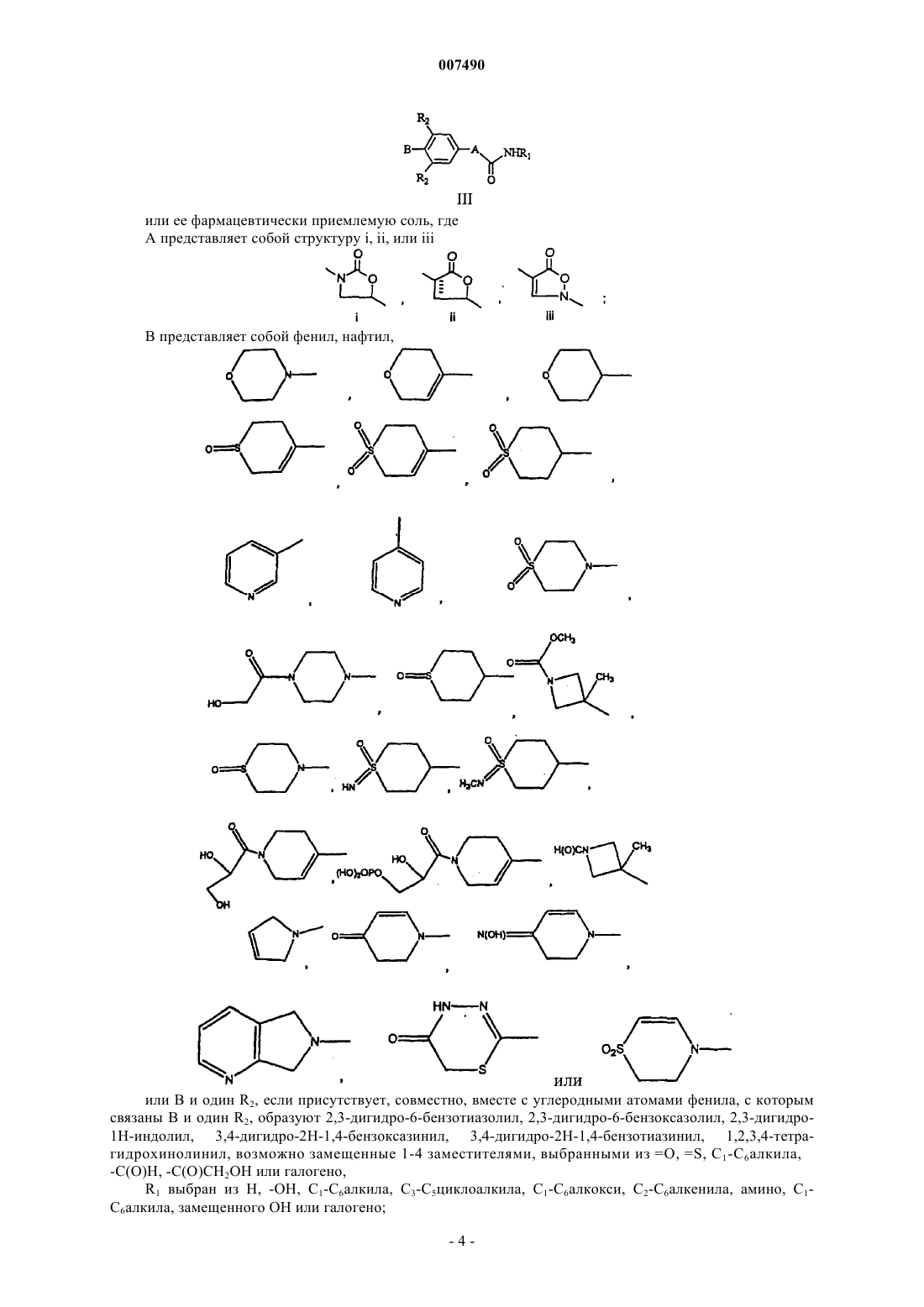
13. Соединение формулы III
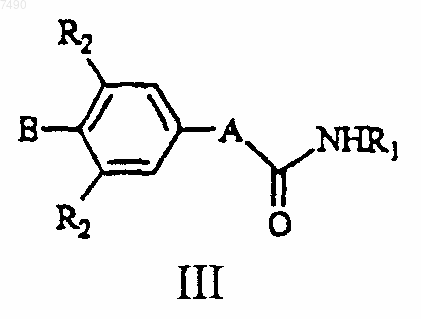
или ее фармацевтически приемлемая соль,
где А представляет собой структуру i, ii или iii

В представляет собой фенил, нафтил
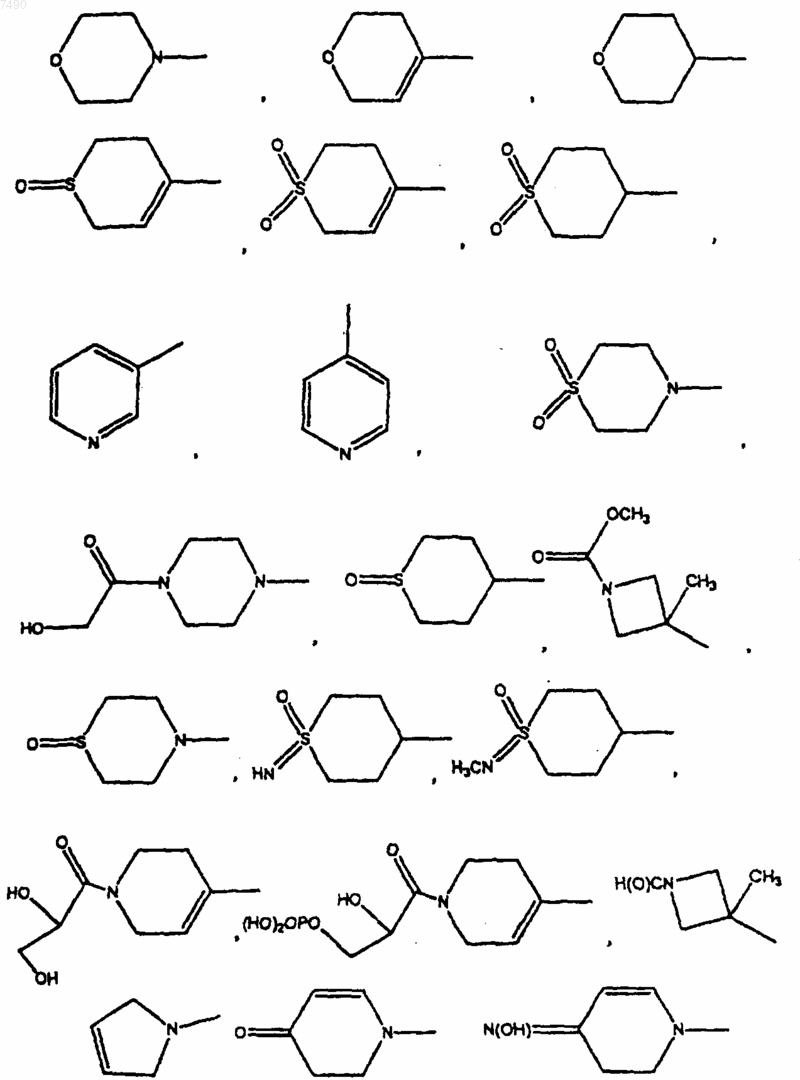
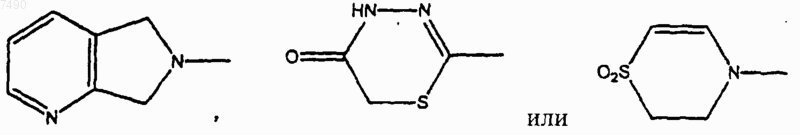
или В и один R2, если присутствует, совместно, вместе с углеродными атомами фенила, с которым связаны В и один R2, образуют 2,3-дигидро-6-бензотиазолил, 2,3-дигидро-6-бензоксазолил, 2,3-дигидро-1Н-индолил, 3,4-дигидро-2Н-1,4-бензоксазинил, 3,4-дигидро-2Н-1,4-бензотиазинил, 1,2,3,4-тетрагидрохинолинил, возможно замещенные 1-4 заместителями, выбранными из =O, =S, C1-С6алкила, -С(O)Н, -С(O)СН2OН или галогено;
R1 выбран из Н, -ОН, C1-С6алкила, С3-С5циклоалкила, C1-С6алкокси, С2-С6алкенила, амино, C1-С6алкила, замещенного ОН или галогено;
каждый R2 независимо выбран из С1-С2алкила, амино, галогено.
14. Соединение по п.13, в котором каждый R2 независимо выбран из F, Cl, Br, NH2 и СН3.
15. Соединение по п.13, в котором структура А представляет собой
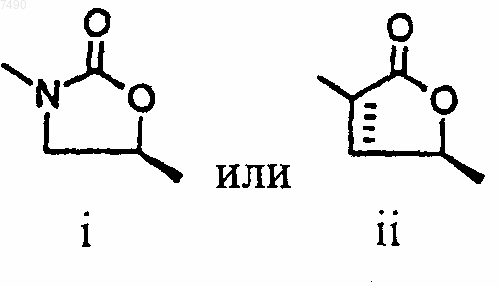
16. Соединение по п.15, в котором структура А представляет собой
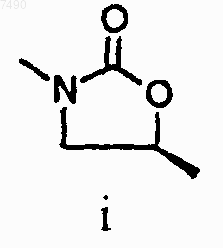
17. Соединение по п.13, в котором R1 представляет собой Н, -NH2, -ОН, С1-4алкил, С3-5циклоалкил, С1-4алкокси или С2-4алкенил, причем С1-4алкил возможно замещен галогено или -ОН.
18. Соединение по п.17, в котором R1 представляет собой Н, -ОН, -СН2-СН=СН2, метил, этил, пропил, -CH2-CH2F, -CH2-CH2OH или метокси.
19. Соединение по п.13, в котором В выбран из
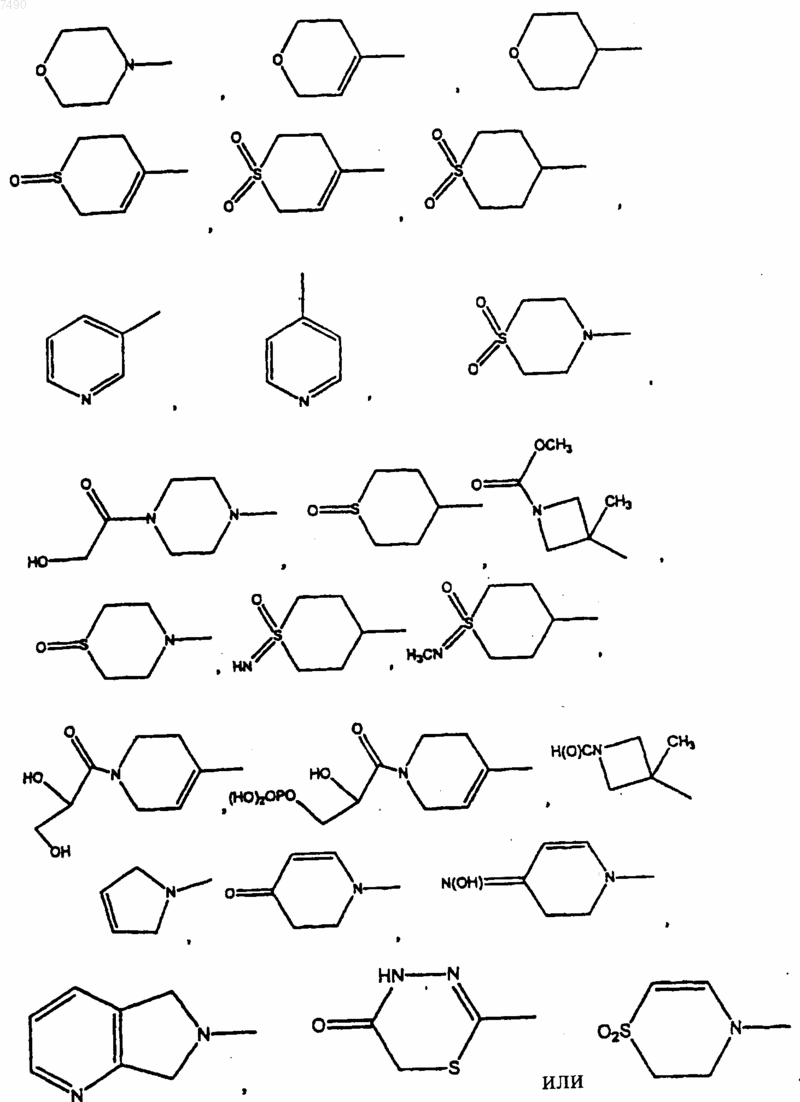
20. Соединение по п.13, в котором В представляет собой

21. Соединение по п.13, в котором В представляет собой

22. Соединение по п.13, в котором оба заместителя R2 представляют собой F.
23. Соединение, выбранное из
(5R)-(-)-3-[3-фтор-4-(4-морфолинил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-(-)-3-[3-фтор-4-(4-морфолинил)фенил]-N-метил-2-оксо-5-оксазолидинкарбоксамида;
(5R)-(-)-3-[3-фтор-4-(4-морфолинил)фенил]-N-аллил-2-оксо-5-оксазолидинкарбоксамида;
(5R)-(-)-3-[3-фтор-4-(4-морфолинил)фенил]-N-пропил-2-оксо-5-оксазолидинкарбоксамида;
(5R)-(-)-3-[3-фтор-4-(4-морфолинил)фенил]-N-метокси-2-оксо-5-оксазолидинкарбоксамида;
(5R)-(-)-N-метил-3-[3,5-дифтор-4-(4-морфолинил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-(-)-3-[3-фтор-4-(4-морфолинил)фенил]-N-гидрокси-2-оксо-5-оксазолидинкарбоксамида и
(5R)-(-)-3-[3,5-дифтор-4-(4-морфолинил)фенил]-2-оксо-5-оксазолидинкарбоксамида.
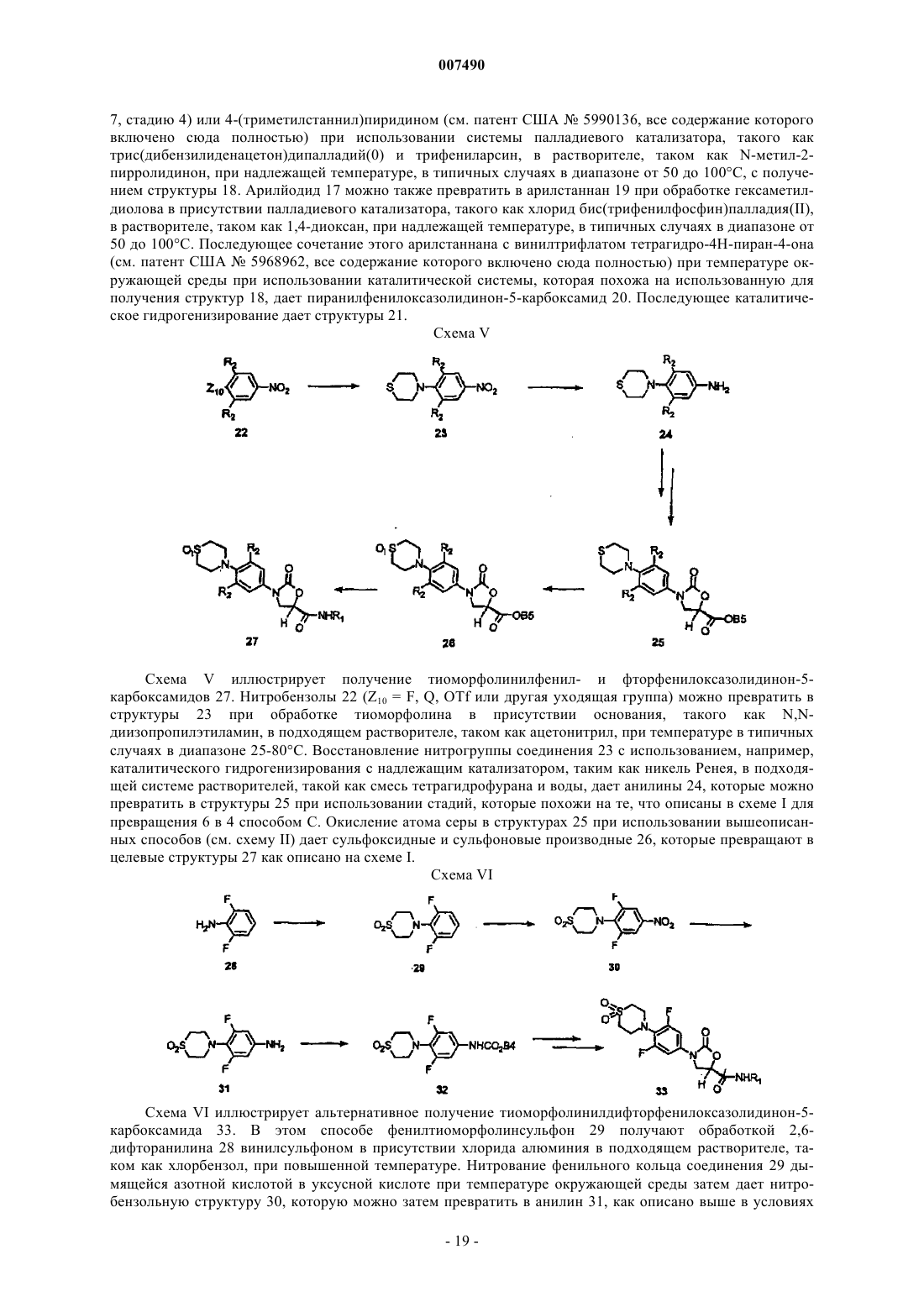
24. Соединение, выбранное из (5R)-(-)-3-[4-(3-пиридил)-3-фторфенил]-2-оксо-5-оксазолидинкарбоксамида и (5R)-(-)-3-[4-(4-пиридил)-3-фторфенил]-2-оксо-5-оксазолидинкарбоксамида.
25. Соединение, выбранное из (5R)-(-)-3-[4-(3,6-дигидро-2Н-пиран-4-ил)-3-фторфенил]-2-оксо-5-оксазолидинкарбоксамида и (5R)-(-)-3-[4-(тетрагидро-2Н-пиран-4-ил)-3-фторфенил]-2-оксо-5-оксазолидинкарбоксамида.
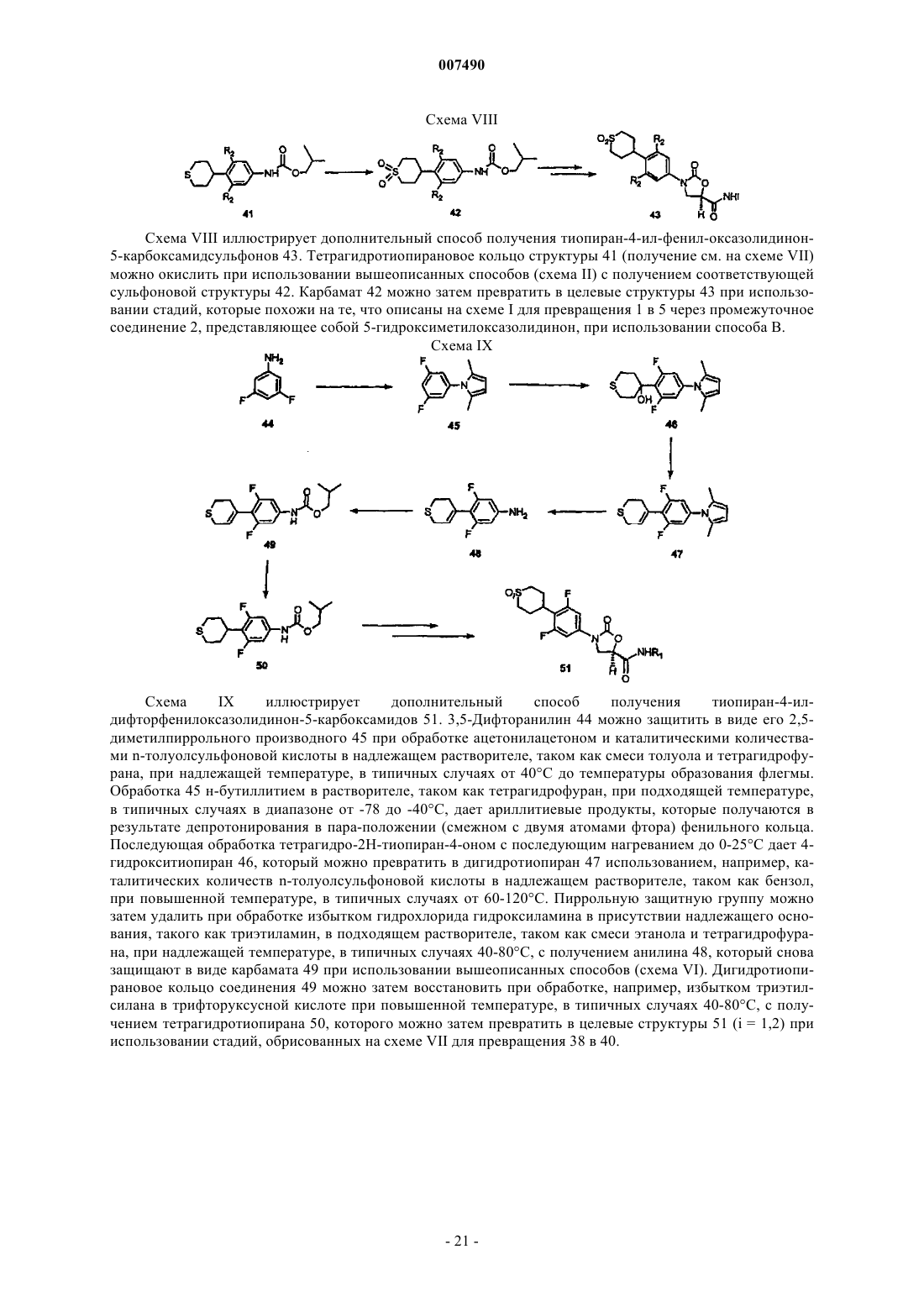
26. Соединение, выбранное из S-оксида (5R)-3-[4-(3,6-дигидро-2Н-тиопиран-4-ил)-3-фторфенил]-2-оксо-5-оксазолидинкарбоксамида;
S,S-диоксида (5R)-(-)-3-[4-(3,6-дигидро-2Н-тиопиран-4-ил)-3-фторфенил]-2-оксо-5-оксазолидинкарбоксамида;
S,S-диоксида (5R)-(-)-3-[4-(тетрагидро-2Н-тиопиран-4-ил)-3-фторфенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-3-[3-фтор-4-(цис-тетрагидро-1-оксидо-2Н-тиопиран-4-ил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-3-[3-фтор-4-(транс-тетрагидро-1-оксидо-2Н-тиопиран-4-ил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
S,S-диоксида(5R)-(-)-3-[4-(тетрагидро-2Н-тиопиран-4-ил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-3-[4-(цис-тетрагидро-1-оксидо-2Н-тиопиран-4-ил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-3-[4-(транс-тетрагидро-1-оксидо-2Н-тиопиран-4-ил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
S,S-диоксида (5R)-(-)-N-метил-3-[4-(тетрагидро-2Н-тиопиран-4-ил)-3-фторфенил]-2-оксо-5-оксазолидинкарбоксамида;
S,S-диоксида (5R)-3-[3,5-дифтор-4-(тетрагидро-2Н-тиопиран-4-ил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-(-)-3-[3,5-дифтор-4-(цис-тетрагидро-1-оксидо-2Н-тиопиран-4-ил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-(-)-3-[3,5-дифтор-4-(транс-тетрагидро-1-оксидо-2H-тиопиран-4-ил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-N-метил-3-[3,5-дифтор-4-(транс-тетрагидро-1-оксидо-2H-тиопиран-4-ил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-3-[4-(цис-1-имино-1-оксидо-1,1,3,4,5,6-гексагидро-2H-тиопиран-4-ил)-3-фторфенил]-2-оксо-5-оксазолидинкарбоксамида и
(5R)-N-метил-3-[3-фтор-4-(транс-тетрагидро-1-оксидо-2H-тиопиран-4-ил)фенил]-2-оксо-5-оксазолидинкарбоксамида.
27. Соединение (5R)-(-)-3-[3-фтор-4-[4-(гидроксиацетил)-1-пиперазинил]фенил]-2-оксо-5-оксазолидинкарбоксамид.
28. Соединение, выбранное из
S,S-диоксида (5R)-(-)-3-[4-(тиоморфолин-4-ил)-3,5-дифторфенил]-2-оксо-5-оксазолидинскарбоксамида;
S,S-диоксида (5R)-(-)-3-[4-(тиоморфолин-4-ил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
S,S-диоксида (5R)-(-)-3-[3-фтор-4-(тиоморфолин-4-ил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
S-оксида (5R)-(-)-3-[3-фтор-4-(тиоморфолин-4-ил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
S-оксида (5R)-(-)-3-[3,5-дифтор-4-(тиоморфолин-4-ил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
S-оксида (5R)-(-)-N-метил-3-[3,5-дифтор-4-(тиоморфолин-4-ил)фенил]-2-оксо-5-оксазолидинкарбоксамида и
S,S-диоксида (5R)-(-)-N-метил-3-[3,5-дифтор-4-(тиоморфолин-4-ил)фенил]-2-оксо-5-оксазолидинкарбоксамида.
29. Соединение, выбранное из
(5R)-(-)-3-(2,3-дигидро-3-метил-2-оксо-6-бензотиазолил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-(-)-3-(2,3-дигидро-3-этил-2-оксо-6-бензотиазолил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-(-)-3-(2,3-дигидро-3-изопропил-2-оксо-6-бензотиазолил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-(-)-N-метил-3-(2,3-дигидро-3-метил-2-оксо-6-бензотиазолил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-(-)-N-этил-3-(2,3-дигидро-3-метил-2-оксо-6-бензотиазолил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-(-)-N-(2-гидроксиэтил)-3-(2,3-дигидро-3-метил-2-оксо-6-бензотиазолил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-N-(2-фторэтил)-3-(2,3-дигидро-3-метил-2-оксо-6-бензотиазолил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-(-)-N-метил-3-(2,3-дигидро-3-этил-2-оксо-6-бензотиазолил)-2-оксо-5-оксазолидинкарбоксамида и
(5R)-(-)-N-метил-3-(2,3-дигидро-3-изопропил-2-оксо-6-бензотиазолил)-2-оксо-5-оксазолидинкарбоксамида.
30. Соединение, выбранное из
(5R)-(-)-3-(2,3-дигидро-3-метил-2-оксо-6-бензоксазолил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-(-)-3-(2,3-дигидро-3-этил-2-оксо-6-бензоксазолил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-(-)-3-(2,3-дигидро-3-изопропил-2-оксо-6-бензоксазолил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-(-)-N-метил-3-(2,3-дигидро-3-метил-2-оксо-6-бензоксазолил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-(-)-N-метил-3-(2,3-дигидро-3-этил-2-оксо-6-бензоксазолил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-(-)-N-метил-3-(2,3-дигидро-3-изопропил-2-оксо-6-бензоксазолил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-3-(2,3-дигидро-3-метил-4-фтор-2-оксо-6-бензоксазолил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-N-метил-3-(2,3-дигидро-3-метил-4-фтор-2-оксо-6-бензоксазолил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-3-(2,3-дигидро-3-этил-4-фтор-2-оксо-6-бензоксазолил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-N-метил-3-(2,3-дигидро-3-этил-4-фтор-2-оксо-6-бензоксазолил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-3-(2,3-дигидро-3-изопропил-4-фтор-2-оксо-6-бензотиазолил)-2-оксо-5-оксазолидинкарбоксамида и
(5R)-N-метил-3-(2,3-дигидро-3-изопропил-4-фтор-2-оксо-6-бензоксазолил)-2-оксо-5-оксазолидинкарбоксамида.
31. Соединение, выбранное из
(5R)-3-[(2R)-2,3-дигидро-1 -формил-2-метил-1Н-индол-5-ил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-3-[(2R)-2,3-дигидро-1-(гидроксиацетил)-2-метил-1Н-индол-5-ил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-3-[4-(5,7-дигидро-6Н-пирроло[3,4-b]пиридин-6-ил)-3-фторфенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-N-метил-3-[4-(5,7-дигидро-6Н-пирроло[3,4-b]пиридин-6-ил)-3-фторфенил]-2-оксо-5-оксазолидинкарбоксамида.
32. Соединение, выбранное из
(5R)-(-)-3-[3,5-дифтор-4-(1-метоксикарбонил-3-метилазетидин-3-ил)фенил]-2-оксо-5-оксазолидинкарбоксамида и
(5R)-(-)-N-метил-3-[3,5-дифтор-4-(1-метоксикарбонил-3-метилазетидин-3-ил)фенил]-2-оксо-5-оксазолидинкарбоксамида.
33. Соединение, выбранное из
(5R)-3-(3,4-дигидро-4-метил-3-оксо-2H-1,4-бензоксазин-7-ил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-N-метил-3-(3,4-дигидро-4-метил-3-оксо-2H-1,4-бензоксазин-7-ил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-N-(2-фторэтил)-3-(3,4-дигидро-4-метил-3-оксо-2H-1,4-бензоксазин-7-ил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-3-(3,4-дигидро-4-метил-3-оксо-2H-1,4-бензотиазин-7-ил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-3-(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-6-ил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-N-метил-3-(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-6-ил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-3-(2,2-дифтор-4-метил-3,4-дигидро-3-оксо-2H-1,4-бензоксазин-7-ил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-N-метил-3-(2,2-дифтор-4-метил-3,4-дигидро-3-оксо-2H-1,4-бензоксазин-7-ил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-3-(8-фтор-1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-6-ил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-N-метил-3-(8-фтор-1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-6-ил)-2-оксо-5-оксазолидинкарбоксамида;
(5R)-3-(4-метил-3-тиоксо-3,4-дигидро-2Н-1,4-бензотиазин-7-ил)-2-оксо-5-оксазолидинкарбоксамида и
(5R)-N-метил-3-(3,4-дигидро-4-метил-3-оксо-2H-1,4-бензотиазин-7-ил)-2-оксо-5-оксазолидинкарбоксамида.
34. Соединение, выбранное из
(5R)-3-[3-фтор-4-(5-оксо-5,6-дигидро-4H-[1,3,4]-тиадиазин-2-ил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-3-[4-(1,1-диоксидо-2,3-дигидро-4Н-1,4-тиазин-4-ил)-3,5-дифторфенил]-2-оксо-5-оксазолидинкарбоксамида и
(5R)-3-[4-(2,5-дигидро-1Н-пиррол-1-ил)-3,5-дифторфенил]-2-оксо-5-оксазолидинкарбоксамида.
35. Соединение, выбранное из
(5R)-3-[4-(4-оксо-3,4-дигидро-1(2H)-пиридинил)-3-фторфенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-N-метил-3-[4-(4-оксо-3,4-дигидро-1(2H)-пиридинил)-3-фторфенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-N-этил-3-[4-(4-оксо-3,4-дигидро-1(2H)-пиридинил)-3-фторфенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-3-[4-(4-оксо-3,4-дигидро-1(2H)-пиридинил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-N-метил-3-[4-(4-оксо-3,4-дигидро-1(2H)-пиридинил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-N-этил-3-[4-(4-оксо-3,4-дигидро-1(2H)-пиридинил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-N-(2-фторэтил)-3-[4-(4-оксо-3,4-дигидро-1(2H)-пиридинил)фенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-3-[4-(4-оксо-3,4-дигидро-1(2H)-пиридинил)-3,5-дифторфенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-N-метил-3-[4-(4-оксо-3,4-дигидро-1(2H)-пиридинил)-3,5-дифторфенил]-2-оксо-5-оксазолидинкарбоксамида;
(5R)-N-этил-3-[4-(4-оксо-3,4-дигидро-1(2H)-пиридинил)-3,5-дифторфенил]-2-оксо-5-оксазолидинкарбоксамида и
(5R)-3-[4-[3,4-дигидро-4-(гидроксиимино)-1(2H)-пиридинил]-3-фторфенил]-2-оксо-5-оксазолидинкарбоксамида.
36. Способ лечения микробных инфекций у млекопитающих, при котором указанному млекопитающему вводят эффективное количество соединения по п.1 или 13.
37. Способ по п.36, где указанное соединение вводят млекопитающему перорально, парентерально, через кожу или локально в фармацевтической композиции.
38. Способ по п.37, где указаное соединение вводят в количестве от около 0,1 до около 100 мг/кг массы тела в сутки.
39. Способ по п.37, где указанное соединение вводят в количестве от около 1 до около 50 мг/кг массы тела в сутки.
40. Фармацевтическая композиция, содержащая соединение по п.1 или соединение по п.13 и фармацевтически приемлемый носитель.
Текст
007490 Настоящее изобретение относится к новым N-арил-2-оксазолидинон-5-карбоксамидам, их производным и их получению. Эти соединения имеют сильную антибактериальную активность. Предшествующий уровень техники Оксазолидиноновые антибактериальные агенты представляют собой новый синтетический класс противомикробных средств с сильной активностью против множества патогенов человека и животных, в том числе против грамположительных аэробных бактерий, таких как мультирезистентные стафилококки и стрептококки, анаэробных организмов, таких как разновидности бактероидов и клостридий, и кислотоустойчивых организмов, таких как Mycobacterium tuberculosis и Mycobacterium avium. Краткое изложение сущности изобретения В одном аспекте это изобретение предлагает соединение формулы I или его фармацевтически приемлемую соль, где А представляет собой структуру i, ii или iii С представляет собой фенил или нафтил, возможно замещенный одним-тремя из R2; В выбран из фенила, нафтила, или В и один R2, если присутствует, совместно, вместе с углеродными атомами фенила, с которым связаны В и один R2, образуют 2,3-дигидро-6-бензотиазолил, 2,3-дигидро-6-бензоксазолил, 2,3-дигидро-1 Ниндолил, 3,4-дигидро-2 Н-1,4-бензоксазинил, 3,4-дигидро-2 Н-1,4-бензотиазинил, 1,2,3,4-тетрагидрохинолинил, возможно замещенные 1-4 заместителями, выбранными из =O, =S, C1-С 6 алкила, -С(O)Н, -С(O)СН 2OН или галогено,-1 007490R1 выбран из Н, -ОН, C1-С 6 алкила, С 3-С 7 циклоалкила, C1-С 6 алкокси, С 2-С 6 алкенила, амино, C1-С 6 алкила, замещенного ОН или галогено; каждый R2 независимо выбран из C1-С 6 алкила, амино, галогено. В другом аспекте это изобретение предлагает соединение формулы II или его фармацевтически приемлемую соль, где А представляет собой структуру i, ii или iii В выбран из фенила, нафтила, или В и один R2, если присутствует, совместно, вместе с углеродными атомами фенила, с которым связаны В и один R2, образуют 2,3-дигидро-6-бензотиазолил, 2,3-дигидро-6-бензоксазолил, 2,3-дигидро 1H-индолил, 3,4-дигидро-2 Н-1,4-бензоксазинил, 3,4-дигидро-2 Н-1,4-бензотиазинил, 1,2,3,4-тетрагидрохинолинил, возможно замещенные 1-4 заместителями, выбранными из =O, =S, C1-С 6 алкила, -С(O)Н,-С(O)СН 2OН или галогено,R1 выбран из Н, -ОН, C1-С 6 алкила, С 3-С 7 циклоалкила, C1-С 6 алкокси, С 2-С 6 алкенила, амино, C1 С 6 алкила, замещенного ОН или галогено; каждый R2 независимо выбран из C1-С 6 алкила, амино, галогено. Предпочтительно каждый R2 независимо выбран из F, Cl, Br, NH2 и СН 3. Предпочтительно структура А представляет собой Более предпочтительно структура А представляет собойR1 может представлять собой Н, -NH2, -ОН, С 1-4 алкил, С 3-5 циклоалкил, С 1-4 алкокси или С 2-4 алкенил,причем С 1-4 алкил возможно замещен галогено или -ОН. Предпочтительно R1 представляет собой Н, -ОН, -СН 2-СН=СН 2, метил, этил, пропил, -CH2-CH2F,-CH2-CH2OH или метокси. Предпочтительно В представляет собой Оба заместителя R2 могут представлять собой F. Один R2 и В могут совместно образовывать 2,3-дигидро-6-бензотиазолил, 2,3-дигидро-6 бензоксазолил, 2,3-дигидро-1 Н-индолил, 3,4-дигидро-2 Н-1,4-бензоксазинил, 3,4-дигидро-2 Н-1,4 бензотиазинил, 1,2,3,4-тетрагидрохинолинил, возможно замещенные 1-4 заместителями, выбранными из=O, =S, C1-С 6 алкила, -С(O)Н, -С(O)СН 2 ОН или галогено. В другом аспекте это изобретение содержит в себе соединение формулы III или ее фармацевтически приемлемую соль, где А представляет собой структуру i, ii, или iii В представляет собой фенил, нафтил, или В и один R2, если присутствует, совместно, вместе с углеродными атомами фенила, с которым связаны В и один R2, образуют 2,3-дигидро-6-бензотиазолил, 2,3-дигидро-6-бензоксазолил, 2,3-дигидро 1 Н-индолил, 3,4-дигидро-2 Н-1,4-бензоксазинил, 3,4-дигидро-2 Н-1,4-бензотиазинил, 1,2,3,4-тетрагидрохинолинил, возможно замещенные 1-4 заместителями, выбранными из =O, =S, C1-С 6 алкила,-С(O)Н, -С(O)СН 2 ОН или галогено,R1 выбран из Н, -ОН, C1-С 6 алкила, С 3-С 5 циклоалкила, C1-С 6 алкокси, С 2-С 6 алкенила, амино, C1 С 6 алкила, замещенного ОН или галогено;-4 007490 каждый R2 независимо выбран из C1-С 2 алкила, амино, галогено. Предпочтительно каждый R2 независимо выбран из F, Cl, Br, NH2 и СН 3. Структура А может представлять собойR1 может представлять собой Н, -NH2, -ОН, С 1-4 алкил, С 3-5 циклоалкил, C1-4 алкокси или С 2-4 алкенил,причем С 1-4 алкил возможно замещен галогено или -ОН. Предпочтительно R1 представляет собой Н, -ОН, -СН 2-СН=СН 2, метил, этил, пропил, -CH2-CH2F,-CH2-CH2OH или метокси. Предпочтительно В выбран из Оба заместителя R2 могут представлять собой F. Конкретные соединения выбраны из следующих соединений, без ограничения ими:(5R)-3-[4-[3,4-дигидро-4-(гидроксиимино)-1(2H)-пиридинил]-3-фторфенил]-2-оксо-5-оксазолидинкарбоксамида. Согласно данному изобретению также предложен способ лечения микробных инфекций у млекопитающих, при котором указанному млекопитающему вводят эффективное количество соединения, как они описаны выше. Указанное соединение можно вводить млекопитающему перорально, парентерально, через кожу или локально в фармацевтической композиции. Предпочтительно указанное соединение вводят в количестве от около 0,1 до около 100 мг/кг массы тела в сутки. Более предпочтительно указанное соединение вводят в количестве от около 1 до около 50 мг/кг массы тела в сутки. Согласно данному изобретению также предложена фармацевтическая композиция, содержащая соединение, как оно определено выше, и фармацевтически приемлемый носитель. Подробное описание изобретения Использованы следующие определения, если не указано иначе. Переменные, включающие в себя букву с последующим численным надстрочным индексом, эквивалентны той же букве с последующим тем же числом в качестве подстрочного индекса. К примеру, R1 иR1 являются эквивалентными и относятся к одной и той же переменной. Содержание атомов углерода у разных содержащих углеводороды группировок может быть указано префиксом, обозначающим минимальное и максимальное число атомов углерода в группировке, то есть,префикс Ci-j указывает группировку с числом атомов углерода от целого "i" до целого "j" включительно. Так, например, С 1-7 алкил относится к алкилу, имеющему от одного до семи атомов углерода включительно. Термин "галогено" относится к атому галогена, выбранному из Cl, Br, I и F. Термин "алкил" относится к группировкам как с прямой, так и разветвленной цепью. Если конкретно не указано иначе, как, например, префиксом i-j, группировки, представляющие собой алкил, включают в себя число атомов углерода между 1 и 6. Термин "алкенил" относится к группировкам как с прямой, так и разветвленной цепью, содержащим по меньшей мере одну -С=С-. Если конкретно не указано иначе, как, например, префиксом i-j, группировки, представляющие собой алкенил, включают в себя число атомов углерода между 2 и 6. Термин "алкинил" относится к группировкам как с прямой, так и разветвленной цепью, содержащим по меньшей мере одну -С С-. Если конкретно не указано иначе, как, например, префиксом i-j,группировки, представляющие собой алкинил, включают в себя число атомов углерода между 2 и 6. Термин "алкокси" относится к группам, представляющим собой -О-алкил. Если конкретно не указано иначе, как, например, префиксом i-j, алкильная часть группы, представляющей собой -О-алкил,включают в себя число атомов углерода между 1 и 6. Термин "амино" относится к NH2.-8 007490 Термин "циклоалкил" относится к группировке, представляющей собой циклический алкил. Если конкретно не указано иначе, как, например, префиксом i-j, группировка, представляющая собой циклоалкил, должна включать в себя число атомов углерода между 3 и 7. Термин "циклоалкенил" относится к группировке, представляющей собой циклический алкенил. Если конкретно не указано иначе, как, например, префиксом i-j, группировка, представляющая собой циклоалкенил, должна включать в себя число атомов углерода между 3 и 7 и по меньшей мере одну группу -С=С- в циклическом кольце. Термин "арил" относится к фенилу и нафтилу. Термин "гетероцикл" относится к моно- или бициклическим кольцевым системам, содержащим по меньшей мере один гетероатом, выбранный из О, S и N. Каждое моноциклическое кольцо может быть ароматическим, насыщенным или частично ненасыщенным. Бициклическая кольцевая система может включать в себя моноциклическое кольцо, содержащее по меньшей мере один гетероатом, конденсированное с группой, представляющей собой циклоалкил или арил. Бициклическая кольцевая система может также включать в себя моноциклическое кольцо, содержащее по меньшей мере один гетероатом, конденсированное с другой гетероциклической моноциклической кольцевой системой. Примеры "гетероцикла" включают в себя, но без ограничения ими, пиридин, тиофен, фуран, пиразолин, пиримидин, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил,3-пиридазинил, 4-пиридазинил, 3-пиразинил, 4-оксо-2-имидазолил, 2-имидазолил, 4-имидазолил, 3 изоксазолил, 4-изоксазолил, 5-изоксазолил, 3-пиразолил, 4-пиразолил, 5-пиразолил, 2-оксазолил, 4 оксазолил, 4-оксо-2-оксазолил, 5-оксазолил, 1,2,3-оксатиазол, 1,2,3-оксадиазол, 1,2,4-оксадиазол, 1,2,5 оксадиазол, 1,3,4-оксадиазол, 2-тиазолил, 4-тиазолил, 5-тиазолил, 3-изотиазол, 4-изотиазол, 2-изотиазол. 2-фуранил, 3-фуранил, 2-тиенил, 3-тиенил, 2-пирролил, 3-пирролил, 3-изопирролил, 4-изопирролил, 5 изопирролил, 1,2,3-оксатиазол-1-оксид, 1,2,4-оксадиазол-3-ил, 1,2,4-оксадиазол-5-ил, 5-оксо-1,2,4 оксадиазол-3-ил, 1,2,4-тиадиазол-3-ил, 1,2,4-тиадиазол-5-ил, 3-оксо-1,2,4-тиадиазол-5-ил, 1,3,4 тиадиазол-5-ил, 2-оксо-1,3,4-тиадиазол-5-ил, 1,2,4-триазол-3-ил, 1,2,4-триазол-5-ил, 1,2,3,4-тетразол-5-ил,5-оксазолил, 3-изотиазолил, 4-изотиазолил, 5-изотиазолил, 1,3,4,-оксадиазол, 4-оксо-2-тиазолинил, 5 метил-1,3,4-тиадиазол-2-ил, тиазолдион, 1,2,3,4-тиатриазол, 1,2,4-дитиазолон, фталимид, хинолинил,морфолинил, бензоксазоил, диазинил, триазинил, хинолинил, хиноксалинил, нафтиридинил, азетидинил,пирролидинил, гидантоинил, оксатиоланил, диоксоланил, имидазолидинил, и азабицикло[2.2.1]гептил. Термин "гетероарил" относится к ароматической гетероциклической системе, примеры которой включают в себя, но без ограничения ими, пиридин и тиофен. Термин "замещенный алкил" относится к группировке, представляющей собой алкил, которая включает в себя 1-4 заместителя, выбранных из галогено, гетероцикла, циклоалкила, циклоалкенила, арила, -OQ10, -SQ10,-S(O) 2Q 10, -S(O)Q 10, -OS(O) 2Q 10, -C(=NQ 10)Q 10, -C(=NOH)Q 10, -SC(O)Q 10, -NQ10Q 10, -C(O)Q10,-C(S)Q 10, -C(O)OQ 10, -OC(O)Q 10, -C(O)NQ 10Q 10, -C(O)C(Q 16) 20C(O)Q 10, -CN, =O, =S, -NQ 10C(O)Q 10,-NQ 10C(O)NQ 10Q 10, -S(O)2NQ 10Q 10, -NQ 10S(O) 2Q 10, -NQ 10S(O)Q 10, -NQ 10SQ 10, -NO 2, -OPO(OH) 2 и-SNQ 10Q 10. Каждый из гетероцикла, циклоалкила, циклоалкенила и арила может быть возможно замещенным 1-4 заместителями, независимо выбранными из галогено и Q15. Термин "замещенный арил" относится к группировке, представляющей собой арил, которая имееет 1-3 заместителя, выбранных из -OQ 10 , -SQ 10 , -S(O) 2 Q 10 , -S(O)Q 10 , -OS(O) 2 Q 10 , -C(=NQ 10 )Q 10 ,-C(=NOH)Q 10 , -SC(O)Q 10 , -NQ 10 Q 10 , -C(O)Q 10 , -C(S)Q 10 , -C(O)OQ 10 , -OC(O)Q 10 , -C(O)NQ 10 Q 10 ,-C(O)C(Q 16 ) 2 OC(O)Q 10 , -CN, -NQ 10 C(O)Q 10 , -NQ 10 C(O)NQ 10 Q 10 , -S(O) 2 NQ 10 Q 10 , -NQ 10 S(O) 2 Q 10 ,-NQ 10 S(O)Q 10 , -NQ 10 SQ 10 , -NO 2 , -SNQ 10 Q 10 , алкила, замещенного алкила, гетероцикла, галогено,циклоалкила, циклоалкенила и арила. Гетероцикл, циклоалкил, циклоалкенил и арил может быть возможно замещенным 1-3 заместителями, выбранными из галогено и Q15. Термин "замещенный гетероцикл" относится к гетероциклической группировке, включающей в себя 1-4 заместителя, которые выбраны из -OQ10, -SQ10, -S(O)2Q10, -S(O)Q10, -OS(O)2Q10, -C(=NQ10)Q10,-C(=NOH)Q 10 , -SC(O)Q 10 , -NQ 10 Q 10 -C(O)Q 10 , -C(S)Q 10 , -C(O)OQ 10 , -OC(O)Q 10 , -C(O)NQ 10 Q 10 ,-C(O)C(Q 16 ) 2 OC(O)Q 10 , -CN, -NQ 10 C(O)Q 10 , -NQ 10 C(O)NQ 10 Q 10 , -S(O) 2 NQ 10 Q 10 , -NQ 10 S(O) 2 Q 10 ,-NQ 10 S(O)Q 10 , -NQ 10 SQ 10 , -NO 2 , -SNQ 10 Q 10 , алкила, замещенного алкила, гетероцикла, галогено, циклоалкила, циклоалкенила и арила. Замещенный гетероцикл также может быть замещенным одним или более чем одним из заместителей, представляющих собой =O или =S, при том условии, что О или S связаны с атомами кольца, способными поддерживать двойную связь между атомом кольца и О или S. Гетероцикл, циклоалкил, циклоалкенил и арил может быть возможно замещенным 1-3 заместителями, выбранными из галогено и Q15. Термин "замещенный алкенил" относится к группировке, представляющей собой алкенил, которая включает в себя 1-3 заместителя, представляющего собой -OQ10, -SQ10, -S(O)2Q10, -S(O)Q10, -OS(O)2Q10,-C(=NQ 10)Q 10, -SC(O)Q 10, -NQ 10Q 10, -C(O)Q 10, -C(S)Q 10, -C(O)OQ10, -OC(O)Q 10, -C(O)NQ 10Q10,-C(O)C(Q 16) 2OC(O)Q 10, -CN, =O, =S, -NQ 10C(O)Q 10, -NQ 10C(O)NQ 10Q 10, -S(O) 2NQ 10Q 10,-NQ 10S(O) 2Q 10, -NQ 10S(O)Q 10, -NQ 10SQ10, -NO 2, -SNQ 10Q 10, алкил, замещенный алкил, гетероцикл,галогено, циклоалкил, циклоалкенил и арил. Гетероцикл, циклоалкил, циклоалкенил и арил может быть возможно замещенным 1-3 заместителями, выбранными из галогено и Q15.-9 007490 Термин "замещенный алкокси" относится к группировке, представляющей собой алкокси, которая включает в себя 1-3 заместителя, представляющих собой -OQ10, -SQ10, -S(O)2Q10, -S(O)Q10, -OS(O)2Q10,-C(=NQ 10)Q 10, -SC(O)Q 10 -NQ 10Q 10, -C(O)Q 10, -C(S)Q 10, -C(O)OQ 10, -OC(O)Q10, -C(O)NQ 10Q 10,-C(O)C(Q 16) 2OC(O)Q 10, -CN, =O, =S, -NQ 10C(O)Q 10, -NQ 10C(O)NQ 10Q 10, -S(O) 2NQ 10Q 10,-NQ 10S(O) 2Q 10, -NQ10S(O)Q10, -NQ10SQl0, -NO2, -SNQ10Q10, алкил, замещенный алкил, гетероцикл, галогено, циклоалкил, циклоалкенил и арил. Гетероцикл, циклоалкил, циклоалкенил, и арил может быть возможно замещенным 1-3 заместителями, выбранными из галогено и Q15. Термин "замещенный циклоалкенил" относится к группировке, представляющей собой циклоалкенил, которая включает в себя 1-3 заместителя, представляющих собой -OQ10, -SQ10, -S(O)2Q10, -S(O)Q10,-OSC(O) 2Q 10, -C(=NQ 10)Q10, -SC(O)Q 10, -NQ 10Q 10, -C(O)Q 10, -C(S)Q 10, -C(O)OQ 10, -OC(O)Q 10,-C(O)NQ 10Q 10, -(O)C(Q 16) 2OC(O)Q 10, -CN, =O, =S, -NQ 10C(O)Q 10, -NQ 10C(O)NQ10Q 10, -S(O) 2NQ 10Q 10,-NQ 10S(O) 2Q 10, -NQ 10S(O)Q 10, -NQ 10SQ 10, -NO 2, -SNQ 10Q 10, алкил, замещенный алкил, гетероцикл,галогено, циклоалкил, циклоалкенил и арил. Гетероцикл, циклоалкил, циклоалкенил, и арил может быть возможно замещенным 1-3 заместителями, выбранными из галогено и Q15. Термин "замещенный амино" относится к группировке, представляющей собой амино, в которой один или оба из водородов амино заменены на группу, выбранную из -OQ10, -SQ10, -S(O)2Q10, -S(O)Q10,-OS(O)2Q10, -C(O)Q10, -C(S)Q10, -C(O)OQ10, -OC(O)Q10, -C(O)NQ10Q10, -C(O)C(Q16)2OC(O)Q10, -CN, алкила,замещенного алкила, гетероцикла, галогено, циклоалкила, циклоалкенила и арила. Гетероцикл, циклоалкил, циклоалкенил и арил может быть возможно замещенным 1-3 заместителями, выбранными из галогено и Q15. Каждый Q10 независимо выбирают из -Н, алкила, циклоалкила, гетероцикла, циклоалкенила и арила. Гетероцикл, циклоалкил, циклоалкенил и арил может быть возможно замещенным 1-3 заместителями, выбранными из галогено и Q13. Каждый Q11 независимо выбирают из -Н, галогено, алкила, арила, циклоалкила и гетероцикла. Алкил, циклоалкил и гетероцикл может быть возможно замещенным 1-3 заместителями, независимо выбранными из галогено, -NO2, -CN, =S, =O и Q14. Арил может быть возможно замещенным 1-3 заместителями, независимо выбранными из галогено, -NO2, -CN и Q14. Каждый Q 13 независимо выбирают из Q 11, -OQ 11, -SQ 11, -S(O) 2Q 11, -S(O)Q 11, -OS(O) 2Q 11,-C(=NQ 11)Q 11, -SC(O)Q 11, -NQ 11Q 11, -C(O)Q l1, -C(S)Q 11, -C(O)OQ 11, -OC(O)Q 11, -C(O)NQ11Q 11,-C(O)C(Q 16) 2OC(O)Q 10, -CN, =O, =S, -NQ 11C(O)Q l1, -NQ 11C(O)NQ 11Q 11, -S(O) 2NQ 11Q 11,-NQ11S(O)2Q11, -NQ11S(O)Q11, -NQ11SQ11, -NO2 и -SNQ11Q11 при том условии, что Q13 представляет собой не =O или =S, когда Q10 представляет собой арил или гетероцикл, не имеющий никакого атома, способного образовать двойную связь с О или S. Каждый Q14 представляет собой -Н или заместитель, выбранный из алкила, циклоалкила, циклоалкенила, фенила или нафтила, причем каждый возможно замещен 1-4 заместителями, независимо выбранными из -F, -Cl, -Br, -I, -OQ16, -SQ 16, -S(O) 2Q 16, -S(O)Q 16, -OS(O) 2Q 16, -NQ 16Q I6, -C(O)Q 16, -C(S)Q 16,-C(O)OQ16, -NO2, -C(O)NQ16Q16, -CN, -NQ16C(O)Q16, -NQ16C(O)NQ16Q16, -S(O)2NQ16Q16 и -NQ16S(O)2Q16. Алкил, циклоалкил и циклоалкенил может быть далее замещен =O или =S. Каждый Q15 представляет собой алкил, циклоалкил, циклоалкенил, гетероцикл, фенил или нафтил,причем каждый возможно замещен 1-4 заместителями, независимо выбранными из -F, -Cl, -Br, -I, -OQ16,-SQ16, -S(O)2Q16, -S(O)Q16, -OS(O)2Q16, -C(=NQ16)Q16, -SC(O)Q16, -NQ16Q16, -C(O)Q16, -C(S)Q16, -C(O)OQ16,-OC(O)Q16, -C(O)NQ16Q16, -C(O)C(Q16)2OC(O)Q16, -CN, -NQ16C(O)Q16, -NQ16C(O)NQ16Q16, -S(O)2NQ16Q16,-NQ16S(O)2Q16, -NQ16S(O)Q16, -NQ16SQ16, -NO2 и -SNQ16Q16. Алкил, циклоалкил и циклоалкенил может быть далее замещен =O или =S. Каждый Q16 независимо выбирают из -Н, алкила и циклоалкила. Алкил и циклоалкил может возможно включать в себя 1-3 галогено. Конкретные заместители, представляющие собой R2, включают в себя Н, F, Cl, Br, -CN, -NH2, -NO2,-CH3. Конкретные структуры А включают в себя Млекопитающее относится к человеку или животному. Соединения по настоящему изобретению в общем названы в соответствии с номенклатурными системами IUPAC или СAS. Могут быть использованы сокращения, хорошо известные обычному специалисту в данной области, (например "Ph" для фенила, "Me" для метила, "Et" для этила, "О" для атома кислорода, "S" для атома серы, "N" для атома азота, "ч" для часа или часов и "к.т." для комнатной температуры).- 10007490 Надо понимать, что настоящее изобретение охватывает любые рацемические, оптически-активные,полиморфные, таутомерные или стереоизомерные формы или их смеси соединения по этому изобретению, которые обладают раскрытыми здесь полезными свойствами. Соединения по настоящему изобретению можно превратить в их соли, если это уместно, в соответствии с общепринятыми способами. В случаях, когда соединения являются достаточно основными или кислотными для образования стабильных нетоксичных солей с кислотой или основанием, может быть уместным использование этих соединении в виде фармацевтически приемлемых солей. Примеры фармацевтически приемлемых солей,которые входят в объем настоящего изобретения, включают в себя соли присоединения органической кислоты, которая образует физиологически приемлемый анион, и неорганические соли. Примеры фармацевтически приемлемых солей включают в себя, но без ограничения ими, следующие кислоты: уксусная,аспарагиновая, бензосульфоновая, бензойная, двуугольная, двусерная, двувинная, масляная, эдетат кальция, камсиловая, угольная, хлорбензойная, лимонная, эдетовая, эдисиловая, эстоловая, эсил, эсиловая,муравьиная, фумаровая, глюцептовая, глюконовая, глутаминовая, гликолиларсаниловая, гексамовая, гексилрезорциновая, гидрабамовая, бромисто-водородная, хлористо-водородная, йодисто-водородная, гидроксинафтоевая, изетионовая, молочная, лактобионовая, малеиновая, яблочная, малоновая, миндальная,метансульфоновая, метилазотная, метилсерная, муциновая, муконовая, напсиловая, азотная, оксаловая,n-нитрометансульфоновая, памоевая, пантотеновая, фосфорная, моноводородфосфорная, диводородфосфорная, фталевая, полигалактуроновая, пропионовая, салициловая, стеариновая, янтарная, сульфаминовая, сульфаниловая, сульфоновая, серная, дубильная, винная, теоклиевая и толуолсульфоновая. Примеры фармацевтически приемлемых солей включают в себя, но без ограничения ими, следующие основания: первичные, вторичные и третичные амины, замещенные амины, в том числе встречающиеся в природе замещенные амины, циклические амины, аргинин, бетаин, кофеин, холин, N,N-дибензилэтилендиамин,диэтиламин,2-диэтиламиноэтанол,2-диметиламиноэтанол,этаноламин,этилендиамин,Nэтилморфолин, N-этилпиперидин, глутамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин,метилглюкамин, морфолин, пиперазин, пиперидин, полиаминовые смолы, прокаин, пурины, теобромин,триэтиламин, триметиламин, трипропиламин и тому подобные. Фармацевтически приемлемые соли могут быть в гидратированной форме. Фармацевтически приемлемый соли можно получать с использованием стандартных процедур, хорошо известных в данной области, например проведением взаимодействия между достаточно основным соединением, таким как амин, и подходящей кислотой, дающей физиологически приемлемый анион. Также можно получать соли щелочного металла (например натрия, калия или лития) или щелочноземельного металла (например кальция) и карбоновые кислоты. Соединения формулы I по этому изобретению содержат хиральный центр, такой как при С-5 оксазолидинонового кольца, и как у таковых, у них существуют два энантиомера или рацемическая смесь обоих. Это изобретение относится к обоим энантиомерам, которые обладают раскрытыми здесь полезными свойствами, а также к смесям, содержащим оба из этих изомеров. Вдобавок, в зависимости от заместителя, дополнительные хиральные центры и другие изомерные формы могут присутствовать в любых из групп А, В или R1, и это изобретение охватывает все возможные стереоизомеры и геометрические формы в этих группах. Соединения по этому изобретению полезны для лечения микробных инфекций у людей и других теплокровных животных. Дозировки и фармацевтические композиции Фраза "эффективное количество" соединения при использовании здесь подразумевает нетоксическое, но достаточное количество одного или более чем одного из соединений по этому изобретению для получения желаемого эффекта. Желаемый эффект может состоять в предотвращении, избавлении от или облегчении микробных инфекций. Как отмечено ниже, точное количество соединения по этому изобретению, требуемое для лечения микробной инфекции, должно варьировать от субъекта к субъекту, в зависимости от биологического вида, возраста и общего состояния субъекта, тяжести заболевания, подлежащего лечению, конкретного(ых) используемого(ых) соединения(й) и способа введения, такого как путь и частота введения, и тому подобного. Таким образом, невозможно специфицировать точное "эффективное количество". Однако обычный специалист в данной области может определить надлежащее эффективное количество при использовании только рутинного экспериментирования. Фармацевтические композиции по этому изобретению можно получать комбинированием соединений по этому изобретению с твердым или жидким фармацевтически приемлемым носителем и, возможно, с фармацевтически приемлемыми адъювантами и эксципиентами при использовании стандартных и общепринятых методик. Композиции, представляющие собой твердые формы, включают в себя порошки, таблетки, диспергируемые гранулы, капсулы, облатки и суппозитории. Твердым носителем может быть по меньшей мере одно вещество, которое также может функционировать как разбавитель, вкусовой агент, солюбилизатор, смазка, суспендирующий агент, связующий агент, агент для дезинтеграции таблеток и инкапсулирующий агент. Инертные твердые носители включают в себя карбонат магния, стеарат- 11007490 магния, тальк, сахар, лактозу, пектин, декстрин, крахмал, желатин, целлюлозные материалы, низкоплавкий воск, масло какао и тому подобное. Композиции жидких форм включают в себя растворы, суспензии и эмульсии. Например, можно давать растворы соединений по этому изобретению, растворенных в воде,системах вода-пропиленгликоль, возможно содержащих подходящие общепринятые красители, вкусовые агенты, стабилизаторы и загустители. Предпочтительно, фармацевтическую композицию предоставляют с использованием общепринятых методик в стандартной лекарственной форме, содержащей эффективные или надлежащие количества активного компонента, который представляет собой соединение в соответствии с этим изобретением. Количество активного компонента, который представляет собой соединение в соответствии с этим изобретением, в фармацевтической композиции и ее стандартной лекарственной форме можно варьировать или устанавливать в широких пределах в зависимости от конкретного применения, действенности конкретного соединения и желаемой концентраций. В общем, количество активного компонента должно быть в диапазоне от 0,5 до 90% от массы композиции. В терапевтическом применении для лечения бактериальных инфекций или борьбы с ними у теплокровных животных соединения или их фармацевтические композиции надо вводить перорально, парентерально или локально в дозе для получения и поддержания концентрации, то есть, такого количества или уровня в крови активного компонента у животного, подвергнутого лечению, которая будет обладать антибактериальной эффективностью. В общем, такое антибактериально эффективное количество дозировки активного компонента должно быть в диапазоне от около 0,1 до около 100, более предпочтительно от около 3,0 до около 50 мг/кг массы тела/день. Надо понимать, что дозировки могут варьировать в зависимости от требований пациента, от тяжести бактериальной инфекции, которую лечат, и от конкретного соединения, которое используют. Также надо понимать, что исходную вводимую дозировку можно увеличить сверх вышеуказанного верхнего предела, чтобы быстро достичь желаемого уровня в крови, или исходная дозировка может быть меньше, чем оптимальная, и суточную дозировку можно прогрессивно увеличивать по ходу лечения в зависимости от конкретной ситуации. При желании суточную дозу можно также делить на множественные дозы для введения, например, 2-4 раза в сутки. Конкретный активный агент может иметь больше чем один рекомендованный диапазон дозировки,в частности, для разных путей введения. В общем, эффективное количество дозировки соединения по этому изобретению, вводимого как индивидуально, так и в комбинации с другим(и) ингибиторным(и) соединением(ями), должно быть в диапазоне от около 5 до около 2500 мг/день, более конкретно от около 10 до около 750 мг/день и наиболее удобно от 50 до 500 мг в стандартной лекарственной форме. Надо понимать, что дозировки активного(ых) компонента(ов) могут варьировать в зависимости от требований каждого субъекта, которого лечат, и от тяжести микробной инфекции. Исходное лечение пациента, страдающего микробной инфекцией, можно начинать с вышеуказанного режима дозировки. Лечение обычно продолжают как необходимо в течение периода от нескольких дней до нескольких месяцев, пока состояние или нарушение не будет под контролем или элиминировано. Пациентов, проходящих лечение композицией по этому изобретению, можно рутинно мониторировать любыми из способов, хорошо известных в данной области, для определения эффективности терапии. Непрерывный анализ данных такого мониторинга позволяет модифицировать режим лечения во время терапии так, чтобы вводить в любое время оптимально эффективные количества лекарственного средства и чтобы можно было определить длительность лечения. Таким путем режим лечения и схему дозировки можно рационально модифицировать по ходу терапии так, чтобы вводить самое низкое количество соединения по этому изобретению, проявляющее удовлетворительную эффективность, и чтобы продолжать введение только так долго, как необходимо для успешного лечения состояния или нарушения. При комбинированной терапии соединение(я) по этому изобретению и другое(ие) ингибиторное(ые) соединение(я) можно вводить одновременно или через отдельные интервалы. При одновременном введении соединение(я) по этому изобретению и другое(ие) ингибиторное(ые) соединение(я) можно инкорпорировать в одну фармацевтическую композицию или в отдельные композиции, например, соединение(я) по этому изобретению в одной композиции и другое(ие) ингибиторное(ые) соединение(я) в другой композиции. К примеру, соединение(я) по этому изобретению можно вводить наряду или вместе с другим(и) ингибиторым(и) соединением(ями). Термин "наряду" означает, что субъект, которого лечат,принимает одно лекарственное средство в пределах около 5 мин от принятия другого лекарственного средства. Термин "вместе" означает, что субъект принимает одно лекарственное средство в пределах того же периода лечения, в котором он принимает другое лекарственное средство. Тот же период лечения находится предпочтительно в пределах двенадцати часов и до сорока восьми часов. При раздельном введении терапевтически эффективные количества соединения(й) по этому изобретению и другого(их) ингибиторого(ых) соединения(ий) вводят по разным схемам. Одно можно вводить до другого, в той мере, в какой время между двумя введениями попадает в терапевтически эффективный интервал. Терапевтически эффективный интервал представляет собой период времени, который начинается с того, что млекопитающему вводят либо (а) соединение(я) по этому изобретению, либо (b) другое(ие) ингибиторное(ые) соединение(я), и оканчивается на пределе полезного эффекта комбинации (а) и(b) при лечении микробных инфекций. Способы введения соединения(й) по этому изобретению и друго- 12007490 го(их) ингибиторного(их) соединения(й) могут варьировать. Так, один агент можно вводить перорально,тогда как другой вводят инъекцией. Вдобавок к соединениям по этому изобретению и другим противомикробным агентам фармацевтическая композиция для терапевтического применения может также содержать один или более чем один из материалов, представляющих собой нетоксичные фармацевтически приемлемые носители или эксципиенты. Термин "носитель" или "эксципиент" здесь означает любое вещество, которое само по себе не является терапевтическим агентом, используемое как носитель, и/или разбавитель, и/или адъювант, или среда доставки терапевтического агента субъекту, или добавляемое к фармацевтической композиции для улучшения обращения с ней или свойств при хранении или для того, чтобы позволить или облегчить образование стандартной лекарственной формы композиции в дискретном изделии, таком как капсула или таблетка, пригодная для перорального введения. Эксципиенты могут включать в себя, для иллюстрации, но не ограничения, разбавители, дезинтегрирующие агенты, связующие агенты, адгезивные агенты, смачивающие агенты, полимеры, смазки, агенты скользкости, вещества, добавляемые для маскирования нежелательного вкуса или запаха или для противодействия им, вкусовые добавки, красители, ароматизаторы и вещества, добавляемые для улучшения внешнего вида композиции. Приемлемые эксципиенты включают в себя лактозу, сахарозу, порошковый крахмал, целлюлозные эфиры алканоевых кислот,алкильные эфиры целлюлозы, тальк, стеариновую кислоту, стеарат магния, оксид магния, натриевые и кальциевые соли фосфорной и серной кислот, желатин, гуммиарабик, альгинат натрия, поливинилпирролидон и/или поливиниловый спирт, и затем их таблетируют или инкапсулируют для удобного введения. Такие капсулы или таблетки могут содержать состав для контролируемого высвобождения, какой можно предоставлять в дисперсии активного соединения в гидроксипропилметилцеллюлозе или другими способами, известными специалистам. Для перорального введения фармацевтическая композиция может быть в форме, например, таблетки, капсулы, суспензии или жидкости. При желании в композицию можно включать другие активные ингредиенты. Пути введения В терапевтическом применении для лечения инфекций у млекопитающего (то есть, людей и животных) или борьбы с ними фармацевтическую композицию можно вводить перорально, парентерально,локально, в прямую кишку или в нос. Вдобавок к пероральному введению, отмеченному выше, композиции по настоящему изобретению можно вводить любым пригодным путем, в форме фармацевтической композиции, адаптированной к такому пути, и в дозе, эффективной для предполагаемого лечения. Композиции можно, например, вводить парентерально, например в сосуд, в брюшину, под кожу или в мышцу. Для парентерального введения можно использовать в качестве подходящего носителя физиологический раствор, раствор декстрозы или воду. Составы для парентерального введения могут быть в форме водных или неводных изотонических стерильных растворов или суспензий для инъекции. Эти растворы и суспензии можно получать из стерильных порошков или гранул, имеющих один или более чем один из носителей или разбавителей,упомянутых для применения в составах для перорального введения. Соединения можно растворять в воде, полиэтиленгликоле, пропиленгликоле, этаноле, кукурузном масле, хлопковом масле, арахисовом масле, кунжутном масле, бензиловом спирте, хлориде натрия и/или в разных буферах. Другие адъюванты и пути введения хорошо и широко известны в фармацевтике. В общем, концентрация каждого соединения по этому изобретению в жидкой композиции, такой как лосьон, должна быть от около 0,1 до около 20 мас.%, предпочтительно от около 0,5 до около 10 мас.%. Раствор может содержать другие ингредиенты, такие как эмульгаторы, антиоксиданты или буферы. Концентрация в полутвердой или твердой композиции, такой как гель или порошок, должна быть от около 0,1 до около 5 мас.%, предпочтительно от около 0,5 до около 2,5 мас.%. При локальной доставке фармацевтической композиции по настоящему изобретению, которую используют для достижения прицельного лечения конкретного внутреннего участка, каждое соединение по этому изобретению предпочтительно содержится в композиции в количестве 0,05-10 мас.%, более предпочтительно 0,5-5 мас.%. Парентеральные введения включают в себя инъекции для генерирования системного эффекта или инъекции прямо в пораженную область. Примерами парентеральных введений являются подкожное,внутривенное, внутримышечное, в кожу, в мозговые оболочки, в глаз, в желудочек мозга, и общие инфузионные методики. Локальные введения включают в себя лечение инфицированных областей или органов, легко достигаемых локальным нанесением, таких как, например, глаза, уши, что включает в себя инфекции наружного и среднего уха, вагину, открытые и зашитые или закрытые раны и кожу. Это также включает в себя чрескожную доставку для генерирования системного эффекта. Введение в прямую кишку включает в себя таковое в форме суппозиториев. Введение в нос включает в себя нанесение аэрозолем в нос или ингаляцией. Фармацевтические композиции, включающие в себя соединения по этому изобретению, можно получать способами, хорошо известными в данной области, например, общепринятыми процессами смешивания, растворения, гранулирования, получения драже, отмучивания, эмульгирования, инкапсулирования, заключения в гранулы, лиофилизации и распылительной сушки.- 13007490 Фармацевтические композиции для использования в соответствии с настоящим изобретением можно составлять общепринятым образом с использованием одного или более чем одного из физиологически приемлемых носителей, в том числе эксципиентов и вспомогательных агентов, которые облегчают введение активного соединения в препараты, которые можно использовать фармацевтически. Правильное составление зависит от выбранного пути введения. Для перорального введения соединения по этому изобретению можно вводить в стандартные лекарственные формы комбинированием активного соединения с фармацевтически приемлемыми носителями,хорошо известными в данной области. Такие носители позволяют вводить соединения по этому изобретению в стандартные лекарственные формы в виде таблеток, пилюль, лепешек, драже, капсул, жидкостей, растворов, эмульсий, гелей, сиропов, взвесей, суспензий и тому подобного для перорального приема пациентом. Носитель может быть по меньшей мере одним веществом, который может также функционировать как разбавитель, вкусовой агент, солюбилизатор, смазка, суспендирующий агент, связующий агент, агент для дезинтеграции таблеток и инкапсулирующий агент. Примеры таких носителей или эксципиентов включают в себя, но без ограничения ими, карбонат магния, стеарат магния, тальк, сахар,лактозу, сахарозу, пектин, декстрин, маннит, сорбит, крахмалы, желатин, целлюлозные материалы, низкоплавкий воск, масло какао или порошок, полимеры, такие как полиэтиленгликоли, и другие фармацевтически приемлемые материалы. Сердцевины драже снабжены подходящими покрытиями. Для этой цели можно использовать концентрированные растворы сахара, которые возможно могут содержать гуммиарабик, тальк, поливинилпирролидон, гель карбопола, полиэтиленгликоль и/или диоксид титана, растворы глазури и подходящие органические растворители или смеси растворителей. В таблетки или покрытия драже можно также добавлять красящие вещества или пигменты для идентификации или характеризации разных комбинаций доз активного соединения. Фармацевтические композиции, которые можно применять перорально, включают в себя устойчивые к сдавливанию капсулы, сделанные из желатина, а также мягкие герметичные капсулы, сделанные из желатина и пластификатора, такого как глицерин или сорбит. Устойчивые к сдавливанию капсулы могут содержать активные ингредиенты в смеси с наполнителем, таким как лактоза, связующий агент, такой как крахмал, и смазку, такую как тальк или стеарат магния, и, возможно, стабилизаторы. В мягких капсулах активные соединения можно растворять или суспендировать в подходящих жидкостях, таких как жирные масла, жидкий парафин, жидкие полиэтиленгликоли, кремофор, капмул, средне- или длинноцепочечные моно-, ди- или триглицериды. В эти составы можно также добавлять стабилизаторы. Жидкие формы композиций включают в себя растворы, суспензии и эмульсии. Например можно предоставлять растворы фармацевтических композиций с соединениями по этому изобретению, растворенными в воде и системах вода/пропиленгликоль и вода/полиэтиленгликоль, возможно содержащих подходящие общепринятые красители, вкусовые агенты, стабилизаторы и загустители. Соединения по этому изобретению можно также вводить в состав для парентерального введения,например, инъекциями, разовой инъекцией или непрерывным вливанием. Составы для парентерального введения можно предоставлять в стандартной лекарственной форме, например, в ампулах или в многодозовых контейнерах, с добавленным консервантом. Эти композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать материалы для приготовления таких составов, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Для инъекции соединения по этому изобретению можно вводить в состав водного раствора, предпочтительно в физиологически совместимые буферы или физиологический буфер на физиологическом растворе. Подходящие забуферивающие агенты включают в себя трехзамещенный ортофосфат натрия,бикарбонат натрия, цитрат натрия, N-метилглюкамин, L(+)-лизин и L(+)-аргинин. Композиции можно также вводить внутривенно или внутрибрюшинно инфузией или инъекцией. Растворы активного соединения или его соли можно получать в воде, возможно смешанной с нетоксическим поверхностно-активным веществом. Дисперсии можно также получать в глицерине, жидких полиэтиленгликолях, триацетине и их смесях и в маслах. В обычных условиях хранения и применения эти препараты содержат консерванты для предотвращения роста микроорганизмов. Фармацевтические лекарственные формы, пригодные для инъекции или инфузии, могут включают в себя стерильные водные растворы или дисперсии или стерильные порошки, содержащие активный ингредиент, который адаптирован для приготовления стерильных инъецируемых или инфузируемых растворов или дисперсий для немедленного применения, возможно инкапсулированные в липосомы. Во всех случаях конечная лекарственная форма должна быть стерильной, жидкой и стабильной в условиях изготовления и хранения. Жидким носителем или средой доставки может быть растворитель или среда,представляющая собой жидкую дисперсию, содержащую, например, воду, этанол и полиол (например,глицерин, пропиленгликоль, жидкие полиэтиленгликоли и тому подобное), растительные масла, нетоксические эфиры глицерина и их подходящие смеси. Правильную текучесть можно поддерживать, например, образованием липосом, поддержанием требуемого размера частиц в случае дисперсий или применением поверхностно-активных веществ. Предотвращение действия микроорганизмов можно достичь раз- 14007490 ными антибактериальными и противогрибковыми агентами, например, парабенами, хлорбутанолом, фенолом, сорбиновой кислотой, тимеросалем и тому подобным. Во многих случаях должно быть предпочтительным добавление изотонических агентов, например, сахаров, буферов или хлорида натрия. Длительную абсорбцию инъецируемых композиций можно достичь, применяя в композициях агенты задержанной абсорбции, например, моностеарат алюминия и желатин. Стерильные инъецируемые растворы можно получать инкорпорированием активного соединения в требуемом количестве в надлежащий растворитель с разными другими ингредиентами, перечисленными выше, как требуется, с последующей стерилизацией фильтрацией. В случае стерильных порошков для приготовления стерильных инъецируемых растворов предпочтительными способами приготовления являются методики вакуумной сушки и лиофилизации, которые дают порошок активного ингредиента плюс любого дополнительного желаемого ингредиента, присутствующего в растворах, прежде стерилизованных фильтрацией. Другие парентеральные введения также включают в себя водные растворы водорастворимых форм соединения по этому изобретению, таких как, без ограничения ими, соль. Дополнительно, суспензии активного соединения можно получать в липофильной среде доставки. Пригодные липофильные среды доставки включают в себя жирные масла, такие как кунжутное масло, синтетические эфиры жирных кислот, такие как этилолеат и триглицериды, или такие материалы, как липосомы. Водным инъекционные суспензии могут содержать вещества, которые увеличивают вязкость суспензии, такие как натриевая форма карбоксиметилцеллюлозы, сорбит или декстран. Возможно суспензия может также содержать подходящие стабилизаторы и/или агенты, которые увеличивают растворимость соединения, чтобы дать возможность для приготовления высококонцентрированных растворов. Или же соединения по этому изобретению могут быть в форме порошка для восстановления влагосодержания подходящей средой доставки (например, стерильной апирогенной водой) перед использованием. Для введение суппозитория фармацевтические композиции можно также вводить в состав стандартного лекарственного средства смешиванием соединения по этому изобретению с подходящим нераздражающим эксципиентом, который является твердым при комнатной температуре, но жидкостью при ректальной температуре и поэтому должен плавиться в прямой кишке с высвобождением лекарственного средства. Такие материалы включают в себя масло какао, пчелиный воск и другие глицериды. Для введение ингаляцией соединения по этому изобретению можно удобным образом доставлять распылением аэрозоля в форме раствора, сухого порошка или крема. Для аэрозоля может использовать упаковку под давлением или распылитель с подходящим газом-выталкивателем. В случае аэрозоля под давлением единицу дозировки можно контролировать предоставлением клапана для доставки отмеренного количества. Капсулы и картриджи, например, из желатина для использования в ингаляторе можно составлять содержащими порошковую основу, такую как лактоза или крахмал. Для применений в офтальмологии и при отитах фармацевтические композиции можно вводить в состав стандартной лекарственной формы в виде микронизированных суспензий в изотоническом стерильном физиологическом растворе с установленным рН или предпочтительно в виде растворов в изотоническом стерильном физиологическом растворе с установленным рН при наличии или отсутствии консерванта, такого как хлорид бензилалкония. Или же для офтальмологических применений фармацевтические композиции можно вводить в состав мази, такой как вазелин. Вдобавок к вышеописанным составам, соединения по этому изобретению можно также вводить в состав депонируемых препаратов. Такие длительно действующие составы могут быть в форме имплантатов. В состав стандартных лекарственных форм для этого пути введения соединения по этому изобретению можно вводить с подходящими полимерами, гидрофобными материалами или в виде слаборастворимых производных, таких как, без ограничения ими, слаборастворимые соли. Дополнительно соединения по этому изобретению можно доставлять с использованием системы постоянного высвобождения. Определены и хорошо известны специалистам в данной области разные материалы для постоянного высвобождения. Капсулы для постоянного высвобождения могут, в зависимости от их химической природы, высвобождать соединения в течение времени от 24 ч до нескольких суток. В зависимости от химической природы и биологической стабильности терапевтического реагента,можно использовать дополнительные стратегии стабилизации белка. В определенных воплощениях соединения по этому изобретению наносят локально. Для локального нанесения фармацевтическую композицию можно вводить в состав подходящей мази, содержащей соединения по этому изобретению, суспендированные или растворенные в одном или более чем одном из носителей. Носители для локального введения соединений по этому изобретению включают в себя, но без ограничения ими, минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, полиоксиэтилен, полиоксипропиленовое соединение, эмульгирующий воск и воду. Или же фармацевтические композиции можно вводить в состав подходящего лосьона, такого как суспензия, эмульсия или крем, содержащего активные компоненты, суспендированные или растворенные в одном или более чем одном из фармацевтически приемлемых носителей. Подходящие носители включают в себя, но без ограничения- 15007490 ими, минеральное масло, моностеарат сорбитана, полисорбат 60, воск, представляющий собой эфиры цетила, цетеарный спирт, 2-октилдодеканол, бензиловый спирт и воду. В некоторых воплощениях антибактериальные соединения представляют собой пролекарства соединений по этому изобретению. Выражение "пролекарство" обозначает производное известного лекарственного средства прямого действия, трансформируемое в активное лекарственное средство ферментативным или химическим процессом. Пролекарства соединений по этому изобретению получены модифицированием функциональных групп, присутствующих на соединении, таким путем, что эти модификации отщепляются до исходного соединения как при рутинном манипулировании, так и in vivo. Пролекарства включают в себя, но без ограничения ими, соединения, в которых группы, представляющие собой гидрокси, амин или сульфгидрил, связаны с любой группой, которая при введении животному отщепляется с образованием свободной гидроксильной, аминной или сульфгидрильной группы, соответственно. Репрезентативные примеры пролекарств включают в себя, но без ограничения ими, ацетатные,формиатные и бензоатные производные спиртовых и аминных функциональных групп. См. Notari, R. E.Bundgaard, ed.), Elsevier, N.Y. (1985). Антибактериальные агенты по этому изобретению имеют полезную активность против множества разных организмов. Активность in vitro соединений по этому изобретению можно оценивать стандартными процедурами тестирования, такими как определение минимальной ингибиторной концентрации(МИК) разведением в агаре как описано в "Approved Standard. Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically", 3rd. ed., published 1993 by the National Committee forClinical Laboratory Standards, Villanova, Pennsylvania, USA. Нижеследующие схемы раскрывают получение соединений по настоящему изобретению. Исходные материалы получены процедурами, описанными в этих схемах, или процедурами, известными обычному специалисту в данной области. Схема I Схема I иллюстрирует способы получения арилоксазолидинон-5-карбоксамидов 5 и их Nзамещенных производных. В способе А производные арилкарбамата 1 (В 4 = С(1-6)алкил или бензил) (известны в литературе, получены известными способами, такими как дериватизация анилина 6, или описанными нижеследующими схемами) можно депротонировать литиевым основанием, таким как н- 16007490 бутиллитий в подходящем растворителе, таком как тетрагидрофуран, при подходящей температуре, в типичных случаях в диапазоне от -78 до -40 С, с получением литиированных продуктов, которых непосредственно обрабатывают (2R)-глицидатом калия (J. Org. Chem. 1992, 57(12), 3380-3387). Нагревание до температуры окружающей среды и перемешивание в течение подходящего периода времени дает арилоксазолидинон-5(R)-карбоновые кислоты 3. Кислоты 3 можно превратить в целевые структуры 5 при использовании способов, известных специалистам. К примеру, обработка кислот 3 оксалилхлоридом в инертной атмосфере дает промежуточные соединения, представляющие собой хлорангидрид кислоты,которые можно превратить в амиды 5 (R1 = H или возможно замещенный алкил) при обработке аммиаком или возможно замещенными алкиламинами (R1NH2) или в гидроксаматы 5 (R1 = О-алкил) при обработке O-алкилгидроксиламинами. Производные гидроксамата можно получать непосредственно из кислоты 3 при обработке О-алкилгидроксиламином (или его солью, представляющей собой гидрохлорид) в присутствии конденсирующего агента сочетания, такого как 1-(3-диметиламинопропил)-3 этилкарбодиимида гидрохлорид. Когда R1 представляет собой О-бензил, гидрогенолиз соединения 5 затем дает производные гидроксамовой кислоты (R1 = ОН). Или же кислоты 3 можно превратить в целевые структуры 5 через промежуточные соединения, представляющие собой сложный эфир 4 (например, В 5 = метил, этил, пропил, бутил), при использовании способов, известных специалистам, например, метиловые эфиры 4 (В 5 = Me) можно получать обработкой метанольных растворов кислот 3 кислым катализатором, таким как серная кислота, при температуре окружающей среды. Последующая обработка аминами, представляющими собой R1NH2, в подходящем растворителе, таком как метанол или ацетонитрил затем дает амиды 5 (R1 = H или возможно замещенный алкил). Аналогичным образом обработка гидразином дает гидразиды 5 (R1=NH2). В способе В (5R)-гидpoкcимeтилapилoкcaзoлидинoны 2 можно окислять использованием, например, оксида хрома(VI)/серной кислоты в системе растворителей, такой как ацетон/вода (ЕР 91-417044, 13 марта 1991; заявка на ЕР 90-810654, 29 августа 1990), или хлорида рутения(III) (кат.)/перйодата натрия в присутствии однозамещенного фосфата натрия в системе растворителей, такой как ацетонитрил/метиленхлорид/вода (см. патент США 5614535, все содержание которого включено сюда полностью), с получением арилоксазолидинон-5(R)-карбоновых кислот 3, которые можно затем превратить в целевые структуры 5, как описано выше. Исходные материалы 2, представляющие собой (5R)гидpoкcимeтиларилоксазолидинон, можно получать обработкой арилкарбаматов 1 литиевым основанием, таким как н-бутиллитий или гексаметилдисилазид лития в растворителе, таком как тетрагидрофуран,при подходящей температуре, в типичных случаях в диапазоне от -78 до -40 С, с получением литиированных продуктов, которые непосредственно обрабатывают R-(-)-глицидилбутиратом. Нагревание до комнатной температуре затем дает структуры 2. В способе С анилины 6, которые известны в литературе или получены известными способами (см. также нижеследующие схемы), можно превратить в структуры 7 при обработке алкил-(2R)эпоксипропаноатом и трифлатом лития в подходящем растворителе, таком как ацетонитрил, при подходящей температуре, в типичных случаях в диапазоне от 20 до 110 С, в зависимости от растворителя. Аминоспирты 7 можно затем подвергнуть закрытию кольца с получением арилоксазолидинонов 4 при использовании способов, известных специалисту. К примеру, обработка структур 7 1,1'карбонилдиимидазолом в растворителе, таком как ацетонитрил или тетрагидрофуран, при надлежащей температуре, в типичных случаях в диапазоне от 20 до 60 С, или фосгеном в таком растворителе, как толуол или метиленхлорид или их смеси, в присутствии основания, такого как триэтиламин, при надлежащей температуре, в типичных случаях в диапазоне от -10 до 25 С, дает оксазолидиноны 4. Струкуры 4 можно затем превратить в целевые соединения 5 при использовании вышеописанных способов. Схема II(3,6-Дигидро-2 Н-тиопиран-4-ил)-фенилкарбаматы 8 (см., например, патент США 6239283, все содер- 17007490 жание которого включено сюда полностью; см. также схему VII и IX) можно превратить в оксазолидинон-5-карбоксамид 9 при использовании стадий, которые похожи на те, что описаны в схеме I для превращения 1 в 5 при использовании способа А. Серную группу в структурах 9 можно затем окислить надлежащим окислителем, таким как перйодат натрия, в надлежащем растворителе, таком как смеси метанола и воды, или тетроксидом осмия (кат.) и N-оксидом N-метилморфолина в надлежащем растворителе,таком как смеси ацетона и воды, с получением соответствующих сульфоксидных и сульфоновых производных 10 (i = 1,2). Двойную связь в структурах 10 можно восстановить каталитическим гидрогенизированием с использованием надлежащего катализатора, такого как палладий на углероде, в подходящем растворителе, таком как метанол, с получением структуры 11. См. на схемах VII, VIII и IX альтернативные способы получения тиопиран-4-ил-фенил- оксазолидинон-5-карбоксамидов. Схема III Схема III иллюстрирует получение пиперазинилфенилоксазолидинон-5-карбоксамидов 15. Пиперизинилфенилкарбаматы 12 (см., например, J. Med. Chem. 1996, 39(3), 673-679) можно превратить в оксазолидинон-5-карбоксамид 13 при использовании стадий, которые похожи на те, что описаны в схеме I для превращения 1 в 5 при использовании способа А. Защитную группу CBZ можно удалить из 13 гидрогенизированием в присутствии надлежащего катализатора, такого как палладий на углероде или катализатор Перлмана, в растворителе, таком как метанол, этанол, этилацетат или их смеси, и пиперазиновое кольцо соединения 14 можно затем ацилировать или алкилировать способами, хорошо известными специалистам, с получением целевых структур 15. В случае, когда R107 представляет собой бензилоксиацетил, последующее каталитическое гидрогенизирование соединения 15 дает замещенный гидроксиацетилом пиперазинилфенилоксазолидинон-5-карбоксамид 15 (R107 = С(=O)СН 2 ОН). Или же структуры 12 можно подвергнуть двойному снятию защиты при использовании способов, известных специалисту, с получением промежуточного соединения, представляющего собой пиперазинилфторбензамин, который можно затем превратить в структуры 15 при использовании стадий, которые похожи на те, что описаны в схеме XII для превращения 68 в 70. Схема IV Схема IV иллюстрирует получение 3- и 4-пиридил и 4-пиранилфенилоксазолидинон-5 карбоксамидов 18, 20 и 21. Йодфенилкарбаматы 16 (см., например, Org. Process Res. Dev. 2001, 5(1), 8083) можно превратить в 4-йодфенилоксазолидинон-5-карбоксамид 17 при использовании стадий, которые похожи на те, что описаны в схеме I для превращения 1 в 5 при использовании способа В. Арилйодид 17 можно затем подвергнуть реакции сочетания с 3-(триметилстаннил)пиридином (см. ниже пример- 18007490 7, стадию 4) или 4-(триметилстаннил)пиридином (см. патент США 5990136, все содержание которого включено сюда полностью) при использовании системы палладиевого катализатора, такого как трис(дибензилиденацетон)дипалладий(0) и трифениларсин, в растворителе, таком как N-метил-2 пирролидинон, при надлежащей температуре, в типичных случаях в диапазоне от 50 до 100 С, с получением структуры 18. Арилйодид 17 можно также превратить в арилстаннан 19 при обработке гексаметилдиолова в присутствии палладиевого катализатора, такого как хлорид бис(трифенилфосфин)палладия(II),в растворителе, таком как 1,4-диоксан, при надлежащей температуре, в типичных случаях в диапазоне от 50 до 100 С. Последующее сочетание этого арилстаннана с винилтрифлатом тетрагидро-4H-пиран-4-она(см. патент США 5968962, все содержание которого включено сюда полностью) при температуре окружающей среды при использовании каталитической системы, которая похожа на использованную для получения структур 18, дает пиранилфенилоксазолидинон-5-карбоксамид 20. Последующее каталитическое гидрогенизирование дает структуры 21. Схема V Схема V иллюстрирует получение тиоморфолинилфенил- и фторфенилоксазолидинон-5 карбоксамидов 27. Нитробензолы 22 (Z10 = F, Q, OTf или другая уходящая группа) можно превратить в структуры 23 при обработке тиоморфолина в присутствии основания, такого как N,Nдиизопропилэтиламин, в подходящем растворителе, таком как ацетонитрил, при температуре в типичных случаях в диапазоне 25-80 С. Восстановление нитрогруппы соединения 23 с использованием, например,каталитического гидрогенизирования с надлежащим катализатором, таким как никель Ренея, в подходящей системе растворителей, такой как смесь тетрагидрофурана и воды, дает анилины 24, которые можно превратить в структуры 25 при использовании стадий, которые похожи на те, что описаны в схеме I для превращения 6 в 4 способом С. Окисление атома серы в структурах 25 при использовании вышеописанных способов (см. схему II) дает сульфоксидные и сульфоновые производные 26, которые превращают в целевые структуры 27 как описано на схеме I. Схема VI Схема VI иллюстрирует альтернативное получение тиоморфолинилдифторфенилоксазолидинон-5 карбоксамида 33. В этом способе фенилтиоморфолинсульфон 29 получают обработкой 2,6 дифторанилина 28 винилсульфоном в присутствии хлорида алюминия в подходящем растворителе, таком как хлорбензол, при повышенной температуре. Нитрование фенильного кольца соединения 29 дымящейся азотной кислотой в уксусной кислоте при температуре окружающей среды затем дает нитробензольную структуру 30, которую можно затем превратить в анилин 31, как описано выше в условиях- 19007490 каталитического гидрогенизирования при использовании подходящего катализатора, такого как никель Ренея. Обработка анилина 31 надлежащим алкил- или бензил-хлороформатом в присутствии основания, такого как бикарбонат натрия, дает карбаматные структуры 32, которые можно затем превратить в целевые структуры 33 при использовании стадий, которые похожи на те, что описаны на схеме I для превращения 1 в 5 при использовании способа А. Или же анилин 31 можно превратить в 33 при использовании стадий, которые похожи на те,что описаны на схеме I для превращения 6 в 5 при использовании способа С. Схема VII Схема VII иллюстрирует альтернативное получение тиопиран-4-ил-фенилоксазолидинон-5 карбоксамида 40. Для структур 40, где R2 = Н, 4-бром- или 4-йоданилин 35 (Z10 = Br, I) можно превратить в его изобутилкарбаматное производное 36 (Z10 = Br, I) при обработке изобутилхлороформатом в присутствии надлежащего основания, такого как бикарбонат натрия, в подходящей системе растворителей. Обработка 36 двумя эквивалентами н-бутиллития в подходящем растворителе, таком как тетрагидрофуран,при надлежащей температуре, в типичных случаях в диапазоне от -78 до -40 С, дает дилитиированные продукты, которые получаются в результате депротонирования карбамата и замены галогена арилгалогенида на металл. Последующая обработка тетрагидро-2 Н-тиопиран-4-оном с последующим нагреванием до 0-25 С дает 4-гидрокситиопиран-4-ил-фенилкарбамат 37, который можно затем восстановить в тиопиран-4-ил-фенилкарбамат 38 использованием, например, избытка триэтилсилана в трифторуксусной кислоте при температуре окружающей среды. Изобутилкарбаматную группу соединения 38 с легкостью отщепляют при обработке, к примеру, водным гидроксидом калия в этиленгликоле при повышенной температуре, например 100 С, с получением анилина 39, который можно затем превратить в целевые структуры 40 (R2 = H, i = 1,2) при использовании стадий, которые похожи на те, что обрисованы на схемеV для превращения 24 в 27. Или же атом серы карбамата 38 можно сначала окислить при использовании вышеописанных способов (схема II) с получением соответствующих сульфоксидных и сульфоновых производных. Карбамат затем расщепляют, как описано выше с получением S-оксида или S,S-диоксида анилина 39, который можно превратить в структуру 40 при использовании стадий, которые похожи на те,что описаны на схеме I для превращения 6 в 5 при использовании способа С. Следует иметь в виду, что окисления с получением сульфоксидных продуктов дают смеси цис- и транс-изомеров, которых можно разделить препаративной ВЭЖХ. Однако существуют способы селективного окисления для образование транс-изомера (см. Tetrahedron Lett. 2000, 4301-4305, и цитированные там ссылки). Для структуры 40, где один R2 = Н, а другой R2 = F, 3-фторанилин (Z10 = H) можно превратить в 4 гидрокситиопиран-4-ил-фенилкарбамат 37 через карбамат 36 (Z10 = I, Br), как описано в Org. Proc. Res.Dev. 2001, 5, 80-83, и Tetrahedron Lett. 2000, 4301-4305. Карбамат 37 можно затем превратить в целевые структуры 40 (R2, R2 = H, F; i = 1,2) при использовании вышеописанных способов. Для структуры 40, где R1 = F, 3,5-дифторанилин (Z10 = H) можно превратить в его изобутилкарбаматное производное 36 как описано выше. Обработка 36 двумя эквивалентами н-бутиллития в подходящем растворителе, таком как тетрагидрофуран, при подходящей температуре, в типичных случаях в диапазоне от -78 до -40 С, дает дилитиированные продукты, которые получаются в результате депротонирования карбамата и металлирования в пара-положении (смежном с двумя атомами фтора) фенильного кольца. В этой реакции можно использовать хелатирующую добавку, такую как N,N,N',N'тетраметилэтилендиамин (TMEDA). Последующая обработка тетрагидро-2 Н-тиопиран-4-оном с последующим нагреванием до 0-25 С дает 4-гидрокситиопиран-4-ил-фенилкарбамат 37, который можно затем восстановить в тиопиран-4-ил-фенилкарбамат 38 при обработке, например, избытком триэтилсилана в трифторуксусной кислоте при повышенной температуре, в типичных случаях от 40 до 75 С. Карбамат 38 можно затем превратить в целевые структуры 40 (R2 = F, i = 1,2) при использовании вышеописанных способов. Схема VIII иллюстрирует дополнительный способ получения тиопиран-4-ил-фенил-оксазолидинон 5-карбоксамидсульфонов 43. Тетрагидротиопирановое кольцо структуры 41 (получение см. на схеме VII) можно окислить при использовании вышеописанных способов (схема II) с получением соответствующей сульфоновой структуры 42. Карбамат 42 можно затем превратить в целевые структуры 43 при использовании стадий, которые похожи на те, что описаны на схеме I для превращения 1 в 5 через промежуточное соединение 2, представляющее собой 5-гидроксиметилоксазолидинон, при использовании способа В. Схема IXIX иллюстрирует дополнительный способ получения тиопиран-4-илдифторфенилоксазолидинон-5-карбоксамидов 51. 3,5-Дифторанилин 44 можно защитить в виде его 2,5 диметилпиррольного производного 45 при обработке ацетонилацетоном и каталитическими количествами n-толуолсульфоновой кислоты в надлежащем растворителе, таком как смеси толуола и тетрагидрофурана, при надлежащей температуре, в типичных случаях от 40 С до температуры образования флегмы. Обработка 45 н-бутиллитием в растворителе, таком как тетрагидрофуран, при подходящей температуре,в типичных случаях в диапазоне от -78 до -40 С, дает ариллитиевые продукты, которые получаются в результате депротонирования в пара-положении (смежном с двумя атомами фтора) фенильного кольца. Последующая обработка тетрагидро-2 Н-тиопиран-4-оном с последующим нагреванием до 0-25 С дает 4 гидрокситиопиран 46, который можно превратить в дигидротиопиран 47 использованием, например, каталитических количеств n-толуолсульфоновой кислоты в надлежащем растворителе, таком как бензол,при повышенной температуре, в типичных случаях от 60-120 С. Пиррольную защитную группу можно затем удалить при обработке избытком гидрохлорида гидроксиламина в присутствии надлежащего основания, такого как триэтиламин, в подходящем растворителе, таком как смеси этанола и тетрагидрофурана, при надлежащей температуре, в типичных случаях 40-80 С, с получением анилина 48, который снова защищают в виде карбамата 49 при использовании вышеописанных способов (схема VI). Дигидротиопирановое кольцо соединения 49 можно затем восстановить при обработке, например, избытком триэтилсилана в трифторуксусной кислоте при повышенной температуре, в типичных случаях 40-80 С, с получением тетрагидротиопирана 50, которого можно затем превратить в целевые структуры 51 (i = 1,2) при использовании стадий, обрисованных на схеме VII для превращения 38 в 40. Схема X иллюстрирует получение N-алкилированных бензотиазолон- и бензоксазолоноксазолидинон-5-карбоксамидов 58 (X1 = О, S; R300 = алкил или замещенный алкил). Для бензотиазолонов (X = S) 6-нитро-2-бензотиазолиноны 52 (имеются в продаже, известны в литературе или получены при использовании способов, известных специалисту) можно N-алкилировать в условиях, известных специалистам (конкретные примеры, представляющие интерес, см. в J. Heterocyclic Chem., 1992, 29,1069, и в патенте США 6069160, все содержание которого включено сюда полностью), что включает в себя обработку алкилирующим агентом, таким как йодметан, диметилсульфат, йодэтан, 2-йодпропан,бромацетонитрил или 1-бром-2-фторэтан, в присутствие основания, такого как гидрид натрия, 1,8 диазобицикло[5.4.0]ундец-7-ен (DBU) или карбонат калия, в подходящем растворителе, таком как диметилформамид, тетрагидрофуран, ацетонитрил или ацетон, при надлежащей температуре, в типичных случаях от 0 С до 100 С, с получением структур 53 (X1 = S). Для бензоксазолонов (X1 = О) 6-нитро-2 бензоксазолоны 55 (получены, например, из 2-амино-5-нитрофенола 54 в соответствии с J. HeterocyclicChem. 1992, 29, 1069) можно N-алкилировать с получением 53 (X1 = 0) в условиях, описанных выше для бензотиазолинона 52 (альтернативные пути к структуре 53 (X1 = О) см. в J. Heterocyclic Chem. 1992, 29,1069; а также в Pharmazie, 1971, 26, 280, и J. Am. Chem. Soc, 1958, 50, 1662). Или же 2-амино-5 нитрофенолы 54 можно восстановительно алкилировать простыми альдегидами или кетонами, например ацетоном, в присутствии подходящего восстановителя, такого как цианоборгидрид натрия, в подходящем растворителе, таком как этанол, с получением структур 56, которые можно затем превратить в структуры 53 (X1 = О) при обработке, например, 1,1'-карбонилдиимидазолом в условиях, которые похожи на те, что использованы для получения 55 из 54. Восстановление нитрогруппы соединения 53 при использовании способов, известных специалисту, каталитическим гидрогенизированием, к примеру, над надлежащим катализатором, таким как палладий на углероде или оксид платины, в подходящей системе растворителей, такой как смеси тетрагидрофурана и метанола (см., например, J. Heterocyclic Chem; 1992,29, 1069), дает анилин 57, который можно затем превратить в структуры 58 (X1 = О, S) при использовании стадий, которые похожи на те, что описаны на схеме I для превращения 6 в 5 способом С. Схема XI иллюстрирует получение индолинилоксазолидинон-5-карбоксамидов 67. Двойное снятие защиты с аминоиндолина 59 (для (2R)-метильного производного см. PCT/US 00/08224; WO 00/73301) при использовании способов, известных специалисту, например каталитическим гидрогенизированием над надлежащим катализатором, таким как палладий на углероде или катализатор Перлмана, в подходящем растворителе, дает аминоиндолин 60. 5-Аминогруппу снова защищают в виде ее 2,5-диметил-1Hпиррольного производного 61 использованием способов, описанных на схеме IX для превращения 44 в 45, и азот индолина снова защищают в виде его бензилкарбамата использованием способов, известных специалисту, с получением структуры 62. Пиррольную защитную группу можно затем удалить использованием способов, описанных на схеме IX для превращения 47 в 48, с получением аминоиндолина 63,который затем превращают в структуры 64 при использовании стадий, обрисованных на схеме I для превращения 6 в 4 способом С. Защитную группу CBZ затем удаляют и азот индолина ацилируют или алкилируют при использовании способов, известных специалисту, с получением 66 при использовании стадий, которые похожи на те, что описаны на схеме III для превращения 13 в 15, и 66 затем превращают в целевые структуры 67, как описано на схеме I для превращения 4 в 5. Или же аминоиндолин 59 можно превратить в целевые структуры 67 при использовании стадий, которые похожи на те, что описаны на схеме III для превращения 12 в 15. Схема XII(получены при использовании стадий, которые похожи на те, что описаны в PCT/US 96/12766) можно селективно ацилировать по кольцевому азоту при использовании способов, известных специалистам, с получением структуры 69, которую можно затем превратить в целевые структуры 70 при использовании стадий, которые похожи на те, что описаны на схеме I для превращения 6 в 5. Схема XIII иллюстрирует общий синтез тиадиазиноноксазолидинон-5-карбоксамидов 77. Сначала нитробензолкарбоновую кислоту 71 подвергают реакции сочетания с подходящим N-замещенным гидразиновым реагентом, таким как N-(трет-бутоксикарбонил)-гидразин. Это взаимодействие можно проводить с любым числом известных реагентов сочетания, таких как HATU или карбодиимиды. Реакцию сочетания в типичных случаях проводят в полярном апротонном растворителе, таком как диметилформамид, ацетонитрил или их смеси, в присутствии органического основания, такого как триэтиламин или(N,N-диизопропил)-этиламин (DIEA). Этот процесс в типичных случаях проводят при от около 0 С до около 50 С. Затем гидразид превращают в тиогидразид 73 реагентом Лоуссона (Lawesson) в условиях,многократно описанных в химической литературе. Это превращение можно проводить в подходящем органическом растворителе, таком как диоксан или тетрагидрофуран, и в типичных случаях его проводят при температурах в диапазоне от около 25 С до около 100 С. Для примера, химия Лоуссона рассмотрена в статье Cava et al. в Tetrahedron, 1985, vol. 41, pp. 5061-5087. На следующей стадии проводят алкилирование получившегося защищенного тиогидразидного реагента подходящим альфа-замещенным сложноэфирным реагентом (таким как метиловый или этилового эфир) с получением структуры 74. Сложный эфир несет хорошую уходящую группу в альфа-положении относительно сложноэфирной функциональной группировки, например, бромо, йодо, нитробензосульфонилокси, мезилокси (OMs) или подобную группу. Это взаимодействие в типичных случаях проводят в полярном органическом растворителе, таком как ацетонитрил, тетрагидрофуран или диметилформамид, в присутствии органического или неорганического основания, такого как карбонат калия, пиридин или триэтиламин. Типичным диапазоном температур для этого превращения является от около 0 С до около 50 С. На следующей стадии проводят снятие защиты, представляющей собой чувствительную к кислоте тиогидразидную защитную группу (примером которой в этом случае является Воc). В условиях взаимодействия за вызванным кислотой снятиемN-защиты немедленно следует происходящая с высоким выходом гетероциклизация в желаемое тиадиазиноновое производное 75. Это превращение удобно проводить в присутствии органической или неорганической кислоты, такой как трифторуксусная кислота или хлорид водорода. Это взаимодействие проводят в органическом растворителе, таком как дихлорметан, дихлорэтан, диоксан или тетрагидрофуран,при температурах в диапазоне от около 10 С до около 60 С. Затем восстанавливают нитрогруппы при использовании способов, известных специалисту, с получением анилина 76. Это восстановление можно осуществлять проведением взаимодействия промежуточного нитросоединения с металлическим железом. Это взаимодействие проводят при температурах между 60 и 90 С в смеси воды и спирта (метанол,этанол и т.д.) в качестве растворителя и в присутствии хлорида аммония для забуферивания реакционной смеси. Анилин затем превращают в целевые структуры 77 при использовании стадий, которые похожи на те, что описаны на схеме I для превращения 6 в 5. Синтезы дигидропиридонов хорошо известны из уровня техники. Так, дигидропиридоновые соединения можно получать вариациями окислительных превращений производных пиперидона, примеры чему дают следующие ссылки: Stutz et al. в Tetrahedron Lett, 1973, pp. 5095-5098; Dodd et al., TetrahedronLett, 1991, pp. 3643-3646; Evans et al., Tetrahedron Lett., 1995, pp. 3985-3988; Blache et al., Heterocycles,1997, pp. 57-69; и Ishii et al., Tetrahedron Lett., 1997, pp. 7565-7568. В другом воплощении дигидропиридоновые соединения можно синтезировать вариациями гетеротрансформаций Дильса-Альдера производных имина, примеры чему дают следующие публикации: Diez et al., Heterocycles, 1990, p. 485; Waldmannal., J. Org. Chem, 1998, pp. 4936-4946. В еще одном воплощении дигидропиридоновые соединения можно получать восстановительной трансформацией производных пиридина и пиридона, см., например ссылки:Haider et. al., Helv. Chim. Acta, 1975, p.1287; Guerry et al Synthesis, 1984, p. 485; Guerry et al., Chimia,1987, p. 341; Comins et al., Heterocycles, 1994, pp. 1121-1140; и Dehmlow et al., Heterocycles, 1994, pp. 355366. Схема XIV иллюстрирует один общий способ получения дигидропиридоноксазолидинон-5 карбоксамидов из производных нитробензола и пиперидина. На первой стадии проводят взаимодействие,представляющее собой нуклеофильное ароматическое замещение, подходящего нитробензола 78 (Z10 =F, Cl, OTf или другая уходящая группа) с производным пиперидина, таким как 4-пиперидон, с получением структуры 79. Это взаимодействие проводят в апротонном полярном растворителе, таком как диметилформамид, ацетонитрил или диметилсульфоксид, в присутствии органического или неорганического основания, такого как пиридин, триэтиламин или карбонат калия. Для этого взаимодействия в общем пригоден температурный диапазон от около 20 до около 80 С. На следующей стадии проводят образование силиленолята 80 из промежуточного соединения 79, представляющего собой 1-арилпиперидон, и силилирующего агента, такого как хлорид триизопропилсилила, трифлат триалкилсилила или аналогичный реагент. Это взаимодействие в типичных случаях проводят в присутствии органического основания,такого как триэтиламин, пиридин или имидазол, при температурах от около 0 до около 60 С. На стадии 3 этого синтеза проводят окисление промежуточных соединений, представляющих собой силиленоляты,до дигидропиридоновых соединений 81 подходящим неорганическим окислителем, таким как церийаммоний нитрат (CAN, как описали Evans et al. в Tetrahedron Lett., 1995, vol. 36, pp. 3985-3988) или ацетат палладия (как описали Comins et al. в Tetrahedron Lett., 1995, vol. 36, pp. 9449-9452). Нитрогруппу соединения 81 можно затем восстановить при использовании способов, известных специалисту, например через восстановление металлическим железом (см. схему ХIII) или через каталитическое гидрогенизирование над палладием/СаСО 3 в присутствии уксусной кислоты с получением анилина 82, который затем превращают в целевые структуры 83 (W10 = О) при использовании стадий, которые похожи на те,что описаны на схеме I для превращения 6 в 5. Оксимовые производные соединения 83 можно затем получить использованием способов, известных специалисту. Простой оксим (W10 = N(OH можно получить из 83 при обработке гидрохлорида гидроксиламина в присутствии надлежащего основания, такого как пиридин, который можно использовать также как растворитель или как часть смеси растворителей. Схема XV иллюстрирует получение оксазолидинон-5-карбоксамидов бензоксазин-3-он-, бензотиазин-3-он- и тетрагидрохинолин-2-он- 88. Структуры 84 (Z5 = О, S, СН 3 и т.д.), которые известны в литературе (см. конкретные примеры в WO 99/37641 и WO 99/40094 и цитированных там ссылках) или которых можно получать использованием известных способов (таких как нитрование исходной бициклической кольцевой системы), можно алкилировать при использовании вышеописанных способов (см. схемуX) с получением 85. Затем восстанавливают нитрогруппы при использовании способов, известных специалисту, например через восстановление металлически железом (см. схему ХIII) или через каталитическое гидрогенизирование, с получением анилина 86, который можно затем превратить в целевые структуры 88 (V1 = O) при использовании стадий, которые похожи на те, что описаны на схеме I для превращения 6 в 5. Вдобавок из промежуточных структур 87 (V1 = О) можно получать тиоксо-производные (V1= S). Обработка 87 (V1 = О) реагентом Лоуссона в условиях, хорошо описанных в литературе (см. схему ХIII) дает промежуточные тиоксосоединения 87 (V1 = S), который можно затем превратить в целевые структуры 88 (V1 = S), как описано выше. Схема XVI Схема XVI иллюстрирует общие способы получения тиопирансульфоксиминоксазолидинон-5 карбоксамидов 95. Сульфоксидные структуры 89 как в цис-, так и в транс-конфигурации (получены, как обрисовано на схеме VII или при использовании способов, аналогичных тем, что раскрывает патент США 6239283) можно превратить в сульфоксиимины 90 с сохранением стереохимии сульфоксида при использовании способов аминирования, известных специалисту, например через обработку Омезитиленсульфонилгидроксиламином (MSH) в подходящем растворителе, таком как метиленхлорид, в общем при или близко к температуре окружающей среды (см. также WO 01/46185 и Synthesis, 2000, 1, 1). Сульфоксимины 90 можно затем превратить в целевые структуры 95 (R315 = H) при использовании стадий, которые похожи на те, что описаны на схеме VII для превращения 38 в 39, с последующими похожими на те, что описаны на схеме I для превращения 6 в 5. Сульфоксимины 90 можно также алкилировать с получением структур 91 (где R315 представляет собой алкил или замещенный алкил), например через взаимодействие с альдегидом или кетоном, триэтилсиланом и трифторуксусной кислотой подходящем растворителе, таком как ацетонитрил, при температуре, в зависимости от растворителя, в диапа- 26007490 зоне 10-120 С, или через взаимодействие с альдегидом или кетоном и муравьиной кислотой при использовании условий Лейкарта-Уоллаха (Leuckart-Wallach) или Эшвейлера-Кларка (Eschweiler-Clarke). Удобным источником формальдегида для этого взаимодействия с получением N-метильных производных является пара-формальдегид (дополнительные способы функционализации сульфоксиминовых групп см. вWO 01/46185). Замещенные сульфоксимины 91 можно затем превратить в целевые структуры 95 как описано выше. Или же алкилирование можно проводить на последней стадии в этой последовательности с использованием структуры 95 (R315 = H). Аминирование также можно проводить на более поздней стадии в синтезе, начиная с сульфоксидных структур 92. Эти структуры можно получать из карбаматов 89, как описано выше или использованием способов, обрисованных на схеме VII. Аминирование 92 в вышеописанных условиях дает сульфоксимины 93, которые можно затем превратить в целевые структуры 95 (R315 = H), как описано выше. Сульфоксиминовую группу можно также функционализировать, как описано выше. Соответствующие производные тиоморфолинсульфоксимина, где тиопирановое кольцо заменяют тиоморфолиновым кольцом в 95, можно получать использованием стадий, аналогичных вышеописанным. Однако аминирование в общем проводят при использовании азида натрия в полифосфорной кислоте при температуре в общем в диапазоне от около 40 до около 70 С. Схема XVII Схема XVII иллюстрирует один способ получения дигидротиазинилсульфоноксазолидинон-5 карбоксамидов 98. S,S-диоксиды тиоморфолиноксазолидинон-5-карбоксамидов 96 (см. схему V) можно превратить в производные дигидротиазинов 97 при обработке подходящим органическим окислителем,таким как 2,3-дихлор-5,6-дицианобензохинон (DDQ) или хлоранил. Эти превращения в типичных случаях проводят в полярном органическом растворителе, таком как диоксан, тетрагидрофуран или диметилацетамид, при температуре в диапазоне от около 60 С до около 110 С. Структуры 97 можно затем превратить в целевые структуры как описано выше на схеме I. Схема XVIII Схема XVIII иллюстрирует один способ получения оксазолидинон-5-карбоксамидов тетрагидропиридил- или пиперидинил- 102. Производные тетрагидропиридиланилинов 99 (см. WO 97/09328 или WO 99/64417) можно превратить в производные тетрагидропиридилоксазолидинонов 100 способом С, описанным выше для схемы I. Удаление защитной группы (Z12 = Cbz, BOC или Bn) использованием известных способов дает незащищенные производные 101. Сохранение двойной связи в тетрагидропиридильной группе можно осуществлять при удалении группы Cbz обработкой TMSI и далее метанолом, группы ВОС-трифторуксусной кислотой или группы Bn - -хлорэтилхлороформатом и далее метанолом. ДляZ12= Bn или Cbz отщепление защитной группы в условиях каталитического гидрогенизирования приводит к восстановлению двойной связи с получением пиперидинильной структуры 101. Функционализацию азота тетрагидропиридила или пиперидинила можно осуществить известными способами, такими как алкилирование и ацилирование (См. также WO 99/64417, WO 02/096916 и WO 01/40236). Подходящие промежуточные соединения, полезные в получении соединений по этому изобретению, и дополнительный синтетические способы в помощь получению этих соединений можно найти,например, в следующих публикациях, каждое из которых включено сюда ссылкой.PCT/US95/12751, WO 96/15130, PCT/US96/00718, WO 96/23788, WO 98/54161, WO 99/29688, WO 99/03846,WO 99/37641, WO 99/37652, WO 99/40094, WO 97/30995, WO 97/09328, WO 01/81350, WO 01/40236, WO 00/21960 WO 01/04022, WO 00/73301, WO 01/46185, WO 99/64417, WO 02/59155, WO 02/096916 и WO 95/07271. В некоторых воплощениях антибактериальные соединения представляют собой пролекарства соединений формул I, II и III. Выражение "пролекарство" обозначает производное известного лекарственного средства прямого действия, трансформируемое в активное лекарственное средство ферментативным или химическим процессом. Пролекарства соединений формул I, II и III получены модифицированием функциональных групп, присутствующих на соединении, таким путем, что эти модификации отщепляются до исходного соединения как при рутинном манипулировании, так и in vivo. Пролекарства включают в себя, но без ограничения ими, соединения формул I, II и III, в которых гидроксильные, аминные или сульфгидрильные группы связаны с любой группой, которая при введении животному отщепляется с образованием свободной гидроксильной, аминной или сульфгидрильной группы, соответственно. Репрезентативные примеры пролекарств включают в себя, но без ограничения ими, ацетатные, формиатные и бензоатные производные спиртовых и аминных функциональных групп. См. Notari, R. E. "Theory andProdrug Design," Drugs of Future, 6(3):165-182 (1981); и Bundgaard, H., "Design of Prodrugs: BioreversibleDerivatives for Various Functional Groups and Chemical Entities," в Design of Prodrugs (H. Bundgaard, ed.),Elsevier, N.Y. (1985). Примеры Без дальнейших разъяснений считается, что специалист в данной области может, используя предшествующее описание, применять настоящее изобретение на практике в его полном объеме. Нижеследующие детализированные примеры описывают, как получать разные соединения и/или осуществлять разные процессы по этому изобретению, и их надо считать всего лишь иллюстративными, а не ограничивающими каким-либо образом предыдущее раскрытие. Специалисты в данной области быстро распознают подходящие вариации этих процедур как в смысле реагентов, так и условий и методик проведения взаимодействий. Пример 1. (5R)-(-)-3-[3-Фтор-4-(4-морфолинил)-фенил]-2-оксо-5-оксазолидинкарбоксамид Способ А Стадия 1: Получение (5R)-(-)-3-[3-фтор-4-(4-морфолинил)-фенил]-2-оксо-5-оксазолидинкарбоновой кислоты Раствор бензил-3-фтор-4-(4-морфолинил)-фенилкарбамата (J. Med. Chem. 1996, 39(3), 673-679, 2,50 г, 7,57 ммоль) в сухом тетрагидрофуране (37,8 мл) при -78 С под азотом обрабатывают н-бутиллитием(1,6 М в гексанах, 4,82 мл, 7,72 ммоль) каплями и перемешивают при -78 С в течение 30 мин. Охладительную баню удаляют и смеси дают медленно нагреться до -40 С, по достижении чего добавляют (2R)глицидат калия (J. Org. Chem. 1992, 57(12), 3380-3387, 974 мг, 7,72 ммоль). После последующего нагревания до температуры окружающей среды получившуюся смесь интенсивно перемешивают в течение 2,75 суток и затем гасят насыщенным водным хлоридом аммония (20 мл), разбавляют водой (20 мл) и экстрагируют этилацетатом (2 х 75 мл) для удаления оставшегося исходного материала. Водную фазу доводят до рН 2 1 М водной соляной кислотой, насыщают хлоридом натрия и экстрагируют метиленхлоридом (5 х 100 мл) и эту объединенную органическую фазу сушат над безводным сульфатом натрия и концентрируют под пониженным давлением с получением неочищенного продукта. Смесь продуктов затем хроматографируют на силикагелевом картридже Flash 40M (90 г, 32-63 мкм) при элюировании градиентом ацетонитрила/метиленхлорида (10/90 - 40/60) с 1%-ой муравьиной кислотой и фракции с Rf=0,15 при ТСХ (ацетонитрил/метиленхлорид, 50/50 + 1% муравьиная кислота) объединяют в пул и концентрируют с получением соединения, указанного в заголовке; 1 Н-ЯМР (400 МГц, ДМСО-d6)13,7 (bs, 1H), 7,48 (dd, 1H), 7,23 (m, 1H), 7,05 (t, 1H), 5,17 (dd, 1H), 4,30 (t,1H), 4,06 (dd, 1 Н), 3,73 (т, 4 Н), 2,96 (m, 4 Н); MS (ESI+) для C14H15FN2O5 m/z 311 (М+Н)+; []25D = -38 (с 0,94,ДМСО).(5R)-(-)-3-[3-фтор-4-(4-морфолинил)фенил]-2-оксо-5-оксазолидинкарбоксамида В высушенную пламенем колбу, содержащую (5R)-(-)-3-[3-фтор-4-(4-морфолинил)фенил]-2-оксо-5 оксазолидинкарбоновую кислоту (Стадия 1; 250 мг; 0,806 ммоль), под азотом добавляют оксалилхлорид(4 мл) при перемешивании. Колбу закрывают сушильной трубкой и смесь перемешивают при температуре окружающей среды в течение 15 ч и затем концентрируют под пониженным давлением с получением промежуточного соединения, представляющего собой хлорангидрид [MS (ESI+) m/z 325 (М+Н)+, измерено для метилового эфира, полученного взаимодействием этого хлорангидрида с метанолом], который используют без дальнейшей очистки. Затем собирают это промежуточное соединение в безводный тетрагидрофуран (8 мл) под азотом, охлаждают до 0 С и пробулькивают аммиак (газ) в течение 5 мин. Получившуюся смесь закрывают сушильной трубкой, перемешивают при температуре окружающей среды в течение 1 ч и затем разбавляют водой (20 мл) и экстрагируют метанолом/хлороформом (10/90, 2 х 30 мл). Объединенную органическую фазу сушат над безводным сульфатом натрия и концентрируют под пониженным давлением и смесь продуктов перекристаллизовывают из этилацетата/гексана с получением соединения, указанного в заголовке, т.пл. 185-187 С (разложение); MS (ESI+) для C14H16FN3O4 m/z 310 Соблюдая общую процедуру примера 1 стадии 2 и делая небольшие вариации, состоящие всего лишь в замене аммиака метиламином, получают соединение, указанное в заголовке, т.пл. 182-183 С (разложение); MS (ESI+) для C15H18FN3O4 m/z 324 (М+Н)+; []25D = -39 (с 0,92, ДМСО). Пример 3. (5R)-(-)-3-[3-Фтор-4-(4-морфолинил)-фенил]-N-аллил-2-оксо-5-оксазолидинкарбоксамид В высушенную пламенем колбу под азотом добавляют аллиламин (0,60 мл, 8,05 ммоль). Охлаждают колбу в ледяной бане и добавляют раствор (5R)-3-[3-фтор-4-(4-морфолинил)-фенил]-2-оксо-5 оксазолидинкарбонилхлорида (пример 1, стадия 2; 0,805 ммоль, теоретическое количество) в безводном тетрагидрофуране (8,0 мл). Получившуюся смесь перемешивают под азотом в течение 2 ч, давая охлаждающей бане медленно выдохнуться, и затем разбавляют водой (10 мл) и экстрагируют метиленхлоридом (20 мл). Органическую фазу промывают водой (10 мл) и физиологическим раствором (10 мл), сушат над безводным сульфатом натрия и концентрируют под пониженным давлением и неочищенный продукт хроматографируют на силикагелевом картридже Flash 40S (40 г, 32-63 мкм) при элюировании градиентом метанола/метиленхлорида (0,5/99,5 - 2/98). Объединение в пул и концентрирование фракций с Rf= 0,44 при ТСХ (метанол/хлороформ, 5/95) дают соединение, указанное в заголовке, т.пл. 167-169 С; MS Соблюдая общую процедуру примера 3 и делая небольшие вариации, состоящие всего лишь в замене аллиламина пропиламином и перетирании и фильтровании готового продукта из метанола/диэтилового эфира, получают соединение, указанное в заголовке, т.пл. 165-167 С; MS (ESI+) для Смесь (5R)-(-)-3-[3-фтор-4-(4-морфолинил)фенил]-2-оксо-5-оксазолидинкарбоновой кислоты (пример 1, стадия 1; 150 мг, 0,483 ммоль) и О-метилгидроксиламина гидрохлорида (61 мг, 0,724 ммоль) в тетрагидрофуране/воде (1/1, 4,8 мл) обрабатывают 1-(3-диметиламинопропил)-3-этилкарбодиимида гидро- 29007490 хлоридом (278 мг, 1,424 ммоль) и получившуюся смесь перемешивают при температуре окружающей среды в течение 30 мин и затем разбавляют водой (10 мл) и экстрагируют этилацетатом (2 х 20 мл). Объединенную органическую фазу промывают водой (10 мл) и физиологическим раствором (10 мл), сушат над безводным сульфатом натрия и концентрируют под пониженным давлением и неочищенный продукт хроматографируют на силикагелевом картридже Flash 40S (40 г, 32 - 63 мкм), элюируя метанолом/метиленхлоридом (2,5/97,5). Объединение в пул и концентрирование фракций с Rf= 0,53 при ТСХ(5R)-(-)-3-[3-фтор-4-(4-морфолинил)фенил]-N-бензилокси-2-оксо-5 оксазолидинкарбоксамида Соблюдая общую процедуру примера 5 и делая небольшие вариации, состоящие всего лишь в замене О-метилгидроксиламина гидрохлорида О-бензил гидроксиламина гидрохлоридом, получают соединение, указанное в заголовке, т.пл. 191-193 С (разложение); MS (ESI+) для C21H22FN3O5 m/z 416 (M+H)+;(77 мг) под азотом. Получившуюся смесь дегазируют и перемешивают под атмосферой водорода (баллон) в течение 1 ч. Катализатор затем удаляют фильтрацией через целит и промыванием метанолом (60 мл) и фильтрат концентрируют под пониженным давлением. Перетирание этого остатка со смесью (5% метанол/метиленхлорид)/диэтиловый эфир дает соединение, указанное в заголовке, т.пл. 141-143 С; MS Стадия 1: Получение (5R)-(-)-3-[3-фтор-4-йодфенил]-5-гидроксиметил-2-оксазолидинона Раствор изобутил 3-фтор-4-йодфенилкарбамата (Org. Process Res. Dev. 2001, 5(1), 80-83, 5,00 г,14,83 ммоль) в сухом тетрагидрофуране (59 мл) при -78 С под азотом обрабатывают гексаметилдисилазидом лития (1,0 М в тетрагидрофуране, 15,6 мл, 15,57 ммоль) каплями и перемешивают при -78'С в течение 45 мин. Затем добавляют каплями (R)-глицидилбутират (2,21 мл, 15,57 ммоль) и перемешивают получившуюся смесь при -78 С в течение 1 ч и при температуре окружающей среды в течение 2,75 суток. Затем реакционную смесь гасят насыщенным водным хлоридом аммония (20 мл), разбавляют водой(20 мл) и слои разделяют. Водную фазу экстрагируют этилацетатом (25 мл) и объединенную органическую фазу промывают водой (25 мл) и физиологическим раствором (25 мл), сушат над безводным сульфатом магния и концентрируют под пониженным давлением. Затем хроматографируют смесь продуктов на силикагелевом картридже Flash 40M (90 г, 32-63 мкм) при элюировании градиентом метанола/метиленхлорида (1/99 - 2/98) и объединяют фракции с Rf= 0,25 при ТСХ (метанол/хлороформ, 5/95) в пул и концентрируют с получением соединения, указанного в заголовке, т.пл. 116 -117 С; MS (ESI+) дляC10H9FINO3 m/z338 (M+H)+; []25D = -41 (с 0,98, ДМСО). Стадия 2. Получение (-)-мeтил-(5R)-3-[3-фтop-4-йoдфeнил]-2-oкco-5-оксазолидинкарбоксилата Раствор (5R)-(-)-3-[3-фтop-4-йoдфeнил]-5-гидpoкcимeтил-2-oкcaзoлидинoнa (стадия 1; 7,61 г, 22,58 ммоль) в ацетоне (150 мл) при -10 С обрабатывают смесью СrО 3 (6,21 г, 62,1 ммоль) в серной кислоте (6 М, 16,9 мл, 101 ммоль) каплями в течение 15 мин. Получившейся смеси дают медленно нагреться до температуры окружающей среды при интенсивном перемешивании (легкая экзотермия до 35 С) и перемешивают в течение дополнительных 16 ч. Смесь затем обрабатывают изопропанолом (35 мл), разбавляют физиологическим раствором (150 мл) и диэтиловым эфиром (150 мл), перемешивают до растворения всех твердых веществ и слои разделяют. Водную фазу экстрагируют диэтиловым эфиром (100 мл) и объединенную органическую фазу сушат над безводным сульфатом магния и концентрируют под пониженным давлением с получением неочищенного промежуточного соединения, представляющего собой
МПК / Метки
МПК: C07D 413/10, C07D 307/58, C07D 263/20, C07D 417/04, C07D 417/10, C07D 307/33, C07D 261/12, A61K 31/421, C07F 9/6558, C07D 413/04, C07D 471/04
Метки: применение, производные, антибактериальных, средств, качестве, n-арил-2-оксазолидинон-5-карбоксамиды
Код ссылки
<a href="https://eas.patents.su/30-7490-n-aril-2-oksazolidinon-5-karboksamidy-ih-proizvodnye-i-ih-primenenie-v-kachestve-antibakterialnyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">N-арил-2-оксазолидинон-5-карбоксамиды, их производные и их применение в качестве антибактериальных средств</a>
Предыдущий патент: Способ промышленного синтеза ранелата стронция и его гидратов
Следующий патент: Производные нуклеозидов в качестве ингибиторов рнк-зависимой рнк вирусной полимеразы
Случайный патент: Компьютерная система и способ управления загрузкой доменной печи посредством пользовательского интерфейса