Пиримидиновые соединения, относящиеся к а2b – селективным антагонистам, их синтез и применение
Номер патента: 7468
Опубликовано: 27.10.2006
Авторы: Коллингтон Эрик Уилльям, Штайниг Арно Г., Кастелано Арлиндо Л., Маккиббен Брайан
Формула / Реферат
1. Соединение структуры
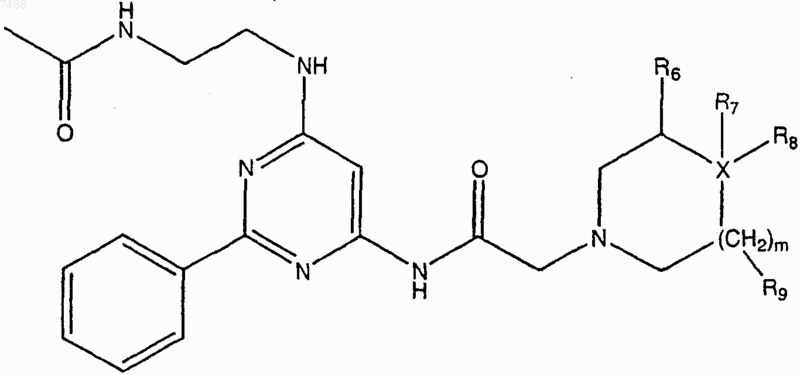
где каждый R6 и R9 независимо представляет собой водород или алкил;
R7 представляет собой водород, ОН, алкоксигруппу, сложный эфир, ацеталь, кеталь или CN;
R8 представляет собой замещенный или незамещенный арил, арилоксигруппу или алкиларил;
где заместители в алкильном фрагменте выбраны из галогена, гидроксила, алкилкарбонилоксигруппы, арилкарбонилоксигруппы, алкоксикарбонилоксигруппы, арилоксикарбонилоксигруппы, карбоксилата, алкилкарбонила, алкоксикарбонила, аминокарбонила, алкилтиокарбонила, алкоксила, фосфата, фосфонатогруппы, фосфинатогруппы, цианогруппы, аминогруппы (включая алкиламиногруппу, диалкиламиногруппу, ариламиногруппу, диариламиногруппу и алкилариламиногруппу), ациламиногруппы (включая алкилкарбониламиногруппу, арилкарбониламиногруппу, карбамоил и уреидогруппу), амидиногруппы, иминогруппы, сульфгидрила, алкилтиогруппы, арилтиогруппы, тиокарбоксилата, сульфата, сульфонатогруппы, сульфамоила, сульфонамидогруппы, нитрогруппы, трифторметила, азидогруппы, гетероциклила, алкиларила или ароматического или гетероароматического радикала, и
заместители в арильном фрагменте представлены галогеном, гидроксилом, алкоксигруппой, алкилкарбонилоксигруппой, арилкарбонилоксигруппой, алкоксикарбонилоксигруппой, арилоксикарбонилоксигруппой, карбоксилатом, алкилкарбонилом, алкоксикарбонилом, аминокарбонилом, алкилтиокарбонилом, фосфатом, фосфонатогруппой, фосфинатогруппой, цианогруппой, аминогруппой (включая алкиламиногруппу, диалкиламиногруппу, ариламиногруппу, диариламиногруппу и алкилариламиногруппу), ациламиногруппой (включая алкилкарбониламиногруппу, арилкарбониламиногруппу, карбамоил и уреидогруппу), амидиногруппой, иминогруппой, сульфгидрилом, алкилтиогруппой, арилтиогруппой, тиокарбоксилатом, сульфатами, сульфонатогруппой, сульфамоилом, сульфонамидогруппой, нитрогруппой, трифторметилом, цианогруппой, азидогруппой, гетероциклилом, алкиларилом или ароматическим или гетероароматическим радикалом;
X представляет собой С или N;
где, если X представляет собой N, R7 или R8 отсутствует;
где, если X представляет собой С, R7XR8 могут образовывать 3-8-членное карбоциклическое или гетероциклическое кольцо; и
m равно 1 или 2;
где алкил представляет собой C1-30алкил;
алкокси представляет собой C1-30алкилокси;
алкиларил представляет собой C1-30алкиларил, где арил состоит из 5-6-членных однокольцевых ароматических групп, включающих 0-4 гетероатома, или полициклических конденсированных 5-6-членных ароматических групп, включающих 0-4 гетероатома в каждой ароматической группе.
2. Соединение по п.1, где R7 представляет собой водород, ОН или CN.
3. Соединение по п.1, где соединение выбрано из группы, включающей
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(3-хлорфенокси)пиперидин-1-ил]ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(2-хлорфенокси)пиперидин-1-ил]ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(4-метоксибензил)пиперидин-1-ил]ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(4-фторбензил)пиперидин-1-ил]ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(2-хлорбензил)пиперидин-1-ил]ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(3-хлорбензил)пиперидин-1-ил]ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(4-хлорбензил)пиперидин-1-ил]ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-(4-бензилпиперазин-1-ил)ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(4-метоксибензил)пиперазин-1-ил]ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(2-метоксибензил)пиперазин-1-ил]ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(3-метоксибензил)пиперазин-1-ил]ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(4-хлорбензил)пиперазин-1-ил]ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(3-хлорбензил)пиперазин-1-ил]ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(2-хлорбензил)пиперазин-1-ил]ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(3-фторбензил)пиперазин-1-ил]ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(2-фторбензил)пиперазин-1-ил]ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(3-трифторметилбензил)пиперазин-1-ил]ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-(4-циклогексилметилпиперазин-1-ил)ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-(4-фенетилпиперазин-1-ил)ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-(4-фенетил-[1,4]диазепан-1-ил)ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-(4-бензил-[1,4]диазепан-1-ил)ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(2-фторбензил)-[1,4]диазепан-1-ил]ацетамид;
N-[6-(2-aцетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(3-фторбензил)-[1,4]диазепан-1-ил]ацетамид;
N-[6-(2-aцетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(4-фторбензил)-[1,4]диазепан-1-ил]ацетамид;
N-[6-(2-aцетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(2-трифторметилбензил)-[1,4]диазепан-1-ил]ацетамид;
N-[6-(2-aцетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(3-трифторметилбензил)-[1,4]диазепан-1-ил]ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(4-трифторметилбензил)-[1,4]диазепан-1-ил]ацетамид;
N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-(4-пиридин-3-илметил-[1,4]диазепан-1-ил)ацетамид;
N-[5-(2-ацетиламиноэтиламино)бифенил-3-ил]-2-[4-(3-хлорбензил)-[1,4]диазепан-1-ил]ацетамид;
N-[5-(2-ацетиламиноэтиламино)бифенил-3-ил]-2-(4-пиридин-2-илметил-[1,4]диазепан-1-ил)ацетамид;
N-[5-(2-ацетиламиноэтиламино)бифенил-3-ил]-2-[4-(6-метилпиридин-2-илметил)-[1,4]диазепан-1-ил]ацетамид;
N-(6-{[2-(aцетиламино)этил]амино}-2-фенилпиримидин-4-ил)-2-{4-[2-нитро-4-(трифторметил)фенил]пиперазин-1-ил}ацетамид;
N-(6-{[2-(ацетиламино)этил]амино}-2-фенилпиримидин-4-ил)-2-[4-(4-трет-бутилбензил)пиперазин-1-ил]ацетамид;
N-(6-{[2-(ацетиламино)этил]амино}-2-фенилпиримидин-4-ил)-2-{4-[(2Е)-3-фенилпроп-2-енил]пиперазин-1-ил}ацетамид и
N-(6-{[2-(ацетиламино)этил]амино}-2-фенилпиримидин-4-ил)-2-(4-бензилпиперидин-1-ил)ацетамид.
4. Соединение по п.1, представляющее собой N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(4-хлорфенил)-4-гидроксипиперидин-1-ил]ацетамид.
5. Способ получения соединения по п.1, включающий взаимодействие соединения структуры
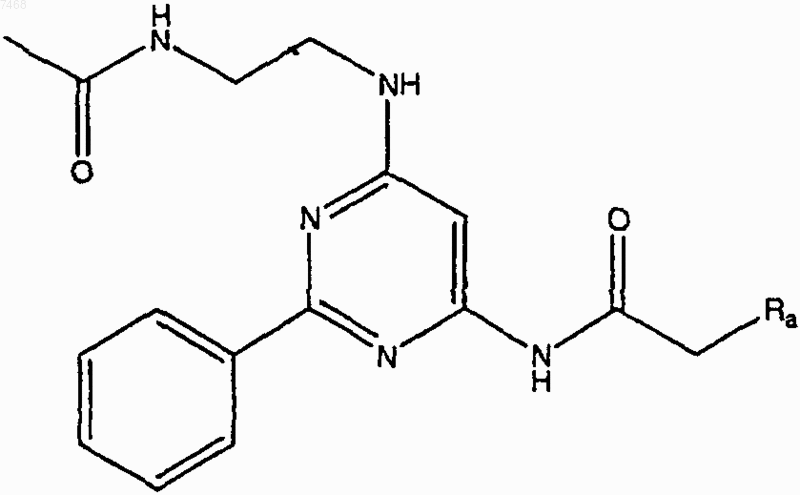
где Ra представляет собой Сl или Вr, с
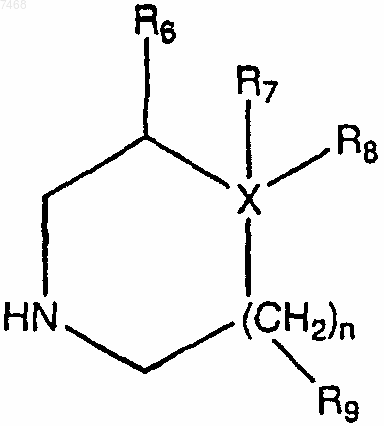
в подходящих условиях с получением
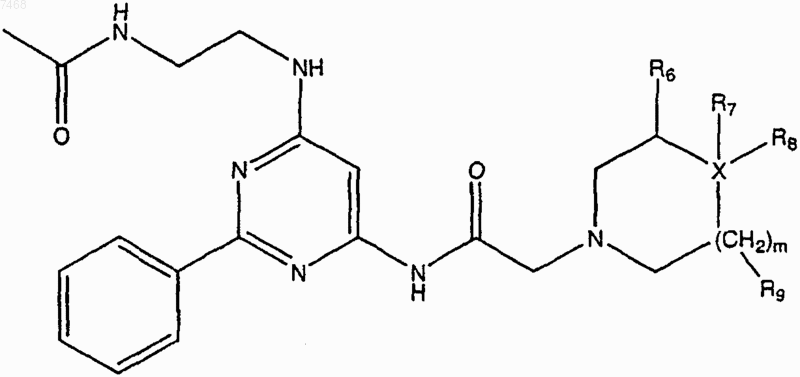
где R6 и R9, каждый независимо, представляют собой водород или алкил;
R7 представляет собой водород, ОН, алкоксигруппу, сложный эфир, ацеталь, кеталь или CN;
R8 представляет собой замещенный или незамещенный арил, арилоксигруппу или алкиларил;
где заместители в алкильном фрагменте выбраны из галогена, гидроксила, алкилкарбонилоксигруппы, арилкарбонилоксигруппы, алкоксикарбонилоксигруппы, арилоксикарбонилоксигруппы, карбоксилата, алкилкарбонила, алкоксикарбонила, аминокарбонила, алкилтиокарбонила, алкоксила, фосфата, фосфонатогруппы, фосфинатогруппы, цианогруппы, аминогруппы (включая алкиламиногруппу, диалкиламиногруппу, ариламиногруппу, диариламиногруппу и алкилариламиногруппу), ациламиногруппы (включая алкилкарбониламиногруппу, арилкарбониламиногруппу, карбамоил и уреидогруппу), амидиногруппы, иминогрупяы, сульфгидрила, алкилтиогруппы, арилтиогруппы, тиокарбоксилата, сульфата, сульфонатогруппы, сульфамоила, сульфонамидогруппы, нитрогруппы, трифторметила, азидогруппы, гетероциклила, алкиларила или ароматического или гетероароматического радикала, и
заместители в арильном фрагменте представлены галогеном, гидроксилом, алкоксигруппой, алкилкарбонилоксигруппой, арилкарбонилоксигруппой, алкоксикарбонилоксигруппой, арилоксикарбонилоксигруппой, карбоксилатом, алкилкарбонилом, алкоксикарбонилом, аминокарбонилом, алкилтиокарбонилом, фосфатом, фосфонатогруппой, фосфинатогруппой, цианогруппой, аминогруппой (включая алкиламиногруппу, диалкиламиногруппу, ариламиногруппу, диариламиногруппу и алкилариламиногруппу), ациламиногруппой (включая алкилкарбониламиногруппу, арилкарбониламиногруппу, карбамоил и уреидогруппу), амидиногруппой, иминогруппой, сульфгидрилом, алкилтиогруппой, арилтиогруппой, тиокарбоксилатом, сульфатами, сульфонатогруппой, сульфамоилом, сульфонамидогруппой, нитрогруппой, трифторметилом, цианогруппой, азидогруппой, гетероциклилом, алкиларилом, или ароматическим или гетероароматическим радикалом;
X представляет собой С или N;
где, если X представляет собой N, R7 отсутствует;
где, если X представляет собой С, R7XR8 могут образовывать 3-8-членное карбоциклическое или гетероциклическое кольцо; и
m равно 1 или 2;
где алкил представляет собой C1-30алкил;
алкокси представляет собой C1-30алкилокси;
алкиларил представляет собой C1-30алкиларил, где арил состоит из 5-6-членных однокольцевых ароматических групп, включающих 0-4 гетероатома, или полициклических конденсированных 5-6-членных ароматических групп, включающих 0-4 гетероатома в каждой ароматической группе.
Текст
007468 По данной заявке испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США 60/342595, поданной 20 декабря 2001 г., содержание которой включено, таким образом,в этот документ в виде ссылки. В материалах настоящей заявки ссылки на различные публикации приведены во всей их полноте. Раскрытия этих публикаций во всей их полноте включены, таким образом, в настоящую заявку в качестве ссылки для более полного описания уровня техники, известного специалисту в данной области техники, на дату описания и раскрытия настоящего изобретения. Предпосылки создания изобретения Аденозин является чрезвычайно широко распространенным модулятором многочисленных физиологических процессов, особенно в пределах сердечно-сосудистой и нервной систем. Эффекты аденозина,по-видимому, опосредованы специфическими рецепторными белками поверхности клеток. Аденозин модулирует различные физиологические функции, включая индукцию седативного эффекта, расширение кровеносных сосудов, уменьшение частоты сердечных сокращений и сократительной способности сердца, ингибирование способности тромбоцитов к агрегации, стимуляцию глюконеогенеза и ингибирование расщепления жира. Было показано, что в дополнение к его эффектам на аденилатциклазу аденозин открывает калиевые каналы, уменьшает ток через кальциевые каналы и ингибирует или стимулирует фосфоинозитидный обмен через рецептор-опосредованные механизмы (см., например, С.Е. Mller and В.Stein "Adenosine Receptor Antagonists: Structures and Potential Therapeutic Applications", Current Pharmaceutical Design, 2: 501 (1996) и C.E. Muller "A1-Adenosine Receptor Antagonists", Exp. Opin. Ther. Patents 7 (5): 419 (1997. Аденозиновые рецепторы принадлежат к суперсемейству пуриновых рецепторов, которые в настоящее время подразделяются на рецепторы P1 (аденозин) и Р 2 (АТФ, АДФ и другие нуклеотиды). До сих пор у различных видов, включая человека, были клонированы четыре подтипа аденозиновых рецепторов. Два подтипа рецепторов (A1 и А 2 а) обладают сродством к аденозину в наномолярных концентрациях, в то время как два других известных подтипа А 2b и А 3 являются низкоаффинными рецепторами,обладающими сродством к аденозину в малых микромолярных концентрациях. Активация аденозинового рецептора A1 и А 3 может приводить к ингибированию аденилатциклазной активности, в то время как активация А 2 а и А 2b вызывает стимуляцию аденилатциклазы. Несколько антагонистов A1 были разработаны для лечения нарушения познавательной способности, почечной недостаточности и сердечных аритмий. Было высказано предположение, что антагонисты А 2 а могут успешно применяться у больных, страдающих Morbus Parkinson (болезнью Паркинсона) . Особым образом, принимая во внимание возможность их местного нанесения, антагонисты аденозинового рецептора могут быть полезными при лечении аллергического воспаления и астмы. Информация из доступных источников (например, NyceMetzger "DNA antisense Therapy for Asthma in an Animal Model",Nature (1997), 385: 721-5) указывает на то, что в этом патофизиологическом контексте антагонисты A1 могут блокировать сокращения гладкой мускулатуры, лежащей под дыхательным эпителием, в то время как антагонисты рецептора А 2b или А 3 могут блокировать дегрануляцию тучных клеток, уменьшая высвобождение гистамина и других медиаторов воспаления. Рецепторы А 2b были обнаружены на всем протяжении желудочно-кишечного тракта, в особенности в эпителии толстого кишечника и тонкого кишечника. Было высказано предположение, что рецепторы А 2b опосредуют цАМФ-ответ (Strohmeier et al., J.Biol. Chem. (1995), 270: 2387-94). Рецепторы А 2b также были вовлечены в широкий ряд физиологических процессов, наводя тем самым на мысль, что лечение ассоциированных с ними нарушений может осуществляться путем блокирования рецептора А 2b. Например, рецептор А 2b играет роль в дегрануляции тучных клеток и, следовательно, в лечении астмы, реперфузионного повреждения миокарда, аллергических реакций, включая без ограничения ринит, реакции, индуцированные ядовитым плющом, крапивницу, склеродермический артрит,других аутоиммунных заболеваний и воспалительных заболеваний кишечника (Gao, Z. et al., J. Biol.Chem. (1999), 274 (9): 5972-5980; Linden, J. et al., Life Sciences (1998), 62 (17-18): 1519-1524; и патент США 6117878, выданный 12 сентября 2000 года). Также было показано, что рецепторы А 2b: ингибируют рост фибробластов сердца, наводя тем самым на мысль, что они могут предупреждать в сердце изменения, ассоциированные с гипертензией, инфарктом миокарда и постишемической реперфузией миокарда (Dubey, R.K. et al., Hypertension (2001), 37: 716-721); опосредуют роль аденозина в активации лимфоцитов (Mirabet, M. et al., J. Cell. Sci. (1999), 112 (4): 491-502), регулируют расширение кровеносных сосудов и рост (Ralevic, V. and Bumstock, G., Pharmacol. Rev. (1998), 50 (3): 413-492; Corset, V. et al., Nature (2000), 407 (6805): 747-750; и Haynes, J. Jr. et al., Am. J. Physiol. (1999), 276 (6): H1877-83); принимают участие в нейрорефлекторных ответах в кишечнике человека (Christofi, F.L. et al., J. Соmр. Neurol.(2001), 439 (1): 46-64); и регулируют ангиогенез в сетчатке, наводя тем самым на мысль о применении антагонистов А 2b для лечения заболеваний, ассоциированных с аберрантной реваскуляризацией, таких как диабетическая ретинопатия и ретинопатия при недоношенности (Grant, M.B. et al., Invest. Opthalmol.Vis. Sci. (2001), 42 (9): 2068-2073). Они также вовлечены в модуляцию кишечного тонуса и секреции, и в передачу нервного импульса и нейросекрецию (Feoktistov, I. and Biaggioni, I., Pharmacol. Rev. (1997), 49-1 007468 Рецепторы А 2b также сопряжены с Gs/Gq-передачей сигнала, вовлеченной, как было показано, в клеточные трансформации, такие как клеточная инвазия (Faivre, К. et al., Molecular Pharmacology (2001),60: 363-372 и Regnauld, К. et al., Oncogene (2002), 21 (25): 4020-4031), наводя тем самым на мысль о применении антагонистов А 2b для лечения злокачественных опухолей. Наличие аденозиновых рецепторов также было показано в сетчатке различных видов, включая коров, свиней, обезьян, крыс, морских свинок, мышей, кроликов и человека (смотри Blazynski et al., Discrete Distributions of Adenosine Receptors in Mammalian Retina, Journal of Neurochemistry, volume 54, pages 648-655 (1990); Woods et al., Characterization of Adenosine A1-Receptor Binding Sites in Bovine RetinalScience, volume 84, pages 3906-3910 (1987. Недавно Williams сообщалось о наблюдении участков транспорта аденозина в культуре клеток сетчатки человека (Williams et al., Nucleoside Transport Sites in a Cultured Human Retinal Cell Line Established By SV-40 T Antigen Gene, Current Eye Research, volume 13, pages 109-118 (1994. Соединения, регулирующие потребление аденозина, ранее предлагались в качестве потенциальных терапевтических средств для лечения повреждения сетчатки и диска зрительного нерва. В выданномShade патенте США 5780450 Shade обсуждает применение ингибиторов потребления аденозина для лечения глазных нарушений. Shade не раскрывает применение конкретных ингибиторов рецептора А 3. Полное содержание патента США 5780450 включено, таким образом, в этот документ в виде ссылки. Соединения, специфичные по отношению к рецепторам A1, А 2 а и А 3, и их применения ранее были раскрыты в международных публикациях согласно РСТWO 99/62518 и WO 01/39777 А 1. Полное содержание международных публикаций согласно РСТWO 99/62518 и WO 01/39777 А 1 включено,таким образом, в этот документ в виде ссылки. В международной публикации РСТWO 99/64407 описан класс производных -(1 пиперазинил)ацетамидоаренкарбоновой кислоты в качестве противодиабетических средств. Однако раскрытые соединения отличаются от соединений по настоящему изобретению тем, что вместо аминогруппы, присоединенной к центральному кольцу, они предпочтительно содержат группу карбоновой кислоты. В дополнение, в цитированной заявке не приведены примеры каких-либо соединений, в которых центральное кольцо представляет собой пиримидин, или каких-либо соединений, которые содержат фенильное кольцо или гетероциклическое кольцо, присоединенное к центральному арильному кольцу. В международной публикации согласно РСТWO 97/47601 раскрыты конденсированные гетероциклические соединения, обладающие активностью в отношении рецептора D4 и D2. Раскрытые соединения отличаются от соединений по настоящему изобретению тем, что в WO 97/47601 центральная кольцевая структура является бициклической, а в соединениях по настоящему изобретению моноциклической, и что в WO 97/47601 центральная кольцевая структура не допускает наличия дополнительного аминоалкильного заместителя. Дополнительные антагонисты аденозиновых рецепторов необходимы в качестве фармакологических инструментов и представляют значительный интерес в качестве лекарств для лечения упомянутых ранее болезненных состояний и/или состояний. Краткое описание изобретения Настоящее изобретение относится к соединениям структуры где R1 представляет собой замещенный или незамещенный фенил, или 5-6-членное гетероциклическое или гетероароматическое кольцо, содержащее от 1 до 5 гетероатомов;R2 представляет собой водород, или замещенный или незамещенный алкильный, -С(О)-алкильный,-С(О)-О-алкильный, алкокси-, циклоалкильный, алкенильный, моноциклический или бициклический арильный, гетероарильный или гетероциклический радикал;R3 представляет собой водород, или замещенный или незамещенный алкильный, -С(О)-алкильный,-С(О)-О-алкильный, алкокси-, циклоалкильный, алкенильный, моноциклический или бициклический арильный, гетероарильный или гетероциклический радикал, или R2 и R3 объединены с образованием гетероциклического кольца; где пунктирная линия представляет собой вторую связь, которая может присутствовать или отсутствовать, и при ее наличии R3 представляет собой кислород;-2 007468 каждый R4 и R5 независимо представляет собой замещенный или незамещенный алкильный, -С(О)алкильный, -С(О)-О-алкильный, алкокси-, циклоалкильный, алкенильный, моноциклический или бициклический арильный, гетероарильный или гетероциклический радикал, илиR4, N и R5 вместе образуют замещенный или незамещенный, моноциклический или бициклический,гетероциклический или гетероарильный радикал, содержащий от 1 до 6 гетероатомов;n равно 0, 1, 2, 3 или 4,или их энантиомеру, или их конкретному таутомеру, или их фармацевтически приемлемой соли. Настоящее изобретение также относится к соединениям структуры где R10 представляет собой замещенный или незамещенный алкил, -С(O)-алкил, -С(O)-О-алкил, алкоксигруппу, циклоалкил, алкенил, или замещенный или незамещенный, моноциклический или бициклический арильный, гетероциклический или гетероарильный радикал, содержащий от 1 до 6 гетероатомов; иR11 представляет собой атом водорода или галогена. Настоящее изобретение дополнительно относится к соединениям структуры где R10 представляет собой замещенный или незамещенный алкил, -С(О)-алкил, -С(О)-О-алкил, алкоксигруппу, циклоалкил, алкенил, или замещенный или незамещенный, моноциклический или бициклический арильный, гетероциклический или гетероарильный радикал, содержащий от 1 до 6 гетероатомов;R11 представляет собой атом водорода или галогена; иR12 представляет собой водород, алкил, галоген или цианогруппу. Настоящее изобретение дополнительно относится к соединениям структурыR12 представляет собой водород, алкил, галоген или цианогруппу. Настоящее изобретение дополнительно относится к соединениям структуры где Rb представляет собой водород или метил. Настоящее изобретение дополнительно относится к соединениям структуры где Rc представляет собой атом галогена;R11 представляет собой атом водорода или галогена; иR12 представляет собой водород, алкил, галоген или цианогруппу. Настоящее изобретение также относится к способу применения соединения любой из структур IVIII для производства лекарственного средства, применимого для лечения ассоциированного с аденозиновым рецептором А 2b заболевания у больного, где ассоциированное с аденозиновым рецептором А 2b заболевание представляет собой астму, крапивницу, склеродермический артрит, инфаркт миокарда, постишемическую реперфузию миокарда, диабетическую ретинопатию, ретинопатию при недоношенности,сахарный диабет, диарею, воспалительное заболевание кишечника, пролиферирующую опухоль, или ассоциировано с дегрануляцией тучных клеток, расширением кровеносных сосудов, гипертензией, гиперчувствительностью или высвобождением медиаторов аллергии. Подробное описание изобретения Настоящее изобретение относится к соединениям структуры где R1 представляет собой замещенный или незамещенный фенил, или 5-6-членное гетероциклическое или гетероароматическое кольцо, содержащее от 1 до 5 гетероатомов;R2 представляет собой водород, или замещенный или незамещенный алкильный, -С(О)-алкильный,-С(О)-О-алкильный, алкокси-, циклоалкильный, алкенильный, моноциклический или бициклический арильный, гетероарильный или гетероциклический радикал;R3 представляет собой водород, или замещенный или незамещенный алкильный, -С(О)-алкильный,-С(О)-О-алкильный, алкокси-, циклоалкильный, алкенильный, моноциклический или бициклический арильный, гетероарильный или гетероциклический радикал, или R2 и R3 объединены с образованием гетероциклического кольца; где пунктирная линия представляет собой вторую связь, которая может присутствовать или отсутствовать, и, при ее наличии, R3 представляет собой кислород; каждый R4 и R5 независимо представляет собой замещенный или незамещенный алкильный, -С(О)алкильный, -С(О)-О-алкильный, алкокси-, циклоалкильный, алкенильный, моноциклический или бициклический арильный, гетероарильный или гетероциклический радикал, илиR4, N и R5 вместе образуют замещенный или незамещенный, моноциклический или бициклический,-4 007468 гетероциклический или гетероарильный радикал, содержащий от 1 до 6 гетероатомов;n равно 0, 1, 2, 3 или 4,или их энантиомеру, или их конкретному таутомеру, или их фармацевтически приемлемой соли. В одном воплощении структуры I R3 представляет собой водород, или замещенный или незамещенный алкил или арил. В другом воплощении структуры I любое гетероциклическое или гетероарильное кольцо, при наличии, представляет собой пиперазиновое, пиперидиновое, [1,4]диазепановое, пиразиновое, пиридиновое,пирролидиновое, пиразольное, пиримидиновое, тиофеновое, имидазольное, азетидиновое, пиррольное,бензотиазольное, бензодиоксолановое, дитиолановое, оксатииновое, имидазолидиновое, хинолиновое,изохинолиновое, дигидроизохинолиновое, индольное, изоиндольное, триазаспиро[4,5]декановое, морфолиновое, фурановое или изотиазольное кольцо. В другом воплощении настоящее изобретение относится к соединениям структуры где каждый R6 и R9 независимо представляет собой водород или алкил;R8 представляет собой замещенный или незамещенный арил, арилоксигруппу или алкиларил;X представляет собой С или N; где если X представляет собой N, R7 или R8 отсустствует; где если X представляет собой С, R7XR8 могут образовывать 3-8-членное карбоциклическое или гетероциклическое кольцо; иm равно 1 или 2. В одном воплощении структуры II R7 представляет собой водород, ОН или CN. В другом воплощении соединение выбирают из группы, состоящей изN-(6-[2-(ацетиламино)этил]амино-2-фенилпиримидин-4-ил)-2-(4-бензилпиперидин-1-ил)ацетамида. В другом воплощении соединение представляет собой N-[6-(2-ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-[4-(4-хлорфенил)-4-гидроксипиперидин-1-ил]ацетамид. В дополнительном воплощении настоящее изобретение относится к соединениям структуры где каждый R4 и R5 независимо представляет собой замещенный или незамещенный алкильный, -С(О)алкильный, -С(О)-О-алкильный, алкокси-, циклоалкильный, алкенильный, моноциклический или бициклический арильный, гетероарильный или гетероциклический радикал, илиR4, N и R5 вместе образуют замещенный или незамещенный, моноциклический или бициклический,гетероциклический или гетероарильный радикал, содержащий от 1 до 6 гетероатомов. В одном воплощении структуры III каждый R4 и R5 независимо представляет собой замещенный или незамещенный алкильный, -С(О)алкильный, -С(О)-О-алкильный, циклоалкильный, алкенильный, моноциклический или бициклический арильный, гетероарильный или гетероциклический радикал, илиR4, N и R5 вместе образуют замещенный или незамещенный, моноциклический или бициклический,гетероциклический или гетероарильный радикал, содержащий от 1 до 6 гетероатомов. В другом воплощении структуры III каждый R4 и R5 независимо представляет собой замещенный или незамещенный алкильный, -С(О)-алкильный, -С(О)-О-алкильный, циклоалкильный, алкенильный,моноциклический или бициклический арильный, гетероарильный или гетероциклический радикал. В другом воплощении каждый R4 и R5 независимо представляет собой замещенный или незамещенный алкил, -С(О)-алкильный, -С(О)-О-алкильный, циклоалкильный, алкенильный, моноциклический или бициклический арильный, гетероарильный или гетероциклический радикал. В другом воплощении любое гетероциклическое или гетероарильное кольцо, при наличии, представляет собой пиперазиновое, пиперидиновое, [1,4]диазепановое, пиразиновое, пиридиновое, пирролидиновое, пиразольное, пиримидиновое, тиофеновое, имидазольное, азетидиновое, пиррольное, бензотиазольное, бензодиоксолановое, дитиолановое, оксатииновое, имидазолидиновое, хинолиновое, изохинолиновое, дигидроизохинолиновое, индольное, изоиндольное, триазаспиро[4,5]декановое, морфолиновое,фурановое или изотиазольное кольцо. Настоящее изобретение также относится к соединениям структуры где R10 представляет собой замещенный или незамещенный алкил, -С(O)-алкил, -С(O)-О-алкил, алкоксигруппу, циклоалкил, алкенил, или замещенный или незамещенный, моноциклический или бициклический арильный, гетероциклический или гетероарильный радикал, содержащий от 1 до 6 гетероатомов; иR11 представляет собой атом водорода или галогена. В одном воплощении структуры IV R10 представляет собой замещенный или незамещенный алкил,-С(О)-алкил, -С(О)-О-алкил, циклоалкил, алкенил, или замещенный или незамещенный, моноциклический или бициклический арильный, гетероциклический или гетероарильный радикал, содержащий от 1 до 6 гетероатомов. В дополнительном воплощении R11 представляет собой водород. В дополнительном воплощении R11 представляет собой атом галогена. В дополнительном воплощении структуры IV любое гетероциклическое или гетероарильное кольцо, при наличии, представляет собой пиперазиновое, пиперидиновое, [1,4]диазепановое, пиразиновое,пиридиновое, пирролидиновое, пиразольное, пиримидиновое, тиофеновое, имидазольное, азетидиновое,пиррольное, бензотиазольное, бензодиоксолановое, дитиолановое, оксатииновое, имидазолидиновое,хинолиновое, изохинолиновое, дигидроизохинолиновое, индольное, изоиндольное, триазаспиро[4,5]декановое, морфолиновое, фурановое или изотиазольное кольцо. Настоящее изобретение также относится к соединениям структуры где R10 представляет собой замещенный или незамещенный алкил, -С(O)-алкил, -С(O)-О-алкил, алкоксигруппу, циклоалкил, алкенил, или замещенный или незамещенный, моноциклический или бициклический арильный, гетероциклический или гетероарильный радикал, содержащий от 1 до 6 гетероатомов;R11 представляет собой атом водорода или галогена; иR12 представляет собой водород, алкил, галоген или цианогруппу. В одном воплощении структуры V R10 представляет собой замещенный или незамещенный алкил,-С(О)-алкил, -С(О)-О-алкил, циклоалкил, алкенил, или замещенный или незамещенный, моноциклический или бициклический арильный, гетероциклический или гетероарильный радикал, содержащий от 1 до 6 гетероатомов, и R12 представляет собой водород или метил. В дополнительном воплощении R11 представляет собой водород. В дополнительном воплощении R12 представляет собой водород. В дополнительном воплощении R12 представляет собой метил. В дополнительном воплощении R11 представляет собой атом галогена. В дополнительном воплощении R12 представляет собой водород. В дополнительном воплощении R12 представляет собой метил. В дополнительном воплощении любое гетероциклическое или гетероарильное кольцо, при наличии,представляет собой пиперазиновое, пиперидиновое, [1,4]диазепановое, пиразиновое, пиридиновое, пирролидиновое, пиразольное, пиримидиновое, тиофеновое, имидазольное, азетидиновое, пиррольное, бензотиазольное, бензодиоксолановое, дитиолановое, оксатииновое, имидазолидиновое, хинолиновое, изохинолиновое, дигидроизохинолиновое, индольное, изоиндольное, триазаспиро[4,5]декановое, морфоли-7 007468 новое, фурановое или изотиазольное кольцо. Настоящее изобретение дополнительно относится к соединениям структурыR12 представляет собой водород, алкил, галоген или цианогруппу. В одном воплощении Ra представляет собой Сl. В другом воплощении Ra представляет собой Вr. Настоящее изобретение дополнительно относится к соединениям структуры где Rb представляет собой водород или метил. В одном воплощении Rb представляет собой водород. В другом воплощении Rb представляет собой метил. Настоящее изобретение дополнительно относится к соединениям структуры где Rc представляет собой атом галогена;R11 представляет собой атом водорода или галогена; иR12 представляет собой водород, алкил, галоген или цианогруппу. В одном воплощении Rc представляет собой Сl. В дополнительном воплощении R11 представляет собой водород. В другом воплощении R12 представляет собой водород. В другом воплощении R12 представляет собой метил. В другом воплощении R11 представляет собой Сl. В дополнительном воплощении R12 представляет собой водород. В другом воплощении R12 представляет собой метил. В дополнительном воплощении структуры IR1 представляет собой незамещенный фенил или фенил, замещенный Сl;R3 представляет собой водород или кислород;R4, N, R5 вместе образуют пиперидиновое кольцо, замещенное -O(С 6 Н 5), -O(С 6 Н 4 Сl), -O(С 6 Н 4[ОСН 3]),-(С 6 Н 5), -СН 2(С 6 Н 4[ОСН 3]), -CH2(C6H4F), -СН 2(С 6 Н 4 Сl), -(ОН)(СН 2)(С 6 Н 5), -(CN)(C6H5), -(CN)(С 6 Н 4 Сl); 3,5-диметилпиперазиновое кольцо, замещенное -CH2(C6H5); пиперазиновое кольцо, замещенное -СН 2(С 6 Н 5),-(С 6 Н 5), -СН 2(С 6 Н 4[ОСН 3]), -СН 2(С 6 Н 4 Сl), -CH2(C6H4F), -CH2(C6H4[CF3]), -CH2(C5H4N), -CH2(C6H11),-(СН 2)2(С 6 Н 5); или [1,4]диазепановое кольцо, замещенное -(С 6 Н 5), -(СН 2)2(С 6 Н 5), -СН 2(С 6 Н 5), -CH2(C6H4F),-CH2(C6H4[CF3]), -CH2(C5H4N), -СН 2(С 6 Н 4 Сl) или -СН 2(C5H3N[СН 3]) ; и-8 007468 Настоящее изобретение также относится к способу лечения ассоциированного с аденозиновым рецептором А 2b заболевания у нуждающегося в подобном лечении больного, который включает введение больному терапевтически эффективного количества соединений структуры I с целью лечения у больного ассоциированного с аденозиновым рецептором А 2b заболевания, где ассоциированное с аденозиновым рецептором А 2b заболевание представляет собой астму, крапивницу, склеродермический артрит, инфаркт миокарда, постишемическую реперфузию миокарда, диабетическую ретинопатию, ретинопатию при недоношенности, сахарный диабет, диарею, воспалительное заболевание кишечника, пролиферирующую опухоль, или ассоциировано с дегрануляцией тучных клеток, расширением кровеносных сосудов, гипертензией, гиперчувствительностью или высвобождением медиаторов аллергии. В одном воплощении ассоциированное с аденозиновым рецептором А 2b заболевание представляет собой сахарный диабет. В другом воплощении ассоциированное с аденозиновым рецептором А 2b заболевание представляет собой астму. В другом воплощении ассоциированное с аденозиновым рецептором А 2b заболевание ассоциировано с дегрануляцией тучных клеток. В другом воплощении ассоциированное с аденозиновым рецептором А 2b заболевание представляет собой пролиферирующую опухоль. Настоящее изобретение также относится к фармацевтической композиции, включающей соединение любой из структур I-V и фармацевтически приемлемый носитель. В одном воплощении фармацевтическую композицию составляют для перорального, местного, парентерального и назального введения. Настоящее изобретение также относится к способу производства фармацевтической композиции,включающему смешивание соединения любой из структур I-V с фармацевтически приемлемым носителем. Настоящее изобретение также относится к упаковке, включающей указанную выше фармацевтическую композицию и инструкции по применению фармацевтической композиции при лечении заболевания, ассоциированного с аденозиновым рецептором А 2b. Настоящее изобретение также относится к фармацевтически приемлемой соли структуры I, где соль представляет собой гидрохлорид. Настоящее изобретение также относится к способу производства соединения структуры VI, включающему этапы:(b) осуществления взаимодействия продукта этапа (а) с хлорирующим агентом с получением(с) осуществления взаимодействия продукта этапа (b) с аминирующим агентом в присуствии растворителя с получением(d) осуществления взаимодействия продукта этапа (с) с N-ацетилэтилендиамином с получением(е) осуществления взаимодействия продукта сR12 представляет собой водород, алкил, галоген или цианогруппу. В одном воплощении указанного выше способа восстановитель на этапе (а) представляет собойDMF, и основание представляет собой DBU. В другом воплощении хлорирующий агент на этапе (b) представляет собой РOСl3. В дополнительном воплощении аминирующий агент на этапе (с) представляет собой аммиак, и растворитель представляет собой ДМСО. В дополнительном воплощении основание представляет собой 2,6-лутидин, и растворитель представляет собой CH2Cl2/DMF. В дополнительном воплощении настоящее изобретение относится к соединению, полученному в соответствии с указанным выше способом. Настоящее изобретение также относится к способу производства соединения структуры II, включающему осуществление взаимодействия соединения структуры где каждый R6 и R9 независимо представляет собой водород или алкил;R8 представляет собой замещенный или незамещенный арил, арилоксигруппу или алкиларил;X представляет собой С или N; где, если X представляет собой N, R7 или R8 отсустствует; где, если X представляет собой С, R7, X и R8 могут образовывать 3-8-членное карбоциклическое или гетероциклическое кольцо; иm равно 1 или 2. Настоящее изобретение также относится к соединению, полученному в соответствии с указанным выше способом. Настоящее изобретение также относится к соединениям структуры где R13 представляет собой замещенный или незамещенный (C1-C4)алкил, алкил или (С 3-С 7)циклоалкил с разветвленной цепью, где заместитель представляет собой -ОН, -OR, -NH2, -NR18R19, -R20NOCR21, R22R23NCO-,карбоксил, карбамоил (-R20NOCNR22R23), карбамат (-R20NOCOR) или гетероциклическое кольцо; или замещенное или незамещенное арильное или гетероциклическое кольцо, где любой заместитель, при наличии, представляет собой ОН, OR, галеоген, NН 2 или NHR, где R представляет собой алкил, циклоалкил, арил, гетероарил, замещенный алкил, арил, арилалкил или гетероцикл;R14 представляет собой замещенный или незамещенный фенил, где заместитель, при наличии, представляет собой галоген, ОН, NH2, OR, NHR или 5-6-членное гетероциклическое кольцо;R16 представляет собой Н, или замещенный или незамещенный алкил или арил, или R15 и R16 объединены вместе с образованием гетероциклического кольца;R17 представляет собой Н, замещенный или незамещенный алкил, арил, арилалкил, гетероцикл, гетероциклический алкил, ОН, OR, NH2, NR18R19, R20NOCR21, R22R23NCO-, карбоксил, карбамоил (-R20NOCNR22R23),карбамат (-R20NOCOR) или (С 3-С 7)циклоалкил; каждый R18 и R19 независимо представляет собой водород, замещенный или незамещенный алкил или арил, или R18, N и R19 вместе образуют 4-8-членное гетероциклическое кольцо; каждый R20 и R21 независимо представляет собой замещенный или незамещенный алкильный,арильный или алкиларильный радикал; каждый R22 и R23 независимо представляет собой водород, замещенный или незамещенный алкил,арил или алкиларил, или R22, N и R23 вместе образуют 4-8-членное гетероциклическое кольцо; каждыйR24 и R25 независимо представляет собой водород, замещенный или незамещенный алкил, циклоалкил,арил, гетероцикл, или R24 и R25 вместе образуют 3-7-членную кольцевую систему, или диоксалановую или диоксановую кольцевую структуру; и р равно 0, 1 или 2. Настоящее изобретение также относится к применению соединения любой из структур I-VIII для производства лекарственного средства, применимого для лечения ассоциированного с аденозиновым рецептором А 2b заболевания у больного, где ассоциированное с аденозиновым рецептором А 2b заболевание представляет собой астму, крапивницу, склеродермический артрит, инфаркт миокарда, постишемическую реперфузию миокарда, диабетическую ретинопатию, ретинопатию при недоношенности, сахарный диабет, диарею, воспалительное заболевание кишечника, пролиферирующую опухоль, или ассоциировано с дегрануляцией тучных клеток, расширением кровеносных сосудов, гипертензией, гиперчувст- 11007468 вительностью или высвобождением медиаторов аллергии. В одном воплощении указанного выше применения ассоциированное с аденозиновым рецептором А 2b заболевание представляет собой сахарный диабет. В другом воплощении ассоциированное с аденозиновым рецептором А 2b заболевание представляет собой астму. В другом воплощении ассоциированное с аденозиновым рецептором А 2b заболевание ассоциировано с дегрануляцией тучных клеток. В другом воплощении ассоциированное с аденозиновым рецептором А 2b заболевание представляет собой пролиферирующую опухоль. Соединение любой из структур I-V или IX, где любой алкил представляет собой (C1-С 30)алкил или(С 3-С 30)алкил с разветвленной цепью, любой циклоалкил представляет собой (C1-С 30)циклоалкил, и любой заместитель, при наличии, выбирают из галогена, гидроксила, (C1-С 30)алкила с неразветвленной цепью, (С 3-С 30)алкила с разветвленной цепью, (C3-С 10)циклоалкила, (C1-С 30)алкилкарбонилоксигруппы с неразветвленной цепью, (C3-С 30)алкилкарбонилоксигруппы с разветвленной цепью, арилкарбонилоксигруппы, (C1-С 30)алкоксикарбонилоксигруппы с неразветвленной цепью, (С 3-С 30)алкоксикарбонилоксигруппы с разветвленной цепью, арилоксикарбонилоксигруппы, карбоксилата, (C1-С 30)алкилкарбонила с неразветвленной цепью, (С 3-С 30)алкилкарбонила с разветвленной цепью, (C1-С 30)алкоксикарбонила с неразветвленной цепью, (C3-С 30)алкоксикарбонила с разветвленной цепью, аминокарбонила, (C1-С 30)алкилтиокарбонила с неразветвленной цепью, (C3-С 30)алкилтиокарбонила с разветвленной цепью, (C1-С 30) алкоксила с неразветвленной цепью, (C1-С 30)алкоксила с разветвленной цепью, фосфата, фосфонатогруппы, цианогруппы, аминогруппы, (C1-С 30)алкиламиногруппы с неразветвленной цепью, (С 3-С 30)алкиламиногруппы с разветвленной цепью, (C1-С 30)диалкиламиногруппы с неразветвленной цепью, (С 3-С 30)диалкиламиногруппы с разветвленной цепью, ариламиногруппы, диариламиногруппы, (C1-С 30)алкилариламиногруппы с неразветвленной цепью, (C3-С 30)алкилариламиногруппы с разветвленной цепью, ациламиногруппы, (C1-С 30)алкилкарбониламиногруппы с неразветвленной цепью, (С 3-С 30)алкилкарбониламиногруппы с разветвленной цепью, арилкарбониламиногруппы, карбамоила, уреидогруппы, амидиногруппы,иминогруппы, сульфгидрила, (C1-С 30)алкилтиогруппы с неразветвленной цепью, (С 3-С 30)алкилтиогруппы с разветвленной цепью, арилтиогруппы, тиокарбоксилата, сульфатов, сульфонатогруппы, сульфамоила,сульфонамидогруппы, нитрогруппы, трифторметила, азидогруппы, 4-10-членного гетероциклила, (C1 С 30)алкиларила с неразветвленной цепью, (С 3-С 30)алкиларила с разветвленной цепью, или ароматического или 5-6-членного гетероароматического радикала,причем заместитель может быть дополнительно замещен любым из указанных выше заместителей. Настоящее изобретение также относится к соединениям структуры где R13 представляет собой алкил (1-4 атома углерода); алкил с разветвленной цепью, замещенный -ОН, -OR, -NH2, -NR18R19, -R20NOCR21, R22R23NCO-,карбоксилом, карбамоилом (-R20NOCNR22R23), карбаматом (-R20NOCOR), гетероциклом; циклоалкиломR17 представляет собой Н, алкил, алкил с разветвленной цепью, замещенный алкил, арил, замещенный арил, арилалкил, гетероцикл, гетероциклический алкил, ОН, OR, NH2, NR18R19, -R20NOCR21,R22R23NCO-, карбоксил, карбамоил (-R20NOCNR22R23), карбамат (-R20NOCOR), циклоалкил (3-7 членный); каждый R18 и R19 независимо представляет собой водород, замещенный или незамещенный алкил или арил, или R18NR19 вместе образуют 4-8-членное гетероциклическое кольцо; каждый R20 и R21 независимо представляет собой замещенный или незамещенный алкильный,арильный или алкиларильный радикал;- 12007468 каждый R22 и R23 независимо представляет собой водород, замещенный или незамещенный алкил,арил или алкиларил, или R22, N и R23 вместе образуют 4-8-членное гетероциклическое кольцо; каждый R24 и R25 независимо представляет собой водород, замещенный или незамещенный алкил,циклоалкил, арил, гетероцикл, или R24 и R25 вместе образуют 3-7-членную кольцевую систему, или диоксалановую или диоксановую кольцевую структуру; и р равно 0, 1 или 2. Настоящее изобретение также относится к конкретным соединениям, объединенным структурой III,таким как рассмотренные в примерах соединения 26.1-26.79. Настоящее изобретение также относится к конкретным соединениям, объединенным структурой IV,таким как рассмотренные в примерах соединения 29.1-29.146 и 34.1-34.155. Настоящее изобретение также относится к конкретным соединениям, объединенным структурой V,таким как рассмотренные в примерах соединения 36.1-36.141, 41.1-41.144 и 46.1-46.82. Настоящее изобретение также относится к конкретным соединениям, объединенным структурой VI,таким как рассмотренное в примерах соединение 6. Настоящее изобретение также относится к конкретным соединениям, объединенным структуройVII, таким как рассмотренные в примерах соединения 24 и 25. Настоящее изобретение также относится к конкретным соединениям, объединенным структуройVIII, таким как рассмотренные в примерах соединения 39 и 44. Подразумевается, что количество атомов углерода, представленное как "(C1-С 30)" или "(C3-С 30)", означает возрастающее целое число между 1 или 3 и 30, например 1, 2, 3, 4, 5 или 30. Настоящее изобретение относится к соединениям, которые избирательно связываются с аденозиновым рецептором А 2b, обеспечивая у больного лечение заболевания, ассоциированного с аденозиновым рецептором А 2b, путем введения больному терапевтически эффективного количества таких соединений. Подвергаемые лечению заболевания ассоциированы, например, с астмой, дегрануляцией тучных клеток,реперфузионным повреждением миокарда, аллергическими реакциями, включая без ограничения ринит,реакции, индуцированные ядовитым плющом, крапивницу, склеродермический артрит, аутоиммунными заболеваниями, воспалительными заболеваниями кишечника, гипертензией, инфарктом миокарда, постишемической реперфузией миокарда, активацией лимфоцитов, расширением кровеносных сосудов, ростом, нейрорефлекторными ответами в кишечнике человека, ангиогенезом в сетчатке, аберрантной реваскуляризацией, такой как диабетическая ретинопатия и неотинопатия при недоношенности, модуляцией кишечного тонуса и секреции, и передачей нервного импульса и нейросекрецией. Рецепторы А 2b также вовлечены в гиперчувствительность, сенную лихорадку, сывороточную болезнь, аллергический васкулит, атопический дерматит, дерматит, экзему, идиопатический фиброз легких,эозинофильный холицистит, хроническое воспаление дыхательных путей, гиперэозинофильные синдромы, эозинофильный гастроэнтерит, отек, эозинофильное поражение миокарда, сопровождающиеся эозинофилией приступы ангионевротического отека, язвенный колит, аллергический гранулематоз, карциноматоз, эозинофильную гранулему, семейный гистиоцитоз, опухоли, гипоксию сердца, ишемию головного мозга, диурез, почечную недостаточность, неврологическое нарушение, психическое расстройство, расстройство познавательной способности, ишемию миокарда, бронхостеноз, болезнь Крона, болезнь Грейвса, сахарный диабет, рассеянный склероз, анемию, псориаз, нарушения фертильности, системную красную волчанку, brain arteriole diameter, высвобождение медиаторов аллергии, склеродермию, инсульт,тотальную ишемию, нарушение центральной нервной системы, нарушение сердечно-сосудистой системы, почечное нарушение, воспалительное нарушение, нарушение желудочно-кишечного тракта, глазное нарушение, аллергическое нарушение, нарушение дыхания или иммунологическое нарушение. Настоящее изобретение дополнительно относится к способам лечения ассоциированных с А 2b нарушений у млекопитающего путем введения млекопитающему такого терапевтически эффективного количества соединений по настоящему изобретению, при котором у млекопитающего происходит лечение нарушения. Настоящее изобретение также относится к упакованным фармацевтическим композициям для лечения ассоциированных с А 2b нарушений. Упакованная фармацевтическая композиция включает контейнер с терапевтически эффективным количеством, по крайней мере, одного из соединений по настоящему изобретению и инструкции по применению упомянутых соединений для лечения ассоциированного с А 2b заболевания. В благоприятном случае соединения по настоящему изобретению могут представлять собой избирательные антагонисты рецептора А 2b. В особенно предпочтительном воплощении соединение представляет собой растворимое в воде пролекарство, которое способно к преобразованию в активное лекарство в ходе обмена веществ in vivo,например, путем катализируемого эстеразой гидролиза. Еще в одном воплощении настоящее изобретение относится к способу ингибирования активности аденозинового рецептора (например, А 2b) в клетке путем обработки клетки соединением по настоящему изобретению (например, предпочтительно, антагонистом аденозинового рецептора). Настоящее изобретение также относится к фармацевтической композиции, включающей соедине- 13007468 ние по настоящему изобретению. Предпочтительно, фармацевтический препарат представляет собой состав для применения в офтальмологии (например, состав для периокулярной, ретробульбарной или внутриглазной инъекции, состав для системного применения, или раствор для орошения при операции). Настоящее изобретение относится к способам лечения ассоциированного с А 2b нарушения у млекопитающего. Способы включают введение млекопитающему такого терапевтически эффективного количества описанных ниже соединений по настоящему изобретению, что у млекопитающего происходит лечение ассоциированного с А 2b нарушения. Выражение "лечение ассоциированного с А 2b нарушения" относится к лечению, которое включает значительное ослабление, по крайней мере, одного симптома или эффекта нарушения, достигаемое посредством применения соединения по настоящему изобретению. Обычно такие нарушения ассоциированы с таким увеличением аденозина в организме, при котором организм часто испытывает физиологические симптомы, включающие без ограничения крапивницу, склеродермический артрит, аллергический ринит, астму, воспалительные заболевания кишечника, гипертензию, диабетическую ретинопатию и ретинопатию при недоношенности. (Смотри, например, С.Е. Muller and В. Stein "Adenosine Receptor Antagonists: Structures and Potential Therapeutic Applications", Current Pharmaceutical Design, 2: 501 (1996) иC.E. Muller "A1-Adenosine Receptor Antagonists", Exp. Opin. Ther. Patents 7 (5): 419 (1997) и I. Feoktistove,R. Polosa, S.T. Holgate and I. Biaggioni "Adenosine A2B receptors: a novel therapeutic target in asthma" TiPS 19; 148 (1998. Эффекты, обычно ассоциируемые с такими симптомами, включают без ограничения жар,учащение дыхания, тошноту, диарею, слабость, головную боль, и даже смерть. В одном воплощении нарушение включает те болезненные состояния, которые опосредованы стимуляцией таких аденозиновых рецепторов, например, A1, А 2 а, А 2b, А 3, и так далее, при которых происходит модуляция содержания кальция в клетках и/или активации PLC (фосфолипазы С). В предпочтительном воплощении нарушение ассоциировано с аденозиновым рецептором (рецепторами), например соединение по настоящему изобретению действует в качестве его антагониста. Примеры подходящих восприимчивых состояний, которые могут подвергаться лечению соединениями по настоящему изобретению, например, подтипы аденозиновых рецепторов, которые опосредуют биологические эффекты, включают эффекты на центральную нервную систему (ЦНС), эффекты на сердечно-сосудистую систему, эффекты на почки, эффекты на дыхательную систему, иммунологические эффекты, эффекты на желудочно-кишечный тракт и метаболические эффекты. Соответственное количество аденозина у больного может быть ассоциировано с перечисленными ниже эффектами; то есть повышенное содержание аденозина может инициировать эффект, например, нежелательный физиологический ответ, например, приступ астмы. Влияние на иммунную систему включает дегрануляцию тучных клеток (А 2b-опосредованную). Терапевтические применения антагонистов включают аллергическое и неаллергическое воспаление, например, высвобождение гистамина и других медиаторов воспаления. Влияние на желудочно-кишечный тракт включает заболевание толстого кишечника и тонкого кишечника и диарею, например диарею, ассоциированную с воспалением тонкого кишечника (А 2bопосредованным). Подразумевается, что термин "болезненное состояние" включает в себя те состояния, которые обусловлены или ассоциированы с нежелательным содержанием аденозина, активностью аденилилциклазы,повышенной физиологической активностью, ассоциированной с аберрантной стимуляцией и/или увеличением содержания цАМФ. В одном воплощении болезненное состояние представляет собой, например,астму, хроническое обструктивное заболевание легких, аллергический ринит, бронхит, почечные нарушения, нарушения желудочно-кишечного тракта или глазные нарушения. Дополнительные примеры включают хронический бронхит и муковисцидоз. Подходящие примеры воспалительных заболеваний включают нелимфоцитарный лейкоз, ишемию миокарда, ангину, инфаркт, ишемию сосудов головного мозга, перемежающуюся хромоту, критическую ишемию конечностей, венозную гипертензию, варикозное расширение вен, венозные изъязвления и артериосклероз. Состояния ослабленной реперфузии включают, например, любую травму после хирургического вмешательства, такого как восстановительная хирургия, растворение тромба и ангиопластика. Настоящее изобретение также относится к сочетанной терапии глаукомы, включающей применение одного из соединений по настоящему изобретению и агониста простагландина, агониста 2-рецептора или антагониста мускаринового рецептора. Подразумевается, что выражение "лечение ассоциированного с А 2b нарушения" или "лечение ассоциированного с А 2b заболевания" включает в себя такие описанные выше изменения в болезненном состоянии или состоянии, при которых физиологические симптомы у млекопитающего могут быть в значительной степени ослаблены или минимизированы. Выражение также включает регуляцию, предупреждение или ингибирование физиологических симптомов или эффектов, ассоциированных с аберрантным содержанием аденозина. В одном предпочтительном воплощении регуляция болезненного состояния или состояния является такой, что болезненное состояние или состояние устраняется. В другом предпочтительном воплощении регуляция является настолько избирательной, что аберрантная активность аденозинового рецептора регулируется, в то время как на другие физиологические системы и параметры влияния не оказывается.- 14007468 Выражение "терапевтически эффективное количество" в отношении описанных ниже соединений по настоящему изобретению относится к такому количеству терапевтического соединения, которое является необходимым или достаточным для выполнения предназначенной для него функции в организме млекопитающего, например, для лечения ассоциированного с А 2b нарушения или заболевания у млекопитающего. Эффективное количество терапевтического соединения может варьировать в зависимости от ряда факторов, таких как количество уже находящегося в организме млекопитающего болезнетворного агента, возраста, пола и веса млекопитающего, и способности терапевтических соединений по настоящему изобретению воздействовать на ассоциированное с А 2b нарушение у млекопитающего. Средний специалист в данной области техники должен быть способен оценить вышеупомянутые факторы и определить эффективное количество терапевтического соединения без постановки дополнительных экспериментов. Для определения "эффективного количества" описанных ниже терапевтических соединений могут применяться методы анализа in vitro и in vivo. Средний специалист в данной области техники может подобрать подходящее количество терапевтического соединения для применения в вышеупомянутом методе анализа или для терапевтического лечения. Терапевтически эффективное количество предпочтительно ослабляет по крайней мере один симптом или эффект, ассоциированный с подвергаемым лечению ассоциированным с А 2b нарушением по крайней мере на 20% (более предпочтительно по крайней мере приблизительно на 40%, еще более предпочтительно по крайней мере приблизительно на 60%, и еще более предпочтительно по крайней мере приблизительно на 80%) относительно не подвергаемых лечению больных. Для оценки ослабления подобных симптомов и/или эффектов специалистом в данной области техники могут быть разработаны различные методы анализа. Подразумевается, что любой известный из уровня техники метод анализа,способный измерить такие параметры, включен как часть в настоящее изобретение. Например, если подвергаемым лечению состоянием является астма, то у больного при помощи известной из уровня техники методики может быть измерен объем выдыхаемого из легких воздуха до и после лечения с целью оценки увеличения этого объема. Более того, если подвергаемым лечению состоянием является воспаление, то при помощи известной из уровня техники методики может быть измерена область воспаления до и после лечения с целью оценки ее уменьшения. Термин "клетка" включает и прокариотические, и эукариотические клетки. Термин "животное" включает любой организм, имеющий аденозиновые рецепторы. Примеры животных включают дрожжи, млекопитающих, пресмыкающихся и птиц. Указанный термин также включает трансгенных животных. Подразумевается, что известный из уровня техники термин "млекопитающее" включает в себя любое животное, более предпочтительно теплокровное животное, наиболее предпочтительно крупный рогатый скот, овец, свиней, лошадей, собак, кошек, крыс, мышей и людей. Млекопитающие, чувствительные к ассоциированному с А 2b нарушениями восприимчивому состоянию, воспалению, эмфиземе, астме,состоянию центральной нервной системы или острому респираторному дистресс-синдрому, включены как часть настоящего изобретения. В другом аспекте настоящее изобретение относится к способам модуляции аденозинового рецептора (рецепторов) у млекопитающего путем введения млекопитающему такого терапевтически эффективного количества соединений по настоящему изобретению, что у млекопитающего происходит модуляция аденозинового рецептора. Подходящие аденозиновые рецепторы включают семейства A1, A2 или А 3. В предпочтительном воплощении соединение представляет собой антагонист аденозинового рецептора. Подразумевается, что выражение "модуляция аденозинового рецептора" включают в себя те отдельные случаи, при которых соединение взаимодействует с аденозиновым рецептором (рецепторами),вызывая повышенную, пониженную или анормальную физиологическую активность, ассоциированную с аденозиновым рецептором, или каскад эффектов, являющийся результатом модуляции аденозинового рецептора. Виды физиологической активности, ассоциированные с аденозиновыми рецепторами, включают индукцию седативного эффекта, расширение кровеносных сосудов, уменьшение частоты сердечных сокращений и сократительной способности сердца, ингибирование способности тромбоцитов к агрегации, стимуляцию глюконеогенеза, ингибирование расщепления жира, открытие калиевых каналов,уменьшение тока через кальциевые каналы, и так далее. Подразумевается, что термины "модулировать", "модулирующий" и "модуляция" включают в себя предупреждение, устранение или ингибирование полученной нежелательной физиологической активности, ассоциированной с анормальной стимуляцией аденозинового рецептора, например, в контексте терапевтических способов по настоящему изобретению. В другом воплощении термин "модулировать" включает антагонистические эффекты, например, ослабление активности или продукции медиаторов аллергии и аллергического воспаления, которое является результатом чрезмерной стимуляции аденозинового рецептора (рецепторов). Например, применяемые в терапии деазапурины по настоящему изобретению могут взаимодействовать с аденозиновым рецептором с ингибированием, например, аденилатциклазной активности. Подразумевается, что выражение "состояние, характеризуемое аберрантной активностью аденозинового рецептора" включает в себя те заболевания, нарушения или состояния, ассоциированные с абер- 15007468 рантной стимуляцией аденозинового рецептора, при которых стимуляция рецептора вызывает биохимическую и/или физиологическую цепь событий, которая прямо или опосредованно ассоциирована с заболеванием, нарушением или состоянием. Такая стимуляция аденозинового рецептора необязательно должна являться единственной причиной заболевания, нарушения или состояния, и может быть ответственной лишь за некоторые симптомы, обычно ассоциируемые с подвергаемым лечению заболеванием,нарушением или состоянием. Аберрантная стимуляция рецептора может являться единственным фактором, или в подвергаемое лечению состояние может быть вовлечен по крайней мере один другой агент. Примеры состояний включают такие перечисленные выше болезненные состояния и такие симптомы,которые проявляются при повышенной активности аденозинового рецептора. Подразумевается, что выражение "процесс лечения или лечение состояния, характеризуемого аберрантной активностью аденозинового рецептора" включает в себя смягчение или ослабление по крайней мере одного симптома, обычно ассоциируемого с состоянием. Лечение также включает смягчение или ослабление более чем одного симптома. Предпочтительно лечение приводит к излечению, например, по существу, устраняет ассоциированные с состоянием симптомы. Настоящее изобретение также относится к способу ингибирования активности аденозинового рецептора (например, аденозинового рецептора А 2b) в клетке путем обработки клетки соединением по настоящему изобретению. Предпочтительно соединение является антагонистом рецептора. В другом воплощении настоящее изобретение относится к фармацевтической композиции, содержащей соединение по настоящему изобретению и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу лечения ассоциированного с А 2b заболевания у млекопитающего путем введения млекопитающему такого терапевтически эффективного количества соединения по настоящему изобретению, при котором происходит лечение ассоциированного с А 2b нарушения. В благоприятном случае болезненное состояние может представлять собой опосредованное аденозином нарушение. Примеры предпочтительных болезненных состояний включают: нарушения центральной нервной системы, нарушения сердечно-сосудистой системы, почечные нарушения, воспалительные нарушения, аллергические нарушения, нарушения желудочно-кишечного тракта, глазные нарушения и нарушения дыхательной системы. Термин "алкил" относится к радикалу насыщенных алифатических групп, включая алкильные группы с неразветвленной цепью, алкильные группы с разветвленной цепью, циклоалкильные (алициклические) группы, замещенные алкилом циклоалкильные группы и замещенные циклоалкилом алкильные группы. В предпочтительных воплощениях алкил с неразветвленной или разветвленной цепью содержит 30 или менее атомов углерода в своем остове (например, C1-С 30 для неразветвленной цепи, С 3-С 30 для разветвленной цепи), и более предпочтительно 20 или менее. Более того, предпочтительные циклоалкилы содержат 4-10 атомов углерода в своей кольцевой структуре, и более предпочтительно 5, 6 или 7 атомов углерода в кольцевой структуре. Термин "замещенные алкилы" относится к алкильным радикалам, содержащим заместители, замещающие один или несколько атомов углерода. Такие заместители могут включать, например, галоген,гидроксил, алкилкарбонилоксигруппу, арилкарбонилоксигруппу, алкоксикарбонилоксигруппу, арилоксикарбонилоксигруппу, карбоксилат, алкилкарбонил, алкоксикарбонил, аминокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонатогруппу, фосфинатогруппу, цианогруппу , аминогруппу (включая алкиламиногруппу, диалкиламиногруппу, ариламиногруппу, диариламиногруппу и алкилариламиногруппу),ациламиногруппу (включая алкилкарбониламиногруппу, арилкарбониламиногруппу, карбамоил и уреидогруппу), амидиногруппу, иминогруппу, сульфгидрил, алкилтиогруппу, арилтиогруппу, тиокарбоксилат, сульфаты, сульфонатогруппу, сульфамоил, сульфонамидогруппу, нитрогруппу, трифторметил, азидогруппу, гетероциклил, алкиларил, или ароматический или гетероароматический радикал. Специалисту в данной области техники следует понимать, что замещающие радикалы в углеводородной цепи сами могут быть подходящим образом замещены. Циклоалкилы могут быть дополнительно замещены, например, описанными выше заместителями. "Алкиларильный" радикал представляет собой алкил, замещенный арилом (например, фенилметилбензил). Термин "алкил" также включает ненасыщенные алифатические группы, аналогичные по своей длине и возможному замещению с описанными выше алкилами, но содержащие, по крайней мере, одну двойную или тройную связь, соответственно. Используемый в этом документе термин "арил" относится к радикалу арильных групп, включая 5- и 6-членные однокольцевые ароматические группы, которые могут содержать от 0 до 4 гетероатомов, например бензол, пиррол, фуран, тиофен, имидазол, бензоксазол, бензотиазол, триазол, тетразол, пиразол,пиридин, пиразин, пиридазин и пиримидин, и тому подобное. Арильные группы также включают полициклические конденсированные ароматические группы, такие как нафтинил, хинолинил, индолил, и тому подобное. Такие арильные группы, содержащие гетероатомы в кольцевой структуре, могут также называться "арильными гетероциклами", "гетероарилами" или "гетероароматическими соединениями". Ароматическое кольцо может быть замещено в одном или нескольких положениях описанными выше заместителями, например галогеном, гидроксилом, алкоксигруппой, алкилкарбонилоксигруппой, арилкарбонилоксигруппой, алкоксикарбонилоксигруппой, арилоксикарбонилоксигруппой, карбоксилатом,алкилкарбонилом, алкоксикарбонилом, аминокарбонилом, алкилтиокарбонилом, фосфатом, фосфонато- 16007468 группой, фосфинатогруппой, цианогруппой, аминогруппой (включая алкиламиногруппу, диалкиламиногруппу, ариламиногруппу, диариламиногруппу и алкилариламиногруппу), ациламиногруппой (включая алкилкарбониламиногруппу, арилкарбониламиногруппу, карбамоил и уреидогруппу), амидиногруппой,иминогруппой, сульфгидрилом, алкилтиогруппой, арилтиогруппой, тиокарбоксилатом, сульфатами,сульфонатогруппой, сульфамоилом, сульфонамидогруппой, нитрогруппой, трифторметилом, цианогруппой, азидогруппой, гетероциклилом, алкиларилом, или ароматическим или гетероароматическим радикалом. Арильные группы также могут быть конденсированы или соединены мостиковой связью с не являющимися ароматическими алициклическими или гетероциклическими кольцами, образуя тем самым полицикл (например, тетралин). Термины "алкенил" и "алкинил" относится к ненасыщенным алифатическим группам, аналогичным по своей длине и возможному замещению с описанными выше алкилами, но содержащим, по крайней мере, одну двойную или тройную связь, соответственно. Например, настоящее изобретение предусматривает цианогруппу и пропаргил. Если количество атомов углерода не определено иначе, используемый в этом документе термин низший алкил означает определенную выше алкильную группу, но содержащую от 1 до 10 атомов углерода, более предпочтительно от 1 до 6 атомов углерода в своем остове, еще более предпочтительно от 1 до 3 атомов углерода в своем остове. Более того, "низший алкенил" и "низший алкинил" имеют сходную длину цепи. Термины "алкоксиалкил", "полиаминоалкил" и "тиоалкоксиалкил" относятся к описанным выше алкильным группам, которые дополнительно содержат атомы кислорода, азота или серы, замещающие один или несколько атомов углерода в углеводородном остове, например атомы кислорода, азота или серы. Термины "полициклил" или "полициклический радикал" относятся к радикалу, состоящему из двух или более циклических колец (например, радикалу циклоалкилов, циклоалкенилов, циклоалкенилов,арилов и/или гетероциклилов), в котором два или более атомов являются общими для двух прилегающих колец, например, кольца представляют собой "конденсированные кольца". Кольца, которые объединены через неприлегающие атомы, обозначают как "соединенные мостиковой связью" кольца. Каждое из колец полицикла может быть замещено описанными выше заместителями, например, галогеном, гидроксилом, алкилкарбонилоксигруппой, арилкарбонилоксигруппой, алкоксикарбонилоксигруппой, арилоксикарбонилоксигруппой, карбоксилатом, алкилкарбонилом, алкоксикарбонилом, аминокарбонилом, алкилтиокарбонилом, алкоксилом, фосфатом, фосфонатогруппой, фосфинатогруппой, цианогруппой, аминогруппой (включая алкиламиногруппу, диалкиламиногруппу, ариламиногруппу, диариламиногруппу и алкилариламиногруппу), ациламиногруппой (включая алкилкарбониламиногруппу, арилкарбониламиногруппу, карбамоил и уреидогруппу), амидиногруппой, иминогруппой, сульфгидрилом, алкилтиогруппой,арилтиогруппой, тиокарбоксилатом, сульфатами, сульфонатогруппой, сульфамоилом, сульфонамидогруппой, нитрогруппой, трифторметилом, азидогруппой, гетероциклилом, алкиларилом, или ароматическим или гетероароматическим радикалом. Используемый в этом документе термин "гетероатом" означает атом или другой элемент, отличный от атома углерода или водорода. Предпочтительные гетероатомы представляют собой атомы азота, кислорода, серы и фосфора. Подразумевается, что используемый в этом документе термин "гетероцикл" или "гетероциклическая система" обозначает стабильное 5, 6 или 7-членное моноциклическое или 7-, 8-, 9-, 10- или 11 членное бициклическое гетероциклическое кольцо, которое является насыщенным или частично ненасыщенным. Термины "карбоциклический" или "гетероциклический" дополнительно включают спиросоединения, которые означают бициклическое соединение, в котором два кольца имеют один общий атом, и этот атом может являться атомом углерода или гетероатомом. Термин "аминокислоты" включает встречающиеся и не встречающиеся в природе обнаруженные в белках аминокислоты, такие как глицин, аланин, валин, цистеин, лейцин, изолейцин, серин, треонин,метионин, глутаминовую кислоту, аспарагиновую кислоту, глутамин, аспарагин, лизин, аргинин, пролин,гистидин, фенилаланин, тирозин и триптофан. Аналоги аминокислот включают аминокислоты с удлиненными или укороченными боковыми цепями, или различными боковыми цепями с подходящими функциональными группами. Аминокислоты также включают D- и L-стереоизомеры аминокислоты, если строение аминокислоты допускает существование стереоизомерных форм. Термин "дипептид" включает две или более аминокислоты, связанные вместе. Предпочтительно дипептиды представляют собой две аминокислоты, связанные через пептидную связь. Особенно предпочтительные дипептиды включают,например, аланин-аланин и глицин-аланин. Следует отметить, что строение некоторых соединений по настоящему изобретению включает асимметричные атомы углерода, а потому наблюдается образование рацематов и рацемических смесей,одиночных энантиомеров, диастереомерных смесей и индивидуальных диастереоизомеров. Все подобные изомерные формы этих соединений специально включены в настоящее изобретение. Каждый атом углерода, способный образовывать стереоизомеры, может иметь R- или S-конфигурацию. Соответственно следует понимать, что изомеры, являющиеся результатом такой асимметрии (например, все энантио- 17007468 меры и диастереоизомеры), включены в объем настоящего изобретения, если не определено иначе. Такие изомеры могут быть получены, по существу, в чистой форме путем классических методик разделения и путем стереохимически контролируемого синтеза. Настоящее изобретение дополнительно относится к фармацевтическим композициям для лечения ассоциированных с А 2b нарушений у млекопитающего. Фармацевтическая композиция включает терапевтически эффективное количество соединения по настоящему изобретению и фармацевтически приемлемый растворитель. Следует понимать, что все описанные ниже соединения предназначены для терапевтического применения. Дополнительно следует понимать, что соединения по настоящему изобретению могут применяться по отдельности или в комбинации с другими соединениями по настоящему изобретению или в комбинации с другими применяемыми в терапии соединениями, такими как, например,антибиотики, противовоспалительные средства или противораковые средства. Подразумевается, что известный из уровня техники термин "антибиотик" включает в себя те продуцируемые растущими организмами вещества и их синтетические производные, которые устраняют или ингибируют рост болезнетворных организмов и обладают избирательной токсичностью в отношении болезнетворного организма, оказывая при этом минимально вредные эффекты в отношении инфицированного организма или не обладая ими. Подходящие примеры антибиотиков включают без ограничения химические классы аминогликозидов, цефалоспоринов, хлорамфениколов, фусцидиновых кислот, макролидов, пенициллинов, полимиксинов, тетрациклинов и стрептомицинов. Подразумевается, что известный из уровня техники термин "противовоспалительный" включает в себя те средства, которые воздействуют на механизмы организма без прямого антагонистического действия в отношении вызывающего воспаления агента, такие как глюкокортикоиды, аспирин, ибупрофен,нестероидные противовоспалительные препараты, и так далее. Подразумевается, что известный из уровня техники термин "противораковое средство" включает в себя те средства, которые ослабляют, устраняют или предупреждают рост опухолевых клеток, предпочтительно без побочного нарушения других физиологических функций. Характерные примеры включают цисплатин и циклофосфамид. Подразумевается, что используемый в этом документе термин "злокачественная опухоль" означает злокачественное клеточное образование, отличительная черта которого - утрата нормальной регуляции приводит к нерегулируемому росту, утрате способности к дифференцировке, и способности поражать местные ткани и метастазировать. Злокачественный характер клеток обычно определяется по наличию опухоли. Поражение местных тканей может являться результатом местного давления опухоли на нормальные ткани, что приводит к воспалению, или опухоль может вырабатывать вещества, которые приводят к ферментативной деструкции. Если соединения по настоящему изобретению вводят людям и млекопитающим в виде фармацевтических препаратов, они могут даваться per se или в виде фармацевтической композиции, содержащей,например, от 0,1 до 99,5% (более предпочтительно, от 0,5 до 90%) активного ингредиента в комбинации с фармацевтически приемлемым носителем. Используемое в этом документе выражение "фармацевтически приемлемый носитель" означает фармацевтически приемлемый материал, композицию или носитель, такой как жидкий или твердый наполнитель, разбавитель, наполнитель, растворитель или материал для заключения в капсулу, который участвует в доставке или транспортировке соединения (соединений) по настоящему изобретению внутри организма или к нему, выполняя, таким образом, предназначенную для него функцию. Обычно такие соединения доставляются или транспортируются от одного органа или части тела к другому органу или части тела. Каждый носитель должен быть "приемлемым" в смысле совместимости с другими ингредиентами состава и не являться вредным для организма. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; измельченный трагакант; солод; желатин; тальк; наполнители, такие как масло какао и воски для суппозиториев; масла,такие как арахисовое масло, хлопковое масло, саффлоровое масло, кунжутное масло, оливковое масло,кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; многоатомные спирты, такие как глицерин, сорбит, маннит и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; забуферивающие средства, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический солевой раствор; раствор Рингера; этиловый спирт; фосфатные буферные растворы; и другие совместимые нетоксичные вещества, применяемые в фармацевтических составах. Как представлено выше в конкретных воплощениях настоящего изобретения, соединения могут содержать основную функциональную группу, такую как аминогруппу или алкиламиногруппу, и потому способны образовывать фармацевтически приемлемые соли с фармацевтически приемлемыми кислотами. В этом смысле термин "фармацевтически приемлемые соли" относится к относительно нетоксичным солям добавления неорганических и органических кислот соединений по настоящему изобретений. Эти соли могут быть получены in situ во время окончательного выделения и очистки соединений по настоящему изобретений, или путем отдельного осуществления взаимодействия очищенного соединения по- 18007468 настоящему изобретению в его свободной основной форме с подходящей органической или неорганической кислотой и выделения полученной таким образом соли. Типичные примеры солей включают гидробромиды, гидрохлориды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, валераты, олеаты, пальмитаты, стеараты, лаураты, бензоаты, лактаты, фосфаты, тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты, нафтилаты, мезилаты, глюкогептонаты, лактобионаты и лаурилсульфонаты, и тому подобное. (Смотри, например, Berge et al. (1977) "Pharmaceutical Salts", J. Pharm. Sci. 66: 1-19). В других случаях соединения по настоящему изобретению могут содержать одну или несколько кислотных функциональных групп, и потому способны образовывать фармацевтически приемлемые соли с фармацевтически приемлемыми основаниями. В этом смысле термин "фармацевтически приемлемые соли" относится к относительно нетоксичным солям добавления неорганических и органических оснований соединений по настоящему изобретений. Эти соли могут быть также получены in situ во время окончательного выделения и очистки соединений, или путем отдельного осуществления взаимодействия очищенного соединения по настоящему изобретению в его свободной кислотной форме с подходящим основанием, таким как гидроксид, карбонат или бикарбонат фармацевтически приемлемого катиона металла, с аммиаком, или с фармацевтически приемлемым первичным, вторичным или третичным органическим амином. Типичные примеры солей щелочных или щелочно-земельных металлов включают соли лития, натрия, калия, кальция, магния и алюминия, и тому подобное. Типичные примеры органических аминов, применимых для образования солей добавления оснований, включают этиламин, диэтиламин,этилендиамин, этаноламин, диэтаноламин, пиперазин, и тому подобное. Термин "фармацевтически приемлемые сложные эфиры" относится к относительно нетоксичным продуктам эстерификации соединений по настоящему изобретению. Такие сложные эфиры могут быть получены in situ во время окончательного выделения и очистки соединений, или путем отдельного осуществления взаимодействия очищенного соединения в его свободной кислотной форме или гидроксила,с подходящим эстерифицирующим агентом. Карбоновые кислоты могут быть преобразованы в сложные эфиры путем обработки спиртом в присутствии катализатора. Производные, содержащие гидроксил, могут быть преобразованы в сложные эфиры путем обработки эстерифицирующим агентом, таким как алканоилгалогениды. Дополнительно подразумевается, что термин включает в себя низшие углеводородные группы, способные сольватироваться в физиологических условиях, например, алкильные сложные эфиры, метиловый, этиловый и пропиловый сложные эфиры. (Смотри, например, цитируемую выше работу Berge et al.). Настоящее изобретение также предполагает применение пролекарств, которые превращаются invivo в терапевтические соединения по настоящему изобретению (смотри, например, R.B. Silverman, 1992,"The Organic Chemistry of Drug Design and Drug Action", Academic Press, Chapter 8). Такие пролекарства могут применяться для изменения биораспределения (например, позволяют применять соединения, которые обычно не достигают активного центра протеазы) или фармакокинетики терапевтического соединения. Например, группа карбоновой кислоты может быть эстерифицирована, например, метильной группой или этильной группой с получением сложного эфира. Когда сложный эфир вводят больному, он разрушается, ферментативно или неферментативно, восстановительно или гидролитически, с открытием анионной группы. Анионная группа может быть эстерифицирована радикалами (например, ацилоксиметиловыми сложными эфирами), которые при расщеплении открывают промежуточное соединение, которое впоследствии разрушается с получением активного соединения. В другом воплощении пролекарство представляет собой восстановленную форму сульфата или сульфоната, например, тиол, который окисляется in vivo до терапевтического соединения. Более того, анионный радикал может быть эстерифицирован до группы, которая активно транспортируется in vivo или которая избирательно потребляется органами-мишенями. Сложный эфир может быть отобран для проведения специфического мечения терапевтическим радикалом конкретных сайтов реакции, как описано ниже для радикалов носителя. Соединения по настоящему изобретению могут включать растворимые в воде пролекарства, которые описаны в заявке на выдачу патента WO 99/33815, заявке на выдачу международного патентаPCT/US98/04595, поданной 9 марта 1998 года и опубликованной 8 июля 1999 года. Полное содержание заявки WO 99/33815 специально включено в этот документ в виде ссылки. Растворимые в воде пролекарства преобразовываются в ходе метаболизма in vivo в активное лекарство, например, посредством катализируемого эстеразой гидролиза. В композициях также могут содержаться смачивающие вещества, эмульгаторы и смазки, такие как лаурилсульфат натрия и стеарат магния, а также красители, антиадгезивные агенты, образующие покрытие агенты, подслащивающие агенты, корригенты и отдушки, консерванты и антиоксиданты. Примеры фармацевтически приемлемых антиоксидантов включают: водорастворимые антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфит натрия, сульфит натрия, и тому подобное; жирорастворимые антиоксиданты, такие как аскорбилпальмитат,бутилированный гидроксианизол (ВНА), бутилированный гидроскитолуол (ВНТ), лецитин, пропилгаллат, -токоферол, и тому подобное; и средства-хелаторы металлов, такие как лимонная кислота, этилендиаминтетрауксусная кислота (EDTA), сорбит, винная кислота, фосфорная кислота, и тому подобное. Составы по настоящему изобретению включают составы для перорального, назального, местного,- 19007468 чрескожного, трансбуккального, подъязычного, ректального, вагинального и/или парентерального введения. Составы могут быть подходящим образом представлены в виде единичных дозированных форм и могут быть приготовлены в соответствии с любыми способами, известными в фармацевтике. Количество активного ингредиента, которое может быть объединено с материалоносителем для получения разовых дозированных форм, обычно представляет собой количество соединения, оказывающее терапевтический эффект. Как правило, почти в 100% случаев, это количество активного ингредиента находится в диапазоне приблизительно от 1 приблизительно до 99%, предпочтительно приблизительно от 5 приблизительно до 70%, более предпочтительно приблизительно от 10 приблизительно до 30%. Способы приготовления данных составов или композиций включают этап приведения соединения по настоящему изобретению в контакт с носителем и, необязательно, одним или несколькими вспомогательными ингредиентами. В общем, составы получают путем однообразного и однородного приведения соединения по настоящему изобретению в контакт с жидкими носителями или с мелкодисперсными твердыми носителями, или обоими, а затем, при необходимости, придания продукту формы. Составы по настоящему изобретению, пригодные для перорального введения, могут находиться в форме капсул, крахмальных капсул, пилюль, таблеток, лепешек (применяя ароматизированную основу,обычно сахарозу и аравийскую камедь или трагакант), порошков, гранул, или в виде раствора или суспензии в водной или неводной жидкости, или в виде эмульсии масла в воде или водомасляной эмульсии,или в виде эликсира или сиропа, или в виде пастилок (применяя инертную основу, такую как желатин и глицерин, или сахарозу и аравийскую камедь) и/или в виде жидкости для полоскания рта, и тому подобное, каждая из которых содержит предопределенное количество соединения по настоящему изобретению в качестве активного ингредиента. Соединение по настоящему изобретению могут также вводиться в виде болюса, лекарственной кашки или пасты. В твердых дозированных формах для перорального введения (капсулах, таблетках, пилюлях, драже,порошках, гранулах, и тому подобное), активный ингредиент смешивают с одним или несколькими фармацевтически приемлемыми носителями, такими как цитрат натрия или дикальцийфосфат, и/или любыми следующими ингредиентами: наполнителями или сухими разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и/или кремниевая кислота; связующими веществами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон и/или аравийская камедь; увлажнителями, такими как глицерин; разрыхляющими средствами, такими как агар-агар, карбонат кальция, картофельный крахмал или крахмал из тапиоки, альгиновая кислота, определенные силикаты и карбонат натрия; добавками, замедляющими процесс растворения, такими как парафин; ускорителями всасывания, такими как четвертичные аммониевые соединения; смачивающими веществами, такими как,например, ацетиловый спирт или моностеарат глицерина; абсорбентами, такими как каолин и бентонитовая глина; смазками, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли,лаурилсульфат натрия, и их смесями; и окрашивающими веществами. В случае таблеток, капсул и пилюль, фармацевтические композиции могут также включать забуферивающие вещества. Твердые композиции сходного типа могут также применяться в качестве наполнителей в мягких и твердых желатиновых капсулах с применением таких наполнителей, как лактоза или молочные сахара, а также полиэтиленгликолей с высокой молекулярной массой, и тому подобное. Таблетки могут быть получены путем сжатия или формования, необязательно с одним или несколькими вспомогательными ингредиентами. Сжатые таблетки могут быть получены с применением связующего вещества (например, желатина или гидроксипропилметилцеллюлозы), смазки, инертного разбавителя, консерванта, разрыхлителя (например, натрийкрахмалгликолята или поперечно-сшитой натрийкарбоксиметилцеллюлозы), поверхностно-активного или диспергирующего вещества. Формованные таблетки могут быть получены путем формования в подходящей установке смеси измельченного соединения, смоченного инертным жидким разбавителем. На таблетки и другие твердые дозированные формы фармацевтических композиций по настоящему изобретению, такие как драже, капсулы, пилюли и гранулы, может быть необязательно нанесена бороздка, или они могут быть получены с применением покрытий и оболочек, таких как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области приготовления фармацевтических составов. Они могут быть также заключены в состав с тем, чтобы обеспечить медленное и контролируемое высвобождение применяемого активного ингредиента, например, для обеспечения желаемого профиля высвобождения включают гидроксипропилметилцеллюлозу в различных пропорциях, другие полимерные основы, липосомы и/или микросферы. Они могут быть подвергнуты стерилизации, например, путем фильтрации через задерживающий бактерии фильтр, или путем включения в состав стерилизующих веществ в форме стерильных твердых композиций, которые могут быть растворены в стерильной воде или какой-либо другой стерильной инъекционной среде непосредственно перед применением. Эти композиции могут также необязательно содержать вещества, делающие материал непрозрачным, и может представлять собой композицию, которая высвобождает активный ингредиент (ингредиенты) только, или главным образом, определенной порцией в желудочно-кишечном тракте, необязательно, замедленным путем. Примеры имплантируемых композиций, которые могут применяться, содержат полимерные вещества и воски. Активный ингредиент может также находиться в микрокапсулированной форме, если- 20007468 подходит, с одним или несколькими описанными выше наполнителями. Жидкие дозированные формы для перорального введения соединений по настоящему изобретению включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активному ингредиенту жидкие дозированные формы могут содержать обычно применяемые в данной области техники инертные разбавители, такие как, например, вода и другие растворители, солюбилизирующие вещества и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3 бутиленгликоль, масла (конкретно, хлопковое, арахисовое, кукурузное, масло из жмыха зародыша кукурузы, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и жирно-кислые эфиры сорбита, и их смеси. Кроме инертных разбавителей композиции для перорального приема могут также включать адъюванты, такие как смачивающие вещества, эмульгирующие и суспендирующие вещества, подслащивающие вещества, корригенты, красители, отдушки и консерванты. В дополнение к активному ингредиенту суспензии могут содержать суспендирующие вещества, такие как, например, этоксилированные изостеариловые спирты, полиэтоксиэтиленсорбит и сложные эфиры сорбита, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, и их смеси. Составы для ректального или вагинального введения, содержащие фармацевтические композиции по настоящему изобретению, могут представлять собой суппозитории, которые могут быть получены путем смешивания одного или нескольких соединений по настоящему изобретению с одним или несколькими подходящими не вызывающими раздражения наполнителями или носителями, включая, например, масло какао, полиэтиленгликоль, воск для суппозиторий или салицилат, и которые являются твердыми при комнатной температуре, но жидкими при температуре тела и поэтому могут плавиться в просвете прямой кишки или во влагалище и высвобождать активное соединение. Составы по настоящему изобретению, которые являются пригодными для вагинального введения,также включают пессарии, тампоны, составы в виде кремов, гелей, паст, пен, кремов, содержащие такие известные в данной области техники носители, которые являются подходящими. Дозированные формы для местного или чрескожного введения соединения по настоящему изобретению включают порошки, аэрозоли, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и летучие препараты. Активное соединение может быть смешано в стерильных условиях с фармацевтически приемлемым носителем и с любыми консервантами, буферными растворами или пропеллентами, которые могут потребоваться. Мази, пасты, кремы и гели могут в дополнение к активному соединению по настоящему изобретению содержать наполнители, такие как животные и растительные жиры, масла, воски, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевую кислоту, тальк и оксид цинка, или их смеси. Порошки и аэрозоли могут в дополнение к соединению по настоящему изобретению содержать наполнители, такие как лактозу, тальк, кремниевую кислоту, гидроксид алюминия, силикаты кальция и полиамидный порошок, или смеси этих веществ. Аэрозоли могут дополнительно содержать обычные пропелленты, такие как фторхлоруглеводороды и летучие незамещенные углеводороды, такие как бутан и пропан. Пластыри для чрескожного введения обладают дополнительным преимуществом контролируемой доставки соединения по настоящему изобретению в организм. Такие дозированные формы могут быть получены путем растворения или диспергирования соединения в подходящей среде. Для увеличения тока соединения через кожу также могут применяться усилители всасывания. Скорость такого тока может контролироваться либо путем применения контролирующей скорость тока мембраны, либо путем диспергирования активного соединения в полимерной основе или геле. Составы для глазного применения, глазные мази, порошки, растворы, и тому подобное, также рассматриваются как подпадающие под объем настоящего изобретения. Предпочтительно, фармацевтический препарат представляет собой глазной состав (например, состав для периокулярной, ретробульбарной или внутриглазной инъекции, состав для системного введения, или раствор для орошения при операции). Глазные составы по настоящему изобретению могут включать одно или несколько соединений по настоящему изобретению и фармацевтически приемлемый носитель. Могут применяться различные типы носителей. Как правило, носители должны быть водными по своей природе. Обычно предпочтительными являются водные растворы, основываясь как на случае применения состава, так и на способности пациента легко вводить такие композиции посредством закапывания одной или двух капель растворов в пораженные глаза. Однако деазапурины по настоящему изобретению могут также легко вводиться в состав других типов композиций, таких как суспензии, вязкие и полувязкие гели, или других типов твердых или полутвердых композиций. Глазные композиции по настоящему изобретению могут также включать различные другие ингредиенты, такие как буферы, консерванты, сорастворители и придающие вязкость вещества.- 21007468 Подходящая буферная система (например, фосфат натрия, ацетат натрия и борат натрия) может быть добавлена для предотвращения сдвига рН в условиях хранения. Глазные препараты обычно упакованы в виде формы для многократного применения. Поэтому для предотвращения бактериального загрязнения во время пользования требуется применение консервантов. Подходящие консерванты включают хлорид бензалкония, тимерозал, хлорбутанол, метилпарабен, пропилпарабен, фенилэтиловый спирт, динатрийэдетат, сорбиновая кислота, поликвартений-1 и другие вещества, известные специалисту в данной области техники. Такие консерванты обычно применяются в количестве от 0,001 до 1,0% отношения массы и объема ("мас.%/об. "). Если соединения по настоящему изобретению вводятся во время внутриглазных хирургических процедур, как, например, путем ретробульбарной или периокулярной инъекции и внутриглазной перфузии или инъекции, наиболее предпочтительным является применение в качестве носителей сбалансированных солевых растворов для орошения. Примерами физиологически сбалансированных солевых растворов для орошения являются BSS Sterile Irrigating Solution и BSS Plus Sterile Intraocular IrrigatingSolution (Alcon Laboratories, Inc., Fort Worth, Texas, USA). Последний тип раствора описан в патенте США 4550022 (Garabedian, et al.), полное содержание которого включено в описание этого документа в качестве ссылки. Ретробульбарные или периокулярные инъекции хорошо известны специалистам в данной области техники и описаны в многочисленных публикациях, включая, например, Ophthalmic Surgery: Principles of Practice, Ed., G.L. Spaeth. W.B. Sanders Co., Philadelphia, Pa., U.S.A., pages 85-87 (1990). Как указано выше, применение соединения по настоящему изобретению для предотвращения или ослабления поражения тканей сетчатки и диска зрительного нерва является особенно важным аспектом одного воплощения настоящего изобретения. Относящиеся к офтальмологии состояния, которые могут лечиться, включают без ограничения ретинопатии и поражения, ассоциированные с повреждением глазных тканей, такие как повреждения при ишемической реперфузии. Соединения могут применяться для лечения временных состояний, или могут вводиться постоянно, в особенности в случае дегенеративного заболевания. Соединения также могут применяться в целях профилактики, в особенности перед глазной операцией или неинвазивными глазными процедурами, или другими типами операций. Фармацевтические композиции по настоящему изобретению, подходящие для парентерального введения, включают одно или несколько соединений по настоящему изобретению в комбинации с одним или несколькими фармацевтически приемлемыми стерильными изотоническими водными или неводными растворами, дисперсиями, суспензиями или эмульсиями, или стерильными порошками, которые могут быть преобразованы в стерильные инъецируемые растворы или дисперсии непосредственно перед применением, которое могут содержать антиоксиданты, буферы, бактериостатические факторы, растворенные вещества, которые приводят состав в состояние, изотоничное по отношению к крови имеющего показания реципиента, или суспендирующие агенты или загустители. Примеры подходящих водных и неводных носителей, которые могут применяться в фармацевтических композициях по настоящему изобретению, включают воду, этанол, полиолы (такие как глицерин,пропиленгликоль, полиэтиленгликоль, и тому подобное), и их подходящие смеси, растительные масла,такие как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. Надлежащая текучесть может поддерживаться, например, путем применения материалов покрытия, таких как лецитин, путем поддержания требуемого размера частиц в случае применения суспензий, и путем применения поверхностно-активных веществ. Указанные композиции могут также содержать адъюванты, такие как консерванты, смачивающие вещества, эмульгирующие агенты и диспергирующие вещества. Профилактика действия микроорганизмов может быть обеспечена путем применения различных противобактериальных и противогрибковых средств, например, парабена, хлорбутанола, фенолсорбиновой кислоты, и тому подобное. Также может быть желательным включение в состав композиции обеспечивающих изотоничность веществ, таких как сахара, хлорид натрия, и тому подобное. В дополнение инъецируемая фармацевтическая форма для пролонгированного всасывания может быть получена путем включения в состав веществ, пролонгирующих всасывание, таких как моностеарат алюминия и желатин. В некоторых случаях для пролонгации действия лекарства является желательным замедление всасывания лекарства при подкожных и внутримышечных инъекциях. Это может быть достигнуто путем применения жидкой суспензии кристаллического или аморфного вещества с плохой растворимостью в воде. Тогда скорость всасывания лекарства зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристаллов и формы кристаллов. Альтернативно, замедленное всасывание формы лекарства для парентерального введения может быть достигнуто путем растворения или суспендирования лекарства в связующем масле. Инъецируемые формы с образованием депо лекарства могут быть получены путем образования микрокапсульных матриц соединений по настоящему изобретению в биологически распадающихся полимерах, таких как полилактид-полигликолид. Скоростью высвобождения можно управлять в зависимости от соотношения количества лекарства и полимера, и природы конкретно применяемого полимера. Примеры других биологически распадающихся полимеров включают полиортоэфиры и полиангидриды. Инъецируемые формы с образованием депо лекарства могут быть также получены путем заключения- 22007468 лекарства в липосомы или микроэмульсии, совместимые с тканями организма. Препараты по настоящему изобретению могут вводиться перорально, парентерально, местно или ректально. Без сомнения, они вводятся в формах, подходящих для каждого пути введения. Например, их вводят в виде таблеток или капсул, путем инъекции, ингаляции, путем применения лосьона для глаз, мази, суппозиториев, и так далее, вводят путем инъекции, инфузии или ингаляции; наносят местно при помощи лосьона или мази; и вводят ректально в виде суппозиториев. Предпочтительным является пероральное введение. Используемые в этом документе выражения парентеральное введение и вводят парентерально означают способы введения, отличные от энтерального и местного введения, обычно путем инъекции, и включают без ограничения внутривенную, внутримышечную, внутриартериальную, внутриоболочечную,внутрикапсульную, внутриглазничную, внутрисердечную, интрадермальную, интраперитонеальную,транстрахеальную, подкожную, субэпителиальную, внутрисуставную, субкапсульную, субарахноидальную, интраспинальную и внутригрудинную инъекцию и инфузию. Используемые в этом документе выражения системное введение, вводят системно, периферическое введение и вводят периферически означают такое введение соединения, лекарства или другого вещества, отличное от введения непосредственно в центральную нервную систему, при котором оно попадает в организм больного и, поэтому, подвергается метаболизму и другим подобным процессам, например, подкожное введение. Такие соединения могут вводиться для терапии людям и другим животным посредством любого подходящего пути введения, включая введение перорально, назально, как, например, путем применения аэрозоля, ректально, интравагинально, парентерально, внутригрудинно и местно, как путем применения порошков, мазей или капель, включая трансбуккально и сублигвально. Вне зависимости от выбранного пути введения соединения по настоящему изобретению, которые могут применяться в подходящей гидратированной форме, и/или фармацевтические композиции по настоящему изобретению, заключают в состав фармацевтически приемлемых дозированных форм путем общепринятых способов, известных специалистам в данной области техники. Для того, чтобы получить содержание активного ингредиента, при котором эффективно достигается желаемый терапевтический эффект для конкретного пациента, можно варьировать фактическими дозировками активных ингредиентов в фармацевтических композициях по настоящему изобретению, композицией и способом введения, не являющимся токсичным для пациента. Выбранная дозировка будет зависеть от различных факторов, включая активность конкретного применяемого соединения по настоящему изобретению или его сложного эфира, соли или амида, пути введения, времени введения, скорости выведения конкретного применяемого соединения, продолжительности лечения, других лекарств, соединений и/или веществ, применяемых в комбинации с конкретным применяемым соединением, возраста, пола, веса, состояния, общего состояния здоровья и анамнеза подвергаемого лечению больного, и похожих факторов, хорошо известных в медицине. Врач или ветеринар, обладающие средней квалификацией в своей области техники, может легко определить и прописать эффективное количество требуемой фармацевтической композиции. Например,врач или ветеринар может начать с дозировки применяемых в фармацевтической композиции соединений по настоящему изобретению меньшей, чем это требуется для достижения терапевтического эффекта,и постепенно увеличивать дозировку до тех пор, пока желаемый эффект не будет достигнут. Обычно подходящей суточной дозой соединения по настоящему изобретению является то количество соединения, которое представляет собой минимальную дозу, эффективно вызывающую терапевтический эффект. Такая эффективная доза обычно зависит от описанных выше факторов. Как правило, при применении с целью достижения у пациента указанных аналгезирующих эффектов внутривенная и подкожная дозировки соединений по настоящему изобретению варьируют приблизительно от 0,0001 приблизительно до 200 мг на килограмм массы тела в сутки, более предпочтительно приблизительно от 0,01 приблизительно до 150 мг на килограмм в сутки, и еще более предпочтительно приблизительно от 0,2 приблизительно до 140 мг на килограмм в сутки. При желании эффективная суточная дозировка активного соединения может вводиться в виде двух,трех, четырех, пяти, шести или более субдоз, вводимых в течение суток по отдельности с подходящими интервалами, необязательно, в виде однократных дозированных форм. Если для соединения по настоящему изобретению возможно его введение без посторонней помощи,то соединение предпочтительно вводить в виде фармацевтической композиции. Настоящее изобретение также относится к упакованным фармацевтическим композициям для лечения у млекопитающего ассоциированных с А 2b нарушений. Упакованные фармацевтические композиции включают емкость с терапевтически эффективным количеством по крайней мере одного соединения по настоящему изобретению, описанного ниже, и инструкции по применению соединения для лечения у млекопитающего ассоциированного с А 2b нарушения. В другом аспекте настоящее изобретение относится к способу лечения повреждения глаза животного (например, человека) путем введения животному эффективного количества соединений по настоящему изобретению. Предпочтительно соединение представляет собой антагонист аденозинового рецептора- 23007468 А 2b в клетках животного. Повреждение относится к сетчатке или диску зрительного нерва и может быть острым и хроническим. Повреждение может являться результатом, например, глаукомы, отека, ишемии,гипоксии или травмы. Настоящее изобретение также относится к способу ингибирования активности аденозинового рецептора (например, аденозинового рецептора А 2b) в клетке путем обработки клетки соединением по настоящему изобретению. Предпочтительно соединение является антагонистом рецептора. В другом воплощении изобретение относится к фармацевтической композиции, содержащей соединение по настоящему изобретению и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу лечения у животного ассоциированного с А 2b болезненного состояния путем введения млекопитающему такого терапевтически эффективного количества соединения по настоящему изобретению, что у животного происходит лечение нарушения. В благоприятном случае заболевание может представлять собой нарушение, опосредуемое аденозином. Примеры предпочтительных болезненных состояний включают: нарушения центральной нервной системы, нарушения сердечно-сосудистой системы, почечные нарушения, воспалительные нарушения, аллергические нарушения, нарушения желудочно-кишечного тракта, глазные нарушения и нарушения дыхательной системы. Настоящее изобретение дополнительно относится к фармацевтическим композициям для лечения у млекопитающего ассоциированного с А 2b болезненного состояния, например, нарушений дыхательной системы (например, астмы, бронхита, хронического обструктивного заболевания легких и аллергического ринита), почечных нарушений, нарушений желудочно-кишечного тракта и глазных нарушений. Фармацевтическая композиция включает терапевтически эффективное количество соединения по настоящему изобретению и фармацевтически приемлемый носитель. Следует понимать, что все описанные ниже соединения предназначены для терапевтического лечения. Также следует понимать, что соединения по настоящему изобретению могут применяться по отдельности или в комбинации с другими соединениями по настоящему изобретению или в комбинации с дополнительными терапевтическими соединениями,такими как, например, антибиотики, противовоспалительные средства или противораковые средства. Как указано выше, применение соединений по настоящему изобретению для предупреждения или уменьшения повреждения тканей сетчатки и диска зрительного нерва на клеточном уровне является особенно важным аспектом одного воплощения настоящего изобретения. Состояния в офтальмологии, которые могут подвергаться лечению, включают без ограничения ретинопатии, дегенерацию желтого пятна, ишемию глаза, глаукому и повреждение, ассоциированное с травмой тканей глаза, такой как ишемические реперфузионные травмы, фотохимические травмы и травмы, ассоциированные с хирургией глаза,особенно травмы сетчатки или диска зрительного нерва под воздействием света или хирургических инструментов. Соединения могут также применяться в качестве вспомогательного средства, такого как вводимого после глазной операции путем инъекции в стекловидное тело или путем субконъюнктивной инъекции. Соединения могут также применяться для неотложного лечения, или могут вводиться постоянно, особенно в случае дегенеративного заболевания. Соединения могут также применяться для профилактических целей, особенно перед глазными операциями или неинвазивными глазными процедурами,или другими типами операций. Характерные черты и другие детали настоящего изобретения будут далее особенно подробно описаны и указаны в формуле изобретения. Следует понимать, что конкретные воплощения настоящего изобретения представлены с целью иллюстрации, а не в качестве ограничений настоящего изобретения. Принципиальные черты настоящего изобретения могут быть использованы в различных воплощениях без отступления от объема настоящего изобретения. Настоящее изобретение дополнительно проиллюстрировано последующими примерами, которые ни в коем случае не должны истолковываться как дополнительно ограничивающие. Содержание всех ссылок, заявок на выдачу патента, находящихся на рассмотрении, и опубликованных заявок на выдачу патента, цитируемых на всем протяжении настоящей заявки, включая приведенных в качестве ссылок в описании предпосылок создания настоящего изобретения, включены, таким образом, в этот документ в качестве ссылки. Следует понимать, что модели, применяемые на всем протяжении примеров настоящего изобретения, являются принятыми моделями, и что демонстрация эффективности этих моделей предсказывает их эффективность у людей. Настоящее изобретение станет более понятно из последующего раздела "Подробности экспериментов". Однако специалист в данной области техники должен с готовностью принимать во внимание, что определенные обсуждаемые способы и результаты являются просто иллюстрациями настоящего изобретения, как описано более полно в следующей за ними формуле изобретения. Подробности экспериментов Общая информация ЖХ/МС-анализ проводили с применением автоматического пробоотборника Gilson 215 и автоматического дозатора Gilson 819, подсоединенных к Hewlett Packard HP110. Масс-спектры получали на масс-спектрометре Micromass Platform II с применением ионизации электрораспылением положительных ионов. ЖХ-анализ проводили с применением УФ-детектора при 254 нм. Образцы элюировали на колонкеPhenomenex Luna C18(2) (5 мкм, 4,6x150 мм) с применением либо линейного градиента 15-99% растворителя А в растворителе В в течение 10 мин (способ А, неполярный), либо 5-100% растворителя А в растворителе В в течение 15 мин (способ В, полярный). Растворителем А служил 100% ацетонитрил, растворителем В служила 0,01% муравьиная кислота, не обладающая заметным эффектом на время удерживания образца, в воде. ИК-спектры записывали на FT-IR-спектрометре Perkin-Elmer Spectrum 1000 с применением диффузного коэффициента отражения в тонких пленках. 1 Н-ЯМР-спектры и 13 С-ЯМР-спектры записывали на оборудовании Varian (400 МГц или 200 МГц 1 для H-ЯМР, 100,6 МГц или 50,3 МГц для 13 С-ЯМР) при температуре окружающей среды, применяя TMS или пик удерживаемого растворителя в качестве внутренних стандартов. Положения линий или мультиплеты представлены в частях на миллион , константы взаимодействия (J) представлены в виде абсолютных значений в Герцах, в то время как мультиплетности сигнала обозначены следующим образом: s(синлет), d (дублет), t (триплет), q (квартет), quint (квинтет), m (мультиплет), mс (центрированный мультиплет), br (уширенный). Все точки плавления определены на аппарате Mel-Temp II и представлены неисправленными. Элементный анализ проводили в Atlantic Microlab, Inc., Norcross, GA. Коммерчески доступные безводные растворители и растворители ВЭЖХ-чистоты применяли без дополнительной очистки. Сокращения: ДМСО-диметилсульфоксид;HATU-O-(7-аза-бензотриазоло-1-ил)-N,N,N',N'тетраметилуронийгексафторфосфат; HPLC - жидкостная хроматография высокого давления; LC/MS жидкостная хроматография/масс-спектрометрия; NMP - N-метилпирролидон; NMR - ядерный магнитный резонанс; PS-NCO -изоцианат на полимерной основе; RT - время удерживания; SCX - сильный катионообменный кремнезем; ТГФ - тетрагидрофуран. Подробности методик экспериментов раздельных примеров Жидкостную хроматографию высокого давления, упоминаемую далее в следующих приготовлениях, выполняли в соответствии со следующим общим способом. Колонку Xterra (заполненную С 18 силикагелем, размер частиц 7 мкм, 19x150 мм) предварительно уравновешивали смесью воды, ацетонитрила и трифторуксусной кислоты (90/10/0,1 по объему) при рН=3,0. Образцы элюировали с применением линейного градиента 10-90% ацетонитрила в воде, содержащей 0,1% трифторуксусной кислоты, при рН=3,0 в течение 10 мин со скоростью потока 10 млмин-1. Анализ проводили при 220 нм с применением диодного матричного детектора. Если очистку соединения проводили по следующему способу, то предполагали выделение соединения в виде его трифторацетата. Очистку в 96-луночном формате с применением сильного катионообменного кремнезема (SCX) с функциональной группой бензолсульфоновой кислоты, упоминаемую далее в следующих приготовлениях, выполняли в соответствии со следующим общим способом. Кремнезем (приблизительно 70 мг на лунку) обрабатывали 500 мкл смеси 1/1 метанол/вода (по объему). Неочищенный материал наносили в виде смеси 4/1 0,1 М HCl/NMP, затем промывали 500 мкл метанола. Очищенный материал элюировали 500 мкл смеси 3/97 гидроксида аммония/метанола по объему. Аналитические методики 1 Н-ЯМР-анализ проводили на аппаратуре Varian Gemini при 400 МГц с применением стандартных методик. ЖХ/МС-анализ проводили с применением автоматического пробоотборника Gilson 215 и автоматического дозатора Gilson 819, подсоединенных к Hewlett Packard HP110. Масс-спектры получали на ЖХ/масс-спектрометре Micromass Platform с применением ионизации электрораспылением положительных и отрицательных ионов. Обнаруженные массы относили к наиболее распространенному обнаруженному положительному МН+ иону, соответствующему указанному в заголовке соединению, если не определено иначе. Анализ проводили при 220 нм с применением диодного матричного детектора. Применяли следующие общие способы. Способ А: колонка Waters Symmetry C18 (3,5 мкм, 2,1x30 мм), градиент с продолжительностью элюирования 4,8 мин; или Способ В: колонка Phenomenex Mercury MS Luna C18 (3 мкм, 2,0x10 мм), градиент с продолжительностью элюирования 3,6 мин. Образцы элюировали с применением линейного градиента 0-100% растворителя В в растворителе А в течение либо 4,8, либо 3,6 мин (см. выше). Применяемый буфер представлял собой 0,1% муравьиную кислоту, не обладающую заметным эффектом на время удерживания образца. Подвижная фаза (плюс буферный раствор). Растворитель А: вода (95%), ацетонитрил (5%). Растворитель В: ацетонитрил (100%).- 25007468 Пример 1. Синтез хлорацетамидного промежуточного продукта 6. Схема I Путем конденсации бензамидингидрохлорида с диэтилмалонатом в DMF с применением DBU в качестве основания получали диол 2, который преобразовывали в дихлорид 3 путем осуществления взаимодействия с чистым РОСl3. Путем селективного поэтапного замещения хлор-заместителей аммиаком в ДМСО и затем чистым N-ацетилэтилендиамином получали диамин 5. Путем ацилирования хлорацетилхлоридом с применением 2,6-лутидина в качестве основания в 12/1 CH2Cl2/DMF получали хлорацетамид 6. 2-Фенилпиримидин-4,6-диол (2). Раствор бензамидингидрохлорида (44,41 г; 0,284 моль), диэтилмалоната (45,51 г; 0,284 моль) и DBU(86,40 г; 0,568 моль) в DMF (250 мл) нагревали при 85 С в течение 20 ч. После охлаждения до комнатной температуры колбу помещали в холодильник на ночь. Кристаллический продукт собирали путем фильтрации и промывали DMF (300 мл), затем растворяли в воде (примерно 110 мл) и подкисляли добавлением 2 М НСl (110 мл) с добавлением воды, в случае необходимости, для поддержания суспензии. Продукт собирали путем фильтрации, промывали водой (100 мл) и сушили до постоянной массы в высоком вакууме с получением 39,09 г (73%) не совсем белого твердого вещества. ЖХ (способ В) время удерживания = 6,2 мин; 1 Н ЯМР (200 МГц, ДМСО-d6)8,08 (м, 2 Н), 7,54 (м, 3 Н), 5,34 (с, 1 Н); МС (ИЭР) 189,0 ([М+Н]+). 4,6-Дихлор-2-фенилпиримидин (3). Взвесь диола 2 (39,08 г; 0,208 моль) в оксихлориде фосфора (124 мл; 1,33 моль) нагревали от 75 до 120 С в течение 45 мин. Через 20 ч при 120 С летучие компоненты удаляли в вакууме. Полученное желтовато-коричневое твердое вещество добавляли к колотому льду (600 мл), перемешивали суспензию в течение 2 ч при к.т., собирали путем фильтрации, промывали водой и сушили до постоянной массы в высоком вакууме с получением желтовато-коричневого твердого вещества (44,34 г; 95%). 1 Н ЯМР (200 МГц, CDCl3)8,44 (м, 2 Н), 7,51 (м, 3 Н), 7,27 (с, 1 Н). 6-Хлор-2-фенилпиримидин-4-иламин (4). Ледяную суспензию пиримидина 3 (44,34 г; 0,197 моль) в ДМСО (366 мл) насыщали аммиаком, в течение этого времени образовывался раствор. Через 24 ч при к.т. по каплям добавляли воду (710 мл). Суспензию охлаждали на ледяной бане в течение 1 ч, затем собирали путем фильтрации и промывали водой (500 мл) с получением после сушки в вакууме светлого желтовато-коричневого порошка (37,84 г; 93%). ЖХ (способ В) время удерживания = 16,0 мин; 1 Н ЯМР (200 МГц, CDCl3)8,33 (м, 2 Н), 8,44 (м, 3 Н), 6,32 (с, 1 Н), 5,12 (ушир.с, 2 Н); 13 С ЯМР (50,3 МГц, CDCl3)165,1, 164,0, 160,5, 136,7, 131,0, 128,4, 128,4, 101,4; МС (ИЭР) 205,9/207,8 (100/34) [МН+].N-[2-(6-Амино-2-фенилпиримидин-4-иламино)этил]ацетамид (5). Раствор хлорарена 4 (20,57 г; 0,100 моль) в N-(2-аминоэтил)ацетамиде (71,05 г; 0,696 моль) нагревали от 60 до 120 С в течение 20 мин, затем выдерживали при 120 С в течение 4,0 ч. После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc (500 мл), затем промывали водой (1x150 мл). Водную фазу экстрагировали EtOAc (3x25 мл) и промывали объединенные органические части водой(2x25 мл) и насыщенным NaCl (2x50 мл). Раствор сушили (MgSO4), фильтровали, затем концентрировали в вакууме до получения 21,34 г не совсем белой твердой пены. Продукт очищали двумя порциями на силикагеле (всего 1,7 л), элюируя 15-8/1 DCM/MeOH, с получением твердой белой пены (15,36 г; 57%). ЖХ (способ В) время удерживания = 5,5 мин; 1 Н ЯМР (200 МГц, CDCl3)8,29 (м, 2 Н), 7,43 (м, 3 Н), 6,71 (ушир.с, 1 Н), 5,41 (с, 1 Н), 5,12 (ушир.т,J=5,4 Гц, 1 Н), 4,68 (ушир.с, 2 Н), 3,53 (м, 1 Н), 3,45 (м, 1 Н), 1,83 (с, 3 Н); МС (ИЭР) 272,03 (100) [МН+].N-[6-(2-Ацетиламиноэтиламино)-2-фенилпиримидин-4-ил]-2-хлорацетамид (6). Раствор амина 5 растирали с хлорацетилхлоридом с мониторингом по методу ТСХ (SiO2, 8/1 и 14/1- 26007468 по стенке колбы, расположенной в ледяной бане, в раствор аминопиримидина 5 (1,531 г; 5,64 ммоль) и 2,6-лутидина (2,0 мл; 17 ммоль) в DCM (30 мл) и DMF (2,5 мл). Оставался исходный материал, поэтому хлорацетилхлорид дополнительно добавляли через 0,4 ч (0,45 мл; 5,7 ммоль) и еще через 0,5 ч (90 мкл; 1,1 ммоль). Через 0,5 ч добавляли EtOAc (150 мл) и промывали раствор насыщенным NаНСО 3 (40 мл),50% насыщенным NaCl (5x40 мл), насыщенным NaCl (2x40 мл), сушили (MgSO4), фильтровали и концентрировали до получения желто-оранжевого кристаллического твердого вещества. Неочищенный материал растирали с гексанами (10 мл), затем с 1/1 гексанами/Et2O (2x10 мл), затем очищали на силикагеле (250 мл), элюируя 18/1 DCM/MeOH, с получением твердой желтой пены (1,78 г; 91%). ЖХ (способ В) время удерживания = 13,5 мин; 1 Н ЯМР (200 МГц, CDCl3)8,70 (ушир.с, 1 Н), 8,35 (м, 2 Н), 7,47 (м, 3 Н), 7,16 (с, 1 Н), 6,48 (ушир.с,1 Н), 5,59 (ушир.т, 1 Н), 4,19 (с, 2 Н), 3,68 (м, 2 Н), 3,54 (м, 2 Н), 1,88 (с, 3 Н); МС (ИЭР) 347,9/349,9 (100/32)[МН+]. Пример 2. Получение коммерчески недоступных аминов 7. Синтез коммерчески недоступных аминов 7 представлен на схеме II. Бензилпиперидины получали путем реакции Хорнера-Уодсворта-Эммонса или из N-Boc-4-метиленпиперидина путем гидроборирования и кросс-сочетания Судзуки. Фениловые эфиры синтезировали из N-Boc-4-гидроксипиперидина и фенолов путем реакции Митцунобу. Путем алкилирования нитрила 17.15 защищенным азотистым ипритом 15 с последующим удалением Вос-группы путем добавления НСl в диоксане получали амин 7.15. Пиперазины и гомопиперазины получали из моно-Вос-защищенных производных путем восстановительного аминирования альдегида с применением NaBH(OAc)3 в качестве восстановителя с последующим снятием защиты путем добавления TFA или НСl/МеОН. Схема II трет-Бутиловый эфир 4-метиленпиперидин-1-карбоновой кислоты (13). Метилтрифенилфосфонийбромид (1,870 г; 5,23 ммоль) добавляли одной порцией к суспензии KOtBu(0,586 г; 5,22 ммоль) в безводном эфире (10 мл). Через 30 мин желтую суспензию охлаждали до 0 С, затем добавляли раствор трет-бутилового эфира 4-оксопиперидин-1-карбоновой кислоты (1,02 г; 5,12 ммоль). Через 2,0 ч добавляли воду (10 мл) и EtOAc (10 мл); органическую часть промывали водой (2x10 мл) и насыщенным NaCl (2x10 мл), сушили (MgSO4), фильтровали и концентрировали до получения белого твердого вещества. Материал, растворимый в 12/1 гексанах/EtOAc, очищали на силикагеле (60 мл) с применением указанной системы растворителей с получением прозрачной бесцветной жидкости (685 мг; 68%). 1 Н ЯМР (200 МГц, CDCl3)4,74 (т, J=1,0 Гц, 2 Н), 3,42 (м, 4 Н), 2,18 (м, 4 Н), 1,47 (с, 9 Н). трет-Бутиловый эфир 4-(2-хлорбензил)пиперидин-1-карбоновой кислоты (14.10). Указанное соединение синтезировали по способу, аналогичному для 14.12, из 1-хлор-2-йодбензола(264 мг; 1,11 ммоль) с получением прозрачного бесцветного масла (262 мг; 76%) после очистки по мето- 27007468 ду хроматографии на силикагеле (40 мл, элюируя 10/1 гексанами/EtOAc). ЖХ (способ А) время удерживания = 12,09 мин; Rf = 0,29 (SiO2/8:1 гексан:ЕtОАс); 1 Н ЯМР (200 МГц, CDCl3)7,35 (м, 1 Н), 7,16 (м, 3 Н), 4,08 (м, 2 Н), 2,8-2,5 (м, 4 Н), 2,0-1,4 (м, 3 Н),1,45 (с, 9 Н), 1,23 (м, 2 Н); МС (ИЭР) 294,9/296,9 (100/34) [МН+ - С 4 Н 9 + CH3CN], 253,9/255,9 (40/12) [МН+- С 4 Н 9]. трет-Бутиловый эфир 4-(3-хлорбензил)пиперидин-1-карбоновой кислоты (14.11). Указанное соединение синтезировали по способу, аналогичному для 14.12, из 1-бром-3-хлорбензола(223 мг; 1,16 ммоль) с получением прозрачного бледно-желтого масла (204 мг; 57%) после очистки по методу хроматографии на силикагеле (40 мл, элюируя 9/1 гексанами/EtOAc). ЖХ (способ А) время удерживания = 12,04 мин; Rf= 0,27 (SiO2/9:1 гексаны:EtOAc); 1 Н ЯМР (200 МГц, CDCl3)7,3-7,1 (м, 3 Н), 7,00 (м, 1 Н), 4,08 (м, 2 Н), 2,63 (м, 2 Н), 2,51 (м, 2 Н), 2,01,4 (м, 3 Н), 1,45 (с, 9 Н), 1,16 (м, 2 Н); ESMC 294,9/296,9 (100/34) [МН+ - С 4 Н 9 + CH3CN], 253,9/255,9(32/10) [МН+ - С 4 Н 9]. трет-Бутиловый эфир 4-(4-хлорбензил)пиперидин-1-карбоновой кислоты (14.12). Раствор алкена 13 (195 мг; 0,988 ммоль) и 9-BBN (1,5 М в ТГФ; 2,0 мл; 1,0 ммоль) погружали в масляную баню при к.т., нагревали с обратным холодильником, выдерживали при нагреванием с обратным холодильником в течение 1,0 ч, затем охлаждали до к.т. Этот раствор добавляли к суспензии 1 бром-4-хлорбензола (172 мг; 0,898 ммоль), К 2 СO3 (163 мг; 1,18 ммоль) и Pd(dppf)Cl2CH2Cl2 (37 мг; 0,045 ммоль) в воде (0,20 мл) и DMF (2,0 мл). Реакционную смесь дегазировали (при пониженном давлении, затем в атмосфере азота в течение трех циклов), затем нагревали при 60 С в течение 3,0 ч. К охлажденному раствору добавляли воду (6 мл) и 1 М NaOH (6 мл) и затем экстрагировали EtOAc (15 мл). Органическую часть промывали 1 М NaOH (4 мл), водой (2x2 мл) и насыщенным NaCl (2x4 мл), затем сушили (MgSO4),фильтровали и концентрировали до получения коричневого масла. Чистый продукт получали в виде прозрачного бесцветного масла после хроматографии на силикагеле (40 мл), элюируя 8/1 гексанами/EtOAcCH3CN], 253,9/255,9 (32/10) [МН+ - С 4 Н 9], 210,0/212,0 (7/3) [МН+ - C4H9 - CO2]. 4-(2-Хлорбензил)пиперидин (7.10). Трифторуксусную кислоту (1 мл) добавляли к карбамату 14.10 (256 мг; 0,826 ммоль). Через 0,5 ч реакционную смесь концентрировали на роторном испарителе. Добавляли эфир (8 мл) и промывали раствор 5 М NaOH (2x3 мл) и водой (3 мл). Продукт экстрагировали добавлением в 1 М НСl (3x2 мл). После подщелачивания кислотной части добавлением 5 М NaOH (4 мл) продукт экстрагировали DCM (3x2 мл). Органическую часть сушили (MgSO4), фильтровали и концентрировали с получением прозрачной бесцветной жидкости (137 мг; 79%). ЖХ (способ В) время удерживания = 9,48 мин; 1(м, 3 Н), 1,21 (м, 2 Н); МС (ИЭР) 210,0/212,0 (100/35) [МН+]. 4-(3-Хлорбензил)пиперидин (7.11). Указанное соединение синтезировали по способу, аналогичному для 7.10, из карбамата 14.11 (200 мг; 0,646 ммоль) с получением прозрачной бледно-желтой вязкой жидкости, которая затвердевала при выдерживании до получения воскоподобного твердого вещества (111 мг; 82%). ЖХ (способ В) время удерживания = 9,84 мин; 1 Н ЯМР (200 МГц, CDCl3)7,3-7,1 (м, 3 Н), 7,01 (м, 1 Н), 3,05 (м, 2 Н), 2,7-2,4 (м, 4 Н), 1,8-1,5 (м, 3 Н),1,14 (м, 2 Н); МС (ИЭР) 210,0/212,0 (100/35) [МН+]. 4-(4-Хлорбензил)пиперидинийтрифторацетат (7.12). Трифторуксусную кислоту (1 мл) добавляли к карбамату 14.12 (153 мг; 0,494 ммоль). Через 0,8 ч реакционную смесь концентрировали на роторном испарителе. Добавляли эфир (8 мл) и растирали полученное твердое вещество с эфиром, собирали путем фильтрации и промывали эфиром с получением твердого вещества (143 мг; 89%). ЖХ (способ В) время удерживания = 10,79 мин; 1 Н ЯМР (200 МГц, CDCl3)9,57 (ушир.с, 1 Н), 9,09 (ушир.с, 1 Н), 7,27 (м, 2 Н), 7,06 (м, 2 Н), 3,38 (м,2 Н), 2,82 (м, 2 Н), 2,57 (м, 2 Н), 1,9-1,4 (м, 5 Н); МС (ИЭР) 210,0/212,0 (100/33) [МН+]. 1-Бензил-4-(4-метоксибензилиден)пиперидин (12.8). Раствор 1-бензилпиперидин-4-она (11) (2,310 г; 12,2 ммоль) и диэтилового эфира (4-метоксибензил) фосфоновой кислоты (3,100 г; 12,0 ммоль) в DME (20 мл) добавляли к NaH (0,51 г; 21 ммоль). Колбу,погруженную при к.т. в масляную баню, нагревали с обратным холодильником и выдерживали при этой температуре в течение 1,6 ч. Реакционную смесь охлаждали, вливали в воду (200 мл) и экстрагировалиEtOAc (4x60 мл). Органическую часть промывали насыщенным NaCl (4x25 мл), сушили (MgSO4), фильтровали и концентрировали до получения масла. Продукт частично очищали на силикагеле (320 мл),- 28007468 элюируя 25/1 DCM/MeOH, с получением масла (0,5 г). Это масло растворяли в 1 М НСl (10 мл) и экстрагировали продукт добавлением в DCM (5x3 мл). Органическую часть промывали насыщенным NаНСО 3,сушили (MgSO4), фильтровали и концентрировали до получения оранжево-коричневой жидкости (0,46 г). Этот материал объединяли с неочищенным материалом (2,41 г, не подвергавшийся хроматографии),полученного сходным образом из кетона (1,535 г; 8,1 ммоль), фосфоната (2,071 г; 8,02 ммоль) и NaH(0,22 г; 8,8 ммоль). Объединенный неочищенный материал очищали на силикагеле (250 мл) , элюируя 2/1 гексанами/EtOAc, с получением бледно-желтого твердого вещества (230 мг; 4%), т.пл.=71,5-72,0 С. 1 Н ЯМР (200 МГц, CDCl3)7,4-7,2 (м, 5 Н), 7,12 (м, 2 Н), 6,84 (м, 2 Н), 6,21 (м, 1 Н), 3,80 (с, 3 Н), 3,52(с, 2 Н), 2,6-2,3 (м, 8 Н). 4-(4-Метоксибензил)пиперидин (7.8). Гидроксид палладия (27 мг) добавляли к раствору N-бензилалкена 10 (204 мг; 0,695 ммоль) в метаноле (9 мл). Суспензию дегазировали, затем выдерживали в атмосфере водорода (1 атм) в течение 45 ч. После фильтрации через недопрессованный слой диатомовой земли раствор концентрировали в вакууме до получения воскоподобного твердого вещества (135 мг; выход неочищенного продукта 95%). ЖХ (способ "polarshort") время удерживания = 3,01 мин; МС (ИЭР) 206,0 ([М + Н]+). трет-Бутиловый эфир 4-(3-хлорфенокси)пиперидин-1-карбоновой кислоты (10.5). Раствор DIAD (11,4 мл; 55,0 ммоль) в ТГФ (15 мл) в течение 35 мин по каплям добавляли к ледяному раствору трет-бутилового эфира 4-гидроксипиперидин-1-карбоновой кислоты (9) (10,06 г; 50,0 ммоль), 3 хлорфенола (5,1 мл; 50,4 ммоль) и трифенилфосфина (14,44 г; 55,1 ммоль) в ТГФ (40 мл). Через 2,9 суток при комнатной температуре растворитель удаляли на роторном испарителе с получением вязкой жидкости; добавляли гексаны, затем упаривали с получением твердого вещества. Добавляли эфир (25 мл), затем гексаны(100 мл), твердое вещество фильтровали и промывали гексанами. Фильтрат концентрировали на роторном испарителе с получением золотистой вязкой жидкости (19,6 г). Неочищенный продукт использовали, как есть. ЖХ (способ А) время удерживания = 11,2 мин; МС (ИЭР) 311,9/313,8 (25/10) [МН+], 296,9/298,8(100/34) [МН+ - С 4 Н 9 + CH3CN], 255,9/257,8 (94/32) [МН+ - С 4 Н 9], 21-2,0/214,0 (13/5) [МН+ - С 4 Н 9 - СO2]. трет-Бутиловый эфир 4-(2-хлорфенокси)пиперидин-1-карбоновой кислоты (10.6). Указанное соединение получали из трет-бутилового эфира 4-гидроксипиперидин-1-карбоновой кислоты (9) (3,505 г; 17,4 ммоль), 2-хлорфенола (3,375 г; 26,3 ммоль), трифенилфосфина (6,002 г; 22,9 ммоль) и DIAD (4,30 мл; 21,8 ммоль) по способу, аналогичному для 10,5. Через 8 суток к неочищенной реакционной смеси добавляли EtOAc (200 мл) и промывали раствор 50% насыщенным NаНСО 3 (50 мл), насыщенным NаНСО 3 (2x25 мл) и насыщенным NaCl (2x25 мл), затем сушили (MgSO4), фильтровали и концентрировали до получения вязкой жидкости. Добавляли эфир (50 мл) и гексаны (50 мл) и выдерживали в течение ночи; после осадок удаляли путем фильтрации и частично концентрировали фильтрат. Большее количество материала выпадало в осадок, который также удаляли путем фильтрации, и концентрировали фильтрат до получения масла. Продукт частично очищали на основном глиноземе (160 мл), элюируя 8/1 гексанами/EtOAc с получением прозрачной бесцветной вязкой жидкости (5,12 г; выход неочищенного продукта 94%). ЖХ (способ А) время удерживания = 11,50 мин; МС (ИЭР) 312,1/314,1 (1/0,3) [МН+], 296,9/298,9(100/34) [МН+ - С 4 Н 9 + CH3CN], 255,9/257,8 (41/12) [МН+ - С 4 Н 9], 212,0/214,0 (4/1) [МН+ - С 4 Н 9 - СО 2]. Соединения 10.2-10.4 получали аналогичным путем. 4-(3-Хлорфенокси)пиперидинийхлорид (7.5). Трифторуксусную кислоту (40 мл) добавляли к неочищенному карбамату 10.5 (18,6 г; 59,7 ммоль) охлаждали в бане с ледяной водой. Через 1 мин реакционную смесь перемешивали при к.т. в течение 15 мин,затем концентрировали на роторном испарителе. Добавляли эфир (200 мл) и промывали 3 М NaOH (3x50 мл) и водой (50 мл). Продукт экстрагировали добавлением в 1 М НСl (3x50 мл) и подщелачивали водн. фазу добавлением 3 М NaOH (60 мл). Свободное основание экстрагировали добавлением в DCM (1x50 мл, затем 2x25 мл), сушили (MgSO4), фильтровали и концентрировали до получения масла. Гидрохлорид выпадал в осадок из метанольного раствора (6 мл) основания при добавлении по каплям НСl эфире (200 мл НСl-насыщенного эфира с 150 мл эфира). Соль собирали путем фильтрации и промывали эфиром (100 мл) с получением не совсем белого твердого вещества (7,97 г; 68% от трет-бутилового эфира 4-гидроксипиперидин-1-карбоновой кислоты). ЖХ (способ В) время удерживания = 8,2 мин; 1 Н ЯМР (200 МГц, ДMCO-d6)8,94 (ушир.с, 2 Н), 7,33 (м, 1 Н), 7,12 (м, 1 Н), 7,00 (м, 2 Н), 4,70 (м,1 Н), 3,20 (м, 2 Н), 3,08 (м, 2 Н), 2,08 (м, 2 Н), 1,85 (м, 2 Н); МС (ИЭР) (свободное основание) 212,0/213,9(100/35) [МН+]. 4-(2-Хлорфенокси)пиперидин (7.6). Трифторуксусную кислоту (4 мл) добавляли к неочищенному карбамату 10.6 (1,030 г). Через 20 мин при комнатной температуре в вакууме удаляли большую часть летучих компонентов и добавляли 1 М НСl(10 мл), после чего разделяли масло. Масло промывали DCM (3x3 мл). Водную часть подщелачивали до рН 12 добавлением 5 М NaOH, экстрагировали DCM (3x4 мл), сушили (MgSO4), фильтровали и концентрировали до получения масла (10 мг). Начальную промывку DCM сушили (MgSO4), фильтровали и концен- 29007468 трировали до получения бледно-желтого масла (1,26 г), ЯМР-анализ которого согласовался с пиперидинийтрифторацетатом. Этот материал и изначально собранное свободное основание (10 мг) растворяли в эфире(30 мл) и промывали 5 М NaOH (10 мл), 1 М NaOH (2x10 мл), водой (10 мл) и насыщенным NaCl (2x10 мл),затем сушили (MgSO4) и фильтровали. Добавляли HCl-насыщенный эфир (35 мл) и экстрагировали мутный раствор 1 М НСl (3x10 мл). Кислотную часть подщелачивали добавлением 5 М NaOH, экстрагировалиDCM (3x8 мл), органическую часть сушили (MgSO4), фильтровали и концентрировали до получения бледно-желтого масла (457 мг; 62% от трет-бутилового эфира 4-гидроксипиперидин-1-карбоновой кислоты). ЖХ (способ В) время удерживания = 8,2 мин; 1 Н ЯМР (200 МГц, CDCl3)7,37 (дд, J=1,6, 8,0 Гц,1 Н), 7,19 (ддд, J=1,5, 7,3, 8,6 Гц, 1 Н), 7,0-6,8 (м, 2 Н), 4,42 (тт, J=3,9, 3,9 Гц, 1 Н), 3,18 (ддд, J=4,0, 6,3, 12,0 Гц,2 Н), 2,73 (ддд, J=3,7, 8,6, 12,3 Гц, 2 Н), 2,00 (м, 2 Н), 1,77 (м, 2 Н); МС (ИЭР) (свободное основание) 212,0/213,9 (100/37) [МН+]. Соединения 7.2-7.4 получали аналогичным путем. Общие методики для восстановительного аминирования Вос-защищенных пиперазинов и гомопиперазинов альдегидами и снятия защиты добавлением TFA трет-Бутиловый эфир 4-(3-хлорбензил)пиперазин-1-карбоновой кислоты (20.24). К раствору трет-бутилового эфира пиперазин-1-карбоновой кислоты (4,00 г, 21,5 ммоль) в безводном дихлорэтане (70 мл) добавляли 3-хлорбензальдегид (2,49 мл, 3,08 г, 21,9 ммоль), НОАс (2,58 мл, 2,71 г,45,1 ммоль) и NaBH(OAc)3 (5,46 г, 25,8 ммоль) при температуре окружающей среды. После перемешивания при температуре окружающей среды в течение 3 суток, добавляли 2 н. NaOH (40 мл), слои разделяли и экстрагировали водный слой СН 2 Сl2 (4 х 50 мл). Объединенные органические экстракты промывали водой (3x50 мл) и насыщенным солевым раствором (80 мл) и сушили над MgSO4. Неочищенный материал очищали по методу хроматографии на силикагеле, элюируя смесями гексана/EtOAc, с получением 5,83 г(18,8 ммоль, 87%) указанного в заголовке соединения в виде желтого масла. МС (ЕС): m/z 311,0/313,0 (50/18) [МН+]. Время удерживания (способ А) = 5,0 мин. 1-(3-Хлорбензил)пиперазин (7.24). К трет-бутиловому эфиру 4-(3-хлорбензил)пиперазин-1-карбоновой кислоты (20.24) (8,82 г, 28,4 ммоль) в течение 5 мин при температуре окружающей среды добавляли TFA (45 мл). Через 1 ч 50 мин TFA выпаривали, остаток растворяли в 2 н. НСl (45 мл) и экстрагировали эфиром (2x45 мл). Водный слой подщелачивали до рН=13 добавлением 2 н. NaOH (60 мл) и экстрагировали добавлением CH2Cl2 (6x90 мл). Объединенные органические экстракты промывали насыщенным солевым раствором (75 мл) и сушили над MgSO4. Неочищенный материал, полученный после фильтрации и концентрации (5,44 г, 25,8 ммоль,91%), использовали без дополнительной очистки. МС (ЕС): m/z 211,0/213,0 (100/35) [МН+]. Время удерживания (способ В) = 5,1 мин. трет-Бутиловый эфир 4-(3-трифторметилбензил)-[1,4]диазепан-1-карбоновой кислоты (20.40). Применяли методику для соответствующего 3-хлорбензилпиперазина. Указанное в заголовке соединение получали в виде желтого масла (выход 87%). МС (ЕС): m/z 359,0 (81) [МН+]. Время удерживания (способ А) = 4,9 мин. 1-(3-Трифторметилбензил)-[1,4]диазепан (7.40). Применяли методику для соответствующего 3-хлорбензилпиперазина. Указанное в заголовке соединение получали в виде желтого масла (выход 93%) и использовали без дополнительной очистки. МС (ЕС): m/z 259,1 (100) [МН+]. Время удерживания (способ А) = 3,4 мин. Трет-Бутиловый эфир 4-бензил-цис-3,5-диметилпиперазин-1-карбоновой кислоты (20.16). Применяли методику для соответствующего 3-хлорбензилпиперазина. Указанное в заголовке соединение получали после хроматографии на силикагеле в виде желтого масла (выход 34%). 1 Н ЯМР (200 МГц, CDCl3)7,40-7,18 (м, 5 Н), 3,90-3,80 (м, 2 Н), 3,81 (с, 2 Н), 2,72-2,50 (м, 4 Н), 1,45(с, 9 Н), 1,04 (д, J=6,0 Гц, 6 Н). Общая методика для удаления Вос-групп путем добавления HCl/МеОН Ацетилхлорид (1,5 мл, 21 ммоль) добавляли по каплям в безводный метанол (8 мл) при температуре окружающей среды. Через 10 мин этот раствор добавляли к раствору Вос-защищенного амина (0,9 ммоль) и перемешивали реакционную смесь при температуре окружающей среды. После полного расхода исходного материала, подтвержденного по методу ТСХ, растворители выпаривали. Остаток (амингидрохлорид) сразу применяли для получения амида. 1-Бензил-цис-2,6-диметилпиперазиндигидрохлорид (7.16). Следуя общей методике, указанное в заголовке соединение получали из трет-бутилового эфира 4 бензил-цис-3,5-диметилпиперазин-1-карбоновой кислоты в виде бежевого твердого вещества (колич.). МС (ES, свободное основание): m/z 205,1 (100) [МН+]. Время удерживания (способ В, свободное основание) = 5,8 мин. трет-Бутиловый эфир бис-(2-хлорэтил)карбаминовой кислоты (16). К суспензии бис-(2-хлорэтил)амингидрохлорида (10,05 г, 56,3 ммоль) и Вос 2 О (13,6 г, 62,3 ммоль) вCH2Cl2 (70 мл), охлажденном ледяной водой, добавляли триэтиламин (9,5 мл, 68,2 ммоль). Через 45 мин охлаждающую баню удаляли и перемешивали реакционную смесь при температуре окружающей среды в
МПК / Метки
МПК: A61P 9/00, A61K 31/535, C07D 473/00, A61K 31/505, A61K 31/495, C07D 413/00, A61K 31/55, A61K 31/50, C07D 239/02, C07D 403/00, C07D 243/08
Метки: пиримидиновые, синтез, относящиеся, селективным, применение, антагонистам, соединения
Код ссылки
<a href="https://eas.patents.su/30-7468-pirimidinovye-soedineniya-otnosyashhiesya-k-a2b-selektivnym-antagonistam-ih-sintez-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Пиримидиновые соединения, относящиеся к а2b – селективным антагонистам, их синтез и применение</a>
Предыдущий патент: Применение cd23 антагонистов для лечения опухолевых заболеваний
Следующий патент: Антитела, блокирующие cripto, и их применения
Случайный патент: Способ идентификации