Нафтильные соединения, промежуточные соединения для их получения, применение нафтильных соединений, способ снижения холестерина
Номер патента: 1600
Опубликовано: 25.06.2001
Авторы: Джонс Чарльз Д., Палковиц Алан Д., Брайант Генри У., Кроуелл Томас А.
Формула / Реферат
1. Соединение формулы I
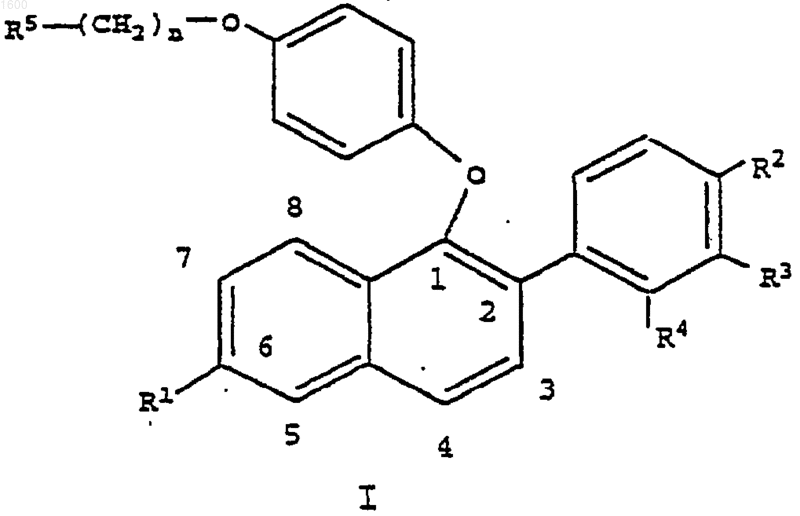
где R1 является -Н, -ОН, -O(С1-С4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr; где Аr является фенилом или замещенным фенилом, OCO(С1-С6-алкилом), -O(СО)O(С1-С6-алкилом) или -ОSО2(С4-С6-алкилом);
R2 является -Н, -F, -Cl, -ОН, -О(С1-С4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом, -OCO(С1-С6-алкилом), -O(СО)O(С1-С6-алкилом) или -ОSО2(С4-С6-алкилом);
R3 и R4 независимо являются -Н, -F, -Cl, -СН3, -ОН, -O(С1-С4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -ОСО(С1-С6-алкилом), -O(СО)O(С1-С6-алкилом) или -OSO2(С4-С6-алкилом), при условии, что как R3, так и R4 не могут быть водородом;
n равно 2 или 3; и
R5 является 1-пиперидинилом, 1-пирролидинилом, метил-1-пирролидинилом, диметил-1-пирролидинилом, 4-морфолино, диметиламино, диэтиламино или 1-гексаметиленимино;
или его фармацевтически приемлемая соль или сольват.
2. Соединение по п.1, отличающееся тем, что R1 и R3 являются -ОН.
3. Соединение по п.1, отличающееся тем, что R1 является гидрокси и R3 является метокси.
4. Соединение по п.1, отличающееся тем, что R1 является метокси и R3 является гидрокси.
5. Соединение по п.1, отличающееся тем, что n равно 2 и R5 является 1-пиперидинилом.
6. Соединение по п.1, отличающееся тем, что указанная соль является гидрохлоридной солью.
7. Соединение по п.1, отличающееся тем, что R1 и R3 являются -ОН, R5 является пиперидинилом, n равно 2 и его указанная соль является гидрохлоридной солью.
8. Соединение по п.1, отличающееся тем, что R1 является гидрокси, R3 является метокси, R5 является пиперидинилом, n равно 2 и его указанная соль является гидрохлоридной солью.
9. Соединение по п.1, отличающееся тем, что R1 является метокси, R3 является гидрокси, R5 является пиперидинилом, n равно 2 и его указанная соль является гидрохлоридной солью.
10. Соединение по п.1, отличающееся тем, что выбрано из группы, состоящей из
1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-метоксифенил)-6-метоксинафталин гидрохлорида;
1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-метоксифенил) нафталин гидрохлорида;
1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-гидроксифенил)-6-гидроксинафталин гидрохлорида;
1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-гидроксифенил)нафталин гидрохлорида;
1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-гидроксифенил)-6-метоксинафталин гидрохлорида и
1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-метоксифенил)-6-гидроксинафталин гидрохлорида.
11. Применение соединения по любому из пп.1-10 или его фармацевтически приемлемой соли или сольвата для ингибирования остеопороза или резорбции кости у больного.
12. Применение соединения по п.11, отличающееся тем, что остеопороз или резорбция кости обусловлены менопаузой или овариэктомией.
13. Применение по п.11 или 12, отличающееся тем, что пациентом является женщина постклимактерического периода.
14. Применение соединения по любому из пп.1-10 или его фармацевтически приемлемой соли или сольвата для снижения у больного уровня холестерина в сыворотке крови.
15. Способ снижения холестерина в сыворотке крови, включающий введение больному, в случае такой необходимости, эффективного количества соединения по п.1 или его фармацевтически приемлемой соли или сольвата.
16. Соединение формулы II
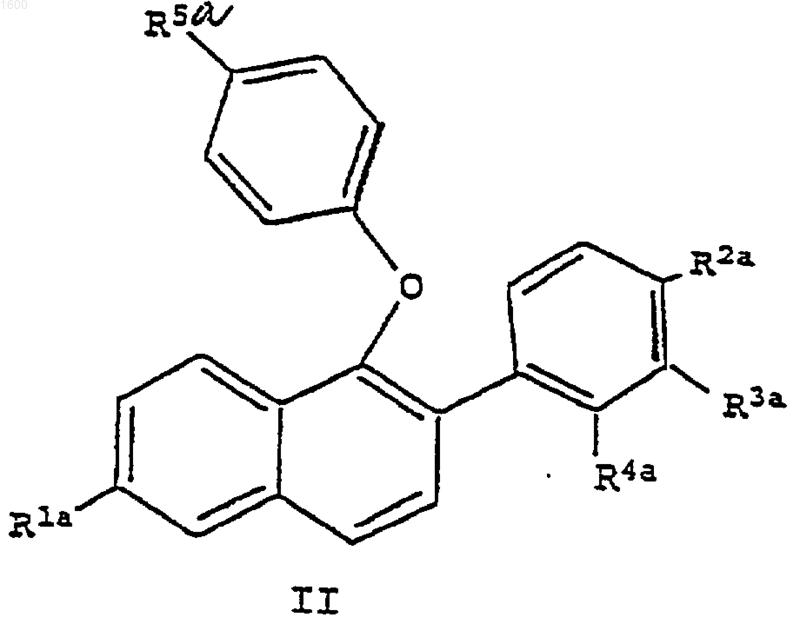
где R1а является -Н или -OR6, где R6 является гидроксизащитной группой;
R2a является -Н, -F, -Cl, -ОН, -O(С1-С4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом, -OCO(С1-С6-алкилом), -O(CO)O(С1-С6алкилом) или -OSO2(С4-С6-алкилом );
R3a является -Н, -F, -Cl или -OR7, где R7 является гидроксизащитной группой;
R4a является -Н, -F, -Cl, -СН3, -ОН, -О(С1-С4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом, -OCO(С1-С6-алкилом), -О(СО)O(С1-С6-алкилом) или -OSO2(С4-С6-алкилом), при условии, что как R3a, так и R4a не могут быть водородом;
R5a является -ОН, -COW или -O(CO)W и W является -Н или С1-С6-алкилом;
или его фармацевтически приемлемая соль или сольват.
17. Соединение по п.16, отличающееся тем, что R1a является -OR6 и R2a является -OR7.
18. Соединение формулы III
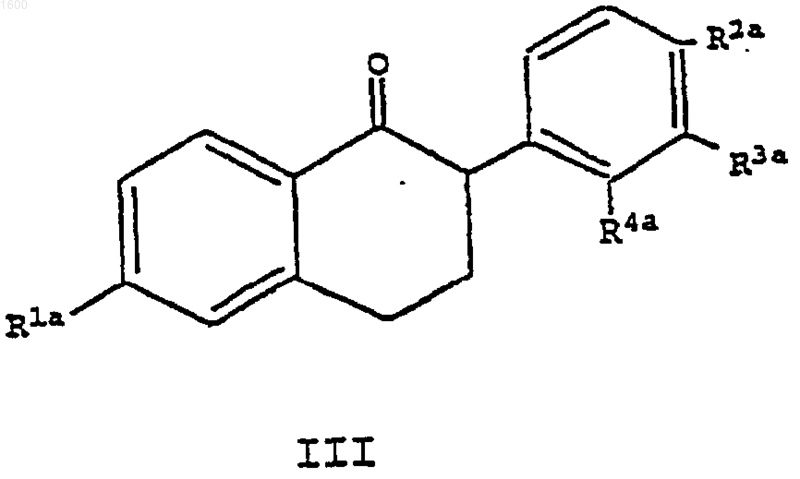
где R1a является -Н или -OR6, где R6 является гидроксизащитной группой;
R2a является -Н, -F, -Cl, -ОН, -O(С1-С4-алкилом) , -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом, -OCO(С1-С6-алкилом), -O(СО)O(С1-С6-алкилом) или -OSO2(С4-С6-алкилом);
R3a и R4a независимо являются -Н, -F, -Cl, -СН3, -ОН, -O(С1-С4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом, -OCO(С1-С6-алкилом), -O(СО)O(С1-С6-алкилом) или -OSO2(C4-С6-алкилом), при условии, что как R3a, так и R4a не могут быть водородом.
19. Соединение формулы IV
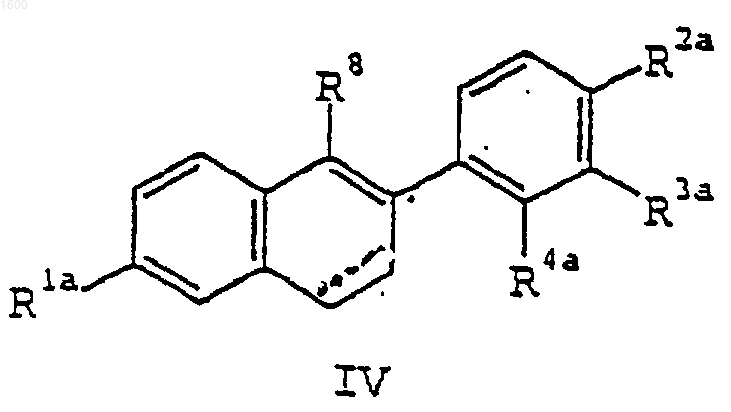
где R1a является -Н или -OR6, где R6 является гидроксизащитной группой;
R2a является -Н, -F, -Cl, -ОН, -O(С1-С4-aлкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом, -OCO(С1-С6-алкилом), -О(СО)О(С1-С6-алкилом) или -ОSО2(С4-С6-алкилом);
R3a является -Н, -F, -Cl или -OR7, где R7 является гидроксизащитной группой;
R4a является -Н, -F, -Cl, -СН3, -ОН, -О(С1-С4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом, -OCO(С1-С6-алкилом), -О(СО)О(С1-С6-алкилом) или -OSO2(С4-С6-алкилом), при условии, что как R3a, так и R4a не могут быть водородом;
R8 является -ОН, или -ОСО(С1-С6-алкилом);
где пунктирная линия представляет собой необязательную ненасыщенность;
или его фармацевтически приемлемая соль или сольват.
20. Соединение формулы VI
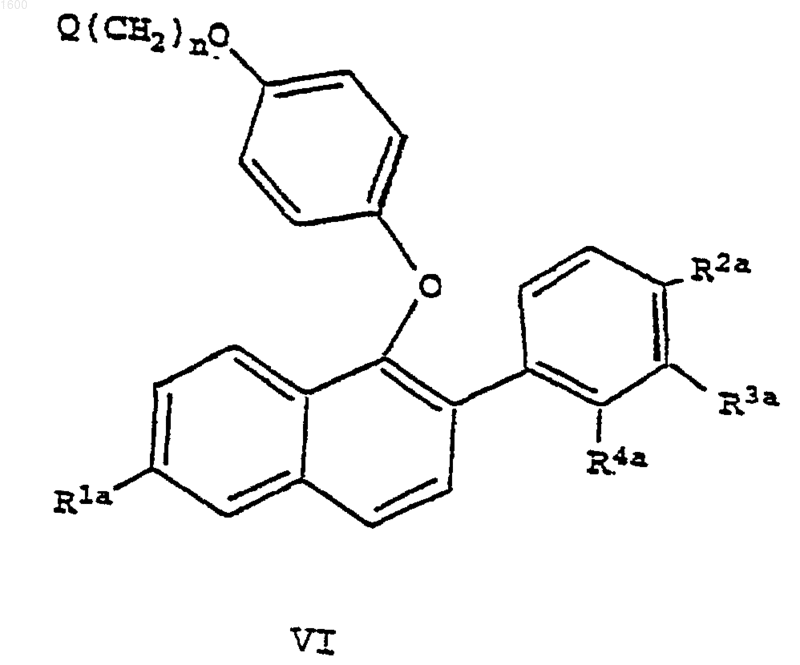
где R1a является -Н или -OR6, уфх R6 является гидроксизащитной группой;
R2a является -Н, -F, -Cl, -ОН, -O(С1-С4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом, -OCO(С1-С6-алкилом), -О(СО)O(С1-С6-алкилом) или -OSO2(С4-С6-алкилом);
R3a является -Н, -F, -Cl или -OR7, где R7 является гидроксизащитной группой;
R4a является -Н, -F, -Cl, -СН3, -ОН, -O(С1-С4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом, -OCO(С1-С6-алкилом), -О(СО)O(С1-С6-алкилом) или -OSO2(С4-С6-алкилом), при условии, что как R3a, так и R4a не может быть водородом;
n равно 2 или 3 и
Q является отщепляемой группой;
или его фармацевтически приемлемая соль или сольват.
Текст
1 Остеопороз охватывает группу заболеваний, которые являются результатом различных этиологий, но которые характеризуются чистой потерей костной массы в единице объема. Следствием такой потери костной массы и получающегося в результате перелома костей является невозможность обеспечения скелетом соответствующей опоры тела. Один из наиболее часто встречающихся видов остеопороза связан с менопаузой. Большинство женщин в течение времени от 3-х до 6-ти лет после прекращения менструации теряют от около 20% до около 60% костной массы в трабекулярной части кости. Такая быстрая потеря обычно связана с увеличением резорбции кости и остеогенезом. Однако доминирующим является резорбционный цикл,в результате которого происходит чистая потеря костной массы. Остеопороз является серьезным распространенным заболеванием у женщин постклимактерического периода. Только в Соединенных Штатах насчитывается 25 миллионов женщин, пораженных этим заболеванием. В результате остеопороза причиняется большой вред человеку и возникают большие экономические потери вследствие хронического характера болезни и необходимости оказания интенсивной и долговременной поддержки (госпитализации и домашнего ухода за больным) при возникновении осложнений болезни. Это в особенности касается больных пожилого возраста. Кроме того, хотя обычно остеопороз не считают состоянием, представляющим опасность для жизни, коэффициент смертности пожилых женщин в результате перелома костей тазобедренного сустава составляет от 20 до 30%. Большой процент коэффициента смертности может быть непосредственно связан с постменопаузальным остеопорозом. Наиболее чувствительной в кости тканью к действию постменопаузального остеопороза является губчатая кость. Эту ткань часто относят к губчатому слою кости или к губчатому веществу кости, и она в особенности сконцентрирована около концов кости (рядом с суставами) и в позвонках позвоночного столба. Трабекулярная ткань характеризуется немногочисленными остеоидными структурами, которые взаимосвязаны друг с другом, а также более твердой и плотной кортикальной тканью, которая составляет наружную поверхность и центральное тело кости. Такая взаимосвязанная сетчатая структура трабекул обеспечивает горизонтальную опору наружной кортикальной структуре и является крайне необходимой для биомеханической прочности всей структуры в целом. При постменопаузальном остеопорозе к повреждению и перелому кости приводит, главным образом, чистая резорбция и разрежение трабекул. С точки зрения разрежения трабекул у женщин постклимактерического периода неудивительно, что большинство встречающихся переломов связано с костями, которые в значи 001600 2 тельной мере зависят от трабекулярной опоры,например с позвонками, шейкой массонесущих костей, таких как бедренная кость и предплечье. В действительности признаками постменопаузального остеопороза являются перелом кости тазобедренного сустава, классический перелом лучевой кости (перелом Коллиса) и переломы позвоночника. Наиболее приемлемым методом лечения постменопаузального остеопороза является эстрогензаместительная терапия. Несмотря на то,что эта терапия является обычно успешной, соблюдение больным режима и схемы лечения при такой терапии является затрудненным в основном из-за того, что эстрогенное лечение часто оказывает нежелательное побочное действие. Дополнительным методом лечения является введение бисфосфонатного соединения, например, такого, как Fosamax (MerckCo.,Inc) (Мерк и Ко., Инк). В предклимактерическом периоде заболеваемость женщин сердечно-сосудистыми заболеваниями реже, чем у мужчин того же возраста. Однако после менопаузы скорость распространения сердечно-сосудистых заболеваний у женщин медленно возрастает и соответствует степени заболевания у мужчин. Такая утрата защиты связана с потерей эстрогена и, в частности, с потерей эстрогеном способности регулировать содержание липидов в сыворотке крови. Происхождение способности эстрогена регулировать содержание липидов в сыворотке крови является не совсем понятным, но факты до настоящего времени указывали на то, что эстроген может регулировать в печени рецепторы липидов низкой плотности (ЛНП), удаляя тем самым избыток холестерина. Кроме того, было показано, что эстроген оказывает действие на биосинтез холестерина и другое благоприятное воздействие на состояние сердечно-сосудистой системы. В литературе сообщалось, что содержание липидов в сыворотке крови у подвергнутых эстрогензаместительной терапии женщин, возвращается к концентрациям, которые были в предклимактерическом состоянии. Поэтому эстрогенное лечение является приемлемым способом лечения этого состояния. Однако побочное действие эстрогензаместительной терапии является неприемлемым для многих женщин, ограничивая тем самым применение этой терапии. Идеальным средством для лечения этого состояния будет средство, которое регулирует содержание липидов в сыворотке крови аналогично эстрогену, но которое позволяет избежать побочных действий и риска, связанных с эстрогенной терапией. В ответ на острую необходимость в новых лекарственных средствах, которые способны облегчить, между прочим, симптомы постменопаузального синдрома, настоящее изобретение предусматривает нафтильные соединения, со 3 держащие их лекарственные препараты и способы применения таких соединений для лечения постменопаузального синдрома и других, связанных с эстрогеном патологических состояний,например таких, которые упомянуты ниже. Поэтому обеспечение новых замещенных нафтильных соединений, пригодных, например,для ингибирования, лечения или профилактики указанных болезненных состояний, представляет собой значительный вклад в развитие данной области. Настоящее изобретение предусматривает соединения формулы IR1 является -Н, -ОН, -O(С 1-С 4-алкилом),-ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом, -ОСО(С 1 С 6-алкилом),-О(СО)О(С 1-С 6-алкилом) илиR2 является -Н, -F, -Cl, -ОН, -О(С 1-С 4 алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом,-ОСО(С 1-С 6-алкилом), О(СО)О(С 1-С 6-алкилом) или -ОSО 2(С 4-С 6-алкилом);R3 и R4 независимо являются -Н, -F, -Cl,-СН 3, -ОН, -O(C1-С 4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом,-ОСО(С 1-С 4-алкилом) , -О(СО)О(С 1-С 6-алкилом) или-ОSО 2(С 4-С 6-алкилом) при условии, что обаR3 и R4 не могут быть водородом;R5 является 1-пиперидинилом, 1-пирролидинилом, метил-1-пирролидинилом, диметил 1-пирролидинилом, 4-морфолино, диметиламино, диэтиламино или 1-гексаметиленимино; или их фармацевтически приемлемые соли или сольваты. Настоящее изобретение также предусматривает промежуточные соединения, которые являются пригодными для получения фармацевтически активных соединений настоящего изобретения. Кроме того, настоящее изобретение предусматривает лекарственные препараты, содержащие соединения формулы I, необязательно содержащие эффективное количество дополнительного терапевтического средства, выбранного из группы, состоящей из эстрогена, прогестина, бисфосфоната, паратиреоидного гормона(РТН) и их подкомбинаций. Настоящее изобретение предусматривает также способы применения соединений формулы I. 4 Предусмотрены также промежуточные соединения, пригодные в синтезе соединений формулы I, которые включают соединения формулы IIR2a является -Н, -F, -Cl, -ОН, -О(С 1-С 4 алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом,-ОСО(С 1-С 6-алкилом), -О(СО)О(С 1-С 6-алкилом) или -OSO2(С 4-С 6-алкилом);R4a является -Н, -F, -Cl, -СН 3, -ОН, -О(С 1 С 4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом,-ОСО(С 1-С 6-алкилом), -О(СО)О(С 1-С 6-алкилом) или -OSO2(С 4-С 6-алкилом), при условии, что обаR3a и R4a не могут быть водородом;W является -Н или C1-С 6-алкилом; или их фармацевтически приемлемые соли или сольваты. Настоящим изобретением предусмотрены также промежуточные соединения формулы III,которые являются пригодными для получения фармацевтически активных соединений настоящего изобретения.R2a является -Н, -F, -Cl, -ОН, -О(С 1-С 4 алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -ОСО(С 1-С 6-алкилом),-О(СО)О(С 1-С 6-алкилом) илиR3a и R4a независимо являются -Н, -F, -Cl,-СН 3, -ОН, -O(C1-С 4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом,-ОСО(С 1-С 6-алкилом), -О(СО)О(С 1-С 6-алкилом) или -ОSО 2(С 4-С 6-алкилом), при условии, что обаR3a и R4a не могут быть водородом. Настоящим изобретением дополнительно предусмотрены промежуточные соединения формулы IV, которые являются пригодными для 5 получения фармацевтически активных соединений настоящего изобретенияR2a является -Н, -F, -Cl, -ОН, -О(С 1-С 4 алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -OCO(С 1-С 6-алкилом),-OSO2(С 4-С 6-О(СО)О(С 1-С 6-алкилом) или алкилом);R4a является -Н, -F, - Cl, -СН 3, -ОН, -O(С 1 С 4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -OCO(C1-C6 алкилом),-О(СО)О(С 1-С 6-алкилом) или-ОSО 2(С 4-С 6-алкилом), при условии, что оба R3a и R4a не могут быть водородом;R8 является -ОН или -ОСО(С 1-С 6 алкилом); где пунктирная линия представляет собой необязательную ненасыщенность; или их фармацевтически приемлемые соли или сольваты. Настоящим изобретением также предусмотрены промежуточные соединения формулы VI, которые являются пригодными для получения фармацевтически активных соединений настоящего изобретения:R2a является -Н, -F, -Cl, -ОН, -О(С 1-С 4 алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -ОСО(С 1-С 6-алкилом),-О(СО)О(С 1-С 6-алкилом) илиR4a является -Н, -F, -Cl, -СН 3, -ОН, -О(С 1 С 4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом,ОСО(С 1-С 6-алкилом), -О(СО)О(С 1-С 6-алкилом) или-ОSО 2(С 4-С 6-алкилом), при условии, что обаR3a и R4a не могут быть водородом; иQ является отщепляемой группой; или их фармацевтически приемлемые соли или сольваты. Общие термины, применяемые при описании указанных соединений, имеют обычные значения. Так например, С 1-С 4-алкил отно 001600 6 сится к прямым или разветвленным алифатическим цепям, содержащим от 1 до 4-х атомов углерода, включающим метил, этил, пропил,изопропил, н-бутил и подобные; и С 1-С 6 алкил, кроме таких групп, как пентильная,изопентильная, гексильная и подобные, охватывает группы, включенные в определение С 1-С 4 алкила. Термин замещенный фенил относится здесь к фенильной группе, имеющей один или несколько заместителей, выбранных из группы,состоящей из С 1-С 4-алкила, С 1-С 3-алкокси, гидрокси, нитро, хлора, фтора, три(хлор или фтор)метила и подобных групп. С 1-С 4 алкокси относится к С 1-С 4-алкильной группе,присоединенной посредством кислородного мостика, и представляет собой, например, метокси, этокси, н-пропокси и изопропокси, бутокси и подобные группы. Из С 1-С 4 алкоксигрупп наиболее предпочтительной является метоксигруппа. Термин ингибирует включает его обычное общепринятое значение, которое включает препятствование, предотвращение, сдерживание и замедление, прекращение или обратное развитие, или уменьшение интенсивности или действия симптомов заболевания. Предпочтительными вариантами настоящего изобретения являются гидрохлорид 1-[4[2-(1-пиперидинил)этокси]фенокси]-2-(3-гидроксифенил)-6-гидроксинафталина, например, гдеR1 и R3 являются гидрокси, R5 является пиперидинилом и его гидрохлоридная соль; и гидрохлорид 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-метоксифенил)-6-гидроксинафталина,например, где R1 является гидрокси, R3 является метокси, R5 является пиперидинилом и его гидрохлоридная соль. Пояснительные примеры соединений настоящего изобретения включают следующие соединения, но не только их: гидрохлорид 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-метоксифенил)-6-метоксинафталина,гидрохлорид 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-метоксифенил)нафталина,гидрохлорид 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-гидроксифенил)-6-гидроксинафталина,гидрохлорид 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-гидроксифенил)нафталина,гидрохлорид 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-гидроксифенил)-6-метоксинафталина и гидрохлорид 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-метоксифенил)-6-гидроксинафталина. Исходным материалом для получения соединений настоящего изобретения являются соединения формулы IIIR2a является -Н, -F, -Cl, -ОН, -О(С 1-С 4 алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -О(СО)ОАr, где Аr является фенилом или замещенным фенилом,-ОСО(С 1-С 6-алкилом), О(СО)О(С 1-С 6-алкилом) или -OSO2(С 4-С 6-алкилом);R3a и R4a независимо являются -Н, -F, -Cl,-СН 3, -ОН, -O(C1-С 4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом,-О(СО)ОАr, где Аr является фенилом или замещенным фенилом,-ОСО(С 1-С 6-алкилом),или ОSО 2(С 4-С 6-О(СО)О(С 1-С 6-алкилом) алкилом), при условии, что оба R3a и R4a не могут быть водородом. Соединения формулы III, где, по меньшей мере, два из заместителей R2a, R3a и R4a являются водородом, хорошо известны в данной области, и их получают по существу так, как описаноBoyle et al., в патенте США 4910212, который включен в описание в качестве ссылки. Смотри также Collins, D.J., et al., Aust. J.Chem., 41: 745756 (1988); и Collins, D.J. et al., Aust. J. Chem.,37: 22 2279-2294 (1984). Обычно при получении соединений настоящего изобретения кетон формулы III ароматизируют, получая тем самым фенол формулыIVc, который, в свою очередь, взаимодействует с 4-галогенбензальдегидом с получением простого биарильного эфира формулы IIа, который,в свою очередь, превращают в фенол формулыIIb. Такой путь синтеза показан ниже на схеме I,где R1a, R2a, R3a и R4a являются такими, как они определены выше. На первой стадии способа настоящего изобретения соединение формулы III превращают в фенол формулы IVc посредством трхступенчатого процесса, который по существу описанWang G., et al., M. Syn. Commun., 21:989(1991). Кетон формулы III no существу енолизируют путм нагревания с обратным холодильником раствора ацетиленолевого сложноэфирного растворителя в присутствии кислотного катализатора. Полученный енолацетат непосредственно превращают в нафтолацетат, который затем гидролизуют до образования фенола формулыIVc. При превращении кетона формулы III в его соответствующий енолацетат могут быть использованы различные известные кислотные катализаторы. Предпочтительными являются неводные кислоты и в особенности предпочтительной является р-толуолсульфоновая кислота. Предпочтительным ацетиленолевым сложно 001600 8 эфирным растворителем является изопропенилацетат. Когда опыт осуществляют в колбе с обратным холодильником, для завершения настоящей реакции необходимо от около 6 до около 48 часов. Полученный в результате этой реакции енольный продукт не выделяют, а по завершении реакции полученный раствор обрабатывают соответствующим окислителем и оптимально нагревают с обратным холодильником в течение времени от около 1 до около 3-х часов. Для второй ступени первой стадии реакции, показанной на схеме I, подходящие окислители ограничены окислителями, известными в данной области, которые могут привести к элиминированию водорода из насыщенной системы с получением ароматизированной системы. Такие окислители включают, например, катализаторы дегидрирования, например платину, палладий и никель, элементарную серу и селен и хиноны. Для настоящей заявки предпочтительными являются хиноновые окислители, в особенности 2,3-дихлор-5,6-дициано-1,4 бензохинон (DDQ). Для осуществления настоящей ступени способа необходимо от около 1 до около 2-х эквивалентов DDQ на эквивалент субстрата. Схема I Полученный продукт настоящей ступени,представляющий собой сложный 1-нафтоловый эфир, затем подвергают гидролизу для получения соединения формулы IVc, после чего первая стадия способа, показанного на схеме I, завершается. Ступень гидролиза осуществляют посредством кислотного или основного гидролиза субстрата в полярном протонном растворителе, 9 например в воде или в одном или нескольких растворителях, содержащих спирт, например метанол или этанол. К раствору для способствования растворимости может быть также добавлен сорастворитель, например, тетрагидрофуран(ТГФ) или диоксан. Соответствующие основания для этой ступени включают гидроксид натрия, гидроксид калия, гидроксид лития и подобные основания. Подходящие кислоты включают, например, хлористоводородную кислоту,метансульфоновую кислоту, р-толуолсульфоновую кислоту и подобные кислоты. Предпочтительной кислотой является хлористоводородная кислота. Конечную ступень первой стадии способа,показанной выше на схеме I, можно осуществить при температуре окружающей среды в течение короткого периода времени, обычно в течение времени от около 1 до около 12 ч. Завершение настоящей реакции можно определить посредством стандартных хроматографических методов, например, посредством тонкослойной хроматографии. На второй стадии схемы I фенол формулыIVc сначала взаимодействует с основанием, после чего для получения простого биарильного эфира формулы На осуществляют добавление 4 галогенбензальдегида или 4-галогенбензокетона в полярном апротонном растворителе в инертной атмосфере, например, под азотом. Эта реакция является хорошо известной в данной области и е осуществляют по существу так, как это описано Yeager, G.W., et al., Synthesis, 63 (1991). Более конкретно, 1 эквивалент соединения формулы IVc сначала обрабатывают, по меньшей мере, 1 эквивалентом гидрида или карбоната щелочного металла в соответствующем растворителе, после чего добавляют по каплям 4 галогенбензальдегида в том же самом растворителе, который использовали с субстратом. Подходящими растворителями для этой реакции являются такие растворители или смесь растворителей, которые остаются инертными в течение всего времени протекания реакции. Предпочтительным является N,N-диметилформамид(ДМФ), в особенности его безводная форма. В качестве необходимого основания предпочтительно применяют гидрид натрия, а в качестве предпочтительного 4-галогенбензальдегида используют 4-фторбензальдегид. Применяемая на стадии настоящего способа температура должна быть достаточной для завершения этой реакции без образования нежелательных побочных продуктов. Предпочтительный диапазон температур для этой реакции составляет от около 30 С до около 100 С. При предпочтительных условиях реакции посредством предпочтительного способа соединение формулы IIа будет получено в течение времени от около 24 до около 48 ч. Конечная реакция, показанная на схеме I,представляющая собой превращение альдегид 001600 10 ной группы соединения формулы IIа в фенольную группу, в результате которой образуется,таким образом, соединение формулы IIb, хорошо известна в данной области как реакция окисления Байера-Виллигера. Смотри, например, Fiesers, L., et al., Reagents for Organic Synthesis, 1:467, Wiley (New York, 1967); Hassall,C.H., Organic Reaction, 9:73-106 (Wiley, NewYork, 1967). Настоящая реакция в общем включает взаимодействие бензальдегида с перкислотой,например, перуксусной кислотой или mхлорпербензойной кислотой в инертном растворителе, например, в хлороформе или метиленхлориде. Продукт этой реакции сложный формиатный эфир может быть затем легко гидролизован до получения требуемого фенола. Смотри,например, выше Yeager, et al.; Godfrey, I.M., et(1970). Предпочтительный вариант настоящей реакции описан Matsumoto, M., et al., J. Org.Chem., 49:4741 (1984). Этот способ включает взаимодействие бензальдегида формулы IIа с 30% пероксидом водорода, взятым в количестве, равном по меньшей мере, от 1 до около 2-х эквивалентов, в спиртовом растворителе, и в присутствии каталитической кислоты. При таких условиях непосредственно образуется фенол, и поэтому нет необходимости в дополнительной стадии гидролиза. Для настоящей реакции предпочтительным растворителем и кислотным катализатором являются соответственно метанол и концентрированная серная кислота. При предпочтительных условиях реакции превращение соединения формулы II в соединение формулы IIb завершается после перемешивания при температуре окружающей среды в течение времени от около 12 до около 48 ч. При получении фармацевтически активных соединений формулы I настоящего изобретения в качестве промежуточных соединений являются пригодными соединения формулы II,IIа и IIb. После получения соединения формулыR5-(CH2)n-Q v 5 где R и n являются такими, как они определены выше, и Q является отщепляемой группой, например, такой, как мезилат, тозилат, хлор или бром, при этом предпочтительной группой является бром, с образованием соединения формулы Iа. Затем если в соединении формулы Iа присутствуют гидроксизащитные группы R6 и/или R7, их удаляют и образуется соединение формулы Ib. Эти стадии способа показаны ниже на схеме II. где R1a, R2a, R3a, R4a, R5 и n являются такими, как они определены выше.R3b является -Н, -ОН или -F или -Сl,или его фармацевтически приемлемые соли или сольваты. На первой стадии способа, показанного на схеме II, алкилирование проводят посредством стандартных методик. Соединения формулы V являются коммерчески доступными или их получают средствами, хорошо известными специалистам в данной области. Предпочтительно используют гидрохлоридную соль соединения формулы V, в особенности гидрохлорид 2 хлорэтилпиперидина. Обычно, по меньшей мере, примерно 1 эквивалент соединения формулы IIb взаимодействует с 2-мя эквивалентами соединения формулыV в присутствии, по меньшей мере, около 4-х эквивалентов карбоната щелочного металла,предпочтительно карбоната цезия, и соответствующего растворителя. Растворителями для этой реакции являются такие растворители или смесь растворителей, которые остаются инертными в течение всего времени протекания реакции. Предпочтительным является N,N-диметилформамид, в особенности его безводная форма. Применяемая на этой стадии температура должна быть достаточной для осуществления завершения реакции алкилирования. Обычно достаточной и предпочтительной является температура окружающей среды. Настоящая реакция предпочтительно протекает в инертной атмосфере, в частности, в атмосфере азота. При предпочтительных условиях реакции эта реакция протекает до завершения в течение времени от около 16 до около 20 ч. Развитие реакции можно контролировать посредством стандартных хроматографических методов. В качестве альтернативного способа получения соединений формулы Iа, соединение формулы IIb взаимодействует с избытком алкилирующего агента формулы VII в щелочном растворе как показано ниже на схеме III:VII где n равно 2 или 3, и Q' и Q являются одинаковыми или разными отщепляемыми группами. где R1a, R2a, R3a, R4a, R5 и n являются такими, как они определены выше. Соответствующие отщепляемые группы включают сульфонаты, например, метансульфонат, 4-бромбензолсульфонат, толуолсульфонат, этансульфонат, изопропилсульфонат, 4 метоксибензолсульфонат, 4-нитробензолсульфонат, 2-хлорбензолсульфонат, трифлат и подобные группы, галогены, например бром, хлор и иод; и другие родственные отщепляемые группы. Предпочтительными отщепляемыми группами являются галогены, и в особенности предпочтительным является бром. Предпочтительный щелочный раствор для этой реакции алкилирования содержит карбонат калия в инертном растворителе, например, таком как метилэтилкетон (МЭК) или (ДМФ). В этом растворе 4-гидроксигруппа бензоильного фрагмента соединения формулы IIb существует в виде феноксид-иона, который замещает одну из отщепляемых групп алкилирующего агента. Эта реакция протекает наиболее благоприятно, когда содержащий реагенты щелочной раствор нагревают в колбе с обратным холодильником и обеспечивают протекание реакции до е завершения. При применении в качестве предпочтительного растворителя МЭК время протекания реакции обычно составляет от около 6 до около 20 ч. Продукт реакции с этой стадии затем взаимодействует с эквивалентным или избыточным количеством 1-пиперидина, 1 пирролидина, метил-1-пирролидина, диметил-1 пирролидина, 4-морфолина, диметиламина, диэтиламина или 1-гексаметиленимина посредством стандартных методик с образованием соединений формулы Iа. Протекание реакции можно облегчить путм добавления сильного основания, например третичного алкиламина или неорганического основания, например К 2 СО 3, Сs2 СО 3 и подобных оснований. Предпочтительно гидрохлоридная соль пиперидина взаимодействует с алкилированным соединением формулы IIb в инертном растворителе, например, таком как безводный ДМФ, в присутствии Сs2 СО 3, при этом смесь нагревают до температуры в диапазоне от около 60 С до около 110 С. Когда смесь нагревают до предпочтительной температуры около 90 С, время протекания реакции составляет лишь от около 30 до около 1 ч. Однако изменение реакционных ус 13 ловий будет оказывать влияние на количество времени, необходимое для протекания реакции до е завершения. Конечно, развитие этой стадии реакции можно контролировать посредством стандартных хроматографических методов. Гидроксисоединения формулы I получают путм отщепления защитных групп R6 и R7 для гидрокси, в случае их присутствия, от соединений формулы 1 а посредством хорошо известных методов. Многочисленные реакции, предназначенные для образования и удаления таких защитных групп, описаны в ряде учебников,включающих, например, Protective Groups inand The Peptides, Vol. I, Schrooder and Lubke,Academic Press (London and New York, 1965). Способы нерегиоселективного удаления предпочтительных гидроксизащитных групп R6 и/или R7, в особенности метильной, являются по существу такими, которые описаны ниже в примерах 2 и 4. Соединения формулы I, в которых R1 и R3 являются соответственно метокси и гидрокси,получают путм селективного расщепления 3'метоксигруппы (смотри ниже пример 5). Методика расщепления метоксильной группы в 3'положении включает взаимодействие 6-,3'диметоксисоединения с реагентом деметилирования, выбранным из группы, состоящей из трибромида бора, трихлорида бора или трииодида бора, или с АlСl3 и различными тиольными реагентами, например, EtSH. Реакцию проводят в инертной атмосфере, например в атмосфере азота, с одним или несколькими молями реагента на моль подлежащей расщеплению метоксильной группы. Для этой реакции подходящими растворителями являются такие растворители или смесь растворителей, которые остаются инертными в течение всего времени протекания реакции деметилирования. Предпочтительными являются галогенированные растворители, например, дихлорметан, 1,2-дихлорэтан и хлороформ, или ароматические растворители, например бензол и толуол. Применяемая в этой реакции настоящего способа температура должна быть достаточной для завершения реакции деметилирования. Однако для максимального селективного расщепления 3'-метоксильной группы и избежания образования нежелательных побочных продуктов, в особенности продукта,представляющего собой аналог 6,3'-дигидрокси,появляющегося в результате чрезмерного деметилирования, выгодно поддерживать температуру 0 С. При предпочтительных условиях реакции после перемешивания реакционной смеси в течение времени от около 1 до около 24-х ч будет образовываться селективно деалкилированный продукт. Предпочтительный вариант включает применение трибромида бора в количестве, равном примерно 1,5 моля, для взаимо 001600 14 действия с одним молем 6-,3'-диметоксисоединения в дихлорметане в атмосфере азота в течение времени от 1 до 4 ч при температуре 20 С. Соединения формулы I, в которых R1 и R3 являются соответственно гидрокси и метокси,получают путм региоселективного расщепления 6-метоксигруппы (смотри ниже пример 6). Методика региоселективного расщепления метоксильной группы в 6-положении включает взаимодействие 6-, 3'- диметоксисоединения с реагентом деметилирования, выбранным из группы, состоящей тиоалкильных соединений щелочного металла, например тиометилата натрия, тиометилата лития, тиоэтилата натрия,тиоэтилата лития, 2-пропантиолата натрия, 2 метилпропан-2-тиолата лития и подобных соединений. Реакцию проводят в инертной атмосфере, например в атмосфере азота, с одним или несколькими молями реагента на моль подлежащей расщеплению метоксильной группы. Для этой реакции подходящими растворителями являются такие растворители или смесь растворителей, которые остаются инертными в течение всего времени протекания реакции деметилирования. Предпочтительными являются такие растворители, которые облегчают протекание бимолекулярных нуклеофильных реакций замещения, например, N,N-диметилформамид(ДМФ), N,N-диметилацетамид (ДМАА), диметилсульфоксид (ДМСО) или N-метилпирролидинон (НМП), в особенности их безводные формы. В особенности предпочтительным является безводный N,N-диметилформамид. Для осуществления завершения реакции деметилирования необходима температура от около 80 С до 120 С. Однако для максимальной селективности расщепления 6-метоксильной группы и избежание образования нежелательных побочных продуктов и в особенности 6-,3'дигидроксисоединения, которое получается в результате чрезмерного деметилирования, температуру необходимо доводить до минимального значения. При предпочтительных условиях реакции после перемешивания реакционной смеси в течение времени от около 2 до около 8 ч будет образовываться селективно деалкилированный продукт. Предпочтительный вариант включает применение тиоэтилата лития в количестве, равном примерно 15 молям, для взаимодействия с одним молем 6-, 3'-диметоксисоединения в безводном ДМФ в атмосфере азота в течение 5 ч при температуре 107 С. Другие предпочтительные соединения формулы I получают путм замены гидроксильных групп в 6- и/или 3'-положении, в случае их присутствия, группой формулы -O-СО-(С 1-С 6 алкил) или -О-SО 2- (С 4-C6-алкил) посредством хорошо известных методик. Смотри, например,патент США 4358593. Когда требуется группа-O-СО(С 1-С 6-алкил) моно- или дигидроксисоединение формулы I взаимодействует с реаген 15 том, например, с ацетилхлоридом, бромидом,цианидом или азидом или с соответствующими ангидридом или со смесью ангидридов. Реакции обычно осуществляют в основном растворителе,например в пиридине, лутидине, хинолине или изохинолине или в третичноаминовом растворителе, например, в триэтиламине, трибутиламине, метилперидине и подобных растворителях. Реакции можно также осуществлять в инертном растворителе, например этилацетате,диметилформамиде, диметилсульфоксиде, диоксане, диметоксиэтане, ацетонитриле, ацетоне,метилэтилкетоне и подобных растворителях, к которому добавляют, по меньшей мере один эквивалент акцептора кислоты (исключая указанные ниже), например третичный амин. По желанию могут быть использованы катализаторы ациллирования, например, 4-диметиламинопиридин или 4-пирролидинопиридин. Смотри,например, Haslam, et al., Tetrahedron, 36:24092433 (1980). Настоящие реакции проводят при умеренных температурах, в диапазоне от около -25 С до около 100 С, часто в инертной атмосфере,например в атмосфере азота. Однако обычно для протекания реакции достаточной является температура окружающей среды. Ацилирование гидроксильной группы в 6-положении и/или в 3'-положении можно также осуществлять посредством реакции соответствующих карбоновых кислот в инертных органических растворителях, катализируемых кислотой. Обычно используют такие кислотные катализаторы, как серную кислоту, полифосфорную кислоту, метансульфоновую кислоту и подобные кислоты. Вышеупомянутые R1 и/или R3 группы соединений формулы I могут быть также получены путм образования активного сложного эфира соответствующей кислоты, например сложных эфиров, образованных посредством таких известных реагентов, как дициклогексилкарбодиимид, ацилимидазолы, нитрофенолы, пентахлорфенол, N-гидроксисукцинимид и 1-гидроксибензотриазол. Смотри, например Bull. Chem.Soc. Japan, 38:1979 (1965) и Chem. Ber. 788 и 2024 (1970). Каждый из вышеупомянутых способов,который обеспечивает группу -O-СО(С 1-С 6 алкил), осуществляют в указанных выше растворителях. Такие способы, которые не дают кислотный продукт в ходе реакции, не предусматривают применение акцептора кислоты в реакционной смеси. Когда является желательным соединение формулы I, в котором гидроксильную группу соединения формулы I, находящуюся в 6- и/или 3'-положении, превращают в группу формулы -O-SO2-(С 4-С 6-алкил), моноили дигидроксисоединение взаимодействует,например, с сульфоновым ангидридом или производным соответствующей сульфоновой кислоты, например, с сульфонилхлоридом, бромидом или с сульфониламмониевой солью, как 16 описано King and Monoir, J. Am. Chem. Soc.,97:2566-2567 (1975). Такие реакции осуществляют при условиях, которые описаны выше при обсуждении реакции с галогенангидридами кислот и подобными веществами. Термин "сольват" означает агрегат, который содержит одну или несколько молекул растворимого вещества, например соединения формулы I, с одной или несколькими молекулами растворителя. Хотя в способах настоящего изобретения может быть использована не содержащая основания форма соединений формулы I, предпочтительно получать и применять фармацевтически приемлемую солевую форму. Термин "фармацевтически приемлемая соль" или к солям присоединения кислоты, или к солям присоединения основания, которые, как известно, являются нетоксичными, и его обычно применяют в фармацевтической литературе. Фармацевтически приемлемые соли по сравнению с соединением, из которого они получены,обычно имеют повышенную растворимость и поэтому из них более легко получать препараты в виде жидкостей или эмульсий. Применяемые в способах этого изобретения соединения образуют, главным образом, фармацевтически приемлемые соли присоединения кислоты с множеством органических и неорганических кислот и включают физиологически приемлемые соли,которые часто применяют в фармацевтической химии. Такие соли также являются частью этого изобретения. Типичные неорганические кислоты, применяемые для образования таких солей,включают хлористоводородную, бромистоводородную, иодистоводородную, азотную, серную,фосфорную, фосфорноватую и подобные кислоты. Могут быть также использованы соли, полученные из органических кислот, например, из алифатических моно- и дикарбоновых кислот,фенилзамещнных алкановых кислот, гидроксиалкановых и гидроксиалкандиовых кислот, ароматических кислот, алифатических и ароматических сульфоновых кислот. Такие фармацевтически приемлемые соли включают, таким образом, ацетат, фенилацетат, трифторацетат, акрилат, аскорбат, бензоат, хлорбензоат, динитробензоат, гидроксибензоат, метоксибензоат, метилбензоат, о-ацетоксибензоат, нафталин-2 бензоат, бромид, изобутират, фенилбутират, гидроксибутират, бутин-1,4-диоат, гексин-1,4 диоат, капроат, каприлат, хлорид, циннамат,цитрат, формиат, фумарат, гликолят, гептаноат,гиппурат, лактат, малат, малеат, гидроксималеат, малонат, манделат, мезилат, никотинат, изоникотинат, нитрат, оксалат, фталат, терефталат,фосфат, вторичный кислый фосфат, первичный кислый фосфат, метафосфат, пирофосфат, пропионат, фенилпропионат, салицилат, себакат,сукцинат, суберат, сульфат, бисульфат, пиросульфат, сульфит, бисульфит, сульфонат, бензолсульфонат, р-бромфенилсульфонат, хлорбензолсульфонат, этансульфонат, 2-гидроксиэтан 17 сульфонат, метансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, р-толуолсульфонат, ксилолсульфонат, тартрат и подобные соли. Предпочтительной солью является гидрохлоридная соль. Фармацевтически приемлемые соли присоединения кислоты образуются обычно путм взаимодействия соединения формулы I с эквимолярным или избыточным количеством кислоты. Реагенты обычно соединяют в общем растворителе, например, диэтиловом эфире или этилацетате. Соль обычно осаждается из раствора в течение времени от около 1 часа до 10 дней и может быть выделена фильтрацией, или обычными способами отгоняют растворитель. Настоящее изобретение, кроме того, предусматривает фармацевтически приемлемые препараты, предназначенные для введения млекопитающему, включая людей, в случае необходимости такого лечения, которое включает эффективное количество соединения формулы I и фармацевтически приемлемый разбавитель или носитель. Термин "эффективное количество", означает количество соединения настоящего изобретения, которое способно к ингибированию,смягчению, уменьшению интенсивности, лечению или профилактике симптомов заболевания у млекопитающих, включая людей, страдающих от эстрогенной недостаточности, например при менопаузе или после овариэктомии, или от неподходящей эстрогенной стимуляции, например при маточном фиброзе или эндометриозе, или страдающих от разрастания клеток гладкой мышцы аорты или рестеноза. В случае эстрогенозависимых раковых опухолей термин "эффективное количество", означает количество соединения настоящего изобретения, которое способно к смягчению, уменьшению интенсивности заболевания, ингибированию роста опухоли,лечению или профилактике рака и/или его симптомов у млекопитающих, включая людей. Термин "фармацевтически приемлемый препарат" означает, что носитель, разбавитель,наполнители и соль должны быть совместимы с активным ингредиентом (соединением формулыI) и не должны быть вредными для реципиента. Лекарственные препараты могут быть получены известными в данной области методами. Так,например, соединения этого изобретения могут быть сформулированы с обычными наполнителями, разбавителями или носителями и могут быть формированы в виде таблеток, капсул и т.д. Примеры наполнителей, разбавителей, подходящих для таких препаратов, включают наполнители и сухие разбавители, например,крахмал, сахара, маннит и кремниевые производные; связующие вещества, например, карбоксиметилцеллюлозу и другие производные целлюлозы, альгинаты, желатин и поливинилпирролидон; увлажняющие средства, например,глицерин; средства способствующие распаду, 001600 18 например, агар-агар, карбонат кальция и бикарбонат натрия; средства для замедления растворения, например, парафин; ускорители всасывания, например, четвертичные аммониевые соединения; поверхностно-активные вещества,например, цетиловый спирт, глицеролмоностеарат, адсорбирующие носители, например, каолин и бентонит; и смазывающие вещества, например, тальк, стеарат кальция и магния и тврдые полиэтиленгликоли. Конечные фармацевтические формы могут представлять собой: пилюли, таблетки, порошки, лепшки, сиропы,аэрозоли, саше, крахмальные капсулы, эликсиры, суспензии, эмульсии, мази, суппозитории,стерильные инъецируемые растворы или стерильные упакованные порошки и подобные формы, зависящие от вида применяемого наполнителя. Соединения этого изобретения, кроме того, хорошо подходят для препарата в виде лекарственных форм пролонгированного действия. Препараты можно также сформулировать таким образом, что они будут выделять активный ингредиент только или предпочтительно в определнной части кишечника, возможно в течение некоторого периода времени. Такие препараты будут включать покрытия, оболочки или защитные матрицы, которые могут быть выполнены из полимерных веществ или восков. Конкретная доза соединения формулы I,необходимая для лечения, ингибирования или профилактики симптомов и/или заболеваний млекопитающих, включая людей, страдающих от вышеперечисленных заболеваний, будет зависеть в соответствии с изобретением от конкретной болезни, симптомов и тяжести заболевания. Доза, способы введения и частота дозирования лучше всего определяются лечащим врачом. Обычно приемлемые и эффективные дозы будут составлять от 15 до 1000 мг и более,предпочтительно от 15 до 80 мг. Такие дозы будут вводиться больному, в случае необходимости лечения, от одного до трх раз в день или так часто, как это необходимо для достижения необходимого действия, в течение периода времени, равного, по меньшей мере, двум месяцам,более типично, в течение по меньшей мере,шести месяцев, или хронически. В качестве дополнительного варианта изобретения соединения формулы I могут быть введены вместе с эффективным количеством дополнительного терапевтического средства,включающего, не ограниченного нижеперечисленными, эстроген, прогестин, бензотиофеновые соединения, включающие ралоксифен, нафтильные соединения, имеющие антиэстрогенную активность, бисфосфонатные соединения,например, алендронат и тилудронат, паратиреоидный гормон (РТН), включающий усечнные и/или рекомбинантные формы РТН, например,такие как РТН (1-34), кальцитонин, костные морфогенные белки (BMPs) или их комбинации. Различные доступные формы таких дополнительных терапевтических средств, а также различные их назначения и применяемые схемы прима лекарственного средства хорошо известны специалистам в данной области. Коммерчески доступны различные формы эстрогена и прогестина. Термин "эстроген", как используется здесь, включает соединения, обладающие эстрогенной активностью, и средства на основе эстрогена. Соединения эстрогена,пригодные в практике настоящего изобретения,включают, например, эстрадиолэстрон, эстриол,эквилин, эквиленин, эстрадиолципионат, эстрадиолвалерат, этинилэстрадиол, полиэстрадиолфосфат, эстропипат, диэтилстибестрол, диенестрол, хлортрианизен и их смеси. Средства на основе эстрогена включают, например, 17-аэтинилэстрадиол (0,01-0,03 мг/день), местранол(0,05-0,15 мг/день) и сопряжнные эстрогенные гормоны, например, Premarin (Wyeth-Ayerst; 0,2-2,5 мг/день). Используемый в описании термин "прогестин" включает соединения, обладающие прогестагенной активностью, например, такие как прогестерон, норэтинодрел, норгестрел, мегестролацетат, норэтиндрон, средства на основе прогестина и т.д. Средства на основе прогестина включают, например, медроксипрогестерон, например, Provera (Upjohn; 2,5-10 мг/день), норэтилнодрел (1,0-10 мг/день) и норэтиндрон (0,5-2,0 мг/день). Предпочтительным соединением на основе эстрогена является Premarin, а норэтилнодрел и норэтиндрон являются предпочтительными соединениями на основе прогестина. Способ введения каждого средства на основе эстрогена и прогестина согласуется с известными способами введения в данной области. Приведнные ниже лекарственные препараты представлены только с целью иллюстрации и ни в коей мере не ограничивают изобретение. Общее количество активных ингредиентов в таких препаратах составляет от 0,1 до 99,9 % по весу относительно веса препарата. Термин "активный ингредиент" означает соединение формулы I. Препарат 1. Желатиновые капсулы. Ингредиент Активный ингредиент Крахмал NF Свободнотекущий порошок крахмала Силиконовая жидкость 350 сантистоксов Ингредиенты смешали, пропустили через сито 45 меш США и заполнили тврдые желатиновые капсулы. Препарат 2. Таблетки. Ингредиент Активный ингредиент Крахмал Целлюлоза микрокристаллическая Поливинилпирролидон (в виде 10% раствора в воде) Натрийкарбоксиметилцеллюлоза Стеарат магния Тальк 20 Активный ингредиент, крахмал и целлюлозу пропустили через сито 45 меш США и тщательно перемешали. С полученным порошком смешали раствор поливинилпирролидона и затем пропустили через сито 14 меш США. Полученные таким образом гранулы сушили при температуре 50-60 С и пропустили через сито 18 меш США. Предварительно через сито 60 меш США пропустили натрийкарбоксиметилцеллюлозу, стеарат магния и тальк, которые затем добавили к вышеуказанным гранулам и тщательно перемешали. Полученную смесь прессовали в таблетки на таблетировочной машине. Препарат 3. Аэрозоль. Ингредиент Активный ингредиент Этанол Пропеллент 22 (хлордифторметан) Всего Активный ингредиент смешали с этанолом и смесь добавили к порции пропеллента 22, охладили до -30 С и перенесли в наполняющее устройство. Затем в сосуд из нержавеющей стали подали необходимое количество и разбавили остатком пропеллента. После этого сосуд снабдили клапаном. Препарат 4. Суппозитории. Ингредиент Активный ингредиент Глицериды насыщенной жирной кислоты Активный ингредиент пропустили через сито 60 меш США и суспендировали в глицеридах жирных кислот, которые предварительно нагрели до их температуры плавления. Смесь влили в пресс-форму для суппозиториев и охладили. Препарат 5. Суспензии. Каждая суспензия содержала 0,1-1000 мг соединения формулы I на 5 мл-овую дозу. Ингредиент Активный ингредиент Натрийкарбоксиметилцеллюлоза Сироп Раствор бензойной кислоты (0,1 М) Корригент Краситель Дистиллированная вода - остальное Соединение формулы I пропустили через сито 45 меш США и смешали с натрийкарбоксиметилцеллюлозой и сиропом до образования однородной пасты. Добавили разбавленные в воде раствор бензойной кислоты, корригент и краситель и смесь тщательно перемешали. Для доведения препарата до конечного объма добавили воду. Последующие примеры и препараты предназначены для лучшего разъяснения настоящего изобретения при его применении на практике, и их ни в коей мере не следует интерпретировать как примеры, ограничивающие изобретение. Специалисты в данной области понимают, что 21 могут быть сделаны различные модификации,не изменяющие область и сущность настоящего изобретения. Все упомянутые в описании публикации и патенты приведены лишь с целью иллюстрации уровня техники в области, к которой относится это изобретение. Примеры Данные ЯМР для следующих примеров получены с применением прибора GE 300 мГц,причм в качестве растворителя, если не указано иначе, применяли безводный d-6 ДМСО. Способ получения 1. 2,4-Ди-(3-метоксифенил)масляная кислота. Приготовили раствор 50,68 г(305 ммолей) 3-метоксифенилуксусной кислоты в 1,4 л безводного ТГФ и охладили до -70 С в атмосфере азота. Медленно добавили 400 мл 1,6 М (640 ммолей) н-бутиллития и раствор перемешивали в течение 2-х ч при -70 С. Добавили раствор 72.1 г (335 ммолей) 2-(3-метоксифенил) этилбромида в 100 мл ТГФ и обеспечили протекание реакции в течение шестнадцати часов при медленном нагревании до температуры окружающей среды. Выпариванием в вакууме удалили растворитель. Остаток растворили в 50 мл раствора 5N NaOH и 450 мл воды и перемешали в течение одного часа. Водный раствор три раза экстрагировали простым эфиром. Водный раствор подкислили добавлением 150 мл 5N НСl и продукт три раза экстрагировали СНСl3. Органические экстракты соединили, промыли рассолом и сушили фильтрацией над безводнымNa2SO4. Выпариванием удалили растворитель. В результате получили 90 г названного соединения в виде прозрачного масла. Способ получения 2. 2-(3-Метоксифенил)6-метокси-1-тетралон. Приготовили раствор 90 г (300 ммолей) 2,4-ди-(3-метоксифенил)масляной кислоты в 1,5 л CH2Cl2 и медленно добавили 62,4 г (300 ммолей) PCl5. Реакционную смесь в течение четырх часов нагрели в колбе с обратным холодильником в атмосфере азота. Выпариванием удалили растворитель. Остаток суспендировали в 100 мл водного NаНСО 3 и суспензию три раза экстрагировали СНСl3. Объединнные органические экстракты промыли рассолом, сушилиNa2SO4 и выпарили до образования сухого остатка. Продукт выкристаллизовали из 2-пропанола при -70 С и затем дважды из метилового спирта при -70 С. В результате получили 65 г названного соединения в виде рыжеватокоричневого тврдого вещества. Температура плавления: 81-82 С. Способ получения 3. 1-Ацетилокси-2-(3 метоксифенил)-6-метокси-3,4-дигидронафталин. Приготовили суспензию 47 г (167 ммолей) 2-(3-метоксифенил)-6-метокси-1-тетралона и 4,7 г моногидрата р-толуолсульфоновой кислоты в 470 мл изопропенилацетата. Реакционную смесь в течение сорока восьми часов нагревали в колбе с обратным хо 001600 22 лодильником в атмосфере азота. Реакционную смесь охладили и добавили 10 г NаНСО 3, раствор влили в 500 мл водного раствора NaHCO3. Водный раствор трижды экстрагировали 200 мл-овыми порциями EtOAc. Объединнные органические экстракты промыли рассолом, сушили Nа 2SO4 и выпарили до образования тмного масла. В результате получили 52,7 г названного соединения. Способ получения 4. 1-Ацетилокси-2-(3 метоксифенил)-6-метоксинафталин. Приготовили раствор 52,7 г (162 ммоля) 1 ацетилокси-2-(3-метоксифенил)-6-метокси-3,4 дигидронафталина и 36,9 г (162 ммоля) DDQ в 500 мл р-диоксана. Раствор в течение двух часов нагревали в колбе с обратным холодильником в атмосфере азота. Реакционную смесь охладили и выпариванием удалили растворитель. Остаток экстрагировали путм перемешивания в СНСl3 в течение шестнадцати часов, затем фильтровали для удаления нерастворимых веществ. СНСl3 экстракт очистили хроматографией в силикагельной колонке при экстрагировании СНСl3. В результате получили красное масло, которое суспендировали в метиловом спирте и кристаллизовали при -70 С. Получили 46,5 г названного соединения в виде тврдого вещества с низкой температурой плавления. Способ получения 5. 1-Гидрокси-2-(3 метоксифенил)-6-метоксинафталин. Приготовили суспезию 46,5 г 1-ацетилокси-2-(3-метоксифенил)-6-метоксинафталина и 40 мл 5N НСl в 400 мл метилового спирта. Реакционную смесь в течение одиннадцати часов нагревали в колбе с обратным холодильником. Реакционную смесь выпарили до образования прозрачного масла. В результате получили 38,6 г названного соединения. ПМР: (СDСl3) 8.19 м.д. (д, J=9.1 Гц, 1 Н); 7.51-6.94 м.д. (м, 8 Н); 5.91 м.д. (с, 1 Н); 3.94 м.д.MC:m/e=280 (M) FD. ЭА: Вычислено для С 18 Н 16 О 3: С 77.12; Н 5.75. Найдено: С 76.91; Н 5.81. Способ получения 6. 1-Гидрокси-2-(3 метоксифенил)нафталин. Названное соединение получили способом,аналогичным тому, который описан в способах получения 1-5. ПМР: 8.30 м.д. (м, 1 Н); 7.80 м.д. (м, 1 Н); 7.57-7.45 м.д. (м, 4 Н); 7.40 м.д. (д, J=7.1 Гц, 1 Н); 7.35 м.д. (д, J=6.0 Гц, 1 Н); 7.06 м.д. (с, 1 Н 0); 6.97 м.д. (дд, J=6.0 Гц, 1 Н); 6.00 м.д. (с, 1 Н); 3.90 м.д. 23 Приготовили раствор 9,8 г (35 ммолей) 1 гидрокси-2-(3-метоксифенил)-6-метоксинафталина в 490 мл ДМФ, и к этому раствору медленно в атмосфере азота добавили 1,47 г (36,8 ммоля) 60% NaH в минеральном масле. Через 10 мин добавили 7,5 мл (70 ммолей) 4 фторбензальдегида и реакционную смесь в течение шестидесяти четырх часов нагрели до 70 С. Реакционную смесь выпарили до образования сухого остатка и остаток разделили между водой и EtOAc. Слой EtOAc сушили Na2SO4 и подвергли хроматографии в силикагельной колонке при элюировании EtOAc - гексаном(1:9) (об/об). Затем конечный продукт очистили кристаллизацией из метилового спирта. В результате получили 2,4 г названного соединения в виде рыжевато-коричневого тврдого вещества, температура плавления: 145-146 С. ПМР: (СDСl3) 9.80 м.д. (с, 1 Н); 7.79 м.д. (д,J=9.2 Гц, 1 Н); 7.75 м.д. (д, J=8.8 Гц, 1 Н); 7.67 м.д. (д, J=8. 9 Гц, 2 Н); 7.58 м.д. (д, J=8.4 Гц, 1 Н); 7.31-7.05 м.д. (м, 5 Н); 6.86-6.75 м.д. (м, 3 Н); 3.95 м.д. (с, 3 Н); 3.72 м.д. (с, 3 Н). МС: m/e=384 (M) FD. ЭА: Вычислено для С 25 Н 20O4; С 78.11; Н 5.24. Найдено: С 78.26; Н 5.33. Способ получения 8. 1-(4-формилфенокси)-2-(3-метоксифенил)нафталин. Названное соединение получили способом,аналогичным тому, который описан в способе получения 7. ПМР: (CDCl3) 9.90 м.д. (с, 1 Н); 7.90-7.83 м.д.(м, 2 Н); 7.70 м.д. (д, J=8.0 Гц, 1 Н); 7.35-7.20 м.д. (м, 4 Н); 7.58-7.43 м.д. (м, 2 Н); 7.58 м.д. (д,J=8.4 Гц, 1 Н); 7.10 м.д. (м, 2 Н); 6.80 м.д. (д,J=8.0 Гц, 2 Н); 3.80 м.д. (с, 3 Н). МС: m/e=354 (M) FD. ЭА: Вычислено для C24H18O3-0.2 molEtOAc: С 86.06; Н 5.31. Найдено: С, 80.17; Н, 5.29. Способ получения 9. 1-(4-гидроксифенокси)-2-(3-метоксифенил)-6-метоксинафталин. В 15 мл метилового спирта суспендировали 2,3 г (6 ммолей) 1-(4-формилфенокси)-2-(3 метоксифенил)-6-метоксинафталина и добавили 1,7 мл (9 ммолей) 30% Н 2O2. При перемешивании смеси медленно добавили 0,76 мл концентрированной Н 2SО 4. Дополнительно добавили 30 мл метилового спирта и обеспечили протекание реакции в течение сорока восьми часов. Реакционную смесь нейтрализовали раствором(с, 3 Н); МС: m/e=372 (M) FD. ЭА: Вычислено для С 24H20O4: С 77.40; Н 5.41. Найдено: С 77.69; Н 5.30. Способ получения 10. 1-(4-гидроксифенокси)-2-(3-метоксифенил)нафталин. Названное соединение получили способом,аналогичным тому, который описан в способе получения 9, и выделили в виде прозрачного масла. ПМР: (СDСl3) 7.90 м.д. (д, J=8.0 Гц, 1 Н); 7.87 м.д. (д, J=7.0 Гц, 1 Н); 7.80 м.д. (д, J=8.0 Гц,1 Н); 7.60 м.д. (д, J=8.0 Гц, 1 Н); 7.50-7.40 м.д. (м,3 Н); 7.10 м.д. (м, 2 Н); 6.80 м.д. (д, J=8.0 Гц, 1 Н); 6.60 м.д. (с, 4 Н); 4.40 м.д. (с, 1 Н); 3.70 м.д. (с,3 Н). МС: m/e=342 (M) FD. ЭА: Вычислено для С 23 Н 18O3-0.5 molEtOAc: С, 77.70; Н, 5.74. Найдено: С, 77.93; Н, 5.82. Пример 1. Гидрохлорид 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-метоксифенил)6-метоксинафталина. Приготовили раствор 1,5 г (4 ммоля) 1-(4 гидроксифенокси)-2-(3-метоксифенил)-6-метоксинафталина в 40 мл ДМФ. К этому раствору добавили 920 мг (5 ммолей) гидрохлорида 2 хлорэтилпиперидина и 5,2 г (16 ммолей) Сs2 СО 3 и реакционную смесь перемешивали в течение шестнадцати часов при температуре окружающей среды в атмосфере азота. Выпариванием удалили растворитель и остаток разделили между водой и этилацетатом. Слой этилацетата промывали водой, затем рассолом, сушилиNa2SO4 и выпаривали до образования сухого остатка. Остаток растворили в 10 мл МеОН и добавили 1 мл 5N НСl. Выпариванием удалили растворители и продукт кристаллизовали из этилацетата. В результате получили 1,8 г названного соединения в виде белого тврдого вещества, с температурой плавления: 161-162 С. ПМР: 10.43 м.д. (ушир.с, 1 Н); 7.81 м.д. (д,J=8.3 Гц, 1 Н); 7.67 м.д. (д, J=9.0 Гц, 1 Н); 7.59 м.д. (дд, J=8.8 1.1 Гц, 1 Н); 7.41 м.д. (д, с, 1 Н); 7.24 м.д. (т, J=7.8 Гц, 1 Н); 7.18-7.06 м.д. (м, 3 Н); 6.88-6.75 м.д. (м, 3 Н); 6.59 м.д. (дд, J=8.8, 1.1 Гц,2 Н); 4.22 м.д. (т, J=4.3 Гц, 2 Н); 3.85 м.д. (с, 3 Н); 3.65 м.д. (с, 3 Н); 3.47-3.22 м.д. (м, 4 Н); 2.98-2.79 м.д. (м, 2 Н); 1.83-1.57 м.д. (м, 5 Н); 1.39-1.22 м.д.(м, 1 Н). МС: m/e=483 (M-HCl) FD. ЭА: Вычислено для С 31 Н 33NO4-НСl: С 71.60; Н 6.59; N 2.69. Найдено: С 71.87; Н 6.43; N 2.76. Пример 2. Гидрохлорид 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-метоксифенил) нафталина. Названное соединение получили способом,подобным тому, который применяли в примере 25 1, и выделили в виде белого кристаллического продукта, температура плавления: 145 С. ПМР: (CDCl3) 7.90 м.д. (дд, J=8.0 Гц, 2 Н); 7.80 м.д. (д, J=9.0 Гц, 1 Н); 7.60 м.д. (д, J=8.0 Гц,2 Н); 7.48-7.44 м.д. (м, 3 Н); 7.20 м.д. (д, J=7.0 Гц,2 Н); 7.10 м.д. (д, J=7.0, Гц, 2 Н); 6.80 м.д. (д,J=9.0 Гц, 1 Н); 6.60 м.д. (с, 3 Н); 4.40-4.30 м.д. (м,2 Н); 3.70 м.д. (с, 3 Н); 3.60-3.50 м.д. (м, 1 Н); 3.20 м.д. (м, 2 Н); 2.80-2.60 м.д. (м, 2 Н); 2.30-2.10 м.д.(м, 2 Н); 1.90-1.80 м.д. (м, 3 Н); 1.70-1.60 м.д. (м,2 Н); 1.50-1.30 м.д. (м, 1 Н). МС: m/e=453 (M-HCl) FD. ЭА: Вычислено для С 30 Н 31NО 3-НСl: С 73.53; Н 6.58; N 2.86. Найдено: С 73.31; Н 6.73; N 3.05. Пример 3. Гидрохлорид 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-гидроксифенил)-6 гидроксинафталина. Приготовили раствор 1,5 г (2,9 ммоля) гидрохлорида 1-[4-[2-(1-пиперидинил)этокси] фенокси]-2-(3-метоксифенил)-6-метоксинафталина в 30 мл СН 2 Сl2 и раствор охладили до 0 С в атмосфере азота. К этому раствору добавили 1,09 мл (2,89 г, 11,5 ммоля) ВВr3 и обеспечили протекание реакции в течение двух часов при 0 С. Реакционную смесь закалили путм добавления водного раствора NaHCO3 (50 мл). Реакционную смесь экстрагировали СНСl3. Органический слой промыли рассолом, сушили Na2SO4 и выпарили до образования сухого остатка. Остаток суспендировали в ТГФ и фильтровали. К фильтрату добавили 1 мл 5N НСl и выпариванием удалили растворители. В результате получили 0,99 г названного соединения в виде рыжевато-коричневого аморфного порошка. ПМР: 9.90 м.д. (с,1 Н 0); 9.88 м.д. (ушир.с,1 Н); 9.3 м.д. (с, 1 Н); 7.65 м.д. (д, J=8.4 Гц, 1 Н 0); 7.60 м.д. (д, J=8.8 Гц, 1 Н); 7.45 м.д. (д, J=8.7 Гц,1 Н); 7.17 м.д. (с, 1 Н); 7.14-7.01 м.д. (м, 2 Н); 6.99-6.92 м.д. (м, 2 Н); 6.77 м.д. (д, J=8.9 Гц, 2 Н); 6.68-6.54 м.д. (м, 3 Н); 4.18 м.д. (т, J=4.7, Гц, 2 Н); 3.47-3.18 м.д. (м, 4 Н); 2.98-2.81 м.д. (м, 2 Н); 1.81-1.58 м.д. (м, 5 Н); 1.38-1.22 м.д. (м, 1 Н). МС: m/e-455 (M-HCl) FD. ЭА: Вычислено для C29H29NO4-HCl: С 70.80; Н 6.15; N 2.85. Найдено: С 70.68; Н 6.29; N 2.65. Пример 4. Гидрохлорид 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-гидроксифенил)6-нафталина. Названное соединение получили способом,подобным тому, который применяли в примере 3, и выделили в виде белого кристаллического тврдого вещества, температура плавления: 194195 С. ПМР: (MeOD-d4) 7.96-7.84 м.д. (м, 2 Н); 7.80 м.д. (д, J=8.0 Гц, 1 Н); 7.50 м.д. (д, J=8.0 Гц,1 Н); 7.50-7.40 м.д. (м, 3 Н); 7.12-7.09 м.д. (дд,J=8.0 Гц, 1 Н); 7.00-6.90 м.д. (м, 2 Н); 4.70 м.д. (с,1 Н); 4.20-4.10 м.д. (м, 1 Н); 3.50-3.40 м.д. (м, 2 Н); 3.40-3.20 м.д. (м, 4 Н); 1.90-1.70 м.д. (м, 4 Н); 1.80-1.60 м.д. (м, 2 Н). 26 МС: m/e=439 (M-HCl) FD. ЭА: Вычислено для С 29 Н 29NО 3-НСl: С 73.17; Н 6.35; N 2.94. Найдено: С 72.88; Н 6.31; N 2.90. Пример 5. Гидрохлорид 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-гидроксифенил)-6-метоксинафталина. Раствор гидрохлорида 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-метоксифенил)-6 метоксинафталина (0,500 г, 0,96 ммоля) в 20 мл безводного метиленхлорида в атмосфере N2 охладили в бане сухого льда с ацетонитрил - сухой лд до -20 С. В течение 3-х мин посредством шприца по каплям добавили трибромид бора(1,44 ммоля) в виде 1 М раствора (1,44 мл) также в метиленхлориде. Полученную смесь нагрели до 0 С и перемешивали в течение 2-х ч. Затем реакционную смесь влили в перемешиваемый раствор холодного насыщенного бикарбоната натрия (100 мл) и сырой продукт экстрагировали этилацетатом (4 х 25 мл). Органические экстракты соединили, сушили (сульфат магния) и концентрировали до образования маслянистой пены. Сырое свободное основание очистили радиальной хроматографией с применением смеси метанол/метиленхлорид с соотношением компонентов в смеси 5:95. Соответственные фракции соединили и концентрировали в вакууме, при этом получили 220 мг (49%) 1-[4-[2(1-пиперидинил)этокси]фенокси]-2-(3-гидроксифенил)-6-метоксинафталина в виде белого кристаллического твердого вещества, температура плавления: 170-171 С. ПЯМР д, 9.36 (с, 1 Н), 7.77 (д, J=8.6 Гц,1 Н), 7.68 (д, J=9.2 Гц, 1 Н), 7.53 (д, J=8.6 Гц, 1 Н),7.39 (д, J=2. 4 Гц, 1 Н), 7.09 (м, 2 Н), 6.93 (м, 2 Н),6.69 (д, J=9.1 Гц, 2 Н), 6.61 (м, 1 Н), 6.52 (д, J=9.1 Гц, 2 Н), 3.84 (т, J=6.0 Гц, 2 Н), 3.83 (с, 3 Н), 2.51(т, J=6.0 Гц, 2 Н), 2.25-2.40 (м, 4 Н), 1.35-1.45 (м,4 Н), 1.25-1.35 (м, 2 Н). МС (FD) m/e 470 (МН+). Анал. вычислено для С 30 Н 31NO4: С 76.73; Н 6.65; N 2.98. Найдено: С 76.94; Н 6.83; N 3.26. При определении анализом ПМР места деметилирования обработка продукта в растворе ДМСО несколькими эквивалентами NaOD в ДМСО дала следующие изменения в химических сдвигах: три сигнала, соответствующие двум ароматическим протонам, которые находились в орто-положении по отношению к гидроксильной группе в 2-арильном фрагменте, и одному протону, который находился в параположении, сдвинулись вверх соответственно,на 0,59, 0,57 и 0,75 м.д. В противоположность этому, воздействие на сигналы, свойственные протонам в нафталиновой группе в положениях 5 и 7, было незначительным (сдвиг составил 0,2 м.д.). Оставшиеся сигналы в спектре продукта в ДМСО по существу не изменились при добавлении NaOD. Описанные выше сдвиги 27 показывают, что группа ОН расположена в 2 арильном кольце, а оставшаяся метоксильная группа находится в нафталиновом кольце (т.е. региоселективное избирательное деметилирование произошло в 2-(3-метоксифенильной) группе). Пример 6. 1-[4-[2-(1-пиперидинил)этокси] фенокси]-2-(3-метоксифенил)-6-гидроксинафталин. Раствор этанола (2,85 мл) в безводном ДМФ (125 мл) в атмосфере азота охладили в бане со льдом и по каплям добавили 20,1 мл 1,6 М н-бутиллития в гексане. Полученный раствор, который представлял собой примерно 0,22 М раствор тиоэтилата лития (LiSEt), перед применением нагрели до температуры окружающей среды. К гидрохлориду 1-[4-[2-(1 пиперидинил)этокси]фенокси]-2-(3-гидроксифенил)-6-метоксинафталина (0,550 г, 1,05 ммоля) в атмосфере азота добавили 70 мл (15,4 ммоля) раствора LiSEt, и полученную реакционную смесь в течение 5 ч нагрели до 107 С в масляной бане. Образовавшийся желтый раствор для удаления большей части растворителя концентрировали под пониженным давлением и концентрат желтого масла распределили между 300 мл этилацетата и 1 Н НСl (100 мл), к которой добавили 50 г льда. Экстракт этилацетатного слоя промыли 4 х 25 мл порциями рассола, сушили над сульфатом магния, фильтровали и концентрировали до получения неприятно пахнущего желтого масла. Сырой продукт очистили порциями посредством радиальной хроматографии, в которой в качестве растворителя при элюировании применяли 5% метанол в хлороформе. Соответствующие фракции объединили,концентрировали и сушили в вакууме, при этом получили 265 мг (53%) 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2-(3-метоксифенил)-6-гидроксинафталина в виде серой пены. ПМР: (ДМСО-d6) д 9.90 (с, 1 Н), 7.66 (д,J=8.0 Гц, 1 Н), 7.63 (д, J=8.6 Гц, 1 Н), 7.50 (д,J=8.6 Гц, 1 Н), 7.25-7.16 (м, 2 Н), 7.10-6.95 (м,3 Н), 6,79 (м, 1 Н), 6.70 (д, J=9.0 Гц, 2 Н), 6.54 (д,J=9.0 Гц, 2 Н), 3.86 (т, J=6.0 Гц, 2 Н), 3.64 (с, 3 Н),2.52 (т, J=6.0 Гц, 2 Н), 2.25-2.40 (м, 4 Н), 1.35-1.45(м, 4 Н), 1.25-1.35 (м, 2 Н). МС (FD) m/e 470 (М+). Анал. вычислено для С 30 Н 31NO4: С 76.73; Н 6.65; N 2.98. Найдено: С, 75.89; Н, 6.81; N, 3.01. Место деметилирования определили анализом ПЯМР в эксперименте, подобном тому,который описан в примере 5: обработка продукта в растворе ДМСО несколькими эквивалентами NaOD в ДМСО показала следующие изменения в химических сдвигах: сигналы, соответствующие двум ароматическим протонам в положениях 5 и 7 нафталинового кольца (а также другим протонам в нафталиновой группе) значительно сдвинулись вверх. В противоположность этому, воздействие на сигналы, свойст 001600 28 венные протонам в 2-арильном фрагменте, было незначительным (сдвиг составил 0,2 часть/ миллион). Оставшиеся сигналы в спектре продукта в ДМСО при добавлении NaOD по существу не изменились. Описанные выше сдвиги показывают, что группа ОН расположена в нафталиновом кольце, а оставшаяся метоксильная группа находится в 2-арильном фрагменте (т.е. региоселективное избирательное деметилирование произошло в 7-метоксильной группе). Последующие обсуждения иллюстрируют способы применения соединений формулы I на экспериментальных моделях или в клинических исследованиях. Эти примеры приведены только с целью иллюстрации, а не с целью какого-либо ограничения. А. Остеопороз. Экспериментальные модели постменопаузального остеопороза известны в данной области. Подходящей для этого изобретения является модель овариэктомизованной крысы, которая описана в патенте США 5393763. Соединения формулы I будут активными на этой модели и с помощью их можно осуществлять эффективное лечение или профилактику остеопороза,появляющегося вследствие эстрогенной недостаточности. Способ лечения или профилактики остеопороза, появляющегося вследствие эстрогенной недостаточности, можно дополнительно продемонстрировать следующим: были выбраны 100 пациентов, которые являлись здоровыми женщинами постклимактерического периода возрастом 45 - 60 лет и были подходящими кандидатами для эстрагенозаменительной терапии. Указанные пациенты включали женщин с интактной маткой, у которых последний менструальный цикл был более шести месяцев назад, но менее шести лет назад. Для проведения исследований были исключены пациенты, которые за шесть месяцев до исследований принимали эстрогены, прогестины или кортикостероиды или такие пациенты, которые когда-либо принимали бисфосфонаты. Пятьдесят женщин (исследуемая группа) должны были принять в день 15-80 мг соединения формулы I, например, препарата I (приведенного выше). Другие пятьдесят женщин (контрольная группа) должны были получать ежедневно соответственное плацебо. Обе группы должны были также ежедневно принимать таблетки карбоната кальция (648 мг). Исследование представляло собой модель двойного слепого анализа. Ни исследователи, ни пациенты не знали, к какой группе приписан каждый пациент. Начальное обследование каждого пациента включало определение количественного содержания кальция в моче, креатинина, гидроксипролина и пиридинолиновых поперечных связей. Брали также пробы крови для определения содержания в сыворотке крови содержания ос 29 теокальцина и щелочной фосфатазы. Начальное обследование также включало осмотр матки и определение посредством фотонной абсорбциометрии минеральной плотности кости. Исследования продолжались в течение шести месяцев и каждого пациента обследовали на изменение указанных выше параметров. Во время курса лечения пациенты подвергнутой лечению группы по сравнению с пациентами контрольной группы показывали уменьшенное изменение биохимических маркеров резорбции кости. Подвергнутая лечению группа по сравнению с контрольной группой также показывала незначительное уменьшение минеральной плотности кости или отсутствие такового. Обе группы имели подобную маточную гистологию, что указывало на то, что соединения формулы I обладают незначительным утротрофическим действием или вообще не оказывают такого действия. В. Гиперлипидемия. Экспериментальные модели постменопаузальной гиперлипидемии известны в данной области. Подходящей для этого изобретения является модель овариэктомизованной крысы,которая описана в патенте США 5464845. Представленные в таблице I данные показывают сравнительные результаты для овариэктомизованных крыс, крыс, подвергнутых лечению 17 а-этинилэстрадиолом (ЕЕ 2), и крыс, подвергнутых лечению некоторыми соединениями этого изобретения. Хотя ЕЕ 2 и вызывал уменьшение холестерина в сыворотке крови при пероральном приеме дозы 0,1 мг/кг/день, он также оказывал стимулирующее действие на матку,вследствие чего масса матки крыс, подвергнутых лечению ЕЕ 2, была значительно больше массы матки овариэктомизованных животных. Такая реакция матки на эстроген хорошо известна в данной области. Соединения настоящего изобретения не только понижают уровень холестерина в сыворотке крови у животных по сравнению с уровнем холестерина у овариэктомизованных животных, но при этом увеличивают массу матки в меньшей степени, чем ЕЕ 2. По сравнению с известными в данной области эстрогенными соединениями, наблюдаемое при применении соединений настоящего изобретения преимущество, состоящее в уменьшении холестерина в сыворотке крови и одновременном уменьшении воздействия на массу матки, является необычным и желательным. Как показано в нижеприведенной таблице,эстрогенность также оценивали путем определения в матке эозинофильной инфильтрации. Соединения этого изобретения не вызывают такого большого увеличения количества эозинофилов, наблюдаемого в стромальном слое матки овариэктомизованной крысы. ЕЕ 2 вызывал значительное и ожидаемое увеличение эозинофильной инфильтрации. 30 Данные, представленные в таблице 1, отражают реакцию подвергнутой лечению группы.соедине- Доза,ния мг/кг 3 а ЕЕ 2e Пример 1% увеличения массы матки по сравнению с массой матки овариэктомизованных животных контрольной группы; с эозинофильная пероксидаза, Vmах;d уменьшение холестерина в сыворотке крови по сравнению с уровнем холестерина овариэктомизованных животных контрольной группы; е 17-а-этинилэстрадиол; Способ лечения гиперлипидемии, возникающей вследствие эстрогенной недостаточности, можно дополнительно проиллюстрировать следующим: были выбраны 100 пациентов, которые являлись здоровыми женщинами постклимактерического периода возрастом 45-60 лет и были подходящими кандидатами для экстрагенозаместительной терапии. Указанные пациенты включали женщин с интактной маткой,у которых отсутствовал менструальный цикл в течение времени более шести месяцев, но менее шести лет. Для проведения исследований были исключены пациенты, которые за шесть месяцев до исследований принимали эстрогены, прогестины или кортикостероиды. Пятьдесят женщин (исследуемая группа) должны были принять в день 15-80 мг соединения формулы I, например, препарата I. Другие пятьдесят женщин (контрольная группа) должны были получать ежедневно соответственное плацебо. Исследование представляло собой двойной слепой анализ. Ни исследователи, ни пациенты не знали, к какой группе приписан каждый пациент. Начальное обследование каждого пациента включало определение содержания холестерина и триглицеридов в сыворотке крови. В конце периода исследования (через шесть месяцев) каждый пациент имел свой профиль липидов в 31 сыворотке. Анализ данных подтвердил снижение содержания липидов, например холестерина и/или триглицеридов, в исследуемой группе в сравнении с контрольной группой. Из вышеизложенного следует, что это изобретение хорошо адаптировано к достижению всех указанных выше конечных целей и преимуществ, свойственных этому изобретению. Следует понимать, что полезность представляют также некоторые признаки и подкомбинации, которые могут быть применены без отсылки на другие признаки и подкомбинации. Вышеприведенное подтверждается объемом формулы изобретения. Вследствие того, что без отклонения от сущности изобретения могут быть сделаны его возможные варианты, следует иметь в виду, что все что было изложено в описании, приведено лишь с целью иллюстрации, а не для какого-либо ограничения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I где R1 является -Н, -ОН, -O(С 1-С 4-алкилом),-ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr; где Аr является фенилом или замещенным фенилом, OCO(С 1 С 6-алкилом),-O(СО)O(С 1-С 6-алкилом) илиR2 является -Н, -F, -Cl, -ОН, -О(С 1-С 4 алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом,-OCO(С 1-С 6-алкилом), -O(СО)O(С 1-С 6-алкилом) или -ОSО 2(С 4-С 6-алкилом);R3 и R4 независимо являются -Н, -F, -Cl,-СН 3, -ОН, -O(С 1-С 4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом,-ОСО(С 1-С 6-алкилом), -O(СО)O(С 1-С 6-алкилом) или -OSO2(С 4-С 6-алкилом), при условии, что какR3, так и R4 не могут быть водородом;R5 является 1-пиперидинилом,1 пирролидинилом,метил-1-пирролидинилом,диметил-1-пирролидинилом, 4-морфолино, диметиламино,диэтиламино или 1 гексаметиленимино; или его фармацевтически приемлемая соль или сольват. 2. Соединение по п.1, отличающееся тем,что R1 и R3 являются -ОН. 3. Соединение по п.1, отличающееся тем,что R1 является гидрокси и R3 является метокси. 4. Соединение по п.1, отличающееся тем,что R1 является метокси и R3 является гидрокси. 32 5. Соединение по п.1, отличающееся тем,что n равно 2 и R5 является 1-пиперидинилом. 6. Соединение по п.1, отличающееся тем,что указанная соль является гидрохлоридной солью. 7. Соединение по п.1, отличающееся тем,что R1 и R3 являются -ОН, R5 является пиперидинилом, n равно 2 и его указанная соль является гидрохлоридной солью. 8. Соединение по п.1, отличающееся тем,что R1 является гидрокси, R3 является метокси,R5 является пиперидинилом, n равно 2 и его указанная соль является гидрохлоридной солью. 9. Соединение по п.1, отличающееся тем,что R1 является метокси, R3 является гидрокси,R5 является пиперидинилом, n равно 2 и его указанная соль является гидрохлоридной солью. 10. Соединение по п.1, отличающееся тем,что выбрано из группы, состоящей из 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2(3-метоксифенил)-6-метоксинафталин гидрохлорида; 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2(3-метоксифенил) нафталин гидрохлорида; 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2(3-гидроксифенил)-6-гидроксинафталин гидрохлорида; 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2(3-гидроксифенил)нафталин гидрохлорида; 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2(3-гидроксифенил)-6-метоксинафталин гидрохлорида и 1-[4-[2-(1-пиперидинил)этокси]фенокси]-2(3-метоксифенил)-6-гидроксинафталин гидрохлорида. 11. Применение соединения по любому из пп.1-10 или его фармацевтически приемлемой соли или сольвата для ингибирования остеопороза или резорбции кости у больного. 12. Применение соединения по п.11, отличающееся тем, что остеопороз или резорбция кости обусловлены менопаузой или овариэктомией. 13. Применение по п.11 или 12, отличающееся тем, что пациентом является женщина постклимактерического периода. 14. Применение соединения по любому из пп.1-10 или его фармацевтически приемлемой соли или сольвата для снижения у больного уровня холестерина в сыворотке крови. 15. Способ снижения холестерина в сыворотке крови, включающий введение больному, в случае такой необходимости, эффективного количества соединения по п.1 или его фармацевтически приемлемой соли или сольвата. 16. Соединение формулы IIR2a является -Н, -F, -Cl, -ОН, -O(С 1-С 4 алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом,-OCO(С 1-С 6-алкилом), -O(CO)O(С 1-С 6 алкилом) или -OSO2(С 4-С 6-алкилом );R4a является -Н, -F, -Cl, -СН 3, -ОН, -О(С 1 С 4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом,-OCO(С 1-С 6-алкилом), -О(СО)O(С 1-С 6-алкилом) или -OSO2(С 4-С 6-алкилом), при условии, что какR3a, так и R4a не могут быть водородом;R5a является -ОН, -COW или -O(CO)W и W является -Н или С 1-С 6-алкилом; или его фармацевтически приемлемая соль или сольват. 17. Соединение по п.16, отличающееся тем, что R1a является -OR6 и R2a является -OR7. 18. Соединение формулы IIIR2a является -Н, -F, -Cl, -ОН, -O(С 1-С 4 алкилом) , -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом,-OCO(С 1-С 6-алкилом), -O(СО)O(С 1-С 6-алкилом) или -OSO2(С 4-С 6-алкилом);R3a и R4a независимо являются -Н, -F, -Cl,-СН 3, -ОН, -O(С 1-С 4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом,-O(СО)ОАr, где Аr является фенилом или замещенным фенилом,-OCO(С 1-С 6-алкилом),-O(СО)O(С 1-С 6-алкилом) или-OSO2(C4-С 6 алкилом), при условии, что как R3a, так и R4a не могут быть водородом. 19. Соединение формулы IVR2a является -Н, -F, -Cl, -ОН, -O(С 1-С 4aлкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом,-OCO(С 1-С 6-алкилом), -О(СО)О(С 1-С 6-алкилом) или -ОSО 2(С 4-С 6-алкилом);R4a является -Н, -F, -Cl, -СН 3, -ОН, -О(С 1 С 4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом,-OCO(С 1-С 6-алкилом), -О(СО)О(С 1-С 6-алкилом) или -OSO2(С 4-С 6-алкилом), при условии, что какR3a, так и R4a не могут быть водородом;R8 является -ОН, или -ОСО(С 1-С 6 алкилом); где пунктирная линия представляет собой необязательную ненасыщенность; или его фармацевтически приемлемая соль или сольват. 20. Соединение формулы VIR2a является -Н, -F, -Cl, -ОН, -O(С 1-С 4 алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом,-OCO(С 1-С 6-алкилом), -О(СО)O(С 1-С 6-алкилом) или -OSO2(С 4-С 6-алкилом);R4a является -Н, -F, -Cl, -СН 3, -ОН, -O(С 1 С 4-алкилом), -ОСОАr, где Аr является фенилом или замещенным фенилом, -O(СО)ОАr, где Аr является фенилом или замещенным фенилом,-OCO(С 1-С 6-алкилом), -О(СО)O(С 1-С 6-алкилом) или -OSO2(С 4-С 6-алкилом), при условии, что какR3a, так и R4a не может быть водородом;Q является отщепляемой группой; или его фармацевтически приемлемая соль или сольват.
МПК / Метки
МПК: A61P 19/10, A61K 31/33, C07D 211/06, C07C 47/546
Метки: холестерина, снижения, способ, применение, соединения, соединений, нафтильные, нафтильных, промежуточные, получения
Код ссылки
<a href="https://eas.patents.su/18-1600-naftilnye-soedineniya-promezhutochnye-soedineniya-dlya-ih-polucheniya-primenenie-naftilnyh-soedinenijj-sposob-snizheniya-holesterina.html" rel="bookmark" title="База патентов Евразийского Союза">Нафтильные соединения, промежуточные соединения для их получения, применение нафтильных соединений, способ снижения холестерина</a>
Предыдущий патент: Способ и устройство для измерения расхода текучей среды
Следующий патент: Средство для воздействия на организм
Случайный патент: Способ концентрирования потока водного карбамата аммония












