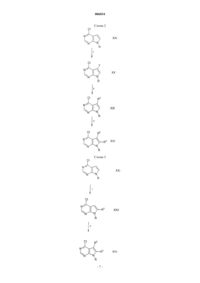
Пирроло[2,3-d]пиримидиновые соединения
Номер патента: 6034
Опубликовано: 25.08.2005
Авторы: Браун Маттью Фрэнк, Фланаган Марк Эдуард, Блуменкопф Тодд Эндрю, Чанджелиэн Пол Стивен
Формула / Реферат
1. Соединение формулы
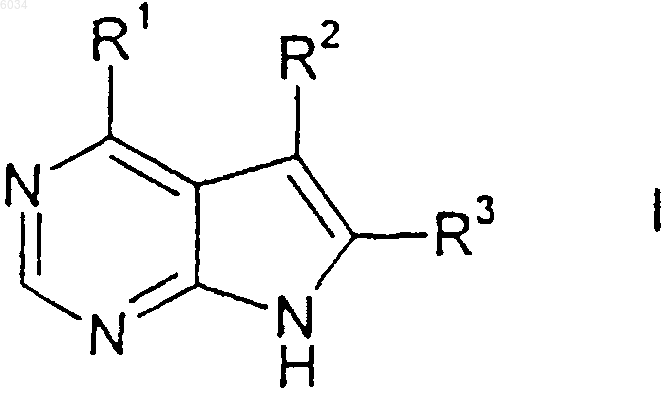
или его фармацевтически приемлемая соль, где R1 представляет собой группу формулы
где пунктирная линия обозначает возможные двойные связи;
m равняется 0, 1 или 2;
n равняется 1 или 2,
X представляет собой кислород, NR6 или CR7R8;
каждый из B и D представляет собой CR7R8;
каждый из A и E представляет собой CR7R8; и
R6 выбран из группы, состоящей из водорода, (C1-C6)алкила;
каждый из R7 и R8 независимо выбран из группы, состоящей из водорода, (C1-C6)алкила, гидрокси, (C1-C6)алкиламино, (C1-C6)ациламино, карбокси, трифторметила, (C6-C10)арила, 5-10-членных гетероциклов, содержащих азот, (C6-C10)арил(C1-C6)алкила, гидрокси(C1-C6)алкила, (C1-C6)алкокси(C1-C6)алкила;
или группы формулы

где p равняется 0 или 2 и
Z представляет собой гидрокси, (C1-C6)алкокси или NR1R2, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, (C1-C6)алкила;
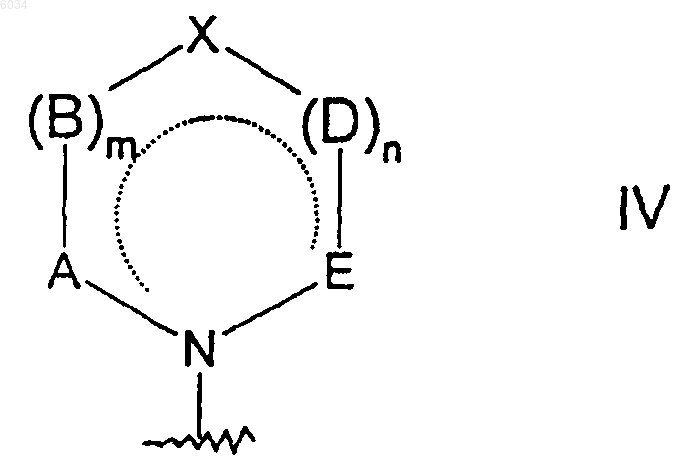
или когда n равняется по меньшей мере 1, а каждый из D и E или из D и X представляет собой CR7R8, тогда соседние R7 группы, взятые вместе с углеродами, к которым они присоединены, могут образовывать группы формулы
где пунктирные линии обозначают возможные двойные связи;
a равняется 1;
m равняется 0 или 1;
A, B и X представляют собой CR7R8, где R7 и R8 такие, как определено выше; и
каждый из G, J, L и M представляет собой CR7R8, где R7 и R8 такие, как определено выше;
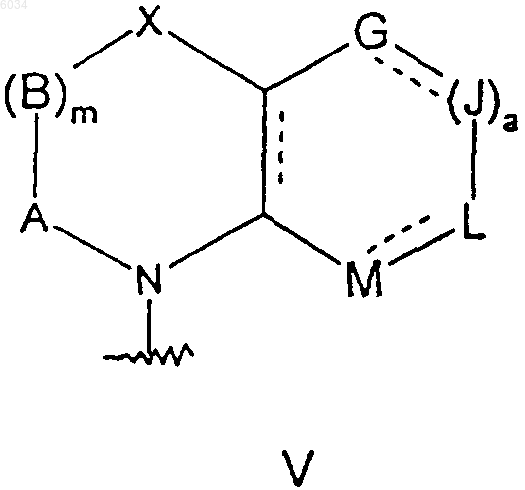
или когда n равняется 1, а каждый из D и E представляет собой CR7R8, и m равняется 1, а каждый из A и B представляет собой CR7R8, тогда соответственные соседние R7 группы, взятые вместе с углеродами, к которым они присоединены, могут образовывать группу формулы
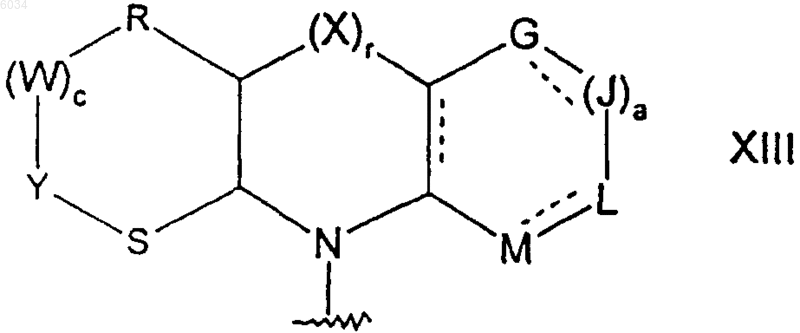
где пунктирные линии обозначают возможные двойные связи;
a равняется 1;
G, J, L и M такие, как определено выше,
r равняется 0,
c равняется 1 и
каждый из R, W, Y и S независимо представляет собой CR7R8, где R7 и R8 такие, как определено выше;
R2 выбран из группы, состоящей из водорода, циано, триэтилсиланилэтинила, галогено, или R2 представляет собой (C6-C10)арил, возможно замещенный одним-тремя галогено, (C1-C6)алкилом, трифторметилом, гидрокси(C1-C6)алкилом, (C1-C6)алкокси, (C1-C6)алкоксикарбонилом,
R3 выбран из группы, состоящей из водорода, галогено, (C1-C6)алкила, (C6-C10)арила и тиенила,
при условии, что когда A, B или X в формуле V определено как CR7R8, тогда R2 и/или R3 должны быть галогено;
при условии, что когда каждый из R2 и R3 независимо представляет собой водород или (C1-C6)алкил, тогда R1 не может быть незамещенным пиперидинилом,
при условии, что когда каждый из R2 и R3 представляет собой водород, тогда R1 не может быть незамещенным морфолинилом или пирролидинилом;
при условии, что когда каждый из R2 и R3 представляет собой водород, тогда R1 не может быть пиперазинилом; и
при условии, что группы формул IV, V или XIII не содержат два или более чем два атома кислорода в соседних положениях.
2. Соединение по п.1, где R1 представляет собой группу формулы

где пунктирная линия обозначает возможные двойные связи;
m равняется 0, 1 или 2;
n равняется 1 или 2,
X представляет собой кислород, NR6 или CR7R8;
каждый из B и D представляет собой CR7R8;
каждый из A и E независимо представляет собой CR7R8;
или когда n равняется 1, а каждый из D и E представляет собой CR7R8, и m равняется 1, а каждый из A и B представляет собой CR7R8, тогда соответственные соседние R7 группы, взятые вместе с углеродами, к которым они присоединены, могут образовывать группу формулы
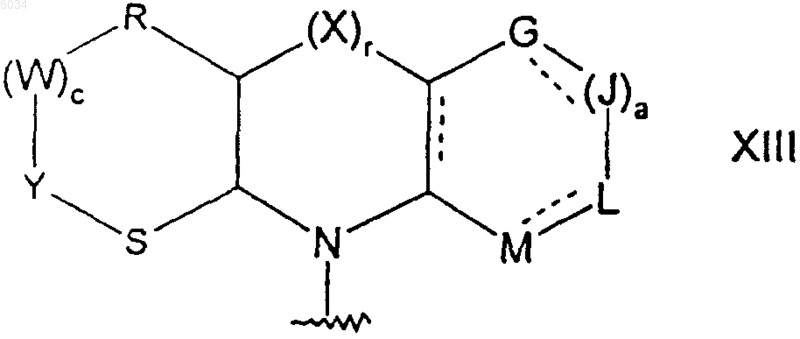
где пунктирные линии обозначают возможные двойные связи;
a равняется 1;
G, J, L и M такие, как определено выше;
r равняется 0;
c равняется 1; и
каждый из R, W, Y и S независимо представляет собой CR7R8, где R7 и R8 такие, как определено выше.
3. Соединение по п.1, где R2 выбран из группы, состоящей из водорода и (C6-C10)арила, и R3 независимо выбран из группы, состоящей из водорода, (C1-C6)алкила и (C6-C10)арила.
4. Соединение по п.1, где указанное соединение выбрано из группы, состоящей из
5-хлор-4-пиперидин-1-ил-7H-пирроло[2,3-d]пиримидина,
5-хлор-4-(октагидроиндол-1-ил)-7H-пирроло[2,3-d]пиримидина,
5-этинил-4-пиперидин-1-ил-7H-пирроло[2,3-d]пиримидина и
4-(3,3-диметилпиперидин-1-ил)-7H-пирроло[2,3-d]пиримидина.
Текст
006034 Предпосылки изобретения Настоящее изобретение относится к пирроло[2,3-d]пиримидиновым соединениям, которые являются ингибиторами протеинтирозинкиназ, таких как фермент Janus киназа 3 (ниже упоминаемый также какJAK3), и в этом качестве пригодны в терапии как иммуносупрессорные агенты для трансплантатов органов, в терапии волчанки, рассеянного склероза, ревматоидного артрита, псориаза, диабета типа I и осложнений диабета, рака, астмы, атопического дерматита, аутоиммунных расстройств щитовидной железы, неспецифического язвенного колита, болезни Крона, болезни Альцгеймера, лейкоза и при других показаниях, где иммуносупрессия была бы желательна. Данное изобретение также относится к способу применения таких соединений в лечении указанных показаний у млекопитающих, особенно людей, и к фармацевтическим композициям, пригодным для этого.JAK3 является представителем Janus семейства протеинтирозинкиназ. Хотя другие представители этого семейства экспрессируются, по существу, всеми тканями, экспрессия JAK3 ограничена кроветворными клетками. Это согласуется с ее существенной ролью в передаче сигнала через рецепторы для IL-2, IL-4,IL-7, IL-9 и IL-15 путем нековалентного соединения JAK3 с гамма-цепью, общей для этих многоцепочечных рецепторов. Были выявлены группы больных XSCID (X-Linked Severe Combined Immunodeficiency,Х-сцепленный тяжелый комбинированный иммунодефицит) с сильно сниженными уровнями JAK3 белка или с генетическими дефектами общей гамма-цепи, что означает, что иммуносупрессия является результатом блокирования передачи сигналов по JAK3 пути. Исследования на животных позволили предположить, что JAK3 не только играет решающую роль в созревании В и Т лимфоцитов, но она также существенно необходима для поддержания функции Т клеток. Модуляция иммунной активности посредством этого нового механизма может оказаться полезной при лечении Т-клеточных пролиферативных нарушений, таких как отторжение трансплантата и аутоиммунные заболевания. Краткое изложение сущности изобретения Настоящее изобретение относится к соединению формулы или его фармацевтически приемлемой соли; где R1 представляет собой группу формулы где пунктирная линия обозначает возможные двойные связи;n равняется 0, 1, 2 или 3; каждый из X, В и D независимо представляет собой кислород, S(O)d, где d равняется 0, 1 или 2, NR6 или CR7R8; каждый из А и Е представляет собой CR7R8; иaлкилa, где R13 представляет собой R20O или R20R21N, где каждый из R20 и R21 независимо выбран из группы, состоящей из водорода, (С 1-С 6)алкила, (С 6-С 10)арил(С 1-С 6)алкила или (С 5-С 9)гетероарил(С 1-С 6) алкила; или R14(C2-C6)aлкилa, где R14 представляет собой (C1-С 6)ацилпиперазино, (С 6-С 10)арилпиперазино,(С 5-С 9)гетероарилпиперазино, (C1-С 6)алкилпиперазино, (С 6-С 10)арил(С 1-С 6)алкилпиперазино, (С 5-С 9)гетероарил(С 1-С 6)алкилпиперазино, морфолино, тиоморфолино, пиперидино, пирролидино, пиперидил, (С 1-С 6) алкилпиперидил, (С 6-С 10)арилпиперидил, (С 5-С 9)гетероарилпиперидил, (С 6-С 10)арил(С 1-С 6)алкилпиперидил,(С 5-С 9)гетероарил(С 1-С 6)алкилпиперидил, (С 1-С 6)алкоксиацил, (С 1-С 6)алкиламиноарил, С 1-С 6)алкил)2 аминоацил или (С 1-С 6)ацилпиперидил;-1 006034 каждый из R7 и R8 независимо выбран из группы, состоящей из водорода, дейтерия, (С 1-С 6)алкила,амино, гидрокси, (С 1-С 6)алкокси, (С 1-С 6)алкиламино, С 1-С 6)алкил)амино, (С 1-С 6)ациламино, (С 1-С 6) ацил(С 1-С 6)алкиламино, карбокси, (С 1-С 6)алкоксиацила, (С 1-С 6)алкиламиноацила, С 1-С 6)алкил)2 аминоацила, аминоацила, трифторметила, трифторметил(С 1-С 6)алкила, (С 1-С 6)алкил(дифторметилена), (С 1-С 3) алкил(дифторметилен)(С 1-С 3)алкила, (С 6-С 10)арила, (C5-С 9)гетероарила, (С 6-С 10)арил(С 1-С 6)алкила, (С 5-С 9) гетероарил(С 1-С 6)алкила, (С 6-С 10)арил(С 6-С 10)арила, (С 6-С 10)арил(С 6-С 10)арил(С 1-С 6)алкила, (С 3-С 6)циклоалкила, (С 3-С 6)циклоалкил(С 1-С 6)алкила, гидрокси(С 1-С 6)алкила, (С 1-С 6)ацилокси(С 1-С 6)алкила, (С 1-С 6) алкокси(С 1-С 6)алкила, пиперазинил(С 1-С 6)алкила, (C1-С 6)ациламино(С 1-С 6)алкила, пиперидила, (С 1-С 6) алкилпиперидила, (С 6-С 10)арил(С 1-С 6)алкокси(С 1-С 6)алкила, (С 5-С 9)гетероарил(С 1-С 6)алкокси(С 1-С 6)алкила,(С 1-С 6)алкилтио(С 1-С 6)алкила, (С 6-С 10)арилтио(С 1-С 6)алкила, (С 1-С 6)алкилсульфинил(С 1-С 6)алкила, (С 6-С 10) арилсульфинил(С 1-С 6)алкила, (C1-С 6)алкилсульфонил(С 1-С 6)алкила, (С 6-С 10)арилсульфонил(С 1-С 6)алкила,амино(С 1-С 6)алкила, (С 1-С 6)алкиламино(С 1-С 6)алкила, С 1-С 6)алкил)2 амино(С 1-С 6)алкила, R13CO(С 1-С 6)aлкилa или R13CO(C3-C10)циклoaлкилa, где R13 представляет собой R20O или R20R21N, где каждый из R20 иR21 независимо выбран из группы, состоящей из водорода, (С 1-С 6)алкила, (С 6-С 10)арил(С 1-С 6)алкила илиZ представляет собой гидрокси, (С 1-С 6)алкокси или NR1R2, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, (С 1-С 6)алкила, пиперидила, (С 1-С 6)алкилпиперидила, (С 6-С 10) арилпиперидила, (С 5-С 9)гетероарилпиперидила, (С 6-С 10)арил(С 1-С 6)алкилпиперидила, (С 5-С 9)гетероарил(С 1-С 6)алкилпиперидила, (С 1-С 6)ацилпиперидила, (С 6-С 10)арила, (С 5-С 9)гетероарила, (С 6-С 10)арил(С 1-С 6) алкила, (С 5-С 9)гетероарил(С 1-С 6)алкила, (С 6-С 10)арил(С 6-С 10)арила, (С 6-С 10)арил(С 6-С 10)арил(С 1-С 6)алкила,(С 3-С 6)циклоалкила, (С 3-С 6)циклоалкил(С 1-С 6)алкила, R5(C1-C6)aлкилa, (C1-C5)aлкил(CHR5)(C1-С 6)алкила,где R5 представляет собой гидрокси, (С 1-С 6)ацилокси, (C1-С 6)алкокси, пиперазино, (С 1-С 6)ациламино,(С 1-С 6)алкилтио, (С 6-С 10)арилтио, (С 1-С 6)алкилсульфинил, (С 6-С 10)арилсульфинил, (С 1-С 6)алкилсульфоксил,(С 6-С 10)арилсульфоксил, амино, (С 1-С 6)алкиламино, С 1-С 6)алкил)2 амино, (C1-С 6)ацилпиперазино, (С 1-С 6) алкилпиперазино, (С 6-С 10)арил(С 1-С 6)алкилпиперазино, (С 5-С 9)гетероарил(С 1-С 6)алкилпиперазино, морфолино, тиоморфолино, пиперидино или пирролидино; R6(С 1-С 6)алкила, (C1-C5)aлкил(CHR6)(C1-С 6)алкила,где R6 представляет собой пиперидил, (С 1-С 6)алкилпиперидил, (С 6-С 10)арилпиперидил, (С 6-С 10)арил(С 1-С 6) алкилпиперидил, (C5-С 9)гетероарилпиперидил или (С 5-С 9)гетероарил(С 1-С 6)алкилпиперидил; или когда n равняется по меньшей мере 1, а каждый из D и Е или D и Х представляет собой CR7R8,тогда соседние R7 группы, взятые вместе с углеродами, к которым они присоединены, могут образовывать группы формул где пунктирные линии обозначают возможные двойные связи; а равняется 0,1 или 2;m, А, В и Х такие, как определено выше; и каждый из G, J, L и М независимо представляет собой кислород, S(O)d, где d равняется 0, 1 или 2,NR6 или CR7R8, где R6, R7 и R8 такие, как определено выше; или когда n равняется 1, а каждый из D и Е представляет собой CR7R8, и m равняется 1, а каждый из А и В представляет собой CR7R8, тогда соответствующие соседние R7 группы, взятые вместе с углеродами, к которым они присоединены, могут образовывать группу формулы где пунктирные линии обозначают возможные двойные связи; а, G, J, L и М такие, как определено выше;r равняется 0 или 1; с равняется 0, 1 или 2; и каждый из R, W, Y и S независимо представляет собой кислород, S(O)d, где d равняется 0, 1 или 2,NR6 или CR7R8, где R6, R7 и R8 такие, как определено выше; каждый из R2 и R3 независимо выбран из группы, состоящей из водорода, дейтерия, амино, галогено,гидрокси, нитро, карбокси, (С 2-С 6)алкенила, (С 2-С 6)алкинила, трифторметила, трифторметокси, (С 1-С 6) алкила, (С 1-С 6)алкокси, где алкильные или алкоксигруппы возможно замещены группами в количестве от одной до трех, выбранными из галогено, гидрокси, карбокси, амино(C1-С 6)алкилтио, (С 1-С 6)алкиламино,С 1-С 6)алкил)2 амино, (С 5-С 9)гетероарила, (C2-С 9)гетероциклоалкила, (С 3-С 9)циклоалкила или (С 6-С 10) арила; или каждый из R2 и R3 независимо представляет собой (С 3-С 10)циклоалкил, (С 3-С 10)циклоалкокси,(С 1-С 6)алкиламино, С 1-С 6)алкил)2 амино, (С 6-С 10)ариламино, (С 1-С 6)алкилтио, (С 6-С 10)арилтио, (С 1-С 6) алкилсульфинил, (С 6-С 10)арилсульфинил, (C1-С 6)алкилсульфонил, (С 6-С 10)арилсульфонил, (С 1-С 6)ацил,(С 1-С 6)алкокси-СО-NH-, (С 1-С 6)алкиламино-СО-, (С 5-С 9)гетероарил, (С 2-С 9)гетероциклоалкил или (С 6-С 10) арил, где гетероарильные, гетероциклоалкильные и арильные группы возможно замещены 1-3 галогено,(С 1-С 6)алкилом, (С 1-С 6)алкил-СО-NН-, (C1-С 6)алкокси-СО-NН-, (С 1-С 6)алкил-СО-NН-(С 1-С 6)алкилом, (С 1-С 6) алкокси-СО-NН-(С 1-С 6)алкилом, (С 1-С 6)алкокси-СО-NН-(С 1-С 6)алкокси, карбокси, карбокси(С 1-С 6)алкилом,карбокси(С 1-С 6)алкокси, бензилоксикарбонил(С 1-С 6)алкокси, (С 1-С 6)алкоксикарбонил(С 1-С 6)алкокси, (С 6-С 10) арилом, амино, амино(С 1-С 6)алкилом, (С 1-С 6)алкоксикарбониламино, (С 6-С 10)арил(С 1-С 6)алкоксикарбониламино, (С 1-С 6)алкиламино, С 1-С 6)алкил)2 амино, (C1-С 6)алкиламино(С 1-С 6)алкилом, С 1-С 6)алкил)2 амино(С 1-С 6)алкилом, гидрокси, (С 1-С 6)алкокси, карбокси, карбокси(С 1-С 6)алкилом, (С 1-С 6)алкоксикарбонилом, (С 1-С 6)алкоксикарбонил(С 1-С 6)алкилом, (С 1-С 6)алкокси-СО-NН-, (С 1-С 6)алкил-CO-NH-, циано,(С 5-С 9)гетероциклоалкилом, амино-CO-NH-, (С 1-С 6)алкиламино-CO-NH-, С 1-С 6)алкил)2 амино-СО-NН-,(С 6-С 10)ариламино-СО-NН-, (C5-С 9)гетероариламино-СО-NН-, (С 1-С 6)алкиламино-СО-NН-(С 1-С 6)алкилом,C1-С 6)алкил)2 амино-СО-NН-(С 1-С 6)алкилом, (С 6-С 10)ариламино-СО-NН-(С 1-С 6)алкилом, (С 5-С 9)гетероариламино-СО-NН-(С 1-С 6)алкилом, (С 1-С 6)алкилсульфонилом, (С 1-С 6)алкилсульфониламино, (С 1-С 6)алкилсульфониламино(С 1-С 6)алкилом, (С 6-С 10)арилсульфонилом, (С 6-С 10)арилсульфониламино, (С 6-С 10)арилсульфониламино(С 1-С 6)алкилом, (С 1-С 6)алкилсульфониламино, (C1-С 6)алкилсульфониламино(С 1-С 6)алкилом,(С 5-С 9)гетероарилом или (С 2-С 9)гетероциклоалкилом; при условии, что когда А, В или Х в формулах V или VI определены как NR6 или CR7R8, то R2 и/или 3R должны быть галогено; при условии, что когда каждый из R2 и R3 независимо представляет собой водород или (С 1-С 6)алкил,1 то R не может быть незамещенным пиперидинилом; при условии, что когда каждый из R2 и R3 представляет собой водород, то R1 не может быть незамещенным морфолинилом или пирролидинилом; при условии, что когда каждый из R2 и R3 представляет собой водород, то R1 не может быть пиперазинилом; и при условии, что группы формул IV, V, VI или XIII не содержат два или более чем два атомов кислорода, серы или их комбинации в соседних положениях. Настоящее изобретение также относится к фармацевтически приемлемым солям присоединения кислот соединений формулы I. Кислотами, используемыми для получения фармацевтически приемлемых солей присоединения кислот вышеупомянутых основных соединений по данному изобретению, являются такие кислоты, которые образуют нетоксичные соли присоединения кислот, то есть соли, содержащие фармакологически приемлемые анионы, такие как соли гидрохлориды, гидробромиды, гидроиодиды, нитраты, сульфаты, бисульфаты, фосфаты, кислые фосфаты, ацетаты, лактаты, цитраты, кислые цитраты, тартраты, битартраты, сукцинаты, малеаты, фумараты, глюконаты, сахараты, бензоаты, метансульфонаты, этансульфонаты, бензолсульфонаты, п-толуолсульфонаты и памоаты [то есть 1,1'-метилен-бис-(2-гидрокси-3-нафтоаты)]. Изобретение также относится к солям присоединения оснований формулы I. Химическими основаниями, которые можно использовать в качестве реагентов для получения фармацевтически приемлемых солей оснований тех соединений формулы I, которые являются кислыми по своей природе, являются такие основания, которые образуют нетоксичные соли оснований с такими соединениями. Такие нетоксичные соли оснований включают в себя соли, полученные с такими фармацевтически приемлемыми катионами, как катионы щелочных металлов (например, калия и натрия) и катионы щелочно-земельных металлов (например, кальция и магния), аммонийные или водорастворимые соли присоединения аминов,-3 006034 такие как N-метилглюкамин(меглюмин), и (низший алканол)аммониевые и другие соли фармацевтически приемлемых органических аминов, но не ограничены ими. Используемый здесь термин "алкил", если не указано иного, включает в себя насыщенные одновалентные углеводородные радикалы, имеющие прямые, разветвленные или циклические группировки или их комбинации. Используемый здесь термин "алкокси" включает в себя O-алкильные группы, где "алкил" определен выше. Используемый здесь термин "галогено", если не указано иного, включает в себя фтор, хлор, бром или иод. Соединения по данному изобретению могут содержать двойные связи. Когда такие связи в них присутствуют, соединения по изобретению существуют в виде цис- и транс-конфигураций и их смесей. Если не указано иного, алкильные и алкенильные группы, упоминаемые здесь, а также алкильные группировки других групп, упоминаемых здесь (например, алкокси), могут быть линейными или разветвленными, а также они могут быть циклическими (например, циклопропил, циклобутил, циклопентил, циклогексил или циклогептил), либо могут быть линейными или разветвленными и содержать циклические группировки. Если не указано иного, галоген включает в себя фтор, хлор, бром и иод. Используемый здесь термин (С 3-С 10)циклоалкил относится к циклоалкильным группам, содержащим от нуля до двух уровней ненасыщенности, таким как циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, 1,3-циклогексадиен, циклогептил, циклогептенил, бицикло[3,2,1]октан,норборнанил и так далее. Используемый здесь термин (С 2-С 9)гетероциклоалкил относится к пирролидинилу, тетрагидрофуранилу, дигидрофуранилу, тетрагидропиранилу, пиранилу, тиопиранилу, азиридинилу, оксиранилу, метилендиоксилу, хроменилу, изоксазолидину, 1,3-оксазолидин-3-илу, изотиазолидинилу, 1,3-тиазолидин-3-илу,1,2-пиразолидин-2-илу, 1,3-пиразолидин-1-илу, пиперидинилу, тиоморфолинилу, 1,2-тетрагидротиазин 2-илу, 1,3-тетрагидротиазин-3-илу, тетрагидротиадиазинилу, морфолинилу, 1,2-тетрагидродиазин-2-илу,1,3-тетрагидродиазин-1-илу, тетрагидроазепинилу, пиперазинилу, хроманилу и так далее. Специалисту в данной области очевидно, что присоединение указанных (С 2-С 9)гетероциклоалкильных колец происходит через углеродный или sp3-гибридизированный гетероатом азота. Используемый здесь термин (С 2-С 9)гетероарил относится к фурилу, тиенилу, тиазолилу, пиразолилу,изотиазолилу, оксазолилу, изоксазолилу, пирролилу, тиазолилу, тетразолилу, имидазолилу, 1,3,5-оксадиазолилу, 1,2,4-оксадиазолилу, 1,2,3-оксадиазолилу, 1,3,5-тиадиазолилу, 1,2,3-тиадиазолилу, 1,2,4-тиадиазолилу, пиридилу, пиримидилу, пиразинилу, пиридазинилу, 1,2,4-триазинилу, 1,2,3-триазинилу,1,3,5-триазинилу, пиразоло[3,4-b]пиридинилу, циннолинилу, птеридинилу, пуринилу, 6,7-дигидро-5 Н[1]пириндинилу, бензо[b]тиофенилу, 5,6,7,8-тетрагидрохинолин-3-илу, бензоксазолилу, бензотиазолилу,бензизотиазолилу, бензизоксазолилу, бензимидазолилу, тианафтенилу, изотианафтенилу, бензофуранилу,изобензофуранилу, изоиндолилу, индолилу, индолизинилу, индазолилу, изохинолилу, хинолилу, фталазинилу, хиноксалинилу, хиназолинилу, бензоксазинилу и так далее. Специалисту в данной области очевидно, что присоединение указанных (С 2-С 9)гетероциклоалкильных колец происходит через атом углерода или sр 3-гибридизированный гетероатом азота. Используемый здесь термин (С 6-С 10)арил относится к фенилу или нафтилу. Соединения формулы I можно вводить в фармацевтически приемлемой форме либо сами по себе,либо в сочетании с одним или более чем одним вспомогательным агентом, модулирующим иммунную систему млекопитающих, или с противовоспалительными агентами. Эти агенты могут включать в себя циклоспорин А (например, Sandimmune или Neoral), рапамицин, FK-506 (Tacrolimus), лефлюномид,дезоксиспергуалин, микофенолат (например, Cellcept), азатиоприн (например, Imuran), даклизумаб(например, Zenapax), OKT3 (например, Orthoclone), AtGam, аспирин, ацетаминофен, ибупрофен, напроксен, пироксикам и противовоспалительные стероиды (например, преднизолон или дексаметазон), но не ограничиваются ими. Эти агенты можно вводить как часть тех же самых или отдельных лекарственных форм посредством тех же самых или отличных путей введения и в соответствии с теми же самыми или отличными схемам введения согласно стандартной фармацевтической практике. Соединения по данному изобретению включают в себя все конфигурационные изомеры (например,цис- и транс-изомеры) и все оптические изомеры соединения формулы I (например, энантиомеры и диастереомеры), а также рацемические, диастереомерные и другие смеси таких изомеров. Данное изобретение также включает в себя все поворотные изомеры соединения формулы I, так же как их смеси. Предпочтительные соединения формулы I включают в себя такие соединения, где R1 представляет собой группу формулы-4 006034 где пунктирная линия обозначает возможные двойные связи;n равняется 0, 1, 2 или 3; каждый из X, В и D независимо представляет собой кислород, S(O)d, где d равняется 0, 1 или 2, NR6 или CR7R8; каждый из А и Е независимо представляет собой CR7R8 или NR6; или когда n равняется 1, а каждый из D и Е представляет собой CR7R8, и m равняется 1, а каждый из А и В представляет собой CR7R8, то соответствующие соседние R7 группы, взятые вместе с углеродами,к которым они присоединены, могут образовывать группу формулы где пунктирная линия обозначает возможные двойные связи;r равняется 0 или 1; с равняется 0, 1 или 2; и каждый из R, W, Y и S независимо представляет собой кислород, S(O)d, где d равняется 0, 1 или 2,NR6 или CR7R8, где R6, R7 и R8 такие, как определено выше. Другие предпочтительные соединения формулы I включают в себя те соединения, в которых каждый из R2 и R3 независимо выбран из группы, состоящей из водорода, (С 1-С 6)алкила, (С 1-С 6)алкокси, (С 3-С 10) циклоалкила, (С 2-С 9)гетероциклоалкила, (С 2-С 9)гетероарила или (С 6-С 10)арила. Конкретные предпочтительные соединения формулы I включают в себя следующие: 5-фтор-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин; 4-пиперидин-1-ил-5-трифторметил-7 Н-пирроло[2,3-d]пиримидин; 2-3-этил-4-[метил-(7 Н-пирроло[2,3-d]пиримидин-4-ил)амино]циклопентилпропан-2-ол; 2-3-этил-4-[(2-гидроксиэтил)-(7 Н-пирроло[2,3-d]пиримидин-4-ил)амино]циклопентилпропан-2-ол;N,N-диметил-N'-[3-(4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин-5-ил)бензил]этан-1,2-диамин; 2-[1-(5-м-толил-7 Н-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-ил]этанол; 5-(3-изопропилфенил)-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин; 5-(3-метил-3 Н-имидазол-4-ил)-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин; 5-(1-метил-1 Н-имидазол-4-ил)-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиpимидин; 5-(2-метилпиридин-4-ил)-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин; 5-хлор-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин; 5-хлор-4-(октагидроиндол-1-ил)-7 Н-пирроло[2,3-d]пиримидин; 5-этинил-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин; 4-пиперидин-1-ил-5-м-толил-7 Н-пирроло[2,3-d]пиримидин; и 4-(3,3-диметил-пиперидин-1-ил)-7 Н-пирроло[2,3-d]пиримидин. Настоящее изобретение также относится к фармацевтической композиции для (а) лечения или предотвращения расстройства или состояния, выбранного из отторжения трансплантата органа, волчанки,рассеянного склероза, ревматоидного артрита, псориаза, диабета типа I и осложнений диабета, рака, астмы,атопического дерматита, аутоиммунных расстройств щитовидной железы, неспецифического язвенного колита, болезни Крона, болезни Альцгеймера, лейкоза и других аутоиммунных заболеваний, или (б) ингибирования протеинтирозинкиназ или Janus киназы 3 (JAK3) у млекопитающего, включая человека,содержащей количество соединения формулы I или его фармацевтически приемлемой соли, эффективное при таких расстройствах или состояниях, и фармацевтически приемлемый носитель. Настоящее изобретение также относится к фармацевтической композиции для (а) лечения или предотвращения расстройства или состояния, выбранного из отторжения трансплантата органа, волчанки,рассеянного склероза, ревматоидного артрита, псориаза, диабета типа I и осложнений диабета, рака, астмы,атопического дерматита, аутоиммунных расстройств щитовидной железы, неспецифического язвенного колита, болезни Крона, болезни Альцгеймера, лейкоза и других аутоиммунных заболеваний, или (б) ингибирования протеинтирозинкиназ или Janus киназы 3 (JAK3) у млекопитающего, включая человека,содержащей количество соединения формулы I или его фармацевтически приемлемой соли, одного или в сочетании с Т-клеточными иммуносупрессорными или противоспалительными агентами, эффективное при таких расстройствах или состояниях, и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу ингибирования протеинтирозинкиназ или Janus киназы 3 (JAK3) у млекопитающего, включая человека, при котором указанному млекопитающему вводят эффективное количество соединения формулы I или его фармацевтически приемлемой соли.-5 006034 Настоящее изобретение также относится к способу лечения или предотвращения расстройства или состояния, выбранного из отторжения трансплантата органа, волчанки, рассеянного склероза, ревматоидного артрита, псориаза, диабета типа I и осложнений диабета, рака, астмы, атопического дерматита,аутоиммунных расстройств щитовидной железы, неспецифического язвенного колита, болезни Крона,болезни Альцгеймера, лейкоза и других аутоиммунных заболеваний, у млекопитающего, включая человека, при котором указанному млекопитающему вводят количество соединения формулы I или его фармацевтически приемлемой соли, эффективное при лечении такого состояния. Настоящее изобретение также относится к способу ингибирования протеинтирозинкиназ или Janus киназы 3 (JAK3) у млекопитающего, включая человека, при котором указанному млекопитающему вводят эффективное количество соединения формулы I или его фармацевтически приемлемой соли, одного или в сочетании с Т-клеточными иммуносупрессорными или противоспалительными агентами. Настоящее изобретение также относится к способу лечения или предотвращения расстройства или состояния, выбранного из отторжения трансплантата органа, волчанки, рассеянного склероза, ревматоидного артрита, псориаза, диабета типа I и осложнений диабета, рака, астмы, атопического дерматита,аутоиммунных расстройств щитовидной железы, неспецифического язвенного колита, болезни Крона,болезни Альцгеймера, лейкоза и других аутоиммунных заболеваний, у млекопитающего, включая человека, при котором указанному млекопитающему вводят количество соединения формулы I или его фармацевтически приемлемой соли, одного или в сочетании с Т-клеточными иммуносупрессивными или противовоспалительными агентами, эффективное при лечении такого состояния. Подробное описание изобретения Следующие реакционные схемы иллюстрируют получение соединений по данному изобретению. Если не указано иного, то R1, R2, R3 и R9 в следующих ниже реакционных cхемах и обсуждении являются такими, как определено выше. Схема 1 В реакции 1 cхемы 1 4-хлорпирроло[2,3-d]пиримидиновое соединение формулы XVII превращают в соответствующее соединение формулы XVI, где R представляет собой бензолсульфонил или бензил, путем обработки XVII бензолсульфонилхлоридом, бензилхлоридом или бензилбромидом в присутствии основания, такого как гидрид натрия или карбонат калия, и полярного апротонного растворителя, такого как диметилформамид или тетрагидрофуран. Реакционную смесь перемешивают при температуре между приблизительно 0 С и приблизительно 70 С, предпочтительно при приблизительно 30 С, в течение промежутка времени между приблизительно 1 ч и приблизительно 3 ч, предпочтительно приблизительно 2 ч. В реакции 2 cхемы 1 это 4-хлорпирроло[2,3-d]пиримидиновое соединение формулы XVI превращают в соответствующее 4-аминопирроло[2,3-d]пиримидиновое соединение формулы XV путем сочетания XVI с соединением формулы R1H. Реакцию проводят в спиртовом растворителе, таком как третбутанол, метанол или этанол, или других высококипящих органических растворителях, таких как диметилформамид, 1,4-диоксан или 1,2-дихлорэтан, при температуре между приблизительно 60 С и приблизительно 120 С, предпочтительно при приблизительно 80 С. Обычно длительности реакций находятся в пределах между приблизительно 2 ч и приблизительно 48 ч, предпочтительно составляют приблизительно 16 ч. В реакции 3 cхемы 1 удаление защитной группы с соединения формулы XV, где R представляет собой бензолсульфонил, с получением соответствующего соединения формулы I проводят путем обработки XV щелочным основанием, таким как гидроксид натрия или гидроксид калия, в спиртовом растворителе, таком как метанол или этанол, или в смешанных растворителях, таких как спирт/тетрагидрофуран или спирт/вода. Реакцию проводят при комнатной температуре в течение промежутка времени между приблизительно 15 мин и приблизительно 1 ч, предпочтительно в течение 30 мин. Удаление защитной группы с соединения формулы XV, где R представляет собой бензил, проводят путем обработки XV натрием в аммиаке при температуре приблизительно -78 С в течение промежутка времени между приблизительно 15 мин и приблизительно 1 ч. В реакции 1 cхемы 2 4-хлорпирроло[2,3-d]пиримидиновое соединение формулы XXI, где R представляет собой водород или бензолсульфонат, превращают в 4-хлор-5-галогенопирроло[2,3-d]пиримидиновое соединение формулы XX, где Y представляет собой хлор, бром или иод, путем взаимодействияXXI с N-хлоросукцинимидом, N-бромосукцинимидом или N-иодосукцинимидом. Реакционную смесь нагревают с обратным холодильником в хлороформе в течение промежутка времени между приблизительно 1 ч и приблизительно 3 ч, предпочтительно приблизительно 1 ч. Альтернативно в реакции 1cхемы 2 это 4-хлорпирроло[2,3-d]пиримидиновое соединение формулы XXI, где R представляет собой водород, превращают в соответствующий 4-хлор-5-нитропирроло[2,3-d]пиримидин формулы XX, где Y представляет собой нитро, путем взаимодействия XXI с азотной кислотой в серной кислоте при температуре между приблизительно -10 С и приблизительно 10 С в течение промежутка времени между приблизительно 5 мин и приблизительно 15 мин, предпочтительно в течение приблизительно 10 мин. Соединение формулы XXI, где Y представляет собой нитро, превращают в соответствующий 4-хлор-5-аминопирроло[2,3-d]пиримидин формулы XX, где Y представляет собой амино, путем взаимодействия XXI с соблюдением ряда условий, известных специалистам, таких как палладиевый гидрогенолиз или хлорид олова (IV) и соляная кислота. В реакции 2 cхемы 2 это 4-хлор-5-галогенопирроло[2,3-d]пиримидиновое соединение формулы XX,где R представляет собой водород, превращают в соответствующее соединение формулы XIX, где R2 представляет собой (С 1-С 6)алкил или бензил, путем обработки XX N-бутиллитием при температуре приблизительно -78 С, и взаимодействия образованного таким образом промежуточного дианионного соединения с алкилгалогенидом или бензилгалогенидом при температуре между приблизительно -78 С и комнатной температурой, предпочтительно при комнатной температуре. Альтернативно образованный таким образом дианион подвергают взаимодействию с молекулярным кислородом с образованием соответствующего 4-хлор-5-гидроксипирроло[2,3-d]пиримидинового соединения формулы XIX, где R2 является гидрокси. Соединение формулы XX, где Y представляет собой бром или иод и R является бензолсульфонатом, превращают в соединение формулы XIX, где R2 представляет собой (С 6-С 12)арил или винил, путем обработки XX N-бутиллитием при температуре приблизительно -78 С с последующим добавлением хлорида цинка при температуре приблизительно -78 С. Образованное таким образом соответствующее органоцинковое промежуточное соединение затем подвергают взаимодействию с арилиодидом или винилиодидом в присутствии каталитического количества палладия. Реакционную смесь перемешивают при температуре между приблизительно 50 С и приблизительно 80 С, предпочтительно при приблизительно 70 С, в течение промежутка времени между приблизительно 1 ч и приблизительно 3 ч,предпочтительно в течение приблизительно 1 ч. В реакции 3 cхемы 2 это соединение формулы XIX превращают в соответствующее соединение формулы XVI путем обработки XIX N-бутиллитием, диизопропиламином лития или гидридом натрия при температуре приблизительно -78 С в присутствии полярного апротонного растворителя, такого как тетрагидрофуран. Образованное таким образом анионное промежуточное соединение дополнительно подвергают взаимодействию с (а) алкилгалогенидом или бензилгалогенидом при температуре между приблизительно -78 С и комнатной температурой, предпочтительно при -78 С, когда R3 представляет собой алкил или бензил; (б) альдегидом или кетоном при температуре между приблизительно -78 С и комнатной температурой, предпочтительно при -78 С, когда R3 представляет собой алкокси; и (в) хлоридом цинка при температуре между приблизительно -78 С и комнатной температурой, предпочтительно при -78 С, и образованное таким образом соответствующее органоцинковое промежуточное соединение затем подвергают взаимодействию с арилиодидом или винилиодидом в присутствии каталитического количества палладия. Полученную в результате реакционную смесь перемешивают при температуре между приблизительно 50 С и приблизительно 80 С, предпочтительно при приблизительно 70 С, в течение промежутка времени между приблизительно 1 ч и приблизительно 3 ч, предпочтительно в течение приблизительно 1 ч. Альтернативно образованный таким образом анион подвергают взаимодействию с молекулярным кислородом с образованием соответствующего 4-хлор-6-гидроксипирроло[2,3-d]пиримидинового соединения формулы XVI, где R3 является гидрокси. В реакции 1 cхемы 3 4-хлоропирроло[2,3-d]пиримидиновое соединение формулы XXI превращают в соответствующее соединениe формулы XXII в соответствии с методикой, описанной выше для реакции 3 cхемы 2. В реакции 2 cхемы 3 это соединение формулы XXII превращают в соответствующее соединениe формулы XVI в соответствии с методиками, описанными выше для реакций 1 и 2 cхемы 3. В реакции 1 cхемы 4 4-хлоропирроло[2,3-d]пиримидиновое соединение формулы XX превращают в соответствующее 4-аминопирроло[2,3-d]пиримидиновое соединениe формулы XXIV в соответствии с методикой, описанной выше для реакции 2 cхемы 1. В реакции 2 cхемы 4 это 4-амино-5-галогенопирроло[2,3-d]пиримидиновое соединение формулыXXIV, где R представляет собой бензолсульфонат, a Z представляет собой бром или иод, превращают в соответствующее соединениe формулы XXIII путем взаимодействия XXIV с (а) арилбороновой кислотой, когда R2 представляет собой арил, в апротонном растворителе, таком как тетрагидрофуран или диоксан, в присутствии каталитического количества палладия (0) при температуре между приблизительно 50 С и приблизительно 100 С, предпочтительно при приблизительно 70 С, в течение промежутка времени между приблизительно 2 ч и приблизительно 48 ч, предпочтительно приблизительно 12 ч; (б) алкинами, когда R2 представляет собой алкинил, в присутствии каталитического количества иодида меди (I) и-9 006034 палладия (0) и полярного растворителя, такого как диметилформамид, при комнатной температуре в течение промежутка времени между приблизительно 1 ч и приблизительно 5 ч, предпочтительно приблизительно 3 ч; и (в) алкенами или стиренами, когда R2 представляет собой винил или стиренил, в присутствии каталитического количества палладия в диметилформамиде, диоксане или тетрагидрофуране при температуре между приблизительно 80 С и приблизительно 100 С, предпочтительно при приблизительно 100 С, в течение промежутка времени между приблизительно 2 ч и приблизительно 48 ч, предпочтительно приблизительно 48 ч. В реакции 3 cхемы 4 это соединение формулы XXIII превращают в соответствующее соединениe формулы XV в соответствии с методикой, описанной выше для реакции 3 cхемы 2. Соединения по настоящему изобретению, которые являются основными по своей природе, могут образовывать большое множество разных солей с различными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, на практике часто желательно вначале выделить соединение по настоящему изобретению из реакционной смеси в виде фармацевтически неприемлемой соли, а затем просто превратить последнее обратно в соединение,являющееся свободным основанием, путем обработки щелочным реагентом и последующего превращения последнего свободного основания в фармацевтически приемлемую соль присоединения кислоты. Соли присоединения кислот основных соединений по данному изобретению легко получают путем обработки основного соединения, по существу, эквивалентным количеством выбранной минеральной или органической кислоты в водной среде растворителя или в подходящем органическом растворителе, таком как метанол или этанол. Желаемую твердую соль легко получают путем аккуратного выпаривания растворителя. Желаемую соль кислоты также можно осадить из раствора свободного основания в органическом растворителе путем добавления к этому раствору соответствующей минеральной или органической кислоты. Те соединения по настоящему изобретению, которые являются кислыми по своей природе, могут образовывать соли оснований с различными фармакологически приемлемыми катионами. Примеры таких солей включают в себя соли щелочных металлов или щелочно-земельных металлов, и в частности натриевые и калиевые соли. Все эти соли получают традиционными методами. Химическими основаниями, которые пригодны в качестве реагентов для получения фармацевтически приемлемых солей оснований по данному изобретению, являются основания, которые образуют нетоксичные соли оснований с кислыми соединениями по настоящему изобретению. Такие нетоксичные соли оснований включают в себя соли, полученные с такими фармакологически приемлемыми катионами, как натрий, калий, кальций, магний и так далее. Эти соли можно легко получить, обрабатывая соответствующие кислые соединения водным раствором, содержащим желаемые фармакологически приемлемые катионы, и затем упаривая полученный в результате раствор до сухости, предпочтительно под пониженным давлением. Альтернативно их также можно получить, смешивая вместе растворы в низших спиртах кислых соединений и алкоголята желаемого щелочного металла и затем упаривая полученный в результате раствор до сухости аналогичным описанному выше способом. В обоих случаях предпочтительно используют стехиометрические количества реагентов, чтобы обеспечить полноту реакции и максимальные выходы желаемого конечного продукта. Композиции по настоящему изобретению могут быть составлены традиционным способом с использованием одного или более чем одного фармацевтически приемлемого носителя. Так, активные соединения по изобретению могут быть приготовлены в виде препарата для перорального, трансбуккального, интраназального, парентерального (например, внутривенного, внутримышечного или подкожного) или ректального введения или в форме, подходящей для введения ингаляцией или инсуффляцией. Активные соединения по изобретению также могут быть приготовлены в виде препарата для пролонгированного выделения. Фармацевтические композиции для перорального введения могут принимать форму, например, таблеток или капсул, изготавливаемых традиционными способами с фармацевтически приемлемыми эксципиентами, такими как связывающие агенты (например, прежелатинизированный маисовый крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); разрыхлители (например, картофельный крахмал или натрийгликолят крахмала); или смачивающие агенты (например, лаурилсульфат натрия). Таблетки могут быть покрыты оболочкой способами, хорошо известными в данной области. Жидкие препараты для перорального введения могут принимать форму, например, растворов, сиропов или суспензий, или они могут быть представлены в виде сухого продукта для разведения водой или другим подходящим растворителем перед применением. Такие жидкие препараты могут быть приготовлены традиционными способами с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сироп сорбита, метилцеллюлоза или гидрогенизированные пищевые жиры); эмульгирующие агенты (например, лецитин или аравийская камедь); неводные наполнители (например, миндальное масло, сложные эфиры масел или этиловый спирт); и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота).- 10006034 Для трансбуккального введения композиция может принимать форму таблеток или леденцов, приготовленных традиционным способом. Активные соединения по изобретению могут быть приготовлены в виде препаратов для парентерального введения путем инъекций, включая применение традиционных методов катетеризации или инфузии. Инъекционные препараты могут быть представлены в стандартной лекарственной форме, например в ампулах или многодозовых контейнерах, с добавленным консервантом. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать вспомогательные агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно активный ингредиент может быть в форме порошка для разведения перед применением в подходящем носителе, например стерильной апирогенной воде. Активные соединения по изобретению также могут быть включены в состав ректальных композиций, таких как суппозитории или удерживающие клизмы, например, содержащих традиционные суппозиторные основы, такие как какао масло или другие глицериды. Для интраназального введения или введения ингаляцией активные соединения по изобретению удобно вводить в виде раствора или суспензии из контейнера с распылением путем нагнетания, который сжимает или накачивает пациент, или представленными как аэрозольный спрей в контейнере под давлением или распылитель с использованием подходящего пропеллента, например дихлордифторметана,трихлорфторметана, дихлортетрафторэтана, углекислого газа или другого подходящего газа. В случае аэрозоля под давлением стандартная доза может быть определена путем обеспечения контейнера клапаном для введения отмеренного количества. Контейнер под давлением или распылитель может содержать раствор или суспензию активного соединения. Капсулы и картриджи (сделанные, например, из желатина) для использования в ингаляторе или инсуффляторе можно приготовить в виде препарата, содержащего порошковую смесь соединения по изобретению и подходящей порошковой основы, такой как лактоза или крахмал. Предлагаемая доза активных соединений по изобретению для перорального, парентерального или трансбуккального введения среднему взрослому человеку для лечения состояний, указанных выше (например, астмы), составляет от 0,1 до 1000 мг активного ингредиента на стандартную дозу, которую можно вводить, например, от 1 до 4 раз в день. Аэрозольные препараты для лечения состояний, указанных выше (например, ревматоидного артрита), для среднего взрослого человека предпочтительно компонуют таким образом, чтобы каждая отмерeнная доза или "впрыск" аэрозоля содержали от 20 до 1000 мкг соединения по изобретению. Общая суточная доза в случае аэрозоля будет в пределах от 0,1 до 1000 мг. Введение можно осуществлять несколько раз в сутки, например 2, 3, 4 или 8 раз, давая, например, 1, 2 или 3 дозы каждый раз. Соединение формулы I вводят в фармацевтически приемлемой форме либо одно, либо в сочетании с одним или более чем одним дополнительным агентом, который модулирует иммунную систему млекопитающего, или с противовоспалительными агентами, агентами, которые могут включать в себя, но не ограничены ими, циклоспорин А (например, Sandimmune или Neoral), рапамицин, FK-506 (Tacrolimus),лефлюномид, дезоксиспергуалин, микофенолат (например, Cellcept), азатиоприн (например, Imuran),даклизумаб (например, Zenapax), ОКТ 3 (например, Orthoclone), AtGam, аспирин, ацетаминофен, ибупрофен, напроксен, пироксикам и противовоспалительные стероиды (например, преднизолон или дексаметазон); и такие агенты можно вводить как часть тех же самых или отдельных лекарственных форм посредством тех же самых или отличных путей введения и в соответствии с теми же самыми или отличными схемам введения согласно стандартной фармацевтической практике.FK-506 (Tacrolimus) дают перорально по 0,10-0,15 мг/кг массы тела каждые 12 ч в течение первых 48 ч после операции. Дозу проверяют по уровням проникновения Tacrolimus в сыворотку. Циклоспорин A (Sandimmune, пероральный или внутривенный препарат, или Neoral, пероральный раствор или капсулы) дают перорально по 5 мг/кг массы тела каждые 12 ч в течение первых 48 ч после операции. Дозу проверяют по уровням проникновения циклоспорина А в кровь. Активные агенты можно приготавливать в виде препаратов для пролонгированного введения в соответствии со способами, хорошо известными специалистам в данной области. Примеры таких препаратов можно найти в патентах США 3 538 214, 4 060 598, 4 173 626, 3 119 742 и 3 492 397. Способность соединений формулы I или их фармацевтически приемлемых солей ингибировать Janus киназу 3 и, следовательно, демонстрировать свою эффективность в лечении расстройств или состояний, определяемых Janus киназой 3, показана в следующих in vitro тестах для анализа. Биологический анализ Ферментативный анализ JAK3 (JH1:GST). Для анализа киназы JAK3 использовали белок, экспрессируемый в SF9 клетках, инфицированных бакуловирусом (белок, являющийся продуктом слияния GST и каталитического домена человеческойJAK3), очищенный аффинной хроматографией на глутатион-Сефарозе (Sepaharose). Субстратом реакции является полиглутаминовая кислота-тирозин (PGT (4:1), каталог SigmaP0275), нанесенный на NuncMaxi Sorp планшеты в концентрации 100 мкг/мл на ночь при 37 С. Следующим утром после нанесения планшеты промывали 3 раза и добавляли JAK3 в лунки, содержащие 100 мкл киназного буфера (50 мМ+ 0,2 мкМ АТФ + 1 мМ Na ортованадата). Реакция продолжается в течение 30 мин при комнатной температуре, и планшеты промывают еще 3 раза. Уровень фосфорилированного тирозина в данной лунке определяют количественно стандартным ELISA анализом (твердофазный иммуноферментный анализ), используя антифосфотирозиновое антитело (ICN PY20, кат. 69-151-1).DND 39/IL-4 клеточный анализ для ингибиторов киназы JAK3.DND 39/IL-4 анализ предназначен для обнаружения ингибиторов JAK3 киназной активности, которые могут стать главными кандидатами для иммуносупрессии и/или аллергии. В анализе используют линию В-клеток, обозначенную DND 39, которая имеет ген люциферазы, управляемый IgE промотром гаплоидных клеток, происходящих из специализированных клеток куриных гонад, стабильно интегрированным в одну из хромосом. Когда эти клетки стимулируют с помощью IL-4, киназа JAK3, которая ассоциирована с IL-4 рецептором, фосфорилирует трансдуктор сигнала STAT6. STAT6 затем связывается с указанным IgЕ промотором и начинает транскрипцию гена люциферазы. Люциферазу определяют в лизате этих клеток, используя Рrоmеgа систему реагентов для анализа на люциферазу. Примечание: DND39 клетки выращивают в RPMI 1640 с добавлением 10% ФТС (фетальная телячья сыворотка), инактивированной нагреванием, 2 мМ L-глутамина и 100 единиц/мл пенициллин/стрептомицин. Клетки поддерживают в концентрации от 1 х 105 до 1 х 106 клеток/мл. Поделившихся до 1 х 105 в пятницу клеток в понедельник было около 1 х 106. Затем следует деление 1:2 в течение недели, при поддержании в сосуде объема 200 мл, как требуется. 3 х 105 DND39 клеток помещали в 100 мкл RPMI 1640 с добавлением 10% ФТС, инактивированной нагреванием, 2 мМ L-глутамина и 100 единиц/мл пенициллина/стрептомицина в 96-луночный планшет cV-образными лунками (Nunc). Соединения разбавляют серийно 1:2 в ДМСО (диметилсульфоксид), начиная с 4 мМ и до 1,9 мкМ, в 96-луночном полипропиленовом планшете, меняя наконечники после каждого разведения. Затем по 5 мкл каждого разведения добавляют к 500 мкл RPMI/1% сыворотка в держателе с 96 пробирками. 125 мкл разведений соединений добавляют к клеткам и инкубируют при 37 С, 5% СO2 в течение 1 ч. Через 1 ч 25 мкл IL-4 в концентрации 25 нг/мл добавляют к клеткам и смешивают. Конечная концентрация IL-4 составляет 2,5 нг/мл, и конечная концентрация соединения составляет от 20 мкМ до 156 нМ. Затем клетки инкубируют в течение ночи 16-18 ч. Планшеты затем центрифугируют при 2500-3000 об./мин в настольной центрифуге в течение 5 мин. Культуральный супернатант аккуратно удаляют путем отсасывания с помощью 8-ячейкового устройства. 100 мкл ЗФР (забуференный фосфатом физиологический раствор) с кальцием и магнием добавляют к осажденным при центрифугировании клеткам. Клетки ресуспендируют в ЗФР и переносят в Packard white OptiPlate. 100 мкл Packard's LucLite реагента добавляют в ячейки OptiPlate. Следующие примеры иллюстрируют получение соединений по настоящему изобретению, но не ограничивают его в деталях. Точки плавления не скорректированы. Данные ЯМР приведены в миллионных доляхи соотнесены к сигналу синхронизации дейтерия от растворителя образца (дейтериохлороформа, если не указано иного). Коммерческие реагенты использовали без дальнейшей очистки. THF относится к тетрагидрофурану. DMF относится к N,N-диметилформамиду. Масс-спектры низкого разрешения(LRMS) были получены либо на Hewlett Packard 5989 с использованием химической ионизации (аммоний), либо на Fisons (или Micro Mass) платформе для химической ионизации при атмосферном давлении(АРСI), которая использует смесь 50/50 ацетонитрил/вода с 0,1% муравьиной кислоты в качестве ионизирующего агента. Комнатная или температура окружающей среды относится к 20-25 С. Пример 1. Циклогексилметил(7 Н-пирроло[2,3-d]пиримидин-4-ил)амин. Способ А. Циклогексилметил(7 Н-пирроло[2,3-d]пиримидин-4-ил)амин. Смесь 200 мг (1,30 ммоль) 4-хлор-7 Н-пирроло[2,3-d]пиримидина (полученного методом Davoli, J.Am. Chem. Soc., (1960), 82, 131), продукта cпособа А (589/5,21 ммоль) и 3 мл трет-бутанола перемешивали в герметично закрытой пробирке при 100 С в течение 24 ч. Реакционную смесь добавляли к воде,подкисляли до рН 1 с помощью 1 н соляной кислоты (водн.), промывали дважды диэтиловым эфиром(эфиром) и подщелачивали до рН 14 с помощью 1 н гидроксида натрия (NaOH). Полученный в результате осадок отфильтровывали и сушили под вакуумом с получением 263 мг (88%) указанного в заголовке соединения, точка плавления 177-180 С. 1H ЯМР (400 МГц, CDCl3) : 1,11-1,22 (m,1H), 1,43-1,63 (m, 4 Н),1,73 (br d, 1H, J=13,3 Гц), 1,83-1,90 (m, 4H), 3,23 (s, 3 Н), 4,69 (br, 1H), 6,53 (d, 1H, J=3,5 Гц), 7,03 (d, 1H,J=3,5 Гц), 8,30 (s, 1H), 10,6 (br, 1H). LRMS: 231 (М+1). Указанные в заголовках примеров 2-51 соединения были получены способом, аналогичным описанному в примере 1. Пример 2. 9-(7 Н-Пирроло[2,3-d]пиримидин-4-ил)-2,3,4,4 а,9,9 а-гексагидро-1 Н-карбазол. Пример 3. 4-(2,6-Диметилморфолин-4-ил)-7 Н-пирроло[2,3-d]пиримидин. 2,6-Диметилморфолин. LRMS: 233,3. Пример 4. 4-Морфолин-4-ил-7 Н-пирроло[2,3-d]пиримидин. 4-Морфолин. LRMS: 205. Пример 5. 4-(2,5-Диметилпирролидин-1-ил)-7 Н-пирроло[2,3-d]пиримидин.- 13006034 3,3-Диметилпиперидин. Точка плавления: 204 С; LRMS: 231. Пример 37. 1-(7 Н-Пирроло[2,3-d]пиримидин-4-ил)пиперидин-3-карбоновая кислота. Пиперидин-3-карбоновая кислота. Точка плавления: 159-160 С; LRMS: 307,3. Пример 38. 1-Метил-4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-10-окса-4-аза-трицикло[5,2,1,02,6]декан. 1-Метил-10-окса-4-аза-трицикло[5,2,1,02,6]декан. Точка плавления: 251-252 С; LRMS: 271,3. Пример 39. 1-(5-Хлор-7 Н-пирроло[2,3-d]пиримидин-4-ил)декагидрохинолин. Декагидрохинолин. Точка плавления: 190-192 С; LRMS: 291,8. Пример 40. Этиловый эфир 3-[1-(7 Н-пирроло[2,3-d]пиримидин-4-ил)пиперидин-3-ил]пропионовой кислоты. Этиловый эфир пиперидин-3-ил-пропионовой кислоты. Точка плавления: 101-103 С; LRMS: 303,4. Пример 41. 3-[1-(7 Н-Пирроло[2,3-d]пиримидин-4-ил)пиперидин-3-ил]пропионовая кислота. Пиперидин-3-ил-пропионовая кислота. Точка плавления: 217-219 С; LRMS: 275,3. Пример 42. 1-(7 Н-Пирроло[2,3-d]пиримидин-4-ил)пиперидин-3-ол. Пиперидин-3-ол. Точка плавления: 152-154 С; LRMS: 219,3. Пример 43. 3-[1-(7 Н-Пирроло[2,3-d]пиримидин-4-ил)пиперидин-3-ил]пропионамид. Пиперидин-3-ил-пропионамид. Точка плавления: 212-214 С; LRMS: 274,3. Пример 44. 4-(2,6-Диметилпиперидин-1-ил)-7 Н-пирроло[2,3-d]пиримидин. 2,6-Диметилпиперидин. LRMS: 231. Пример 45. 2-[1-(7 Н-Пирроло[2,3-d]пиримидин-4-ил)пиперидин-3-ил]пропан-2-ол. Пиперидин-3-ил-пропан-2-ол. Точка плавления: 182,8-183,6 С; LRMS: 261. Пример 46. 2-[1-(7 Н-Пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-ил]пропан-2-ол. Пиперидин-4-ил-пропан-2-ол. Точка плавления: 170,1-171,3 С; LRMS: 261. Пример 47. 4-Метил-1-(7 Н-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-ол. 4-Метилпиперидин-4-ол. Точка плавления: 163,8-165,1 С; LRMS: 233,1. Пример 48. 3-Метил-8-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-8-аза-бицикло[3,2,1]октан-3-ол. 3-Метил-8-аза-бицикло[3,2,1]октан-3-ол. Точка плавления: 142,1-143,8 С; LRMS: 259,1. Пример 49. 2-[1-(7 Н-Пирроло[2,3-d]пиримидин-4-ил)пирролидин-2-ил]пропан-2-ол. Пирролидин-2-ил-пропан-2-ол. Точка плавления: 173C с разложением; LRMS: 247,1. Пример 50. 3-Метил-1-(7 Н-пирроло[2,3-d]пиримидин-4-ил)пирролидин-3-ол. 3-Метилпирролидин-3-ол. LRMS: 219. Пример 51. 4-Пиразол-1-ил-7 Н-пирроло[2,3-d]пиримидин. Пиразол. LRMS: 186,2. Пример 52. Циклогексилметил-(6-фенил-7 Н-пирроло[2,3-d]пиримидин-4-ил)амин. Циклогексилметиламин. Способ Б. 7-Бензолсульфонил-4-хлор-7 Н-пирроло[2,3-d]пиримидин. В высушенной пламенем колбе в атмосфере азота 780 мг 60%-ного гидрида натрия (19,5 ммоль) в минеральном масле добавляли к 30 мл диметилформамида (ДМФ) и полученную смесь охлаждали до 0 С. Раствор 2,0 г (13,0 ммоль) 4-хлор-7 Н-пирроло[2,3-d]пиримидина в 10 мл ДМФ медленно добавляли в течение 5 мин. Реакционную смесь перемешивали в течение 10 мин, за которые прекращалось образование водорода (Н 2). Добавляли бензолсульфонилхлорид (1,7 мл/13,0 ммоль), реакционную смесь подогревали до комнатной температуры и перемешивали в течение 1 ч. Добавляли воду и полученный в результате осадок отфильтровывали и сушили под вакуумом с получением 3,4 г (89%) указанного в заголовке соединения в виде кристаллического твердого вещества, т.пл. 163-167 С. Способ В. 7-Бензолсульфонил-4-хлор-6-фенил-7 Н-пирроло[2,3-d]пиримидин. В высушенной пламенем колбе в атмосфере азота 0,53 мл (3,79 ммоль) диизопропиламина растворяли в 5 мл тетрагидрофурана (ТГФ) и раствор охлаждали до -78 С. Добавляли н-бутиллитий (3,75 ммоль в виде 2,5 М раствора в гексане) и полученную в результате смесь доводили до 0 С с продолжающимся перемешиванием в течение 10 мин. Реакционную смесь снова охлаждали до -78 С и к этой смеси добавляли раствор 1,0 г (3,40 ммоль) продукта cпособа Б в 10 мл ТГФ за промежуток времени 10 мин. Реакционную смесь перемешивали в течение 1 ч при -78 С, после чего добавляли 8,2 мл (4,10 ммоль) 0,5 М раствора хлорида цинка в ТГФ, реакционную смесь доводили до комнатной температуры и перемешивали в течение 1 ч. Добавляли иодбензол (0,46 мл/4,11 ммоль) и суспензию 197 мг тетракис(трифенилфосфин) палладия в 2 мл ТГФ. Полученную в результате смесь перемешивали при нагревании с обратным холодильником в течение 3 ч, охлаждали до комнатной температуры и фракционировали между дихлорметаном и водой. Водный слой подкисляли 1 н HCl и экстрагировали дважды дихлорметаном. Дихлорметановые слои объединяли, промывали 1 н HCl и рассолом, сушили над сульфатом магния (МgSO4), отделяли фильтрованием и концентрировали под вакуумом с получением указанного в заголовке соединения.LRMS: 370, 372 (М+2). Способ Г. 4-Хлор-6-фенил-7 Н-пирроло[2,3-d]пиримидин. Продукт cпособа В растворяли в 10 мл ТГФ и к этому раствору добавляли 5,0 мл метанола и 1,0 гNaOH. Реакционную смесь перемешивали в течение 15 мин, концентрировали в вакууме и фракционировали между насыщенным водным раствором хлорида аммония (NH4Cl) и этилацетатом. Полученный в- 14006034 результате водный слой дважды экстрагировали этилацетатом. Этилацетатные слои объединяли, промывали рассолом, сушили над MgSO4, отделяли фильтрованием и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле (1:5 этилацетат/гексан) с получением 0,59 г (76%) указанного в заголовке соединения в виде бледно-желтого твердого вещества, т.пл. 145 С (с разложением). LRMS: 230, 232 (М+2). Способ Д. Циклогексилметил-(6-фенил-7 Н-пирроло[2,3-d]пиримидин-4-ил)амин. Продукт cпособа Г (50 мг/0,218 ммоль) подвергали взаимодействию с 0,12 мл N-метилциклогексиламина (0,920 ммоль), как описано в cпособе А. Реакционную смесь концентрировали в вакууме, добавляли метанол и полученный в результате осадок отделяли фильтрованием с получением 7 мг (10%) указанного в заголовке соединения в виде желтого твердого вещества. 1H ЯМР (400 МГц, CDCl3) : 1,18-1,25(m, 1H), 1,47-1,66 (m, 4H), 1,75-1,90 (m, 5H), 3,30 (s, 3 Н), 4,74 (br, 1H), 6,79 (s, 1H), 7,32-7,36 (m, 1H), 7,477,51 (m, 2H), 7,77 (d, 2H, J=7,9 Гц), 8,33 (s, 1H). LRMS: 307 (M+1). Указанные в заголовках примеров 53-58 соединения были получены способом, аналогичным описанному в примере 52. Пример 53. 1-(6-Фенил-7 Н-пирроло[2,3-d]пиримидин-4-ил)декагидрохинолин. Декагидрохинолин. LRMS: 333,4. Пример 54. 4-(2-Этилпиперидин-1-ил)-6-фенил-7 Н-пирроло[2,3-d]пиримидин. 2-Этилпиперидин. LRMS: 307,4. Пример 55. 4-(3,3-Диметилпиперидин-1-ил)-6-фенил-7 Н-пирроло[2,3-d]пиримидин. 3,3-Диметилпиперидин. LRMS: 307,4. Пример 56. 6-Фенил-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин. Пиперидин. LRMS: 279,4. Пример 57. 4-Пиперидин-1-ил-6-тиофен-3-ил-7 Н-пирроло[2,3-d]пиримидин. Пиперидин. LRMS: 285,4. Пример 58. 4-Пиперидин-1-ил-6-тиофен-2-ил-7 Н-пирроло[2,3-b]пиримидин. Пиперидин. LRMS: 285,4. Пример 59. Циклогексилметил-(6-метил-7 Н-пирроло[2,3-d]пиримидин-4-ил)амин. Циклогексилметиламин. Способ Е. 7-Бензолсульфонил-4-хлор-6-метил-7 Н-пирроло[2,3-d]пиримидин. В высушенную пламенем колбу под N2 загружали 0,57 мл (4,07 ммоль) диизопропиламина и 5,0 мл безводного ТГФ. Раствор охлаждали до -78 С и добавляли 1,63 мл (4,08 ммоль) 2,5 М раствора н-бутиллития в гексанах. Полученную в результате смесь доводили до 0 С и перемешивали в течение 10 мин. После охлаждения смеси снова до -78 С, добавляли за 10-минутный промежуток времени раствор 1,0 г(3,40 ммоль) неочищенного продукта cпособа В в 10 мл безводного ТГФ. Полученную в результате смесь перемешивали в течение 1 ч, после чего добавляли 0,28 мл (4,50 ммоль) иодметана. Реакционную смесь перемешивали в течение 2 ч, гасили насыщенным раствором NH4Cl и нагревали до комнатной температуры. Смесь перемешивали в течение 5 мин, разбавляли водой и экстрагировали 3 раза этилацетатом. Объединенные экстракты промывали соляным раствором, сушили над MgSO4, фильтровали и упаривали под вакуумом с получением указанного в заголовке соединения. LRMS: 308, 310 (М+2). Способ Ж. 4-Хлор-6-метил-7 Н-пирроло[2,3-d]пиримидин. С продукта cпособа Е снимали защиту, как описано в cпособе Д. Неочищенный продукт очищали растиранием в порошок с гексанами и дихлорметаном с получением 250 мг (44%) указанного в заголовке соединения в виде желтого твердого вещества. Т.пл. 205 С (с разложением). LRMS: 168, 170 (М+2). Способ З. Циклогексилметил-(6-метил-7 Н-пирроло[2,3-d]пиримидин-4-ил)амин. Продукт cпособа Ж (50 мг/0,298 ммоль) подвергали взаимодействию с 100 мг (0,883 ммоль) N-метилциклогексиламина, как описано в cпособе А. Реакционную смесь обрабатывали как в cпособе А, за исключением того, что вместо эфира использовали этилацетат. Указанное в заголовке соединение (42 мг,58%-ный выход) было получено в виде белого твердого вещества. Т.пл. 221 С с разложением. 1H ЯМР(d, 3H, J=0,8 Гц), 3,21 (s, 3 Н), 4,63 (br s, 1 Н), 6,20 (s,1H), 8,22 (s,1H), 10,1 (brs, 1H). LRMS: 245 (М+1). Указанное в заголовке примера 60 соединение было получено способом, аналогичным описанному в примере 59. Пример 60. 6-Метил-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин. Пиперидин. LRMS: 217,3. Пример 61. 6-Хлор-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин. Способ И. 4,5-Дихлоро-7 Н-пирроло[2,3-d]пиримидин. 4-Хлор-7 Н-пирроло[2,3-d]пиримидин (154 мг, 1,0 ммоль) суспендировали в 6,0 мл безводного дихлорметана в высушенной пламенем колбе и к этой смеси за один прием добавляли N-хлорсукцинимид(147 мг, 1,1 ммоль). Полученную в результате смесь перемешивали при комнатной температуре в течение 18 ч, после чего растворитель удаляли под пониженным давлением. Остаток растирали в порошок с- 15006034 водой и выделяли фильтрацией с получением 137 мг (72%) указанного в заголовке соединения в виде серого твердого вещества, т.пл. 224-227 С (с разложением). LRMS: 188 (М+1). Способ К. 5-Хлор-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин. Продукт cпособа И (57 мг, 0,3 ммоль) суспендировали в 3,0 мл трет-бутанола, к этому раствору добавляли пиперидин (90 мкл, 0,9 ммоль) и полученную в результате систему нагревали с обратным холодильником в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли воду(4,0 мл). Раствор доводили 1 н HCl до рН 1 и затем промывали эфиром. Водный слой отделяли и доводили 2 н NaOH до рН 12. Этот раствор затем экстрагировали 2 х 15 мл дихлорметана и объединенные органические слои промывали водой, затем рассолом, и сушили над МgSO4. После выпаривания растворителя получали 45 мг желтого твердого вещества, которое очищали хроматографией на силикагеле (3:1 этилацетат/гексаны) с получением 23 мг (32%) указанного в заголовке соединения в виде светло-желтого твердого вещества. Т.пл. 170 - 172 С. 1 Н ЯМР (400 МГц, CDCl3) : 1,67-1,74 (m, 6H), 3,65-3,67 (m, 4 Н),7,10 (s, 1 Н), 8,31 (s, 1H). LRMS: 237 (М+1). Указанные в заголовке примеров 62-63 соединения были получены способом, аналогичным описанному в примере 61. Пример 62. 5-Хлор-4-(октагидроиндол-1-ил)-7 Н-пирроло[2,3-d]пиримидин. Октагидроиндол. Точка плавления: 193 С; LRMS: 277,8. Пример 63. 1-(5-Хлор-7 Н-пирроло[2,3-d]пиримидин-4-ил)декагидрохинолин. Декагидрохинолин. Точка плавления: 190-192 С. LRMS: 291,8. Пример 64. 5-Фенил-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин. Способ Л. 5-Бром-4-хлор-7 Н-пирроло[2,3-d]пиримидин. К перемешиваемому раствору 4-хлор-7 Н-пирроло[2,3-d]пиримидина (30 г/0,02 моль), растворенного в 75 мл хлороформа, добавляли 3,5 г (0,02 моль) N-бромсукцинамида и полученную в результате смесь нагревали с обратным холодильником в течение 1 ч. После охлаждения до комнатной температуры осадок отделяли фильтрацией и сушили под пониженным давлением с получением 4,1 г (89%) указанного в заголовке соединения. 1H ЯМР (400 МГц) (CDCl3) : 7,93 (d, 1H, J=2,8 Гц), 8,60 (s, 1H). Способ М. 7-Бензолсульфонил-5-бром-4-хлор-7 Н-пирроло[2,3-d]пиримидин. К взвеси продукта cпособа Л (4,1 г/0,018 моль) в ДМФ (15 мл) и охлажденной до 0 С, добавляли 1,0 г(0,025 моль) 60%-ногo гидрида натрия в минеральном масле и полученную в результате смесь перемешивали при 0 С в течение 15 мин. Добавляли бензолсульфонилхлорид (3,2 г/0,018 моль), реакционную смесь нагревали до комнатной температуры и перемешивали в течение 2 ч. Затем добавляли воду (15 мл) и полученное в результате твердое вещество отделяли фильтрацией и сушили под вакуумом с получением 5,9 г (89%) указанного в заголовке соединения. Способ Н. 7-Бензолсульфонил-5-бром-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин. Смесь 2,0 г (5,37 ммоль) продукта cпособа М и 1,1 г (13,4 ммоль) пиперидина в 10 мл трет-бутанола нагревали при перемешивании при 60 С в течение 2 ч. После охлаждения до комнатной температуры реакционную смесь фракционировали между дихлорметаном (25 мл) и водой (25 мл). Дихлорметановый слой сушили над сульфатом натрия (Na2SO4) и концентрировали до сухости под вакуумом с получением 2,2 г (97%) указанного в заголовке соединения. 1 Н ЯМР (400 МГц, CDCl3) : 1,63-1,72 (m, 6H), 3,54-3,57(m, 4H), 7,53 (t, 2H, J=2,0 Гц), 7,60 (s, 1H), 7,61 (t, 1H, J=2,0 Гц), 8,17-8,20 (m, 2H), 8,43 (s, 1H). LRMS: 422,7, 420,7 (М+1). Способ О. 5-Фенил-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин. При перемешивании к раствору продукта cпособа Н (100 мг/0,237 ммоль) в 1,0 мл диоксана добавляли 32 мг (0,261 ммоль) фенилборной кислоты и 75 мг (0,356 ммоль) трехосновного фосфата калия, а затем 7 мг (0,006 ммоль) тетракис(трифенилфосфин)палладия. Полученную в результате смесь дегазировали азотом и перемешивали при 100 С в течение 48 ч. После охлаждения до комнатной температуры добавляли 1,0 мл метанола, а затем 50 мг NaOH и новую смесь перемешивали при комнатной температуре в течение 1 ч. Полученную в результате смесь затем фракционировали между дихлорметаном и водой,дихлорметановый слой сушили над МgSO4 и концентрировали до сухости под вакуумом. Неочищенный продукт очищали хроматографией на силикагеле (2:1 этилацетат/гексаны) с получением 13 мг (20%) указанного в заголовке соединения. 1H ЯМР (400 МГц) (CDCl3) : 1,33-1,34 (m, 4H), 1,43-1,44 (m, 2H), 3,263,28 (m, 4H), 7,12 (s, 1H), 7,27 (t, 2H, J=7,2 Гц), 7,38 (t, 2H, J=8,0 Гц), 7,45 (d, 2H, J=0,8 Гц), 8,42 (s, 1H).LRMS: 279,2 (М+1). Указанные в заголовке примеров 65-77 соединения были получены способом, аналогичным описанному в примере 64. Пример 65. 5-(3-Хлор-4-фторфенил)-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин. Пиперидин. LRMS: 331,8. Пример 66. 5-(4-Фторфенил)-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин. Пиперидин. LRMS: 297. Пример 67. 5-(4-Хлорфенил)-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин. Пиперидин. LRMS: 313.(приготовленного способом Townsend, et al., J. Am. Chem. Soc., 1969, 91, 2102), суспендированного в 3,0 мл трет-бутанола, добавляли пиперидин (59 мкл/0,60 ммоль). Полученную в результате смесь нагревали с обратным холодильником в течение 2,5 ч и после охлаждения до комнатной температуры переносили в делительную воронку и разбавляли диэтиловым эфиром (20 мл). Раствор экстрагировали 2 х 10 мл 1 нHCl, объединенные водные слои доводили 2 н раствором гидроксида калия (KОН) до рН 7 с образованием осадка, который собирали фильтрацией, промывали водой и сушили под пониженным давлением с получением 29 мг (42%) указанного в заголовке соединения в виде бесцветного твердого вещества. Т.пл. 209-211 С; 1H ЯМР (400 МГц) (ацетон-d6) : 1,72-1,74 (m, 6H), 3,72-3,79 (m, 4 Н), 8,12 (s, 1H), 8,29 (s, 1H).LRMS: 228 (М+1). Пример 79. 5-Этинил-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин. Способ Р. 4-Хлор-5-иод-7 Н-пирроло[2,3-d]пиримидин. При перемешивании к раствору 4-хлор-7 Н-пирроло[2,3-d]пиримидина (30 г/0,02 моль), растворенного в 80 мл хлороформа, добавляли 4,5 г (0,02 моль) N-иодсукцинимида и полученную в результате смесь нагревали с обратным холодильником в течение 1 ч. После охлаждения до комнатной температуры осадок отделяли фильтрацией и сушили под пониженным давлением с получением 4,6 г (82%) указанного в заголовке соединения. Способ С. 7-Бензолсульфонил-4-хлор-5-иод-7 Н-пирроло[2,3-d]пиримидин. Указанное в заголовке соединение получали, как описано ранее в cпособе М, используя продуктcпособа П, с получением 5,4 г (80%) вещества. LRMS: 419,6 (М+1), 279,7. Способ Т. 7-Бензолсульфонил-5-иод-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин. Указанное в заголовке соединение получали по методике, описанной в cпособе Н, используя продукт cпособа С, с получением указанного в заголовке соединения. LRMS: 469 (М+1), 329,1. Способ У. 7-Бензолсульфонил-4-пиперидин-1-ил-5-триэтилсиланилэтинил-7 Н-пирроло[2,3-d]пиримидин. В высушенную пламенем колбу в атмосфере азота загружали 211 мг (0,5 ммоль) продукта cпособа Т, 19 мг (0,1 ммоль) иодида меди (I) и 58 мг (0,05 ммоль) тетракис(трифенилфосфин)палладия. К этой смеси затем добавляли 0,14 мл (1,0 ммоль) триэтиламина и 0,27 мл (1,5 ммоль) триэтилсилилацетилена в виде раствора в 1,5 мл безводного ДМФ. Полученную в результате смесь перемешивали при комнатной температуре в течение 3 ч, после чего добавляли 5,0 мл воды и смесь экстрагировали этилацетатом. Этилацетатный экстракт сушили над МgSO4 и концентрировали под вакуумом. Полученный в результате неочищенный продукт затем очищали хроматографией на силикагеле (смесь 7:1 гексаны/этилацетат) с получением 194 мг (89%) указанного в заголовке соединения. LRMS 481 (М+1), 341. Способ Ф. 5-Этинил-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидин. При перемешивании к раствору продукта cпособа У (194 мг/0,40 ммоль), растворенного в 2,0 мл безводного ТГФ, добавляли по каплям 0,4 мл (0,4 ммоль) 1 М раствора тетрабутиламмонийфторида в ТГФ. Полученную в результате смесь перемешивали при комнатной температуре в течение 10 мин, затем переносили в метанольный раствор (3,0 мл), содержащий 1 г KОН, новую смесь перемешивали при комнатной температуре в течение 15 мин и концентрировали под вакуумом. Остаток фракционировали между водой и этилацетатом, этилацетатный слой промывали водой и рассолом, сушили над MgSO4 и кон- 17006034 центрировали до сухости под вакуумом. Неочищенный продукт очищали хроматографией на силикагеле(2:1 этилацетат/гексаны) с получением 72 мг (64%) указанного в заголовке соединения в виде белого кристаллического твердого вещества. Т.пл. 179-181 С. 1 Н ЯМР (400 МГц, CDCl3) : 1,72 (br s, 6H), 3,20 или его фармацевтически приемлемая соль, где R1 представляет собой группу формулы где пунктирная линия обозначает возможные двойные связи;R6 выбран из группы, состоящей из водорода, (С 1-С 6)алкила; каждый из R7 и R8 независимо выбран из группы, состоящей из водорода, (С 1-С 6)алкила, гидрокси,(С 1-С 6)алкиламино, (С 1-С 6)ациламино, карбокси, трифторметила, (С 6-С 10)арила, 5-10-членных гетероциклов, содержащих азот, (С 6-С 10)арил(С 1-С 6)алкила, гидрокси(С 1-С 6)алкила, (С 1-С 6)алкокси(С 1-С 6)алкила; или группы формулыZ представляет собой гидрокси, (С 1-С 6)алкокси или NR1R2, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, (С 1-С 6)алкила; или когда n равняется по меньшей мере 1, а каждый из D и Е или из D и Х представляет собойCR7R8, тогда соседние R7 группы, взятые вместе с углеродами, к которым они присоединены, могут образовывать группы формулы где пунктирные линии обозначают возможные двойные связи; а равняется 1;m равняется 0 или 1; А, В и Х представляют собой CR7R8, где R7 и R8 такие, как определено выше; и каждый из G, J, L и М представляет собой CR7R8, где R7 и R8 такие, как определено выше; или когда n равняется 1, а каждый из D и Е представляет собой CR7R8, и m равняется 1, а каждый из А и В представляет собой CR7R8, тогда соответственные соседние R7 группы, взятые вместе с углеродами, к которым они присоединены, могут образовывать группу формулы где пунктирные линии обозначают возможные двойные связи; а равняется 1;G, J, L и М такие, как определено выше,r равняется 0,с равняется 1; и каждый из R, W, Y и S независимо представляет собой CR7R8, где R7 и R8 такие, как определено выше;R2 выбран из группы, состоящей из водорода, циано, триэтилсиланилэтинила, галогено, или R2 представляет собой (С 6-С 10)арил, возможно замещенный одним-тремя галогено, (С 1-С 6)алкилом, трифторметилом, гидрокси(С 1-С 6)алкилом, (С 1-С 6)алкокси, (C1-С 6)алкоксикарбонилом,R3 выбран из группы, состоящей из водорода, галогено, (С 1-С 6)алкила, (С 6-С 10)арила и тиенила,при условии, что когда А, В или Х в формуле V определено как CR7R8, тогда R2 и/или R3 должны быть галогено; при условии, что когда каждый из R2 и R3 независимо представляет собой водород или (С 1-С 6)алкил, тогда R1 не может быть незамещенным пиперидинилом,при условии, что когда каждый из R2 и R3 представляет собой водород, тогда R1 не может быть незамещенным морфолинилом или пирролидинилом; при условии, что когда каждый из R2 и R3 представляет собой водород, тогда R1 не может быть пиперазинилом; и при условии, что группы формул IV, V или XIII не содержат два или более чем два атома кислорода в соседних положениях. 2. Соединение по п.1, где R1 представляет собой группу формулы где пунктирная линия обозначает возможные двойные связи;n равняется 1 или 2,Х представляет собой кислород, NR6 или CR7R8; каждый из В и D представляет собой CR7R8; каждый из А и Е независимо представляет собой CR7R8; или когда n равняется 1, а каждый из D и Е представляет собой CR7R8, и m равняется 1, а каждый из А и В представляет собой CR7R8, тогда соответственные соседние R7 группы, взятые вместе с углеродами, к которым они присоединены, могут образовывать группу формулы где пунктирные линии обозначают возможные двойные связи; а равняется 1;r равняется 0; с равняется 1; и каждый из R, W, Y и S независимо представляет собой CR7R8, где R7 и R8 такие, как определено выше. 3. Соединение по п.1, где R2 выбран из группы, состоящей из водорода и (С 6-С 10)арила, и R3 независимо выбран из группы, состоящей из водорода, (C1-С 6)алкила и (С 6-С 10)арила. 4. Соединение по п.1, где указанное соединение выбрано из группы, состоящей из 5-хлор-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидина,5-хлор-4-(октагидроиндол-1-ил)-7 Н-пирроло[2,3-d]пиримидина,5-этинил-4-пиперидин-1-ил-7 Н-пирроло[2,3-d]пиримидина и 4-(3,3-диметилпиперидин-1-ил)-7 Н-пирроло[2,3-d]пиримидина.
МПК / Метки
МПК: A61K 31/505, C07D 487/04, A61P 35/02
Метки: соединения, пирроло[2,3-d]пиримидиновые
Код ссылки
<a href="https://eas.patents.su/20-6034-pirrolo23-dpirimidinovye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Пирроло[2,3-d]пиримидиновые соединения</a>
Предыдущий патент: Способ освобождения прихваченной бурильной трубы
Следующий патент: Новое терапевтическое применение еноксапарина
Случайный патент: Маркировка на основе модифицированных хиральных жидкокристаллических полимеров