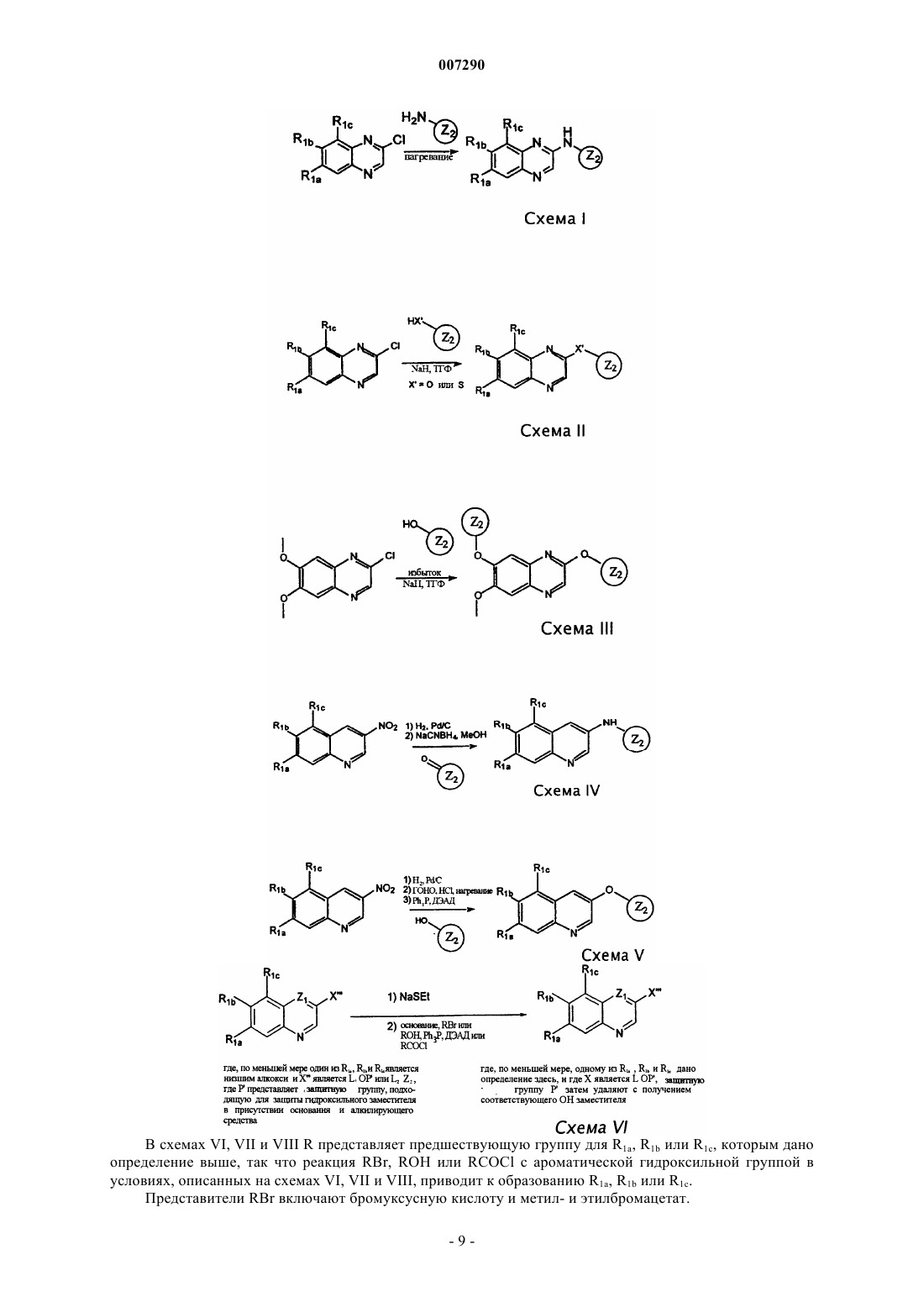
Стентовое устройство с полимерным покрытием, содержащим хинолиновые и хиноксалиновые соединения, и применение этих соединений при изготовлении стента для ингибирования рестеноза
Формула / Реферат
1. Стентовое устройство, имеющее полимерное покрытие, отличающее тем, что полимерное покрытие содержит соединение формулы I
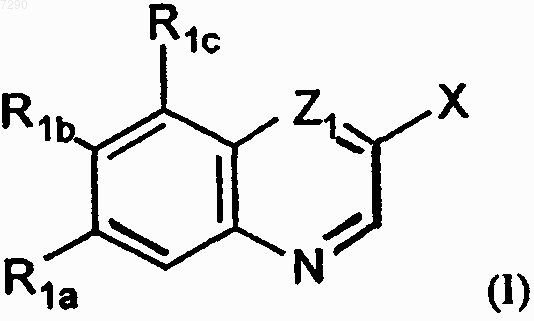
где Х представляет L1OH или L2Z2;
L1 представляет (СR3аR3b)r или (СR3аR3b)m-Z3-(СR3'аR3'b)n;
L2 представляет (СR3аR3b)p-Z4-(СR3'аR3'b)q или этенил;
Z1 представляет СН или N;
Z2 представляет гидрокси(C3-С10)циклоалкил, необязательно замещенный 1-3 заместителями, выбранными из группы, включающей C1-С10алкил, гидрокси, ацилокси, C1-С10алкокси, галоген, R5R6N, ацилR5N, карбокси и R5R6NCO; гидрокси(C3-С10)циклоалкенил, необязательно замещенный 1-3 заместителями, выбранными из группы, включающей C1-С10алкил, гидрокси, ацилокси, C1-С10алкокси, галоген, R5R6N, ацилR5N, карбокси и R5R6NCO; гидроксигетероциклил, где гетероциклил представляет 4-10-членную, моноциклическую или полициклическую систему, в которой один или более атомов кольца являются отличными от углерода и выбраны из азота, кислорода или серы, необязательно замещенный 1-3 заместителями, выбранными из группы, включающей C1-С10алкил, гидрокси, ацилокси, C1-С10алкокси, галоген, R5R6N, ацилR5N, карбокси и R5R6NCO; или гидроксигетероцикленил, где гетероцикленил представляет собой гетероциклил, определенный выше, содержащий по меньшей мере одну двойную связь углерод-углерод или углерод-азот, необязательно замещенный 1-3 заместителями, выбранными из группы, включающей C1-С10алкил, гидрокси, ацилокси, C1-С10алкокси, галоген, R5R6N, ацилR5N, карбокси и R5R6NCO;
Z3 представляет O, NR4, S, SO или SO2;
Z4 представляет О, NR4, S, SO, SO2 или связь;
m равно 0 или 1;
n равно 2 или 3 и n+m=2 или 3;
р и q равны, независимо, 0, 1, 2, 3 или 4 и р+q=0, 1, 2, 3 или 4, когда Z4 является связью, и р+q=0, 1, 2 или 3, когда Z4 представляет другое, чем связь;
r равно 2, 3 или 4;
R1a и R1b представляют независимо C1-С10алкил с прямой или разветвленной цепью, необязательно замещенный C1-С10алкоксигруппой, галогеном, карбокси, гидрокси или R5R6N-группой; C6-С10арил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей водород, гидрокси, галоген, C1-С10алкил, C1-С10алкокси, карбокси, C1-С10алкоксикарбонил и Y1Y2NCO, где Y1 и Y2 независимо представляют водород или C1-С10алкил; гетероарил, представляющий 5-10-членную ароматическую моноциклическую или полициклическую углеводородную систему колец, в которой один или более атомов кольца являются отличными от углерода и выбраны из азота, кислорода или серы, необязательно замещенную одним или более заместителями, выбранными из группы, включающей водород, гидрокси, галоген, C1-С10алкил, C1-С10алкокси, карбокси, C1-С10алкоксикарбонил и Y1Y2NCO, где Y1 и Y2 независимо представляют водород или C1-С10алкил; гидрокси; ацилокси; C1-С10алкокси, необязательно замещенный одним или более заместителями, выбранными из группы, включающей амино, C1-С10алкокси, карбокси, C1-С10алкоксикарбонил, карбокси(C6-С10)арил, карбамоил или гетероциклил, где гетероциклил имеет вышеуказанное значение; циклоалкил-O-, где циклоалкил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; гетероциклил-O-, где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; гетероциклил-С(О)О-, где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; C6-С10арилокси, необязательно замещенный группами, как указано выше для арила; гетероарил-O-, где гетероарил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для арила; циано; R5R6N или ацил-R5N, или один из R1a и R1b представляет водород или галоген, а другой представляет C1-С10алкил, необязательно замещенный, как указано для него выше; C6-С10арил, необязательно замещенный, как указано для него выше; гетероарил, как он определен выше,необязательно замещенный, как указано выше для арила; гидрокси; ацилокси; C1-С10алкокси, необязательно замещенный, как указано для него выше; циклоалкил-O-, где циклоалкил имеет вышеуказанные значения, необязательно замещенный, как указано для него выше; гетероциклил-O-, где гетероциклил определен выше, необязательно замещенный, как указано выше для циклоалкила; гетероциклил-С(О)О-, где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; C6-С10арилокси, необязательно замещенный группами, как указано выше для арила; гетероарил-O-, где гетероарил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для арила; циано, R5R6N или ацил-R5N;
R1c представляет водород, C1-С10алкил с прямой или разветвленной цепью, необязательно замещенный, как указано для него выше; C6-С10арил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей водород, гидрокси, галоген, C1-С10алкил, C1-С10алкокси, карбокси, C1-С10алкоксикарбонил и Y1Y2CO, где Y1 и Y2 независимо представляют водород или C1-С10алкил; гетероарил, представляющий 5-10-членную ароматическую моноциклическую или полициклическую углеводородную систему колец, в которой один или более атомов кольца являются отличными от углерода и выбраны из азота, кислорода или серы, необязательно замещенную одним или более заместителями, выбранными из группы, включающей водород, гидрокси, галоген, C1-С10алкил, C1-С10алкокси, карбокси, C1-С10алкоксикарбонил и Y1Y2NCO, где Y1 и Y2 независимо представляют водород или C1-С10алкил; гидрокси; ацилокси; C1-С10алкокси, необязательно замещенный одним или более заместителями, выбранными из группы, включающей амино, C1-С10алкокси, карбокси, C1-С10алкоксикарбонил, карбокси(C6-С10)арил, карбамоил или гетероциклил, где гетероциклил имеет вышеуказанное значение; циклоалкил-O-, где циклоалкил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; гетероциклил-O-, где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; гетероциклил-С(О)О-, где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; C6-С10арилокси, необязательно замещенный группаьш, как указано выше для арила; гетероарил-O-, где гетероарил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для арила; галоген; циано; R5R6N или ацил-R5N;
R3а, R3b, R3'а и R3'b независимо представляют водород или C1-С10алкил с прямой или разветвленной цепью;
R4 представляет водород, C1-С10алкил с прямой или разветвленной цепью, Н-СО- или C1-С10алкил-СО-; и
R5 и R6 независимо представляют водород или C1-С10алкил с прямой или разветвленной цепью, или R5 и R6, взятые вместе с атомом азота, с которым связаны R5 и R6, образуют азагетероциклил, где гетероциклил определен выше, или его N-оксид, его гидрат, его сольват, его пролекарство или его фармацевтически приемлемую соль.
2. Стентовое устройство по п.1, полимерное покрытие которого содержит соединение формулы I,
где Х представляет L2Z2;
L2 представляет (СR3аR3b)p-Z4-(СR3'аR3'b)q;
Z2 представляет гидрокси(C3-С10)циклоалкил, необязательно замещенный 1-3 заместителями, выбранными из группы, включающей C1-С10алкил, гидрокси, ацилокси, C1-С10алкокси, галоген, R5R6N, aцилR5N, карбокси и R5R6NCO;
Z4 представляет О и NR4;
р равно 0;
q равно 0 или 1;
R1a и R1b независимо представляют C1-С10алкил с прямой или разветвленной цепью, необязательно замещенный C1-С10алкоксигруппой, галогеном, карбокси, гидрокси или R5R6N-группой; C1-С10алкокси, необязательно замещенный одним или более заместителями, выбранными из группы, включающей амино, C1-С10алкокси, карбокси, C1-С10алкоксикарбонил, карбокси(C6-С10)арил, карбамоил или гетероциклил, где гетероциклил имеет вышеуказанное значение; циклоалкил-O-, где циклоалкил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила, или гетероциклил-O-, где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; или один из R1a и R1b представляет водород или галоген, а другой из R1a и R1b представляет C1-С10алкил с прямой или разветвленной цепью, необязательно замещенный C1-С10алкоксигруппой, галогеном, карбокси, гидрокси или R5R6N-группой; C1-С10алкокси, необязательно замещенный одним или более заместителями, выбранными из группы, включающей амино, C1-С10алкокси, карбокси, C1-С10алкоксикарбонил, карбокси(C6-С10)арил, карбамоил или гетероциклил, где гетероциклил имеет вышеуказанное значение, или циклоалкил-O-, где циклоалкил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; гетероциклил-O-, где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила;
R1c представляет водород;
R3'а и R3'b независимо представляют водород; и
R4 представляет водород, или
его N-оксид, его гидрат, его сольват, его пролекарство или его фармацевтически приемлемую соль.
3. Стентовое устройство по п.1, полимерное покрытие которого содержит соединение формулы I, где Z1 представляет СН.
4. Стентовое устройство по п.1, полимерное покрытие которого содержит соединение формулы I, где Z1 представляет N.
5. Стентовое устройство по п.1, полимерное покрытие которого содержит соединение формулы I, где Z4 представляет О.
6. Стентовое устройство по п.1, полимерное покрытие которого содержит соединение формулы I, где Z4 представляет NR4.
7. Стентовое устройство по п.1, полимерное покрытие которого содержит соединение формулы I, где Z4 представляет S.
8. Стентовое устройство по п.1, полимерное покрытие которого содержит соединение формулы I, которое выбирают из группы, включающей
транс-4-(7-хлор-6-метоксихиноксалин-2-иламино)циклогексанол;
транс-4-(6-хлор-7-метоксихиноксалин-2-иламино)циклогексанол;
транс-4-(6,7-диметоксихиноксалин-2-иламино)циклогексанол;
цис-4-(6,7-диметоксихиноксалин-2-иламино)циклогексанол;
(2эндо,5экзо)-5-(6,7-диметоксихиноксалин-2-иламино)бицикло[2,2,1]гептан-2-ол;
(2экзо,5экзо)-5-(6,7-диметоксихиноксалин-2-иламино)бицикло[2,2,1]гептан-2-ол;
(2эндо,3экзо,5экзо)-5-(6,7-диметоксихиноксалин-2-иламино)бицикло[2,2,1]гептан-2,3-диол;
цис-2-(6-метоксихиноксалин-4-иламино)циклопентанол;
транс-2-(6-метоксихиноксалин-2-иламино)циклопентанол;
транс-4-(6-метоксихиноксалин-2-иламино)циклогексанол;
этиламид [3aR,4S,6R,6аS]-6-(6,7-диметоксихиноксалин-2-иламино)-2,2-диметилтетрагидроциклопента[1,3]диоксол-4-карбоновой кислоты;
2-(1,4-диоксаспиро[4,5]дец-8-илокси)-6,7-диметоксихиноксалин;
4-(6,7-диметоксихиноксалин-2-илоксиметил)циклогексанол;
3-(6,7-диметоксихиноксалин-2-илокси)циклогексанол;
4-(6,7-диметоксихиноксалин-2-илокси)циклогексанол;
5-(6,7-диметоксихиноксалин-2-илокси)бицикло[2,2,1]гептан-2,3-диол;
(2экзо,3экзо,5экзо)-5-(6,7-диметоксихиноксалин-2-иламино)бицикло[2,2,1]гептан-2,3-диол;
цис-4-(6,7-диметоксихиноксалин-2-илокси)циклогексиловый эфир уксусной кислоты;
цис-4-(6,7-диметоксихиноксалин-2-илокси)циклогексанол;
4-(6,7-диметоксихиноксалин-2-илокси)циклогексиловый эфир диметилкарбаминовой кислоты;
транс-4-(6,7-диметокси-4-оксихиноксалин-2-иламино)циклогексанол;
транс-4-(6,7-диметоксихиноксалин-2-иламино)циклогексиловый эфир уксусной кислоты;
(2экзо,5экзо)-5-(6,7-диметоксихиноксалин-2-иламино)бицикло[2,2,1]гептан-2-ол;
(2эндо,5экзо)-5-(6,7-диметоксихинолин-2-иламино)бицикло[2,2,1]гептан-2-ол;
(2экзо,6экзо)-6-(6,7-диметоксихинолин-2-иламино)бицикло[2,2,1]гептан-2-ол;
4-(6,7-диметоксихиноксалин-2-иламино)-2-метилциклогексанол;
(2транс,4транс)-4-(6,7-диметоксихиноксалин-2-иламино)-2-метилциклогексанол;
(+)-(2транс,4транс)-4-(6,7-диметоксихиноксалин-2-иламино)-2-метилциклогексанол;
(-)-(2транс,4транс)-4-(6,7-диметоксихиноксалин-2-иламино)-2-метилциклогексанол;
(2транс,4цис)-4-(6,7-диметоксихиноксалин-2-иламино)-2-метилциклогексанол;
(2цис,4цис)-4-(6,7-диметоксихиноксалин-2-иламино)-2-метилциклогексанол;
(2цис,4транс)-4-(6,7-диметоксихиноксалин-2-иламино)-2-метилциклогексанол;
4-(6,7-диметилхиноксалин-2-иламино)циклогексанол или
(1S,2R,4S,5R)-5-(6,7-диметоксихиноксалин-2-иламино)бицикло[2,2,1]гептан-2-ол,
или их N-оксид, их гидрат, их сольват, их пролекарство или их фармацевтически приемлемую соль.
9. Стентовое устройство по п.1, где полимерное покрытие содержит один или несколько полимеров, выбранных из группы, включающей поликапролактон, поли(этиленсовинилацетат), поли(винилацетат) и силиконовый каучук.
10. Стентовое устройство по п.1, где полимерное покрытие содержит один или несколько полимеров, выбранных из группы, включающей латексы, уретаны, полисилоксаны и стиролэтилен/бутиленстирольные блок-сополимеры.
11. Стентовое устройство по п.1, где полимерное покрытие содержит один или несколько полимеров, выбранных из группы, включающей поли-DL-молочную кислоту, поли-L-молочную кислоту, полиортоэфиры, полииминокарбонаты, алифатические поликарбонаты и полифосфазены.
12. Стентовое устройство по п.1, где полимерное покрытие дополнительно содержит порозиген.
13. Стентовое устройсттю по п.12, где порозиген выбирают из группы, включающей микрогранулы хлорида натрия, ликтозы или гепарина натрия.
14. Стентовое устройство по п.12, где порозиген выбирают из группы, включающей полиэтиленгликоль и полиэтиленоксид/полипропиленоксидные сополимеры.
15. Стентовое устройство по п.1, где на полимерное покрытие сверху нанесена регулирующая скорость высвобождения мембрана для ограничения скорости высвобождения соединения формулы I из полимерного покрытия.
16. Стентовое устройство по п.15, где регулирующая скорость высвобождения мембрана содержит порозиген, выбранный из группы, включающей хлорид натрия, лактозу, гепарин натрия, полиэтиленгликоль, полиэтиленоксид/полипропиленоксидные сополимеры и их смеси.
17. Стентовое устройство по п.1, где соединение формулы I вводится в полимерное покрытие путем нанесения соединения формулы I по меньшей мере на одну поверхность стентового устройства с образованием биоактивного слоя, а затем нанесением одного слоя или более из пористого полимерного материала на биоактивный слой.
18. Стентовое устройство по п.17, где пористый полимерный материал включает полиамид, парилен или производное парилена.
19. Стентовое устройство по п.17, где пористый полимерный материал наносят плазменным напылением.
20. Стентовое устройство по п.19, где пористый полимерный материал выбирают из группы, включающей полиэтиленоксид, полиэтиленгликоль, полипропиленоксид и полимеры из метана, силикона и тетрафторэтилентетраметилдисилоксана.
21. Стентовое устройство по п.1, где полимерное покрытие получают фотополимеризуемым присоединением полиэтиленовоненасыщенного сложного эфира акриловой или метакриловой кислоты, содержащего две акрилатные или метакрилатные группы на молекулу или более, или их смесей.
22. Стентовое устройство по п.21, где мономер выбирают из группы, включающей этиленгликольдиакрилат, этиленгликольдиметикрилат, триметилпропантриакрилат, триметилпропантриметакрилат, пентаэритритолтетраакрилат, пентаэритритолетраметакрилат, 1,6-гександиолдиметакрилат и диэтиленгликольдиметакрилат.
23. Стентовое устройство по п.21, где мономер выбирают из группы, включающей н-бутилакрилат, н-бутилметакрилат, 2-этилгексилакрилат, лаурилакрилат и 2-гидроксипропилакрилат.
24. Стентовое устройство по п.1, где полимерное покрытие содержит полимер, выбранный из группы, включающей поли(L-молочную кислоту), поликапролактон, поли(лактидсогликолид), поли(гидроксибутират), поли(гидроксибутиратсовалерат), полидиоксанон, полиортоэфир, полиангидрид, полигликолевую кислоту, поли(DL-молочную кислоту), поли(гликолевая кислота-сотриметиленкарбонат), полифосфоэфир, полифосфоэфируретан, полиаминокислоты, цианоакрилаты, политриметиленкарбонат, полииминокарбонат, поли(простой эфир-сложный эфир), полиалкиленоксалаты, полифосфазены, фибрин, фибриноген, целлюлозу, крахмал, коллаген и гиалуроновую кислоту.
25. Стентовое устройство по п.1, где полимерное покрытие содержит полимер, выбранный из группы, включающей полиуретаны, силиконы, полиэфиры, полиолефины, полиизобутилен, и этилен-альфаолефиновые сополимеры; акриловые полимеры и сополимеры, винилгалогенидные полимеры и сополимеры, такие как поливинилхлорид; поливиниловые простые эфиры, такие как поливинилметиловый эфир; поливинилиденгалогениды, такие как поливинилиденфторид и поливинилиденхлорид; полиакрилонитрил, поливинилкетоны, поливинилароматические соединения, такие как полистирол, поливиниловые сложные эфиры, такие как поливинилацетат; сополимеры виниловых мономеров друг с другом и олефинами, такие как этиленметакрилатные сополимеры, акрилонитрилстирольные сополимеры, смолы ABS, и этиленвинилацетатные сополимеры; полиамиды, такие как найлон 66 и поликапролактам; алкильные смолы, поликарбонаты; полиоксиметилены; полиимиды, полиэфиры, эпоксисмолы, полиуретаны, целлюлозный шелк, триацетатный шелк, целлюлозу, ацетатцеллюлозу, бутиратцеллюлозу, бутиратацетатцеллюлозу, целлофан, нитратцеллюлозу, пропионатцеллюлозу, простые эфиры целлюлозы и карбоксиметилцеллюлозу.
26. Применение соединения формулы I, определенного в п.1, в изготовлении стента для ингибирования рестеноза, где соединение формулы I введено в полимерное покрытие, нанесенное на указанный стент.
27. Применение по п.26, где указанный рестеноз является результатом механического повреждения стенки артерии, полученного при лечении атеросклеротического поражения путем ангиопластики.
Текст
007290 Предпосылки создания изобретения Область изобретения Данное изобретение относится к подавлению клеточной пролиферации, и/или продукции клеточного матрикса, и/или движению клеток (хемотаксис), и/или активации и пролиферации Т-клеток с использованием хинолиновых/хиноксалиновых соединений, которые пригодны как ингибиторы тирозинкиназы(ИТК). Конкретно, данное изобретение относится к применению хинолиновых/хиноксалиновых соединений при изготовлении стента для ингибирования рестеноза и к стентовому устройству с полимерным покрытием, содержащим хинолиновые и хиноксалиновые соединения. Клеточная сигнализация опосредуется системой взаимодействий, которая включает контакт клеткаклетка, или контакт клетка-матрикс, или контакт внеклеточный рецептор-субстрат. Экстраклеточный сигнал часто передается в другие части клетки с помощью акта, опосредуемого тирозинкиназой фосфорилирования, которое действует на субстратные белки ниже сигнального комплекса границы клеточной мембраны. Специфический набор рецепторов-ферментов, таких как инсулиновые рецепторы, рецепторы эпидермального фактора роста (ЭФР-Р) или рецептор полученного из тромбоцитов фактора роста (ТФРР) являются примерами тирозинкиназных ферментов, которые участвуют в клеточной сигнализации. Автофосфорилирование фермента необходимо для эффективного опосредуемого ферментом фосфорилирования субстратных белков, содержащих тирозиновые остатки. Эти субстраты, как известно, ответственны за многие события в клетке, включая клеточную пролиферацию, продукцию клеточного матрикса,клеточной миграции и апоптоз, не говоря о других. Понятно, что причиной большого числа болезненных состояний является или неконтролируемая репродукция клеток, или сверхпродукция матрикса, или плохо регулируемая программированная гибель клеток (апоптоз). В этих болезненных состояниях участвует ряд типов клеток, и эти состояния включают такие заболевания, как лейкемия, рак, глиобластома, псориаз, воспалительные заболевания, болезни костей, фиброзные заболевания, атеросклероз и рестеноз, происходящие после ангиопластики коронарных,бедренных и почечных артерий или фибропролиферативного заболевания, такого как при артрите, фиброзе легкого, почек и печени. Кроме того, состояния разрегулированной клеточной пролиферации следуют после операций коронарного шунтирования. Подавление активности тирозинкиназы, как полагают,обладает полезным действием по ограничению нерегулируемой репродукции клеток, или сверхпродукции матрикса, или плохо регулируемой программированной гибели клеток (апоптоза). Подразумевается также, что некоторые ингибиторы тирозинкиназы могут взаимодействовать с более чем одним типом тирозинкиназных ферментов. Некоторые тирозинкиназные ферменты являются решающими для нормальных функций организма. Например, было бы нежелательно подавлять действие инсулина в большинстве случаев при нормальных условиях. Поэтому соединения, которые ингибируют тирозинкиназную активность ТФР-Р при концентрациях менее концентраций, эффективных для подавления киназы инсулиновых рецепторов, могли бы представлять ценные средства для селективного лечения заболеваний, характеризующихся клеточной пролиферацией, и/или продукцией клеточного матрикса, и/или движением клеток (хемотаксисом), таких как рестеноз. Данное изобретение относится к модуляции и/или подавлению передачи сигналов клеток, пролиферации клеток, продукции внеклеточного матрикса, хемотаксиса, регуляции ненормального роста клеток и воспалительной реакции клеток. Более конкретно, данное изобретение относится к применению замещенных хиноксалиновых соединений, которые проявляют селективное подавление дифференциации,пролиферации или выделения медиатора путем эффективного подавления тирозинкиназной активности рецепторов полученного из тромбоцитов фактора роста (ТФР-Р) и LCK тирозинкиназной активности. Опубликованные разработки В ряде публикаций научной литературы описаны ингибиторы тирозинкиназы, которые являются селективными в отношении ферментов тирозинкиназных рецепторов, таких как ФРЭ-Р (рецепторы фактора роста эпидермиса) или ТФР-Р, или нерецепторными цитозольными тирозинкиназными ферментами,такими как v-abl, p56lck или c-src. В недавних обзорах Spada and Myers (Exp. Opin. Ther. Patents, 1995,5(8), 805) и Bridges (Exp. Opin. Ther. Patents, 1995, 5(12), 1245) обобщена литература по тирозинкиназным ингибиторам и селективным ингибиторам ФРЭ-Р соответственно. Кроме того, Law и Lydon обобщили информацию о противораковом потенциале ингибиторов тирозинкиназы (Emerging Drugs: The Prospectfor Improved Medicines, 1996, 241-260). Известные ингибиторы активности тирозинкиназы ТФР-Р включают ингибиторы на основе хинолина, сообщено Maguire, et al. (J. Med. Chem., 1994, 37, 2129) и Dolle, et al. (J. Med. Chem., 1994, 37, 2627). Недавно сообщено о классе ингибиторов на основе фениламинопиримидина Traxler, et al. В ЕР 564409 иal. (Proc. Nat. Acad. Sci., 1995, 92, 2558). Несмотря на прогресс в данной области, не существует средств в этих классах соединений, которые были одобрены для применения при лечении пролиферативных заболеваний у людей. Корреляция между многофакторным заболеванием рестенозом и ТФР и ТФР-Р вполне подтверждена в научной литературе. Однако недавние разработки в области фиброзных заболеваний легких(Antoniades H.N., et al. J. Clin. Invest., 1990, 86, 1055), почек и печени (Peterson T.C., Hepatology, 1993, 17,-1 007290 486) указывают на то, что ТФР и ТФР-Р играют определенную роль. Например, гломерулонефрит является основной причиной почечной недостаточности, а ТФР, как установлено, представляет собой сильный митоген для клеток мезангия in vitro, что показано Shultz, et al. (Am. J. Physiol., 1988, 255, F674) иFloege, et al. (Clin. Exp. Immun., 1991, 86, 334). Thornton S.C., et al. (Clin. Exp. Immun., 1991, 86, 79) сообщили, что ФНО (фактор некроза опухолей)-альфа и ТФР (полученный от людей - пациентов с ревматоидным артритом) являются основными цитокинами, участвующими в пролиферации синовиальных клеток. Кроме того, были установлены специфические виды опухолевых клеток (см. Silver B.J., BioFactors,1992, 3, 217), такие как глиобластома и саркома Капоши, которые отличаются сверхэкспрессией или протеина ТФР, или рецептора, приводя таким образом к неконтролируемому росту раковых клеток путем аутокринного или паракринного механизма. Поэтому прогнозируется, что ингибитор тирозинкиназы ТФР был бы полезным при лечении множества внешне несвязанных болезненных состояний человека,которые могут быть охарактеризованы участием ТФР и/или ТФР-Р по их этиологии. Роль различных нерецепторных тирозинкиназ, таких как p56lck (здесь далее Lck) при связанных с воспалением состояниях, подразумевающих активацию Т клеток и пролиферацию, была рассмотренаHanke, et al. (Inflamm. Res., 1995, 44, 357) и Bolen and Brugge (Ann. Rev. Immunol., 1997, 15, 371). Эти воспалительные состояния включают аллергию, аутоиммунные заболевания, ревматоидный артрит и отторжение трансплантата. В другом недавнем обзоре рассмотрены различные классы ингибиторов тирозинкиназы, включая соединения, обладающие активностью подавления Lck (Groundwater, et al.,Progress in Medicinal Chemistry, 1996, 33, 233). Ингибиторы активности тирозинкиназы Lck включают некоторые природные продукты, которые обычно являются неселективными ингибиторами тирозинкиназы, такими как стауроспорин, генистеин, некоторые флавоны и эрбстатин. Недавно было сообщено,что дамнакатол является низко нМ ингибитором Lck (Faltinek et al., Biochemistry, 1995, 34, 12404). Примеры синтетических ингибиторов Lck включают серии дигидроксиизохинолиновых ингибиторов, в отношении которых сообщалось, как об имеющих активность от низкомикромолярной до субмикромолярной (Burke et al. J. Med. Chem. 1993, 36, 425); и хинолиновое производное, которое, как обнаружено, намного менее активно, обладая IC50 для Lck, равной 610 микромолям. Исследователи открыли также серии 4-замещенных хиназолинов, которые подавляют Lck при интервале активности от низкомикромолярной до субмикромолярной (Myers et al., WO 95/15758 и Myers et al., Bioorg. Med. Chem. Lett. 1997, 7,417). Исследователи в Pfizer (Hanke et al. J. Biol. Chem. 1996, 271, 695) открыли два специфических пиразолопиримидиновых ингибитора, известных как РР 1 и РР 2, которые обладают низкой наномолярной активностью против Lck и Fyn (другая киназа семейства Src). Не сообщалось ни о каком подавлении Lck в отношении соединений на основе хинолина или хиноксалина. Поэтому прогнозируется, что ингибитор тирозинкиназной активности Lck на основе хинолина или хиноксалина мог бы быть полезным при лечении ряда внешне несвязанных болезненных состояний человека, которые могут быть охарактеризованы вовлечением тирозинкиназной Lck передачи сигналов в их этиологию. Краткое изложение изобретения Данное изобретение направлено на стентовое устройство, имеющее полимерное покрытие, которое содержит ингибиторы ТФР-Р и/или LCK тирозинкиназы, представленные соединением формулы IZ1 представляет СН или N;Z2 представляет гидрокси(С 3-С 10)циклоалкил, необязательно замещенный 1-3 заместителями, выбранными из группы, включающей C1-С 10 алкил, гидрокси, ацилокси, C1-С 10 алкокси, галоген, R5R6N,ацилR5N, карбокси и R5R6NCO; гидрокси(С 3-С 10)циклоалкенил, необязательно замещенный 1-3 заместителями, выбранными из группы, включающей C1-С 10 алкил, гидрокси, ацилокси, C1-С 10 алкокси, галоген,R5R6N, aцилR5N, карбокси и R5R6NCO; гидроксигетероциклил, где гетероциклил представляет 4-10 членную, моноциклическую или полициклическую систему, в которой один или более атомов кольца являются отличными от углерода и выбраны из азота, кислорода или серы, необязательно замещенный 13 заместителями, выбранными из группы, включающей C1-С 10 алкил, гидрокси, ацилокси, C1-С 10 алкокси,галоген, R5R6N, aцилR5N, карбокси и R5R6NCO; или гидроксигетероцикленил, где гетероцикленил представляет собой гетероциклил, определенный выше, содержащий по меньшей мере одну двойную связь углерод-углерод или углерод-азот, необязательно замещенный 1-3 заместителями, выбранными из группы, включающей C1-С 10 алкил, гидрокси, ацилокси, C1-С 10 алкокси, галоген, R5R6N, aцилR5N, карбокси иR1a и R1b представляют независимо C1-С 10 алкил с прямой или разветвленной цепью, необязательно замещенный C1-С 10 алкоксигруппой, галогеном, карбокси, гидрокси или R5R6N-группой; C6-С 10 арил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей водород, гидрокси, галоген, C1-С 10 алкил, C1-С 10 алкокси, карбокси, C1-С 10 алкоксикарбонил и Y1Y2NCO, где Y1 и Y2 независимо представляют водород или C1-С 10 алкил; гетероарил, представляющий 5-10-членную ароматическую моноциклическую или полициклическую углеводородную систему колец, в которой один или более атомов кольца являются отличными от углерода и выбраны из азота, кислорода или серы,необязательно замещенную одним или более заместителями, выбранными из группы, включающей водород, гидрокси, галоген, C1-С 10 алкил, C1-С 10 алкокси, карбокси, C1-С 10 алкоксикарбонил и Y1Y2NCO, где Y1 и Y2 независимо представляют водород или C1-С 10 алкил; гидрокси; ацилокси; C1-С 10 алкокси, необязательно замещенный одним или более заместителями, выбранными из группы, включающей амино, C1 С 10 алкокси, карбокси, C1-С 10 алкоксикарбонил, карбокси(C6-С 10)арил, карбамоил или гетероциклил, где гетероциклил имеет вышеуказанное значение; циклоалкил-O-, где циклоалкил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; гетероциклил-O-,где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; гетероциклил-С(О)О-, где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; C6-С 10 арилокси, необязательно замещенный группами, как указано выше для арила; гетероарил-O-, где гетероарил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для арила; циано; R5R6N или ацилR5N, или один из R1a и R1b представляет водород или галоген, а другой представляет C1-С 10 алкил, необязательно замещенный, как указано для него выше; C6-С 10 арил, необязательно замещенный, как указано для него выше; гетероарил, как он определен выше, необязательно замещенный как указано выше для арила; гидрокси; ацилокси; C1-С 10 алкокси, необязательно замещенный, как указано для него выше; циклоалкил-O-, где циклоалкил имеет вышеуказанные значения, необязательно замещенный как указано для него выше; гетероциклил-O-, где гетероциклил определен выше, необязательно замещенный, как указано выше для циклоалкила; гетероциклил-С(О)О-, где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; C6-С 10 арилокси, необязательно замещенный группами, как указано выше для арила; гетероарил-O-, где гетероарил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для арила; циано, R5R6N или ацилR5N;R1c представляет водород, C1-С 10 алкил с прямой или разветвленной цепью, необязательно замещенный как указано для него выше; C6-С 10 арил, необязательно замещенный одним или более заместителями,выбранными из группы, включающей водород, гидрокси, галоген, C1-С 10 алкил, C1-С 10 алкокси, карбокси,C1-С 10 алкоксикарбонил и Y1Y2NCO, где Y1 и Y2 независимо представляют водород или C1-С 10 алкил; гетероарил, представляющий 5-10-членную ароматическую моноциклическую или полициклическую углеводородную систему колец, в которой один или более атомов кольца являются отличными от углерода и выбраны из азота, кислорода или серы, необязательно замещенную одним или более заместителями, выбранными из группы, включающей водород, гидрокси, галоген, C1-С 10 алкил, C1-С 10 алкокси, карбокси,C1-С 10 алкоксикарбонил и Y1Y2NCO, где Y1 и Y2 независимо представляют водород или C1-С 10 алкил; гидрокси; ацилокси; C1-С 10 алкокси, необяаательно замещенный одним или более заместителями, выбранными из группы, включающей амино, C1-С 10 алкокси, карбокси, C1-С 10 алкоксикарбонил, карбокси(C6 С 10)арил, карбамоил или гетероциклил, где гетероциклил имеет вышеуказанное значение; циклоалкил-O-,где циклоалкил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; гетероциклил-O-, где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; гетероциклил-С(О)О-, где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила;C6-С 10 арилокси, необязательно замещенный группами, как указано выше для арила; гетероарил-O-, где гетероарил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для арила; галоген; циано; R5R6N или ацил-R5N;R3 а, R3b, R3'а и R3'b независимо представляют водород или C1-С 10 алкил с прямой или разветвленной цепью;R4 представляет водород, C1-С 10 алкил с прямой или разветвленной цепью, Н-СО- или C1-С 10 алкилСО-; иR5 и R6 независимо представляют водород или C1-С 10 алкил с прямой или разветвленной цепью, илиR5 и R6, взятые вместе с атомом азота, с которым связаны R5 и R6, образуют азагетероциклил, где гетероциклил определен выше, или-3 007290 его N-оксидом, его гидратом, его сольватом, его пролекарством или его фармацевтически приемлемой солью. В другом аспекте данное изобретение направлено на применение соединения формулы I при изготовлении стента для ингибирования рестеноза. Подробное описание изобретения Как использовано выше и в описании данного изобретения, следующие термины, если не указано иначе, нужно понимать, как имеющие следующие значения. Определения"Пациент" включает как человека, так и других млекопитающих. "Эффективное количество" означает количество соединения формулы I, эффективное для подавления активности тирозинкиназы ТФР-Р и/или активности тирозинкиназы Lck и, таким образом, дающее желаемый терапевтический эффект."Алкил" означает алифатическую углеводородную группу, которая может быть с прямой или разветвленной цепью, имеющей примерно от 1 до примерно 10 атомов углерода. Предпочтительный алкил является низшим алкилом, имеющим примерно от 1 до примерно 6 атомов углерода. Разветвленный означает, что одна низшая алкильная группа или более, такая как метил, этил или пропил, связаны с линейной алкильной цепью. Алкильная группа также необязательно замещена алкокси, галогеном, карбокси, гидрокси или R5R6N-. Примеры алкила включают метил, фторметил, дифторметил, трифторметил,этил, н-пропил, изопропил, бутил, вторичный бутил, трет-бутил, амил и гексил."Алкенил" означает алифатическую углеводородную группу, содержащую углерод-углеродную двойную связь, и которая может быть с прямой или разветвленной цепью, имеющей от 2 до 10 атомов углерода в цепи. Предпочтительные алкенильные группы имеют от 2 до примерно 6 атомов углерода и более предпочтительно от примерно 2 до примерно 4 атомов углерода в цепи. Разветвленная означает,что одна низшая алкильная группа или более, такая как метил, этил или пропил, связаны с линейной алкенильной цепью. "Низший алкенил" означает от примерно 2 до примерно 4 атомов углерода в цепи,которая может быть прямой или разветвленной. Алкенильная группа может быть замещенной карбалкокси. Примеры алкенильных групп включают этенил, пропенил, н-бутенил, изобутенил, 3-метилбут-2 енил, н-пентенил, гептенил, октенил, циклогексилбутенил и деценил. "Этиленил" означает -СН=СНгруппу."Циклоалкил" означает неароматическую моно- или полициклические кольцевые системы из примерно от 3 до примерно 10 атомов углерода. Циклоалкильная группа может быть замещенной одним или более, предпочтительно от одного до трех, более предпочтительно от одного до двух из следующих "заместителей циклоалкила", алкильного, гидрокси, ацилокси, алкокси, галогенового, R5R6N-, ацилR3N-,карбокси или R5R6NCO-заместителей, более предпочтительными заместителями являются алкил, гидрокси, ацилокси, алкокси и R5R6NCO-. Кроме того, когда циклоалкильная группа замещена по меньшей мере двумя гидроксильными заместителями, то по меньшей мере два из гидроксильных заместителей могут быть кеталированными или ацеталированными альдегидом или кетоном из от 1 до 6 атомов углерода с образованием соответствующих кеталя или ацеталя."Гидроксициклоалкил" означает НО-циклоалкил, причем циклоалкил может быть замещенным, как указано. Когда гидроксициклоалкильная группа получена из циклоалкильной группы, которая также замещена гидрокси, два из гидрокси-заместителей могут быть кеталированы или ацеталированы альдегидом или кетоном из от 1 до 6 атомов углерода с образованием соответствующих кеталя или ацеталя. Кетализация из gеm-диола приводит к образованию спироконденсированной системы колец. Предпочтительным спироциклоалкильным кольцом является 1,4-диоксаспиро[4,5]дец-8-ил. Предпочтительные незамещенные или замещенные моноциклические циклоалкильные кольца включают циклопентил, гидроксициклопентил, фторциклопентил, циклогексил, гидроксициклогексил, гидроксиметилциклогексил и циклогептил; более предпочтительны гидроксициклогексил и гидроксициклопентил. Примеры полициклических циклоалкильных колец включают 1-декалин, адамант-(1- или 2-)ил, [2,2,1]бициклогептанил"Циклоалкенил" означает неароматическую моноциклическую или полициклическую систему колец, содержащую двойную углерод-углеродную связь и имеющую от примерно 3 до примерно 10 атомов углерода. Циклоалкенильная группа может быть замещенной одним или более, предпочтительно от 1 до 3, более предпочтительно от 1 до 2 из циклоалкильных заместителей, которые описаны выше. "Гидроксициклоалкенил" означает НО-циклоалкенил, причем циклоалкил может быть замещенным, как указано. Предпочтительные незамещенные или замещенные моноциклические циклоалкенильные кольца включают циклопентенил, циклогексенил, гидроксициклопентенил, гидроксициклогексенил и циклогептенил; более предпочтительными являются гидроксициклопентенил и гидроксициклогексенил. Предпочтительные полициклические циклоалкенильные кольца включают [2,2,1]бициклогептенил (норборненил) и [2,2,2]бициклооктенил."Арил" означает ароматический карбоциклический радикал, содержащий примерно от 6 до примерно 10 атомов углерода. Примеры арила включают фенил или нафтил или фенил или нафтил, замещенные-4 007290 одним или более из заместителей арильной группы, которые могут быть одинаковыми или разными, где заместители арильной группы включают водород, гидрокси, галоген, алкил, алкокси, карбокси, алкоксикарбонил или Y1Y2NCO-, где Y1 и Y2 независимо представляют водород или алкил. Предпочтительные заместители арильной группы включают водород, галоген и алкокси."Гетероарил" означает примерно от 5- до примерно 10-членную ароматическую моноциклическую или полициклическую углеводородную систему колец, в которой один атом углерода или более в кольцевой системе является/являются другим(и) элементами, отличными от углерода, например азотом, кислородом или серой. "Гетероарил" может быть также замещенным одним или более из вышеназванных"заместителей арильной группы". Примеры гетероарильных групп включают замещенный пиразинил,фуранил, тиенил, пиридил, пиримидинил, изоксазолил, изотиазолил, оксазолил, тиазолил, пиразолил,фуразанил, пирролил, имидазо[2,1-b]тиазолил, бензофуразанил, индолил, азаиндолил, бензимидазолил,бензотиенил, хинолинил, имидазолил и изохинолинил."Гетероциклил" означает примерно от 4- до примерно 10-членную моноциклическую или полициклическую кольцевую систему, в которой один или более атомов кольца являются другим элементом, отличным от углерода, выбранным из азота, кислорода или серы. Гетероциклическая группа может быть замещенной одним или более, предпочтительно от 1 до 3, более предпочтительно от 1 до 2 из заместителей циклоалкила, которые описаны выше. "Гидроксигетероциклил" означает НО-гетероциклил, где гетероциклил может быть замещен, как указано выше. "Азагетероциклил" означает гетероциклил, как указано выше, у которого по меньшей мере один из атомов в кольце является азотом. Примеры гетероциклильных фрагментов включают хинуклидин, пентаметиленсульфид, тетрагидропиранил, тетрагидротиофенил, пирролидинил, тетрагидрофуранил или 7-оксабицикло[2,2,1]гептанил."Гетероциклилкарбонилокси" означает гетероциклильную группу, которая определена выше и которая связана с основной частью молекулы через карбонилокси (-С(О)О-)группу. Гетероциклильная часть необязательно замещена одним или более, предпочтительно от 1 до 3, более предпочтительно одним из заместителей циклоалкила, которые определены выше. Представителем гетероциклилкарбонилокси является [1,4']-бипиперидин-1'-илкарбонилокси."Гетероцикленил" означает гетероциклильную кольцевую систему, которая определена выше, содержащую по меньшей мере одну двойную связь углерод-углерод или углерод-азот. Гетероцикленильная группа может быть замещенной одним или более, предпочтительно от 1 до 3, более предпочтительно от 1 до 2 из заместителей циклоалкила, которые описаны выше. "Гидроксигетероцикленил" означает НОгетероцикленил, причем гетероцикленил может быть замещенным, как указано выше. "Азагетероцикленил" означает гетероцикленил, который определен выше, причем по меньшей мере один из атомов в кольце является азотом. Представители моноциклических гетероцикленильных групп включают 1,2,3,4 тетрагидрогидропиридин, 1,2-дигидропиридил, 1,4-дигидропиридил, 1,2,3,6-тетрагидропиридин, 1,4,5,6 тетрагидропиримидин, 3,4-дигидро-2 Н-пиран, 2-пирролинил, 3-пирролинил, 2-имидазолинил, 2 пиразолинил, тетрагидротиофенил, тетрагидротиопиранил и тому подобное."Ацил" означает Н-СО- или алкил-СО-группу, в которой алкильная группа такая, как описано выше. Предпочтительные ацилы содержат низший алкил. Примеры ацильных групп включают формил,ацетил, пропаноил, 2-метилпропаноил, бутаноил и пальмитоил."Ароил" означает арил-СО-группу, в которой алкильная группа такая, как описано выше. Примеры групп включают бензоил и 1- и 2-нафтоил."Алкокси" означает алкил-O-группу, в которой алкильная группа такая, как описано выше. Предпочтительный алкокси является "низшим алкокси", имеющим от примерно 1 до примерно 6 атомов углерода. Алкокси может быть необязательно замещенным одной или более из амино, алкокси, карбокси,алкоксикарбонильной, карбоксиарильной, карбамоильной или гетероциклильной групп. Примеры алкоксигрупп включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, гептокси, 2-(морфолин-4 ил)этокси, 2-(этокси)этокси, 2-(4-метилпиперазин-1-ил)этокси, карбамоил, N-метилкарбамоил, N,Nдиметилкарбамоил, карбоксиметокси и метоксикарбонилметокси."Циклоалкилокси" означает циклоалкил-O-группу, в которой циклоалкильная группа такая, как описано выше. Примеры циклоалкилоксигрупп включают циклопентилокси, циклогексилокси, гидроциклопентилокси и гидроксициклогексилокси."Гетероциклилокси" означает гетероциклил-O-группу, в которой гетероциклильная группа такая,как описано выше. Примеры гетероциклилоксигрупп включают хинуклидилокси, пентаметиленсульфидокси, тетрагидропиранилокси, тетрагидротиофенилокси, пирролидинилокси, тетрагидрофуранилокси или 7-оксабицикло[2,2,1]гептанилокси, гидрокситетрагидропиранилокси и гидрокси-7-оксабицикло"Арилокси" означает арил-O-группу, в которой арильная группа такая, как описанo выше."Гетероарилокси" означает гетероарил-O-группу, в которой гетероарильная группа такая, как описано выше."Ацилокси" означает ацил-O-группу, в которой ацильная группа такая, как описано выше."R5R6N-" означает замещенную или незамещенную аминогруппу, где R5 и R6 такие, как описано выше. Примеры групп включают амино (H2N-), метиламино, этилметиламино, диметиламино и диэтиламино."R5R6NCO-" означает замещенную или незамещенную карбамоильную группу, в которой R5 и R6 такие, как описано выше. Примерами групп являются карбамоил (H2NCO-), N-метилкарбамоил"Галоген" означает фтор, хлор, бром или йод. Предпочтительными являются фтор, хлор или бром и более предпочтительными являются фтор или хлор."Пролекарство" означает форму соединения формулы I, подходящую для введения пациенту без чрезмерной токсичности, раздражения, аллергической реакции и тому подобное и эффективную при предназначенном ей использовании, включая кеталь, сложный эфир или цвиттерионные формы. Пролекарство трансформируется in vivo с получением исходного соединения вышеуказанной формулы, например, путем гидролиза в крови. Полное обсуждение представлено в Т. Higuchi and V. Stella, Prodrugs asCarriers In Drug Design, American Pharmaceutical Association and Pergamon Press, 1987, оба из которых включены сюда в виде ссылки."Сольват" означает физическую связь соединения формулы I с одной молекулой растворителя или более. Эта физическая связь подразумевает различные степени ионного или ковалентного связывания,включая водородные связи. В некоторых случаях сольват можно будет выделить, например, когда одна молекула растворителя или более включаются в кристаллическую решетку твердого кристаллического вещества. "Сольват" охватывает как фазу раствора, так и выделяемые сольваты. Представители сольватов включают этаноляты, метаноляты и тому подобное. "Гидрат" представляет собой сольват, в котором молекулой(ами) растворителя(ей) является(ются) H2O. Предпочтительные осуществления Предпочтительным соединением в полимерном покрытии стентового устройства в аспекте данного изобретения является соединение формулы I, где Х представляет L2Z2;R1a и R1b независимо представляют C1-С 10 алкил с прямой или разветвленной цепью, необязательно замещенный C1-С 10 алкоксигруппой, галогеном, карбокси, гидрокси или R5R6N-группой; C1-С 10 алкокси,необязательно замещенный одним или более заместителями, выбранными из группы, включающей амино, C1-С 10 алкокси, карбокси, C1-С 10 алкоксикарбонил, карбокси(C6-С 10)арил, карбамоил и гетероциклил,где гетероциклил имеет вышеуказанное значение; циклоалкил-O-, где циклоалкил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; или гетероциклилO-, где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; или один из R1a и R1b представляет водород или галоген, а другой из R1a и R1b представляет C1-С 10 алкил с прямой или разветвленной цепью, необязательно замещенный C1 С 10 алкоксигруппой, галогеном, карбокси, гидрокси или R5R6N-группой; C1-С 10 алкокси, необязательно замещенный одним или более заместителями, выбранными из группы, включающей амино, C1 С 10 алкокси, карбокси, C1-С 10 алкоксикарбонил, карбокси(C6-С 10)арил, карбамоил и гетероциклил, где гетероциклил имеет вышеуказанное значение; циклоалкил-O-, где циклоалкил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; гетероциклил-O-, где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; R1c представляет водород; R3 а' и R3'b независимо представляют водород; или его N-оксид, его гидрат, его сольват, его пролекарство или его фармацевтически приемлемая соль. Другим предпочтительным соединением в полимерном покрытии стентового устройства в аспекте данного изобретения является соединение формулы I, где Z1 представляет СН. Ещe одним предпочтительным стентовым устройством в аспекте данного изобретения является стентовое устройство, полимерное покрытие которого содержит соединение формулы I, где Z1 представляет N. Другим предпочтительным стентовым устройством в аспекте данного изобретения является стентовое устройство, полимерное покрытие которого содержит соединение формулы I, где Z4 представляет О. Ещe одним предпочтительным соединением в полимерном покрытии стентового устройства в аспекте данного изобретения является соединение формулы I, где Z4 представляет NR4. Ещe одним предпочтительным соединением в полимерном покрытии стентового устройства в аспекте данного изобретения является соединение формулы I, где Z4 представляет S.-6 007290 Другим предпочтительным стентовым устройством в аспекте данного изобретения является стентовое устройство, полимерное покрытие которого содержит соединение формулы I, которое выбирают из следующих: транс-4-(7-хлор-6-метоксихиноксалин-2-иламино)циклогексанола; транс-4-(6-хлор-7-метоксихиноксалин-2-иламино)циклогексанола; транс-4-(6,7-диметоксихиноксалин-2-иламино)циклогексанола; цис-4-(6,7-диметоксихиноксалин-2-иламино)циклогексанола;(1S,2R,4S,5R)-5-(6,7-диметоксихиноксалин-2-иламино)бицикло[2,2,1]гептан-2-ола,или их N-оксидов, их гидратов, их сольватов, их пролекарств или их фармацевтически приемлемых солей. Другим предпочтительным стентовым устройством в аспекте данного изобретения является стентовое устройство, полимерное покрытие которого содержит один или несколько полимеров, выбранных из группы, включающей латексы, уретаны, полисилоксаны и стиролэтилен/бутиленстирольные блоксополимеры. Еще одним предпочтительным стентовым устройством в аспекте данного изобретения является стентовое устройство, полимерное покрытие которого содержит один или несколько полимеров, выбранных из группы, включающей поли-DL-молочную кислоту, поли-L-молочную кислоту, полиортоэфиры, полиминокарбонаты, алифатические поликарбонаты и полифосфазены. Другим предпочтительным стентовым устройством в аспекте данного изобретения является стентовое устройство, полимерное покрытие которого дополнительно содержит порозиген. Предпочтительно порозиген выбирают из группы, включающей микрогранулы хлорида, натрия, лактозы или гепарина натрия. Кроме того, порозиген выбирают из группы, включающей полиэтиленгликоль и полиэтиленоксид/полипропиленоксидные сополимеры. Другим предпочтительным стентовым устройством в аспекте данного изобретения является стентовое устройство, где на полимерное покрытие сверху нанесена регулирующая скорость высвобождения мембрана для ограничения скорости высвобождения соединения формулы I из полимерного покрытия. Предпочтительно регулирующая скорость высвобождения мембрана содержит порозиген, выбранный из группы, включающей хлорид натрия, лактозу, гепарин натрия, полиэтиленгликоль, полиэтиленоксид/полипропиленоксидные сополимеры и их смеси. Предпочтительно соединение формулы I вводится в полимерное покрытие путем нанесения соединения формулы I по меньшей мере на одну поверхность стентового устройства с образованием биоак-7 007290 тивного слоя, а затем нанесением одного слоя или более из пористого полимерного материала на биоактивный слой. Вышеуказанный полимерный материал предпочтительно включает полиамид, парилен или производное парилена. Предпочтительно указанный полимерный материал наносят плазменным напылением. Причем пористый полимерный материал предпочтительно выбирают из группы, включающей полиэтиленоксид,полиэтиленгликоль, полипропиленоксид и полимеры из метана, силоксана и тетрафторэтилентетраметилдисилоксана. Другим предпочтительным стентовым устройством в аспекте данного изобретения является стентовое устройство, где полимерное покрытие получают из фотополимеризуемого мономера фотополимеризуемым присоединением полиэтиленовоненасыщенного сложного эфира акриловой или метакриловой кислоты, содержащего две акрилатные или метакрилатные группы или более на молекулу или их смесей. Предпочтительно мономер выбирают из группы, включающей этиленгликольдиакрилат, этиленгликольдиметакрилат, триметилпропантриакрилат, триметилпропантриметакрилат, пентаэритритолтетраакрилат или пентаэритритолтетраметакрилат, 1,6-гександиолдиметакрилат и диэтиленгликольдиметакрилат. Кроме того, мономер выбирают из группы, включающей н-бутилакрилат, н-бутилметакрилат, 2 этилгексилакрилат, лаурилакрилат и 2-гидроксипропилакрилат. Еще одним предпочтительным стентовым устройством в аспекте данного изобретения является стентовое устройство, где полимерное покрытие содержит полимер, выбранный из группы, включающей поли(L-молочную кислоту), поликапролактон, поли(лактидсогликолид), поли(гидроксибутират), поли(гидроксибутиратсовалерат), полидиоксанон, полиортоэфир, полиангидрид, полигликолевую кислоту,поли(D,L-молочную кислоту), поли(гликолевая кислота-сотриметилен-карбонат), полифосфоэфир, полифосфоэфируретан, полиаминокислоты, цианоакрилаты, политриметиленкарбонат, полииминокарбонат, сополи(простой эфир-сложные эфиры), полиалкиленоксалаты, полифосфазены, фибрин, фибриноген, целлюлозу, крахмал, коллаген и гиалуроновую кислоту. Другим предпочтительным стентовым устройством в аспекте данного изобретения является стентовое устройство, где полимерное покрытие содержит полимер, выбранный из группы, включающей полиуретаны, силиконы, полиэфиры, полиолефины, полиизобутилен, и этиленальфаолефиновые сополимеры; акриловые полимеры и сополимеры, винилгалогенидные полимеры и сополимеры, такие как поливинилхлорид, поливиниловые простые эфиры, такие как поливинилметиловый эфир; поливинилиденгалогениды, такие как поливинилиденфторид и поливинилиденхлорид; полиакрилонитрил, поливинилкетоны,поливинилароматические соединения, такие как полистирол, поливиниловые сложные эфиры, такие как поливинилацетат; сополимеры виниловых мономеров друг с другом и олефинами, такие как этиленметилметакрилатные сополимеры, акрилонитрилстирольные сополимеры, смолы ABS и этиленвинилацетатные сополимеры; полиамиды, такие как найлон 66 и поликапролактам; алкильные смолы, поликарбонаты; полиоксиметилены; полимиды, полиэфиры; эпоксисмолы, полиуретаны; целлюлозный шелк; триацетатный шелк; целлюлозу, ацетатцеллюлозу, бутиратцеллюлозу, бутиратацетатцеллюлозу, целлофан,нитратцеллюлозу; пропионатцеллюлозу; простые эфиры целлюлозы, и карбоксиметилцеллюлозу. В другом аспекте данное изобретение направлено на применение соединения формулы I при изготовлении стента для ингибирования рестеноза, где соединение формулы I введено в полимерное покрытие, нанесенное на указанный стент. Предпочтительно рестеноз является результатом механического повреждения стенки артерии, полученного при лечении атеросклеротического поражения путем ангиопластики. Должно быть понятно, что данное изобретение охватывает все подходящие комбинации конкретных и предпочтительных группировок, названных здесь. Соединения формулы I, используемые при изготовлении стентового устройства, могут быть получены путем использования методик, известных из литературы, исходя из известных соединений или легко получаемых промежуточных соединений. Примеры общих методик следуют ниже. Кроме того, соединения формулы I получают в соответствии со следующими схемами I-Х, ниже, с изменениями, которые описаны выше, за исключением тех изменений, которые, как должен понять специалист в данной области, были бы несоответствующими описанному методу. В схемах VI, VII и VIII R представляет предшествующую группу для R1a, R1b или R1c, которым дано определение выше, так что реакция RBr, ROH или RCOCl с ароматической гидроксильной группой в условиях, описанных на схемах VI, VII и VIII, приводит к образованию R1a, R1b или R1c. Представители RBr включают бромуксусную кислоту и метил- и этилбромацетат.I. Общие методики. 1. Сочетание 2-хлорзамещенного хиноксалина и аминов или анилинов. Смесь 2-хлор-6,7-диметоксихиноксалина (1 экв.) и амина (примерно от 1 до примерно 5 экв.) нагревают при примерно от 160 до примерно 180 С в течение от примерно 3 ч до в течение ночи. Темнокоричневый остаток растворяют в смеси метанол/дихлорметан (0-10%) и подвергают хроматографии на силикагеле, элюируемом смесью гексан/этилацетат или метанол/метиленхлорид (0-100%) с получением целевого продукта. Целевой продукт может быть далее очищен перекристаллизацией из метанола, дихлорметана или смеси метанол/вода. 2. Сочетание 2-хлорзамещенного хиноксалина и спиртов или фенолов. Суспензию спирта или меркаптана (1 экв.) и гидрида натрия (примерно от 1 до примерно 3 экв.) в безводном ДМФ/ТГФ (0-50%) кипятят с обратным холодильником в течение 1 ч перед добавлением 2 хлор-6,7-диметоксихиноксалина (1 экв.). Полученную смесь кипятят с обратным холодильником в течение от примерно 1 до примерно 4 ч. Суспензию нейтрализуют до примерно рН 5-8 и распределяют между метиленхлоридом и насыщенным раствором соли. Остаток после концентрирования из метиленхлорида подвергают хроматографии на силикагеле, элюируемом смесью гексан/этилацетат или метанол/метиленхлорид (0-100%) с получением целевого продукта. 3. Реакция восстановительного аминирования с аминохинолинами и альдегидами или кетонами.- 11007290 Соответственно замещенный 3-аминохинолин (1 экв.) перемешивают с 1 экв. подходящего альдегида или кетона в метаноле (или другой подходящей смеси растворителей) до тех пор, пока ТСХ не покажет, что образование имина завершено. Добавляют избыток NaCNBH4, или NaBH4, или другого подходящего восстанавливающего вещества, и смесь перемешивают до тех пор, пока ТСХ не покажет полное израсходование промежуточного имина. Смесь концентрируют и остаток подвергают хроматографии на силикагеле со смесью гексан/этилацетат (0-100%) или хлороформ/метанол (0-20%) с получением целевого продукта. 4. Реакция сочетания 3-аминозамещенных хинолинов и бромфенильных соединений. Соответственно замещенный 3-аминохинолин (1 экв.) перемешивают с 1,4 экв. сильного основания, такого как трет-бутоксид натрия, 1 экв. соответствующего бромфенильного соединения и каталитическими количествами 2,2'-бис(дифенилфосфино)-1,1'бинафтила (S-BINAP=S-БИНАФ) и бис(дибензиллиденацетон)палладий (Рd(dba)2)=(Рd(дба)2) смешивают в инертном органическом растворителе, таком как толуол, в инертной атмосфере, такой как аргон, и нагревают до примерно 80 С в течение ночи. Смесь охлаждают, разбавляют растворителем, таким как эфир, фильтруют, концентрируют и хроматографируют со смесью 50% EtOAc/гексан с получением целевого продукта. 5. Образование простого эфира из 3-гидроксизамещенных хинолинов в условиях Митсунобу. ТГФ раствор соответственно замещенного гидроксихиноксалина (при примерно от 0 до примерно 25 С) обрабатывают 1 экв. каждого из требуемых спирта, трифенилфосфина и в конце диэтилазодикарбоксилата (ДЭАД) или подходящего эквивалента. За развитием реакции следят с помощью ТСХ и по завершении реакции (примерно от 1 до примерно 24 ч) смесь концентрируют и остаток хроматографируют на силикагеле с получением целевого продукта. 6. Деалкилирование замещенного низшим алкокси хинолина или хиноксалина и последующее алкилирование. Соответствующий замещенный низшим алкокси хинолин или хиноксалин (1 экв.) в ДМФ обрабатывают избытком этантиолята натрия (обычно примерно 2 экв. или более) и реакционную смесь перемешивают при нагревании в течение от примерно 1 до примерно 24 ч. Смесь распределяют между водой и этилацетатом. Обработка экстрагированием с последующей хроматографией, если необходимо, дает соответствующий целевой гидроксизамещенный хинолиновый или хиноксалиновый продукт. Гидроксизамещенный хинолиновый или хиноксалиновый продукт может быть алкилирован с применением условий для реакции Митсунобу, которые детализированы выше. Альтернативно, простое алкилирование с использованием методов, хорошо известных специалистам, с реактивным алкил- или бензилгалогенидом и использованием NaH или другого подходящего основания в подходящем растворителе дает целевой алкилированный продукт. 7. Окисление азота в хинолине или хиноксалине до соответствующего N-оксида. Иминовый (=N-) фрагмент в хинолиновом или хиноксалиновом соединении формулы (I) может быть превращeн в соответствующее соединение, причем иминовый фрагмент окисляется до N-оксида предпочтительно путем реакции с перкислотой, например перуксусной кислотой в уксусной кислоте или м-хлорпероксибензойной кислотой в инертном растворителе, таком как дихлорметан, при температуре от примерно комнатной температуры до температуры кипения, предпочтительно при повышенной температуре. Соединения формулы I (далее соединение данного изобретения) применяются в виде свободного основания, или свободной кислоты, или в виде их фармацевтически приемлемых солей. Все формы входят в объем этого изобретения. Когда соединение данного изобретения замещено основным фрагментом, образуются аддитивные соли кислоты, и они просто являются более удобной для использования формой: и на практике использование солевой формы по существу равносильно использованию формы свободного основания. Кислоты, которые могут использоваться для получения аддитивных солей кислоты, включают предпочтительно те, которые дают при соединении со свободным основанием фармацевтически приемлемые соли, то есть соли, анионы которых нетоксичны для пациента в фармацевтических дозах солей, так что благоприятные подавляющие действия на ТФР (PDGF), присущие свободному основанию, не ослаблялись побочным действием, относимым к анионам. Хотя фармацевтически приемлемые соли указанных основных соединений предпочтительны, все аддитивные соли кислоты пригодны в качестве источников формы свободного основания, даже если конкретная соль, сама по себе, желательна только в качестве промежуточного продукта, как например, когда соль образуется только в целях очистки и идентификации или когда она используется в качестве промежуточного соединения при получении фармацевтически приемлемой соли методами ионного обмена. Фармацевтически приемлемыми солями в объеме данного изобретения являются те, которые получают со следующими кислотами: минеральными кислотами, такими как соляная кислота, серная кислота, фосфорная кислота и сульфамовая кислота; и органическими кислотами, такими как уксусная кислота, лимонная кислота, молочная кислота, винная кислота, малоновая кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, птолуолсульфоновая кислота, циклогексилсульфамовая кислота, хинная кислота и тому подобное. Соответствующие аддитивные соли кислоты включают следующие: гидрогалогениды, например гидрохлорид- 12007290 и гидробромид, сульфат, фосфат, нитрат, сульфамат, ацетат, цитрат, лактат, тартрат, малонат, оксалат,салицилат, пропионат, сукцинат, фумарат, малеат, метилен-бисгидроксинафтоаты, гентизаты, мезилаты, изотионаты и ди-п-толуоилтартраты, метансульфонат, этансульфонат, бензолсульфонат, птолуолсульфонат, циклогексилсульфамат и хиннат соответственно. В соответствии с дополнительным признаком данного изобретения аддитивные соли кислоты соединений данного изобретения получают реакцией свободного основания с подходящей кислотой путем применения или адаптации известных методов. Например, аддитивные соли кислоты соединений данного изобретения получают или растворением свободного основания в водном, или водно-спиртовом растворе, или других подходящих растворителях, содержащих подходящую кислоту, и выделением соли выпариванием раствора, или реакцией свободного основания и кислоты в органическом растворителе, в случае, если соль выделяется непосредственно или она может быть выделена концентрированием раствора. Соединения данного изобретения можно регенерировать из аддитивных солей кислоты путем применения и адаптации известных методов. Например, родственные соединения данного изобретения можно регенерировать из их аддитивных солей кислоты путем взаимодействия со щелочью, например с водным раствором бикарбоната натрия или водным раствором аммиака. Когда соединение данного изобретения замещено кислотным заместителем, могут образовываться аддитивные соли основания, и они являются просто более удобной для использования формой; и на практике использование солевой формы по существу равноценно использованию формы свободной кислоты. Основания, которые могут использоваться для получения аддитивных солей основания, предпочтительно включают те, которые образуют при соединении со свободной кислотой фармацевтически приемлемые соли, то есть соли, катионы которых нетоксичны для организма животного в фармацевтических дозах солей, так что благоприятные ингибиторные действия на ТФР, присущие свободной кислоте, не ослабляются побочными действиями, связываемыми с катионами. Фармацевтически приемлемыми солями, включающими, например, соли щелочных и щелочно-земельных металлов, в рамках данного изобретения являются те, которые получаются со следующими основаниями: гидридом натрия, гидроксидом натрия, гидроксидом калия, гидроксидом кальция, гидроксидом алюминия, гидроксидом лития, гидроксидом магния, гидроксидом цинка, аммиаком, триметиламмонием, триэтиламмонием, этилендиамином, н-метилгликамином, лизином, аргинином, орнитином, холином, N,N'-дибензилэтилендиамином,хлорпрокаином, диэтаноламином, прокаином, н-бензилфенетиламином, диэтиламином, пиперазином,трис(гидроксиметил)аминометаном, гидроксидом тетраметиламмония и тому подобное. Соли металлов соединений данного изобретения могут быть получены путем приведения в контакт гидрида, гидроксида, карбоната или подобного реакционного соединения выбранного металла в водном или органическом растворителе с соединением в форме свободной кислоты. Используемый водный растворитель может быть водой или он может быть смесью воды с органическим растворителем, предпочтительно спиртом, таким как метанол или этанол, кетон, такой как ацетон, алифатический простой эфир,такой как тетрагидрофуран, или сложный эфир, такой как этилацетат. Такие реакции обычно проводятся при комнатной температуре, но они, если желательно, могут проводиться с нагреванием. Соли с аминами соединений данного изобретения могут быть получены путем приведения в контакт амина в водном или органическом растворителе с соединением в форме свободной кислоты. Подходящие водные растворители включают воду и смесь воды со спиртами, такими как метанол или этанол,простыми эфирами, такими как тетрагидрофуран, нитрилы, такие как ацетонитрил, или кетоны, такие как ацетон. Соли аминокислот могут быть получены подобным же образом. Соединения данного изобретения могут быть регенерированы из солей с присоединением основания путем применения или адаптации известных методов. Например, родоначальные соединения данного соединения могут быть регенерированы из их солей с присоединением основания путем приведения во взаимодействие с кислотой, например соляной кислотой. Являясь такими же полезными сами по себе, как и активные соединения, соли соединений данного изобретения являются полезными для целей очистки соединений, например, путем использования разности в растворимости солей и их родоначальных соединений, побочных продуктов и/или исходных материалов с помощью методик, хорошо известных специалистам в данной области. Соединения данного изобретения могут содержать асимметричные центры. Эти асимметричные центры могут независимо быть R или S конфигурации. Для специалистов будет также очевидно, что некоторые соединения формулы I могут проявлять геометрический изомеризм. Геометрические изомеры включают цис- и транс-формы соединений данного изобретения, т.е. соединения, имеющие алкенильные составляющие или заместители в кольцевых системах. Кроме того, бициклические системы колец включают эндо- и экзоизомеры. Данное изобретение включает отдельные геометрические изомеры, стереоизомеры, энантиомеры и их смеси. Такие изомеры могут быть разделены из их смесей путем применения или адаптации известных методов, например хроматографических методик и методик перекристаллизации, или их получают отдельно из соответствующих изомеров их промежуточных соединений, например, с помощью применения и адаптации описанных здесь методов.- 13007290 Исходные материалы и промежуточные соединения получают путем применения или адаптации известных методов, например методов, которые описаны в справочных примерах, или их химических эквивалентов, или способами, представленными в данном описании. Данное изобретение далее поясняется примерами, но не ограничивается следующими иллюстративными примерами, в которых описано получение соединений формулы I. Кроме того, последующие примеры являются типичными образцами процессов, используемых для синтеза соединений формулы I. Пример 1. 3-Циклогексилокси-6,7-диметоксихинолин. К ТГФ раствору (30 мл) при 0 С добавляют 3-гидрокси-6,7-диметоксихинолин (0,237 г, 1,15 ммоль), циклогексанол (0,347 г, 3,46 ммоль), Рh3 Р (0,908 г, 3,46 ммоль). Порциями добавляют диэтилазодикарбоксилат до тех пор, пока раствор не станет сохранять глубокий красный цвет (0,663 г, 3,81 ммоль). Через 4 ч раствор концентрируют и остаток хроматографируют (50% EtOAc в гексанах). Продукт перекристаллизовывают из смеси изопропанол/ гексаны как НСl соль в виде белого твердого вещества (т.пл. 229-232 С, разл.). Пример 2. Гидрохлорид 2-анилино-6-изопропоксихинолина. К NaH (0,033 г, 0,84 ммоль) в атмосфере аргона добавляют 1 мл ДМФ. Порциями добавляют 2 анилино-6-хиноксалинол (0,1 г, 0,42 ммоль) в 1,5 мл ДМФ. Через 30 мин по каплям добавляют 2 бромпропан и раствор нагревают до 50 С в течение 1,5 ч. Охлажденную реакционную смесь гасят водой и распределяют между EtOAc и Н 2O, промывают Н 2O (3 х), насыщенным раствором соли, сушат (МgSO4) и концентрируют. Полученный остаток хроматографируют (30% EtOAc/гексаны) с получением 0,05 г диалкилированного продукта и 0,1 г соединения, названного в заголовке. Аналитический образец НСl соли получают добавлением ИПА (изопропанол)/НСl к Еt2O/ИПА раствору свободного основания с получением НСl соли (т.пл. 205-210 С, разл.). Анал. Вычислено для C17H17N3OHCl: С 64,65; Н 5,74; N 13,31; найдено: С 64,51; Н 5,90; N 13,09. Пример 3. Гидрохлорид 2-анилино-6-метоксихиноксалина. К 2-хлор-6-метоксихиноксалину (0,93 г, 4,8 ммоль) в атмосфере аргона добавляют анилин (1,3 мл,14,3 ммоль). Реакционную смесь нагревают при 120 С в течение 2 ч, затем при 150 С в течение 1,5 ч. Смесь охлаждают и добавляют CH2Cl2. Полученную суспензию перемешивают и твердое оранжевое вещество отфильтровывают, промывают CH2Cl2/Et2O, затем энергично перемешивают с H2O в течение 40 мин, фильтруют и промывают Et2O с получением ярко-желтого твердого вещества. Пример 4. 2-Анилино-6-хиноксалинол. По методу Feutrill G.I.; Mirrington R.N., Tet. Lett. 1970, 1327; арилметиловый простой эфир превращают в фенольное производное. К раствору 2-анилино-6-метоксихиноксалина (0,27 г, 1,07 ммоль) в атмосфере аргона в ДМФ добавляют натриевую соль этантиола (0,19 г, 2 ммоль). Реакционную смесь нагревают до 110 С в течение ночи. Смесь концентрируют и распределяют между EtOAc и H2O/5% винной кислотой, так что рН водного слоя равен примерно 4. Органический слой промывают Н 2 О (4 х), затем 2,5% NaOH (4 х). Слои с основной реакцией объединяют, промывают EtOAc (2 х), снова подкисляют 5% винной кислотой и промывают многими порциями EtOAc. Органические слои объединяют, промывают насыщенным раствором соли, сушат (Na2SO4) и концентрируют. Полученное твердое вещество хроматографируют (50% EtOAc/гексаны). Аналитический образец получают растиранием продукта с Et2O с получением желтого порошка (т.пл. 211-213 С). Анал. Вычислено для С 14 Н 11N3 О: С 70,88; Н 4,67; N 17,71; найдено: С 70,64; Н 4,85; N 17,58. Пример 5. Фенил-[6-(тетрагидрофуран-3-(R)-илокси)хиноксалин-2-ил]амин. К ТГФ раствору при 0 С в атмосфере аргона добавляют 2-анилино-6-хиноксалинол (0,23 г, 0,97 ммоль), (S)-(+)-3-гидрокситетрагидрофуран (0,086 мл, 1,3 ммоль) и трифенилфосфин (0,31 г, 1,2 ммоль). Порциями добавляют ДЭАД (0,18 мл, 1,2 ммоль). Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 1,5 ч. Смесь концентрируют и распределяют между EtOAc и H2O. Органический слой промывают H2O, насыщенным раствором соли, сушат (MgSO4) и концентрируют. Полученное желтое масло хроматографируют (50% EtOAc/гексаны) и собирают в Et2O/ИПА. По каплям добавляют HCl/Et2O раствор и полученный красно-оранжевый порошок сушат в вакууме. Порошок превращают в свободное основание растиранием в МеОН с промытой (3 x H2O, 5 х МеОН) основной ионообменной смолой. Смесь перемешивают в течение 30 мин, фильтруют, концентрируют и перекристаллизовывают из смеси EtOAc/гексаны с получением, в два выхода, продукта (т.пл. 173-175 С). Анал. Вычислено для C18H17N3O2: С 70,35; Н 5,57; N 13,67; найдено: С 70,19; Н 5,60; N 13,66. Пример 6. 2,7-бис-Циклогексилокси-6-метоксихиноксалин. К ДМФ раствору (5 мл) NaH (0,32 г, 8 ммоль) в атмосфере аргона по каплям добавляют циклогексанол (0,7 мл, 6,7 ммоль). Смесь перемешивают при комнатной температуре в течение 25 мин, затем по каплям добавляют 2-хлор-6,7-диметоксихиноксалин. Реакционную смесь перемешивают в течение 15 мин при комнатной температуре, при 90 С в течение 2 ч и при 110 С в течение 1 ч. Смесь охлаждают,гасят Н 2 О и насыщенным раствором соли и распределяют между EtOAc/H2O. Органический слой промывают H2O и насыщенным раствором соли, сушат (MgSO4) и хроматографируют (10% EtOAc/гексаны) с- 14007290 получением воскообразного белого твердого вещества (т.пл. 75-78 С). Анал. Вычислено для C21H28N2O3: С 70,76; Н 7,92; N 7,86; найдено: С 70,81; Н 7,79; N 7,70. Пример 7. Циклогексил(6,7-диметоксихиноксалин-2-илметил)амин. К 0,067 М раствору 6,7-диметокси-2-хиноксалинкарбоксальдегида в смеси МеОН/1,2-дихлорэтан 2:1 (7,5 мл, 0,5 ммоль) добавляют циклогексиламин (0,11 мл, 0,9 ммоль). Реакционную смесь оставляют перемешиваться при комнатной температуре в течение ночи, затем добавляют NaBH4 (0,038 г, 1 ммоль) и реакционную смесь перемешивают в течение ночи. Смесь затем концентрируют и хроматографируютEtOAc/гексаны и обрабатывают НСl в EtOH. Полученный раствор концентрируют и твердые вещества растирают с изопропанолом с получением белого твердого вещества после сушки в вакууме при 60 С(т.пл. 185-190 С, разл.). Анал. Вычислено для С 17 Н 23N3O2 НСl: С 60,44; Н 7,16; N 12,44; найдено: С 60,48; Н 6,88; N 12,07. Пример 8. (6,7-Диметоксихинолин-3-ил)-транс(3-(R)-метилциклогексил)амин и (6,7-диметоксихинолин-3-ил)-цис(3-(R)-метилциклогексил)амин. Реакцию осуществляют подобно изложенному выше получению с использованием свободного основания 3-амино-6,7-диметоксихинолина (0,32 г, 1,6 ммоль) и (R)-(+)-3-метилциклогексанона (0,23 мл,1,9 ммоль). Полученную смесь продуктов хроматографируют (70% EtOAc/гексаны) и перекристаллизовывают из смеси EtOAc/гексаны с получением белого твердого вещества (смесь 1:1 цис- и трансизомеров) (т.пл. 153-160 С). Анал. Вычислено для C18H24N2O2: С 71,97; Н 8,05; N 9,33; найдено: С 72,12; Н 7,85; N 9,29. Пример 9. 3-(6,7-Диметоксихинолин-3-иламино)-2,2-диметилпропан-1-ол. Реакцию проводят подобно получению в примере 7. К МеОН раствору 4 А порошка молекулярного сита (0,35 г) в атмосфере аргона добавляют 3-амино-6,7-диметоксихинолин (0,32 г, 1,6 ммоль) и 2,2 диметил-3-гидроксипропиональдегид (0,19 г, 1,9 ммоль). Полученную смесь хроматографируют (3% МеОН/СНСl3) с получением 0,10 г материала, который распределяют между CH2Cl2/10% NaOH. Органический слой промывают 10% NaOH, H2O и насыщенным раствором соли, затем сушат (MgSO4) и перекристаллизовывают из смеси EtOAc/гексаны с получением светло-оранжевого твердого вещества (т.пл. 170-173,5 С). Анал. Вычислено для С 16 Н 22N2 О 3: С 66,18; Н 7,64; N 9,65; найдено: С 66,11; Н 7,49; N 9,33. Пример 10. Циклогексил(6-метокси-7-морфолин-4-илхиноксалин-2-ил)амин. Это получение основано на адаптации способа, описанного Buchwald, et al. J. Am. Chem. Soc., 1996,118, 7215. К толуольному раствору 2-циклогексиламино-6-метокси-7-бромхиноксалина (0,1 г, 0,3 ммоль) в атмосфере аргона добавляют морфолин (0,1 г, 0,3 ммоль), трет-бутоксид натрия (0,04 г, 0,42 ммоль), S(-)-БИНАФ (кат., 0,001 г) и бис(дибензилиденацетон)палладий (кат. 0,001 г). Реакционную смесь нагревают до 80 С в течение ночи. Смесь охлаждают, разбавляют Еt2O3, фильтруют, концентрируют и хроматографируют (50% EtOAc/гексаны). Продукт перекристаллизовывают из смеси EtOAc/гексаны с получением в два приема желтого твердого вещества (т.пл. 194-196 С). Анал. Вычислено для C19H26N4O2: С 66,64; Н 7,65; N 16,36; найдено: С 66,60; Н 7,60; N 16,51. Пример 11. транс-4-(7-Хлор-6-метоксихиноксалин-2-амино)циклогексанол и транс-4-(6-хлор-7 метоксихиноксалин-2-иламино)циклогексанол. В реакционную колбу в атмосфере аргона, снабженную ловушкой Дина-Старка и конденсатором,добавляют 6:1 2,7-дихлор-6-метоксихиноксалин:2,6-дихлор-7-метоксихиноксалин (0,30 г, 1,3 ммоль) и транс-4-аминоциклогексанол (0,35 г, 3 ммоль). Реакционную смесь нагревают до 170 С в течение примерно 10 ч, затем концентрируют и дважды хроматографируют (7% МеОН/СНСl3, затем 5% МеОН/ СНСl3). Продукт перекристаллизовывают из EtOAc/гексанов с получением светло-желтого твердого вещества (т.пл. 144-147 С). Анал. Вычислено для C19H26N4O20,4H2O: С 57,20; Н 6,02; N 13,34; найдено: С 57,21; Н 5,97; N 13,08. 1H ЯМР анализ выявил, что продукт является смесью 2:1 транс-4-(7-хлор-6 метоксихиноксалин-2-амино)циклогексанол:транс-4-(6-хлор-7-метоксихиноксалин-2-иламино)циклогексанол. Пример 12. транс-4-(6,7-Диметоксихиноксалин-2-иламино)циклогексанол. Транс-4-аминоциклогексанол (0,11 г, 2 экв.) и 2-хлор-6,7-диметоксихиноксалин (0,1 г, 1 экв.) соединяют и нагревают до 160-180 С за срок, равный 4-8 ч. Темно-коричневую суспензию фильтруют и концентрируют. Остаток очищают на флэш-колонке, элюируют смесью 3% метанол/дихлорметан с получением продукта в виде желтого порошка с т.пл. 119-123 С. Анал. Вычислено для C16H21N3O3: С 62,33; Н 7,05; N 13,63; найдено: С 62,35; Н 7,09; N 13,18. Соединение можно было бы перекристаллизовать следующим методом. Исходя из 0,2 г желтого порошка в смеси 2,5 мл воды и 1,25 мл метанола, получают прозрачный окрашенный в оранжевый цвет раствор после кипячения с обратным холодильником. Горячий раствор оставляют стоять и постепенно охлаждаться. Иглоподобные оранжевого цвета кристаллы собирают фильтрованием и сушат под высоким вакуумом с получением желтого твердого вещества (т.пл. 119-120 С). Альтернативно, НСl соль соединения, названного в заголовке, получают следующим образом. К раствору транс-4-(6,7-диметоксихиноксалин-2-иламино)циклогексанола в изопропаноле добавляют рас- 15007290 твор НСl при 0 С. Смесь перемешивают в течение 15 мин перед фильтрованием. Собранное твердое вещество сушат под высоким вакуумом с получением гидрохлоридной соли транс-4-(6,7 диметоксихиноксалин-2-иламино)циклогексанола. Анал. Вычислено для С 16 Н 22 СlN3 О 31,2 Н 2O: С 53,19; Н 6,80; N 11,63; Cl 9,81; найдено: С 53,14; Н 6,85; N 11,24; Cl 10,28. Альтернативно, сульфатную соль соединения, названного в заголовке, получают следующим образом: по типичной методике транс-4-(6,7-диметоксихиноксалин-2-иламино)циклогексанол растворяют в ацетоне или другом подходящем органическом растворителе с нагреванием до 45 С, когда необходимо. К полученному раствору осторожно добавляют водный раствор H2SO4 (1 экв., 1 М р-ра) при быстром перемешивании. Образованную таким образом соль собирают и сушат с получением сульфата с 80% выходом. Следующие соединения получают подобным же образом, исходя из соответствующего исходного материала. 3-(6,7-Диметоксихиноксалин-2-иламино)пропан-1-ол (т.пл. 154,5-156 С). Анал. Вычислено для С 13 Н 17N3 О 3: С 59,30; Н 6,51; N 15,96; найдено: С 59,30; Н 6,46; N 15,87. 3-(6,7-Диметоксихиноксалин-2-иламино)-2,2-диметилпропан-1-ол (т.пл. 174-176,5 С). Анал. Вычислено для C15H21N3O3: С 61,84; Н 7,27; N 14,42; найдено: С 61,67; Н 7,22; N 14,22. 4-(6,7-Диметилхиноксалин-2-иламино)циклогексанол (т.пл. 168-171 С). Анал. Вычислено для С 16H21N3 О: С 70,82; Н 7,80; N 15,48; найдено: С 70,76; Н 7,90; N 15,20. Пример 13. цис-4-(6,7-Диметоксихиноксалин-2-иламино)циклогексанол. Смесь цис-4-аминоциклогексанола (400 мг, 3,48 ммоль) и 2-хлор-6,7-диметоксихиноксалина (450 мг, 2 ммоль) в 5 мл этанола помещают в запаянную трубку и затем нагревают при 180 С в течение 3 ч. Темно-коричневую смесь хроматографируют на силикагеле и элюируют этилацетатом с получением целевого продукта (т.пл. 65-67 С). Вычислено для С 16 Н 21N3 О 30,6 Н 2 О: С 61,17; Н 7,12; N 13,37; найдено: С 61,22; Н 7,19; N 12,19. Пример 14. -Бицикло[2,2,1]гепт-2-ил-(6,7-диметоксихиноксалин-2-ил)амин. Процедура А. Смесь 2-хлор-6,7-диметоксихиноксалина (5 г, 22,3 ммоль) и -экзо-норборнил-2-амина (10 г, 90 ммоль) нагревают при 160-180 С в течение ночи. Темно-коричневый остаток растворяют в 200 мл метиленхлорида и промывают 1 н. NaOH (50 мл). Органический слой сушат над сульфатом магния и затем фильтруют. Остаток после концентрирования подвергают хроматографии на силикагеле, элюируемом смесью гексан/этилацетат (80%) с получением целевого продукта в виде желтого твердого вещества, которое перекристаллизовывают из метанола. Процедура В. Смесь 2-хлор-6,7-диметоксихиноксалина (9 г, 40,1 ммоль) и -экзо-норборнил-2-амина (5,77 г, 52 ммоль), трет-бутоксида натрия (4,22 г, 44 ммоль), 2,2'-бис(дифенилфосфино)-1,1'-бинафтила (БИНАФ,120 мг) и бис(дибензилиденацетон) палладия Рd(дба)2, 40 мг в 80 мл толуола нагревают до 80 С в течение 8 ч. Добавляют другую порцию БИНАФ (60 мг) и Рd(дба)2 (20 мг) и смесь нагревают до 100 С в течение ночи. После разбавления 200 мл дихлорметана реакционную смесь промывают 1 н. NaOH (100 мл). Органический слой сушат над сульфатом магния и фильтруют. Остаток после концентрирования подвергают хроматографии на силикагеле, элюируемом смесью гексан/этилацетат (80%) с получением целевого продукта в виде светло-желтого твердого вещества (т.пл. 188-189 С). Анал. Вычислено для С 17 Н 21N3 О 3: С 68,20; Н 7,07; N 14,04; найдено: С 68,18; Н 7,03; N 14,03. Следующие соединения получают подобным же образом, начиная с соответствующего исходного материала (процедура А). экзо-Бицикло[2,2,1]гепт-5-ен-2-ил-(6,7-диметоксихиноксалин-2-ил)амин (т.пл. 175-177 С). Анал. Вычислено для С 17 Н 19N3O20,4 Н 2O: С 60,94; Н 6,56; N 13,78; найдено: С 66,98; Н 6,62; N 12,73.(6,7-Диметоксихиноксалин-2-ил)-(4-метоксициклогексил)амин (т.пл. 58-68 С). Анал. Вычислено для C17H23N3O30,5H2O: С 62,56; Н 7,41; N 12,87; найдено: С 62,53; Н 7,22; N 12,22. Пример 15. экзо-2-(Бицикло[2,2,1]гепт-2-илокси)-6,7-диметоксихиноксалин. Смесь экзо-2-норборнеола (223 мг, 2 ммоль) и NaH (60%, 100 мг, 2,5 ммоль) в 10 мл безводного ТГФ кипятят с обратным холодильником в течение 0,5 ч перед добавлением 2-хлор-6,7 диметоксихиноксалина (336 мг, 1,5 ммоль). Полученную смесь продолжают кипятить с обратным холодильником в течение 2 ч. Остаток после фильтрования и концентрации хроматографируют на силикагеле(50% эфир/гексан) с получением целевого продукта в виде белого твердого вещества (т.пл. 135-137 С). Анал. Вычислено для C17H20N2O3: С 67,98; Н 6,71; N 9,33; найдено: С 67,96; Н 6,762; N 9,19. Следующие соединения получают подобным же образом, начиная с соответствующего исходного материала. экзо-2-(Бицикло[2,2,1]гепт-5-ен-2-илокси)-6,7-диметоксихиноксалин (т.пл. 108-110 С). Анал. Вычислено для C17H18N2O3: С 68,44; Н 6,08; N 9,39; найдено: С 68,54; Н 6,23; N 9,27. 2-(Бицикло[2,2,1]гепт-5-ен-2-илокси)-6,7-диметоксихиноксалин (т.пл. 93-95 С). Анал. Вычислено для С 17 Н 18N2 О 3: С 68,44; Н 6,08; N 9,39; найдено: С 68,32; Н 5,98; N 9,25. 2-(1,4-Диоксаспиро[4,5]дек-8-илокси)-6,7-диметоксихиноксалин (т.пл. 124-125 С). Анал. Вычислено для C18H22N2O5: С 62,42; Н 6,40; N 8,09; найдено: С 62,63; Н 6,46; N 7,79. Пример 16. цис/транс-4-(6,7-Диметоксихиноксалин-2-илокси)циклогексанкарбоновая кислота. Смесь цис/транс-4-гидроксициклогексанкарбоновой кислоты (144 мг, 1 ммоль) и NaH (60%, 160 мг,4 ммоль) в безводном ТГФ/ДМФ (10 мл/2 мл) кипятят с обратным холодильником в течение 1 ч перед добавлением 2-хлор-6,7-диметоксихиноксалина (225 мг, 1 ммоль). Полученную смесь продолжают нагревать с обратным холодильником в течение 4 ч. Реакционную смесь нейтрализуют до рН 5 и экстрагируют этилацетатом (250 мл). Объединенные органические растворы сушат над сульфатом магния и фильтруют. Остаток после концентрирования хроматографируют на силикагеле (этилацетат, с последующим метанолом) с получением целевого продукта в виде белого твердого вещества (т.пл. 90-93 С). Анал. Вычислено для C17H20N2O50,5H2O: С 59,89; Н 6,19; N 8,22; найдено: С 59,91; Н 6,62; N 7,90. Следующие соединения получают подобным же образом, начиная с соответствующего исходного материала: 4-(6,7-Диметоксихиноксалин-2-илоксиметил)циклогексанол (т.пл. 118-121 С). Анал. Вычислено дляC16H20N2O4: С 63,14; Н 6,62; N 9,20; найдено: С 62,52; Н 6,80; N 8,88. Пример 17. 5-(6,7-Диметоксихиноксалин-2-илокси)бицикло[2,2,1]гептан-2,3-диол. К раствору 2-(бицикло[2,2,1]гепт-5-ен-2-илокси)-6,7-диметоксихиноксалин (149 мг, 0,5 ммоль) и 4 метилморфолин-N-оксида (234 мг, 2 ммоль) при комнатной температуре в 5 мл ТГФ добавляют раствор ОsO4 в трет-бутаноле (2,5% по весу, 0,2 мл). Коричневый раствор энергично перемешивают в течение 2 ч перед тем, как погасить насыщенным NаНS2O3 (2 мл). Для экстрагирования используют эфир (3100 мл) и затем сушат над сульфатом магния. Остаток после фильтрования и концентрации подвергают хроматографии на силикагеле (50% этилацетат/гексан) с получением целевого продукта (т.пл. 85-88 С). Анал. Вычислено для C17H20N2O50,9H2O: С 58,73; Н 6,29; N 8,06; найдено: С 58,74; Н 5,91; N 7,53. Подобным же образом получен (2-экзо,3-экзо,5-экзо)-5-(6,7-диметоксихиноксалин-2-иламино) бицикло[2,2,1]гептан-2,3-диол (т.пл. 150-153 С). Пример 18. цис-4-(6,7-Диметоксихиноксалин-2-илокси)циклогексиловый эфир уксусной кислоты и цис-4-(6,7-диметоксихиноксалин-2-илокси)циклогексанол. Смесь цис-4-ацетоксициклогексанола (632 мг, 4 ммоль) и NaH (60%, 220 мг, 5,5 ммоль) в 15 мл безводного ТГФ кипятят с обратным холодильником в течение 0,5 ч перед добавлением 2-хлор-6,7 диметоксихиноксалина (674 мг, 3 ммоль). Полученную смесь продолжают кипятить с обратным холодильником в течение 2 ч. Остаток после фильтрования и концентрирования хроматографируют на силикагеле (эфир) с получением цис-4-(6,7-диметоксихиноксалин-2-илокси)циклогексилового эфира уксусной кислоты (т.пл. 150-152 С), анал.: вычислено для C18H22N2O5: С 62,42; Н 6,40; N 8,09; найдено: С 62,39; Н 6,55; N 7,82, и цис-4-(6,7-диметоксихиноксалин-2-илокси)циклогексанола (т.пл. 148-150 С). Анал. Вычислено для C16H20N2O4: С 63,14; Н 6,62; N 9,20; найдено: С 62,80; Н 6,76; N 8,67. транс-4-(6,7-Диметоксихиноксалин-2-илокси)циклогексанол [MS m/z: 304 (М+)] получен аналогично. Пример 19. 4-(6,7-Диметоксихиноксалин-2-илокси)циклогексиловый эфир диметилкарбаминовой кислоты. Смесь 4-(6,7-диметоксихиноксалин-2-илокси)циклогексанола (100 мг, 0,33 ммоль), диметилкарбамилхлорид (90 мкл, 1,2 ммоль) и NaH (60%, 19,6 мг, 0,49 ммоль) в 5 мл ТГФ перемешивают при комнатной температуре в течение 3 дней с получением белого твердого вещества (т.пл. 152-155 С), выделенно- 17007290 го с помощью хроматографии (50% этилацетат/гексан). Анал.: вычислено для C19H25N3O5: С 60,79; Н 6,71; N 11,19; найдено: С 60,38; Н 6,54; N 10,43. Пример 20. 3-Циклогексилокси-6,7-диметоксихиноксалин-1-оксид. Смесь 2-циклогексилокси-6,7-диметоксихиноксалин (110 мг, 0,38 ммоль) и метахлорбензойной перкислоты (70%, 113 мг, 0,46 ммоль) в 10 мл дихлорметана перемешивают при комнатной температуре в течение 1 дня. Раствор после фильтрования концентрируют и остаток хроматографируют на силикагеле(20% этилацетат/гексан) с получением целевого продукта (т.пл. 167-169 С). транс-4-(6,7-Диметокси-4-оксихиноксалин-2-иламино)циклогексанол (т.пл. 220-222 С) получают подобным же образом. Анал. Вычислено для С 16 Н 21N3O40,2H2O: С 59,42; Н 6,69; N 12,99; найдено: С 59,43; Н 6,64; N 12,95. Пример 21. транс-4-(6,7-Диметоксихиноксалин-2-иламино)циклогексиловый эфир уксусной кислоты. Смесь транс-4-(6,7-диметоксихиноксалин-2-иламино)циклогексанола (303 мг, 1 ммоль), уксусного ангидрида (2 мл) и пиридина (2 мл) в 10 мл дихлорметана перемешивают при комнатной температуре в течение ночи. Смесь гасят водой (5 мл) и экстрагируют дихлорметаном (230 мл). После сушки над сульфатом магния и фильтрования раствор концентрируют на роторном испарителе. Остаток хроматографируют на силикагеле (этилацетат) с получением целевого ацетата в виде светло-желтого твердого вещества (т.пл. 176-177 С). Анал. Вычислено для C18H23N3O4: С 62,59; Н 6,71; N 12,17; найдено: С 62,89; Н 6,67; N 11,95. Пример 22. (2-экзо,5-экзо)-5-(6,7-Диметоксихиноксалин-2-иламино)бицикло[2,2,1]гептан-2-ол. Смесь (2-экзо,5-экзо)-5-аминобицикло[2,2,1]гептан-2-ацетата (127 мг, 0,75 ммоль) и 2-хлор-6,7 диметоксихиноксалина (224 мг, 1 ммоль) нагревают до 180 С в течение 6 ч. После этого срока смесь охлаждают до комнатной температуры, растворяют в дихлорметане и очищают на флэш-колонке. Выделенный продукт (20 мг, 7,5% выход) растворяют в метаноле (2 мл) и добавляют свежий раствор 1 н. метоксида натрия (0,063 мл, 0,063 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 90 мин. Неочищенную смесь очищают препаративной тонкослойной хроматографией с получением продукта в виде твердого желтого вещества с т.пл. 97-100 С. С 17 Н 21N3 О 3 (m/z): 315. Следующие соединения получают подобным же образом, начиная с соответствующего исходного материала:(2-эндо,5-экзо)-5-(6,7-диметоксихинолин-2-иламино)бицикло[2,2,1]гептан-2-ол в виде желтого твердого вещества. С 17 Н 21N3 О 3 (m/z): 315.(2-экзо,6-экзо)-6-(6,7-Диметоксихинолин-2-иламино)бицикло[2,2,1]гептан-2-ол в виде желтого твердого вещества (30 мг, всего 21%). C17H21N3O3 (m/z): 315. Анал. Вычислено для C17H21N3O3: С 64,74; Н 6,71; N 13,32; найдено: С 58,42; Н 6,26; N 11,56. Пример 23. (2-транс,4-цис)-4-(6,7-Диметоксихиноксалин-2-иламино)-2-метилциклогексанол и (2 транс,4-транс)-4-(6,7-диметоксихиноксалин-2-иламино)-2-метилциклогексанол. Смесь 2-хлор-6,7-диметоксихиноксалина (1,08 г, 4,81 ммоль) и (2-транс)-4-амино-2 метилциклогексанола (620 мг, 4,81 ммоль) нагревают до 180 С в течение 6 ч. Реакция дает два диастереомера. Основной изомер выделяют в виде желтого твердого вещества, идентифицированного как (2 транс,4-транс)-4-(6,7-диметоксихиноксалин-2-иламино)-2-метилциклогексанол (240 мг, 0,76 ммоль).C17H23N3O3 (m/z): 317. Анал. Вычислено для C17H23N3O32H2O: С 58,00; Н 7,69; N 11,94; найдено: С 58,0; Н 6,58; N 11,24. Минорный изомер также представляет собой твердое желтое вещество, идентифицированное как(2-транс,4-транс)-4-(6,7-Диметоксихиноксалин-2-иламино)-2-метилциклогексанол далее разделяют с помощью хиральной ВЭЖХ на его отдельные энантиомеры. Первый энантиомер обладает (+)вращением (порядок элюирования на Chiracel OJ). Второй энантиомер обладает (-)-вращением (порядок элюирования на Chiracel OJ). Аналитические условия с использованием колонки Chiracel OD приводили к элюированию (+)-энантиомера вторым. (-)-Энантиомер проявляет предпочтительную активность ТФРР при иммуноферментном анализе ELISA. Пример 24. (2-цис,4-цис)-4-(6,7-Диметоксихиноксалин-2-иламино)-2-метилциклогексанол и (2 цис,4-транс)-4-(6,7-диметоксихиноксалин-2-иламино)-2-метилциклогексанол. К раствору смеси 2:1 (2-транс,4-транс)-4-(6,7-диметоксихиноксалин-2-иламино)-2-метилциклогексанола и (2-транс,4-цис)-4-(6,7-диметоксихиноксалин-2-иламино)-2-метилциклогексанола (120 мг,0,38 ммоль) в ТГФ (7 мл) добавляют трифенилфосфин (110 мг, 0,42 ммоль) и диэтилазодикарбоксилат(0,066 мл, 0,42 ммоль) и бензойную кислоту (46,4 мг, 0,38 ммоль). Смесь перемешивают при комнатной температуре в течение ночи и остаток после обработки разделяют на силикагеле (30% этилацетат/гексан) с получением смеси бензоатов. К раствору преобладающего бензоата (50 мг, 0,12 ммоль) в метаноле (2 мл) добавляют 1 н. гидроксид натрия (0,12 мл, 0,12 ммоль). Чистый продукт (13 мг, 32% выход) выделяют с помощью препара- 18007290 тивной тонкослойной хроматографии в виде твердого желтого вещества (т.пл. 85-88 С), идентифицированного как (2-цис,4-цис)-4-(6,7-диметоксихиноксалин-2-иламино)-2-метилциклогексанол. C17H23N3O3(m/z): 317. Подобным же образом минорный бензоат (4,4 мг) гидролизуют и целевой продукт (3,3 мг, 100%) также выделяют препаративной тонкослойной хроматографией в виде твердого желтого вещества, идентифицированного как (2-цис,4-транс)-4-(6,7-диметоксихиноксалин-2-иламино)-2-метилциклогексанол.(+)-Бицикло[2,2,1]гепт-2-ил-(6,7-диметоксихиноксалин-2-ил)амин из примера 14 разделяют на хиральной колонке для ВЭЖХ (Chiralpac AD, 252 см, 60% гептан/40% этанол с 10 мМ (1S)-(+)камфорсульфоновая кислота, 12 мл/мин) и названный выше в заголовке продукт получают в качестве первого элюента. Собранные фракции объединяют и промывают 50 мл 1 н. NaOH перед сушкой (MgSO4). Раствор после фильтрования концентрируют на роторном испарителе и затем сушат под высоким вакуумом. Получают желтое твердое вещество. []d20+19,5 (с=0,20, CH2Cl2) т.пл. 184-186 С. Анал. Вычислено для C17H21N3O20,3H2O: С 66,90; Н 7,15; N 13,77; найдено: С 66,86; Н 7,01; N 13,86. Пример 26. Биотрансформационное получение (1S,2R,4S,5R)-5-(6,7-диметоксихиноксалин-2 иламино)бицикло[2,2,1]гептан-2-ол. Штамм грибков F 2052 (Mortierella isabellina) закуплен в Northern Utilisation Research andDevelopment Division (NRRL). Грибок хранили при -25 С. 250 мл конические колбы, каждая из которых содержит 50 мл посевной культуральной среды (среда 216) высевали 2 мл суспензии грибка и инкубировали на роторном шейкере(200 об./мин) при 23 С в течение 3 дней. 250 мл конические колбы, каждая из которых содержит 50 мл той же среды высевают 2 мл посевной культуры и инкубируют на роторном шейкере (200 об./мин) при 23 С. Через 24 ч (1R,2R,4S)-(+)-бицикло[2,2,1]гепт-2-ил-(6,7-диметоксихиноксалин-2-ил)амин из примера 25 растворяют в МеОН и добавляют в колбы до конечной концентрации, равной 300 мг/л. Культуры собирают после 24 ч инкубации. (Среда 216: глюкозы 0,4%, дрожжевой экстракт 0,05%, соевая мука 0,05%, NaCl 0,05%, KН 2 РO4 0,05). Экстрагирование осуществляют, используя 2 объема ацетонитрила, 1 объем трет-бутилметилового эфира и 1 объем н-гептана, которые добавляют к 1 объему бульона. После перемешивания с магнитной мешалкой при 22 С экстракт разделяется на 3 слоя. Промежуточный слой собирают и выпаривают досуха и растворяют в этилацетате. Этилацетатный экстракт разделяют на силикагеле (0,04-0,063 мм), применяя этилацетат в качестве элюента. Фракции, содержащие продукт биотрансформации разделяют на С 18 диоксида кремния, используя градиент H2O/MeOH в качестве элюента. Эта хроматография дает чистое соединение, названное в заголовке, в виде аморфного желтого порошка,т.пл. 190-192 С. Пример 27. транс-4-[7-Метокси-6-(2-морфолин-4-илэтокси)хиноксалин-2-иламино]циклогексанол и транс-4-[6-метокси-7-(2-морфолин-4-илэтокси)хиноксалин-2-иламино]циклогексанол. Соединение, названное в заголовке, получают путем сочетания Митсунобу 6-гидрокси-7-метокси-2 хлорхиноксалина: 7-(2-морфолин-4-илэтокси)-6-метокси-2-хлорхиноксалина и 2-(морфолин-4-ил) этанола, используя методику из примера 1, и реакции полученного 6-(2-морфолин-4-илэтокси)-7 метокси-2-хлорхиноксалина: 7-(2-морфолин-4-илэтокси)-6-метокси-2-хлорхиноксалина и транс-4 аминоциклогексанола, используя методику из примера 11. Пример 28. 2-[2-(транс-4-Гидроксициклогексиламино)-7-метоксихиноксалин-6-илокси]-1-уксусная кислота и 2-[2-(транс-4-гидроксициклогексиламино)-6-метоксихиноксалин-7-илокси]-1-уксусная кислота. Соединение, названное в заголовке, получают деалкилированием 4-(6,7-диметоксихиноксалин-2 иламино)циклогексанола, используя натриевую соль этантиола в ДМФ, как описано в примере 4, с последующим алкилированием с помощью бромуксусной кислоты в присутствии основания, как описано в общей методике 6. Пример 29. 2-[2-(транс-4-Гидроксициклогексиламино)-7-метоксихиноксалин-6-илоксил]-N,Nдиметилацетамид и 2-[2-(транс-4-гидроксициклогексиламино)-6-метоксихиноксалин-7-илоксил]-N,Nдиметилацетамид. Соединение, названное в заголовке, получают аминолизом соединения из примера 28, используя диметиламин. Пример промежуточного соединения 1. Дигидрохлорид 4-бром-5-метоксибензол-1,2-диамина. К раствору EtOAc (50 мл) и 5-бром-4-метокси-2-нитрофениламина (2,5 г, 10 ммоль) в атмосфере аргона добавляют 5% Pd/C (0,5 г). Реакционную смесь гидрируют при 50 фунт/дюйм 2 в течение 1 ч. Смесь фильтруют через целит в раствор НСl/ИПА/EtOAc и слой промывают дополнительным количествомEtOAc. Полученный осадок отфильтровывают с получением белого твердого вещества. Пример промежуточного соединения 2. 7-Бром-5-метоксихиноксалин-2-ол и 6-бром-7 метоксихиноксалин-2-ол. К раствору МеОН (15 мл) в атмосфере аргона добавляют измельченные в порошок гранулы NaOH(0,86 г, 21 ммоль) и дигидрохлорид 4-бром-5-метоксибензол-1,2-диамина (2,7 г, 9,3 ммоль). Смесь пере- 19007290 мешивают в течение 10 мин, затем по каплям добавляют раствор 45% этилглиоксилата в толуоле (2,7 г,12 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 1 ч, затем охлаждают. Добавляют воду, затем суспензию фильтруют. Полученное твердое вещество последовательно промывают Н 2 О, МеОН, ИПА и Et2O с получением желтого порошка. Пример промежуточного соединения 3. 7-Бром-2-хлор-6-метоксихиноксалин и 6-бром-2-хлор-7 метоксихиноксалин. К смеси 7-бром-6-метоксихиноксалин-2-ола и 6-бром-7-метоксихиноксалин-2-ола (1 г, 3,9 ммоль) добавляют РОСl3 (5 мл). Реакционную смесь кипятят с обратным холодильником 1 ч, выливают в ледяную воду, фильтруют, затем промывают водой с получением светло-коричневого твердого вещества. Отношение 7-бром-2-хлор-6-метоксихиноксалина:6-бром-2-хлор-7-метоксихиноксалин составляет примерно 7:1 по 1H ЯМР. Пример промежуточного соединения 4. 5-Хлор-4-метокси-2-нитроанилин. К раствору N-(5-хлор-4-метокси-2-нитрофенил)ацетамида (2 г, 8,2 ммоль) в 5N НСl (20 мл) добавляют 1,4-диоксан (10 мл) и смесь перемешивают при 60 С в течение 1,5 ч. Реакционную смесь концентрируют и распределяют между EtOAc/2N NaOH. Водные слои промывают EtOAc (3 х), насыщенным раствором соли, сушат (МgSO4), адсорбируют на силикагеле и хроматографируют (70% EtOAc/гексаны) с получением оранжевого порошка. Пример промежуточного соединения 5. Дигидрохлорид 4-хлор-5-метоксибензол-1,2-диамина. К раствору EtOAc (25 мл) и 5-хлор-4-метокси-2-нитрофениламина (1,6 г, 7,9 ммоль) в атмосфере аргона добавляют 5% Pd/C (0,5 г). Реакционную смесь гидрируют при 50 фунт/дюйм 2 в течение 1 ч. Смесь фильтруют в атмосфере N2 через целит в раствор 1 н. HCl/Et2O в EtOAc и осадок промывают дополнительным количеством EtOAc. Полученный осадок отфильтровывают с получением белого твердого вещества. Пример промежуточного соединения 6. 7-Хлор-6-метоксихиноксалин-2-ол и 6-хлор-7 метоксихиноксалин-2-ол. К раствору дигидрохлорида 4-хлор-5-метоксибензол-1,2-диамина (1,8 г, 7,2 ммоль) в EtOH (15 мл) в атмосфере аргона добавляют ТЭА (2,5 мл, 18 ммоль) при 0 С. Смесь перемешивают в течение 20 мин,затем порциями добавляют 45% раствор этилглиоксилата в толуоле (2,1 г, 9,3 ммоль). Реакционную смесь нагревают до комнатной температуры, кипятят с обратным холодильником в течение 1,5 ч, затем охлаждают, добавляют воду, затем суспензию фильтруют и последовательно промывают H2O, ИПА иEt2O с получением светло-желтого порошка. Продукт несколько раз подвергают азеотропной перегонке с толуолом и сушат в вакууме перед использованием. Пример промежуточного соединения 7. 2,7-Дихлор-6-метоксихиноксалин и 2,6-дихлор-7 метоксихиноксалин. К смеси 7-хлор-6-метоксихиноксалин-2-ола и 6-хлор-7-метоксихиноксалин-2-ола (1 г, 4,7 ммоль) в трубке при осушении CaCl2 добавляют РОСl3 (5 мл). Реакционную смесь нагревают с обратным холодильником 30 мин, выливают в холодный насыщенный раствор NаНСО 3, фильтруют, затем промывают водой с получением твердого вещества. Отношение 2,7-дихлор-6-метоксихиноксалин:2,6-дихлор-7 метоксихиноксалин составляет примерно 6:1 по 1H ЯМР. Пример промежуточного соединения 8. цис-4-Аминоциклогексанол. цис-4-Аминоциклогексанол получают по литературной методике с незначительной модификацией[J. Med. Chem. 18(6) 634, 1975]. Пример промежуточного соединения 9. экзо-Бицикло[2,2,1]гепт-5-ен-2-амин. экзо-Бицикло[2,2,1]гепт-5-ен-2-амин получают по той же процедуре, что и в примере промежуточного соединения 15 из 5-норборнен-2-ола через неустойчивое промежуточное соединение экэо-2 бицикло[2,2,1]гепт-5-ен-2-илизоиндол-1,3-дион. Пример промежуточного соединения 10. (2-экзо,6-зкзо)-2-(6-Гидроксибицикло[2,2,1]гепт-2 илизоиндол-1,3-дион и (2-экзо,5-экзо)-2-(5-гидроксибицикло[2,2,1]гепт-2-илизоиндол-1,3-дион. К смеси экзо-2-бицикло[2,2,1]гепт-5-ен-2-илизоиндол-1,3-диона (320 мг, 1,34 ммоль) в 5 мл ТГФ при 0 С добавляют раствор ВН 3/ТГФ (1 М, 2 мл, 2 ммоль). Смесь перемешивают при комнатной температуре в течение 2 ч перед добавлением воды (2 мл) и NаВО 34 Н 2O (900 мг). Полученную суспензию перемешивают в течение ночи. Для экстрагирования используют эфир (350 мл) и сушат над сульфатом магния. Остаток после фильтрования и концентрации хроматографируют на силикагеле (эфир) с получением целевых продуктов, которые могут быть дополнительно разделены. Пример промежуточного соединения 11. (2-экзо,5-эндо)-2-(5-Гидроксибицикло[2,2,1]гепт-2 илизоиндол-1,3-дион.(2 г) в 10 мл метиленхлорида перемешивают при комнатной температуре в течение выходных дней. После разбавления эфиром (100 мл) суспензию фильтруют и раствор концентрируют. Остаток хроматографируют на силикагеле (эфир) с получением 750 мг (95%) соответствующих кетонов. Кетоны дополни- 20007290 тельно разделяют ВЭЖХ с обращенной фазой (СН 3 СN/Н 2 О, 10-70%) с получением экзо-2-(5 оксибицикло[2,2,1]гепт-2-илизоиндол-1,3-диона.(b) К раствору экзо-2-(5-оксибицикло[2,2,1]гепт-2-илизоиндол-1,3-диона (250 мг, 0,98 ммоль) в 10 мл метанола при 0 С добавляют NaBH4 (38 мг, 1 ммоль). Смесь перемешивают в течение ещe получаса и гасят 1 н. НСl (1 мл). После концентрации остаток экстрагируют метиленхлоридом (2 х 50 мл). Выпаривание метиленхлорида дает целевой продукт, используемый непосредственно, без дополнительной очистки. Пример промежуточного соединения 12. (2-эндо,5-зкзо)-5-Аминобицикло[2,2,1]гептан-2-ол, (2 экзо,5-экзо)-5-аминобицикло[2,2,1]гептан-2-ол, (2-эндо,6-экзо)-6-аминобицикло[2,2,1]гептан-2-ол и (2 экзо,6-экзо)-6-амино-бицикло[2,2,1]гептан-2-ол. Соединения, названные в заголовке, получают из соответствующего исходного материала по изложенной выше методике примера промежуточного соединения 11. Пример промежуточного соединения 13. 2-Метил-6,7-диметоксихиноксалин. Соединение, названное в заголовке, получают, используя адаптацию опубликованного методаTamao, et al. Tetrahedron, 1982, 38, 3347-3354. К раствору ТГФ в атмосфере аргона добавляют 2-хлор-6,7 диметоксихиноксалин (5 г, 26 ммоль) и NiCl2 (dppp) (0,14 г, 0,26 ммоль). Реакционную смесь охлаждают до 0 С и порциями добавляют 3 М раствор МеМgВr в Et2O (13 мл, 39 ммоль). Реакционной смеси дают нагреться до комнатной температуры, перемешивают в течение 1 ч, затем нагревают с обратным холодильником в течение 1,5 ч. Смесь охлаждают, гасят 10% НСl, перемешивают 10 мин, затем делают основной 5% NaOH. К реакционной смеси добавляют CH2Cl2 и H2O и смесь перемешивают в течение ночи. Затем дополнительно добавляют CH2Cl2, H2O и NaCl и смесь фильтруют. Полученный раствор выливают в разделительную воронку и водные слои промывают 3 х CH2Cl2. Органические слои объединяют, промывают насыщенным раствором соли, сушат (МgSO4), концентрируют на силикагеле и хроматографируют (50-80% EtOAc/гексаны) с получением оранжевого твердого вещества (49% выход). Пример промежуточного соединения 14. 6,7-Диметокси-2-хиноксалинкарбоксальдегид. В реакционную колбу в атмосфере аргона добавляют 1,4-диоксан (20 мл), 2-метил-6,7 диметоксихиноксалин (1,09 г, 5,3 ммоль) и SeO2 (1,8 г, 16 ммоль). Смесь нагревают до 100 С в течение 2 ч 45 мин, охлаждают и фильтруют через целит. Осадок промывают порциями EtOAc и CH2Cl2. Полученный раствор концентрируют, собирают в MeOH/CH2Cl2, загружают на колонку силикагеля и хроматографируют (30% EtOAc/CH2Cl2) с получением не совсем белого твердого вещества (73% выход). Пример промежуточного соединения 15. (2-экзо,5-экзо)-5-Аминобицикло[2,2,1]гептан-2-ацетат. экзо-5-Ацетоксибицикло[2,2,1]гептан-2-он и экзо-6-ацетоксибицикло[2,2,1]гептан-2-он получают из бицикло[2,2,1]гепта-2,5-диена по методике R. Gagnon (J. Chem. Soc. Perkin trans. 1, 1505, 1995) с незначительными изменениями. К раствору экзо-5-ацетоксибицикло[2,2,1]гептан-2-он (350 мг, 2,08 ммоль) в 10 мл ТГФ при комнатной температуре добавляют 1 М боран/ТГФ раствор (1,2 мл, 1,2 ммоль). Смесь перемешивают в течение 0,5 ч перед тем, как гасят при 0 С метанолом (3 мл) и 1 н. НСl (1,5 мл). Для экстрагирования используют этилацетат (330 мл), высушенный над сульфатом магния. Остаток после фильтрования и концентрирования хроматографируют на силикагеле с получением(2-эндо,5-экзо)-5-ацетоксибицикло[2,2,1]гептан-2-ола. К раствору (2-эндо,5-экзо)-5-ацетоксибицикло[2,2,1]гептан-2-ола (350 мг, 2,06 ммоль) в ТГФ (10 мл) добавляют фталимид (454 мг, 3,09 ммоль), трифенилфосфин (810 мг, 3,09 ммоль) и диэтилазодикарбоксилат (0,49 мл, 3,09 ммоль) при 0 С. Реакционную смесь оставляют перемешиваться в течение ночи и затем конденсируют на роторном испарителе и остаток очищают колоночной хроматографией (20% этилацетат/гексан) с получением целевого продукта в виде твердого желтого вещества. Смесь вышеуказанного твердого вещества (300 мг, 1 ммоль) и гидразина (0,126 мл, 2,2 ммоль) в 5 мл метанола нагревают с обратным холодильником в течение 6 ч. После удаления метанола для экстрагирования остатка используют дихлорметан (330 мл). Концентрация растворителя дает (экзо,экзо)-5 аминобицикло[2,2,1]гептан-2-ацетат (127 мг, 75%), который используют в реакции сочетания без дополнительной очистки. Подобным же образом получают (2-эндо,5-экзо)-5-аминобицикло[2,2,1]гептан-2-ацетат, (2-эндо,6 экзо)-6-аминобицикло[2,2,1]гептан-2-ацетат и (2-экзо,6-экзо)-6-аминобицикло [2,2,1]гептан-2-ацетат из соответствующего исходного материала. Пример промежуточного соединения 16. (2-транс)-4-Амино-2-метилциклогексанол. Смесь 3-метил-2-циклогексенона (4 г, 36,36 ммоль), толуолсульфоновой кислоты (100 мг) и этиленгликоля (7 мл) в 100 мл толуола нагревают с обратным холодильником в течение ночи и образовавшуюся воду удаляют с помощью ловушки Дина Старка. Остаток после концентрации хроматографируют на силикагеле (10% этилацетат/гексан) с получением 3,36 г (62%) 7-метил-1,4-диоксаспиро[4,5]дец-7-ен. К перемешиваемому раствору 7-метил-1,4-диоксаспиро [4,5]дец-7-ена (3,36 г, 22,47 ммоль) в тетрагидрофуране (ТГФ) (125 мл) добавляют 1 М раствор борана в ТГФ (22,47 мл, 22,47 ммоль) при комнатной температуре. Смесь перемешивают в течение 1 ч и реакцию гасят добавлением H2O (10 мл) при 0 С с последующим добавлением тетрагидрата пербората натрия (10,0 г, 66 ммоль). Смесь оставляют переме- 21007290 шиваться в течение ночи. Два слоя разделяют и водный слой несколько раз промывают этилацетатом(4150 мл). Целевой спирт получают в виде прозрачной жидкости после колоночной флэшхроматографии. Вышеуказанный спирт (1,8 г, 10,5 ммоль) растворяют в метаноле (50 мл) и 1 н. НСl (16 мл). Реакционную смесь оставляют перемешиваться на ночь. Кислый раствор нейтрализуют 1 н. раствором гидроксида натрия (18 мл) и затем следует обычная обработка водой. Неочищенную смесь очищают на флэшколонке (50% этилацетат) с получением транс-4-гидрокси-3-метилциклогексанона. К раствору транс-4-гидрокси-3-метилциклогексанона (780 мг, 6,1 ммоль) в воде (3 мл) добавляют гидрохлорид гидроксиламина (550 мг, 7,92 ммоль) с последующим медленным добавлением насыщенного раствора карбоната натрия (326 мг, 3,8 ммоль) в воде (1,02 мл). После перемешивания в течение 30 мин к реакционной смеси добавляют эфир и два слоя разделяют. Органический слой конденсируют и растворяют в этаноле (10 мл). К кипящему с обратным холодильником этанольному раствору добавляют натрий (1,8 г, 78,3 ммоль) в течение 1 ч и полученную смесь нагревают в течение еще 2,5 ч. После удаления этанола добавляют н-пропанол (10 мл), эфир (25 мл) и воду (3 мл). Органический слой сушат над сульфатом магния и фильтруют. Концентрация растворителей дает смесь (2-транс)-4-амино-2 метилциклогексанола в виде белого твердого вещества. Пример промежуточного соединения 17. Дигидрохлорид 2-метокси-4,5-диаминофенола. Соединение, названное в заголовке, получают гидрированием 2-метокси-4,5-динитрофенола по методике Ehrlich et al., J. Org. Chem., 1947, 12, 522. Пример промежуточного соединения 18. 7-Гидрокси-6-метоксихиноксалин-2-ол и 6-гидрокси-7 метоксихиноксалин-2-ол. Соединения, названные в заголовке, получают из дигидрохлорида 4-метокси-5-гидроксибензол-1,2 диамина взаимодействием с NaOH и этилглиоксалатом, используя методику примера промежуточного соединения 2. Пример промежуточного соединения 19. 7-Гидрокси-6-метокси-2-хлорхиноксалин и 6-гидрокси-7 метокси-2-хлорхиноксалин. Соединения, названные в заголовке, получают из 7-гидрокси-6-метоксихиноксалин-2-ола и 6 гидрокси-7-метоксихиноксалин-2-ола путем реакции с РОСl3, используя методику примера промежуточного соединения 3. Соединения формулы I, которые описаны здесь, ингибируют подавление пролиферации клеток и/или продукцию клеточного матрикса и/или движение клеток (хемотаксис) путем подавления тирозинкиназной активности ТФР-Р. Большое число болезненных состояний вызывается или неконтролируемой репродукцией клеток или сверхпродукцией матрикса, или плохо регулируемым запрограммированным отмиранием клеток (апоптоз). Эти болезненные состояния охватывают ряд типов клеток и включают такие заболевания, как лейкемия, рак, глиобластома, псориаз, воспалительные заболевания, заболевания костей, фиброзные заболевания, атеросклероз и происходящие после ангиопластики коронарных, бедренных артерий и артерий почек, или фибропролиферативные заболевания, такие как артрит, фиброз легких, почек и печени. В частности, ТФР и ТФР-Р, как сообщается, связаны со специфическими типами рака и опухолей, такими как рак головного мозга, рак яичников, рак толстого кишечника, рак простаты,рак легкого, саркома Капоши и злокачественная меланома. Кроме того, состояния разрегулированной клеточной пролиферации наступают после операций коронарного шунтирования. Подавление активности тирозинкиназы, как полагают, полезно для борьбы с нерегулируемой репродукцией клеток или сверхпродукцией матрикса или плохо регулируемой запрограммированной гибелью клеток (апоптоз). Благодаря эффективному подавлению активности Lck тирозинкиназы соединения формулы I полезны также при лечении сопротивляемости трансплантации и аутоиммунных заболеваний, таких как ревматоидный артрит, рассеянный склероз и системная красная волчанка, при отторжении трансплантата, при реакции трансплантат-против-хозяина, при заболеваниях с гиперпролиферацией, таких как опухоли и псориаз, и при заболеваниях, при которых клетки получают провоспалительные сигналы, таких как астма, воспалительное заболевание кишечника и панкреатит. При лечении сопротивляемости трансплантации соединение формулы I может использоваться или профилактически, или в ответ на антагонистичную реакцию человеческого организма на трансплантированный орган или ткань. При профилактическом использовании соединение формулы I вводят пациенту или в ткань, или в орган, которые будут трансплантированы, перед операцией трансплантации. Профилактическое лечение может также включать применение лекарственного лечения после операции трансплантации, но до того, как появятся признаки реакции антагонизма к трансплантату. При применении в ответ на реакцию антагонизма соединение формулы I вводят непосредственно пациенту, чтобы воздействовать на сопротивляемость трансплантации после того, как проявились видимые признаки невосприимчивости к трансплантации. Соединения формулы I могут быть представлены в форме, позволяющей введение многими подходящими путями. Композиции для доставки соединений формулы I могут быть созданы способом, который противодействует быстрому выведению из сосудистой (артериальной или венозной) стенки путем конвекции и/или диффузии, повышая тем самым время присутствия вирусных частиц в желаемом месте действия.- 22007290 Периадвентициальное депо, содержащее соединение по данному изобретению, может использоваться для длительного высвобождения. Одним из таких депо, пригодных для введения соединения по данному изобретению, может быть матрица из сополимера, такого как этиленвинилацетат, или гель из поливинилового спирта, окруженный оболочкой из силастика. Альтернативно, соединение по данному изобретению может доставляться местно из силиконового полимера, имплантированного в адвентиций. Для сведения, минимуму вымывания соединения формулы I во время чрескожной, сосудистой доставки способствует использование недиффундирующих, выделяющих лекарственное вещество микрочастиц. Микрочастицы могут быть составлены из ряда синтетических полимеров, таких как полилактид,например, или природными веществами, включая белки или полисахариды. Такие микрочастицы делают возможной стратегическую манипуляцию переменных, включая общую дозу лекарственного вещества и кинетику его высвобождения. Микрочастицы могут быть эффективно введены инъекцией в артериальную или венозную стенку через пористый шаровой катетер или шар на стенте и сохраняются в сосудистой стенке и периадвентициальной ткани в течение, по меньшей мере, примерно двух недель. Готовые формы и методологии для местной, внутримышечной сайт-специфической доставки терапевтических средств обсуждаются Reissen et al. (J. Am. Coll. Cardiol. 1994; 23: 1234-1244), полное содержание которых включено в данное описание в виде ссылки. Композиция для доставки соединения формулы I может также содержать гидрогель, который готовят из любого биосовместимого или нецитотоксичного (гомо или гетеро)полимера, такого как гидрофильный полимер полиакриловой кислоты, который может действовать как абсорбирующая лекарственное вещество губка. Подобные полимеры были описаны, например, в заявке WО 93/08845, полное содержание которой включено в данное описание в виде ссылки. Некоторые из них, такие как, в частности,полученные из этилен- и/или пропиленоксида являются коммерчески доступными. При использовании соединений формулы I для лечения патологий, которые связаны с гиперпролиферативными заболеваниями, соединения формулы I можно вводить разными путями. Для лечения рестеноза соединения формулы I вводят непосредственно в стенку кровеносного сосуда с помощью шара для ангиопластики, который покрыт гидрофильной пленкой (например, гидрогелем), которая насыщается данным соединением, или с помощью какого-либо другого катетера, содержащего инфузионную камеру для данного соединения, который, таким образом, может быть точно применен в месте, требующем лечения, и позволяет соединению освобождаться локально и эффективно в месте расположения клеток,требующих лечения. Этот способ введения преимущественно дает возможность соединению быстро проконтактировать с клетками, нуждающимися в лечении. Лечение предпочтительно заключается во введении соединения формулы I в место, где необходимо лечение. Например, гидрогель, содержащий композицию, может быть помещен непосредственно на поверхность ткани, которая нуждается в лечении, например, во время хирургического вмешательства. Преимущественно гидрогель вводят в желаемое место внутри сосуда с помощью покрытия катетера, например шарового катетера, и доставки в сосудистую стенку, предпочтительно, во время ангиопластики. При особенно предпочтительном способе насыщенный гидрогель вводится в место, которое требует лечения,с помощью шарового катетера. Шар может быть покрыт защитной оболочкой, когда катетер продвигается к целевому сосуду, чтобы свести к минимуму вымывание лекарственного вещества после введения катетера в кровяное русло. Другое воплощение данного изобретения представляет соединение формулы I, которое нужно вводить с помощью перфузионных шаров. Эти перфузионные шары, которые делают возможным сохранение кровотока и, таким образом, снижают риск ишемии миокарда после надувания шара, также дают возможность локальной доставки соединения формулы I при нормальном давлении в течение относительно продолжительного времени, в течение более чем 20 мин, что может быть необходимо для его оптимального действия. Альтернативно, может использоваться канальный шаровой катетер (канальный шаровой катетер для ангиопластики, Mansfield Medical, Boston Scientific Corp., Watertown, MA). Последний состоит из обычного шара, покрытого слоем из 24 перфорированных каналов, которые перфузируются через независимый просвет сквозь дополнительные инфузионные отверстия. Различные типы шаровых катетеров, таких как с двойным шаром, пористым шаром, микропористым шаром, шаром с каналом, шаром поверх стента и гидрогелевым катетером, все из которых могут использоваться при практическом осуществлении изобретения, раскрыты в Reissen et al. (1994), полное содержание которой включено сюда в виде ссылки. Применение перфузионного шарового катетера особенно благоприятно, так как те преимущества,что шар может оставаться надутым в течение более продолжительного периода времени при сохранении свойств облегченного скольжения и сайт-специфичность гидрогеля, достигаются одновременно. Фармацевтическая композиция для доставки активного соединения может содержать соединение формулы I и полоксамер, такой как полоксамер 407, который является нетоксичным биосовместимым полиолом, который является коммерчески доступным (BASF, Parsippany, NJ). Полоксамер, пропитанный соединением формулы I, может быть помещен непосредственно на поверхности ткани, которая нуждается в лечении, например, во время хирургического вмешательства. По- 23007290 локсамер обладает, по существу, теми же преимуществами, что и гидрогель, и в то же время обладает меньшей вязкостью. Применение шарового катетера с каналом с полоксамером, пропитанным соединением формулы I,особенно благоприятно. В этом случае те преимущества, что шар как может поддерживаться надутым в течение длительного периода времени при сохранении свойств облегченного скольжения, так и наличие сайт-специфичности полоксамера, достигаются одновременно. Процентное содержание активного ингредиента в фармацевтических композициях может меняться; необходимо, чтобы оно составляло бы такую часть, что получалась бы соответствующая доза. Безусловно, несколько дозированных форм могут применяться в одно и то же время. Применяемая доза может определяться врачом или квалифицированным медицинским персоналом и зависит от желаемого терапевтического эффекта, пути введения, продолжительности лечения и состояния пациента. В каждом конкретном случае дозы определяются в соответствии с факторами, определяемыми для пациента, которого нужно лечить, такими как возраст, вес, общее состояние здоровья и другие характеристики, которые могут влиять на эффективность соединения формулы I. Соединения формулы I также могут быть изготовлены для применения в сочетании с другими терапевтическими средствами, такими средствами или в сочетании с применением таких терапевтических методик, чтобы направить силы на фармакологические условия, которые можно улучшить посредством применения соединения формулы I, таких, которые представлены в следующем ниже. Соединения формулы I могут использоваться при лечении рестеноза после ангиопластики с применением любого устройства, такого как баллон, методы удаления или лечения лазером. Соединения данного изобретения могут использоваться при лечении рестеноза после помещения стента в сосудистую систему или в качестве 1) первичного лечения блокады сосудов, или 2) в случае, когда ангиопластика с использованием любого устройства не способна обеспечить открытую артерию. Соединения формулы I могут применяться или перорально, парентеральным введением, или соединение могло бы применяться местно посредством введения специального устройства или в виде соответственно изготовленного покрытия на стентовом устройстве. Полимерные материалы, подходящие для включения соединения данного изобретения включают полимеры, имеющие относительно низкие температуры переработки, такие как поликапролактон, поли(этилен-совинилацетат), или поливинилацетат, или силиконовый каучук и полимеры, имеющие подобные относительно низкие температуры переработки. Другие подходящие полимеры включают неразрушаемые полимеры, способные нести и доставлять терапевтические лекарственные средства, такие как латексы, уретаны, полисилоксаны, стиролэтилен/бутиленстирольные блоксополимеры (СЭБС) и биоразрушаемые, биоабсорбируемые полимеры, способные нести и доставлять терапевтические лекарственные средства, такие как поли-DL-молочная кислота (DL-ПМК) и поли-L-молочная кислота (L-ПМК), полиортоэфиры, полииминокарбонаты, алифатические поликарбонаты и полифосфазены. Порозиген может быть также включен в полимер, нагруженный лекарственным веществом, путем добавления порозигена к полимеру вместе с терапевтическим лекарственным средством с образованием пористой, нагруженной лекарственным веществом полимерной мембраны."Порозиген" означает любой компонент, такой как микрогранулы хлорида, натрия, лактозы или гепарина натрия, например, которые будут растворяться или же разрушаться при погружении в жидкости организма, оставляя после себя пористую сеть в полимерном материале. Поры, оставляемые такими порозигенами, могут обычно быть такого большого размера, как 10 мкм. Поры, образованные порозигенами, такие как в полиэтиленгликоле (ПЭГ), полиэтиленоксид/полипропиленоксидных (ПЭО/ППО) сополимерах, например, могут быть также и менее одного микрона, хотя другие подобные материалы, которые образуют фазовые разделы с непрерывной полимерной матрицей, нагруженной лекарственным веществом, и могут позднее вымываться жидкостями организма, также могут быть подходящими для образования пор менее одного микрона. Полимерный материал может наноситься на стент, причем терапевтическое лекарственное вещество и материал порозигена содержатся в полимерном материале, что дает возможность порозигену быть растворенным или разрушенным жидкостями организма, когда стент помещают в кровеносный сосуд, или альтернативно, порозиген может быть растворен и удален из полимерного материала с образованием пор в полимерном материале перед помещением полимерного материала, соединенного со стентом, в кровеносный сосуд. Если желательно, может также применяться регулирующая скорость высвобождения мембрана поверх нагруженного лекарственным веществом полимера, чтобы ограничить скорость высвобождения соединения данного изобретения. Регулирующая скорость высвобождения мембрана может быть также добавлена путем нанесения покрывающей формы, раствора или ламинирования. Регулирующая скорость высвобождения мембрана, наносимая на полимерный материал, может формироваться так, что она включает равномерную дисперсию порозигена в регулирующей скорость высвобождения мембране, и порозиген в регулирующей скорость высвобождения мембране может растворяться, оставляя поры в регулирующей скорость высвобождения мембране, обычно такие большие, как 10 мкм, или такие малые,как 1 мкм, например, хотя поры могут быть также менее 1 мкм. Порозигеном в регулирующей скорость- 24007290 освобождения мембране может быть, например, хлорид натрия, лактоза, гепариннатрий, полиэтиленгликоль, полиэтиленоксид/полипропиленоксидные сополимеры и их смеси. В другом аспекте покрытие на стентовом устройстве может быть образовано нанесением соединения формулы I по меньшей мере на одну поверхность стентового устройства с образованием биоактивного слоя, а затем нанесением одного слоя или более из пористого полимерного материала на биоактивный слой, так что пористый полимерный материал имеет толщину, достаточную для обеспечения регулируемого высвобождения соединения. В одном из аспектов пористый полимерный материал состоит из полиамида, парилена или производного парилена, наносимых безкатализаторным осаждением из паровой фазы. "Париленом" называется полимер на основе п-ксилена и изготовленный полимеризацией в газовой фазе, как описано в патенте США 5824049, включенном сюда в виде ссылки. Альтернативно пористый полимерный материал наносится плазменным напылением. Примеры полимеров, пригодных для плазменного напыления, включают полиэтиленоксид, полиэтиленгликоль, полипропиленоксид и полимеры из метана, силикона, тетрафторэтилентетраметилдисилоксана и тому подобного. Другие системы подходящих полимеров включают полимеры, производимые из фотополимеризуемых мономеров, таких как жидкие мономеры, предпочтительно имеющие по меньшей мере две перекрестно связываемые С-С (углерод-углерод) двойные связи и являющиеся негазообразным полимеризуемым наращиванием этиленовоненасыщенным соединением, имеющим температуру кипения выше 100 С при атмосферном давлении, молекулярный вес, равный примерно 100-1500, и способным к легкому образованию высокомолекулярных полимеров путем присоединения. Более предпочтительно, когда мономер предпочтительно является фотополимеризуемым присоединением полиэтиленовоненасыщенным сложным эфиром акриловой или метакриловой кислот, содержащим две акриловые или метакриловые группы или более на молекулу, или их смесями. Типичными примерами таких полифункциональных акрилатов являются этиленгликольдиакрилат, этиленгликольдиметакрилат, триметилпропантриакрилат, триметилпропантриметакрилат,пентаэритритолтетраакрилат или пентаэритритолтетраметакрилат,1,6 гександиолдиметакрилат и диэтиленгликольдиметакрилат. Также в некоторых особых случаях пригодны моноакрилаты, такие как н-бутилакрилат, нбутилметакрилат, 2-этилгексилакрилат, лаурилакрилат и 2-гидроксипропилакрилат. Также пригодны небольшие количества амидов метакриловой кислоты, таких как бутиловый эфир Nметилолметакриламида, N-виниловые соединения, такие как N-винилпирролидон, сложные виниловые эфиры алифатических монокарбоновых кислот, такие как винилолеат, простые виниловые эфиры диолов,такие как бутандиол-1,4-дивиниловый простой эфир, и аллиловый простой эфир, и аллиловый сложный эфир. Включаются также и другие мономеры, такие как продукты реакции ди- или полиэпоксидов, таких как бутандиол-1,4-диглицидиловый эфир или бис-фенол-А-диглицидиловый простой эфир с метакриловой кислотой. Характеристики фотополимеризуемой жидкой диспергирующей среды могут быть модифицированы с конкретной целью путем соответствующего выбора мономеров и их смесей. Другие пригодные полимерные системы включают полимер, который биосовместим и дает минимальное раздражение сосудистой стенки, когда имплантируется стент. Полимер может быть или биостабильным или биоабсорбируемым полимером в зависимости от желаемой скорости освобождения или желаемой степени стабильности полимера. Биоабсорбируемые полимеры, которые могли бы использоваться, включают поли(L-молочную кислоту), поликапролактон, поли(лактидсогликолид), поли(гидроксибутират), поли(гидроксибутиратсовалерат), полидиоксанон, полиортоэфир, полиангидрид,полигликолевую кислоту, поли(D,L-молочную кислоту), поли(гликолевая кислота-сотриметиленкарбонат), полифосфоэфир, полифосфоэфируретан, полиаминокислоты, цианоакрилаты, политриметиленкарбонат, полиминокарбонат, сополи(простой эфир-сложные эфиры) (например, ПЭО/ПЛК), полиалкиленоксалаты, полифосфазены и биомолекулы, такие как фибрин, фибриноген, целлюлоза, крахмал,коллаген и гиалуроновая кислота. К тому же могли бы использоваться биостабильные полимеры с относительно низкой хронической реакцией ткани, такие как полиуретаны, силиконы, полиэфиры, и также могли бы использоваться другие полимеры, если они могут быть растворены и вулканизированы или полимеризованы на стенте, такие как полиолефины, полиизобутилен и этилен-альфаолефиновые сополимеры, акриловые полимеры и сополимеры, винилгалогенидные полимеры и сополимеры, такие как поливинилхлорид, поливиниловые простые эфиры, такие как поливинилметиловый эфир, поливинилиден-галогениды, такие как поливинилиденфторид и поливинилиденхлорид; полиакрилонитрил, поливинилкетоны, поливинилароматические соединения, такие как полистирол, поливиниловые сложные эфиры, такие как поливинилацетат, сополимеры виниловых мономеров друг с другом и олефинами, такие как этиленметилметакрилатные сополимеры, акрилонитрилстирольные сополимеры, смолы АБС (ABS) и этиленвинилацетатные сополимеры; полиамиды, такие как найлон 66 и поликапролактам; алкильные смолы, поликарбонаты; полиоксиметилены; полимиды, полиэфиры; эпоксисмолы, полиуретаны; целлюлозный шелк; триацетатный шелк; целлюлоза, ацетатцеллюлоза, бутиратцеллюлоза, бутиратацетатцеллюлоза, целлофан, нитратцеллюлоза; пропионатцеллюлоза; простые эфиры целлюлозы и карбоксиметилцеллюлоза.- 25007290 В дополнение к плазменному напылению и напылению из газообразной фазы, для нанесения различных покрытий на поверхности стента могут применяться другие методики. Например, полимерный раствор может быть нанесен на стент, и растворителю дают испариться, в результате чего на поверхности стента остается покрытие из полимера и терапевтического вещества. Обычно раствор может наноситься на стент или напылением раствора на стент, или погружением стента в раствор. Соединения формулы I могут использоваться при лечении рестеноза в сочетании с антикоагулянтом, антитромбоцитным, антитромбозным или профибринолитическим средством. Часто параллельно лечат перед, во время и после процедуры вмешательства или для предотвращения пагубных эффектов тромбообразования. Некоторые примеры классов средств, известных как антикоагулянты, антитромбоцитные, антитромбозные и профибринолитические средства, включают любые препараты гепарина, гепарины с низким молекулярным весом, пентасахариды, антагонисты фибриногеновых рецепторов, ингибиторы тромбина, ингибиторы фактора Ха или ингибиторы фактора VIIa. Соединения формулы I могут использоваться в сочетании с любым антигипертензивным средством или средством, регулирующим уровень холестерина и липидов, при лечении рестеноза или атеросклероза одновременно с лечением высокого давления крови или атеросклероза. Некоторые примеры средств,которые пригодны для лечения давления крови, включают соединения следующих групп: бетаблокаторы, ингибиторы АПФ, блокаторы кальциевых каналов и антагонисты альфа-адренорецепторов. Некоторые примеры средств, которые пригодны для лечения повышенных уровней холестерина или нарушенной регуляции уровней липидов, включают соединения, известные как ингибиторы ГМГ-КоА, соединения фибратной группы. Соединения формулы I могут использоваться при лечении различных форм рака или отдельно, или в сочетании с соединениями, известными как пригодные для лечения рака. Понятно, что данное изобретение включает сочетания соединений формулы I с одним из вышеупомянутых средств групп терапевтических препаратов или более. Соединения формулы I, используемые в полимерном покрытии стентового устройства данного изобретения, проявляют явную фармакологическую активность в испытаниях, описанных в литературе, результаты которых, как полагают, коррелируют с фармакологической активностью у людей и других млекопитающих. Следующие далее результаты испытаний in vitro и in vivo являются типичными для характеристики соединений формулы I. Раздел изготовления фармацевтических композиций и фармакологических испытаний Соединения формулы I проявляют значительную активность как ингибиторы протеина тирозинкиназы и имеют терапевтическое значение как средства против клеточной пролиферации для лечения некоторых патологических состояний, включая поражения при псориазе, атеросклерозе и рестенозе. Соединения формулы I оказывает модуляцию и/или подавление сигналов клеток и/или пролиферации клеток,и/или продукции матрикса, и/или хемотаксиса, и/или воспалительной реакции клеток и могут использоваться для профилактики или задержки проявления или повторного появления таких патологических состояний, или же лечения указанных патологических состояний. Чтобы определить эффективность соединений формулы I, используют фармакологические испытания, описанные ниже, которые приняты в данной области и, как установлено, коррелируют с фармакологической активностью у млекопитающих. Соединения формулы I подвергались этим различным испытаниям, и полученные результаты, как полагают, коррелируют с полезной активностью медиаторов клеточной дифференциации. Результаты этих испытаний, как полагают, дают достаточную информацию специалистам в области фармакологической и медицинской химии для определения параметров для использования изучаемых соединений при одном или более из видов терапии, здесь указанных. 1. Твердофазный иммуноферментный анализ (ELISA) аутофосфорилирования тирозинкиназы ТФР-Р. Указанное в заголовке исследование выполняется, как описано в Dolle, et al. (J. Med. Chem., 1994,37, 2627), которая включена сюда в виде ссылки, с исключением использования лизатов клеток, полученных из клеток гладких мышц человеческой аорты (КГМЧА=HAMSC), как описано ниже. 2. Общая методика изучения митогенеза. а. Клеточная культура. Клетки гладких мышц человеческой аорты (пассажи 4-9) засевают на 96-луночные планшеты в поддерживающую рост среду при плотности 6000 клеток на лунку и дают расти 2-3 дня. При примерно 85% слиянии рост клеток останавливают с помощью бессывороточной среды (БСС=SFM).b. Исследование митогенеза. Через 24 ч после удаления сыворотки среду удаляют и заменяют испытуемым соединением/носителем в БСС (200 мкл/мл). Соединения солюбилизируют в клеточной культуре ДМСО при концентрации 10 мМ и делают дополнительные разведения в БСС. Через 30 мин предварительной инкубации с соединением клетки стимулируют ТФР при 10 нг/мл. Определение производят в двух повторностях ячеек со стимулированными и нестимулированными клетками для каждой концентрации соединения. Через 4 ч добавляют 1 мкКи 3H-тимидина/лунка.- 26007290 Культуры терминируют через 24 ч после добавления фактора роста. Клетки снимают трипсином и собирают на пластину фильтра, применяя автоматизированный коллектор клеток (Wallac MachII96). С пластинки фильтра производят подсчет на сцинтилляционном счетчике (Wallac Betaplate) для определения включенной в ДНК метки. 3. Испытание на хемотаксис. Клетки гладких мышц человеческой аорты (КГМЧА) из более ранних пассажей получены из АТСС. Клетки выращивают в Clonetics SmGM 2 SingleQuots (используются среда и клетки с пассажей 4-10). Когда клетки сливаются до 80%, в среду добавляют флуоресцентную пробу, кальцеин AM (5 мМ,Molecular Probe) и клетки инкубируют в течение 30 мин. После промывания буферным раствором соли с ГЭПЭС клетки снимают с помощью трипсина и нейтрализуют с помощью буфера MCDB 131 (Gibco) с 0,1% БСА, 10 мМ глютамина и 10% плодной бычьей сыворотки. После центрифугирования клетки промывают еще 1 раз и снова суспендируют в том же буфере без плодной бычьей сыворотки до плотности 30000 клеток/50 мл. Клетки инкубируют с разными концентрациями соединения формулы I (конечная концентрация ДМСО =1%) в течение 30 мин при 37 С. Для испытаний хемотаксиса используют 96 ячеечные модифицированные камеры Boyden (Neuroprobe, Inc.) и поликарбонатную мембрану с размерами пор 8 мм (Poretics, CA). Мембрану покрывают коллагеном (Sigma С 3657, 0,1 мг/мл). ТФР(PDGF-) (3 нг/мл) в буфере с соединением формулы I или без него помещают в низшую камеру. Клетки (30000) с ингибитором или без ингибитора помещают в верхнюю камеру. Клетки инкубируют в течение 4 ч. Фильтровальную мембрану удаляют и клетки с верхней стороны мембраны удаляют. После высушивания измеряют флуоресценцию на мембране, используя Cytofluor II (Millipore) при длинах волн возбуждения излучения 485/530 нм. В каждом эксперименте среднюю клеточную миграцию получают из шести повторов. Процент подавления определяют по значениям контроля с обработкой ДМСО. По пяти точкам зависящего от концентрации подавления рассчитывают значение IC50. Результаты представлены как среднее СКО по пяти таким экспериментам. 4. Очистка ЭФР-рецепторов. Очистка ЭФР-рецепторов основана на методике Yarden and Schlessinger. Клетки А 431 выращивают в 80 см 2 бутылях до сливного роста (2107 клеток на бутыль). Клетки промывают дважды ФБФР (PBS) и собирают ФБФР, содержащим 11,0 ммоль ЭДТУ (1 ч при 37 С и центрифугируют при 600 g в течение 10 мин). Клетки солюбилизируют в 1 мл на 2107 клеток холодного буфера для солюбилизации (50 ммоль буфер ГЭПЭС, рН 7,6, 1% тритон X-100, 150 ммоль NaCl, 5 ммоль ЭГТУ, 1 ммоль ФМСФ, 50 мг/мл апротинина, 25 ммоль бенамидина, 5 мг/мл лейпептина и 10 мг/мл ингибитора трипсина соевых бобов) в течение 20 мин при 4 С. После центрифугирования при 100000 g в течение 30 мин супернатант загружают на колонку агарозы WGA (100 мл упакованной смолы на 2107 клеток) и встряхивают в течение 2 ч при 4 С. Неабсорбированный материал удаляют и смолу дважды промывают буфером ГТН (HTN) (50 ммоль ГЭПЭС, рН 7,6, 0,1% тритон Х-100, 150 ммоль NaCl), дважды буфером ГТН, содержащим 1 МNaCl и дважды буфером ГТНГ (HTNG) (50 ммоль ГЭПЭС, рН 7,6, 0,1% тритон Х-100, 150 ммоль NaCl и 10% глицерина). Рецепторы ЭФР элюируют партиями буфером ГТНГ, содержащим 0,5 М N-ацетил-Dглюкозамин (200 мл на 2107 клеток). Элюированный материал хранят в аликвотных образцах при -70 С и разбавляют перед использованием буфером ТМТНГ (TMTNG) (50 ммоль трис-мес буфера, рН 7,6, 0,1% тритон Х-100, 150 ммоль NaCl, 10% глицерина). 5. Подавление аутофосфорилирования ЭФР-Р. Клетки А 431 выращивают до сливного роста на покрытых фибронектином чашках для культур тканей. После промывания 2 раза ледяным ФБФР клетки лизируют добавлением 500 мл/чашку буфера для лизиса (50 ммоль ГЭПЭС, рН 7,5, 150 ммоль NaCl, 1,5 ммоль MgCl2, 1 ммоль ЭГТУ, 10% глицерин, 1% тритон Х-100, 1 ммоль ФМСФ, 1 мг/мл апротинина, 1 мг/мл лейпептина) и инкубации в течение 5 мин при 4 С. После стимуляции ЭФР (500 мг/мл, 10 мин при 37 С) выполняется иммунопреципитация с анти-ЭФР-Р (Аb 108) и образец реакции аутофосфорилирования (50 мл аликвотные пробы, 3 мКи [g32P]AТФ) проводится в присутствии от 2 до 10 мМ соединения формулы I в течение 2 мин при 4 С. Реакцию останавливают добавлением горячего буфера для образца для электрофореза. За анализом ЭПАГДСН (SDA-PAGE) (7,5% els) следует ауторадиография, и реакцию оценивают количественно с помощью денситометрического сканирования рентгеновских пленок. а. Культура клеток. Клетки, названные HER 14 и К 721 А, получают трансфицированием клеток NIH3T3 (клон 2.2) (от С.Fryling, NCl, NIH), у которых отсутствуют эндогенные рецепторы рецепторов ЭФР, с конструкциями кДНК рецепторов ЭФР дикого типа или мутантных рецепторов ЭФР, у которых отсутствует тирозинкиназная активность (у которых Lys 721 в сайте связывания АТФ заменен на Аlа остаток соответственно). Все клетки выращивают на МДСИ (DMEM) с 10% телячьей сыворотки (Hyclon, Logan, Utah). 6. Селективность в сравнении с РКА и РКС определяют, используя продаваемые наборы: а. Прокалываемый колориметрический набор для определения РКА, формата Spinzyme (Pierce colorimetric PKA Assay Kit, Spinzyme Format).- 27007290 Краткое изложение методики. РКА фермент (сердца быка) 1 Е/пробирку для определения Пептидный субстрат кемптид (меченный красителем) 45 мин при 30 С Поглощение при 570 нмb. Прокалываемый колориметрический набор для определения РКС, формата Spinzyme (Pierce colorimetric PKA Assay Kit, Spinzyme Format). Краткое изложение методики. Фермент РКС (головной мозг крысы) 0,025 Е/пробирку для определения Пептидный субстрат нейрогранин (меченный красителем) 30 мин при 30 С Поглощение при 570 нм. 7. Определение подавления активности тирозинкиназы p56lck. Подавление активности тирозинкиназы p56lck определяют по методике, описанной в патенте США 5714493, включенного сюда в виде ссылки. В качестве альтернативы подавление активности тирозинкиназы определяют следующим методом. Субстрат (содержащий тирозин субстрат, Biot-(Ala)3-Lys-Val-Glu-Lys-Ile-Gly-Glu-Gly-Thr-Tyr-Glu-ValVal-Tyr-Lys-(NH2), распознаваемый по p56lck, 1 мкМ) сначала фосфорилируют в присутствии или в отсутствии данной концентрации испытуемого соединения данным количеством фермента (фермент получают экспрессией гена p56lck в конструкции из дрожжей), выделенного и очищенного из клонированных дрожжей (очистка фермента осуществляется классическими методами) в присутствии АТФ (10 мкМ),MgCl2 (2,5 мМ), MnCl2 (2,5 мМ), NaСl (25 мМ), ДТТ (0,4 мМ) в ГЭПЭС 50 мМ, рН 7,5 в течение 10 мин при комнатной температуре. Общий объем реакции составляет 50 мкл, и реакцию выполняют в черном 96-луночном флюоропланшете. Реакцию останавливают добавлением 150 мкл останавливающего буфера(100 мМ ГЭПЭС рН 7,5, КФ 400 мМ, ЭДТУ 133 мМ, БСА 1 г/л), содержащего выбранные антитирозиновые антитела, меченные криптатом европия (PY20-K) при 0,8 мкг/мл и меченный нином стрептавидин(XL665) при 4 мкг/мл. Мечение стрептавидина и антитирозиновых антител выполняли в Cis-BioInternational (France). Излучение смеси считают, используя счетчик Packard Discovery, который способен обеспечить определение разрушаемой со временем гомогенной передачи флуоресценции (возбуждение при 337 нм, регистрация при 620 нм и 665 нм). Отношение сигнала при 665 нм/сигналу при 620 нм является мерой концентрации фосфорилированного тирозина. Пустой образец получают заменой фермента буфером. Специфический сигнал представляет собой разницу между отношением, полученным без ингибитора, и отношением к пустому образцу. Процент специфического сигнала высчитывают. IC50 рассчитывают по 10 концентрациям ингибитора в двух повторностях, используя программу Xlfit. Соединением для сравнения является стауроспорин (Sigma) и оно дает IC50, равную 306 нМ (n=20). 8. Определение подавления опухоли in vitro. Подавление роста опухоли in vitro соединениями формулы I определяют следующим образом. Линию клеток глиомы крыс С 6 (полученную из АТСС) выращивают в виде монослоев в модифицированной Дульбекко среде Игла, содержащей 2 мМ L-глютамина, 200 Ед/мл пенициллина, 200 мкг/мл стрептомицина и дополненной 10% (об.) прогретой инактивированной плодной телячьей сыворотки. Клетки в экспоненциальной фазе роста обрабатывают трипсином, промывают ФБФР (PBS) и разбавляют до конечной концентрации 6500 клеток/мл в полной среде. Лекарственное вещество, которое нужно испытать, или контрольный растворитель добавляют к суспензии клеток (2,5 мл) в объеме до 50 мкл и добавляют 0,4 мл 2,4% агара Noble Difco, выдерживаемого при 45 С, и перемешивают. Смесь сразу же выливают в чашки Петри и оставляют стоять в течение 5 мин при 4 С. Число клеточных клонов (60 клеток) подсчитывают через 12 дней инкубации при 37 С в атмосфере 5% СO2. Каждое лекарственное вещество испытывают при концентрации 10, 1, 0,1 и 0,01 мкг/мл (конечная концентрация в агаре) в двух повторностях. Результаты выражают в процентах подавления клоногенности по отношению к контролям без воздействия лекарства. IC50 определяют графически по графикам в полулогарифмическом масштабе среднего значения, определяемого для каждой концентрации лекарственного вещества. 9. Определение подавления опухоли in vivo. Подавление роста опухоли in vivo соединениями данного изобретения определяют, используя модель подкожного ксенотрансплантата, как описано в патентах США 5700823 и 5760066, при которой мышам имплантируют клетки глиомы С 6 и рост опухоли измеряют, используя циркулей венье. Результаты, полученные с помощью вышеприведенных экспериментальных методов, свидетельствуют, что соединения, входящие в объем данного изобретения, обладают полезными свойствами подавления протеина тирозинкиназы рецепторов ТФР или свойствами подавления тирозинкиназы P56lck и, таким образом, имеют терапевтическое значение. Приведенные выше результаты фармакологического испытания могут использоваться для определения дозировки и способа введения для конкретного подбора терапии. Данное изобретение может быть воплощено в других конкретных формах без выхода из его существа или существенных признаков.- 28007290 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Стентовое устройство, имеющее полимерное покрытие, отличающее тем, что полимерное покрытие содержит соединение формулы IZ1 представляет СН или N;Z2 представляет гидрокси(C3-С 10)циклоалкил, необязательно замещенный 1-3 заместителями, выбранными из группы, включающей C1-С 10 алкил, гидрокси, ацилокси, C1-С 10 алкокси, галоген, R5R6N,ацилR5N, карбокси и R5R6NCO; гидрокси(C3-С 10)циклоалкенил, необязательно замещенный 1-3 заместителями, выбранными из группы, включающей C1-С 10 алкил, гидрокси, ацилокси, C1-С 10 алкокси, галоген,R5R6N, ацилR5N, карбокси и R5R6NCO; гидроксигетероциклил, где гетероциклил представляет 4-10 членную, моноциклическую или полициклическую систему, в которой один или более атомов кольца являются отличными от углерода и выбраны из азота, кислорода или серы, необязательно замещенный 13 заместителями, выбранными из группы, включающей C1-С 10 алкил, гидрокси, ацилокси, C1-С 10 алкокси,галоген, R5R6N, ацилR5N, карбокси и R5R6NCO; или гидроксигетероцикленил, где гетероцикленил представляет собой гетероциклил, определенный выше, содержащий по меньшей мере одну двойную связь углерод-углерод или углерод-азот, необязательно замещенный 1-3 заместителями, выбранными из группы, включающей C1-С 10 алкил, гидрокси, ацилокси, C1-С 10 алкокси, галоген, R5R6N, ацилR5N, карбокси иR1a и R1b представляют независимо C1-С 10 алкил с прямой или разветвленной цепью, необязательно замещенный C1-С 10 алкоксигруппой, галогеном, карбокси, гидрокси или R5R6N-группой; C6-С 10 арил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей водород, гидрокси, галоген, C1-С 10 алкил, C1-С 10 алкокси, карбокси, C1-С 10 алкоксикарбонил и Y1Y2NCO, где Y1 и Y2 независимо представляют водород или C1-С 10 алкил; гетероарил, представляющий 5-10-членную ароматическую моноциклическую или полициклическую углеводородную систему колец, в которой один или более атомов кольца являются отличными от углерода и выбраны из азота, кислорода или серы,необязательно замещенную одним или более заместителями, выбранными из группы, включающей водород, гидрокси, галоген, C1-С 10 алкил, C1-С 10 алкокси, карбокси, C1-С 10 алкоксикарбонил и Y1Y2NCO, где Y1 и Y2 независимо представляют водород или C1-С 10 алкил; гидрокси; ацилокси; C1-С 10 алкокси, необязательно замещенный одним или более заместителями, выбранными из группы, включающей амино, C1 С 10 алкокси, карбокси, C1-С 10 алкоксикарбонил, карбокси(C6-С 10)арил, карбамоил или гетероциклил, где гетероциклил имеет вышеуказанное значение; циклоалкил-O-, где циклоалкил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; гетероциклил-O-,где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; гетероциклил-С(О)О-, где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; C6-С 10 арилокси, необязательно замещенный группами, как указано выше для арила; гетероарил-O-, где гетероарил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для арила; циано; R5R6N или ацилR5N, или один из R1a и R1b представляет водород или галоген, а другой представляет C1-С 10 алкил, необязательно замещенный, как указано для него выше; C6-С 10 арил, необязательно замещенный, как указано для него выше; гетероарил, как он определен выше, необязательно замещенный, как указано выше для арила; гидрокси; ацилокси; C1-С 10 алкокси, необязательно замещенный, как указано для него выше; циклоалкил-O-, где циклоалкил имеет вышеуказанные значения, необязательно замещенный, как указано для него выше; гетероциклил-O-, где гетероциклил определен выше, необязательно замещенный, как указано выше для циклоалкила; гетероциклил-С(О)О-, где гетероциклил имеет вышеуказанные значения,необязательно замещенный группами, как указано выше для циклоалкила; C6-С 10 арилокси, необязательно замещенный группами, как указано выше для арила; гетероарил-O-, где гетероарил имеет вышеука- 29007290 занные значения, необязательно замещенный группами, как указано выше для арила; циано, R5R6N или ацил-R5N;R1c представляет водород, C1-С 10 алкил с прямой или разветвленной цепью, необязательно замещенный, как указано для него выше; C6-С 10 арил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей водород, гидрокси, галоген, C1-С 10 алкил, C1-С 10 алкокси, карбокси, C1-С 10 алкоксикарбонил и Y1Y2CO, где Y1 и Y2 независимо представляют водород или C1-С 10 алкил; гетероарил, представляющий 5-10-членную ароматическую моноциклическую или полициклическую углеводородную систему колец, в которой один или более атомов кольца являются отличными от углерода и выбраны из азота, кислорода или серы, необязательно замещенную одним или более заместителями, выбранными из группы, включающей водород, гидрокси, галоген, C1-С 10 алкил, C1-С 10 алкокси, карбокси, C1-С 10 алкоксикарбонил и Y1Y2NCO, где Y1 и Y2 независимо представляют водород или C1 С 10 алкил; гидрокси; ацилокси; C1-С 10 алкокси, необязательно замещенный одним или более заместителями, выбранными из группы, включающей амино, C1-С 10 алкокси, карбокси, C1-С 10 алкоксикарбонил, карбокси(C6-С 10)арил, карбамоил или гетероциклил, где гетероциклил имеет вышеуказанное значение; циклоалкил-O-, где циклоалкил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; гетероциклил-O-, где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; гетероциклил-С(О)О-, где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; C6-С 10 арилокси, необязательно замещенный группами, как указано выше для арила; гетероарил-O-, где гетероарил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для арила; галоген; циано; R5R6N или ацил-R5N;R3 а, R3b, R3'а и R3'b независимо представляют водород или C1-С 10 алкил с прямой или разветвленной цепью;R4 представляет водород, C1-С 10 алкил с прямой или разветвленной цепью, Н-СО- или C1-С 10 алкилСО-; иR5 и R6 независимо представляют водород или C1-С 10 алкил с прямой или разветвленной цепью, илиR5 и R6, взятые вместе с атомом азота, с которым связаны R5 и R6, образуют азагетероциклил, где гетероциклил определен выше, или его N-оксид, его гидрат, его сольват, его пролекарство или его фармацевтически приемлемую соль. 2. Стентовое устройство по п.1, полимерное покрытие которого содержит соединение формулы I,где Х представляет L2Z2;R1a и R1b независимо представляют C1-С 10 алкил с прямой или разветвленной цепью, необязательно замещенный C1-С 10 алкоксигруппой, галогеном, карбокси, гидрокси или R5R6N-группой; C1-С 10 алкокси,необязательно замещенный одним или более заместителями, выбранными из группы, включающей амино, C1-С 10 алкокси, карбокси, C1-С 10 алкоксикарбонил, карбокси(C6-С 10)арил, карбамоил или гетероциклил, где гетероциклил имеет вышеуказанное значение; циклоалкил-O-, где циклоалкил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила, или гетероциклил-O-, где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; или один из R1a и R1b представляет водород или галоген, а другой из R1a и R1b представляет C1-С 10 алкил с прямой или разветвленной цепью, необязательно замещенный C1 С 10 алкоксигруппой, галогеном, карбокси, гидрокси или R5R6N-группой; C1-С 10 алкокси, необязательно замещенный одним или более заместителями, выбранными из группы, включающей амино, C1 С 10 алкокси, карбокси, C1-С 10 алкоксикарбонил, карбокси(C6-С 10)арил, карбамоил или гетероциклил, где гетероциклил имеет вышеуказанное значение, или циклоалкил-O-, где циклоалкил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила; гетероциклил-O-,где гетероциклил имеет вышеуказанные значения, необязательно замещенный группами, как указано выше для циклоалкила;R4 представляет водород, или его N-оксид, его гидрат, его сольват, его пролекарство или его фармацевтически приемлемую соль. 3. Стентовое устройство по п.1, полимерное покрытие которого содержит соединение формулы I,где Z1 представляет СН. 4. Стентовое устройство по п.1, полимерное покрытие которого содержит соединение формулы I,где Z1 представляет N.
МПК / Метки
МПК: C07D 405/12, A61K 31/50, C07D 241/44, C07D 215/20, A61P 9/00, C07D 241/42, C07D 215/38
Метки: применение, соединений, хинолиновые, содержащим, ингибирования, соединения, изготовлении, полимерным, рестеноза, стента, устройство, стентовое, хиноксалиновые, этих, покрытием
Код ссылки
<a href="https://eas.patents.su/30-7290-stentovoe-ustrojjstvo-s-polimernym-pokrytiem-soderzhashhim-hinolinovye-i-hinoksalinovye-soedineniya-i-primenenie-etih-soedinenijj-pri-izgotovlenii-stenta-dlya-ingibirovaniya-resten.html" rel="bookmark" title="База патентов Евразийского Союза">Стентовое устройство с полимерным покрытием, содержащим хинолиновые и хиноксалиновые соединения, и применение этих соединений при изготовлении стента для ингибирования рестеноза</a>
Предыдущий патент: Фосфонаты и их производные в качестве веществ, усиливающих действие инсектицидов
Следующий патент: Гибкий контейнер для жидкости
Случайный патент: Конструкция оплетённого каната