Способ получения аминопроизводных алкилоксифуранона, получаемые этим способом соединения и применение этих соединений
Номер патента: 2883
Опубликовано: 31.10.2002
Авторы: Лагуарда Жак, Колладан Колетт, Брион Франсис, Буше Рафаель
Формула / Реферат
1. Соединения формулы (IVa), (IVb), (IVc) или (IVd)
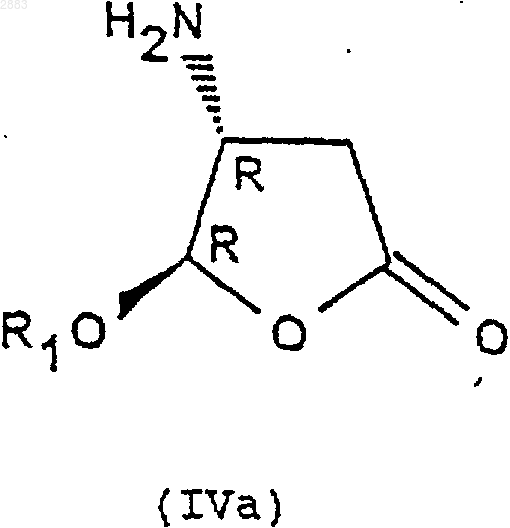
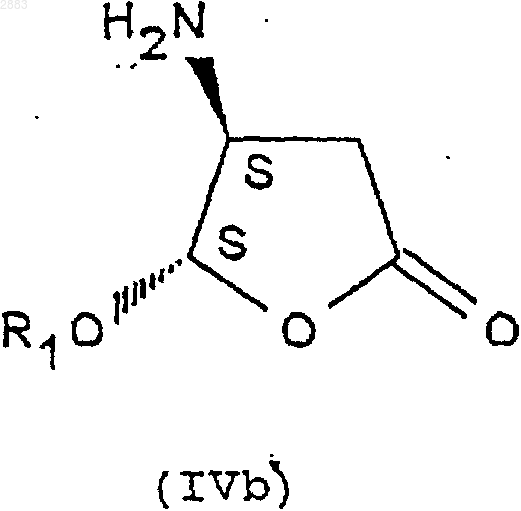
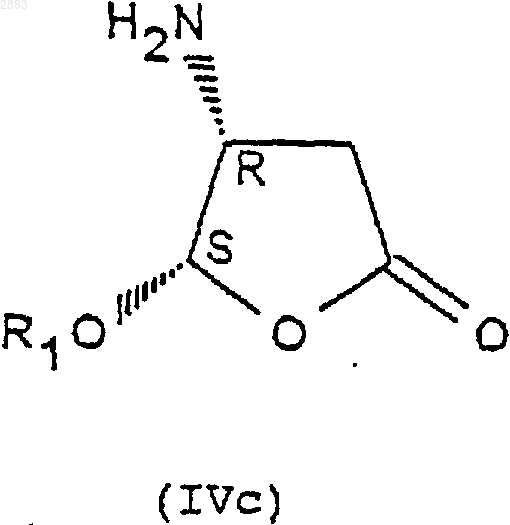
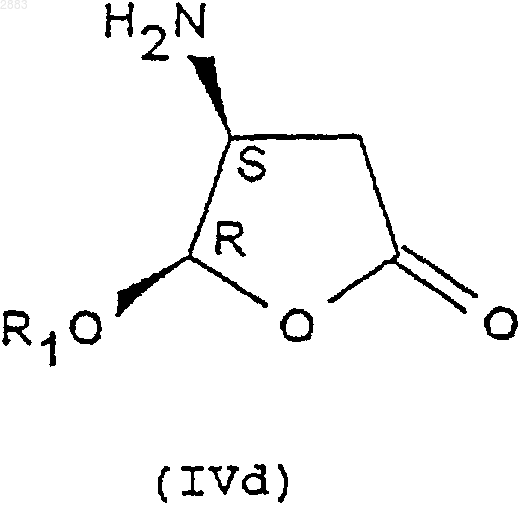
в которых R1 представляет собой алкильную группу, содержащую от 1 до 4 атомов углерода, или фенилалкильную группу, содержащую от 7 до 11 атомов углерода, а также их соли присоединения с кислотами.
2. Соединение формулы (IVd) по п.1, а также его соли присоединения с кислотами.
3. Соединение формулы (IVd) по п.2, в котором R1 представляет собой этил, а также его соли присоединения с кислотами.
4. Способ получения соединений формулы (IVa), (IVb), (IVc) или (IVd) по п.1, отличающийся чем, что он включает, по меньшей мере, одну из следующих стадий:
а) действие ариламина формулы R3R4CHNH2, в которой R3 представляет собой атом водорода или алкильную группу, содержащую от 1 до 4 атомов углерода, a R4 представляет собой арил, при необходимости замещенный на рацемический алкилоксифуранон формулы (II)
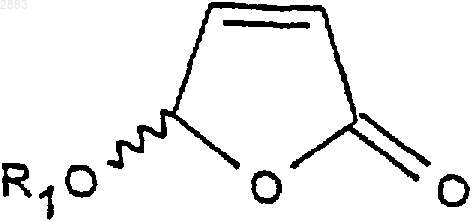
в которой R1 представляет собой алкильную группу, содержащую от 1 до 4 атомов углерода, или фенилалкильную группу, содержащую от 7 до 11 атомов углерода,
и получение транс-изомерных соединений (4R, 5R) и (4S, 5S) соответственно формул (IIIa) и (IIIb)
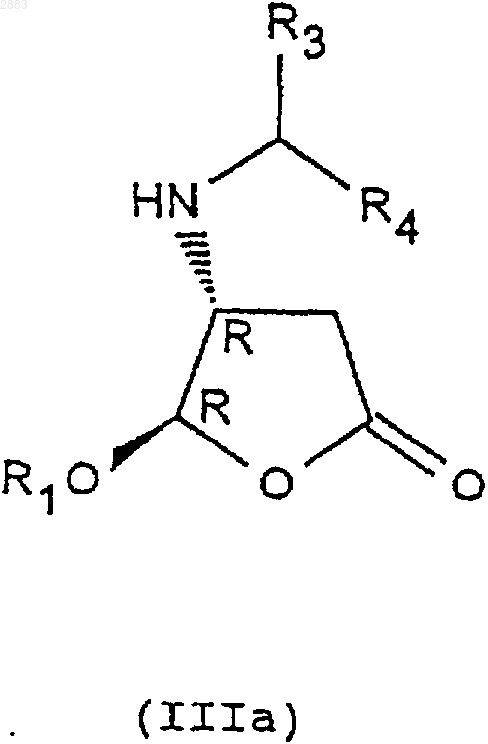
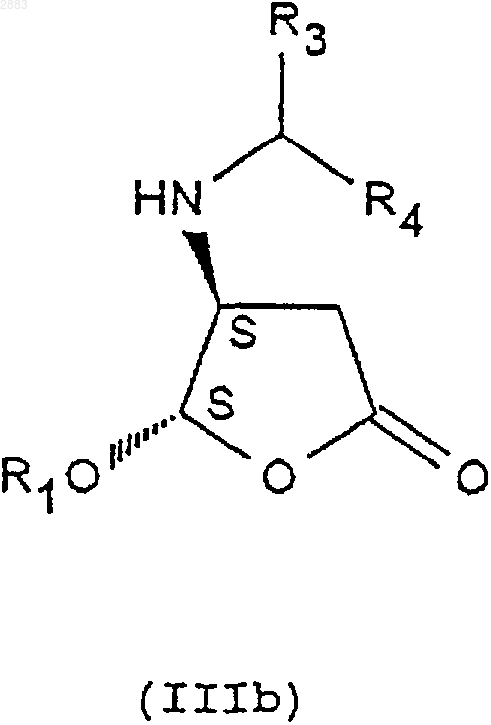
которые затем
- разделяют кристаллизацией, осуществляя при необходимости одну или несколько реакций перевода в соль,
- или, когда R3 представляет собой атом водорода, разделяют действием оптически активной кислоты,
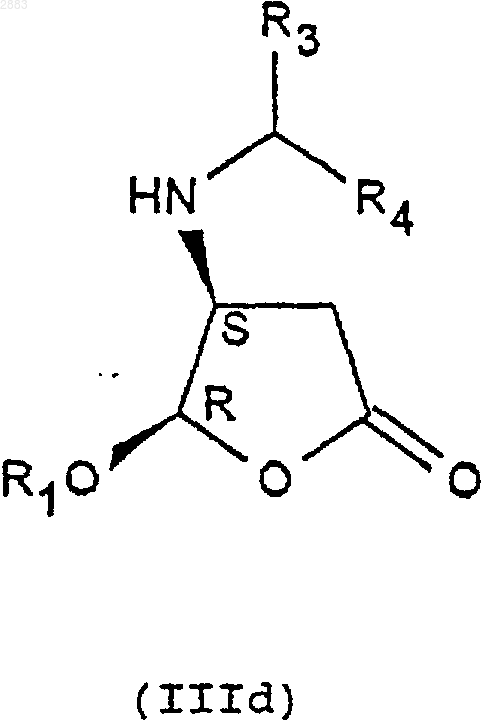
б) при необходимости, реакция эпимеризации соединения формулы (IIIa) или (IIIb), переведенного или не переведенного в соль, в присутствии кислоты с целью получения цис-изомерных соединений (4R, 5S) или (4S, 5R) формулы (Шс) или (IIId), которые при необходимости переводят в соль,

в) реакция гидрогенолиза,
- либо на транс-изомере (4R, 5R) или (4S, 5S) формулы (IIIa) или (IIIb), переведенном или не переведенном в соль, с целью получения соединения формулы (IVa) или (IVb) в виде транс-изомера (4R, 5R) или (4S, 5S), которые при необходимости переводят в соль и/или защищают,
- либо на цис-изомере (4R, 5S) или (4S, 5R) формулы (IIIс) или (IIId), переведенном или не переведенном в соль, с целью получения соединения формулы (IVc) или (IVd) в виде цис-изомера (4R, 5S) или (4S, 5R), которые при необходимости переводят в соль и/или защищают.
5. Способ по п.4, отличающийся тем, что реакцию защиты аминов формулы (IVa), (IVb), (IVc) или (IVd), переведенных или не переведенных в соль, осуществляют действием хлорформиата формулы Cl-CO-O-CH2-R2, причем R2 представляет собой трет.-бутил, (С2-С4)-алкенил, (С2-С4)-алкинил или фенил, замещенный или не замещенный, с целью получения соединений формулы (Iа), (Ib), (Iс) или (Id) соответственно в виде транс-диастереоизомеров (4R, 5R), (4S, 5S) или цис-диастереоизомеров (4R, 5S), (4S, 5R), которые при необходимости переводят в соль.

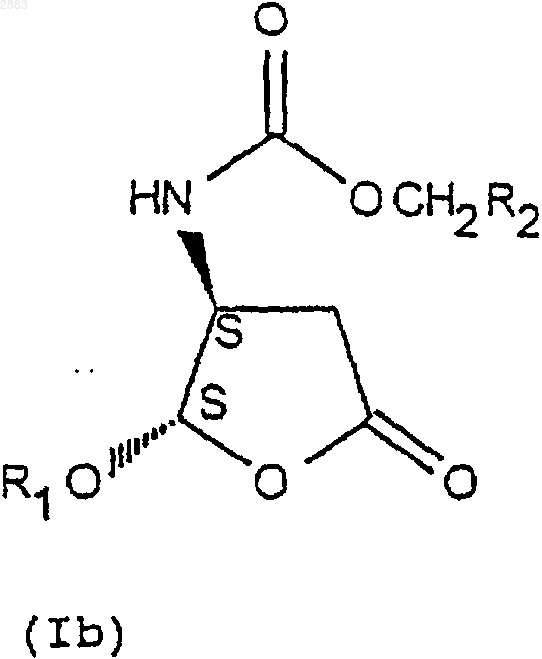
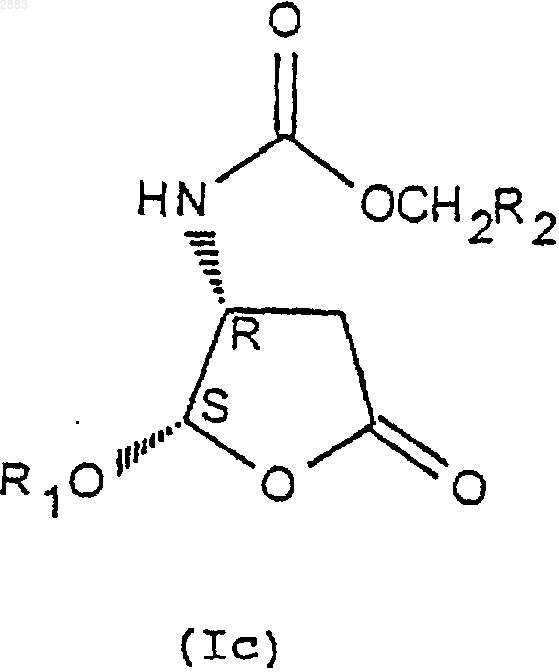
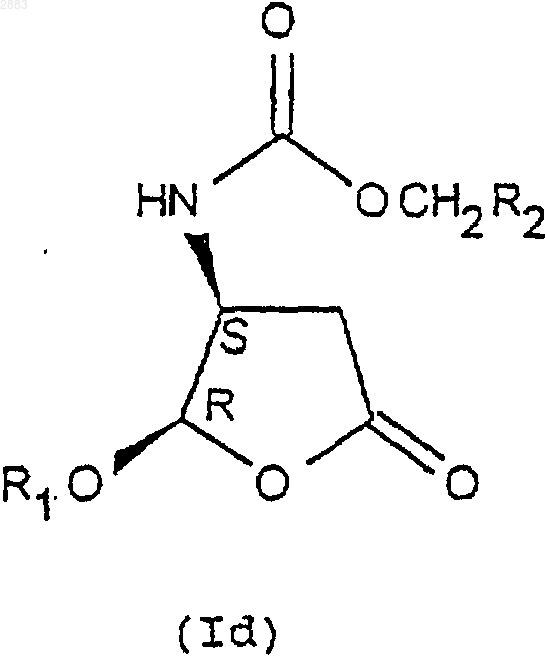
6. Способ по п.4, отличающийся тем, что разделение кристаллизацией соединений формул (IIIa) и (IIIb) по п.4 осуществляют
а) действием трихлоруксусной кислоты с целью получения соответствующей соли формулы (IIIa) или (IIIb),
б) затем действием монохлоруксусной кислоты на маточные растворы с целью получения соли, соответствующей другому диастереоизомеру формулы (IIIa) или (IIIb).
7. Способ получения по п.4 соединений формулы (IVd) по п.2 или соединений формулы (Id) по п.5, отличающийся тем, что он включает, по меньшей мере, одну из следующих стадий:
а) действие фенилэтиламина R на соединение формулы (II) с целью получения следующих соединений формул (III'a) и (III'b)
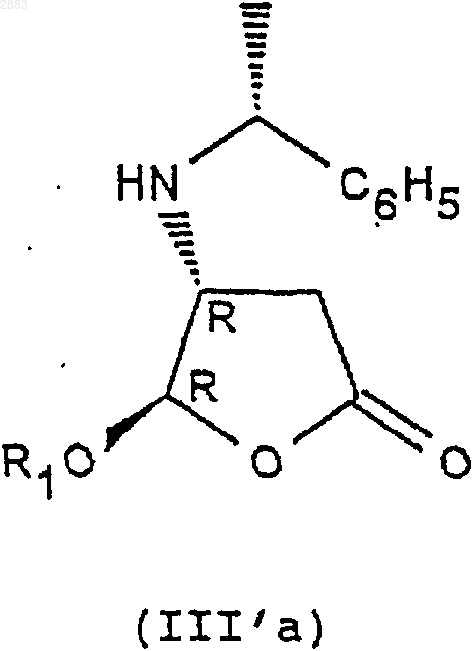
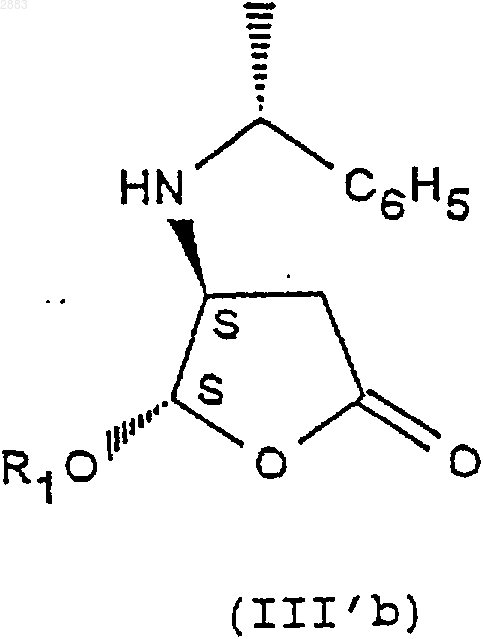
б) разделение транс-стереоизомеров формул (III'a) и (III'b) действием трихлоруксусной кислоты с целью получения стереоизомера (III'b) (4S, 5S) в виде соли трихлоруксусной кислоты, затем действием монохлоруксусной кислоты с целью получения стереоизомера (III'a) (4R, 5R) в виде соли монохлоруксусной кислоты,
в) при необходимости возврат к свободному амину путем действия основанием,
г) реакция эпимеризации стереоизомера (4S, 5S) формулы (III'b) в присутствии кислоты с целью получения цис-стереоизомера (4S, 5R) формулы (III'd)
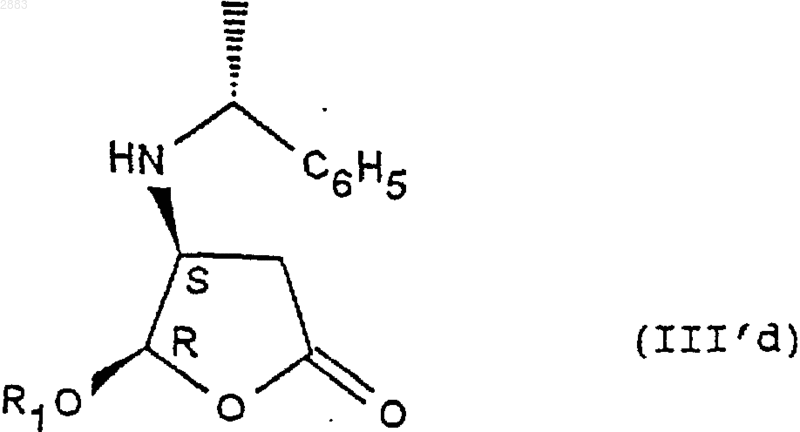
д) при необходимости кристаллизация после перевода в соль действием монохлоруксусной или дихлоруксусной кислоты,
е) при необходимости возврат к свободному амину путем действия основанием,
ж) при необходимости повторная кристаллизация после перевода в соль, в частности, в виде гидрохлорида,
з) гидрогенолиз цис-стереоизомера (4S, 5R) формулы (III'd) с целью получения соединения формулы (IVd) в виде цис-диастереоизомера (4S, 5R),
и) при необходимости действие хлорформиатом аллила на соединение формулы (IVd) с целью получения соединения формулы (Id) в виде цис-диастереоизомера (4S, 5R) с R2, представляющего собой -СН=СН2.
8. Способ получения по п.4 соединений формулы (IVd) по п.2 или соединений формулы (Id) по п.5, отличающийся тем, что он включает, по меньшей мере, одну из следующих стадий:
а) действие фенилэтиламином S на соединение формулы (II) с целью получения следующих соединений формул (III''а) и (III''b):

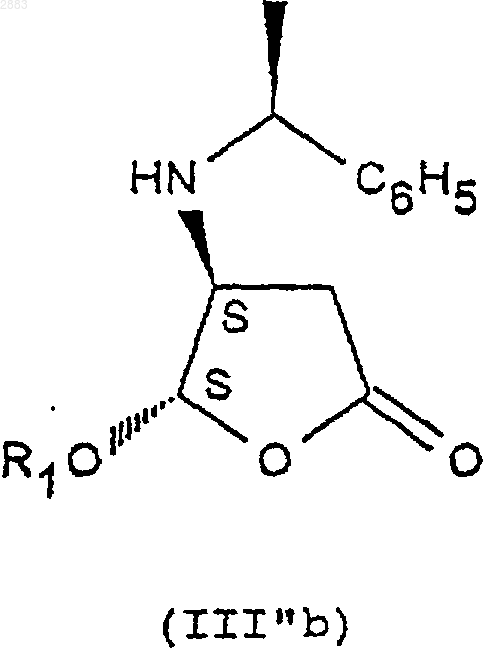
б) разделение транс-стереоизомеров формул (III''а) и (III''b) действием трихлоруксусной кислоты с целью получения стереоизомера (III''a) (4R, 5R) в виде соли трихлоруксусной кислоты, затем действием монохлоруксусной кислоты с целью получения стереоизомера (III''b) (4S, 5S) в виде соли монохлоруксусной кислоты,
в) при необходимости обессоливание путем действия основанием,
г) реакция эпимеризации стереоизомеров (4S, 5S) формулы (III''b) в присутствии кислоты с целью получения цис-стереоизомера (4S, 5R) формулы (III''d)
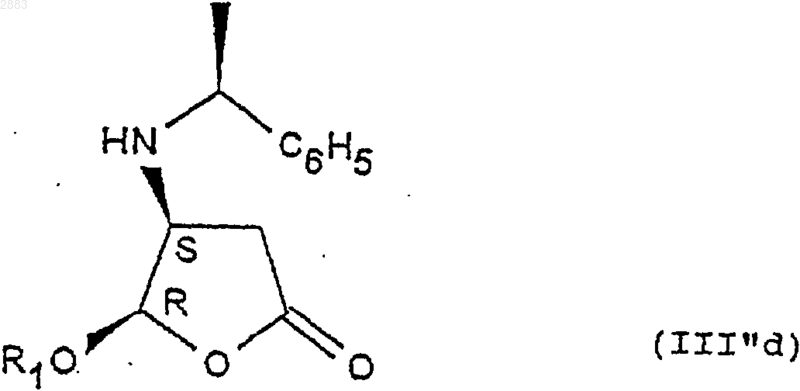
д) при необходимости кристаллизация после перевода в соль действием такой кислоты, как монохлоруксусная или дихлоруксусная кислота,
е) при необходимости возврат к свободному амину путем действия основанием,
ж) при необходимости повторная кристаллизация после перевода в соль, в частности, в виде гидрохлорида,
з) гидрогенолиз цис-стереоизомера (4S, 5R) формулы (III''d) с целью получения соединения формулы (IVd) в виде цис-диастереоизомера (4S, 5R),
и) при необходимости действие хлорформиатом аллила на соединение формулы (IVd) с целью получения соединений формулы (Id) в виде цис-диастереоизомера (4S, 5R), где R2 представляет собой радикал -СН=СН2.
9. Способ по одному из пп.4-8, отличающийся тем, что присоединение амина к соединению формулы (II) по п.4 осуществляют в диметилформамиде или водном растворе изопропанола.
10. Способ по одному из пп.4-8, отличающийся тем, что реакцию эпимеризации осуществляют с тетрахлоридом олова или метансульфокислотой.
11. Способ по одному из пп.4-8, отличающийся тем, что R1 представляет собой этил.
12. Способ по одному из пп.8-11, отличающийся тем, что разделение транс-стереоизомеров с трихлоруксусной кислотой (стадия б) осуществляют в водном растворе изопропанола.
13. Способ по одному из пп.8-11, отличающийся тем, что реакцию эпимеризации стереоизомера (4S, 5S) формулы (III''b, стадия г) осуществляют в присутствии метансульфокислоты в толуоле.
14. Способ по одному из пп.8-11, отличающийся тем, что кристаллизацию (стадия д) осуществляют действием дихлоруксусной кислоты в толуоле.
15. Применение соединений формулы (IVa), (IVb), (IVc) или (IVd) no п.1 или получаемых по способу по п.4 в реакциях аминирования, исходя из кислоты формулы А-СООН для получения следующего соединения формулы (V)
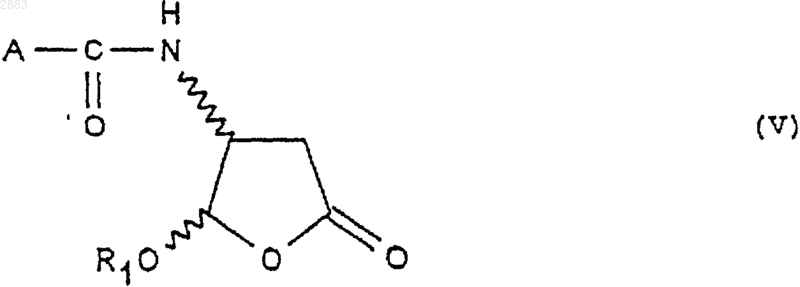
при этом А представляет собой некоторый органический радикал.
16. Применение соединений формулы (Ia), (Ib), (Ic) или (Id), получаемых по способу по п.5 в реакциях амирования, исходя из кислоты формулы А-СООН, для получения следующего соединения формулы (V)
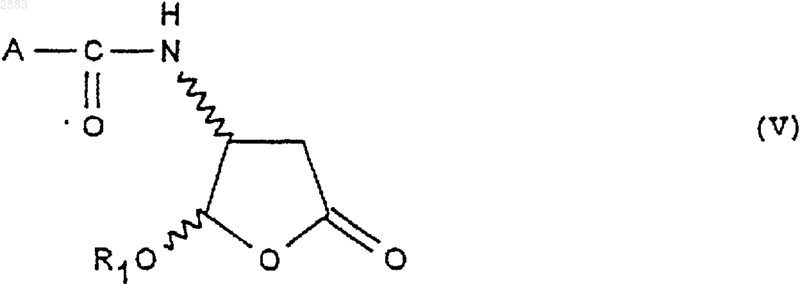
при этом А представляет собой некоторый органический радикал.
17. Применение соединений формулы (IVb) или (IVd) по п.1 или получаемых по способу по п.4 в синтезе соединений формулы (V), обладающих ингибиторной активностью в отношение фермента преобразования интерлейкина.
18. Применение соединений формулы (Ib) или (Id), получаемых по способу по п.5 в синтезе соединений формулы (V), обладающих ингибиторной активностью в отношении фермента преобразования интерлейкина.
19. Применение соединения формулы (IVd), где R1 - этил, по п.3 или получаемого по способу по п.7 или 8 для получения соединения формулы (V), обладающего ингибиторной активностью в отношении фермента преобразования интерлейкина.
20. Применение по п.19 соединений формулы (IVd) по п.19 для получение соединения формулы (V), имеющего следующую структуру:
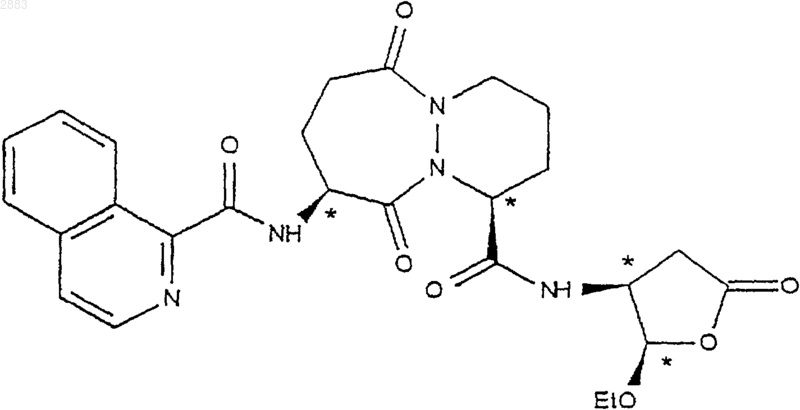
21. Применение соединения формулы (Id), где R1 - этил, получаемого по способу по п.5 для получения соединения формулы (V), обладающего ингибиторной активностью в отношении фермента преобразования интерлейкина.
22. Применение по п.21 соединений формулы (Id) по п.21 для получения соединения формулы (V), имеющего следующую структуру:
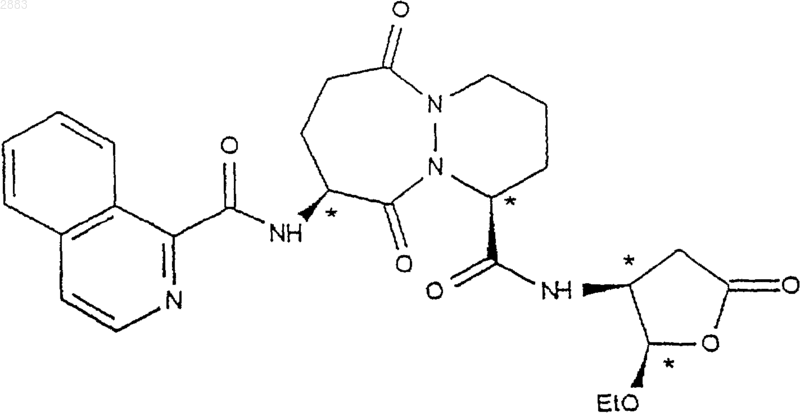
23. Соединения формул (IIIa), (IIIb), (IIIc), (IIId) в качестве новых промежуточных соединений, а также их соли присоединения с кислотами, за исключением формул (III''а) и (III''b) по п.8, где R1 - метил.
Текст
1 Предметом настоящего изобретения является новый способ получения аминопроизводных алкилоксифуранона, получаемые этим способом соединения и применение этих соединений в синтезе ингибиторов фермента преобразования интерлейкина-1 бета. В заявках на патент WO 9535308, WO 9722619, WO 9722618, ЕР 519748, WO 9633209 описаны соединения - ингибиторы фермента преобразования интерлейкина-1 бета. В способе получения некоторых соединений, описанных в приведенных выше заявках на патенты, используют следующие соединения формулы (I) в которой R1 представляет собой этил, a R2 представляет собой радикал -СН=СН 2. Соединения формулы (I) получают из защищенной L-аспаргиновой кислоты, и на это требуется 4 стадии синтеза: 1) ацилирование; 2) восстановление; 3) окисление; 4) циклизация(Chapman К.Т. et al Bioorg. Med. Chem. Lett. 2(6), 613-8 (1992. Этот способ имеет ряд крупных недостатков, в частности, в том случае, когда хотят получить хиральные соединения формулы (I). Действительно, необходимо применять исходный дорогостоящий хиральный реагент: сложный -трет.-бутиловый эфир L-аспаргиновой кислоты и особенно применять хроматографические методы для выделения и/или очистки различных диастереоизомеров. Поэтому, цель настоящего изобретения отыскать другой способ синтеза соединений формулы (I), не использующий этот исходный продукт и не требующий разделений методом хроматографии. Заявитель предлагает, следовательно, новый способ синтеза из алкилоксифуранона формулы (II) в рацемической форме, позволяющий получать новые соединения приводимых ниже формул (IVa), (IVb), (IVc) или (IVd), переведенные или не переведенные в соль, которые впоследствии при необходимости защищаются, с целью получения, в частности, соединений формулы (I). Преимущество этого способа заключается в возможности применения в большом масштабе, исходя из соединения формулы (II), которое является легко доступным и недорогим, причем стадии разделения и/или очистки осуществляются кристаллизацией, а не хроматографией. Таким образом может быть выделен каждый диастереоизомер формулы (III), (IV) или (I). Предметом настоящего изобретения являются, следовательно с одной стороны, следующие соединения формул (IVa), (IVb), (IVc) или в которых R1 является алкильной группой, содержащей от 1 до 4 атомов углерода, или фенилалкильной группой, содержащей от 7 до 11 атомов углерода, а также их соли присоединения с кислотами. Изобретение естественно распространяется на соли соединений формулы (IVa), (IVb), (IVc) или (IVd), как, например, соли, образованные с неорганическими или органическими кислотами с амином. Это могут быть соляная, бромистоводородная, азотная, серная, фосфорная, уксусная, муравьиная, пропионовая, бензойная, малеиновая, фумаровая, янтарная, винная, лимонная, щавелевая, глиоксиловая, аспарагиновая,алкансульфокислоты, такие как метан- или этансульфокислоты, арилсульфокислоты, такие как бензолсульфо- или паратолуолсульфокислоты и арилкарбоновые кислоты. Речь может также идти о хлоруксусной или трихлоруксусной кислотах. В частности,речь идет о солях, образованных с соляной кислотой. Когда R1 представляет собой алкильную группу, содержащую от 1 до 4 атомов углерода,речь идет, в частности, о метиле, этиле, бутиле или пропиле и особенно об этиле. Под фенилалкилом подразумевают предпочтительно бензильную группу. В частности, предметом изобретения является соединение определенной выше формулы(IVd), а также его соли присоединения с кислотами. Особенно, предметом изобретения является соединение формулы (IVd), в которой R1 представляет собой этильную группу, а также его соли присоединения с кислотами. С другой стороны, предметом настоящего изобретения является способ получения определенных выше соединений формулы (IVa), (IVb),(IVc) или (IVd), отличающийся тем, что он включает, по меньшей мере, одну из следующих стадий: а) действие ариламина формулыR3R4 СНNН 2, в которой R3 представляет собой атом водорода или алкильную группу, содержащую от 1 до 4 атомов углерода, a R4 представляет собой возможно замещенный арил, с рацемическим алкилоксифураноном формулы в которой R1 представляет собой алкильную группу, содержащую от 1 до 4 атомов углерода,или фенилалкильную группу, содержащую от 7 до 11 атомов углерода,и получение транс-изомерных соединений- разделяют кристаллизацией с осуществлением при необходимости одной или нескольких реакций перевода в соль,- или, когда R3 представляет собой атом водорода, разделяют действием оптически активной кислоты,б) при необходимости, реакция эпимеризации соединения формулы (IIIa) или (IIIb), переведенного или не переведенного в соль, в присутствии кислоты, с целью получения цисизомерных соединений (4R, 5S) или (4S, 5R) формулы (IIIc) или (IIId), которые при необходимости переводятся в соль в) реакция гидрогенолиза,- либо на транс-изомере (4R, 5R) или (4S,5S) формулы (IIIa) или (IIIb), переведенном или не переведенном в соль, с целью получения соединения формулы (IVa) или (IVb) в виде определенного выше транс-изомера (4R, 5R) или (4S,5S), который при необходимости переводится в соль и/или защищается,- либо на цис-изомере (4R, 5S) или (4S, 5R) формулы (IIIс) или (IIId), переведенном или не переведенном в соль, с целью получения соединения формулы (IVc) или (IVd) в виде определенного выше цис-изомера (4R, 5S) или (4S,5R), который при необходимости переводится в соль и/или защищается. В частности, реакцию защиты аминов формулы (IVa), (IVb), (IVc) или (IVd), переведенных или не переведенных в соль, осуществляют посредством хлорформиата формулыCl-CO-O-CH2-R2, при этом R2 представляет собой третичный бутил, (С 2-С 4)-алкенил, (С 2-C4)алкинил или фенил, замещенный или не замещенный, с целью получения соединений формулы (Ia), (Ib), (Ic) или (Id), соответственно в 4 виде транс-диастереоизомеров (4R, 5R), (4S, 5S) или цис-изомеров (4R, 5S), (4S, 5R), которые при необходимости переводятся в соль, Действие ариламина формулы R3R4 СНNН 2 на рацемический алкилоксифуранон формулы(II) осуществляют в соответствии с традиционными методами путем реакции Михаэля, а именно, в частности, в диполярном апротонном растворителе, таком как диметилформамид, при температуре окружающей среды. Возможно также работать с использованием фенилэтиламина R или S или в водном растворе изопропанола. Разделение двух транс-изомеров (4R, 5R) и(4S, 5S), а именно соответственно соединений формул (IIIa) и (IIIb) посредством кристаллизации осуществляют по известным специалисту методикам, касающимся разделения изомеров. В качестве предпочтительного примера разделение осуществляют действием трихлоруксусной кислоты в таком растворителе, как простой трет.-бутилметиловый эфир или водном растворе изопропанола. Транс-изомер (4R, 5R) (IIIa) кристаллизуется в виде соли трихлоруксусной кислоты, тогда как транс-изомер (4S, 5S) (IIIb) получают в виде соли монохлоруксусной кислоты посредством обработки маточных растворов в присутствии монохлоруксусной кислоты. Когда R3 представляет собой атом водорода (нехиральный амин), разделение (раздваивание) осуществляют при этом посредством хиральной кислоты, такой как винная, камфосульфокислота, салициловая, дибензоилвинная, R+ 2,4-гидроксифеноксипропионовая кислота. Реакцию эпимеризации на одном из изомеров (4R, 5R) или (4S, 5S) формулы (IIIa) или(IIIb) осуществляют в присутствии кислоты Льюиса, такой как хлорид железа, тетрахлорид титана, при необходимости в комплексе с тетрагидрофураном, трихлорид бора, этерат трифторида бора и тетрахлорид олова, или органической кислоты, такой как метансульфокислота,трифторуксусная кислота и паратолуолсульфокислота. Предпочтительно используют тетрахлорид олова, в присутствии слабополярного растворителя, такого как дихлорметан, или метансульфокислоту в таком растворителе, как толуол. 5 Реакцию гидрогенолиза на цис- или трансдиастереоизомерах формулы (IIIa), (IIIb), (IIIc) или (IIId) осуществляют по традиционным, известным специалисту методикам, например,действием водорода в присутствии 10%-го палладия на угле в тетрагидрофуране. Реакцию ацилирования с хлорформиатом осуществляют предпочтительно в присутствии такого основания, как пиридин, в слабополярном растворителе, таком как дихлорметан. Образование основания из соответствующей соли, т.е. возврат к свободному амину, а также методы перевода в соль с такими кислотами, как указанные выше, осуществляют по известным специалиста методикам. Что касается соединений формулы (III),когда R3 представляет собой алкильную группу,содержащую от 1 до 4 атомов углерода, речь идет предпочтительно о метиле или этиле, а когда R4 представляет собой арильную группу,речь идет предпочтительно о фениле или нафтиле. Что касается соединении формулы (I), когда R2 представляет собой группу (С 2-С 4) алкенил или (С 2-С 4) алкинил, речь предпочтительно идет о -СН=СН 2, -ССН, -СН=СН 2-СН 3, -СССН 3. Реакции защиты соединений формулы (I) осуществляют по известным специалисту методикам и, в частности, согласно работе Philip J.Verlog Stuttgart New-York 1994. Предметом настоящего изобретения является, в частности, определенный выше способ,отличающийся тем, что разделение кристаллизацией соединений формул (IIIa) и (IIIb) осуществляют: а) действием трихлоруксусной кислоты с целью получения соответствующей соли формулы (IIIa) или (IIIb),б) с последующим действием монохлоруксусной кислоты на маточные растворы с целью получения соли, соответствующей другому диастереоизомеру формулы (IIIa) или (IIIb). Предметом изобретения является, в частности, описанный выше способ получения описанных выше соединений формул (IVd) или (Id),отличающийся тем, что он включает, по меньшей мере, одну из следующих стадий: а) действие фенилэтиламина R на соединение формулы (II) с целью получения следующих соединений формул (III'a) и (III'b): б) разделение транс-стереоизомеров формул (III'а) и (III'b) действием трихлоруксусной кислоты с целью получения стереоизомера(III'b) (4S, 5S) в виде соли трихлоруксусной кислоты с последующим действием монохлоруксусной кислоты с целью получения стереоизомера (III'a) (4R, 5R) в виде соли монохлоруксусной кислоты; в) при необходимости возврат к свободному амину путем действия основанием; г) реакция эпимеризации стереоизомера д) при необходимости кристаллизация после перевода в соль действием такой кислоты,как монохлоруксусная или дихлоруксусная кислота; е) при необходимости возврат к свободному амину путем действия основанием; ж) при необходимости повторная кристаллизация после перевода в соль, в частности, в виде гидрохлорида; з) гидрогенолиз цис-стереоизомера (4S,5R) формулы (III'd) с целью получения соединения формулы (IVd) в виде цис-диастереоизомера (4S, 5R); и) при необходимости действие хлорформиатом аллила на соединение формулы (IVd) с целью получения соединения формулы (Id) в виде цис-диастереоизомера (4S, 5R), при этомR1 представляет собой -СН=СН 2. Предметом настоящего изобретения является также, в частности, описанный выше способ получения описанных выше соединений формулы (IVd) или (Id) , отличающийся тем, что он включает, по меньшей мере, одну из следующих стадий: а) действие фенилэтиламином S на соединение формулы (II) с целью получения следующих соединений формул (IIIа) и (IIIb): б) разделение транс-стереоизомеров формулы (IIIа) и (IIIb) действием трихлоруксусной кислоты с целью получения стереоизомера(IIIa) (4R, 5R) в виде соли трихлоруксусной кислоты с последующим действием монохлоруксусной кислотой с целью получения стереоизомера (IIIb) (4S, 5S) в виде соли монохлоруксусной кислоты; в) при необходимости, возврат к свободному амину путем действия основанием; г) реакция эпимеризации стереоизомера д) при необходимости кристаллизация после перевода в соль под действием такой кислоты, как монохлоруксусная или дихлоруксусная кислота; е) при необходимости возврат к свободному амину путем действия основанием; ж) при необходимости повторная кристаллизация после перевода в соль, в частности, в виде гидрохлорида; з) гидрогенолиз цис-стереоизомера (4S,5R) формулы (IIId) с целью получения соединения формулы(IVd) в виде цисдиастереоизомера (4S, 5R); и) при необходимости действие хлорформиатом аллила на соединение формулы (IVd) с целью получения соединения формулы (Id) в виде цис-диастереоизомера (4S, 5R). Предметом изобретения является, в частности, описанный выше способ, отличающийся тем, что добавление амина к соединению формулы (II) осуществляют в диметилформамиде или в водном растворе изопропанола. Предметом изобретения является, в частности, описанный выше способ, отличающийся тем, что реакцию эпимеризации осуществляют с тетрахлоридом олова или метансульфокислотой. Предметом изобретения является, в частности, описанный выше способ, отличающийся тем, что R1 представляет собой этил. Предметом изобретения является, в частности, описанный выше способ, отличающийся тем, что разделение транс-стереоизомеров с трихлоруксусной кислотой (стадия б) осуществляют в водном растворе изопропанола. Предметом изобретения является, в частности, способ, в котором используют фенилэтиламин (R), отличающийся тем, что реакцию эпимеризации стереоизомера (4S, 5S) формулы(IIIb) (стадия г) осуществляют в присутствии метансульфокислоты в толуоле. Предметом изобретения является, в частности, способ, в котором используют фенилэтиламин (R), отличающийся тем, что кристаллизацию (стадия д) осуществляют действием дихлоруксусной кислотой в толуоле. Предметом изобретения является также применение: либо соединений формулы (IVa), (IVb),(IVc) или (IVd), описанных выше или получаемых согласно описанному выше способу,либо соединений формулы (Ia), (Ib), (Ic) или (Id), полученных согласно описанному выше способу в реакциях аминирования, исходя из кислоты формулы А-СООН для получения следующего соединения формулы (V) при этом А представляет собой некоторый органический радикал. Предметом изобретения является также применение: либо соединений формулы (IVb) или (IVd),описанных выше или получаемых согласно описанному выше способу,либо соединений формулы (Ib) или (Id),получаемых согласно описанному выше способу при синтезе соединений формулы (V), обладающих ингибиторной активностью в отношении фермента преобразования интерлейкина. Эти соединения формулы (V) описаны, в частности, в заявках на патент WO 9535308, WO 9722619, ЕР 0519748 и WO 9633209. Предметом изобретения является, в частности, применение: либо соединения формулы (IVd) с R1 = этил, описанного выше или получаемого согласно описанному выше способу,либо соединения формулы (Id) с R1 = этил,получаемого согласно описанному выше способу для получения соединения формулы (V), обладающего ингибиторной активностью в отношении фермента преобразования интерлейкина. Предметом изобретения является также применение: либо соединений формулы (IVd) с R1 = этил, описанного выше или получаемого согласно описанному выше способу,либо соединений формулы (Id) с R1 = этил,получаемого согласно описанному выше способу для получения следующего соединения формулы (V), имеющего следующую структуру: Это соединение описано в заявке на патентWO 9722619 (Pdt 412 е). Предметом изобретения являются также соединения формул (IIIa), (IIIb), (IIIc), (IIId), а также их соли присоединения с описанными выше кислотами, в качестве новых промежуточных соединений, за исключением соединений формул (IIIа) и (IIIb) с R1 = метил. Соединения формулы (II) известны и могут быть легко получены из метоксифуранона действием ПТСК (паратолуолсульфокислоты) в присутствии воды, затем реагента формулы(R1O)3 СН в присутствии кислого катализатора. Приводимые ниже примеры иллюстрируют изобретение, однако, не ограничивая его. Пример 1. (2R-цис) 2-Пропенил-(2-этокситетрагидро-5-оксо-3-фуранил)-карбамат. 9 Стадия 1: добавка Михаэля. 4(R) Дигидро-5-этокси-4[(1-фенилэтил) амин]-2(3 Н)-фуранон. Добавляют за 30 мин при температуре от 23 до 25 С в инертной атмосфере 15 мл 98%-гоR(+)фенилэтиламина к 15 г рацемического этоксифуранона в 75 мл диметилформамида, перемешивают 24 ч получаемый раствор, затем выливают в смесь вода/лед. Добавляют простой изопропиловый эфир, экстрагируют, промывают и сушат, и выпаривают при пониженном давлении до получения 27 г масла, соответствующего ожидаемой смеси транс-изомеров 50/50. ЯМР (СDСl3; 250 Hz).(4S,5S). 4(S)[4(S),5]-Дигидро-5-этокси-4-[(1 фенилэтил)амин]-2(3 Н)-фуранонтрихлорацетат. Добавляют за 20 мин раствор 10,6 г трихлоруксусной кислоты (99,5%) в 50 мл простого метилтрет.-бутилового эфира к 27 г смеси диастереоизомеров, полученных на предыдущей стадии в 164 мл простого метилтрет.-бутилового эфира. Полученный раствор перемешивают в течение 2 ч при температуре 20-25 С, затем при температуре 0-5 С. Получают 12 г изомера (4S,5S) в виде соли трихлоруксусной кислоты. Б) Получение транс-диастереизомера (4R,5R). 4(R)[4(R),5]-Дигидро-5-этокси-4-[(1 фенилэтил)амин]-2(2 Н)-фуранонхлорацетат. Маточные растворы с предыдущей стадии промывают насыщенным раствором бикарбоната натрия, затем водой, после чего повторно экстрагируют за один раз простым изопропиловым эфиром. После сушки выпаривают при по 002883 10 ниженном давлении до получения 15,45 г ожидаемого продукта в виде масла. Добавляют 5 г монохлоруксусной кислоты к 15,45 г продукта в 130 мл изопропанола и нагревают до 40 С. Наблюдают растворение, затем кристаллизацию,после чего перемешивают в течение 1 ч при температуре окружающей среды, затем 2 ч при 0-5 С. Получают 11,98 г изомера (ожидаемый 4R, 5R) в виде соли монохлоруксусной кислоты. Стадия 3: получение обессоленного соединения (4S,5S). 4(S)[4(S),5]-Дигидро-5-этокси-4-[(1 фенилэтил)амин]-2(3 Н)-фуранон. Смешивают при температуре окружающей среды 11,8 г соли, полученной на стадии 2 А, и 120 мл дихлорметана, после чего добавляют 100 мл насыщенного раствора бикарбоната натрия. После перемешивания в течение 10 мин экстрагируют, промывают, сушат и выпаривают при пониженном давлении до получения 7,1 г обессоленного продукта.[D] = +114 (с = 1% СН 3 ОН). Стадия 4: эпимеризация: получение диастереоизомера (4S,5R). 4(S)[4(S),5]-Дигидро-5-этокси-4-[(1 фенилэтил)амин]-2(3 Н)-фуранон. Добавляют в инертной атмосфере за 1 ч при 4 +/- 1 С, 28,6 мл тетрахлорида олова 1 М в дихлорметане с 6,8 г обессоленного соединения(4S, 5S), полученного на стадии 3, в 135 мл дихлорметана и перемешивают в течение 40 мин при этой температуре. После чего добавляют 11 мл уксусной кислоты, перемешивают в течение 30 мин при 5 С, выливают в смесь вода/лед,промывают, добавляют циклогексан, доводят рН до 7-8 добавлением бикарбоната натрия, экстрагируют циклогексаноном, сушат и выпаривают при пониженном добавлении до получения 4,39 г ожидаемого продукта в виде масла, соответствующего отношению цис/транс 90/10). Стадия 5: образование соли монохлоруксусной кислоты цис-диастереоизомера (4S, 5R). 4(S)[4(S),5]-дигидро-5-этокси-4-[(1 фенилэтил)амин]-2(3 Н)-фуранонхлорацетат. Добавляют 1,82 г монохлоруксусной кислоты (96%) в инертной атмосфере при 20-25 С к 5 г цис-диастереоизомера, полученного на предыдущей стадии, в 50 мл простого трет.бутилметилового эфира. Получают раствор,который быстро кристаллизуется, и оставляют в[D] = -115 (с = 1% СН 3 ОН). Стадия 6: гидрогенолиз. а) Обессоливание (возврат к свободному амину). 4(S)[4(S),5]-Дигидро-5-этокси-4-[(1 фенилэтил)амин]-2(3 Н)-фуранона. Смешивают при 0-5 С в инертной атмосфере 5,55 г соли монохлоруксусной кислоты,полученной на предыдущей стадии, 60 мл дихлорметана и 55 мл бикарбоната натрия, перемешивают в течение 10 мин, промывают, экстрагируют, сушат и выпаривают при пониженном давлении до получения 3,95 г обессоленного продукта в виде масла. б) Образование гидрохлорида. 4(S)[4(S),5]-Дигидро-5-этокси-4-[(1 фенилэтил)амин]-2(3 Н)-фуранонгидрохлорид. Добавляют по каплям при 0-5 С, 6,6 мл соляной кислоты (2N) в простом изопропиловом эфире к 3,36 г полученного ранее продукта в 66 мл простого изопропилового эфира и выдерживают в течение 1 ч при этой температуре. Наблюдают кристаллизацию. Получают 3,77 г ожидаемого гидрохлорида. в) Гидрогенолиз.(4(S)-цис)-4-Амин-5-этоксидигидро-2(3 Н)фуранонгидрохлорид. Во взвесь 4 г полученного ранее гидрохлорида в 60 мл тетрагидрофурана добавляют 1,8 мл воды для получения раствора, затем 400 мг 10%-го палладия на угле. Перемешивают при давлении 1,5 бар водорода в течение 18 ч при 27-28 С. После фильтрования и промывания смесью тетрагидрофуран/вода выпаривают при пониженном давлении. Получают 2,54 г ожидаемого продукта.(2R-цис) 2-пропенил-(2-этокси-тетрагидро-5 оксо-3-фуранил)карбамат. Добавляют при +5 С в инертной атмосфере 3 мл пиридина в смесь, состоящую из 2,4 г полученного на предыдущей стадии продукта,50 мл дихлорметана и 1,55 мл хлорформиата аллила, перемешивают в течение 1 ч при этой температуре, затем добавляют 0,56 мл хлорформиата аллила и 1 мл пиридина. Перемешивают в течение 6 ч при температуре окружающей среды, переливают в воду, экстрагируют дихлорметаном, промывают, сушат, выпаривают при пониженном давлении до получения 12 2,66 г чернового продукта, который повторно кристаллизуют в простом изопропиловом эфире. Получают 1,95 г ожидаемого чистого продукта. Пример 2. (2R-цис) 2-Пропенил-(2-этокситетрагидро-5-оксо-3-фуранил)карбамат. Стадия 1: добавка Михаэля. 4(S) Дигидро-5-этокси-4[(1-фенилэтил) амин]-2(3 Н)-фуранон. Добавляют за 30 мин при температуре 2325 С в инертной атмосфере 15 мл 98%-го S(-) фенилэтиламина к 15 г рацемического этоксифуранона в 75 мл диметилформамида, перемешивают в течение 24 ч полученный раствор,затем выливают в смесь вода/лед. После экстракции циклогексаном, промывки и сушки выпаривают при пониженном давлении до получения 26,6 г масла, соответствующего ожидаемой смеси транс-изомеров 45/55. ЯМР (CDCl3; 250 MHz)(4R,5R) 4(R)[4(S),5]-дигидро-5-этокси-4-[(1 фенилэтил)амин]-2(3 Н)-фуранонтрихлорацетат. Добавляют за 30 мин раствор 10,24 г трихлоруксусной кислоты (99,5%) в 50 мл простого трет.-бутилового эфира в 26 г смеси с предыдущей стадии в 155 мл простого трет.-бутилового эфира. Полученный раствор перемешивают в течение 2 ч при 20-25 С, затем в течение 2 ч при 5 С. Получают 12,63 г изомера (4R, 5R) в виде соли трихлоруксусной кислоты.(4S,5S). 4(S)[4(R),5]-дигидро-5-этокси-4-[(1 фенилэтил)амин]-2(3 Н)-фуранонхлорацетат. Маточные растворы с предыдущей стадии промывают насыщенным раствором бикарбоната натрия, затем повторно экстрагируют простым трет.-бутиловым эфиром. После сушки выпаривают при пониженном давлении до получения 17,43 г ожидаемого продукта в виде масла. Добавляют 130 мл изопропанола, затем 5 г монохлоруксусной кислоты и нагревают до 40 С. Наблюдают растворение, затем кристаллизацию, после чего перемешивают в течение 1 ч при температуре окружающей среды, затем в течение 2 ч при 0-5 С. Получают 12,48 г изомера (ожидаемого 4S, 5S) в виде соли монохлоруксусной кислоты. Стадия 3: получение обессоленного соединения (4S,5S). 4(S)[4(R),5]-Дигидро-5-этокси-4-[(1 фенилэтил)амин]-2(3 Н)-фуранон. Смешивают при 0-5 С, 12,35 г соли, полученной на стадии 2 Б, и 130 мл дихлорметана,затем добавляют 100 мл насыщенного раствора бикарбоната натрия. После 10 мин перемешивания экстрагируют, промывают, сушат и выпаривают при пониженном давлении до получения 8,9 г обессоленного продукта.[D] = -6,6 (с = 1% СН 3 ОН) Стадия 4: эпимеризация: получение диастереоизомера (4S,5R). 4(S)[4(R),5]-Дигидро-5-этокси-4-[(1 фенилэтил)амин]-2(3 Н)-фуранон. Смешивают в инертной атмосфере за 45 мин при 0-5 С 37 мл тетрахлорида олова (1 М) в дихлорметане с 8,8 г обессоленного соединения(4S, 5S), полученного на стадии 3, в 175 мл дихлорметана и перемешивают 1 ч при этой тем 002883 14 пературе. После этого добавляют 14,1 мл уксусной кислоты, перемешивают 1 ч при 0-5 С, переливают в смесь вода/лед, промывают, добавляют циклогексан, доводят рН до 7-8 добавлением бикарбоната натрия, экстрагируют циклогексаном, сушат и выпаривают при пониженном давлении до получения 3,96 г ожидаемого продукта в виде масла, соответствующего отношению цис/транс 90/10). ЯМР (СDСl3; 250 MHz). Стадия 5: образование соли трихлоруксусной кислоты цис-диастереоизомера (4S-5R). 4(S)[4(R),5]-Дигидро-5-этокси-4[(1 фенилэтил) амин]-2(3 Н)-фуранонтрихлорацетат. Добавляют 2,34 г трихлоруксусной кислоты (99%) в инертной атмосфере при 20-25 С, к 3,8 г полученного на предыдущей стадии цисдиастереоизомера в 40 мл простого трет.бутилметилового эфира. Оставляют на 1 ч при 0-5 С и получают 5,58 г ожидаемого продукта.[D] = -49 (с = 0,9% СН 3 ОН). Стадия 6: гидрогенолиз. а) Обессоливание (возврат к свободному амину). 4(S)[4(R),5]-Дигидро-5-этокси-4-[(1 фенилэтил)амин]-2(3 Н)-фуранона. Смешивают при 0-5 С в инертной атмосфере, 5,41 г полученной на предыдущей стадии соли трихлоруксусной кислоты, 50 мл циклогексана и 50 мл насыщенного раствора бикарбоната натрия, перемешивают до растворения,промывают, экстрагируют, сушат и выпаривают при пониженном давлении до получения 3,18 г обессоленного продукта в виде масла.[D] = -93 (с = 0,62% СН 3 ОН). Повторно очищают этот продукт, смешивая в течение 10 мин 2,85 г этого продукта с 30 мл циклогексана и 2,8 г двуоксида кремния. После обработки собирают 2,3 г бесцветного масла. б) Образование гидрохлорида. 4(S)[4(R),5]-Дигидро-5-этокси-4-[(1 фенилэтил)амин]-2(3 Н)-фуранонгидрохлорида. Добавляют по каплям при 0-5 С 4 мл соляной кислоты (2N) в простом изопропиловом эфире к 2 г полученного ранее продукта в 40 мл простого изопропилового эфира и выдерживают в течение 15 мин при этой температуре. Выпаривают при пониженном давлении до получения 2,29 г ожидаемого гидрохлорида. в) Гидрогенолиз.(4(S)-цис)-4-Амин-5-этокси-дигидро 2(3 Н)-фуранонгидрохлорид. К взвеси 2,29 г полученного ранее хлоргидрата в 40 мл тетрагидрофурана добавляют 1 мл воды, затем 300 мг 10%-го палладия на угле. Перемешивают при давлении 1,5 бар водорода в течение 5 ч. После фильтрования и промывки смесью тетрагидрофуран/ вода выпаривают при пониженном давлении при 45 С. Получают 1,40 г ожидаемого продукта.(2 Н-цис) 2-Пропенил-(2-этокситетрагидро 5-оксо-3-фуранил)карбамат. Добавляют при +5 С в инертной атмосфере 1 мл хлорформиата аллила 99%, затем 2 мл пиридина к 1,3 г полученного на предыдущей стадии продукта в 50 мл дихлорметана, перемешивают в течение 1 ч 40 при этой температуре, после чего добавляют 0,3 мл хлорформиата аллила и 0,6 мл пиридина. Перемешивают в течение 16 ч при температуре окружающей среды,переливают в воду, экстрагируют дихлорметаном, промывают, сушат, выпаривают при пониженном давлении до получения 1,62 г чернового продукта, который повторно кристаллизуют в простом изопропиловом эфире. Получают 1,34 г ожидаемого продукта. Пример 3. 4(S)[4(S),5]-Дигидро-5 этокси-4-[(1-фенилэтил)амин]-2(3 Н)-фуранондихлорацетат. Стадия 1: добавка Михаэля. 4(R) Дигидро-5-этокси-4[(1-фенилэтил) амин]-2(3 Н)-фуранон. Добавляют приблизительно за 1 ч 30 с перемешиванием в атмосфере азота, поддерживая температуру 0+/-2 С, 20 мл R (+)-1-фенилэтил амина (19,06 г) к раствору 20 г рацемического этоксифуранона в 156,8 мл изопропанола и 3,2 мл воды и перемешивают в течение 24 ч при этой температуре. 16 Стадия 2: разделение двух трансдиастереоизомеров. Получение транс-диастереоизомера (4S,5S). 4(S)[4(S),5]-Дигидро-5-этокси-4-[(1 фенилэтил)амин]-2(3 Н)-фуранонтрихлорацетат. Добавляют к предыдущему раствору (продукт не выделен) раствор, образованный 25,55 г трихлоруксусной кислоты в 39,2 мл изопропанола и 0,8 мл умягченной воды, ожидают, когда температура составит 20-22 С, и наблюдают кристаллизацию соли после окончания введения. Эту суспензию выдерживают в течение 24 ч при 20+/-2 С, после чего продукт обезвоживают и промывают изопропанолом с 2% воды. Получают 18 г ожидаемого продукта. Стадия 3: эпимеризация. Получение диастереоизомера (4S,5R) 4(S)[4(S),5]-Дигидро-5-этокси-4-[(1 фенилэтил) амин]-2(3 Н)-фуранон. Добавляют в атмосфере азота, поддерживая температуру 20+/-2 С, 45 мл метансульфокислоты в суспензии 50 г трихлорацетата (4S,5S), полученного на предыдущей стадии, в 150 мл толуола, выдерживают в течение 2 ч при 20+/-2 С и, понизив температуру до 0+5 С, добавляют 111 мл триэтиламина за 1 ч 30. После серии промывки, экстракции и сушки получают 400 мл раствора, содержащего смесь 85/15 цис/транс-изомера. Стадия 4: образование соли дихлоруксусной кислоты цис-диастереоизомера (4S,5R). 4(S)[4(S),5]-Дигидро-5-этокси-4-[(1 фенилэтил)амин]-2(3 Н)-фуранондихлорацетат. Добавляют 10 мл дихлоруксусной кислоты к 400 мл предыдущего раствора, концентрируют до 6 объемов, наблюдают кристаллизацию и перемешивают при 20 +/-2 С в течение 2 ч в атмосфере азота. После промывки толуолом получают 32,8 г ожидаемого продукта. в которых R1 представляет собой алкильную группу, содержащую от 1 до 4 атомов углерода,или фенилалкильную группу, содержащую от 7 до 11 атомов углерода, а также их соли присоединения с кислотами. 2. Соединение формулы (IVd) по п.1, а также его соли присоединения с кислотами. 3. Соединение формулы (IVd) по п.2, в котором R1 представляет собой этил, а также его соли присоединения с кислотами. 4. Способ получения соединений формулыR3R4CHNH2, в которой R3 представляет собой атом водорода или алкильную группу, содержащую от 1 до 4 атомов углерода, a R4 представляет собой арил, при необходимости замещенный на рацемический алкилоксифуранон формулы (II) в которой R1 представляет собой алкильную группу, содержащую от 1 до 4 атомов углерода,или фенилалкильную группу, содержащую от 7 до 11 атомов углерода,и получение транс-изомерных соединений- разделяют кристаллизацией, осуществляя при необходимости одну или несколько реакций перевода в соль,- или, когда R3 представляет собой атом водорода, разделяют действием оптически активной кислоты, 002883 18 б) при необходимости, реакция эпимеризации соединения формулы (IIIa) или (IIIb), переведенного или не переведенного в соль, в присутствии кислоты с целью получения цисизомерных соединений (4R, 5S) или (4S, 5R) формулы (IIIс) или (IIId), которые при необходимости переводят в соль, в) реакция гидрогенолиза,- либо на транс-изомере (4R, 5R) или (4S,5S) формулы (IIIa) или (IIIb), переведенном или не переведенном в соль, с целью получения соединения формулы (IVa) или (IVb) в виде трансизомера (4R, 5R) или (4S, 5S), которые при необходимости переводят в соль и/или защищают,- либо на цис-изомере (4R, 5S) или (4S, 5R) формулы (IIIс) или (IIId), переведенном или не переведенном в соль, с целью получения соединения формулы (IVc) или (IVd) в виде цисизомера (4R, 5S) или (4S, 5R), которые при необходимости переводят в соль и/или защищают. 5. Способ по п.4, отличающийся тем, что реакцию защиты аминов формулы (IVa), (IVb),(IVc) или (IVd), переведенных или не переведенных в соль, осуществляют действием хлорформиата формулы Cl-CO-O-CH2-R2, причем R2 представляет собой трет.-бутил, (С 2-С 4)алкенил, (С 2-С 4)-алкинил или фенил, замещенный или не замещенный, с целью получения соединений формулы (Iа), (Ib), (Iс) или (Id) соответственно в виде транс-диастереоизомеров(4R, 5S), (4S, 5R), которые при необходимости переводят в соль. 6. Способ по п.4, отличающийся тем, что разделение кристаллизацией соединений формул (IIIa) и (IIIb) по п.4 осуществляют а) действием трихлоруксусной кислоты с целью получения соответствующей соли формулы (IIIa) или (IIIb), 19 б) затем действием монохлоруксусной кислоты на маточные растворы с целью получения соли, соответствующей другому диастереоизомеру формулы (IIIa) или (IIIb). 7. Способ получения по п.4 соединений формулы (IVd) по п.2 или соединений формулы(Id) по п.5, отличающийся тем, что он включает,по меньшей мере, одну из следующих стадий: а) действие фенилэтиламина R на соединение формулы (II) с целью получения следующих соединений формул (III'a) и (III'b) б) разделение транс-стереоизомеров формул (III'a) и (III'b) действием трихлоруксусной кислоты с целью получения стереоизомера(III'b) (4S, 5S) в виде соли трихлоруксусной кислоты, затем действием монохлоруксусной кислоты с целью получения стереоизомера (III'a)(4R, 5R) в виде соли монохлоруксусной кислоты,в) при необходимости возврат к свободному амину путем действия основанием,г) реакция эпимеризации стереоизомера д) при необходимости кристаллизация после перевода в соль действием монохлоруксусной или дихлоруксусной кислоты,е) при необходимости возврат к свободному амину путем действия основанием,ж) при необходимости повторная кристаллизация после перевода в соль, в частности, в виде гидрохлорида,з) гидрогенолиз цис-стереоизомера (4S,5R) формулы (III'd) с целью получения соединения формулы(IVd) в виде цисдиастереоизомера (4S, 5R),и) при необходимости действие хлорформиатом аллила на соединение формулы (IVd) с целью получения соединения формулы (Id) в виде цис-диастереоизомера (4S, 5R) с R2, представляющего собой -СН=СН 2. 8. Способ получения по п.4 соединений формулы (IVd) по п.2 или соединений формулы(Id) по п.5, отличающийся тем, что он включает,по меньшей мере, одну из следующих стадий: а) действие фенилэтиламином S на соединение формулы (II) с целью получения следующих соединений формул (IIIа) и (IIIb): б) разделение транс-стереоизомеров формул (IIIа) и (IIIb) действием трихлоруксусной кислоты с целью получения стереоизомера(IIIa) (4R, 5R) в виде соли трихлоруксусной кислоты, затем действием монохлоруксусной кислоты с целью получения стереоизомера(IIIb) (4S, 5S) в виде соли монохлоруксусной кислоты,в) при необходимости обессоливание путем действия основанием,г) реакция эпимеризации стереоизомеров д) при необходимости кристаллизация после перевода в соль действием такой кислоты,как монохлоруксусная или дихлоруксусная кислота,е) при необходимости возврат к свободному амину путем действия основанием,ж) при необходимости повторная кристаллизация после перевода в соль, в частности, в виде гидрохлорида,з) гидрогенолиз цис-стереоизомера (4S,5R) формулы (IIId) с целью получения соединения формулы(IVd) в виде цисдиастереоизомера (4S, 5R),и) при необходимости действие хлорформиатом аллила на соединение формулы (IVd) с целью получения соединений формулы (Id) в виде цис-диастереоизомера (4S, 5R), где R2 представляет собой радикал -СН=СН 2. 9. Способ по одному из пп.4-8, отличающийся тем, что присоединение амина к соединению формулы (II) по п.4 осуществляют в диметилформамиде или водном растворе изопропанола. 10. Способ по одному из пп.4-8, отличающийся тем, что реакцию эпимеризации осуществляют с тетрахлоридом олова или метансульфокислотой. 11. Способ по одному из пп.4-8, отличающийся тем, что R1 представляет собой этил. 12. Способ по одному из пп.8-11, отличающийся тем, что разделение трансстереоизомеров с трихлоруксусной кислотой 13. Способ по одному из пп.8-11, отличающийся тем, что реакцию эпимеризации стереоизомера (4S, 5S) формулы (IIIb, стадия г) осуществляют в присутствии метансульфокислоты в толуоле. 14. Способ по одному из пп.8-11, отличающийся тем, что кристаллизацию (стадия д) осуществляют действием дихлоруксусной кислоты в толуоле. 15. Применение соединений формулы(IVa), (IVb), (IVc) или (IVd) no п.1 или получаемых по способу по п.4 в реакциях аминирования, исходя из кислоты формулы А-СООН для получения следующего соединения формулы 18. Применение соединений формулы (Ib) или (Id), получаемых по способу по п.5 в синтезе соединений формулы (V), обладающих ингибиторной активностью в отношении фермента преобразования интерлейкина. 19. Применение соединения формулы(IVd), где R1 - этил, по п.3 или получаемого по способу по п.7 или 8 для получения соединения формулы (V), обладающего ингибиторной активностью в отношении фермента преобразования интерлейкина. 20. Применение по п.19 соединений формулы (IVd) по п.19 для получение соединения формулы (V), имеющего следующую структуру: при этом А представляет собой некоторый органический радикал. 16. Применение соединений формулы (Ia),(Ib), (Ic) или (Id), получаемых по способу по п.5 в реакциях амирования, исходя из кислоты формулы А-СООН, для получения следующего соединения формулы (V) 21. Применение соединения формулы (Id),где R1 - этил, получаемого по способу по п.5 для получения соединения формулы (V), обладающего ингибиторной активностью в отношении фермента преобразования интерлейкина. 22. Применение по п.21 соединений формулы (Id) по п.21 для получения соединения формулы (V), имеющего следующую структуру: при этом А представляет собой некоторый органический радикал. 17. Применение соединений формулы(IVb) или (IVd) по п.1 или получаемых по способу по п.4 в синтезе соединений формулы (V),обладающих ингибиторной активностью в отношение фермента преобразования интерлейкина. 23. Соединения формул (IIIa), (IIIb), (IIIc),(IIId) в качестве новых промежуточных соединений, а также их соли присоединения с кислотами, за исключением формул (IIIа) и (IIIb) по п.8, где R1 - метил.
МПК / Метки
МПК: A61K 38/07, C07D 307/33, C07K 5/10
Метки: этих, получаемые, применение, способом, соединения, соединений, получения, алкилоксифуранона, способ, аминопроизводных, этим
Код ссылки
<a href="https://eas.patents.su/12-2883-sposob-polucheniya-aminoproizvodnyh-alkiloksifuranona-poluchaemye-etim-sposobom-soedineniya-i-primenenie-etih-soedinenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения аминопроизводных алкилоксифуранона, получаемые этим способом соединения и применение этих соединений</a>
Предыдущий патент: Производные гидроксамовой кислоты в качестве ингибиторов металлопротеаз матрикса (мпм)
Следующий патент: Адгезив на основе органических растворителей (варианты)
Случайный патент: Способ и соединение для ингибирования забивания трубопроводов газовыми гидратами












