Замещенные бициклические производные для лечения аномального роста клеток
Номер патента: 5525
Опубликовано: 28.04.2005
Авторы: Моррис Джоэл, Кат Джон Чарльз, Бхаттачариа Самит Кумар
Формула / Реферат
1. Соединение формулы 1

или его фармацевтически приемлемая соль,
где m равно целому числу от 0 до 3;
p равно целому числу от 0 до 4;
каждый из R1 и R2 независимо выбран из H и C1-C6-алкила;
R3 выбран из
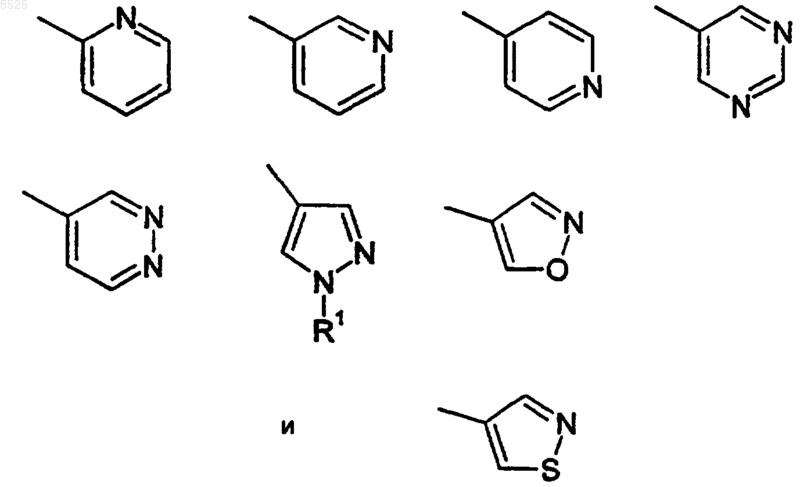
где упомянутые выше R3-группы необязательно замещены 1-3 R8-группами;
R4 представляет -(CR16R17)m-Cу C-(CR16R17)kR13 или -(CR16R17)m-C=C-(CR16R17)kR13, где каждое из k равно целому числу от 1 до 3 и каждое из m равно целому числу от 0 до 3;
каждый из R5 независимо выбран из галогена, гидрокси, NR1R2, C1-C6-алкила, трифторметила, C1-C6-алкокси, трифторметокси, -NR6C(O)R1, -C(O)NR6R7, -SO2NR6R7, -NR6C(O)NR7R1 и -NR6C(O)OR7;
каждый из R6, R6a и R7 независимо выбран из H, C1-C6-алкила, группы -(CR1R2)t(C6-C10-арил) и группы -(CR1R2)t(4-10-членный гетероцикл), где t равно целому числу от 0 до 5, 1 или 2 кольцевых атомов углерода гетероциклической группы необязательно замещены оксо (=O)-группой, алкильные, арильные и гетероциклические группы упомянутых выше R6 и R7-групп необязательно замещены 1-3 заместителями, независимо выбранными из галогена, циано, нитро, -NR1R2, трифторметила, трифторметокси, C1-C6-алкила, C2-C6-алкенила, C2-C6-алкинила, гидрокси и C1-C6-алкокси;
R6 и R7 или R6a и R7, когда они присоединены к одному и тому же атому азота, взятые вместе, могут образовывать 4-10-членное гетероциклическое кольцо, которое может включать 1-3 дополнительных гетерофрагментов, кроме атома азота, к которому указанные R6, R6a и R7 присоединены, выбранных из N, N(R1), O и S, при условии, что два атома O, два атома S и атомы O и S не соединены непосредственно друг с другом;
каждый из R8 независимо выбран из групп: оксо(=O), галоген, циано, нитро, трифторметокси, трифторметил, азидо, гидрокси, C1-C6-алкокси, C1-C10-алкила, C2-C6-алкенила, C2-C6-алкинила, -C(O)R6, -C(O)OR6, -OC(O)R6, -NR6C(O)R7, -NR6SO2NR7R1, -NR6C(O)NR1R7, -NR6C(O)OR7, -C(O)NR6R7, -NR6R7, -NR6OR7, -SO2NR6R7, -S(O)j(C1-C6-алкил) где j равно целому числу от 0 до 2, -(CR1R2)t(C6-C10-арил), -(CR1R2)t(4-10-членный гетероцикл), -(CR1R2)qC(O)(CR1R2)t(C6-C10-арил), -(CR1R2)qC(O)(CR1R2)t(4-10-членный гетероцикл), -(CR1R2)tO(CR1R2)q(C6-C10-арил), -(CR1R2)tO(CR1R2)q(4-10-членный гетероцикл), -(CR1R2)qS(O)j(CR1R2)t(C6-C10-арил) и -(CR1R2)qS(O)j(CR1R2)t(4-10-членный гетероцикл), где j равно 0, 1 или 2; каждое из q и t независимо равно целому числу от 0 до 5; 1 или 2 кольцевых атомов углерода гетероциклических групп упомянутых выше R8-групп необязательно замещены оксо (=O)-фрагментом, и алкильные, алкенильные, алкинильные, арильные и гетероциклические группы упомянутых выше R8 групп необязательно замещены 1-3 заместителями, независимо выбранными из галогена, циано, нитро, трифторметила, трифторметокси, азидо, -OR6, -C(O)R6, -C(O)OR6, -OC(O)R6, -NR6C(O)R7, -C(O)NR6R7, -NR6R7, -NR6OR7, C1-C6-алкила, C2-C6 алкенила, C2-C6 алкинила, групп -(CR1R2)t(C6-C10-арил) и -(CR1R2)t(4-10-членный гетероцикл), где t равно целому числу от 0 до 5;
каждый R11 независимо выбран из заместителей, указанных при определении R8, при условии, что R11 не представляет оксо (=O)-группу;
R12 представляет R6, -OR6, -OC(O)R6, -OC(O)NR6R7, -OCO2R6, -S(O)jR6, -S(O)jNR6R7, -NR6R7, -NR6C(O)R7, -NR6SO2R7, -NR6C(O)NR6aR7, -NR6SO2NR6aR7, -NR6CO2R7, CN, -C(O)R6 или галоген, где j равно целому числу от 0 до 2;
R13 представляет NR1R14 или -OR14;
R14 представляет H, R15, -C(O)R15, -SO2R15, -C(O)NR15R7, -SO2NR15R7 или -CO2R15;
R15 представляет R18, -(CR1R2)t(C6-C10-арил), -(CR1R2)t(4-10-членный гетероцикл), где t равно целому числу от 0 до 5, 1 или 2 кольцевых атомов углерода гетероциклический группы необязательно замещены оксо(=O)-фрагментом и арильная и гетероциклическая группа указанных выше R15-групп необязательно замещены 1-3 R8-заместителями;
каждый из R16 и R17 независимо выбран из H, C1-C6-алкила и -CH2OH или R16 и R17, взятые вместе, представляют -CH2CH2- или -CH2CH2CH2-группу;
R18 представляет C1-C6-алкил, где каждый углерод, не связанный с атомом N или O или с S(O)j, где j равно целому числу от 0 до 2, необязательно замещен R12;
и где любой из вышеупомянутых заместителей, содержащий группы CH3 (метил), CH2 (метилен) или CH (метин), который не связан с галогеном, SO или SO2-группой или с атомами N, O или S, необязательно замещен группой, выбранной из гидрокси, галогена, C1-C4-алкила, C1-C4-алкокси и -NR1R2.
2. Соединение по п.1, где R3 представляет пиридин-3-ил, необязательно замещенный 1-3 группами R8.
3. Соединение по п.1, где следующий структурный фрагмент соединения формулы 1
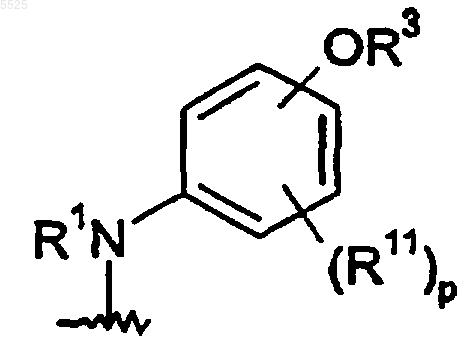
выбран из группы, состоящей из,
3-метил-4-(пиридин-2-илокси)фениламино,
3-хлор-4-(пиридин-2-илокси)фениламино,
3-метокси-4-(пиридин-2-илокси)фениламино,
4-(пиридин-2-илокси)фениламшэю,
2-метил-4-(пиридин-2-илокси)фениламино,
2-метокси-4-(пиридин-2-илокси)фениламино,
3-хлор-4-(6-метилпиридин-2-илокси)фениламино,
3-метокси-4-(6-метилпиридин-2-илокси)фениламино,
3-метил-4-(6-метилпиридин-2-илокси)фениламино,
2-метокси-4-(6-метилпиридин-2-илокси)фениламино,
2-метил-4-(6-метилпиридин-2-илокси)фениламино,
4-(6-метилпиридин-2-илокси)фениламино,
3-метокси-4-(2-метилпиридин-3-илокси)фениламино,
3-метил-4-(2-метилпиридин-3-илокси)фениламино,
3-хлор-4-(2-метилпиридин-3-илокси)фениламино,
2-метокси-4-(2-метилпиридин-3-илокси)фениламино,
2-метил-4-(2-метилпиридин-3-илокси)фениламино,
4-(2-метилпиридин-3-илокси)фениламино,
3-метил-4-(6-метилпиридин-3-илокси)фениламино,
3-хлор-4-(6-метилпиридин-3-илокси)фениламино,
3-метокси-4-(6-метилпиридин-3-илокси)фениламино,
2-метил-4-(6-метилпиридин-3-илокси)фениламино,
2-метокси-4-(6-метилпиридин-3-илокси)фениламино,
4-(6-метилпиридин-3-илокси)фениламино,
3-метил-4-(пиридин-3-илокси)фениламино,
3-хлор-4-(пиридин-3-илокси)фениламино,
3-метокси-4-(пиридин-3-илокси)фениламино,
2-метил-4-(пиридин-3-илокси)фениламино,
2-метокси-4-(пиридин-3-илокси)фениламино,
4-(пиридин-3-илокси)фениламино,
3-метил-4-(2-метилпиримидин-5-илокси)фениламино,
3-хлор-4-(2-метилпиримидин-5-илокси)фениламино,
3-метокси-4-(2-метилпиримидин-5-илокси)фениламино,
2-метил-4-(2-метилпиримидин-5-илокси)фениламино,
2-метокси-4-(2-метилпиримидин-5-илокси)фениламино,
4-(2-метилпиримидин-5-илокси)фениламино,
3-метил-4-(4-метилпиримидин-5-илокси)фениламино,
3-хлор-4-(4-метилпиримидин-5-илокси)фениламино,
3-метокси-4-(4-метилпиримидин-5-илокси)фениламино,
2-метил-4-(4-метилпиримидин-5-илокси)фениламино,
2-метокси-4-(4-метилпиримидин-5-илокси)фениламино,
4-(4-метилпиримидин-5-илокси)фениламино,
3-метил-4-(2-метилпиридин-4-илокси)фениламино,
3-хлор-4-(2-метилпиридин-4-илокси)фениламино,
3-метокси-4-(2-метилпиридин-4-илокси)фениламино,
2-метил-4-(2-метилпиридин-4-илокси)фениламино,
2-метокси-4-(2-метилпиридин-4-илокси)фениламино,
4-(2-метилпиридин-4-илокси)фениламино,
3-метил-4-(пиридин-4-илокси)фениламино,
3-хлор-4-(пиридин-4-илокси)фениламино,
3-метокси-4-(пиридин-4-илокси)фениламино,
2-метил-4-(пиридин-4-илокси)фениламино,
2-метокси-4-(пиридин-4-илокси)фениламино,
4-(пиридин-4-илокси)фениламино,
3-метил-4-(2-метилпиримидин-4-илокси)фениламино,
3-метокси-4-(2-метилпиримидин-4-илокси)фениламино,
3-хлор-4-(2-метилпиримидин-4-илокси)фениламино,
2-метил-4-(2-метилпиримидин-4-илокси)фениламино,
2-метокси-4-(2-метилпиримидин-4-илокси)фениламино,
4-(2-метилпиримидин-4-илокси)фениламино,
3-метил-4-(6-метилпиримидин-4-илокси)фениламино,
3-метокси-4-(6-метилпиримидин-4-илокси)фениламино,
3-хлор-4-(6-метилпиримидин-4-илокси)фениламино,
2-метил-4-(6-метилпиримидин-4-илокси)фениламино,
2-метокси-4-(6-метилпиримидин-4-илокси)фениламино,
4-(6-метилпиримидин-4-илокси)фениламино,
3-метил-4-(пиридазин-3-илокси)фениламино,
3-хлор-4-(пиридазин-3-илокси)фениламино,
3-метокси-4-(пиридазин-3-илокси)фениламино,
2-метил-4-(пиридазин-3-илокси)фениламино,
2-метокси-4-(пиридазин-3-илокси)фениламино,
4-(пиридазин-3-илокси)фениламино,
3-метил-4-(6-метилпиридазин-3-илокси)фениламино,
3-хлор-4-(6-метилпиридазин-3-илокси)фениламино,
3-метокси-4-(6-метилпиридазин-3-илокси)фениламино,
2-метил-4-(6-метилпиридазин-3-илокси)фениламино,
2-метокси-4-(6-метилпиридазин-3-илокси)фениламино,
4-(6-метилпиридазин-3-илокси)фениламино,
3-метил-4-(6-метилпиридазин-4-илокси)фениламино,
3-хлор-4-(6-метилпиридазин-4-илокси)фениламино,
3-метокси-4-(6-метилпиридазин-4-илокси)фениламино,
2-метил-4-(6-метилпиридазин-4-илокси)фениламино,
2-метокси-4-(6-метилпиридазин-4-илокси)фениламино,
4-(6-метилпиридазин-4-илокси)фениламино,
3-метил-4-(3-метилпиридазин-4-илокси)фениламино,
3-хлор-4-(3-метилпиридазин-4-илокси)фениламино,
3-метокси-4-(3-метилпиридазин-4-илокси)фениламино,
2-метил-4-(3-метилпиридазин-4-илокси)фениламино,
2-метокси-4-(3-метилпиридазин-4-илокси)фениламино,
4-(3-метилпиридазин-4-илокси)фениламино,
3-метил-4-(пиридазин-4-илокси)фениламино,
3-хлор-4-(пиридазин-4-илокси)фениламино,
3-метокси-4-(пиридазин-4-илокси)фениламино,
2-метил-4-(пиридазин-4-илокси)фениламино,
2-метокси-4-(пиридазин-4-илокси)фениламино,
4-(пиридазин-4-илокси)фениламино,
3-хлор-4-(1-метил-1H-пиразол-4-илокси)фениламино,
3-метокси-4-(1-метил-1H-пиразол-4-илокси)фениламино,
3-метил-4-(1-метил-1H-пиразол-4-илокси)фениламино,
2-метокси-4-(1-метил-1H-пиразол-4-илокси)фениламино,
2-метил-4-(1-метил-1H-пиразол-4-илокси)фениламино и
4-(1-метил-1H-пиразол-4-илокси)фениламино.
4. Соединение по п.1, где R4 представляет -(CR16R17)m-Cу C-(CR16R17)kR13, где k равно целому числу от 1 до 3, а m равно целому числу от 0 до 3.
5. Соединение по п.1, где R4 представляет -(CR16R17)m-Cу C-(CR16R17)kR13, где k равно целому числу от 1 до 3 и m равно целому числу от 0 до 3, где R13 представляет -NR1R14, где R14 выбран из групп -C(O)R15, -SO2R15 и -C(O)NR15R7.
6. Соединение по п.1, где R4 представляет -(CR16R17)m-C=C-(CR16R17)kR13, где k равно целому числу от 1 до 3 и m равно целому числу от 0 до 3.
7. Соединение по п.1, где R4 представляет -(CR16R17)m-C=C-(CR16R17)kR13, где k равно целому числу от 1 до 3 и m равно целому числу от 0 до 3, где R13 представляет -NR1R14, где R14 выбран из групп -C(O)R15, -SO2R15 и -C(O)NR15R7.
8. Соединение по п.1, где R4 представляет -(CR16R17)m-Cу C-(CR16R17)kR13 или -(CR16R17)m-C=C-(CR16R17)kR13, где k равно целому числу от 1 до 3 и m равно целому числу от 0 до 3, R13 представляет -NR1R14 или -OR14, R14 представляет R15, R15 представляет R18 и R18 представляет C1-C6-алкил, необязательно замещенный -OR6, -S(O)jR6, -NR6R7, -NR6C(O)R7, -NR6SO2R7, -NR6CO2R7, CN, -C(O)R6 или галогеном.
9. Соединение по п.1, выбранное из группы, состоящей из соединений
(+)-[3-метил-4-(пиридин-3-илокси)фенил]-(6-пиперидин-3-илэтинилхиназолин-4-ил)амин;
2-метокси-N-(3-{4-[3-метил-4-(пиридин-3-илокси)фениламино]хиназолин-6-ил}проп-2-инил)ацетамид;
(+)-[3-метил-4-(6-метилпиридин-3-илокси)фенил]-(6-пиперидин-3-илэтинилхиназолин-4-ил)амин;
2-метокси-N-(3-{4-[3-метил-4-(2-метилпиридин-3-илокси)фениламино]хиназолин-6-ил}проп-2-инил)ацетамид;
[3-метил-4-(2-метилпиридин-3-илокси)фенил]-(6-пиперидин-4-илэтинилхиназолин-4-ил)амин;
[3-метил-4-(6-метилпиридин-3-илокси)фенил]-(6-пиперидин-4-илэтинилхиназолин-4-ил)амин;
2-метокси-N-(3-{4-[3-метил-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-ил}проп-2-инил)ацетамид;
2-фтор-N-(3-{4-[3-метил-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-ил}проп-2-инил)ацетамид;
Е-2-метокси-N-(3-{4-[3-метил-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-ил}аллил)ацетамид;
[3-метил-4-(пиридин-3-илокси)фенил]-(6-пиперидин-4-илэтинилхиназолин-4-ил)амин;
2-метокси-N-(1-{4-[3-метил-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-илэтинил}циклопропил)ацетамид;
E-N-(3-{4-[3-хлор-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-ил}аллил)-2-метоксиацетамид;
N-(3-{4-[3-хлор-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-ил}проп-2-инил)ацетамид;
N-(3-{4-[3-метил-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-ил)проп-2-инил)ацетамид;
E-N-(3-{4-[3-хлор-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-ил}аллил)ацетамид;
Е-2-этокси-N-(3-{4-[3-метил-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-ил}аллил)ацетамид;
1-этил-3-(3-{4-[3-метил-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-ил}проп-2-инил)мочевина;
(3-{4-[3-метил-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-ил}проп-2-инил)амид пиперазин-1-карбоновой кислоты;
(+)-(3-{4-[3-метил-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-ил}проп-2-инил)амид 2-гидроксиметилпирролидин-1-карбоновой кислоты;
2-диметиламино-N-(3-{4-[3-метил-4-(пиридин-3-илокси)фениламино]хиназолин-6-ил}проп-2-инил)ацетамид;
E-N-(3-{4-[3-метил-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-ил}аллил)метансульфонамид;
(3-{4-[3-метил-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-ил}проп-2-инил)амид изоксазол-5-карбоновой кислоты;
1-(1,1-диметил-3-{4-[3-метил-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-ил}проп-2-инил)-3-этилмочевина;
и фармацевтически приемлемые соли упомянутых выше соединений.
10. Фармацевтическая композиция для лечения аномального роста клеток у млекопитающих, включающая соединение по п.1 в эффективном для лечения аномального роста клеток количестве и фармацевтически приемлемый носитель.
Текст
005525 Данное изобретение относится к новым бициклическим производным, которые применяются для лечения аномального роста клеток, каким является рак у млекопитающих. Данное изобретение также относится к способу применения таких соединений для лечения аномального роста клеток у млекопитающих, главным образом, у человека и к фармацевтическим композициям, содержащим такие соединения. Известно, что клетка может стать злокачественной вследствие трансформации части ее ДНК в онкоген (то есть в ген, активация которого ведет к образованию клеток злокачественной опухоли). Многие онкогены кодируют белки, являющиеся аберрантными тирозинкиназами, способными вызывать трансформацию клетки. С другой стороны, экспрессия в повышенных количествах нормальной протоонкогенной тирозинкиназы может также привести к пролиферативным нарушениям, иногда заканчивающимся злокачественным фенотипом. Рецепторные тирозинкиназы представляют собой ферменты, которые пронизывают клеточную мембрану и обладают внеклеточным доменом, связывающим факторы роста, такие как эпидермальный фактор роста, трансмембранным доменом и внутриклеточной частью, которая функционирует как киназа для фосфорилирования специфических остатков тирозина в белках и, следовательно, влияет на пролиферацию клеток. Другие рецепторные тирозинкиназы включают c-erbB-2, c-met, tie-2, PDGFr, FGFr иVEGFR. Известно, что такие киназы часто аберрантно экспрессируются, как правило, при раковых новообразованиях человека, таких как рак молочной железы, злокачественные новообразования желудочнокишечного тракта, такие как рак толстой кишки, прямой кишки или рак желудка, при лейкозе и раке яичников, бронхов или поджелудочной железы. Также было показано, что при многих злокачественных образованиях человека, таких как опухоли мозга, легкого, плоскоклеточный рак, рак мочевого пузыря,желудка, молочной железы, головы и шеи, пищевода, при гинекологических опухолях и опухолях щитовидной железы рецептор эпидермального фактора роста (EGFR), обладающий тирозинкиназной активностью, мутирован и/или экспрессирован в повышенных количествах. Соответственно было признано, что ингибиторы рецепторных тирозинкиназ применимы в качестве селективных ингибиторов роста раковых клеток у млекопитающих. Например, эрбстатин, ингибитор тирозинкиназы, селективно уменьшает у бестимусных голых мышей рост трансплантированной карциномы молочной железы человека, которая экспрессирует рецепторные тирозинкиназы эпидермального фактора роста (EGFR), но не действует на рост другой карциномы, которая не экспрессирует EGFрецептор. Таким образом, соединения настоящего изобретения, являющиеся селективными ингибиторами некоторых рецепторных тирозинкиназ, применимы для лечения аномального роста клеток, в частности, рака у млекопитающих. Кроме рецепторных тирозинкиназ, соединения настоящего изобретения могут также проявлять ингибиторную активность против ряда других нерецепторных тирозинкиназ (например: lck, src, abl) или серин/треонинкиназ (например: циклинзависимых киназ). Многие другие соединения, такие как производные стирола, также, по-видимому, обладают свойствами ингибировать тирозинкиназу. В пяти ранее опубликованных Европейских патентах, а именно, в ЕР 0566226 А 1 (опубликованном 20 октября 1993), ЕР 0602851 А 1 (опубликованном 22 июня 1994), ЕР 0635507 А 1 (опубликованном 25 января 1995), ЕР 0635498 А 1 (опубликованном 25 января 1995) и ЕР 0520722 А 1 (опубликованном 30 декабря 1992) сообщается о некоторых бициклических производных, в частности, о производных хиназолина, обладающих антиканцерогенными свойствами вследствие их способности ингибировать тирозинкиназу. В международной заявке на патент WO 92/20642 (опубликованной 26 ноября 1992) также сообщается о некоторых соединениях бис-моно- и бициклических арилов и гетероарилов как ингибиторах тирозинкиназы, которые применяются для ингибирования аномальной пролиферации клеток. В международных заявках на патент WO96/16960 (опубликованной 6 июня 1996),WO 96/09294 (опубликованной 6 марта 1996), WO 97/30034 (опубликованной 21 августа 1997), WO 98/02434 (опубликованной 22 января 1998), WO 98/02437 (опубликованной 22 января 1998) и WO 98/02438 (опубликованной 22 января 1998) также сообщается о замещенных бициклических гетероароматических производных как ингибиторах тирозинкиназы, которые применяются для той же самой цели. В других заявках на патент США 09/488350 (зарегистрированной 20 января 2000) и 09/488378 (зарегистрированной 20 января 2000), обе из которых включены здесь в полном объеме путем ссылки, также сообщается об антиканцерогенных соединениях. Краткое содержание изобретения Настоящее изобретение относится к соединениям формулы 1-1 005525 и к их фармацевтически приемлемым солям, гдеm равно целому числу от 0 до 3; р равно целому числу от 0 до 4; каждый из R1 и R2 независимо выбран из Н и C1-С 6-алкила; где упомянутые выше R3-группы необязательно замещены 1-3-мя R8-группами;R4 представляет -(CR16R17)m-СС-(CR16R17)kR13 или -(CR16R17)m-С=С-(CR16R17)kR13, где каждое из k равно целому числу от 1 до 3, и каждое из m равно целому числу от 0 до 3; каждый из R5 независимо выбран из галогена, гидрокси, NR1R2, C1-С 6-алкила, трифторметила, C1C6-алкокси, трифторметокси, -NR6C(O)OR1, -C(O)NR6R7, -SO2NR6R7, -NR6C(O)NR7R1 и -NR6C(O)OR7; каждый из R6, R6a и R7 независимо выбран из Н, C1-С 6-алкила, группы -(СR1R2)t(С 6-С 10-арил) и группы -(CR1R2)t(4-10-членный гетероцикл), где t равно целому числу от 0 до 5, 1 или 2 кольцевых атомов углерода гетероциклический группы необязательно замещены оксо (=O)-группой, алкильные, арильные и гетероциклические группы упомянутых выше R6 и R7-групп необязательно замещены 1-3-мя заместителями, независимо выбранными из галогена, циано, нитро, -NR1R2, трифторметила, трифторметокси, C1-С 6-алкила, С 2-С 6-алкенила, С 2-С 6-алкинила, гидрокси и C1-С 6-алкокси;R6 и R7 или R6a и R7, когда они присоединены к одному и тому же атому азота, взятые вместе, могут образовывать 4-10-членное гетероциклическое кольцо, которое может включать 1-3 дополнительных гетерофрагментов, кроме атома азота, к которому указанные R6, R6a и R7 присоединены, выбранных из N,N(R1), О и S, при условии, что два атома О, два атома S и атомы О и S не соединены непосредственно друг с другом; каждый из R8 независимо выбран из групп: оксо(=O), галоген, циано, нитро, трифторметокси, трифторметил, азидо, гидрокси, C1-С 6-алкокси, C1-С 10-алкила, С 2-С 6-алкенила, С 2-С 6-алкинила,-C(O)R6, -С(O)OR6, -OC(O)R6, -NR6C(O)R7, -NR6SO2NR7R1,-NR6C(O)NR1R7, -NR6C(O)OR7, -C(O)NR6R7, -NR6R7, -NR6OR7, -SO2NR6R7,-S(O)j(C1-С 6-алкил), где j равно целому числу от 0 до 2,-(СR1R2)t(С 6-С 10-арил), -(CR1R2)t(4-10-членный гетероцикл),-(CR1R2)qC(O)(CR1R2)t(C6-C10-арил),-(CR1R2)qC(O)(CR1R2)t(4-10-членный гетероцикл),1 2 1 2-(CR R )tO(CR R )q(С 6-С 10-арил),-(CR1R2)tO(CR1R2)q(4-10-членный гетероцикл),-(CR1R2)qS(O)j(CR1R2)t(C6-C10-apил) и -(CR1R2)qS(О)j(CR1R2)t(4-10-членный гетероцикл), где j равно 0, 1 или 2; каждое из q и t независимо равно целому числу от 0 до 5; 1 или 2 кольцевых атомов углерода гетероциклических групп упомянутых выше R8-групп необязательно замещены оксо (=O)-фрагментом, и алкильные, алкенильные, алкинильные, арильные и гетероциклические группы упомянутых выше R8 групп необязательно замещены 1-3 заместителями, независимо выбранными из галогена, циано, нитро,трифторметила, трифторметокси, азидо, -OR6, -C(O)R6, -С(О)OR6, -OC(O)R6, -NR6C(O)R7, -C(O)NR6R7,-NR6R7, -NR6OR7, C1-С 6-алкила, С 2-C6 алкенила, C2-C6 алкинила, групп -(CR1R2)t(С 6-С 10-арил) и-(CR1R2)t(4-10-членный гетероцикл), где t равно целому числу от 0 до 5; каждый R11 независимо выбран из заместителей, указанных при определении R8, при условии, что 11R не представляет оксо (=O)-группу;R12 представляет R6, -OR6, -OC(O)R6, -OC(O)NR6R7, -OCO2R6,-S(O)jR6, -S(O)jNR6R7, -NR6R7, -NR6C(O)R7, -NR6SO2R7, -NR6C(O)NR6aR7,-NR6SO2NR6aR7, -NR6CO2R7, CN, -C(O)R6 или галоген, где j равно целому числу от 0 до 2;R15 представляет R18, -(CR1R2)t(С 6-С 10-арил), -(CR1R2)t(4-10-членный гетероцикл), где t равно целому числу от 0 до 5, 1 или 2 кольцевых атомов углерода гетероциклический группы необязательно заме-2 005525 щены оксо(=O)-фрагментом, и арильная и гетероциклическая группа указанных выше R15-групп необязательно замещены 1-3 R8-заместителями; каждый из R16 и R17 независимо выбран из Н, C1-С 6-алкила и -СН 2 ОН, или R16 и R17, взятые вместе,представляют -CH2CH2- или -СН 2 СН 2 СН 2-группу;R18 представляет C1-С 6-алкил, где каждый углерод, несвязанный с атомом N или О или с S(O)j, где j равно целому числу от 0 до 2, необязательно замещен R12; и где любой из вышеупомянутых заместителей, содержащий группы СН 3(метил), СН 2(метилен) или СН(метин), который не связан с галогеном, SO или SO2-группой или с атомами N, О или S, необязательно замещен группой, выбранной из гидрокси, галогена, С 1-С 4-алкила, С 1-С 4-алкокси и -NR1R2. Еще один конкретный пример соединений формулы 1 включает те соединения, где R3 представляет пиридин-3-ил, необязательно замещенный 1-3 R8-группами. Еще один конкретный пример соединений формулы 1 включает те соединения, в которых следующая часть структурной формулы соединения формулы 1-4 005525 Еще один конкретный пример соединений формулы 1 включает соединения, в которых R4 представляет -(CR16R17)m-CC-(CR16R17)kR13, где k равно целому числу от 1 до 3; m равно целому числу от 0 до 3. Еще один конкретный пример соединений формулы 1 включает соединения, в которых R4 представляет -(CR16R17)m-C=C-(CR16R17)kR13, где k равно целому числу от 1 до 3; m равно целому числу от 0 до 3; R13 представляет -NR1R14, где R14 выбран из -C(O)R15, -SO2R15 и C(O)NR15R7. Еще один конкретный пример соединений формулы 1 включает соединения, в которых R4 представляет -(CR16R17)m-С=С-(CR16R17)kR13, где k равно целому числу от 1 до 3; m равно целому числу от 0 до 3. Еще один конкретный пример соединений формулы 1 включает соединения, в которых R4 представляет -(CR16R17)m-C=C-(CR16R17)kR13, где k равно целому числу от 1 до 3; m равно целому числу от 0 до 3; R13 представляет -NR1R14, где R14 выбран из -C(O)R15, -SO2R15 и -C(O)NR15R7. Еще один конкретный пример соединений формулы 1 включает соединения, в которых R4 представляет -(CR16R17)m-CC-(CR16R17)kR13 или -(CR16R17)m-C=C-(CR16R17)kR13, где k равно целому числу от 1 до 3; m равно целому числу от 0 до 3; R13 представляет -NR1R14 или-OR14; R14 представляет R15, R15 представляет R18, и R18 представляет C1-С 6-алкил, необязательно замещенный группами -OR6, -S(O)jR6, -NR6R7, -NR6C(O)R7, -NR6SO2R7, -NR6CO2R7, CN, -C(O)R6 или галогеном. Конкретные предпочтительные соединения согласно настоящему изобретению включают соединения, выбранные из группы, содержащей(3-4-[3-метил-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-илпроп-2-инил)амид изоксазол-5-карбоновой кислоты; 1-(1,1-диметил-3-4-[3-метил-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-илпроп-2 инил)-3-этилмочевина; и фармацевтически приемлемые соли упомянутых выше соединений. Данное изобретение также относится к фармацевтической композиции для лечения аномального роста клеток у млекопитающих, включая человека, содержащей соединение формулы 1, описанное вы-5 005525 ше, или его фармацевтически приемлемую соль в количестве, эффективном для лечения аномального роста клеток, и фармацевтически приемлемый носитель. В одном из воплощений указанной композиции,указанный аномальный рост клеток представляет рак, включая, но не ограничиваясь перечисленным, рак легкого, рак кости, рак поджелудочной железы, рак кожи, опухоли головы или шеи, кожную или внутриглазную меланому, рак матки, рак яичника, рак прямой кишки, рак анальной области, рак желудка, рак толстой кишки, рак молочной железы, рак матки, карциному фаллопиевых труб, карциному эндометрия,карциному шейки матки, карциному влагалища, карциному вульвы, болезнь Ходжкина, рак пищевода,рак тонкой кишки, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечника, саркому мягких тканей, рак уретры, рак полового члена, рак простаты, хроническую или острую лейкемию, лимфолимфомы, рак мочевого пузыря, рак почки или мочеточника, карциному клеток почечного эпителия, карциному почечной лоханки, неоплазмы (опухоли) центральной нервной системы(ЦНС), первичную лимфому ЦНС, опухоли позвоночника, глиому ствола мозга, аденому гипофиза или сочетание одного или более вышеперечисленных новобразований. При другом воплощении указанной фармацевтической композиции указанный аномальный рост клеток представляет доброкачественное пролиферативное заболевание, включая, но не ограничиваясь перечисленным, псориаз, доброкачественную гипертрофию простаты или рестеноз. Изобретение также относится к фармацевтической композиции для лечения аномального роста клеток у млекопитающих, включая человека, содержащей соединение формулы 1, описанное выше, или его фармацевтически приемлемую соль в количестве, эффективном для лечения аномального роста клеток, в сочетании с фармацевтически приемлемым носителем и противоопухолевым агентом, выбранным из группы, состоящей из митотических ингибиторов, алкилирующих агентов, антиметаболитов, интеркалирующих антибиотиков, ингибиторов фактора роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, модификаторов биологического ответа, антигормонов и антиандрогенов. В фармацевтических композициях, описанных здесь, вместе с соединением формулы 1 можно применять антиангиогенные средства, такие как ингибиторы ММР-2 (матриксной металлопротеиназы-2),ингибиторы ММР-9 (матриксной металлопротеиназы-9) и ингибиторы СОХ-II (циклооксигеназы II). Примеры применяемых ингибиторов COX-II включают CELEBREX (alecoxib), вальдекоксиб (valdecoxib) и рофекоксиб(rofecoxib). Примеры применения ингибиторов матриксной металлопротеиназы описаны в заявках WO 96/33172 (опубликованной 24 октября 1996), WO 96/27583 (опубликованной 7 марта 1996), в заявке на европейский патент 97304971.1 (зарегистрованной 8 июля 1997), в заявке на европейский патент 99308617.2 (зарегистрированной 29 октября, 1999), в заявках WO 98/07697 (опубликованной 26 февраля 1998), WO 98/03516 (опубликованной 29 января 1998), WO 98/34918 (опубликованной 13 августа 1998), WO 98/34915 (опубликованной 13 августа 1998), WO 98/33768 (опубликованной 6 августа 1998), WO 98/30566 (опубликованной 16 июля 1998), в публикации европейского патента 606046(опубликованной 13 июля 1994), в публикации европейского патента 931788 (опубликованной 28 июля 1999), в заявках WO 90/05719 (опубликованной 31 мая 1990), WO 99/52910 (опубликованной 21 октября 1999), WO 99/52889 (опубликованной 21 октября 1999), WO 99/29667 (опубликованной 17 июня 1999), в международной заявке РСТPCT/IB98/01113 (зарегистрированной 21 июля 1998), в заявке на европейский патент 99302232.1 (зарегистрированной 25 марта 1999), в заявке на патент Великобритании номер 9912961.1 (зарегистрированной 3 июня 1999), в предварительной заявке на патент США 60/148464(зарегистрированной 12 августа 1999), в патенте США 5863949 (выданном 26 января 1999), в патенте США 5861510 (выданном 19 января 1999) и в публикации европейского патента 780386 (опубликованном 25 июня 1997), каждый из которых включен здесь в полном объеме путем ссылки. Предпочтительными ингибиторами ММР-2 и ММР-9 являются ингибиторы, обладающие слабой ингибирующей активностью к ММР-1 или вовсе ей не обладающие. Более предпочтительными являются ингибиторы, селективно ингибирующие ММР-2 и/или ММР-9, по сравнению с другими матриксными металлопротеиназами (то есть, ММР-1, ММР-3, ММР-4, ММР-5, ММР-6, ММР-7, ММР-8, ММР-10, ММР-11, ММР-12 и ММР-13). Некоторыми конкретными примерами ММР-ингибиторов, применяемых в сочетании с соединениями согласно настоящему изобретению, являются AG-3340, RO 32-3555, RS 13-0830 и соединения,указанные в следующем списке: 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил)амино]пропионовая кислота; гидроксиамид 3-экзо-3-[4-(4-фторфенокси)бензолсульфониламино]-8-оксабицикло[3.2.1]октан-3 карбоновой кислоты; гидроксиамид-6 005525 гидроксиамид 4-[4-(4-хлорфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; гидроксиамид 3-[4-(4-хлорфенокси)бензолсульфониламино]тетрагидропиран-3-карбоновой кислоты; гидроксиамид (2R,3R)-1-[4-(4-фтор-2-метилбензилокси)бензолсульфонил]-3-гидрокси-3-метилпиперидин-2-карбоновой кислоты; 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоил-1-метилэтил)амино]пропионовая кислота; 3-4-(4-фторфенокси)бензолсульфонил]-(4-гидроксикарбамоилтетрагидропиран-4-ил)амино]пропионовая кислота; гидроксиамид 3-экзо-3-[4-(4-хлорфенокси)бензолсульфониламино]-8-оксабицикло[3.2.1]октан-3 карбоновой кислоты; гидроксиамид 3-эндо-3-[4-(4-фторфенокси)бензолсульфониламино]-8-оксабицикло[3.2.1]октан-3 карбоновой кислоты; и гидроксиамид 3-[4-(4-фторфенокси)бензолсульфониламино]тетрагидрофуран-3-карбоновой кислоты; и фармацевтически приемлемые соли указанных соединений. Соединения формулы 1 и их фармацевтически приемлемые соли также могут применяться в сочетании с ингибиторами передачи сигнала, такими как средства, ингибирующие EGFR-ответы (рецептора эпидермального фактора роста), такими как EGFR-антитела, EGF-антитела и молекулы, являющиеся ингибиторами EGFR; с ингибиторами VEGF (васкулярно-эндотелиального фактора роста); и с ингибиторами erbB2-рецепторов, такими как органические молекулы или антитела, которые связываются с еrbВ 2-рецептором, например, HERCEPTIN (Genentech, Inc. South San Francisco, Калифорния, США). Ингибиторы EGFR описаны, например в заявке WO 95/19970 (опубликованной 27 июля 1995), WO 98/14451 (опубликованной 9 апреля 1998), WO 98/02434 (опубликованной 22 января 1998) и в патенте США 5747498 (выданным 5 мая 1998). EGFR-ингибирующие агенты включают, но не ограничиваются перечисленным, моноклональные антитела С 225 и анти-EGFR 22Mab (ImClone Systems Incorporated ofNew York, Нью-Йорк, США), соединения ZD-1839 (AstraZeneca), BIBX-1382 (Boehringer Ingelheim),MDX-447 (Medarex Inc. Annandale, Нью-Джерси, США) и OLX-103 (MerckCo. of Whitehouse Station,Нью-Джерси, США), VRCTC-310 (Ventech Research) и связанный с EGF токсин (Seragen Inc. of Hopkinton, Массачусетс). С соединением формулы 1 также можно объединять ингибиторы VEGF, например, SU-5416 и SU6668 (Sugen Inc. of South San Francisco, Калифорния, США). Ингибиторы VEGF описаны, например, в заявке WO 99/24440 (опубликованной 20 мая 1999), международной заявке PCT/IB99/00797 (зарегистрированной 3 мая 1999), в заявке WO 95/21613 (опубликованной 17 августа 1995), WO 99/61422 (опубликованной 2 декабря 1999), в патенте США 5834504 (выданном 10 ноября 1998), в заявке WO 98/50356(опубликованной 22 января 1998), каждая из которых включена здесь в полном объеме путем ссылки. Другими примерами некоторых специфических VEGF-ингибиторов являются IM862 (Cytran Inc. ofKirkland, Вашингтон, США); анти-VEGF моноклональное антитело Genentech Inc. of South San Francisco,Калифорния; и ангиозим, синтетический рибозим от Ribozyme (Boulder, Колорадо) и Chiron (Emeryville,Калифорния). В сочетании с соединением формулы 1 можно вводить ингибиторы ЕrbВ 2-рецепторов, такие какWoodlands, Техас, США) и 2 В-1 (Chiron). Такие еrbВ 2-ингибиторы включают ингибиторы, описанные в заявках WO 98/02434 (опубликованной 22 января 1998), WO 99/35146 (опубликованной 15 июля 1999),WO 99/35132 (опубликованной 15 июля 1999), WO 98/02437 (опубликованной 22 января 1998), WO 97/13760 (опубликованной 17 апреля 1997), WO 95/19970 (опубликованной 27 июля 1995), в патенте США 5587458 (выданном 24 декабря 1996) и в патенте США 5877305 (выданном 2 марта 1999), каждый из которых включен здесь в полном объеме путем ссылки. Ингибиторы ЕrbВ 2-рецепторов, применяемые в настоящем изобретении, также описаны в предварительной заявке на патент 60/117341, зарегистрированной 27 января 1999, и в предварительной заявке на патент 60/117346, зарегистрированной 27 января 1999, каждая из которых включена здесь в полном объеме путем ссылки. Другие противопролиферативные средства, которые можно применять совместно с соединениями настоящего изобретения, включают ингибиторы фермента фарнезилпротеинтрансферазы и ингибиторы рецепторной тирозинкиназы PDGFr, включая соединения, описанные и заявленные в следующих заявках-7 005525 на патент США: 09/221946 (зарегистрированной 28 декабря 1998); 09/454058 (зарегистрированной 2 декабря 1999); 09/501163 (зарегистрированной 9 февраля 2000); 09/539930 (зарегистрированной 31 марта 2000); 09/202796 (зарегистрированной 22 мая 1997); 09/384339 (зарегистрированной 26 августа 1999) и 09/383755 (зарегистрированной 26 августа 1999); и соединения, описанные и заявленные в следующих предварительных заявках на патент США: 60/168207 (зарегистрированной 30 ноября 1999); 60/170119(зарегистрированной 10 декабря 1999); 60/177718 (зарегистрированной 21 января 2000); 60/168217 (зарегистрированной 30 ноября 1999) и 60/200834 (зарегистрированной 1 мая 2000). Каждая из упомянутых выше заявок на патент и предварительных заявок на патент включена здесь в полном объеме путем ссылки. Соединение формулы 1 также можно применять с другими средствами, применяемыми для лечения аномального роста клеток или рака, включая, но не ограничиваясь перечисленным, агенты, способные усиливать противоопухолевые иммунные ответы, такие как CTLA4 (цитотоксичный лимфоцитарный антиген-4)-антитела, и другие средства, способные блокировать CTLA4; противопролиферативные средства, такие как другие ингибиторы фарнезилпротеинтрансферазы, например ингибиторы фарнезилпротеинтрансферазы, описанные в ссылках, цитируемых ранее в разделе предшествующий уровень техники. Специфические CTLA4-антитела, которые можно применять в настоящем изобретении, включают антитела, описанные в предварительной заявке на патент США 60/113647 (зарегистрированной 23 декабря 1998), которая включена здесь в полном объеме путем ссылки. Термин аномальный рост клеток в применяемом здесь значении, если не оговорено иначе, относится к росту клеток, который не зависит от нормальных регуляторных механизмов (например, потери контактного торможения). Он включает аномальный рост: (1) клеток опухоли (опухолей), которые пролиферируют путем экспрессии мутированной тирозинкиназы или экспрессии рецепторной тирозинкиназы в повышенных количествах; (2) доброкачественных и злокачественных клеток при других пролиферативных заболеваниях, при которых происходит активация аберрантной тирозинкиназы; (3) любых опухолей, в пролиферации которых участвуют рецепторные тирозинкиназы; (4) любых опухолей, пролиферация которых связана с активацией аберрантной серин/треонинкиназы; и (5) доброкачественных и злокачественных клеток при других пролиферативных заболеваниях, в которых происходит активация аберрантной серин/треонинкиназы. Термин лечение в применяемом здесь значении, если не оговаривается иначе, означает реверсию,облегчение, торможение развития (болезни), или предотвращение заболевания или состояния, к которому такой термин применяется, или одного или более симптомов такого заболевания или состояния. Термин курс лечения, в применяемом здесь значении, если не оговаривается иначе, относится к проведению лечения, в том смысле как непосредственно лечение определяется выше. Термин галоген в применяемом здесь значении, если не оговаривается иначе, включает фтор,хлор, бром или йод. Предпочтительно галогены представляют фтор и хлор. Термин алкил в применяемом здесь значении, если не оговаривается иначе, включает насыщенные одновалентные углеводородные радикалы, содержащие фрагменты с прямой цепью, циклические(включая моно- или многоядерные фрагменты) или фрагменты с разветвленной цепью. Подразумевается,что указанная алкильная группа для включения циклических фрагментов должна содержать, по меньшей мере, три атома углерода. Термин циклоалкил в применяемом здесь значении, если не оговаривается иначе, включает насыщенные одновалентные углеводородные радикалы, содержащие циклические (включая моно- или многоядерные) фрагменты. Термин алкенил в применяемом здесь значении, если не оговаривается иначе, включает алкильные группы, указанные выше, имеющие по меньшей мере одну двойную связь углерод-углерод. Термин алкинил в применяемом здесь значении, если не оговаривается иначе, включает алкильные группы, указанные выше, имеющие по меньшей мере одну тройную связь углерод-углерод. Термин арил в применяемом здесь значении, если не оговаривается иначе, включает органический радикал, такой как фенил или нафтил, полученный из ароматического углеводорода при удалении одного атома водорода. Термин алкокси в применяемом здесь значении, если не оговаривается иначе, включает группы-O-алкил, где алкил имеет такое же значение, как указано выше. Термин 4-10-членный гетероцикл в применяемом здесь значении, если не оговаривается иначе,включает ароматические и неароматические гетероциклические группы, содержащие один или более гетероатомов, каждый из которых выбран из О, S и N, где каждая гетероциклическая группа имеет в кольцевой системе от 4 до 10 атомов. Неароматические гетероциклические группы включают группы,содержащие только 4 атома в кольцевой системе, однако, ароматические гетероциклические группы должны содержать, по меньшей мере, 5 атомов в кольцевой системе. Гетероциклические группы включают конденсированные с бензолом кольцевые системы и кольцевые системы, замещенные одним или более оксофрагментами. Примером 4-членной гетероциклической группы является азетидинил (производное азетидина). Примером 5-членной гетероциклической группы является тиазолил, и примером 10 членной гетероциклической группы является хинолинил. Примерами неароматических гетероцикличе-8 005525 ских групп являются пирролидинил, тетрагидрофуранил, тетрагидротиенил, тетрагидропиранил, тетрагидротиопиранил, пиперидино, морфолино, тиоморфолино, тиоксанил, пиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, 1,2,3,6 тетрагидропиридинил, 2-пирролинил, 3-пирролинил, индолинил, 2 Н-пиранил, 4 Н-пиранил, диоксанил,1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, пиразолидинил, имидазолинил, имидазолидинил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил, 3 Н-индолил и хинолизинил. Примерами ароматических гетероциклических групп являются пиридинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил. Упомянутые выше группы, производные от перечисленных выше соединений, могут присоединяться к атому С или присоединяться к атому N, где это возможно. Например, группа, производная от пиррола,может быть группой пиррол-1-ил (присоединенной по N) или пиррол-3-ил (присоединенной по С). Термин Me означает метил, Et означает этил и Ас означает ацетил. При данном выше определении X1, фрагменты -(CR1R2)m и (CR16R17)k и другие подобные фрагменты, указанные выше, могут варьироваться при определении R1, R2, R16 и R17 для каждой итерации нижнего индекса (то есть, m, k и т.д) более чем на 1. Таким образом, -(CR1R2)m-, когда m равно 2, может включать -СН 2 С(Ме)(Et). Фраза фармацевтически приемлемая соль(соли) в применяемом здесь значении, если не указано иное значение, включает кислые или основные соли, которые могут присутствовать в соединениях согласно настоящему изобретению. Соединения настоящего изобретения, имеющие основной характер,способны к образованию широкого ряда солей с различными неорганическими и органическими кислотами. Кислоты, которые можно применять для получения фармацевтически приемлемых кислотноаддитивных солей таких основных соединений, представляют кислоты, которые образуют нетоксичные кислотно-аддитивные соли, то есть соли, содержащие фармакологически приемлемые анионы, такие как хлористо-водородные, бромисто-водородные, иодисто-водородные соли, нитраты, сульфаты, бисульфаты, фосфаты, кислые фосфаты, изоникотинаты, ацетаты, лактаты, салицилаты, цитраты, кислые цитраты,тартраты, пантотенаты, битартраты, аскорбаты, сукцинаты, малеаты, гентизинаты, фумараты, глюконаты, глюкуронаты, сахараты, формиаты, бензоаты, глютаматы, метансульфонаты, этансульфонаты, бензолсульфонаты, п-толуолсульфонаты и памоаты [то есть 1,1'-метилен-бис-(2-гидрокси-3-нафтоаты)]. Соединения настоящего изобретения, которые содержат основную группу, такую как аминогруппа, кроме кислот, упомянутых выше, могут образовывать фармацевтически приемлемые соли с различными аминокислотами. Те соединения настоящего изобретения, которые имеют кислый характер, способны образовывать основные соли с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных металлов или щелочно-земельных металлов и в частности, кальциевые, магниевые,натриевые и калиевые соли соединений настоящего изобретения. Некоторые функциональные группы, содержащиеся в соединениях настоящего изобретения, могут быть замещены на биоизостерические группы, то есть группы, которые имеют похожие пространственные или электронные условия по отношению к исходной группе, но отличаются или улучшенными физико-химическими, или другими свойствами. Подходящие примеры хорошо известны специалистам в данной области и включают, но не ограничены фрагментами, описанными в публикации Patini и др.,Chem. Rev., 1996, 96, 3147-3176 и в цитируемых там ссылках. Подробное описание изобретения Общие способы синтеза, которые могут касаться получения соединений настоящего изобретения,описаны в патенте США 5747498 (выданном 5 мая 1998), в заявке на патент США с порядковым номером 08/953078 (зарегистрированной 17 октября 1997), в заявках WO 98/02434 (опубликованной 22 января 1998), WO 98/02438 (опубликованной 22 января 1998), WO 96/40142 (опубликованной 19 декабря 1996),WO 96/09294 (опубликованной 6 марта 1996), WO 97/03069 (опубликованной 30 января 1997), WO 95/19774 (опубликованной 27 июля 1995) и WO 97/13771 (опубликованной 17 апреля 1997). Дополнительные методики упоминаются в заявках на патент США 09/488350 (зарегистрированной 20 января 2000) и 09/488378 (зарегистрированной 20 января 2000). Упомянутые выше патенты и заявки на патенты включены здесь в полном объеме в качестве ссылки. В соответствии с известными способами можно получить некоторые исходные материалы и осуществить некоторые модификации синтеза в соответствии со способами, известными специалистам в данной области. Стандартная методика получения 6 иодхиназолинона описана в публикации Stevenson T.M., Kazmierczak F., Leonard N.J., J. Org. Chem. 1986,51, 5, р.616. Катализируемые палладием сочетания бороновой кислоты описаны в публикации MiyauraN., Yanagi Т., Suzuki A., Syn. Comm. 1981, 11, 7, р.513. Катализируемые палладием сочетания по Хеку(Heck) описаны в публикации Heck и др., Organic Reactions, 1982, 27, 345 или в публикации Cabri и др. в Асc. Chem. Res., 1995, 28, 2. Примеры катализируемых палладием сочетаний алкинов с концевыми группами с арилгалогенидами приведены в публикациях: Castro и др., J.Org.Chem. 1963, 28, 3136 или Sonogashira и др. Synthesis, 1977, 777. Синтез алкинов с концевыми группами можно провести, применяя соответственно замещенные/защищенные альдегиды, как описано в публикациях: Colvin E.W.J. и др., Chem.Soc. Perkin Trans.I, 1977, 869; Gilbert J.C. и др., J. Org. Chem., 47, 10, 1982; Hauske J.R. и др., Tet. Lett., 33,26, 1992, 3715; Ohira S. и др., J. Chem. Soc. Chem.Commun., 9, 1992, 721; Trost B.M., J.Amer. Chem.Soc.,119, 4, 1997, 698; или Marshall J.A. и др., J. Org. Chem., 62, 13, 1997, 4313. Альтернативно алкины с концевыми группами можно получить по двухстадийной методике. Сначала добавляют TMS(триметилсилил)ацетиленид лития к соответственно замещенному/защищенному альдегиду, как описано в публикации: Nakatani К. и др., Tetrahedron, 49, 9, 1993, 1901. Затем для выделения промежуточного алкина с концевой группой можно применить последующее снятие защиты основанием, как описано в публикации Malacria M.; Tetrahedron, 33, 1977, 2813; или в публикации White J.D. и др., Tet. Lett., 31, 1, 1990, 59. Исходные материалы, синтез которых специально не описывается выше, или имеются в продаже,или могут быть получены известными специалистам в данной области способами.- 10005525 В каждой из реакций, обсуждаемых выше или проиллюстрированных на схемах, если не оговорено иначе, давление не является критическим. В общем случае приемлемо давление около 0,5-5 атмосфер, а предпочтительным является давление окружающей среды, то есть около 1 атмосферы, как наиболее удобное. Со ссылкой на приведенную выше схему 1, соединение формулы 1 можно получить взаимодействием соединения формулы D, где R4 и R5 имеют такие же значения, как указано выше, с амином формулы Е, где R1, R3 и R11 имеют такие же значения, как указано выше, в безводном растворителе, в частности, в растворителе, выбранном из DMF (N,N-диметилформамида), DME (этиленгликольдиметилового простого эфира), DCE (дихлорэтана), трет-бутанола и фенола, или в смеси упомянутых растворителей при температуре в пределах приблизительно 50-150 С в течение периода времени 1-48 ч. Гетероарилоксианилины формулы Е можно получить с помощью известных специалистам в данной области способами, таких как восстановление соответствующих промежуточных нитросоединений. Восстановление нитрогрупп ароматического кольца можно провести согласно способам, описанным в общих чертах в публикациях: Brown R.K., Nelson N.A., J.Org.Chem., 1954, р.5149; Yuste R., Saldana M., Walls F., Tet.Lett.,1982, 23, 2, р.147; или в WO 96/09294, упомянутой выше. Подходящие производные гетероарилоксинитробензола можно получить из галогеннитробензольных предшественников при нуклеофильном замещении галогена соответствующим спиртом, как описано в публикациях: Dinsmore C.J. и др., Bioorg. Med.Chem. Lett., 7, 10, 1997, 1345; Loupy А. и др., Synth. Commun., 20, 18, 1990, 2855; или Brunelle D.J.,Tet.Lett., 25, 32, 1984, 3383. Соединения формулы Е, в которых R1 представляет С 1-С 6-алкильную группу,можно получить при восстановительном аминировании исходного анилина с участием R1CH(O). Соединение формулы D можно получить обработкой соединения формулы С, где Z1 представляет активную группу, такую как бром, иод, -N2, или -OTf (который представляет группу -ОSО 2 СF3), или предшественников активной группы, таких как NO2, NH2 или ОН, агентом сочетания, таким как концевые алкиновые или алкеновые группы, винилгалоген, винилстаннан, винилборан, алкилборан, алкил- или алкенилцинковый реагент. Соединение формулы С можно получить обработкой соединения формулы В хлорирующим агентом, таким как РОСl3, SOCl2 или СlС(О)С(О)Сl/ДМФ(DMF) в галогенированном растворителе при температуре около 60-150 С в течение приблизительно 2-24 ч. Соединения формулы В можно получить из соединения формулы А, где Z1 имеет такое же значение, как описано выше, a Z2 представляетNH2, C1-C6-алкокси или ОН в соответствии с одной из методик, описанных в публикации WO 95/19774,упомянутой выше. Любое соединение формулы 1 может быть преобразовано в другое соединение формулы 1 при помощи стандартных манипуляций с R4-группой. Такие способы известны специалистам в данной области и включают: а) удаление защитной группы с помощью способов, описанных в общих чертах в публикации T.W. Greene и P.G.M. Wuts, Protective Groups in Organic Synthesis Second Edition, John Wiley andSons, New York, 1991; b) замещение удаляемой группы (галогена, мезилата, тозилата и т.д) первичным или вторичным амином, тиолом или спиртом с образованием вторичного или третичного амина, простого тиоэфира или простого эфира, соответственно; с) обработка фенилкарбаматов или (замещенных фенил)карбаматов первичными или вторичными аминами с образованием соответствующей мочевины, как описано в публикации Thavonekham В. и др., Synthesis (1997), 10, р.1189; d) восстановление пропаргилового или гомопропаргилового спиртов, или N-BOC-защищенных первичных аминов до производных Еаллила или Е-гомоаллила при обработке бис-(2-метоксиэтокси)алюмогидридом натрия (красным Аl), как описано в публикациях Denmark S.E.; Jones Т.К. J. Org. Chem. (1982) 47, 4595-4597 или van BenthemR.A.T.M.; Michels J.J.; Speckamp W.N., Synlett (1994), 368-370; е) восстановление алкинов до соответствующих производных Z-алкенов при обработке газообразным водородом в присутствии Pd-катализатора,как описано в публикации Tomassy В. и др., Synth.Commun. (1998), 28, р.1201; f) обработка первичных и вторичных аминов изоцианатом, хлоридом карбоновой кислоты (или другим активированным производным карбоновой кислоты), алкил/арилхлорформиатом или сульфонилхлоридом до получения соответствующих мочевины, амида, карбамата или сульфонамида; g) восстановительное аминирование первичного или вторичного амина с применением R1 СН(O); и h) обработка спиртов изоцианатом, хлоридом карбоновой кислоты (или другим активированным производным карбоновой кислоты), алкил/арилхлорформиатом или сульфонилхлоридом до получения соответствующих карбамата, сложного эфира, карбоната или сложного эфира сульфоновой кислоты. Соединения формул 1, имеющие основной характер, способны к образованию широкого ряда солей с различными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, часто на практике желательно сначала выделить соединение формулы 1 из реакционной смеси в виде фармацевтически неприемлемой соли и затем последнюю просто преобразовать обратно до свободного основного соединения, обрабатывая щелочным реагентом и затем преобразовывая полученное свободное основание до фармацевтически приемлемой кислотноаддитивной соли. Кислотно-аддитивные соли основных соединений данного изобретения легко получить, обрабатывая основное соединение по существу эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. После осторожного выпаривания растворителя легко получается- 11005525 требуемая твердая соль. Требуемую кислую соль можно также осадить из раствора свободного основания в органическом растворителе при добавлении к раствору соответствующей минеральной или органической кислоты. Те соединения формулы 1, которые являются кислыми по характеру, способны образовывать основные соли с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных металлов или щелочно-земельных металлов и в частности, соли натрия и калия. Все такие соли получают обычными способами. Химические основания, применяемые в качестве реагентов для получения фармацевтически приемлемых основных солей данного изобретения, представляют основания, которые образуют нетоксичные основные соли с кислыми соединениями формулы 1. Такие нетоксичные основные соли включают фармакологически приемлемые соли таких катионов, как натрий, калий, кальций, магний и т.д. Такие соли можно легко получить, обрабатывая соответствующие кислые соединения водным раствором, содержащим требуемые фармакологически приемлемые катионы, и затем упаривая полученный раствор досуха, предпочтительно при пониженном давлении. Альтернативно их также можно получить при совместном перемешивании растворов кислых соединений в низших спиртах и алкоксида (алкоголята) требуемого щелочного металла, и затем упаривая полученный раствор досуха также как прежде. В любом случае предпочтительно использовать стехиометрические количества реагентов, чтобы гарантировать полноту реакции и максимальный выход требуемого конечного продукта. Так как отдельное соединение настоящего изобретения может включать более чем один кислый или основной фрагмент(часть), соединения настоящего изобретения одновременно могут являться моно-, диили трисолями. Соединения настоящего изобретения являются сильными ингибиторами erbB-семейств, а онкогенных и протоонкогенных тирозинпротеинкиназ, в частности, еrbВ 2, и поэтому все они подходят для терапевтического применения в качестве противопролиферативных средств (например, противораковых) для млекопитающих, особенно для человека. В частности, соединения настоящего изобретения применимы для предотвращения и лечения ряда гиперпролиферативных заболеваний у человека, таких как злокачественные и доброкачественные опухоли печени, почки, мочевого пузыря, молочной железы, желудка,яичника, толстой и прямой кишки, простаты, поджелудочной железы, легкого, вульвы, щитовидной железы, карцином печени, сарком, глиобластом, опухолей головы и шеи и других гиперпластических состояний, таких как доброкачественная гиперплазия кожи (например, псориаз) и доброкачественная гиперплазия простаты (например, ВРН). Кроме того, ожидается, что соединение настоящего изобретения может обладать активностью против ряда лейкемий и лимфоидных злокачественных новообразований. Соединения настоящего изобретения также можно применять для лечения аддитивных заболеваний, в которые вовлечены аберрантная экспрессия лиганд/рецепторных взаимодействий или активация,или явления передачи сигнала, связанные с различными тирозинпротеинкиназами. Такие заболевания могут включать заболевания нейронной, глиальной, астроцитальной природы, расстройства гипоталамуса и другие гландулярные расстройства, заболевания макрофагальной, эпителиальной, стромальной и бластоцельной природы, в которые вовлечены аберрантная функция, экспрессия, активация или передача сигнала еrbВ-тирозинкиназ. Кроме того, соединения настоящего изобретения могут иметь терапевтическое применение при воспалительных, ангиогенных и иммунологических расстройствах, в которые вовлечены не только идентифицированные, но и пока еще неидентифицированные тирозинкиназы, которые ингибируются соединениями настоящего изобретения. Активность in vitro соединений формулы 1 можно определить по следующей методике. Анализ с-еrbВ 2-киназы проводили в соответствии с методикой, описанной ранее в публикацииSchrang и др., Anal. Biochem. 211, 1993, р.233-239. 96-луночные планшеты Nunc MaxiSorp заполнялись из расчета 100 мл на лунку раствором 0,25 мг/мл Poly (Glu, Туr): (PGT) Sigma Chemical Co., St.Louis, МО), в соотношении 4:1 в РВS(фосфорном буферном солевом растворе) и инкубировались в течение ночи при 37 С. Избыток PGT удаляли путем аспирации и трижды промывали планшет буферным раствором (0,1%Tween-20 в PBS). Киназную реакцию проводили в 50 мл 50 мМ раствора HEPES (рН 7,5), содержащего 125 мМ хлорида натрия, 10 мМ хлорида магния, 0,1 мМ ортованадата натрия, 1 мМ АТФ, 0,48 мг/мл (24 нг/лунку) с-еrbВ 2-внутриклеточного домена. Внутриклеточный домен еrbВ 2-тирозинкиназы (аминокислоты 674-1255) экспрессируется как связанный с белком GST в бакуловирусе и очищается путем связывания с бусинками, покрытыми глутатионом, и дальнейшим элюированием. Добавляли соединение в ДМСО (диметилсульфоксиде) до достижения конечной концентрации ДМСО приблизительно 2,5%. Фосфорилирование инициировали добавлением АТФ (аденозинтрифосфата) и проводили в течение 6 мин при комнатной температуре с постоянным перемешиванием. Киназную реакцию прерывали путем аспирации реакционной смеси и последующим промыванием буферным раствором для промывки (см. выше). Фосфорилированный PGT определяли после 25-минутной инкубации с 50 мл на лунку HRPконъюгированного с PY54(Oncogene Science Inc. Uniondale, NY)-антифосфотирозиновым антителом,разбавленным до 0,2 мг/мл в блокирующем буфере (3% BSA и 0,05% Tween-20 в PBS). Антитело удаляли путем аспирации и 4 раза промывали планшет буферным раствором для промывки. Колориметрический сигнал развивался при добавлении 50 мл/на лунку ТМВ Microwell Peroxidase Substrate (субстрат пероксидазы для микролунок) (Kirkegaard and Perry, Gaithersburg, MD) и останавливался при добавлении- 12005525 50 мл/на лунку 0,09 М серной кислоты. Концентрацию фосфотирозина устанавливали, измеряя поглощение при 450 нм. Контрольный сигнал составляет обычно 0,6-1,2 единиц поглощения по сравнению с незначительным фоном для лунок без PGT-субстрата и пропорционален времени инкубации в течение 10 мин. Ингибиторы идентифицируют по уменьшению сигнала по сравнению с лунками без ингибитора и определяют значения IC50, соответствующие концентрации соединения, необходимой для 50%-ного ингибирования. Соединения, иллюстрируемые здесь и соответствующие формуле 1, имеют значение IС 5010 мкМ по еrbВ 2-киназе. Активность соединений формулы 1 in vivo можно определить по итогам ингибирования роста опухоли тестовым соединением по сравнению с контрольным. Ингибирующее влияние различных соединений на рост опухоли измеряли согласно способу, описанному в публикациях Corbett Т.Н. и др., TumorColon-tumor Model for Experimental Therapy, Cancer Chemother. Rep.(часть 2), 5, 169-186 (1975), с небольшими модификациями. Опухоли индуцировали в левом боку подкожной (sc) инъекцией 1-5 миллионов культивированных опухолевых клеток в лог-фазе (мышиных FRE-ErbB2-клеток или клеток карциномы яичника SK-OV3 человека), суспендированных в 0,1 мл RPMI-1640-среды. По истечении достаточного времени, чтобы опухоли стали пальпируемыми (100-150 мм 3 при размере/5-6 мм в диаметре), испытуемых животных (бестимусных самок мыши) обрабатывали тестируемым соединением (приготовленном в концентрации 10-15 мг/мл в 5 Gelucire) при интраперитонеальном (ip) или пероральном (ро) способе введения один или два раза в день в течение подряд 7-10 дней. Чтобы определить противоопухолевый эффект, опухоль измеряли в миллиметрах штангенциркулем с нониусом по двум диаметрам крестнакрест и вычисляли размер опухоли (мм 3), применяя формулу: Размер опухоли (мм 3) = (длина х [ширина]2)/2,согласно способу, описанному в публикации: Geran R.I. и др., Protocols for Screening Chemical Agentsand Natural Products Against Animal Tumors and Other Biological Systems, третье издание. Cancer Chemother.Rep., 3, 1-104 (1972). Результаты выражены в виде процента ингибирования, согласно формуле: Ингибирование(%) = ТuWконтрол.-ТuWтест.)/ТuWконтр.) х 100%. Место имплантации опухоли обеспечивает воспроизводимые эффекты доза/ответ для различных химиотерапевтических агентов, а способ измерения (диаметра опухоли) является надежным способом для оценки скоростей роста опухоли. Введение соединений настоящего изобретения (в дальнейшем активного соединения(й можно провести любым способом, который позволяет доставить соединения к месту воздействия. Данные способы включают оральный путь введения, интрадуоденальный путь введения, парентеральные инъекции(включая внутривенные, подкожные, внутримышечные, интраваскулярные или инфузии), локальное и ректальное введение. Количество вводимого активного соединения будет зависеть от субъекта, подвергающегося лечению, серьезности заболевания или состояния, скорости введения, распределения соединения и предписания по усмотрению врача. Однако эффективная дозировка находится в пределах приблизительно 0,001100 мг на кг веса тела в день, предпочтительно приблизительно 1-35 мг/кг/день, в отдельной или разделенной общей дозе. Для 70 кг человека такое количество составило бы приблизительно 0,05-7 г/день,предпочтительно приблизительно 0,2-2,5 г/день. В некоторых случаях могут быть более чем подходящими уровни дозировок, находящиеся ниже нижнего предела вышеупомянутого диапазона, в то время как в других случаях можно применять еще большие дозы без какого-либо вредного побочного эффекта, при условии, что такие большие дозы сначала будут разделены на несколько доз для введения в течение дня. Активное соединение можно применять в качестве отдельной терапии или можно включать дополнительно одно или более других противоопухолевых веществ, например, выбранных из митотических ингибиторов, например, винбластина; из алкилирующих агентов, например из цис-платина, карбоплатина и циклофосфамида; из антиметаболитов, например, 5-фторурацила, цитозинарабинозида и гидроксимочевины, или, например, одного из предпочтительных антиметаболитов, описанного в заявке на Европейский патент 239362, такого как N-(5-[N-(3,4-дигидро-2-метил-4-оксохиназолин-6-илметил)-Nметиламино]-2-теноил)-L-глутаминовая кислота; из ингибиторов факторов роста; из ингибиторов клеточного цикла; из интеркалирующих антибиотиков, например адриамицина и блеомицина; из ферментов,например интерферона; и из антигормонов, например антиэстрогенов, таких как NolvadexTM (тамоксифен) или, например, из антиандрогенов, таких как CasodexTM (4'-циано-3-(4-фторфенилсульфонил)-2 гидрокси-2-метил-3'-(трифторметил)пропионанилид). Такой общий курс лечения можно провести путем одновременной, последовательной или специальной дозировки индивидуальных компонентов курса лечения. Фармацевтическая композиция может быть, например, в форме, подходящей для перорального введения, в виде таблетки, капсулы, пилюли, порошка, композиции непрерывного высвобождения, раствора,суспензии; для парентеральной инъекции - в виде стерильного раствора, суспензии или эмульсии; для локального введения - в виде мази или крема; или для ректального введения в виде суппозиториев. Фармацевтическая композиция может быть в дозированной лекарственной форме, подходящей для разового- 13005525 введения определенных доз. Фармацевтическая композиция будет включать общеизвестный фармацевтический носитель или наполнитель и соединение согласно изобретению в качестве активного компонента. Кроме того, она может включать другие лекарственные или фармацевтические агенты, носители,адъюванты и т.д. Типичные формы для парентерального введения включают растворы или суспензии активных соединений в стерильных водных растворах, например, в водном растворе пропиленгликоля или в растворах декстрозы. Такие формы дозировки, если требуется, могут быть подходящим образом забуферены. Подходящие фармацевтические носители включают инертные разбавители или наполнители, воду и различные органические растворители. Фармацевтические композиции, если требуется, могут содержать дополнительные ингредиенты, такие как корригенты, связующие, наполнители и т.п. Таким образом,таблетки для перорального введения, содержащие различные наполнители, такие как лимонная кислота,можно применять вместе с различными дезинтеграторами, такими как крахмал, альгиновая кислота и некоторые комплексные силикаты, и со связующими агентами, такими как сахароза, желатин и акация. Дополнительно для изготовления таблеток часто применяются смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции подобного типа можно также применять для заполнения мягких и твердых желатиновых капсул. Предпочтительные материалы для указанного выше включают лактозу или молочный сахар и полиэтиленгликоли с высоким молекулярным весом. Когда нужны водные суспензии или эликсиры для перорального введения, активное соединение можно объединить с различными подсластителями или корригентами, окрашивающими веществами или красителями и, если требуется, эмульгаторами или суспендирующими агентами, совместно с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин или их комбинации. Способы получения различных фармацевтических композиций с определенным количеством активного соединения известны, или будут очевидны специалистам в данной области. Для примера см. публикацию Remington's Pharmaceutical Sciences, Mack Publishing Company, Easter, Pa., 15-oe издание(1975). Примеры и методики, описанные ниже, служат иллюстрацией и примером соединений настоящего изобретения и способов получения таких соединений. Должно быть понято, что объем настоящего изобретения никоим образом не ограничивается объемом следующих примеров и методик. В следующих примерах молекулы с одним хиральным центром, если не отмечено иначе, существуют в виде рацемической смеси. Молекулы с двумя или более хиральными центрами, если не отмечено иначе, существуют в виде рацемической смеси диастереомеров. Отдельные энантиомеры/диастереомеры можно получить известными специалистам в данной области способами. Там, где в примерах и методиках ниже упоминается ВЭЖХ-хроматография, если не оговорено иначе, она проводится при следующих общих условиях. Применяемая колонка представляет собой колонкуZORBAX RXC18 (производства фирмы Hewlett Packard) 150 мм длины и внутреннего диаметра 4,6 мм. Образцы прокачиваются на системе Hewlett Packard-1100. Применяется способ градиента растворителя(градиентного элюирования), заключающийся в прокачивани в течение более 10 мин от 100% смеси ацетат аммония/уксуснокислый буфер (0,2 М) до 100% ацетонитрила. Затем система продолжает цикл вымывания 100%-ным ацетонитрилом в течение 1,5 мин и затем 100%-ным буферным раствором в течение 3 мин. Скорость потока в течение данного периода является постоянной и составляет 3 мл/мин. В следующих примерах и методиках Et означает этил, АС означает ацетил, Me означает метил, ЕТОАС или ЕТОАс означает этилацетат, ТГФ означает тетрагидрофуран и Вu означает бутил. Способ А. Синтез [3-Метил-4-(пиридин-3-илокси)фенил]-(6-пиперидин-4-илэтинилхиназолин-4 ил)амина (1). Сложный трет-бутиловый эфир 4-(4-хлорхиназолин-6-илэтинил)пиперидин-1-карбоновой кислоты. Смесь трет-бутилового эфира 4-этинилпиперидин-1-карбоновой кислоты (1,12 г, 5,35 ммоль), 4 хлор-6-иодхиназолина (1,35 г, 4,65 ммоль), дихлор-бис-(трифенилфосфин)палладия (II) (0,16 г, 0,23 ммоль), иодида меди(I) (0,044 г, 0,23 ммоль) и диизопропиламина (0,47 г, 4,65 ммоль) в сухом ТГФ (20 мл) перемешивают при комнатной температуре в атмосфере азота в течение 2 ч. После концентрирования остаток растворяют в СН 2 Сl2 (100 мл), промывают водным NH4Cl и насыщенным раствором соли,сушат над сульфатом натрия и концентрируют до получения неочищенного продукта в виде коричневого маслянистого вещества. Очищают на колонке с силикагелем, применяя 20% EtOAc в гексане, получая при этом 1,63 г (94%) указанного в заголовке соединения в виде липкого желтого маслянистого вещества: 1H ЯМР (СDСl3)1,45 (с, 9 Н), 1,67-1,75 (м, 2 Н), 1,87-1,92 (м, 2 Н), 2,84 (м, 1 Н), 3,20-3,26 (м, 2 Н), 3,78[3-метил-4-(пиридин-3-илокси)фенил]-(6-пиперидин-4-илэтинилхиназолин-4-ил)амин. Трет-бутиловый эфир 4-(4-хлорхиназолин-6-илэтинил)пиперидин-1-карбоновой кислоты (80 мг,0,21 ммоль) и 3-метил-4-(пиридин-3-илокси)фениламин (43 мг, 0,21 ммоль) смешивают вместе в третбутаноле (1 мл) и дихлорэтане (1 мл) и нагревают в герметичной колбе при 90 С в течение 20 мин. Реакционной смеси дают остыть и барботируют через нее НСl (газ) в течение 5 мин. Затем добавляют EtOAC,после чего образуется желтый осадок. Осадок собирают и сушат, получая при этом требуемый продукт[3-метил-4-(пиридин-3-илокси)фенил]-(6-пиперидин-4-илэтинилхиназолин-4-ил)амин в виде желтого твердого вещества (96 мг, 95%). 1H ЯМР (СDСl3)2,01 (м, 2 Н), 2,22 (м, 2 Н), 2,35 (с, 3 Н), 3,20 (м, 2 Н) ,3,45 (м, 2 Н), 7,28 (д, 1 Н, J=8,7 Гц), 7,75 (дд, 3 Н, J1=8,7, J2=8,7 Гц), 8,06 (дд, J=8,7), 8,10 (дд, J1=J2=8,7 Гц), 8,17 (м, 1 Н), 8,60 (д, 1 Н, J=5,4 Гц), 8,80 (с, 1 Н), 8,89 (с, 1 Н). MS: M+1, 436,6. Способ В. Синтез 2-хлор-N-(3-(4-[3-метил-4-(пиридин-3-илокси)фениламино]хиназолин-6-ил) проп-2-инил)ацетамида(2). 2-Хлор-N-[3-(4-хлорхиназолин-6-ил)проп-2-инил]ацетамид. 2-Хлор-N-проп-2-инилацетамид (385 мг; 2,93 ммоль) и 4-хлор-6-иодхиназолин (850 мг; 1 экв.) растворяют в сухом ТГФ и диизопропиламине (296 мг; 0,41 мл; 1 экв.). К данной смеси добавляют 0,04 эквивалентов иодида меди (22 мг) и Pd(РРh3)2 Сl2 (82 мг). Реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение ночи (20 ч). Затем растворитель удаляют в вакууме и остаток растворяют в СН 2 Сl2. Полученный раствор помещают в делительную воронку и однократно промывают насыщенным раствором NH4Cl, насыщенным раствором соли, сушат над Na2SO4 и удаляют растворитель в вакууме. Продукт очищают храматографией на силикагеле, элюируя смесью гексан/EtOAc 1:1 и собирая фракции при Rf = 0,25. При этом получают 2-хлор-N-[3-(4-хлорхиназолин-6-ил)проп-2 инил]ацетамид в виде не совсем белого твердого вещества (454 мг; 53 %). 1H ЯМР (400 МГц; СDСl3)4,12 (2 Н, с), 4,40 (2 Н, д, J=5,2 Гц), 7,91-7,93 (1 Н, дд, J=2, 6,8 Гц), 8,00 (1 Н, д, J=8,4 Гц), 8,34 (1:4, д, J=1,6 Гц), 9,03 (1 Н, с). Irms (M+): 294,0, 296,0, 298,1. 2-Хлор-N-(3-4-[3-метил-4-(пиридин-3-илокси)фениламино]хиназолин-6-илпроп-2-инил)ацетамид: Смесь 2-хлор-N-[3-(4-хлорхиназолин-6-ил)проп-2-инил]ацетамида (0,90 г, 3,05 ммоль) и 3-метил-4(пиридин-3-илокси)фениламина (0,61 г, 3,05 ммоль) в TВuОН/DCE (5,0/5,0 мл) кипятят с обратным холодильником в атмосфере азота в течение 40 мин и концентрируют. Остаток растворяют в МеОН (2,0 мл) и добавляют к EtOAc с энергичным перемешиванием, осаждая при этом HCl-соль в виде желтоватокоричневого твердого вещества, которое собирают на вакуум-фильтре, промывают EtOAc и затем сушат,получая при этом 1,24 г (82 %) 2-хлор-N-(3-4-[3-метил-4-(пиридин-3-илокси)фениламино]хиназолин-6 илпроп-2-инил)ацетамида: 1H ЯМР (СD3OD)2,27 (с, 3 Н), 4,09 (с, 2 Н), 4,29 (с, 2 Н), 7,07 (д, 1 Н), 7,51 (м,2 Н), 7,60 (д, 1 Н), 7,70 (с, 1 Н), 7,78 (д, 1 Н), 8,05 (д, 1 Н), 8,32 (м, 2 Н), 8,67 (с, 1 Н), 8,75 (с, 1 Н); MS m/z(MH+) 458,0. Способ С. Синтез 2-диметиламино-N-(3-4-[3-метил-4-(пиридин-3-илокси)фениламино]хиназолин 6-илпроп-2-инил)ацетамида (3). 2-диметиламино-N-(3-4-[3-метил-4-(пиридин-3-илокси)фениламино]хиназолин-6-илпроп-2-инил) ацетамид. К раствору 2-хлор-N-(3-4-[3-метил-4-(пиридин-3-илокси)фениламино]хиназолин-6-илпроп-2 инил)ацетамида (99 мг, 0,20 ммоль) в МеОН (5 мл) добавляют раствор диметиламина в ТГФ (2 мл, 4,0 ммоль). Полученный раствор кипятят с обратным холодильником в атмосфере азота в течение 1 ч. Затем после концентрирования остаток сушат, растворяют в МеОН (1,0 мл) и обрабатывают газообразным НСl в течение 3 мин. Полученный раствор добавляют к EtOAc при энергичном перемешивании, осаждая при этом HCl-соль в виде желтого твердого вещества, которое собирают на вакуум-фильтре, промываютEtOAc и затем сушат, получая при этом 110 мг (99 %) указанного в заголовке соединения. 1H ЯМР(МН+) 467,3. Способ D. Синтез 1-(3-4-[3-хлор-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-илпроп 2-инил)-3-метилмочевины(4). 1-(3-4-[3-хлор-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-илпроп-2-инил)-3-метилмочевина. Смесь фенилового эфира (3-4-[3-хлор-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-ил проп-2-инил)карбаминовой кислоты (0,1 г, 0,18 ммоль), полученного согласно способу В, метиламина(2,0 М раствор метанола, 1 мл, 2 ммоль) и ДМСО (0,5 мл) перемешивают при 80 С в течение ночи. Растворители удаляют в вакууме (GeneVac HT8) и остаток снова растворяют в МеОН (1 мл). Газообразный НСl барботируют через раствор и EtOAc, получая при этом в осадке требуемый продукт. Указанное в заголовке соединение (80 мг, выход 90 %) получают при фильтровании в виде желтого твердого вещества. 1H ЯМР (400 МГц, CD3OD)2,72 (3 Н, с), 2,76 (3H, с), 4,19 (2 Н, с), 7,49 (1 Н, д, J=9 Гц), 7,84 (1 Н, д,J=2 Гц), 7,86 (1 Н, д, J=2 Гц), 7,92 (1 Н, д, J=9 Гц), 8,12 (2 Н, м, J=2 Гц), 8,16 (1 Н, д, J=2,4 Гц), 8,60 (1 Н, д,J=3,2 Гц), 8,74 (1 Н, д, J=1,2 Гц), 8,87 (1 Н, с). LRMS(М+): 473,0, 475,0, 476,0. Способ Е. Синтез 3-4-[3-Метил-4-(пиридин-3-илокси)фениламино]хиназолин-6-илпроп-2-ен-1-ол(5). 3-4-[3-метил-4-(пиридин-3-илокси)фениламино]хиназолин-6-илпроп-2-ен-1-ол. К раствору 0,56 г (1,47 ммоль) 3-4-[3-метил-4-(пиридин-3-илокси)фениламино]хиназолин-6 илпроп-2-ин-1-ола (полученного согласно способу В) в 6 мл сухого тетрагидрофурана при 0 С добавляют 0,73 мл 65%-ного (мас.%) толуольного раствора бис-(2-метоксиэтокси)алюмогидрида натрия (крас- 15005525 ный Аl, 2,35 ммоль) в 1 мл ТГФ. Реакционную смесь перемешивают при комнатной температуре в течение 3 ч. После повторного охлаждения до 0 С добавляют дополнительно 0,73 мл раствора красного Аl в 1 мл ТГФ. После перемешивания в течение 1 ч при комнатной температуре смесь гасят добавлением капля по капле 10%-ного водного карбоната калия и экстрагируют этилацетатом. Органические фракции сушат над сульфатом натрия, отфильтровывают и упаривают до получения 650 мг. Хроматография на 90 г силикагеля, элюирование смесью 96:4:0,1 хлороформ/метанол/концентрированный гидроксид аммония дает 268 мг указанного в названии соединения. 1 Н ЯМР (d6 ДМСО):9,79[3-Метил-4-(пиридин-3-илокси)фенил]-[6-(3-морфолин-4-ил-пропенил)хиназолин-4-ил]амин. К суспензии 0,035 г (0,091 ммоль) 3-4-[3-метил-4-(пиридин-3-илокси) фениламино]хиназолин-6 илпроп-2-ен-1-ола в 0,5 мл метиленхлорида и 1 мл этилендихлорида добавляют 1 мл тионилхлорида. Реакционную смесь нагревают при 100 С в течение 1 ч и выпаривают растворители, получая при этом [6(3-хлорпропенил)хиназолин-4-ил]-[3-метил-4-(пиридин-3-илокси)фенил]амин [МС: М- 403,1], который растворяют в ТГФ и применяют непосредственно в следующей реакции. К раствору [6-(3-хлорпропенил)хиназолин-4-ил]-[3-метил-4-(пиридин-3-илокси)фенил]амина добавляют 0,10 мл морфолина и 0,044 мл триэтиламина. Смесь нагревают при 85 С в течение 16 ч, охлаждают до комнатной температуры и распределяют между 10%-ным водным раствором карбоната калия и этилацетатом. Затем водный слой экстрагируют этилацетатом, а объединенную органику сушат и упаривают, получая при этом 57 мг вещества. Продукт очищают на силикагеле элюированием смесью 96:4:0,1 хлороформ/метанол/концентрированный гидроксид аммония, получая при этом 26 мг указанного в заголовке соединения; 1H ЯМР(СDСl3):8,71 (с,1), 8,33 (м,2), 7,94 (c, 1), 7,80 (м,2), 7,69 (с,1), 7,58 (м, 1), 7,20 (м,1), 6, 94 (д, J=8,7 Гц,1),6, 68 (д, J=15,8 Гц,1), 6,46 (м,1), 3,79 (м,4), 3,26 (м,2), 2,63 (м,4), 2,25 (с,3). Способ G. Синтез E-N-(3-4-[3-хлор-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6 илаллил)ацетамида (7). Сложный трет-бутиловый эфир Е-(3-4-[3-хлор-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-илаллил)карбаминовой кислоты. К раствору 7,53 мл 65%-ного (мас.%) толуольного раствора бис-(2-метоксиэтокси)алюмогидрида натрия (красный Аl, 24,2 ммоль) в 90 мл тетрагидрофурана при 0 С добавляют 5,0 г сложного третбутилового эфира (3-4-[3-хлор-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-илпроп-2-инил) карбаминовой кислоты в виде твердого вещества. Реакционную смесь перемешивают при 0 С в течение 2 ч, гасят 10%-ным водным раствором карбоната калия и экстрагируют этилацетатом. Объединенную органику сушат и упаривают. Неочищенный материал очищают на 115 г селикагеля, элюируют смесью 80% этилацетат/гексан, получая при этом 4,42 г сложного трет-бутилового эфира Е-(3-4-[3-хлор-4-(6 метилпиридин-3-илокси)фениламино]хиназолин-6-илаллил)карбаминовой кислоты. 1H ЯМР (CDCl3):8,66 (с, 1), 8,24 (м, 1), 8,03 (м, 2), 7,77-7,65 (м, 3), 7,13 (м, 2), 6, 97 (д, J=8,7 Гц, 1), 6,54 (д, 1), 6,35 (м, 1),4,9 (м, 1), 3,90 (м, 2), 2,52 (с, 3), 1,46 (с, 9). Е-[6-(3-аминопропенил)хиназолин-4-ил]-[3-хлор-4-(6-метилпиридин-3-илокси)фенил]амин. К раствору 4,42 г сложного трет-бутилового эфира E-(3-4-[3-хлор-4-(6-метилпиридин-3-илокси) фениламино]хиназолин-6-илаллил)карбаминовой кислоты в 21 мл тетрагидрофурана добавляют 21 мл 2N хлористо-водородной кислоты. Смесь нагревают при 60 С в течение 3 ч, охлаждают до комнатной температуры и подщелачивают 10%-ным водным раствором карбоната калия. К водной смеси добавляют метиленхлорид, осаждая при этом твердое вещество. Твердое вещество отфильтровывают и сушат, получая при этом 2,98 г Е-[6-(3-аминопропенил)хиназолин-4-ил]-[3-хлор-4-(6-метилпиридин-3-илокси)фенил] амина. 1 Н ЯМР (d6 ДМСО):8,62 (с, 1), 8,53 (м, 1), 8,26 (м, 2), 7,99 (м, 1), 7,89 (м, 1), 7,77 (м, 1), 7,30 (м,3), 6,67 (м, 2), 3,44 (м, 2), 2,47 (c, 3).E-N-(3-4-[3-хлор-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-илаллил)ацетамид. Смесь 14,4 мкл (0,25 ммоль) уксусной кислоты и 40,3 мг (0,33 ммоль) дициклогексилкарбодиимида в 2 мл метиленхлорида перемешивают в течение 10 мин и обрабатывают 100,3 мг Е-[6-(3-аминопропенил)хиназолин-4-ил]-[3-хлор-4-(6-метилпиридин-3-илокси)фенил]амина. Реакционную смесь оставляют при перемешивании при комнатной температуре в течение ночи. Образовавшийся осадок отильтровывают и очищают хроматографией на силикагеле, элюируя смесью 6-10% метанол/хлороформ,получая при этом 106 мг указанного в заголовке соединения; т.пл. 254-256 С; 1 Н ЯМР (d6 ДМСО):9,88 (с, 1), 8,58 (с, 1), 8,48 (м, 1), 8,20 (м, 3), 7,95 (м, 1), 7,83 (м, 1), 7,71(д,J=8,7 Гц, 1), 7,24 (м, 2), 7,19 (д, J=8,7 Гц, 1), 6,61 (д, J=16,2 Гц, 1), 6,48 (м, 1), 3,90 (м, 2) . Способ Н. (3-4-[3-метил-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6-илаллил)амид E2S-метоксиметилпирролидин-1-карбоновой кислоты (8). К раствору 0,125 г (0,31 ммоль) E-[6-(3-аминопропенил)хиназолин-4-ил]-[3-метил-4-(6-метилпиридин-3-илокси)фенил]амина (полученного согласно способу G) в 1 мл дихлорметана при 0 С при- 16005525 перемешивании добавляют 60,3 мкл (0,34 ммоль) основания Хюнига, сопровождая добавлением капля по капле раствора 48,2 мкл (0,34 ммоль) 4-хлорфенилхлорформиата в 1 мл дихлорметана. Реакционную смесь перемешивают 30 мин и упаривают при пониженном давлении. Остаток растворяют в 2 мл диметилсульфоксида и добавляют 123 мкл (0,94 ммоль) неразбавленного (S)-(+)-2-(метоксиметил)пирролидина. Реакционную смесь перемешивают в течение 3 ч при комнатной температуре. Реакцию гасят 10%-ным раствором карбоната калия и экстрагируют этилацетатом. Органический слой промывают несколько раз водой и дважды насыщенным раствором соли. Органический слой сушат над сульфатом натрия и концентрируют, получая при этом неочищенное вещество. Полученное вещество очищают на более чем 90 г силикагеля, применяя смесь 96:4:0,1 хлороформ:метанол:гидроксид аммония в качестве элюента, получая при этом 75 мг (0,14 ммоль) указанного в заголовке соединения. 1 Н ЯМР (d6 ДМСО):9,83 (с, 1), 8,56 (с, 2), 8,21 (д, 1), 7,95 (д, 1), 7,80 (д, 1), 7,50 (д, 1), 7,25 (м, 2), 7,01 (д, 1), 6,63 (д,1), 6,53 (м, 1), 3,95 (м, 2), 3,40 (дд, 1), 3,28 (с, 3), 2,49 (с, 3), 2,24 (с, 3), 1,85 (м, 4). Способ I: Е-2-гидрокси-N-(3-4-[3-метил-4-(6-метилпиридин-3-илокси)фениламино]хиназолин-6 илаллил)изобутирамид (9). К раствору 0,170 г (0,42 ммоль) E-[6-(3-аминопропенил)хиназолин-4-ил]-[3-метил-4-(6-метилпиридин-3-илокси)фенил]амина (полученного согласно способу G) в 1 мл дихлорметана при 0 С добавляют 65 мкл (0,47 ммоль) триэтиламина, после чего добавляют раствор 65 мкл (0,45 ммоль) 2 ацетоксиизобутирилхлорида в 1 мл дихлорметана. Реакционную смесь перемешивают при 0 С в течение 1 ч. Смесь гасят добавлением капля по капле 10%-ного раствора карбоната калия. Водный слой экстрагируют дихлорметаном, а объединенную органику промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают. Неочищенное вещество очищают на 90 г силикагеля, элюируя смесью 96:4:0,1 хлороформ/метанол/гидроксид аммония, получая при этом 2-ацетокси-N-(3-4-[3-метил-4-(6 метилпиридин-3-илокси)фениламино]хиназолин-6-илаллил)изобутирамид. Раствор полученного вещества в 2 мл метанола обрабатывают капля по капле раствором 41 мг (3,02 ммоль) карбоната калия в 0,5 мл воды. Раствор перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь упаривают и остаток распределяют между водой и хлороформом. Водный слой дважды экстрагируют хлороформом, а объединенную органику промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают, получая при этом 100 мг указанного в заголовке соединения (47%). 1H ЯМР (d6 ДМСО):9,78 (с, 1), 8,50 (с, 1), 8,48 (с, 1), 8,15 (д, 1), 7,95 (м, 2), 7,65 (м, 3), 7,21 (м, 2), 6,96 (д, 1), 6,56Z-[6-(3-аминопропенил)хиназолин-4-ил]-[3-метил-4-(6-метилпиридин-3-илокси)фенил]амин. Берут раствор сложного трет-бутилового эфира (3-4-[3-метил-4-(6-метилпиридин-3-илокси) фениламино]хиназолин-6-илпроп-2-инил)карбаминовой кислоты (1 г, 2,01 ммоль) в метаноле (20 мл), добавляют палладий на углероде (Pd/C) (50 мг) и полученную суспензию подвергают гидрогенизации при давлении 40 фунт/кв.дюйм в течение восьми часов. После чего суспензию отфильтровывают через рыхлый слой целита, а фильтрат концентрируют в вакууме, получая при этом соединение Z-алкена. Вносят его в метанол и добавляют НСl (г). Затем при выпаривании растворителя получают Z-[6-(3-аминопропенил)хиназолин-4-ил]-[3-метил-4-(6-метилпиридин-3-илокси)фенил]амин в виде его хлористоводородной соли. Вносят соль в CH2Cl2 и перемешивают с Nа 2 СО 3, отфильтровывают и выпаривают растворитель, получая при этом 700 мг свободного амина. 1H ЯМР (CD3OD):8,49 (с, 1), 8,31 (с, 1), 8,07 (м,1), 7,78 (с, 2 Н), 7,72 (м, 1 Н), 7,67 (с, 1 Н), 7,58 (д, J=10,5 Гц, 1H), 7,25 (м, 2 Н), 6,99 (м, 2 Н), 5,88 (м, 1 Н),3,95 (д, J=8 Гц, 2H), 2,47 (с, 3H), 2,23 (с, 3H). МС:М+1, 399,3.(100 мг, 0,25 ммоль) в DMF (3 мл), добавляют HATU (143 мг, 0,38 ммоль) и циклопропанкарбоновую кислоту (36 мг, 0,42 ммоль) и дают возможность полученному раствору перемешиваться в течение 18 ч. Затем добавляют воду, реакционную смесь экстрагируют метиленхлоридом, органический экстракт промывают насыщенным раствором соли и сушат над Na2SO4. После концентрирования в вакууме неочищенное вещество очищают препаративной ВЭЖХ (хроматографией с обращенной фазой, 5-40% СН 3 СNН 2 О), получая при этом 46 мг указанного в заголовке соединения. 1H ЯМР (СD3 ОD):8,77 (с, 1 Н), 8,72(уш. неразрешенный м, 1 Н), 0,79 (м, 3H). МС:М+1 466,3. Следующие соединения получены с применением способов, описанных выше.
МПК / Метки
МПК: A61K 31/517, A61P 35/00, C07D 401/12
Метки: производные, аномального, бициклические, роста, лечения, замещенные, клеток
Код ссылки
<a href="https://eas.patents.su/30-5525-zameshhennye-biciklicheskie-proizvodnye-dlya-lecheniya-anomalnogo-rosta-kletok.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные бициклические производные для лечения аномального роста клеток</a>
Предыдущий патент: Применение дексмедетомидина для седативного воздействия в отделении интенсивной терапии
Следующий патент: Ингибиторы клеточной адгезии
Случайный патент: S-замещенные тиоловые эфиры 11&beta-бензальдоксимэстра-4,9-диенугольной кислоты, способ их получения и содержащие эти соединения фармацевтические композиции












