Бициклические аминокислоты в качестве фармацевтических агентов
Формула / Реферат
1. Соединение формулы (I)
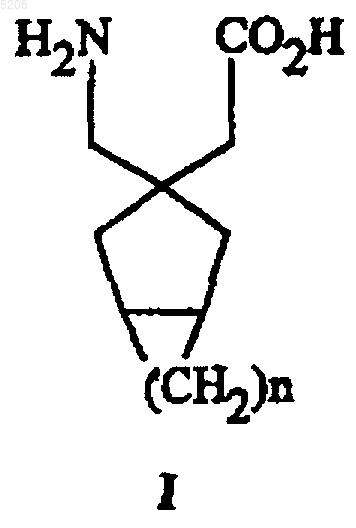
или его фармацевтически приемлемая соль, или его эфирное или амидное производное, где n равно целому числу от 1 до 4.
2. Соединение по п.1, выбранное из
(1a,6a,8b)(2-аминометилоктагидроинден-2-ил)уксусной кислоты,
(1a,6a,8a)(2-аминометилоктагидроинден-2-ил)уксусной кислоты,
(1a,3a,5a)(2-аминометилоктагидропентален-2-ил)уксусной кислоты,
(+/-)-(1a,5b)(2-аминометилоктагидропентален-2-ил)уксусной кислоты,
(1a,3a,5a)(3-аминометилбицикло[3.2.0]гепт-3-ил)уксусной кислоты,
(+/-)-(1a,5b)(3-аминометилбицикло[3.2.0]гепт-3-ил)уксусной кислоты,
(+/-)-(1a,6b)(2-аминометилоктагидроинден-2-ил)уксусной кислоты,
(1a,3b,5a)(3-аминометилбицикло[3.2.0]гепт-3-ил)уксусной кислоты и
(1a,3b,5a)(2-аминометилоктагидропентален-2-ил)уксусной кислоты,
или его фармацевтически приемлемая соль, или его эфирное или амидное производное.
3. Соединение по п.1 под названием (1a,3a,5a)(3-аминометилбицикло[3.2.0]гепт-3-ил)уксусная кислота, или его фармацевтически приемлемая соль, или его эфирное или амидное производное.
4. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп.1-3, или его фармацевтически приемлемой соли, или его эфирного или амидного производного, и фармацевтически приемлемый носитель.
5. Способ лечения эпилепсии, при котором вводят терапевтически эффективное количество соединения по п.1 млекопитающему, нуждающемуся в таком лечении.
6. Способ лечения нейродегенеративных расстройств, при котором вводят терапевтически эффективное количество соединения по п.1 млекопитающему, нуждающемуся в таком лечении.
7. Способ лечения депрессии, при котором вводят терапевтически эффективное количество соединения по п.1 млекопитающему, нуждающемуся в таком лечении.
8. Способ лечения тревоги, при котором вводят терапевтически эффективное количество соединения по п.1 млекопитающему, нуждающемуся в таком лечении.
9. Способ лечения паники, при котором вводят терапевтически эффективное количество соединения по п.1 млекопитающему, нуждающемуся в таком лечении.
10. Способ лечения боли, при котором вводят терапевтически эффективное количество соединения по п.1 млекопитающему, нуждающемуся в таком лечении.
11. Способ по п.10, где боль представляет собой невропатическую боль.
12. Способ лечения невропатологических расстройств, при котором вводят терапевтически эффективное количество соединения по п.1 млекопитающему, нуждающемуся в таком лечении.
Текст
1 Предшествующий уровень техники Соединения формулы где R1 представляет собой водород или низший алкильный радикал, и n равно 4, 5 или 6, известны по заявке на патент Соединенных Штатов номер 4024175 и его выделенной заявке на патент Соединенных Штатов номер 4087544. Раскрытые применения представляют собой: защитный эффект против спазмов, вызванных тиосемикарбазидом; защитное действие против спазмов, вызванных кардиазолом; церебральные болезни, эпилепсия, приступы дурноты, гипокинезия и черепно-мозговые травмы; и улучшение мозговых функций. Соединения полезны для пациентов старческого возраста. Эти патенты включены здесь посредством ссылки. Краткое изложение сущности изобретения Данное изобретение представляет собой ряд новых бициклических аминокислот, их фармацевтически приемлемые соли и эфирные или амидные производные этих аминокислот. Соединения представляют собой соединения формулы: где n представляет собой целое число от 1 до 4,где имеются стереоцентры, причем каждый центр может быть независимо R или S. Предпочтительные соединения по данному изобретению представляют собой соединения вышеуказанной формулы I, где n представляет собой целое число от 2 до 4. Другими предпочтительными соединениями являются соединения, выбранные из(1,3,5)(2-аминометилоктагидропентален-2-ил)уксусной кислоты,или их фармацевтически приемлемые соли, или их эфирные или амидные производные. 2 Особенно предпочтительным соединением является (1,3,5)(3-аминометилбицикло[3.2.0] гепт-3-ил)уксусная кислота, или его фармацевтически приемлемая соль, или его эфирное или амидное производное. Настоящее изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения указанной выше формулы I, или его фармацевтически приемлемой соли, или его эфирного или амидного производного, и фармацевтически приемлемый носитель. Кроме того, данное изобретение относится к способу лечения эпилепсии, при котором вводят терапевтически эффективное количество соединения указанной выше формулы I млекопитающему, нуждающемуся в таком лечении. Данное изобретение относится также к способу лечения нейродегенеративных расстройств, при котором вводят терапевтически эффективное количество соединения указанной выше формулы I млекопитающему, нуждающемуся в таком лечении. Данное изобретение относится также к способу лечения депрессии, при котором вводят терапевтически эффективное количество соединения указанной выше формулы I млекопитающему, нуждающемуся в таком лечении. Данное изобретение относится также к способу лечения тревоги, при котором вводят терапевтически эффективное количество соединения указанной выше формулы I млекопитающему, нуждающемуся в таком лечении. Данное изобретение относится также к способу лечения паники, при котором вводят терапевтически эффективное количество соединения указанной выше формулы I млекопитающему, нуждающемуся в таком лечении. Данное изобретение относится также к способу лечения боли, при котором вводят терапевтически эффективное количество соединения указанной выше формулы I млекопитающему, нуждающемуся в таком лечении. В частности, данное изобретение относится к способу лечения боли, где боль представляет собой невропатическую боль. Данное изобретение относится также к способу лечения невропатологических расстройств, при котором вводят терапевтически эффективное количество соединения указанной выше формулы I млекопитающему, нуждающемуся в таком лечении. Соединения по данному изобретению являются также полезными при лечении ряда расстройств. Эти расстройства включают в себя: эпилепсию, приступы дурноты, гипокинезию,черепно-мозговые расстройства, нейродегенеративные расстройства, депрессию, тревогу, панику, боль, невропатологические расстройства и нарушения сна. 3 Промежуточные соединения, полезные в получении конечных продуктов, также включены в рамки данного изобретения. Подробное описание изобретения Соединения по данному изобретению, их эфирные или амидные производные и их фармацевтически приемлемые соли являются такими, как определено выше в формуле I. Фармацевтические композиции, включающие терапевтически эффективное количество соединения вышеуказанной формулы I,включены в данное изобретение. Способы применения соединений по изобретению в качестве агентов для лечения эпилепсии, приступов дурноты, гипокинезии, черепно-мозговых расстройств, нейродегенеративных расстройств, депрессии, тревоги, паники, боли, невропатологических расстройств,нарушений сна и предменструального синдрома являются частью данного изобретения. Так как аминокислоты являются амфотерными, то фармакологически совместимые соли,в случае когда R представляет собой водород,могут быть солями соответствующих неорганических или органических кислот, например, соляной, серной, фосфорной, уксусной, щавелевой, молочной, лимонной, яблочной, салициловой, малоновой, малеиновой, янтарной и аскорбиновой. Исходя из соответствующих гидроксидов или карбонатов, образуют соли с щелочными металлами или щелочно-земельными металлами, например натрием, калием, магнием или кальцием. Также можно приготовить соли с ионами четвертичного аммония, например, с ионом тетраметиламмония. Пролекарства соединений формулы I включены в рамки данного изобретения. Аминоацил-гликолевый и -молочный эфиры известны как пролекарства аминокислот (WermuthC.G., Chemistry and Industry, 1980:433-435). Карбонильную группу аминокислот можно этерифицировать посредством известных способов. Пролекарства и мягкие лекарства известны в данной области техники (Palomino E., Drugs ofthe Future, 1990;15(4):361-368). Два последних источника включены здесь посредством ссылки. Эффективность перорально вводимого лекарства зависит от эффективного переноса лекарства через слизистый эпителий и его устойчивости в кишечно-печеночной циркуляции. Лекарства, которые эффективны при парентеральном введении, но менее эффективны при пероральном, или чей период полувыведения из плазмы считается слишком коротким, можно химически модифицировать в форму пролекарства. Пролекарство представляет собой лекарство, которое модифицировали химически, и оно может быть биологически неактивным в месте своего действия, но которое можно разложить или модифицировать посредством одного или более ферментативных или других процессов invivo до исходной биологически активной формы. Это химически модифицированное лекарство или пролекарство должно иметь другой фармакокинетический профиль по сравнению с исходным, давая возможность более легкой абсорбции через слизистый эпителий, лучшего образования соли и/или растворимости, улучшенной системной устойчивости (например, для увеличения периода полувыведения из плазмы). Этими химическими модификациями могут быть: 1) эфирные или амидные производные, которые можно расщепить при помощи, например,эстераз или липаз. Для эфирных производных,эфир получают из карбоксильной группировки молекулы лекарства посредством известных способов. Для амидных производных, амид получают из карбоксильной или аминной группировки молекулы лекарства посредством известных способов. 2) пептиды, которые можно различить при помощи специфических и неспецифических протеиназ. Пептид можно присоединить к молекуле лекарства путем образования амидной связи с карбоксильной или аминной группировкой молекулы лекарства посредством известных способов. 3) производные, которые накапливаются в месте действия благодаря мембранному отбору формы пролекарства или модифицированной формы пролекарства. 4) любое сочетание с (1) по (3). Настоящее исследование в экспериментах с животными показало, что пероральную абсорбцию определенных лекарств можно повысить посредством приготовления мягких четвертичных солей. Четвертичную соль называют мягкой четвертичной солью, так как в отличие от нормальных четвертичных солей, например R-N+(CH3)3, она может высвобождать активное лекарство при гидролизе. Мягкие четвертичные соли обладают полезными физическими свойствами по сравнению с основным лекарством или его солями. Растворимость в воде можно повысить по сравнению с другими солями, такими как гидрохлорид, но более важной может быть повышенная абсорбция лекарства из кишечника. Повышенная абсорбция, возможно, обусловлена тем фактом, что мягкая четвертичная соль обладает поверхностно-активными свойствами и способна к образованию мицелл и неионизированных ионных пар с желчными кислотами и т.д., которые могут проникать в кишечный эпителий более эффективно. Пролекарство после абсорбции быстро гидролизуется с высвобождением активного исходного лекарства. Определенные соединения по данному изобретению могут существовать в несольватированных формах, а также в сольватированных формах, включая гидратированные формы. В 5 основном, сольватированные формы, включая гидратированные формы, являются эквивалентными несольватированным формам и предназначены для включения в рамки данного изобретения. Определенные соединения по данному изобретению обладают одним или более чем одним хиральным центром, и каждый центр может существовать в R(D) или S(L) конфигурации. Данное изобретение включает все энантиомерные и эпимерные формы, а также их соответствующие смеси. Например, соединение по примеру 2 представляет собой смесь всех четырех возможных стереоизомеров. Соединение по примеру 6 представляет собой один из изомеров. Конфигурация углеродных центров циклогексанового кольца может быть R или S в тех соединениях, где конфигурацию можно определить. Использовали анализ связывания радиолигандов, используя [3 Н]габапентин и 2 субъединицу, извлеченную из ткани мозга свиньи Вышеуказанная табл. 1 показывает сродство связывания соединений по изобретению с 2 субъединицей. Соединения по изобретению сравнивали сNeurontin, имеющимся в продаже лекарством,эффективным при лечении таких расстройств как эпилепсия. Neurontin представляет собой 1-(аминометил)циклогексануксусную кислоту структурной формулы Габапентин (Neurontin) составляет примерно от 0,10 до 0,12 мкМ в этом анализе. Поэтому ожидали, что соединения по данному изобретению будут проявлять фармакологические свойства, сравнимые с габапентином. Например, в качестве агентов для лечения судорог,тревоги и боли. Данное изобретение также относится к терапевтическому применению миметиков в качестве агентов для нейродегенеративных расстройств. Такие нейродегенеративные расстройства представляют собой, например, болезнь Альцгеймера, болезнь Хантингтона, болезнь Паркинсона и боковой амиотрофический склероз. Данное изобретение также включает лечение нейродегенеративных расстройств, которые называют острым повреждением головного мозга. Они включают в себя удар, травму головы и асфиксию, но не ограничиваются ими. Удар относится к цереброваскулярному заболеванию и также может быть назван инсультом (CVA) и включает в себя острый тромбоэмболический удар. Удар включает в себя как локальную, так и общую ишемию. Также сюда включены преходящие нарушения мозгового 7 кровообращения и другие цереброваскулярные проблемы, сопровождающиеся ишемией головного мозга. Также включает лечение пациентов,перенесших, в частности, каротидную эндартерэктомию или другие цереброваскулярные или сосудистые хирургические операции вообще,или диагностические сосудистые процедуры,включая церебральную ангиографию и им подобные. Другие случаи представляют собой травму головы, травму спинного мозга или повреждения в результате общего кислородного голодания, гипоксии, гипогликемии, гипотензии, а также сходные повреждения, наблюдаемые во время операций по эмболии, гиперфузии и гипоксии. Данное изобретение будет полезным в ряде случаев, например, во время аортокоронарного шунтирования, в случаях внутричерепного кровоизлияния, при перинатальной асфиксии,при остановке сердца и эпилептическом статусе. Боль относится к острой, а также к хронической боли. Острая боль обычно является непродолжительной и связана со гиперактивностью симпатической нервной системы. Примерами служат послеоперационная боль и аллодиния. Хроническую боль обычно характеризуют как боль, сохраняющуюся от 3 до 6 месяцев и включающую в себя соматогенные боли и психогенные боли. Другая боль является ноцицептивной. Еще одна боль вызвана повреждением или инфекцией периферических нервных окончаний. Она включает в себя боль в результате повреждения периферических нервов, герпесной инфекции, сахарного диабета, каузалгии, авульсии сплетения, невромы, ампутации конечности и васкулита, но не ограничивается ими. Невропатическая боль также вызвана повреждением нервов вследствие хронического алкоголизма,ВИЧ-инфекции, гипотиреоза, уремии или недостатка витаминов. Невропатическая боль включает в себя боль, вызванную повреждением нервов, такую как, например, боль, от которой страдают диабетики, но не ограничивается ею. Психогенная боль представляет собой боль, не имеющую органического происхождения, такую как боль в нижней части спины, атипичная лицевая боль и хроническая головная боль. Другими типами болей являются: боль при воспалении, остеоартритная боль, тригеминальная невралгия, боль при раке, диабетическая невропатия, синдром усталых ног, острая герпесная и постгерпесная невралгия, каузалгия,авульсия плечевого сплетения, затылочная невралгия, подагра, фантомная боль в ампутированных конечностях, ожог и другие формы невралгии, синдром невропатической и идиопатической боли. 8 Квалифицированный врач сможет определить соответствующую ситуацию, при которой субъекты восприимчивы или подвержены риску, например, удара, а также страдают от удара,для введения посредством способов по данному изобретению. Также ожидается, что соединения по изобретению будут полезными при лечении депрессии. Депрессия может являться результатом органического заболевания,последствием стресса, связанного с личной утратой или неясного происхождения. Существует устойчивая тенденция наследственного происхождения некоторых форм депрессии, предполагающая механистическую причину по меньшей мере некоторых форм депрессии. Диагностику депрессии осуществляют главным образом путем количественной оценки изменений настроения пациентов. Эти оценки настроения обычно проводит врач или оценивает психоневропатолог, используя общепринятые оценочныешкалы, такие как депрессивная шкала Гамильтона (Hamilton Depression Rating Scale) или краткая психиатрическая оценочная шкала (Brief Psychiatric RatingScale). Разработаны другие многочисленные шкалы для количественной оценки и измерения степени изменения настроений у пациентов с депрессией, такой как бессонница, трудности с концентрацией внимания, упадок сил, чувство ненужности и вины. Критерии для диагностики депрессии, а также все психиатрические диагнозы собраны в Руководстве по диагностике и статистике психиатрических болезней (Diagnostic and Statistical Manual of MentalDisorders)(издание четвертое), именуемом DSMIV-R руководством, изданном Американской Психиатрической Ассоциацией в 1994 году. Аминомасляная кислота (ГАМК) является ингибирующим нейромедиатором центральной нервной системы. В пределах основного контекста угнетения кажется вероятным,что ГАМК-миметики могут снижать или угнетать деятельность мозга и поэтому могут замедлять деятельность и подавлять настроение, ведущее к депрессии. Соединения по данному изобретению могут оказывать противосудорожный эффект посредством увеличения уровня вновь образованной ГАМК в нервно-мышечном синапсе. Если габапентин действительно увеличивает уровень ГАМК или эффективность ГАМК в нервномышечном синапсе, тогда его можно классифицировать как ГАМК-миметик, и он может снижать или угнетать деятельность мозга и поэтому может замедлять деятельность и подавлять настроение, ведущее к депрессии. Тот факт, что агонист ГАМК или ГАМКмиметик может работать прямо противоположным образом посредством повышения настроения и, таким образом, являться антидепрессантом, представляет собой новую концепцию, ко 9 торая отличается от широко распространенного прежде мнения об активности ГАМК. Ожидается также, что соединения по данному изобретению будут полезными при лечении тревоги и паники, как показано посредством стандартных фармакологических методов. Материалы и методы Гипералгезия, вызванная каррагенином Ноцицептивные пороговые значения давления измеряли в тесте сдавливания лапок крыс,используя аналгезиметр (Randall-Selitto method:Arch. Int. Pharmacodyn., 1957;4:409-419). Самцов крыс Sprague-Dawley (70-90 г) приучали к этому прибору до дня тестирования. Давление постепенно прикладывали к задней лапке каждой крысы, и определяли ноцицептивные пороговые значения как давление (g), необходимое для того, чтобы вызвать отдергивание лапки. Пороговую точку 250 g использовали, чтобы предотвратить любое повреждение тканей лапки. В день теста проводили два или три базовых измерения перед тем, как животным вводили 100 мкл 2% каррагенина путем интраплантарной инъекции в правую заднюю лапку. Снова измеряли ноцицептивные пороговые значения через 3 ч после введения каррагенина, чтобы установить, что животные проявляют признаки гипералгезии. Животным вводили дозами либо габапентин (3-300 мг, подкожно), морфин (3 мг/кг,подкожно), либо физиологический раствор через 3,5 ч после каррагенина, и определяли ноцицептивные пороговые значения через 4, 4,5 и 5 ч после введения каррагенина. В вышеуказанной модели гипералгезии,вызванной каррагенином, тестировали (R)-2-азаспиро[4.5]декан-4-карбоновой кислоты гидрохлорид. Соединение вводили перорально дозами по 30 мг/кг, и через 1 ч после введения дозы максимально возможный эффект (МРЕ) составлял 53%. Через 2 ч после введения дозы он составлял только 4,6% МРЕ. Тонические эпилептические припадки, вызванные семикарбазидом Тонические эпилептические припадки у мышей вызывали посредством подкожного введения семикарбазида (750 мг/кг). Отмечали латентный период перед тоническим вытяжением передних лапок. Любых мышей, у которых не наблюдали судорог в течение 2 ч после введения семикарбазида, считали устойчивыми и устанавливали максимальный латентный период в пределах 120 мин. Животные Самцов крыс линии Hooded Lister (200-250 г) получали из Interfauna (Huntingdon, UK), а самцов мышей линии ТО (20-25 г) получали изBantin and Kingman (Hull, UK). Оба вида грызунов содержали в группах по шесть штук. Десять игрунок обыкновенных (Callithrix Jacchus),имеющих вес между 280 и 360 г, разводимых вManchester University Medical School (Manchester, UK), содержали парами. Всех животных содержали при 12-часовом цикле свет/темнота(свет включали в 7 ч утра), кормили и поили без ограничений. Введение лекарства Лекарства вводили либо внутрибрюшинно(IP), либо подкожно (SC) за 40 мин до теста в объеме 1 мл/кг для крыс и игрунок и 10 мл/кг для мышей. Темная/светлая камера для мышей Это установка представляла собой открытую сверху камеру 45 см длиной, 27 см шириной и 27 см высотой, разделенную на малый(2/5) и большой (3/5) отсеки при помощи перегородки, которая выходит за пределы стенок на 20 см (Costall В., et al., "Exploration of mice in ablack and white box: validation as a model of anxiety", Pharmacol. Biochem. Behav., 1989;32:777785). В центре перегородки на уровне пола находилось отверстие 7,5 х 7,5 см. Малый отсек выкрашен в черный цвет, а большой отсек в белый. Белый отсек освещали при помощи 60 Вт вольфрамовой лампы накаливания. Лабораторию освещали красным светом. Каждую мышь тестировали, помещая ее в центр белого участка и позволяя ей исследовать новую окружающую обстановку в течение 5 мин. Измеряли время, проведенное мышью на освещенной стороне (Kilfoil Т., et al., "Effects of anxiolytic andmodel of anxiety in mice", Neuropharmacol.,1989;28:901-905). Крестообразный приподнятый лабиринт для крыс Стандартный приподнятый крестообразный лабиринт (Handley S.L., et al., "Effects ofmaze-exploration model of 'fear'-motivated behavior", Naunyn-Schiedeberg's Arch. Pharmacol.,1984;327:1-5) автоматизировали, как было описано ранее (Field, et al., "Automation of the ratelevated X-maze test of anxiety", Br. J. Pharmacol.,1991;102(Suppl.):304P). Животных помещали в центр крестообразного лабиринта напротив одного из открытых рукавов. Для определения транквилизирующих эффектов измеряли вхождение и время, проведенное в дальних участках открытых рукавов, в течение 5-минутного периода теста (Costall, et al., "Use of the elevatedplus maze to assess anxiolytic potential in the rat",Br. J. Pharmacol., 1989;96(Suppl.):312p). Тестирование игрунок при угрозе со стороны человека Общее число положений тела, принятых животным по отношению к раздражителю, от которого исходит угроза (человек, стоящий приблизительно в 0,5 м от клетки игрунки и смотрящий в глаза игрунки) регистрировали в течение 2-минутного периода теста. Зафиксированные положения тела представляют собой 11 прищуренные пристальные взгляды, положение хвоста, ольфакторное мечение клетки/ перекладин, пилоэрекция, бегство и выгибание спины. Каждое животное в день теста дважды подвергали раздражителю, от которого исходит угроза,до и после введения лекарства. Разницу между этими двумя вариантами анализировали, используя односторонний дисперсионный анализ с последующим тестом Даннетта (Dunnett's ttest). Все введение лекарств осуществляли подкожно, по меньшей мере, через 2 ч после первой(контрольной) угрозы. Время подготовки для каждого соединения составляет 40 мин. Конфликтный тест на крысах Крыс приучали нажимать рычаги за вознаграждение пищей в камерах, предназначенных для выработки условных рефлексов. Программа состояла в чередовании четырех 4-минутных периодов без наказания при непостоянных 30 секундных интервалах, сигнализируемых при помощи освещения камеры, и трех 3-минутных периодов наказаний при фиксированном коэффициенте 5 (посредством электрошока лап, сопровождающего подачу пищи), сигнализируемых выключением света в камере. Степень электрошока регулировали для каждой крысы,чтобы получить приблизительно от 80% до 90% подавления ответной реакции по сравнению с реакцией без наказания. Крысы получали физиологический раствор в дни тестирования. Моделирование противосудорожной эффективности на мышах линии DBA2 Все процедуры проводили в соответствии с NIH Guide for the Care and Use of LaboratoryDBA/2, в возрасте от 3 до 4 недель, были получены из Jackson Laboratories, Bar Harbour, Maine. Непосредственно перед противосудорожным тестированием мышей помещали на проволочную сетку площадью 4 дюйма, подвешенной к стальному стержню. Площадку медленно поворачивали на 180, и наблюдали за мышами в течение 30 с. Любую мышь, которая падала с проволочной сетки, считали атаксическойmotor function in mice", Pharm. Biochem. Behav.,1977;6(3):351-3). Мышей помещали в закрытую камеру из плексигласа (высотой 21 см, диаметром приблизительно 30 см) с высокочастотным динамиком (диаметром 4 см) в центре верхней крышки. Использовали генератор звуковых сигналов (Protek model B-810), чтобы получить непрерывный синусоидальный тональный сигнал,который развертывали линейно на частоте между 8 кГц и 16 кГц каждые 10 м. Средний уровень звукового давления (SPL) во время стимуляции составлял приблизительно 100 дБ на уровне пола камеры. Мышей помещали внутрь камеры и давали им акклиматизироваться в течение одной минуты. Мыши линии DBA/2 в 12 группе, которой вводили физиологический раствор, реагировали на звуковой стимул (применяемый до появления тонического вытяжения,или в течение максимум 60 с) характерной последовательностью припадков, которые состояли из дикого метания с последующими клоническими припадками, а потом с тоническим вытяжением и, в конце концов, с остановкой дыхания и смертью у 80% и более мышей. У мышей, которым вводили физиологический раствор, вся последовательность припадков до остановки дыхания длилась приблизительно от 15 до 20 с. Фиксировали степень всех стадий припадка у мышей, которым вводили лекарство, и у мышей, которым вводили физиологический раствор, а случаи тонических припадков использовали для подсчета противосудорожных значений ED50 (средняя эффективная доза) посредством пробит-анализа (Litchfield J.T., Wilcoxon F.experiments", J. Pharmacol., 1949;96:99-113). Мышей использовали только один раз при тестировании на каждую дозу. Группы мышей линии DBA/2 (n = 5-10 на дозу) тестировали на ответные реакции на припадки, спровоцированные звуком, в течение 2 ч (предварительно определенное время максимального эффекта) после перорального введения лекарства. Все лекарства в данном исследовании растворяли в дистиллированной воде и вводили посредством искусственного перорального питания в объеме 10 мл/кг веса тела. Соединения, которые являются нерастворимыми, суспендировали в 1% карбоксиметоцеллюлозе. Дозы выражали в виде веса активного компонента лекарства. Также ожидают, что соединения по данному изобретению будут полезны при лечении боли и фобий (Am. J. Pain Manag., 1995;5:7-9). Также ожидают, что соединения по данному изобретению будут полезны при лечении симптомов маниакальной, острой или хронической, одноэпизодной или возвратной депрессии. Также ожидают, что они будут полезны при лечении и/или профилактике биполярных расстройств (патент Соединенных Штатов номер 5510381). Соединения по данному изобретению можно получать и вводить в большом разнообразии пероральных и парентеральных лекарственных форм. Таким образом, соединения по данному изобретению можно вводить посредством инъекций, то есть внутривенно, внутримышечно, внутрикожно, подкожно, внутридуоденально или внутрибрюшинно. Также соединения по данному изобретению можно вводить посредством ингаляций, например, интраназально. Кроме того, соединения по данному изобретению можно вводить чрескожно. Специалисту в данной области техники будет ясно,что следующие лекарственные формы могут содержать в качестве активного компонента либо соединение формулы I, либо соответст 13 вующую фармацевтически приемлемую соль соединения формулы I. Для получения фармацевтических композиций из соединений по данному изобретению фармацевтически приемлемые носители могут быть либо твердыми, либо жидкими. Препараты твердых форм включают порошки, таблетки,пилюли, капсулы, облатки, суппозитории и растворимые гранулы. Твердый носитель может представлять собой одно или более чем одно вещество, которое может также выступать в качестве разбавителя, ароматизатора, связующего вещества, консерванта, разрыхлителя таблетки или инкапсулирующего материала. В порошках носитель представляет собой тонко измельченное твердое вещество, которое находится в смеси с тонко измельченным активным компонентом. В таблетках активный компонент смешан с носителем, который обладает необходимыми связывающими свойствами, в приемлемых пропорциях и спрессован в требуемую форму и размер. Порошки и таблетки предпочтительно содержат от пяти или десяти до примерно семидесяти процентов активного соединения. Подходящими носителями являются карбонат магния,стеарат магния, тальк, сахар, лактоза, пектин,декстрин, крахмал, желатин, трагакант, метилцеллюлоза,натрийкарбоксиметилцеллюлоза,низкоплавкий воск, масло какао и им подобные. Подразумевают, что название препарат включает в себя препарат активного соединения с инкапсулирующим материалом в качестве носителя, который обеспечивает капсулу, в которой активный компонент с другими носителями или без них окружен носителем, который, таким образом, с ним связан. Также сюда включены облатки и лепешки. Таблетки, порошки, капсулы, пилюли, облатки и лепешки можно использовать в качестве твердых лекарственных форм,подходящих для перорального введения. Для получения суппозиториев сначала расплавляют низкоплавкий воск, такой как смесь глицеридов жирных кислот или масло какао, и равномерно диспергируют в нем активный компонент, как правило, при помощи перемешивания. Расплавленную однородную смесь затем заливают в подходящие по размеру формы, дают остыть и, таким образом, затвердеть. Препараты жидких форм включают в себя растворы, суспензии и эмульсии, например водные растворы или водные пропиленгликолевые растворы. Жидкие препараты для парентеральных инъекций можно готовить в виде раствора в водном полиэтиленгликолевом растворе. Водные растворы, подходящие для перорального применения, можно получать посредством растворения активного компонента в воде и добавления подходящих красителей, ароматизаторов, стабилизирующих агентов и загустителей, согласно требованиям. 14 Водные суспензии, подходящие для перорального применения, можно готовить посредством диспергирования тонко измельченного активного компонента в воде с вязким материалом, таким как натуральные или синтетические камеди, смолы, метилцеллюлоза, натрийкарбоксиметилцеллюлоза и другие хорошо известные суспендирующие агенты. Также включены препараты твердых форм,которые нужно превратить перед применением в препараты жидких форм для перорального введения. Такие жидкие формы включают в себя растворы, суспензии и эмульсии. Эти препараты, кроме активного компонента, могут содержать красители, ароматизаторы, стабилизаторы, буферы, искусственные и натуральные подслащивающие вещества, диспергаторы, загустители, солюбилизаторы и им подобные. Фармацевтический препарат предпочтительно находится в стандартной лекарственной форме. В такой форме препарат разделен на единичные дозы, содержащие соответствующие количества активного компонента. Стандартная лекарственная форма может представлять собой упакованный препарат, причем упаковка содержит отдельные количества препарата, такие как пакетированные таблетки, капсулы и порошки в пузырьках или ампулах. Также стандартная лекарственная форма может представлять собой саму капсулу, таблетку, облатку или лепешку,или может представлять собой соответствующее количество любой из этих форм в упакованной форме. Количество активного компонента в единичной дозе препарата можно изменять или регулировать от 0,1 мг до 1 г, в соответствии с конкретным применением и эффективностью активного компонента. При медицинском применении лекарство можно вводить три раза в день, как, например, капсулы по 100 или 300 мг. Композиция может, если требуется, содержать также другие совместимые терапевтические агенты. Соединения, используемые в фармацевтическом способе по данному изобретению, при терапевтическом применении вводят в первоначальной дозировке от примерно 0,01 мг до примерно 100 мг/кг ежедневно. Предпочтительным является диапазон ежедневной дозы от примерно 0,01 мг до примерно 100 мг/кг. Дозировки,однако, можно изменять в зависимости от потребностей пациента, тяжести состояния, которое лечат, и соединения, которое применяют. Специалист в данной области техники сможет определить подходящую дозировку для конкретной ситуации. Как правило, лечение начинают с небольших дозировок, которые меньше,чем оптимальная доза соединения. Впоследствии дозировку увеличивают путем небольших добавлений до тех пор, пока не будет достигнут оптимальный эффект при данных обстоятельствах. Для удобства общую дневную дозировку 15 можно разделить и вводить порциями в течение дня, если требуется. Следующие примеры иллюстрируют данное изобретение, но не ограничивают его. Пример 1. Гидрохлорид -(1,6)(2 аминометилоктагидроинден-2-ил)уксусной кислоты.(ТГФ) (5 мл) при 0 С в атмосфере аргона. Триэтилфосфоноацетат (0,5 мл) добавляли по каплям, и раствор перемешивали в течение 10 мин. Кетон (0,37 г; 7,7 ммоль) в ТГФ (5 мл) добавляли по каплям при перемешивании и оставляли нагреваться до комнатной температуры. Через 18 ч реакционную смесь разделяли между водой(80 мл) и диэтиловым эфиром (3x20 мл). Растворитель удаляли под вакуумом с получением желтого масла, которое очищали при помощи флэш-хроматографии (диоксид кремния, гептан/ЕtOАС 19:1). Получали 0,34 г (62%) эфира в виде бесцветного масла. 1 Н ЯМР (CDCl3) (400 МГц): 1.05-1.29 (9 Н,m, протоны кольца + СН 3), 1.76-1.78 (2 Н, m,протоны кольца), 1.87 - 1.97 (2 Н, m, протоны кольца), 2.0-2.16 (2 Н, m, протоны кольца), 2.512.56 (1 Н, dd, J = 5.7, 27.5 Гц, протоны кольца),3.12-3.18 (1 Н, dd, J = 5.4, 18.8 Гц, протоны кольца), 4.12-4.20 (2 Н, m, СН 2), 5.77 (1 Н, s, CH). МС (ES+) m/e 209 [М + Н]+ 100%. Стадия 2. Эфир (0,34 г; 1,63 ммоль) растворяли в ТГФ (5 мл) при перемешивании в атмосфере аргона. Добавляли нитрометан (0,25 мл), и нагревали реакционную смесь до 60 С. По каплям добавляли тетрабутиламмонийфторид (ТБАФ) (2,3 мл) к горячему раствору на протяжении 1 ч и перемешивали в течение 4 ч. Реакционную смесь разделяли между 2 н. HCl и диэтиловым эфиром, и слой диэтилового эфира промывали рассолом. Растворитель удаляли под вакуумом с получением желтого масла, которое очищали при помощи флэш-хроматографии(1 Н, d, J = 11.5 Гц, CH2NO2), 4.73-4.75 (1 Н, d, J = 11.5 Гц, CH2NO2). Стадия 3. Нитроэфир (0,24 г; 0,9 ммоль) растворяли в метаноле с губчатым никелем. Реакционную смесь гидрировали при 50 фунт/кв.дюйм (344,75 кПа) и 30 С в течение 15 ч. Реакционную смесь фильтровали через целит,а растворитель удаляли под вакуумом с получением продукта 0,18 г (85%) в виде желтого твердого вещества. Этот продукт представлял собой смесь лактама и аминоэфира. Стадия 4. Аминоэфир помещали в 6 н. HCl(5 мл) и диоксан (2,5 мл) и нагревали с обратным холодильником в течение 4 ч. Раствор промывали дихлорметаном (3x5 мл), и водную фракцию выпаривали под вакуумом с получением 0,196 г (99%) продукта в виде бесцветного твердого вещества. 1 Н ЯМР (ДМСО (диметилсульфоксид Стадия 1. Гидрид натрия (0,6 г; 14,5 ммоль) перемешивали с ТГФ (50 мл) при 0 С в атмосфере аргона. По каплям добавляли триэтилфосфоноацетат (2,9 мл), и перемешивали раствор в течение 10 мин. Кетон (1,8 г; 14,5 ммоль) в ТГФ (10 мл) добавляли по каплям при перемешивании и оставляли нагреваться до комнатной температуры. Через 18 ч реакционную смесь разделяли между водой (250 мл) и диэтиловым эфиром (3x50 мл). Растворитель удаляли под вакуумом с получением желтого масла, которое очищали при помощи флэшхроматографии (диоксид кремния, гептан/ ЕtOАС 19:1). Получали 1,95 г (69%) эфира в виде бесцветного масла. 1 Н ЯМР (CDCl3) (400 МГц):1.14-1.19(4 Н, m, 2 хСН 2), 2.03-2.10 (4 Н, m, 2 хСН 2), 2.452.55 (1 Н, dd, CH), 3.05-3.15 (1 Н, dd, СН), 4.12 17 4.17 (2 Н, q, J = 7.3, 14.4 Гц, СОСН 2), 5.76 (1 Н, m,СН). Стадия 2. Эфир (1,9 г; 10 ммоль) растворяли в ТГФ (15 мл) при перемешивании в атмосфере аргона. Добавляли нитрометан (1,4 мл), и нагревали реакционную смесь до 60 С. По каплям добавляли ТБАФ (14 мл) к горячему раствору в течение 1 ч и перемешивали в течение 5 ч. Реакционную смесь разделяли между 2 н. HCl и диэтиловым эфиром, и слой диэтилового эфира промывали рассолом. Диэтиловый эфир удаляли под вакуумом с получением оранжевого масла, которое очищали при помощи флэшхроматографии (диоксид кремния, гептан/ ЕtOАС 19:1) с получением 1,59 г (64%) продукта в виде бесцветного масла. 1 Н ЯМР (CDCl3) (400 МГц):1.14-1.31(2 Н, q, J = 7.1, 14.2 Гц, ОСН 2 СН 3), 4.56-4.59 (1 Н,d, J = 11.5 Гц, CH2NO2), 4.77-4.80 (1 Н, d, J = 11.5 Гц, CH2NO2). ИК (четкий) 2957, 2870, 1731, 1547, 1374,1182, 1030 см-1. Стадия 3. Нитроэфир (1,59 г; 5,9 ммоль) растворяли в метаноле (40 мл) с губчатым никелем. Реакционную смесь гидрировали при 50 фунт/кв.дюйм (344,75 кПа) и 30 С в течение 5 ч. Реакционную смесь фильтровали через целит,растворитель удаляли под вакуумом с получением лактама 1,08 г (97%) в виде белого твердого вещества с желтоватым оттенком. 1 Н ЯМР (CDCl3) (400 МГц):1.08-1.11+ Н] 21%, 381 [2 М + Na]+100%. Стадия 4. Лактам помещали в 6 н. HCl (20 мл) и диоксан (8 мл) и нагревали с обратным холодильником в течение 4 ч. Раствор промывали дихлорметаном (3x10 мл), и водную фракцию выпаривали под вакуумом с получением 0,65 г (84%) продукта в виде бесцветного твердого вещества. 1 Н ЯМР (ДМСО) (400 МГц):1.0-1.18 (4 Н,m, протоны кольца), 1.52-1.72 (6 Н, m, протоны кольца), 1.95-2.02 (2 Н, m, протоны кольца),2.33-2.67 (2 Н, m, СН 2 СО 2 Н), 2.90-2.94 (1 Н, d, J = 12.9 Гц, CH2NH2), 3.00-3.03 (1 Н, d, J = 12.7 Гц,CH2NH2), 7.94 (2 Н, bs, NH2). МС (ES+) m/e 198 [М + Н]+100%. ЖХМС (ELSD) (система жидкостной хроматограф-масс-спектрометр с испаряющим светорассеивающим детектором (evaporative lightscattering detector, ELSD, колонка 50 мм х 2 мм Стадия 1. К суспензии NaH (0,45 г; 11,3 ммоль) в ТГФ (25 мл) при 0 С в атмосфере аргона медленно добавляли (в течение примерно 10 мин) триэтилфосфоноацетат (2,3 мл; 11,6 ммоль) с последующим добавлением 5 (1,29 г; 10,4 ммоль в 2x3 мл ТГФ). Реакционной смеси давали нагреться до комнатной температуры и оставляли перемешиваться в течение 4 ч, после чего ее разбавляли водой (100 мл), экстрагировали эфиром (2x200 мл), промывали насыщенным рассолом (50 мл) и осушали (MgSO4). После колоночной хроматографии (9:1 гептан/ этилацетат) получали продукт в виде бесцветного масла, 1,75 г, 86%. ИК (тонкая пленка) (см-1)= 2964, 1713,1655, 1371, 1208, 1125, 1040. 1 Н ЯМР (CDCl3):5.72 (1 Н, m), 4.14 (2 Н,q, J = 7.2), 3.02-2.92 (1 Н, m), 2.72-2.54 (3 Н, m),2.52-2.42 (1 Н, m), 2.28-2.20 (1 Н, m), 1.85-1.31m/z AP+ 195 (MI+ 1) при 100%. Стадия 2. В раствор 6 (2,75 г; 22,2 ммоль) в ТГФ (22 мл) добавляли ТБАФ (24 мл; 24,0 ммоль) с последующим добавлением нитрометана (4,4 мл; 8,14 ммоль). Реакционную смесь нагревали (масляная баня при 60 С) в течение 4,75 ч, после чего ее разбавляли этилацетатом(100 мл) и промывали 2 М HCl (30 мл), с последующей промывкой насыщенным рассолом (40 мл), осушали (MgSO4) и концентрировали при пониженном давлении. После колоночной хроматографии (9:1 гептан/этилацетат) получали продукт в виде бесцветного масла, 0,73 г, 20%. При помощи 1 Н ЯМР установили, что продукт представляет собой смесь диастереоизомеров 9:1. 1 Н ЯМР (CDCl3):4.67 (1 Н, s), 4.60 (1 Н, s),4.15 (2 Н, q, J = 7.2), 4.14 (2 Н, q, 7.2), 2.58 (2 Н, s),2.49 (2 Н, s), 2.12-2.0 (2 Н + 2 Н, m), 1.63-1.49 (4 Н+ 4 Н, m), 1.44-1.36 (2 Н + 2 Н, m), 1.28 (3 Н, t, J = 7.2), 1.27 (3 Н, t, J= 7), 1.16-1.04 (2 Н + 2 Н, m). Стадия 3. Соединение 7 (0,88 г; 3,45 ммоль) в метаноле (100 мл) с никелевым губчатым катализатором подвергали гидрированию при 30 С и давлении 56 фунт/кв.дюйм (386,12 кПа) и оставляли на 5 ч. Перед использованием никелевый губчатый катализатор промывали 19 несколько раз сначала водой, а затем метанолом. После завершения гидрирования реакционную смесь фильтровали через целит, и получившийся раствор концентрировали под вакуумом с получением желтого твердого вещества,0,62 г, 80%. 1 Н ЯМР (CDCl3):5.43 (1 Н, br s), 3.15 (2 Н,s), 2.56-2.44 (3 Н, m), 1.99 (2 Н, dd, J= 12.6, 8.2),1.64-1.50 (2 Н, m), 1.44-1.34 (3 Н, m), 1.22-1.14(2 Н, m). m/z ES+ 226 (MI+ 1) при 100%. Стадия 4. Соединение 8 (0,61 г; 2,7 ммоль) в диоксане (10 мл) и 6 М HCl (30 мл) нагревали с обратным холодильником (масляная баня при 100 С) в течение 4 ч. После охлаждения реакционную смесь разбавляли водой (40 мл), промывали дихлорметаном (3x40 мл) и концентрировали под вакуумом с получением белого кристаллического продукта в виде диастереоизомеров в соотношении 6:1. Продукт дважды перекристаллизовывали из этилацетата/метанола с получением смеси диастереоизомеров 10:1.Dean-Stark в течение 6 ч. Смеси давали остыть, а затем разбавляли этилацетатом (100 мл) и промывали насыщенным раствором гидрокарбоната натрия (60 мл). Отделяли органический слой, а водный слой экстрагировали далее этилацетатом (2x50 мл). Объединенные органические(MgSO4), и выпаривали растворитель при пониженном давлении. Остаток хроматографировалиmax(пленка)/см-1 1483, 1331, 1291, 1105; Н (400 МГц; CDCl3): 7.19-7.14 (4 Н, m, Ph), 4.02 (4 Н, s,2 хСН 2 СО 2), 3.18 (4 Н, s, 2 хСН 2 О). Синтез соединения 2 Ацеталь 1 (0,5 г; 2,84 ммоль) в этаноле (50 мл) встряхивали с каталитическим количеством 5% родия на оксиде алюминия в атмосфере водорода (70 фунт/кв.дюйм (482,65 кПа), 50 С) в течение 16 ч. Катализатор отфильтровывали, и растворитель выпаривали при пониженном давлении с получением ацеталя 2 (0,51 г; 99%) в виде бесцветного масла;(6 Н, m). Синтез соединения 3 Ацеталь 2 (1,01 г; 5,54 ммоль) перемешивали в смеси 2 н. соляной кислоты (10 мл) и ацетона (10 мл) в течение 24 ч. По прошествии этого времени ТСХ показывала полное исчерпание исходного ацеталя. Добавляли насыщенный раствор карбоната натрия (20 мл), и смесь экстрагировали эфиром (3x25 мл). Объединенные эфирные фракции промывали рассолом, осушали (MgSO4), и выпаривали растворитель при пониженном давлении. Остаток хроматографировали (SiO2, пентан/эфир, 95:5) с получением кетона 3 (0,75 г; 97%) в виде бесцветного масла;Rf (гептан/этилацетат, 8:2) 0,42; max (пленка)/см-1 1743 (С = О); Н (400 МГц; CDCl3): 2.372.28 (2 Н, m), 2.20 (2 Н, dd, J=18.5, 7.5), 2.12 (2 Н,dd, J= 18.7, 6.3), 1.65-1.24 (10 Н, m). Синтез соединения 4 Триэтилфосфоноацетат (1,13 мл; 5,70 ммоль) по каплям добавляли к перемешиваемой суспензии гидрида натрия (0,22 г 60% дисперсии в масле; 5,43 ммоль) в ТГФ (15 мл) при 0 С в атмосфере аргона. Через 20 мин по каплям добавляли кетон 3 (0,75 г; 5,43 ммоль) в ТГФ (6 мл). Смеси давали нагреться до комнатной температуры и перемешивали в течение 16 ч. Добавляли воду (5 мл), и экстрагировали смесь эфиром (15 мл х 3). Объединенные органические фракции промывали рассолом и осушали(МgSО 4). Растворитель выпаривали при пониженном давлении. Остаток хроматографировали(20 мл) и подкисляли разбавленной соляной кислотой (15 мл). Отделяли органический слой,и водный слой далее экстрагировали этилацетатом (2x15 мл). Объединенные органические фракции промывали рассолом,осушали(МgSO4), и выпаривали растворитель при пониженном давлении. Остаток хроматографировали(30 мл) встряхивали с каталитическим количеством катализатора губчатого никеля в атмосфере водорода (50 фунт/кв.дюйм (344,75 кПа),30 С) в течение 12 ч. Смесь фильтровали, и растворитель выпаривали при пониженном давлении с получением смеси 9:1 аминоэфиров 7 и 8(0,42 г; 72%) в виде белого твердого вещества;(1,6,8)(2-аминометилоктагидроинден-2-ил)уксусной кислоты. Смесь 7 и 8 (0,42 г; 2,17 ммоль) растворяли в 1,4-диоксане (8 мл) и соляной кислоте (20 мл 6 н. раствора), и нагревали смесь с обратным холодильником в течение 6 ч. После охлаждения смесь разбавляли водой (20 мл) и промывали дихлорметаном (2x15 мл). Водный слой упаривали при пониженном давлении с получением смеси кислот 9 и 10 (0,43 г; 79%) 9:1 в виде белого твердого вещества. Перекристаллизация с использованием этилацетата/метанола давала исключительно кислоту 9 (0,27 г); Н (400 МГц; Синтез соединения 1 н-Бутиллитий (5,1 мл 2,5 М раствора в гексане; 12,75 ммоль) по каплям добавляли к перемешиваемой смеси нитрометана (0,34 мл, 6,3 ммоль) в ТГФ (20 мл) и НМРА (гексаметилфосфортриамид) (2 мл) при -78 С в атмосфере аргона. Смеси давали нагреться до -60 С и перемешивали в течение 1 ч. Смесь охлаждали до-78 С, и добавляли 3 (0,79 г; 5,73 ммоль). Смеси давали нагреться до -60 С и перемешивали в течение 2 последующих часов. Смесь гасили путем добавления насыщенного раствора хлорида аммония (5 мл). После нагревания до комнатной температуры добавляли разбавленную соляную кислоту (10 мл) и эфир (30 мл). Отделяли органический слой, и водный слой далее экстрагировали эфиром (2x25 мл). Объединенные органические фракции промывали рассолом, осушали (МgSО 4), и выпаривали растворитель при пониженном давлении. Остаток хроматографировали (SiO2, гептан/этилацетат, 95:5) с получением нитроспирта 1 (0,50 г; 43%) в виде белого твердого вещества; Rf (гептан/ этилацетат, 9:1) 0,14; max(CH2Cl2)/cм-1 3424 (ОН), 1548(2 Н, s, CH2NO2), 3.26 (1 Н, s, ОН), 2.04-1.95 (2 Н,m), 1.85-1.80 (4 Н, m), 1.64-1.24 (8 Н, m). Синтез соединения 2 Смесь 1 (0,50 г; 2,49 ммоль) и концентрированной серной кислоты (1 капля) нагревали до 50 С в уксусном ангидриде (1 мл) в течение 5 мин. Смеси давали остыть и затем разделяли между эфиром (100 мл) и водой (50 мл). Слой эфира промывали рассолом, осушали (MgSO4),и выпаривали растворитель при пониженном давлении с получением нитроацетата 2 (0,49 г; 82%) в виде бесцветного масла; Rf (гептан/ этилацетат, 9:1) 0,44; mах(пленка)/см-1 1739 23 Метилат калия (0,15 г; 2,04 ммоль) в метаноле (3 мл) по каплям добавляли к перемешиваемому раствору 2 (0,49 г; 2,04 ммоль) в метаноле (5 мл) при 0 С. Через 10 мин смесь разделяли между эфиром (100 мл) и водой (50 мл). Слой эфира промывали рассолом, осушали(MgSO4), и выпаривали растворитель при пониженном давлении. Остаток хроматографировали= 2.0, CHNO2), 3.01 (1 Н, ddt, J = 20.5, 8.0, 2.1),2.90 (1 Н, ddt, J = 20.5, 7.3, 2.1), 2.54 (1 Н, ddt, J = 17.8, 7.1, 2.0), 2.43 (1 Н, ddt, J = 17.7, 5.6, 1.9),2.21 (1 Н, m), 2.12 (1 Н, m), 1.60-1.24 (8 Н, m). Синтез соединения 4 Этилацетат (0,12 мл; 1,22 ммоль) в ТГФ (2 мл) по каплям добавляли к перемешиваемому раствору бис(триметилсилил)амида лития (1,22 мл 1 М раствора в ТГФ; 1,22 ммоль) при -78 С в атмосфере аргона. Через 20 мин добавляли 3(0,21 г; 1,16 ммоль) в ТГФ (1 мл), и смесь перемешивали в течение 2 ч. Смесь гасили путем добавления насыщенного раствора хлорида аммония (3 мл) и давали нагреться до комнатной температуры. Смесь разбавляли эфиром (20 мл),и добавляли разбавленную соляную кислоту (15 мл). Отделяли органический слой, и водный слой далее экстрагировали эфиром (2x10 мл). Объединенные органические фракции промывали рассолом, осушали (МgSO4), и выпаривали растворитель при пониженном давлении. Остаток хроматографировали (SiO2, гептан/этилацетат, 99:1) с получением нитроэфира 4 (0,13 г; 41%) в виде бесцветной жидкости; Rf (гептан/этилацетат, 9:1) 0,32; mах(пленка)/см-1 1731(3H, t, J = 7.2, CO2CH2Me); m/z (ES+) 270 (M + H,100%). Синтез соединения 5 Встряхивали 4 (0,122 г; 0,45 ммоль) в метаноле (40 мл) с каталитическим количеством катализатора губчатого никеля в атмосфере водорода (60 ф/кв.дюйм (413,7 кПа), 30 С) в течение 6 ч. Смесь фильтровали, и растворитель выпаривали при пониженном давлении с получением аминоэфира 5 (0,084 г; 96%) в виде белого твердого вещества; mах(пленка)/см-1 3228 24 мл 6 н. раствора), и нагревали смесь с обратным холодильником в течение 5 ч. После охлаждения смесь разбавляли водой (20 мл) и промывали дихлорметаном (2x15 мл). Водный слой упаривали при пониженном давлении с получением кислоты 6 (0,097 г; 91%) в виде белого твердого вещества. Ее перекристаллизовывали с использованием этилацетата/метанола с получением чистого 10 (0,057 г); Н (400 МГц; d6-ДМСО): 7.90 (2 Н, br s, NH2), 3.02 (2 Н, s, CH2NH2), 2.43 Синтез соединения 1 Алюмогидрид лития (69,4 мл 1 М раствора в эфире, 69,4 ммоль) по каплям добавляли к перемешиваемому раствору цис-циклобутан-1,2 дикарбоновой кислоты (5 г; 34,7 ммоль) в ТГФ(60 мл) при 0 С в атмосфере аргона. Смеси давали нагреться до комнатной температуры и перемешивали в течение 16 ч. Смесь охлаждали до 0 С и гасили путем осторожного добавления воды (2,7 мл), раствора гидроксида натрия (2,7 мл 15%-ного (мас/об) раствора) и воды (8,1 мл). Смесь перемешивали в течение 15 мин и осадок удаляли посредством фильтрации. Растворитель выпаривали при пониженном давлении с получением спирта 1 в виде бесцветного масла (4,0 г; 98%); н (400 МГц; CDCl3): 3.85 (2 Н, m), 3.6 (2 Н,m), 3.2 (2 Н, s), 2.7 (2 Н, m), 2 (2 Н, m), 1.55 (2 Н,m); C (400 МГц; CDCl3): 63.15, 37.83, 20.40. Синтез соединения 2 Мезилхлорид (6,2 мл; 79,1 ммоль) по каплям добавляли к перемешиваемому раствору 1-40 С в атмосфере аргона. Затем по каплям добавляли триэтиламин (12,0 мл; 86,0 ммоль), и давали смеси медленно нагреться до комнатной температуры. После перемешивания в течение 16 ч смесь гасили путем добавления разбавленной соляной кислоты (50 мл). Отделяли органический слой, а водный слой далее экстрагировали дихлорметаном (2x50 мл). Объединенные органические фракции промывали рассолом,осушали (МgSO4), и выпаривали растворитель 25 при пониженном давлении. Остаток хроматографировали (SiO2, гептан/этилацетат, 6:4) с получением мезилата 2 (6,1 г; 73%) в виде белого твердого вещества; Rf (гептан/этилацетат,1:1) 0,18. н (400 МГц; CDCl3): 4.3 (4 Н, m), 3.05(400 МГц; CDCl3): 69.51, 37.45, 35.28, 21.09. Синтез соединения 3 Безводный бромид лития (10,6 г; 121,8 ммоль) добавляли к перемешиваемой смеси 2(5,95 г; 24,4 ммоль) в ацетоне (50 мл) в атмосфере аргона, и нагревали смесь с обратным холодильником в течение 2 ч. После охлаждения ацетон выпаривали при пониженном давлении, а остаток помещали в эфир (50 мл), промывали водой (50 мл), рассолом, осушали (MgSO4),и выпаривали растворитель при пониженном давлении. Остаток хроматографировали (SiO2,гептан/этилацетат, 95:5) с получением дибромида 3 (5,36 г; 86%) в виде оранжевой жидкости;CDCl3): 3.6 (2 Н, m), 3.45 (2 Н, m), 2.85 (2 Н, m),2.1 (2 Н, m), 1.7 (2 Н, m); с (400 МГц; CDCl3): 39.70, 33.79, 23.95. Синтез соединения 4 К охлажденной (0 С) суспензии гидрида калия (1,58 г; 39,5 ммоль) (предварительно троекратно промытого пентаном) в тетрагидрофуране (22 мл) добавляли в атмосфере аргона раствор метил-метилтиометилсульфоксида (1,36 мл; 13,04 ммоль, предварительно высушенного на молекулярных ситах в течение 3 ч) в тетрагидрофуране (3 мл) в течение 1 ч. После перемешивания в течение последующих 30 мин добавляли раствор 3 (3,17 г; 13,1 ммоль) в ТГФ (2 мл) при 0 С в течение 1 ч. Реакционной смеси затем давали нагреться до комнатной температуры и перемешивали в течение ночи. Смесь гасили путем добавления водного хлорида аммония (6 мл; 25%). Через 10 мин твердую фазу отфильтровывали, а фильтрат концентрировали. Остаток помещали в эфир (20 мл), и добавляли 9 н. серную кислоту (0,05 мл). После перемешивания в течение 30 ч добавляли насыщенный гидрокарбонат натрия. Эфирную фазу отделяли и концентрировали до 5 мл. Добавляли насыщенный раствор гидросульфита натрия (1,5 г), и перемешивали смесь в течение 30 мин. Разделяли фазы. Эфирную фазу перемешивали в течение последующих 30 мин с насыщенным раствором гидросульфита натрия (0,5 г). Разделяли фазы, собранные водные фазы обрабатывали водным гидроксидом натрия (5 мл; 20%) и экстрагировали эфиром. Эфирную фазу осушали(MgSO4) и упаривали при пониженном давлении с получением 4 в виде желтой жидкости (0,16 г; 11%). н (400 МГц; CDCl3): 3.0 (2 Н, m), 2.15-2.45 26 Триэтилфосфоноацетат (0,32 мл; 1,61 ммоль) по каплям добавляли к перемешиваемой суспензии гидрида натрия (0,059 г 60% дисперсии в масле; 1,47 ммоль) в ТГФ (2 мл) при 0 С в атмосфере аргона. Через 20 мин по каплям добавляли кетон 4 (0,16 г; 1,45 ммоль) в ТГФ (1 мл). Смеси давали нагреться до комнатной температуры и перемешивали в течение 16 ч. Добавляли воду (5 мл), и экстрагировали смесь этилацетатом. Объединенные органические фракции промывали рассолом и осушали(MgSO4). Выпаривали растворитель при пониженном давлении. Остаток хроматографировали(0,092 мл; 1,7 ммоль) и тетрабутиламмонийфторид (1,03 мл 1 М раствора в ТГФ, 1,03 ммоль) нагревали до 65 С в ТГФ (1 мл) в течение 4 ч. Смеси давали остыть, разбавляли эфиром (30 мл) и подкисляли 2 н. соляной кислотой (5 мл). Органический слой промывали рассолом, осушали (МgSO4), и выпаривали растворитель при пониженном давлении. Остаток хроматографировали (SiO2, гептан/эфир, 95:5) с получением нитроэфира 6 (0,085 г; 0,35 ммоль; 41%) в виде бесцветной жидкости; Н (400 МГц; CDCl3): 4.4(400 МГц; CDCl3): 171.48, 79.68, 60.52, 50.10,44.15, 41.06, 37.36, 25.76, 14.28. Синтез соединений 7 А и 7 В Нитроэфир 6 (0,076 г; 0,31 ммоль) в метаноле (10 мл) встряхивали с каталитическим количеством катализатора губчатого никеля в атмосфере водорода (50 ф/кв.дюйм (344,75 кПа),30 С) в течение 12 ч. Смесь фильтровали и растворитель выпаривали при пониженном давлении с получением смеси лактама 7 А и аминоэфира 7 В (0,05 г) в виде белого твердого вещества. Его использовали без дальнейшей очистки и определения параметров. Синтез соединения 8 7 А и 7 В (0,05 г) растворяли в соляной кислоте (2 мл 6 н. раствора), и нагревали смесь с обратным холодильником в течение 4 ч. После охлаждения растворитель выпаривали при пониженном давлении с получением кислоты в виде белого твердого вещества. Его перекристаллизовывали с использованием этилацетата/метанола с получением чистого 8 (0,045 г; 0,2 ммоль, 64%); Н (400 МГц; D2O): 3 (2 Н, s), 2.85 Синтез соединения 1 Алюмогидрид лития (134,8 мл 1 М раствора в эфире, 134,8 ммоль) по каплям добавляли к перемешиваемому раствору цис-циклобутан 1,2-дикарбоновой кислоты (9,71 г; 67,39 ммоль) в ТГФ (120 мл) при 0 С в атмосфере аргона. Смеси давали нагреться до комнатной температуры и перемешивали в течение 16 ч. Смесь охлаждали до 0 С и гасили путем осторожного добавления воды (5,2 мл), раствора гидроксида натрия (5,2 мл 15%-ного (мас./об) раствора) и воды (15,7 мл). Смесь перемешивали в течение 15 мин, и осадок удаляли посредством фильтрации. Растворитель выпаривали при пониженном давлении с получением спирта 1 в виде бледножелтого масла (6,73 г; 57,64 ммоль; 85%); Н(2 Н, s), 2.7 (2 Н, m), 2 (2 Н, m), 1.55 (2 Н, m). Синтез соединения 2 Мезилхлорид (29,3 мл; 373,8 ммоль) по каплям добавляли к перемешиваемому раствору 1-40 С в атмосфере аргона. Затем по каплям добавляли триэтиламин (63,4 мл: 454,4 ммоль), и давали смеси медленно нагреться до комнатной температуры. После перемешивания в течение 16 ч смесь гасили путем добавления разбавленной соляной кислоты (100 мл). Отделяли органический слой, а водный слой далее экстрагировали дихлорметаном (2x100 мл). Объединенные органические фракции промывали рассолом,осушали (MgSO4), и выпаривали растворитель при пониженном давлении. Остаток хроматографировали (SiO2, гептан/этилацетат, 6:4) с получением мезилата 2 (15,89 г; 58,3 ммоль; 77%) в виде белого твердого вещества; Н (400 МГц; CDCl3): 3.0 (6 Н, m), 2.6 (2 Н, m), 2.05 (2 Н,m), 1.8 (2 Н, m). Синтез соединения 3 Безводный бромид лития (25 г; 287,3 ммоль) добавляли к перемешиваемой смеси 2(15,84 г; 57,4 ммоль) в ацетоне (150 мл) в атмосфере аргона, и нагревали смесь с обратным холодильником в течение 2 ч. После охлаждения ацетон выпаривали при пониженном давле 005206(MgSO4), и выпаривали растворитель при пониженном давлении с получением дибромида 3(2 Н, m), 2.05 (2 Н, m), 1.6 (2 Н, m). Синтез соединения 4 К охлажденной (0 С) суспензии гидрида калия (1,08 г; 27 ммоль) (предварительно троекратно промытого пентаном) в ТГФ (15 мл) добавляли в атмосфере аргона раствор метилметилтиометилсульфоксида (0,93 мл; 8,92 ммоль, предварительно высушенного на молекулярных ситах в течение 3 ч) в ТГФ (2 мл) в течение 1 ч. После перемешивания в течение последующих 30 мин добавляли раствор 3 (2,16 г; 8,93 ммоль) в ТГФ (1 мл) при 0 С в течение 1 ч. Реакционной смеси затем давали нагреться до комнатной температуры и перемешивали в течение ночи. Смесь гасили путем добавления водного хлорида аммония (6 мл; 25%). Через 10 мин твердую фазу отфильтровывали, а фильтрат концентрировали. Остаток помещали в эфир (20 мл), и добавляли 9 н. серную кислоту (0,03 мл). После перемешивания в течение 30 ч добавляли насыщенный гидрокарбонат натрия. Эфирную фазу отделяли и концентрировали до 5 мл. Добавляли насыщенный раствор гидросульфита натрия (1,5 г), и перемешивали смесь в течение 30 мин. Разделяли фазы. Эфирную фазу перемешивали в течение последующих 30 мин с насыщенным раствором гидросульфита натрия(0,5 г). Разделяли фазы, собранные водные фазы обрабатывали водным гидроксидом натрия (5 мл; 20%) и экстрагировали эфиром. Эфирную фазу осушали (MgSO4), и выпаривали растворитель при пониженном давлении с получением 4 в виде желтой жидкости (0,141 г; 15%). Н (400 МГц; CDCl3): 2.25 (4 Н, m), 2.0 (4 Н, m), 1.7 (2H,m). Синтез соединения 5 Триэтилфосфоноацетат (0,28 мл; 1,41 ммоль) по каплям добавляли к перемешиваемой суспензии гидрида натрия (0,052 г 60% дисперсии в масле; 1,29 ммоль) в ТГФ (2 мл) при 0 С в атмосфере аргона. Через 20 мин по каплям добавляли кетон 4 (0,141 г; 1,28 ммоль) в ТГФ (1 мл). Смеси давали нагреться до комнатной температуры и перемешивали в течение 16 ч. Добавляли воду (5 мл), и экстрагировали смесь. Объединенные органические фракции промывали рассолом и осушали (MgSO4). Выпаривали растворитель при пониженном давлении. Остаток хроматографировали (SiO2, гептан/этилацетат, 95:5) с получением эфира 5 (0,092 г; 0,51 ммоль; 40%) в виде бесцветного масла; Н (400 МГц; CDCl3): 5.85 (1 Н, s), 4.1 (2 Н, q), 3.1 (1 Н,d.d), 2.45 (1 Н, d.d), 2.2 (2 Н, m), 1.75 (2 Н, m), 1.4(0,055 мл; 1,02 ммоль) и тетрабутиламмонийфторид (0,61 мл 1 М раствора в ТГФ, 0,61 ммоль) нагревали до 65 С в ТГФ (1 мл) в течение 4 ч. Смеси давали остыть, разбавляли эфиром (30 мл) и подкисляли 2 н. соляной кислотой (5 мл). Органический слой промывали рассолом, осушали (MgSO4), и выпаривали растворитель при пониженном давлении. Остаток хроматографировали (SiO2, гептан/эфир, 95:5) с получением нитроэфира 6 (0,063 г; 0,26 ммоль; 52%) в виде бесцветной жидкости; Н (400 МГц; CDCl3): 4.65(2 Н, [AB]q), 4.15 (2 Н, q), 2.65 (2 Н, [AB]q), 1.21.95 (3 Н, t и m, 13H); С (400 МГц; CDCl3): 171.28, 82.42, 60.56, 49.97, 45.80, 45.32, 42.88,40.19, 40.09, 27.64, 14.26. Синтез соединений 7 А и 7 В Нитроэфир 6 (0,063 г; 0,26 ммоль) в метаноле (10 мл) встряхивали с каталитическим количеством катализатора губчатого никеля в атмосфере водорода (50 фунт/кв.дюйм (344,75 кПа), 30 С) в течение 12 ч. Смесь фильтровали,а растворитель выпаривали при пониженном давлении с получением смеси лактама 7 А и аминоэфира 7 В (0,051 г) в виде белого твердого вещества. Его использовали без дальнейшей очистки и определения параметров. Синтез соединения 8 7 А и 7 В (0,051 г) растворяли в соляной кислоте (2 мл 6 н. раствора), и нагревали смесь с обратным холодильником в течение 4 ч. После охлаждения растворитель выпаривали при пониженном давлении с получением кислоты в виде белого твердого вещества. Его перекристаллизовывали с использованием этилацетата/метанола с получением чистого 8 (0,046 г; 0,21 ммоль, 81%); н (400 МГц; D2O): 3.3 (2 Н,[AB]q), 2.7 (2 Н, [AB]q), 2 (2 Н, m), 1.35-1.85 (8 Н,т); С (400 МГц; D2O): 174.8, 47.50, 46.59, 44.28,43.61, 41.64, 38.37, 38.09, 25.88. m/z (ES+) 184N,N-диметилформамиде (ДМФ) (100 мл) в течение 48 ч. Добавляли разбавленную соляную кислоту (100 мл), и экстрагировали смесь эфиром(3x100 мл). Объединенные органические фракции промывали рассолом, осушали (MgSO4), и 30 выпаривали растворитель при пониженном давлении. Остаток хроматографировали (SiO2, гептан/этилацетат, 98:2) с получением цианоэфира 2 (4,3 г; 100%) в виде смеси диастереоизомеров 68:32; Rf (гептан/этилацетат, 9:1) 0,28; max(0,14 мл; 7,82 ммоль) и хлорид лития (0,66 г; 15,6 ммоль) нагревали до 150 С в ДМСО (40 мл) в течение 22 ч. Смеси давали остыть, разбавляли водой (150 мл) и экстрагировали эфиром (3x50 мл). Объединенные эфирные фракции промывали рассолом, осушали (МgSO4), и выпаривали растворитель при пониженном давлении. Остаток хроматографировали(0,21 г; 44%) в виде смеси диастереоизомеров 60:40; Rf (гептан/этилацетат, 9:1) 0,44;(1 Н, m), 2.87 (2 Н, m), 2.32-2.18 (2 Н, m), 2.101.96 (3 Н, m), 1.92-1.78 (2 Н, m), 1.48-1.38 (1 Н,m). Синтез соединения (4) Цианид 3 (0,86 г; 7,1 ммоль) в ТГФ (30 мл) по каплям добавляли в течение 1 ч к перемешиваемой смеси гексаметилдисилазида лития (7,8 мл 1 М раствора в ТГФ; 7,8 ммоль) в ТГФ (40 мл) при -78 С в атмосфере аргона. Смеси давали нагреться до -40 С и перемешивали в течение 2 ч. Смесь охлаждали до -78 С, и добавляли диметилаллилбромид (1,3 мл; 10,6 ммоль). Смесь перемешивали в течение 2 последующих часов при -78 С, а затем давали нагреться до комнатной температуры в течение ночи. Добавляли насыщенный раствор хлорида аммония (20 мл),и разбавляли смесь эфиром (50 мл) и разбавленной соляной кислотой (30 мл). Водный слой далее экстрагировали эфиром (2x50 мл), а объединенные органические фракции промывали рассолом, осушали (МgSO4), и выпаривали растворитель при пониженном давлении. Остаток хроматографировали (SiO2, гептан/этилацетат,98:2) с получением цианоалкена 4 (0,96 г; 72%) в виде бесцветного масла; Rf (гептан/этилацетат, 95:5) 0,38; mах(пленка)/см-1 2230m/z (AP+) 190 (M + H, 100%). Синтез соединения (5) Цианоалкен 4 (0,96 г; 5,1 ммоль) и гидроксид натрия (10,2 мл 2,5 М раствора в метаноле; 25,5 ммоль) совместно перемешивали в дихлорметане (80 мл) при -78 С. Озон пропускали через смесь, которая немедленно становилась оранжевой. Через 2 ч смесь приобретала зеленый цвет, и раствор продували кислородом в течение 5 мин, а затем азотом. Перемешиваемую смесь разбавляли эфиром (100 мл) и водой(100 мл) и давали нагреться до комнатной температуры в течение ночи. Водный слой далее экстрагировали эфиром (2x50 мл), а объединенные органические фракции промывали рассолом, осушали (МgSO4), и выпаривали растворитель при пониженном давлении. Остаток хроматографировали (SiO2, гептан/этилацетат, 95:5) с получением цианоэфира 5 (0,70 г; 71%) в виде желтого масла; Rf (гептан/этилацетат, 8:2) 0,36;(100 мл) встряхивали с каталитическим количеством катализатора губчатого никеля в атмосфере водорода (60 фунт/кв.дюйм (413,70 кПа),30 С) в течение 6 ч. Смесь фильтровали, и растворитель выпаривали при пониженном давлении с получением лактама 6 (0,64 г; 92%) в виде белого твердого вещества; mаx(пленка)/см-1 1692 (С=О); Н (400 МГц; CDCl3): 5.52 (1 Н, br s,NH), 3.54 (2 Н, s, СН 2NH), 2.80 (2 Н, m), 2.26 (2 Н,m), 2.16 (2 Н, s, СН 2 СО), 1.93 (2 Н, ddd, J 13.4,8.1, 2.4), 1.74 (2 Н, dd, J 13.0, 3.2), 1.64 (2 Н, m). Синтез гидрохлорида (1,3,5)(3-аминометилбицикло[3.2.0]гепт-3-ил)уксусной кислоты. Лактам 6 (0,64 г; 3,87 ммоль) растворяли в 1,4-диоксане (4 мл) и соляной кислоте (16 мл 6 н. раствора), и нагревали смесь с обратным холодильником в течение 6 ч. После охлаждения смесь разбавляли водой (20 мл) и промывали дихлорметаном (2x15 мл). Водный слой выпаривали при пониженном давлении с получением кислоты 7 (0,67 г; 79%) в виде белого твердого вещества. Перекристаллизация с использованием этилацетата/метанола давала исключительно кислоту 7 (0,26 г); н (400 МГц; d6-ДМСО): 7.98 32 Следующие соединения получены посредством одного из вышеуказанных способов: 2R,4S,9S)-2-аминометилдекагидробензоциклофептен-2-ил)уксусная кислота. Следующие способы относятся конкретно к получению (1,3,5)(3-аминометилбицикло Нитрометан добавляют к ненасыщенному эфиру в растворителе, таком как диметилсульфоксид или N,N-диметилформамид, с основанием, таким как карбонат калия, карбонат натрия или карбонат цезия, при температуре от 0 С до 120 С. Этот способ дает более высокий выход нитроэфира и сокращает выход несопряженного эфира по сравнению с предыдущими способами. Способ 2 А а) Алкилцианацетат, например, этилцианацетат добавляли к смеси циклопентанона формулы (1) в растворителе, выбранном из толуола,бензола, ксилолов или н-гептана, к которой добавляли уксусную кислоту и -аланин или ацетат аммония, или пиперидин. Смесь перемешивали при температуре от 0 до 150 С с удалением воды посредством, например, использования отделителя Dean-Stark или активированных молекулярных сит, для получения алкена формулы(2); б) добавление продукта вышеуказанной стадии (а) к смеси бензилмагнийхлорида или бензилмагнийбромида, или бензилмагнийиодида в безводном растворителе, выбранном из тетрагидрофурана, 1,4-диоксана, н-гептана, толуола, диэтилового эфира или трет-бутилметилового эфира, при температуре от -100 до 110 С, для получения дополнительного продукта формулы (3); в) добавление продукта вышеуказанной стадии (б) к смеси основания, выбранного из гидроксида калия, гидроксида натрия, гидроксида лития или гидроксида цезия, в растворителе, выбранном из этиленгликоля, 2 метоксиэтилового эфира, 1,4-диоксана или диэтиленгликоля, и перемешивание смеси при температуре от 25 до 250 С для получения карбоновой кислоты формулы (4); 35 г) добавление продукта вышеуказанной стадии (в) к смеси иодометана в растворителе,выбранном из дихлорметана, хлороформа, тетрагидрофурана, толуола или 1,4-диоксана, к которой добавляли основание, такое как 1,8 диазабицикло[5.4.0]ундец-7-ен (DBU), триэтиламин или 1,5-диазабицикло[4.3.0]нон-5-ен(DBN), и перемешивали при температуре от-40 до 110 С, для получения эфира формулы (5); или добавление продукта вышеуказанной стадии (в) к смеси метанола и концентрированной кислоты, такой как серная кислота или соляная кислота при температуре, изменяющейся от 0 до 100 С; или добавление продукта вышеуказанной стадии (в) к триметилсилилдиазометану и метанолу в бензоле или толуоле при температуре от -40 до 100 С; или добавление продукта вышеуказанной стадии (в) к диазометану в растворителе, таком как бензол, толуол, дихлорметан или диэтиловый эфир, при температуре от-40 до 40 С; д) добавление продукта вышеуказанной стадии (г) к смеси четыреххлористого углерода или этилацетата и ацетонитрила, к которой добавляли воду, периодат натрия и хлорид рутения (III), и перемешивали при температуре от-40 до 80 С, для получения карбоновой кислоты формулы (6); е) добавление продукта вышеуказанной стадии (д) к смеси основания, выбранного из триэтиламина или диизопропилэтиламина, и растворителя, выбранного из толуола, бензола,ксилолов, тетрагидрофурана, диэтилового эфира или н-гептана, к которой добавляли дифенилфосфорилазид (DPPA) и перемешивание при температуре от 0 до 150 С, для получения изоцианата формулы (7); или добавление продукта вышеуказанной стадии (д) к этилхлорформиату или изобутилхлорформиату и основанию, такому как триэтиламин или диизопропилэтиламин в тетрагидрофуране или ацетоне, или диэтиловом эфире, при температуре от -40 С до 78 С с последующим добавлением азида натрия в воде или тетрагидрофуране, или ацетоне с последующим добавлением толуола или бензола и дефлегмация; и ж) добавление продукта вышеуказанной стадии (е) к растворителю, выбранному из толуола, бензола, ксилолов или н-гептана, к которому добавляли метанол или трет-бутанол, с получением (8) и затем добавление (8) к водной соляной кислоте в концентрации от 0,01 М до 12 М в присутствии или отсутствии растворителя,такого как 1,4-диоксан, уксусная кислота или вода, для получения аминокислоты (9); или добавление продукта вышеуказанной стадии (е) к растворителю, выбранному из толуола, бензола,ксилолов или н-гептана, к которому добавляли бензиловый спирт, с получением (8) и, затем,гидрирование над никелем или палладием, или платиной, с получением лактама, который затем гидролизовали при использовании водной соля 005206 36 ной кислоты в концентрации от 0,01 М до 12 М в присутствии или отсутствии растворителя,такого как 1,4-диоксан, уксусная кислота или вода, для получения аминокислоты (9). Способ 2 Б а) Цианоэфир (2) добавляли к аллилмагнийхлориду или бромиду или 2 бутенилмагнийхлориду в безводном растворителе, выбранном из тетрагидрофурана, 1,4 диоксана, н-гептана, толуола, диэтилового эфира или трет-бутил метилового эфира, при температуре от -100 С до 110 С, для получения дополнительного продукта формулы (10); б) добавление продукта вышеуказанной стадии (а) к смеси основания, выбранного из гидроксида калия, гидроксида натрия, гидроксида лития или гидроксида цезия, в растворителе, выбранном из этиленгликоля, 2 метоксиэтилового эфира, 1,4-диоксана или диэтиленгликоля, и перемешивание смеси при температуре от 25 до 250 С, для получения карбоновой кислоты формулы (11); в) добавление продукта вышеуказанной стадии (б) к смеси иодометана в растворителе,выбранном из дихлорметана, хлороформа, тетрагидрофурана, толуола или 1,4-диоксана, к которой добавляли основание, такое как 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), триэтиламин или 1,5-диазабицикло[4.3.0]нон-5-ен(DBN), и перемешивали при температуре от-40 до 110 С, для получения эфира формулы(11); или добавление продукта вышеуказанной стадии (б) к смеси метанола и концентрированной кислоты, такой как серная кислота или соляная кислота при температуре, изменяющейся от 0 до 100 С; или добавление продукта вышеуказанной стадии (б) к триметилсилилдиазометану и метанолу в бензоле или толуоле при температуре от -40 до 100 С; или добавление продукта вышеуказанной стадии (б) к диазометану в растворителе, таком как бензол, толуол, дихлорметан или диэтиловый эфир, при температуре от -40 до 40 С; и г) добавление продукта вышеуказанной стадии (в) к смеси четыреххлористого углерода или этилацетата и ацетонитрила, к которой добавляли воду, периодат натрия и хлорид рутения (III), и перемешивали при температуре от-40 до 80 С, для получения карбоновой кислоты формулы (6). а) металлорганический реагент, такой как виниллитий или винилмагний хлорид или бромид, в растворителе, таком как тетрагидрофуран или диэтиловый эфир, при температуре от-100 до 0 С добавляют к цианоэфиру (2) с получением (13); б) добавление продукта вышеуказанной стадии (а) к смеси основания, выбранного из гидроксида калия, гидроксида натрия, гидроксида лития или гидроксида цезия, в растворителе, выбранном из этиленгликоля, 2 метоксиэтилового эфира, 1,4-диоксана или диэтиленгликоля, и перемешивание смеси при температуре от 25 до 250 С, для получения карбоновой кислоты формулы (14); в) добавление продукта вышеуказанной стадии (б) к смеси иодметана в растворителе,выбранном из дихлорметана, хлороформа, тетрагидрофурана, толуола или 1,4-диоксана, к которой добавляли основание, такое как 1,8 диазабицикло[5.4.0]ундец-7-ен (DBU), триэтиламин или 1,5-диазабицикло[4.3.0]нон-5-ен(DBN), и перемешивали при температуре от-40 до 110 С, для получения эфира формулы(15); или добавление продукта вышеуказанной стадии (б) к смеси метанола и концентрированной кислоты, такой как серная кислота или соляная кислота при температуре в пределах от 0 до 100 С; или добавление продукта вышеуказанной стадии (б) к триметилсилилдиазометану и метанолу в бензоле или толуоле при температуре от -40 до 100 С; или добавление продукта вышеуказанной стадии (б) к диазометану в растворителе, таком как бензол, толуол, дихлорметан или диэтиловый эфир, при температуре от-40 до 40 С; г) продукт вышеуказанной стадии (в) подвергали озонолизу в растворителе, таком как хлороформ или дихлорметан, или метанол с последующим добавлением гасителя реакции,такого как трифенилфосфин или диметилсульфид, при температуре от -100 до 0 С, с получением (16); д) продукт вышеуказанной стадии (г) в растворителе, таком как метанол или этанол,подвергали взаимодействию с раствором аммиака или газообразным аммиаком с последующим восстановлением с использованием боргидрида натрия, цианоборгидрида натрия или триацетоксиборгидрида натрия, или восста 005206 38 новлением путем гидрирования в присутствии катализатора, такого как никель, палладий или платина, с получением (17); и е) продукт вышеуказанной стадии (д) гидролизовали с использованием водной соляной кислоты в концентрации от 0,01 М до 12 М в присутствии или отсутствии растворителя, такого как 1,4-диоксан, уксусная кислота или вода,для получения аминокислоты (9). Способ 3 Ненасыщенный эфир и бензилтиоизоцианат перемешивали в смеси растворителей, состоящей из тетрагидрофурана, диэтилового эфира или 1,4-диоксана, координирующего растворителя, такого как НМРА или DMPU (1,3 диметил-3,4,5,6-тетрагидро-2(1 Н)-пиримидинон), и спирта, такого как трет-бутанол, с дииодидом самария при температуре от -100 до 0 С; полученный эфир гидрировали в растворителе,таком как метанол, этанол, этилацетат, при использовании катализатора, такого как никель,палладий, платина или родий, при температуре от 20 до 100 С с получением аминокислоты. Способ 4 А а) металлорганический реагент, такой как виниллитий или винилмагний хлорид или бромид, смешивают с диметилцинком, хлоридом цинка, иодидом меди (I), диметилсульфидным комплексом бромида меди (I) или цианидом меди (I) в присутствии кислоты Льюиса, такой как эфират фтористого бора или хлорид алюминия, в растворителе, таком как тетрагидрофуран или диэтиловый эфир, при температуре от(1) с получением дополнительного продукта (2); б) продукт вышеуказанной стадии (а) подвергали озонолизу в растворителе, таком как хлороформ или дихлорметан, или метанол с последующим добавлением гасителя реакции,такого как трифенилфосфин или диметилсульфид, при температуре от -100 до 0 С с получением (3); в) Продукт вышеуказанной стадии (б) в растворителе, таком как метанол или этанол,подвергали взаимодействию с раствором аммиака или газообразным аммиаком с последующим восстановлением с использованием боргидрида натрия, цианоборгидрида натрия или триацетоксиборгидрида натрия, или восстановлением путем гидрирования в присутствии катализатора, такого как никель, палладий или платина, с получением (4); и 39 г) продукт вышеуказанной стадии (в) гидролизуют с использованием водной соляной кислоты в концентрации от 0,01 М до 12 М в присутствии или отсутствии растворителя, такого как 1,4-диоксан, уксусная кислота или вода для получения аминокислоты (5). Способ 4 Б а) металлорганический реагент, такой как аллилмагнийхлорид или бромид, смешивали с диметилцинком, хлоридом цинка, иодидом меди(I), диметилсульфидным комплексом бромида меди (I) или цианидом меди (I) в присутствии кислоты Льюиса, такой как эфират фтористого бора или хлорид алюминия, в растворителе, таком как тетрагидрофуран или диэтиловый эфир,при температуре от -100 до 0 С, и добавляют ненасыщенный эфир (1), с получением дополнительного продукта (6); или металлорганический реагент, такой как бензилмагнийхлорид или бромид, смешивают с диметилцинком, хлоридом цинка, иодидом меди (I), диметилсульфидным комплексом бромида меди (I) или цианидом меди (I) в присутствии кислоты Льюиса,такой как эфират фтористого бора или хлорид алюминия, в растворителе, таком как тетрагидрофуран или диэтиловый эфир, при температуре от -100 до 0 С, и добавляют ненасыщенный эфир (1) с получением дополнительного продукта (7); б) добавление продукта вышеуказанной стадии (а) к смеси четыреххлористого углерода или этилацетата и ацетонитрила, к которой добавляли воду, периодат натрия и хлорид рутения (III), и перемешивали при температуре от-40 до 80 С, для получения карбоновой кислоты формулы (8); в) добавление продукта вышеуказанной стадии (б) к смеси основания, выбранного из триэтиламина или диизопропилэтиламина, и растворителя, выбранного из толуола, бензола,ксилолов, тетрагидрофурана, диэтилового эфира или н-гептана, к которой добавляли дифенилфосфорилазид (DPPA), и перемешивание при температуре от 0 до 150 С, для получения изоцианата формулы (9); или добавление продукта вышеуказанной стадии (б) к этилхлорформиату или изобутилхлорформиату и основанию, тако 005206 40 му как триэтиламин или диизопропилэтиламин,в тетрагидрофуране или ацетоне, или диэтиловом эфире, при температуре от -40 до 78 С с последующим добавлением азида натрия в воде или тетрагидрофуране, или ацетоне с последующим добавлением толуола или бензола и дефлегмация; г) добавление продукта вышеуказанной стадии (в) к растворителю, выбранному из толуола, бензола, ксилолов или н-гептана, к которому добавляли метанол или трет-бутанол, с получением (10), и затем добавление (10) к водной соляной кислоте в концентрации от 0,01 М до 12 М в присутствии или отсутствии растворителя, такого как 1,4-диоксан, уксусная кислота или вода, для получения аминокислоты (5); или добавление продукта вышеуказанной стадии (в) к растворителю, выбранному из толуола,бензола, ксилолов или н-гептана, к которому добавляли бензиловый спирт, с получением(10), и затем гидрирование (10) над никелем или палладием, или платиной, с получением лактама, который затем гидролизовали при использовании водной соляной кислоты в концентрации от 0,01 М до 12 М в присутствии или отсутствии растворителя, такого как 1,4-диоксан, уксусная кислота или вода, для получения аминокислоты а) Соединение (1) и цианид калия или цианид натрия и воду и этанол или метанол совместно нагревали с обратным холодильником с удалением воды посредством, например, использования отделителя Dean-Stark с получением (2); б) продукт стадии (а) перемешивали с этанолом и толуолом или бензолом, и насыщали раствор газообразной соляной кислотой при температуре от -30 С до 40 С, с получением (3); в) продукт вышеуказанной стадии (б) гидрировали в метаноле, этаноле или этилацетате при использовании катализатора, такого как никель, палладий, платина или родий, при температуре от 15 до 60 С с получением (4); г) продукт вышеуказанной стадии (в) гидролизовали с использованием водной соляной кислоты в концентрации от 0,01 М до 12 М в присутствии или отсутствии растворителя, такого как 1,4-диоксан, уксусная кислота или вода,для получения аминокислоты (5). или его фармацевтически приемлемая соль, или его эфирное или амидное производное, где n равно целому числу от 1 до 4. 2. Соединение по п.1, выбранное из(1,3,5)(2-аминометилоктагидропентален-2-ил)уксусной кислоты,или его фармацевтически приемлемая соль, или его эфирное или амидное производное. 3. Соединение по п.1 под названием(1,3,5)(3-аминометилбицикло[3.2.0]гепт-3 ил)уксусная кислота, или его фармацевтически приемлемая соль, или его эфирное или амидное производное. 42 4. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп.1-3, или его фармацевтически приемлемой соли, или его эфирного или амидного производного, и фармацевтически приемлемый носитель. 5. Способ лечения эпилепсии, при котором вводят терапевтически эффективное количество соединения по п.1 млекопитающему, нуждающемуся в таком лечении. 6. Способ лечения нейродегенеративных расстройств, при котором вводят терапевтически эффективное количество соединения по п.1 млекопитающему, нуждающемуся в таком лечении. 7. Способ лечения депрессии, при котором вводят терапевтически эффективное количество соединения по п.1 млекопитающему, нуждающемуся в таком лечении. 8. Способ лечения тревоги, при котором вводят терапевтически эффективное количество соединения по п.1 млекопитающему, нуждающемуся в таком лечении. 9. Способ лечения паники, при котором вводят терапевтически эффективное количество соединения по п.1 млекопитающему, нуждающемуся в таком лечении. 10. Способ лечения боли, при котором вводят терапевтически эффективное количество соединения по п.1 млекопитающему, нуждающемуся в таком лечении. 11. Способ по п.10, где боль представляет собой невропатическую боль. 12. Способ лечения невропатологических расстройств, при котором вводят терапевтически эффективное количество соединения по п.1 млекопитающему, нуждающемуся в таком лечении.
МПК / Метки
МПК: C07C 229/28, A61K 31/195
Метки: агентов, аминокислоты, фармацевтических, бициклические, качестве
Код ссылки
<a href="https://eas.patents.su/22-5206-biciklicheskie-aminokisloty-v-kachestve-farmacevticheskih-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Бициклические аминокислоты в качестве фармацевтических агентов</a>
Предыдущий патент: Замещенные пиразолы как ингибиторы р38 киназы
Следующий патент: Соединения, обладающие противовоспалительной и иммунносупрессорной активностью, ингибирующие клеточную адгезию
Случайный патент: Способ количественного анализа содержащего углеводород сырья












