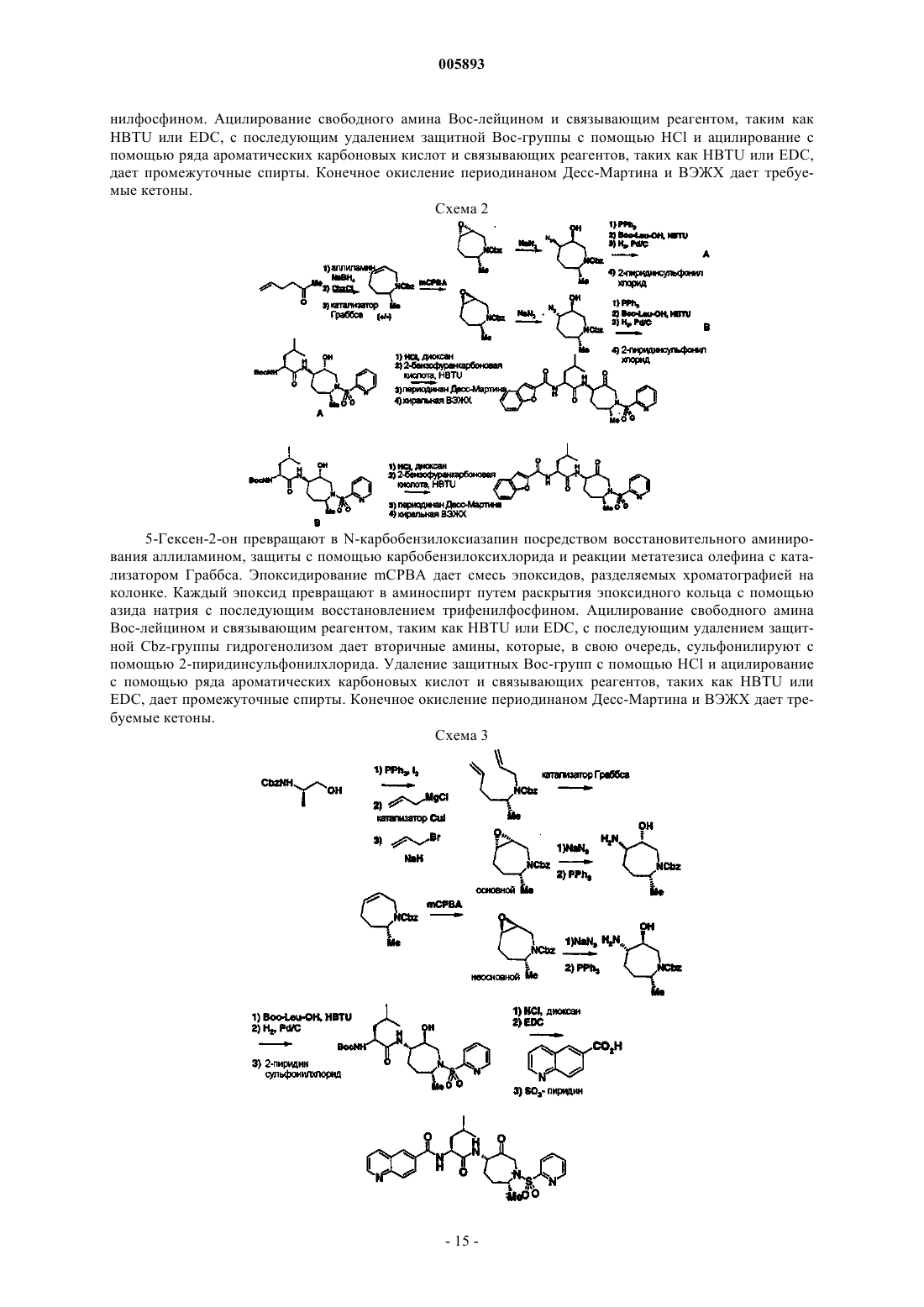
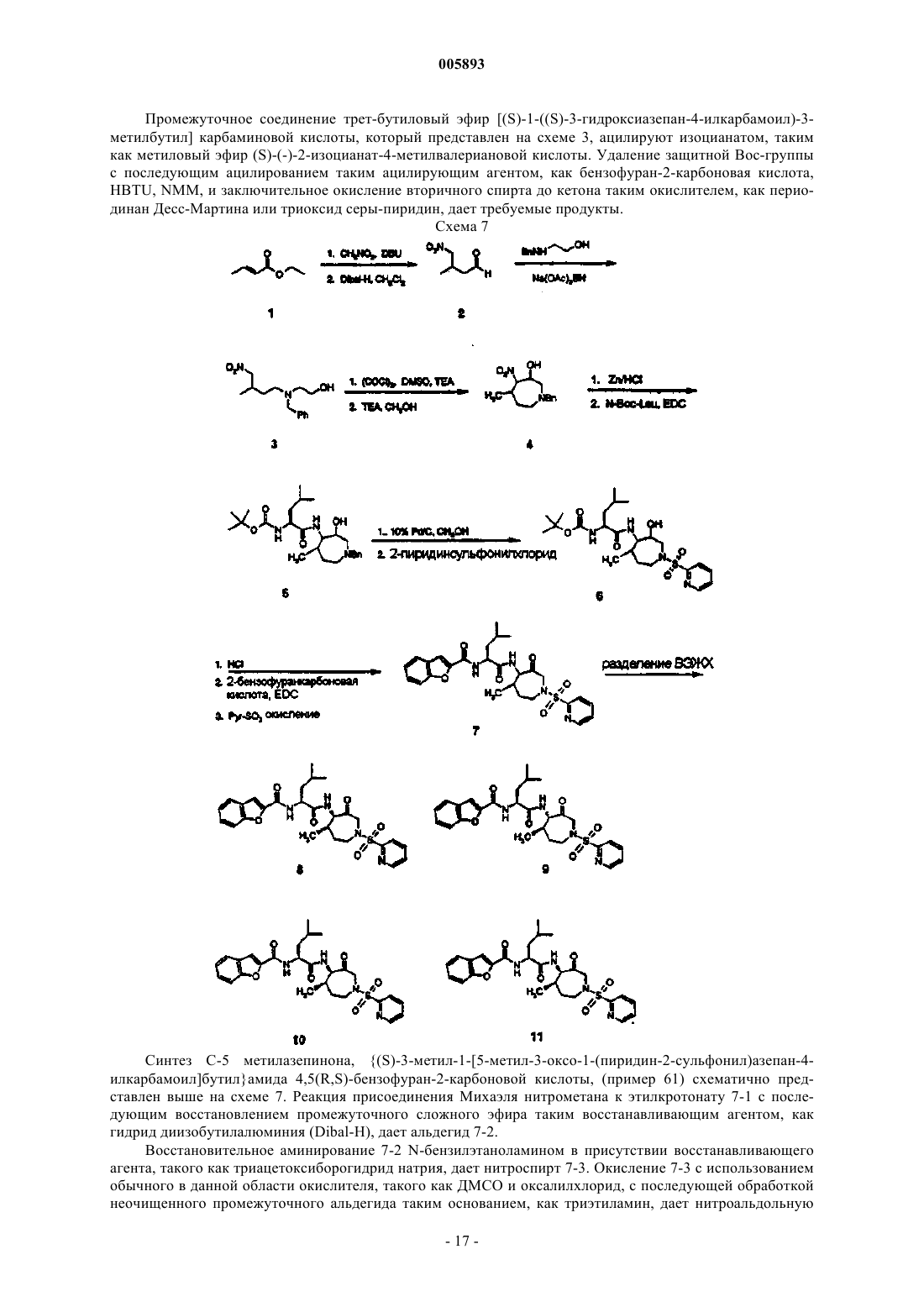
Ингибиторы протеаз
Номер патента: 5893
Опубликовано: 30.06.2005
Авторы: Ру Ю., Каммингс Максвелл Д., Маркьюс Роберт В., Ямасита Деннис С., Томпсон Скотт К., Вебер Дэниел Ф.
Формула / Реферат
1. Соединение формулы I
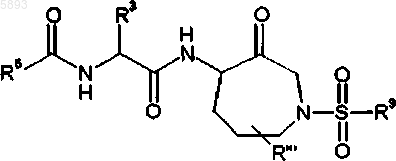
где R5 выбран из группы, включающей бензофуранил,3-метилфуро[3,2,b]пиридинил, N-метилиндолил, бензо[b]тиофенил, тиено[3,2,b]тиофенил или хинолинил;
R"' представляет цис-7-C1-6-алкил;
R3 выбран из группы, состоящей из C1-6-алкила, C3-6-циклоалкил-C1-6-алкила, C1-6-алкилзамещенного фенила, C1-6-алкилзамещенного нафтила или C1-6-алкилзамещенного тиофенила;
R9 выбран из группы, включающей пиридинил, 1-оксипиридинил, фенил, галогензамещенный фенил, C1-6алкоксифенил, цианофенил, имидазолил, C1-6алкилзамещенный имидазолил,
и его фармацевтически приемлемые соли, гидраты и сольваты.
2. Соединение по п.1, где
R3 выбран из группы C1-6-алкил и C1-6-алкилзамещенный фенил;
R5 выбран из группы, состоящей из бензофуранил,3-метилфуро[3,2,b]пиридинил, N-метилиндолил, бензо[b]тиофенил, тиено[3,2,b]тиофенил или хинолинил.
3. Соединение по п.2, где
R3 выбран из группы, состоящей из метила, этила, н-пропила, проп-2-ила, н-бутила, изобутила, бут-2-ила, циклопропилметила, циклогексилметила, толуила, нафталин-2-илметила;
R5 выбран из группы, состоящей из бензофуранила, бензо[b]тиофенила, хинолинила; фуро[3,2-b]пиридинила, 3-метилфуро[3,2-b]пиридинила, тиено[3,2-b]тиофенила, и
R9 выбран из группы, состоящей из C1-6-алкоксифенила, цианофенила, фенила, галогензамещенного фенила, пиридинила, 1-оксипиридинила, 1H-имидазолила, C1-6-алкилзамещенного имидазолила.
4. Соединение по п.2, где R5 выбран из группы, состоящей из
бензофуран-2-ила; бензо[b]тиофен-2-ила;
хинолин-2-ила, хинолин-3-ила, хинолин-4-ила, хинолин-6-ила и хинолин-8-ила;
фуро[3,2-b]пиридин-2-ила;
тиено[3,2-b]тиофен-2-ила.
5. Соединение по п.2, где R5 выбран из группы, состоящей из
N-метилиндол-2-ила; 3-метилфуро[3,2-b]пиридин-2-ила.
6. Соединение по п. 2, где R9 выбран из группы, состоящей из
3,4-дихлорфенила, 4-бромфенила, 2-фторфенила, 4-фторфенила, 3-хлорфенила, 4-хлорфенила, 3-метоксифенила, 4-метоксифенила, 3,4-диметоксифенила, 2-цианофенила;
пиридин-2-ила, пиридин-3-ила, 1-оксипиридин-2-ила, 1-оксипиридин-3-ила;
1H-имидазол-2-ила, 1H-имидазол-4-ила, 1-метил-1H-имидазол-2-ила, 1-метил-1H-имидазол-4-ила.
7. Соединение по п.2, где
R3 является C1-6-алкилом;
R5 представляет бензофуранил, 3-метилфуро[3,2,b]пиридинил, N-метилиндолил, бензо[b]тиофенил, тиено[3,2,b]тиофенил или хинолинил;
R9 представляет пиридил, 1-оксипиридинил, фенил, галогензамещенный фенил, C1-6алкоксифенил, цианофенил, имидазолил, C1-6алкилзамещенный имидазолил и
R"' является 7-C1-6-алкилом.
8. Соединение по п.7, где
R3 является изобутилом;
R5 выбран из группы, состоящей из бензо[b]тиофен-2-ила, тиено[3,2-b]тиофен-2-ила, бензофуран-2-ила, фуро[3,2-b]пиридин-2-ила и 3-метилфуро[3,2-b]пиридин-2-ила;
R9 выбран из группы, состоящей из пиридин-2-ила и 1-оксипиридин-2-ила; и
R"' является 7-C1-6-алкилом.
9. Соединение по п.1, где R"' является цис-7-метилом.
10. Соединение по п.9, где R5 представляет бензофуран-2-ил.
11. Соединение по п.10, где R9 представляет пиридин-2-ил.
12. Соединение по п.1, выбранное из группы, которая включает
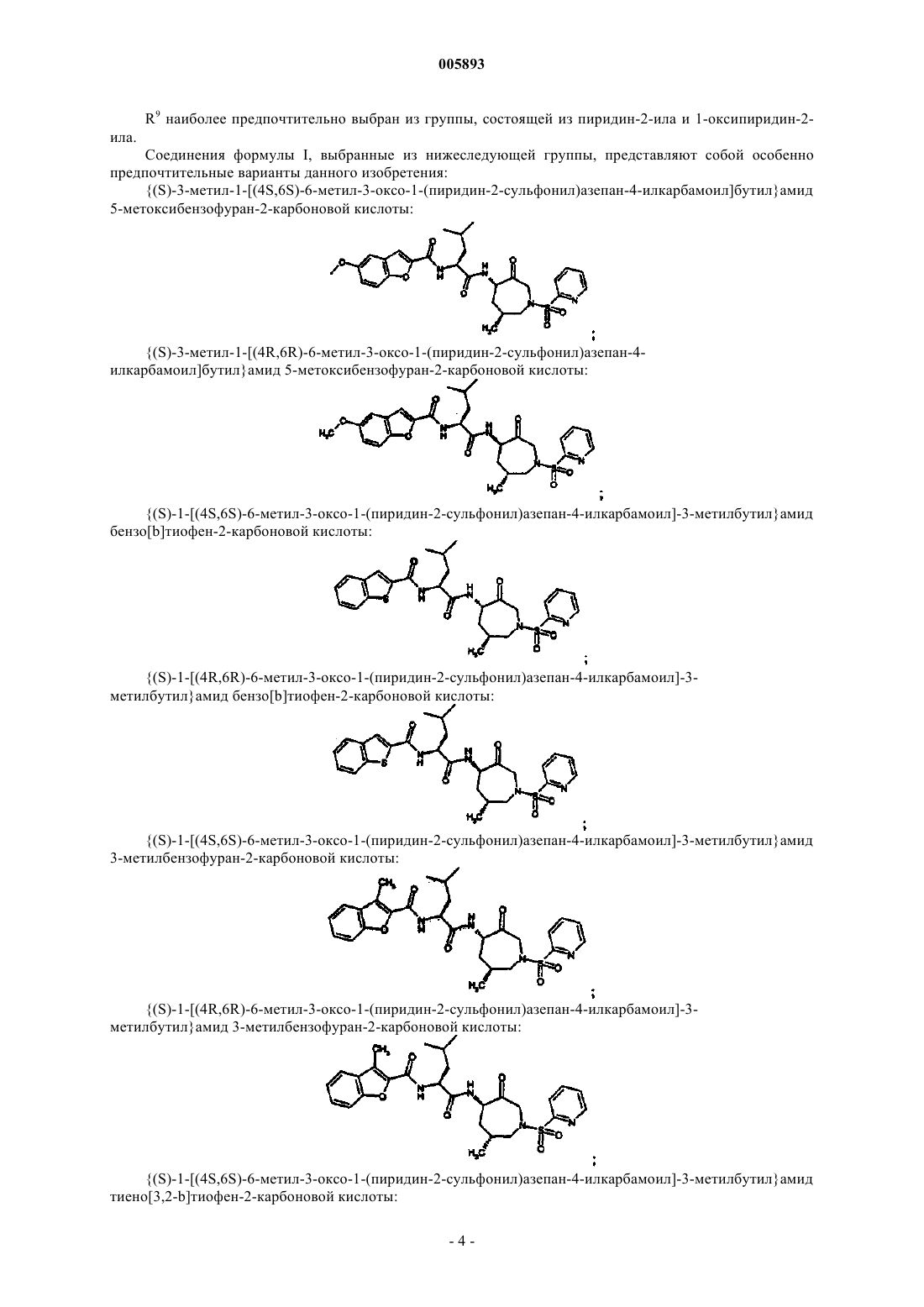
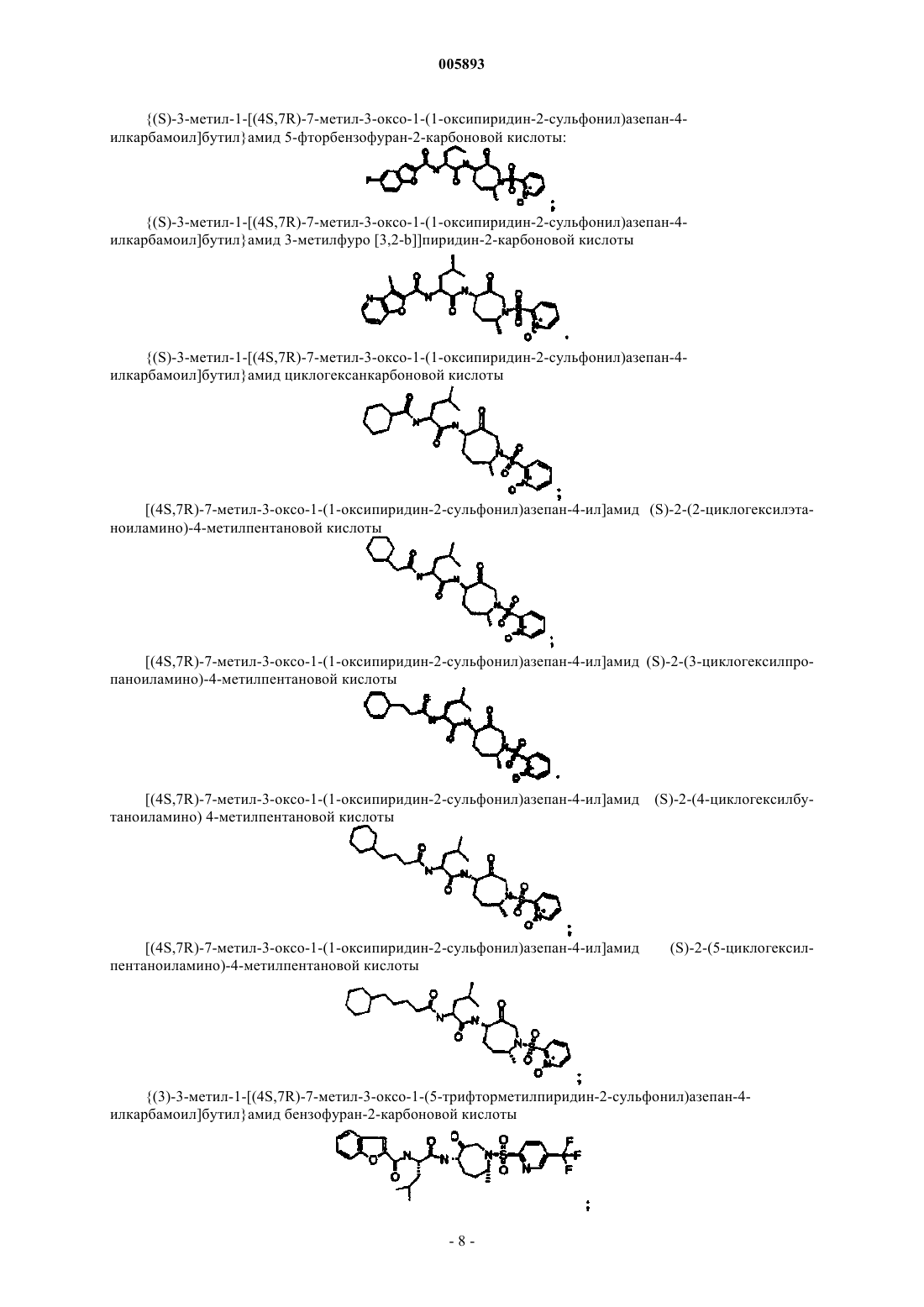
{(S)-3-метил-1-[(4S,6S)-6-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 5-метоксибензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(4R,6R)-6-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 5-метоксибензофуран-2-карбоновой кислоты;
{(S)-1-[(4S,6S)-6-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутил}амид бензо[b]тиофен-2-карбоновой кислоты;
{(S)-1-[(4R,6R)-6-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутил}амид бензо[b]тиофен-2-карбоновой кислоты;
{(S)-1-[(4S,6S)-6-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутил}амид 3-метилбензофуран-2-карбоновой кислоты;
{(S)-1-[(4R,6R)-6-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутил}амид 3-метилбензофуран-2-карбоновой кислоты;
{(S)-1-[(4S,6S)-6-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутил}амид тиено[3,2-b]тиофен-2-карбоновой кислоты;
{(S)-1-[(4R,6R)-6-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутил}амид тиено[3,2-b]тиофен-2-карбоновой кислоты;
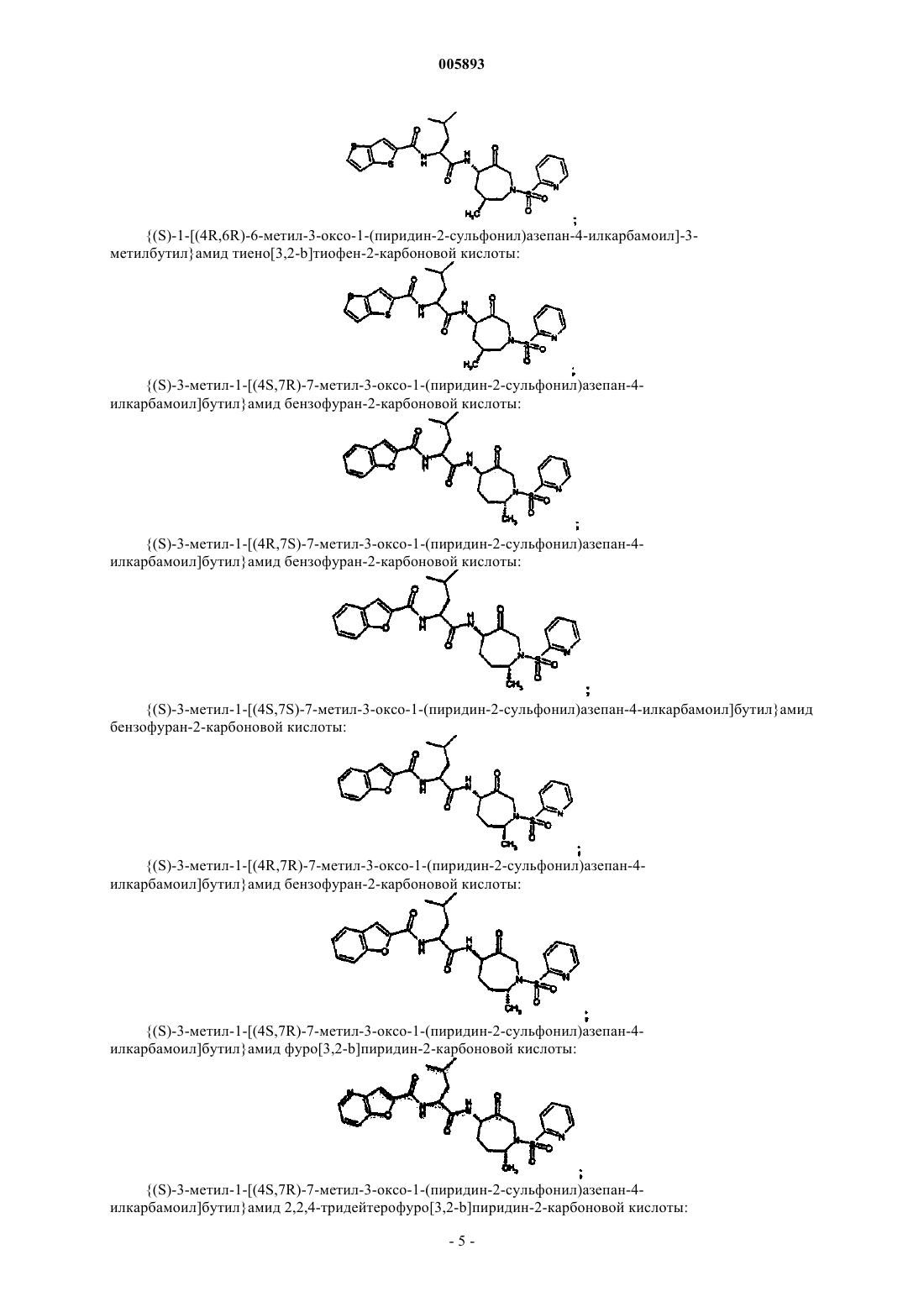
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид бензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(4R,7S)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид бензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7S)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид бензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(4R,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид бензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид фуро[3,2-b]пиридин-2-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 2,2,4-тридейтерофуро[3,2-b]пиридин-2-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 3-метилфуро[3,2-b]пиридин-2-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 2,2,4-тридейтеро-3-метилфуро[3,2-b]пиридин-2-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид хинолин-6-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид хинолин-3-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 5-метоксибензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 3-метилбензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид тиено[3,2-b]тиофен-2-карбоновой кислоты;
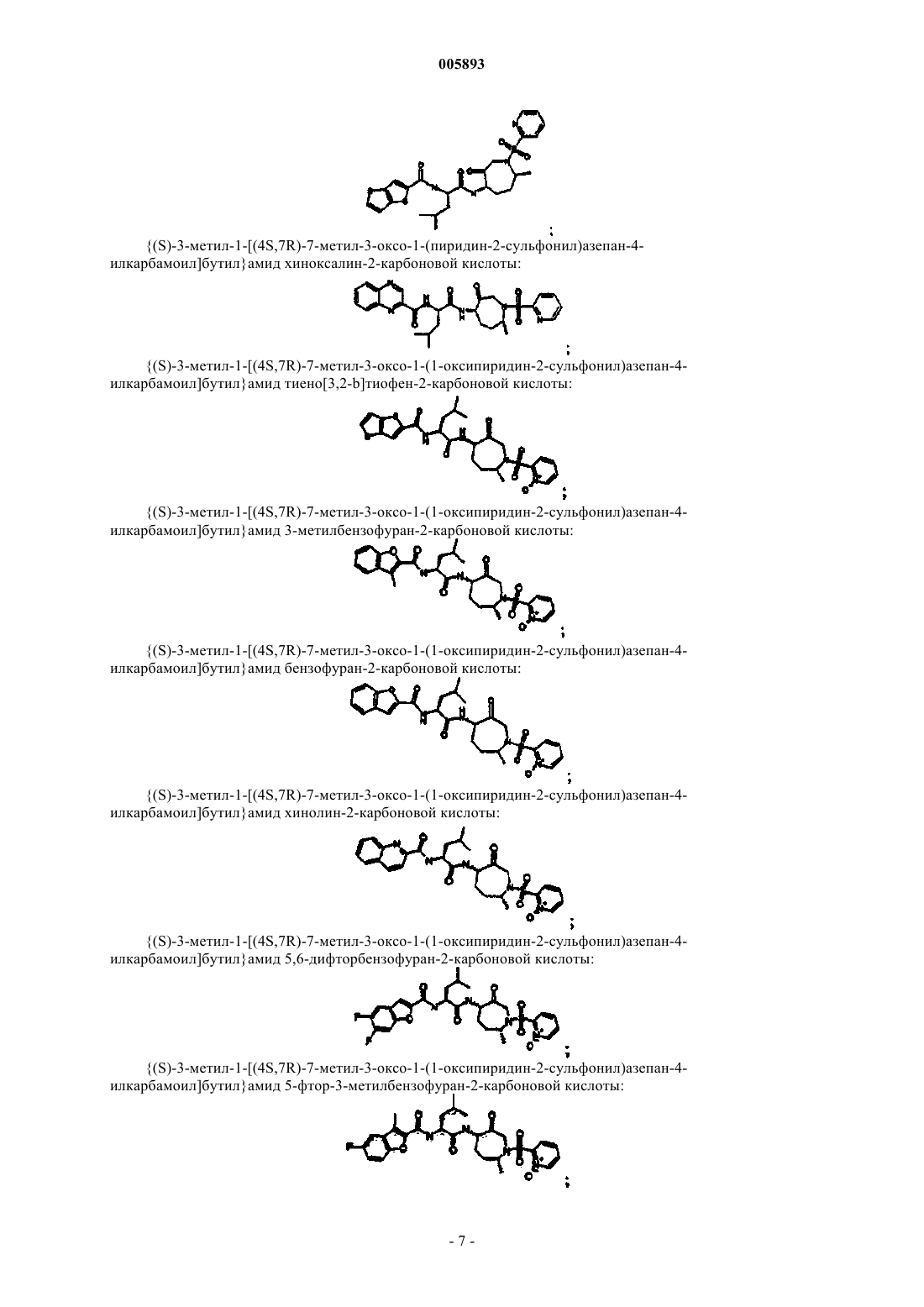
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид хиноксалин-2-карбоновой кислоты;
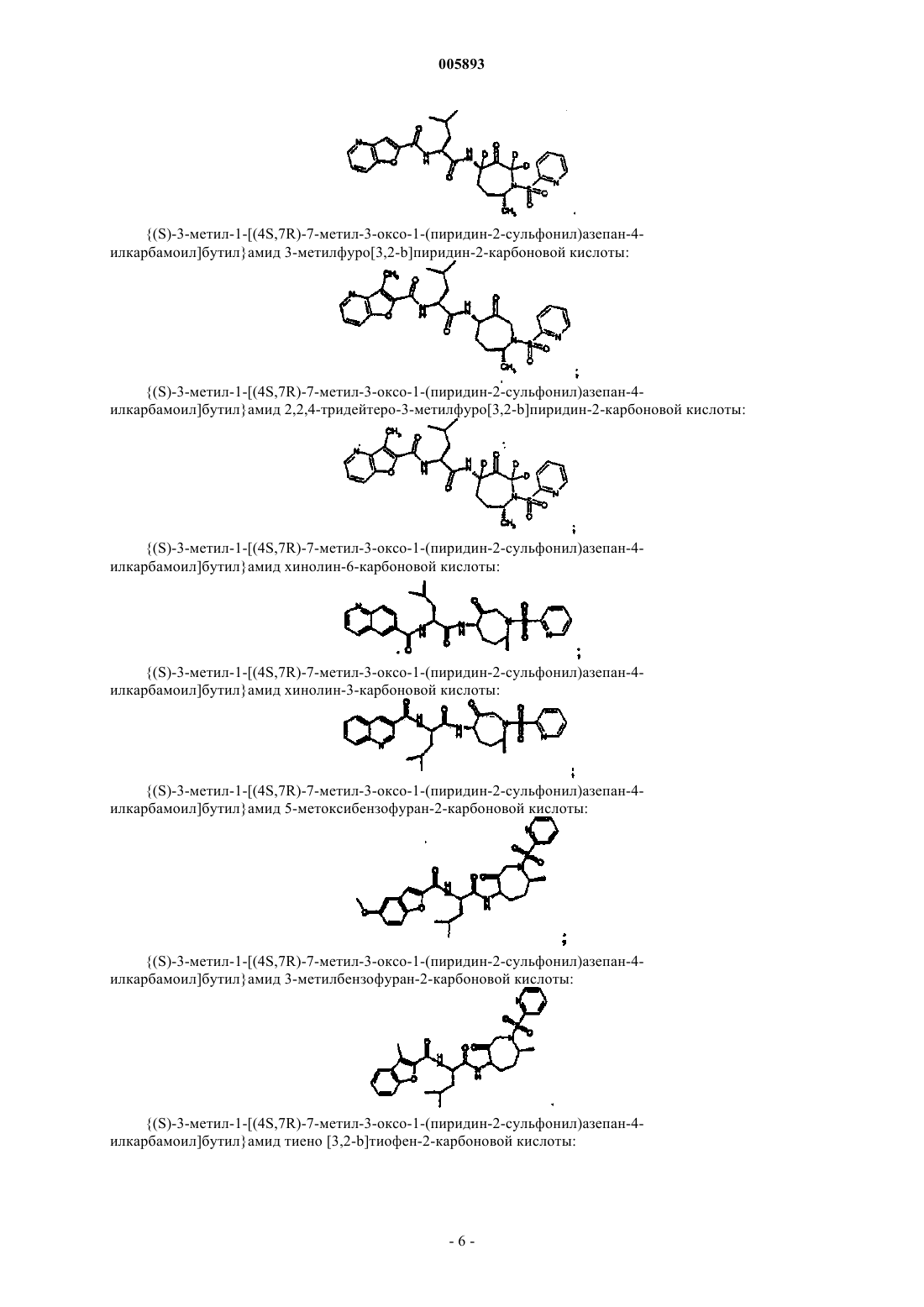
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(1-оксипиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид тиено[3,2-b]тиофен-2-карбоновой кислоты
Ki = 0,05 нМ;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(1-оксипиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 3-метилбензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(1-оксипиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид бензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(1-оксипиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид хинолин-2-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(1-оксипиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 5,6-дифторбензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(1-оксипиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 5-фтор-3-метилбензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(1-оксипиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 5-фторбензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(1-оксипиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 3-метилфуро[3,2-b]]пиридин-2-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(1-оксипиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид циклогексанкарбоновой кислоты;
[(4S,7R)-7-метил-3-оксо-1-(1-оксипиридин-2-сульфонил)азепан-4-ил]амид (S)-2-(2-циклогексилэтаноиламино)-4-метилпентановой кислоты;
[(4S,7R)-7-метил-3-оксо-1-(1-оксипиридин-2-сульфонил)азепан-4-ил]амид (S)-2-(3-циклогексилпропаноиламино)-4-метилпентановой кислоты;
[(4S,7R)-7-метил-3-оксо-1-(1-оксипиридин-2-сульфонил)азепан-4-ил]амид (S)-2-(4-циклогексилбутаноиламино)-4-метилпентановой кислоты;
[(4S,7R)-7-метил-3-оксо-1-(1-оксипиридин-2-сульфонил)азепан-4-ил]амид (S)-2-(5-циклогексилпентаноиламино)-4-метилпентановой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(5-трифторметилпиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид бензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(5-трифторметилпиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 5-фторбензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(5-трифторметилпиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид тиено[3,2-b]тиофен-2-карбоновой кислоты;
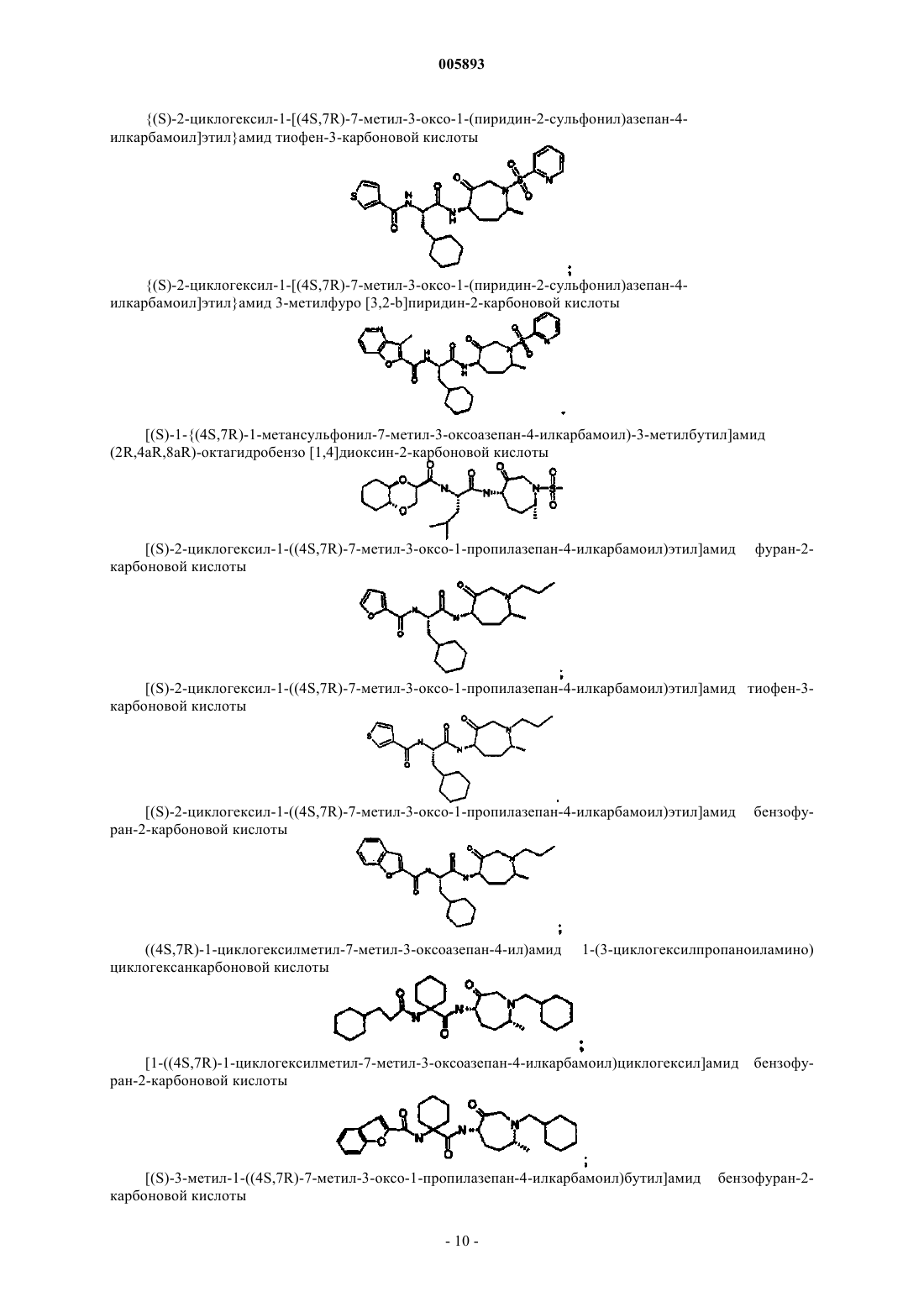
{1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]циклогексил}амид бензофуран-2-карбоновой кислоты;
{(S)-3,3-диметил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид тиофен-3-карбоновой кислоты;
{(S)-3,3-диметил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид фуран-2-карбоновой кислоты;
{(S)-3,3-диметил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид тиено[3,2-b]тиофен-2-карбоновой кислоты;
{(S)-2-циклогексил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]этил}амид бензофуран-2-карбоновой кислоты;
{(S)-2-циклогексил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]этил}амид фуран-2-карбоновой кислоты;
{(S)-2-циклогексил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]этил}амид тиофен-3-карбоновой кислоты;
{(S)-2-циклогексил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]этил}амид 3-метилфуро [3,2-b]пиридин-2-карбоновой кислоты;
[(S)-1-((4S,7R)-1-метансульфонил-7-метил-3-оксоазепан-4-илкарбамоил)-3-метилбутил]амид(2R,4aR,8aR)-октагидробензо[1,4]диоксин-2-карбоновой кислоты;
[(S)-2-циклогексил-1-((4S,7R)-7-метил-3-оксо-1-пропилазепан-4-илкарбамоил)этил]амид фуран-2-карбоновой кислоты;
[(S)-2-циклогексил-1-((4S,7R)-7-метил-3-оксо-1-пропилазепан-4-илкарбамоил)этил]амид тиофен-3-карбоновой кислоты;
[(S)-2-циклогексил-1-((4S,7R)-7-метил-3-оксо-1-пропилазепан-4-илкарбамоил)этил]амид бензофуран-2-карбоновой кислоты;
((4S,7R)-1-циклогексилметил-7-метил-3-оксоазепан-4-ил)амид 1-(3-циклогексилпропаноиламино) циклогексанкарбоновой кислоты;
[1-((4S,7R)-1-циклогексилметил-7-метил-3-оксоазепан-4-илкарбамоил)циклогексил]амид бензофуран-2-карбоновой кислоты;
[(S)-3-метил-1-((4S,7R)-7-метил-3-оксо-1-пропилазепан-4-илкарбамоил)бутил]амид бензофуран-2-карбоновой кислоты;
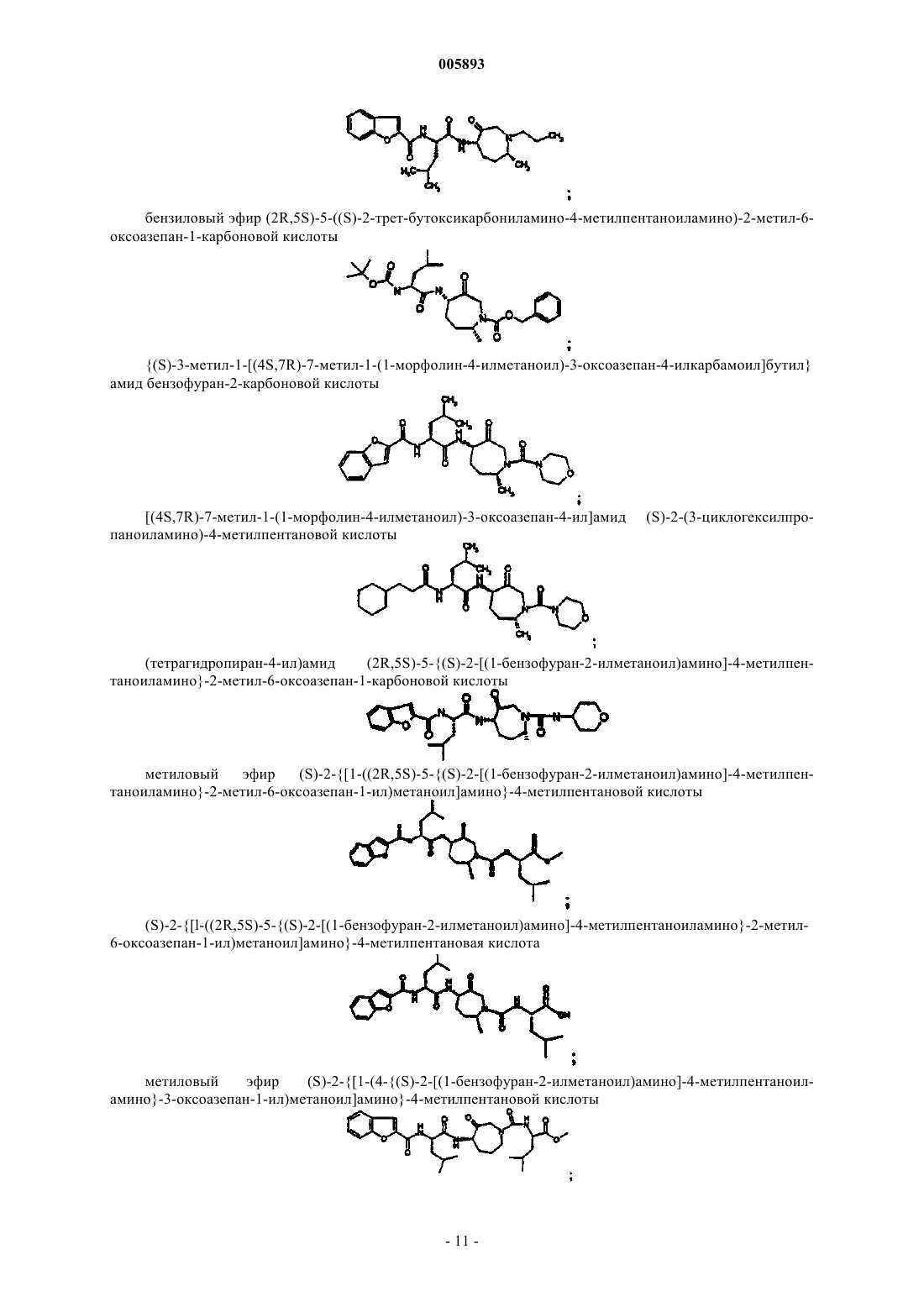
бензиловый эфир (2R,5S)-5-((S)-2-трет-бутоксикарбониламино-4-метилпентаноиламино)-2-метил-6-оксоазепан-1-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-1-(1-морфолин-4-илметаноил)-3-оксоазепан-4-илкарбамоил]бутил}амид бензофуран-2-карбоновой кислоты;
[(4S,7R)-7-метил-1-(1-морфолин-4-илметаноил)-3-оксоазепан-4-ил]амид (S)-2-(3-циклогексилпропаноиламино)-4-метилпентановой кислоты;
(тетрагидропиран-4-ил)амид (2R,5S)-5-{(S)-2-[(1-бензофуран-2-илметаноил)амино]-4-метилпентаноиламино}-2-метил-6-оксоазепан-1-карбоновой кислоты;
метиловый эфир (S)-2-{[1-((2R,5S)-5-{(S)-2-[(1-бензофуран-2-илметаноил)амино]-4-метилпентаноиламино}-2-метил-6-оксоазепан-1-ил)метаноил]амино}-4-метилпентановой кислоты;
(S)-2-{[1-((2R,5S)-5-{(S)-2-[(1-бензофуран-2-илметаноил)амино]-4-метилпентаноиламино}-2-метил-6-оксоазепан-1-ил)метаноил]амино}-4-метилпентановая кислота;
метиловый эфир (S)-2-{[1-(4-{(S)-2-[(1-бензофуран-2-илметаноил)амино]-4-метилпентаноиламино}-3-оксоазепан-1-ил)метаноил]амино}-4-метилпентановой кислоты;
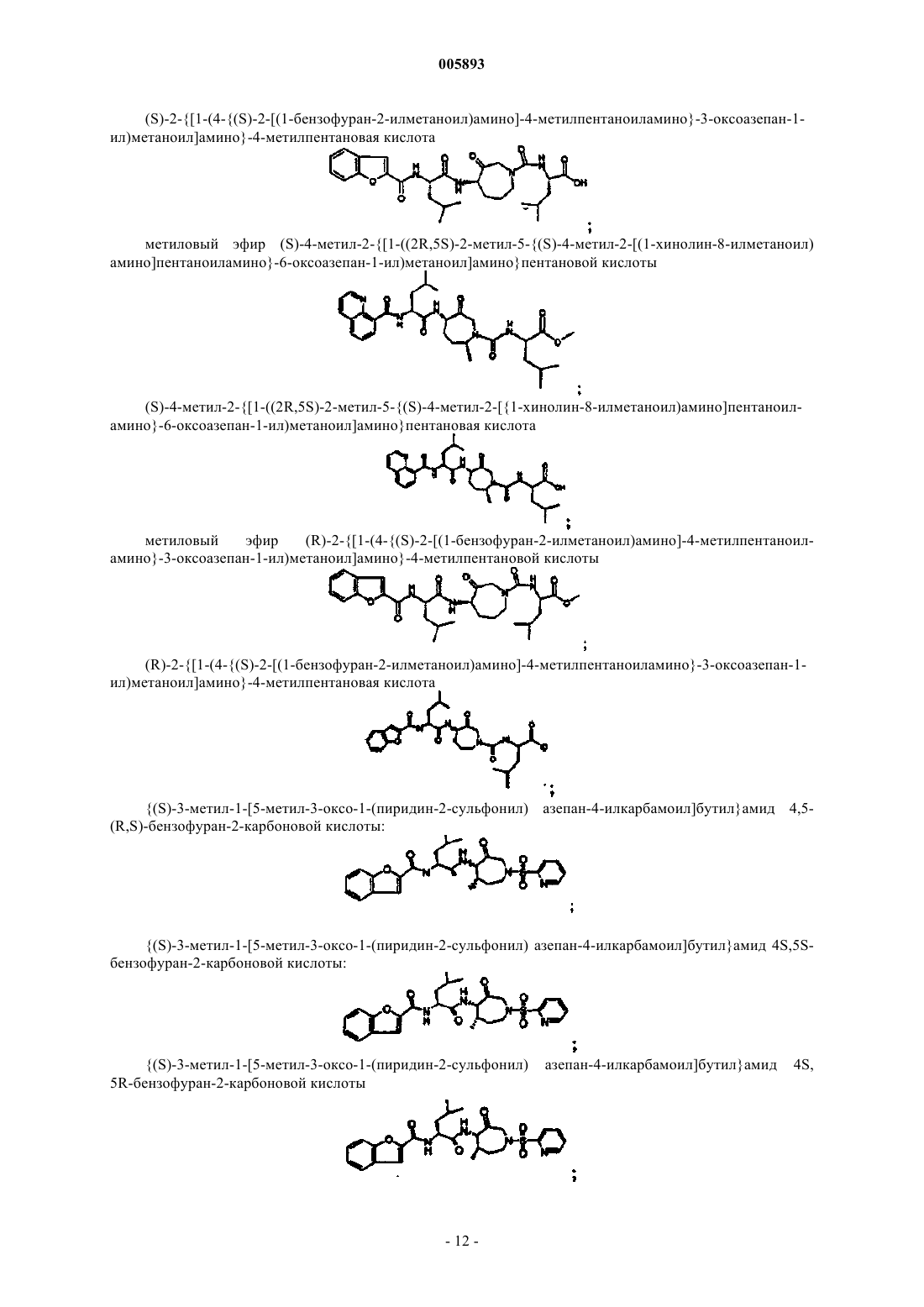
(S)-2-{[1-(4-{(S)-2-[(1-бензофуран-2-илметаноил)амино]-4-метилпентаноиламино}-3-оксоазепан-1-ил)метаноил]амино}-4-метилпентановая кислота;
метиловый эфир (S)-4-метил-2-{[1-((2R,5S)-2-метил-5-{(S)-4-метил-2-[(1-хинолин-8-илметаноил)амино]пентаноиламино}-6-оксоазепан-1-ил)метаноил]амино}пентановой кислоты;
(S)-4-метил-2-{[1-((2R,5S)-2-метил-5-{(S)-4-метил-2-[(1-хинолин-8-илметаноил)амино]пентаноиламино}-6-оксоазепан-1-ил)метаноил]амино}пентановая кислота;
метиловый эфир (R)-2-{[1-(4-{(S)-2-[(1-бензофуран-2-илметаноил)амино]-4-метилпентаноиламино}-3-оксоазепан-1-ил) метаноил]амино}-4-метилпентановой кислоты;
(R)-2-{[1-(4-{(S)-2-[(1-бензофуран-2-илметаноил)амино]-4-метилпентаноиламино}-3-оксоазепан-1-ил)метаноил]амино}-4-метилпентановая кислота;
[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-ил]амид (R)-2-бифенил-3-ил-4-метилпентановой кислоты;
{1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]циклогексил}амид 3-метилфуро[3,2-b]пиридин-2-карбоновой кислоты и
[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-ил]амид 1-(3-циклогексилпропаноиламино)циклогексанкарбоновой кислоты.
13. Соединение по п.12, которое представляет собой {(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид бензофуран-2-карбоновой кислоты.
14. Фармацевтическая композиция, содержащая соединение по пп.1-13 и фармацевтически приемлемый носитель, разбавитель или эксципиент.
15. Соединение формулы II
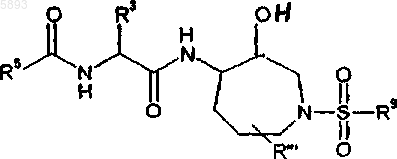
где R5 выбран из группы, включающей бензофуранил, 3-метилфуро[3,2,b]пиридинил, N-метилиндолил, бензо[b]тиофенил, тиено[3,2,b]тиофенил или хинолинил;
R"' представляет цис-7-C1-6-алкил;
R3 выбран из группы, состоящей из C1-6-алкила, C3-6-циклоалкил-C1-6-алкила, C1-6-алкилзамещенного фенила, C1-6-алкилзамещенного нафтила или C1-6-алкилзамещенного тиофенила;
R9 выбран из группы, включающей пиридинил, 1-оксипиридинил, фенил, галогензамещенный фенил, C1-6алкоксифенил, цианофенил, имидазолил, C1-6алкилзамещенный имидазолил,
и его фармацевтически приемлемые соли, гидраты и сольваты.
16. Соединение по п.15, где цис-7-C1-6-алкил выбран из группы, состоящей из цис-7-метила, -этила, -пропила, -бутила, -пентила и -гексила.
17. Соединение по п.16, где цис-7-C1-6-алкил выбран из цис-7-метила.
18. Соединение по п.15, выбранное из группы, включающей
3-метил-1-(пиридин-2-сульфонил)-2,3,4,7-тетрагидро-1H-азепин;
5-метил-3-(пиридин-2-сульфонил)-8-окса-3-азабицикло [5.1.0]октан;
4-азидо-5-метил-1-(пиридин-2-сульфонил)азепан-3-ол;
4-амино-6-метил-1-(пиридин-2-сульфонил)азепан-3-ол;
трет-бутиловый эфир {(S)-1-[3-гидрокси-6-метил-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутил}карбаминовой кислоты;
{(S)-1-[3-гидрокси-6-метил-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутил}амид 5-метоксибензофуран-2-карбоновой кислоты;
бензиловый эфир аллил-(1-метилпент-4-енил) карбаминовой кислоты;
бензиловый эфир 2-метил-2,3,4,7-тетрагидроазепин-1-карбоновой кислоты;
бензиловый эфир 4-метил-8-окса-3-азабицикло[5.1.0]октан-3-карбоновой кислоты;
бензиловый эфир 5-азидо-6-гидрокси-2-метилазепан-1-карбоновой кислоты;
бензиловый эфир 5-амино-6-гидрокси-2-метилазепан-1-карбоновой кислоты;
бензиловый эфир (2R,5S,6S)-5-((S)-2-трет-бутоксикарбониламино-4-метилпентаноиламино)-6-гидрокси-2-метилазепан-1-карбоновой кислоты;
бензиловый эфир (2S,5R,6R)-5-((S)-2-трет-бутоксикарбониламино-4-метилпентаноиламино)-6-гидрокси-2-метилазепан-1-карбоновой кислоты;
трет-бутиловый эфир [(S)-1-((3S,4S,7R)-3-гидрокси-7-метилазепан-4-илкарбамоил)-3-метилбутил] карбаминовой кислоты;
трет-бутиловый эфир [(S)-1-((3R,4R,7S)-3-гидрокси-7-метилазепан-4-илкарбамоил)-3-метилбутил] карбаминовой кислоты;
трет-бутиловый эфир [(S)-1-((3S,4S,7R)-1-бензолсульфонил-3-гидрокси-7-метилазепан-4-илкарбамоил)-3-метилбутил] карбаминовой кислоты;
трет-бутиловый эфир [(S)-1-((3R,4R,7S)-1-бензолсульфонил-3-гидрокси-7-метилазепан-4-илкарбамоил)-3-метилбутил]карбаминовой кислоты;
((3S,4S,7R)-1-(2-пиридин)сульфонил-3-гидрокси-7-метилазепан-4-ил)амид (S)-2-амино-4-метилпентановой кислоты;
((3R,4R,7S)-1-(2-пиридин)сульфонил-3-гидрокси-7-метилазепан-4-ил)амид (S)-2-амино-4-метилпентановой кислоты;
{(S)-1-[(3S,4S,7R)-3-гидрокси-7-метил-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутил}амид бензофуран-2-карбоновой кислоты;
{(S)-1-[(3R,4R,7S)-3-гидрокси-7-метил-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутил}амид бензофуран-2-карбоновой кислоты;
бензиловый эфир ((R)-1-метилпент-4-енил)карбаминовой кислоты;
бензиловый эфир аллил((R)-1-метилпент-4-енил)карбаминовой кислоты;
бензиловый эфир 2-метил-2,3,4,7-тетрагидроазепин-1-карбоновой кислоты;
бензиловый эфир (1S,4R,7R)-4-метил-8-окса-3-азабицикло[5.1.0]октан-3-карбоновой кислоты;
бензиловый эфир (2R,5S,6S)-5-азидо-6-гидрокси-2-метилазепан-1-карбоновой кислоты;
бензиловый эфир (2R,5S,6S)-5-амино-6-гидрокси-2-метилазепан-1-карбоновой кислоты;
бензиловый эфир (2R,5S,6S)-5-((S)-2-трет-бутоксикарбониламино-4-метилпентаноиламино)-6-гидрокси-2-метилазепан-1-карбоновой кислоты;
трет-бутиловый эфир [(S)-1-((3S,4S,7R)-3-гидрокси-7-метилазепан-4-илкарбамоил)-3-метилбутил]карбаминовой кислоты;
трет-бутиловый эфир [(S)-1-((3S,4S,7R)-2-пиридинсульфонил-3-гидрокси-7-метилазепан-4-илкарбамоил)-3-метилбутил]карбаминовой кислоты;
((3S,4S,7R)-1-(2-пиридин)сульфонил-3-гидрокси-7-метилазепан-4-ил)амид (S)-2-амино-4-метилпентановой кислоты;
{(S)-3-метил-1-[(3R,4R,6R)-6-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 5-метоксибензофуран-2-карбоновой кислоты;
{(S)-1-[(3S,4S,6S)-6-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутил}амид бензо[b]тиофен-2-карбоновой кислоты;
{(S)-1-[(3R,4R,6R)-6-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутил}амид бензо [b]тиофен-2-карбоновой кислоты;
{(S)-1-[(3S,4S,6S)-6-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутил}амид 3-метилбензофуран-2-карбоновой кислоты;
{(S)-1-[(3R,4R,6R)-6-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутил}амид 3-метилбензофуран-2-карбоновой кислоты;
{(S)-1-[(3S,4S,6S)-6-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутил}амид тиено[3,2-b]тиофен-2-карбоновой кислоты;
{(S)-1-[(3S,4R,6R)-6-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутил}амид тиено[3,2-b]тиофен-2-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид бензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7S)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид бензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(3R,4R,7S)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид бензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(3R,4R,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид бензофуран-2-карбоновой кислоты;
бензиловый эфир ((R) -2-йод-1-метилэтил)карбаминовой кислоты;
бензиловый эфир ((R)-1-метилпент-4-енил)карбаминовой кислоты;
бензиловый эфир аллил((R)-1-метилпент-4-енил)карбаминовой кислоты;
бензиловый эфир 2-метил-2,3,4,7-тетрагидроазепин-1-карбоновой кислоты;
бензиловый эфир (1S,4R,7R)-4-метил-8-окса-3-азабицикло[5.1.0)октан-3-карбоновой кислоты;
бензиловый эфир (2R,5S,6S)-5-азидо-6-гидрокси-2-метилазепан-1-карбоновой кислоты;
бензиловый эфир (2R,5S,6S)-5-амино-6-гидрокси-2-метилазепан-1-карбоновой кислоты;
бензиловый эфир (2R,5S,6S)-5-((S)-2-трет-бутоксикарбониламино-4-метилпентаноиламино)-6-гидрокси-2-метилазепан-1-карбоновой кислоты;
трет-бутиловый эфир [(S)-1-((3S,4S,7R)-3-гидрокси-7-метилазепан-4-илкарбамоил)-3-метилбутил] карбаминовой кислоты;
трет-бутиловый эфир [(S)-1-((3S,4S,7R)-2-пиридинсульфонил-3-гидрокси-7-метилазепан-4-илкарбамоил)-3-метилбутил] карбаминовой кислоты;
((3S,4S,7R)-1-(2-пиридин)сульфонил-3-гидрокси-7-метилазепан-4-ил)амид (S)-2-амино-4-метилпентановой кислоты;
{(S)-1-[(3S,4S,7R)-3-гидрокси-7-метил-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутил}амид фуро[3,2-b]пиридин-2-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид фуро[3,2-b]пиридин-2-карбоновой кислоты;
{(S)-1-[(3S,4S,7R)-3-гидрокси-7-метил-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутил}амид 3-метилфуро [3,2-b]пиридин-2-карбоновой кислоты;
{(S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 3-метилфуро[3,2-b] пиридин-2-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид хинолин-6-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид хинолин-3-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 5-метоксибензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 3-метилбензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид тиено[3,2-b]тиофен-2-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид хиноксалин-2-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(1-оксипиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид тиено[3,2-b]тиофен-2-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(1-оксипиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 3-метилбензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(1-оксипиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид бензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(1-оксипиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид хинолин-2-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(1-оксипиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 5,6-дифторбензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(1-оксипиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 5-фтор-3-метилбензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(1-оксипиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 5-фторбензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(1-оксипиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид 3-метилфуро[3,2-b]]пиридин-2-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(1-оксипиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид циклогексанкарбоновой кислоты;
[(3S,4S,7R)-7-метил-3-гидрокси-1-(1-оксипиридин-2-сульфонил)азепан-4-ил]амид (S)-2-(2-циклогексилэтаноиламино)-4-метилпентановой кислоты;
[(3S,4S,7R)-7-метил-3-гидрокси-1-(1-оксипиридин-2-сульфонил)азепан-4-ил]амид (S)-2-(3-циклогексилпропаноиламино)-4-метилпентановой кислоты;
[(3S,4S,7R)-7-метил-3-гидрокси-1-(1-оксипиридин-2-сульфонил)азепан-4-ил]амид (S)-2-(4-циклогексилбутаноиламино)-4-метилпентановой кислоты;
[(3S,4S,7R)-7-метил-3-гидрокси-1-(1-оксипиридин-2-сульфонил)азепан-4-ил]амид (S)-2-(5-циклогексилпентаноиламино)-4-метилпентановой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(5-трифторметилпиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид бензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(5-трифторметилпиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}аьшф 5-фторбензофуран-2-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(5-трифторметилпиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид тиено[3,2-b]тиофен-2-карбоновой кислоты;
{1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]циклогексил} амид бензофуран-2-карбоновой кислоты;
{(S)-3,3-диметил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид тиофен-3-карбоновой кислоты;
{(S)-3,3-диметил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид фуран-2-карбоновой кислоты;
{(S)-3,3-диметил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил}амид тиено[3,2-b]тиофен-2-карбоновой кислоты;
{(S)-2-циклогексил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]этил}амид бензофуран-2-карбоновой кислоты;
{(S)-2-циклогексил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]этил}амид фуран-2-карбоновой кислоты;
{(S)-2-циклогексил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]этил}амид тиофен-3-карбоновой кислоты;
{(S)-2-циклогексил-1-[(3S,4S,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]этил}амид 3-метилфуро[3,2-b]пиридин-2-карбоновой кислоты;
[(S)-1-((3S,4S,7R)-1-метансульфонил-7-метил-3-гидроксиазепан-4-илкарбамоил)-3-метилбутил]амид (2R,4aR,8aR)-октагидробензо[1,4]диоксин-2-карбоновой кислоты;
[(S)-2-циклогексил-1-((3S,4S,7R)-7-метил-3-гидрокси-1-пропилазепан-4-илкарбамоил)этил]амид фуран-2-карбоновой кислоты;
[(S)-2-циклогексил-1-((3S,4S,7R)-7-метил-3-гидрокси-1-пропилазепан-4-илкарбамоил)этил]амид тиофен-3-карбоновой кислоты;
[(S)-2-циклогексил-1-((3S,4S,7R)-7-метил-3-гидрокси-1-пропилазепан-4-илкарбамоил)этил]амид бензофуран-2-карбоновой кислоты;
((3S,4S,7R)-1-циклогексилметил-7-метил-3-гидроксиазепан-4-ил)амид 1-(3-циклогексилпропаноиламино)циклогексанкарбоновой кислоты;
[1-((3S,4S,7R)-1-циклогексилметил-7-метил-3-гидроксиазепан-4-илкарбамоил)циклогексил]амид бензофуран-2-карбоновой кислоты;
[(S)-3-метил-1-((3S,4S,7R)-7-метил-3-гидрокси-1-пропилазепан-4-илкарбамоил)бутил]амид бензофуран-2-карбоновой кислоты;
бензиловый эфир (2R,5S)-5-((S)-2-трет-бутоксикарбониламино-4-метилпентаноиламино)-2-метил-6-гидроксиазепан-1-карбоновой кислоты;
{(S)-3-метил-1-[(3S,4S,7R)-7-метил-1-(1-морфолин-4-илметаноил)-3-гидроксиазепан-4-илкарбамоил]бутил}амид бензофуран-2-карбоновой кислоты;
[(3S,4S,7R)-7-метил-1-(1-морфолин-4-илметаноил)-3-гидроксиазепан-4-ил]амид (S)-2-(3-циклогексилпропаноиламино)-4-метилпентановой кислоты;
(тетрагидропиран-4-ил)амид (2R,5S,6S)-5-{(S)-2-[(1-бензофуран-2-илметаноил)амино]-4-метилпентаноиламино}-2-метил-6-гидроксиазепан-1-карбоновой кислоты;
метиловый эфир (S)-2-{[1-((2R,5S,6S)-5-{(S)-2-[(1-бензофуран-2-илметаноил)амино]-4-метилпентаноиламино}-2-метил-6-гидроксиазепан-1-ил)метаноил]амино}-4-метилпентановой кислоты;
метиловый эфир (S)-2-{[1-(4-{(S)-2-[(1-бензофуран-2-илметаноил)амино]-4-метилпентаноиламино}-3-гидроксиазепан-1-ил)метаноил]амино}-4-метилпентановой кислоты;
метиловый эфир (S)-4-метил-2-{[1-((2R,5S,6S)-2-метил-5-{(S)-4-метил-2-[(1-хинолин-8-илметаноил) амино] пентаноиламино}-6-гидроксиазепан-1-ил)метанол]амино}пентановой кислоты;
метиловый эфир (R)-2-{[1-(4-{(S)-2-[(1-бензофуран-2-илметаноил)амино]-4-метилпентаноиламино}-3-гидроксиазепан-1-ил)метаноил]амино}-4-метилпентановой кислоты;
[(3R,4R,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-ил]амид 2-бифенил-3-ил-4-метилпентановой кислоты;
{1-[(4S,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]циклогексил}амид 3-метилфуро[3,2-b]пиридин-2-карбоновой кислоты и
[(4S,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-ил]амид 1-(3-циклогексилпропаноиламино)циклогексанкарбоновой кислоты.
19. Способ получения соединения по п.1, включающий в себя стадию окисления соответствующего соединения по п.15 окислителем, с получением соединения формулы I в виде смеси диастереомеров.
20. Способ по п.19, отличающийся тем, что окислителем является комплекс диоксида серы и пиридина.
21. Способ по п.19, отличающийся тем, что он дополнительно включает стадию разделения диастереомеров способами разделения.
22. Способ по п.21, отличающийся тем, что способы разделения представляют собой высокоэффективную жидкостную хроматографию (ВЭЖХ).
23. Способ по п.19, отличающийся тем, что он дополнительно включает стадию дейтерирования указанных диастереомеров дейтерирующим агентом.
24. Способ по п. 23, отличающийся тем, что дейтерирующим агентом является CO3OD:D2O (10:1) в триэтиламине.
25. Применение соединения по одному из пп.1-13 в производстве лекарственного средства для использования в ингибировании протеазы, выбранной из группы, состоящей из цистеин-протеазы и серин-протеазы.
26. Применение по п.25, отличающееся тем, что протеазой является цистеин-протеаза.
27. Применение по п.25, отличающееся тем, что цистеин-протеазой является катепсин K.
28. Применение по п.25, отличающееся тем, что цистеин-протеазой является фальципаин.
29. Применение соединения по любому из пп.1-13 в производстве лекарственного средства для использования при лечении заболевания, характеризующегося потерей костной массы.
30. Применение по п.29, отличающееся тем, что заболеванием является остеопороз.
31. Применение по п.29, отличающееся тем, что заболеванием является периодонтит.
32. Применение по п.29, отличающееся тем, что заболеванием является гингивит.
33. Применение соединения по любому из пп.1-13 в производстве лекарственного средства для использования при лечении заболевания, характеризующегося избыточной деградацией хряща или матрикса.
34. Применение по п.33, отличающееся тем, что заболеванием является остеоартрит.
35. Применение по п.33, отличающееся тем, что заболеванием является ревматоидный артрит.
36. Применение соединения по любому из пп.1-13 в производстве лекарственного средства для лечения заболевания, вызванного инфекцией паразитом, выбранным из группы, состоящей из Plasmodium falciparum, Trypanosoma cruzi, Trypanosoma brucei, Leishmania mexicana, Leishmania pifanoi, Leishmania major, Schistosoma mansoni, Onchocerca volvulus, Brugia pahangi, Entamoeba histolytica, Giardia lamblia, гельминтов Haemonchus contortus и Fasciola hepatica, гельминтов родов Spirometra, Trichinella, Necator и Ascaris и простейших родов Cryptosporidium, Eimeria, Toxoplasma и Naegleria.
37. Применение по п.36, отличающееся тем, что заболевание выбрано из группы, состоящей из малярии, трипаносомоза (африканской сонной болезни, болезни Шагаса), лейшманиоза, шистосомоза, онхоцеркоза (речной слепоты) и жиардиаза.
38. Применение по п.37, отличающееся тем, что заболеванием является малярия.
Текст
005893 Данное изобретение относится к ингибиторам протеаз, представляющим собой С 1-6-алкил-4 аминоазепан-3-оны, в частности к таким ингибиторам цистеин- и серин-протеаз, более конкретно к соединениям, которые ингибируют цистеин-протеазы, еще более конкретно к соединениям, которые ингибируют цистеин-протеазы суперсемейства папаина, еще более конкретно к соединениям, которые ингибируют цистеин-протеазы семейства катепсина, наиболее конкретно к соединениям, которые ингибируют катепсин К. Такие соединения, в частности, пригодны для лечения заболеваний, в которые вовлечены цистеин-протеазы, особенно заболеваний, связанных с чрезмерной потерей костной или хрящевой ткани,например, остеопороза, периодонтита или артрита; и некоторых паразитарных болезней, например малярии. Катепсины являются ферментами, которые представляют собой часть суперсемейства папаина цистеин-протеаз. В литературе описаны катепсины В, Н, L, N и S. Недавно в патенте США 5501969 описан полипептид катепсина К и кДНК, кодирующая этот полипептид (названный в указанной работе катепсином О). Катепсин К был недавно экспрессирован, очищен и охарактеризован. Bossard, M. J., et al.,(1996) J. Biol. Chem. 271, 12517-12524; Drake, F. H., et al., (1996) J. Biol. Chem. 271, 12511-12516; Bromme,D., et al., (1996) J. Biol. Chem. 271, 2126-2132. В литературе катепсин К также обозначен различными наименованиями: катепсином О или катепсином О 2. Наиболее подходящим обозначением считается катепсин К. Катепсины функционируют в обычном физиологическом процессе деградации белков у животных,включая человека, например, в деградации соединительной ткани. Однако результатом повышенных уровней указанных ферментов в организме могут быть патологические состояния, приводящие к болезни. Таким образом, катепсины рассматривались как причинные факторы при различных состояниях болезни, включая, но не ограничиваясь этим, инфекции Pneumocystis carinii, Trypanosoma cruzi, Trypanosoma brucei brucei и Crithidia fusiculata; а также при шистосомозе, малярии, опухолевых метастазах, метахроматической лейкодистрофии, мышечной дистрофии, амиотрофии и тому подобное. См. международную заявку на патент номер WO 94/04172, опубликованную 3 марта 1994 г., и цитированные в указанной работе ссылки. Также см. Европейскую заявку на патент ЕР 0603873 А 1 и цитированные в ней ссылки. Две бактериальные цистеин-протеазы из P.gingivallis, названные гингипаинами, были связаны с патогенезом гингивита. Potempa, J., et al. (1994) Perspectives in Drug Discovery and Design, 2, 445-458. Предполагают, что катепсин К играет причинную роль при заболеваниях с избыточный потерей костной и хрящевой ткани. Кость состоит из белкового матрикса, в который включены кристаллы гидроксиапатита в форме веретена или пластинки. Коллаген типа I представляет собой основной структурный белок кости, составляющий примерно 90% белкового матрикса. Оставшиеся 10% матрикса состоят из множества неколлагеновых белков, включая остеокальцин, протеогликаны, остеопонтин, остеонектин,тромбоспондин, фибронектин и костный сиалопротеид. Скелетная кость в течение жизни в отдельных очагах подвергается повторному моделированию. Указанные очаги, или единицы повторного моделирования, подвергаются циклу, состоящему из фазы резорбции кости с последующей фазой замены кости. Резорбция костей осуществляется остеокластами, которые представляют собой многоядерные клетки гематопоэтической линии. Остеокласты прилипают к поверхности кости и образуют зону плотного контакта с последующим обширным образованием гофрированной мембраны на их апикальной поверхности (т.е. резорбирующей). Это создает закрытый экстрацеллюлярный компартмент на поверхности кости, в котором создается кислая среда протонными насосами в собранной в складки мембране, и в который остеокласт секретирует протеолитические ферменты. Низкое значение рН компартмента растворяет кристаллы гидроксиапатита на поверхности кости, в то время как протеолитические ферменты расщепляют белковый матрикс. Таким образом, формируется лакуна резорбции или углубление. К концу данной фазы цикла остеобласты выстилают новый белковый матрикс, который впоследствии минерализуется. При некоторых патологических состояниях, таких как остеопороз и болезнь Пэджета, нарушается нормальный баланс между резорбцией и формированием костей, и имеет место чистая потеря кости в каждом цикле. В конце концов это приводит к ослаблению кости и в результате может привести к повышенному риску перелома при минимальной травме. В нескольких опубликованных исследованиях показано, что ингибиторы цистеин-протеаз эффективны в ингибировании опосредованной остеокластами резорбции костей, и показана важнейшая роль цистеин-протеаз в резорбции костей. Например, Delaisse, et al., Biochem. J., 1980, 192, 365, описали серию ингибиторов протеаз в системе органной культуры костей мыши и высказали предположение о том,что ингибиторы цистеин-протеаз (например, леупептин, Z-Phe-Ala-CHN2) предотвращают резорбцию кости, тогда как ингибиторы серин-протеаз были неэффективными. Delaisse, et al., Biochem. Biophys. Res.Commun., 1984, 125, 441, показали, что Е-64 и леупептин также эффективны в предотвращении резорбции костей in vivo, что измерено по резким изменениям содержания кальция в сыворотке крыс, находящихся на диете, дефицитной по кальцию. Lerner, et al., J. Bone Min. Res., 1992, 7, 433, показали, что цистатин, эндогенный ингибитор цистеин-протеаз, ингибирует стимулированную РТН резорбцию кости свода черепа у мышей. В других исследованиях, таких, как Delaisse, et al., Bone, 1987, 8, 305, Hill, et al., J.Cell. Biochem., 1994, 56, 118, и Everts, et al., J. Cell. Physiol., 1992, 150, 221, также сообщается о корреляции между ингибированием активности цистеин-протеаз и резорбции костей. Tezuka, et al., J. Biol.Lett., 1995, 357, 129 раскрыли, что при нормальных условиях катепсин К, цистеин-протеаза, в большом количестве экспрессируется в остеокластах и может являться основной цистеин-протеазой, присутствующей в данных клетках. Обильная избирательная экспрессия катепсина К в остеокластах строго свидетельствует о том, что указанный фермент важен для резорбции костей. Таким образом, избирательное ингибирование катепсина К может обеспечивать эффективное лечение заболеваний при избыточной потере костной ткани,включая, но не ограничиваясь этим, остеопороз, заболеваний десен, таких как гингивит и периодонтит,болезни Пэджета, гиперкальциемии при злокачественном процессе и болезни обмена веществ в костях. Также показано, что уровни катепсина К повышены в хондрокластах синовиальной оболочки при остеоартрите. Таким образом, избирательное ингибирование катепсина К также может быть полезным при лечении заболеваний, сопровождающихся избыточной деградацией хряща или матрикса, включая, но не ограничиваясь этим, остеоартрит и ревматоидный артрит. Неопластические клетки метастазов обычно также экспрессируют высокие уровни протеолитических ферментов, которые деградируют окружающий матрикс. Таким образом, избирательное ингибирование катепсина К также может быть полезным при лечении некоторых неопластических заболеваний. Известны некоторые ингибиторы цистеин-протеаз. Palmer, (1995) J. Med. Chem., 38, 3193, описал несколько винилсульфонов, которые необратимо ингибируют цистеин-протеазы, такие как катепсины В,L, S, О 2 и крузаин. Также сообщалось, что другие классы соединений, такие, как альдегиды, нитрилы, кетокарбонильные соединения, галогенметилкетоны, диазометилкетоны, (ацилокси)метилкетоны, соли кетометилсульфония и эпоксисукцинильные соединения ингибируют цистеин-протеазы. См., Palmer там же, и цитированные в указанной работе ссылки. В патенте США 4518528 описаны пептидилфторметилкетоны как необратимые ингибиторы цистеин-протеазы. В опубликованной международной заявке на патент WO 94/04172 и Европейских заявках на патент ЕР 0525420 А 1, ЕР 0603873 А 1 и ЕР 0611756 А 2 описаны алкоксиметил- и меркаптометилкетоны, которые ингибируют цистеин-протеазы катепсины В, Н и L. В международной заявке на патентPCT/US94/08868 и Европейской заявке на патент ЕР 0623592 А 1 описаны алкоксиметил- и меркаптометилкетоны, которые ингибируют цистеин-протеазу IL-1-конвертазу. Алкоксиметил- и меркаптометилкетоны также были описаны как ингибиторы серин-протеазы кининогеназы (международная заявка на патент PCT/GB 91/01479). Азапептиды, которые предназначены для доставки азааминокислоты к активному сайту серинпротеаз и которые имеют легко удаляемую группу, описаны Elmore et al., Biochem. J., 1968, 107, 103,Garker et al., Biochem. J., 1974, 139, 555, Gray et al., Tetrahedron, 1977, 33, 837, Gupton et al., J. Biol. Chem.,1984, 259, 4279, Powers et al., J. Biol. Chem., 1984, 259, 4288, и известно, что они ингибируют серинпротеазы. Кроме того, в J. Med. Chem., 1992, 35, 4279 описаны некоторые сложные эфиры азапептидов в качестве ингибиторов цистеин-протеаз. Антипаин и леупептин описаны в качестве обратимых ингибиторов цистеин-протеазы в работеUmezawa et al., 45 Meth. Enzymol. 678. E64; и его синтетические аналоги также являются хорошо известными ингибиторами цистеин-протеаз (Barrett, Biochem. J., 201, 189, и Grinde, Biochem. Biophys. Acta, 701,328). 1,3-Диамидопропаноны были описаны как аналгетические средства в патентах США 4749792 и 4638010. Таким образом, идентифицировано множество разнообразных по структуре ингибиторов протеаз. Однако указанные известные ингибиторы считаются непригодными в качестве терапевтических средств для животных, особенно людей, поскольку они имеют множество недостатков. Указанные недостатки включают отсутствие избирательности, цитотоксичность, плохую растворимость и слишком быстрый клиренс плазмы. Поэтому существует необходимость в способах лечения заболеваний, вызываемых патологическими уровнями протеаз, особенно цистеин-протеаз, более конкретно катепсинов, наиболее конкретно катепсина К, и в новых соединениях-ингибиторах, пригодных для таких способов. Авторы данного изобретения в настоящее время открыли новый класс С 1-6-алкил-4-аминоазепан-3 оновых соединений, которые являются ингибиторами протеаз, наиболее конкретно, катепсина К. Задачей данного изобретения является создание С 1-6-алкил-4-аминоазепан-3-он-карбонильных ингибиторов протеаз, в частности, таких ингибиторов цистеин- и серин-протеаз, более конкретно, таких соединений, которые ингибируют цистеин-протеазы, еще более конкретно, таких соединений, как цистеин-протеазы суперсемейства папаина, еще более конкретно, таких соединений, которые ингибируют цистеин-протеазы семейства катепсина, наиболее конкретно, таких соединений, которые ингибируют катепсин К, и которые пригодны для лечения заболеваний, которые можно терапевтически модифицировать посредством изменения активности таких протеаз. Соответственно, в первом аспекте изобретение относится к соединению согласно формуле I.-2 005893 В другом аспекте данное изобретение относится к фармацевтической композиции, содержащей соединение формулы I и фармацевтически приемлемый носитель, разбавитель или эксципиент. В еще одном аспекте данное изобретение относится к промежуточным соединениям, пригодным для получения соединений формулы I. В еще одном аспекте данное изобретение относится к способу лечения заболеваний, при котором патологию заболевания можно модифицировать терапевтически путем ингибирования протеаз, в частности, цистеин и серин-протеаз, более конкретно, цистеин-протеаз, еще более конкретно, цистеин-протеаз суперсемейства папаина, еще более конкретно, цистеин-протеаз семейства катепсина, наиболее конкретно катепсина К. В конкретном аспекте соединения согласно данному изобретению особенно полезны для лечения заболеваний, характеризующихся потерей костной ткани, таких как остеопороз, и заболеваний десен,таких как гингивит или периодонтит, или заболеваний, характеризующихся избыточной деградацией хряща или матрикса, таких как остеоартрит и ревматоидный артрит; и для лечения некоторых паразитарных болезней, таких как малярия. Данное изобретение относится к соединениям формулы IR3 выбран из группы, состоящей из C1-6-алкила, С 3-6-циклоалкил-С 1-6-алкила, C1-6-алкилзамещенный фенил, C1-6-алкилзамещенный нафтил или, C1-6-алкилзамещенный тиофенил; R9 выбран из группы,включающей пиридил, 1-оксипиридинил, фенил, галогензамещенный фенил, C1-6 алкоксифенил, цианофенил, имидазолил, C1-6 алкилзамещенный имидазолил и их фармацевтически приемлемым солям, гидратам и сольватам. В соединениях формулы (I), предпочтительно, чтобы R3 выбран из группы, состоящей из Н, метила, этила, н-пропила, проп-2-ила, н-бутила, изобутила, бут-2-ила, циклопропилметила, циклогексилметила, 2-метансульфинилэтила, 1-гидроксиэтила, толуила, нафтален-2-илметила, бензилоксиметила и гидроксиметила. Еще более предпочтительно R3 выбран из группы, состоящей из толуила, изобутила и циклогексилметила. Наиболее предпочтительным R3 является изобутил.R5 предпочтительно выбирают из группы, состоящей из бензофуранил,3-метилфуро[3,2,b]пиридинил, N-метилиндолил, бензо[b]тиофенил, тиено[3,2,b]тиофенил или хинолинил. Наиболее предпочтительно, если R5 выбран из группы, состоящей из бензофуранила, бензо[b]тиофенила, хинолинила; фуро[3,2-b]пиридинила, 3-метилфуро[3,2-b]пиридинила, тиено[3,2-b]тиофенила; бензофуран-2-ила; бензо[b]тиофен-2-ила; хинолин-2-ила, хинолин-3-ила, хинолин-4-ила, хинолин-6-ила и хинолин-8-ила; фуро[3,2-b]пиридин-2-ила; тиено[3,2-b]тиофен-2-ила. Еще более предпочтителен R5, выбранный из группы, состоящей изN-метилиндол-2-ила; 3-метилфуро[3,2-b]пиридин-2-ила. Наиболее предпочтительным R"' является выбранный из группы, состоящей из метила, этила, пропила, бутила, пентила и гексила; наиболее предпочтительно цис-7-метил.R9 предпочтительно выбран из фенила, в частности, галогензамещенного фенила, более конкретно 3,4-дихлорфенила, 4-бромфенила, 2-фторфенила, 4-фторфенила, 3-хлорфенила, 4-хлорфенила, в частности, C1-6-алкоксифенила, более конкретно 3-метоксифенила, 4-метоксифенила, 3,4-диметоксифенила, в частности, цианфенила, более конкретно, 2-цианфенила; пиридинила, в частности, пиридин-2-ила, пиридин-3-ила, в частности, 1-оксипиридинила, более конкретно,1-оксипиридин-2-ила, 1-оксипиридин-3-ила; 1 Н-имидазолила, в частности, 1 Н-имидазол-2-ила, 1 Н-имидазол-4-ила, более конкретно, C1-6 алкилзамещенного имидазолила, еще более конкретно, 1-метил-1 Н-имидазол-2-ила, 1-метил-1 Нимидазол-4-ила;R9 наиболее предпочтительно выбран из группы, состоящей из пиридин-2-ила и 1-оксипиридин-2 ила. Соединения формулы I, выбранные из нижеследующей группы, представляют собой особенно предпочтительные варианты данного изобретения: 1-(3-циклогексилпропаноил Самым предпочтительным вариантом данного изобретения является (S)-3-метил-1-[(4S,7R)-7 метил-3-оксо-1-(пиридин-2-сульфонил) азепан-4-илкарбамоил]бутиламид бензофуран-2-карбоновой кислоты: Конкретные типичные соединения согласно данному изобретению указаны в примерах 1-64. По сравнению с соответствующими соединениями с 5- и 6-членными кольцами, соединения с 7 членным кольцом согласно данному изобретению структурно более стабильны в альфа-углеродном центре кетона. Данное изобретение включает дейтерированные аналоги соединений согласно данному изобретению. Характерные примеры таких дейтерированных соединений указаны в примерах 7,9 и 11. Типичный путь синтеза дейтерированных соединений согласно данному изобретению указан на схеме 4, приведенной ниже. Дейтерированные соединения согласно данному изобретению проявляют более высокую хиральную стабильность по сравнению с протонированным изомером. Определения Данное изобретение включает все гидраты, сольваты, комплексы и пролекарства соединений согласно данному изобретению. Пролекарства представляют собой любые ковалентно связанные соединения, которые высвобождают активное исходное лекарство согласно формуле I in vivo. Если в соединении согласно данному изобретению имеется хиральный центр или другая форма изомерного центра, подразумевается, что при этом охвачены все формы такого изомера или изомеров, включая энантиомеры и диастереомеры. Соединения согласно данному изобретению, содержащие хиральный центр, можно использовать в виде рацемической смеси, смеси, обогащенной одним из энантиомеров, или рацемическую смесь можно разделить, используя хорошо известные способы, и можно использовать только отдельный энантиомер. В тех случаях, когда соединения имеют ненасыщенные двойные углерод-углеродные связи,- 13005893 в объем данного изобретения входят как цис-(Z), так и транс-(Е) изомеры. В тех случаях, когда соединения могут существовать в таутомерных формах, таких как кетоенольные таутомеры, каждая таутомерная форма считается включенной в объем данного изобретения, существует ли она в равновесии или преимущественно в одной форме. Значение любого заместителя в каком бы то ни было положении в формуле I или любой ее подформуле независимо от своего значения или какого-либо другого значения заместителя в любом другом положении, если не оговорено особо. Чтобы описать соединения согласно данному изобретению в данном описании используются сокращения и символы, обычно используемые в области пептидов и реагентов. В общем, при сокращении аминокислот следуют правилам объединенной комиссии ИЮПАК-ИЮБ по биохимической номенклатуре, как описано в Eur. J. Biochem., 158, 9 (1984). Протеазы представляют собой ферменты, которые катализируют расщепление амидных связей пептидов и белков посредством нуклеофильного замещения у амидной связи, в конечном итоге приводя к гидролизу. Такие протеазы включают: цистеин-протеазы, серин-протеазы, аспарагин-протеазы и металлопротеазы. Соединения согласно данному изобретению способны связываться с ферментом более прочно, чем субстрат, и, в общем, не подвергаются отщеплению после того, как фермент осуществил катализ атаки нуклеофилом. Поэтому данные соединения конкурентно препятствуют распознаванию и гидролизу протеазами природных субстратов, и тем самым действуют как ингибиторы. Термин аминокислота в используемом здесь смысле относится к D- или L-изомерам аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, пролина, серина, треонина, триптофана,тирозина и валина. Термин водород или Н включает все его возможные изотопы, включая дейтерий или D или 2 Н; и тритий или Т или 3 Н. Подразумевается, что C1-6-алкил в используемом здесь смысле включает в себя замещенный и незамещенный метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил, пентил, н-пентил, изопентил, неопентил и гексил, и их простые алифатические изомеры. C1-6-алкил необязательно может быть замещен. Имеется в виду, что С 3-6-циклоалкил в используемом здесь смысле включает в себя замещенный или незамещенный циклопропан, циклобутан, циклопентан и циклогексан. Галоген означает F, Cl, Вr иI. Аr или арил означает фенил или нафтил, необязательно замещенный одним или более Ph-C1-6 алкилами. Некоторые группы радикалов приведены здесь в сокращении. t-Bu относится к радикалу третбутилу, Воc относится к радикалу трет-бутилоксикарбонилу, Fmoc относится к радикалу флуоренилметоксикарбонилу, Ph относится к фенильному радикалу, Cbz относится к бензилоксикарбонильному радикалу. Некоторые реагенты даны здесь в сокращении. m-СРВА относится к 3-хлорпероксибензойной кислоте, EDC относится к N-этил-N'-(диметиламинопропил)карбодиимиду, ДМФА относится к диметилформамиду, ДМСО относится к диметилсульфоксиду, TEA относится к триэтиламину, ТФУ относится к трифторуксусной кислоте и ТГФ относится к тетрагидрофурану. Способы получения Соединения общей формулы I можно получить способом, аналогичным способам, показанным на схемах 1 - 8. Этиловый эфир 2-метилпент-4-еновой кислоты превращают в N-2-пиридинсульфонилазапин путем восстановления до альдегида, восстановительного аминирования аллиламином, сульфонилирования 2 пиридилсульфонилхлоридом и реакции метатезиса олефина с катализатором Граббса. ЭпоксидированиеmСРВА дает смесь эпоксидов, разделяемых хроматографией на колонке. Син-эпоксид превращают в аминоспирт путем раскрытия кольца с помощью азида натрия с последующим восстановлением трифе- 14005893 нилфосфином. Ацилирование свободного амина Вос-лейцином и связывающим реагентом, таким какHBTU или EDC, с последующим удалением защитной Вос-группы с помощью НСl и ацилирование с помощью ряда ароматических карбоновых кислот и связывающих реагентов, таких как HBTU или EDC,дает промежуточные спирты. Конечное окисление периодинаном Десс-Мартина и ВЭЖХ дает требуемые кетоны. Схема 2 5-Гексен-2-он превращают в N-карбобензилоксиазапин посредством восстановительного аминирования аллиламином, защиты с помощью карбобензилоксихлорида и реакции метатезиса олефина с катализатором Граббса. Эпоксидирование mСРВА дает смесь эпоксидов, разделяемых хроматографией на колонке. Каждый эпоксид превращают в аминоспирт путем раскрытия эпоксидного кольца с помощью азида натрия с последующим восстановлением трифенилфосфином. Ацилирование свободного амина Вос-лейцином и связывающим реагентом, таким как HBTU или EDC, с последующим удалением защитной Cbz-группы гидрогенолизом дает вторичные амины, которые, в свою очередь, сульфонилируют с помощью 2-пиридинсульфонилхлорида. Удаление защитных Вос-групп с помощью НСl и ацилирование с помощью ряда ароматических карбоновых кислот и связывающих реагентов, таких как HBTU илиEDC, дает промежуточные спирты. Конечное окисление периодинаном Десс-Мартина и ВЭЖХ дает требуемые кетоны. Схема 3- 15005893 Карбобензилокси-D-аланинол (Cbz-D-аланинол) сначала превращают в йодид, затем подвергают реакции с аллилом Гриньяра с медным (I) катализатором или с подобным аллил-металлоорганическим реагентом. Затем амин алкилируют аллилйодидом. Затем используют катализатор Граббса, чтобы образовать азапиновое кольцо путем метатезиса, замыкающего кольцо. Эпоксидирование алкена с последующим разделением диастереомеров, за которым следует раскрытие кольца эпоксида неосновного компонента с помощью азида натрия дает промежуточный азидоспирт. Восстановление азида с последующим ацилированием амина защищенной аминокислотой, такой как Вос-лейцин, с последующим удалением защитной Cbz-групы дает промежуточный вторичный амин, который затем сульфонилируют сульфонилхлоридом, таким как пиридинсульфонилхлорид. Удаление защитной Вос-группы с последующим ацилированием таким ацилирующим агентом, как хинолин-6-карбоновая кислота,HBTU, NMM, и конечное окисление вторичного спирта до кетона таким окислителем, как триоксид серы-пиридин или периодинан Десс-Мартина, дает требуемые продукты. Схема 4 Дейтерированные ингибиторы можно получить из исходных ингибиторов, таких как (S)-3-метил 1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутиламид бензофуран-2 карбоновой кислоты, посредством обработки таким основанием, как триэтиламин, и перемешиванием в течение нескольких дней в дейтерированном протонном растворителе, таком как CD3OD:D2O. Схема 5 Промежуточное соединение (S)-3-циклогексил-N-3S,4S,7R)-3-гидрокси-7-метилазепан-4-ил)-2 метилпропионамид, который описан на схеме 3 (с использованием Вос-циклогексилаланина вместо BocL-лейцина), подвергают восстановительному аминированию альдегидом или кетоном, таким как пропиональдегид, затем обрабатывают восстанавливающим агентом, таким как борогидрид натрия. Удаление защитной Вос-группы с последующим ацилированием таким ацилирующим агентом, как 2 фуранкарбоновая кислота, HBTU, NMM, и конечное окисление вторичного спирта до кетона таким окислителем, как триоксид серы-пиридин дает требуемые продукты. Схема 6- 16005893 Промежуточное соединение трет-бутиловый эфир [(S)-1-S)-3-гидроксиазепан-4-илкарбамоил)-3 метилбутил] карбаминовой кислоты, который представлен на схеме 3, ацилируют изоцианатом, таким как метиловый эфир (S)-(-)-2-изоцианат-4-метилвалериановой кислоты. Удаление защитной Вос-группы с последующим ацилированием таким ацилирующим агентом, как бензофуран-2-карбоновая кислота,HBTU, NMM, и заключительное окисление вторичного спирта до кетона таким окислителем, как периодинан Десс-Мартина или триоксид серы-пиридин, дает требуемые продукты. Схема 7 Синтез С-5 метилазепинона, (S)-3-метил-1-[5-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4 илкарбамоил]бутиламида 4,5(R,S)-бензофуран-2-карбоновой кислоты, (пример 61) схематично представлен выше на схеме 7. Реакция присоединения Михаэля нитрометана к этилкротонату 7-1 с последующим восстановлением промежуточного сложного эфира таким восстанавливающим агентом, как гидрид диизобутилалюминия (Dibal-H), дает альдегид 7-2. Восстановительное аминирование 7-2 N-бензилэтаноламином в присутствии восстанавливающего агента, такого как триацетоксиборогидрид натрия, дает нитроспирт 7-3. Окисление 7-3 с использованием обычного в данной области окислителя, такого как ДМСО и оксалилхлорид, с последующей обработкой неочищенного промежуточного альдегида таким основанием, как триэтиламин, дает нитроальдольную- 17005893 реакцию с получением азепанола 7-4. Восстановление нитрогруппы цинком в присутствии соляной кислоты с последующим связыванием полученного в результате амина с N-Boc-лейцином в присутствии обычного в данной области связывающего агента, такого как EDC, дает промежуточное соединение 7-5. Восстановительное удаление N-бензильного компонента газообразным водородом в присутствии такого катализатора, как 10% Pd на угле, с последующим сульфонилированием сульфонилхлоридом в присутствии такого основания, как N-метилморфолин или триэтиламин, дает промежуточное соединение сульфонамид 7-6. Удаление защитной N-Boc-группы в кислых условиях с последующим связыванием полученной в результате соли амина с бензофуран-2-карбоновой кислотой и окисление спирта обычным в данной области окислителем, таким как комплекс триоксида серы и пиридина или периодинан ДессМартина, дает кетон 7. Отдельные диастереомеры 7-7 можно разделить способами ВЭЖХ, чтобы получить диастереомеры 7-8, 7-9, 7-10 и 7-11. Схема 8 Промежуточное соединение бензиловый эфир (2R,5R,6R)-5-амино-6-гидрокси-2-метилазепан-1 карбоновой кислоты (полученное из основного эпоксида на схеме 3) защищают с помощью Восангидрида. Затем Cbz-группу удаляют путем гидрогенолиза. Затем выполняют сульфонилирование 2 пиридинсульфонилхлоридом и Вос-группу удаляют соляной кислотой в диоксане. Затем первичный амин связывают с 2-бифенил-3-ил-4-метилпентановой кислотой (как описано в J. Am. Chem. Soc. 1997,120, 9114), затем вторичный спирт окисляют до кетона таким окислителем, как периодинан ДессМартина или триоксид серы-пиридин. Затем азепанон эпимеризуют с использованием триэтиламина в МеОН, чтобы получить смесь диастереомеров. Требуемое соединение получают разделением диастереомеров с использованием хиральной ВЭЖХ. Используемые здесь исходные вещества и коммерчески доступные аминокислоты получают обычными способами, хорошо известными специалистам в данной области, которые можно найти в обычных справочниках, таких как COMPENDIUM OF ORGANIC SYNTHETIC METHODS, Vol. I-VI (опубликованном Wiley-Interscience). Способы связывания для того, чтобы в данном случае образовать амидные связи, как правило, хорошо известны в данной области. Способы пептидного синтеза, в общем изложенные Bodansky et al.,THE PRACTICE OF PEPTIDE SYNTHESIS, Springer-Verlag, Berlin, 1984; E. Gross and J. Meienhofer, THEEd., Pierce Chemical Co., Rockford, Ill., 1984, являются общими иллюстративными способами и включены здесь в виде ссылки. В методах синтеза для получения соединений согласно данному изобретению часто используют защитные группы для того, чтобы защитить реакционно-способные функциональные группы или минимизировать нежелательные побочные реакции. Такие защитные группы в общем описаны в Green, T. W,PROTECTIVE GROUPS IN ORGANIC SYNTHESIS, John Wiley and Sons, New York (1981). Термин защитные группы аминогруппы в общем относится к группам Воc, ацетилу, бензоилу, Fmoc и Cbz и их производным, которые известны в данной области. Способы присоединения и удаления защитных групп и замены групп, защищающих аминогруппу другой группой, хорошо известны. Кислотно-аддитивные соли соединений формулы I получают стандартным способом в подходящем растворителе из исходного соединения и избытка кислоты, такой как хлористо-водородная, бромистоводородная, фтористо-водородная, серная, фосфорная, уксусная, трифторуксусная, малеиновая, янтарная или метансульфоновая. Некоторые соединения образуют внутренние соли или цвиттерионы, которые могут быть приемлемыми. Катионные соли получают обработкой исходного соединения избытком ще- 18005893 лочного реагента, такого как гидроксид, карбонат или алкоксид, содержащего соответствующий катион; или с помощью соответствующего органического амина. Такие катионы как Li+, Na+, K+, Ca, Mg иNH4+ являются конкретными примерами катионов, присутствующих в фармацевтически приемлемых солях. Галогениды, сульфаты, фосфаты, алканоаты (такие, как ацетат и трифторацетат), бензоаты и сульфонаты (такие, как мезилат) являются примерами анионов, присутствующих в фармацевтически приемлемых солях. Данное изобретение также относится к фармацевтической композиции, которая содержит соединение согласно формуле I и фармацевтически приемлемый носитель, разбавитель или эксципиент. Соответственно, соединения формулы I можно использовать в производстве лекарственного средства. Фармацевтические композиции соединений формулы I, полученные, как описано выше, можно приготовить в виде растворов или лиофильно высушенных порошков для парентерального введения. Порошки можно повторно растворить добавлением подходящего разбавителя или другого фармацевтически приемлемого носителя перед использованием. Жидкие композиции могут представлять собой забуференный изотоничный водный раствор. Примерами подходящих разбавителей являются нормальный изотоничный раствор соли, стандартная 5% декстроза в воде или забуференный раствор ацетата натрия или ацетата аммония. Такая композиция особенно подходит для парентерального введения, но также может быть использована для перорального введения или находиться в дозирующем ингаляторе или распылителе для инсуффляции. Желательным может быть добавление таких эксципиентов, как поливинилпирролидон, желатин, гидроксицеллюлоза, смола акации, полиэтиленгликоль, маннит, хлорид натрия или цитрат натрия. В альтернативном случае данные соединения могут быть инкапсулированы, таблетированы или приготовлены в виде эмульсии или сиропа для перорального введения. Можно добавить фармацевтически приемлемые твердые или жидкие носители, чтобы улучшить или стабилизировать композицию, или чтобы облегчить приготовление композиции. Твердые носители включают крахмал, лактозу, дигидрат сульфата кальция, каолин, стеарат магния или стеариновую кислоту, тальк, пектин, смолу акации, агар или желатин. Жидкие носители включают сироп, арахисовое масло, оливковое масло, солевой раствор или воду. Носитель также может включать в себя материал замедленного высвобождения, такой как глицерилмоностеарат или глицерилдистеарат, как таковой или с воском. Количество твердого носителя варьирует, но предпочтительно будет составлять примерно от 20 мг до 1 г на стандартную дозу. Фармацевтические препараты готовят, следуя традиционным для фармации способам, включая при необходимости измельчение, смешивание, гранулирование и прессование для таблетированных форм; или измельчение, смешивание и наполнение для форм в виде твердых желатиновых капсул. В том случае, когда используют жидкий носитель, препараты будут в форме сиропа, эликсира, эмульсии или водной или неводной суспензии. Такую жидкую композицию можно вводить непосредственно перорально или заполнять в мягкую желатиновую капсулу. Для ректального введения соединения согласно данному изобретению также можно комбинировать с такими эксципиентами, как масло какао, глицерин, желатин или полиэтиленгликоли, и формовать в суппозиторий. Новые промежуточные соединения Что касается способов получения соединений формулы I, указанных выше на схемах 1-8, специалисту будет очевидно, что данное изобретение включает в себя все новые промежуточные соединения, требуемые для того, чтобы получить соединения формулы I. В частности, данное изобретение относится к соединениям формулы II:R5 выбран из группы, включающий бензофуранил,3-метилфуро[3,2,b]пиридинил, N-метилиндолил,бензо[b]тиофенил, тиено[3,2,b]тиофенил или хинолинил; R"' представляет цис-7-С 1-6-алкил; R3 выбран из группы, состоящей из C1-6-алкила, С 3-6-циклоалкил-С 1-6-алкила, C1-6-алкилзамещенный фенил, C1-6 алкилзамещенный нафтил или C1-6-алкилзамещенный тиофенил; R9 выбран из группы, включающей пиридинил, 1-оксипиридинил, фенил, галогензамещенный фенил, C1-6 алкоксифенил, цианофенил, имидазолил, C1-6 алкилзамещенный имидазолил и их фармацевтически приемлемым солям, гидратам и сольватам. Следующие соединения являются предпочтительными новыми промежуточными соединениями: 3-метил-1-(пиридин-2-сульфонил)-2,3,4,7-тетрагидро-1 Н-азепин; 5-метил-3-(пиридин-2-сульфонил)-8-окса-3-азабицикло-[5.1.0]октан; 4-азидо-5-метил-1-(пиридин-2 сульфонил)азепан-3-ол; 4-амино-6-метил-1-(пиридин-2-сульфонил)азепан-3-ол; трет-бутиловый эфир (S)-1-[3-гидрокси-6-метил-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]3-метилбутил карбаминовой кислоты;[(4S,7R)-7-метил-3-гидрокси-1-(пиридин-2-сульфонил)азепан-4-ил]амид 1-(3-циклогексилпропаноиламино)циклогексанкарбоновой кислоты. Обращаясь к схемам 1-8, указанным выше, видно, что данное изобретение относится к способу получения соединений формулы (I), включающему стадию окисления соответствующего соединения фор- 22005893 мулы (II) окислителем, чтобы получить соединение (I) в виде смеси диастереомеров. Предпочтительно окислителем является комплекс триоксида серы и пиридина. На схеме 4 видно, что данное изобретение также относится к способу получения дейтерированных соединений формулы (I). В частности, в том случае, когда требуется дейтерированный изомер, к синтезу после стадии окисления добавляется дополнительная стадия дейтерирования протонированного изомера дейтерирующим агентом, чтобы получить дейтерированное соединение формулы (I) в виде смеси диастереомеров. Предпочтительно дейтерирующим агентом является CD3OD:D2O (10:1) в триэтиламине. Способ, кроме того, включает стадию разделения диастереомеров формулы (I) методами разделения, предпочтительно высокоэффективной жидкостной хроматографией (ВЭЖХ). Соединения формулы (I) полезны в качестве ингибиторов протеаз, в частности, в качестве ингибиторов цистеин- и серин-протеаз, более конкретно, в качестве ингибиторов цистеин-протеаз, еще более конкретно, в качестве ингибиторов цистеин-протеаз суперсемейства папаина, еще более конкретно, в качестве ингибиторов цистеин-протеаз семейства катепсина, наиболее конкретно, в качестве ингибиторов катепсина К. Данное изобретение также относится к пригодным композициям и составам, содержащим указанные соединения. Данные соединения полезны для лечения заболеваний, в которые вовлечены цистеин-протеазы,включая инфекции Pneumocystis carinii, Trypanosoma cruzi, Trypanosoma brucei и Crithidia fusiculata; а также при шистосомозе, малярии, опухолевом метастазе, метахроматической лейкодистрофии, мышечной дистрофии, амиотрофии; и, в частности, заболеваний, в которые вовлечен катепсин К, наиболее конкретно, заболеваний с избыточной потерей костной и хрящевой ткани, включая остеопороз, заболевания десен, включая гингивит и периодонтит, артрита, более конкретно, остеоартрита и ревматоидного артрита, болезни Пэджета; гиперкальциемии при злокачественном процессе и заболевания, связанного с обменом веществ в костях. Паразитирующие организмы, которые, как известно, используют цистеин-протеазы в своем жизненном цикле, (и заболевания, вызываемые этими паразитами) включают Trypanosoma cruzi, Trypanosoma brucei [трипаносомоз (африканская сонная болезнь, болезнь Шагаса)], Leishmania mexicana, Leishmania pifanoi, Leishmania major (лейшманиоз), Schistosoma mansoni (шистосомоз), Onchocerca volvulus[онхоцеркоз (речная слепота)] Brugia pahangi, Entamoeba histolytica, Giardia lambia, гельминты, Haemonchus contortus и Fasciola hepatica, а также гельминты родов Spirometra, Trichinella, Necator и Ascaris, и простейшие родов Cryptosporidium, Eimeria, Toxoplasma и Naegleria. Соединения согласно данному изобретению пригодны для лечения заболеваний, вызываемых указанными паразитами, которых можно модифицировать терапевтическим способом посредством изменения активности цистеин-протеаз. В частности, данные соединения пригодны для лечения малярии посредством ингибирования фальципаина. Неопластические клетки метастазов обычно также экспрессируют высокие уровни протеолитических ферментов, которые вызывают деградацию окружающего матрикса, и некоторые опухоли и метастатические новообразования можно эффективно лечить соединениями данного изобретения. Данное изобретение также относится к способам лечения заболеваний, вызываемых патологическими уровнями протеаз, в частности, цистеин- и серин-протеаз, более конкретно, цистеин-протеаз, еще более конкретно, цистеин-протеаз суперсемейства папаина, еще более конкретно, цистеин-протеаз семейства катепсина, и данные способы включают введение соединения согласно изобретению животному,в частности, млекопитающему, более конкретно, человеку, который в этом нуждается. Данное изобретение, в частности, относится к способам лечения заболеваний, вызываемых патологическими уровнями катепсина К, и указанные способы включают введение животному, в частности, млекопитающему, более конкретно человеку, который в этом нуждается, ингибитора катепсина К, включая соединение данного изобретения. Данное изобретение, в частности, относится к способам лечения заболеваний, в которые вовлечены цистеин-протеазы, включая инфекции Pneumocystis carinii, Trypanosoma cruzi, Trypanosomabrucei и Crithidia fusiculata; а также шистосомоза, малярии, метастазов опухолей, метахроматической лейкодистрофии, мышечной дистрофии, амиотрофии, и особенно заболеваний, в которые вовлечен катепсин К, более конкретно, заболеваний с избыточной потерей костной и хрящевой ткани, включая остеопороз, заболеваний десен, включая гингивит и периодонтит, артрита, более конкретно, остеоартрита и ревматоидного артрита, болезни Пэджета, гиперкальциемии при злокачественном процессе и заболевания, связанного с обменом веществ в костях. Данный способ обеспечивает лечение заболеваний (в скобках), вызываемых инфекцией Trypanosoma cruzi, Trypanosoma brucei [трипаносомоз (африканская сонная болезнь, болезнь Шагаса)], Leishmania mexicana, Leishmania pifanoi, Leishmania major (лейшманиоз), Schistosoma mansoni (шистосомоз), Onchocerca volvulus [онхоцеркоз (речная слепота)] Brugia pahangi, Entamoeba histolytica, Giardia lambia,гельминтами, Haemonchus contortus и Fasciola hepatica, а также гельминтами родов Spirometra, Trichinella,Necator и Ascaris, и простейшими родов Cryptosporidium, Eimeria, Toxoplasrna и Naegleria посредством ингибирования цистеин-протеаз суперсемейства папаина при введении пациенту, который в этом нуждается, в частности, животному, более конкретно, млекопитающему, наиболее конкретно, человеку, одного или нескольких из перечисленных выше соединений.- 23005893 Наиболее конкретно данное изобретение относится к способу лечения малярии, вызываемой инфекцией Plasrnodium falciparum, посредством ингибирования фальципаина при введении пациенту, который в этом нуждается, в частности, животному, более конкретно, млекопитающему, наиболее конкретно,человеку, одного или нескольких из перечисленных выше соединений. Данный способ можно использовать на практике посредством введения перечисленных выше соединений по отдельности или в комбинации друг с другом или с другими терапевтически эффективными соединениями. Данное изобретение, кроме того, относится к способу лечения остеопороза или ингибирования потери костной ткани, который включает внутреннее введение пациенту эффективного количества соединения формулы I, отдельно или в комбинации с другими ингибиторами резорбции костей, такими как бифосфонаты (т.е. аллендронат), гормон-заместительной терапией, антиэстрогенами или кальцитонином. Кроме того, лечение соединением согласно данному изобретению и анаболическим средством, таким,как морфогенный белок костей, ипрофлавон, можно применять для предотвращения потери костной ткани или увеличения костной массы. При острой терапии предпочтительно парентеральное введение соединения формулы I. Наиболее эффективной является внутривенная инфузия соединения в 5% декстрозе в воде или нормальном физиологическом растворе, или сходной композиции с подходящими эксципиентами, хотя также применима внутримышечная болюсная инъекция. Парентеральная доза, как правило, будет составлять примерно от 0,01 до 100 мг/кг; предпочтительно от 0,1 до 20 мг/кг, таким образом, чтобы поддержать в плазме концентрацию лекарственного средства на уровне концентрации, эффективной для того, чтобы ингибировать катепсин К. Соединения вводят от одного до четырех раз в день на таком уровне, чтобы достичь общей суточной дозы примерно от 0,4 до 400 мг/кг/сутки. Точное количество соединения согласно изобретению, которое является терапевтически эффективным, и путь, которым лучше всего вводить такое соединение, легко определит специалист в данной области при сравнении уровня лекарственного средства в крови с концентрацией, необходимой для получения терапевтического действия. Соединения согласно данному изобретению также можно вводить пациенту перорально, таким образом, чтобы концентрация лекарственного средства была достаточной для того, чтобы ингибировать резорбцию костей, или для того, чтобы достичь какого-либо другого терапевтического эффекта, который здесь описан. Обычно фармацевтическую композицию, содержащую соединение, вводят в оральной дозе, составляющей примерно от 0,1 до 50 мг/кг, в соответствии с состоянием пациента. Предпочтительно оральная доза будет составлять примерно от 0,5 до 20 мг/кг. Не ожидается никаких недопустимых токсикологических эффектов при введении соединений согласно данному изобретению в соответствии с данным изобретением. Биологические анализы Соединения данного изобретения можно тестировать в одном из нескольких биологических анализов, чтобы определить концентрацию соединения, которая необходима для получения заданного фармакологического действия. Определение протеолитической каталитической активности катепсина К. Все анализы катепсина К выполняли с использованием рекомбинантного фермента человека. При стандартных условиях анализа для определения кинетических констант использовали флуорогенный пептидный субстрат, обычно Cbz-Phe-Arg-AMC, и определяли в 100 мМ Na-ацетате при рН 5,5, содержащем 20 мМ цистеина и 5 мМ EDTA. Исходные растворы субстрата готовили в концентрациях 10 или 20 мМ в ДМСО при конечной концентрации субстрата в анализе 20 мкМ. Все анализируемые пробы содержали 10% ДМСО. В независимых экспериментах обнаружено, что указанный уровень ДМСО не влияет на ферментативную активность или на кинетические константы. Все анализы проводили при температуре окружающей среды. Флуоресценцию продукта (возбуждение при 360 нм; эмиссия при 460 нм) регистрировали с помощью устройства, регистрирующего флуоресценцию на пластинках Perceptive Biosystems Cytofluor II. Кривые образования продукта строили в течение от 20 до 30 мин после образования АМС-продукта. Исследования ингибирования Потенциальные ингибиторы оценивали с помощью метода на основе кривых развития реакции. Анализы выполняли в присутствии варьирующих концентраций тестируемого соединения. Реакции инициировали добавлением фермента к забуференным растворам ингибитора и субстрата. Анализ результатов проводили в соответствии с одной из двух методик, в зависимости от вида кривых развития реакции в присутствии ингибиторов. Для тех соединений, для которых кривые развития реакции были линейными, кажущиеся константы ингибирования (Ki,app) рассчитывали согласно уравнению 1 (Brandt et al., Biochemistry, 1989, 28, 140):v = VmA/[Ka(1 + I/Ki,app) +A] (1) где v означает скорость реакции и максимальная скорость обозначена Vm, А означает концентрацию субстрата и константа Михаэлиса обозначена Kа, и I означает концентрацию ингибитора.- 24005893 Для тех соединений, при которых кривые развития реакции имеют перегиб вниз, характерный для зависимого от времени ингибирования, анализировали результаты отдельных партий, чтобы получить[АМС] = vss t + (vo-vss) [1-exp(-kobst)]/kobs (2) где [АМС] означает концентрацию продукта, образованного за время t, v0 означает начальную скорость реакции, и vss означает конечную установившуюся скорость. Затем значения kobs анализировали как линейную функцию концентрации ингибитора, чтобы получить кажущуюся константу скорости второго порядка (kobs/концентрация ингибитора или kobs/[I]), описывающую зависимое от времени ингибирование. Подробное обсуждение данной кинетической обработки полно описано (Morrison et al., Adv. Enzymol. Relat. Areas Mol. Biol., 1988, 61, 201). Анализ резорбции остеокластами человека Извлекали аликвоты суспензии клеток, полученных из остеокластомы, хранящихся в жидком азоте,быстро нагревали до 37 С и промывали x1 в среде RPMI-1640 при центрифугировании (1000 об./мин, 5 мин при 4 С). Среду отсасывали и заменяли мышиным анти-HLA-DR антителом, разведенным 1:3 в среде RPMI-1640, и инкубировали в течение 30 мин на льду. Суспензию клеток часто перемешивали. Клетки промывали х 2 холодной RPMI-1640 при центрифугировании (1000 об/мин, 5 мин при 4 С) и затем переносили в стерильную центрифужную пробирку объемом 15 мл. Количество мононуклеарных клеток подсчитывали в усовершенствованной камере для подсчета Neubauer. Достаточное количество магнитных шариков (5/мононуклеарная клетка), покрытых антителом козы против IgG мыши, отбирали из исходного флакона и помещали в 5 мл свежей среды (которая отмывала токсичный консервант азид). Среду удаляли посредством иммобилизации шариков на магните и заменяли свежей средой. Шарики смешивали с клетками и суспензию инкубировали в течение 30 мин на льду. Суспензию часто перемешивали. Клетки, покрытые шариками, иммобилизовали на магните и оставшиеся клетки(фракцию, обогащенную остеокластами) декантировали в стерильную центрифужную пробирку объемом 50 мл. К клеткам, покрытым шариками, добавляли свежую среду, чтобы удалить какие-либо захваченные остеокласты. Указанный процесс промывки повторяли х 10. Клетки, покрытые шариками, выбрасывали. Остеокласты подсчитывали в счетной камере, используя одноразовую пластиковую пастеровскую пипетку с большим отверстием, чтобы заполнить камеру образцом. Клетки осаждали центрифугированием и доводили плотность остеокластов до 1,5 х 104/мл в среде ЕМЕМ с добавлением 10% фетальной сыворотки теленка и 1,7 г/л бикарбоната натрия. Аликвоты суспензии клеток объемом 3 мл (на обработку) декантировали в центрифужные пробирки объемом 15 мл. Клетки осаждали центрифугированием. В каждую пробирку добавляли 3 мл соответствующего средства для обработки (разведенного до 50 мкМ в среде ЕМЕМ). Также включали контроли соответствующих наполнителей, позитивный контроль(87 МЕМ 1, разведенный до 100 мкг/мл) и контроль изотипа (IgG2a, разведенный до 100 мкг/мл). Пробирки инкубировали при 37 С в течение 30 мин. Аликвоты клеток объемом 0,5 мл высевали на стерильные дентиновые пластинки в 48-луночные планшеты и инкубировали при 37 С в течение 2 ч. Каждую обработку проверяли четырехкратно. Пластинки промывали шестью сменами теплого PBS (10 мл/лунка в 6-луночном планшете) затем помещали в свежее средство обработки или контроль и инкубировали при 37 С в течение 48 ч. Затем пластинки промывали в фосфатно-солевом буфере и фиксировали в 2% глутаральдегиде (в 0,2 М какодилате натрия) в течение 5 мин, после чего промывали в воде и инкубировали в буфере в течение 5 мин при 37 С. Затем пластинки промывали холодной водой и инкубировали в холодном ацетатном буфере/красителе для быстрого окрашивания красный гранат в течение 5 мин при 4 С. Избыток буфера отсасывали и пластинки сушили на воздухе после промывки в воде.TRAP-позитивные остеокласты подсчитывали с помощью широкопольной микроскопии, и затем снимали с поверхности дентина ультразвуковой обработкой. Объемы углублений определяли с использованием конфокального микроскопа Nikon/Lasertec ILM21W. Спектры ядерного магнитного резонанса регистрировали либо при 250, либо при 400 МГц, используя, соответственно, спектрометр Bruker AM 250 или Bruker AC 400. CDCl3 означает дейтерохлороформ,DMSO-d6 означает гексадейтерированный диметилсульфоксид и CD3OD означает тетрадейтерированный метанол. Химические сдвиги выражены в миллионных долях (d) вниз по полю от внутреннего стандарта тетраметилсилана. Сокращения для данных ЯМР означают следующее: с=синглет, д=дублет, т=триплет,кв=квартет, м=мультиплет, дд=дублет дублетов, дт=дублет триплетов, каж.=кажущийся,уш.=уширенный. J указывает константу взаимодействия ЯМР, измеренную в герцах. Непрерывные спектры волн инфракрасного излучения (ИК) регистрировали на инфракрасном спектрометре Perkin Elmer 683, и инфракрасные (ИК) спектры с преобразованиями Фурье (FTIR) записывали на инфракрасном спектрометре Nicolet Impact 400 D. ИК-спектры и FTIR-спектры записывали в режиме пропускания, и положения полос выражают в обратных волновых числах (см-1). Масс-спектры получали либо на приборах VG 70 FE, РЕ Syx API III, либо на VG ZAB HF, используя способы ионизации быстрой атомной бомбардировкой (FAB) или электрораспылением (ES). Элементный анализ осуществляли, используя анали- 25005893 затор элементов Perkin-Elmer 240C. Точки плавления определяли на аппаратуре для измерения точек плавления Thomas-Hoover и не корректировали. Все температуры выражены в градусах по Цельсию. Для тонкослойной хроматографии использовали пластинки с тонким слоем Analtech Silica Gel GF и Е. Merck Silica Gel 60 F-254. Как флэш-хроматографию, так и хроматографию под действием силы тяжести проводили на силикагеле Е. Merck Kieselgel 60 (230-400 меш). Там, где это указано, определенные реагенты приобретали у Aldrich Chemical Co., Milwaukee, Wisconsin, Chemical Dynamics Corp., South Plainfield, New Jersey, и Advanced Chemtech, Louisville, Kentucky. Примеры В нижеследующих примерах синтеза температура дана в градусах по Цельсию (С). Если не оговорено особо, все исходные вещества получали из коммерческих источников. Предполагается, что без дополнительных уточнений специалист в данной области, используя предшествующее описание, сможет использовать данное изобретение в его наибольшей степени. Указанные примеры даны для иллюстрации изобретения, не ограничивая его объем. Указание формулы изобретения дано для того, чтобы сохранить права авторов изобретения. Пример 1. (S)-3-Метил-1-[(4S,6S)-6-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил] бутиламид 5-метоксибензофуран-2-карбоновой кислоты а. Аллил(2-метилпент-4-енил)амин. К раствору этилового эфира 2-метилпент-4-еновой кислоты (7,1 г, 50 ммоль) по каплям добавляли раствор DIBAL (1,0 М в гексане, 75 мл) при -78 С в течение 1,0 ч. После добавления реакционную смесь перемешивали при -78 С в течение следующего часа. Реакцию гасили насыщенным NH4Cl (10 мл) и 4% НСl, затем экстрагировали EtOAc (3 х 100 мл). Объединенные органические экстракты сушили MgSO4,фильтровали, концентрировали на роторном испарителе и сырой продукт реакции использовали в следующей реакции без дополнительной очистки. 2-Метил-4-пентеналь (3,3 г, 33,7 ммоль) растворяли в СН 2 Сl2 (100 мл). К полученному раствору добавляли аллиламин (2,9 г, 50,5 ммоль). Использовали молекулярные сита (5 г), чтобы абсорбировать воду, образуемую во время реакции. Смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали на роторном испарителе и сырой продукт использовали в следующей реакции без дополнительной очистки. Аллил(2-метилпент-4 енилиден)амин (3,2 г, 23,4 ммоль) разбавляли 50 мл МеОН. К раствору добавляли NaBH4 (1,0 г, 26,3 ммоль) при 0 С. После добавления смесь перемешивали при КТ в течение 5 ч. Реакционную смесь концентрировали и остаток распределяли между EtOAc/20% водн. NaOH. Органический слой сушили надNа 2SO4, фильтровали и концентрировали на роторном испарителе, получая аллил(2-метилпент-4 енил)амин (1,5 г, выход 48%): 1 Н-ЯМР (400 Гц, CDCl3): d=5,93-5,68 (м, 2 Н), 5,18-4,92 (м, 4 Н), 3,21 (д,2 Н), 2,60-2,40 (м, 2 Н), 1,97-1,65 (м, 2 Н), 0,92 (д, 3 Н).b. Аллил(2-метилпент-4-енил)амид пиридин-2-сульфоновой кислоты. Аллил(2-метилпент-4-енил)амин (1,0 г, 7,2 ммоль) и NMM (1,7 г, 17,2 ммоль) смешивали в 30 мл СН 2 Сl2. К раствору во время его охлаждения на водяной бане со льдом медленно добавляли 2 пиридинсульфонилхлорид (1,53 г, 8,6 ммоль). После добавления реакционную смесь перемешивали при КТ в течение ночи. Реакционную смесь промывали 10% NаНСО 3 и насыщенным раствором соли, затем очищали хроматографией на колонке, получая указанное в заголовке соединение в виде бесцветного масла (1,2 г, выход 60%): МС (М+Н+) 281,2; 1H-ЯMP (400 Гц, CDCl3): d=8,70 (д, 1 Н), 8,0-7,75 (м, 2 Н), 7,5CH2Cl2 (100 мл). После тщательного дегазирования в Аr, добавляли катализатор Граббса (0,35 г, 0,43 ммоль) при защите Аr. Затем смесь кипятили с обратным холодильником в течение 2 ч, после чего реакционную смесь концентрировали на роторном испарителе. Продукт очищали хроматографией на колонкеd. 5-Метил-3-(пиридин-2-сульфонил)-8-окса-3-азабицикло [5.1.0]октан. К раствору 3-метил-1-(пиридин-2-сульфонил)-2,3,4,7-тетрагидро-1 Н-азепина (1,3 г, 5,16 ммоль) в СН 2 Сl2 (50 мл) добавляли NaHCO3 (1,3 г, 15,5 ммоль), а затем порциями mСРВА (2,67 г, 15,5 ммоль). Перемешивали при КТ в течение 4 ч перед промыванием 15% NaOH, насыщенным K2 СО 3 и насыщенным раствором соли. Сушили над Na2SO4. Реакционную смесь концентрировали на роторном испарителе и два изомера разделяли хроматографией на колонке (30%-40% EtOAc/гексан). Продукт первого элюирования (транс-изомер, 230 мг) использовали на следующих стадиях, продукт второго элюирования (цисизомер, 200 мг) хранили: МС (М+Н+): 269,0; 1H-ЯMP (400 Гц, CDCl3): d=8,70 (д, 1 Н), 8,0-7,75 (м, 2 Н),7,50 (м, 1 Н), 4,39 (м, 1 Н), 3,92 (м, 1 Н), 3,34-2,00 (м, 6 Н) 1,40 (м, 1 Н), 0,88 (д, 3 Н).e. 4-Азидо-5-метил-1-(пиридин-2-сульфонил)азепан-3-ол. 5-Метил-3-(пиридин-2-сульфонил)-8-окса-3-азабицикло[5.1.0]октан(230 мг, 0,86 ммоль) растворяли в смеси 8 мл МеОН и 2 мл Н 2 О. К раствору добавляли NaN3 (170 мг, 2,6 ммоль) и NH4Cl (140 мг, 2,6 ммоль). Реакционную смесь кипятили с обратным холодильником в течение ночи. После удаления МеОН остаток разбавляли EtOAc и промывали 10% NаНСО 3 и насыщенным раствором соли. Очистка хроматографией на колонке давала указанное в заголовке соединение (170 мг, выход 64%). МС (М+Н+) 312,2; 1 Н-ЯМР (400 Гц, CDCl3): d=8,69 (д, 1 Н), 8,04-7,94 (м, 2 Н), 7,54 (м, 1 Н), 4,00-2,95 (м, 7 Н), 2,20 (м,1 Н) , 1,90-1,74 (м, 2 Н), 0,98 (д, 3H).f. 4-Амино-6-метил-1-(пиридин-2-сульфонил)азепан-3-ол. 4-Азидо-6-метил-1-(пиридин-2-сульфонил)азепан-3-ол (0,33 г, 1,06 ммоль) растворяли в ТГФ (50 мл) и Н 2 О (0,2 мл). К полученному раствору добавляли PPh3 (0,42 г, 1,59 ммоль). Реакционную смесь перемешивали при 45 С в течение ночи. ТСХ показала, что исходного материала не осталось. ТГФ выпаривали, подвергали азеотропной перегонке с толуолом (2 х 100 мл). Полученное в результате густое масло растворяли в МеОН, обрабатывали НСl в эфире, чтобы довести рН до кислого значения. Добавляли еще эфир и раствор становился мутным, давая указанное в заголовке соединение в виде белого осадкаHCl-соль 4-амино-6-метил-1-(пиридин-2-сульфонил)азепан-3-ола (0,21 г, 0,59 ммоль) растворяли в 5 мл ДМФА. К полученному раствору добавляли Boc-Leu-OH (0,22 г, 0,88 ммоль) и HBTU (0,34 г, 0,90 ммоль) и затем NMM (0,24 г, 2,4 ммоль). Смесь перемешивали при КТ в течение ночи. ДМФА удаляли в условиях высокого вакуума. Остаток разбавляли EtOAc и промывали Н 2 О, 10% NаНСО 3 и насыщенным раствором соли. Очистка хроматографией на колонке давала указанное в заголовке соединение (0,2 г,выход 68%). МС (М+Н+): 499,1; 1 Н-ЯМР (400 Гц, CDCl3): 8,75 (д, 1 Н), 8,07-7,75 (м, 2 Н), 7,55 (м, 1 Н), 5,10h. (S)-1-[3-Гидрокси-6-метил-1-(пиридин-2-сульфонил) азепан-4-илкарбамоил]-3-метилбутиламид 5-метоксибензофуран-2-карбоновой кислоты. К трет-бутиловому эфиру (S)-1-[3-гидрокси-6-метил-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутил карбаминовой кислоты (0,13 г, 0,28 ммоль) добавляли НСl/диоксан (4 М, 2,8 мл,11,2 ммоль). Смесь перемешивали при КТ в течение 2 ч, после чего растворители и избыточное количество HCl удаляли на роторном испарителе. Полученное в результате белое твердое вещество растворяли в 5 мл ДМФА. К раствору добавляли 5-метоксибензофуран-2-карбоновую кислоту (63,4 мг, 0,33 ммоль),HBTU (125 г, 0,33 ммоль) и NMM (0,14 г, 1,34 ммоль). Смесь перемешивали при КТ в течение ночи. Затем ДМФА удаляли и остаток вновь растворяли в EtOAc (50 мл), промывали 10% NаНСО 3 (50 мл х 2) и насыщенным раствором соли (50 мл) . Объединенные органические слои концентрировали на роторном испарителе. Очистка хроматографией на колонке давала указанное в заголовке соединение (110 мг с выходом 69 %, 2 стадии): МС (М+Н+): 573,4; 1H-ЯМР (400 Гц, CDCl3): d=8,74-8,66 (дд, 1 Н), 7,96-6,97 (м,9 Н), 4,72 (м, 1 Н), 4,18-3,21 (м, 7 Н), 2,81 (м, 1 Н), 2,04-1,74 (м, 6 Н), 1,25 (м, 2 Н), 0,99-0,87 (м, 9 Н).i. (S)-3-Метил-1-[(4S,6S)-6-метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]бутил амид 5-метоксибензофуран-2-карбоновой кислоты и (S)-3-метил-1-[(4R,6R)-6-метил-3-оксо-1-(пиридин 2-сульфонил)азепан-4-илкарбамоил]бутиламид 5-метоксибензофуран-2-карбоновой кислоты. К раствору (S)-1-[3-гидрокси-6-метил-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутиламида 5-метоксибензофуран-2-карбоновой кислоты (110 мг, 0,19 ммоль) в 5 мл СН 2 Сl при КТ добавляли реагент Десс-Мартина (122 мг, 0,29 ммоль). Раствор перемешивали в течение 2 ч, после чего- 27005893 добавляли 50 мл СН 2 Сl2 и затем промывали 10% NаНСО 3 и насыщенным раствором соли. Очистка хроматографией на колонке (50% этилацетат в гексане) давала указанное в заголовке соединение (90 мг, выход 82%). 1 Н-ЯМР (400 Гц, CDCl3): d (м.д.): 8,69 (д, 1 Н), 7,94 (м, 2 Н), 7,39-7,24 (м, 3 Н), 7,02 (м, 4 Н), 5,26(м, 1 Н), 4,69 (м, 2 Н), 3,84 (м, 4 Н), 3,00 (м, 1 Н), 2,05 (м, 1 Н), 1,73 (м, 2 Н), 1,61 (м, 4 Н), 1,18 (д, 3 Н), 0,97 (д,6 Н). Диастереомеры разделяли посредством ВЭЖХ. Диастереомер 1: МС (М+Н+): 571,2; Диастереомер 2: МС (М+Н+): 571,2. Пример 2. (S)-1-[(4S,6S)-6-Метил-3-оксо-1-(пиридин-2-сульфонил)азепан-4-илкарбамоил]-3-метилбутиламид бензо[b]тиофен-2-карбоновой кислоты Следуя методике примера 1 (a-i), за исключением замены 5-метоксибензофуран-2-карбоновой кислоты бензо[b]тиофен-2-карбоновой кислотой, получали указанное в заголовке соединение: МС(м, 4 Н), 1,18 (д, 3 Н), 0,97 (д, 6 Н). Диастереомеры разделяли посредством ВЭЖХ. Диастереомер 1: МС (М+Н+): 557,2. Диастереомер 2: МС (М+Н+): 557,2. Пример 3. (S)-1-[(4S,6S)-6-Метил-3-оксо-1-(пиридин-2-сульфонил) азепан-4-илкарбамоил]-3 метилбутиламид 3-метилбензофуран-2-карбоновой кислоты Следуя методике примера 1 (a-i), за исключением замены 5-метоксибензофуран-2-карбоновой кислоты 3-метилбензофуран-2-карбоновой кислотой, получали указанное в заголовке соединение: МС(дд, 2 Н), 5,26 (м, 1 Н), 4,70-4,61 (м, 1 Н), 3,82 (д, 1 Н), 3,76 (м, 1 Н), 2,99 (д, 1 Н), 2,60 (с, 3 Н), 2,05 (м, 2 Н),1,76-1,58 (м, 5 Н), 1,19 (д, 3 Н), 0,97 (д, 6 Н). Диастереомеры разделяли посредством ВЭЖХ. Диастереомер 1: МС (М+Н+): 555,2; Диастереомер 2: МС (М+Н+): 555,4. Следуя методике примера 1 (a-i), за исключением замены 5-метоксибензофуран-2-карбоновой кислоты тиено[3,2-b]тиофен-2-карбоновой кислотой, получали указанное в заголовке соединение: МС(М+Н+): 563,2; 1 Н-ЯМР (400 Гц, CDCl3): d (м.д.): 8,69 (д, 1 Н), 7,97-7,78 (м, 5 Н), 7,41-7,38 (м, 3 Н), 6,95 (д,1 Н), 6,65 (д, 1 Н), 5,26 (м, 1 Н), 4,69-4,60 (м, 2 Н), 3,85 (д, 1 Н), 3,80 (м, 1 Н), 2,99 (д, 1 Н) , 2,04 (м, 2 Н), 1,751,55 (м, 4 Н), 1,18 (д, 3 Н), 0,97 (д, 6 Н). Диастереомеры разделяли посредством ВЭЖХ. Диастереомер 1: МС (М+Н+): 563,2; Диастереомер 2: МС (М+Н+): 563,2. Пример 5. (S)-3-метил-1-[(4S,7R)-7-метил-3-оксо-1-(пиридин-2-сульфонил) азепан-4-илкарбамоил] бутиламид бензофуран-2-карбоновой кислотыa. Аллил(1-метилпент-4-енилиден)амин, аллил(1-метилпент-4-енил)амин. Гекс-5-ен-2-он (9,8 г, 11,6 мл, 100 ммоль) добавляли к перемешиваемому раствору аллиламина (8,55 ммоль, 11,25 мл, 150 ммоль), молекулярных сит с размером пор 4 ангстрема (52 г) и паратолуолсульфоновой кислоты (10 мг) в СН 2 Сl2 (200 мл) и перемешивали в течение ночи. Реакционную смесь концентрировали в вакууме на роторном испарителе и использовали в следующей реакции без дальнейшей очистки (13 г, 95%). Электрораспылительная масс-спектрометрия: М+Н+=137,9.b. Рацемат аллил(1-метилпент-4-енил)амина. Борогидрид натрия (2,7 г, 71 ммоль) частями добавляли к перемешиваемому раствору аллил-(1 метилпент-4-енилиден)амина (6,5 г, 47 ммоль) в МеОН (100 мл) при 0 С. Реакционную смесь перемешивали в течение 30 мин, затем нагревали до КТ. Примерно 90 мл МеОН удаляли из реакционной смеси выпариванием на роторном испарителе, затем реакционную смесь разбавляли эфиром (200 мл), затем экстрагировали водой, затем насыщенным раствором соли. Объединенные органические слои сушилиMgSO4, фильтровали, концентрировали в вакууме на роторном испарителе, получая бледно-желтую жидкость, которую использовали в следующей реакции без дополнительной очистки (5,2 г, 80%).c. Рацемат бензилового эфира аллил(1-метилпент-4-енил)карбаминовой кислоты.- 29005893 Карбобензилоксихлорид (9,56 г, 8 мл) по каплям добавляли к перемешиваемому раствору аллил(1 метилпент-4-енил)амина (7 г, 50 ммоль), триэтиламина (5,5 г, 8,0 мл, 57,5 ммоль) в CH2Cl2 (100 мл) при 0 С. Реакционную смесь нагревали до КТ, затем перемешивали в течение 2 ч. Реакционную смесь разбавляли СН 2 Сl2 (100 мл), затем экстрагировали водой, затем насыщенным раствором соли. Объединенные органические слои сушили над MgSO4, фильтровали, концентрировали в вакууме выпариванием на роторном испарителе, затем хроматографировали (силикагель, 4% EtOAc/ гексаны), получая указанное в заголовке соединение (8,9 г, выход 65%): жидкостная хроматография/электрораспылительная массспектрометрия: М+Н+=274,2.d. Рацемат бензилового эфира 2-метил-2,3,4,7-тетрагидроазепин-1-карбоновой кислоты. Бензиловый эфир аллил(1-метилпент-4-енил)карбаминовой кислоты (1,036 г, 3,8 ммоль) растворяли в CH2Cl2 (10 мл) и реакционную смесь барботировали потоком газообразного аргона в течение 10 мин. Затем добавляли дихлорид бис(трициклогексилфосфин)бензилидинрутения (IV) (Strem Chemicals, катализатор Граббса, 22 мг, 0,027 ммоль) и реакционную смесь кипятили с обратным холодильником в течение 2 ч. Дополнительно добавляли дихлорид бис(трициклогексилфосфин) бензилидинрутения (IV) (11 мг, 0,014 ммоль) и реакционную смесь кипятили с обратным холодильником еще 1,5 ч. Реакционную смесь охлаждали до КТ в атмосфере аргона в течение ночи, затем концентрировали в вакууме на роторном испарителе, затем подвергали хроматографии (силикагель, 5% EtOAc/гексаны), получая указанное в заголовке соединение (0,83 г, 89%): 1 Н-ЯМР: 7,35-7,20 (м, 5 Н), 5,65 (1 Н, м), 5,13 (2 Н, АВ), 4,45-4,05 (м,2 Н) 3,56 (1 Н, д), 2,25-2,10 (м, 2 Н), 1,90-1,60 (м, 2 Н), 1,12 (3 Н, д). Жидкостная хроматография/электрораспылительная масс-спектрометрия: М+Н+=246,2.e. Рацемат бензилового эфира (1S,4R,7R)-4-метил-8-окса-3-азабицикло[5.1.0]октан-3-карбоновой кислоты. Мета-хлорпербензойную кислоту (1,05 г, 57-86% чистоты) добавляли к раствору бензилового эфира 2-метил-2,3,4,7-тетрагидроазепин-1-карбоновой кислоты (0,83 г, 3,34 ммоль) в СН 2 Сl2 при 0 С. Реакционную смесь перемешивали в течение получаса, затем нагревали до КТ. Добавляли дополнительное количество мета-хлорпербензойной кислоты (0,3 г, 57-86% чистоты) и реакционную смесь перемешивали 2 ч. Реакционную смесь концентрировали в вакууме на роторном испарителе, затем добавляли 80 мл смеси 9:1 гексаны/EtOAc, и реакционную смесь фильтровали. Фильтрат концентрировали в вакууме на роторном испарителе, затем подвергали хроматографии (силикагель, 20% EtOAc/гексаны), получая рацемат бензилового эфира (1S,4R,7S)-4-метил-8-окса-3-азабицикло[5.1.0]октан-3-карбоновой кислоты (0,44 г,50%) и указанного в заголовке соединения в виде рацемической смеси указанного в заголовке соединения (0,15 г, выход 17%): 1 Н-ЯМР: 7,42-7,22 (м, 5 Н), 5,13 (2 Н, с), 4,50-4,15 (м, 2 Н), 3,27 (1 Н, д), 3,12-2,95f. Рацемат бензилового эфира (2R,5S,6S)-5-азидо-6-гидрокси-2-метилазепан-1-карбоновой кислоты. Азид натрия (0,56 г, 8,62 ммоль) добавляли к раствору рацемата бензилового эфира (1S,4R,7R)-4 метил-8-окса-3-азабицикло[5.1.0]октан-3-карбоновой кислоты (0,75 г, 2,87 ммоль) и хлорида аммония(0,46 г, 8,62 ммоль) в МеОН (5 мл) и Н 2 О (0,5 мл), затем кипятили с обратным холодильником в течение 6 ч. Реакционную смесь концентрировали в вакууме на роторном испарителе, затем разбавляли водой (5 мл) и экстрагировали EtOAc (10 мл). Затем органический слой экстрагировали водой, насыщенным раствором соли, сушили MgSO4, фильтровали, концентрировали в вакууме на роторном испарителе и подвергали хроматографии (силикагель, 20% EtOAc/гексаны) , получая указанное в заголовке соединение:(0,7 г, 80%): 7,39-7,30 (м, 5 Н), 5,15 (2 Н, с), 4,10-3,67 (м, 2 Н), 3,10 (1 Н, д) , 1,85-1,53 (м, 4 Н) , 1,09 (3 Н,д). Жидкостная хроматография/электрораспылительная масс-спектрометрия: М+Н+=305,2.g. Рацемат бензилового эфира (2R,5S,6S)-5-амино-6-гидрокси-2-метилазепан-1-карбоновой кислоты. Трифенилфосфин (1,94 г, 7,4 ммоль) добавляли к раствору рацемата бензилового эфира (2R,5S,6S)5-азидо-6-гидрокси-2-метилазепан-1-карбоновой кислоты (1,5 г, 4 93 ммоль) в ТГФ (185 мл) и Н 2 О (0,7 мл), затем нагревали до 45 С в течение ночи. Затем реакционную смесь разбавляли толуолом (100 мл х 2) и дважды подвергали азеотропной перегонке в вакууме на роторном испарителе. Полученное в результате масло растворяли в МеОН и НСl в Et2O, после фильтрования собирали полученную в результате соль и использовали в следующей реакции без дальнейшей очистки (1,4 г, 90%).(0,25 г, 1,85 ммоль) и рацемата бензилового эфира (2R,5S,6S)-5-амино-6-гидрокси-2-метилазепан-1 карбоновой кислоты (0,5 г, 1,6 ммоль) в ДМФА (10 мл). Реакционную смесь перемешивали в течение ночи при КТ, затем разбавляли EtOAc (100 мл), промывали Н 2 О (3 х 50 мл), насыщенным раствором соли(50 мл), сушили сульфатом магния, фильтровали, концентрировали в вакууме на роторном испарителе и
МПК / Метки
МПК: A61P 19/08, A61K 31/55, C07D 401/00
Метки: ингибиторы, протеаз
Код ссылки
<a href="https://eas.patents.su/30-5893-ingibitory-proteaz.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы протеаз</a>
Предыдущий патент: Способ получения противораковых соединений
Следующий патент: Упаковка с uht-концентратом молока и способ её получения
Случайный патент: Устройство для калибровки гидравлических инструментов для передачи вращающего момента