Способ получения противораковых соединений
Номер патента: 5892
Опубликовано: 30.06.2005
Авторы: Норрис Тимоти, Сантафьянос Динос Пол, Лехнер Ричард Шелтон
Формула / Реферат
1. Способ получения соединения формулы 9
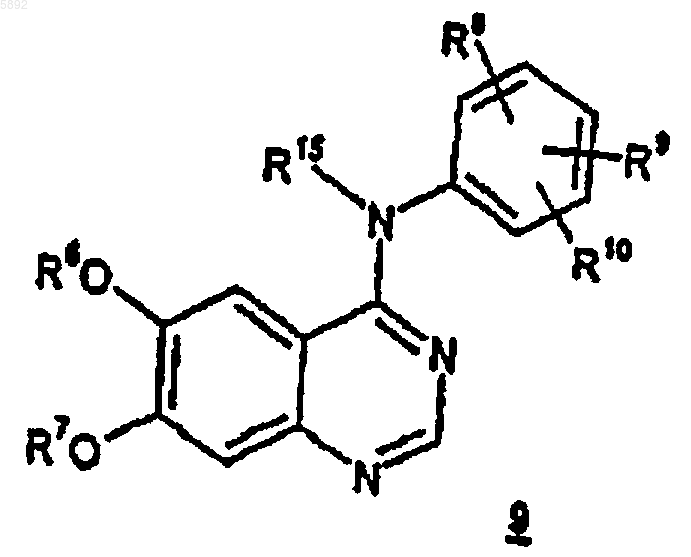
или его фармацевтически приемлемых соли или сольвата, в которых
R6 является C1-C10-алкилом или -(CH2)mO(CH2)nCH3;
R7 представляет собой C1-C10-алкил или -(C1-C6-алкил)(C6-C10-арил);
каждый m, независимо, является целым числом от 1 до 6, а n является целым числом от 0 до 3;
R8, R9 и R10, каждый независимо, выбираются из H, C1-C10-алкила и -OR11;
каждый R11, независимо, представляет собой C1-C10-алкил;
R15 представляет собой H или C1-C10-алкил;
который включает обработку соединения формулы 10
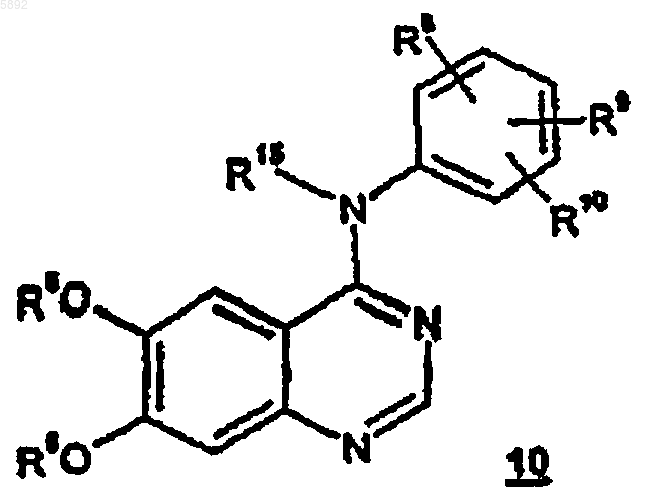
где R15, R6, R8, R9 и R10 определены, как указано выше; первичным или вторичным спиртом формулы R7-OH, где R7 является C1-C10-алкилом или группой -(C1-C6-алкил)(C6-C10-арил); в присутствии гидроксида щелочного или щелочно-земельного металла.
2. Способ по п.1, в котором указанный гидроксид щелочного металла или щелочно-земельного металла выбирается из гидроксида натрия, гидроксида лития, гидроксида цезия, гидроксида кальция, гидроксида магния и гидроксида калия.
3. Способ по п.1, в котором указанный гидроксид щелочного металла является гидроксидом натрия, а указанный спирт формулы R7-OH является первичным спиртом.
Текст
005892 Предпосылки создания изобретения Настоящее изобретение относится к способам получения соединений, которые применимы для лечения заболеваний, обусловленных гиперпролиферацией, таких как различные виды рака, у млекопитающих. Патент Соединенных Штатов 5747498, который опубликован 5 мая 1998 г. и упомянут здесь для сведения во всей его полноте, относится к новым сериям хиназолиновых производных, включая [6,7 бис(2-метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил)амина гидрохлорид, которые являются ингибиторами семейства еrbB онкогенных и протоонкогенных белковых тирозинкиназ, таких как рецепторы эпидермального фактора роста (РЭФР), и поэтому применимы для лечения заболеваний, обусловленных пролиферацией, таких как разновидности рака у людей. Заявка на предварительный патент США на изобретение, озаглавленная Безводный N-(3-этинилфениламино)-6,7-бис(2-метоксиэтокси)-4-хиназолинаминмезилат и его моногидрат, зарегистрированная 29 апреля 1998 г., авторами которой названы Т.Norris, D. Santafianos, D.J.M. Alien, R.M. Shanker, and J.W. Raggon, досье поверенного PC 10074, которая упомянута здесь для сведения во всей полноте, относится к N-(3-этинилфениламино)-6,7-бис-(2 метоксиэтокси)-4-хиназолинаминмезилату, безводному и его гидратным формам, которые обладают таким же противораковым действием, что и соответствующая гидрохлоридная соль, упомянутая выше. Данное изобретение относится к способам получения и промежуточным соединениям для получения противораковых соединений, о которых говорится в патенте Соединенных Штатов и в патентной заявке,упомянутых выше. Краткое описание изобретения Настоящее изобретение относится к способу получения соединений формулы и их фармацевтически приемлемых солей и сольватов, в которыхR7 представляет собой C1-С 10-алкил или -(C1-C6-алкил)(С 6-С 10-арил); каждый m независимо является целым числом от 1 до 6, а n является целым числом от 0 до 3;R15 представляет собой Н или C1-С 10-алкил; который включает обработку соединения формулы 10 где R15, R6, R8, R9 и R10 определены как указано выше; первичным или вторичным спиртом формулы R7 ОН, где R7 определен как указано выше, предпочтительно, первичным спиртом, в присутствии гидроксида щелочного или щелочно-земельного металла, такого как гидроксид натрия, гидроксид лития, гидроксид цезия, гидроксид кальция, гидроксид магния или гидроксид калия, наиболее предпочтителен гидроксид натрия. Вышеуказанные соединения формулы 9 применимы при лечении заболеваний, обусловленных гиперпролиферацией, таких как разновидности рака, у млекопитающих. Термин алкил, как он используется в данном описании, если не указано иначе, включает предельные одновалентные углеводородные радикалы, имеющие составные части с прямой, разветвленной цепью или циклические составные части, или же сочетание вышеуказанных составных частей. В отношении указанной алкильной группы понятно, что для того, чтобы указанная алкильная группа включала циклические составные части, необходимо, чтобы она содержала по меньшей мере три атома углерода. Термин арил, как он используется в данном описании, если не указано иначе, включает органический радикал, получаемый из ароматического углеводорода путем удаления одного атома водорода, такой как фенил или нафтил.-1 005892 Выражение фармацевтически приемлемая(ые) соль(и), как оно используется в данном описании,если не указано иначе, включает соли кислотных и основных групп, которые могут присутствовать в соединениях данного изобретения. Соединения, полученные в соответствии с данным изобретением, которые по своей природе являются основными, способны к образованию широкого разнообразия солей с различными неорганическими и органическими кислотами. Кислотами, которые могут использоваться для получения фармацевтически приемлемых солей присоединения кислот таких основных соединений,являются те, которые образуют нетоксичные соли присоединения кислот, т.е. соли, содержащие фармакологически приемлемые анионы, например такие как гидрохлорид, гидробромид, гидройодид, нитрат,сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, кислый цитрат, тартрат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глютамат, метансульфонат, этансульфонат, бензолсульфонат, птолуолсульфонат, и памоат [т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат). Соединения, полученные в соответствии с данным изобретением, которые включают основной остаток, такой как аминогруппа, могут образовывать фармацевтически приемлемые соли с разными аминокислотами, в дополнение к кислотам, упомянутым выше. Те соединения, полученные согласно настоящему изобретению, которые являются по природе кислотными, способны к образованию солей с основаниями с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных и щелочно-земельных металлов и, в частности,кальциевые, магниевые, натриевые и калиевые соединений данного изобретения. Соединения, полученные по данному изобретению, имеют центры асимметрии, и поэтому существуют в разных энантиомерных и диастереомерных формах. Это изобретение относится также ко всем оптическим изомерам и стереоизомерам соединений, получаемым по данному изобретению, и их смесям. Предмет изобретения также включает меченные изотопами соединения, полученные по данному изобретению, и их фармацевтически приемлемые соли. В таких соединениях один или более атомов заменены атомами, имеющими атомную массу или массовое число, отличные от атомной массы или массового числа, обычно находимых для природных атомов. Примеры изотопов, которые могут быть включены в соединения этого изобретения, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2H, 3H, 13 С, 14 С, 15N, 18 О, 17 О, 35S, 18F и 36Cl, соответственно. Соединения, полученные по данному изобретению, их пролекарства и фармацевтически приемлемые соли указанных соединений или указанных пролекарств, которые содержат вышеназванные изотопы и/или другие изотопы других атомов, входят в объем данного изобретения. Некоторые меченные изотопами соединения данного изобретения, например, те, в которые включены радиоактивные изотопы, такие как 3H и 14 С,применимы в испытаниях по распределению лекарственных препаратов и/или субстратов в тканях. Меченные тритием, т.е. 3 Н, и углеродом-14, т.е. 14 С, изотопы особенно предпочтительны из-за легкости их получения и детектируемости. Кроме того, замещение более тяжелыми изотопами, такими как дейтерии,т.е. 2H, может давать определенные терапевтические преимущества, являющиеся результатом большей метаболической стабильности, например повышенный период полураспада in vivo или сниженная требуемая дозировка, и, следовательно, могут быть предпочтительными при некоторых обстоятельствах. Меченные изотопами соединения по изобретению и их пролекарства могут быть, в общем, получены путем выполнения методик, раскрываемых в схемах и/или в примерах и препаративных примерах ниже,путем замены не меченного изотопом реагента доступным меченым изотопом реагентом. Подробное описание изобретения Схема 1-2 005892 Способ данного изобретения может быть описан со ссылкой на схему 1 выше. В реакциях, описанных ниже, все реакции проводятся при атмосферном давлении и комнатной температуре (примерно 2025 С), если не оговорены иные условия. Кроме того, если не указано иначе, заместители R6 - R10 и R15 определены как указано выше. В схеме 1 соединения формулы 9 могут быть получены путем обработки соединений формулы 10 первичным или вторичным спиртом формулы R7-OH, где R7 определен как указано выше, в присутствии гидроксида щелочного металла или щелочноземельного металла, такого как гидроксид натрия, гидроксид лития, гидроксид цезия, гидроксид кальция, гидроксид магния или гидроксид калия, предпочтительно, гидроксида натрия, при температуре в интервале от примерно 100 С до примерно 150 С. Использование вторичного спирта формулы R7-OH будет сводить к минимуму превращение в асимметричный аналог формулы 9, тогда как использование первичного спирта формулы R7-OH будет повышать относительную концентрацию асимметричного аналога формулы 9. Таким образом, в зависимости от аналога,который является предпочтительным, может быть предпочтительным вторичный или первичный спирт. Так как целью реакции по схеме 1 является получение асимметричного аналога, предпочтительно использование первичного спирта формулы R7-OH. Соединения формулы 9 могут быть превращены в фармацевтически приемлемые соли, как описано ниже. Некоторые соединения, полученные согласно данному изобретению, упомянутые выше, могут иметь асимметричные атомы углерода. Соединения, содержащие смесь изомеров по одному или более центрам будут существовать как диастереомерные смеси, которые могут быть разделены на их отдельные диастереомеры на основе их физико-химических различий методами, известными квалифицированным специалистам, например, хроматографией или дробной кристаллизацией. Все такие изомеры, включая диастереомерные смеси, рассматриваются как часть этого изобретения. Соединения, названные выше, которые являются по природе основными, способны к образованию широкого круга различных солей с разными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения млекопитающим, часто на практике желательно сначала выделить соединение данного изобретения из реакционной смеси в виде фармацевтически неприемлемой соли, а затем просто превратить последнюю снова в соединение - свободное основание путем обработки щелочным реагентом, и затем превратить последнее свободное основание в фармацевтически приемлемую соль присоединения кислоты. Соли присоединения кислоты основных соединений согласно настоящему изобретению легко получаются путем обработки основного соединения с, по существу, эквивалентным количеством избранной минеральной или органической кислоты в среде водного растворителя или в соответствующем органическом растворителе, таком как метанол или этанол. При осторожном выпаривании растворителя легко получают желаемую твердую соль. Желаемая кислая соль может быть также осаждена из раствора свободного основания в органическом растворителе путем добавления раствора соответствующей минеральной или органической кислоты. Те соединения, названные выше, которые являются по природе кислотными, способны к образованию солей с основаниями, образуемых различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных или щелочно-земельных металлов и, в частности, соли натрия и калия. Все эти соли получают по стандартным методикам. Химическими основаниями, которые используются в качестве реагентов для получения фармацевтически приемлемых солей с основаниями согласно настоящему изобретению, являются те, которые образуют нетоксичные соли с кислотными соединениями данного изобретения. Такие нетоксичные соли с основаниями включают соли, которые являются производными таких фармакологически приемлемых катионов, как натрий, калий, кальций и магний и т.д. Эти соли могут быть легко получены путем обработки соответствующих кислотных соединений водным раствором, содержащим алкоксид желаемого щелочного металла или его гидроксид, и затем выпариванием полученного раствора досуха, предпочтительно под пониженным давлением. Альтернативно, они могут быть получены путем смешивания растворов в низших алканолах кислотных соединений и алкоксида желаемого щелочного металла или его гидроксида вместе и затем выпаривания полученного раствора досуха таким же образом, что и ранее. В том и другом случае, предпочтительно,используются стехиометрические количества реагентов для обеспечения полноты протекания реакции и максимальных выходов желаемого конечного продукта. Представленные ниже примеры дополнительно иллюстрируют способы данного изобретения, хотя понятно, что объем данного изобретения не ограничивается следующими примерами. Пример 1. Получение N-(3-этилфенил)-6,7-бис-(2-метоксиэтокси)-4-хиназолинамина. 4-Хлор-6,7-бис-(2-метоксиэтокси)хиназолин (50 г, 160 ммоль), 3-этиланилин (21,34 г, 176 ммоль) и пропан-2-ол (500 мл) нагревали при 78-82 С в течение 16 ч. Смесь охлаждали до 5-10 С и перемешивали в течение 1 ч. Твердое вещество собирали фильтрованием и перемешивали с водой (200 мл) и этилацетатом (500 мл). Смесь доводили до рН 10-12 с помощью 50% водного раствора гидроксида натрия с получением прозрачных слоев. Органический слой отделяли и промывали водой (200 мл), насыщенным солевым раствором (200 мл) и сушили над безводным сульфатом магния, фильтровали и концентрировали до масла. Маслу давали затвердеть и сушили под пониженным давлением при 20-25 С с получением продукта, названного в заголовке (57,2 г, 90%) в виде белого твердого вещества.N-(3-этилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамин, полученный, как описано выше (4,0 г,10 ммоль), твердый безводный гидроксид натрия (104 мг, 2,6 ммоль) и бензиловый спирт (20 мл) нагревали при 150-152 С в течение 23 ч. Реакционной смеси давали остыть до комнатной температуры и очищали колоночной хроматографией на силикагеле, используя градиентную систему с этилацетатом/гексаном в качестве элюента, с получением белого твердого вещества, которое сушили под пониженным давлением при 45-50 С с получением продукта, указанного в заголовке (2,52 г, 58%). Т.пл. 156-157 С. н (300 МГц; СDCl3) 1,17 (3 Н, т, J=7,6), 2,58 (2 Н, кв., J=7,6), 3,33 (3 Н, с), 3,65-3,68N-(3-этилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамин, полученный, как описано выше (4,0 г,10 ммоль), твердый безводный гидроксид натрия (94 мг, 2,36 ммоль) и бутан-1-ол (20 мл) нагревали с обратным холодильником в течение 12 дней. Реакционной смеси давали остыть до комнатной температуры и очищали колоночной хроматографией на силикагеле, используя градиентную систему с этилацетатом/гексаном в качестве элюента, с получением белого твердого вещества, которое сушили под вакуумом при 45-50 С с получением продукта, указанного в заголовке, 2,57 г, 65%. Т.пл. 90-92 С. н (300 МГц; СDСl3) 0,93 (3 Н, т, J=7,4), 1,19 (3 Н, т, J=7,6), 1,45 (2 Н, секстет, J=7,5),1,79 (2 Н, пентет, J=6,9), 2,61 (2 Н, кв, J=7,6), 3,39 (3 Н, с), 3,70-3,74 (2 Н, м), 4,00 (2 Н, т, J=6,6), 4,12-4,15N, 10,63%). Пример 4. Получение N-(4-метоксифенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина. 4-Хлор-6,7-бис(2-метоксиэтокси)хиназолин (25 г, 79,9 ммоль), 4-анизидин (9,8 г, 79,9 ммоль) и пропан-2-ол (250 мл) нагревали при 78-82 С в течение 16 ч. Смесь охлаждали до 5-10 С и перемешивали в течение 1 ч. Твердое вещество собирали фильтрованием и промывали пропан-2-олом (25 мл). Выделенное твердое вещество перекристаллизовывали из этанола/воды и сушили в течение ночи в вакуумном шкафу при 40-45 С. Перекристаллизованное твердое вещество смешивали с водой (100 мл) и этилацетатом (250 мл). Смесь доводили до рН 10-12 с помощью 50% водного раствора гидроксида натрия с получением двух прозрачных слоев. Органический слой отделяли и промывали водой (200 мл), насыщенным раствором соли (200 мл) и сушили над безводным сульфатом магния, фильтровали и упаривали с получением белого твердого вещества, которое сушили под пониженным давлением при 40-45 С с получением продукта, 20,86 г, 65%. Т.пл. 186-187 С. н (300 МГц; СDCl3) 3,31 (3 Н, с), 3,35 (3 Н, с), 3,62-3,65 (2 Н, м), 3,70-3,72 (2 Н, м),3,74 (3 Н, с), 4,04-4,11 (4 Н, м), 6,83 (2 Н, д, J=9,0), 7,09 (1H, с), 7,33 (1H, с), 7,46 (2 Н, д, J=9,0), 8,12 (1H,шир.с), (1H, с); с (75,5 МГц; СDCl3) 55,4, 59,2, 68,2, 69,0, 70,4, 70,8, 103,1, 108,3, 109,1, 114,2, 124,7,131,4, 146,8, 148,6, 153,7, 154,3, 156,7, 157,3; vmax (KBr) см-1 1619, 1590, 1582, 1511; m/z 400 (М+Н)+ (найдено: С 63,30; Н 6,37; N 10,47. Расчет для C21H25N3O5: С 63,42; Н 6,31; N 10,52%). Пример 5. Получение N-(4-метоксифенил)-6-(2-метоксиэтокси)-7-бензилокси-4-хиназолинамина.N-(4-метоксифенил)-6,7-бис(2-метоксиэтокси)-4-иназолинамин, полученный, как описано выше (2,0 г, 4,6 ммоль), твердый безводный гидроксид натрия (104 мг, 2,6 ммоль) и бензиловый спирт (20 мл) нагревали при 145-150 С в течение 18 ч. Реакционной смеси давали остыть до комнатной температуры и очищали колоночной хроматографией на силикагеле, используя градиентную систему с этилацетатом/гексаном в качестве элюента, с получением белого твердого вещества, которое сушили под вакуумом при 45-50 С с получением продукта, названного в заголовке. 0,915 г, 42%. Т.пл. 208-209 С. н (300 МГц; CDCl3) 3,34 (3 Н,с), 3,91 (2 Н, т, J=4,2), 3,74 (3 Н, с), 4,10 (2 Н, шир.с),5,13 (2 Н, с), 6,83 (2 Н, д, J=8,9), 7,20-7,30 (5 Н, м), 7,36-7,38 (3 Н, м), 7,47 (2 Н, д, J=8,9), 8,10 (1 Н, шир.с),8,54 (1H, с); с (75,5 МГц; СDСl3) 55,5, 59,3, 69,2, 70,7, 70,9, 103,3, 109,0, 109,1, 114,2, 124,6, 127,3, 128,1,128,5, 131,3, 135,8, 146,8, 148,8, 153,7, 154,2, 154,2, 156,8, 157,2; vmax (KBr) см-1 1619, 1580, 1511; m/z 432-4 005892 Пример 6. Получение N-фенил-N-метил-6,7-бис-(2-метоксиэтокси)-4-хиназолинамина. 4-Хлор-6,7-бис(2-метоксиэтокси)хиназолин (10 г, 31,97 ммоль), N-метиланилин (3,5 мл, 31,97 ммоль) и ацетонитрил (100 мл) нагревали при 78-82 С в течение 24 ч. Смесь охлаждали до 5-10 С и перемешивали в течение 0,5 ч. Твердое вещество собирали фильтрованием и сушили в течение 5 ч в вакуумном шкафу при 50-55 С. Выделенное твердое вещество смешивали с водой (50 мл) и этилацетатом(200 мл). Смесь доводили до рН 10-12 50% водным раствором гидроксида натрия с получением прозрачных слоев. Органический слой отделяли и промывали водой (50 мл), насыщенным раствором соли (50 мл) и сушили над безводным сульфатом магния, фильтровали и упаривали с получением белого твердого вещества, которое сушили под вакуумом при 50-55 С с получением продукта. 8,55 г, 70%. Т.пл. 109-111 С. н (300 МГц; СDCl3) 3,33 (3 Н, с), 3,39 (3 Н, с), 3,42-3,45 (2 Н, м), 3,48-3,51 (2 Н, м),3,58 (3 Н, с), 3,74-3,78 (2 Н, м), 4,16-4,20 (2 Н, м), 6,33 (1 Н, с), 7,11-7,20 (4 Н, м), 7,83 (2 Н, т, J=7,8), 8,68 (1 Н,с); с (75,5 МГц; CDCl3) 42,0, 59,2, 59,3, 67,6, 68,2, 70,3, 70,4, 106,5, 107,9, 110,9, 125,8, 126,0, 129,9, 147,0,148,4, 148,7, 153,0, 153,4, 160,4; vmax (KBr) см-1 1615, 1571, 1497; m/z 384 (М+H)+ (найдено: С 65,85; Н 6,52; N 11,01. Расчет для C21H25N3O4: С 65,78; Н 6,57; N 10,96%). Пример 7. Получение N-фенил-N-метил-6-(2-метоксиэтокси)-7-бутилокси-4-хиназолинамина.N-метил-N-фенил-6,7-бис(2-метоксиэтокси)-4-хиназолинамин, полученный, как описано выше (1,0 г, 2,61 ммоль), твердый безводный гидроксид натрия (97,5 мг, 2,43 ммоль) и бутан-1-ол (10 мл) нагревали с обратным холодильником в течение 24 ч. Реакционной смеси давали остыть до комнатной температуры и очищали колоночной хроматографией на силикагеле, используя градиентную систему с этилацетатом/гексаном в качестве элюента, с получением белого твердого вещества, которое сушили под вакуумом при 45-50 С с получением продукта. 517 мг, 52%, т.пл. 62-63 С. н (300 МГц; СDCl3) 0,93 (3 Н, т, J=7,4), 1,45 (2 Н, секстет, J=7,4), 1,80 (2 Н, пентет, J=6,7), 3,35 (3 Н,с), 3,44-3,52 (4 Н, м), 3,59 (3 Н, с), 4,05 (2 Н, т, J=6,7), 6,34 (1 Н, с), 7,12-7,21 (4 Н, м), 7,34 (2 Н, т, J=7,7), 8,69(1 Н, с); с (75,5 МГц; СDCl3) 13,8, 19,2, 30,7, 42,0, 59,2, 67,8, 68,6, 70,4, 106,5, 107,7, 110,6, 125,8, 125,9,129,9, 147,0, 148,6, 153,0, 153,8, 160,4; vmах (KBr) см-1 1616, 1572, 1543; m/z 382 (М+Н)+ (найдено: С 69,39; Н 7,38; N 10,86. Расчет для C22H27N3O3: С 69,27; Н 7,14; N 11,02%). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы 9 или его фармацевтически приемлемых соли или сольвата, в которыхR7 представляет собой C1-С 10-алкил или -(C1-С 6-алкил)(С 6-С 10-арил); каждый m, независимо, является целым числом от 1 до 6, а n является целым числом от 0 до 3;R15 представляет собой Н или C1-С 10-алкил; который включает обработку соединения формулы 10 где R15, R6, R8, R9 и R10 определены, как указано выше; первичным или вторичным спиртом формулы R7-OH, где R7 является C1-С 10-алкилом или группой-(C1-C6-алкил)(С 6-С 10-арил); в присутствии гидроксида щелочного или щелочно-земельного металла. 2. Способ по п.1, в котором указанный гидроксид щелочного металла или щелочно-земельного металла выбирается из гидроксида натрия, гидроксида лития, гидроксида цезия, гидроксида кальция, гидроксида магния и гидроксида калия. 3. Способ по п.1, в котором указанный гидроксид щелочного металла является гидроксидом натрия,а указанный спирт формулы R7-OH является первичным спиртом. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6
МПК / Метки
МПК: C07D 239/94
Метки: получения, противораковых, соединений, способ
Код ссылки
<a href="https://eas.patents.su/6-5892-sposob-polucheniya-protivorakovyh-soedinenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения противораковых соединений</a>
Предыдущий патент: Катализаторы циглера-натта процессов полимеризации в растворе при высоких температурах
Следующий патент: Ингибиторы протеаз
Случайный патент: Новые соединения бензотиазина и бензотиадиазина, способ их получения и фармацевтические композиции, которые их содержат










