Производные аминоалкоксибензоилбензофурана, способ их получения и содержащие их композиции
Номер патента: 5825
Опубликовано: 30.06.2005
Авторы: Низато Дино, Ассенс Жан-Луи, Бернар Клод, Кабанель-Одрикур Фредерик
Формула / Реферат
1. Производные бензофурана общей формулы
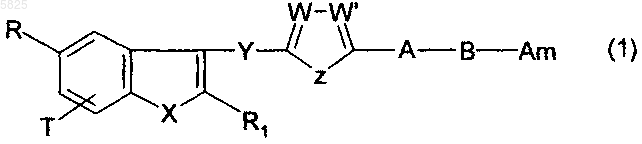
а также их фармацевтически приемлемые соли,
в которой A представляет собой -O или -S-;
B представляет собой линейную или разветвленную C1-C5алкиленовую группу, возможно замещенную гидроксильной группой;
T представляет собой водород или C1-C4алкильный радикал;
R представляет собой
цианогруппу или гидроксиметильную группу,
оксимную группу формулы
R4-O-N=CH-,
в которой R4 представляет собой C1-C4алкильную группу,
карбоксильную группу общей формулы

в которой R5 представляет собой водород или атом щелочного металла, линейную или разветвленную C1-C10алкильную группу либо C3-C6циклоалкильную группу или R5 представляет собой группу общей формулы
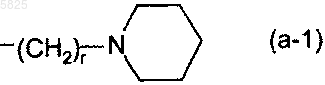
в которой г равно числу от 1 до 4,
карбоксильную группу общей формулы
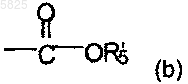
в которой R'5 представляет собой пиперидинильную группу, возможно N-замещенную C1-C4алкильной группой или одной из групп общей формулы
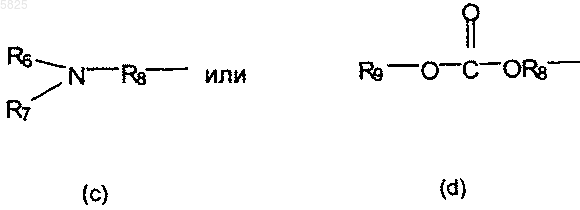
в которой R6 и R7, которые могут быть одинаковыми или разными, представляют собой C1-C4алкильную фуппу, R8 представляет собой линейную или разветвленную C1-C6алкиленовую группу и R9 представляет собой водород, атом щелочного металла или C1-C4алкильную группу,
аминокарбонильную группу формулы
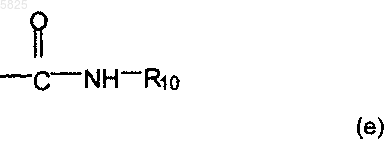
в которой R10 представляет собой водород, C1-C4алкильную группу, гидроксильную группу или аминогруппу, вышеуказанную группу (c) или одну из групп
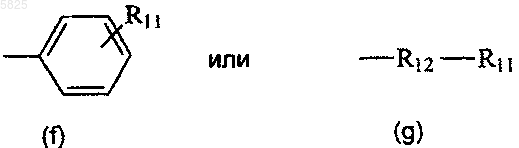
в которых R11 представляет собой группу (a), а R12 представляет собой C1-C6алкиленовый радикал,
группу формулы
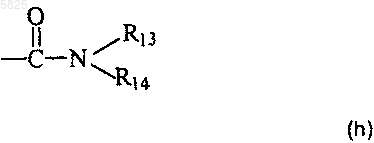
в которой R13 и R14, которые могут быть одинаковыми или разными, представляют собой C1-C4алкильный радикал или C1-C4гидроксиалкильную группу,
одну из групп приведенных ниже формул
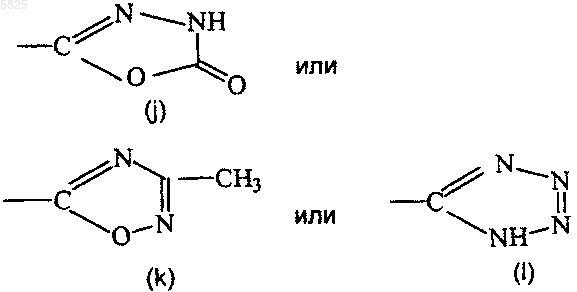
R1 представляет собой C1-C6алкильную группу или группу формулы
-(CH2)p-R11 (m),
в которой R11 имеет такое же значение, как указано выше, и р равно числу от 1 до 4;
Am представляет собой азотсодержащую группу формулы
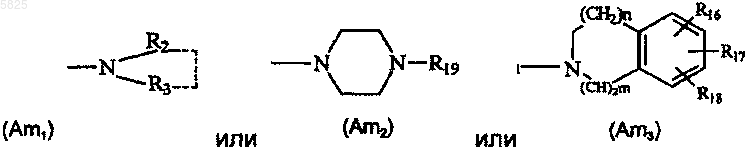
в которой R2 представляет собой водород, линейную или разветвленную C1-C6алкильную группу, возможно замещенную гидроксильной группой, группу (m), C3-C6циклоалкильную группу или бензильную группу,
R3 представляет собой линейную или разветвленную C1-C6алкильную группу, возможно замещенную гидроксильной группой, C3-C6циклоалкильную группу, группу (m), бензильную группу или фенильную группу формулы
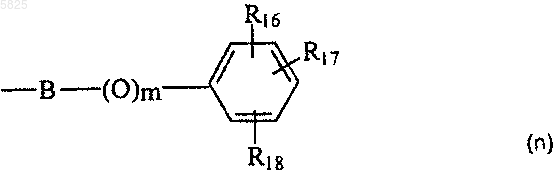
где R16, RI7 и R18, которые могут быть одинаковыми или разными, представляют собой водород или гидроксильную группу, нитрогруппу, аминогруппу, C1-C4алкоксигруппу или C1-C4алкилсульфонамидогруппу,
R19 представляет собой водород, C1-C5алкильную группу, дифенилметильную группу, моно-, ди- или триметилфенильную группу, моно-, ди- или триметоксифенильную группу, группу (a), группу (b) или группу (c),
каждое m и n равно 0 или 1,
R2 и R3, когда они взяты вместе, представляют собой линейную или разветвленную C3-C10алкиленовую группу, возможно замещенную гидроксильной группой, группой (a) или группой (m) и возможно прерванную -O-,
W, W' и Z являются такими, что
когда W и W', которые являются одинаковыми, представляют собой CH, тогда Z представляет собой -O- или -S-,
когда W представляет собой CH, а W' представляет собой C-R20, тогда Z представляет собой 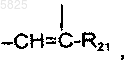
при этом R20 и R21 являются одинаковыми или разными и представляют собой водород, атом галогена, C1-C4алкильный радикал или C1-C4алкоксильный радикал;
X представляет собой -O-;
Y представляет собой радикал -CO- или -CH2- либо радикал формулы
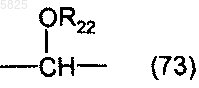
в которой R22 представляет собой водород, C1-C4апкильный радикал или ацильный радикал формулы
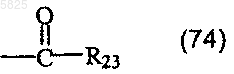
в которой R23 представляет собой C1-C4алкильный радикал, или Y представляет собой

причем подразумевается, что комбинация групп R, R1 и Am содержит 0, 1 или 2 группы (a),
причем эти производные бензофурана находятся в форме индивидуальных изомеров или их смеси.
2. Производные бензофурана по п.1, в которых Y представляет собой радикал -CO-, или Y представляет собой
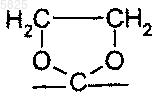
3. Производные бензофурана по п.1 или 2, в которых R представляет собой изопропоксикарбонильную группу.
4. Производные бензофурана по одному из пп.1-3, в которых Am представляет собой диэтилпиперидинильную группу.
5. Производные бензофурана по одному из пп.1-4, в которых Y представляет собой радикал -CO-.
6. Производные бензофурана по одному из пп.1-5, в которых
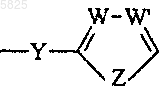
представляет собой бензоильный радикал.
7. Производные бензофурана по одному из пп.1-6, в которых
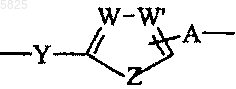
представляет собой 4-оксибензоильный радикал.
8. Производные бензофурана по одному из пп.1-7, в которых цепь A-B-Am находится в положении 4.
9. Производные бензофурана по одному из пп.1-8, в которых R1 представляет собой н-бутил, B представляет собой пропиленовую группу и Am представляет собой диэтилпиперидинильную группу.
10. Производные бензофурана по п.9, в которых диэтилпиперидинильная группа представляет собой 3,5-диэтилпиперидинильную группу.
11. Производные бензофурана по одному из пп.1-10, в которых фармацевтически приемлемая соль выбрана из солей оксалата, малеата, фумарата, метансульфоната, бензоата, аскорбата, памоата, сукцината, гексамата, бисметиленсалицилата, этандисульфоната, ацетата, пропионата, тартрата, салицилата, цитрата, глюконата, лактата, малата, циннамата, манделата, цитраконата, аспартата, пальмитата, стеарата, итаконата, гликолята, п-аминобензоата, глутамата, бензолсульфоната, п-толуолсульфоната и теофиллинацетата и солей, образованных с аминокислотой, таких как соль с лизином или гистидином.
12. Производные бензофурана по одному из пп.1-10, в которых фармацевтически приемлемая соль выбрана из солей гидрохлорида, гидробромида, сульфата, сульфамата, фосфата и нитрата.
13. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу -CO-, R1, (Am1) и (Am2) не содержат карбоксильную группу или группу карбоксилат щелочного металла, R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы и R представляет собой цианогруппу или гидроксиметильную группу, группу (k) или группу (a), в которой R5 представляет собой C1-C10алкильную группу или C3-C6циклоалкильную группу, отличающийся тем, что производное кетона общей формулы
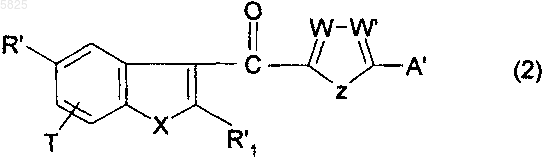
в которой R'1 представляет собой C1-C6алкильную группу или группу (m), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, T, W, W', X и Z имеют такое же значение, как в п.1, A' представляет собой OH, SH или NH2 и R' представляет собой цианогруппу или гидроксиметильную группу, группу (k) или группу -CO2R"5, в которой R"5 представляет собой C1-C10алкильный радикал или C3-C6циклоалкильный радикал, подвергают взаимодействию в присутствии основного агента с соединением общей формулы
R24-B-Am' (3),
в которой Am' представляет собой группу (Am1) или (Am2), как определено в п.1, причем эта группа не содержит карбоксильную группу или группу карбоксилат щелочного металла, или Am' представляет собой группу (Am3), как определено в п.1, в которой R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы, B имеет такое же значение, как в п.1, и R24 представляет собой
либо атом галогена, или C1-C4алкилсульфонилоксирадикал, или C6-C10арилсульфонилоксирадикал, что позволяет получить желаемые соединения в форме свободного основания, в которых A представляет собой -O- или -S-,
причем полученные таким образом соединения в форме свободного основания возможно, если необходимо, обрабатывают подходящей органической или неорганической кислотой с образованием фармацевтически приемлемой соли.
14. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу -CO-, R1, (Am1) и (Am2) не содержат карбоксильную группу или группу карбоксилат щелочного металла, R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы и R представляет собой цианогруппу, группу (k), группу R4-O-N=CH- или группу (a), в которой R5 представляет собой C1-C10алкильную группу или C3-C6циклоалкильную группу, отличающийся тем, что соединение общей формулы
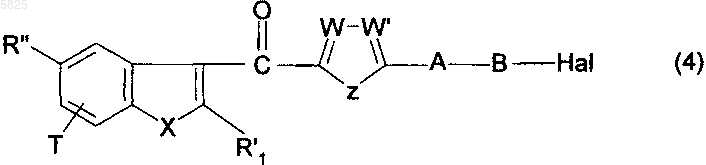
в которой A, B, T, X, W, W' и Z имеют такое же значение, как в п.1, R'1 представляет собой C1-C6алкильную группу или группу (m), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, и R" представляет собой цианогруппу, группу (k), группу R4-O-N=CH- или группу -CO2R"5, в которой R"5 представляет собой C1-C10алкильную группу или C3-C6циклоалкильную группу и Hal представляет собой атом галогена, подвергают взаимодействию с соединением общей формулы
H-Am' (5)
возможно в форме соли, в которой Am' представляет собой группу (Am1) или (Am2), как определено в п.1, причем эта группа не содержит карбоксильную группу или группу карбоксилат щелочного металла, или Am' представляет собой группу (Am3), как определено в п.1, в которой R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы, причем взаимодействие проводят в присутствии основного агента или избытка амина формулы (5) в основной форме, что приводит к получению желаемых соединений в форме свободного основания, которые могут быть подвергнуты взаимодействию, если необходимо, с подходящей органической или неорганической кислотой с образованием фармацевтически приемлемой соли.
15. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу -CO-, R1, (Am1) и (Am2) не содержат карбоксильную группу или группу карбоксилат щелочного металла, R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы и R представляет собой цианогруппу, группу R4-O-N=CH-, группу (a), в которой R5 представляет собой C1-C10алкильную группу, или C3-C6циклоалкильную группу, или группу (k), отличающийся тем, что соединение общей формулы
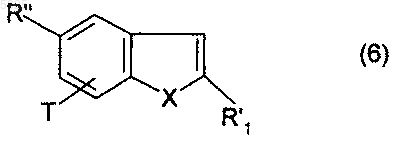
в которой T и X имеют такое же значение, как в п.1, R" представляет собой цианогруппу, группу (k), группу R4-O-N=CH- или группу -CO2R"5 в которой R"5 представляет собой C1-C10алкильную группу или C3-C6циклоалкильную группу и R'1 представляет собой C1-C6алкильную группу или группу (m), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, подвергают взаимодействию с галогенидом общей формулы
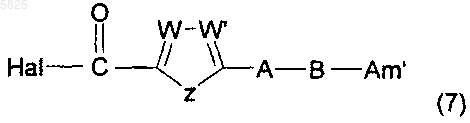
в которой A, B, W, W' и Z имеют такое же значение, как в п.1, Hal представляет собой атом галогена и Am' представляет собой группу (Am1) или (Am2), как определено в п.1, причем эта группа не содержит карбоксильную группу или группу карбоксилат щелочного металла, или Am' представляет собой группу (Am3), как определено в п.1, в которой R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы, причем взаимодействие возможно проводят в присутствии кислоты Льюиса, что приводит к получению желаемых соединений в форме свободного основания, которые могут быть подвергнуты взаимодействию, если необходимо, с органической или неорганической кислотой с образованием фармацевтически приемлемой соли.
16. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу -CO-, R1, (Am1) и (Am2) не содержат карбоксильную группу или группу карбоксилат щелочного металла, R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы и R представляет собой группу (j), отличающийся тем, что соединение формулы
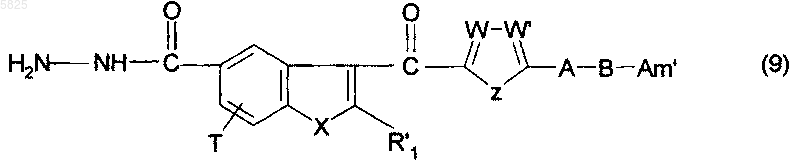
в которой A, B, T, W, W', X и Z имеют такое же значение, как в п.1, R'1 представляет собой C1-C6алкильную группу или группу (m), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, и Am' представляет собой группу (Am1) или (Am2), как определено в п.1, причем эта группа не содержит карбоксильную группу или группу карбоксилат щелочного металла, или Am' представляет собой группу (Am3), как определено в п.1, в которой R16, и/или R17, и/или R18 отличны от аминофуппы или C1-C4алкилсульфонамидогруппы, подвергают взаимодействию с фосгеном, что приводит к получению желаемых соединений в форме гидрохлорида, которые могут быть обработаны, если необходимо, основным агентом, таким как гидроксид щелочного металла или карбонат щелочного металла, что приводит к получению желаемых соединений в форме свободного основаншя, которые могут быть подвергнуты взаимодействию, если необходимо, с органической или неорганической кислотой с образованием фармацевтически приемлемой соли.
17. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу -CO-, R1, (Am1) и (Am2) не содержат карбоксильную группу или группу карбоксилат щелочного металла, R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы и R представляет собой группу (b), в которой R'5 представляет собой группу (c) типа первичного диалкиламиноалкила, отличающийся тем, что соединение формулы
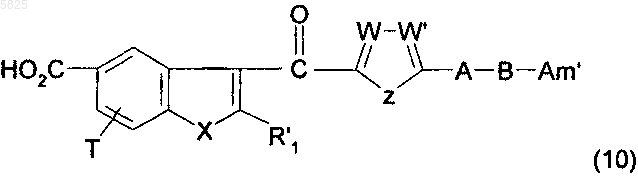
в которой A, B, T, W, W', X и Z имеют такое же значение, как в п.1, R'1 представляет собой C1-C6алкильную группу или группу (m), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, и Am' представляет собой группу (Am1) или (Am2), как определено в п.1, причем эта группа не содержит карбоксильную группу или группу карбоксилат щелочного металла, или Am1 представляет собой группу (Am3), как определено в п.1, в которой R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы, после защиты аминной функциональной группы, когда Am' представляет собой группу (Am1), в которой R2 представляет собой водород, подвергают взаимодействию со спиртом общей формулы
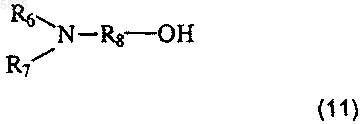
в которой R6 и R7 имеют такое же значение, как в п.1, а R8 представляет собой линейную C1-C8алкиленовую группу, причем взаимодействие проводят в присутствии карбонилдиимидазола и 1,8-диазабицикло[5.4.0]ундец-7-ена, а затем, если необходимо, удаляют защиту с образовавшегося соединения, что приводит к получению желаемых соединений в форме свободного основания, которые могут быть обработаны, если необходимо, подходящей органической или неорганической кислотой с получением фармацевтически приемлемой соли.
18. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу -CO-, R1, (Am1) и (Am2) не содержат карбоксильную группу или группу карбоксилат щелочного металла, R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы, и R представляет собой группу (b), в которой R'5 представляет собой группу (c) типа вторичного или третичного диалкиламиноалкила, отличающийся тем, что соединение формулы
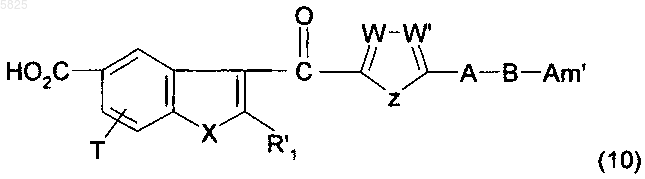
в которой A, B, T, X, W, W' и Z имеют такое же значение, как в п.1, R'1 представляет собой C1-C6алкильную группу или группу (m), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, и Am' представляет собой группу (Am1) или (Am2), как определено в п.1, причем эта группа не содержит карбоксильную группу или группу карбоксилат щелочного металла, или Am' представляет собой группу (Am3), как определено в п.1, в которой R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы, после защиты аминной функциональной группы, когда Am' представляет собой группу (Am1), в которой R2 представляет собой водород, подвергают взаимодействию с галогенирующим агентом с получением ацилгалогенида, который затем обрабатывают спиртом формулы
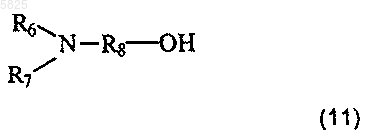
в которой R6 и R7 имеют такое же значение, как в п.1, а R8 представляет собой вторичную или третичную C2-C6алкиленовую группу, а затем, если необходимо, удаляют защиту с образовавшегося соединения, что приводит к получению желаемых соединений в форме гидрогалогенида или в форме свободного основания, если соединение формулы (10) присутствует в избытке, причем этот гидрогалогенид может быть обработан, если необходимо, основным агентом, таким как гидроксид щелочного металла или карбонат щелочного металла, с получением желаемых соединений в форме свободного основания, причем образовавшееся таким образом свободное основание возможно, если необходимо, обрабатывают подходящей органической или неорганической кислотой с получением фармацевтически приемлемой соли.
19. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу -CO-, R1, (Am1) и (Am2) не содержат карбоксильную группу или группу карбоксилат щелочного металла, R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы и R представляет собой либо группу (a), в которой R5 представляет собой C1-C10алкильную группу или C3-C6циклоалкильную группу, либо группу (b), в которой R'5 представляет собой пиперидинильную группу, возможно N-замещенную C1-C4алкильной группой, или в которой R'5 представляет собой группу (d), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, отличающийся тем, что соединение формулы
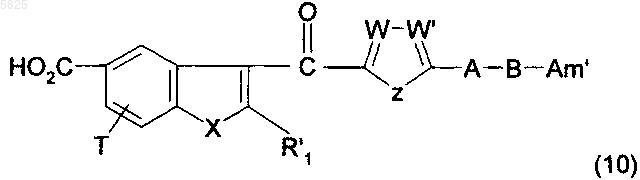
в которой A, B, T, X, W, W' и Z имеют такое же значение, как в п.1, R'1 представляет собой C1-C6алкильную группу или группу (m), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, и Am' представляет собой группу (Am1) или (Am2), как определено в п.1, причем эта группа не содержит карбоксильную группу или группу карбоксилат щелочного металла, или Am' представляет собой группу (Am3), как определено в п.1, в которой R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы, после защиты аминной функциональной группы, когда Am' представляет собой группу (Am1), в которой R2 представляет собой водород, подвергают взаимодействию с галогенирующим агентом с получением ацилгалогенида, который затем обрабатывают спиртом общей формулы
R'''5-OH (12),
в которой R'"5 представляет собой C1-C10алкильную группу, или C3-C6циклоалкильную группу, или группу (b), в которой R'5 представляет собой пиперидинильную группу, возможно N-замещенную C1-C4алкильной группой, или R'5 представляет собой группу (d), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, а затем, если необходимо, удаляют защиту с образовавшегося соединения, что приводит к получению желаемых соединений в форме гидрогалогенида или в форме свободного основания, если соединение формулы (10) присутствует в избытке, и этот гидрогалогенид может быть обработан, если требуется, основным агентом, таким как гидроксид щелочного металла или карбонат щелочного металла, с получением желаемых соединений в форме свободного основания, причем образовавшееся таким образом свободное основание возможно, если необходимо, обрабатывают подходящей органической или неорганической кислотой с получением фармацевтически приемлемой соли.
20. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу -CO-, R1, (Am1) и (Am2) не содержат карбоксильную группу или группу карбоксилат щелочного металла, R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы и R представляет собой группу (e), в которой R10 представляет собой группу (f), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, отличающийся тем, что соединение формулы
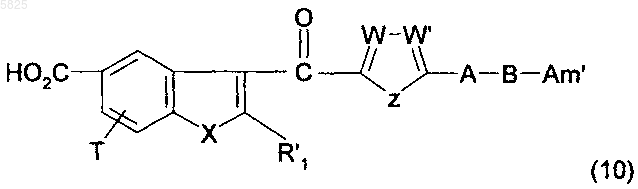
в которой A, B, T, X, W, W' и Z имеют такое же значение, как в п.1, R'1 представляет собой C1-C6алкильную группу или группу (m), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, и Am' представляет собой группу (Am1) или (Am2), как определено в п.1, причем эта группа не содержит карбоксильную группу или группу карбоксилат щелочного металла, или Am' представляет собой группу (Am3), как определено в п.1, в которой R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы, после защиты аминной функциональной группы, когда Am' представляет собой группу (Am1), в которой R2 представляет собой водород, подвергают взаимодействию с галогенирующим агентом с получением хлорангидрида карбоновой кислоты, который затем обрабатывают соединением формулы
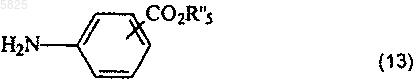
в которой R"5 представляет собой C1-C10алкильный радикал или C3-C6циклоалкильный радикал, а затем, если необходимо, удаляют защиту с образовавшегося соединения, что приводит к получению желаемых соединений в форме свободного основания, в которых R10 представляет собой группу (f), в которой группа R11 представляет собой группу (a), в которой R5 представляет собой C1-C4алкильную группу или C3-C6циклоалкильную группу, и образовавшееся таким образом свободное основание возможно, если необходимо, обрабатывают подходящей органической или неорганической кислотой с образованием фармацевтически приемлемой соли.
21. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу -CO-, R1, (Am1) и (Am2) не содержат карбоксильную группу или группу карбоксилат щелочного металла, R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы и R представляет собой группу (e), в которой R10 представляет собой C1-C4алкильную группу, аминогруппу или группу (c), отличающийся тем, что соединение формулы
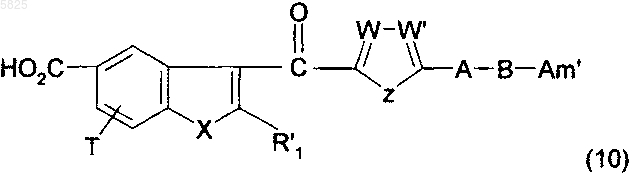
в которой A, B, T, X, W, W' и Z имеют такое же значение, как в п.1, R'1 представляет собой C1-C6алкильную группу или группу (m), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, и Am' представляет собой группу (Am1) или (Am2), как определено в п.1, причем эта группа не содержит карбоксильную группу или группу карбоксилат щелочного металла, или Am' представляет собой группу (Am3), как определено в п.1, в которой R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы, после защиты аминной функциональной группы, когда Am' представляет собой группу (Am1), в которой R2 представляет собой водород, подвергают взаимодействию с галогенирующим агентом с получением ацилгалогенида, который затем обрабатывают амином общей формулы

в которой R6, R7 и R8 имеют такое же значение, как в п.1, а R'10 представляет собой C1-C4алкильный радикал или аминорадикал, а затем, если необходимо, удаляют защиту с образовавшегося соединения, что приводит к получению, возможно, после обработки основанием, желаемого соединения формулы (1) в форме гидрогалогенида или в форме свободного основания, если соединение формулы (10) присутствует в избытке, и этот гидрогалогенид может быть обработан, если необходимо, основным агентом, таким как гидроксид щелочного металла или карбонат щелочного металла, с получением желаемых соединений в форме свободного основания, которые, если необходимо, могут быть подвергнуты взаимодействию с подходящей органической или неорганической кислотой с образованием фармацевтически приемлемой соли.
22. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу -CO-, R1, (Am1) и (Am2) не содержат карбоксильную группу или группу карбоксилат щелочного металла, R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы и R представляет собой группу (e), в которой R10 представляет собой группу (g), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, отличающийся тем, что соединение формулы
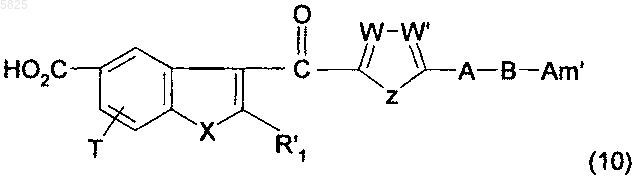
в которой A, B, T, X, W, W' и Z имеют такое же значение, как в п.1, R'1 представляет собой C1-C6алкильную группу или группу (m), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, и Am' представляет собой группу (Am1) или (Am2), как определено в п.1, причем эта группа не содержит карбоксильную группу или группу карбоксилат щелочного металла, или Am' представляет собой группу (Am3), как определено в п.1, в которой R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы, после защиты аминной функциональной группы, когда Am' представляет собой группу (Am1), в которой R2 представляет собой водород, подвергают взаимодействию с солью соединения общей формулы
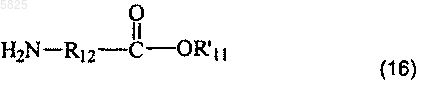
в которой R12 имеет такое же значение, как в п.1, а R'11 представляет собой C1-C4алкильный радикал или C3-C6циклоалкильный радикал, причем взаимодействие проводят в присутствии акцептора кислоты, а затем, если необходимо, удаляют защиту с образовавшегося соединения, что приводит к получению желаемых соединений в форме свободного основания, в которых R10 представляет собой группу (g), в которой группа R11 представляет собой группу (a), в которой R5 представляет собой C1-C4алкильную группу или C3-C6циклоалкильную группу, причем образовавшееся таким образом свободное основание возможно, если необходимо, обрабатывают подходящей органической или неорганической кислотой с получением фармацевтически приемлемой соли.
23. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу -CO-, R1, (Am1) и (Am2) не содержат карбоксильную группу или группу карбоксилат щелочного металла, R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы и R представляет собой группу (h), отличающийся тем, что соединение формулы
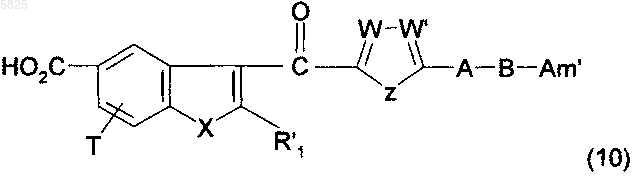
в которой A, B, T, X, W, W' и Z имеют такое же значение, как в п.1, R'1 представляет собой C1-C6алкильную группу или группу (m), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, и Am' представляет собой группу (Am1) или (Am2), как определено в п.1, причем эта группа не содержит карбоксильную группу или группу карбоксилат щелочного металла, или Am' представляет собой группу (Am3), как определено в п.1, в которой R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы, после защиты аминной функциональной группы, когда Am' представляет собой груяяу (Am1), в которой R2 представляет собой водород, подвергают взаимодействию с галогенирующим агентом с получением ацилгалогенида, который затем обрабатывают амином общей формулы

в которой R13 и R14 имеют такое же значение, как в п.1, а затем, если необходимо, удаляют защиту с образовавшегося соединения, что приводит к получению соли желаемого соединения, которую обрабатывают подходящим основным агентом с получением желаемых соединений в форме свободного основания, причем образовавшееся таким образом свободное основание возможно, если необходимо, обрабатывают органической или неорганической кислотой с получением фармацевтически приемлемой соли.
24. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу -CO-, R1, (Am1) и (Am2) не содержат карбоксильную группу или группу карбоксилат щелочного металла, R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы, и R представляет собой группу (e), в которой R10 представляет собой гидроксильную группу, отличающийся тем, что соединение формулы
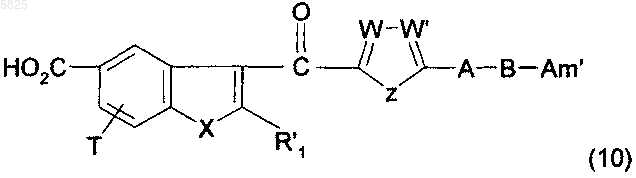
в которой A, B, T, X, W, W' и Z имеют такое же значение, как в п.1, R'1 представляет собой C1-C6алкильную группу или группу (m), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, и Am' представляет собой группу (Am1) или (Am2), как определено в п.1, причем эта группа не содержит карбоксильную группу или группу карбоксилат щелочного металла, или Am' представляет собой группу (Am3), как определено в п.1, в которой R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы, после защиты аминной функциональной группы, когда Am' представляет собой группу (Am1), в которой R2 представляет собой водород, подвергают взаимодействию с солью бензилоксиамина в присутствии акцептора кислоты и гексафторфосфата бензотриазол-1-илокситрис(диметиламино)фосфония, а затем, если необходимо, удаляют защиту с образовавшегося соединения, что приводит к получению бензилоксиаминокарбонильных производных, которые гидрируют в присутствии подходящего катализатора с получением желаемых соединений в форме свободного основания, которые обрабатывают, если необходимо, подходящей органической или неорганической кислотой с образованием фармацевтически приемлемой соли.
25. Способ по одному из пп.18-24, отличающийся тем, что защиту аминной функциональной группы осуществляют путем обработки 9-флуоренилметилхлорформиатом, и удаление защиты осуществляют путем обработки вторичным амином.
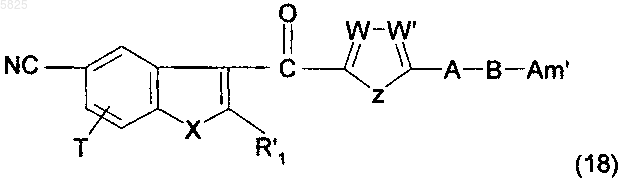
26. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу -CO-, R1, (Am1) и (Am2) не содержат карбоксильную группу или группу карбоксилат щелочного металла, R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы и R представляет собой группу (e), в которой R10 представляет собой водород, отличающийся тем, что соединение формулы
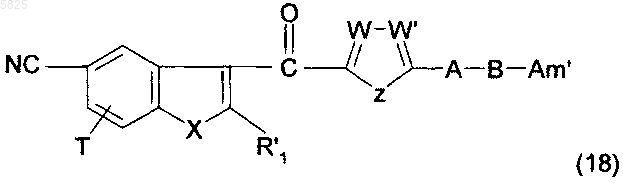
в которой A, B, T, X, W, W' и Z имеют такое же значение, как в п.1, R'1 представляет собой C1-C6алкильную группу или группу (m), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, и Am' представляет собой группу (Am1) или (Am2), как определено в п.1, причем эта группа не содержит карбоксильную группу или группу карбоксилат щелочного металла, или Am' представляет собой группу (Am3), как определено в п.1, в которой R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы, гидролизуют в присутствии сильной кислоты, что приводит к получению желаемых соединений в форме свободного основания, которые могут быть обработаны, если необходимо, подходящей органической или неорганической кислотой с образованием фармацевтически приемлемой соли.
27. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу -CO-, R1, (Am1) и (Am2) не содержат карбоксильную группу или группу карбоксилат щелочного металла, R16, и/или R17, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы и R представляет собой группу (1), отличающийся тем, что соединение формулы
в которой A, B, T, X, W, W' и Z имеют такое же значение, как в п.1, R'1 представляет собой C1-C6алкильную группу или группу (m), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, и Am' представляет собой группу (Am1) или (Am2), как определено в п.1, причем эта группа не содержит карбоксильную группу или группу карбоксилат щелочного металла, или группу (Am3), как определено в п.1, в которой R16, и/или R16, и/или R18 отличны от аминогруппы или C1-C4алкилсульфонамидогруппы, подвергают взаимодействию с трибутилазидооловом, что приводит к получению желаемых соединений в форме свободного основания, которые могут быть обработаны, если необходимо, подходящей органической или неорганической кислотой с образованием фармацевтически приемлемой соли.
28. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу -CO-, R1 не содержит карбоксильную группу или группу карбоксилат щелочного металла и Am представляет собой группу (Am1), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, в которой R16, и/или R17, и/или R18 представляют собой аминогруппу, или Am представляет собой группу (Am3), в которой R16, и/или R17, и/или R18 представляют собой аминогруппу, отличающийся тем, что нитросоединение формулы
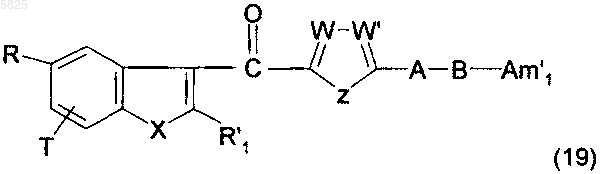
в которой A, B, T, W, W', X и Z имеют такое же значение, как в п.1, R имеет такое же значение, как в п.1, но не содержит карбоксильную группу или группу карбоксилат щелочного металла, R'1 представляет собой C1-C6алкильную группу или группу (m), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, и Am'1 представляет собой либо группу (Am1), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, и в которой R16, и/или R17, и/или R18 представляют собой нитрогруппу, либо группу (Am3), в которой R16, и/или R17, и/или R18 представляют собой нитрогруппу, гидрируют в присутствии подходящего катализатора, что приводит к получению желаемых соединений в форме свободного основания, которые могут быть подвергнуты взаимодействию, если необходимо, с подходящей органической или неорганической кислотой с образованием фармацевтически приемлемой соли.
29. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу -CO-, R1 не содержит карбоксильную группу или группу карбоксилат щелочного металла, и Am представляет собой группу (Am1), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, в которой R16, и/или R17, и/или R18 представляют собой C1-C4алкилсульфонамидогруппу, или Am представляет собой группу (Am3), в которой R16, и/или R17, и/или R18 представляют сосющ C1-C4алкилсульфонамидогруппу, отличающийся тем, что аминосоединение формулы
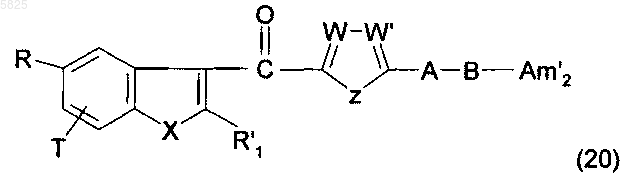
в которой A, B, T, W, W', X и Z имеют такое же значение, как в п.1, R имеет такое же значение, как в п.1, но не содержит карбоксильную группу или группу карбоксилат щелочного металла, R'1 представляет собой C1-C6алкильную группу или группу (m), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, и Am'2 представляет собой либо группу (Am1), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, и в которой R16, и/или R17, и/или R18 представляют собой аминогруппу, либо группу (Am3), в которой R16, и/или R17, и/или R18 представляют собой аминогруппу, подвергают взаимодействию с галогенидом общей формулы
Hal-SO2-R'16 (21)
или ангидридом общей формулы
(R'16SO2)2O (22),
в которых R'16 представляет собой линейный или разветвленный C1-C4алкильный радикал, возможно в присутствии акцептора кислоты, что приводит к получению желаемых соединений в форме свободного основания, которые могут быть подвергнуты взаимодействию, если необходимо, с подходящей органической или неорганической кислотой с образованием фармацевтически приемлемой соли.
30. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу -CO- и одна или две из групп R, R1 и (Am1) или (Am2) содержат группу -CO2R5, в которой R5 представляет собой водород или атом щелочного металла, а другая(ие) группа(ы) отлична(ны) от группы -CO2R5, в которой R5 представляет собой C1-C10алкильный радикал или C3-C6цклоалкильный радикал, отличающийся тем, что соединение формулы

в которой A, B, R, R1, T, W, W', X и Z имеют такое же значение, как в п.1, Am'3 представляет собой группу (Am1) или (Am2), как определено в п.1, и R, R1 и (Am1) или (Am2) являются такими, что одна или две из них содержит группу -CO2R"5, в которой R"5 представляет собой C1-C10алкильный радикал или C3-C6циклоалкильный радикал, а другая(ие) группа(ы) отлична(ны) от группы -CO2R5, в которой R5 представляет собой C1-C10алкильный радикал или C3-C6циклоалкильный радикал, омыляют в присутствии гидроксида щелочного металла, что приводит к получению желаемых соединений формулы (1), в которой одна или две из групп R, R1 и (Am1) или (Am2) содержит(ат) группу -CO2R5, в которой R5 представляет собой атом щелочного металла, в форме свободного основания, и это соединение может быть обработано, если необходимо, сильной кислотой, что приводит к получению желаемых соединений формулы (1), в которой R5 представляет собой водород, в форме свободного основания, причем образовавшиеся таким образом свободные основания возможно, если необходимо, обрабатывают подходящей органической или неорганической кислотой с получением фармацевтически приемлемой соли.
31. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу -CO- и одна из двух групп из групп R, R1 и (Am1) или (Am2) содержит группу -CO2R5, в которой R5 представляет собой водород или атом щелочного металла, другая содержит группу -CO2R5, в которой R5 представляет собой C1-C10алкильную или C3-C6циклоалкильную группу, а третья группа отлична от группы -CO2R5, в которой R5 представляет собой C1-C10алкильную или C3-C6циклоалкильную группу, отличающийся тем, что соединение формулы
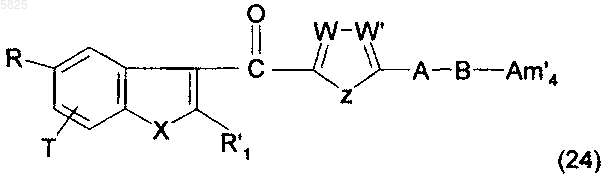
в которой A, B, R, R1, T, W, W', X и Z имеют такое же значение, как в п.1, Am'4 представляет собой группу (Am1) или (Am2), как определено в п.1, и R, R1 и (Am1) или (Am2) являются такими, что одна из них содержит группу -CO2R''5, в которой R"5 представляет собой C1-C10алкильную группу или C3-C6циклоалкильную группу, другая содержит бензилоксикарбонильную группу, а третья группа отлична от группы -CO2R5, в которой R5 представляет собой C1-C10алкильную группу или C3-C6циклоалкильную группу, гидрируют в присутствии подходящего катализатора;
соединение формулы
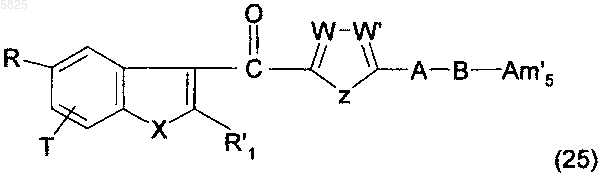
в которой A, B, R, R1, T, W, W', X и Z имеют такое же значение, как в п.1, Am'5 представляет собой группу (Am1) или (Am2), как определено в п.1, и R, R1 и (Am1) или (Am2) являются такими, что одна из них содержит группу -CO2R''5, в которой R''5 имеет такое же значение, как указано выше, другая содержит трет-бутоксикарбонильную группу, а третья группа отлична от группы -CO2R5, в которой R5 представляет собой C1-C10алкильную группу или C3-C6циклоалкильную группу, гидролизуют в присутствии трифторуксусной кислоты, что позволяет получить желаемые соединения формулы (1), в которой одна из двух групп из групп R, R1 и (Am1) или (Am2) содержит группу -CO2R5, в которой R5 представляет собой C1-C10алкильную группу или C3-C6циклоалкильную группу, а другая содержит группу -CO2R5, в которой R5 представляет собой водород, и эти соединения могут быть обработаны, если необходимо, подходящим основным агентом с получением желаемых соединений формулы (1), в которой одна из двух групп из групп R, R1 и (Am1) или (Am2) содержит группу -CO2R5, в которой R5 представляет собой атом щелочного металла, а другая содержит группу -CO2R5. в которой R5 представляет собой C1-C10алкильную группу или C3-C6циклоалкильную группу, в форме свободного основания, и сами эти соединения могут быть обработаны, если необходимо, сильной кислотой с получением желаемых соединений формулы (1), в которой одна из двух групп из групп R, R1 и (Am1) или (Am2) содержит карбоксильную группу, а другая содержит группу -CO2R5. в которой R5 представляет собой C1-C10алкильную группу или C3-C6циклоалкильную группу, в форме свободного основания, и образовавшиеся таким образом свободные основания возможно, если необходимо, обрабатывают подходящей органической или неорганической кислотой с получением фармацевтически приемлемой соли.
32. Способ получения производных бензофурана по п.1, в которых Y представляет собой -CO-, R представляет собой цианогруппу и одна из групп R1, (Am1) или (Am2) содержит карбоксильную группу, отличающийся тем, что соединение формулы (1) по п.1, в которой Y представляет собой группу -CO-, R представляет собой цианогруппу и в которой A, B, R1, T, W, W', X и Z имеют такое же значение, как в п.1, Am представляет собой группу (Am1) или (Am2), как определено в п.1, и R1, (Am1) и (Am2) являются такими, что одна из них содержит группу -CO2R"5, в которой R"5 представляет собой C1-C10алкильный радикал или C3-C6циклоалкильный радикал, обрабатывают оксидом трибутилолова с получением желаемых соединений в форме свободного основания, которые могут быть подвергнуты взаимодействию, если необходимо, с органической или неорганической кислотой с образованием фармацевтически приемлемой соли.
33. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу
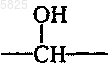
отличающийся тем, что соединение формулы (1) по п.1, в которой Y представляет собой группу -CO- и в которой A, B, Am, R, R1, T, W, W', X и Z имеют такое же значение, как в п.1, восстанавливают борогидридом щелочного металла, что приводит к получению желаемых соединений в форме свободного основания, которые могут быть подвергнуты взаимодействию, если необходимо, с органической или неорганической кислотой с получением фармацевтически приемлемой соли.
34. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу
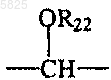
в которой R22 представляет собой C1-C4алкильный радикал, отличающийся тем, что соединение формулы (1) по п.1, в которой Y представляет собой группу -CHOH- и в которой A, B, Am, R, R1, T, W, W', X и Z имеют такое же значение, как в п.1, подвергают взаимодействию с алкоголятом щелочного металла, а затем с галогенидом формулы
R23-Hal,
в которой Hal представляет собой атом галогена, а R23 представляет собой C1-C4алкильный радикал, что приводит к получению желаемых соединений в форме свободного основания, которые могут быть подвергнуты взаимодействию, если необходимо, с органической или неорганической кислотой с получением фармацевтически приемлемой соли.
35. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу
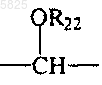
в которой R22 представляет собой ацильный радикал формулы -CO-R23, в которой R23 представляет собой C1-C4алкильный радикал, отличающийся тем, что соединение формулы (1) по п.1, в которой Y представляет собой группу -CHOH- и в которой A, B, Am, R, R1, T, W, W', X и Z имеют такое же значение, как в п.1, подвергают взаимодействию с ацилгалогенидом формулы

в которой Hal представляет собой атом галогена, а R23 представляет собой C1-C4алкильный радикал, что приводит к получению желаемых соединений в форме свободного основания, которые могут быть подвергнуты взаимодействию, если необходимо, с органической или неорганической кислотой с образованием фармацевтически приемлемой соли.
36. Способ получения производных бензофурана по п.1, в которых Y представляет собой группу -CH2-, отличающийся тем, что соединение формулы (1) по п.1, в которой Y представляет собой группу -CHOH- и в которой A, B, Am, R, R1, T, W, W', X и Z имеют такое же значение, как в п.1, восстанавливают борогидридом щелочного металла в присутствии трифторуксусной кислоты, что приводит к получению желаемых соединений в форме свободного основания, которые могут быть подвергнуты взаимодействию, если необходимо, с подходящей органической или неорганической кислотой с образованием фармацевтически приемлемой соли.
37. Лекарственный продукт, отличающийся тем, что он содержит производное бензофурана либо его фармацевтически приемлемую соль по любому из пп.1-12.
38. Фармацевтическая или ветеринарная композиция, отличающаяся тем, что она содержит в качестве активного начала по меньшей мере одно производное бензофурана или его фармацевтически приемлемую соль по любому из пп.1-12 в комбинации с подходящим эксципиентом или фармацевтическим носителем.
39. Фармацевтическая или ветеринарная композиция по п.38 для лечения патологических синдромов сердечно-сосудистой системы.
40. Фармацевтическая или ветеринарная композиция по п.38 или 39 для лечения стенокардии, гипертензии, предсердной аритмии, желудочковой экстрасистолии или наджелудочковой аритмии, недостаточности мозгового кровообращения, сердечной недостаточности, инфаркта миокарда, возможно осложненного сердечной недостаточностью, или для предупреждения смертности после инфаркта.
41. Фармацевтическая или ветеринарная композиция по одному из пп.38-40, отличающаяся тем, что она содержит от 50 до 500 мг активного начала.
42. Применение по меньшей мере одного производного бензофурана либо его фармацевтически приемлемой соли по одному из пп.1-12 для изготовления лекарственного продукта, предназначенного для лечения патологических синдромов сердечно-сосудистой системы.
Текст
005825 Данное изобретение, в общем, относится к новым гетероциклическим производным, а также к способу их получения. В частности, изобретение относится к новым производным бензофурана, которые могут быть представлены общей формулой а также их фармацевтически приемлемым солям, в которой А представляет собой -О-, -S-; В представляет собой линейную или разветвленную С 1-С 5 алкиленовую группу, возможно замещенную гидроксильной группой; Т представляет собой водород или С 1-С 4 алкильный радикал; R представляет собой: цианогруппу или гидроксиметильную группу,оксимную группу формулы: в которой R5 представляет собой водород или атом щелочного металла, линейную или разветвленную С 1-С 10 алкильную группу либо С 3-С 6 циклоалкильную группу или R5 представляет собой группу общей формулы в которой r равно числу от 1 до 4,карбоксильную группу общей формулы: в которой R'5 представляет собой пиперидинильную группу, возможно N-замещенную С 1-С 4 алкильной группой или одной из групп общей формулы:(d) в которой R6 и R7, которые могут быть одинаковыми или разными, представляют собой С 1-С 4 алкильную группу, R8 представляет собой линейную или разветвленную C1-С 6 алкиленовую группу, и R9 представляет собой водород, атом щелочного металла или С 1-С 4 алкильную группу,аминокарбонильную группу формулы в которой R10 представляет собой водород, С 1-С 4 алкильную группу, гидроксильную группу или аминогруппу, вышеуказанную группу (с) или одну из групп: в которых R11 представляет собой группу (a), a R12 представляет собой С 1-С 6 алкиленовый радикал,группу формулы в которой R13 и R14, которые могут быть одинаковыми или разными, представляют собой С 1-С 4 алкиль-1 005825 ный радикал или С 1-С 4 гидроксиалкильную группу,одну из групп приведенных ниже формулR1 представляет собой C1-С 6 алкильную группу или группу формулы(m) в которой R11 имеет такое же значение, как указано выше, и р равно числу от 1 до 4;Am представляет собой азотсодержащую группу формулыR2 представляет собой водород, линейную или разветвленную С 1-С 6 алкильную группу, возможно замещенную гидроксильной группой, группу (m), С 3-С 6 циклоалкильную группу или бензильную группу,R3 представляет собой линейную или разветвленную С 1-С 6 алкильную группу, возможно замещенную гидроксильной группой, С 3-С 6 циклоалкильную группу, группу (m), бензильную группу или фенильную группу формулы в которой R16, R17 и R18, которые могут быть одинаковыми или разными, представляют собой водород,или гидроксильную группу, нитрогруппу, аминогруппу, С 1-С 4 алкоксигруппу, или С 1-С 4 алкилсульфонамидогруппу,R19 представляет собой водород, С 1-С 5 алкильную группу, дифенилметильную группу, моно-, диили триметилфенильную группу, моно-, ди- или триметоксифенильную группу, группу (а), группу (b) или группу (с),каждое m и n равно 0 или 1,R2 и R3, когда они взяты вместе, представляют собой линейную или разветвленную С 3-С 10 алкиленовую группу, возможно замещенную гидроксильной группой, группой (а) или группой (m) и возможно прерванную -О-,причем эти альтернативы, R2 и R3, которые являются независимыми, или R2 и R3, взятые вместе,представлены в формуле (Am1) символом при этом R20 и R21 являются одинаковыми или разными и представляют собой водород, атом галогена, например фтора, хлора или брома, С 1-С 4 алкильный радикал, такой как метил, или С 1 С 4 алкоксильный радикал, такой как метокси;Y представляет собой радикал -СО- или -СН 2- либо радикал формулы в которой R22 представляет собой водород, С 1-С 4 алкильный радикал или ацильный радикал формулы причем подразумевается, что комбинация групп R, R1 и Am содержит 0, 1 или 2 группы (а),причем эти производные бензофурана находятся в форме индивидуальных изомеров или их смеси. Классы предпочтительных соединений по изобретению могут быть представлены соединениями формулы (1), в которой: либо R представляет собой изопропоксикарбонильную группу,либо Am представляет собой диэтилпиперидиногруппу. Также, конкретный класс соединений формулы (1) представляет собой класс соединений, в которыхY представляет собой радикал -СО-. Другим классом предпочтительных соединений формулы (1) являются соединения, в которых: представляет собой бензоильный радикал. Также, конкретный класс соединений формулы (1) представляет собой класс соединений, в которых группировка представляет собой 4-оксибензоильный радикал. Также, предпочтительными соединениями являются соединения формулы (1), в которой X представляет собой -О-, так же как и соединения, в которых цепь:-А-В-Аm находится в положении 4. Наконец, предпочтительными можно считать также соединения формулы (1), в которой R1 представляет собой н-бутил, В представляет собой пропиленовую группу, и Am представляет собой диэтилпиперидинильную группу, в частности, 3,5-диэтилпиперидинильную. Соединения формулы (1) могут существовать в форме оптических или геометрических изомеров,например соединения, в которых Am представляет собой диэтилпиперидинильную группу или в которыхR представляет собой группу -R4-O-N=CH-. Соответственно, изобретение относится как к индивидуальным изомерам соединений формулы (1),так и к их смесям, в частности, к рацемической смеси. Изобретение также относится к фармацевтически приемлемым солям соединений формулы (1), образованным с органической или неорганической кислотой. В качестве примеров органических солей этого типа можно упомянуть соли оксалат, малеат, фумарат, метансульфонат, бензоат, аскорбат, памоат, сукцинат, гексамат, бисметиленсалицилат, этандисульфонат, ацетат, пропионат, тартрат, салицилат, цитрат, глюконат, лактат, малат, циннамат, манделат, цитраконат, аспартат, пальмитат, стеарат, итаконат, гликолят, п-аминобензоат, глутамат, бензолсульфонат,п-толуолсульфонат и теофиллинацетат, а также соли, образованные с аминокислотой, такие как соль с лизином или гистидином. В качестве неорганических солей этого типа можно упомянуть соли гидрохлорид, гидробромид,сульфат, сульфамат, фосфат и нитрат. Обнаружено, что соединения по изобретению обладают заслуживающими внимания фармакологическими свойствами, в частности антиаритмическими свойствами, поскольку было доказано, что они способны подавлять или предупреждать расстройства желудочкового и предсердного ритма. Большинство соединений по изобретению обладают электрофизиологическими свойствами классов 1, 2, 3 и 4 по классификации Вогана-Вильямса, которые придают брадикардические, антигипертензивные и анти-адренергические и антиадренергические свойства, которые являются неконкурентными. Кроме того,большинство соединений проявляют также свойства антиоксидантов, сродство к сигма-рецепторам и способность увеличивать синтез NO. Более того, соединения по изобретению проявляют ингибиторные свойства по отношению к различным гормональным агентам, таким как, например, ангиотензин II, аргинин-вазопрессин, нейропептидY или эндотелин. Эти свойства делают рассматриваемые соединения очень полезными в лечении некоторых патологических синдромов сердечно-сосудистой системы, в частности, в лечении стенокардии, гипертензии,аритмии, в частности, предсердной аритмии, желудочковой экстрасистолии или наджелудочковой арит-3 005825 мии, или недостаточности мозгового кровообращения. Также, соединения по изобретению можно применять в лечении сердечной недостаточности или инфаркта миокарда, возможно осложненного сердечной недостаточностью, или для предупреждения смертности после инфаркта. В противоопухолевой области соединения по изобретению могут быть использованы в качестве потенцирующих средств для противораковых агентов. Соответственно, изобретение также относится к лекарственному продукту, отличающемуся тем,что он содержит производное бензофурана либо его фармацевтически приемлемую соль по изобретению. Соответственно, изобретение также относится к фармацевтическим или ветеринарным композициям, содержащим в качестве активного начала по меньшей мере одно соединение по изобретению в комбинации с подходящим эксципиентом или фармацевтическим носителем. В зависимости от выбранного способа введения суточная дозировка для человека массой 60 кг будет составлять от 2 до 2000 мг активного начала, в частности, от 50 до 500 мг активного начала. Соединения формулы (1) могут быть получены следующими способами:Y представляет собой группу -СО-,R1 не содержит карбоксильную группу или группу карбоксилат щелочного металла,Am представляет собой группу (Am1) или (Аm2), причем эта группа не содержит карбоксильную группу или группу карбоксилат щелочного металла, или Am представляет собой группу (Аm3), в которойR16, и/или R17, и/или R18 отличны от аминогруппы или С 1-С 4 алкилсульфонамидогруппы,могут быть получены следующими способами: А. Когда R представляет собой циано или гидроксиметильную группу, группу (а), в которой R5 представляет собой C1-С 10 алкильную или С 3-С 6 циклоалкильную группу, или группу (k), производное кетона общей формулы: в которой R'1 представляет собой C1-С 6 алкильную группу или группу (m), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, Т, W, W', X и Z имеют такое же значение, как указано выше, А' представляет собой ОН, SH или NH2, и R' представляет собой цианогруппу или гидроксиметильную группу, группу (k) или группу -CO2R"5, в которой R"5 представляет собой С 1-С 10 алкильный радикал или С 3-С 6 циклоалкильный радикал, подвергают взаимодействию в присутствии основного агента, такого как карбонат или гидроксид щелочного металла, с соединением общей формулы:(3) в которой Am' представляет собой группу (Am1), или (Аm2), причем эта группа не содержит карбоксильную группу или группу карбоксилат щелочного металла, или группу (Аm3), в которой R16, и/или R17,и/или R18 отличны от аминогруппы или С 1-С 4 алкилсульфонамидогруппы, В имеет такое же значение, как указано выше и R24 представляет собой: атом галогена, такой как, например, атом хлора, или C1-С 4 алкилсульфонилоксирадикал или С 6 С 10 арилсульфонилоксирадикал, что позволяет получить желаемые соединения формулы (1), в которой А представляет собой -О- или -S-, в форме свободного основания. Взаимодействие обычно проводят при температуре дефлегмации используемого растворителя или при температуре, не превышающей 90 С, при этом растворитель, возможно, представляет собой, например, полярный растворитель, такой как N,N-диметилформамид, или кетон, такой как, например, метилэтилкетон. В. Когда R представляет собой цианогруппу, группу R4-O-N=CH-, группу (а), в которой R5 представляет собой C1-С 10 алкильную группу или С 3-С 6 циклоалкильную группу, или группу (k), соединение общей формулы в которой А, В, R'1, Т, X, W, W и Z имеют такое же значение, как указано выше, и R" представляет собой цианогруппу, группу (k), группу R4-O-N=CH- или группу -CO2R"5, в которой R"5 имеет такое же значение, как указано выше,и Hal представляет собой атом галогена, такого как, например, хлора или брома, подвергают взаимодействию с соединением общей формулы: Н-Аm'(5) возможно в форме соли, например, в форме гидрохлорида, в которой Am' имеет такое же значение, как-4 005825 указано выше, причем взаимодействие проводят в присутствии основного агента, такого как карбонат или гидроксид щелочного металла, или избытка амина формулы (5) в основной форме, что приводит к получению желаемых соединений формулы (1) в форме свободного основания. В общем случае, взаимодействие проводят при температуре дефлегмации среды и в полярном растворителе, таком как N,N-диметилформамид, ацетонитрил или метилэтилкетон, или в неполярном растворителе, таком как бензол или толуол. С. Когда R представляет собой цианогруппу, группу R4-O-N=CH-, группу (а), в которой R5 представляет собой C1-С 10 алкильную группу или С 3-С 6 циклоалкильную группу, или группу (k), соединение общей формулы: в которой R", R'1, T и X имеют такое же значение, как указано выше, подвергают взаимодействию с галогенидом общей формулы: в которой А, В, Am', W, W', Z и Hal имеют такое же значение, как указано выше, причем взаимодействие возможно проводят в присутствии кислоты Льюиса, такой как хлорид алюминия, хлорид олова (IV), хлорид железа (III) или трифторметансульфонат серебра, что приводит к получению желаемых соединений формулы (1) в форме свободного основания. Обычно приведенное выше взаимодействие проводят в неполярном растворителе, таком как галогенированное соединение, например дихлорметан или дихлорэтан, и при температуре между температурой окружающей среды и температурой дефлегмации. Альтернативно, можно получать соединения формулы (1), в которой группа Am представляет собой группу (Am1), в которой R2 и R3 являются разными, путем превращения вторичного амина формулы (1),содержащего группу (Am1) формулы -NH-R2, в третичный амин путем взаимодействия с соединением общей формулы:(8),в которой Hal представляет собой атом галогена, предпочтительно брома, a R3 имеет такое же значение,как указано выше, причем взаимодействие предпочтительно проводят при температуре дефлегмации в присутствии основного агента, такого как карбонат или гидроксид щелочного металла, что приводит к получению желаемых соединений формулы (1) в форме свободного основания. Соединения формулы (1), в которой R представляет собой оксимную группу формулы R4-O-N=CH-,могут быть в форме стереоизомеров. Способы, описанные выше в (В) и (С), позволяют получать эти оксимные производные в форме смесей изомеров. Однако эти изомеры могут быть получены по отдельности с использованием известных способов, таких как, например, хроматография или осаждение.D. Когда R представляет собой группу (j), соединение общей формулы: в которой А, В, Т, W, W', X и Z имеют такое же значение, как указано выше, подвергают взаимодействию, предпочтительно при температуре дефлегмации среды, с фосгеном, что приводит к получению желаемых соединений формулы (1) в форме гидрохлорида, которые, если необходимо, могут быть обработаны основным агентом, таким как гидроксид щелочного металла или карбонат щелочного металла, что приводит к получению желаемых соединений в форме свободного основания. Производные бензофурана формулы (1), которые также соответствуют общей формуле: в которой A, Am', В, R'1, Т, X, W, W и Z имеют такое же значение, как указано выше, сами являются синтетическими промежуточными соединениями для получения других соединений формулы (1), в которой Y представляет собой -СО-, и Am представляет собой группу (Am1), или (Am2), причем эта группа не содержит карбоксильную группу или группу карбоксилат щелочного металла, или группу (Аm3), в-5 005825 которой R16, и/или R17, и/или R18 отличны от аминогруппы или С 1-С 4 алкилсульфонамидогруппы, и в которой R1 не содержит карбоксильную группу или группу карбоксилат щелочного металла. С этой целью, для получения желаемых соединений формулы (1) могут быть использованы следующие способы, начиная с рассматриваемых соединений формулы (10), а именно: Е. Когда R представляет собой группу (b), в которой R'5 представляет собой фуппу (с): а) если эта группа (с) представляет собой группу типа первичного диалкиламиноалкила, то соединение формулы (10), после защиты аминной функциональной группы, когда Am' представляет собой группу (Am1), в которой R2 представляет собой водород, подвергают взаимодействию, предпочтительно в полярном растворителе, таком как N,N-диметилформамид, и обычно при температуре от 30 до 50 С, со спиртом общей формулы: в которой R6 и R7 имеют такое же значение, как указано выше, a R8 представляет собой линейную C1-С 6 алкиленовую группу, причем взаимодействие проводят в присутствии карбонилдиимидазола и 1,8 диазабицикло[5.4.0]ундец-7 ена, а затем, если необходимо, удаляют защиту с образовавшегося соединения, что приводит к получению желаемых соединений формулы (1) в форме свободного основания;b) если эта группа (с) представляет собой группу типа вторичного или третичного диалкиламиноалкила, то соединение формулы (10), после защиты аминной функциональной группы, когда Am' представляет собой группу (Am1), в которой R2 представляет собой водород, подвергают взаимодействию, предпочтительно в апротонном растворителе, таком как галогенированный углеводород, и, в общем случае,при температуре дефлегмации среды, с галогенирующим агентом, таким как тионилхлорид, с получением ацилгалогенида, который затем обрабатывают, предпочтительно при температуре окружающей среды, спиртом вышеуказанной формулы (11), в которой R6 и R7 имеют такое же значение, как указано выше, a R8 представляет собой вторичную или третичную С 2-С 6 алкиленовую группу, а затем, если необходимо, удаляют защиту с образовавшегося соединения, что приводит к получению соединений формулы(1) в форме гидрогалогенида или в форме свободного основания, если соединение формулы (10) присутствует в избытке, и этот гидрогалогенид может быть обработан, если необходимо, основным агентом,таким как гидроксид щелочного металла или карбонат щелочного металла, с получением желаемых соединений в форме свободного основания.F. Когда R представляет собой либо группу (а), в которой R5 представляет собой C1-C10 алкильную группу или С 3-С 6 циклоалкильную группу, либо группу (b), в которой R'5 представляет собой пиперидинильную группу, возможно N-замещенную С 1-С 4 алкильной группой, или в которой R'5 представляет собой группу (d), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, соединение формулы (10), после защиты аминной функциональной группы, когда Am' представляет собой группу (Am1), в которой R2 представляет собой водород, подвергают взаимодействию, предпочтительно в галогенированном углеводороде и, в общем случае, при температуре дефлегмации среды, с галогенирующим агентом, таким как тионилхлорид, с получением ацилгалогенида, который затем обрабатывают спиртом общей формулы:(12),в которой R'"5 представляет собой C1-C10 алкильную группу, или С 3-С 6 циклоалкильную группу, или группу (b), в которой R'5 представляет собой пиперидинильную группу, возможно N-замещенную С 1-С 4 алкильной группой, или R'5 представляет собой группу (d), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, а затем, если необходимо, удаляют защиту с образовавшегося соединения, что приводит к получению желаемых соединений формулы (1) в форме гидрогалогенида или в форме свободного основания, если соединение формулы (10) присутствует в избытке, и этот гидрогалогенид, если необходимо, может быть обработан основным агентом, таким как гидроксид щелочного металла или карбонат щелочного металла, с получением желаемых соединений в форме свободного основания.G. Когда R представляет собой группу (е), в которой R10 представляет собой группу (f), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, соединение формулы (10),после защиты аминной функциональной группы, когда Am' представляет собой группу (Am1), в которойR2 представляет собой водород, подвергают взаимодействию, предпочтительно в галогенированном углеводороде и, в общем случае, при температуре дефлегмации, с галогенирующим агентом, таким как тионилхлорид, с получением хлорангидрида карбоновой кислоты, который затем обрабатывают, предпочтительно при температуре окружающей среды, соединением формулы:-6 005825 в которой R"5 имеет такое же значение, как указано выше, а затем, если необходимо, удаляют защиту с образовавшегося соединения, что приводит к получению желаемых соединений формулы (1), в которойR10 представляет собой группу (f), в которой группа R11 представляет собой группу (а), в которой R5 представляет собой С 1-С 4 алкильную группу или С 3-С 6 циклоалкильную группу, в форме свободного основания. Н. Когда R представляет собой группу (е), в которой R10 представляет собой С 1-С 4 алкильную группу, аминогруппу или группу (с), соединение формулы (10), после защиты аминной функциональной группы, когда Am' представляет собой группу (Am1), в которой R2 представляет собой водород, подвергают взаимодействию, предпочтительно в галогенированном углеводороде и, в общем случае, при температуре дефлегмации, с галогенирующим агентом, таким как тионилхлорид, с получением ацилгалогенида, который затем обрабатывают, предпочтительно при температуре окружающей среды, амином общей формулы: в которой R6, R7 и R8 имеют такое же значение, как указано выше, и R'10 представляет собой С 1-С 4 алкильный радикал или аминорадикал, а затем, если необходимо, удаляют защиту с образовавшегося соединения, что приводит к получению, возможно, после обработки основанием, желаемого соединения формулы (1) в форме гидрогалогенида или в форме свободного основания, если соединение формулы(10) присутствует в избытке, и этот гидрогалогенид, если необходимо, может быть обработан основным агентом, таким как гидроксид щелочного металла или карбонат щелочного металла, с получением желаемых соединений в форме свободного основания.I. Когда R представляет собой группу (е), в которой R10 представляет собой группу (g), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, соединение формулы (10), после защиты аминной функциональной группы, когда Am' представляет собой группу (Am1), в которой R2 представляет собой водород, подвергают взаимодействию, предпочтительно в полярном или неполярном растворителе, таком как N,N-диметилформамид, или в галогенированном углеводороде, например дихлорметане, с солью соединения общей формулы: в которой R12 имеет такое же значение, как указано выше, R'11 представляет собой С 1-С 4 алкильный радикал или С 3-С 6 циклоалкильный радикал, причем взаимодействие проводят в присутствии акцептора кислоты, такого как амин, например триэтиламин, а затем, если необходимо, удаляют защиту с образовавшегося соединения, что приводит к получению желаемых соединений формулы (1), в которой R10 представляет собой группу (g), в которой группа R11 представляет собой группу (а), в которой R5 представляет собой С 1-С 4 алкильную группу или С 3-С 6 циклоалкильную группу, в форме свободного основания.J. Когда R представляет собой группу (h), соединение формулы (10), после защиты аминной функциональной группы, когда Am' представляет собой группу (Am1), в которой R2 представляет собой водород, подвергают взаимодействию, предпочтительно в галогенированном углеводороде и, в общем случае,при температуре дефлегмации среды, с галогенирующим агентом, таким как тионилхлорид, с получением ацилгалогенида, который затем обрабатывают амином общей формулы: в которой R13 и R14 имеют такое же значение, как указано выше, а затем, если необходимо, удаляют защиту с образовавшегося соединения, что приводит к получению соли желаемого соединения формулы(1), которую обрабатывают соответствующим основным агентом, таким как карбонат щелочного металла, с получением желаемых соединений формулы (1) в форме свободного основания.K. Когда R представляет собой группу (е), в которой R10 представляет собой гидроксильную группу, соединение формулы (10), после защиты аминной функциональной группы, когда Am' представляет собой группу (Am1), в которой R2 представляет собой водород, подвергают взаимодействию с солью бензилоксиамина, например гидрохлоридом, в присутствии акцептора кислоты, например амина, такого как триэтиламин, и гексафторфосфата бензотриазол-1-илокситрис(диметиламино)фосфония (ВОР), а затем,если необходимо, удаляют защиту с образовавшегося соединения, что приводит к получению бензилоксиаминокарбонильных производных, которые гидрируют в присутствии подходящего катализатора, например палладированного угля или платиновой черни, с получением желаемых соединений формулы (1) в форме свободного основания.-7 005825 В способах Е - К, приведенных выше, защита аминной функциональной группы соединения формулы (10), то есть защита, предусмотренная, когда Am' представляет собой группу (Аm1), в которой R2 представляет собой водород, может быть обеспечена, например, путем обработки соединением, которое дает возможность присоединить группу, которую легко можно удалить, в частности, 9-флуоренилметилхлорформиатом, и удаление защиты затем осуществляют путем обработки вторичным амином,например пиперидином или диэтиламином, в подходящем растворителе, например N,Nдиметилформамиде. Другие соединения формулы (1) могут быть использованы в качестве промежуточных соединений для синтеза соединений по изобретению, в частности, цианопроизводные, которые также соответствуют общей формуле: в которой Am', А, В, R'1 T, W, W', X и Z имеют такое же значение, как указано выше. Так, можно использовать следующие способы, начиная с рассматриваемых соединений формулы(18), для получения соединений формулы (1), в которой Y представляет собой -СО-, Am представляет собой группу (Am1) или (Аm2), причем эта группа не содержит карбоксильную группу или группу карбоксилат щелочного металла, или группу (Аm3), в которой R16, и/или R17, и/или R18 отличны от аминогруппы или C1-С 4 алкилсульфонамидогруппы, и в которой R1 не содержит карбоксильную группу или группу карбоксилат щелочного металла, а именно:L. Когда R представляет собой группу (е), в которой R10 представляет собой водород, соединение формулы (18) гидролизуют в присутствии сильной кислоты, такой как, например, серная кислота, и, в общем случае, при температуре окружающей среды, что приводит к получению желаемых соединений формулы (1) в форме свободного основания. М. Когда R представляет собой группу (I), соединение формулы (18) подвергают взаимодействию,предпочтительно в апротонном растворителе, таком как ароматический углеводород, например бензол или толуол и, в общем случае, при температуре дефлегмации среды, с трибутилазидооловом, что приводит к получению желаемых соединений формулы (1) в форме свободного основания.Y представляет собой группу -СО-,R1 не содержит карбоксильную группу или группу карбоксилат щелочного металла,Am представляет собой группу (Am1), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, и в которой R16, и/или R17, и/или R18 представляют собой аминогруппу или С 1 С 4 алкилсульфонамидогруппу, или Am представляет собой группу (Аm3), в которой R16, и/или R17, и/илиR18 представляют собой аминогруппу или С 1-С 4 алкилсульфонамидогруппу,могут быть получены следующими способами: а) Когда R16, и/или R17, и/или R18 представляют собой аминогруппу, нитросоединение формулы: в которой А, В, R'1, T, W, W', X и Z имеют такое же значение, как указано выше, R имеет такое же значение, как указано выше, но не содержит карбоксильную группу или группу карбоксилат щелочного металла, и Am'1 представляет собой либо группу (Аm1), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, и в которой R16, и/или R17, и/или R18 представляют собой нитрогруппу,либо группу (Аm3), в которой R16, и/или R17, и/или R18 представляют собой нитрогруппу, гидрируют,предпочтительно при температуре окружающей среды и нормальном давлении, в присутствии подходящего катализатора, такого как никель Ренея, оксид платины, или оксид палладия, или цинк в среде хлороводородной кислоты, и предпочтительно в полярном растворителе, например спирте, что приводит к получению желаемых соединений формулы (1) в форме свободного основания.-8 005825 в которой А, В, R'1, T, W, W', X и Z имеют такое же значение, как указано выше, R имеет такое же значение, как указано выше, но не содержит карбоксильную группу или группу карбоксилат щелочного металла, и Аm'2 представляет собой либо группу (Am1), не содержащую карбоксильную группу или группу карбоксилат щелочного металла, и в которой R16, и/или R17, и/или R18 представляют собой аминогруппу,либо группу (Am3), в которой R16, и/или R17, и/или R18 представляют собой аминогруппу, подвергают взаимодействию с галогенидом общей формулы:(21) или ангидридом общей формулы(22),в которых R'16 представляет собой линейный или разветвленный С 1-С 4 алкильный радикал, причем взаимодействие проводят предпочтительно при температуре окружающей среды и в органическом растворителе, например апротонном растворителе, и возможно в присутствии акцептора кислоты, такого как амин, например триэтиламин, что приводит к получению желаемых соединений формулы (1) в форме свободного основания.Y представляет собой группу -СО-,комбинация, образованная R, R1 и Am, точнее R, R1 и (Am1) или (Аm2), содержащая 1 или 2 карбоксильные группы или группы карбоксилат щелочного металла, то есть 1 или 2 вышеуказанные группы (а),в которых R5 представляет собой водород или атом щелочного металла, могут быть получены следующими способами: а) Когда в этой формуле (1) одна или две из групп R, R1 и (Am1) или (Аm2) содержат группу -CO2R5,в которой R5 представляет собой водород или атом щелочного металла, а другая(ие) группа(ы) отлична(ны) от группы -CO2R5, в которой R5 представляет собой C1-C10 алкильный радикал или С 3 С 6 циклоалкильный радикал, соединение формулы: в которой А, В, R, R1, T, W, W', X и Z имеют такое же значение, как указано выше, Am'3 представляет собой группу (Am1) или (Аm2), как определено выше, a R, R1 и (Am1) или (Аm2) являются такими, что одна или две из них содержат группу -CO2R"5, в которой R"5 имеет такое же значение, как указано выше,а другая(ие) группа(ы) отлична(ны) от группы -CO2R5, в которой R5 представляет собой C1-C10 алкильный радикал или С 3-С 6 циклоалкильный радикал, омыляют в присутствии основного агента, а именно гидроксида щелочного металла, например гидроксида натрия, что приводит к получению соединений формулы (1), в которой одна или две из групп R, R1 и (Am1) или (Аm2) содержит(ат) группу -CO2R5, в которойR5 представляет собой атом щелочного металла, в форме свободного основания, и это соединение обрабатывают, если необходимо, сильной кислотой, например хлороводородной кислотой, что приводит к получению желаемых соединений формулы (1), в которой R5 представляет собой водород, в форме свободного основания. Однако, когда в этой формуле (1) R представляет собой цианогруппу, а одна из группR1, (Am1) или (Am2) содержит карбоксильную группу, соединение формулы (1), в которой Y представляет собой -СО-, А, В, Т, W, W, X и Z имеют такое же значение, как указано выше, R представляет собой цианогруппу, a R1, (Am1) и (Am2) такие, что одна из них содержит группу -CO2R"5, в которой R5 имеет такое же значение, как указано выше, также возможно обрабатывать оксидом трибутилолова, что приводит к получению желаемых соединений формулы (1) в форме свободного основания.b) Когда в этой формуле (1) одна из двух групп из групп R, R1, (Am1) или (Am2) содержит группу-CO2R5, в которой R5 представляет собой водород или атом щелочного металла, другая содержит группу-CO2R5, в которой R5 представляет собой C1-C10 алкильную группу или С 3-С 6 циклоалкильную группу, а третья группа отлична от группы -CO2R5, в которой R5 представляет собой C1-С 10 алкильный радикал или С 3-С 6 циклоалкильный радикал, либо соединение формулы в которой А, В, R, R1, T, W, W, X и Z имеют такое же значение, как указано выше, Am'4 представляет собой группу (Am1) или (Аm2), как определено выше, и R, R1 и (Am1) или (Am2) являются такими, что одна из них содержит группу -CO2R"5, в которой R"5 имеет такое же значение, как указано выше, другая содержит бензилоксикарбонильную группу, а третья группа отлична от группы -CO2R5, в которой R5 представляет собой C1-C10 алкильный радикал или С 3-С 6 циклоалкильный радикал, гидрируют в присутст-9 005825 вии подходящего катализатора, например палладированного угля или платиновой черни, и предпочтительно в органическом растворителе; либо соединение формулы: в которой А, В, R, R1, T, W, W', X и Z имеют такое же значение, как указано выше, Am'5 представляет собой группу (Am1) или (Аm2), как определено выше, и R, R1 и (Am1) или (Аm2) такие, что одна из них содержит группу -CO2R"5, в которой R"5 имеет такое же значение, как указано выше, другая содержит трет-бутоксикарбонильную группу, а третья группа отлична от группы -CO2R5, в которой R5 представляет собой С 1-С 10 алкильную группу или С 3-С 6 циклоалкильную группу, гидролизуют в присутствии трифторуксусной кислоты и предпочтительно в органическом растворителе, например апротонном растворителе, таком как метиленхлорид, что позволяет получить желаемые соединения формулы (1), в которой одна из двух групп из групп R, R1 и (Аm1) или (Аm2) содержит группу -CO2R5, в которой R5 представляет собой C1-C10 алкильную группу или С 3-С 6 циклоалкильную группу, а другая содержит группу-CO2R5, в которой R5 представляет собой водород, то есть карбоксильную группу, и эти соединения могут быть обработаны, если необходимо, подходящим основным агентом, например гидроксидом щелочного металла, с получением желаемых соединений формулы (1), в которой одна из двух групп из группR, R1 и (Am1) или (Аm2) содержит группу -CO2R5, в которой R5 представляет собой атом щелочного металла, а другая содержит группу формулы -CO2R5, в которой R5 представляет собой C1-C10 алкильную группу или С 3-С 6 циклоалкильную группу, в форме свободного основания, и сами эти соединения могут быть обработаны, если необходимо, сильной кислотой, например хлороводородной кислотой, с получением желаемых соединений формулы (1), в которой одна из двух групп из групп R, R1 и (Аm1) или (Аm2) содержит карбоксильную группу, а другая содержит группу -CO2R5, в которой R5 представляет собой С 1-C10 алкильную группу или С 3-С 6 циклоалкильную группу, в форме свободного основания. могут быть получены следующим путем:a) когда R22 представляет собой водород, соединение формулы (1), в которой Y представляет собой группу -СО-, восстанавливают борогидридом щелочного металла, таким как борогидрид натрия, и предпочтительно в растворителе, таком как спирт или эфир, что приводит к получению желаемых соединений формулы (1), в форме свободного основания;b) когда R22 представляет собой С 1-С 4 алкильный радикал или ацильный радикал формулы -CO-R23,образовавшийся таким образом вторичный спирт, то есть соединение формулы (1), в которой Y представляет собой группу -СНОН-, подвергают взаимодействию с: либо гидроксидом щелочного металла, а затем с галогенидом общей формулы:(26),в которой Hal и R23 имеют такое же значение, как указано выше,либо ацилгалогенидом общей формулы в которой Hal и R23 имеют такое же значение, как указано выше, причем взаимодействие проводят в присутствии акцептора кислоты, такого как пиридин, чтобы получить желаемые соединения формулы (1) в форме свободного основания. В зависимости от структуры исходного продукта, в процессе восстановления могут быть получены смеси соединений. Эти соединения могут быть выделены из их смеси общепринятыми методами, например посредством элюентной хроматографии.V. Соединения формулы (1), в которой Y представляет собой группу -СН 2-, могут быть получены,предпочтительно, путем восстановления соединения формулы (1), в которой Y представляет собой группу -СНОН-, борогидридом щелочного металла, таким как борогидрид натрия, в присутствии трифторуксусной кислоты и предпочтительно в растворителе, таком как спирт, эфир или галогенированный углеводород, что приводит к получению желаемых соединений формулы (1) в форме свободного основания. В общем случае, восстановление соединений формулы (1), в которой Y представляет собой группу-СО- или -СНОН-, осуществляют при температуре примерно от -10 С до +10 С, предпочтительно при 0 С. Соединения формулы (1), полученные в форме свободного основания одним из описанных выше способов, могут быть затем превращены в фармацевтически приемлемые соли путем взаимодействия с- 10005825 подходящей органической или неорганической кислотой, например щавелевой, малеиновой, фумаровой,метансульфоновой, бензойной, аскорбиновой, памовой, янтарной, гексамовой, бисметиленсалициловой,этандисульфоновой, уксусной, пропионовой, винной, салициловой, лимонной, глюконовой, молочной,яблочной, коричной, миндальной, цитраконовой, аспарагиновой, пальмитиновой, стеариновой, итаконовой, гликолевой, п-аминобензойной, глутаминовой, бензолсульфоновой, п-толуолсульфоновой или теофиллинуксусной кислотой, или с лизином или гистидином. Соединения формулы (2), в которой R' представляет собой цианогруппу или группу -CO2R"5, а также соединения формулы (4), в которой R" представляет собой цианогруппу или группу -CO2R"5, могут быть получены, начиная с соединения общей формулы: в которой R' представляет собой цианогруппу или группу -CO2R"5, a R'1, T и X имеют такое же значение,как указано выше, которое обрабатывают соединением общей формулы: в которой W, W', Z и Hal имеют такое же значение, как указано выше, а R25 представляет собой метоксигруппу, ацетилтиогруппу или нитрогруппу, или группу -A-B-Hal, в которой А, В и Hal имеют такое же значение, как указано выше, в присутствии кислоты Льюиса в качестве катализатора, например хлорида железа (III), хлорида олова (IV) или хлорида алюминия, и в растворителе, таком как галогенированный углеводород, чтобы получить кетон общей формулы: в которой R' представляет собой цианогруппу или группу -CO2R5, a R'1, Т, W, W', X, Z и R25 имеют такое же значение, как указано выше, что приводит к получению,когда R25 представляет собой группу -A-B-Hal, желаемых соединений формулы (4),когда R25 представляет собой метоксигруппу, соединений, которые О-деметилируют в присутствии подходящего агента, такого как гидрохлорид пиридина, трибромид бора или хлорид алюминия, с получением соединений формулы (2), в которой А' представляет собой ОН,когда R25 представляет собой ацетилтиогруппу, соединений, которые обрабатывают подходящим основным агентом, таким как гидроксид щелочного металла, с получением желаемых соединений формулы (2), в которой А представляет собой SH,когда R25 представляет собой нитрогруппу, соединений, которые восстанавливают путем гидрирования в присутствии подходящего катализатора, такого как палладированный уголь, с получением желаемых соединений формулы (2), в которой А' представляет собой NH2. Альтернативно, соединения формулы (2), в которой А' представляет собой гидроксильную группу,a R' представляет собой цианогруппу или группу-CO2R"5, могут быть получены, начиная с соединения формулы (28), которое обрабатывают фосгеном, а затем соединением общей формулы в которой W, W' и Z имеют такое же значение, как указано выше, причем взаимодействие проводят в присутствии кислоты Льюиса, такой как, например, хлорид алюминия или хлорид олова (IV), с получением кетонов формулы (30), в которой R25 представляет собой метоксигруппу. Полученные таким образом кетоны формулы (30) затем подвергают О-деметилированию в присутствии подходящего агента, такого как гидрохлорид пиридина, трибромид бора или хлорид алюминия, с получением, в результате, желаемых соединений. Соединения формулы (2), в которой А' представляет собой гидроксильную группу, a R' представляет собой гидроксиметильную группу, могут быть получены, начиная с соединения формулы (2), в которой R' представляет собой группу -CO2R"5, согласно приведенной ниже последовательности стадий: а) рассматриваемый сложный эфир формулы (2) обрабатывают при температуре дефлегмации среды гликолем в присутствии п-толуолсульфоновой кислоты с образованиеем диэфира общей формулы: в которой R'1, R"5 T, X, W, W' и Z имеют такое же значение, как указано выше,b) это соединение формулы (32) восстанавливают гидридом щелочного металла, таким как алюмогидрид лития, в растворителе, таком как эфир, что приводит к получению диспирта общей формулы: в которой R'1,T, X, W, W и Z имеют такое же значение, как указано выше,с) с полученного таким образом диспирта удаляют защиту с помощью п-толуолсульфоната пиридина, предпочтительно при температуре дефлегмации среды, что приводит к получению желаемых соединений. Соединения формулы (2), в которой R' представляет собой группу (k), могут быть получены путем обработки соединения формулы (2), в которой R1 представляет собой группу -CO2R"5,. оксимом ацетамида в присутствии гидрида щелочного металла, что приводит к получению желаемых соединений. Соединения формулы (4), в которой R" представляет собой цианогруппу, группу -CO2R"5 или группу (k), могут быть получены путем взаимодействия, предпочтительно при температуре дефлегмации,соединения формулы (2), в которой R' представляет собой цианогруппу или группу -CO2R"5, с дигалогенированным соединением общей формулы:(34),в которой Hal представляет собой атом галогена, предпочтительно брома, а В имеет такое же значение,как указано выше, причем взаимодействие проводят в присутствии основного агента, такого как карбонат или гидроксид щелочного металла, что приводит к получению желаемых соединений. Подобным образом, соединения формулы (4), в которой R" представляет собой группу R4-O-N=CH-,могут быть получены: а) путем восстановления эфира формулы (28), в которой R' представляет собой группу (а), в которой R5 представляет собой C1-C10 алкильный радикал или С 3-Сциклоалкильный радикал, подходящим агентом, таким как гидрид, например алюмогидрид лития, с получением спирта общей формулы: в которой R'1, T и X имеют такое же значение, как указано выше,b) путем окисления этого спирта формулы (35) оксалилхлоридом с образованием альдегида общей формулы в которой R'1 T и X имеют такое же значение, как указано выше, и с) путем взаимодействия полученного таким образом альдегида с соединением общей формулы:(37),возможно в форме одной из его солей, в растворителе-акцепторе кислоты, например пиридине, с образованием оксима общей формулы: в которой R'1, T и R4 имеют такое же значение, как указано выше. Затем это соединение формулы (38) обрабатывают либо соединением формулы (29), чтобы получать желаемые соединения, либо сначала фосгеном, а затем соединением формулы (31) и в конце аген- 12005825 том, подходящим для осуществления О-деметилирования, например хлоридом алюминия, гидрохлоридом пиридина или трибромидом бора, что приводит к получению желаемых соединений. Что касается соединений формулы (6), то они могут быть получены следующим образом: А - Соединения формулы (6), в которой R" представляет собой группу -CO2R"5, находящуюся в положении 5, a R'1, находящаяся в положении 2, представляет собой C1-С 6 алкильную группу, С 3-С 6 циклоалкильную группу, фенильную группу или бензильную группу, могут быть получены согласно приведенной ниже последовательности стадий: а) сначала бензоат общей формулы: в которой R"5, T и X имеют такое же значение, как указано выше, обрабатывают метансульфоновой кислотой в присутствии пентоксида фосфора и гексаметилентетрамина с получением формилового производного общей формулы: в которой R5, T и X имеют такое же значение, как указано выше,b) затем это соединение формулы (40) подвергают взаимодействию с эфиром общей формулы: в которой R"1 представляет собой C1-С 6 алкильную группу, что приводит к получению соединений общей формулы в которой R"1, R"5, T и X имеют такое же значение, как указано выше,с) этот эфир формулы (42) обрабатывают муравьиной кислотой или трифторуксусной кислотой, что приводит к получению кислот общей формулы: в которой R"1, R"5, T и X имеют такое же значение, как указано выше,d) это соединение подвергают циклизации в присутствии бензосульфонилхлорида или птолуолсульфонилхлорида и акцептора кислоты, такого как триэтиламин, что приводит к получению желаемых соединений формулы (6). В. Соединения формулы (6), в которых R" представляет собой цианогруппу, находящуюся в положении 5, a R'1, находящаяся в положении 2, представляет собой С 1-С 6 алкильную группу, могут быть получены следующим образом: а) сначала формиловое производное общей формулы:- 13005825 в которой Hal, T и X имеют такое же значение, как указано выше, обрабатывают цианидом цинка в присутствии подходящего катализатора, например палладиевого производного, такого как, например, тетракис(трифенилфосфин)палладий, что приводит к получению соединений общей формулы: в которой Т и X имеют такое же значение, как указано выше, b) затем это соединение формулы (45) подвергают деметилированию хлоридом лития, что приводит к получению соединения общей формулы: в которой Т и X имеют такое же значение, как указано выше, с) затем это соединение формулы (46) обрабатывают эфиром общей формулы: в которой R"1 и R"5 имеют такое же значение, как указано выше, в присутствии основного агента, такого как карбонат щелочного металла, что приводит к получению соединений общей формулы: в которой R'5, R"5, T и X имеют такое же значение, как указано выше,(d) и (е) этот эфир формулы (48) омыляют в присутствии основного агента, такого как гидроксид щелочного металла, и полученную таким образом кислоту подвергают циклизации в присутствии бензосульфонилхлорида или п-толуолсульфонилхлорида и акцептора кислоты, такого как триэтиламин, что приводит к получению желаемых соединений. С. Соединения формулы (6), в которой R" представляет собой цианогруппу или группу -СО 2R5, находящуюся в положении 5, a R'1, находящаяся в положении 2, представляет собой группу (m), в которойR11 представляет собой группу -CO2R"5, могут быть получены согласно приведенной ниже последовательности стадий: а) либо цианопроизводное общей формулы: в которой Т и X имеют такое же значение, как указано выше, обрабатывают иодом в присутствии водного аммиака с образованием иодопроизводного общей формулы: в которой Т и X имеют такое же значение, как указано выше, либо соединение общей формулы: в которой Т и X имеют такое же значение, как указано выше, обрабатывают сначала иодидом щелочного металла и окисляющим агентом, таким как гипохлорит щелочного металла, например гипохлорит натрия, затем галогенирующим агентом, таким как тионилхлорид, и в конце спиртом общей формулы:(52),в которой R"5 имеет такое же значение, как указано выше, что приводит к получению иодопроизводного общей формулы: в которой R"5, T и X имеют такое же значение, как указано выше,b) иодированное производное формулы (50) или (53) подвергают взаимодействию с ацетиленовым эфиром общей формулы:(54),в которой R"5 и р имеют такое же значение, как указано выше, в присутствии подходящего катализатора,такого как палладиевое производное, например дихлорбис(трифенилфосфин)палладий, и иодида меди (I) и в присутствии тетраметилгуанидина, что приводит к получению желаемых соединений формулы (6).D. Альтернативно, соединения формулы (6), в которой R" представляет собой цианогруппу или группу -CO2R"5, находящуюся в положении 5, a R'1, находящаяся в положении 2, представляет собой С 3-С 6 алкильную группу, могут быть получены путем взаимодействия иодированного производного формулы (53) с ацетиленовым производным общей формулы: в которой р имеет такое же значение, как указано выше, и в присутствии подходящего катализатора такого, как палладиевое производное, например тетракис(трифенилфосфин)палладий, и иодида меди (I),что приводит к получению желаемых соединений формулы (6). Е. Соединения формулы (6), в которой R" представляет собой цианогруппу или группу -CO2R'5, находящуюся в положении 6, a R'1, находящаяся в положении 2, имеет такое же значение, как указано выше, могут быть получены следующим образом: а) соединение общей формулы: в которой R26, T и X имеют такое же значение, как указано выше, подвергают взаимодействию с ангидридом трифторметансульфоновой кислоты в присутствии пиридина с получением соединения общей формулы: в которой R26, T и X имеют такое же значение, как указано выше,b) образовавшееся таким образом соединение подвергают взаимодействию с ацетиленовым производным общей формулы:(58),в которой R'1 имеет такое же значение, как указано выше, в присутствии подходящего катализатора, например палладиевого производного, такого как дихлорбис(трифенилфосфин)палладий, и акцептора кислоты, такого как триэтиламин, с получением соединений общей формулы: в которой R'1, R26, Т и X имеют такое же значение, как указано выше,с) затем это соединение формулы (59) подвергают циклизации в присутствии трибромида бора при температуре ниже -50 С, что приводит к получению гетероциклических соединений общей формулы: в которой R'1, Т и X имеют такое же значение, как указано выше, a R'26 представляет собой цианогруппу,что приводит к получению желаемых соединений формулы (6), или R'26 представляет собой карбоксильную группу, что приводит к получению кислоты,d) эту кислоту этерифицируют спиртом формулы (52), что приводит к получению желаемых соединений формулы (6).F. Соединения формулы (6), в которых R" представляет собой цианогруппу или группу -CO2R"5,находящуюся в положении 4, a R'1, находящаяся в положении 2, имеет такое же значение, как указано выше, могут быть получены следующим образом: а) соединение общей формулы: в которой R26, T и X имеют такое же значение, как указано выше, подвергают взаимодействию с трифторметансульфоновым ангидридом в присутствии пиридина с получением соединения общей формулы: в которой R26, T и X имеют такое же значение, как указано выше, b) образовавшееся таким образом соединение подвергают взаимодействию с ацетиленовым производным формулы (58) в присутствии подходящего катализатора, такого как палладиевое производное, например дихлор-бис-(трифенилфосфин) палладий, и акцептора кислоты, такого как триэтиламин, с образованием соединений общей формулы: в которой R'1, R26,. Т и X имеют такое же значение, как указано выше,с) затем это соединение формулы (63) подвергают циклизации в присутствии трибромида бора, что приводит к получению гетероциклических соединений общей формулы: в которой R'1, T и X имеют такое же значение, как указано выше, a R'26 представляет собой цианогруппу,что приводит к получению желаемых соединений формулы (6), или R'26 представляет собой карбоксильную группу, что приводит к получению кислоты,d) эту кислоту этерифицируют спиртом формулы (52), что приводит к получению желаемых соединений формулы (6).G. Соединения формулы (6), в которой R" представляет собой цианогруппу или группу -CO2R5, находящуюся в положении 7, a R'1, находящаяся в положении 2, имеет такое же значение, как указано выше, могут быть получены следующим образом: а) спирт общей формулы: в которой R27 представляет собой цианогруппу или формильную группу, а Т и X имеют такое же значение, как указано выше, обрабатывают метилиодидом в присутствии гидрида щелочного металла с получением соединения общей формулы: в которой R27, T и X имеют такое же значение, как указано выше,b) образовавшееся таким образом соединение подвергают взаимодействию с трифторметансульфоновым ангидридом с получением соединения общей формулы: в которой R27, T и X имеют такое же значение, как указано выше, с) образовавшееся таким образом соединение обрабатывают соединением формулы (58) в присутствии подходящего катализатора, такого как палладиевое производное, например, дихлорбис(трифенилфосфин)палладий, что приводит к получению соединения общей формулы: в которой R'1, R27, Т и X имеют такое же значение, как указано выше, d) затем образовавшееся таким образом соединение формулы (68) подвергают взаимодействию: когда R27 представляет собой цианогруппу, с хлоридом лития с образованием желаемых соединений формулы (6), в которой R" представляет собой цианогруппу,когда R27 представляет собой формильную группу, с цианидом щелочного металла в присутствии оксида марганца (II) и уксусной кислоты с получением соединения общей формулы: в которой R27, T и X имеют такое же значение, как указано выше, которое подвергают циклизации с использованием хлорида лития с получением смеси сложного эфира и кислоты общей формулы: в которой R28 представляет собой метоксикарбонильную группу или карбоксильную группу, a R'1, T и X имеют такое же значение, как указано выше, и эту смесь обрабатывают метанолом в присутствии сильной кислоты, такой как серная кислота, что приводит к получению желаемых соединений формулы (6), в которой R" представляет собой метоксикарбонильную группу. Другие соединения формулы (6), то есть соединения формулы (6), в которых R", находящийся в положении 7, представляет собой группу -CO2R"5, за исключением метоксикарбонильной группы, могут быть получены путем омыления сложного эфира формулы (6), в которой группа R", находящаяся в положении 7, представляет собой метоксикарбонильную группу, в присутствии основного агента, такого как гидроксид щелочного металла, с получением соли, которую окисляют сильной кислотой, такой как хлороводородная кислота, с получением 7-карбоксибензофуранового производного, которое этерифицируют спиртом общей формулы:(71) в которой R'a представляет собой С 2-C10 алкильный радикал или С 3-С 6 циклоалкильный радикал, что приводит к получению желаемых соединений формулы (6). Н. Соединения формулы (6), в которой R" представляет собой группу (k), могут быть получены путем циклизации соединения формулы (6), в которой R" представляет собой группу -CO2R"5,. с оксимом- 17005825 ацетамида в присутствии гидрида щелочного металла, такого как гидрид натрия, что приводит к получению желаемых соединений.I. Соединения формулы (6), в которой R" представляет собой группу R4-O-N=CH-, в действительности соответствуют соединениям формулы (38), получение которых описано выше. Большинство других исходных или промежуточных соединений, используемых в различных способах, описанных выше, являются известными соединениями или соединениями, которые могут быть получены известными способами. Например, некоторые амины формулы (3) или формулы (5) известны и описаны, в частности, в US 4831054 и ЕР 471609, или могут быть получены описанными в них способами. Например, 1-(2-хлорэтил)-4-дициклогексилметилпиперазин можно получить путем взаимодействияN-дициклогексилметилпиперазина с этиленоксидом с образованием 1-(2-гидроксиэтил)-4-дициклогексилметилпиперазина, который затем обрабатывают хлорирующим агентом, таким как тионилхлорид, с получением желаемого соединения. Подобным образом, 1-(2-хлорэтил)-3,5-диэтилпиперидин может быть получен аналогичным способом, включающим в себя образование 1-(2-гидроксиэтил)-3,5-диэтилпиперидина из этиленоксида и 2,5 диэтилпиперидина с последующим превращением его с использованием галогенирующего агента, такого как тионилхлорид, в желаемое соединение. Известны производные бензофурана или бензотиофена, которые содержат моноалкиламино- или диалкиламиноалкоксибензоильную цепь и которые замещены на гомоциклическом ядре аминогруппой,которая сама может быть или не быть замещенной. Было показано, что такие соединения, которые были раскрыты в патенте ЕР 0471609, обладают полезными антиаритмическими свойствами, вызывающими, в частности, фармакологические эффекты 1, 2, 3 и 4 классов Вогана-Вильямса. Однако эти производные бензофурана и бензотиофена демонстрируют низкую растворимость в водной среде и низкую доступность при пероральном введении. Фактически, теперь, в контексте данного изобретения, обнаружено, что производные бензофурана и бензотиофена, содержащие аминоалкоксибензоильную цепь и другие группы, присоединенные к гетероциклу через атом углерода, демонстрируют фармакологический профиль, подобный профилю соединений, известных из уровня техники, и при этом проявляют лучшую метаболическую стабильность, более высокую растворимость и большую биодоступность при пероральном введении. Результаты фармакологических испытаний, проведенных с целью определения свойств соединений по изобретению в отношении сердечно-сосудистой системы, перечислены ниже. 1. Антиаритмическая активность. Целью этого испытания является определение способности соединений по изобретению обеспечивать защиту от аритмий, индуцированых реперфузией. Для этого использовали методику, описаннуюA.S. Manning et al. в Circ. Res. 1984, 55: 545-548, модифицированную следующим образом. Сначала крыс, разделенных на группы, анестезируют пентобарбиталом натрия (60 мг/кг внутрибрюшинно), а затем интубируют и поддерживают вспомогательную искусственную вентиляцию легких. Затем в их правую яремную вену вставляют канюлю для внутривенного введения, вводят внутривенную дозу исследуемого соединения и через 5 мин накладывают лигатурную петлю вокруг левой передней нисходящей коронарной артерии в непосредственной близости от ее начала. Эту артерию затем перекрывают на 5 мин затягиванием концов лигатуры, чтобы вызвать реперфузию путем ослабления натяжения. Затем оценивают аритмии, индуцированные этой реперфузией. Аналогичное испытание проводят посредством перорального введения. В этом случае исследуемое соединение вводят за 120 мин до наложения лигатуры на левую переднюю нисходящую коронарную артерию. Результаты этих испытаний показали, что соединения по изобретению в значительной степени защищают подвергнутых обработке животных вплоть до 100% при дозах между 0,3 и 10 мг/кг внутривенно и между 10 и 90 мг/кг перорально.II. Антиадренергические свойства. Целью этого испытания является определение способности соединений по изобретению снижать увеличение кровяного давления, индуцированное фенилэфрином (анти- эффект), и увеличение частоты сердечных сокращений, индуцированное изопреналином (анти- эффект), у собак, предварительно анестезированных пентобарбиталом и хлоралозой. Сначала для каждой собаки определяют дозу фенилэфрина (5 или 10 мкг/кг), которая вызывает увеличение артериального давления между 25 и 40 мм рт. ст., и дозу изопреналина (0,9 или 1 мкг/кг), которая будет вызывать увеличение частоты сердечных сокращений между 60 и 120 ударами в минуту. Определенные таким образом дозы фенилэфрина и изопреналина поочередно вводят каждые 10 мин, и после получения 2 последовательных эталонных ответных реакций внутривенно вводят дозу исследуемого соединения. Анти- эффект. Регистрируют процент снижения соединением по изобретению индуцированной гипертензии по сравнению с эталонной гипертензией до. инъекции этого соединения (около 100 мм рт.ст.). Анти- эффект Регистрируют процент снижения исследуемым соединением индуцированного увеличения частоты сердечных сокращений. Результаты этих испытаний показывают, что при дозах в пределах от 1 до 10 мг/кг соединения по изобретению проявляют анти- и/или анти- эффекты, выражающиеся в снижении индуцированной гипертензии и/или индуцированного увеличения частоты сердечных сокращений в пределах от 50% до практически 100%.III. Фибрилляция предсердий. Целью этого испытания является оценка эффективности соединений по изобретению в отношении фибрилляции предсердий, индуцированной перманентной стимуляцией блуждающего нерва у собак,анестезированных по методу, описанному в Circulation 1993; 88:1030-1044. Исследуемые соединения вводят в кумулятивных дозах 3 и 10 мг/кг посредством медленных внутривенных вливаний по 10 мин во время эпизода длительной фибрилляции предсердий. При дозе 10 мг/кг соединения по изобретению в целом на 100% преобразует фибрилляцию предсердий в синусовый ритм и предотвращают его повторное индуцирование в от 50 до 100% случаев. При этой дозе наблюдается значительное увеличение сердечного периода и предсердных эффективных рефрактерных периодов для различных базальных значений сердечного периода.IV. Ингибиторные эффекты на нейрогормональную систему. Целью данного испытания является исследование ингибиторных эффектов соединений по изобретению в отношении сосудосуживающих эффектов, индуцированных различными пептидами, такими как норадреналин (NA), ангиотензин II (А-II), аргинин-вазопрессин (AVP), нейропептид Y (NPY) и эндотелин (ЕТ), а также в отношении тахикардических эффектов, индуцированных изопреналином (Iso), у крыс, находящихся в сознании. Самцам крыс Sprague Dawley массой примерно 300 г за 24 ч до испытания имплантируют артериальный катетер (в правую сонную артерию) для измерения артериального давления и венозный катетер(в правую яремную вену) для введения исследуемого продукта. На следующий день крыс помещают в цилиндрические клетки и соединяют артериальный катетер с датчиком давления через шарнирное соединение, вращающееся на маятнике. Сам этот датчик давления соединяют с полиграфом для записи артериального давления. Затем исследуют действие введенных внутривенно соединений по изобретению в отношении сосудосуживающих эффектов, индуцированных NA (1 мкг/кг), А-II (100 мкг/кг) и AVP (40 мкг/кг), в соответственных дозах либо 3, 10 и 30 мг/кг, либо от 1,3 до 10 мг/кг, и только в дозе 10 мг/кг в отношении сосудосуживающих эффектов, индуцированных NPY (6 мкг/кг) и ЕТ (0,5 мкг/кг), или тахикардических эффектов, индуцированных Iso (1 мкг/кг). Сначала различные пептидные агонисты растворяют в 0,9% физиологическом растворе, и исследуемое соединение растворяют в подходящем растворителе. Затем эти пептиды вводят в виде болюса в объеме 0,05 мл/кг за 30 и 10 мин до внутривенного введения 0,1 мл/кг раствора исследуемого соединения или растворителя. Затем эти инъекции пептидов повторяют через 10, 30, 60 и 120 мин после введения исследуемого соединения. В зависимости от длительности действия тестируемого соединения можно повторять эти инъекции каждые 30 мин, не превышая в целом 5 ч. Затем изменения артериального давления после введения данного пептида оценивают путем измерения в разное время разницы между максимальным эффектом, индуцированным пептидным агонистом и базальным значением артериального давления. Полученные результаты показывают, что NA, A-II,AVP, NPY и ЕТ индуцируют соответственные увеличения артериального давления 453, 403, 302 и 34 4 мм рт.ст., и Iso индуцирует увеличение частоты сердечных сокращений 209 7 сокращений в минуту. Кроме того, наблюдается, что соединения по изобретению оказывают антагонистическое воздействие дозо-зависимым образом на сосудосуживающие эффекты, индуцированные NA, A-II и AVP. Они также оказывают антагонистическое воздействие на эффекты, индуцированые NPY и ЕТ, и увеличение частоты сердечных сокращений, индуцированное Iso. При наиболее высоких дозах максимальное ингибирование, полученное через 15 мин, изменяется в пределах между 40 и 80%, и продолжительность действия составляет по меньшей мере 30 мин или более.V. Токсичность. Было доказано, что токсичность соединений по изобретению совместима с их терапевтическим применением. Фармацевтические композиции по изобретению могут быть представлены в любой форме, подходящей для введения в медицине человека или ветеринарии. Например, фармацевтические композиции по данному изобретению могут быть приготовлены в виде препаратов для перорального, сублингвального,- 19005825 подкожного, внутримышечного, внутривенного, трансдермального или ректального введения. Что касается единицы введения, то она может иметь форму, например, таблетки, таблетки с сахарным покрытием, капсулы, твердой желатиновой капсулы, порошка, суспензии, сиропа или гранул для перорального введения, суппозитория для ректального введения или раствора либо суспензии для парентерального введения. Фармацевтические композиции по изобретению могут содержать на единицу введения, например,от 50 до 500 мг по массе активного ингредиента для перорального введения, от 50 до 200 мг активного ингредиента для ректального введения и от 50 до 150 мг активного ингредиента для парентерального введения. В зависимости от выбранного способа введения фармацевтические или ветеринарные композиции по изобретению могут быть приготовлены путем объединения по меньшей мере одного из соединений формулы (1) или фармацевтически приемлемой соли этого соединения с подходящим эксципиентом,причем последний возможно состоит, например, по меньшей мере из одного ингредиента, выбранного из следующих веществ: лактоза, крахмалы, тальк, стеарат магния, поливинилпирролидон, альгиновая кислота, коллоидный диоксид кремния, дистиллированная вода, бензиловый спирт или подслащивающие агенты. Если композиции представляют собой таблетки, то эти таблетки могут быть обработаны так, чтобы проявлять пролонгированную или замедленную активность и чтобы непрерывно высвобождать предварительно определенное количество активного начала. Следующие неограничивающие примеры иллюстрируют получение соединений и композиций по изобретению: Пример 1. Метил-2-бутил-3-[4-(3-дибутиламинопропокси)бензоил]-1-бензофуран-5-карбоксилат.A. Метил-3-формил-4-гидроксибензоат. В трехгорлую круглодонную колбу помещают 2 г фосфорного ангидрида и 40 мл метансульфоновой кислоты. Смесь нагревают до примерно 85 С, затем нагревание прекращают и при температуре от 85 до 90 С частями добавляют однородную смесь 7,6 г (0,05 моль) метил-4-гидроксибензоата и 10,22 г(0,073 моль) гексаметилентетрамина. После окончания добавления смесь нагревают при 85 С/90 С в течение 2 ч, оставляют остывать до 70 С, а затем добавляют 60 мл воды. Смеси дают возможность постепенно достичь температуры окружающей среды, а затем экстрагируют этилацетатом. Затем промывают водой, водным раствором бикарбоната натрия, водой, раствором гидросульфата калия, снова водой до нейтральности и в конце насыщенным раствором хлорида натрия. Этим способом получают 6,73 г желаемого соединения в неочищенном виде. Выход: 75%. Т. пл. (температура плавления) 80-81 С.N,N-диметилформамида. Этот раствор охлаждают с помощью смеси вода/лед и при температуре примерно 7 С по каплям добавляют 32,8 г (2 эквивалента) оксалилхлорида в 50 мл бензола. Смесь перемешивают на холоде в течение 1 ч, а затем оставляют до достижения температуры окружающей среды. Растворитель выпаривают. После этого полученный хлорангидрид кислоты растворяют в 500 мл дихлорметана, а затем при температуре ниже 10 С добавляют смесь 120 г (12,5 эквивалента) трет-бутанола и 24,9 г(1,75 эквивалента) триэтиламина. Смеси дают возможность достичь температуры окружающей среды и ее промывают 500 мл воды, а затем 100 мл 3% хлороводородной кислоты. Дихлорметан выпаривают и остаток растворяют в диэтиловом эфире и промывают водой, водным раствором бикарбоната натрия, водой, раствором сульфата калия, водой и в конце насыщенным раствором хлорида натрия. Затем проводят дистилляцию при пониженном давлении. Таким способом получают 25 г желаемого соединения. Выход: 77%. Т.кип.(температура кипения): 104-107 С (20 мм рт. ст. (2,7 кПа).C. трет-Бутил-2-[(2-формил-4-метоксикарбонил)фенокси]гексаноат. 6,73 г (37 ммоль) метил-3-формил-4-гидроксибензоата и 10,32 г (1,1 эквивалента) трет-бутил-2 бромгексаноата растворяют в 100 мл N,N-диметилформамида. Затем добавляют 6,45 г (1,25 эквивалента) карбоната калия, и эту смесь нагревают на водяной бане (при примерно 80 С) в течение 3 ч. Затем выпаривают N,N-диметилформамид. Остаток растворяют в этилацетате и промывают 3% раствором гидросульфата калия, водой и насыщенным раствором хлорида натрия. Проводят очистку посредством хроматографии на диоксиде кремния (элюент: дихлорметан/этилацетат 100/2). Таким способом получают 11,4 г желаемого соединения. Выход: 88%.D. 2-[(2-Формил-4-метоксикарбонил)фенокси]гексановая кислота. В течение 24 ч при температуре окружающей среды перемешивают смесь 17,16 г трет-бутил-2-[(2 формил-4-метоксикарбонил)фенокси]гексаноата и 100 мл муравьиной кислоты. Затем смесь разбавляют- 20005825 водой и экстрагируют этилацетатом. Проводят промывку водой до нейтрального рН, а затем насыщенным раствором хлорида натрия. Таким способом получают 14,7 г желаемого соединения. Выход: 100%.E. Метил-2-бутил-1-бензофуран-5-карбоксилат. К смеси 141,6 мл триэтиламина в 250 мл толуола добавляют 52,5 мл бензолсульфонилхлорида, растворенного в 250 мл толуола. Нагревают при 80 С, а затем при температуре ниже и равной 90 С по каплям добавляют 85,3 г 2-[(2-формил-4-метоксикарбонил)фенокси]гексановой кислоты, растворенной в 500 мл толуола. По окончании добавления нагревание продолжают в течение 0,5 ч, смеси дают возможность достичь температуры окружающей среды и ее разбавляют этилацетатом. Затем промывают водой, раствором гидросульфата калия, водой, раствором бикарбоната натрия, водой и насыщенным раствором хлорида натрия. Затем осуществляют дистилляцию при пониженном давлении. Таким способом получают 28,4 г желаемого соединения. Выход: 39% относительно метил-4-гидроксибензоата. Т.кип.126-132 С (0,03 мбар (3 х 10-3 кПа).F. Метил-2-бутил-3-(4-метоксибензоил)-1-бензофуран-5-карбоксилат. Под аргоном растворяют 45,6 г (0,28 моль) хлорида железа (III) в 270 мл дихлорэтана, а затем при приблизительно 10 С добавляют 32,51 г (0,14 моль) метил-2-бутил-1-бензофуран-5-карбоксилата, растворенного в 180 мл дихлорэтана. После этого при температуре между 10 и 15 С добавляют 48,2 г (0,28 моль) анизоилхлорида, растворенного в 180 мл дихлорэтана. Смеси дают возможность достичь температуры окружающей среды, а затем перемешивают ее при этой температуре в течение 5 ч. Выливают реакционную смесь на смесь лед/вода и затем отфильтровывают осадок. Фильтрат разделяют посредством отстаивания, и водную фазу экстрагируют дихлорметаном. Органические фазы промывают раствором бикарбоната натрия, водой и насыщенным раствором хлорида натрия, а затем проводят очистку посредством кристаллизации. Таким способом получают 48,84 г желаемого соединения. Выход: 95%. Т. пл. 75-78 С.G. Метил-2-бутил-3-(4-гидроксибензоил)-1-бензофуран-5-карбоксилат. 48,84 г метил-2-бутил-3-(4-метоксибензоил)-1-бензофуран-5-карбоксилата и 55 г хлорида алюминия растворяют в 550 мл толуола. Проводят нагревание при 60 С на водяной бане в течение 2 ч, а затем толуол отделяют посредством отстаивания. Остаток растворяют в тетрагидрофуране, добавляют лед, и смесь перемешивают в течение 2 ч. Проводят разделение путем отстаивания, и водную фазу экстрагируют этилацетатом. Объединяют 3 органические фазы и промывают водой, а затем насыщенным водным раствором хлорида натрия. Затем осуществляют очистку посредством кристаллизации из диизопропилового эфира. Таким способом получают 26,45 г желаемого соединения. Выход: 56%. Т.пл. 152-153 С. Н. Метил-2-бутил-3-[4-(3-дибутиламино)пропокси]бензоил]-1-бензофуран-5-карбоксилат. В 35 мл метилэтилкетона растворяют 2,14 г (6 ммоль) метил-2-бутил-3-(4 гидроксибензоил)-1 бензофуран-5-карбоксилата, 1,25 г (6 ммоль) 3-хлор-1-(дибутиламино)пропана и 1 г карбоната калия. Смесь доводят до температуры дефлегмации в течение 22 ч, разбавляют водой и экстрагируют этилацетатом. Промывают насыщенным раствором хлорида натрия и очищают посредством хроматографии на диоксиде кремния (элюент: гексан/этилацетат 5/5). Таким способом получают 2,95 г желаемого соединения в форме свободного основания. Выход: 94%. Спектр ядерного магнитного резонанса (ЯМР): соответствует. Пример 2. Оксалат метил-2-бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-1-бензофуран-5 карбоксилата. 1,957 г метил-2-бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-1-бензофуран-5-карбоксилата и 0,338 г (1 эквивалент) щавелевой кислоты растворяют в метаноле. Проводят выпаривание, остаток растворяют в диэтиловом эфире и растирают, после чего проводят выпаривание. Затем проводят сушку в вакууме. Таким способом получают 2,13 г желаемого соединения. Выход: 93%. Т.пл.: 82-84oC. Спектр ЯМР: соответствует. Таким же способом, как описано выше (пример 1 и пример 2), получено следующее соединение: метил-2-бутил-6-метил-3-[4-[3-(1-пиперидинил)пропокси]бензоил]-1-бензофуран-5-карбоксилат- 21005825 Т.пл.: 181-183 С (диэтиловый эфир). Спектр ЯМР: соответствует. Пример 4. Оксалат циклогексил-2-бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-1-бензофуран 5-карбоксилата. Смесь 3,25 г 2-бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-1-бензофуран-5-карбоновой кислоты и 3 мл тионилхлорида в 60 мл хлороформа доводят до температуры дефлегмации в течение 1 ч. Концентрируют досуха, а затем последовательно растворяют в диэтиловом эфире и концентрируют, что приводит к получению хлорангидрида кислоты, который далее используют в неочищенном виде. Затем добавляют 50 мл циклогексанола и проводят нагревание при 100 С в течение 2 ч. После охлаждения проводят дистилляцию под вакуумом, чтобы удалить циклогексанол. Нерастворенную фракцию подвергают хроматографии на диоксиде кремния (элюент: хлорметан/метанол: 98/2), и основную фракцию растворяют в разбавленном водном растворе карбоната натрия. Проводят экстракцию диэтиловым эфиром,сушку и концентрирование, что приводит к получению желаемого продукта в форме свободного основания, которое преобразуют в соль путем добавления щавелевой кислоты в абсолютном этаноле. Таким способом выделяют 2,203 г желаемого соединения. Выход: 50,6%. Т.пл.: 96 С. Спектр ЯМР: соответствует. Пример 5. Оксалат 2-бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-N-гидрокси-1-бензофуран-5 карбоксамида.A. 2-Бутил-3-[4-[З-(дибутиламино)пропокси]бензоил]-N-бензилокси-1-бензофуран-5-карбоксамид. 2,45 г 2-бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-1-бензофуран-5-карбоновой кислоты,0,855 г (1,1 эквивалента) гидрохлорида бензилоксиамина, 2,36 г (1,1 эквивалент) ВОР и 2 мл (приблизительно 3 эквивалента) триэтиламина подвергают взаимодействию в 70 мл дихлорметана. Смесь перемешивают в течение 1 ч при комнатной температуре и упаривают, и остаток растворяют в этилацетате. Затем экстракты промывают водой, раствором гидросульфата калия, водой, раствором бикарбоната натрия,водой до нейтрального рН, а затем насыщенным раствором хлорида натрия. Таким способом получают приблизительно 3 г неочищенного желаемого соединения.B. Оксалат 2-бутил-3-[4-[З-(дибутиламино)пропокси]бензоил]-N-гидрокси-1-бензофуран-5-карбоксамида. 3,24 г 2-бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-N-бензилокси-1-бензофуран-5-карбоксамида в 100 мл метанола гидрируют в присутствии 5% палладированного угля при температуре окружающей среды и при нормальном давлении. Проводят фильтрацию через диатомовую землю и выпаривание. После этого проводят очистку посредством хроматографии на диоксиде кремния (элюент: дихлорметан/метанол/водный аммиак 90/10/0,5), что приводит к получению 1,82 г (выход 66%) желаемого продукта в форме основания. Затем 1,565 г полученного таким образом основания вносят в раствор 0,270 г щавелевой кислоты в метаноле. Проводят упаривание, остаток растворяют в диэтиловом эфире и оставляют кристаллизоваться. Таким способом получают желаемое соединение в виде аморфного порошка. Спектр ЯМР: соответствует. Пример 6. Метил-2-бутил-3-[4-[3-[(2,2-диметилпропил)амино]пропокси]бензоил]-1-бензофуран-5 карбоксилат. 16,73 г метил-2-бутил-3-[4-(3-бромпропокси)бензоил]-1-бензофуран-5-карбоксилата, 15,52 г (5 эквивалентов) неопентиламина и 19,7 г карбоната калия вводят в 200 мл диметилсульфоксида. Смесь перемешивают в течение 18 ч при температуре окружающей среды, проводят упаривание,остаток растворяют в воде и проводят экстракцию этилацетатом. После этого проводят промывание два раза водой, а затем насыщенным раствором хлорида натрия. Затем осуществляют очистку посредством хроматографии на диоксиде кремния (элюент: дихлорметан/метанол 95/5), и оставляют кристаллизоваться из гептана. Таким способом получают 10,6 г желаемого соединения. Выход: 62,5%. Т.пл.:61-63 С. Спектр ЯМР: соответствует. Пример 7. Оксалат 2-бутил-3-[4-[З-(дибутиламино)пропокси]бензоил]-N,N-диэтил-1-бензофуран-5 карбоксамида. 2,27 г 2-Бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-1 -бензофуран-5-карбоновой кислоты и 2,5 мл тионилхлорида вносят в 50 мл хлороформа. Смесь доводят до температуры дефлегмации в течение 1 ч и упаривают. Остаток растворяют в диэтиловом эфире и дважды проводят выпаривание. Затем остаток растворяют в 50 мл дихлорметана и добавляют 1,61 г N,N-диэтиламина, растворенного в 10 мл дихлорметана. Проводят упаривание, остаток растворяют в растворе карбоната калия, а затем проводят экстрак- 22005825 цию диэтиловым эфиром. После этого проводят промывание водой и насыщенным раствором хлорида натрия и очистку посредством хроматографии на диоксиде кремния (элюент: дихлорметан/метанол 95/5),что приводит к получению 1,65 г (выход: 66%) желаемого соединения в форме свободного основания. Затем 1,62 г полученного таким образом основания и 0,259 г щавелевой кислоты растворяют в метаноле, и проводят упаривание. Остаток растворяют в диэтиловом эфире и оставляют кристаллизоваться. Проводят фильтрование, промывание диэтиловым эфиром и сушку под вакуумом. Таким способом получают 1,54 г желаемого соединения в форме твердого вещества. Спектр ЯМР: соответствует. Пример 8. Оксалат [2-(диметиламино)этанол]-2-бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-1 бензофуран-5-карбоксилата. В атмосфере азота 1,93 г (3,8 ммоль) 2-бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-1 бензофуран-5-карбоновой кислоты и 0,615 г карбонилдиимидазол смешивают в 20 мл N,N-диметилформамида. Эту реакционную среду нагревают при 40 С в течение 1 ч, а затем добавляют 0,583 г 1,8 диазабицикло[5.4.0]ундец-7-ена и затем 0,678 г (7,60 ммоль) 2-(диметиламино)этанола. Смесь выдерживают при 40 С в течение 18 ч, а затем концентрируют досуха. После этого проводят экстракцию этилацетатом, экстракт промывают водой и насыщенным раствором хлорида натрия, и проводят очистку посредством хроматографии на диоксиде кремния (элюент: дихлорметан/метанол 90/10) с получением 1,47 г желаемого продукта в форме основания, которое затем обрабатывают раствором щавелевой кислоты в абсолютном этаноле. Таким способом выделяют 1,122 г желаемого соединения в виде аморфного твердого вещества. Выход: 66,8%. Спектр ЯМР: соответствует. Пример 9. Метил-3-[(2-бутил-3-4-[3-(дибутиламино)пропокси]бензоил-1-бензофуран-5-ил)карбонил]аминопропаноат. В 50 мл дихлорметана, содержащего 15 мл N,N-диметилформамида, вносят 2,54 г (5 ммоль) 2 бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-1-бензофуран-5-карбоновой кислоты, 0,768 г (5,5 ммоль) гидрохлорида 2-(метоксикарбонил)этиламина, 2,3 мл (16,5 ммоль) триэтиламина и 2,43 г (5,5 ммоль) ВОР. Реакционную среду перемешивают при температуре окружающей среды в течение 2 ч, упаривают и остаток экстрагируют этилацетатом. Затем промывают водой, раствором гидросульфата калия, водой, раствором бикарбоната натрия,водой до нейтрального рН и насыщенным раствором хлорида натрия. Затем проводят очистку посредством хроматографии на диоксиде кремния (элюент: дихлорметан/метанол 100/3). Таким способом получают 2,1 г желаемого соединения. Выход: 71%. Спектр ЯМР: соответствует. Пример 10. 3-[(2-Бутил-3-4-[3-(дибутиламино)пропокси]бензоил-1-бензофуран-5-ил)карбонил] аминопропионовая кислота. 2 г метил-3-[(2-бутил-3-4-[3-(дибутиламино)пропокси]бензоил-1-бензофуран-5-ил)карбонил] аминопропаноата и 0,270 г (2 эквивалента) гидроксида натрия вносят в смесь 50 мл диоксана, затем 10 мл метанола и 10 мл воды. Эту смесь перемешивают в течение 2 ч при температуре окружающей среды,упаривают, и остаток затем растворяют в воде. Затем проводят подкисление до значения рН приблизительно 5 разбавленной хлороводородной кислотой, экстракцию дихлорметаном и промывку насыщенным раствором хлорида натрия. После этого проводят очистку посредством хроматографии на диоксиде кремния (элюент: дихлорметан/метанол 100/7). Таким способом получают 1,55 г желаемого соединения в виде аморфного твердого вещества. Выход: 79%. Спектр ЯМР: соответствует. Пример 11. 2-Бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-1-бензофуран-5-карбоксамид. 3,5 г 2-Бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-5-циано-1-бензофурана перемешивают в 35 мл концентрированной серной кислоты. Реакционную среду перемешивают в течение 24 ч при температуре окружающей среды, а затем выливают на лед. Проводят подщелачивание на холоде гидроксидом натрия и экстракцию дихлорметаном. Затем проводят промывку насыщенным раствором хлорида натрия и осуществляют очистку посредством кристаллизации из гептана. Таким способом получают 2,68 г желаемого соединения. Выход: 74%. Т.пл.: 90-92 С. Спектр ЯМР: соответствует. Пример 12. 2-Бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-5-(1 Н-тетразол-5-ил)-1-бензофуран. 3,26 г 2-бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-5-циано-1-бензофурана и 4,5 (приблизительно 2 эквивалента) азида трибутилолова вносят в 80 мл толуола. Смесь кипятят с обратным холодильником в течение 90 ч, растворитель выпаривают и остаток подвергают хроматографии на диоксиде- 23005825 кремния (элюент: дихлорметан/метанол 92/8). Затем оставляют кристаллизоваться из диизопропилового эфира. Таким способом получают 3,05 г желаемого соединения. Выход: 86 %. Т.пл.: 145-147oC. Спектр ЯМР: соответствует. Пример 13. 2-Бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-1-бензофуран-5-карбогидразид. 2,16 г (4,3 ммоль) 2-бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-1-бензофуран-5-карбоновой кислоты и 2,5 мл тионилхлорида вносят в 50 мл хлороформа. Смесь доводят до температуры дефлегмации в течение 1 ч и упаривают. Остаток растворяют в диэтиловом эфире, и растворитель выпаривают. Повторяют эти две операции. Полученный таким образом хлорангидрид кислоты растворяют в 15 мл тетрагидрофурана, и этот раствор по каплям добавляют к раствору 1 мл 98% гидразингидрата в 15 мл тетрагидрофурана. Реакционную среду перемешивают при температуре окружающей среды, а затем выпаривают. Проводят экстракцию этилацетатом и промывку водой. Затем проводят очистку посредством хроматографии на диоксиде кремния (элюент: дихлорметан/метанол/водный аммиак 85/5/0,2). Таким способом получают 1,13 г желаемого соединения. Выход: 41%. Спектр ЯМР: соответствует. Пример 14. Гидрохлорид 5-(2-бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-1-бензофуран-6-ил)1,3,4-оксадиазол-2-(3H)-она. 1,13 г 2-бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-1-бензофуран-5-карбогидразида растворяют в 20 мл хлороформа и этот раствор по каплям добавляют к раствору 2,2 г фосгена в 30 мл хлороформа. Смесь доводят до температуры дефлегмации в течение 6 ч. После того, как температура смеси достигнет температуры окружающей среды, проводят промывку сначала водой до нейтрального рН, а затем насыщенным раствором бикарбоната натрия. Таким способом после кристаллизации из диэтилового эфира получают 0,535 г желаемого соединения. Выход: 45%. Спектр ЯМР: соответствует. Пример 15. Оксалат (Е)-О-метилоксима 2-бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-1-6 ензофуран-5-карбальдегида. А. 2-Бутил-5-гидроксиметилбензофуран. К 0,400 г алюмогидрида лития в 20 мл диэтилового эфира по каплям добавляют 2,32 г (0,01 моль) метил-2-бутил-1-бензофуран-5-карбоксилата в 20 мл диэтилового эфира, и эту смесь доводят до температуры дефлегмации эфира. Сразу после завершения добавления смесь перемешивают в течение 1 ч при температуре окружающей среды. Смесь охлаждают в смеси лед/вода, подвергают гидролизу 1 н. раствором хлороводородной кислоты и проводят разделение путем отстаивания. Проводят экстрагирование диэтиловым эфиром и промывку водой и насыщенным раствором хлорида натрия. Таким способом получают 1,92 г желаемого соединения. Выход: 94%. В. 2-Бутил-1 -бензофуран-5-карбальдегид. 3,17 г (0,025 моль) оксалихлорида в 50 мл дихлорметана охлаждают до -60 С, и затем добавляют 3,67 г (0,054 моль) диметилсульфоксида в 20 мл дихлорметана. Смесь перемешивают в течение 10 мин,затем добавляют 3,43 г (17 ммоль) 2-бутил-5-гидроксиметил-1-бензофурана в 50 мл дихлорметана. Перемешивание осуществляют в течение 15 мин, добавляют 15,7 мл (0,113 моль) триэтиламина и смесь оставляют до достижения температуры окружающей среды. Добавляют воду и проводят разделение путем отстаивания. Экстрагируют дихлорметаном. Затем промывают водой, раствором гидросульфата калия до нейтрального рН, водой, раствором карбоната натрия, водой и в конце насыщенным раствором хлорида натрия. Таким способом получают желаемое соединение, которое используют в неочищенном виде. С. (Е)-О-Метилоксим 2-бутил-1-бензофуран-5-карбальдегида. К 25 мл метанола добавляют 2,07 г 2-бутил-1-бензофуран-5-карбальдегида, 1,38 г гидрохлорида метоксиамина и 1,57 г пиридина. Смесь перемешивают в течение 1,5 ч при температуре окружающей среды, упаривают и остаток растворяют в диэтиловом эфире. Проводят промывку водой, раствором гидросульфата калия, водой и насыщенным раствором хлорида натрия. Затем проводят очистку посредством хроматографии на диоксиде кремния (элюент: дихлорметан/гептан 1/1). Таким способом получают 1,96 г желаемого соединения. Выход: 83%.- 24005825 Под аргоном 6,94 г (2 эквивалента) хлорида железа (III) вносят в 40 мл дихлорэтана. Затем при приблизительно +10 С добавляют 4,91 г (21 ммоль) (Е)-О-метилоксима 2-бутил-1-бензофуран-5-карбальдегида, растворенного в 25 мл дихлорэтана, а затем при температуре между +10 С и +15 С вносят 11,89 г(2 эквивалента) 1-хлоркарбонил-4-(3-бромпропокси)бензола в 25 мл дихлорметана. Смесь оставляют стоять до достижения температуры окружающей среды, а затем перемешивают в течение 5 ч при температуре окружающей среды. Затем ее выливают на смесь лед/вода, осадок отфильтровывают и фильтрат разделяют посредством отстаивания. Затем проводят очистку посредством хроматографии на диоксиде кремния (элюент: дихлорметан). Таким способом получают желаемое соединение, а именно: 2,74 г (Е)-изомера (выход 27,5%) и 2,05 г (Z)-изомера. Т.пл.: 78-81 С. Е. Оксалат (Е)-О-метилоксима 2-бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-1-бензофуран-5 карбальдегида. К 25 мл ацетонитрила добавляют 2,3 г (5 ммоль) (Е)-О-метилоксима 2-бутил-3-[4-(3-бромпропокси)бензоил]-1-бензофуран-5-карбальдегида, 1,28 г (2 эквивалента) дибутиламина, 1,38 г (2 эквивалента) карбоната калия и 0,75 г (1 эквивалент) иодида натрия. Смесь доводят до температуры дефлегмации в течение 4 ч и выпаривают. Проводят экстракцию этилацетатом и промывку водой и насыщенным раствором хлорида натрия. Затем осуществляют очистку путем хроматографии на диоксиде кремния (элюент: дихлорметан/метанол 100/2,5), что приводит к получению 2,24 г (выход 88%) желаемого соединения в форме основания. Затем 2,0 г полученного таким способом основания и 0,361 г щавелевой кислоты добавляют к метанолу, и проводят выпаривание. Остаток растворяют в диэтиловом эфире и оставляют кристаллизоваться. Таким способом получают 2,25 г желаемого соединения. Выход: 92%. Т.пл.: 97-99 С. Спектр ЯМР: соответствует. Пример 16. Оксалат 2-бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-5-гидроксиметил-1 бензофурана. А. Метил-2-бутил-3-[2-(4-гидроксифенил)-1,3-диоксолан-2-ил]-1-бензофуран-5-карбоксилат. Смесь 4,93 г (14 ммоль) метил-2-бутил-3-(4-(этиленгликольгидрокси)бензоил)-1-бензофуран-5 карбоксилата, 2,17 г и 0,500 г п-толуолсульфоновой кислоты в 250 мл бензола доводят до температуры дефлегмации. Затем разбавляют диэтиловым эфиром и промывают раствором бикарбоната натрия, водой и раствором хлорида натрия, выпаривают и сушат.B. 2-Бутил-5-гидроксиметил-3-[2-(4-гидроксифенил)-1,3-диоксолан-2-ил]-1-бензофуран. К 1,4 г алюмогидрида лития в 50 мл тетрагидрофурана по каплям добавляют полученный на предшествующей стадии неочищенный продукт, растворенный в 50 мл тетрагидрофурана. Смесь перемешивают в течение 2 ч при температуре окружающей среды, проводят гидролиз разбавленным раствором хлороводородной кислоты до тех пор, пока значение рН не составит 3, и разделение посредством отстаивания. Проводят экстракцию диэтиловым эфиром, а затем промывку водой и насыщенным раствором хлорида натрия. Таким способом получают желаемое соединение, которое используют в неочищенном виде. Однако это соединение может быть очищено посредством хроматографии на диоксиде кремния (элюент: дихлорметан/метанол 100:2,5). Т.пл.: 100-101oС.C. 2-Бутил-3-(4-гидроксибензоил)-5-гидроксиметил-1-бензофуран. Раствор, образованный неочищенным продуктом, полученным на предыдущей стадии, и 0,8 г птолуолсульфоната пиридина в 100 мл ацетона, содержащего 10 мл воды, доводят до температуры дефлегмации в течение 3 ч. Проводят выпаривание, и остаток растворяют в смеси диэтиловый эфир/вода. Полученный осадок отфильтровывают и промывают водой и диэтиловым эфиром, что приводит к получению первой порции желаемого продукта. Органическую фазу отделяют посредством отстаивания и промывают водой, раствором бикарбоната натрия, водой и раствором хлорида натрия. Проводят сушку и выпаривание, остаток растворяют в диэтиловом эфире и фильтруют, что приводит к получению второй порции желаемого соединения. Таким способом после кристаллизации из диэтилового эфира получают 3,37 г желаемого соединения. Выход: 74%. Т.пл.: 180-182 С.D. Оксалат 2-бутил-3-[4-[3-(дибутиламино)пропокси]бензоил]-5-гидроксиметил-1-бензофурана. 1,68 г 2-бутил-3-(4-гидроксибензоил)-5-гидроксиметил-1-бензофурана, 1,18 г 1-хлор-3-(дибутиламино)пропана и 0,960 г карбоната калия растворяют в 70 мл метилэтилкетона. Смесь доводят до температуры дефлегмации в течение 6 ч, добавляют воду и проводят разделение посредством отстаивания.- 25005825 Проводят экстрагирование этилацетатом и промывание насыщенным раствором хлорида натрия. Затем проводят очистку посредством хроматографии на диоксиде кремния (элюент: дихлорметан/метанол 95/5), что приводит к получению желаемого соединения в форме свободного основания. 2,50 г полученного таким образом основания затем смешивают с 0,455 г щавелевой кислоты в метаноле, проводят выпаривание, и остаток растворяют в диэтиловом эфире. Оставляют кристаллизоваться и проводят фильтрацию и промывку диэтиловым эфиром. Таким способом получают 2,57 г желаемого соединения. Выход: 85,5%. Спектр ЯМР: соответствует. Пример 17. 2-Бутил-3-[4-[3-(цис-3,5-диэтил-1-пиперидинил)пропокси]бензоил-5-(3-метил-1,2,4 оксадиазол-5-ил]-1-бензофуран. А. 2-Бутил-3-(4-гидроксибензоил)-5-(3-метил-1,2,4-оксадиазол-5-ил)-1-бензофуран. В трехгорлую круглодонную колбу помещают, под аргоном, 1,018 г оксима ацетамида, 0,660 г гидрида натрия, 6 г молекулярного сита и 60 мл тетрагидрофурана. Смесь нагревают при 60 С в течение 1 ч,добавляют 4,03 г метил-2-бутил-3-(4-гидроксибензоил)-1-бензофуран-5-карбоксилата, растворенного в 50 мл тетрагидрофурана, и доводят до температуры дефлегмации в течение 3 ч. Смесь разбавляют водой,добавляют раствор хлорида натрия и экстрагируют этилацетатом. Проводят промывку насыщенным раствором хлорида натрия. Этим способом получают 3,4 г желаемого соединения в кристаллической форме. Выход: 79%. Т.пл.: 180-182 С.B. 2-Бутил-3-[4-(3-бромпропокси)бензоил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-1-бензофуран. 4,26 г (0,0113 моль) соединения, полученного на предыдущей стадии, 11,44 г (5 эквивалентов) 1,3 дибромпропана и 1,88 г (1,2 эквивалента) карбоната калия смешивают в 100 мл метилэтилкетона. Смесь доводят до температуры дефлегмации в течение 3 ч и упаривают. Остаток растворяют в воде и проводят экстракцию этилацетатом. Проводят промывку насыщенным раствором хлорида натрия и очистку посредством хроматографии на диоксиде кремния (элюент: дихлорметан/метанол 100/3). Таким способом получают 3,58 г желаемого соединения. Выход: 64%. Т.пл.: 85-87 С.C. 2-Бутил-3-[4-[3-(цис-3.5-диэтил-1-пиперидинил)пропокси]бензоил-5-(3-метил-1,2,4-оксадиазол 5-ил]-1-бензофуран. В 100 мл ацетонитрила вносят 3,4 г соединения, полученного на предыдущей стадии, 1,21 г (1,1 эквивалента) гидрохлорида цис-3,5-диэтилпиперидина,1,03 г (1 эквивалент) иодида натрия и 2,83 г (3 эквивалента) карбоната калия. Смесь доводят до температуры дефлегмации в течение 6 часов, разбавляют водой и разделяют посредством отстаивания. Проводят экстракцию этилацетатом и промывку насыщенным раствором хлорида натрия. После этого проводят очистку посредством хроматографии на диоксиде кремния (элюент: дихлорметан/метанол 100/2,5 и 20% водный аммиак: 2 капли). Таким способом получают 2,55 г желаемого соединения. Выход: 67%. Т.пл.: 81-83 С (после перекристаллизации из гептана). Спектр ЯМР: соответствует. Пример 18. Гидрохлорид метил-2-бутил-3-[4-[3-(цис-3,5-диметил-1-пиперидинил)пропокси]бензоил]-1-бензофуран-6-карбоксилата. А. Изопропил-3-метокси-4-трифторметансульфонилоксибензоат. В 20 мл дихлорметана вносят 2,1 г (0,01 моль) изопропил-3-метокси-4-гидроксибензоата и 0,3 г (1,1 эквивалента) пиридина. Затем при температуре между 0 и 5 С по каплям добавляют раствор 3,1 г (1,1 эквивалента) трифторметансульфонового ангидрида в 10 мл дихлорметана. Смесь оставляют стоять до достижения температуры окружающей среды и перемешивают при этой температуре в течение 0,5 ч, а затем упаривают. Проводят экстракцию этилацетатом и промывку водой, разбавленной хлороводородной кислотой, раствором бикарбоната натрия, водой и в конце насыщенным раствором хлорида натрия. Таким способом получают 3,22 г желаемого соединения. Выход: 94%. В. Изопропил-3-метокси-4-(1-гексин-1-ил)бензоат. В 25 мл N,N-диметилформамида вносят 3,18 г (9,3 ммоль) соединения, полученного на предыдущей стадии, 1,52 г (2 эквивалента) 1-гексина, 6,5 мл (примерно 5 эквивалентов) триэтиламина и 0,325 г (0,05 эквивалента) дихлорбис(трифенилфосфин)палладия. Смесь нагревают при 90 С в течение 2 ч, разбавляют водой и добавляют разбавленную хлороводородную кислоту. Экстрагируют диэтиловым эфиром и промывают водой и насыщенным раствором хлорида натрия. Затем очищают посредством хроматографии на диоксиде кремния (элюент: дихлорметан/гептан 1/1). Таким способом получают 1,35 г желаемого соединения. Выход: 53%. С. 2-Бутил-1-бензофуран-6-карбоновая кислота.- 26005825 В 200 мл дихлорметана вносят 9,62 г (35 ммоль) соединения, полученного на предыдущей стадии, и смесь охлаждают до примерно -70 С. Затем добавляют 70 мл (2 эквивалента) 1 М раствора трибромида бора в дихлорметане. Смесь оставляют стоять до достижения температуры окружающей среды и перемешивают при этой температуре в течение 1 ч. Смесь охлаждают с помощью смеси лед/вода и гидролизуют. Экстрагируют дихлорметаном и промывают водой и насыщенным раствором хлорида натрия. Затем очищают посредством хроматографии на диоксиде кремния (элюент: дихлорметан/метанол 100/3). Таким способом получают 2,5 г желаемого соединения. Выход: 32,7%. Т.пл.: 102-104 С.D. Метил-2-бутил-1-бензофуран-6-карбоксилат. 2,5 г соединения, полученного на предыдущей стадии, вносят в 80 мл метанола и добавляют 1 мл концентрированной серной кислоты. Смесь доводят до температуры дефлегмации в течение 6 часов и упаривают. Проводят экстракцию диэтиловым эфиром и промывку водой, раствором бикарбоната натрия, водой и насыщенным раствором хлорида натрия. Таким способом получают 2,60 г желаемого соединения. Выход: 98%.E. Метил-2-бутил-3-[4-(3-бромпропокси)бензоил]-1-бензофуран-6-карбоксилат. В 150 мл дихлорметана вносят 2,60 г (11 ммоль) соединения, полученного на предыдущей стадии, и 4,58 г (1,5 эквивалента) 4-(3-бромпропокси)бензоилхлорида. Затем при температуре между 15 и 20oС добавляют 2,2 мл хлорида олова (IV) в 50 мл дихлорметана. Смесь перемешивают при температуре окружающей среды в течение 72 ч, выливают на смесь лед/вода, фильтруют и выпаривают. Проводят экстракцию этилацетатом и промывку раствором карбоната натрия, водой и насыщенным раствором хлорида натрия. Затем проводят очистку посредством хроматографии на диоксиде кремния (элюент: дихлорметан/этилацетат 100/2). Таким способом получают 3,95 г желаемого соединения. Выход: 76%.F. Гидрохлорид метил-2-бутил-3-[4-[З-(цис-3,5-диметил-1-пиперидинил)пропокси]бензоил]-1 бензофуран-6-карбоксилата. В 100 мл ацетонитрила вносят 3,9 г (8,2 ммоль) соединения, полученного на предыдущей стадии,1,36 г (1,1 эквивалента) гидрохлорида цис-3,5-диэтилпиперидина, 1,25 г (1 эквивалент) иодида натрия и 3,42 г (3 эквивалента) карбоната калия. Смесь доводят до температуры дефлегмации в течение 3 ч, разводят в воде и разделяют посредством отстаивания. Проводят экстракцию этилацетатом. Затем проводят очистку посредством хроматографии на диоксиде кремния (элюент: дихлорметан/метанол/аммиак 100/3/0,1), что приводит к получению 3,36 г (выход 81%) желаемого соединения в форме основания(спектр ЯМР: соответствует). 3,30 г полученного таким способом основания растворяют в диэтиловом эфире и добавляют раствор хлороводорода в диэтиловом эфире. Проводят фильтрацию, а затем промывку диэтиловым эфиром. Затем проводят очистку посредством кристиллизации из диэтилового эфира. Таким способом получают 2,74 г желаемого соединения. Выход: 77%. Т.пл.: 169-171oС. Спектр ЯМР: соответствует. По методике, описанной выше, было получено следующее соединение: гидрохлорид метил-2 бутил-3-[4-(1-пиперидинил)пропокси]бензоил]-1-бензофуран-6-карбоксилата (пример 19). Т.пл.: 176-178 С. Спектр ЯМР: соответствует. Пример 20. Метил-2-бутил-3-(42-[метил(4-нитрофенэтил)амино]этоксибензоил)-1-бензофуран-5 карбоксилат. 4,3 г (9,36 ммоль) метил-2-бутил-3-[4-(3-бромпропокси)бензоил]-1-бензофуран-6-карбоксилата вводят в 50 мл ацетонитрила, а затем добавляют 1,7 г (9,36 ммоль) N-метил-N-(4-нитрофенил)этиламина, 1,4 г (9,36 ммоль) иодида натрия и 2,58 г (18,7 ммоль) карбоната калия. Смесь доводят до температуры дефлегмации в течение 18 ч, концентрируют досуха и экстрагируют этилацетатом. Проводят промывку водой и насыщенным раствором хлорида натрия, а затем очистку посредством хроматографии на диоксиде кремния (элюент: дихлорметан/метанол 99/1, затем 97/3). Таким способом получают 5,0 г желаемого соединения. Выход: 95,6%. Спектр ЯМР: соответствует. Пример 21. Метил-3-(4-2-[(4-аминофенэтил)(метил)амино]этоксибензоил)-2-бутил-1-бензофуран 5-карбоксилат. В 100 мл абсолютного этанола вносят 5,0 г соединения, полученного в предыдущем примере, и добавляют каталитическое количество никеля Ренея. Смесь гидрируют при нормальном давлении и температуре окружающей среды. Когда реакция пре- 27005825 кращается, смесь фильтруют через диатомовую землю и промывают абсолютным этанолом. Проводят концентрирование и очистку посредством хроматографии на диоксиде кремния (элюент: дихлорметан/метанол 97/3, затем 95/5). Таким способом получают 3,57 г желаемого соединения. Выход: 75,5%. Спектр ЯМР: соответствует. Пример 22. Метил-2-бутил-3-4-[2-(метил-4-[(метилсульфонил)амино]фенэтиламино)этокси] бензоил-1-бензофуран-5-карбоксилат. В 200 мл дихлорметана вносят 3,57 г (6,75 ммоль) соединения, полученного на предыдущей стадии,и 2,59 г (14,9 ммоль) метансульфонового ангидрида. Смесь перемешивают при температуре окружающей среды в течение 18 ч и концентрируют досуха. Остаток растворяют в 2 н. растворе бикарбоната натрия, и проводят экстракцию этилацетатом. Проводят промывку водой и раствором хлорида натрия с последующей очисткой посредством хроматографии на диоксиде кремния (элюент: дихлорметан/метанол 97/3,затем 50/50 и в конце чистый метанол). Таким способом получают 2,928 г желаемого соединения. Выход: 71,5%. Спектр ЯМР: соответствует. Пример 23. Оксалат метил-3-(5-циано-3-4-[3-(дибутиламино)пропокси]бензоил-1-бензофуран-2 ил)пропаноата. А. 3-Иод-4-гидроксибензонитрил. 11,9 г (0,1 моль) 4-гидроксибензонитрила растворяют в 250 мл метанола и добавляют 250 мл 20% водного аммиака. Затем осторожно, по причине взрывоопасности реакции, по каплям добавляют раствор 31,75 г иода в 250 мл метанола. После окончания добавления смесь перемешивают в течение 2 ч при температуре окружающей среды. Метанол выпаривают, осуществляют разведение в воде и подкисление до значения рН от 2 до 3 раствором хлороводородной кислоты. Затем проводят экстракцию этилацетатом и промывку водой, раствором тиосульфата натрия и насыщенным раствором хлорида натрия. Таким способом получают 24,73 г желаемого соединения. Т.пл.: 144-146oC. По такой же методике было получено соединение, указанное ниже: изопропил-3-иодо-4-гидроксибензоат.B. Метил-3-(5-циано-1-бензофуран-2-ил)пропаноат. В 125 мл N,N-диметилформамида вносят 19,38 г (79 ммоль) соединения, полученного на предыдущей стадии, 9,81 г (1,1 эквивалента) метил-4-пентаноата, 0,750 г (0,05 эквивалента) иодида меди, 2,77 г дихлорбис(трифенилфосфин)палладия и 100 мл (10 эквивалентов) тетраметилгуанидина. Смесь перемешивают при температуре окружающей среды в течение 20 ч, разбавляют 1000 мл воды и экстрагируют 600 мл этилацетата. Проводят промывку водой, разбавленной хлороводородной кислотой, водой и насыщенным раствором хлорида натрия. Затем проводят очистку посредством хроматографии на диоксиде кремния (элюент: дихлорметан/этилацетат 100/1). Таким способом получают 9,93 г желаемого соединения. Выход: 59%. Т.пл.: 91-92 С. Таким же способом было получено соединение, указанное ниже: Метил-3-(5-изопропоксикарбонил-1-бензофуран-2-ил)пропаноат. Т.пл.: 62-64 С.C. Метил-3-[5-циано-3-(4-метоксибензоил)-1-бензофуран-2-ил]пропаноат 9,91 г соединения, полученного на предыдущей стадии, в 50 мл дихлорэтана добавляют, при приблизительно +10 С, к раствору 11,46 г (1,5 эквивалента) хлорида железа (III) в 80 мл дихлорэтана под аргоном, а затем при температуре от +10 до +15 С вносят 12,03 г (1,5 эквивалента) анизоилхлорида в 50 мл дихлорэтана. Смесь оставляют стоять до достижения температуры окружающей среды, а затем перемешивают при этой температуре в течение 5 ч. Ее выливают на смесь лед/вода, осадок отфильтровывают, и фильтрат отделяют посредством отстаивания. Водную фазу экстрагируют дихлорметаном, и органические фазы промывают и очищают посредством хроматографии на диоксиде кремния (элюент: дихлорметан/этилацетат 100/2). Таким способом получают 10,78 г желаемого соединения. Выход: 64%. Т.пл.: 95-98 С.D. Метил-3-[5-циано-3-(4-гидроксибензоил)-1 -бензофуран-2-ил]пропаноат. 9,73 г соединения, полученного на предыдущей стадии, и 10,8 г хлорида алюминия вводят в 350 мл толуола. Смесь нагревают при 80 С в течение 6 ч, а затем разделяют посредством отстаивания. Остаток растворяют в тетрагидрофуране и осторожно добавляют лед. Разделяют посредством отстаивания, экстрагируют водную фазу этилацетатом и объединяют 3 органические фазы. Проводят промывку водой с последующей очисткой посредством хроматографии на диоксиде кремния (элюент: дихлорметан/этилацетат 95/5, затем 90/10).- 28005825 Таким способом получают 5,57 г желаемого соединения. Выход: 95%. Т.пл.: 156-158 С. Е. Оксалат метил-3-(5-циано-3-4-[3-(дибутиламино)пропокси]бензоил-1-бензофуран-2-ил)пропаноата. В 70 мл метилэтилкетона вносят 4,54 г (13 ммоль) соединения, полученного на предыдущей стадии,2,95 г (1,1 эквивалента) 3-хлор-1-(дибутиламино)пропана и 2,16 г (1,2 эквивалента) карбоната калия. Смесь доводят до температуры дефлегмации в течение 6 ч, затем разбавляют водой и экстрагируют этилацетатом. Промывают насыщенным раствором хлорида натрия, а затем очищают посредством хроматографии на диоксиде кремния (элюент:гептан/этилацетат 5/5, дихлорметан/метанол 95/3, затем 90/10), что приводит к получению 6,65 г желаемого соединения в форме свободного основания. Берут пробу 2,32 г этого основания и вводят ее в метанол. Туда же добавляют 0,416 г щавелевой кислоты и проводят упаривание. Остаток растворяют в диэтиловом эфире и проводят выпаривание. Затем проводят очистку посредством кристаллизации из диэтилового эфира. Таким способом получают 2,4 г желаемого соединения. Выход: 87%. Т.пл.: 76-79 С. Спектр ЯМР: соответствует. Таким же способом, но используя хлороводородную кислоту вместо щавелевой кислоты, получают: Гидрохлорид метил-3-(4-3-[цис-3,5-диэтилпиперидинил]пропоксибензоил)-2-(3-метокси-3 оксопропил)-1-бензофуран-5-карбоксилата (пример 24). Выход: 81%. Т.пл.: 166-169 С (после кристаллизации из диэтилового эфира). Спектр ЯМР: соответствует. Пример 25. Оксалат 2-бутил-5-циано-3-[4-[3-(дибутиламино)пропокси]бензоил]-1-бензофурана. А. 2-Метокси-5-цианобензальдегид. Смесь 40,63 г 2-метокси-5-бромбензальдегида, 13,35 г цианида цинка и 8,7 г тетракис(трифенилфосфин)палладия в 240 мл дезоксигенированного N,N-диметилформамида нагревают под аргоном в течение 3 ч. Смесь оставляют стоять до достижения температуры окружающей среды и экстрагируют 600 мл толуола. После этого промывают дважды 600 мл 2 н. водного аммиака, а затем насыщенным раствором хлорида натрия. Затем проводят очистку посредством кристаллизации из диизопропилового эфира. Таким способом получают 30,2 г желаемого соединения. Выход: 99%. Т.пл.: 115-118 С. В. 2-Гидрокси-5-цианобензальдегид. В 500 мл N,N-диметилформамида вносят 31,08 г соединения, полученного на предыдущей стадии, и 24,52 г хлорида лития. Смесь доводят до температуры дефлегмации в течение 2 ч и выпаривают растворитель. Остаток растворяют в растворе гидросульфата калия и экстрагируют этилацетатом. Затем проводят промывку водой и насыщенным раствором хлорида натрия. Таким способом получают 24,5 г желаемого соединения. Выход: 86%.C. Метил-2-(2-формил-4-цианофенокси)гексаноат. В 400 мл N,N-диметилформамида помещают 24,5 г соединения, полученного на предыдущей стадии, 47,52 г метил-2-бромгексаноата и 28,8 г карбоната калия. Смесь нагревают при температуре около 80 С в течение 1,5 ч и растворитель выпаривают. Остаток растворяют в растворе гидросульфата калия и экстрагируют этилацетатом. Затем проводят промывку водой и насыщенным раствором хлорида натрия. Таким способом получают 53,6 г желаемого соединения в виде сырого продукта. Т.пл.: 77-79 С.D. 2-(2-Формил-4-цианофенокси)гексановая кислота. 53,6 г неочищенного соединения, полученного на предыдущей стадии, и 8,6 г гидроксида натрия вводят в 320 мл метанола, содержащего 200 мл диоксана и 160 мл воды. Смесь перемешивают в течение 1,5 ч при температуре окружающей среды и упаривают. Остаток растворяют в воде, содержащей концентрированную хлороводородную кислоту, и проводят экстракцию этилацетатом. Затем проводят промывку водой и насыщенным раствором хлорида натрия. Таким способом получают 52,1 г желаемого соединения в виде сырого продукта.E. 2-Бутил-5-циано-1 бензофуран. 47,66 г бензолсульфонилхлорида вводят в 100 мл толуола и добавляют 68,23 г триэтиламина в 50 мл толуола. Смесь нагревают до 80 С, а затем при температуре ниже 90 С по каплям добавляют 52,1 г соединения, полученного на предыдущей стадии, растворенного в 400 мл толуола. После завершения добавления нагревание продолжают в течение 0,5 ч, а затем смесь оставляют стоять до достижения температуры окружающей среды. Проводят промывку водой, и водную фазу экстрагируют толуолом. Объединенные органические фазы перемешивают со 100 мл 2 н. гидроксида натрия и разделяют посредством- 29005825 отстаивания. Проводят экстракцию толуолом и промывку водой, раствором бисульфата калия, водой и насыщенным раствором хлорида натрия. Затем осуществляют очистку посредством хроматографии на диоксиде кремния (элюент: дихлорметан). Таким способом получают 19,94 г желаемого соединения. Общий выход по 5 стадиям: 53%.F. 2-Бутил-5-циано-3-(4-метоксибензоил)-1-бензофуран. 32,43 г (2 эквивалента) хлорида железа (III) вводят в 200 мл дихлорэтана под аргоном. После этого при примерно 10 С добавляют 19,92 г соединения, полученного на предыдущей стадии, а затем при температуре между +10 и +15 С вводят 34,36 г (2 эквивалента) анизоилхлорида, растворенного в 200 мл дихлорэтана. Смесь оставляют стоять до достижения температуры окружающей среды и перемешивают при этой температуре в течение 16 ч. Ее выливают на смесь лед/вода, и проводят фильтрацию через фильтр из пористого стекла. Фильтрат разделяют посредством отстаивания, водную фазу экстрагируют дихлорметаном, и органические фазы смешивают. Проводят промывку разбавленным раствором бикарбоната натрия, водой и насыщенным раствором хлорида натрия. Затем осуществляют очистку посредством хроматографии на диоксиде кремния (элюент:дихлорметан). Таким способом получают 24,87 г желаемого соединения. Выход: 74,5%.G. 2-Бутил-5-циано-3-(4-гидроксибензоил)-1-бензофуран. В 200 мл толуола вводят 16,27 г соединения, полученного на предыдущей стадии, и 19,9 г хлорида алюминия. Смесь нагревают при 60 С в течение 2 ч, и толуол отделяют посредством отстаивания. Остаток растворяют в тетрагидрофуране и добавляют смесь вода/лед. Смесь перемешивают в течение 1 ч и разделяют посредством отстаивания, и водную фазу экстрагируют этилацетатом. Затем 3 органические фазы смешивают и промывают водой и раствором хлорида натрия. Затем осуществляют очистку посредством кристаллизации из гептана. Таким способом получают 14,05 г желаемого соединения. Выход: 90%. Т.пл.: 152-153 С. Н. Оксалат 2-бутил-5-циано-3-[4-[3-(дибутиламино)пропокси]бензоил]-1-бензофурана. В 30 мл метилэтилкетона вводят 2,02 г соединения, полученного на предыдущей стадии, 1,45 г 3 хлор-1-(дибутиламино)пропана и 1,06 г карбоната калия. Смесь доводят до температуры дефлегмации в течение 6 часов и добавляют воду. Смесь разделяют посредством отстаивания, и водную фазу экстрагируют этилацетатом. Объединенные водные фазы промывают насыщенным раствором хлорида натрия и экстрагируют этилацетатом. Затем осуществляют очистку посредством хроматографии на оксиде алюминия (элюент: гептан/этилацетат 95/5), что приводит к получению желаемого соединения в форме свободного основания (2,25 г; выход 72%). Затем смешивают 1,86 г этого основания и 0,343 г щавелевой кислоты, растворенной в метаноле. Смесь упаривают и добавляют диэтиловый эфир. Смесь перемешивают в течение нескольких часов, фильтруют и промывают диэтиловым эфиром. Затем оставляют кристаллизоваться. Таким способом получают 2,11 г желаемого соединения. Выход: 96%. Т.пл.: 85-87 С. Спектр ЯМР: соответствует. Пример 26. Метил-3-[(2-бутил-3-4-[3-(неопентиламино)пропокси]бензоил-1-бензофуран-5-ил) карбонил]амино)пропаноат.A. Метил-2-бутил-3-4-[3-[(N-неопентил-N-трет-бутоксикарбонил)]амино]пропокси]бензоил-1 бензофуран-5-карбоксилат. В 100 мл хлороформа вводят 8,57 г (18 ммоль) 2-бутил-3-4-[3-(неопентиламино]пропокси]бензоил-5-метоксикарбонилбензофурана и 4,29 г (1,1 эквивалента) ангидрида трет-бутоксикарбоновой кислоты. Смесь доводят до температуры дефлегмации в течение 3 ч, а затем выпаривают. Таким способом получают желаемое соединение в неочищенном виде.B. 2-Бутил-3-(4-[3-[(N-неопентил-N-трет-бутоксикарбонил)]амино]пропокси]бензоил]-1-бензофуран-5-карбоновая кислота. Неочищенный продукт, полученный на предыдущей стадии, растворяют в 200 мл диоксана, содержащего 40 мл метанола и 40 мл воды. Добавляют 1,45 г (приблизительно 2 эквивалента) гидроксида натрия, и эту смесь затем перемешивают при температуре окружающей среды в течение 48 ч. Проводят упаривание, остаток растворяют в воде и для подкисления используют раствор гидросульфата калия. Проводят экстракцию этилацетатом и промывку водой и насыщенным раствором хлорида натрия. Таким способом получают 11,23 г желаемого соединения в форме неочищенного продукта. Выход: 100%. С. Метил-3-[(2-бутил-3-4-[3-[(N-неопентил-N-трет-бутоксикарбонил)амино]пропокси]бензоил 1-бензофуран-5-ил)карбонил]аминопропаноат. 7,48 г неочищенного продукта, полученного на предыдущей стадии, 2 г (1,1 эквивалента) гидрохло- 30
МПК / Метки
МПК: C07D 307/84, C07D 407/04, C07D 405/04, A61K 31/41
Метки: получения, способ, производные, аминоалкоксибензоилбензофурана, содержащие, композиции
Код ссылки
<a href="https://eas.patents.su/30-5825-proizvodnye-aminoalkoksibenzoilbenzofurana-sposob-ih-polucheniya-i-soderzhashhie-ih-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные аминоалкоксибензоилбензофурана, способ их получения и содержащие их композиции</a>
Предыдущий патент: Соединения, эффективные в качестве агонистов &beta- 2 – адренорецептора и ингибиторов фосфодиэстеразы pde4
Следующий патент: Передача речевой информации через цифровую абонентскую линию со встроенным речевым шлюзовым модулем
Случайный патент: Способы и композиции для удаления примесей и воды из способа байера












