Производные бензоимидазола, используемые в качестве антипролиферативного средства
Номер патента: 5407
Опубликовано: 24.02.2005
Авторы: Барт Уэйн Эрнест, Луццио Майкл Джозеф, Лиссикатос Джозеф Петер
Формула / Реферат
1. Соединение формулы
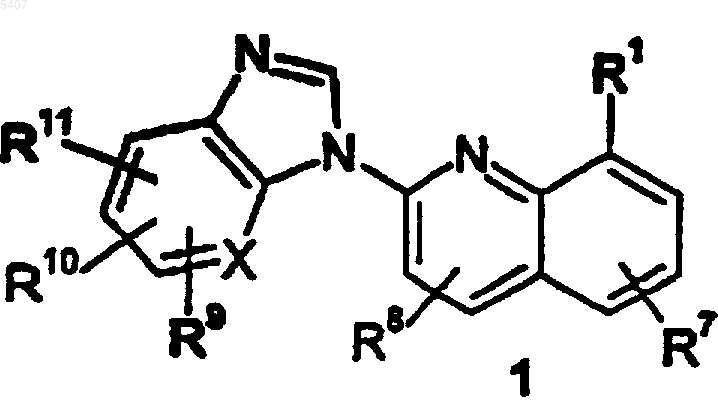
и его фармацевтически приемлемая соль, пролекарство или сольват,
где X означает CH или N;
R1 выбран из -(CR4R5)tC(O)OR3, -(CR4R5)tC(O)NR3R4, -(CR4R5)tOR3, -(CR4R5)tC(O)(C3-C10циклоалкил), -(CR4R5)tC(O)(C6-C10арил), -(CR4R5)tC(O)(5-6-членный полностью насыщенный или ароматический гетероциклический радикал, содержащий 1 или 2 атома, выбранных из N или O), -(CR4R5)t(C3-C10циклоалкил), -(CR4R5)t(C6-C10арил) и -(CR4R5)t(5-6-членный полностью насыщенный или ароматический гетероциклический радикал, содержащий 1 или 2 атома, выбранных из N или O), где каждый t независимо означает целое число от 0 до 5; указанные циклоалкильные, арильные и гетероциклические R1 группы необязательно конденсированы с бензольным кольцом, C5-C8циклоалкильной группой или 5-6-членной полностью насыщенной или ароматической гетероциклической группой, содержащей 1 или 2 атома, выбранных из N или O; -(CR4R5)t фрагменты указанных выше R1 групп необязательно включают двойную углерод-углеродную или тройную связь, где t означает целое число между 2 и 5; каждая из указанных выше R1 групп необязательно замещена 1 или 2 группами, независимо выбранными из -NR3R4, -OR3, C1-C10алкила, C2-C10алкенила и C2-C10алкинила, где указанные алкильные, алкенильные и алкинильные группы замещены 1 или 2 группами, независимо выбранными из -NR3R4 и -OR3; и указанные выше R1 группы необязательно замещены 1-3 R2 группами;
каждый R2 независимо выбран из H, C1-C10алкила, C2-C10алкенила, C2-C10алкинила, C3-C10циклоалкила, оксо, галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -OR3, -C(O)R3, -C(O)OR3, -NR4C(O)OR6, -OC(O)R3, -NR4SO2R6, -SO2NR3R4, -NR4C(O)R3, -C(O)NR3R4, -NR5C(O)NR3R4, -NR3R4, -S(O)j(CR4R5)m (C6-C10арил), -S(O)j(C1-C6алкил), где j означает целое число от 0 до 2, -(CR4R5)m(C6-C10арил), -O(CR4R5)m(C6-C10арил), -NR4(CR4R5)m(C6-C10арил), -O(CR4R5)m(5-6-членный полностью насыщенный или ароматический гетероцикл, содержащий 1 или 2 атома, выбранных из N или O), -NR4(CR4R5)m(5-6-членный полностью насыщенный или ароматический гетероцикл, содержащий 1 или 2 атома, выбранных из N или O), -(CR4R5)m(5-6-членный полностью насыщенный или ароматический гетероциклический радикал, содержащий 1 или 2 атома, выбранных из N или O) и -(CR4R5)m(C3-C10циклоалкил), где каждый m независимо означает целое число от 0 до 4; указанные алкильные, алкенильные и алкинильные группы необязательно содержат 1 или 2 гетерогруппы, выбранные из O, -S(O)j-, где j означает целое число от 0 до 2, и -N(R3)-, при условии, что два атома O, два атома S или атом O и атом S не соединены непосредственно друг с другом, и при условии, что атом O, атом S или атом N не соединены непосредственно с тройной связью или неароматической двойной связью; указанные циклоалкильные, арильные и гетероциклические R2 группы необязательно конденсированы с C6-C10арильной группой, C5-C8циклоалкильной группой или 5-6-членной полностью насыщенной или ароматической гетероциклической группой, содержащей 1 или 2 атома, выбранных из N или O; и указанные алкильные, циклоалкильные, арильные и гетероциклические R2 группы необязательно замещены 1-5 заместителями, независимо выбранными из: оксо(=O), галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -NR4SO2R6, -SO2NR3R4, -C(O)R3, -C(O)OR3, -OC(O)R3, -NR4C(O)OR6, -NR4C(O)R3, -C(O)NR3R4, -NR3R4, -OR3, C1-C10алкила, -(CR4R5)m(C6-C10арил) и -(CR4R5)m(5-6-членный полностью насыщенный или ароматический гетероциклический радикал, содержащий 1 или 2 атома, выбранных из N или O), где каждый m независимо означает целое число в пределах от 0 до 4;
каждый R3 независимо выбран из H, C1-C10алкила, -(CR4R5)m(C6-C10арил) и -(CR4R5)m(5-6-членный полностью насыщенный или ароматический гетероциклический радикал, содержащий 1 или 2 атома, выбранных из N или O), где каждый m независимо означает целое число от 0 до 4; указанная алкильная группа необязательно включает 1 или 2 гетерогруппы, выбранные из O, -S(O)j-, где j означает целое число в пределах от 0 до 2, и -N(R4)-, при условии, что два атома O, два атома S или атом O и атом S не соединены непосредственно друг с другом; указанные циклоалкильные, арильные и гетероциклические R3 группы необязательно конденсированы с C6-C10арильной группой, C5-C8циклоалкильной группой или 5-6-членной полностью насыщенной или ароматической гетероциклической группой, содержащей 1 или 2 атома, выбранных из N или O; и указанные выше R3 заместители, за исключением H, необязательно замещены 1-5 заместителями, независимо выбранными из оксо, галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -C(O)R4, -C(O)OR4, -OC(O)R4, -NR4C(O)R5, -C(O)NR4R5, -NR4R5, гидрокси, C1-C6алкила и C1-C6алкокси;
каждый R4 и R5 независимо означает H или C1-C6алкил; или,
когда R4 и R5 присоединены к одному и тому же атому углерода или азота, R4 и R5 вместе с указанным углеродом или азотом могут образовывать 4-10-членный карбоцикл или 5-6-членный гетероцикл;
каждый R6 выбран из заместителей, указанных в определении R3, за тем исключением, что R6 не означает H;
каждый R7, R8, R9, R10 и R11 независимо выбран из заместителей, указанных в определении R2.
2. Соединение по п.1, где R1 означает C6-C10арил или 5-6-членный полностью насыщенный или ароматический гетероциклический радикал, содержащий 1 или 2 атома, выбранных из N или O, где каждая из указанных выше R1 групп замещена 1 или 2 группами, независимо выбранными из -NR3R4, -OR3 и C1-C3алкила, где указанные алкильные группы замещены 1 или 2 группами, независимо выбранными из -NR3R4 ш -OR3; и указанные выше R1 группы необязательно замещены 1-3 R2 группами;
каждый R2 независимо выбран из H, C1-C10алкила, C3-C10циклоалкила, оксо(=O), -OR3, -C(O)R3, -C(O)OR3, -NR4C(O)R3, -C(O)NR3R4, -NR3R4, -NR4SO2R6, -SO2NR3R4, -(CR4R5)m(5-6-членный полностью насыщенный или ароматический гетероциклический радикал, содержащий 1 или 2 атома, выбранных из N или O) и (CR4R5)m(C3-C10циклоалкил); и указанные алкильные группы необязательно содержат 1 или 2 гетерогруппы, выбранные из O, -S(O)j-, где j означает целое число от 0 до 2, и -N(R3)-, при условии, что два атома O, два атома S или атом O и атом S не соединены непосредственно друг с другом; и указанные алкильные и циклоалкильные R2 группы необязательно замещены 1-5 заместителями, независимо выбранными из оксо, циано, трифторметила, трифторметокси, -NR4SO2R6, -SO2NR3R4, -C(O)R3, -C(O)OR3, -NR4C(O)OR6, -NR4C(O)R3, -C(O)NR3R4, -NR3R4, -OR3 и C1-C10алкила, где каждый m независимо означает целое число в пределах от 0 до 4.
3. Соединение по п.1, где R1 означает пиперидинил, пиперазинил или фенил, где указанные R1 группы замещены -NR3R4, оксо(=O), -OR3 и C1-C3алкилом, где указанные алкильные группы замещены 1 или 2 группами, выбранными из -NR3R4 и -OR3; и указанные выше R1 группы необязательно замещены 1-3 R2 группами.
4. Соединение по п.2, где указанные R1 группы замещены -NR3R4, оксо(=O), OR3 или C1-C3алкилом, где указанные алкильные группы необязательно замещены -NR3R4.
5. Соединение по п.1, где указанный R1 означает фенил, замещенный пирролидин-1-илом, где указанный пирролидин-1-ил необязательно замещен 1-3 заместителями, независимо выбранными из оксо, циано, трифторметила, трифторметокси, -NR4SO2R6, -SO2NR3R4, -C(O)R3, -C(O)OR3, -NR4C(O)OR6, -NR4C(O)R3, -C(O)NR3R4, -NR3R4, -OR3 и C1-C10алкила; и R11 означает -OR3.
6. Соединение по п.5, где R1 означает 4-пирролидин-1-илметилфенил, необязательно замещенный 1-3 заместителями, независимо выбранными из оксо, циано, трифторметила, трифторметокси, -NR4SO2R6, -SO2NR3R4, -C(O)R3, -C(O)OR3, -NR4C(O)OR6, -NR4C(O)R3, -C(O)NR3R4, -NR3R4, -OR3 и C1-C10алкила; и R11 означает -OR3.
7. Соединение по п.6, где R11 присоединен в положение 5 бензимидазольного фрагмента соединения формулы 1 и означает -OR3.
8. Соединение по п.7, где R11 присоединен в положение 5 бензимидазольного фрагмента соединения формулы 1 и означает 2-метоксиэтокси.
9. Соединение по п.1, где R1 означает пирролидин-1-ил или пиперидин-1-ил, указанный R1 необязательно замещен 1-3 заместителями, независимо выбранными из оксо, циано, трифторметила, трифторметокси, -NR4SO2R6, -SO2NR3R4, -C(O)R3, -C(O)OR3, -NR4C(O)OR6, -NR4C(O)R3, -C(O)NR3R4, -NR3R4, -OR3 и C1-C10алкила.
10. Соединение по п.9, где R1 означает пирролидин-1-ил или пиперидин-1-ил, замещенный -NR3R4 и необязательно замещенный 1-2 заместителями, независимо выбранными из оксо, циано, трифторметила, трифторметокси, -NR4SO2R6, -SO2NR3R4, -C(O)R3, -C(O)OR3, -NR4C(O)OR6, -NR4C(O)R3, -C(O)NR3R4, -NR3R4, -OR3 и C1-C10алкила; и R11 означает -OR3.
11. Соединение по п.10 или 9, где R11 присоединен в положение 5 бензимидазольного фрагмента соединения формулы 1 и означает -OR3 и R9 и R10 оба означают H.
12. Соединение по п.10 или 9, где R11 присоединен в положение 5 бензимидазольного фрагмента соединения формулы 1 и означает 2-метоксиэтокси и R9 и R10 оба означают H.
13. Соединение по п.1, где R9 означает -C(O)R3, где R3 означает пирролидин-1-ил или азетидин-1-ил, где указанные R3 группы необязательно замещены 1-3 заместителями, независимо выбранными из оксо, галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -C(O)R4, -C(O)OR4, -OC(O)R4, -NR4C(O)R5, -C(O)NR4R5, -NR4R5, гидрокси, C1-C6алкила и C1-C6алкокси.
14. Соединение по п.1, выбранное из группы, включающей
(1) 1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(2) 1-[8-(4-аминопиперидин-1-ил)хинолин-2-ил]-1H-бензоимидазол-5-ол;
(3) 1-{2-[5-(пиридин-2-илметокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(4) {1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ил}диметиламин;
(5) {4-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]бензил}метиламин;
(6) {4-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]бензил}диметиламин;
(7) циклопропил-{4-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]бензил}амин;
(8) трет-бутил-{4-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]бензил}амин;
(9) 4-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]бензиламин;
(10) 1-[2-(5-этоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(11) {1-[2-(5-этоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ил}диметиламин;
(12) 1-[2-(5-трифторметоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(13) {4-[2-(5-этоксибензоимидазол-1-ил)хинолин-8-ил]бензил}метиламин;
(14) циклопропил-{4-[2-(5-этоксибензоимидазол-1-ил)хинолин-8-ил]бензил}амин;
(15) трет-бутил-{4-[2-(5-этоксибензоимидазол-1-ил)хинолин-8-ил]бензил}амин;
(16) {4-[2-(5-этоксибензоимидазол-1-ил)хинолин-8-ил]бензил}диметиламин;
(17) 1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-он;
(18) 1-[2-(5-этоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-он;
(19) 1-[2-(5-этоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ол;
(20) трет-бутил-{1-[2-(5-этоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ил}амин;
(21) {1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ил}метиламин;
(22) 2-(5-метоксибензоимидазол-1-ил)-8-(1-окса-6-азаспиро[2.5]окт-6-ил)хинолин;
(23) 4-диметиламинометил-1-[2-(5-метоксибензоимидазол-1-ил) хинолин-8-ил]пиперидин-4-ол;
(24) 1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]-4-метиламинометилпиперидин-4-ол;
(25) 4-аминометил-1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ол;
(26) 1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пирролидин-3-иламин;
(27) 1-(2-бензоимидазол-1-илхинолин-8-ил)пиперидин-4-иламин;
(28) 1-(2-имидазю[4,5-b]пиридин-3-илхинолин-8-ил)пиперидин-4-иламин;
(29) 1-{2-[5-(4-метоксифенил)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(30) 1-[2-(5-циклопропилметоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(31) 1-{2-[5-(3-диметиламинопропокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(32) 1-{2-[5-(3-аминопропокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(33) 1-{2-[5-(2-диметиламиноэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(34) 1-{2-[5-(пиридин-4-илметокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(35) 1-[2-(5-бензилоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(36) 1-{2-[5-(пиридин-3-илметокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(37) 1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(38) этиловый эфир 1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-карбоновой кислоты;
(39) 1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-карбоновая кислота;
(40) 4-диметиламинометил-1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ол;
(41) N-{1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ил}ацетамид;
(42) N-{1-[2-(5-циклопропилметоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ил}ацетамид;
(43) 1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ол;
(44) {1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ил}мочевина;
(45) 4-аминометил-1-{2-[5-(пиридин-2-илметокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ол;
(46) циклопропил-(1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ил)амин;
(47) (1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ил)диметиламин;
(48) (1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ил)метиламин;
(49) (1-{2-[5-(3-диметиламинопропокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ил)диметиламин;
(50) {1-[2-(5-циклопропилметоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ил}метиламин;
(51) {1-[2-(5-циклопропилметоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ил}диметиламин;
(52) 2-амино-N-(1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ил)ацетамид;
(53) (S)-2-амино-N-(l-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ил)пропионамид;
(54) (R)-2-амино-N-(l-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ил)пропионамид;
(55) 2-амино-N-(l-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ил)изобутирамид;
(56) 1-(1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламино)-2-метилпропан-2-ол;
(1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ил)пиридин-2-илметиламин;
(58) (1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ил)пиридин-3-илметиламин;
(59) 4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}фенол;
(60) [2-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}фенокси)этил]диметиламин;
(61) 2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]-8-пиперазин-1-илхинолин;
(62) [2-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперазин-1-ил)этил]диметиламин;
(63) 2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]-8-(4-пиридин-2-илметилпиперазин-1-ил)хинолин;
(64) 2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]-8-(4-пиридин-3-илметилпиперазин-1-ил)хинолин;
(65) 2-амино-1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперазин-1-ил)-2-метилпропан-1-он;
(66) (S)-2-амино-1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперазин-1-ил)пропан-1-он;
(67) (R)-2-амино-1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперазин-1-ил)пропан-1-он;
(68) 2-амино-1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперазин-1-ил)этанон;
(69) (1-аминоциклопропил)-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперазин-1-ил)метанон;
(70) 2-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперазин-1-ил)этиламин;
(71) (R)-2-амино-3-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперазин-1-ил)пропан-1-ол;
(72) 3-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}-3-азабицикло[3.1.0]гекс-6-иламин;
(73) (S)-1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пирролидин-3-иламин;
(74) (R)-1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пирролидин-3-иламин;
(75) 2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]-8-пиридин-3-илхинолин;
(76) 2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]-8-(6-метоксипиридин-3-ил)хинолин;
(77) метиловый эфир 4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензойной кислоты;
(78) 1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}-4-метилпиперидин-4-иламин;
(79) 1-[2-(6,7-дигидро-5,8-диокса-1,3-диазациклопента[b]нафталин-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(80) 2-{1-[8-(4-аминопиперидин-1-ил)хинолин-2-ил]-1H-бензоимидазол-5-илокси}этанол;
(81) 4-циклопропиламинометил-1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ол;
(82) диметиламид 1-[8-(4-аминопиперидин-1-ил)хинолин-2-ил]-1H-бензоимидазол-5-сульфоновой кислоты;
(83) 1-[2-(6-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(84) 1-[2-(5,6-диметоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(85) 2-диметиламино-1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперазин-1-ил)этанон;
(86) 1-[2-(5-бензилоксибензоимидазол-1-ил)хинолин-8-ил]-4-метилпиперидин-4-ол;
(87) (4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)диметиламин;
(88) (4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)метиламин;
(89) 2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]-8-(4-морфолин-4-илметилфенил)хинолин;
(90) 2-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензиламино)этанол;
(91) 4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензиламин;
(92) 2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]-8-(4-пирролидин-1-илметилфенил)хинолин;
(93) 2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]-8-(4-пирролидин-1-илметилфенил)хинолин;
(94) 2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]-8-(4-пирролидин-1-илметилфенил)хинолин;
(95) 1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)цис-пирролидин-3,4-диол;
(96) R,R-(1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)транс-пирролидин-3,4-диол);
(97) 1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)пирролидин-3-ол;
(98) R-(1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)пирролидин-3-ол);
(99) S-(1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)пирролидин-3-ол);
(100) 1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)азетидин-3-ол;
(101) 2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]-8-[4-(4-метилпиперазин-1-илметил)фенил]хинолин;
(102) трет-бутиловый эфир 4-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)пиперазин-1-карбоновой кислоты;
(103) трет-бутиловый эфир [1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)пиперидин-4-ил]карбаминовой кислоты;
(104) 1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)пиперидин-4-иламин;
(105) (1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ил)метанол;
(106) (1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-илметил)метиламин;
(107) 2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]-8-[4-(4-метилпиперазин-1-илметил)пиперидин-1-ил]хинолин;
(108) (1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-илметил)диметиламин;
(109) 1-(1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-илметил)пирролидин-3-ол;
(110) C-(1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ил)метиламин;
(111) 1-{2-[5-(2-диметиламиноэтокси)бензоимидазол-1-ил]хинолин-8-ил}-4-метилпиперидин-4-ол;
(112) 1-{2-[5-(2-диметиламиноэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ол;
(113) S,S-(1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)транс-пирролидин-3,4-диол);
(114) 4-{2-[5-(3-аминопропокси)бензоимидазол-1-ил]хинолин-8-ил}фенол;
(115) 4-{2-[5-(3-диметиламинопропокси)бензоимидазол-1-ил]хинолин-8-ил}фенол;
(116) 1-[2-(5-фенилбензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(117) 1-[2-(5-пиридин-4-илбензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(118) 1-{2-[5-(3-метоксифенил)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(119) 1-[2-(5-пиридин-3-илбензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(120) 1-{2-[5-(6-метоксипиридин-3-ил)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(121) 1-{2-[5-(4-аминометилфенил)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(122) метиловый эфир 4-{1-[8-(4-аминопиперидин-1-ил)хинолин-2-ил]-1H-бензоимидазол-5-ил}бензойной кислоты;
(123) 4-{1-[8-(4-аминопиперидин-1-ил)хинолин-2-ил]-1H-бензоимидазол-5-ил}фенол;
(124) метиловый эфир 2-(5-метоксибензоимидазол-1-ил)хинолин-8-карбоновой кислоты;
(125) метиловый эфир 2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-карбоновой кислоты;
(126) (2-диметиламиноэтил)амид 2-(5-метоксибензоимидазол-1-ил)хинолин-8-карбоновой кислоты;
(127) метиловый эфир 2-(5-циклопропилметоксибензоимидазол-1-ил)хинолин-8-карбоновой кислоты;
(128) [2-(5-циклопропилметоксибензоимидазол-1-ил)хинолин-8-ил]пирролидин-1-илметанон;
(129) [2-(5-циклопропилметоксибензоимидазол-1-ил)хинолин-8-ил]морфолин-4-илметанон;
(130) [2-(5-циклопропилметоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-1-илметанон;
(131) (3-аминопирролидин-1-ил)-[2-(5-циклопропилметоксибензоимидазол-1-ил)хинолин-8-ил]метанон;
(132) 8-аллилокси-2-(5-метоксибензоимидазол-1-ил)хинолин;
(133) {2-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-илокси]этил}метиламин;
(134) {2-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-илокси]этил}диметиламин;
(135) 2-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-илокси]этиламин;
(136) тригидрохлорид 1-[[2-[5-(3-морфолиноэтокси)-1H-бензимидазол-1-ил]хинолин-8-ил]]пиперидин-4-иламина;
(137) 1-[[2-[5-(3-морфолиноэтокси)-1H-бензимидазол-1-ил]хинолин-8-ил]]пиперидин-4-иламинтригидрохлорид;
(138) 5-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}[1,3,4]оксадиазол-2-иламин;
(139) этил 1-[8-(4-аминопиперидин-1-ил)хинолин-2-ил]бензимидазол-5-карбоксилат;
(140) 1-[8-(4-аминопиперидин-1-ил)хинолин-2-ил]бензимидазол-5-карбоновая кислота;
(141) N-(4-морфолино)этил-1-[8-(4-аминопиперидин-1-ил)хинолин-2-ил]бензимидазол-5-карбоксамид;
(142) 4-{1-[8-(4-аминопиперидин-1-ил)хинолин-2-ил]-1H-бензоимидазол-5-ил}бензальдегид;
(143) 1-{2-[5-(4-метиламинометилфенил)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(144) 1-{2-[5-(4-диметиламинометилфенил)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(145) 1-(2-{5-[2-(2-метилимидазол-1-ил)этокси]бензоимидазол-1-ил}хинолин-8-ил)пиперидин-4-иламин и
(146) 1-(2-{5-(2-[1,2,4]триазол-1-илэтокси)бензоимидазол-1-ил}хинолин-8-ил)пиперидин-4-иламин,
и фармацевтически приемлемые соли, пролекарства и сольваты указанных выше соединений.
15. Соединение по п.1, выбранное из группы, включающей
(1) 1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(2) 1-[8-(4-аминопиперидин-1-ил)хинолин-2-ил]-1H-бензоимидазол-5-ол;
(3) 1-{2-[5-(пиридин-2-илметокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(4) {1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ил}диметиламин;
(5) {4-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]бензил}метиламин;
(6) {4-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]бензил}диметиламин;
(10) 1-[2-(5-этоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(11) {1-[2-(5-этоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ил}диметиламин;
(13) {4-[2-(5-этоксибензоимидазол-1-ил)хинолин-8-ил]бензил}метиламин;
(16) {4-[2-(5-этоксибензоимидазол-1-ил)хинолин-8-ил]бензил}диметиламин;
(21) {1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ил}метиламин;
(23) 4-диметиламинометил-1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ол;
(24) 1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]-4-метиламинометилпиперидин-4-ол;
(25) 4-аминометил-1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ол;
(29) 1-{2-[5-(4-метоксифенил)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(30) 1-[2-(5-циклопропилметоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(31) 1-{2-[5-(3-диметиламинопропокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(32) 1-{2-[5-(3-аминопропокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(33) 1-{2-[5-(2-диметиламиноэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(34) 1-{2-[5-(пиридин-4-илметокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(35) 1-[2-(5-бензилоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(36) 1-{2-[5-(пиридин-3-илметокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(37) 1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(40) 4-диметиламинометил-1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ол;
(45) 4-аминометил-1-{2-[5-(пиридин-2-илметокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ол;
(47) 1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ил)диметиламин;
(48) 1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ил)метиламин;
(49) (1-{2-[5-(3-диметиламинопропокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-илдиметиламин;
(50) {1-[2-(5-циклопропилметоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ил}метиламин;
(51) {1-[2-(5-циклопропилметоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-ил}диметиламин;
(1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ил)пиридин-2-илметиламин;
(58) (1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ил)пиридин-3-илметиламин;
(59) 4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}фенол;
(60) [2-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}фенокси)этил]диметиламин;
(61) 2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]-8-пиперазин-1-илхинолин;
(62) [2-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперазин-1-ил)этил]диметиламин;
(65) 2-амино-1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперазин-1-ил)-2-метилпропан-1-он;
(66) (S)-2-амино-1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперазин-1-ил)пропан-1-он;
(67) (S)-2-амино-1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперазин-1-ил)пропан-1-он;
(68) 2-амино-1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперазин-1-ил)этанон;
(70) 2-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперазин-1-ил)этиламин;
(72) 3-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}-3-азабицикло[3.1.0]гекс-6-иламин;
(74) 1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}-4-метилпиперидин-4-иламин;
(79) 1-[2-(6,7-дигидро-5,8-диокса-1,3-диазациклопента[b]нафталин-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(80) 2-{1-[8-(4-аминопиперидин-1-ил)хинолин-2-ил]-1H-бензоимидазол-5-илокси}этанол;
(84) 1-[2-(5,6-диметоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(87) (4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)диметиламин;
(88) (4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)метиламин;
(90) 2-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензиламино)этанол;
(91) 4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензиламин;
(92) 2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]-8-(4-пирролидин-1-илметилфенил)хинолин;
(93) 2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]-8-(4-пирролидин-1-илметилфенил)хинолин;
(94) 2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]-8-(4-пирролидин-1-илметилфенил)хинолин;
(95) 1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)цис-пирролидин-3,4-диол;
(96) R,R-(l-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)транс-пирролидин-3,4-диол);
(97) 1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)пирролидин-3-ол;
(98) R-(1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)пирролидин-3-ол);
(99) S-(1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)пирролидин-3-ол);
(100) 1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)азетидин-3-ол;
(101) 2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]-8-[4-(4-метилпиперазин-1-илметил)фенил]хинолин;
(103) 1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)пиперидин-4-иламин;
(105) (1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ил)метанол;
(106) (1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-илметил)метиламин;
(107) 2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]-8-[4-(4-метилпиперазин-1-илметил)пиперидин-1-ил]хинолин;
(108) (1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-илметил)диметиламин;
(110) C-(1-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-ил)метиламин;
(113) S,S-(1-(4-{2-[5-(2-метоксиэтокси)бензоимидазол-1-ил]хинолин-8-ил}бензил)транс-пирролидин-3,4-диол);
(115) 4-{2-[5-(3-диметиламинопропокси)бензоимидазол-1-ил]хинолин-8-ил}фенол;
(116) 1-[2-(5-фенилбензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(117) 1-[2-(5-пиридин-4-ил-бензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(118) 1-{2-[5- (3-метоксифенил)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(119) 1-[2-(5-пиридин-3-илбензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин;
(120) 1-{2-[5-(6-метоксипиридин-3-ил)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(121) 1-{2-[5-(4-аминометилфенил)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(122) метиловый эфир 4-{1-[8-(4-аминопиперидин-1-ил)хинолин-2-ил]-1H-бензоимидазол-5-ил}бензойной кислоты;
(123) 4-{1-[8-(4-аминопиперидин-1-ил)хинолин-2-ил]-1H-бензоимидазол-5-ил}фенол;
(136) тригидрохлорид 1-[[2-[5-(3-морфолиноэтокси)-1H-бензимидазол-1-ил]хинолин-8-ил]]пиперидин-4-иламина;
(139) этил 1-[8-(4-аминопиперидин-1-ил)хинолин-2-ил]бензимидазол-5-карбоксилат;
(141) N-(4-морфолино)этил-1-[8-(4-аминопиперидин-1-ил)хинолин-2-ил]бензимидазол-5-карбоксамид;
(143) 1-{2-[5-(4-метиламинометилфенил)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(144) 1-{2-[5-(4-диметиламинометилфенил)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин;
(145) 1-(2-{5-[2-(2-метилимидазол-1-ил)этокси]бензоимидазол-1-ил}хинолин-8-ил)пиперидин-4-иламин и
(146) 1-{2-[5-(2-[1,2,4]триазол-1-илэтокси)бензоимидазол-1-ил]хинолин-8-ил}пиперидин-4-иламин
и фармацевтически приемлемые соли, пролекарства и сольваты указанных выше соединений.
16. Фармацевтическая композиция для лечения аномального роста клеток у млекопитающих, включающая соединение по п.1, эффективное для лечения аномального роста клеток, и фармацевтически приемлемый носитель.
17. Фармацевтическая композиция по п.16, где указанный аномальный рост клеток означает рак.
Текст
005407 Уровень техники Настоящее изобретение относится к новым производным бензимидазола, полезным при лечении аномального роста клеток, таких как раковые, у млекопитающих. Настоящее изобретение относится также к способу применения указанных соединений для лечения аномального роста клеток у млекопитающих, в особенности человека, и фармацевтическим композициям, содержащим указанные соединения. Известно, что клетка может становиться раковой путем трансформации части ее ДНК в онкоген(т.е. ген, который при активации приводит к образованию злокачественных опухолевых клеток). Многие белки, кодирующие онкогены, такие как аберрантные тирозинкиназы, способны вызывать трансформацию клеток. Альтернативно, сверхэкспрессия нормальной протоонкогенной тирозинкиназы может также вызывать пролиферативные нарушения, иногда приводя к злокачественному фенотипу. Рецепторные тирозинкиназы являются ферментами, которые соединяют клеточную мембрану и обладают внеклеточным доменом связывания факторов роста, таких как эпидермальный фактор роста,трансмембранным доменом и внутриклеточной частью, которая функционирует как киназа по отношению к фосфорилат-специфическим остаткам тирозина в белках и, таким образом, влияют на клеточную пролиферацию. Другие рецепторные тирозинкиназы включают c-erbB-2, c-met, tie-2, PDGFr, FGFr иVEGFR. Известно, что указанные киназы часто аберрантно экспрессированы в обычных раковых опухолях человека, таких как карцинома молочной железы, раковых опухолях желудочно-кишечного тракта,таких как карцинома толстой кишки, прямой кишки или желудка, лейкоз и овариальная, бронхиальная карцинома или карцинома поджелудочной железы. Показано также, что рецептор эпидермального фактора роста (EGFR), обладающий активностью тирозинкиназы, является мутированным и/или сверхэкспрессированным во многих раковых опухолях человека, таких как опухоли головного мозга, легких,сквамозных клеток, мочевого пузыря, желудка, молочной железы, головы и шеи, пищевода, гинекологические опухоли и опухоли щитовидной железы. Таким образом, установлено, что ингибиторы рецепторных тирозинкиназ полезны в качестве селективных ингибиторов роста раковых клеток млекопитающих. Например, эрбстатин, ингибитор тирозинкиназы, селективно ослабляет рост трансплантированной голым мышам без вилочковой железы человеческой карциномы молочной железы, которая экспрессирует тирозинкиназу с рецептором эпидермального фактора роста (EGFR), но не действует на рост другой карциномы, которая не экспрессирует EGF рецептор. Таким образом, соединения по настоящему изобретению, которые являются селективными ингибиторами некоторых рецепторных тирозинкиназ, в частности PDGFr, полезны при лечении аномального роста клеток, в частности раковой опухоли, у млекопитающих. Показано также, что различные другие соединения, такие как производные стирола, обладают способностями ингибировать тирозинкиназу. Позднее было опубликовано пять патентных заявок, а именно ЕР 0566226 А 1 (опубликована 20 октября 1993 г.), ЕР 0602851 А 1 (опубликована 22 июня 1994 г.), ЕР 0635507 А 1 (опубликована 25 января 1995 г.), ЕР 0635498 А 1 (опубликована 25 января 1995 г.) и ЕР 0520722 А 1 (опубликована 30 декабря 1992 г.), относящихся к некоторым бициклическим производным,в частности производным хиназолина, как обладающим противораковыми свойствами, вытекающими из их ингибирующих способностей в отношении тирозинкиназ. Также международная патентная заявка WO 92/20642 (опубликована 26 ноября 1992 г.) относится к некоторым бис-моно- и бициклическим арильным и гетероарильным соединениям, являющимся ингибиторами тирозинкиназ, полезных для ингибирования аномальной пролиферации клеток. Международные патентные заявки WO 96/16960 (опубликована 6 июня 1996 г.), WO 96/09294 (опубликована 6 марта 1996 г.), WO 97/30034 (опубликована 21 августа 1997 г.), WO 98/02434 (опубликована 22 января 1998 г.), WO 98/02437 (опубликована 22 января 1998 г.) иWO 98/02438 (опубликована 22 января 1998 г.), также относятся к замещенным бициклическим гетероароматическим производным в качестве ингибиторов тирозинкиназ, используемых для указанной цели. См. также WO 99/16755, J. Med. Chem. 1998, 41, 5457-5465 и J. Med. Chem. 1999, 42 2373-2382. Краткое описание изобретения Настоящее изобретение относится к соединениям формулы 1 и их фармацевтически приемлемым солям, пролекарствам и сольватам,где X означает СН или N;-(CR R )t(C3-C10 циклоалкил), -(CR R )t(C6-C10 арил) и -(CR4R5)t(4-10-членный гетероциклический радикал), где каждый t независимо означает целое число от 0 до 5; указанные циклоалкильные, арильные и гетероциклические R1 группы необязательно конденсированы с бензольным кольцом, C5C8 циклоалкильной группой или 4-10-членной гетероциклической группой; -(CR4R5)t фрагменты указан-1 005407 ных выше R1 групп необязательно включают двойную углерод-углеродную или тройную связь, где t означает целое число между 2 и 5; каждая из указанных выше R1 групп необязательно замещена 1 или 2 группами, независимо выбранными из -NR3R4, -OR3, C1-С 10 алкила, С 2-С 10 алкенила и С 2-С 10 алкинила, где указанные алкильные, алкенильные и алкинильные группы замещены 1 или 2 группами, независимо выбранными из -NR3R4 и -OR3; и указанные выше R1 группы необязательно замещены 1-3 R2 группами; каждый R2 независимо выбран из Н, C1-С 10 алкила, С 2-С 10 алкенила, С 2-С 10 алкинила, С 3-С 10 циклоалкила, оксо, галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -OR3, -C(O)R3,-С(О)OR3, -NR4C(O)OR6, -OC(O)R3, -NR4SO2R6, -SO2NR3R4, -NR4(CR4Rs)m(C6-C10 арил), -O(CR4R5)m(4-10 членный гетероцикл), -NR4(CR4R5)m(4-10-членный гетероцикл), -(CR4R5)m(4-10-члeнный гетероциклический радикал) и -(CR4Rs)m(C3-C10 циклоалкил), где каждый m независимо означает целое число от 0 до 4; указанные алкильные, алкенильные и алкинильные группы необязательно содержат 1 или 2 гетерогруппы, выбранные из О, -S(O)3-, где j означает целое число от 0 до 2, и -N(R3)-, при условии, что два атома О, два атома S или атом О и атом S не соединены непосредственно друг с другом, и при условии,что атом О, атом S или атом N не соединены непосредственно с тройной связью или неароматической двойной связью; указанные циклоалкильные, арильные и гетероциклические R2 группы необязательно конденсированы с С 6-С 10 арильной группой, С 5-С 8 циклоалкильной группой или 4-10-членной гетероциклической группой; и указанные алкильные, циклоалкильные, арильные и гетероциклические R2 группы необязательно замещены 1-5 заместителями, независимо выбранными из оксо(=0), галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -NR4SO2R6, -SO2NR3R4, -C(O)R3, -С(О)OR3,-OC(O)R3, -NR4C(O)OR6, -NR4C(O)R3, -C(O)NR3R4, -NR3R4, -OR3, C1-С 10 алкила, -(CR4R5)m(С 6-С 10 арил) и-(CR4R5)m(4-10-члeнный гетероциклический радикал), где каждый m независимо означает целое число в пределах от 0 до 4; каждый R3 независимо выбран из Н, C1-С 10 алкила, -(CR4R5)m(C6-C10 арил) и -(CR4R5)m(4-10-члeнный гетероциклический радикал), где каждый m независимо означает целое число от 0 до 4; указанная алкильная группа необязательно включает 1 или 2 гетерогруппы, выбранные из О, -S(O)j-, где j означает целое число в пределах от 0 до 2, и -N(R4)-, при условии, что два атома О, два атома S или атом О и атомS не соединены непосредственно друг с другом; указанные циклоалкильные, арильные и гетероциклические R3 группы необязательно конденсированы с С 6-С 10 арильной группой, С 5-С 8 циклоалкильной группы или 4-10-членной гетероциклической группой; и указанные выше R3 заместители, за исключением Н,необязательно замещены 1-5 заместителями, независимо выбранными из оксо, галогена, циано, нитро,трифторметила, дифторметокси, трифторметокси, азидо, -C(O)R4, -С(О)OR4, -OC(O)R4, -NR4C(O)R5,-C(O)NR4R5, -NR4R5, гидрокси, C1-С 6 алкил и C1-C6 алкокси; каждый R4 и R5 независимо означает Н или C1-С 6 алкил; или когда R4 и R5 присоединены к одному и тому же атому углерода или азота, R4 и R5 вместе с указанным углеродом или азотом могут образовывать 4-10-членное кольцо, которое может быть карбоциклическим или гетероциклическим; каждый R6 выбран из заместителей, указанных в определении R3, за тем исключением, что R6 не означает Н; каждый R7, R8, R9, R10 и R11 независимо выбран из группы заместителей, указанных в определении 2R. В варианте настоящего изобретения R1 означает С 6-С 10 арил или 4-10-членный гетероциклический радикал, где каждая из указанных выше R1 групп замещена 1 или 2 группами, которые независимо выбраны из -NR3R4, -OR3 и C1-С 3 алкила, где указанные алкильные группы замещены 1 или 2 группами, независимо выбранными из -NR3R4 и -OR3; и указанные выше R1 группы необязательно замещены 1-3 R2 группами; каждый R2 независимо выбран из Н, C1-С 10 алкила, С 3-С 10 циклоалкила, оксо(=O), -OR3,-C(O)R3, -С(O)OR3, -NR4C(O)R3, -C(O)NR3R4, -NR3R4, -NR4SO2R6, -SO2NR3R4, -(CR4R5)m(4-10-членный гетероциклический радикал) и -(CR4R5)m(C3-C10 циклоалкил); и указанные алкильные группы необязательно содержат 1 или 2 гетерогруппы, выбранные из О, -S(O)j-, где j означает целое число от 0 до 2, и-N(R3)-, при условии, что два атома О, два атома S или атом О и атом S не соединены непосредственно друг с другом; и указанные алкильные и циклоалкильные R2 группы необязательно замещены 1-5 заместителями, независимо выбранными из оксо, циано, трифторметила, трифторметокси, -NR4SO2R6,-SO2NR3R4, -C(O)R3, -С(О)OR3, -NR4C(O)OR6, -NR4C(O)R3, -C(O)NR3R4, -NR3R4, -OR3 и C1-С 10 алкила, где каждый m независимо означает целое число в пределах от 0 до 4. В другом варианте настоящего изобретения R1 означает пиперидинил, пиперазинил или фенил, где указанные R1 группы замещены -NR3R4, оксо(=O), -OR3 и C1-C3 алкилом, где указанные алкильные группы замещены 1 или 2 группами, независимо выбранными из -NR3R4 и -OR3; и указанные выше R1 группы необязательно замещены 1-3 R2 группами. В более конкретном варианте указанные R1 группы замещены -NR3R4, оксо(=O), OR3 или C1-С 3 алкилом, где указанные алкильные группы замещены -NR3R4. В другом варианте настоящего изобретения R1 означает фенил, замещенный пирролидин-1-илом,где указанный пирролидин-1-ил необязательно замещен 1-3 заместителями, независимо выбранными из оксо, циано, трифторметила, трифторметокси, -NR4SO2R6, -SO2NR3R4, -C(O)R3, -C(O)OR3, -NR4C(O)OR6,-2 005407-NR4C(O)R3, -C(O)NR3R4, -NR3R4, -OR3 и C1-С 10 алкила; и R11 означает -OR3. Конкретнее, R1 означает 4 пирролидин-1-илметилфенил, необязательно замещенный 1-3 заместителями, независимо выбранными из: оксо, циано, трифторметила, трифторметокси, -NR4SO2R6, -SO2NR3R4, -C(O)R3, -C(O)OR3,-NR4C(O)OR6, -NR4C(O)R3, -C(O)NR3R4, -NR3R4, -OR3 и C1-С 10 алкила; и R11 означает -OR3. Более конкретно R11 присоединен по положению 5 бензимидазольного фрагмента соединения формулы 1 и означает -OR3. Более конкретно, R11 присоединен по положению 5 бензимидазольного фрагмента соединения формулы 1 и означает 2-метоксиэтокси. В другом варианте настоящего изобретения R1 означает пирролидин-1-ил или пиперидин-1-ил, указанный R1 необязательно замещен 1-3 заместителями, независимо выбранными из оксо, циано, трифторметила, трифторметокси, -NR4SO2R6, -SO2NR3R4, -C(O)R3, -С(О)OR3, -NR4C(O)OR6, -NR4C(O)R3,-C(O)NR3R4, -NR3R4, -OR3 и C1-С 10 алкила. Более конкретно, R1 означает пирролидин-1-ил или пиперидин-1-ил, замещенный -NR3R4, и необязательно замещен 1 или 2 заместителями, независимо выбранными из оксо, циано, трифторметила, трифторметокси, -NR4SO2R6, -SO2NR3R4, -C(O)R3, -C(O)OR3,-NR4C(O)OR6, -NR4C(O)R3, -C(O)NR3R4, -NR3R4, -OR3 и C1-С 10 алкила; и R11 означает -OR3. Более конкретно, R11 присоединен по положению 5 бензимидазольного фрагмента соединения формулы 1 и означает -OR3, и R9 и R10 оба означают Н. Более конкретно, R11 присоединен по положению 5 бензимидазольного фрагмента соединения формулы 1 и означает 2-метоксиэтокси, и R9 и R10 оба означают Н. Предпочтительные соединения включают соединения, выбранные из группы, включающей(146) 1-(2-5-(2-[1,2,4]триазол-1-ил-этокси)бензоимидазол-1-ил]хинолин-8-илпиперидин-4-иламин,и фармацевтически приемлемые соли, пролекарства и сольваты вышеуказанных соединений. Согласно настоящему изобретению предпочтительные соединения включают соединения, выбранные из группы, включающей(146) 1-2-[5-(2-[1,2,4]триазол-1-илэтокси)бензоимидазол-1-ил]хинолин-8-илпиперидин-4-иламин и фармацевтически приемлемые соли, пролекарства и сольваты вышеуказанных соединений. Изобретение относится также к фармацевтической композиции для лечения гиперпролиферативного нарушения у млекопитающих, которая включает терапевтически эффективное количество соединения формулы 1 или его фармацевтически приемлемой соли, пролекарства или гидрата и фармацевтически приемлемый носитель. В одном из вариантов указанная фармацевтическая композиция предназначена для лечения раковой опухоли, такой как злокачественная опухоль головного мозга, легких, сквамозных клеток, мочевого пузыря, желудка, поджелудочной железы, молочной железы, головы, шеи, почек, яичников, предстательной железы, толстой кишки, пищевода, яичек, женских половых органов или щитовидной железы. В другом варианте указанная фармацевтическая композиция предназначена для лечения незлокачественного гиперпролиферативного нарушения, такого как доброкачественная гиперплазия кожи (например, псориаз), рестеноз, или лечения простаты (например, доброкачественной гипертрофии предстательной железы (ВРН. Изобретение относится также к фармацевтической композиции для лечения панкреатита или болезни почек (включая пролиферативный гломерулонефрит и болезнь почек, вызванную диабетом) у млекопитающих, которая включает терапевтически эффективное количество соединения формулы 1 или его фармацевтически приемлемой соли, пролекарства или гидрата и фармацевтически приемлемый носитель. Изобретение относится также к фармацевтической композиции для предупреждения имплантации бластоцитов у млекопитающих, которая включает терапевтически эффективное количество соединения формулы 1 или его фармацевтически приемлемой соли, пролекарства или гидрата и фармацевтически приемлемый носитель. Изобретение относится также к фармацевтической композиции для лечения заболеваний, связанных с образованием и развитием сосудов или развитием кровеносных сосудов у млекопитающих, которая включает терапевтически эффективное количество соединения формулы 1 или его фармацевтически приемлемой соли, пролекарства или гидрата и фармацевтически приемлемый носитель. В одном из вариантов указанная фармацевтическая композиция предназначена для лечения болезни, выбранной из группы, включающей развитие кровеносных сосудов в опухолях, хроническое воспалительное заболевание,такое как ревматоидный артрит, атеросклероз, кожные заболевания, такие как псориаз, экзема и склеродермия, диабет, диабетическую ретинопатию, ретинопатию раннего возраста, возрастную дегенерацию желтого пятна, гемангиому, глиому, меланому, саркому Капоши и овариальную карциному, рак молочной железы, легкого, поджелудочной железы, предстательной железы, ободочной кишки и эпидермиса. Изобретение также относится к способу лечения гиперпролиферативного нарушения у млекопитающих, который включает введение указанному млекопитающему терапевтически эффективного количества соединения формулы 1 или его фармацевтически приемлемой соли, пролекарства или гидрата. В одном из вариантов указанный способ относится к лечению раковой опухоли, такой как злокачественная опухоль головного мозга, сквамозных клеток, мочевого пузыря, желудка, поджелудочной железы, молочной железы, головы, шеи, пищевода, предстательной железы, прямой кишки, легких, почек, яичников, яичек, женских половых органов или щитовидной железы. В другом варианте указанный способ относится к лечению незлокачественного гиперпролиферативного нарушения, такого как доброкачественная гиперплазия кожи (например, псориаз), рестеноз, или лечения простаты (например, доброкачественной гипертрофии предстательной железы (ВРН. Изобретение также относится к способу лечения гиперпролиферативного нарушения у млекопитающих, который включает введение указанному млекопитающему терапевтически эффективного количества соединения формулы 1 или его фармацевтически приемлемой соли, пролекарства или гидрата в сочетании с противоопухолевым средством, выбранным из группы, включающей митотические ингибиторы, алкилирующие средства, антиметаболиты, интеркалирующие антибиотики, ингибиторы факторов роста, ингибиторы клеточного цикла, ферменты, ингибиторы топоизомеразы, модификаторы биологической ответной реакции, антигормоны, ингибиторы развития кровеносных сосудов и антиандрогены. Изобретение также относится к способу лечения панкреатита или болезни почек у млекопитающих,который включает введение указанному млекопитающему терапевтически эффективного количества соединения формулы 1 или его фармацевтически приемлемой соли, пролекарства или гидрата. Изобретение также относится к способу предотвращения имплантации бластоцитов у млекопитающих, который включает введение терапевтически эффективного количества соединения формулы 1 или его фармацевтически приемлемой соли, пролекарства или гидрата.-8 005407 Изобретение также относится к способу лечения заболеваний, связанных с образованием и развитием сосудов или развитием кровеносных сосудов у млекопитающих, который включает введение указанному млекопитающему терапевтически эффективного количества соединения формулы 1 или его фармацевтически приемлемой соли, пролекарства или гидрата. В одном из вариантов указанный способ предназначен для лечения заболеваний, выбранных из группы, включающей: развитие кровеносных сосудов в опухолях, хронические воспалительные заболевания, такие как ревматоидный артрит, атеросклероз,кожные заболевания, такие как псориаз, экзема и склеродермия, диабет, диабетическую ретинопатию,ретинопатию раннего возраста, возрастную дегенерацию желтого пятна, гемангиому, глиому, меланому,саркому Калоши и овариальную карциному, рак молочной железы, легкого, поджелудочной железы,предстательной железы, ободочной кишки и эпидермиса. В число пациентов, которых можно лечить соединениями формулы 1 или фармацевтически приемлемыми солями, пролекарствами или гидратами указанных соединений согласно способам по настоящему изобретению, входят, например, пациенты с таким диагнозом, как псориаз, рестеноз, атеросклероз,ВРН, рак легкого, рак костей, CMML, рак поджелудочной железы, рак кожи, рак головы и шеи, кожная или внутриглазная меланома, рак матки, рак яичника, рак прямой кишки, рак анальной области, рак желудка, рак ободочной кишки, рак молочной железы, тестикулярные, гинекологические опухоли (например, саркома матки, карцинома маточных труб, карцинома эндометрия, карцинома шейки матки, карцинома влагалища или карцинома вульвы), болезнь Ходжкина, рак пищевода, рак тонкой кишки, рак эндокринной системы (например, рак щитовидной железы, паращитовидной железы или надпочечников),саркома мягкой ткани, рак уретры, рак полового члена, рак предстательной железы, хронический или острый лейкоз, детские твердые опухоли, лимфоцитарные лимфомы, рак мочевого пузыря, рак почек или мочеточника (например, почечная карцинома клеток, карцинома почечной лоханки), или опухоли центральной нервной системы (например, первичная лимфома ЦНС, опухоли спинного мозга, глиомы ствола мозга или гипофизарные аденомы). Настоящее изобретение также относится к фармацевтической композиции для ингибирования аномального роста клеток, которая включает некоторое количество соединения формулы 1 или его фармацевтически приемлемой соли, или сольвата, или пролекарства в сочетании с некоторым количеством химиотерапевтических средств, где общее количество соединения, соли, сольвата или пролекарства и химиотерапевтического средства эффективно для ингибирования аномального роста клеток. Многие химиотерапевтические средства известны в настоящее время из уровня техники. В одном из вариантов химиотерапевтическое средство выбрано из группы, включающей митотические ингибиторы, алкилирующие средства, антиметаболиты, интерполирующие антибиотики, ингибиторы факторов роста, ингибиторы клеточного цикла, ферменты, ингибиторы топоизомеразы, биологические модификаторы ответной реакции, антигормоны, например антиандрогены. Изобретение также относится к способу ингибирования аномального роста клеток у млекопитающих или лечения гиперпролиферативного нарушения, указанный способ включает введение млекопитающему некоторого количества соединения формулы 1 или его фармацевтически приемлемой соли, или сольвата, или пролекарства в сочетании с лучевой терапией, где количество соединения, соли, сольвата или пролекарства в сочетании с лучевой терапией эффективно для ингибирования аномального роста клеток или лечения гиперпролиферативного нарушения у млекопитающих. Способы осуществления лучевой терапии известны из уровня техники, и указанные способы могут быть использованы в указанной выше комплексной терапии. Введение соединения по изобретению при указанной комплексной терапии может быть определено в соответствии с данным описанием. Считается, что соединения формулы 1 могут придавать аномальным клеткам большую чувствительность при лечении облучением с целью уничтожения и/или подавления роста указанных клеток. Следовательно, настоящее изобретение также относится к способу повышения чувствительности аномальных клеток млекопитающих при лечении облучением, который включает введение млекопитающему некоторого количества соединения формулы 1 или его фармацевтически приемлемой соли, или сольвата, или пролекарства в количестве, эффективном для повышения чувствительности аномальных клеток при лечении облучением. Количество соединения, соли или сольвата в указанном способе может быть определено в соответствии с описываемыми способами установления эффективных количеств указанных соединений. Настоящее изобретение относится также к способу ингибирования аномального роста клеток у млекопитающих и к фармацевтической композиции для ингибирования аномального роста клеток у млекопитающих, включающей некоторое количество соединения формулы 1, его фармацевтически приемлемой соли или сольвата, пролекарства или меченного изотопом производного и некоторое количество одного или более веществ, выбранных из группы, включающей средства против развития кровеносных сосудов, ингибиторы передачи сигнала и антипролиферативные средства. Средства против развития кровеносных сосудов, такие как ингибиторы ММР-2 (матриксметаллопротеиназы 2), ингибиторы ММР-9 (матрикс-металлопротеиназы 9) и COX-II (циклооксигеназыII), могут быть использованы в сочетании с соединением формулы 1 и описываемыми фармацевтическими композициями. Примеры полезных ингибиторов COX-II включают CELEBREX (алекоксиб), валде-9 005407 коксиб и рофекоксиб. Примеры полезных ингибиторов матрикс-металлопротеиназы описаны в WO 96/33172 (опубликована 24 октября 1996 г.), WO 96/27583 (опубликована 7 марта 1996 г.), европейской патентной заявке 97304971.1 (подана 8 июля 1997 г.), европейской патентной заявке 99308617.2(подана 29 октября 1999 г.), WO 98/07697 (опубликована 26 февраля 1998 г.), WO 98/03516 (опубликована 29 января 1998 г.), WO 98/34918 (опубликована 13 августа 1998 г.), WO 98/34915 (опубликована 13 августа 1998 г.), WO 98/33768 (опубликована 6 августа 1998 г.), WO 98/30566 (опубликована 16 июля 1998 г.), европейской патентной заявке 606046 (опубликована 13 июля 1994 г.), европейской патентной заявке 931788 (опубликована 28 июля 1999 г.), WO 90/05719 (опубликована 31 мая 1990 г.), WO 99/52910(опубликована 21 октября 1999 г.), WO 99/52889 (опубликована 21 октября 1999 г.), WO 99/29667 (опубликована 17 июня 1999 г.), международной патентной заявке РСТPCT/IB 98/01113 (подана 21 июля 1998 г.), европейской патентной заявке 99302232.1 (подана 25 марта 1999 г.), патентной заявке Великобритании 9912961.1 (подана 3 июня 1999 г.), предварительной патентной заявке США 60/148464(подана 12 августа 1999 г.), патенте США 5863949 (выдан 26 января 1999 г.), патенте США 5861510 (выдан 19 января 1999 г.) и европейской патентной заявке 780386 (опубликована 25 июня 1997 г.), приведенные в данном описании в полном объеме в качестве ссылок. Предпочтительными ингибиторами ММР-2 и ММР-9 являются ингибиторы, имеющие низкую активность или не активные при ингибировании ММР-1. Более предпочтительными являются те ингибиторы, которые селективно ингибируют ММР 2 и/или ММР-9 относительно других матрикс-металлопротеиназ (т.е. ММР-1, ММР-3, ММР-4, ММР-5,ММР-6, ММР-7, ММР-8, ММР-10, ММР-11, ММР-12 и ММР-13). Некоторыми специфическими примерами ингибиторов ММР, полезных по настоящему изобретению, являются AG-3340, RO 32-3555, RS13-0830 и соединения, перечисленные в следующем списке: 1) 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидрокси-карбамоилциклопентил)амино]пропионовая кислота; 2) гидроксиамид 3-экзо-3-[4-(4-фторфенокси)бензолсульфониламино]-8-оксабицикло[3.2.1]октан-3 карбоновой кислоты; 3) гидроксиамид (2R,3R)-1-[4-(2-хлор-4-фторбензилокси)бензолсульфонил]-3-гидрокси-3-метилпиперидин-2-карбоновой кислоты; 4) гидроксиамид 4-[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; 5) 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклобутил)амино]пропионовая кислота; 6) гидроксиамид 4-[4-(4-хлорфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; 7) гидроксиамид (R)-3-[4-(4-хлорфенокси)бензолсульфониламино]тетрагидропиран-3-карбоновой кислоты; 8) гидроксиамид (2R,3R)-1-[4-(4-фтор-2-метилбензилокси)бензолсульфонил]-3-гидрокси-3-метилпиперидин-2-карбоновой кислоты; 9) 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоил-1-метилэтил)амино]пропионовая кислота; 10) 3-4-(4-фторфенокси)бензолсульфонил]-(4-гидроксикарбамоилтетрагидропиран-4-ил)амино] пропионовая кислота; 11) гидроксиамид 3-экзо-3-[4-(4-хлорфенокси)бензолсульфониламино]-8-оксабицикло[3.2.1]октан 3-карбоновой кислоты; 12) гидроксиамид 3-эндо-3-[4-(4-фторфенокси)бензолсульфониламино]-8-оксабицикло[3.2.1]октан 3-карбоновой кислоты и 13) гидроксиамид (R)-3-[4-(4-фторфенокси)бензолсульфониламино]тетрагидрофуран-3-карбоновой кислоты; и фармацевтически приемлемые соли и сольваты указанных соединений. Другие средства против развития кровеносных сосудов, включая другие ингибиторы СОХ-II и другие ингибиторы ММР, также могут быть использованы по настоящему изобретению. Соединения формулы 1 могут также быть использованы вместе с ингибиторами передачи согнала,такими как агенты, способные ингибировать ответ EGFR (рецептора эпидермального фактора роста),такими как антитела к EGFR, антитела к EGF и молекулы, являющиеся ингибиторами EGFR; ингибиторами VEGF (васкулярного фактора эндотелиального роста), такими как рецепторы VEGF и молекулы,которые могут ингибировать VEGF; и ингибиторами рецептора еrbВ 2, такими как органические молекулы или антитела, связывающие рецептор еrbВ 2, например, HERCEPTIN (Genentech, Inc. of South SanFrancisco, California, USA). Ингибиторы EGFR описаны, например, в WO 95/19970 (опубликована 27 июля 1995 г.), WO 98/14451 (опубликована 9 апреля 1998 г.), WO 98/02434 (опубликована 22 января 1998 г.) и патенте США 5747498 (выдан 5 мая 1998 г.), и указанные вещества могут быть использованы по настоящему изобретению, как описано здесь. EGFR-ингибирующие агенты включают, но не ограничиваясь ими, моноклональные антитела С 225, анти-EGFR 22Mab (ImClone Systems Incorporated of New York, New York, USA) иABX-EGF (Abgenix antibody) соединения ZD-1839 (AstraZeneca), BIBX-1382 (Boehringer Ingelheim),MDX-447 (Medarex Inc. of Annandale, New Jersey, USA) и OLX-103 (MerckCo. of Whitehouse Station,New Jersey, USA), VRCTC-310 (Ventech Research) и EGF слитый токсин (Seragen Inc. of Hopkinton, Massachusettes). Указанные и другие EGFR-ингибирующие агенты могут быть использованы по настоящему изобретению. Ингибиторы VEGF, например SU-5416 и SU-6668 (Sugen Inc. Of South San Francisco, California,USA), также могут быть объединены с соединением по настоящему изобретению. Ингибиторы VEGF описаны, например, в WO 99/24440 (опубликована 20 мая 1999 г.), международной патентной заявке(опубликована 2 декабря 1999 г.), патенте США 5834504 (выдан 10 ноября 1998 г.), WO 98/50356 (опубликована 12 ноября 1998 г.), патенте США 5883113 (выдан 16 марта 1999 г.), патенте США 5886020 (выдан 23 марта 1999 г.), патенте США 5792783 (выдан 11 августа 1998 г.), WO 99/10349 (опубликована 4 марта 1999 г.), WO 97/32856 (опубликована 12 сентября 1997 г.), WO 97/22596 (опубликована 26 июня 1997 г.), WO 98/54093 (опубликована 3 декабря 1998 г.), WO 98/02438 (опубликована 22 января 1998 г.),WO 99/16755 (опубликована 8 апреля 1999 г.) и WO 98/024 37 (опубликована 22 января 1998 г.), приведенные в данном описании в полном объеме в качестве ссылок. Другими примерами некоторых специфических ингибиторов VEGF, используемых по настоящему изобретению, являются IM862 (Cytran Inc.of Kirkland, Washington, USA); IMC-1C11 моноклональное антитело, анти-VEGF моноклональное антитело от Genentech, Inc. of South San Francisco, California; и ангиозим, синтетический рибозим от Ribozyme(Boulder, Colorado) и Chiron (Emeryville, California). Указанные и другие ингибиторы VEGF могут быть использованы по настоящему изобретению, как описано выше. Ингибиторы ЕrbВ 2 рецептора, такие как GW-282974 (Glaxo Wellcome plc) и моноклональные антитела AR-209 (Aronex Pharmaceuticals Inc. of The Woodlands, Texas, USA), и 2 В-1 (Chiron), могут быть,кроме того, объединены с соединением по изобретению, например, ингибиторы, указанные в WO 98/02434 (опубликована 22 января 1998 г.), WO 99/35146 (опубликована 15 июля 1999 г.), WO 99/35132(опубликована 15 июля 1999 г.), WO 98/02437 (опубликована 22 января 1998 г.), WO 97/13760 (опубликована 17 апреля 1997 г.), WO 95/19970 (опубликована 27 июля 1995 г.), патенте США 5587458 (выдан 24 декабря 1996 г.) и патенте США 5877305 (выдан 2 марта 1999 г.), приведенные в данном описании в полном объеме в качестве ссылок. Ингибиторы ЕrbВ 2 рецептора, используемые по настоящему изобретению, описаны также в предварительной патентной заявке США 60/117341, поданной 27 января 1999 г., и в предварительной патентной заявке США 60/117346, поданной 27 января 1999 г., приведенные в данном описании в полном объеме в качестве ссылок. Соединения, ингибирующие рецептор еrbВ 2, и вещество, описанное в указанных выше патентных заявках РСТ США, патентах США и предварительных патентных заявках США, также как другие соединения и вещества, которые ингибируют рецептор еrbВ 2, могут быть использованы согласно настоящему изобретению с соединением по настоящему изобретению. Соединение по изобретению может также быть использовано с другими агентами, полезными для лечения аномального роста клеток или раковой опухоли, включающими, но не ограничиваясь ими, агенты, способные усиливать противоопухолевые иммунные реакции, такие как антитела к CTLA4 (цитотоксическому лимфоцитарному антигену 4) и другие агенты, способные блокировать CTLA4; и антипролиферативные агенты, такие как ингибиторы фарнезилпротеинтрансферазы, и ингибиторы v33, такие как антитело к v3 Vitaxin, и ингибиторы v5 и тому подобные. Специфические антитела к CTLA4, которые могут быть использованы по настоящему изобретению, включают антитела, описанные в предварительной патентной заявке США 60/113647 (подана 23 декабря 1998 г.), представленная в данном описании в полном объеме в качестве ссылки, однако, и другие антитела к CTLA4 могут быть использованы по настоящему изобретению. Соединения формулы 1 и их фармацевтически приемлемые соли, пролекарства и сольваты могут также, каждый независимо, быть использованы в паллиативной не вспомогательной/дополнительной терапии для облегчения симптомов, вызываемых указанными выше болезнями, а также симптомов, связанных с аномальным ростом клеток. Указанная терапия может быть монотерапией или сочетаться с химиотерапией и/или иммунотерапией. Изобретение также относится к способу получения соединения формулы 1. Термины "аномальный рост клеток" и "гиперпролиферативное нарушение" используются в данном описании как взаимозаменяемые."Аномальный рост клеток, как использовано в данном описании, если не оговорено особо, означает рост клеток, происходящий независимо от нормальных регуляторных механизмов (например, утрата контактного ингибирования). Понятие включает аномальный рост (1) опухолевых клеток (опухолей),которые пролиферируют путем экспрессии мутированной тирозинкиназы или сверхэкспрессии рецепторной тирозинкиназы; (2) доброкачественных и злокачественных клеток других пролиферативных заболеваний, при которых наблюдается активация аберрантной тирозинкиназы; (4) любых опухолей, которые пролиферируют посредством рецепторной тирозинкиназы; (5) любых опухолей, которые пролифе- 11005407 рируют путем активации аберрантной серин/треонинкиназы; и (6) доброкачественных и злокачественных клеток других пролиферативных заболеваний, при которых наблюдается активация аберрантной серин/треонинкиназы. Термин "лечение (в смысле подвергать воздействию)", как использовано в данном описании, если не оговорено особо, означает излечивание, облегчение, подавление прогрессирования или предупреждение нарушения или состояния, к которому указанный термин применяется, или одного или более симптомов указанного заболевания или состояния. Термин "лечение (в смысле процесса)", как использовано в данном описании, если не оговорено особо, означает применение лечения, где понятие "лечение" определено непосредственно выше. Термин "Me" означает метил, "Et" означает этил и "Ас" означает ацетил. Термин "галоген", как использовано в данном описании, если не оговорено особо, означает фтор,хлор, бром или иод. Предпочтительными галогенными группами являются фтор, хлор и бром. Термин "алкил", как использовано в данном описании, если не оговорено особо, включает насыщенные одновалентные углеводородные радикалы с линейными, разветвленными или циклическими составляющими (включая конденсированные, соединенные мостиковой связью и спироциклические радикалы) или комбинацию вышеперечисленных групп. Чтобы алкильная группа имела циклические радикалы, группа должна содержать по меньшей мере три атома углерода. Термин "циклоалкил", как использовано в данном описании, если не оговорено особо, включает циклические алкильные радикалы, где алкил принимает указанные выше значения. Использование термина "циклоалкил" не следует истолковывать как ограничение термина "алкил" только нециклическими радикалами. Термин "алкенил", как использовано в данном описании, если не оговорено особо, включает алкильные радикалы, имеющие по меньшей мере одну двойную углерод-углеродную связь, где алкил принимает указанные выше значения, и включает Е и Z изомеры указанных алкенильных радикалов. Термин "алкинил", как использовано в данном описании, если не оговорено особо, включает алкильные радикалы, имеющие по меньшей мере одну тройную углерод-углеродную связь, где алкил принимает указанные выше значения. Термин "алкокси", как использовано в данном описании, если не оговорено особо, включает Оалкильные группы, где алкил принимает указанные выше значения. Термин "арил", как использовано в данном описании, если не оговорено особо, включает органический радикал, полученный из ароматического углеводорода путем удаления одного водорода, такой как фенил или нафтил. Термин "4-10-членный гетероциклический радикал", как использовано в данном описании, если не оговорено особо, включает ароматические или неароматические гетероциклические группы, содержащие от 1 до 4 гетероатомов, каждый из которых выбран из О, S и N, где каждая гетероциклическая группа имеет 4-10 атомов в циклической системе, и при условии, что цикл указанной группы не содержит двух соседних атомов О или S. Неароматические гетероциклические группы включают группы, имеющие только 4 атома в своей циклической системе, а ароматические гетероциклические группы должны иметь по меньшей мере 5 атомов в своей циклической системе. Гетероциклические группы включают бензоконденсированные циклические системы. Примером 4-членной гетероциклической группы является азетидинил (полученный из азетидина). Примером 5-членной гетероциклической группы является тиазолил,и примером 10-членной гетероциклической группы является хинолинил. Примерами неароматических гетероциклических групп являются пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил/тетрагидропиранил, дигидропиранил, тетрагидротиопиранил, пиперидино, морфолино, тиоморфолино, тиоксанил, пиперазинил, гомопиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидинил,оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, 1,2,3,6-тетрагидропиридинил, 2-пирролинил, 3-пирролинил, индолинил, 2 Н-пиранил, 4 Н-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, пиразолидинилимидазолинил, имидазолидинил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил, азабицикло[2.2.2]гексанил, 3 Н-индолил и хинолизинил. Примерами ароматических гетероциклических групп являются пиридинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил,тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил,бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил. Спирорадикалы, также входящие в рамки объема данного определения, включают 1-окса-6-азаспиро[2.5]окт-6-ил. Указанные выше в описании группы, в качестве производных перечисленных выше групп, могут быть С-присоединенными или N-присоединенными там, где это возможно. Например,группой, производной от пиррола, может быть пиррол-1-ил (N-присоединенный) или пиррол-3-ил (Сприсоединенный). Далее, группой, производной от имидазола, может быть имидазол-1-ил (Nприсоединенный) или имидазол-3-ил (С-присоединенный). Примером гетероциклической группы, где 2 углеродных атома цикла замещены оксо(=О)группами, является 1,1-диоксотиоморфолинил.- 12005407 Фраза "фармацевтически приемлемая соль(соли)", как использовано в данном описании, если не оговорено особо, включает соли кислотных или основных групп, которые могут присутствовать в соединениях формулы 1. Соединения формулы 1, являющиеся по своей природе основными, способны образовывать широкий ряд солей с различными неорганическими или органическими кислотами. Кислотами,которые могут быть использованы для получения фармацевтически приемлемых кислотно-аддитивных солей указанных основных соединений формулы 1, являются кислоты, образующие нетоксические кислотно-аддитивные соли, т.е. соли, содержащие фармацевтически приемлемые анионы, такие как ацетат,бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, эдетат кальция, камзилат,карбонат, хлорид, клавуланат, цитрат, дигидрохлорид, эдетат, эдисилат, эстолат, эзилат, этилсукцинат,фумарат, глюцептат, глюконат, глютамат, гликоллиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, иодид, изотионат, лактат, лактобионат, лаурат, малат, малеат, манделат, мезилат,метилсульфат, мукат, напзилат, нитрат, олеат, оксалат, памоат (эмбонат), пальмитат, пантофенат, фосфат/дифосфат, полигалактуронат, салицилат, стеарат, субацетат, сукцинат, таннат, тартрат, теоклат, тозилат, триэтиодод и валерат. Поскольку отдельное соединение по настоящему изобретению может включать более одной кислотной или основной группы, соединения по настоящему изобретению могут содержать одну, две или три соли в одном соединении. Те соединения по настоящему изобретению, которые являются по своей природе кислотными, способны образовывать соли оснований с различными фармацевтически приемлемыми катионами. Примеры указанных солей включают соли щелочных металлов и щелочно-земельных металлов и, в частности, соли соединений по настоящему изобретению с кальцием, магнием, натрием и калием. В соединениях формулы 1, где используются такие термины, как (CR4R5)m или (CR4R5)t, R4 и R5 могут изменяться с каждой итерацией m или t выше 1. Например, когда m или t равно 2, термины (CR4R5)m или (CR4R5)t могут равняться -СН 2 СН 2- или -СН(СН 3)С(СН 2 СН 3)(СН 2 СН 2 СН 3)-, или любому числу подобных радикалов, подпадающих под определения R4 и R5. Некоторые соединения формулы 1 могут иметь асимметрические центры и поэтому существовать в различных энантиомерных формах. Считается, что все оптические изомеры и стереоизомеры соединений формулы 1 и их смеси входят в объем настоящего изобретения. В отношении соединений формулы 1,изобретение включает использование рацемата, одной или более энантиомерных форм, одной или более диастереомерных форм, или их смесей. Соединения формулы 1 могут также существовать в виде таутомеров. Настоящее изобретение относится к использованию всех подобных таутомеров и их смесей. Рассматриваемое изобретение также включает меченные изотопами соединения, которые идентичны соединениям, описываемым формулой 1, но при том, что один или более атомов замещены атомом,имеющим атомную массу или массовое число, отличное от атомной массы или массового числа обычно существующих в природе. Примеры изотопов, которые могут быть введены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2 Н, 3 Н,13 С, 14 С, 15N, 18O, 17O, 31 Р, 32 Р, 35S, 18F и 36 Сl соответственно. Соединения по настоящему изобретению, их пролекарства и фармацевтически приемлемые соли указанных соединений или указанных пролекарств,содержащие указанные выше изотопы и/или изотопы других атомов, входят в объем настоящего изобретения. Некоторые меченные изотопами соединения по настоящему изобретению, например соединения,в которые включены радиоактивные изотопы, такие как 3 Н и 14 С, полезны для анализа на распределение лекарственных средств и/или субстрата в тканях. Тритированные, т.е. 3 Н, и содержащие углерод-14, т.е. 14 С, изотопы особенно предпочтительны из-за легкости их получения и обнаружения. Кроме того, замещение тяжелыми изотопами, такими как дейтерий, т.е. 2 Н, может дать некоторые терапевтические преимущества, выражающиеся в большей метаболической устойчивости, например большем периоде полураспада in vivo, или пониженных потребностях в лекарственном средстве, следовательно, может быть предпочтительно при некоторых обстоятельствах. Меченные изотопами соединения формулы 1 по настоящему изобретению и их пролекарства обычно могут быть получены выполнением способов, представленных на приведенных ниже схемах и/или в примерах и препаративных методиках, заменой не содержащего изотопную метку реагента на легко доступный меченный изотопом реагент. Настоящее изобретение также охватывает фармацевтические композиции, содержащие пролекарства соединений формулы 1, и способы лечения пролиферативных нарушений или аномального роста клеток путем введения пролекарств соединений формулы 1. Соединения формулы 1, имеющие свободные амино-, амидо-, гидроксильные или карбоксильные группы, могут быть превращены в пролекарства. Пролекарства включают соединения, в которых аминокислотный остаток или полипептидная цепь из двух или более (например, двух, трех или четырех) аминокислотных остатков ковалентно соединены через амидную или сложноэфирную связь со свободной амино-, гидроксильной группой или группой карбоновой кислоты соединений формулы 1. Аминокислотные остатки включают, но не ограничиваясь ими, 20 распространенных в природе аминокислот, обычно обозначаемых символами из трех букв, а также включают 4-гидроксипролин, гидроксилизин, демозин, изодемозин, 3-метилгистидин, норвалин,бета-аланин, гамма-аминомасляную кислоту, цитрулингомоцистеин, гомосерин, омитин и метионинсульфон. Изобретение охватывает также дополнительные типы пролекарств. Например, могут быть получены производные свободных карбоксильных групп, такие как амиды или алкиловые эфиры. Произ- 13005407 водные свободных гидроксильных групп могут быть получены использованием групп, включающих, но не ограничиваясь ими, гемисукцинаты, сложные эфиры фосфорной кислоты, диметиламиноацетаты и фосфорилоксиметилоксикарбонилы, как кратко изложено в Advanced Drug Delivery Reviews, 1996, 19,115. Включаются также карбаматные пролекарства гидроксильных и аминогрупп, какими являются карбонатные пролекарства, сложные сульфонатные эфиры и сложные сульфатные эфиры гидроксильных групп. Включаются также производные гидроксильных групп в виде простых (ацилокси)метиловых и(ацилокси)этиловых эфиров, где ацильной группой может быть сложный алкиловый эфир, необязательно замещенный группами, включающими, но не ограничиваясь ими, простую эфирную, амино и карбокислотную функциональности, или где ацильной группой является указанный выше эфир аминокислоты. Пролекарства указанного типа описаны в J. Med. Chem. 1996, 39, 10. Свободные амины могут также быть превращены в амиды, сульфонамиды или фосфонамиды. Все указанные пролекарственные фрагменты могут включать, но не ограничиваясь ими, простую эфирную, амино- и карбокислотную функциональности. Схема 1- 16005407 Подробное описание изобретения Основные способы синтеза, которые могут быть указаны в связи с получением соединений по настоящему изобретению, представлены в патенте США 5990146 (выдан 23 ноября 1999 г.) (WarnerLambert Со.) и опубликованной патентной заявке РСТ WO 99/16755 (опубликована 8 апреля 1999 г.)(MerckСо.). Указанные выше патент и патентная заявка представлены в данном описании в полном объеме в качестве ссылки. Схема 1 иллюстрирует синтез соединений формулы 1. На стадии 1 диол формулы 2 подвергают взаимодействию с триалкилсилилхлоридом или триалкилсилилтрифторметансульфонатом (таким как трет-бутилдиметилсилил) в присутствии подходящего органического основания, такого как имидазол или пиридин, в органическом растворителе, таком как дихлорметан (ДХМ), при температуре в пределах от -78 до 45 С, предпочтительно при температуре окружающей среды, в течение 1-12 ч, получая соединение формулы 3. На стадии 2 соединение формулы 3 подвергают взаимодействию с трифлатирующим реагентом и основанием, таким как N-фенилбис(трифторметансульфонимид) и гидрид натрия, или трифторметансульфоновый ангидрид и 2,6-диметилпиридин, в безводном органическом растворителе, таком как тетрагидрофуран (ТГФ) или ДХМ, при температуре в пределах от -78 С до температуры окружающей среды, предпочтительно при температуре окружающей среды, в течение 1-12 ч, получая соединение формулы 4. На стадии 3 соединение формулы 4 подвергают взаимодействию с амином формулы 5, предпочтительно, X = С, в присутствии палладиевого катализатора, такого как трис(дибензилиденацетон) дипалладий(0) или ацетат палладия(II), и основания, такого как карбонат цезия или трет-бутоксид натрия, предпочтительно карбонат цезия, и палладиевого лиганда, такого как 2,2'-бис(дифенилфосфино)1,1'-бинафтил (BINAP) или 1,2-бис(дифенилфосфино)этан (DIPHOS), в растворителе, таком как 1,4 диоксан или толуол, предпочтительно толуол, при температуре в пределах от температуры окружающей среды до интервала 80-105 С, предпочтительно при 105 С, в течение 1-48 ч. На стадии 4 полученное соединение формулы 6 восстанавливают над палладиевым катализатором, используя либо 10% палладий на угле, либо 20% гидроксид палладия на угле, в присутствии источника водорода, такого как гидразин,формиат аммония или муравьиная кислота, в органическом растворителе, таком как этанол или метанол,в присутствии или в отсутствие сорастворителя, такого как ТГФ, при температуре в интервале от температуры окружающей среды до температуры кипения флегмы в течение 1-24 ч, получая соединение формулы 7. На стадии 5 соединение формулы 7 подвергают взаимодействию с формамидинацетатом или муравьиной кислотой в органическом растворителе, таком как 2-метоксиэтанол, 1-бутанол, этанол или муравьиная кислота, предпочтительно в этаноле, при температуре в интервале от температуры окружающей среды до температуры кипения флегмы, предпочтительно при температуре кипения флегмы, в течение 148 ч, получая соединение формулы 8. На стадии 6 соединение формулы 8 подвергают взаимодействию с трифлатирующим реагентом и основанием, таким как N-фенилбис(трифторметансульфонимид) и гидрид натрия или триэтиламин, в безводном органическом растворителе, таком как ТГФ, в присутствии или в отсутствие сорастворителя, такого как диметилформамид (ДМФ), при температуре от -78 С до температуры окружающей среды, предпочтительно при температуре окружающей среды, в течение 1-24 ч, получая соединение формулы 9. На стадии 7 в случае R1 групп, которые включают арильную или гетероарильную группу (где Аr = арил или гетероарил), соединение формулы 9 подвергают взаимодействию над палладиевым катализатором, таким как тетракис(трифенилфосфин)палладий(0), с подходящим органобораном (где Z = В(ОН)2 или В(алкил)2), органостаннаном (где Z = Sn(алкил)3) или органоцинком (где Z = Zn(галоген. Когда Z = В(ОН)2, основание, такое как фосфат калия, используют в растворителе, таком как 1,4-диоксан или 1,2 диметоксиэтан, при температуре в интервале от температуры окружающей среды до температуры кипения флегмы, предпочтительно при температуре кипения флегмы, в течение 1-48 ч, получая соединение формулы 1. Когда Z = В(алкил)2, основание, такое как карбонат натрия, в присутствии или в отсутствие хлорида лития, используют в системе растворителей, включающей этанол и воду, в присутствии или в отсутствие толуола, при температуре в интервале от температуры окружающей среды до температуры кипения флегмы, предпочтительно порядка 90 С, в течение 1-48 ч, получая соединение формулы 1. Когда Z = Zn(алкил)3, в присутствии или в отсутствие основания, такого как фосфат калия, в подходящем органическом растворителе, таком как толуол или 1,4-диоксан, используя температуру в интервале от температуры окружающей среды до температуры кипения флегмы, предпочтительно между 80-100 С, в течение 1-48 ч, получают соединение формулы 1. Когда Z = Zn(галоген), подходящий органический растворитель, такой как ТГФ, 1,4-диоксан или 1,2-диметоксиэтан, используют при температуре в интервале от -78 С до температуры кипения флегмы, предпочтительно между 20-45 С, в течение 1-48 ч, с получением соединения формулы 1. В случае R1 с группой NR5R6, соединение формулы 9 подвергают взаимодействию с амином HNR5R6, используя палладиевый катализатор, такой как трис(дибензилиденацетон) дипалладий(0) или ацетат палладия, и основание, такое как карбонат цезия или трет-бутоксид натрия,предпочтительно карбонат цезия, и палладиевый лиганд, такой как 2,2'-бис(дифенилфосфино)-1,1'бинафтил (BINAP) или 1,2-бис(дифенилфосфино)этан (DIPHOS), в растворителе, таком как 1,4-диоксан,- 17005407 толуол и ксилол, предпочтительно толуол, при температуре в пределах от температуры окружающей среды до температуры кипения флегмы, предпочтительно при температуре кипения флегмы, в течение 148 ч, получая соединение формулы 1. Соединения формулы 1 могут иметь защитные группы, такие какR11, R10 или R9 = ОМе, которые могут быть удалены использованием стандартных условий, как описано в"Protective Groups for Organic Synthesis". Например, R11, R10 или R9 = ОМе могут быть превращены в R11,R10 или R9 = ОН путем обработки трибромидом бора в органическом растворителе, таком как ДХМ, при температуре в интервале от -78 до 45 С, предпочтительно при температуре окружающей среды, в течение 1-24 ч. Схема 1 А иллюстрирует альтернативный синтез соединений формулы 7. На стадии 1 диол формулы 2 подвергают взаимодействию с бензилхлоридом или бензилбромидом, предпочтительно бензилбромидом, в присутствии подходящего основания, такого как карбонат калия, карбонат натрия или карбонат цезия, в органическом растворителе, таком как ДМФ, при температуре в интервале от -78 до 100 С,предпочтительно в интервале 60-80 С, в течение 3-24 ч, получая соединение формулы 3 А. На стадии 2 соединение формулы 3 А подвергают взаимодействию с трифлатирующим реагентом и основанием, такими как N-фенил-бис(трифторметансульфонимид) и гидрид натрия, или ангидрид трифторметансульфоновой кислоты и 2,6-диметилпиридин, в безводном органическом растворителе, таком как тетрагидрофуран (ТГФ) или ДХМ при температуре в интервале от -78 С до температуры окружающей среды,предпочтительно при температуре окружающей среды, в течение 1-12 ч, получая соединение формулы 4 А (где V = OTf). Альтернативно, соединение формулы 3 А подвергают взаимодействию с хлорирующим реагентом, таким как оксихлорид фосфора, тионилхлорид или оксалилхлорид, в органическом растворителе, таком как ДХМ, 1,2-дихлорэтан (ДХЭ) или хлороформ, при температуре в пределах от температуры окружающей среды до температуры кипения флегмы, предпочтительно при температуре кипения флегмы, получая соединение формулы 4 А (где V = Сl). Альтернативно, соединение формулы 3 А подвергают взаимодействию с бромирующим реагентом, таким как оксибромид фосфора, в органическом растворителе, таком как ДХМ, 1,2-дихлорэтан (ДХЭ) или хлороформ, при температуре в пределах от температуры окружающей среды до температуры кипения флегмы, предпочтительно при температуре кипения флегмы, получая соединение формулы 4 А (где V = Вr). На стадии 3 соединение формулы 4 А подвергают взаимодействию с амином формулы 5, предпочтительно X = С, в присутствии палладиевого катализатора, такого как трис(дибензилиден-ацетон) дипалладий(0) или ацетат палладия(II), и основания, такого как карбонат цезия или трет-бутоксид натрия, предпочтительно карбонат цезия, и палладиевого лиганда, такого как 2,2'-бис(дифенилфосфино)1,1'-бинафтил (BINAP) или 1,2-бис(дифенилфосфино)этан (DIPHOS), в растворителе, таком как 1,4 диоксан или толуол, предпочтительно толуол, при температуре в пределах от температуры окружающей среды до 105 С, предпочтительно в пределах 80-105 С, в течение 1-48 ч. На стадии 4 полученное соединение формулы 6 А восстанавливают над палладиевым катализатором, используя либо 10% палладий на угле, либо 20% гидроксид палладия на угле, в присутствии источника водорода, такого как формиат аммония, формиат триэтиламмония или муравьиная кислота, предпочтительно формиат аммония, формиат триэтиламмония, в органическом растворителе, таком как этанол (EtOH) или метанол (МеОН), в присутствии или в отсутствие сорастворителя, такого как ТГФ, при температуре в интервале от температуры окружающей среды до температуры кипения флегмы, предпочтительно между 75 С и температурой кипения флегмы, в течение 1-24 ч, получая соединение формулы 7. Схема 1B иллюстрирует альтернативный синтез соединений формулы 6 А. На стадии 1 аминохинолин формулы 2 В подвергают взаимодействию с бензилхлоридом или бензилбромидом, предпочтительно бензилбромидом, в присутствии подходящего основания, такого как гидрид натрия или гидрид калия, в органическом растворителе, таком как ДМФ, ТГФ или 1,2-диметоксиэтан, при температуре в интервале от -78 до 65 С, предпочтительно в пределах 0-25 С, в течение 1-24 ч, получая соединение формулы 3 В. На стадии 2 соединение формулы 3 В подвергают взаимодействию с бромароматическим соединением формулы 5 А в присутствии палладиевого катализатора, такого как трис(дибензилиденацетон)дипалладий(0) или ацетат палладия(II), предпочтительно трис(дибензилиденацетон)дипалладий(0), и основания,такого как карбонат цезия или трет-бутоксид натрия, предпочтительно трет-бутоксид натрия, и палладиевого лиганда, такого как 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (BINAP) или 1,2 бис(дифенилфосфино)этан (DIPHOS), предпочтительно 2,2'-бис(дифенилфосфино)-1,1'-бинафтил(BINAP), в растворителе, таком как 1,4-диоксан или толуол, при температуре в пределах от температуры окружающей среды до 105 С, предпочтительно в пределах 80-105 С, в течение 1-48 ч, получая соединение формулы 6 А. Схема 2 иллюстрирует синтез соединений формулы 11. На стадии 1 соединение формулы 10 в стандартных условиях алкилирования обрабатывают электрофилом R3Y, где Y может означать мезилат, тозилат, бром, иод и хлор, предпочтительно бром или иод, и основанием, таким как гидрид натрия, гидрид калия, карбонат натрия, карбонат калия или карбонат цезия, предпочтительно карбонат цезия, в органическом растворителе, таком как ДМФ или ТГФ, предпочтительно ДМФ, в течение 1-48 ч, в интервале температур от -78 до 85 С. Соединения, определяемые формулой 11, можно также получать, исходя из подходящего аминосоединения формулы 5 по стадии 3 схемы 1 или стадии 2 схемы 1 А.- 18005407 Альтернативно, соединения, определяемые формулой 11, можно также получать, исходя из подходящего бромароматического соединения формулы 5 А по стадии 2 схемы 1 В. Схема 2 иллюстрирует также синтез соединений формулы 13 (где Аr означает арильную или гетероарильную группу). На стадии 2 соединение формулы 10 подвергают взаимодействию с трифлатирующим реагентом и основанием, таким как N-фенил-бис(трифторметансульфонимид) и гидрид натрия или трифторметансульфоновый ангидрид и пиридин, в безводном органическом растворителе, таком как ТГФ, в присутствии или в отсутствие сорастворителя, такого как ДМФ, при температуре в пределах от-78 С до температуры окружающей среды, предпочтительно при температуре окружающей среды, в течение 1-24 ч, получая соединение формулы 12. На стадии 2 соединение формулы 12 подвергают взаимодействию над палладиевым катализатором, таким как тетракис(трифенилфосфин)палладий(0), с подходящим органобораном (где Z = В(ОН)2 или В(алкил)2)/органостаннаном (где Z = Sn(алкил)3) или органоцинком (где Z = Zn(галоген. Когда Z = В(ОН)2, основание, такое как фосфат калия, используют в растворителе, таком как 1,4-диоксан или 1,2-диметоксиэтан, при температуре в интервале от температуры окружающей среды до температуры кипения флегмы, предпочтительно при температуре кипения флегмы, в течение 1-48 ч, получая соединение формулы 13. Когда Z = В(алкил)2, основание, такое как карбонат натрия, в присутствии или в отсутствие хлорида лития, используют в системе растворителей, включающей этанол и воду, в присутствии или в отсутствие толуола, при температуре в интервале от температуры окружающей среды до температуры кипения флегмы, предпочтительно порядка 90 С, в течение 1-48 ч, получая соединение формулы 13. Когда Z = Sn(алкил)3, в присутствии или отсутствии основания,такого как фосфат калия, в подходящем органическом растворителе, таком как толуол или 1,4-диоксан, и при температуре в интервале от температуры окружающей среды до температуры кипения флегмы,предпочтительно между 80-100 С, в течение 1-48 ч, получают соединение формулы 13. Когда Z =Zn(галоген), подходящий органический растворитель, такой как ТГФ, 1,4-диоксан или 1,2 диметоксиэтан, используют при температуре в интервале от -78 С до температуры кипения флегмы,предпочтительно между 20-45 С, в течение 1-48 ч, получая соединение формулы 13. Соединения формулы 13 могут иметь защитные группы, такие как R11, R10 или R9 = ОМе, которые могут быть удалены использованием стандартных условий, как описано в "Protective Groups for Organic Synthesis". Например,R11, R10 или R9 = ОМе могут быть превращены в R11, R10 или R9 = ОН путем обработки трибромидом бора в органическом растворителе, таком как ДХМ, при температуре в интервале от -78 до 45 С, предпочтительно при температуре окружающей среды, в течение 1-24 ч. Соединения, определяемые формулой 13,можно также получать, исходя из подходящего аминосоединения формулы 5 по стадии 3 схемы 1 или стадии 2 схемы 1 А. Альтернативно, соединения, определяемые формулой 11, можно также получать,исходя из подходящего бромароматического соединения формулы 5 А по стадии 2 схемы 1 В. Схема 3 иллюстрирует синтез соединений формулы 15 (где W = арил или гетероцикл). На стадии 1 соединение формулы 14 подвергают взаимодействию с амином HNR3R4 и восстанавливающим агентом,таким как цианоборгидрид натрия или триацетоксиборгидрид натрия, и уксусной кислотой в органическом растворителе, таком как метанол или этанол, и в присутствии или в отсутствие сорастворителя, такого как 1,2-дихлорэтан, при температуре в интервале от 0 до 80 С, предпочтительно при температуре окружающей среды, в течение 1-24 ч. Соединения формулы 15 могут иметь защитные группы, такие какR11, R10 или R9 = ОМе, которые могут быть удалены использованием стандартных условий, как описано вProtective Groups for Organic Synthesis". Например, R11, R10 или R9 = ОМе могут быть превращены в R11,R10 или R9 = ОН путем обработки трибромидом бора в органическом растворителе, таком как ДХМ, при температуре в интервале от -78 до 45 С, предпочтительно при температуре окружающей среды, в течение 1-24 ч. Соединения, определяемые формулой 15, можно также получать, исходя из подходящего ArZ или амина NR5R6 по стадии 7 схемы 1. Схема 4 иллюстрирует синтез соединений формулы 18. На стадии 1 соединение формулы 16 подвергают взаимодействию с триметилсульфонийиодидом и основанием, таким как гидрид натрия, в органическом растворителе, таком как диметилсульфоксид (ДМСО) или ТТФ, при температуре в интервале от -78 до 65 С, предпочтительно при температуре окружающей среды, в течение 1-24 ч. Полученное соединение формулы 17 подвергают взаимодействию по стадии 2 с амином NR3R4 в растворителе, таком как ТГФ, метанол, этанол, вода, ДМФ, ДМСО или любой комбинации из них, при температуре в пределах от 0 до 100 С, предпочтительно при 65 С, в запаянной трубке, в течение 1-48 ч, получая соединение формулы 18. Соединения формулы 18 могут иметь защитные группы, такие как R11, R10 или R9 = ОМе,которые могут быть удалены использованием стандартных условий, как описано в "Protective Groups forOrganic Synthesis". Например, R11, R10 или R9 = ОМе могут быть превращены в R11, R10 или R = ОН путем обработки трибромидом бора в органическом растворителе, таком как ДХМ, при температуре в интервале от -78 до 45 С, предпочтительно при температуре окружающей среды, в течение 1-24 ч. Соединения,определяемые формулой 18, можно также получать, исходя из подходящего амина NR5R6 по стадии 7 схемы 1. Схема 4 иллюстрирует также синтез соединения формулы 19. На стадии 1 соединение формулы 16 подвергают взаимодействию с амином HNR3R4 и восстанавливающим агентом, таким как цианоборгидрид натрия или триацетоксиборгидрид натрия, и уксусной кислотой в органическом растворителе, таком- 19005407 как метанол, этанол, и в присутствии или в отсутствие сорастворителя, такого как 1,2-дихлорэтан (ДХЭ),при температуре в интервале от 0 до 80 С, предпочтительно при температуре окружающей среды, в течение 1-24 ч. Соединения формулы 19 могут иметь защитные группы, такие как R11, R10 или R9 = ОМе,которые могут быть удалены использованием стандартных условий, как описано в "Protective Groups forOrganic Synthesis". Например, R11, R10 или R9 = ОМе могут быть превращены в R11, R10 или R = ОН путем обработки трибромидом бора в органическом растворителе, таком как ДХМ, при температуре в интервале от -78 до 45 С, предпочтительно при температуре окружающей среды, в течение 1-24 ч. Соединение,определяемое формулой 19, можно также получать, исходя из подходящего амина NR5R6 по стадии 7 схемы 1. Схемы 5 и 6 иллюстрируют альтернативную схему синтеза соединения формулы 1. На стадии 1 броманилин 20 ацилируют циннамилхлоридом в органическом растворителе, таком как ДХМ или ТГФ,предпочтительно ДХМ, в присутствии органического основания, такого как пиридин или триэтиламин,предпочтительно пиридин, при температуре в интервале от -78 до 40 С, предпочтительно между 0 и 25 С, в течение 1-24 ч, получая соединение формулы 21. На стадии 2, соединение формулы 21 подвергают взаимодействию с сильной кислотой Льюиса, такой как трихлорид алюминия, в органическом растворителе, таком как хлорбензол, при температуре в интервале от 25 до 120 С, предпочтительно в интервале между 90 и 120 С, в течение 1-24 ч, получая соединение формулы 22. На стадии 3 соединение формулы 22 подвергают взаимодействию с трифлатирующим реагентом и основанием, таким как Nфенилбис(трифторметансульфонимид) и гидрид натрия или трифторметансульфоновый ангидрид и 2,6 диметилпиридин, в безводном органическом растворителе, таком как ТГФ или ДХМ, при температуре в пределах от -78 С до температуры окружающей среды, предпочтительно при температуре окружающей среды, в течение 1-24 ч, получая соединение формулы 23. По схеме 6 соединение формулы 23, на стадии 1, подвергают взаимодействию с амином формулы 5,предпочтительно X = С, в присутствии палладиевого катализатора, такого как трис(дибензилиденацетон)дипалладий(0) или ацетат палладия(II), и основания, такого как карбонат цезия или третбутоксид натрия, предпочтительно карбонат цезия, и палладиевого лиганда, такого как 2,2'бис(дифенилфосфино)-1,l'-бинафтил (BINAP) или 1,2-бис(дифенилфосфино)этан (DIPHOS), в растворителе, таком как 1,2-диоксан или толуол, предпочтительно толуол, при температуре в пределах от температуры окружающей среды до 105 С, предпочтительно в пределах 80-105 С, в течение 1-48 ч. На стадии 2 полученное соединение формулы 24 восстанавливают железным порошком и хлоридом аммония в органическом растворителе, таком как этанол или метанол, в присутствии или в отсутствие сорастворителя,такого как вода, при температуре в интервале от температуры окружающей среды до температуры кипения флегмы, предпочтительно при температуре кипения флегмы, в течение 1-24 ч, получая соединение формулы 25. На стадии 3 соединение формулы 25 подвергают взаимодействию с формамидинацетатом или муравьиной кислотой в органическом растворителе, таком как 2-метоксиэтанол, 1-бутанол, этанол или муравьиная кислота, предпочтительно в этаноле, при температуре в интервале от температуры окружающей среды до температуры кипения флегмы, предпочтительно при температуре кипения флегмы, в течение 1-48 ч, получая соединение формулы 26. На стадии 4 в случае R1 групп, которые включают арильную или гетероарильную группу (где Аr = арил или гетероарил), соединение формулы 26 подвергают взаимодействию над палладиевым катализатором, таким как тетракис(трифенилфосфин)палладий(0), с подходящим органобораном (где Z = В(ОН)2 или В(алкил)2), органостаннаном (где Z = Sn(алкил)3) или органоцинком (где Z = Zn(галоген. Когда Z = В(ОН)2, основание, такое как фосфат калия, используют в растворителе, таком как 1,4 диоксан или 1,2-диметоксиэтан, при температуре в интервале от температуры окружающей среды до температуры кипения флегмы, предпочтительно при температуре кипения флегмы, в течение 1-48 ч, получая соединение формулы 1. Когда Z = В(алкил)2, основание, такое как карбонат натрия, в присутствии или в отсутствие хлорида лития, используют в системе растворителей, включающей этанол и воду, в присутствии или в отсутствие толуола, при температуре в интервале от температуры окружающей среды до температуры кипения флегмы, предпочтительно порядка 90C, в течение 1-48 ч, получая соединение формулы 1. Когда Z = Sn(алкил)3, в присутствии или в отсутствие основания, такого как фосфат калия, в подходящем органическом растворителе, таком как толуол или 1,4-диоксан, и при температуре в интервале от температуры окружающей среды до температуры кипения флегмы, предпочтительно между 80100 С, в течение 1-48 ч, получают соединение формулы 1. Когда Z = Zn(галоген), подходящий органический растворитель, такой как ТГФ, 1,4-диоксан или 1,2-диметоксиэтан, используют при температуре в интервале от -78 С до температуры кипения флегмы, предпочтительно между 20-45 С, в течение 1-48 ч,получая соединение формулы 1. В случае R1 с группой NR5R6, соединение формулы 26 подвергают взаимодействию с аминомHNR5R6,используя палладиевый катализатор,такой как трис(дибензилиденацетон)дипалладий(0) или ацетат палладия, и основание, такое как карбонат цезия или трет-бутоксид натрия, предпочтительно карбонат цезия, и палладиевый лиганд, такой как 2,2'бис(дифенилфосфино)-1,1'-бинафтил (BINAP) или 1,2-бис(дифенилфосфино)этан (DIPHOS), в растворителе, таком как 1,4-диоксан, толуол и ксилол, предпочтительно толуол, когда Y = Вr и предпочтительно- 20005407 ксилол, когда Y = Сl, при температуре в пределах от температуры окружающей среды до температуры кипения флегмы, предпочтительно при температуре кипения флегмы, в течение 1-72 ч, получая соединение формулы 1. Соединения формулы 1 могут иметь защитные группы, такие как R11, R10 или R9 = ОМе,которые могут быть удалены использованием стандартных условий, как описано в "Protective Groups forOrganic Synthesis". Например, Ru, R10 или R9 = ОМе могут быть превращены в R11, R10 или R9 = ОН путем обработки трибромидом бора в органическом растворителе, таком как ДХМ, при температуре в интервале от -78 до 45 С, предпочтительно при температуре окружающей среды, в течение 1-24 ч. Альтернативно, соединение формулы 26 может быть получено из соединения 22 в две последовательные стадии, схематично представленные на схеме 7. На стадии 1 соединение формулы 22, где X = Сl,подвергают взаимодействию с оксихлоридом фосфора, тионилхлоридом или оксалилхлоридом, предпочтительно оксалилхлоридом, в присутствии или в отсутствие органического растворителя, такого как хлороформ или ДХЭ, предпочтительно ДХЭ, при температуре в пределах от температуры окружающей среды до температуры кипения флегмы, предпочтительно при температуре кипения флегмы, в течение 1-24 ч, получая соединение формулы 27. Когда X = Вr, соединение формулы 22 подвергают взаимодействию с оксибромидом фосфора в присутствии органического растворителя, такого как хлороформ или ДХЭ,предпочтительно хлороформ, при температуре в пределах от температуры окружающей среды до температуры кипения флегмы, предпочтительно при температуре кипения флегмы, в течение 1-24 ч, получая соединение формулы 27. На стадии 2 соединение формулы 27, где X = Вr или Сl, подвергают взаимодействию с соединением формулы 28 в органическом растворителе, таком как ДМФ или 1-метил-2 пирролидинон, в присутствии или в отсутствие основания, такого как гидрид натрия или натрийбис(триметилсилил)амид, при температуре в пределах от температуры окружающей среды до 150 С,предпочтительно при 60-85 С, когда используют основание, и 150 С, когда не используют основание, в течение 1-24 ч, получая соединение формулы 26. На стадии 1 схемы 8 соединение формулы 8 подвергают взаимодействию с электрофилом RY, где Y означает мезилат, тозилат, бромид, хлорид или иодид, и основанием, таким как гидрид натрия, гидрид калия, карбонат калия, карбонат натрия или карбонат цезия, в растворителе, таком как ДМФ, ТГФ,ДМСО или 1,2-диметоксиэтан, при температуре в интервале от -78 до 65 С, получая соединение формулы 29. Соединения формулы 29 могут иметь защитные группы, такие как R11, R10 или R9 = ОМе, которые могут быть удалены использованием стандартных условий, как описано в "Protective Groups for OrganicSynthesis". Например, R11, R10 или R9 = ОМе могут быть превращены в R11, R10 или R9 = ОН путем обработки трибромидом бора в органическом растворителе, таком как ДХМ, при температуре в интервале от-78 до 45 С, предпочтительно при температуре окружающей среды, в течение 1-24 ч. Также схематически изображенное на схеме 1 соединение формулы 9 на стадии 1 подвергают взаимодействию с монооксидом углерода при давлении в интервале от атмосферного до 50 фунт/кв.дюйм(345 кПа), предпочтительно 50 фунт/кв. дюйм (345 кПа), в присутствии органического основания, такого как триэтиламин, над палладиевым катализатором, таким как ацетат палладия, с лигандом, таким как 1,3 бис(дифенилфосфино)пропан, в растворителе, таком как ДМФ, в присутствии метанола, получая соединение формулы 30. На стадии 2 соединение формулы 30 подвергают взаимодействию с предварительно полученным комплексом амина HNR3R4 (или его гидрохлорида) с триметилалюминием в растворителе,таком как ДХМ или ДХЭ, при температуре в интервале от 0 С до температуры кипения флегмы, получая соединение формулы 31. Соединения формулы 31 могут иметь защитные группы, такие как R11, R10 илиR9 = ОМе, которые могут быть удалены использованием стандартных условий, как описано в "ProtectiveGroups for Organic Synthesis". Например, R11, R10 или R9 = ОМе могут быть превращены в R11, R10 илиR9 = ОН путем обработки трибромидом бора в органическом растворителе, таком как ДХМ, при температуре в интервале от -78 до 45 С, предпочтительно при температуре окружающей среды, в течение 1-24 ч. Соединения по настоящему изобретению могут иметь асимметрические углеродные атомы. Диастереомерные смеси могут быть разделены на отдельные диастереомеры на основании различий в физикохимических свойствах с использованием способов, известных специалистам в данной области, например,путем хроматографии или фракционированной кристаллизации. Энантиомеры могут быть разделены путем превращения энантиомерных смесей в диастереомерную смесь за счет взаимодействия с подходящим оптически активным соединением (например, спиртом), разделения диастереомеров и превращения(например, гидролизом) отдельных диастереомеров в соответствующие чистые энантиомеры. Все указанные изомеры, включая диастереомерные смеси и чистые энантиомеры, рассматриваются как часть изобретения. Соединения формул 1, 13, 15, 18, 19, 29, 31, являющиеся основными по природе, способны к образованию широкого ряда различных солей с разнообразными неорганическими и органическими кислотами. Несмотря на то, что указанные соли должны быть фармацевтически приемлемыми для введения животным, практически часто удобнее сначала выделять соединение формулы 1, 13, 15, 18, 19, 29, 31 из реакционной смеси в виде фармацевтически приемлемой соли и затем просто превращать последние обратно в соединение, являющееся свободным основанием, путем обработки щелочным реагентом, и после этого превращать последнее свободное основание в фармацевтически приемлемую кислотноаддитивную соль.- 21005407 Кислотно-аддитивные соли основных соединений по настоящему изобретению легко получают обработкой основного соединения, по существу, эквивалентным количеством выбранной неорганической или органической кислоты в среде водного растворителя или в подходящем органическом растворителе,таком как метанол или этанол. Требуемую твердую соль легко получают осторожным выпариванием растворителя. Требуемая кислотная соль может быть также осаждена из раствора свободного основания в органическом растворителе добавлением к раствору подходящей неорганической или органической кислоты. Те соединения формул 1, 13, 15, 18, 19, 29, 31, которые имеют кислотную природу, способны образовывать соли оснований с различными фармацевтически приемлемыми катионами. Примеры указанных солей включают соли щелочных металлов и щелочно-земельных металлов, и, в частности, соли натрия и калия. Все указанные соли получают общепринятыми способами. Химическими основаниями, используемыми в качестве реагентов для получения фармацевтически приемлемых основных солей по настоящему изобретению, являются такие основания, которые образуют нетоксические соли оснований с кислотными соединениями формул 1, 13, 15, 18, 19, 29, 31. Указанные нетоксические соли оснований включают соли,полученные из таких фармацевтически приемлемых катионов, как натрий, калий, кальций и магний, и т.д. Указанные соли легко могут быть получены обработкой соответствующих кислотных соединений водным раствором, содержащим требуемые фармакологически приемлемые катионы, и затем выпариванием полученного раствора досуха, предпочтительно при пониженном давлении. Альтернативно, указанные соли могут также быть получены смешиванием растворов кислотных соединений в низших спиртах и требуемого алкоголята щелочного металла, и последующим выпариванием полученного раствора досуха таким же образом, как описано выше. В обоих случаях предпочтительно использовать стехиометрические количества реагентов для уверенности в полноте прохождения реакции и максимальных выходах требуемого конечного продукта. Поскольку отдельное соединение по настоящему изобретению может включать более чем одну кислотную или основную группы, соединения по настоящему изобретению могут содержать одну, две или три соли в одном соединении. Активность соединений формул 1, 13, 15, 18, 19, 29, 31 может быть оценена следующим способом. Общий ELISA анализ на PGT киназу Использованы следующие реагенты и основные растворы: аденозинтрифосфат (АТФ) Sigma, cat.A-2383 альбумин бычьей сыворотки (BSA) Sigma, cat.A-3294(a) Для покрытия пластинки заполняют пластинку Nunc MaxiSorp по 100 мкл на лунку Поли-GluTyr (PGT), разбавленным dPBS (различные концентрации). Пластинку инкубируют в течение ночи при 37 С. Затем супернатант PGT отбрасывают и пластинку трижды промывают промывным буфером.(b) Затем фермент PDGF разбавляют РВ до соответствующей концентрации и добавляют 25 мкл указанного исходного раствора на лунку.(c) Затем разбавляют АТФ (от исходных 20 мМ) до требуемой концентрации (0,5 нМ-2 мкМ) с помощью РВ. Реакцию фосфорилирования начинают добавлением 25 мкл раствора АТФ в каждую лунку пластинки для анализа. Инкубирование продолжают около 10 мин, встряхивая при комнатной температуре.(d) Реакцию останавливают отсасыванием реакционной смеси. Затем пластинку четырежды промывают WB.(e) Антитело HRP-PY54 разбавляют до соответствующей концентрации блокирующим буфером. Затем добавляют по 50 мкл указанного раствора на лунку с последующим инкубированием в течение 2535 мин при комнатной температуре. Содержащий антитело раствор отсасывают и пластинку вновь четырежды промывают WB.(f) Степень взаимодействия определяют, измеряя поглощение света при 450 нм. Первоначально создают окраску добавлением раствора ТМВ 50 мкл на лунку и дают реакции протекать до достижения в лунках положительных сигналов OD450 порядка 0,6-1,2 единиц. Дальнейшее проявление окраски прекращают добавлением 50 мкл на лунку 0,09 М H2SO4. Контролями фона служат лунки без PGT, но со- 22005407 держащие все другие компоненты. Как указано выше, предпочтительный OD сигнал отвечает обычно области 0,6-1,2 единиц при практическом отсутствии фона. Активность in vitro соединений по настоящему изобретению в отношении ингибирования рецептора PDGFP может быть определена следующим способом. Ингибирование активности тирозинкиназы может быть оценено с использованием рекомбинантного фермента в анализе по измерению способности соединений ингибировать фосфорилирование экзогенного субстрата, полиGluTyr (PGT, Sigma, 4:1). Цитоплазмический домен рецептора PDGF человека(аминокислоты 559-1106) (Ishikawa, F., et al. Nature 338: 557-562, 1989) экспрессируют в Sf9 клетках насекомых в качестве глютатион-S-трансфраза(GST)-слитого белка, используя бакуловирусную систему экспрессии. Затем белок очищают от лизатов указанных клеток, используя аффинные колонки с глютатионагарозой. Испытание на фермент осуществляют в 96-луночных планшетах, которые покрывают субстратомPGT (0,625 мкг PGT на лунку). Испытуемые соединения разбавляют диметилсульфоксидом (ДМСО) и затем добавляют в планшеты с PGT так, чтобы конечная концентрация ДМСО в пробе составляла 1,6%(об./об.). Рекомбинантный фермент разбавляют фосфорилирующим буфером (50 мМHepes, pH 7,3, 125 мМ NaCl, 24 мМ MgCl2). Реакцию инициируют добавлением АТФ до конечной концентрации 10 мкМ. После 10-минутной инкубации при комнатной температуре, при встряхивании, реакционную смесь отсасывают и планшеты промывают промывным буфером (PBS-содержащим 0,1% Tween-20). Количественное содержание фосфорилированного PGT определяют путем инкубации с пероксидазой хрена (HRP),конъюгированной с антителом PY-54 (Transduction Labs), проявляя ТМВ пероксидазой (ТМВ означает 3,3',5,5'-тетраметилбензидин) и обнаруживая с помощью считывающего устройства BioRad Microplate при 450 нМ. Ингибирование ферментативной активности киназы с помощью испытуемого соединения обнаруживают по пониженной спектральной поглощательной способности и концентрацию соединения,требуемую для 50% подавления сигнала (в условиях испытания), приводят в качестве IC50 значения для испытуемого соединения. Для оценки способности соединений ингибировать PDGFR активность тирозинкиназы для полноразмерного белка, существующего в клеточном контексте, могут быть использованы эндотелиальные клетки аорты свиньи (РАЕ), трансфицированные PDGFR человека (Westermark, Bengt, et. al., PNAS 87,pp128-132, 1990). Клетки высевают и оставляют связываться с содержимым 96-луночных планшетов в той же среде (Ham's F12) с 10% FBS (околоплодной сывороткой теленка) в течение 6-8 ч. Клетки промывают, вновь вводят питательную среду, не содержащую сыворотки, и оставляют инкубироваться в течение ночи. Непосредственно перед дозированным введением соединения клетки подкармливают не содержащей сыворотки питательной средой. Испытуемые соединения, растворенные в ДМСО, разбавляют питательной средой (конечная концентрация ДМСО 0,5% (об./об По окончании 10-минутного инкубирования, PDGF-BB (конечная концентрация 100 нг/мл) добавляют к среде и инкубируют в течение 8 мин. Клетки промывают Hepes буферным солевым раствором (HBSS) и лизируют в 50 мкл HNTG буферного раствора (Hepes 20 мМ, рН 7,5, NaCl 150 мМ, Triton Х-100 0,2%, глицерин 10% плюс PMSF (фениметилсульфонилфторид) 0,2 мМ, пепстатин 1 мкг/мл, лейпептин 1 мкг/мл, апротонин 1 мкг/мл, пирофосфат натрия 2 мМ, ортованадат натрия 2 мМ) и затем разбавляют 50 мкл HG разбавляющего буфераProtein А планшеты, блокируют Superblock (Pierce) и покрывают 0,5 мкг на лунку анти-PDGFR Р 20 антителом (Santa Cruz, номер по каталогу SC-339). Все несвязанные антитела вымывают с планшетов перед тем, как добавить клеточный лизат. После инкубирования в течение 2 ч при комнатной температуре лизатов (50 мкл) с антителом PDGFR,PDGFR-связанный фосфотирозин определяют количественно, проявляя HRP, конъюгированной с антителом РУ-54, и ТМВ, как описано выше. Способность соединений ингибировать при используемых условиях PDGF-BB-стимулированную реакцию аутофосфорилирования на 50%, по сравнению с PDGF-BBстимулированными контролями, приводится как IC50 значение для испытуемого соединения. Соединения по настоящему изобретению, включая перечисленные ниже примеры, при использовании вышеуказанной методики обычно дают значения IC50, находящиеся в следующих пределах: 1-1000 нМ. Испытание на активность по ингибированию KDR/VEGF рецептора Активность in vitro соединений по настоящему изобретению по ингибированию KDR/VEGF рецептора может быть определена следующим способом. Способность соединений по настоящему изобретению ингибировать активность тирозинкиназы может быть оценена с использованием рекомбинантного фермента в испытании по измерению способности соединений ингибировать фосфорилирование экзогенного субстрата, полиGluTyr (PGT, Sigma,4:1). Домен киназ KDRA/EGF человека рецептора (аминокислоты 805-1350) экспрессируют в Sf9 клетках насекомых в качестве глютатион-3-трансфраза(GSТ)-слитого белка, используя бакуловирусную систему экспрессии. Белок очищают от лизатов указанных клеток, используя аффинные колонки с глютатионага- 23005407 розой. Испытание на фермент осуществляют в 96-луночных планшетах, которые покрывают PGT субстратом (0,625 мкг PGT на лунку). Испытуемые соединения разбавляют диметилсульфоксидом (ДМСО) и затем добавляют в планшеты с PGT так, чтобы конечная концентрация ДМСО в пробе составляла 1,6%(об./об.). Рекомбинантный фермент разбавляют фосфорилирующим буфером (50 мМ Hepes, рН 7,3, 125 мМ NaCl, 24 мМ МgСl2). Реакцию инициируют добавлением АТФ до конечной концентрации 10 мкМ. После 30-минутной инкубации при комнатной температуре, при встряхивании, реакционную смесь отсасывают и планшеты промывают промывным буфером (PBS-содержащим 0,1% Tween-20). Количество фосфорилированного PGT определяют путем инкубации с HRP, конъюгированной (HRP означает пероксидазу хрена) с антителом PY-54 (Transduction Labs), проявляя ТМВ пероксидазой (ТМВ означает 3,3',5,5'-тетраметилбензидин), и взаимодействие оценивают количественно с помощью считывающего устройства BioRad Microplate при 450 нМ. Ингибирование ферментативной активности киназы с помощью испытуемого соединения обнаруживают по пониженной спектральной поглощательной способности, и концентрацию соединения, требуемую для 50% подавления сигнала (в условиях испытания),приводят в качестве IC50 значения для испытуемого соединения. Для оценки способности соединений ингибировать активность KDR тирозинкиназы для полноразмерного белка, существующего в клеточном контексте, могут быть использованы эндотелиальные клетки аорты свиньи (РАЕ), трансфицированные KDR человека (Waltenberger et al., J. Biol. Chem. 269:26988,1994). Клетки высевают и оставляют связываться с содержимым 96-луночных планшетов в той же среде(Ham's F12) с 10% FBS (околоплодной сывороткой теленка). Затем клетки промывают, вновь вводят не содержащую сыворотки питательную среду, включающую 0,1% (об./об,) альбумин бычьей сыворотки(BSA), и оставляют инкубироваться в течение 24 ч. Непосредственно перед дозированным введением соединения клетки подкармливают не содержащей сыворотки питательной средой (без BSA). Испытуемые соединения, растворенные в ДМСО, разбавляют питательной средой (конечная концентрация ДМСО 0,5% (об./об По окончании 2-часового инкубирования, VEGF165 (конечная концентрация 50 нг/мл) добавляют к среде и инкубируют в течение 8 мин. Клетки промывают и лизируют в HNTG буферном растворе (Hepes 20 мМ, рН 7,5, NaCl 150 мМ, Triton Х-100 0,2%, глицерин 10%, PMSF (фениметилсульфонилфторид) 0,2 мМ, пепстатин 1 мкг/мл, лейпептин 1 мкг/мл, апротонин 1 мкг/мл, пирофосфат натрия 2 мМ, ортованадат натрия 2 мМ). Степень фосфорилирования KDR измеряют, используя испытание ELISA. 96-Луночные планшеты покрывают 1 мкг на лунку козьим антителом кроличьего антитела. Несвязанное антитело вымывают с планшета и оставшиеся участки блокируют Superblock буферным раствором (Pierce) перед добавлением анти-flk-1 C-20 антитела (0,5 мкг на планшет, Santa Cruz). Все несвязанные антитела вымывают с планшетов перед тем, как добавить клеточный лизат. После инкубирования в течение 2 ч лизатов с flk-1 антителом, KDR-связанный фосфотирозин определяют количественно, проявляя HRP, конъюгированной с антителом PY-54, и ТМВ, как описано выше. Способность соединений ингибировать VEGF-стимулированную реакцию аутофосфорилирования на 50%, по сравнению сVEGF-стимулированными контролями, приводится как IC50 значение для испытуемого соединения. Введение соединений по настоящему изобретению (здесь и далее "активное соединение (соединения)") может быть эффективным при любом способе, дающем возможность доставки соединений к участку влияния. Указанные способы включают пероральные способы, интрадуоденальные способы, парентеральную инъекцию (включая внутривенную, подкожную, внутримышечную, внутрисосудистую или вливание), местное и ректальное введение. Количество вводимого активного соединения зависит от требующего лечения субъекта, тяжести нарушения или состояния, скорости введения, распределения соединения и предписаний, устанавливаемых лечащим врачом. Однако эффективная доза составляет в пределах приблизительно от 0,001 до 100 мг на кг массы тела в день, предпочтительно порядка 1-35 мг/кг/день, в виде разовой или разделенной общей дозы. Для человека массой 70 кг данное количество должно составлять порядка 0,05-7 г/день,предпочтительно порядка 0,2-2,5 г/день. В некоторых случаях уровни доз ниже нижнего предела вышеуказанного интервала могут оказаться более чем адекватными, тогда как в других случаях могут быть использованы еще большие дозы, не вызывающие нежелательного побочного эффекта, при условии, что указанные повышенные дозы первоначально разделены на несколько небольших доз для приема в течение дня. Активное соединение может использоваться для независимой терапии или может включать одно или более других противоопухолевых средств, выбранных, например, из группы, включающей митотические ингибиторы, например вибрастин; алкилирующие средства, например цис-платин, карбоплатин и циклофосфамид; антиметаболиты, например 5-фторурацил, цитозинарабинозид и гидроксимочевина,или, например, один из предпочтительных метаболитов, описанных в европейской патентной заявке 239362, такой как N-(5-[N-(3,4-дигидро-2-метил-4-оксохиназолин-6-илметил)-N-метиламино]-2 теноил)-L-глутаминовая кислота; ингибиторы фактора роста; ингибиторы клеточного цикла; интеркалирующие антибиотики, например адриамицин и блеомицин; ферменты, например интерферон; и антигормоны, например антиэстрогены, такие как Nolvadex (тамоксифен), или, например, антиандрогены, такие как Casodex (4'-циано-3-(4-фторфенилсульфонил)-2-гидрокси-2-метил-3'-(трифторметил)пропион- 24005407 анилид). Указанное совместное лечение может осуществляться одновременным, последовательным или раздельным дозированным введением индивидуальных компонентов, используемых для лечения. Фармацевтическая композиция может, например, существовать в форме, подходящей для перорального введения, такой как таблетка, капсула, пилюля, порошок, составы замедленного высвобождения, раствор, суспензия, для парентеральной инъекции, такой как стерильные растворы, суспензия или эмульсия, для местного применения, в такой форме, как мазь или крем, или для ректального введения в виде суппозитория. Фармацевтическая композиция может существовать в дозированных лекарственных формах, подходящих для отдельного введения точно определенных доз. Фармацевтическая композиция может включать общепринятый фармацевтический носитель или наполнитель и соединение по изобретению в качестве активного ингредиента, кроме того, указанная композиция может включать другие лекарственные и фармацевтические средства, носители, вспомогательные средства и т.д. Характерные примеры форм для парентерального введения включают растворы или суспензии активных соединений в стерильных водных растворах, например водных растворах пропиленгликоля или декстрозы. Указанные дозированные формы могут, если требуется, содержать буферный раствор. Подходящие фармацевтические носители включают инертные разбавители или наполнители, воду и различные органические растворители. Фармацевтические композиции могут, если требуется, содержать дополнительные ингредиенты, такие как корригенты, связывающие вещества, наполнители и тому подобное. Так, для перорального введения могут быть использованы таблетки, содержащие различные наполнители, такие как лимонная кислота, вместе с различными дезинтегрантами, такими как крахмал,альгиновая кислота и некоторые комплексные силикаты, и со связующими агентами, такими как сахароза, желатин и сок акации. Вдобавок замасливатели, такие как стеарат магния, лаурилсульфат натрия и тальк, часто полезны в целях таблетирования. Твердые композиции подобного типа можно также использовать в мягких и твердых наполненых желатиновых капсулах. Предпочтительные материалы для этого включают лактозу или молочный сахар и полиэтиленгликоли высокой молекулярной массы. Когда для перорального введения желательны водные суспензии или эликсиры, активное соединение в них может быть объединено с различными подсластителями или корригентами, красящими веществами или красителями и, если требуется, эмульгирующими агентами или суспендирующими агентами, вместе с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин или их комбинации. Способы получения различных фармацевтических композиций с определенным количеством активного соединения известны либо очевидны для специалистов в данной области. Например, см.Remington's Pharmaceutical Sciences, Mack Publishing Company, Easter, Pa., 15th Edition (1975). Примеры и препаративные методики, приведенные ниже, служат дополнительной иллюстрацией и примерами соединений по настоящему изобретению и способов получения указанных соединений. Подразумевается, что рамки объема настоящего изобретения никоим образом не ограничиваются рамками объема следующих примеров и препаративных методик. В следующих примерах молекулы с одним хиральным центром, если не оговорено особо, существуют в виде рацемической смеси. Те молекулы, в которых имеются два или более хиральных центра, если не оговорено особо, существуют в виде рацемической смеси диастереомеров. Отдельные энантиомеры/диастереомеры могут быть получены по методикам, известным специалистам в данной области. Когда в препаративных методиках и примерах, приведенных ниже, упоминается ВЭЖХ хроматография, обычно используемыми условиями, если не оговорено особо, являются следующие. Используют колонку ZORBAX RXC18 (производство Hewlett Packard), длина 150 мм и внутренний диаметр 4,6 мм. Образцы анализируют на системе Hewlett Packard-1100. Используют способ градиентного элюирования,претерпевающего изменения от 100-процентного ацетата аммония/буфер с уксусной кислотой (0,2 М) до 100-процентного ацетонитрила за 10 мин. После этого система переходит на цикл промывки 100 процентным ацетонитрилом в течение 1,5 мин и затем 100-процентным буферным раствором в течение 3 мин. Объемный расход в течение указанного периода постоянен и равен 3 мл/мин. В следующих примерах и препаративных методиках, "Et" означает этил, "Ас" означает ацетил, "Me" означает метил и "Вu" означает бутил. Экспериментальные примеры Пример 1. Синтез 1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламина.- 25005407 2,8-Хинолиндиол (20,0 г, 124 ммоль) суспендируют в 500 мл дихлорметана (ДХМ) в атмосфере сухого азота (N2). К указанному раствору добавляют имидазол (20,3 г, 298 ммоль) с последующим добавлением трет-бутилдиметилсилилхлорида (20,6 г, 137 ммоль) и 4-диметиламинопиридина (1,50 г, 12,4 ммоль). Реакционную смесь перемешивают в течение ночи при температуре окружающей среды, после чего распределяют между ДХМ и 1% водным бисульфатом натрия (NaHSO4). ДХМ слой сохраняют и промывают еще два раза 1% водным NaHSO4, затем насыщенным водным бикарбонатом натрия(NаНСО 3) и, наконец, насыщенным раствором соли. ДХМ слой сушат над сульфатом натрия (Na2SO4),фильтруют и концентрируют в вакууме, получая неочищенный продукт (40 г) в виде белого твердого вещества. Твердое вещество растворяют в 500 мл безводного тетрагидрофурана (ТГФ) в атмосфере сухого N2. К указанному раствору добавляют N-фенилбис(трифторметансульфонимид) (48,7 г, 136 ммоль) и раствор охлаждают до 0 С. К указанному раствору медленно добавляют (3,2 г, 136 ммоль) гидрид натрия(60% в масле). После завершения добавления реакционную смесь нагревают до температуры окружающей среды. Через 1 ч добавляют дополнительно 1,00 г гидрида натрия (60% в масле) и перемешивают еще 30 мин. Смесь концентрируют в вакууме и растворяют в ДХМ. Медленно по каплям добавляют воду(1,0 мл), чтобы погасить весь непрореагировавший гидрид натрия, и затем реакционную смесь дважды экстрагируют 0,1 н. водным гидроксидом натрия (NaOH) и затем промывают насыщенным раствором соли. ДХМ слой сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая 57 г неочищенного трифлата 1 А в виде желтого масла. Пример 1 В. ([8-(трет-Бутилдиметилсиланилокси)хинолин-2-ил]-(4-метокси-2-нитрофенил)амин. 8-(трет-Бутилдиметилсиланилокси)хинолин-2-иловый эфир трифторметансульфоновой кислоты 1 А(9,81 г, 24,1 ммоль) и 4-метокси-2-нитроанилин (4,86 г, 28,9 ммоль) растворяют в 100 мл диоксана в атмосфере сухого N2. К указанному раствору добавляют (11,0 г, 33,7 ммоль) карбонат цезия (Cs2CO3), (900 мг, 1,45 ммоль) рацемический 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (BINAP) и трис(дибензилиденацетон)дипалладий(0) (883 мг, 0,964 ммоль) и реакционную смесь нагревают до 100 С и проводят реакцию при указанной температуре в течение 4 ч. Затем смесь охлаждают до температуры окружающей среды, концентрируют в вакууме, обрабатывают ДХМ, фильтруют и концентрируют в вакууме, получая красное твердое вещество. Твердое вещество очищают флэш-хроматографией на силикагеле, элюируя смесью гексан/ДХМ (3:1), получая 7,25 г указанного в заголовке соединения 1 В в виде красного твердого вещества. Пример 1 С. N1-[8-(трет-Бутилдиметилсиланилокси)хинолин-2-ил]-4-метоксибензол-1,2-диамин.([8-(трет-Бутилдиметилсиланилокси)хинолин-2-ил]-(4-метокси-2-нитрофенил)амин 1 В (21,9 г, 51,3 ммоль) растворяют в смеси 200 мл этанола (EtOH) и 70 мл ТГФ в атмосфере сухого N2. К указанному раствору добавляют 10% палладий на угле (2,18 г) с последующим добавлением по каплям 10 мл безводного гидразина. Реакционную смесь перемешивают при температуре окружающей среды в течение 2 ч,после чего фильтруют через Celite и Celite промывают ДХМ. Объединенные фильтраты концентрируют в вакууме и полученный остаток распределяют между ДХМ и водным насыщенным NаНСО 3. ДХМ слой затем промывают снова насыщенным NaHCO3 и затем насыщенным раствором соли, сушат надN1-[8-(трет-Бутилдиметилсиланилокси)хинолин-2-ил]-4-метокси-бензол-1,2-диамин 1 С (18,3 г, 46,1 ммоль) растворяют в 40 мл 2-метоксиэтанола в атмосфере сухого N2. К указанному раствору добавляют формамидинацетат (5,28 г, 50,7 ммоль) и реакционную смесь нагревают до 125 С и проводят реакцию при указанной температуре в течение 1,5 ч. Растворитель удаляют в вакууме и оставшееся твердое вещество растирают с диэтиловым эфиром (Et2O), сушат в вакууме и получают 13,3 г розового твердого вещества, являющегося указанным в заголовке соединением 1D. Пример 1E. 2-(5-Метоксибензоимидазол-1-ил)хинолин-8-иловый эфир трифторметансульфоновой кислоты. 2-(5-Метоксибензоимидазол-1-ил)хинолин-8-ол 1D (13,9 г, 47,8 ммоль) растворяют в 100 мл безводного ТГФ в атмосфере сухого N2. К указанному раствору добавляют N-фенилбис(трифторметансульфонимид) (20,3 г, 47,8 ммоль) и затем раствор охлаждают до 0 С. К указанному раствору медленно добавляют (1,31 г, 54,9 ммоль) гидрид натрия (60% в масле). После завершения добавления реакционную смесь нагревают до температуры окружающей среды. Спустя 30 мин добавляют еще 500 мг гидрида натрия (60% в масле) с последующим добавлением 3,50 г N-фенилбис(трифторметансульфонимида) и реакционную смесь перемешивают при температуре окружающей среды в течение 1 ч. Затем растворитель удаляют в вакууме и полученный остаток растворяют в ДХМ. К указанному раствору медленно добавляют 1,0 мл воды для разложения непрореагировавшего гидрида натрия. Затем смесь распределяют между ДХМ и 0,1 н. водным NaOH. ДХМ слой затем вновь промывают 0,1 н. воднымNaOH с последующим промыванием насыщенным раствором соли и затем сушат над сульфатом магния- 26005407 Пример 1F. трет-Бутиловый эфир 1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4 илкарбаминовой кислоты. 2-(5-Метоксибензоимидазол-1-ил)хинолин-8-иловый эфир трифторметансульфоновой кислоты 1E(15,0 г, 35,4 ммоль) и трет-бутиловый эфир пиперидин-4-илкарбаминовой кислоты (14,2 г, 70,9 ммоль) растворяют в 200 мл диоксана в атмосфере сухого N2. К указанному раствору добавляют Cs2CO3 (16,2 г,49,6 ммоль), рацемический BINAP (1,28 г, 2,12 ммоль) и трис(дибензилиденацетон)дипалладий(0) (1,29 г,1,41 ммоль) и реакционную смесь нагревают до 100 С и проводят реакцию при указанной температуре в течение ночи. Смесь затем охлаждают до температуры окружающей среды, фильтруют и концентрируют в вакууме, получая оранжевую пену. Пену очищают флэш-хроматографией на силикагеле с градиентным элюированием от этилацетата (EtOAc)/ДXM (1:5) до EtOAc/ДХМ (7:3), получая 12,3 г указанного в заголовке соединения 1F в виде слегка желтоватого твердого вещества. Пример 1G. 1-[2-(5-Метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин. трет-Бутиловый эфир 1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-илкарбаминовой кислоты 1F (8,40 г, 17,7 ммоль) растворяют в 50 мл трифторуксусной кислоты (ТФУ) в атмосфере сухого N2. Реакционную смесь перемешивают при температуре окружающей среды в течение 15 мин,после чего концентрируют в вакууме, получая желтое масло. Масло распределяют между ДХМ и 0,1 н. водным NaOH. ДХМ слой промывают вновь 0,1 н. водным NaOH. ДХМ слой сушат над Na2SO4, фильтруют и концентрируют, получая 5,85 г указанного в заголовке соединения 1 в виде желтого твердого вещества. 1-[2-(5-Метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин 1 (500 мг, 1,10 ммоль) растворяют в 10 мл ДХМ в атмосфере сухого N2. К указанному раствору добавляют трибромид бора (300 мкл, 3,30 ммоль) и смесь перемешивают в течение ночи при температуре окружающей среды. Затем добавляют дополнительно 200 мкл трибромида бора и смесь перемешивают в течение 2 ч. Реакционную смесь выливают затем на колотый лед и рН образовавшегося раствора доводят до 9 осторожным добавлением карбоната натрия (Nа 2 СО 3). Суспензию фильтруют и твердое вещество промывают водой и затемEt2O, затем сушат в вакууме, получая указанное в заголовке соединение 2 в виде желтого твердого вещества. Пример 3 А. трет-Бутиловый эфир 1-[2-(5-гидроксибензоимидазол-1-ил)хинолин-8-ил]пиперидин 4-илкарбаминовой кислоты. 1-[8-(4-Аминолиперидин-1-ил)хинолин-2-ил]-1 Н-бензоимидазол-5-ол 2 (460 мг, 1,30 ммоль) растворяют в 5 мл безводного ДМФ в атмосфере сухого N2. К указанному раствору добавляют ди-третбутилдикарбонат (279 мг, 1,30 ммоль) и реакционную смесь перемешивают при температуре окружающей среды в течение ночи. Затем реакционную смесь концентрируют в вакууме и распределяют между ДХМ и водным насыщенным NaHCO3. ДХМ слой сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая желтое твердое вещество. Твердое вещество очищают флэш-хроматографией на силикагеле, элюируя EtOAc,получая 273 мг указанного в заголовке соединения 3 А в виде желтого твердого вещества.- 27005407 Пример 3 В. трет-Бутиловый эфир (1-2-[5-(пиридин-2-илметокси)бензоимидазол-1-ил]хинолин-8 илпиперидин-4-ил)карбаминовой кислоты. трет-Бутиловый эфир 1-[2-(5-гидроксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-илкарбаминовой кислоты 3 А (73 мг, 0,16 ммоль) растворяют в 1 мл безводного ДМФ в атмосфере сухого N2. К указанному раствору добавляют (37 мг, 0,17 ммоль) калийбис(триметилсилил)амид (95%) с последующим добавлением 2-пиколилхлорида (25 мкл, 0,17 ммоль). Реакционную смесь перемешивают в течение ночи при температуре окружающей среды, после чего реакционную смесь концентрируют в вакууме и затем распределяют между ДХМ и водным насыщенным NaHCO3. ДХМ слой сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая желтый гель. Гель очищают флэш-хроматографией на силикагеле с градиентным элюированием от ДХМ до ДХМ/МеОН (98:2), получая 55 мг указанного в заголовке соединения 3 В. Пример 3 С. 1-[2-[5-(Пиридин-2-илметокси)бензоимидазол-1-ил]хинолин-8-илпиперидин-4-иламин. трет-Бутиловый эфир (1-2-[5-(пиридин-2-илметокси)бензоимидазол-1-ил]хинолин-8-илпиперидин-4-ил)карбаминовой кислоты 3 В (55 мг, 0,094 ммоль) растворяют в 1 мл ТФУ в атмосфере сухого N2 и перемешивают в течение 15 мин при температуре окружающей среды. Реакционную смесь концентрируют затем в вакууме, получая масло, которое затем распределяют между 0,1 н. водным NaOH и ДХМ. ДХМ слой сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая 38,9 мг желтой пленки,являющейся указанным в заголовке соединением 3. 1-[2-(5-Метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин 1 (160 мг, 0,43 ммоль) растворяют в 2 мл хлороформа в атмосфере сухого N2. К указанному раствору добавляют 50 мкл 37% водного формальдегида и 100 мкл муравьиной кислоты и реакционную смесь затем нагревают до 65 С и проводят реакцию при указанной температуре в течение 4 ч. Реакционную смесь затем распределяют между ДХМ и 0,1 н. водным NaOH. ДХМ слой сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая оранжевое твердое вещество, являющееся указанным в заголовке соединением 4. Пример 5 А. 4-[2-(5-Метоксибензоимидазол-1-ил)хинолин-8-ил]бензальдегид. 2-(5-Метоксибензоимидазол-1-ил)хинолин-8-иловый эфир трифторметансульфоновой кислоты 1E(265 мг, 0,630 ммоль) растворяют в 3 мл диоксана в атмосфере сухого N2. К указанному раствору добавляют 4-формилбензолбороновую кислоту (145 мг, 0,940 ммоль), фосфат калия (267 мг, 1,26 ммоль) и тетракис(трифенилфосфин)палладий(0) (36 мг, 0,032 ммоль). Реакционную смесь нагревают до 105 С и проводят реакцию при указанной температуре в течение ночи. Реакционную смесь охлаждают затем до температуры окружающей среды, концентрируют в вакууме и распределяют между ДХМ и насыщенным водным NaHCO3. ДХМ слой промывают затем насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая желтое твердое вещество, являющееся указанным в заголовке соединением 5 А, которое используют в дальнейшем без дополнительной очистки. Пример 5 В. 4-[2-(5-Метоксибензоимидазол-1-ил)хинолин-8-ил]бензилметиламин.- 28005407 4-[2-(5-Метоксибензоимидазол-1-ил)хинолин-8-ил]бензальдегид 5 А (120 мг, 0,32 ммоль) растворяют в 2 мл метанола в атмосфере сухого N2. К указанному раствору добавляют 800 мкл раствора 2,0 М метиламина в метаноле и затем добавляют по каплям уксусную кислоту (АсОН) до рН раствора 5. К указанному раствору добавляют (42 мг, 0,64 ммоль) цианоборгидрид натрия (NaCNBH3) и реакционную смесь перемешивают при температуре окружающей среды в течение ночи. Реакционную смесь концентрируют затем в вакууме и затем распределяют между ДХМ и 0,1 н. водным NaOH. ДХМ слой промывают вновь 0,1 н. водным NaOH, затем сушат над MgSO4, фильтруют и концентрируют в вакууме, получая 220 мг зеленого остатка. Остаток очищают флэш-хроматографией на силикагеле с градиентным элюированием ДХМ/МеОН (5/95) - ДХМ/МеОН (15/85) - ДХМ/МеОН/NН 4 ОН (15/84,5/0,5), получая 50 мг белого твердого вещества, являющегося указанным в заголовке соединением 5. Следуют той же методике, что применяют в примере 5, за тем исключением, что используют 2,0 М диметиламин в метаноле вместо 2,0 М метиламина в метаноле по примеру 5 В, получая указанное в заголовке соединение 6 в виде белого твердого вещества. 4-[2-(5-Метоксибензоимидазол-1-ил)хинолин-8-ил]бензальдегид 5 А (50 мг, 0,13 ммоль) растворяют в 500 мкл дихлорэтана (ДХЭ) в атмосфере сухого N2. К указанному раствору добавляют 80 мкл АсОН,циклолропиламин (50 мкл, 0,65 ммоль) и (42 мг, 0,20 ммоль) триацетоксиборгидрид натрия(NaHB(OAc)3). Реакционную смесь перемешивают при температуре окружающей среды в течение 2 ч,после чего дополнительно добавляют 20 мкл циклопропиламина и 20 мг NaHB(OAc)3 и полученную смесь перемешивают в течение ночи. Реакционную смесь затем распределяют между водным 0,1 н. NaOH и ДХМ. ДХМ слой вновь промывают водным 0,1 н. NaOH и затем сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая 60 мг указанного в заголовке соединения 7 в виде желтого твердого вещества.- 29005407 Следуют той же методике, что применяют в примере 7, за тем исключением, что используют третбутиламин вместо циклопропиламина, получая указанное в заголовке соединение 8 в виде желтого твердого вещества. Следуют той же методике, что применяют в примере 5, за тем исключением, что используют ацетат аммония вместо 2,0 М метиламина в метаноле по примеру 5 В, получая желтое твердое вещество. Твердое вещество очищают флэш-хроматографией на силикагеле с градиентным элюированием от ДХМ/МеОН(5/95) - ДХМ/МеОН (15/85) до ДXM/MeOH/NH4OH (15/94,5/0,5), получая указанное в заголовке соединение 9 в виде белого твердого вещества. Следуют той же методике, что применяют в примере 1, за тем исключением, что используют 4 этокси-2-нитроанилин вместо 4-метокси-2-нитроанилина по примеру 1 В, получая указанное в заголовке соединение 10 в виде желтого твердого вещества. Следуют той же методике, что применяют в примере 4, за тем исключением, что используют 1-[2(5-этоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламин 10 вместо 1-[2-(5-метоксибензоимидазол-1-ил)хинолин-8-ил]пиперидин-4-иламина 1, получая указанное в заголовке соединение 11 в виде желтого твердого вещества.
МПК / Метки
МПК: A61P 35/00, A61K 31/47, C07D 401/14
Метки: средства, бензоимидазола, производные, используемые, качестве, антипролиферативного
Код ссылки
<a href="https://eas.patents.su/30-5407-proizvodnye-benzoimidazola-ispolzuemye-v-kachestve-antiproliferativnogo-sredstva.html" rel="bookmark" title="База патентов Евразийского Союза">Производные бензоимидазола, используемые в качестве антипролиферативного средства</a>
Предыдущий патент: Фармацевтические препараты на основе бибапцитида для визуализации и лечения тромбов
Следующий патент: Тартратная соль производного тиазолидиндиона












