Производные тиооксиндола
Номер патента: 5034
Опубликовано: 28.10.2004
Авторы: Коко Марси С., Джоунс Тодд К., Жанг Пувен, Фенсам Эндрю, Меленски Эвард Дж., Жи Лин, Тегли Кристофер М., Вроубел Джей Э., Эдвардс Джеймс П.
Формула / Реферат
1. Соединение формулы
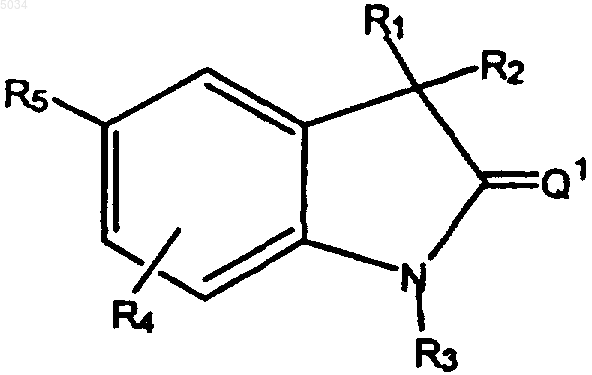
где R1 и R2 независимо выбирают из группы, состоящей из H, C1-C8алкила, замещенного C1-C8алкила, OH, O(C1-C8алкила), O(замещенного C1-C8алкила), OAc, арила, замещенного арила, гетероарила, замещенного гетероарила, C1-C8алкиларила; C1-C8алкилгетероарила, 1-пропинила и 3-пропинила;
или R1 и R2 сконденсированы с образованием кольца, содержащего -CH2(CH2)nCH2-, -CH2CH2C(CH3)2CH2CH2-, -O(CH2)mCH2-; -O(CH2)pO-, -CH2CH2OCH2CH2-; -CH2CH2N(H)CH2CH2- или -CH2CH2N(алкил)CH2CH2-;
m целое число от 1 до 4;
n целое число от 1 до 5;
p целое число от 1 до 4;
или R1 и R2 вместе составляют двойную связь к одной из следующих групп:
C(CH3)2, C(циклоалкилу), O или C(циклоэфиру);
R3 выбирают из группы, состоящей из H, OH, NH2, C1-C6алкила, замещенного C1-C6алкила, C3-C6алкенила, алкинила; замещенного алкинила или CORA;
RA выбирают из группы, состоящей из H, C1-C3алкила, замещенного C1-C3алкила, C1-C3алкокси, замещенного C1-C3алкокси, C1-C3аминоалкила и замещенного C1-C3аминоалкила;
R4 выбирают из группы, состоящей из H, галогена, CN, NH2, C1-C6алкила, замещенного C1-C6алкила, C1-C6алкокси, замещенного C1-C6алкокси, C1-C6аминоалкила или замещенного C1-C6аминоалкила;
R5 выбирают из групп a), b) или c)
a) замещенное бензольное, содержащее заместители X, Y и Z, как показано ниже
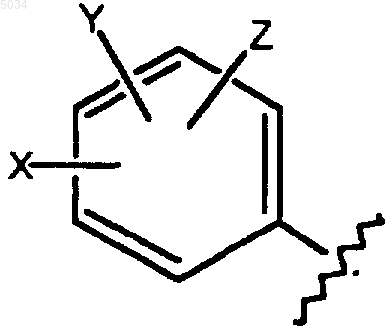
где X выбирают из группы, состоящей из H, галогена, OH, CN, C1-C3алкила, замещенного C1-C3алкила, C1-C3алкокси, замещенного C1-C3алкокси, C1-C3тиоалкила, замещенного C1-C3тиоалкила, S(O)алкила, S(O)2алкила, C1-C3аминоалкила, замещенного C1-C3аминоалкила, NO2, C1-C3перфторалкила, 5- или 6-членного гетероциклического кольца, содержащего в своем скелете от 1 до 3 гетероатомов, CONH2, CSNH2, CONH(C1-C8)алкила, CSNH(C1-C8)алкила, CON(C1-C8алкила)2, CSN(C1-C8алкила)2, CORB, OCORB или NRCCORB;
RB выбирают из группы, состоящей из H, C1-C3алкила, замещенного C1-C3алкила, арила, замещенного арила, C1-C3алкокси, замещенного C1-C3алкокси, C1-C3аминоалкила и замещенного C1-C3аминоалкила;
RC представляет собой H, C1-C3алкил или замещенный C1-C3алкил;
Y и Z независимо выбирают из группы, состоящей из H, галогена, CN, NO2, C1-C3алкокси, C1-C4алкила и C1-C3тиоалкила;
где все X, Y и Z не могут быть одновременно H;
b) 5- или 6-членное гетероциклическое кольцо с 1, 2 или 3 гетероатомами в кольце, выбранными из группы, состоящей из O, S, S(O), S(O2) и NR6 и содержащее 1 или 2 независимых заместителя, выбранных из группы, состоящей из H, галогена, CN, NO2 и C1-C3алкила, C1-C3алкокси, C1-C3аминоалкила, CORD и NRECORD;
RD представляет собой H, C1-C3алкил, замещенный C1-C3алкил, арил, замещенный арил, C1-C3алкокси, замещенный C1-C3алкокси, C1-C3аминоалкил или замещенный C1-C3аминоалкил;
RE представляет собой H, C1-C3алкил или замещенный C1-C3алкил;
R6 отсутствует или представляет собой H, CORD или C1-C3алкил; или
c) индол-4-ил, индол-7-ил или бензо-2-тиофеновый остаток, который необязательно замещен от 1 до 3 заместителями, выбранными из группы, состоящей из галогена, C1-C6алкила, CN, NO2, C1-C6алкокси или CF3;
Q1 представляет собой S, NR7 или CR8R9;
R7 выбирают из группы, состоящей из CN, C1-C6алкила, замещенного C1-C6алкила, C3-C8циклоалкила, замещенного C3-C8циклоалкила, арила, замещенного арила, гетероциклила, замещенного гетероциклила, ацила, замещенного ацила, ароила, замещенного ароила, SO2CF3, OR11 или NR11R12;
R8 и R9 представляют собой независимые заместители, выбранные из группы,состоящей из H, C1-C6алкила, замещенного C1-C6алкила, C3-C8циклоалкила, замещенного C3-C8циклоалкила, арила, замещенного арила, гетероциклила, замещенного гетероциклила, NO2, CN и CO2R10;
R10 представляет собой C1-C3алкил; или
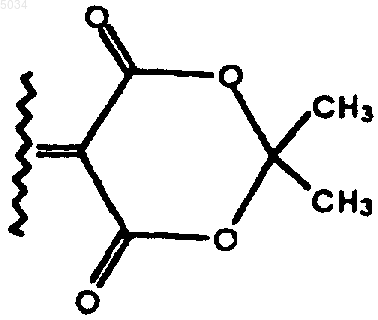
CR8R9 образуют шестичленное кольцо, структура которого показана ниже
R11 и R12 независимо выбирают из группы, состоящей из H, C1-C6алкила, замещенного C1-C6алкила, арила, замещенного арила, гетероарила, замещенного гетероарила, ацила, замещенного ацила, ароила, замещенного ароила или сульфонила;
где арил выбирают из группы, состоящей из фенила, нафтила, бифенила, антрила, тетрагидронафтила или фенантрила;
гетероциклил или гетероарил выбирают из группы, состоящей из тетрагидрофурана, пиперидинила, пиперазинила, 2-оксопиперидинила, азепинила, пирролидинила, имидазолила, пиридила, пиразинила, пиримидинила, пиридазинила, оксазолила, изоксазолила, морфолинила, индолила, хинолинила, тиенила, фурила, бензофуранила, бензотиенила, тиаморфолинила, тиаморфолинилсульфоксида и изохинолинила;
замещенный алкил или замещенный алкинил содержат один или более заместителей, выбранных из группы, содержащей галоген, CN, OH, NO2, амино, арил, гетероциклил, замещенный арил, замещенный гетероциклил, алкокси, арилокси, замещенный алкилокси, алкилкарбонил, алкилкарбокси, алкиламино и арилтио;
замещенный арил содержит 1-4 заместителя, выбранных из группы, содержащей галоген, CN, OH, NO2, амино, алкил, циклоалкил, алкенил, алкинил, алкокси, арилокси, замещенный алкилокси, алкилкарбонил, алкилкарбокси, алкиламино и арилтио;
замещенный гетероциклил или гетероарил содержат 1-4 заместителя, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, алкила, замещенного алкила, циклоалкила, алкенила, замещенного алкенила, алкинила, алкокси, арилокси, замещенного алкилокёш, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный ацил и ароил содержат 1-6 групп, выбранных из галогена CN, OH и NO2;
замещенный алкокси, замещенный аминоалкил и замещенный тиоалкил содержат 1-3 заместителя, выбранных из группы, состоящей из алкила и замещенного алкила;
или его фармацевтически приемлемая соль.
2. Соединение формулы
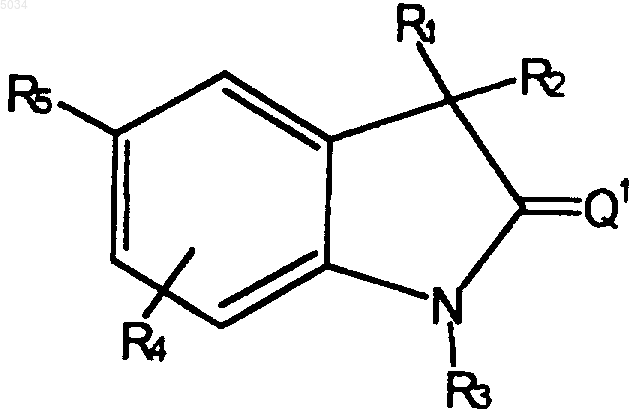
где R1 и R2 сконденсированы с образованием пяти или шестичленного карбоциклического кольца;
R3 выбирают из группы, состоящей из H, OH, NH2, C1-C6алкила, замещенного C1-C6алкила, C3-C6алкенила, алкинила, замещенного алкинила и CORA;
RA выбирают из группы, состоящей из H, C1-C3алкила, замещенного C1-C3алкила, C1-C3алкокси, замещенного C1-C3алкокси, C1-C3аминоалкила и замещенного C1-C3аминоалкила;
R4 выбирают из группы, состоящей из H, галогена, CN, NH2, C1-C6алкила, замещенного C1-C6алкила, C1-C6алкокси, замещенного C1-C6алкокси, C1-C6аминоалкила и замещенного C1-C6аминоалкила;
R5 представляет собой a) или b)
a) замещенное бензольное кольцо формулы
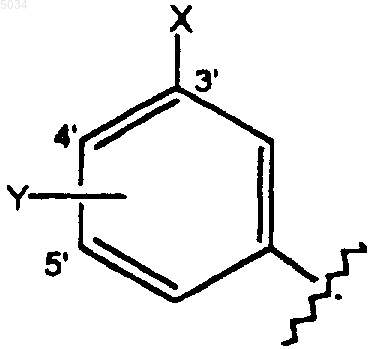
где X выбирают из группы, состоящей из H, галогена, CN, CONH2, CSNH2, CONH(C1-C8алкил), CSNH(C1-C8алкил), CON(C1-C8алкил)2, CSN(C1-C8алкил)2, C1-C3алкокси, C1-C3алкила, NO2, C1-C3перфторалкила, 5-членного гетероциклического кольца, содержащего в своем скелете от 1 до 3 гетероатомов, и C1-C3тиоалкокси;
Y представляет собой заместитель по 4' или 5' положению, выбранный из группы, состоящей из H, галогена, CN, NO2, C1-C3алкокси, C1-C4алкила и C1-C3тиоалкила;
при этом X и Y оба одновременно не являются H; или
b) шестичленное кольцо со структурой
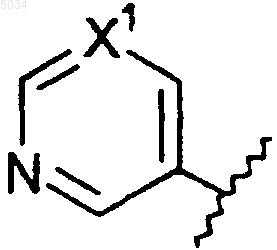
где X1 представляет собой N или CX2,
X2 представляет собой галоген, CN, CONH2, CSNH2, CONH(C1-C8алкил), CSNH(C1-C8алкил), CON(C1-C8алкил)2, CSN(C1-C8алкил)2 или NO2;
Q1 представляет собой S, NR7 или CR8R9;
R7 выбирают из группы, состоящей из CN, C1-C6алкила, замещенного C1-C6 алкила, C3-C8циклоалкила, замещенного C3-C8циклоалкила, арила, замещенного арила, гетероциклила, замещенного гетероциклила и SO2CF3;
R8 и R9 представляют собой независимые заместители, выбранные из группы, состоящей из H, C1-C6алкила, замещенного C1-C6алкила, C3-C8циклоалкила, замещенного C3-C8циклоалкила, арила, замещенного арила, гетероциклила, замещенного гетероциклила, NO2, CN и CO2R10;
R10 представляет собой C1-C3алкил;
или CR8R9 представляет собой шестичленное кольцо, структура которого показана ниже
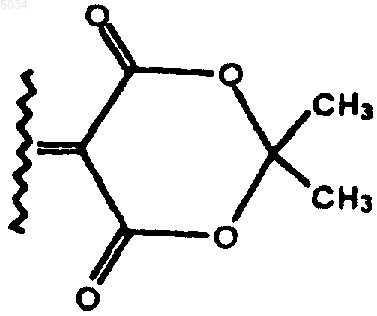
где арил выбирают из группы, состоящей из фенила, нафтила, бифенила, антрила, тетрагидронафтила или фенантрила;
гетероциклил выбирают из группы, состоящей из тетрагидрофурана, пиперидинила, пиперазинила, 2-оксопиперидинила, азепинила, пирролидинила, имидазолила, пиридила, пиразинила, пиримидинила, пиридазинила, оксазолила, изоксазолила, морфолинила, индолила, хинолинила, тиенила, фурила, бензофуранила, бензотиенила, тиаморфолинила, тиаморфолинилсульфоксида и изохинолинила;
замещенный алкил или замещенный алкинил содержат один или более заместителей, выбранных из группы, содержащей галоген, CN, OH, NO2, амино, арил, гетероциклил, замещенный арил, замещенный гетероциклил, алкокси, арилокси, замещенный алкилокси, алкилкарбонил, алкилкарбокси, алкиламино и арилтио;
замещенный арил содержит 1-4 заместителя, выбранных из группы, содержащей галоген, CN, OH, NO2, амино, алкил, циклоалкил, алкенил, алкинил, алкокси, арилокси, замещенный алкилокси, алкилкарбонил, алкилкарбокси, алкиламино и арилтио;
замещенный гетероциклил содержит 1-4 заместителя, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, алкила, замещенного алкила, циклоалкила, алкенила, замещенного алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный ацил и ароил содержат 1-6 групп, выбранных из галогена CN, OH и NO2;
замещенный алкокси, замещенный аминоалкил и замещенный тиоалкил содержат 1-3 заместителя, выбранных из группы, состоящей из алкила и замещенного алкила;
или его фармацевтически приемлемая соль.
3. Соединение формулы
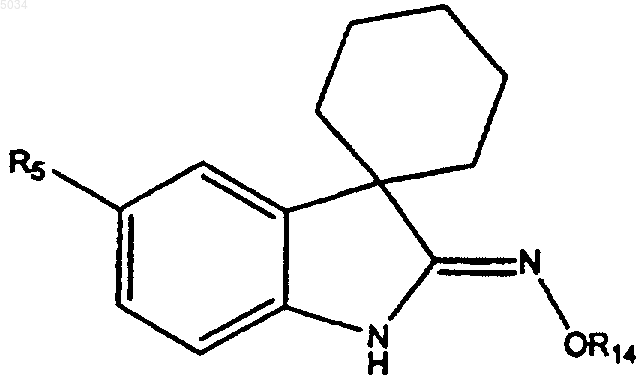
или его таутомер, где
R14 выбирают из группы, состоящей из H, ацила, замещенного ацила, ароила, замещенного ароила, сульфонила и замещенного сульфонила;
R5 представляет собой a), b) или c)
a) замещенное бензольное кольцо, содержащее заместители X и Y, как показано ниже
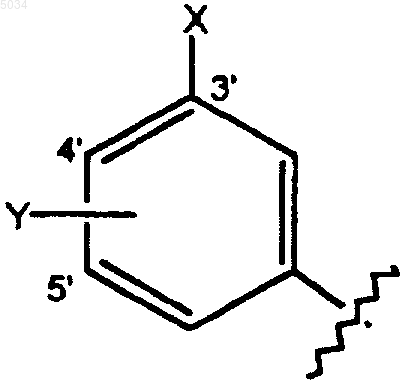
где X выбирают из группы, состоящей из H, галогена, CN, CONH2, CSNH2, CONH(C1-C8алкил), CSNH(C1-C8алкил), CON(C1-C8алкил)2, CSN(C1-C8алкил)2, CNHNHOH, CNH2NOH, C1-C3алкокси, C1-C3алкила, NO2, C1-C3перфторалкила, 5-членного гетероциклического кольца, содержащего в своем скелете от 1 до 3 гетероатомов, C1-C3тиоалкокси;
Y представляет собой заместитель по 4' или 5' положению, выбранный из группы, состоящей из H, галогена, CN, NO2, C1-C3алкокси, C1-C3алкила или C1-C3тиоалкила;
при этом X и Y оба не являются одновременно H;
b) пятичленное кольцо со структурой, представленной ниже
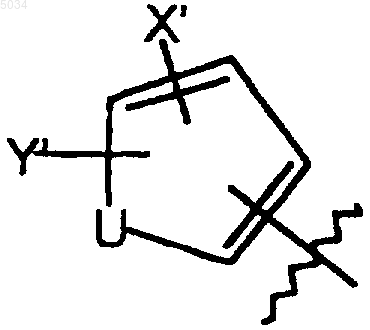
где U представляет собой O, S или NR6;
R6 представляет собой H, C1-C3алкил или алкоксикарбонил(C1-C4)алкил;
X' выбирают из группы, состоящей из галогена, CN, NO2; CONH2, CNHNHOH, CNH2NOH, CSNH2, CONH(C1-C8алкил), CSNH(C1-C8алкил), CON(C1-C8алкил)2, CSN(C1-C8алкил)2, C1-C3алкила и C1-C3алкокси;
Y' выбирают из группы, состоящей из H, галогена и C1-C4алкила; где галоген представляет собой F; или
c) шестичленное кольцо формулы, приведенной ниже
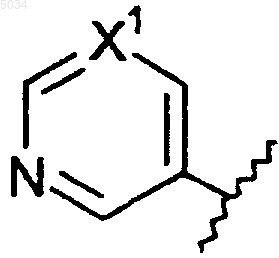
где X1 представляет собой N или CX2,
X2 представляет собой галоген, CN, CONH2, CSNH2, CONH(C1-C8алкил), CSNH(C1-C8алкил), CON(C1-C8алкил)2, CSN(C1-C8алкил)2 или NO2;
где гетероциклил выбирают из группы, состоящей из тетрагидрофурана, пиперидинила, пиперазинила, 2-оксопиперидинила, азепинила, пирролидинила, имидазолила, пиридила, пиразинила, пиримидинила, пиридазинила, оксазолила, изоксазолила, морфолинила, индолила, хинолинила, тиенила, фурила, бензофуранила, бензотиенила, тиаморфолинила, тиаморфолинилсульфоксида и изохинолинила;
замещенный ацил и ароил содержат 1-6 групп, выбранных из группы, состоящей из галогена CN, OH и NO2;
или его фармацевтически приемлемая соль.
4. Соединение формулы
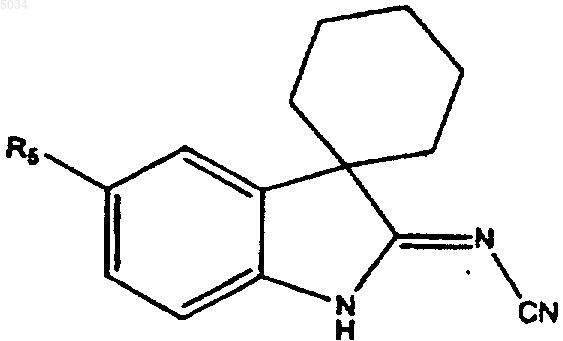
где R5 представляет собой a), b) или c)
a) замещенное бензольное кольцо, содержащее заместители X и Y, как показано ниже
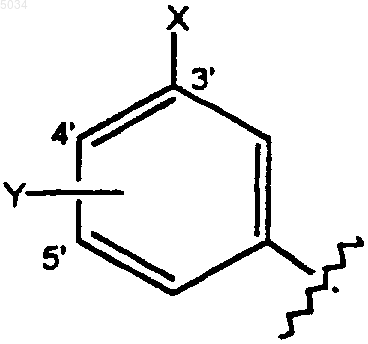
где X выбирают из группы, состоящей из H, галогена, CN, CONH2, CSNH2, CONH(C1-C8алкил), CSNH(C1-C8алкил), CON(C1-C8алкил)2, CSN(C1-C8алкил)2, CNHNOH, C1-C3алкокси, C1-C3алкила, NO2, C1-C3перфторалкила, 5-членного гетероциклического кольца, содержащего в своем скелете от 1 до 3 гетероатомов и C1-C3тиоалкокси;
Y представляет собой заместитель по 4' или 5' положению, выбранный из группы, состоящей из H, галогена, CN, NO2, C1-C3алкокси, C1-C3алкила или C1-C3тиоалкила;
при этом X и Y оба одновременно не являются H;
b) пятичленное кольцо формулы, приведенной ниже
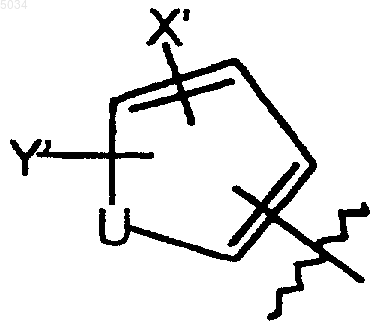
где U представляет собой O, S или NR6;
R6 выбирают из H, C1-C3алкила или алкоксикарбонил(C1-C4)алкила;
X' выбирают из группы, состоящей из галогена, CN, NO2, CONH2, CSNH2, CONH(C1-C8алкил), CSNH(C1-C8алкил), CON(C1-C8алкил)2, CSN(C1-C8алкил)2, C1-C3алкила и C1-C3алкокси;
Y' выбирают из группы, состоящей из H, галогена и C1-C4алкила;
где галоген представляет собой F; или
c) шестичленное кольцо формулы, приведенной ниже
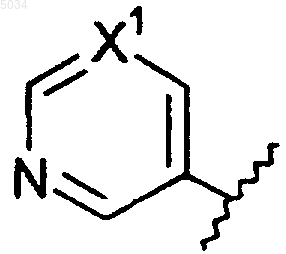
где X1 представляет собой N или CX2,
X2 представляет собой галоген, CN, CONH2, CSNH2, CONH(C1-C8алкил), CSNH(C1-C8алкил), CON(C1-C8алкил)2, CSN(C1-C8алкил)2 или NO2;
где гетероциклил выбирают из группы, состоящей из тетрагидрофурана, пиперидинила, пиперазинила, 2-оксопиперидинила, азепинила, пирролидинила, имидазолила, пиридила, пиразинила, пиримидинила, пиридазинила, оксазолила, изоксазолила, морфолинила, индолила, хинолинила, тиенила, фурила, бензофуранила, бензотиенила, тиаморфолинила, тиаморфолинилсульфоксида и изохинолинила;
или его фармацевтически приемлемая соль.
5. Соединение формулы

где R15 выбирают из группы, состоящей из H, CO2R10, ацила, замещенного ацила, ароила, замещенного ароила, алкила, замещенного алкила и CN;
R10 представляет собой C1-C3алкил;
R5 представляет собой a), b) или c)
a) замещенное бензольное кольцо, содержащее заместители X и Y, как показано ниже
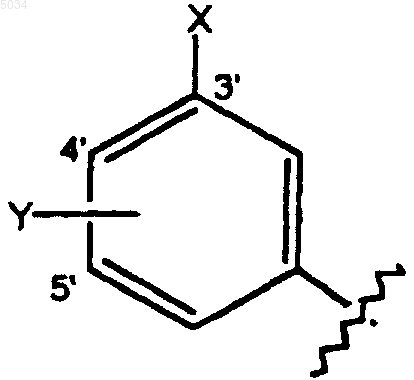
где X выбирают из группы, состоящей из H, галогена, CN, CONH2, CSNH2, CONH(C1-C8алкил), CSNH(C1-C8алкил), CON(C1-C8алкил)2, CSN(C1-C8алкил)2, CNHNOH, C1-C3алкокси, C1-C3алкила, NO2, C1-C3перфторалкила, 5-членного гетероциклического кольца, содержащего в своем скелете от 1 до 3 гетероатомов и C1-C3тиоалкокси;
Y представляет собой заместитель по 4' или 5' положению, выбранный из группы, состоящей из H, галогена, CN, NO2, C1-C3алкокси, C1-C3алкила или C1-C3тиоалкила;
где X и Y оба одновременно не являются H;
b) пятичленное кольцо формулы, приведенной ниже
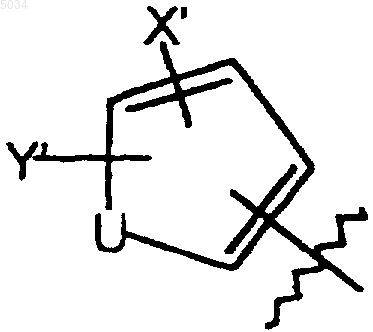
где U представляет собой O, S или NR6;
R6 представляет собой H, C1-C3алкил или алкоксикарбонил(C1-C4)алкил;
X' выбирают из группы, состоящей из галогена, CN, NO2, CONH2, CSNH2, CONH(C1-C8алкил), CSNH(C1-C8алкил), CON(C1-C8алкил)2, CSN(C1-C8алкил)2, C1-C3алкила и C1-C3алкокси;
Y' выбирают из группы, состоящей из H, галогена и C1-C4алкила;
или
c) шестичленное кольцо формулы, приведенной ниже
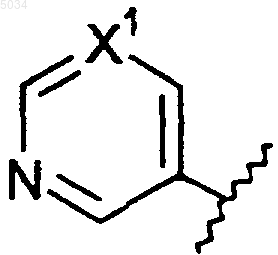
где X1 представляет собой N или CX2,
X2 представляет собой галоген, CN, CONH2, CSNH2, CONH(C1-C8алкил), CSNH(C1-C8алкил), CON(C1-C8алкил)2, CSN(C1-C8алкил)2 или NO2;
где замещенный алкил содержит один или более заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, арила, гетероциклила, замещенного арила, замещенного гетероциклила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
гетероциклил выбирают из группы, состоящей из тетрагидрофурана, пиперидинила, пиперазинила, 2-оксопиперидинила, азепинила, пирролидинила, имидазолила, пиридила, пиразинила, пиримидинила, пиридазинила, оксазолила, изоксазолила, морфолинила, индолила, хинолинила, тиенила, фурила, бензофуранила, бензотиенила, тиаморфолинила, тиаморфолинилсульфоксида и изохинолинила;
замещенный ацил и ароил содержат 1-6 групп, выбранных из группы, состоящей из галогена CN, OH и NO2;
или его фармацевтически приемлемая соль.
6. Соединение формулы
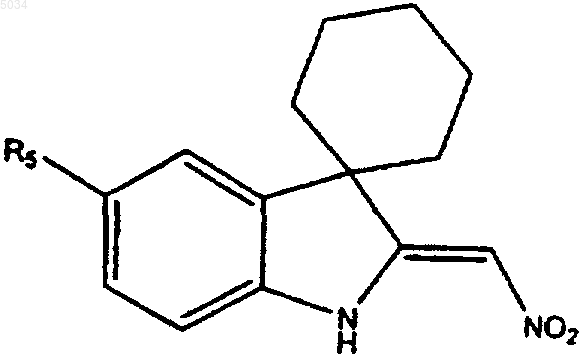
где R5 представляет собой a), b) или c)
a) замещенное бензольное кольцо, содержащее заместители X и Y, как показано ниже
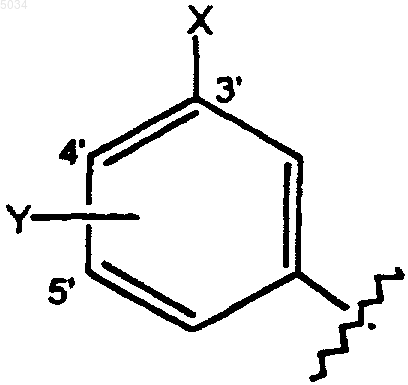
где X выбирают из группы, состоящей из H, галогена, CN, CONH2, CSNH2, CONH(C1-C8алкил), CSNH(C1-C8алкил), CON(C1-C8алкил)2, CSN(C1-C8алкил)2, CNHNOH, C1-C3алкокси, C1-C3алкила, NO2, C1-C2перфторалкила, 5-членного гетероциклического кольца, содержащего в своем скелете от 1 до 3 гетероатомов и C1-C3тиоалкокси;
Y представляет собой заместитель по 4' или 5' положеншю, выбранный из группы, состоящей из H, галогена, CN, NO2, C1-C3алкокси, C1-C3алкила и C1-C3тиоалкила;
где X и Y оба одновременно не являются H;
b) пятичленное кольцо формулы, приведенной ниже
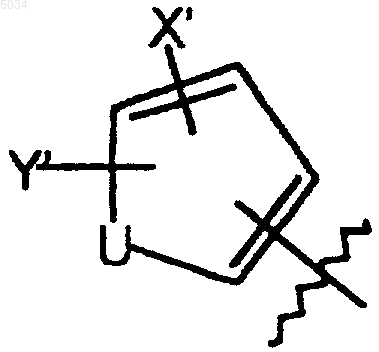
где U представляет собой O, S или NR6;
R6 представляет собой H, C1-C3алкил или алкоксикарбонил(C1-C4)алкил;
X' выбирают из группы, состоящей из галогена, CN, NO2, CONH2, CSNH2, CONH(C1-C8алкил), CSNH(C1-C8алкил), CON(C1-C8алкил)2, CSN(C1-C8алкил)2, C1-C3алкила и C1-C3алкокси;
Y' выбирают из группы, состоящей из H, галогена и C1-C4алкила; при этом галоген представляет собой F; или
c) шестичленное кольцо формулы, приведенной ниже
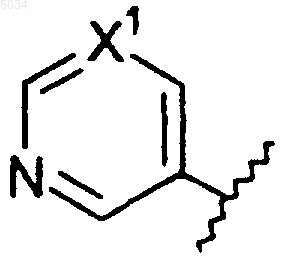
где X1 представляет собой N или CX2, и
X2 представляет собой галоген, CN, CONH2, CSNH2, CONH(C1-C8алкил), CSNH(C1-C8алкил), CON(C1-C8алкил)2, CSN(C1-C8алкил)2 или NO2;
где гетероциклил выбирают из группы, состоящей из тетрагидрофурана, пиперидинила, пиперазинила, 2-оксопиперидинила, азепинила, пирролидинила, имидазолила, пиридила, пиразинила, пиримидинила, пиридазинила, оксазолила, изоксазолила, морфолинила, индолила, хинолинила, тиенила, фурила, бензофуранила, бензотиенила, тиаморфолинила, тиаморфолинилсульфоксида и изохинолинила;
или его фармацевтически приемлемая соль.
7. Соединение, выбранное из группы, содержащей
5"-(3-фторфенил)спиро[циклогексан-1,3'-[3H]индол]-2'(1'H)-он оксим,
5'-(2-фторфенил)спиро[циклогексан-1,3'-[3H]индол]-2'(1'H)-он оксим,
5'-(4-фторфенил)спиро[циклогексан-1,3'-[3H]индол]-2'(1'H)-он оксим,
5'-(3,4-дифторфенил)спиро[циклогексан-1,3'-[3H]индол]-2'(1'H)-он оксим,
5'-(3-метоксифенил)спиро[циклогексан-1,3'-[3H]индол]-2'(1'H)-он оксим,
5'-(3-нитрофенил)спиро[циклогексан-1,3'-[3H]индол]-2'(1'H)-он оксим и
5'-(3-цианофенил)спиро[циклогексан-1,3'-[3H]индол]-2'(1'H)-он оксим,
или его фармацевтически приемлемая соль.
8. Соединение по п.1 или 2 формулы
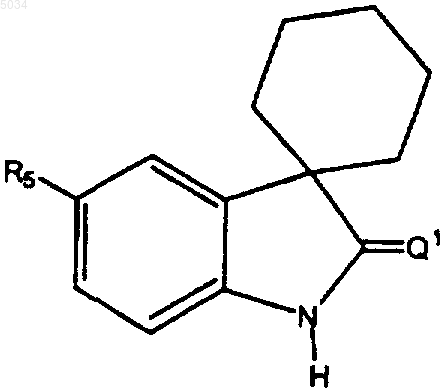
где R5 представляет собой замещенное кольцо формулы
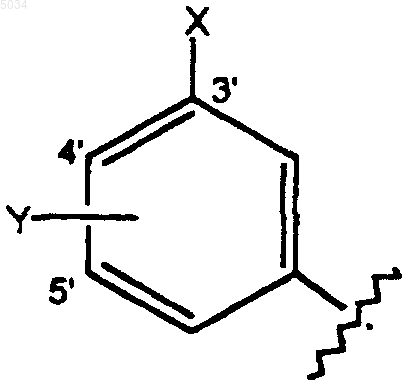
где X выбирают из группы, состоящей из H, галогена, CN, CONH2, CSNH2, CONH(C1-C8алкил), CSNH(C1-C8алкил), CON(C1-C8алкил)2, CSN(C1-C8алкил)2, C1-C3алкокси, C1-C3алкила, NO2, C1-C3перфторалкила, 5-членного гетероциклического кольца, содержащего в своем скелете от 1 до 3 гетероатомов, и C1-C3тиоалкила;
Y представляет собой заместитель по 4' или 5' положению, выбранный из группы, состоящей из H, галогена, CN, NO2, C1-C3алкокси, C1-C3алкила и C1-C3тиоалкила;
где X и Y оба одновременно не являются H.
9. Соединение по п.1 или 2 формулы
где R5 представляет собой пятичленное кольцо со структурой, представленной ниже
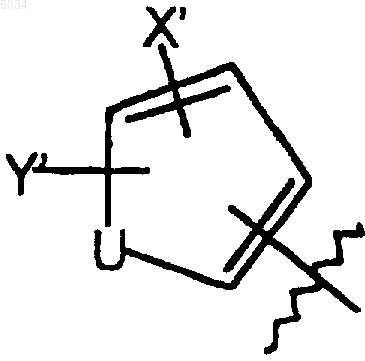
где U представляет собой O, S или NR6;
R6 представляет собой H или C1-C3алкил;
X' выбирают из группы, состоящей из галогена, CN, NO2, C1-C3алкила, C1-C3алкокси;
Y' выбирают из группы, состоящей из H, галогена и C1-C3алкила;
где галоген представляет собой F.
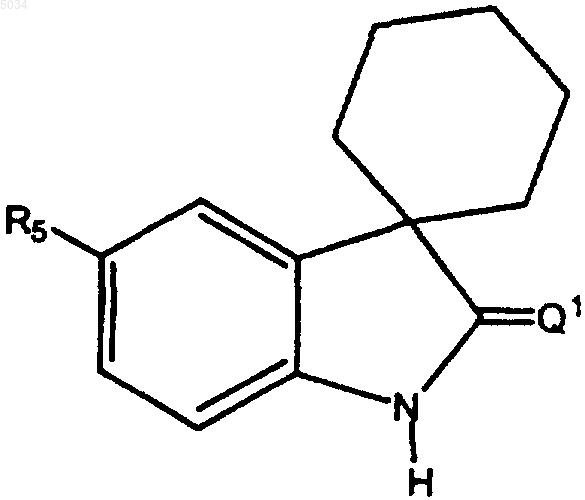
10. Соединение по п.1 или 2 формулы
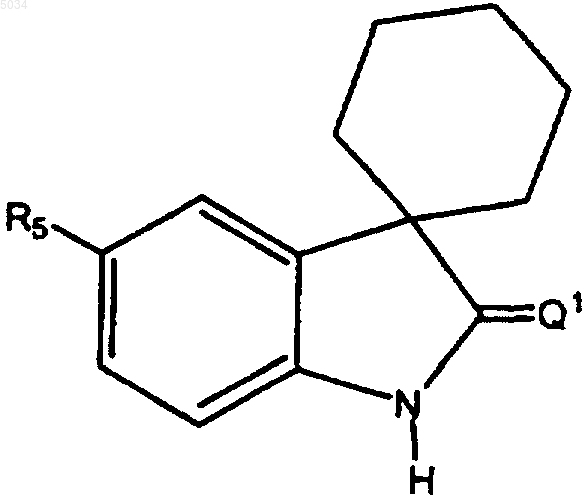
где R5 представляет собой шестичленное кольцо формулы

где X1 представляет собой CX2,
X2 представляет собой галоген, CN, CONH2, CONH(C1-C8алкил), CON(C1-C8алкил)2, или NO2;
R7 выбирают из группы, состоящей из CN, C1-C6алкила, замещенного C1-C6алкила, C3-C8циклоалкила, замещенного C3-C8циклоалкила, арила, замещенного арила, гетероциклила, или замещенного гетероциклила и SO2CF3.
11. Соединение, выбранное из группы, состоящей из
5'-(3-хлорфенил)спиро[циклогексан-1,3'-[3H]индол]-2'(1'H)тиона,
3-(1',2'-дигидро-2'-тиоксоспиро[циклогексан-1,3'-[3H]индол]-5'-ил)бензонитрила,
4-(1',2'-дигидро-2'-тиоксоспиро[циклогексан-1,3'-[3H]индол]-5'-ил)-2-тиофенкарбонитрила,
3-(1,2-дигидро-2-тиоксоспиро[циклогексан-1,3-[3H]индол]-5-ил)-5-фторбензонитрила,
4-метил-5-(1,2-дигидро-2-тиоксоспиро[циклогексан-1,3-[3H]-индол]-5-ил)-2-тиофентиоамида,
5'-(5-циано-1-метил-1H-пиррол-2-ил)спиро[циклогексан-1,3'-[3H]индол]-2'-илиденцианамида,
5-(1,2-дигидро-2-тиоксоспиро[циклопентан-1,3-[3H]индол]-5'-ил)-1H-пиррол-2-карбонитрила,
5-(1,2-дигидро-2-тиоксоспиро[циклогексан-1,3-[3H]индол]-5-ил)-1H-пиррол-2-карбонитрила,
5-(2'-тиоксоспиро[циклогексан-1,3'-[3H]индол]-5'-ил)-1-метилпиррол-2-карбонитрила,
5-(1,2-дигидро-2-тиоксоспиро[циклопентан-1,3-[3H]индол]-5-ил)-3-тиофенкарбонитрила,
5-(1,2-дигидро-2-тиоксоспиро(циклопентан-1,3-[3H]индол)-5-ил)-2-тиофенкарбонитрила,
5-(3-фтор-4-метоксифенил)спиро[циклогексан-1,3-[3H]индол]-2(1H)тиона,
5-(2-амино-5-пиримидинил)спиро[циклогексан-1,3-[3H]индол]-2(1H)тиона,
3-(1,2-дигидро-2-тиоксоспиро[циклопентан-1,3-[3H]индол]-5-ил)-5-фторбензонитрила,
3-(1,2-дигидро-2-тиоксоспиро[циклогексан-1,3-[3H]индол]-2-ил)-4-фторбензонитрила,
5-(1,2-дигидро-2-тиоксоспиро[циклогексан-1,3-[3H]индол]-2-ил)-3-пиридинкарбонитрил,
5-(3,4-дифторфенил)спиро[циклогексан-1,3-[3H]индол]-2(1H)тиона,
5-(5-хлор-2-тиенил)спиро[циклогексан-1,3-[3H]индол]-2(1H)тиона,
5-(1,2-дигидро-2-тиоксоспиро[циклогексан-1,3-[3H]индол]-5-ил)-3-фуранкарбонитрила,
5-(3-хлор-4-фторфенил)спиро[циклогексан-1,3-[3H]индол]-2(1H)тиона,
5-(3-хлор-5-фторфенил)спиро[циклогексан-1,3-[3H]индол]-2(1H)тиона,
5-(3,5-дифторфенил)спиро[циклогексан-1,3-[3H]индол]-2(1H)тиона,
5-(1,2-дигидро-2-тиоксоспиро[циклогексан-1,3-[3H]индол]-5-ил)-4-пропил-2-тиофенкарбонитрила,
5-(3-фтор-4-нитрофенил)спиро[циклогексан-1,3-[3H]индол]-2(1H)тиона,
4-(1,2-дигидро-2-тиоксоспиро[циклогексан-1,3-[3H]индол]-5-ил)-2-фуранкарбонитрила,
5"-(3-хлорфенил)спиро[циклобутан-1,3"-[3H]индол]-2"(1"H)тиона,
5"-(2-хлорфенил)спиро[циклогексан-1,3"-[3H]индол]-2"(1"H)тиона,
5"-(4-хлорфенил)спиро[циклогексан-1,3"-[3H]индол]-2"(1"H)тиона,
5"-(1",2"-дигидро-2"-тиоксоспиро[циклогексан-1,3"-[3H]индол]-5"-ил)-4-метил-2-тиофенкарбонитрила,
5'-(1",2"-дигидро-2"-тиоксоспиро[циклогексан-1,3"-[3H]индол]-5"-ил)-2-тиофенкарбонитрила,
5"-(3-фторфенил)спиро[циклогексан-1,3"-[3H]индол]-2"(1"H)тиона,
5-(3-гидроксифенил)спиро[циклогексан-1,3-[3H]индол]-2(1H)тиона,
5-[4-фтор-3-(трифторметил)фенил]спиро[циклогексан-1,3-[3H]индол]-2(1H)тиона,
4-(1,2-дигидро-2-тиоксоспиро[циклогексан-1,3-[3H]индол]-5-ил)-2-фторбензонитрила,
5-(3-фтор-5-метоксифенил)спиро[циклогексан-1,3-[3H]индол]-2(1H)тиона,
3-[1',2'-дигидро-2'-(гидроксиимино)спиро[циклогексан-1,3'-[3H]индол]-5'-ил]-5-фторбензонитрила,
5-(спиро[циклогексан-1,3'-[3H]индол]-2'-(гидроксиимино)-5'-ил)-4-метил-2-тиофенкарбонитрила,
5-(спиро[циклогексан-1,3'-[3H]индол]-2'-(гидроксиимино)-5'-ил)-2-тиофенкарбонитрила,
4-(спиро[циклогексан-1,3'-[3H]индол]-2'-(гидроксиимино)-5'-ил)-2-тиофенкарбонитрила,
5-(спиро[циклогексан-1,3'-[3H]индол]-2'-(гидроксиимино)-5'-ил)-1H-пиррол-1-метил-2-карбонитрила,
5-(спиро[циклогексан-1,3'-[3H]индол]-2'-(гидроксиимино)-5'-ил)-1H-пиррол-2-карбонитрила,
4-(спиро[циклогексан-1,3'-[3H]индол]-2'-(ацетоксиимино)-5'-ил)-2-тиофенкарбонитрила,
3-фтор-N'-гидрокси-5-[2'-(гидроксиамино)спиро[циклогексан-1,3'-[3H]индол]-5'-ил]бензолкарбоксимидамида,
N'-гидрокси-5-(спиро[циклогексан-1,3'-[3H]индол]-(2'-(гидроксиимино)-5'-ил)-4-метил-2-тиофенкарбоксимидамида,
N'-гидрокси-4-(спиро[циклогексан-1,3'-[3H]индол]-2'(гидроксиимино)-5'-ил-2-тиофенкарбоксимидамида,
N'-гидрокси-5-(спиро[циклогексан-1,3'-[3H]индол]-2'-(гидроксиимино)-5'-ил)-2-тиофенкарбоксимидамида,
5'-(3-хлорфенил)спиро[циклогексан-1,3'-[3H]индол]-2'-илиденцианамида,
5'-(3-циано-5-фторфенил)спиро[циклогексан-1,3'-[3H]индол]-2'-илиденцианамида,
5'-(5-циано-1H-пиррол-2-ил)спиро[циклогексан-1,3'-[3H]индол]-2'-илиденцианамида,
5'-(5-цианотиофен-2-ил)спиро[циклогексан-1,3'-[3H]индол]-2'-илиденцианамида,
5'-(5-циано-3-метилтиофен-2-ил)спиро[циклогексан-1,3'-[3H]индол]-2'-илиденцианамида,
5'-(5-цианотиофен-3-ил)спиро[циклогексан-1,3'-[3H]индол]-2'-илиденцианамида,
3-(спиро[циклогексан-1,3'-[3H]индол]-5'-ил)-5-фторбензонитрила,
5-(спиро[циклогексан-1,3'-[3H]индол]-2'-цианометилен-5'-ил)-1H-пиррол-2-карбонитрила,
5-(спиро[циклогексан-1,3'-[3H]индол]-2'-цианометилен-5'-ил)-1-метил-1H-пиррол-2-карбонитрила,
5-(2'-цианометиленспиро[циклогексан-1,3'-[3H]индол]-5'-ил)тиофен-2-карбонитрила,
5-(спиро[циклогексан-1,3'-[3H]индол]-2'-цианометилен-5'-ил)-4-метилтиофен-2-карбонитрила,
4-(спиро[циклогексан-1,3'-[3H]индол]-2'-цианометилен-5'-ил)тиофен-2-карбонитрила,
5-(3-хлорфенил)-3,3-диметил-1,3-дигидро-2H-индол-2-тиона,
3-бензил-5-(3-хлорфенил)-3-метил-1,3-дигидро-2H-индол-2-тиона,
4-(3,3-диметил-2-тиоксо-2,3-дигидро-1H-индол-5-ил)-2-фуронитрила,
5-(3-метоксифенил)-3,3-диметил-1,3-дигидро-2H-индол-2-тиона и
5-(3-хлорфенил)-3,3-диэтил-1,3-дигидро-2H-индол-2-тиона,
или его фармацевтически приемлемая соль.
12. Соединение по п.2, которое представляет собой 5-(1,2-дигидро-2-тиоксоспиро[циклогексан-1,3-[3H]индол]-5-ил)-1-(трет-бутоксикарбонил)пиррол-2-карбонитрил или 5-(1,2-дигидро-2-тиоксоспиро[циклогексан-1,3-[3H]индол]-5-ил)-4-н-бутил-2-тиофенкарбонитрил, или его фармацевтически приемлемая соль.
13. Соединение по любому из пп.3-6, где R5 представляет собой тиофен или фуран.
14. Фармацевтическая композиция, содержащая соединение по любому из пп.1-13 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или наполнитель.
15. Способ контрацепции у млекопитающего, включающий введение нуждающемуся в этом млекопитающему фармацевтически эффективного количества соединения по любому из пп.1-13 или его фармацевтически приемлемой соли.
16. Способ лечения дисфункционального кровотечения у млекопитающего, включающий введение нуждающемуся в этом млекопитающему фармацевтически эффективного количества соединения по любому из пп.1-13 или его фармацевтически приемлемой соли.
17. Способ лечения карциномы и аденокарциномы эндометрия груди, матки, яичников, толстой кишки или простаты у млекопитающего, включающий введение нуждающемуся в этом млекопитающему фармацевтически эффективного количества соединения по любому из пп.1-13 или его фармацевтически приемлемой соли.
18. Способ гормонозамещающей терапии у млекопитающего, включающий введение нуждающемуся в этом млекопитающему фармацевтически эффективного количества соединения по любому из пп.1-13 или его фармацевтически приемлемой соли.
Текст
1 Область техники, в которой относится изобретение Данное изобретение касается соединений,которые являются агонистами рецептора прогестерона, способа их получения и их применения. Уровень техники Внутриклеточные рецепторы (IR) образуют класс структурно связанных регуляторов генов, известных как "лиганд зависимые факторы транскрипции" (R.М. Evans, Science, 240,889, 1988). Семейство стероидных рецепторов представляет собой подгруппу семейства IR,включая рецептор прогестерона (PR), рецептор эстрогенов (ER), рецептор андрогенов (AR),рецептор глюкокортикоидов (GR) и рецептор минералокортикоидов (MR). Природный гормон или лиганд для рецептора PR представляет собой стероид прогестерон, но и синтетические соединения, такие как медроксипрогестерон ацетат или левоноргестрел, могут быть использованы в качестве этого же лиганда. Как только лиганд появляется в жидкости, окружающей клетку, он проходит через мембрану, посредством пассивной диффузии, и связывается с рецептором IR, образуя комплекс рецептор/лиганд. Этот комплекс связывается со специфическими промоторами генов, присутствующими в клеточной ДНК. После связывания с ДНК, комплекс продуцирует mРНК и белок, кодируемый данным геном. Соединение, которое связывается с рецептором IR и подражает действию природного гормона, называется здесь агонистом, в то время как соединение, которое препятствует действию гормона, называется антагонистом.PR агонисты (природные и синтетические),как известно, играют важную роль в здоровье женщин. Агонисты рецептора PR используются в составах, предназначенных для контроля рождаемости, обычно в присутствие агониста рецептора ER, альтернативно они могут быть использованы вместе с антагонистом рецептораPR. Агонисты рецептора ER обычно используют для лечения симптомов менопаузы, но их действие связывали с пролиферирующим эффектом на матке, что может привести к увеличению риска ее раковых заболеваний. Совместное лечение агонистами рецептора PR сокращает/исключает этот риск. Соединения, по настоящему изобретению,оказывают действие в качестве конкурентных ингибиторов связывания прогестерона с рецептором PR, и они действуют в качестве агонистов. Эти соединения могут быть использованы для контрацепции, а также и постменопаузной гормональной заместительной терапии.Jones, et al. описывают эфир енола В (патент США 5693646), в качестве лиганда рецептора PR.Jones, et al. описывают соединение С (патент США 5696127) в качестве лиганда рецептора PR.Zhi, et al. описывают лактоны -D,E,F в качестве антагонистов рецептора PR (J. Med.Zhi, et al. описывают эфир G в качестве антагониста рецептора PR (J. Med. Chem., 41, 291,1998).Combs, et al. описывают амид Н в качестве лиганда рецептора PR (J. Med. Chem., 38, 4880,1995).Fischer, et al. патентует способ получения соединений, имеющих общую структуру О (патент США 5.453.516)D I в качестве лиганда рецептора PR (Tet.Hamann, et al. описывают антагонист рецептора PR J (Ann. N. Y. Acad. Sci., 761, 383,1995).Chen, et al. описывают антагонист рецептора PR К (Chen, et al., POI-37, 16th Int. Cong.Kurihari, et al. описывают лиганд рецептора PR L (J. Antibiotics, 50, 360, 1997).Kuchla, et al. раскрыли, что оксиндол М обладает кардиотонической активностью (WO 86/03749)Weber предлагает оксиндол N для проведения кардиоваскулярных определений (WO 91/06545)Andreani, et al. описывают цитотоксический агент Q (Acta Pharn Nord., 2, 407, 1990).Binder, et al. описывают структуру R, которая является промежуточной для получения СОХ II ингибиторов (WO 97/13767)Walsh описывает оксиндол S в качестве промежуточного соединения (патент США 4.440.785, патент США 4.670.566)Bohm, et al. запатентовывают оксиндол Т как кардиоваскулярный агент (WO 91/06545)Bohm, et al. включают общую структуру UBoar, et al. описали диоксолан W в качестве промежуточного соединения для получения ингибиторов ацетилхолинэстеразыKendle, et al. описали методику получения 3,3-замещенных оксиндолов, например, X, которые используют в соответствии с настоящим изобретением. (Synth. Commun. 12,1,1982) Сущность изобретения Настоящее изобретение относится к соединениям формулы 1 или 2 где R1 и R2 независимо выбраны из группы, состоящей из Н, алкила, замещенного алкила, ОН,О(алкила), O(замещенного алкила), ОАс, арила,необязательно замещенного арила, гетероарила,необязательно замещенного гетероарила, алкиларила, алкилгетероарила, 1-пропинила или 3 пропинила или R1 и R2 сконденсированы с образованием кольца, содержащего один из следующих остатков:m целое число от 1 до 4;n целое число от 1 до 5; р целое число от 1 до 4; или R1 и R2 вместе составляют двойную связь к одному из следующих остатков: СМе 2; С(циклоалкил), О, С (циклоэфир). 6 нила, алкинила или замещенного алкинила илиRA выбирают из группы, состоящей из Н,C1-С 3 алкила, замещенного C1-С 3 алкила, C1-С 3 алкокси, замещенного C1-С 3 алкокси, C1-С 3 аминоалкила или замещенного C1-С 3 аминоалкила;R5 выбирают из группы, состоящей из а),b) или с): а) R5 представляет собой тризамещенное бензольное кольцо, содержащее заместители X, Y и Z, как показано нижеRC представляет собой Н, C1-С 3 алкил или замещенный C1-С 3 алкил;b) R5 представляет собой пяти или шестичленное гетероциклическое кольцо с 1, 2 или 3 гетероатомами, выбранными из группы О, S,SO, SO2 или NR6 и содержащее один или два независимых заместителя, выбранных из группы Н, галогена, CN, NO2 и C1-С 3 алкила, C1-С 3 алкокси,C1-С 3 аминоалкила,CORD илиRD представляет собой Н, C1-С 3 алкил, замещенный C1-С 3 алкил, арил, замещенный арил,C1-С 3 алкокси, замещенный C1-С 3 алкокси, C1-С 3 аминоалкил или замещенный C1-С 3 аминоалкил;RE представляет собой Н, C1-С 3 алкил или замещенный C1-С 3 алкил;R6 представляет собой Н или C1-С 3 алкил; или с) R5 представляет собой индол-4-ил, индол-7-ил или бензо-2-тиофеновый остаток, оста 7 ток, который необязательно может быть замещен 1-3 заместителями, выбранными из группы,состоящей из галогена, низшего алкила, CN,NO2, низшего алкокси или СF3;R8 и R9 представляют собой независимые заместители, выбранные из группы, включающей Н, C1-С 6 алкил, замещенный C1-С 6 алкил, C3 С 8 циклоалкил, замещенный C3-С 8 циклоалкил,арил, замещенный арил, гетероциклил, замещенный гетероциклил, NO2, CN или CO2R10;R11, R12 и R13 независимо выбирают из группы, состоящей из Н, C1-С 6 алкила, замещенного C1-С 6 алкила, арила, замещенного арила,гетероарила, замещенного гетероарила, ацила,замещенного ацила, ароила, замещенного ароила или сульфонила; или к их фармацевтически приемлемым солям. Предпочтительный перечень заместителей,представленный радикалами R11, R12 и R13 в группах соединений, описанных здесь, определен как Н, C1-С 6 алкил, замещенный C1-С 6 алкил,-С(O)-, (C1-С 6 алкил), -S(O)2-(C1-С 6 алкил), фенил или бензил. Должно быть понятно, что настоящее изобретение включает все таутомерные формы соединений, химические формулы и заместители,перечисленные в описании. Два предпочтительных соединения в соответствии с настоящим изобретением представлены формулами 2 и 3, соответственно где каждый R5 представляет собой дизамещенное бензольное кольцо, содержащее заместители Х и Y, как показано нижеY представляет собой заместитель по 4' или 5' положению, выбранный из группы,включающей Н, галоген, CN, NO2, C1-С 3 алкокси, C1-С 4 алкил или C1-С 3 тиоалкил; или их фармацевтически приемлемая соль. Другой предпочтительной группой соединений формулы 2, являются соединения, в которых R5 представляет собой пятичленное кольцо формулы, приведенной нижеR6 выбирают из группы, состоящей из Н,C1-С 3 алкила или от C1 до С 4 СО 2 алкила;Y' выбирают из группы, состоящей из Н, F или C1-C4 алкила; или их фармацевтически приемлемая соль. Кроме того, предпочтительной подгруппой соединений, приведенных выше, являются те, в которых R5 представляют собой тиофеновое или фурановое кольцо, замещенное такими заместителями как х' и у', как описано выше. Еще одна предпочтительная подгруппа соединений, формул 2 и 3 включает соединения, в которых R5 представляет собой шестичленное кольцо со структурой, приведенной нижеR7 выбирают из группы, состоящей из CN,C1-С 6 алкила, замещенного C1-С 6 алкила, C3 С 8 циклоалкила, замещенного C3-С 8 циклоалкила,арила, замещенного арила, гетероциклила, или замещенного гетероциклила или SO2 СF3;R8 и R9 представляют собой независимые заместители, выбранные из группы, включающей Н, C1-С 6 алкил, замещенный C1-С 6 алкил, C3 С 8 циклоалкил, замещенный C3-С 8 циклоалкил, 9 арил, замещенный арил, гетероциклил, замещенный гетероциклил, NO2, CN или CO2R10; или их фармацевтически приемлемая соль. Еще одна предпочтительная группа указанных соединений включает те, которые имеют общую формулу 10 арила, замещенного арила, гетероциклила, или замещенного гетероциклила или SO2CF3;R8 и R9 представляют собой независимые заместители, выбранные из группы, включающей Н, C1-С 6 алкил, замещенный C1-С 6 алкил, C3 С 8 циклоалкил, замещенный C3-С 8 циклоалкил,арил, замещенный арил, гетероциклил, замещенный гетероциклил, NO2, СN или СО 2R10;CR8R9 образуют шестичленное кольцо формулы, приведенной ниже или их фармацевтически приемлемая соль. Еще одна группа предпочтительных соединений по настоящему изобретению представлена формулой 4,где каждый R5 представляет собой дизамещенное бензольное кольцо, содержащее заместители Х и Y, как показано нижеY представляет собой заместитель по 4' или 5' положению, выбранный из группы, состоящей из Н, галогена, CN, NО 2, C1-С 3 алкокси,C1-С 4 алкила или C1-С 3 тиоалкила; или их фармацевтически приемлемая соль. Другой предпочтительной подгруппой соединений являются соединения формулы в которых R5 представляет собой шестичленное кольцо формулыR7 выбирают из группы, состоящей из CN,C1-С 6 алкила, замещенного C1-С 6 алкила, C3 С 8 циклоалкила, замещенного C3-С 8 циклоалкила, в которой R14 выбраны из группы, состоящей из Н, ацила, замещенного ацила, ароила,замещенного ароила, сульфонила, замещенного сульфонила,в которой R5 представляет собой дизамещенное бензольное кольцо, содержащее заместители Х и Y, как показано нижеY представляет собой заместитель по 4' или 5' положению, выбранный из группы, состоящей из Н, галогена, CN, NO2, C1-С 3 алкокси,C1-С 4 алкила или C1-С 3 тиоалкила; или их фармацевтически приемлемая соль. Другой предпочтительной группой соединений формулы 4 являются соединения, в которых R5 представляет собой пятичленное кольцо формулы, приведенной нижеR6 выбирают из Н, C1-С 3 алкила или от C1 до С 4 СО 2 алкила;Y' выбирают из группы, состоящей из Н, F или C1-С 4 алкила; или их фармацевтически приемлемая соль. Еще одна предпочтительная подгруппа соединений по изобретению включает перечисленные выше соединения, в которых R5 представляет собой тиофеновое или фурановое кольцо, замещенное X', Y', как описано выше. Кроме того, предпочтительной подгруппой соединений формулы 4 являются те, в которыхR5 представляет собой шестичленное кольцо формулыR7 выбирают из группы, состоящей из CN,C1-С 6 алкила, замещенного C1-С 6 алкила, C3 С 8 циклоалкила, замещенного C3-С 8 циклоалкила,арила, замещенного арила, гетероциклила, или замещенного гетероциклила или SО 2 СF3;R8 и R9 представляют собой независимые заместители, выбранные из группы, включающей Н, C1-С 6 алкил, замещенный C1-С 6 алкил, C3 С 8 циклоалкил, замещенный C3-С 8 циклоалкил,арил, замещенный арил, гетероциклил, замещенный гетероциклил, NO2, CN, CO2R10;R10 представляет собой C1-С 3 алкил; или их фармацевтически приемлемая соль. Кроме того, предпочтительной группой соединений в соответствии с настоящим изобретением являются соединения формулы 5 в которой R5 представляет собой дизамещенное бензольное кольцо, содержащее заместители Х и Y, как показано нижеY представляет собой заместитель по 4' или 5' положению, выбранный из группы, состоящей из Н, галогена, CN, NO2, C1-С 3 алкокси,C1-С 4 алкила или C1-С 3 тиоалкила; или их фармацевтически приемлемая соль. Другой предпочтительной группой соединений формулы 5 являются соединения, в которых R5 представляет собой пятичленное кольцо формулыY' выбирают из группы, состоящей из Н, F или C1-С 4 алкила; или их фармацевтически приемлемая соль. Еще одна предпочтительная подгруппа соединений по изобретению включает перечисленные выше соединения, в которых R5 представляет собой тиофеновое или фурановое кольцо, замещенное X', Y', как описано выше. Кроме того, предпочтительной подгруппой соединений формулы 5 являются те, в которыхR5 представляет собой шестичленное кольцо формулыR7 выбирают из группы, состоящей из CN,C1-С 6 алкила, замещенного C1-С 6 алкила, C3-С 8 циклоалкила, замещенного C3-С 8 циклоалкила,арила, замещенного арила, гетероциклила, или замещенного гетероциклила или SО 2 СF3;R8 и R9 представляют собой независимые заместители, выбранные из группы, включающей Н, C1-С 6 алкил, замещенный C1-С 6 алкил, C3 С 8 циклоалкил, замещенный C3-С 8 циклоалкил,арил, замещенный арил, гетероциклил, замещенный гетероциклил, NO2, CN, или CO2R10;R10 представляет собой C1-С 3 алкил; или их фармацевтически приемлемая соль. Следующая предпочтительная группа соединений в соответствии с настоящим изобретением определена формулой 6 13 в которой R15 выбирают из группы, включающей Н, Me, CO2R, ацил, замещенный ацил,ароил, замещенный ароил, алкил, замещенный алкил, CN; в которой R5 представляет собой дизамещенное бензольное кольцо, содержащее заместители Х и Y, как показано нижеY представляет собой заместитель по 4' или 5' положению, выбранный из группы, состоящей из Н, галогена, CN, NO2, C1-С 3 алкокси,C1-С 4 алкила или C1-С 3 тиоалкила; или их фармацевтически приемлемая соль. Другой предпочтительной группой соединений формулы 6 являются те соединения, в которых R5 представляет собой пятичленное кольцо формулы, приведенной нижеY' выбирают из группы, состоящей из Н, F или C1-С 4 алкила; или их фармацевтически приемлемая соль. Еще одна подгруппа предпочтительных соединений по изобретению включает перечисленные соединения, в которых R5 представляет собой тиофеновое или фурановое кольцо, замещенное X', Y', как описано выше. Следующей предпочтительной подгруппой соединений формулы 6 являются те, в которыхR5 представляет собой шестичленное кольцо со структурой, приведенной ниже 14 арила, замещенного арила, гетероциклила, или замещенного гетероциклила или SО 2 СF3;R8 и R9 представляют собой независимые заместители, выбранные из группы, включающей Н, C1-С 6 алкил, замещенный C1-С 6 алкил, C3 С 8 циклоалкил, замещенный C3-С 8 циклоалкил,арил, замещенный арил, гетероциклил, замещенный гетероциклил, NO2, CN или CO2R10;R10 представляет собой C1-С 3 алкил; или их фармацевтически приемлемая соль. Следующая предпочтительная группа соединений имеет формулу 7 где R5 представляет собой дизамещенное бензольное кольцо, содержащее заместители Х и Y,как показано нижеY представляет собой заместитель по 4' или 5' положению, выбранный из группы Н,галогена, CN, NO2, C1-С 3 алкокси, C1-С 4 алкила или C1-С 3 тиоалкила; или их фармацевтически приемлемая соль. Другой предпочтительной группой соединений формулы 7 являются соединения, в которых R5 представляет собой пятичленное кольцо формулыY' выбирают из группы, состоящей из Н, F или C1-С 4 алкила; или их фармацевтически приемлемая соль. Еще одна подгруппа предпочтительных соединений по изобретению включает перечисленные соединения, в которых R5 представляет собой тиофеновое или фурановое кольцо, замещенное X', Y', как описано выше. 15 Следующей подгруппой предпочтительных соединений формулы 7 являются те, в которых R5 представляет собой шестичленное кольцо формулы, приведенной нижеR8 и R9 представляют собой независимые заместители, выбранные из группы, включающей Н, C1-С 6 алкил, замещенный C1-С 6 алкил, C3 С 8 циклоалкил, замещенный C3-С 8 циклоалкил,арил, замещенный арил, гетероциклил, замещенный гетероциклил, NO2, CN, CO2R10;R10 представляет собой C1-С 3 алкил; соли или фармацевтически приемлемая соль. Соединения по изобретению могут содержать асимметрический атом углерода, и некоторые из соединений по изобретению могут содержать один или более асимметрических центров,что может привести к образованию оптических изомеров и диастереоизомеров. Хотя в формуле 1 и 2 не показано стереохимическое строение, настоящее изобретение включает подобные оптические изомеры и диастереоизомеры, также как рацематы и разделенные энантиомерно чистые R и S стереоизомеры; а также иные смеси R и S стереоизомеров и их фармацевтически приемлемая соль. Термин "алкил" используется здесь для обозначения насыщенных алифатических углеводородных групп как с линейной, так и с разветвленной цепью, содержащих от одного до восьми атомов углерода, предпочтительно от 1 до 6 атомов углерода; подразумевается, что понятие "алкенил" включает алкильные группы как с линейной, так и с разветвленной цепью, с 1 или 2 двойными углерод-углеродными связями и содержащие от двух до восьми атомов углерода, предпочтительно от 2 до 6 атомов углерода; подразумевается, что "алкинильная" группа охватывает алкильные группы как с линейной, так и с разветвленной цепью, с по меньшей мере одной или двумя тройными углерод-углеродными связями, содержащие от двух до восьми атомов углерода, предпочтительно от 2 до 6 атомов углерода. Термин "ацил" охватывает карбонильный заместитель, включая как линейную, так и разветвленную насыщенную углеводородную группу, содержащую от 1 до 8 атомов углерода, предпочтительно от 1 до 6 атомов углерода. Термин 16 щенной от 1 до 6 групп, выбранных из галогена,CN, ОН и NO2. Термин "ароил" также относится к карбонильному заместителю, несущему фенильную или гетероароматическую группу. Гетероароматическая группа включает 2-, 3-, 4-пиридинил, 2- и 3 фуранил, 2- или 3-тиофенил или 2- или 4 пиримидинал. Термин "замещенный ароил" также относится к ароильной группе, которая только что описана, необязательно замещенной от 1 до 6 групп, выбранных из галогена, CN, ОН и NO2. Термины "замещенный алкил", "замещенный алкенил" и "замещенный алкинил" обозначают только что описанные алкил, алкенил и алкинил, содержащие один или более заместителей из группы, включающей галоген, CN, ОН, NO2, амино, арил, гетероциклил, замещенный арил, замещенный гетероциклил, алкокси, арилокси, замещенный алкилокси, алкилкарбонил, алкилкарбокси, алкиламино, арилтио. Эти заместители могут быть присоединены к любому атому углерода в составе алкильной, алкенильной или алкинильной группы при условии, что при таком присоединении образуется химически стабильный остаток. Термин "арил" используется здесь для обозначения ароматической системы, в которую может входить одно кольцо или несколько ароматических колец, сконденсированных или связанных друг с другом таким образом, что по крайней мере часть конденсированных или связанных колец образует сопряженную ароматическую систему. Арильные группы включают, но не ограничиваются такими группами, как фенил, нафтил,бифенил, антрил, тетрагидронафтил, фенантрил. Термин "замещенный арил" обозначает определенный выше арил, содержащий от одного до четырех заместителей, выбранных из группы,включающей галоген, CN, ОН, NO2, амино, алкил,циклоалкил, алкенил, алкинил, алкокси, арилокси,замещенный алкилокси, алкилкарбонил, алкилкарбокси, алкиламино или арилтио. Термин "гетероциклил" используется здесь для обозначения стабильного 4-7-членного моноциклического или стабильного полициклического гетероциклического кольца, которое может быть насыщенным, частично или полностью ненасыщенным и состоит из атомов углерода и от одного до четырех гетероатомов, выбранных из группы,включающей атомы N, О, и S. Атомы N и S могут быть окислены. Гетероциклические кольца также включают любые полициклические кольца, в которых любое из определенных выше гетероциклических колец сконденсировано с арильным кольцом. Гетероциклическое кольцо может быть присоединено через любой гетероатом или атом углерода при условии, что полученная структура будет химически стабильной. Такие гетероциклические группы включают, например, тетрагидрофуран, пиперидинил, пиперазинил, 2-оксопиперидинил, азепинил, пирролидинил, имидазолил, пиридил, пиразинил, пиримидинил, пиридазинил,оксазолил, изоксазолил, морфолинил, индолил, 17 хинолинил, тиенил, фурил, бензофуранил, бензотиенил, тиаморфолинил, тиаморфолинилсульфоксид и изохинолинил. Термин "замещенный гетероциклил" используется здесь для описания гетероциклилов,определенных выше, содержащих 1-4 заместителей, выбранных из группы, включающей галоген,CN, ОН, NO2, амино, алкил, замещенный алкил,циклоалкил, алкенил, замещенный алкенил, алкинил, алкокси, арилокси, замещенный алкилокси,алкилкарбонил, алкилкарбокси, алкиламино или арилтио. Термин "тиоалкил" используется здесь для обозначения SR группы, где R представляет собой алкил, содержащий от 1 до 8 атомов углерода,предпочтительно, от 1 до 6 атомов углерода. Термин "алкокси" используется здесь для обозначения OR группы, где R представляет собой алкил или замещенный алкил, содержащий от 1 до 8 атомов углерода, предпочтительно, от 1 до 6 атомов углерода. Термин "арилокси" используется здесь для обозначения OR группы, где R представляет собой арил или замещенный арил, определенные выше. Термин "алкилкарбонил" используется здесь для обозначения RCO группы, где R представляет собой алкил или замещенный алкил, содержащий от 1 до 8 атомов углерода, предпочтительно, от 1 до 6 атомов углерода. Термин "алкилкарбокси" используется здесь для обозначения COOR группы, где R представляет собой алкил или замещенный алкил, содержащий от 1 до 8 атомов углерода, предпочтительно,от 1 до 6 атомов углерода. Термин "аминоалкил" обозначает как вторичные, так и третичные амины, в состав которых входят алкильные или замещенные алкильные группы, содержащие от одного до восьми атомов углерода, которые могут быть одинаковыми или различными, и местом их присоединения является атом азота. Термин "галоген" обозначает элементы Cl, Br, F или I. Соединения по изобретению можно получить, руководствуясь схемами, изображенными ниже. Схема 1 В соответствии со схемой 1 коммерчески доступный оксиндол 3 обрабатывают сильным органометаллическим основанием (например,бутиллитием, диизопропиламидом лития, гексаметилдисилазидом калия) в инертном растворителе (например, ТГФ, диэтиловом эфире) в 18 атмосфере азота при пониженной температуреCommun., 12, 1, 1982) в присутствии хлористого лития или N,N,N,N-тетраметилэтилендиамина. Образующийся дианион затем обрабатывают избытком электрофила, такого как галогеналкил, предпочтительно йодом. Если R1 и R2 должны быть объединены, как в случае продукта 4, который содержит спироцикл в положении 3, то электрофил должен быть бифункциональным, то есть дийодидом. Последующее бромирование 4 протекает гладко при обработке бромом в уксусной кислоте (органический сорастворитель, такой как дихлорметан, может быть добавлен при необходимости) в присутствии ацетата натрия, с получением арилбромида 5. Бромид 5 реагирует с солью палладия (например,тетракис(трифенилфосфин)палладием(0) или ацетатом палладия), в подходящем растворителе (например, таком как ТГФ, диметоксиэтан, ацетон, этанол или толуол) при комнатной температуре в инертной атмосфере (аргон, азот). Смесь затем обрабатывают арил- или гетероарилбороновой кислотой или эфиром бороновой кислоты и основанием (карбонат натрия, триэтиламин, фосфат калия) в воде или источником фтора (фторид цезия) в безводных условиях. Требуемый продукт 6 затем выделяют и очищают стандартными средствами. Реакция производного индолин-2-она 6 или с реагентом Лоэссона (Lawessen) или с пентасульфидом фосфора в подходящем органическом растворителе (пиридин, ТГФ, диоксан,диметоксиэтан, дихлорметан, бензол, толуол,ксилол) при температуре между комнатной температурой и температурой кипения растворителя обеспечивает получение тиокарбонильного производного 7. Добавка реагента, такого как гидрокарбонат натрия, может также быть полезной. Если R1 и R2 являются различными, то промежуточное соединение 4 получают по реакции дианиона 3 с одним эквивалентом электрофила R1-X (X=уходящая группа, например,йодин). Образующееся моноалкилированное соединение затем может быть выделено и введено в реакцию при использовании R2-X, или альтернативно использовано in situ для вторичного алкилирования с помощью R2-X. Альтернативно, если требующийся продукт 7 должен содержать R2=H, то тогда на последующие стадии поступает выделенный моноалкилированный промежуточный продукт. Схема 2 Другие методики также применимы для присоединения пендантной арильной или гете 19 роарильной группы, Аr, к оксиндоловой основе,например, реакцией соединения 5 с арильным или гетероарильным оловом, арильным или гетероарильным цинком или арильным или гетероарильным галогенидом магния в присутствии палладиевого или никелевого катализатора(схема 2). Требующийся арильный или гетероарил-металлический остаток, описанный выше,получают стандартными способами. Другие функциональные группы также могут быть введены в 3-положение индолиновой основы в соответствии со схемой 3. Окисление незамещенного индолина 8, предпочтительно в нейтральных или кислых условиях (например,диоксид селена в сухом диоксане при кипячении с обратным холодильником) приводит к получению изатина 9. В соединение 9 можно далее ввести функциональные группы с получением кеталя 11 обработкой спиртовым и кислотным катализатором в безводных условиях. Альтернативно реакция 9 со вторым кетоном в подходящих условиях (пиперидин в толуоле при кипячении с обратным холодильником; илиTiCl4/Zn в ТГФ при кипячении с обратным холодильником) приводит к получению алкилиденовых производных 11. Реакция изатина 9 с реагентом Гриньяра или органолитием приводит к получению третичных спиртов 12 (R=Н). В эти спирты затем можно ввести следующие функциональные группы путем алкилирования или ацилирования. Схема 3 Реакция производного индолин-2-она 6 или с реагентом Лоэссона (Lawessen's) или с пентасульфидом фосфора в подходящем органическом растворителе (пиридин, ТГФ, диоксане, диметоксиэтане, дихлорметане, бензоле,толуоле, ксилоле) при температуре между комнатной температурой и температурой кипения растворителя обеспечивает получение тиокарбонильного производного 7. Добавка реагента,такого как гидрокарбонат натрия, также может быть осуществлена. Альтернативным способом получения является реакция соединения 5 или с реагентом Лоэссона или с пентасульфидом фосфора в подходящем органическом растворителе (пиридине,ТГФ, диоксане, диметоксиэтане, дихлорметане,бензоле, толуоле, ксилоле) при температуре между комнатной температурой и температурой кипения растворителя, в инертной атмосфере(азот или аргон), что обеспечивает получение тиокарбонильного производного 13. Затем реакция бромида 13 в безводном растворителе(предпочтительно, таким как гидрид натрия, а также гексаметилдисилазид натрия, гидрид калия) с последующей реакцией при пониженной температуре (-50 до -20 С) с н-бутиллитием иN,N,N,N'-тетраметилэтилендиамином, а затем,через подходящий период времени, с триалкилборатом (триметил- или триизопропилборатом) приводит к получению, после обработки кислотой, бороновой кислоты 14 (схема 4). Соединение 14 может затем реагировать в условиях катализа палладием,таким как(толуол/ЕtOН/вода,ТГФ/вода,диметоксиэтан/вода, безводный диметоксиэтан с арил или гетероарилбромидом, арил или гетероарилйодидом, арил или гетероарилтрифторметансульфонатом или арил или гетероарилфторсульфонатом, с получением требующихся соединений 7. Альтернативно, реакция соединения 13 в условиях катализа палладием, таким как (тетракис(трифенилфосфин)палладий(0) или ацетат палладия, в присутствии основания (NaHCO3,Na2CO3, К 2 СО 3, триэтиламин, CsF) растворителя(ацетон/вода, толуол/ЕtOН/вода, ТГФ/вода, диметоксиэтан/вода, безводный диметоксиэтан с арил или гетероарилбромидом, арил или гетероарилйодидом, арил или гетероарилтрифторметансульфонатом или арил или гетероарилфторсульфонатом, обеспечивает получение требующихся соединений 7. Обработка бромида 5 в безводном растворителе (например, ТГФ, Et2O) сильным основанием (предпочтительно гидридом натрия, гексаметилдисилазидом натрия, гидридом калия) с последующей реакцией при пониженной температуре (-50 до -20 С) с н-бутиллитием иN,N,N,N'-тетраметилэтилендиамином, а затем,через подходящий период времени, с триалкилборатом (триметил или триизопропилборатом) приводит к получению после обработки кислотой бороновой кислоты 15 (схема 5). Соединение 15 может затем реагировать при условиях катализа палладием (тетракис(трифенилфосфин)палладий(0), в присутствии основания(NaHCO3, Nа 2 СО 3, К 2 СО 3, триэтиламин, CsF) растворителя (толуол/ЕtOН/вода, ТГФ/вода,диметоксиэтан/вода, безводный диметоксиэтан с арил или гетероарилбромидом, арил или гетероарилйодидом, арил или гетероарилтрифторметансульфонатом или арил или гетероарилфторсульфонатом, с получением требующихся соединений 6. Альтернативной стратегией может быть получение органоцинкового или магниевого реагента из соединения 5 и реакция его in situ с арил или гетероарилбромидом, арил или гетероарилйодидом, арил или гетероарилтрифторметансульфонатом, арил или гетероарилфторсульфонатом, в условиях катализа палладием с получением соединения 6. Такие органоцинковые или магниевые соединения могут быть получены обработкой бромида в безводном растворителе (например, ТГФ, Et2O) сильным основанием (предпочтительно, таким как гидрид натрия, гексаметилдисилазид натрия, гидрид калия) с последующей реакцией при пониженной температуре (-50 до -20 С) с н-бутиллитием и N,N,N',N'-тетраметилэтилендиамином с последующей через подходящий период времени реакцией с безводным хлоридом цинка или бромидом магния. Реакция производного индолин-2-она 6 или с реагентом Лоэссона или с пентасульфидом фосфора в подходящем органическом растворителе (пиридине, ТГФ, диоксане, диметоксиэтане, дихлорметане, бензоле, толуоле, ксилоле) при температуре между комнатной температурой и температурой кипения растворителя,в инертной атмосфере (азот или аргон) обеспе 005034 22 чивает получение тиокарбонильного производного 15. Дополнительный реагент, такой как гидрокарбонат натрия, также может быть введен. Схема 6 В соответствии со схемой 6 производные тиоамида 7 могут быть превращены в производные энамина 16 (Wrobel, et al., J. Med. Chem.,1989, 2493). Так реакция тиоамида 7 (Pg=Н, 2(триметилсилил)этоксиметил, бензил, и т.д.) с тетрафторборатом триэтилоксония с последующей реакцией с нуклеофилом (таким как нитрометаном, цианамидом, трифторметансульфонамидом, кислотой Мельдрума, и т.д.) с последующим удалением защитных групп в подходящих условиях (например, тетрабутиламмоний фторид в ТГФ для Pg=2-(триметилсилил)этоксиметил), приводит к получению производных енамина 16. Подходящие растворители для двух стадий выбирают из дихлорметана, ТГФ, диоксана, 1,2-дихлорэтана, и реакция проводится при температуре от -78 С до точки кипения растворителя в инертной атмосфере (азот или аргон). Схема 7 В соответствии со cхемой 7 обработка промежуточного соединения 7 алкилирующим агентом, например, метилйодидом, этилйодидом,2,4-динитрофторбензолом или 4 нитрофторбензолом, в присутствии подходящего основания (например, амино-основания, такого как пиридин, триэтиламин или диизопропилэтиламин или карбонат лития, натрия, калия или цезия) в подходящем органическом растворителе (например, ДМФА, ТГФ, ДМСО, диоксане или ацетонитриле) при температуре между-78 С и точкой кипения растворителя, будет приводить затем к получению тиоиминутоэфи 23 ров 17. Последующая реакция промежуточным соединением 17 и гидроксиламином или кислой солью гидкоксиламина (например, гидрохлоридом) в подходящем растворителе (например, но не ограничиваясь ими, пиридине, метаноле, этаноле, изопропаноле, ДМФА, ТГФ или ДМСО и необязательно в присутствии дополнительного реагента, такого как третичное основание амина или ацетат натрия или калия) при температуре между -78 С и точкой кипения растворителя,будет приводить затем к получению Nгидроксиамидинов 18. Похожая обработка промежуточного соединения 17 углеродным нуклеофилом, таким как производное малоната (например, малононитрилом, цианоацетатным эфиром, нитроацетатным эфиром или малонатом) в присутствии подходящего основания (например, основания амина, таком как пиридин, триэтиламин или диизопропилэтиламин или карбонат лития, натрия, калия или цезия) или кислоты Льюиса (например, эферата трехфтористого бора, соли свинца II, тетрахлорида титана,соли магния II, или соли серебра) в растворителе, совместимом с выбранным основанием или кислотой Люиса (например, ДМФА, ТГФ,ДМСО, диоксаном или ацетонитрилом, хлороформом, бензолом, толуолом или дихлорметаном) будет приводить затем к получению аддукта 19. Если группа R3 в аддукте 19 представляет собой сложный эфир карбоновой кислоты, то она может быть декарбоксилирована напрямую с получением енаминового производного 20 путем обработки, например,йодидом натрия в ДМСО при температуре между комнатной температурой и точкой кипения растворителя. Альтернативно эфир может быть сначала гидролизован до карбоновой кислоты (путем обработки водным основанием (например, гидроксидом лития, натрия или калия) в подходящем растворителе (например, ТГФ, диоксане, ацетонитриле, метаноле или этаноле, с последующим декарбоксилированием в присутствии кислоты (например, соляной или серной кислоты) в подходящем растворителе (например, ацетонитриле,ТГФ, диоксане), что приводит к получению производных 20. Альтернативно ксантагенатовый эфир карбоновой кислоты может быть получен путем реакции с основанием, таким как гидрид натрия или калия в ТГФ, с последующей обработкой дисульфидом углерода. Последующая реакция с трибутил гидридом олова при повышенных температурах в растворителе, таком как бензол или толуол, в инертной атмосфере азота или аргона в присутствии инициатора радикалов, такого как пероксид бензоила или азо-бисизобутиронитрила, будет приводить затем к получению продукта 20. Альтернативная стратегия для синтеза продукта 18 представлена на схеме 8. Так, бромид 13 (соответствующий хлорид, йодид или трифлатовый эфир также могут применяться) обрабатывают алкилирующим агентом, например, таким как метилйодид, этилйодид, 2,4 динитрофторбензол или 4-нитрофторбензол, в присутствии подходящего основания (например, основания амина, такого как пиридин, триэтиламин или диизопропилэтиламин или карбонат лития, натрия, калия или цезия) в подходящем органическом растворителе (например,ДМФА, ТГФ, ДМСО, диоксане или ацетонитриле) при температуре между -78 С точкой кипения растворителя, что будет приводить затем к получению тиоиминутоэфиров 21. Последующая реакция промежуточного соединения 21 с гидроксиламином или кислой солью гидроксиламина (например, гидрохлоридом, гидробромидом) в подходящем растворителе (например, но не ограничиваясь такими, как пиридин,метанол, этанол, изопропанол, ДМФА, ТГФ или ДМСО и необязательно в присутствии дополнительного реагента, такого как основания третичного амина или ацетата натрия или калия) при температуре между -78 С и точкой кипения растворителя, будет приводить затем к получению N-гидроксиамидина 22. Промежуточное соединение 22 можно затем защитить подходящей группой (например, бензиловым эфиром,ацильным производным, тетрагидропиранильным эфиром, метоксиметиловым эфиром, силильным эфиром) с получением производного 23. Альтернативно соединение 21 может реагировать напрямую с защищенным производным гидроксиламина (с выбранными, но не ограниченными ими, защитными группами, описанными выше) приводя к получению производного 23. Соединение 23 может затем реагировать с солью палладия (например, тетракис(трифенилфосфин)палладием(0) или ацетатом палладия), в подходящем растворителе (например,ТГФ, диметоксиэтане, ацетоне, этаноле или толуоле) при комнатной температуре в инертной атмосфере (аргон, азот). Смесь затем обрабатывают арил или гетероарилбороновой кислотой или эфиром бороновой кислотыи основанием(карбонатом натрия, триэтиламином, фосфатом калия) в воде или источнике фтора (фторид цезия) в безводных условиях, и реакцию затем 25 можно нагреть до точки кипения растворителя. Требующийся продукт 24 затем выделяют и очищают стандартными способами. С соединения 24 можно затем снять защитные группы в условиях, описанных ранее, в зависимости от природы защитных групп. Например, если защитной группой является бензиловый эфир, то обработка бороновым трибромидом или триметилсилил йодидом в подходящем растворителе (дихлорметан для примера) будет приводить к получению соединения 18. Другие способы удаления бензилового эфира включают гидрогенирование (газообразный водород или другой источник водорода, такой как циклогексадиен или формат аммиака) в присутствии палладиевого катализатора. Растворители,подходящие для такого процесса, включают метанол, этанол, ТГФ, этилацетат и диоксан,при температуре между комнатной температурой и точкой кипения растворителя. Если защитной группой было ацетальное производное(тетрагидропиранильные или метоксиметильные эфиры), то гидролиз может осуществляться в кислых условиях (соляная кислота, серная кислота, п-толуолсульфоновая кислота или кислая ионообменная смола) в растворителе, таком как метанол, этанол, ТГФ диоксан или ацетонитрил. Если защитной группой было ацильное производное (ацетат, или бензоат для примера),то гидролиз может осуществляться в кислотных условиях, как описано выше, или в основных условиях (гидроксид лития, натрия или калия) в растворителе, таком как спирт, ТГФ, диоксан или ацетонитрил, при температуре между комнатной температурой и точкой кипения растворителя. Если защитной группой был силильный эфир, то соединение 18 может быть получено гидролизом промежуточного соединения 24 в кислых условиях, описанных выше или альтернативно обработкой соединения 24 источником фтора (например, таким как фторид калия, фторид цезия или тетрабутиламмоний фторид) в растворителе, таком как спирт, ТГФ, диоксан или ацетонитрил, при температуре между комнатной температурой и точкой кипения растворителя. Инертная атмосфера азота или аргона может быть необходима. Другим способом синтеза соединения 18 является превращение защищенногоNгидроксиамидина 23 в бороновую кислоту или эфир бороновой кислоты (путем замещения галогенидом лития с последующим гашением триизопропил боратом, или катализируемого палладием соединения с пинаколатом дибора) и затем конденсацией указанной бороновой кислоты или эфирного производного с арилхлоридом, бромидом, йодидом или трифлатом в подходящей системе, катализируемой палладием,как описано ранее. Последующее снятие защитных групп, как описано для схемы 8, будет приводить к получению требуемых соединений 18. В соответствии со схемой 9 обработка Nгидроксиамидина 18 в условиях восстановления(например, каталитическое гидрогенирование,железо в уксусной кислоте или гидразин-никель Ренея) будет приводить затем к получению промежуточного соединения 25. Подходящие растворители для такого процесса включают метанол, этанол, ТГФ, этилацетат и диоксан,при температуре между комнатной температурой и точкой кипения растворителя. Защита вторичного азота (третичный бутилкарбамат показан в качестве неограничивающего примера) в стандартных условиях будет приводить затем к получению соединения 26. Реакция соединения 26 с электрофильным цианатным агентом(например,цианобромидом,Nцианобензотриазолом или цианобромидом/ 4 диметиламинопиридиновым комплексом) в подходящем растворителе (ТГФ, ацетонитрил или ДМФ, необязательно в присутствии основания, такого, как пиридин или гидрид натрия или калия трет-бутоксид) может приводить затем к получению требующегося соединения 27. В некоторых случаях стадия цианирования может протекать с сопутствующим удалением защитной группы вторичного азота, если это снятие защиты не происходит in-situ, то необходима дальнейшая стадия гидролиза. Альтернативный синтез соединений 27 может заключаться в том, что соединение 18,схема 8, где N-цианоамидинбромид 28, полученный из соединения 22, подобно похожей стратегии для реакций, показанных в схеме 9,может конденсироваться с подходящей функциональной группой арилбороновой кислоты или эфира бороновой кислоты с получением соединения 27. В соответствии с другой стратегией промежуточное соединение 28 может быть превращено в соответствующую бороновую кислоту или эфир бороновой кислоты и введено в реакцию сочетания по Сузуки или по типу сочетания по Сузуки с палладием, с подходящей функциональной группой арилбромида. Соединения по настоящему изобретению могут использоваться в виде солей, образованных из фармацевтически или физиологически 27 приемлемых кислот или оснований. Эти соли включают, но не ограничиваются ими, следующие соли с неорганическими кислотами, такими как соляная кислота, серная кислота, азотная кислота, фосфорная кислота и, если это приемлемо, такими органическими кислотами, как уксусная кислота, щавелевая кислота, янтарная кислота и малеиновая кислота. Другие соли включают соли со щелочными металлами или щелочно-земельными металлами, такими как натрий, калий, кальций или магний в виде эфиров, карбаматов и других стандартных "пролекарственных" форм, которые, при введении в таких формах, превращаются в активную частьin vivo. Настоящее изобретение включает фармацевтические композиции и способы лечения,которые включают введение млекопитающему фармацевтически эффективного количества одного или более соединений, описанных выше,или их фармацевтически приемлемой соли, в качестве агонистов прогестеронового рецептора. Агонисты прогестеронового рецептора настоящего изобретения, используемые сами по себе или в комбинации, могут применяться в методах контрацепции и способах лечения и/или профилактики дисфункционального кровотечения, маточной лейомиомы, эндометриоза,поликистозного синдрома яичников, карцином и аденокарцином эндометрия, яичников, груди,толстой кишки, простатита. Дополнительные использования изобретения включают стимулирование приема пищи. При использовании соединений для указанных выше целей, они могут быть объединены с одним или более фармацевтически приемлемым носителем или наполнителем, например,растворителем, разбавителем и им подобными,и могут вводиться орально в таких формах, как таблетки, капсулы, дисперсионные порошки,гранулы или суспензии, содержащие, например,от примерно 0,05 до 5% суспендированного агента, сиропы, содержащие, например, от примерно 10 до 50% сахара, и эликсиры, содержащие, например, от примерно 20 до 50% этанола,и ему подобных, или парентерально в форме стерильных инъекционных растворов или суспензий, содержащих от примерно 0,05 до 5% суспендированного агента в изотонической среде. Такие фармацевтические формы могут содержать, например, от примерно 25 до примерно 90% активного ингредиента в комбинации с носителем, более предпочтительно между примерно 5% и 60% по весу. Эффективная доза применяемого активного ингредиента может меняться в зависимости от особенностей применяемого соединения,способа введения и жесткости условий при лечении. Однако, вообще, удовлетворительные результаты получают, когда соединения по изобретению вводятся в суточной дозе от примерно 0,5 до примерно 500 мг/кг веса тела животного, 005034 28 предпочтительно вводимых в раздельных дозах от двух до черырех раз в день, или в форме длительного высвобождения. Для самых больших млекопитающих, общая суточная доза составляет от примерно 1 до 100 мг, предпочтительно от примерно 2 до 80 мг. Дозированные формы,пригодные для внутреннего применения, содержат от примерно 0,5 до 500 мг активного соединения в подразумевающейся смеси с твердым или жидким фармацевтически приемлемым носителем. Этот дозированный режим может регулироваться для обеспечения оптимального терапевтического ответа. Например, определенные раздельные дозы могут вводиться ежедневно или доза может пропорционально уменьшаться, что определяется острой необходимостью терапевтической ситуации. Эти активные соединения могут вводиться оральным также как и внутривенным, внутримышечным, или подкожным способами. Твердые носители включают крахмал, лактозу, дифосфат кальция, микрокристаллическую целлюлозу, сахарозу и глину, тогда как жидкие носители включают стерильную воду, полиэтиленгликоль, неионные поверхностно-активные вещества и пищевые масла, такие как кукурузное, арахисовое и кунжутное масла, которые являются подходящими для природы активного ингредиента и требуемой особенной формы введения. Подходящие адъюванты, обычно применимые для получения фармацевтических композиций, могут преимущественно включать такие компоненты, как отдушки, красители,консерванты и антиоксиданты, например, витамин Е, аскорбиновую кислоту, ВНТ и ВНА. Предпочтительными фармацевтическими композициями с точки зрения свободы получения и введения являются твердые композиции,особенно таблетки и твердо-наполненные или жидко-наполненные капсулы. Оральное введение соединений является предпочтительным. Эти активные соединения могут также вводиться парентерально или интраперитонально. Растворы или суспензии этих активных соединений в виде свободного основания или фармакологически приемлемой соли могут быть получены в воде, подходяще смешанной с поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Дисперсии также могут быть получены в глицерине, жидких полиэтиленгликолях и их смеси в маслах. При обычных условиях хранения и использования,эти препараты содержат консервант для предотвращения роста микроорганизмов. Фармацевтические формы, пригодные для инъекционного использования, включают стерильные водные растворы или дисперсии и стерильные порошки для неподготовленного получения стерильных инъекционных растворов или дисперсий. Во всех случаях,форма должна быть стерильной и должна быть жидкой до той степени, чтобы обеспечить легкую способность 29 впрыска. Она должна быть стабильной в условиях производства и хранения и должна быть защищена от разрушительного воздействия микроорганизмов, таких как бактерии и грибки. Носителем может быть растворитель или дисперсионная среда, содержащая, например, воду,этанол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль) их приемлемая смесь, и растительное масло. Это изобретение станет далее более понятным благодаря следующим неограничивающим примерам. Пример 1. 5'-(3-Хлорфенил)спиро[циклогексан-1,3'[3 Н]индол]-2'-(1'Н)-тион. Спиро[циклогексан-1,3'-[3 Н]индол]-2'(1'Н)-он. Раствор оксиндола (25 г, 0,19 моль) в безводном тетрагидрофуране (800 см 3) охлаждают до -20 С, затем медленно добавляют нбутиллитий (2,5 М в гексане, 152 см 3, 0,38 моль) следом за N,N,N,N'-тетраметилэтилендиамином(51 см 3, 0,38 моль). Через 15 мин медленно добавляют 1,5-дийодпентан (174 г, 0,54 моль) и смесь оставляют нагреваться до комнатной температуры. После перемешивания в течение 16 ч добавляют насыщенный водный раствор хлорида аммония (1 л) и ЕtOАс (1 л). Через 15 мин слои разделяют и водную фазу экстрагируютEtOAc (x2). Объединенные органические слои экстрагируют соляной кислотой (1N), затем промывают рассолом (500 см 3), высушивают(MgSO4) и концентрируют с получением масла. Масло обрабатывают гексаном (200 см 3) и бензолом (20 см 3). Осадок собирают и высушивают в вакууме с получением указанного в названии соединения (26,3 г, 69,6%) в виде бесцветных кристаллов: Т.пл. 110-114 С; 1 Н ЯМР (ДМСОd6)1,67 (м, 10 Н), 6,84 (д, 1 Н, J=8 Гц), 6,94 (т,1 Н, J=8 Гц), 7,17 (т, 1 Н, J=8 Гц), 7,44 (д, 1 Н, J=8 Гц), 10,3 (с, 1 Н). 5'-Бромспиро[циклогексан-1,3'-[3 Н]индол]-2'(1'Н)-он. К раствору спиро[циклогексан-1,3'-[3 Н] индол]-2' (1'Н)-она (17,6 г, 0,09 моль) в уксусной кислоте (300 см 3) добавляют при перемешивании ацетат натрия (8,0 г, 0,1 моль) и бром(14,6 г, 0,091 моль). Через 30 мин при комнатной температуре реакционная смесь разделяется на воду и EtOAc. Водную фазу экстрагируют дважды с помощью EtOAc. Объединенные органические слои промывают водой, высушивают (MgSO4) и упаривают, а остаток обрабатывают гексаном. Осадок собирают и высушивают в вакууме с получением указанного в подзаголовке соединения (16,5 г, 67%) в виде грязнобелых кристаллов: Т.пл. 196-199 С; 1 Н ЯМР 30 Раствор 5'-бромспиро[циклогексан-1,3'[3 Н]индол]-2'(1'Н)-она (0,32 г, 1,14 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,14 г,0,12 ммоль) в диметоксиэтане (6 см 3) перемешивают под током N2 в течение 20 мин. К этой смеси затем добавляют 3-хлорфенилбороновую кислоту (0,21 г, 1,37 ммоль) и карбонат натрия(0,36 г, 3,4 ммоль) в воде (3 см 3). Раствор оставляют кипятиться с обратным холодильником в течение 6 ч, затем охлаждают до комнатной температуры, выливают в воду и экстрагируютEtOAc (x3). Объединенные органические экстракты промывают водой, рассолом, высушивают (MgSO4), и упаривают. Остаток очищают колоночной хроматографией (SiO2, этилацетат:гексан 1:3) с получением указанного в подзаголовке соединения (0.28 г, 0,89 ммоль, 80%) в виде твердого вещества желтого цвета: Т.пл. 164-165 С, 1 Н ЯМР (CDCl3)1,60-1,78 (м, 6 Н),1,81-1,99 (м, 4 Н), 7,04 (д, J=8,1 Гц, 1 Н), 7,227,47 (м, 4 Н), 7,53 (с, 1 Н), 7,61 (с, 1 Н), 9,28 (широкий с, 1 Н); 13 С-ЯМР (СDСl3) 20,17, 24,12,31,92 (т), 47,22 (с), 109,21, 121,94, 124,06,125,50, 125,79, 125,97, 126,38, 128,96 (д), 132,88,133,59, 135,60, 139,14, 142,17, 182,89 (c); MS(EI) м/е 310, 312 (М-H)+ Анализ (C19H18ClNO) С,Н, N. К раствору 5'-(3-хлорфенил)спиро [циклогексан-1,3'-[3 Н]индол]-2'(1'Н)-она (0,63 г, 2,0 ммоль) в сухом ксилоле (20 см 3) в атмосфере азота добавляют 2,4-бис(4-метоксифенил)-1,3 дитиа-2,4-дифосфетан-2,4-дисульфид (0,89 г, 2,2 ммоль) и смесь нагревают при кипячении с обратным холодильником. Через 72 ч смесь упаривают и остаток очищают с помощью колоночной хроматографии (SiO2, EtOAc; гексан,градиент элюирования) с получением твердого вещества, которое перекристаллизовывают из диизопропилэфира/гексана с получением указанного в заглавии соединения в виде желтых кристаллов (0,17 г, 0,51 ммоль, 26%): Т.пл. 223227 С; 1 Н ЯМР (СDСl3)1,53-1,66 (м, 8 Н), 1,832,05 (м, 4 Н), 2,07-2,17 (м, 2 Н), 7,11 (д, 1 Н, J=8,0 Гц), 7,31-7,53 (м, 3 Н), 7,54 (с, 1 Н), 7,86 (с, 1 Н),9,93 (с, 1 Н, широкий): MS (+APCI) м/е 328[циклогексан-1,3'-[3 Н]индол]-5'-ил)бензонитрил. К раствору 5'-бромспиро[циклогексан-1,3'[3 Н]индол]-2'(1'Н)-она (1,00 г, 3,57 ммоль) в диметоксиэтане (20 см 3) добавляют тетракис(трифенилфосфин)палладий (0,20 г, 0,17 ммоль). Через 15 мин добавляют 3 формилфенилбороновую кислоту (1,00 г, 6,93 г) и следом карбонат калия (2,90 г, 21 ммоль) в воде (10 см 3). Через 20 ч при кипячении с обратным холодильником смесь охлаждают, выливая в воду, и экстрагируют EtOAc (х 3). Объединенный органический экстракт промывают насыщенным рассолом, высушивают (MgSO4) и 31 упаривают. Остаток очищают колоночной хроматографией (SiO2, EtOAc: гексан, градиент элюирования) с получением указанного в заглавии соединения (0,66 г, 2,15 ммоль, 60%) в виде белого твердого вещества, 1 Н ЯМР (CDCl3)1,65-1,85 (м, 6 Н), 1,86-2,08 (м, 4 Н), 7,22 (д, 1 Н,J=8 Гц), 7,48 (дд, 1 Н, J=8,2 Гц), 7,61 (т, 1H, J=8 Гц), 7,66 (д, 1H, J=2 Гц), 7,81-7,88 (м, 2 Н), 8,06+)ESI) м/е 306 (М+H)+. 3-(1',2'-Дигидро-2'-оксоспиро[циклогексан 1,3'-[3 Н]индол]-5'-ил) бензальдегидоксим. К раствору 3-(1',2'-дигидро-2'-оксоспироциклогексан-1,3'-[3 Н]индол-5'-ил)бензальдегида (0,59 г, 1,95 ммоль) в EtOH:H2O (10 см 3, 8:2) добавляют гидроксиламин гидрохлорид (0,17 г,2,5 ммоль) и ацетат натрия (0,20 г, 2,5 ммоль). Через 20 мин смесь концентрируют, добавляют воду и продукт экстрагируют EtOAc (х 2). Объединенные органические слои промывают насыщенным раствором гидрокарбоната натрия, водой, насыщенным рассолом, высушивают(MgSO4) и упаривают с получением указанного оксима (0,63 г, 1,95 ммоль, 100%) который используют без дальнейшей очистки, 1 Н ЯМРMS-)ESI) м/е 319 (М-Н)-. 3-(1',2'-Дигидро-2'-оксоспиро[циклогексан 1,3'-[3 Н]индол]-5'-ил)бензонитрил. Раствор 3-(1',2'-дигидро-2'-оксоспиро[циклогексан-1,3'-[3 Н]индол]-5'-ил)бензальдегид оксима (0,48 г, 1,49 ммоль) в хлороформе (10 см 3) обрабатывают диоксидом селена (0,38 г,3,50 ммоль) и нагревают при кипячении с обратным холодильником. Через 16 ч смесь концентрируют и остаток очищают колоночной хроматографией (SiO2, EtOAc:гексан 1:4) и продукт перекристаллизовывают из ЕtOАс-гексана с получением указанного в названии соединения (0,161 г, 0,53 ммоль, 35%) в виде белого твердого вещества: Т.пл. 190-191 С; 1 Н ЯМР[циклогексан-1,3]-[3 Н]индол 1-5-ил)-2-тиофенкарбонитрил. 3-(Триметилстаннил)-2-тиофенкарбонитрил. Раствор 2-бром-2-тиофенкарбонитрила (0,8 г, 4,3 ммоль), тетракис(трифенилфосфин) палладия(0) (0,25 г, 0,2 ммоль) и гексаметилдиолова (1,4 г, 4,3 ммоль) в диметоксиэтане (5 см 3) нагревают при кипячении с обратным холодильником в течение 14 ч, затем охлаждают до комнатной температуры. Реакционную смесь абсорбируют на флорисиле и очищают колоночной хроматографией (SiO2, метиленхлорид:гексан 1:9) с получением указанного в названии соединения (1,04 г, 3,8 ммоль, 90%) в виде чистого вязкого масла: 1 Н ЯМР (CDCl3)0,35 (с, 9 Н), 7,56 (д, J=0,9 Гц, 1 Н), 7,66 (д, J=0,9 Гц, 1 Н). 4-(1,2-Дигидро-2-оксоспиро[циклогексан 1,3-[3 Н]индол]-5-ил)-2-тиофенкарбонитрил. Раствор 5'-бромспиро[циклогексан-1,3'[3 Н]индол]-2'(1'Н)-она (0,53 г, 1,9 ммоль), дихлорбис(трифенилфосфин)палладия(II) (0,1 г,0,14 ммоль) и трифенилмышьяка (0,14 г, 0,47 ммоль) в диметоксиэтане (8 см 3) перемешивают в атмосфере N2 в течение 20 мин. К этой смеси затем добавляют 3-(триметилстаннил)-2 тиофенкарбонитрил (0,64 г, 2,35 ммоль). Раствор оставляют кипятиться с обратным холодильником в течение 32 ч. После охлаждения до комнатной температуры реакционную смесь абсорбируют на флоросиле и очищают колоночной хроматографией(1,3 г, 3,2 ммоль) в о-ксилоле (20 мл) нагревают в течение 2,5 ч. Реакционную смесь промывают дистиллированной водой (5 х 100 мл), высушивают над MgSO4 и упаривают. Продукт очищают колоночной хроматографией(SiO2,EtOAc:гексан 1:5) с получением указанного в названии соединения (0,2 г, 20%) в виде бледножелтого твердого вещества: Т.пл. 230-232 С; 1 Н-ЯМР (ДМСО-d6)12,72 (с, 1 Н), 8,52 (д, 1 Н,J=1,5 Гц), 8,36 (д, 1H, J=1,5 Гц), 8,00 (д, 1 Н,J=1,5 Гц), 7,69 (дд, 1 Н, J=6,4, 1,8 Гц), 7,10 (d,1 Н, J=8,3 Гц), 1,98-1,77 (м, 7 Н), 1,43-1,33 (м,3 Н); MS (El) М+м/е 324.[циклогексан-1,3-[3 Н]индол]-5-ил)-5-фторбензонитрил. К раствору 5'-бромспиро[циклогексан-1,3'[3 Н]индол]-2'-(1'Н)-она (1 мг, 0,04 моль) в сухом тетрагидрофуране (200 см 3) добавляют гидрид натрия (60% дисперсия в минутеральном масле,1,6 г, 0,04 моль). Через 30 мин перемешивания при комнатной температуре смесь охлаждают до -78 С и медленно добавляют бутиллитий (1,7 М в гексане, 23,2 см 3, 0,04 моль). Через 30 мин добавляют диизопропилборат (25 см 3, 0,11 моль) и смесь оставляют нагреваться до комнатной температуры. Через 2 ч добавляют соляную кислоту (1 Н, 500 см 3) и этилацетат (500 см 3). Водную фазу экстрагируют этилацетатом,затем объединенные органические слои промывают водой, рассолом, высушивают (MgSO4) и упаривают. Остаток обрабатывают гексаном и осадок высушивают в вакууме с получением (2'оксо-2,3-дигидроспиро[циклогексан-1,3'-[3 Н] индол]-5'-ил)бороновой кислоты (8,3 г, 86%) в виде грязно-белого твердого вещества, которое используют без дальнейшей очистки. Образец,который далее обрабатывают этилацетатом,имеет следующие свойства: Т.пл. 255-260 С разложение; 1 Н ЯМР (ДМСО-d6)1,50 (м, 2 Н),1,73 (м, 8 Н), 6,82 (d, 1H, J=7,72 Гц) 7,66 (д, 1 Н,J=7,72 Гц) 7,91 (с, 3 Н, широкий), 10,36 (с, 1H);MS -)ESI) м/е 244 [М-Н]. 3-(1,2-Дигидро-2-оксоспиро[циклогексан 1,3-[3 Н]индол]-5-ил)-5-фторбензонитрил. К раствору 3,5-дибромфторбензола в диэтиловом эфире (100 см 3) при -78 С по каплям добавляют n-бутиллитий (2,5 М, 8 см 3, 20 ммоль). Через 30 мин смесь обрабатывают ДМФА (20 см 3) в диэтиловом эфире (10 см 3) и перемешивание продолжают при -78 С. Через 30 мин смесь гасят разбавленным водным раствором НСl, разделяют и водный слой экстрагируют ЕtOАс. Объединенные органические слои соединяют, промывают водой, рассолом, высушивают (MgSO4) и упаривают с получением 3 фтор-5-бромбензальдегида (4,0 г, 19,7 ммоль,100%) в виде масла: 1 Н ЯМР (CDCl3)inter alia 7,50-7,53 (м, 2 Н), 7,82 (с, 1H) и 9,93 (м, 1H); MS(El) м/е 202, 204 [М+]. К раствору последнего соединения (4,0 г,19,7 ммоль) в этаноле:воде (8:2, 50 см 3) добавляют ацетат натрия (1,72 г, 21 ммоль) и гидрохлорид гидроксиламина (1,45 г, 21 ммоль), после чего смесь нагревают при кипячении с обратным холодильником. Через 30 мин смесь охлаждают, упаривают и остаток разделяют между водой и EtOAc. Водный слой переэкстрагируют EtOAc и объединенные органические слои промывают водой, насыщенным раствором гидрокарбоната натрия, рассолом, высушивают(MgSO4) и упаривают с получением 3-фтор-5 бромбензальдегид оксима (3,76 г, 17,24 ммоль,87%), который используют без дальнейшей очи 005034(с, 1 Н), 7,68 (с, 1H) и 8,04 (s, 1H); MS (El) м/е 217 [M+]. Указанный выше оксим (3,76 г, 17,24 ммоль) и ацетат меди (II) (370 мг) растворяют в ацетонитриле (100 см 3) в атмосфере азота и нагревают при кипячении с обратным холодильником. Через 5 ч смесь упаривают, остаток выливают в EtOAc, промывают серной кислотой(1 Н), водой, рассолом, высушивают (MgSO4) и упаривают с получением 3-фтор-5-бромбензонитрила (3,08 г, 15,39 ммоль, 89%), который используют без дальнейшей очистки. Указанный выше бромид (3,0 г, 15 ммоль) и тетракис(трифенилфосфин)палладий(0) (0,86 г, 0,75 ммоль) растворяют в диметоксиэтане(2,82 г, 11,5 ммоль) и карбонат натрия (3,1 г,29,3 ммоль), растворенный в воде (40 см 3), после чего смесь нагревают при кипячении с обратным холодильником. Через 8 ч смесь охлаждают, выливают в воду и экстрагируют EtOAc(х 3). Объединенные органические слои затем промывают водой, высушивают (MgSO4) и упаривают. Остаток очищают колоночной хроматографией (EtOAc:гексан, градиент элюирования) и продукт перекристаллизовывают из метанола с получением 3-(1,2-дигидро-2-оксоспиро [циклогексан-1,3-[3 Н]индол]-5-ил)-5-фторбензонитрила (1,78 г, 5,55 ммоль, 48%): Т.пл. 199205 С; 1 Н ЯМР (СDСl3)1,64-2,03 (м, 10 Н),7,03 (д, 1H, J=8 Гц), 7,31 (дт, 1H, J=7,7 и 1,6 Гц),7,41 (дд, 1H, J=8, 1,7 Гц), 7,49 (дт, 1H, J=9,6, 2 Гц), 7,58 (д, 1H, J=2 Гц), 7,64 (с, 1H) и 8,37 (с,1H): MS (El) м/е 320 [М+]. К раствору 3-(1,2-дигидро-2-оксоспиро[циклогексан-1,3-[3 Н]индол]-5-ил)-5-фторбензонитрила (0,32 г, 1,0 ммоль) в ксилоле (10 см 3) в атмосфере азота добавляют реагент Лоэссона(0,89 г, 2,22 ммоль) и реакцию нагревают при кипячении с обратным холодильником. Через 4 ч смесь охлаждают, упаривают и остаток подвергают колоночной хроматографии (SiO2,EtOAc:гексан, градиент элюирования) с получением продукта (0,143 г, 0,42 ммоль, 42%) в виде белого твердого вещества: Т.пл. 236-250 С; 1 Н ЯМР (CDCl3)1,54-1,66 (м, 3 Н), 1,862,18 (м, 7 Н), 7,16 (д, 1H, J=8,1 Гц), 7,33-7,36 (м,1H), 7,46-7,52 (м, 2 Н), 7,65 (с, 1H), 7,85 (д, 1 Н,J=1 Гц), 10,05 (с, 1H); MS +)-APCI) м/e 337EtOAc (x3). Органический экстракт промывают водой, рассолом, высушивают (MgSO4), и упаривают. Сырой остаток очищают колоночной хроматографией (SiO2, этилацетат:гексан 1:1) с получением указанного в заглавии соединения(0,9 г, 28%): Т.пл. 200-203 С, 1 Н ЯМР (CDCl3)1,63 (м, 8 Н), 1,87 (м, 2 Н), 2,27 (с, 3 Н), 6,95 (д,1 Н, J=8,13 Гц), 7,34 (дд, 1 Н, J=8,13 Гц, 1,98 Гц),7,54 (д, 1 Н, J=1,98 Гц), 7,82 (с, 1 Н), 10,50 (с,1 Н); MS (+АРСI) м/е 323 (М+Н)+. Раствор 4-метил-5-(2'-оксо-2',3'-дигидроспиро[циклогексан-1,3'-[3 Н]индол]-5'-ил)-2-тиофенкарбонитрила (0,61 г, 1,9 ммоль) и пентасульфида фосфора в диоксане (17 мл) нагревают до 85 С в течение 30 мин. Реакционную массу выливают в дистиллированную воду (100 мл),промывают водным NаНСО 3, дистиллированной водой и сушат над MgSO4, упаривают досуха. Очистка остатка с помощью колоночной хроматографии (2,5% МеОН/СН 2 Сl2) на силикагеле приводит к получению продукта в виде оранжево-коричневого твердого вещества (0,05 г, 8%), Т.пл. 244-249 С; 1 Н ЯМР (d6-ДМСО)12,75-1,99 (с, 1 Н), 9,54 (с, 1 Н), 9,34 (с, 1 Н), 7,76[M+H]+. Пример 6. Фармакология. Гестогенную активность соединений по настоящему изобретению оценивают с помощью исследований in vitro и in vivo, описанных ниже. Величины активности in vitro находятся в интервале 0,01-10,000 нМ, а величины активности in vivo находятся в интервале от 1 до 30 мкг/кг. А. Биологическая активность in vitro. Биологическую активность in vitro определяют с помощью (1) исследования конкурентного связывания с радиоактивным лигандом: используют А-форму человеческого рецептора прогестерона с прогестероном в качестве радиоактивного лиганда; (2) исследования с использованием совместной трансфекции, результатом которого являются данные о функциональной активности, выраженные с помощью величин ЕС 50 для агонистов и IC50 для антагонистов; (3) исследования пролиферации T47D клеток, которое также является источником данных о функциональной активности агонистов и антагонистов; и (4) исследования с участием щелочной фосфатазы T47D клеток, которое также позволяет получить функциональные данные об агонистах и антагонистах. 1. Исследование связывания с hPR. Это исследование проводят в соответствии с Pathirana, С.; Stein, R.B.; Berger, T.S.; Fenical,W.; Janiro, Т.; Mais, D.E.; Torres, A.; Glodman, 005034modulators from the marine alga cymoplia barbata,J. Steroid Biochem. Mol. Biol., 1992, 41, 733-738. 2. Исследование с использованием PREлюциферазы в СV-1 клетках. Целью данного исследования является определение наличия у соединений гестагенной или антигестагенной активности на основании их воздействия на репортерную активностьPRE-люциферазы в CV-1 клетках, совместно трансфицированных плазмидами человеческогоPR и PRE-люциферазы. В исследовании используют следующие материалы и методы. а. Среда: использовали следующую среду для выращивания.(об./об.) зародышевой бычьей сыворотки (тепло-инактивированной), 0,1 мМ MEM аминокислот, не являющихся незаменимыми, 100 Ед./мл пенициллина, 100 мг/мл стрептомицина и 2 мМGlutaMax (GIBCO, BRL). Использовали следующую экспериментальную среду: DMEM(BioWhittaker), свободная от фенолового красного, содержащая 10% (об./об.), очищенной с помощью угля (тепло-инактивированной) зародышевой бычьей сыворотки, 0,1 мМ MEM аминокислот, не являющихся незаменимыми, 100 Ед./мл пенициллина, 100 мг/мл стрептомицина и 2 мМ GlutaMax (GIBCO.BRL).b. Культивирование клеток, трансфекция,обработка и исследование с участием люциферазы. Исходные CV-1 клетки сохраняли в среде для выращивания. Совместную трансфекцию проводили с использованием 1,2 х 107 клеток, 5 мг плазмиды pLEM с геном hPR-B, клонированным по сайтам Sph1 и BamHl, 10 мг плазмидыpGL3 с двумя вставками PRE выше последовательности люциферазы, и 50 мг обработанной ультразвуком ДНК тимуса теленка в качестве ДНК-носителя в 250 мл. Электропорацию проводили при 260 В и 1000 мФ в Biorad Gene Pulser II. После электропорации клетки повторно суспендировали в среде для выращивания и высевали на 96-луночные планшеты по 40000 клеток/лунка в 200 мкл. После инкубирования в течение ночи среду заменяли на экспериментальную. Затем клетки обрабатывали сравнительными или тестируемыми соединениями в экспериментальной среде. Соединения проверяли на наличие антигестагенной активности в присутствии 3 нМ прогестерона. Через двадцать четыре часа после обработки среду удаляли,клетки три раза промывали D-PBS (GIBCO,BRL). Добавляли по 50 мкл буфера для лизиса клеток (Promega, Madison, WI) в каждую лунку и встряхивали планшеты в течение 15 мин на планшетном шейкере (Lab Line Instrument, Inc.). Активность люциферазы измеряли с использованием специальных реагентов от фирмы Promega. с. Анализ результатов. Каждая обработка состояла по меньшей мере из 4 повторений опыта. Логарифмически преобразованные данные использовали для анализа дисперсии и нелинейных кривых "дозаэффект", соответствующих активности как агонистов, так и антагонистов. Взвешивание Хьюбера (Huber weighting) использовали для сглаживания эффекта резко выделяющихся значений. Величины EC50 или IС 50 рассчитывали на основании повторно преобразованных величин. Программное обеспечение JMP (SAS Institute,Inc.) использовали для одностороннего анализа дисперсии и анализов нелинейных эффектов.d. Сравнительные соединения. Прогестерон и тримегестон служили сравнительными прогестинами, a RU486 служил сравнительным антипрогестином. Для всех сравнительных соединений строили полные кривые "доза-эффект" и рассчитывaли величины ЕС 50 или IC50. Таблица 1 Приблизительные значения EC50, стандартных ошибок (SE) и 95% доверительных интервалов(CI) сравнительных прогестинов для трех отдельных опытов Соединение 95% CI Нижнее Верхнее значение значение 0,616 0,026 0,509 0,746 0,402 0,019 0,323 0,501 0,486 0,028 0,371 0,637 0,0075 0,0002 0,0066 0,0085 0,0081 0,0003 0,0070 0,0094 0,0067 0,0003 0,0055 0,0082(CI) антипрогестина RU486 для трех отдельных опытов Соединение 95% CI Нижнее Верхнее значение значение 0,019 0,042 0,029 0,048 0,013 0,027 Гестагенная активность: соединения, которые значительно (р 0,05) увеличивают активность PRE-люциферазы по сравнению с контрольным веществом, считаются активными. Антигестагенная активность: соединения,которые значительно (р 0,05) снижают активность PRE-люциферазы, индуцированную 3 нМ прогестероном ЕС 50: концентрация соединения, при которой активность PRE-люциферазы возрастает на половину от максимального значения (по умолчанию - нМ), с SE.IC50: концентрация соединения, при которой активность PRE-люциферазы индуцированная 3 нМ прогестероном, уменьшается на поло 38 вину максимальной величины (по умолчанию нМ), с SE. 3. Исследование пролиферации T47D клеток. Целью данного исследования является определение наличия у соединений гестагенной или антигестагенной активности, путем изучения влияния на пролиферацию T47D клеток. Измеряли величину воздействия соединений на синтез ДНК в T47D клетках. В исследовании использовали следующие материалы и методы. а. Среда для выращивания: DMEM:F12(1:1) (GIBCO, BRL), дополненная 10% (об./об.) зародышевой бычьей сыворотки (не теплоинактивированной), 100 Ед./мл пенициллина,100 мг/мл стрептомицина, и 2 мМ GlutaMaxb. Среда для обработки: Минутимальная Необходимая Среда (MEM) (51200-038GIBCO, BRL) свободная от фенолового красного, дополненная 0,5% очищенной с помощью угля зародышевой бычьей сыворотки, 100 Ед./мл пенициллина, 200 мг/мл стрептомицина,и 2 мМ GlutaMax (GIBCO, BRL). с. Культивирование клеток. Исходные Т 47D клетки сохраняли в среде для выращивания. Для исследования включенияBrdU клетки высевали на 96-луночные планшеты (Falcon, Becton Dickinson Labware) no 10000 клеток/лунка в среде для выращивания. После инкубирования в течение ночи среду заменяли на среду для обработки и клетки культивировали еще 24 ч перед обработкой. Исходные соединения растворяли в подходящем растворителе(100% этанол или 50% этанол/50% DMSO), и впоследствии разбавляли средой для обработки и добавляли к клеткам. Для прогестиновых и антипрогестиновых сравнительных соединений строили полные кривые "доза-эффект". Конечная концентрация растворителя составляла 0,1%. В контрольных лунках к клеткам добавляли только растворитель. Антипрогестины тестировали в присутствии 0,03 нМ тримегестона,сравнительного агониста прогестинов. Через 24 ч после обработки среду удаляли и клетки метили 10 мМ BrdU (Amersham Life Science, Arlington Heights, IL) в среде для обработки в течение 4 ч.d. Исследование пролиферации клеток. По окончании мечения BrdU среду удаляли и измеряли включение BrdU, используя набор ELISA для клеточной пролиферации (RPN 250, Amersham Life Science) в соответствии с инструкциями производителя. Кратко, клетки фиксировали с помощью фиксатора, содержащего этанол, в течение 30 мин с последующим инкубированием в блокирующем буфере в течнение 30 мин для уменьшения фона. Добавляли в лунки меченное пероксидазой анти-BrdU антитело и инкубировали в течение 60 мин. Клетки промывали три раза PBS и инкубировали с 3,3'5,5'-тетраметилбензидиновым (ТМВ) суб 39 стратом 10-20 мин в зависимости от активности тестируемых соединений. Затем в каждую лунку добавляли 25 мкл 1 М серной кислоты для остановки цветной реакции и измеряли оптическую плотность с помощью планшетного считывающего устройства при 450 нм в течение 5 мин. е. Анализ результатов. Преобразованные путем извлечения квадратного корня данные использовали для анализа дисперсии и нелинейных кривых "доза-эффект",соответствующих активности как агонистов, так и антагонистов. Взвешивание Хьюбера использовали для сглаживания эффекта резко выделяющихся значений. Величины ЕС 50 или IC50 рассчитывали на основании повторно преобразованных величин. Программное обеспечениеJMP (SAS Institute, Inc.) использовали для одностороннего анализа дисперсии и анализов нелинейных кривых "доза-эффект" как для единичной дозы, так и для зависимости "доза-эффект"f. Сравнительные соединения. Тримегестон и ацетат медроксипрогестерона (МРА) служили сравнительными прогестинами, a RU486 служил сравнительным антипрогестином. Для всех сравнительных соединений строили полные кривые "доза-эффект" и рассчитывали величины EC50 или IC50. Таблица 3 Приблизительные значения EC50, стандартных ошибок (SE) и 95% доверительных интервалов(CI) для отдельных опытов Соединение 95% CI Нижнее Верхнее значение значение 0,007 0,040 0,011 0,017 0,016 0,024 0,013 0,027 0,011 0,024 95% CI Нижнее Верхнее значение значение 0,008 0,014 0,014 0,020 0,014 0,022EC50: концентрация соединения, при которой включение BrdU возрастает на половину от максимального значения, с SE; IC50: Концентрация соединения, при которой включение BrdU,индуцированное 0,1 тримегестоном, уменьшается на половину максимальной величины, с SE. 4. Исследование с участием щелочной фосфатазы T47D клеток. Целью данного исследования является выявление прогестинов и антипрогестинов путем определения воздействия соединений на активность щелочной фосфатазы в T47D клетках. В 40 исследовании использовали следующие материалы и методы. а. Среда для культивирования: DMEM:F12(1:1) (GIBCO, BRL), дополненная 5% (об./об.) очищенной с помощью угля зародышевой бычьей сывороткиb. Буфер для исследования активности щелочной фосфатазы.II. 0,1 M Tris-HCl, pH 9,8, содержащий 4 мМ п-нитрофенилфосфат (Sigma). с. Культивирование и обработка клеток. Замороженные T47D клетки оттаивали при 37 С на водяной бане и разбавили до 280,000 клеток/мл средой для культивирования. Добавили в каждую лунку 96-луночного планшета(Falcon, Becton Dickinson Labware) no 180 мкл разбавленной клеточной суспензии. Затем в каждую лунку добавили по 20 мкл сравнительных или тестируемых соединений. При исследовании активности прогестиновых антагонистов сравнительные антипрогестины или тестируемые соединения добавляли в присутствии 1 нМ прогестерона. Клетки инкубировали при 37 С во влажной атмосфере с 5% CO2, в течение 24 ч.d. Исследование ферментативной активности щелочной фосфатазы. По окончании обработки среду из планшета удаляли и в каждую лунку добавляли по 50 мкл буфера для исследований I. Встряхивали планшеты в течение 15 мин на планшетном шейкере. Затем в каждую лунку добавляли по 150 мкл буфера для исследований II. Проводили измерение оптической плотности с интервалом в 5 мин в течение 30 мин при контрольной длине волны 405 нм. е. Анализ результатов: Анализ данных "доза-эффект". Для сравнительных и тестируемых соединений строили кривые "доза-эффект" на основании зависимости от дозы (ось X) скорости ферментативной реакции (угол наклона) (осьY). Преобразованные путем извлечения квадратного корня данные использовали для анализа дисперсии и нелинейных кривых "доза-эффект",соответствующих активности как агонистов, так и антагонистов. Взвешивание Хьюбера использовали для сглаживания эффекта резко выделяющихся значений. Величины ЕС 50 или IC50 рассчитывали на основании повторно преобразованных величин. Программное обеспечениеJMP (SAS Institute, Inc.) использовали для одностороннего анализа дисперсии и анализов нелинейных кривых "доза-эффект" как для единичной дозы, так и для зависимости "доза-эффект"f. Сравнительные соединения. Прогестерон и тримегестон служили сравнительными прогестинами, a RU486 служил сравнительным антипрогестином. Для всех сравнительных соединений строили полные кривые "доза-эффект" и рассчитывали величины ЕС 50 или IС 50. Таблица 5 Приблизительные значения ЕС 50, стандартных ошибок (SE) и 95% доверительных интервалов(CI) сравнительных прогестинов для трех отдельных экспериментов Соединение 95% CI Нижнее Верхнее значение значение 0,706 0,996 0,611 0,669 1,158 1,429 0,076 0,091 0,072 0,080 0,141 0,181(CI) сравнительного антипрогестина RU486 для трех независимых экспериментов Соединение 95% CI Нижнее Верхнее значение значение 0,092 0,115 0,115 0,126 0,066 0,134 В. Биологическая активность in vivo. Первичное исследование in vivo представляет собой модель стимуляции выделения отпадающей оболочки у крыс, и может быть использовано для определения гестагенного воздействия и агонистов и антагонистов. Вторичное исследование in vivo предсталяет собой модель подавления овуляции у крыс, оно находится в стадии разработки и поэтому его протокол недоступен. 1. Исследование выделения отпадающей оболочки у крыс. Целью этого исследования является оценка воздействия прогестинов и антипрогестинов на выделение отпадающей маточной оболочки у крыс, а также относительной активности различных тестируемых соединений. В исследовании использовали следующие материалы и методы. а. Методы. Тестируемые соединения растворяли в 100% этаноле и смешивали с кукурузным маслом (растворитель). Затем готовили исходные растворы тестируемых соединений в масле (Mazola) путем нагревания этой смеси (-80 С) для упаривания этанола. Впоследствии перед обработкой животных тестируемые соединения разбавляли 100% кукурузным маслом или 10% этанолом в кукурузном масле. При сравнении этих двух растворителей не наблюдалось никакого различия в эффекте выделения отпадающей оболочки.b. Животные (RACUC протокол 5002). Зрелых самок Sprague-Dawley крыс с удаленными яичниками (60 дневного возраста и весом 230 г) получали от (Taconic Farms, NY) после хирургической операции. Удаление яичников осуществляли по меньшей мере за 10 дней до обработки для уменьшения циркуляции половых стероидных гормонов. Животных держали в режиме 12-часового цикла свет/темнота,и давали им стандартную еду для крыс и по необходимости воду. с. Обработка. Крыс перед обработкой взвешивали и беспорядочно разбивали на группы по 4 или 5 животных. Тестируемые соединения вводили в 0,2 мл растворителя путем подкожной инъекции в заднюю часть шеи или в 0,5 мл с помощью зонда. Обработку животных проводили один раз ежедневно в течение семи дней. В случае исследования прогестинов животные получали тестируемые соединения и дозу ЕС 50 прогестерона(5,6 мг/кг) в течение первых 3 дней обработки. После стимуляции выделения отпадающей оболочки животные продолжали получать прогестерон вплоть до вскрытия трупа, которое проводили 4 дня спустя.d. Дозировка. Дозы подбирали на основе мг/кг среднего значения веса тела в группе. Во все опыты включали контрольную группу, получавшую растворитель. Для построения кривых "дозаэффект" использовали полулогарифмическое увеличение доз (например, 0,1, 0,3, 1,0, 3,0 мг/кг) е. Индукция выделения отпадающей оболочки. Приблизительно через 24 ч после третьей инъекции индуцировали выделение отпадающей оболочки в одной из маточных труб путем царапанья антимезометриального полостного эпителия тупой иглой 21 G. Противоположную трубу не трогали и использовали в качестве не стимулированного контроля. Приблизительно через 24 ч после конечной обработки крыс умерщвляли путем удушения с помощью СO2 и взвешивали их тела. Матки удаляли и очищали от жира. Маточные трубы с выделившейся отпадающей оболочкой (D-труба) и контрольныеf. Анализ результатов. Увеличение веса маточной трубы с выделившейся отпадающей оболочкой рассчитывали по соотношению D-труба/С-труба и использовали логарифмическое преобразование для оптимизации нормальности и гомогенности дисперсии. Использовали Huber M-estimator для сглаживания эффекта наблюдаемых резко выделяющихся преобразованных значений для построения кривых "доза-эффект" и одностороннего анализа дисперсии. Программное обеспечение JMP (SAS Institute, Inc.) использовали для одностороннего ANOVA и анализов нелинейных кривых "доза-эффект".g. Сравнительные соединения. Для всех сравнительных прогестиновых соединений строили полные кривые "дозаэффект" и рассчитывали величины EC50 для сырого веса матки. Таблица 7 Приблизительные значения ЕС 50, стандартных ошибок (SE) и 95% доверительных интервалов(CI) для отдельных опытов Соединение Эксп. Прогестерон 3-Кетодезогестрел Левоноргестрел 95% CI Нижнее Верхнее значение значение 4,21 7,20 4,41 8,76 0,07 0,16 0,11 0,25 0,03 0,14 0,04 0,16 0,09 0,17 0,06 0,13 0,06 0,14 0,29 0,60 0,22 0,67 0,25 0,61 Таблица 8 Приблизительные средние значения EC50,стандартных ошибок и 95% доверительных интервалов (CI) кривых "доза-эффект" для трех сравнительных соединений ЕС 50,мг/кг,подкожно Прогестерон 5,62 3-Кетодезогестрел 0,10 Левоноргестрел 0,10 Соединение 95% CI Нижнее Верхнее значение значение 4,55 7,00 0,07 0,14 0,08 0,12 95% CI Нижнее Верхнее значение значение 0,05 0,96 0,08 0,27 Концентрация: концентрация соединения в исследовании (по умолчанию - мг/кг веса тела) Способ введения: способ, которым соединение вводят животным Вес тела: средний общий вес тела животного (по умолчанию - кг)D-труба: сырой вес маточной трубы с выделившейся отпадающей оболочкой (по умолчанию - мг) С-труба: сырой вес контрольной маточной трубы (по умолчанию - мг) Эффект выделения отпадающей оболочки:[(D-C)/C]x100% Гестагенная активность: соединения, которые в значительной степени (р 0,05) индуцируют выделение отпадающей оболочки по срав 44 нению с контрольным растворителем, считаются активными. Антигестагенная активность: соединения,которые в значительной степени (р 0,05) снижают ЕС 50 индуцированного прогестероном выделения отпадающей оболочки. ЕС 50 для веса матки: концентрация соединения, при которой эффект выделения отпадающей оболочки увеличивается на половину максимальной величины (по умолчанию - мг/кг)IC50 для веса матки: концентрация соединения, при которой эффект выделения отпадающей оболочки, индуцированного прогестероном, уменьшается на половину максимальной величины ЕС 50 (по умолчанию - мг/кг) Данные для некоторых представительных соединений Овуляция[циклогексан-1,3'-[3 Н]индол]-5'-ил)-1 Н-пиррол 2-карбонитрил. 5-(2'-Оксо-2',3'-дигидроспироциклопентан-1,3'-[Н]индол)-5'-ил-2-цианопиррол. Раствор 5'-бромспиро[циклогексан-1,3'[3 Н]индол]-2'(1'Н)-она (2,00 г, 7,5 ммоль) и тетракис(трифенилфосфин)палладия (430 г, 0,3 ммоль) в этиленгликолевом диметиловом эфире перемешивают в атмосфере азота 15 мин. К раствору последовательно добавляют 1-третбутоксикарбонилпирролбороновую кислоту (2,1 г, 9,7 ммоль) и следом карбонат калия (2,4 г, 17 ммоль) в воде (10 см 3). Смесь нагревают при 80 С 3 ч и охлаждают. Смесь выливают в воду(50 мл) и экстрагируют EtOAc (50 х 3). Объединенный органический экстракт промывают рассолом (30 мл), высушивают (MgSO4). Раствор фильтруют и концентрируют в вакууме. Кристаллизация из 20% этилацетата/гексана дает трет-бутиловый эфир 2-(1',2'-дигидро-2-оксоспиро[циклопентан-1,3'-[3 Н]индол]-5'-ил)-1 Нпиррол-2-карбоновой кислоты (2,2 г, 83%) в виде белого порошка, т.пл. 179-180,5 С. 1 Н ЯМР(0,63 мл, 7,0 ммоль). Через 90 мин добавляют диметилформамид (11 мл, 140 ммоль) и реакцию оставляют нагреваться до комнатной температуры. Реакционную смесь выливают в воду(50 мл) и экстрагируют этилацетатом (2 х 50 мл). Органические слои объединяют, промывают рассолом (50 мл), высушивают над сульфатом магния, отфильтровывают и концентрируют в вакууме. Очистка с помощью колоночной хроматографии на силикагеле (30% этилацетат/гексан) приводит к получению третбутилового эфира 5-(2'-оксо-2',3'-дигидроспиро[циклопентан-1,3'-[3 Н]индол]-5'-ил)-2-цианопиррол-1-карбоновой кислоты (1,7 г, 75%) в виде белых кристаллов, Т.пл. 167-9 С. 1 Н ЯМР(с, 1 Н). MS (ESI) м/е 376 [М-Н]-. Анал. Вычислено для С 22H23N3 О 3: С, 70,01; Н, 6,14; N, 11,13. Найдено: С, 69,67; Н, 6,38; N, 11,04. Трет-бутиловый эфир 5-(2'-Oксо-2',3'дигидроспиро[циклопентан-1,3'-[3 Н]индол]-5'ил)-2-цианопиррол-1-карбоновой кислоты (1 г,2,7 ммоль) помещают в 25 мл круглодонную колбу, закрытую резиновой пробкой и оборудованную отверстием для ввода азота и капилляром, позволяющим отводить газ. Сильная продувка азота поддерживается, пока колбу помещают в масляную баню и нагревают до 165 С. Через 20 мин при этой температуре колбу вынимают из масляной бани и оставляют охлаждаться. Кристаллизация из этилового эфира приводит к получению указанного в названии соединения (600 мг, 79%) в виде желтого порошка, Т.пл. 285-286 С. 1 Н ЯМР (ДМСО-d6, 400 МГц)1,75-2,03 (м, 8 Н), 6,60 (дд, 1 Н, J=2,4, 3,7 Гц), 6,84 (д, 1H, J= 8,1 Гц), 6,94 (дд, 1 Н, J=2,4,3,7 Гц), 7,52 (дд, 1H, J=1,8, 8,1 Гц), 7,60 (д, 1H,J=1,8 Гц), 10,38 (с, 1 Н), 12,45 (с, 1 Н). MS (ESI) м/е 276 [М-Н]-. Анал. Вычислено для: С 17 Н 15N3 О: С, 73,63; Н, 5,45; N, 15,15. Найдено: С, 73,24; Н, 5,34; N, 14,96. К 5-(1,2-Дигидро-2-оксоспиро[циклопентан-1,3-[3 Н]индол]-5'-ил)-1 Н-пиррол-2-карбонитрилу (0,18 г, 0,7 ммоль, 1 экв.) в п-ксилоле(20 мл) добавляют реагент Лоэссона (0,14 г, 0,36 ммоль, 0,5 экв.) и реакцию нагревают при кипячении с обратным холодильником в течение 1 ч. Реакцию охлаждают до комнатной температуры и адсорбируют на силикагеле. Очистка с помощью колоночной хроматографии (20% этилацетат/гексан) на силикагеле приводит к получению продукта в виде оранжевого порошка. Дальнейшая очистка с помощью ВЭЖХ приводит к получению указанного в названии соединения в виде зеленого твердого вещества (0,144 г, 70%), Т.пл. 275-276 С (разруш.). 1 Н ЯМР(диметоксиэтане) (100 мл) в атмосфере азота добавляют тетракис(трифенилфосфин)палладий(0) (70 мг, 5 моль%). Через 15 мин последовательно добавляют 1-трет-бутиловый эфир 2 бороно-1 Н-пиррол-1-карбоновой кислоты (1,3 экв., 3,31 г, 15,6 ммоль) и раствор K2 СО 3 (2,3 экв., 3,83 г, 27,6 ммоль) в воде (5 мл). Раствор нагревают до 80 С в течение 3 ч и оставляют охлаждаться. Реакционную смесь выливают в воду (200 мл) и экстрагируют ЕtOАс (2 х 100 мл). Органические слои объединяют, промывают рассолом (150 мл) и высушивают над MgSO4. Раствор отфильтровывают, концентрируют в вакууме, и остаток очищают с помощью колоночной хроматографии на силикагеле (элюируя 30% EtOAc/гексан) с получением третбутилового эфира 2-(1',2'-дигидро-2'-оксоспиро(1,15 экв., 0,23 мл, 2,3 ммоль). Через 90 мин добавляют ДМФА (20 экв., 3,6 мл, 46 ммоль) и реакцию оставляют нагреваться до комнатной температуры. Реакционную смесь выливают в воду (50 мл) и экстрагируют этилацетатом (2 х 50 мл). Органические слои объединяют, промывают рассолом (50 мл), высушивают над сульфатом магния, отфильтровывают и концентрируют в вакууме. Очистка с помощью колоночной хроматографии на силикагеле (30% этилацетат/гексан) приводит к получению третбутилового эфира 5-(2'-оксо-2',3'-дигидроспиро[циклогексан-1,3'-[3 Н]индол]-5'-ил)-2-цианопиррол-1-карбоновой кислоты (0,5 г, 63%) в виде масла, которое кристаллизуют из ацетона с получением белых кристаллов, Т.пл. 156 С. 1 Н ЯМР (d6-ДМСО, 400 МГц)1,32 (с, 9 Н), 1,50(д, 1 Н, J=3,7 Гц), 6,87 (д, 1 Н, J=7,9 Гц), 7,18 (дд, 47 1H, J=1,5, 7,9 Гц), 7,27 (д, 1H, J=3,7 Гц), 7,48 (д,1 Н, J=1,8 Гц), 10,42 (широкий с, 1H). MS (El) м/е 391 (M+). Анал. Вычислено для: C23H25N3O3: С, 70,57; H, 6,44; N, 10,73. Найдено: С, 69,82; H,5,46; N, 10,43. К раствору трет-бутилового эфира 2 циано-5-(1,2-дигидро-2-оксоспиро[циклогексан 1,3-[3 Н]индол]-5-ил)-1 Н-пиррол-1-карбоновой кислоты (0,7 г, 1,8 ммоль, 1 экв.) в толуоле (70 мл) добавляют реагент Лоэссона (0,47 г, 1,1 ммоль, 0,65 экв.) и реакцию нагревают при кипячении с обратным холодильником в течение 1 ч. Реакцию охлаждают до комнатной температуры, выливают в воду (100 мл) и экстрагируют этилацетатом (2 х 100 мл). Органические слои объединяют, промывают рассолом (50 мл), высушивают над сульфатом магния, отфильтровывают и концентрируют в вакууме. Очистка с помощью колоночной хроматографии (20-30% этилацетат/гексан) на силикагеле приводит к получению указанного в названии соединения в виде желтого твердого вещества (0,7 г, 96%). 1 Н ЯМР (d6-ДМСО, 500 МГц)1,30-1,98 (м, 19 Н),6,45 (д, 1 Н, J=3,7 Гц), 7,09 (д, 1 Н, J=7,9 Гц),7,31-7,34 (м, 2 Н), 7,81 (д, 1 Н, J=1,4 Гц), 12,74 (с,1H). MS (ESI) [M-H]-=406. Анал. Вычислено для: C23H25N3O2S: С, 7,79; Н, 6,18; N, 10,31. Найдено: С, 67,86; Н, 5,99; N, 10,25. Пример 9. 5-(1,2-Дигидро-2-тиоксоспироNaOEt (0,25 г, 3,6 ммоль, 3 экв.) в ЕtOН (5 мл) и реакцию нагревают до 80 С в течение 24 ч. Растворители удаляют в вакууме и остаток разделяют между этилацетатом (50 мл) и водой (50 мл). Слои разделяют и водный слой экстрагируют этилацетатом (50 мл). Органические слои объединяют, промывают рассолом (50 мл), высушивают над сульфатом магния, отфильтровывают и концентрируют в вакууме. Очистка с помощью колоночной хроматографии (30% этилацетат/гексан) на силикагеле приводит к получению указанного в названии соединения 48 мл) добавляют реагент Лоэссона (0,47 г, 1,1 ммоль, 0,65 экв.) и реакцию нагревают до 80 С в течение 1 ч. Реакцию охлаждают до комнатной температуры, выливают в воду (100 мл) и экстрагируют этилацетатом (2 х 100 мл). Органические слои объединяют, промывают рассолом(50 мл), высушивают над сульфатом магния,отфильтровывают и концентрируют в вакууме. Очистка с помощью колоночной хроматографии на силикагеле приводит к получению продукта в виде белого твердого вещества (0,32 г, 55%). 1 Н ЯМР (d6-ДМСО, 500 МГц)1,36-1,99 (м,10 Н), 3,7 (с, 3 Н), 6,35 (д, 1 Н, J=4,2 Гц), 7,05 (д,1 Н, J=4,2 Гц), 7,16 (д, 1 Н, J=7,9 Гц), 7,44 (дд,1H, J=1,6, 8,1 Гц), 7,83 (д, 1 Н, J=1,6 Гц), 12,75 (с,1H). MS (ESI) [M-H]-= 320. Анал. Вычислено для: C19H19N3S: С, 70,99; Н, 5,96; N, 13,07. Найдено: С, 68,69; Н, 5,36; N, 12,27. Пример 11. 5-(1,2-Дигидро-2-тиоксоспиро(96,0 г, 500 ммоль) гидрохлорида гидроксиламина (111,9 г, 500 ммоль), пиридина (500 мл) и этанола (500 мл) нагревают в атмосфере азота при кипячении с обратным холодильником в течение 2 ч. Реакционную смесь охлаждают до окружающей температуры и концентрируют в вакууме с получением масла. Сырой продукт обрабатывают дважды ледяной водой и полученное твердое вещество собирают на фильтре. Смесь порции указанного выше твердого вещества (44,31 г, 215 ммоль), моногидрата ацетата меди (II) (4,2 г, 21 ммоль) в ацетонитриле (1,4 л) нагревают при кипячении с обратным холодильником в течение часов. Растворитель удаляют в вакууме и остаток растворяют в этилацетате. Раствор промывают 5% водный серной кислотой (2 Х 30 мл), водой (2 Х 30 мл), рассолом(20 мл) и высушивают (MgSO4). Растворитель удаляют в вакууме и остаток растворяют в минутимальном количестве хлороформа (1 л) и оставляют кристаллизоваться. Полученные кристаллы собирают на фильтре и фильтрат концентрируют и очищают с помощью хроматографии (силикагель, хлороформ) с получением указанного в заголовке соединения в виде грязно-белого твердого вещества (31,5 г объединенного, 58%). IR (пленка) см-1 2200. 1 Н-ЯМРJ=8,13, 1,76 Гц), 7,60 (д, 1 Н, J=4,17 Гц), 7,75 (д,1 Н, J=1,76 Гц), 7,93 (д, 1 Н, J=4,17 Гц), 10,51 (с,1 Н); MS +)АРСI) м/е 309 [М+Н]+. Раствор 5-(1,2-дигидро-2-оксоспиро[циклопентан-1,3-[3 Н]индол]-5-ил)-3-тиофенкарбонитрила (0,66 г, 2,4 ммоль), и 2,4-бис(4 метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4 дисульфида (0,97 г, 2,4 ммоль) в толуоле (250 мл) перемешивают при 80 С в течение 2 ч. Раствор концентрируют в вакууме. Остаток экстрагируют этилацетатом, этилацетатный раствор промывают водой, высушивают над сульфатом магния и концентрируют. Остаток очищают с помощью колоночной хроматографии (силикагель, этилацетат, гексан 20/80) с получением указанного в названии соединения, Т.пл. 269272 С (0,24 г, 32%). 1 Н-ЯМР (ДМСО-d6)2,09(циклопентан-1,3-[3 Н]индол)-5-ил)-2-тиофенкарбонитрил. Названное соединение получают из 5-(1,2 дигидрооксоспиро(циклопентан-1,3-[3 Н]индол)5-ил)-2-тиофенкарбонитрила (2 г, 6,8 ммоль) и реагента Лоэссона (3,32 г, 8,2 ммоль) нагреванием при кипячении с обратным холодильником в толуоле (150 мл) в течение 3 ч. Выход 1,5 г (48,3%). Т.пл. 250-253 С. 1 Н ЯМР (ДМСО-d6)12,75 (С, 1 Н), 7,98-7,97 (д, 1 Н, J=3,9 Гц), 7,717,70 (д, 1 Н, J=5,2 Гц), 7,65-7,62 (д, 1 Н, J=8,1 Гц),7,09-7,07 (д, 1 Н, J=8,1 Гц), 2,13-2,08 (м, 6 Н),1,99-1,85 (м, 2 Н); MS. [M-H]-= 309. ИК (SPATR) 1430, 1620, 2220 см-1. Анал. C17H14N2S2. Вычислено для С, 65,77; Н, 4,55; N, 9,02. Найдено: С 65,27; Н, 4,41; N, 8,84. Пример 13. 5-(3-Фтор-4-метоксифенил) спироциклогексан-1,3-[3 Н]индол]-2(1 Н)-тион. 5-(3-Фтор-4-метоксифенил)спиро[циклогексан-1,3-[3 Н]индол]-2(1 Н)-он. Получают из 4-бром-2-фторанизола и (2'оксо-2',3'-дигидроспиро[циклогексан-1,3'-[3 Н] индол]-5'-ил)бороновой кислоты в соответствии с методикой примера 5 с получением указанного в заголовке соединения в виде белого твердого вещества, Т.пл. 178-180 С; 1 Н-ЯМР (ДМСОd6)10,4 (с, 1 Н), 7,65 (д, 1 Н, J=1,1 Гц), 7,5-7,4[М-Н]-; Анал. Вычислено для: для С 20 Н 20FNO2: С, 73,83, Н, 6,20, N, 4,30. Найдено: С, 73,55, Н,6,23, N, 4,40. Указанное в названии соединение получают при кипячении с обратным холодильником в течение ночи смеси 5-(3-фтор-4-метоксифенил)спиро[циклогексан-1,3-[3 Н]индол]-2(1 Н)она и равного веса пентасульфида фосфора в пиридине. Удаление пиридина в вакууме с последующей обработкой остатка 5N раствором 50 соляной кислоты и последующей перекристаллизацией из этанола приводит к получению серого твердого вещества, Т.пл. 228-229 С; 1 НЯМР (ДМСО-d6)12,7 (с, 1H), 7,9 (с, 1H), 7,67,5 (м, 2 Н), 7,5-7,4 (м, 1H), 7,2 (т, 1H, J=8,8 Гц),7,1 (д, 1H, J=8,1 Гц), 3,9 (с, 3 Н), 1,9-1,8 (м, 7 Н),1,4-1,3 (м, 3 Н); MS (APCI (- [М-Н]- м/е 324. Анал. Вычислено для: C20H20FNOS0,25 Н 2O: С,69,44; Н, 5,97; N, 4,05. Найдено: С, 69,43; Н,5,75; N, 4,32. Пример 14. 5-(2-Амино-5-пиримидинил) спиро[циклогексан-1,3-[3 Н]индол]-2(1 Н)-тион. Получают при кипячении с обратным холодильником в течение ночи смеси 5-(2-амино 5-пиримидинил)спиро[циклогексан-1,3-[3 Н]индол]-2(1 Н)-она и равного веса пентасульфида фосфора в пиридине. Удаление пиридина в вакууме с последующей обработкой остатка 5N раствором соляной кислоты и последующая перекристаллизация в этаноле приводит к получению серого твердого вещества; Т.пл. 274277 С (разруш.); 1 Н-ЯМР (ДМСО-d6)12,7 (с, 1H), 8,6 (с,2 Н), 7,9 (с, 1H), 7,5 (д, 1H, J=8,1 Гц), 7,1 (д, 1H,J=8,1 Гц), 6,8 (с, 2 Н), 1,9-1,8 (м, 7 Н), 1,4-1,3 (м,3 Н). MS (APCI (- [М-H]- м/е 309. Пример 15. 3-(1,2-Дигидро-2-тиоксоспиро(1,6 М в гексане, 19,7 см 3, 31,5 ммоль) по каплям. К полученному мутному раствору добавляют N,N,N',N'-тетраметилэтилендиаминут (4,75 см 3, 31,5 ммоль). Через 30 мин добавляют раствор 1,4-дийодбутана (21,9 г, 70,6 ммоль) в ТГФ(3 см 3) и реакционную смесь оставляют нагреваться до комнатной температуры, а затем перемешивают в течение 14 ч. Реакционную смесь выливают в воду, экстрагируют EtOAc (x2),объединенные органические слои промывают разбавленной НСl (рН 1) и водой (x2), высушивают (MgSO4) и упаривают. Остаток очищают с помощью колоночной хроматографии (SiO2,EtOAc: гексан 1:4) с получением указанного в заголовке соединения (1,4 г, 7,5 ммоль, 50%) в виде рыжевато-коричневого твердого вещества: 1 Н ЯМР (CDCl3)1,8-2,2 (м, 8 Н), 6,94 (дд,J=7,5, 1,0 Гц, 1 Н), 7,01 (дд, J=7,5, 1,0 Гц, 1 Н),7,14-7,25 (м, 2 Н), 9,30 (широкий с, 1 Н). 5-Бром-спиро[циклопентан-1,3'-[3 Н]индол]-2'(1'Н)-он. Раствор спиро[циклопентан-1,3'-[3 Н]индол]-2'(1'Н)-она (0,27 г, 1,4 ммоль) и ацетата натрия (0,12 г, 1,46 ммоль) в уксусной кислоте(10 см 3) обрабатывают бромом (0,24 г, 1,51 ммоль) в уксусной кислоте (2 см 3). Через 30 мин смесь выливают в насыщенный раствор гидро 51 карбоната натрия и экстрагируют (EtOAc х 2),объединенные органические слои промывают водой, насыщенным раствором гидрокарбоната натрия, водой, высушивают (MgSO4) и упаривают с получением указанного в заголовке соединения (0,37 г, 1,47 ммоль, 96%) в виде грязно-белого твердого вещества, которое используется без дальнейшей очистки: 1 Н ЯМР (СDСl3)1,8-2,27 (м, 8 Н), 6,79 (д, J=8 Гц, 1 Н), 7,30-7,39(м, 2 Н), 8,63 (широкий с, 1 Н). 5'-(3-Циано-5-фторфенил)спиро[циклопентан-1,3'-[3 Н]индол]-2'(1'Н)-он. Раствор 3-циано-5-фторбромбензола (0,5 г,2,6 ммоль) и тетракис (трифенилфосфин) палладия(0) (0,2 г) в этиленгликолевом диметиловом эфире (20 см 3) перемешивают в атмосфере N2 в течение 20 мин. К этой смеси затем добавляют(спиро[циклопентан-1,3'-[3 Н]индол]-2'(1'Н)-он 5-ил)бороновую кислоту (0,9 г, 3,9 ммоль) и карбонат натрия (0,8 г, 7,8 ммоль) в воде (5 см 5). Раствор оставляют кипятиться с обратным холодильником в течение 18 ч и затем охлаждают до комнатной температуры, выливают в 2NNaOH и экстрагируют EtOAc (x3). Объединенные экстракты промывают водой, рассолом,высушивают (MgSO4) и упаривают. Остаток очищают с помощью колоночной хроматографии (SiO2, EtOAc, гексан) с получением указанного в заголовке соединения (0,35 г, 44%) в виде белых игл, Т.пл. 235-237 С; 1 Н ЯМР (ДМСО-d6)10,5 (с, 1 Н), 8,1 (с, 1 Н), 8,0 (дт, 1 Н, J=1,7, 2,0,7,0 Гц), 7,8-7,7 (м, 2 Н), 7,6 (дд, 1 Н, J=1,8, 6,4 Гц), 6,9 (д, 1 Н, J=8,1 Гц), 2,0-1,9 (м, 8 Н); MS (El)M+м/е 306. Общая методика А. Приведенное в названии соединения получают из 5'-(3-циано-5-фторфенил)спиро[циклопентан-1,3'-[3 Н]индол]-2'(1'Н)-она (40 мг) и реагента Лоэссона (50 мг) в толуоле (10 мл) при кипячении с обратным холодильником в герметично закрытой трубке в течение 16 ч. Смесь концентрируют и остаток растворяют в минутимальном количестве ТГФ, затем очищают с помощью ВЭЖХ (SiO2, 30 см х 2,5 см, ЕtOАсГексан 2:8 при 20 мл/мин) с получением указанного в названии соединения (0,022 г) в виде грязно-белого твердого вещества: Т.пл. 236238 С; 1 Н ЯМР (ДМСО-d6)12,66 (широкий с,1 Н), 8,11 (с, 1 Н), 7,97 (дт, 1 Н, J=10,1 и 2,2 Гц),7,79-7,76 (м, 2 Н), 7,68 (дд, 1H, J=8,1 и 1,7 Гц),7,07 (д, 1 Н, J=8,1 Гц), 2,10-2,05 (м, 6 Н) и 1,971,88 (м, 2 Н); MS (El) м/е 322 [М]+. Пример 16. 5-(3-Хлорфенил)-3,3-диметил 1,3-дигидро-2 Н-индол-2-тион. 5-(3-Хлорфенил)-3,3-диметил-1,3-дигидроиндол-2-он. 5-Бром-1,3-дигидро-3,3-диметил-2 Н-индол-2-он (0,98 г, 4,07 моль) и тетракис(трифенилфосфин)палладий(0) (0,239 г) перемешивают в атмосфере азота в диметоксиэтане (35 см 3). Через 15 мин добавляют 3 005034 52 хлорфенилбороновую кислоту (1,27 г, 8,13 моль) и следом карбонат калия (3,40 г, 45 ммоль) в воде (15 см 3). Реакцию нагревают при кипячении с обратным холодильником в течение 2 ч и затем перемешивают при комнатной температуре в течение ночи. Смесь разбавляют насыщенным хлоридом аммония и экстрагируют EtOAc (х 3). Объединенные органические слои высушивают (MgSO4), отфильтровывают и упаривают. Остаток очищают с помощью колоночной хроматографии (SiO2, EtOAc:гексан, 1:3) с получением указанного в заголовке соединения (0,284 г, 25%): Т.пл. 188-189 С; 1 Н ЯМР(ДМСО-d6)3,34 (с, 6 Н), 6,93 (д, 1 Н, J=8,04 Гц),7,38-7,35 (м, 1 Н), 7,53-7,43 (м, 2 Н), 7,61 (д, 1 Н,J=7,68 Гц), 7,70 (с, 2 Н), 10,40 (с, 1 Н); ИК (KBr) 3420, 3150, 3050, 1700 см-1; MS (El) м/е 270 (МН)-; CHN Вычислено для: C16H14ClNO+ 0,1 С 4 Н 8O2: С, 70,21; Н, 5,32; N, 4,99; Найдено: С, 70,3; Н, 5,44; N, 4,93. Указанное в заголовке соединение получают из 5-(3-хлорфенил)-3,3-диметил-1,3-дигидроиндол-2-она (100 мг) и реагента Лоэссона[М]+. Пример 17. 3-Бензил-5-(3-хлорфенил)-3 метил-1,3-дигидро-2 Н-индол-2-тион. Указанное в заголовке соединение получают из 3-бензил-5-(3-хлорфенил)-3-метил-1,3 дигидроиндол-2-она (100 мг) и реагента Лоэссона (120 мг) в толуоле (10 мл) при кипячении с обратным холодильником в соответствии с общей методикой А, с получением указанного в названии соединения (0,022 г) в виде грязнобелого твердого вещества: Т.пл. 168-170 С; 1 Н ЯМР (СDСl3)9.23 (широкий с, 1 Н), 7,49 (с,1 Н), 7,49-7,30 (м, 4 Н), 7,21 (с, 1 Н), 7,15-7,09 (м,3 Н), 6,96-6,94 (м, 2 Н), 6,89 (д, 1 Н, J=8,0 Гц), 3,19(дд, 2 Н, J=40,5 и 13 Гц) и 1,57 (с, 3 Н); MS (ЕI) м/е 363/365 [М]+. Пример 18. 4-(3,3-Диметил-2-тиоксо-2,3 дигидро-1 Н-индол-5-ил)-2-фуронитрил. 4-(3,3-Диметил-2-оксо-2,3-дигидро-1 Ниндол-5-ил)фуран-2-карбонитрил. Получают в соответствии с методикой примера 5, используя (2'-оксо-[2,3-дигидро-3,3 диметил-1,3'-[3 Н]индол]-5'-ил)бороновую кислоту (354 мг, 1,7 ммоль) и 4-бром-фуран-2 карбонитрил (200 мг, 1,2 ммоль) с получением указанного в заголовке соединения (76 мг, 0,3 ммоль, 26%) в виде белого твердого вещества: Т.пл. 199,6-201,4 С, 1 Н ЯМР (ДМСО-d6)1,28(с, 6 Н), 6,89 (д, J=8,0 Гц, 1 Н), 7,48 (дд, J=8,0, 1,8 Гц, 1 Н), 7,65 (д, J=1,5 Гц, 1 Н), 8,1 (с, 1H), 8,5 (с, 53 1 Н), 10,46 (с, 1H); MS (ESI); м/е 251 (М-Н)-; Анал. C15H12N2O2.0,6 H2O Указанное в названии соединение получают из 4-(3,3-диметил-2-оксо-2,3-дигидро-1 Ниндол-5-ил)фуран-2-карбонитрила (73 мг) и реагента Лоэссона (120 мг) в толуоле (10 мл) при кипячении с обратным холодильником в соответствии с общей методикой А, с получением указанного в названии соединения (0,003 г) в виде грязно-белого твердого вещества: Т.пл. 188-191 С; 1 Н ЯМР (СDСl3)9,63 (широкий с,1H), 7,83 (с, 1 Н), 7,36-7,33 (м, 3 Н), 7,06 (д, 1 Н,J=7,9 Гц) и 1,48 (с, 6 Н); MS (El) м/е 268 [М]+. Пример 19. 5-(3-Метоксифенил-3,3-диметил-1,3-дигидро-2-Н-индол)-2-тион. 5-Бром-1,3-дигидро-3,3-диметил-2 Н-индол-2-он. 3,3-Диметилиндол-2-он (0,65 г, 4,03 ммоль) и ацетат натрия (0,33 г, 4,07 ммоль) перемешивают в уксусной кислоте (5 см 3), затем к реакционной смеси по каплям добавляют бром(0,66 г, 4,13 ммоль) в уксусной кислоте (5 см 3). Реакцию перемешивают в течение 50 мин, затем выливают в воду. Смесь подщелачивают карбонатом натрия, экстрагируют этилацетатом (х 3),высушивают (MgSO4), отфильтровывают и упаривают с получением указанного в заголовке соединения (0,89 г, 92%) 1 Н ЯМР (ДМСО-d6)1,21 (с, 6 Н), 6,76 (д, 1 Н, J= 8,22 Гц), 7,29 (дд, 1 Н,J=2,12 Гц, 8,23 Гц), 7,49 (д, 1 Н, J=2,03 Гц), 10,4(с, 1 Н). 5-Бром-1,3-дигидро-3,3-диметил-2 Н-индол-2-он (0,33 г, 1,38 ммоль) и тетракис(трифенилфосфин)палладий(0) (0,094 г) перемешивают в атмосфере азота в диметоксиэтане (12 см 3). Через 15 мин добавляют 3 метоксифенилбороновую кислоту (0,42 г, 2,76 ммоль) и затем карбонат кальция (1,15 г, 8,34 ммоль) в воде (5 см 3). Реакцию нагревают при кипячении с обратным холодильником в течение 5 ч и затем охлаждают до комнатной температуры. Добавляют насыщенный водный хлорид аммония и ЕtOАс и смесь отфильтровывают. Водный слой экстрагируют EtOAc (x2) и объединенные органические слои высушивают(MgSO4), отфильтровывают и упаривают. Остаток очищают с помощью колоночной хроматографии (SiO2, EtOAc:гексан 1:3) с получением 5(3-метоксифенил)-3,3-диметил-1,3-дигидроиндол-2-она (0,11 г, 31%), Т.пл=157-158 С; 1 Н ЯМР (ДМСО-d6)3,34 (с, 6 Н), 3,82 (с, 3 Н),6,87-6,93 (м, 2 Н), 7,20-7,15 (м, 2 Н), 7,37-7,32 (м,1 Н), 7,49-7,46 (м, 1 Н), 7,63 (д, 1 Н, J=1,14 Гц),10,4 (с, 1H); MS (El) м/е 266 (M-H)-; CHN Анализ. Вычислено для: С 17 Н 17NO2: С, 76,38; Н,6,41; N, 5,24; Найдено: С, 76,02; Н, 6,49; N, 5,02. Указанное в заголовке соединение получают из 5-(3-метоксифенил)-3,3-диметил-1,3 дигидроиндол-2-она (100 мг) и реагента Лоэссона (120 мг) в толуоле (10 мл) при кипячении с обратным холодильником в соответствии с об 005034 54 щей методикой А, с получением указанного в названии соединения (0,022 г) в виде грязнобелого твердого вещества: Т.пл. 149-150 С; 1 Н ЯМР (CDCl3)9,69 (широкий с, 1 Н), 7,49-7,46[циклогексан-1,3-[3 Н]индол]-5-ил)-4-фторбензонитрил. 3-(1,2-Дигидро-2-оксоспиро[циклогексан 1,3-[3 Н]индол]-5-ил)-4-фторбензонитрил. Получают в соответствии с методикой примера 5: Т.пл. 205-206 С. 1 Н ЯМР (ДМСО-d6)10,47 (с, 1 Н), 8,08-8,06 (дд, 1 Н), 7,89-7,85 (м,1 Н), 7,65 (с, 1 Н), 7,54-7,49 (м, 1 Н), 7,43-7,40 (тт,1 Н), 6,95-6,93 (д, 1 Н, J=7,9 Гц), 1,97-1,83 (м,2 Н), 1,69-1,55 (м, 8H); MS(El) м/e 320 (M+). Указанное в заголовке соединение получают из 3-(1,2-дигидро-2-оксоспиро[циклогексан-1,3-[3 Н]индол]-5-ил)-4-фторбензонитрила(2,79 г, 15,26 ммоль), гексаметилдиолова (5,00 г,15,26 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,20 г, 0,17 ммоль) в безводном диметоксиэтане (30 см 3) в атмосфере N2 нагревают при кипячении с обратным холодильником. Через 16 ч смесь концентрируют и очищают с помощью колоночной хроматографии (SiO2, EtOAc: гексан 5:95) с получением 3 цианопиридин-5-триметилстаннана (2,82 г,10,55 ммоль, 69%): 1 Н ЯМР (CDCl3)0,40 (с,9 Н), 8,01 (м, 1 Н), 8,80 (м, 2 Н); MS +) APCI) м/е 269 (М+Н)+. Раствор 5'-бромспиро[циклогексан-1,3'[3 Н]индол]-2'(1'Н)-она (1,97 г, 7,05 ммоль), 3 цианопиридин-5-триметилстаннана (2,26 г, 8,46 ммоль), бис(трифенилфосфин)палладия(II) хлорида (0,33 г, 0,47 ммоль) и хлорида лития (1,48 г, 35 ммоль) в безводном толуоле (30 см 3) нагревают при кипячении с обратным холодильником. Через 16 ч смесь охлаждают, разделяют между EtOAc и водой, водный слой переэкстрагируют EtOAc (х 2), объединенные органические экстракты промывают водой, высушивают(MgSO4) и упаривают. Остаток подвергают ко 55 лоночной хроматографии (SiO2, EtOAc: гексан,1:2) и затем далее очищают препаративной жидкостной хроматографией (Primesphere С 18,10 micron, 50 х 250 мм, MeCN: H2O 1:1, 100 см 3/мин, комнатная температура 7,92 мин) с получением 3-(1',2'-дигидро-2'-оксоспиро[циклогексан-1,3'-[3 Н]индол]-5'-ил)пиридинкарбонитрила в виде белых кристаллов (0,56 г, 1,84 ммоль, 26%): Т.пл. 232-234 С, 1 Н ЯМР (CDCl3)1,68-1,89 (м, 6 Н), 1,93-2,13 (м, 4 Н), 7,12 (д, 1 Н,J=8 Гц), 7,49 (дд, 1 Н, J=8,2 Гц), 7,66 (д, 1 Н, 2 Гц), 8,15 (т, 1 Н, J=2 Гц), 8,39 (с, 1 Н, широкий),8,89 (д, 1 Н, J=2 Гц), 9,06 (д, 1 Н, J=2 Гц); MS+)-ESI) м/е 304 (M+H)+; Анал. С 19 Н 17N3 О CHN. Указанное в заголовке соединение получают из 3-(1',2'-дигидро-2'-оксоспиро[циклогексан-1,3'-[3 Н]индол-5'-ил)пиридинкарбонитрила (100 мг) и реагента Лоэссона (120 мг) в толуоле (10 мл) при кипячении с обратным холодильником в соответствии с общей методикой А, с получением указанного в названии соединения (0,004 г) в виде желтого твердого вещества: Т.пл. 237-238 С; 1 Н ЯМР (CDCl3)9,56(м, 10 Н); MS +)APCI) м/е 314 [М+H]+. Указанное в заголовке соединение получают из 5'-(3,5-дифторфенил)спиро[циклогексан-1,3'-[3 Н]индол]-2'(1'Н)-она (100 мг) и реагента Лоэссона (120 мг) в толуоле (10 мл) при кипячении с обратным холодильником в соответствии с общей методикой А, с получением продукта (0,020 г) в виде желтого твердого вещества: Т.пл. 232-233 С; 1 Н ЯМР (CDCl3)10,05 (широкий с, 1 Н), 7,83 (с, 1 Н), 7,44 (дд, 1 Н,J=8,1 и 1,4 Гц), 7,38-7,30 (м, 1 Н), 7,26-7,19 (м,3 Н), 7,11 (д, 1 Н, J=8,1 Гц), 2,17-1,82 (м, 7 Н) и 1,66-1,53 (м, 3 Н); MS -)-APCI) м/е 328 [М-Н]-. Пример 23. 5-(5-Хлор-2-тиенил)спиро(El) м/е 318 (М+Н)+; Анал. (C17H16ClNOS) С, Н,N. Указанное в заголовке соединение получают из 5-(5-Хлор-2-тиенил)спиро [циклогексан-1,3-[3 Н]индол]-2(1 Н)-она (100 мг) и реагента Лоэссона (120 мг) в толуоле (10 мл) при кипячении с обратным холодильником в соответствии с общей методикой А, с получением продукта (0,041 г) в виде желтого твердого вещества: Т.пл. 231-232 С; 1 Н ЯМР (CDCl3)9,75[циклогексан-1,3-[3 Н]индол]-5-ил)-3-фуранкарбонитрил. 5-(1',2'-Дигидро-2'-оксоспиро[циклогексан 1,3'-[3 Н]индол]-5'-ил)-3-фуранкарбонитрил. Получают в соответствии с методикой примера 5: Т.пл. 243-245 С. 1 Н-ЯМР (ДМСО-d6)10,48 (с, 1H), 8,62 (д, 1 Н, J=0,7 Гц), 7,76 (д, 1 Н,J=1,5 Гц), 7,58-7,55 (дд, 1 Н), 7,33 (д, 1H, J=0,7 Гц), 6,92-6,90 (д, 1 Н, J=8,1 Гц), 1,87-1,83 (м, 2 Н),1,73-1,53 (м, 8 Н). MS +)ЕI) м/е 292 (М+). Указанное в заголовке соединение получают из 5-(1',2'-дигидро-2'-оксоспиро[циклогексан-1,3'-[3 Н]индол]-5'-ил)-3-фуранкарбонитрила (100 мг) и реагента Лоэссона (120 мг) в толуоле (10 мл) при кипячении с обратным холодильником в соответствии с общей методикой А, с получением продукта (0.020 г) в виде желтого твердого вещества: Т.пл. 264-268 С; 1 Н ЯМР (СDСl3)9,66 (широкий с, 1 Н), 7,98 (с,2 Н), 7,59 (дд, 1 Н, J=8,2 и 1,5 Гц), 7,08 (д, 1 Н,J=8,2 Гц), 6,78 (с, 1 Н), 2,16-1,85 (м, 7 Н) и 1,561,52 (м, 2 Н): MS -)-APCI) м/е 307 [М-Н]-. Пример 25. 5-(3-Хлор-4-фторфенил)спиро[M+H]+. Указанное в заголовке соединение получают из 5'-(3-хлор-4-фторфенил) спиро [циклогексан-1,3'-[3 Н]индол]-2'(1'Н)-она (100 мг) и реагента Лоэссона (100 мг) в толуоле (10 мл) при кипячении с обратным холодильником в соответствии с общей методикой А, с получением продукта (0,036 г) в виде грязно-белого твердого вещества: 1 Н ЯМР (ДМСО-d6)12,74 (широкий с, 1 Н), 7,92 (с, 1 Н, J=1,4 Гц), 7,87 (дд, 1 Н,J=7,1 и 2,3 Гц), 7,70-7,65 (м, 1 Н), 7,61 (дд, 1 Н,J=7,1 и 1,5 Гц), 7,49 (т, 1 Н, J=8,9 Гц), 7,14 (д,1 Н, J=8,1 Гц), 1,99-1,82 (м, 7 Н) и 1,40-1,37 (м,3 Н): MS -)-APCI) м/е 344/346 [М-Н]-.MS -)ESI) [M-H]-м/е 328. Указанное в заголовке соединение получают из 5'-(3-хлор-5-фторфенил)спиро[циклогексан-1,3'-[3 Н]индол]-2'(1'Н)-она (100 мг) и реагента Лоэссона (100 мг) в толуоле (10 мл) при кипячении с обратным холодильником в соответствии с общей методикой А, с получением продукта (0,039 г) в виде грязно-белого твердого вещества: 1 Н ЯМР (ДМСО-d6)12,76 (широкий с, 1 Н), 7,97 (д, 1 Н, J=1,1 Гц), 7,67 (дд, 1 Н,J=8,1 и 1,4 Гц), 7,60-7,54 (м, 2 Н), 7,40 (дт, 1 Н,J=8,65 и 2,0 Гц), 7,14 (д, 1 Н, J=8,1 Гц), 1,99-1,83(м, 10 Н); MS +)APCI) м/е 314 [М+H]+. Указанное в заголовке соединение получают из 5'-(3,5-дифторфенил)спиро[циклогексан-1,3'-[3 Н]индол]-2'(1'Н)-она (100 мг) и реагента Лоэссона (100 мг) в толуоле (10 мл) при кипячении с обратным холодильником в соответствии с общей методикой А, с получением указанного в названии соединения 0,029 г в виде грязно-белого твердого вещества: 1 Н ЯМР[циклогексан-1,3-[3 Н]индол]-5-ил)-4-пропил-2 тиофенкарбонитрил. 5-(1,2-Дигидро-2-оксоспиро[циклогексан 1,3-[3 Н]индол]-5-ил)-4-пропил-2-тиофенкарбонитрил. Указанное в названии соединение получают аналогично примеру 5 из 5-бром-4-n-пропил тиофен-2-карбонитрила (1,17 г, 5 ммоль), (1,2 дигидро-2-оксоспиро[циклогексан-1,3-[3 Н]индол])-5-бороновой кислоты (1,24 г, 5 ммоль),тетракис(трифенилфосфин)палладия, карбоната калия (2,75 г, 21 ммоль), воды (10 мл) и диметоксиэтана (50 мл), нагреваемых при кипячении с обратным холодильником в течение ночи, сC21H22N2OS 1/2 Н 2O Вычислено для: С, 70,2; Н,6,39; N, 7,79. Найдено: С, 70,67; Н, 6,34; N, 7,62. Указанное в заголовке соединение получают из 5-(1,2-дигидро-2-оксоспиро[циклогексан-1,3-[3 Н]индол]-5-ил)-4-пропил-2-тиофенкарбонитрила (90 мг) и реагента Лоэссона (90 мг) в толуоле (10 мл) при кипячении с обратным холодильником в соответствии с общей методикой А, с получением указанного в заголовке соединения (0,037 г) в виде оранжевого твердого вещества: 1 Н ЯМР (ДМСО-d6)12,83 (широкий с, 1 Н), 7,96 (с, 1 Н), 7,77 (с, 1 Н), 7,44 (д, 1 Н,J=7,7 Гц), 7,19 (д, 1 Н, J=8,0 Гц), 2,60 (т, 2 Н,J=8,0 Гц), 1,98-1,79 (м, 7 Н), 1,64-1,56 (м, 2 Н),1,39-1,35 (м, 2 Н) и 0,87 (т, 3 Н, J=7,3 Гц):МS -)АРСI) м/е 365 [М-Н]-. Пример 29. 5-(3-Фтор-4-нитрофенил)спиро[циклогексан-1,3'-[3H]индол]-5'-ил)бороновой кислоты (3,2 г, 12,5 ммоль) и 4-бром-2-фторнитробензола (3 г, 13,6 ммоль) как описано в примере 5, с получением указанного в названии соединения (0,7 г, 16%) в виде желтого твердого вещества: Т.пл. 213-215 С; 1 Н ЯМР (ДМСО-d6)1,5-1,8 (м, 8 Н), 1,8-2,0 (м, 2 Н), 6,96 (д, 1 Н,J=8,13 Гц), 7,68 (дд, 1H, J=8,13, 1,76 Гц), 7,74(дд, 1 Н, J=8,68, 1,76 Гц), 7,86 (д, 1 Н, J=1,98 Гц),7,92 (дд, 1H, J=13,4, 1,76 Гц), 8,18 (т, 1 Н, J=8,46 Гц) и 10,52 (с, 1 Н); MS (El) м/е=340 (М+). Указанное в заголовке соединение получают из 5-(3-фтор-4-нитрофенил)спиро[циклогексан-1,3-[3 Н]индол]-2(1 Н)-она (90 мг) и реагента Лоэссона (90 мг) в толуоле (10 мл) при кипячении с обратным холодильником в соответствии с общей методикой А, с получением продукта (0,021 г) в виде желтого твердого вещества: 1 Н ЯМР (ДМСО-d6)12,82 (широкий с,1H), 8,21 (т, 1H, J=8,4 Гц), 8,07 (д, 1H, J=1 Гц),78,9 (дд, 1H, J=13,1 Гц), 7,79 (дт, 1H, J=8,1 и 2,6 Гц), 7,19 (1H, J=8,2 Гц), 1,99-1,83 (м, 7 Н) и 1,421,39 (м, 3 Н): MS -)-APCI) м/е 355 [М-Н]-. Пример 30. 4-(1,2-Дигидро-2-тиоксоспиро[циклогексан-1,3-[3 Н]индол]-5-ил)-2-фуранкарбонитрил. 4-(1,2-Дигидро-2-оксоспиро[циклогексан 1,3-[3 Н]индол]-5-ил)-2-фуранкарбонитрил. Раствор 3-бром-5-цианофурана (0,75 г, 4,4 ммоль) и тетракис(трифенилфосфин) палладия(0) (0,4 г) в этиленгликолевом диметиловом эфире (20 см 3) перемешивают в атмосфере N2 в течение 20 мин. К этой смеси затем добавляют(спиро[циклогексан-1,3'-[3 Н]индол]-2'(1'Н)-он 5-ил)бороновую кислоту (1,6 г, 6,5 ммоль) и ацетат натрия (1,4 г, 13,1 ммоль) в воде (5 см 3). Раствор кипятят с обратным холодильником в течение 18 ч и затем охлаждают до комнатной температуры, выливают в 2N NaOH и экстрагируют EtOAc (x3). Объединенные экстракты промывают водой, рассолом, высушивают(MgSO4) и упаривают. Остаток очищают с помощью колоночной хроматографии (SiO2,EtOAc, гексан) с получением продукта (0,45 г,36%) в виде грязно-белого твердого вещества,Т.пл. 240-242 С; 1 Н ЯМР (ДМСО-d6)10,4 (с,1 Н), 8,5 (с, 1 Н), 8,2 (с, 1 Н), 7,7 (с, 1 Н), 7,5 (дд, 1 Н, J=1,5, 6,5 Гц), 6,9 (д, 1 Н, J=8,0 Гц), 2,0-1,6 (м,10 Н); MS (El) M+м/е 292. Указанное в заголовке соединение получают из 4-(1,2-дигидро-2-оксоспиро[циклогексан-1,3-[3 Н]индол]-5-ил)-2-фуранкарбонитрила (67 мг) и реагента Лоэссона (67 мг) в толуоле (10 мл) при кипячении с обратным холодильником, в соответствии с общей методикой А, с получением указанного в названии соединения (0,018 г) в виде желтого твердого вещества: 1 Н ЯМР (ДМСО-d6)12,74 (с, 1 Н), 8,68 (с, 1 Н),8,26 (с, 1 Н), 7,96 (с, 1 Н), 7,62 (дд, 1 Н, J=8,0 и 1,0 Гц), 7,10 (с, 1 Н, J=8,1 Гц), 1,94-1,78 (м, 7 Н) и 1,35-1,32 (м, 3 Н): MS -)-APCI) м/е 307 [М-Н]-. Пример 31. 5'-(3-Xлopфeнил)cпиро[циклoбутaн-1,3'-[3H]индoл]-2'(1'H)-тиoн. 5-Бромспиро[циклобутан-1,3-[3 Н]индол]2(1 Н)-он. К перемешиваемому раствору спиро[циклобутан-1,3'-[3H]индол]-2'(1'Н)-онаMed. Chem. 1987, 824-9) (1,0 г, 6 ммоль) в ледяной уксусной кислоте (10 мл) добавляют по каплям при комнатной температуре раствор брома(6 мл). После перемешивания в течение 10 мин добавляют безводный ацетат натрия (0,47 г, 6 ммоль) и раствор упаривают в вакууме. Остаток растворяют в этиловом эфире (50 мл) и промывают последовательно водой (50 мл), водным насыщенным раствором бикарбоната натрия (50 мл), водой (50 мл) и рассолом (30 мл). Органический слой высушивают над сульфатом магния, отфильтровывают и упаривают в вакууме. Кристаллизация из этилового эфира приводит к получению продукта в виде белого пушистого твердого вещества (1,1 г, 73%), Т.пл. 235-7 С. 1 Н ЯМР (ДМСО-d6, 300 МГц)2,15-2,41 (м,6 Н), 6,74 (д, 1 Н, J=8,2 Гц), 7,33 (дд, 1 Н, J=2, 8,2 Гц), 7,75 (д, 1 Н, J=2 Гц), 10,36 (широкий с, 1 Н).MS (EI) м/е 251 [M+]. Анал. Вычислено для: С 11 Н 10BrNO: С, 52,41; Н, 4,00; N, 5,56. Найдено: С, 51,98; Н, 4,24; N, 5,42. К раствору 5-бромспиро[циклобутан-1,3[3 Н]индол]-2(1 Н)-она (0,6 г, 2 ммоль) в этиленгликолевом диметиловом эфире (50 мл) в атмосфере азота добавляют тетракис (трифенилфосфин)палладий(0) (140 мг, 0,1 ммоль). К 60 раствору добавляют последовательно 3 хлорфенилбороновую кислоту (0,48 г, 3 ммоль) и карбонат калия (0,76 г, 5 ммоль) в воде (5 мл). Смесь нагревают до 80 С в течение 3 ч и оставляют охлаждаться. Реакционную смесь выливают в воду (100 мл) и экстрагируют этилацетатом(3 х 100 мл). Органические слои объединяют,промывают рассолом (50 мл) и высушивают над сульфатом магния. Раствор отфильтровывают,упаривают в вакууме и остаток очищают с помощью ВЭЖХ (Zorbax PRO, C18, 10u, 15A, 50 X 250 мм; 35% Вода/65% AcCN; 254NM; AMB. темп.) с получением 5-(3-хлорфенил)спироN, 4,94. Найдено: С, 70,75; Н, 5,07; N, 4,68. Указанное в названии соединение получают из 5-(3-хлорфенил)спиро[циклобутан-1,3[3 Н]индол]-2(1 Н)-она (55 мг) и реагента Лоэссона (55 мг) в толуоле (10 мл) при кипячении с обратным холодильником, в соответствии с общей методикой А, с получением 0,016 г указанного в названии соединения в виде оранжевого твердого вещества: 1 Н ЯМР (ДМСО-d6)12,58(д, 1 Н, J=8,32 Гц), 7,05 (д, 1 Н, J=8,14 Гц) и 2,572,27 (м, 6 Н); MS -)-APCI) м/е 298/300 [М-Н]-. Пример 32. 5'-(2-Хлорфенил)спиро[циклогексан-1,3'-[3 Н]индол]-2'(1'Н)-тион. Указанное в названии соединение получают из 5"-(2-xлорфенил)спиро[циклогексан-1,3"[3 Н]индол]-2"(1"Н)-тиона (90 мг) и реагента Лоэссона (90 мг) в толуоле (10 мл) при кипячении с обратным холодильником, в соответствии с общей методикой А, с получением 0,042 г продукта в виде грязно-белого твердого вещества: 1 Н ЯМР (ДМСО-d6)12,75 (широкий с, 1 Н),7,80 (д, 1 Н, J=1,1 Гц) 7,58-7,55 (м, 1 Н), 7,48-7,36(м, 4 Н), 7,16 (д, 1 Н, J=8,0 Гц); MS -)-APCI) м/е 326/328 [М-Н]-. Пример 33. 5'-(4-Хлорфенил)спиро[циклогексан-1,3'[3 Н]индол]-2'(1'Н)-тион. Указанное в названии соединение получают из 5-(4-хлорфенил)спиро[циклогексан-1,3[3 Н]индол]-2(1 Н)-она (90 мг) и реагента Лоэссона (90 мг) в толуоле (10 мл) при кипячении с обратным холодильником, в соответствии с общей методикой А, с получением 0,035 г продукта в виде грязно-белого твердого вещества: 1 Н ЯМР (ДМСО-d6)12,74 (широкий с, 1 Н), 7,91
МПК / Метки
МПК: A61P 5/36, C07D 209/08, A61K 31/404
Метки: производные, тиооксиндола
Код ссылки
<a href="https://eas.patents.su/30-5034-proizvodnye-tiooksindola.html" rel="bookmark" title="База патентов Евразийского Союза">Производные тиооксиндола</a>
Предыдущий патент: Моторное топливо для дизельных, газотурбинных и турбореактивных двигателей и способ его получения
Следующий патент: Способ лечения застойной сердечной недостаточности
Случайный патент: Игровой автомат