Производные 2-аминокарбонил-9h-пурина
Формула / Реферат
1. Соединение формулы
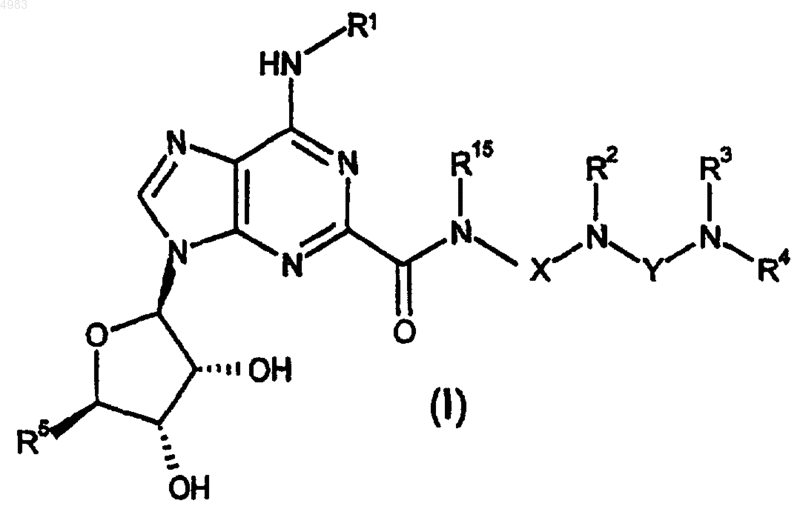
или его фармацевтически приемлемая соль или сольват, где R1 представляет собой H, C1-C6алкил или флуоренил, указанный C1-C6алкил необязательно является замещенным 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила, причем указанный фенил и нафтил необязательно являются замещенными C1-C6алкилом, C1-C6алкокси, галогеном или циано;
(A) R2 представляет собой H или C1-C6алкил, R15 представляет собой H или C1-C6алкил и X представляет собой либо (i) неразветвленный C2-C3алкилен, необязательно замещенный C1-C6 алкилом или C3-C8циклоалкилом, либо (ii) группу формулы
-(CH2)n-W-(CH2)p-,
где W представляет собой C5-C7циклоалкилен, необязательно замещенный C1-C6алкилом, n равно 0 или 1 и p равно 0 или 1, или
(B) R15 представляет собой H или C1-C6алкил и R2 и X, взятые вместе с атомом азота, к которому они присоединены, представляют азетидин-3-ил, пирролидин-3-ил, пиперидин-3-ил, пиперидин-4-ил, гомопиперидин-3-ил или гомопиперидин-4-ил, каждый из которых необязательно является замещенным C1-C6алкилом, или
(C) R2 представляет собой H или C1-C6алкил и R15 и X, взятые вместе с атомом азота, к которому они присоединены, представляют азетидин-3-ил, пирролидин-3-ил, пиперидин-3-ил, пиперидин-4-ил, гомопиперидин-3-ил или гомопиперидин-4-ил, каждый из которых необязательно является замещенным C1-C6алкилом;
либо R3 и R4, взятые вместе с атомом азота, к которому они присоединены, представляют собой азетидинил, пирролидинил, пиперидинил, пиперазинил, гомопиперидинил или гомопиперазинил, каждый из которых необязательно является замещенным по кольцевому атому азота или атому углерода C1-C6алкилом или C3-C8циклоалкилом и необязательно замещен по кольцевому атому углерода, не смежному с атомом азота, NR6R7,
либо R3 представляет собой H, C1-C6алкил, C3-C8циклоалкил или бензил и R4 представляет собой
(a) азетидин-3-ил, пирролидин-3-ил, пиперидин-3-ил, пиперидин-4-ил, гомопиперидин-3-ил или гомопиперидин-4-ил, каждый из которых необязательно является замещенным C1-C6алкилом, C3-C8циклоалкилом, фенилом, бензилом или het или
(b) -(C2-C6алкилен)-R8,
(c) -(C1-C6алкилен)-R13 или
(d) C1-C6алкил или C3-C8циклоалкил;
R5 представляет собой CH2OH или CONR14R14;
R6 и R7, либо каждый независимо, представляют собой H или C1-C6алкил, либо взятые вместе с атомом азота, к которому они присоединены, представляют собой азетидинил, пирролидинил или пиперидинил, указанные азетидинил, пирролидинил или пиперидинил необязательно являются замещенными C1-C6алкилом;
R8 представляет собой
(i) азетидин-1-ил, пирролидин-1-ил, пиперидин-1-ил, морфолин-4-ил, пиперазин-1-ил, гомопиперидин-1-ил, гомопиперазин-1-ил или тетрагидроизохинолин-1-ил, каждый из которых необязательно является замещенным по кольцевому атому углерода C1-C6алкилом, C3-C8циклоалкилом, фенилом, C1-C6алкокси-(C1-C6)-алкилом, R9R9N-(C1-C6)-алкилом, фтор-(C1-C6)-алкилом, -CONR9R9, -COOR9 или C2-C5алканоилом и необязательно замещенным по кольцевому атому углерода, не смежному с атомом азота, фтор-(C1-C6)-алкокси, галогеном, -OR9, циано, -S(O)mR10, -NR9R9, -SO2NR9R9, -NR9COR10 или -NR9SO2R10, и указанный пиперазин-1-ил и гомопиперазин-1-ил необязательно являются замещенными по кольцевому атому азота, не связанному с C2-C6алкиленовой группой, C1-C6алкилом, фенилом, C1-C6алкокси-(C2-C6)-алкилом, R9R9N-(C2-C6)-алкилом, фтор-(C1-C6)-алкилом, C2-C5алканоилом, -COOR10, C3-C8 циклоалкилом, -SO2R10, -SO2NR9R9 или -CONR9R9, или
(ii) NR11R12;
R9 представляет собой H, C1-C6алкил, C3-C8циклоалкил или фенил;
R10 представляет собой C1-C6алкил, C3-C8циклоалкил или фенил;
R11 представляет собой H, C1-C6алкил, C3-C8циклоалкил или бензил;
R12 представляет собой H, C1-C6алкил, C3-C8циклоалкил, фенил, бензил, фтор-(C1-C6)-алкил, -CONR9R9, -COOR10, C2-C5 алканоил или -SO2NR9R9;
R13 представляет (a) фенил, пиридин-2-ил, пиридин-3-ил или пиридин-4-ил, каждый из которых необязательно является замещенным C1-C6алкилом, C1-C6алкокси, -(C1-C3алкилен)-(C1-C6алкокси), галогеном, циано, -(C1-C3алкилен)-CN, CO2H, -(C1-C3алкилен)-CO2H, -CO2(C1-C6алкилом), -(C1-C3алкилен)-CO2(C1-C6алкилом), -(C1-C3алкилен)-NR14R14, -CONR14R14 или -(C1-C3алкилен)-CONR14R14, или (b) азетидин-2-ил, азетидин-3-ил, пирролидин-2-ил, пирролидин-3-ил, пиперидин-2-ил, пиперидин-3-ил, пиперидин-4-ил, гомопиперидин-2-ил, гомопиперидин-3-ил или гомопиперидин-4-ил, каждый из которых необязательно является замещенным C1-C6алкилом, C3-C8циклоалкилом, фенилом, бензилом или het;
R14 представляет собой H или C1-C6алкил, необязательно замещенный циклопропилом;
m равно 0, 1 или 2;
Y представляет собой CO, CS, SO2 или C=N(CN) и
"het", использованный при определении R4 и R13, представляет собой C-связанное, 4-6-членное кольцо, гетероцикл, имеющий либо 1-4 кольцевых гетероатома азота, либо 1-2 кольцевых гетероатома азота и 1 кольцевой гетероатом кислорода или серы, необязательно замещенный C1-C6алкилом, C3-C8циклоалкилом, C1-C6алкокси, C3-C8 циклоалкокси, гидрокси, оксо или галогеном.
2. Соединение по п.1, где R1 представляет собой C1-C6алкил, необязательно замещенный 1 или 2 фенильными заместителями, указанный фенил необязательно является замещенным C1-C6алкилом или галогеном.
3. Соединение по п.2, где R1 представляет собой дифенилэтил, бис(3-метилфенил)этил или бис(3-хлорфенил)этил.
4. Соединение по п.3, где R1 представляет собой 2,2-дифенилэтил, 2,2-бис(3-метилфенил) этшы или 2,2-бис(3-хлорфенил)этил.
5. Соединение по п.4, где R1 представляет собой 2,2-дифенилэтил.
6. Соединение по любому из предшествующих пунктов, где R2 представляет собой H.
7. Соединение по любому из предшествующих пунктов, где R15 представляет собой H.
8. Соединение по любому из предшествующих пунктов, где X представляет собой 1,2-этилен или 1,3-пропилен.
9. Соединение по п.8, где X представляет собой 1,2-этилен.
10. Соединение по любому из пп.1-5, где R2 представляет собой H, R15 представляет собой H и X представляет собой 1,2-этилен, 1,3-пропилен или группу формулы
- (CH2)n-W-(CH2)p-,
где W представляет собой C5-C7циклоалкилен, n равно 0 или 1 и p равно 0 или 1.
11. Соединение по п.10, где R2 представляет собой H, R15 представляет собой H и X представляет собой 1,2-этилен, 1,3-пропилен или группу формулы
-(CH2)n-W-(CH2)p-,
где W представляет собой C5-C7циклоалкилен, n равно 0 и p равно 0.
12. Соединение по п.11, где R2 представляет собой H, R15 представляет собой H и X представляет собой 1,2-этилен, 1,3-пропилен или 1,4-циклогексилен.
13. Соединение по п.12, где R2 представляет собой H, R15 представляет собой H и X представляет собой 1,2-этилен.
14. Соединение по любому из пп.1-5, где R15 представляет собой H и R2 и X, взятые вместе с атомом азота, с которым они связаны, представляют собой 3-пирролидинил или 3- или 4-пиперидинил, каждый из которых необязательно замещен C1-C6алкилом.
15. Соединение по п.14, где R15 представляет собой H и R2 и X, взятые вместе с атомом азота, с которым они связаны, представляют собой 3-пирролидинил или 4-пиперидинил.
16. Соединение по любому из пп.1-5, где R2 представляет собой H и R15 и X, взятые вместе с атомом азота, с которым они связаны, представляют собой 3-пирролидинил или 3- или 4-пиперидинил, каждый из которых необязательно замещен C1-C6 алкилом.
17. Соединение по п.16, где R2 представляет собой H и R15 и X, взятые вместе с атомом азота, с которым они связаны, представляют собой 3-пирролидинил или 4-пиперидинил.
18. Соединение по любому из предшествующих пунктов, где R3 представляет собой H.
19. Соединение по любому из предшествующих пунктов, где R4 представляет собой пиперидин-3-ил или пиперидин-4-ил, каждый из которых необязательно замещен бензилом, пиридин-2-илом, пиридин-3-илом или пиридин-4-илом, каждый из указанных пиридин-2-ила, пиридин-3-ила и пиридин-4-ила необязательно замещен C1-C6алкилом, C3-C8циклоалкилом, C1-C6алкокси, C3-C8циклоалкокси, гидрокси, оксо или галогеном.
20. Соединение по п.19, где R4 представляет собой пиперидин-3-ил или пиперидин-4-ил, каждый из которых замещен бензилом, пиридин-2-илом, пиридин-3-илом или пиридин-4-илом.
21. Соединение по п.20, где R4 представляет собой пиперидин-4-ил, замещенный пиридин-2-илом.
22. Соединение по п.21, где R4 представляет собой 1-(пиридин-2-ил)пиперидин-4-ил.
23. Соединение по любому из пп.1-18, где R4 представляет собой -(C2-C6алкилен)-R8.
24. Соединение по п.23, где R4 представляет собой -CH2CH2R8.
25. Соединение по любому из пп.1-18, где R4 представляет собой -(C1-C6алкилен)-R13.
26. Соединение по п.25, где R4 представляет собой -CH2R13 или -CH2CH2R13.
27. Соединение по любому из пп.1-18, где R4 представляет собой C3-C8циклоалкил.
28. Соединение по п.27, где R4 представляет собой циклогексил.
29. Соединение по любому из предшествующих пунктов, где R5 представляет собой
-CH2OH или -CONH(C1-C6алкил).
30. Соединение по п.29, где R5 представляет собой -CONHCH2CH3.
31. Соединение по п.23 или 24, где R8 представляет собой (i) азетидин-1-ил, пирролидин-1-ил, пиперидин-1-ил, морфолин-4-ил, пиперазин-1-ил, гомопиперидин-1-ил, гомопиперазин-1-ил или тетрагидроизохинолин-1-ил, каждый из которых необязательно является замещенным по кольцевому атому углерода C1-C6алкилом, и указанные пиперазин-1-ил и гомопиперазин-1-ил необязательно являются замещенными по кольцевому атому азота, не связанному с C2-C6алкиленовой группой, C1-C6алкилом или (ii) представляет собой NR11R12.
32. Соединение по п.31, где R8 представляет собой пиперидин-1-ил или тетрагидроизохинолин-1-ил, каждый из которых необязательно является замещенным по кольцевому атому углерода C1-C6алкилом.
33. Соединение по п.32, где R8 представляет собой пиперидин-1-ил, 4-изопропилпиперидин-1-ил или тетрагидроизохинолин-1-ил.
34. Соединение по п.31, где R8 представляет собой NR11R12, где NR11R12 представляет собой N(C1-C6алкил)2, N(C1-C6алкил)(C3-C8 циклоалкил) или N(C1-C6алкил)(бензил).
35. Соединение по п.34, где NR11R12 представляет собой N,N-диизопропиламино, N,N-ди-н-бутиламино, N-циклопентил-N-изопропиламино, N-циклогексил-N-изопропиламино или N-бензил-N-изопропиламино.
36. Соединение по п.31, где R11 представляет собой H или C1-C6 алкил и R12 представляет собой H, C1-C6алкил, C3-C8циклоалкил или бензил.
37. Соединение по п.36, где R11 представляет собой C1-C6 алкил и R12 представляет собой C1-C6алкил, C3-C8циклоалкил или бензил.
38. Соединение по п.37, где R11 представляет собой изопропил или н-бутил и R12 представляет собой изопропил, н-бутил, циклопентил, циклогексил или бензил.
39. Соединение по п.25 или 26, где R13 представляет собой либо фенил, необязательно замещенный -(C1-C3алкилен)-NR14R14 или CO2H, либо пиперидин-2-ил, пиперидин-3-ил или пиперидин-4-ил, каждый из которых необязательно замещен бензилом.
40. Соединение по п.39, где R13 представляет собой фенил, 4-(N,N-диэтиламино)метилфенил, 4-карбоксифенил или 1-бензилпиперидин-4-ил.
41. Соединение по любому из предшествующих пунктов, где Y представляет собой CO.
42. Соединение по п.1, где
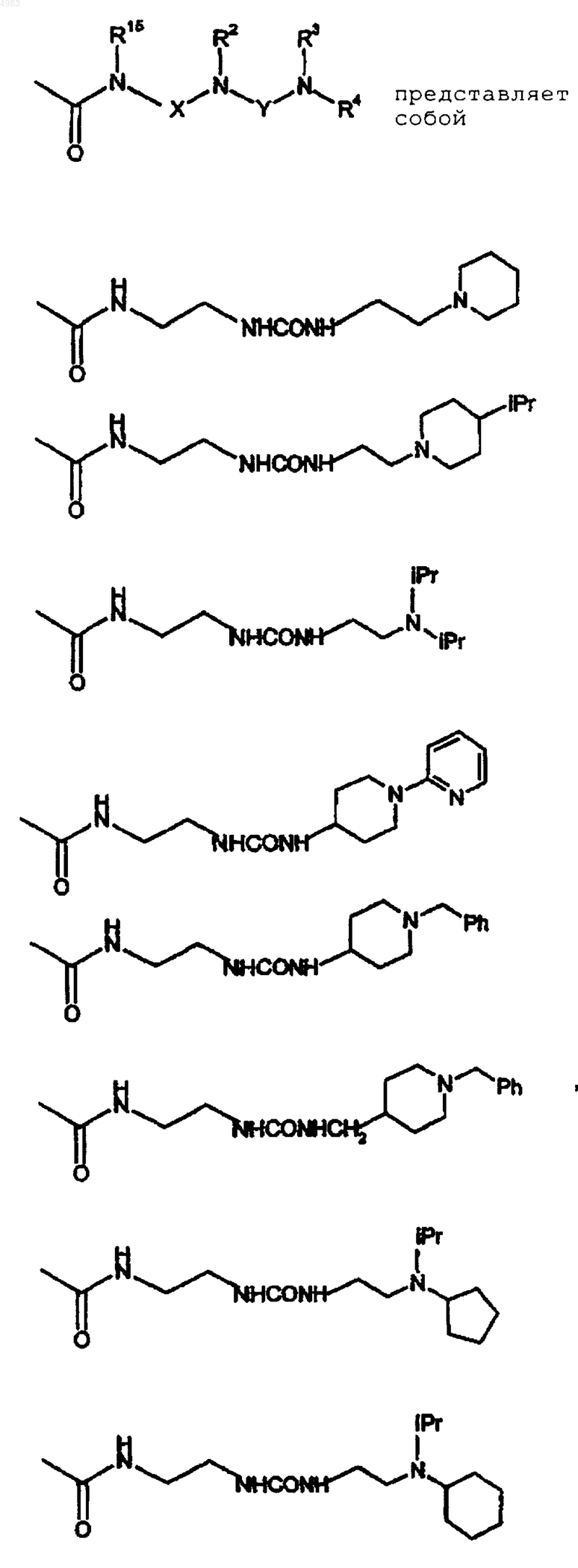
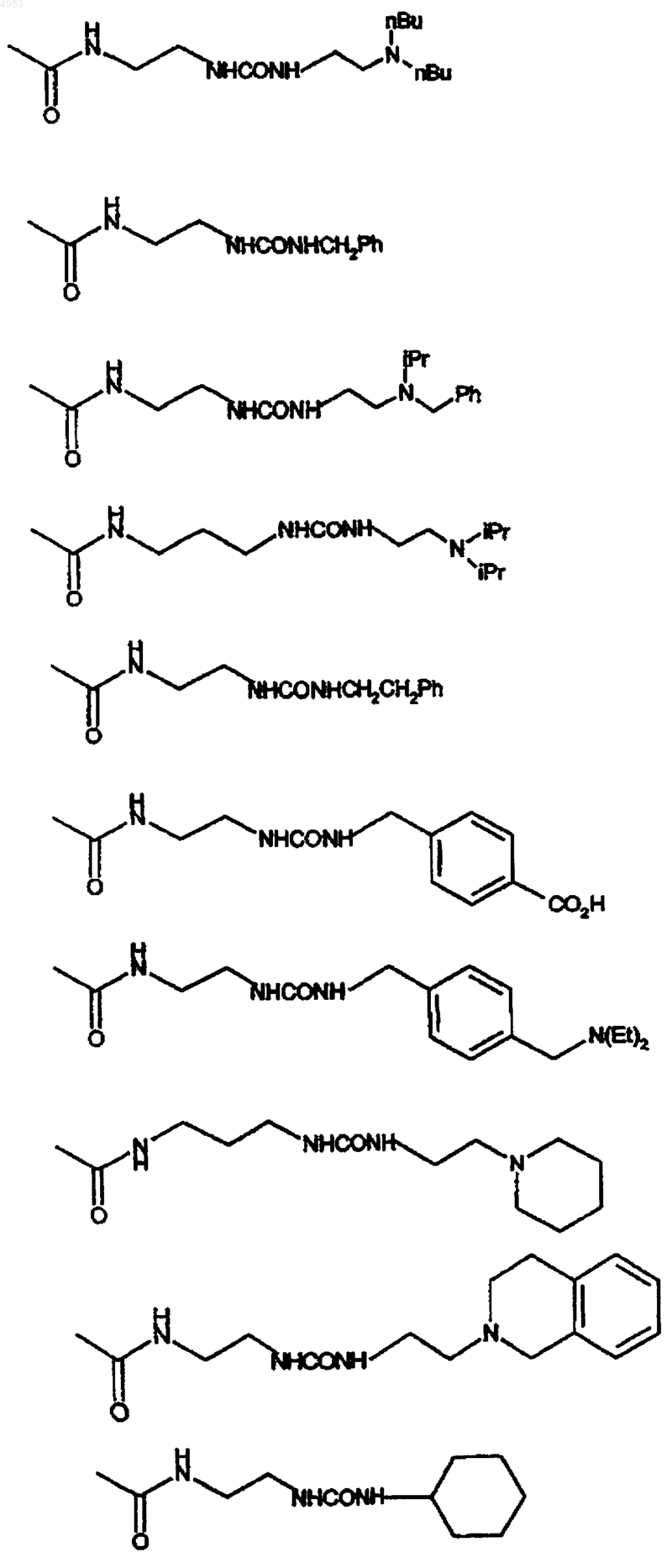
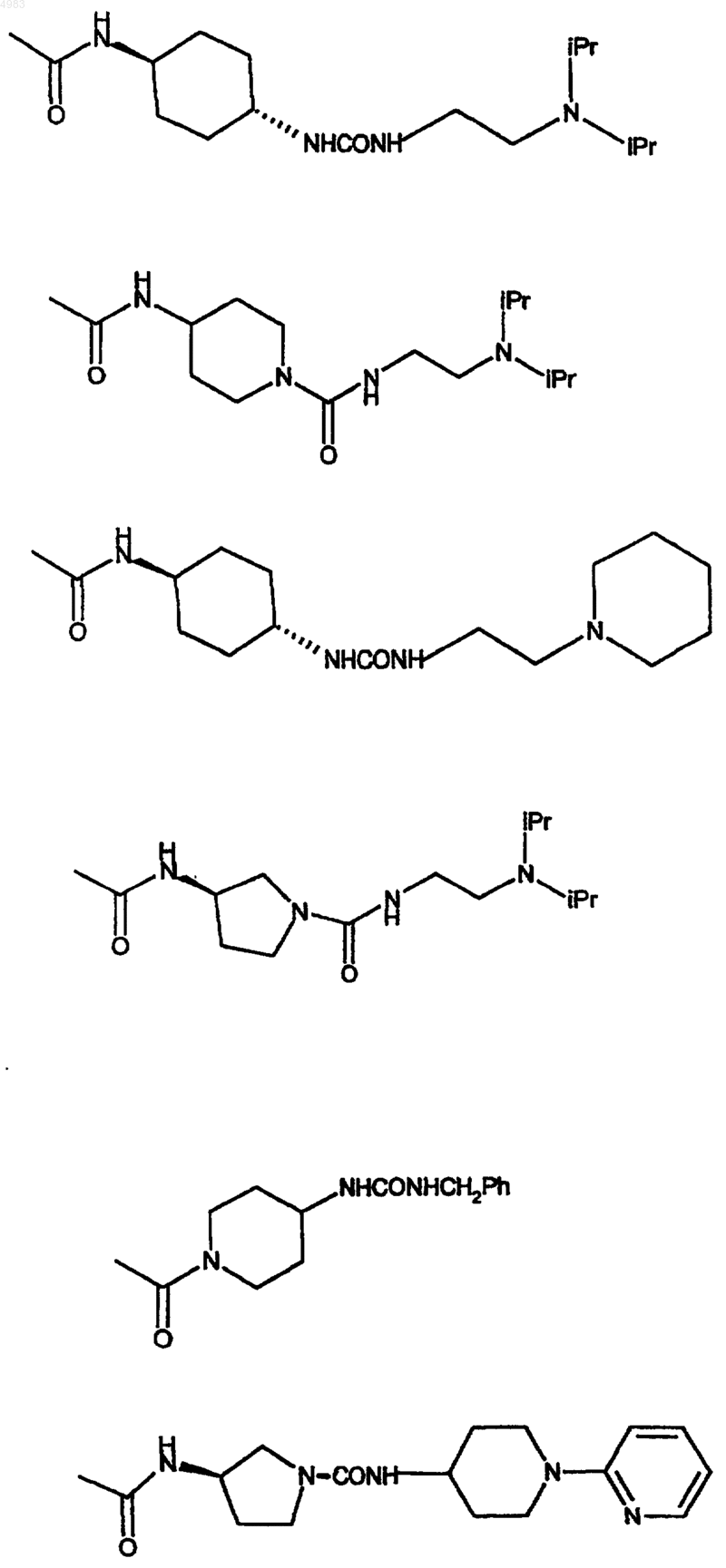
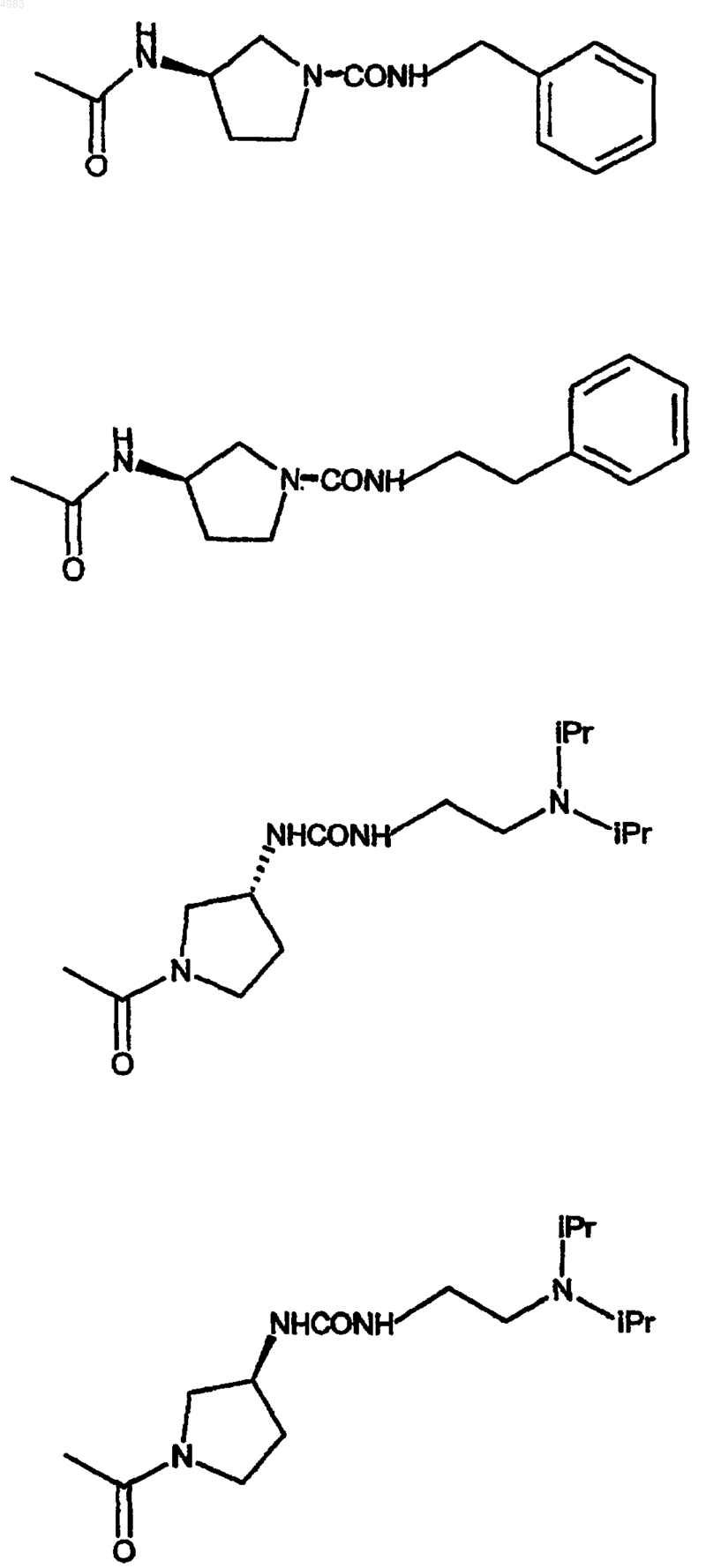
43. Соединение по п.1, представляющее собой 6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-{2-[({[1-(2-пиридинил)-4-пиперидинил]амино}карбонил)амино]этил}-9H-пурин-2-карбоксамид или его фармацевтически приемлемую соль или сольват.
44. Соединение по п.1, представляющее собой 4-[({[(2-{[(6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-9H-пурин-2-ил)карбонил]амино}этил)амино]карбонил}амино)метил]бензойную кислоту или ее фармацевтически приемлемую соль или сольват.
45. Фармацевтическая композиция, включающая соединение формулы (I) или его фармацевтически приемлемую соль или сольват по любому из пп.1-44 вместе с фармацевтически приемлемым эксципиентом, разбавителем или носителем.
46. Применение соединения формулы (I) или его фармацевтически приемлемой соли, сольвата по любому из пп.1-44 для получения лекарственного средства, обладающего агонистической активностью по отношению к A2a рецептору.
47. Применение композиции по п.45 для получения лекарственного средства, обладающего агонистической активностью по отношению к A2a рецептору.
48. Применение соединения формулы (I) или его фармацевтически приемлемой соли, сольвата по любому из пп.1-44 для получения противовоспалительного агента.
49. Применение композиции по п.45 для получения противовоспалительного агента.
50. Применение соединения формулы (I) или его фармацевтически приемлемой соли, сольвата по любому из пп.1-44 для получения лекарственного средства для лечения заболевания дыхательных путей.
51. Применение композиции по п.45 для получения лекарственного средства для лечения заболевания дыхательных путей.
52. Применение по пп.50, 51, где заболевание выбирают из группы, состоящей из синдрома дыхательной недостаточности у взрослых (ARDS), бронхита, хронического бронхита, хронического обструктивного заболевания легких, фиброзно-кистозной дегенерации, астмы, эмфиземы, бронхоэктаза, хронического синусита и ринита.
53. Применение соединения формулы (I) или его фармацевтически приемлемой соли, сольвата по любому из пп.1-44 для получения лекарственного средства для лечения септического шока, мужской эректильной дисфункции, мужского фактора бесплодия, женского фактора бесплодия, гипертензии (повышенного кровяного давления), инсульта, эпилепсии, церебральной ишемии, периферических сосудистых заболеваний, постишемического реперфузионного повреждения, диабета, ревматоидного артрита, рассеянного склероза, псориаза, дерматита, аллергического дерматита, экземы, язвенного колита, болезни Крона, воспалительного заболевания кишечника, вызванного Heliobacter pylori гастрита, вызванного не-Heliobacter pylori гастрита, повреждения желудочно-кишечного тракта или психотического заболевания, вызванного нестероидными противовоспалительными лекарственными средствами, или для заживления ран.
54. Применение композиции по п.45 для получения лекарственного средства для лечения септического шока, мужской эректильной дисфункции, мужского фактора бесплодия, женского фактора бесплодия, гипертензии (повышенного кровяного давления), инсульта, эпилепсии, церебральной ишемии, периферических сосудистых заболеваний, постишемического реперфузионного повреждения, диабета, ревматоидного артрита, рассеянного склероза, псориаза, дерматита, аллергического дерматита, экземы, язвенного колита, болезни Крона, воспалительного заболевания кишечника, вызванного Heliobacter pylori гастрита, вызванного не-Heliobacter pylori гастрита, повреждения желудочно-кишечного тракта или психотического заболевания, вызванного нестероидными противовоспалительными лекарственными средствами, или для заживления ран.
55. Способ лечения млекопитающего, включая человека, агонистом A2a рецептора, включающий обработку указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или композиции по любому из пп.1-44 и п.45, соответственно.
56. Способ лечения млекопитающего, включая человека, для лечения воспалительного заболевания, включающий обработку указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или композиции по любому из пп.1-44 и п.45, соответственно.
57. Способ лечения млекопитающего, включая человека, для лечения заболевания дыхательных путей, включающий обработку указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или композиции по любому из пп. 1-44 и п.45, соответственно.
58. Способ по п.57, где заболевание выбирают из группы, состоящей из синдрома дыхательной недостаточности у взрослых (ARDS), бронхита, хронического бронхита, хронического обструктивного заболевания легких, фиброзно-кистозной дегенерации, астмы, эмфиземы, бронхоэктаза, хронического синусита и ринита.
59. Способ лечения млекопитающего, включая человека, для лечения септического шока, мужской эректильной дисфункции, мужского фактора бесплодия, женского фактора бесплодия, гипертензии (повышенного кровяного давления), инсульта, эпилепсии, церебральной ишемии, периферических сосудистых заболеваний, постишемического реперфузионного повреждения, диабета, ревматоидного артрита, рассеянного склероза, псориаза, дерматита, аллергического дерматита, экземы, язвенного колита, болезни Крона, воспалительного заболевания кишечника, вызванного Heliobacter pylori гастрита, вызванного не-Heliobacter pylori гастрита, повреждения желудочно-кишечного тракта или психотического заболевания, вызванного нестероидными противовоспалительными лекарственными средствами, или для заживления ран, включающий лечение указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или композиции по любому из пп.1-44 и п.45, соответственно.
60. Способ получения соединения формулы (I) по п.1, где Y представляет собой CO и R1, R2, R3, R4, R5, R14 и X являются такими, как определено в п.1, включающий взаимодействие соединения формулы
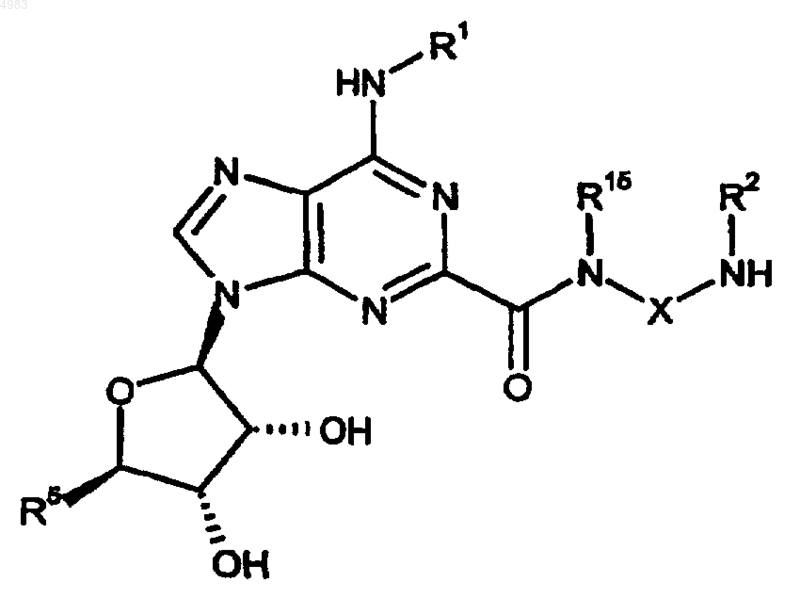
с соединением формулы
R3N4COZ1 (III),
где Z1 представляет собой уходящую группу;
при необязательном последующем преобразовании после любого из указанных способов соединения формулы (I) в его фармацевтически приемлемую соль.
61. Способ получения соединения формулы (I) по п.1, включающий реакцию аминокарбонилирования соединения формулы
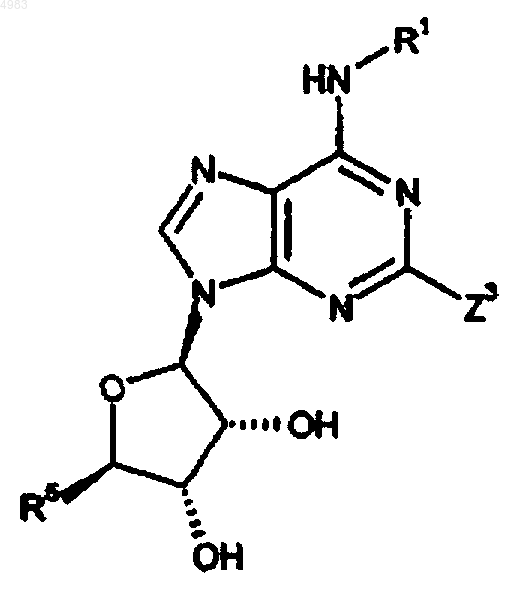 (XVII)
(XVII)
где Z3 представляет собой уходящую группу, с соединением формулы
R15NH-X-NR2-Y-NR3R4 (XVIII),
где R1, R2, R3, R4, R5, R15, X и Y являются такими, как определено в п.1, в присутствии монооксида углерода и катализатора конденсации;
при необязательном последующем преобразовании после любого из указанных способов соединения формулы (I) в его фармацевтически приемлемую соль.
62. Способ получения соединения формулы (I) по п.1, включающий снятие защитных групп в соединении формулы
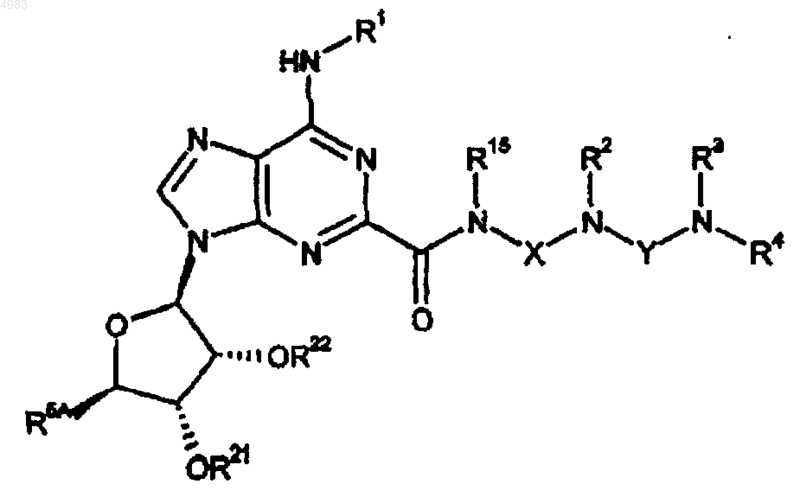 (XXI)
(XXI)
где либо каждый из R21 и R22 представляет собой защитную группу, либо взятые вместе они представляют собой защитную группу, R5A представляет собой CH2OH, CH2OR23 или CONR14R14, R23 представляет собой защитную группу и R1, R2, R3, R4, R14, Rl5, X и Y являются такими, как определено в п.1, защитная(ые) группа(ы) удаляют вместе, по отдельности или в любом сочетании;
при необязательном последующем преобразовании после любого из указанных способов соединения формулы (I) в его фармацевтически приемлемую соль.
63. Способ получения соединения формулы (I) по п.1, где Y представляет собой CS и R1, R2, R3, R4, R5, R15 и X являются такими, как определено в п.1, включающий взаимодействие соединения формулы
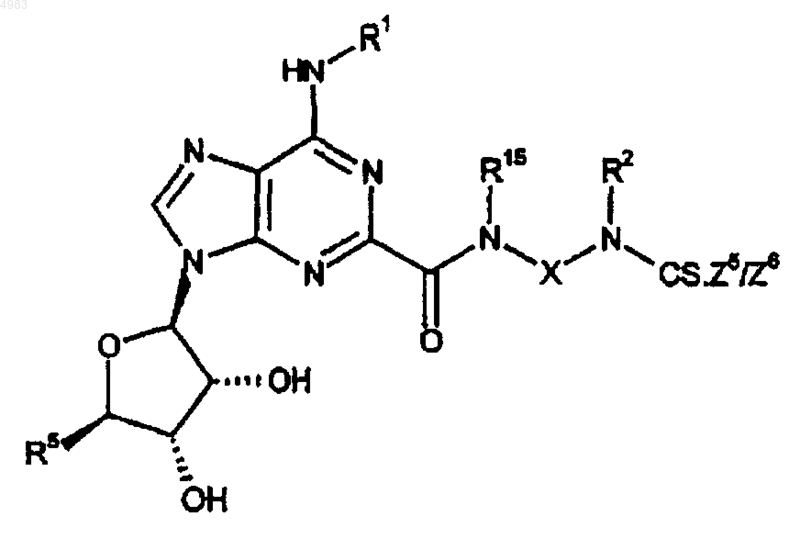 (XXIVA)
(XXIVA)
где Z5/Z6 представляет собой уходящую группу, с амином формулы
R3R4NH;
при необязательном последующем преобразовании поёых любого из указанных способов соединения формулы (I) в его фармацевтически приемлемую соль.
64. Способ получения соединения формулы (I), где Y представляет собой SO2 и R1, R2, R3, R4, R5, R15 и X являются такими, как определено в п.1, включающий взаимодействие соединения формулы
R3R4NSO2Z7 (XXVII),
где Z7 представляет собой уходящую группу, с соединением формулы (II), как определено в части (a);
при необязательном последующем преобразовании после любого из указанных способов соединения формулы (I) в его фармацевтически приемлемую соль.
65. Способ получения соединения формулы (I), где Y представляет собой C=N(CN), и R1, R2, R3, R4, R5, R15 и X являются такими, как определено в п.1, включающий взаимодействие соединения формулы
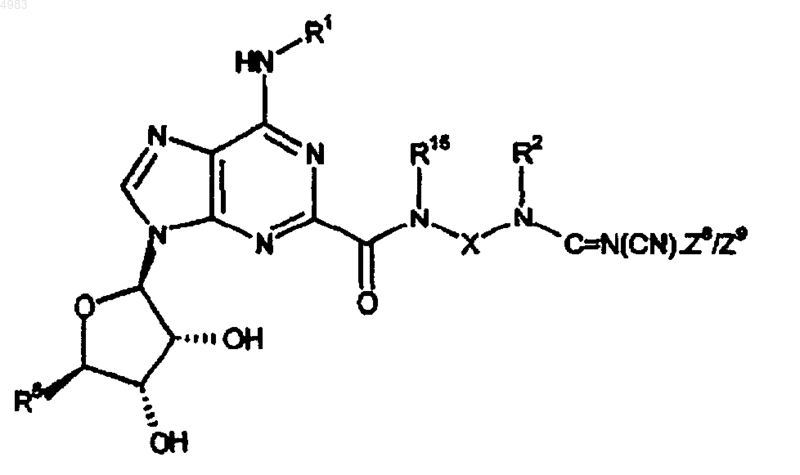 (XXIVB)
(XXIVB)
где Z8/Z9 представляет собой уходящую группу, с амином формулы
R3R4NH;
при необязательном последующем преобразовании после любого из указанных способов соединения формулы (I) в его фармацевтически приемлемую соль.
66. Способ получения соединения формулы (I), включающий взаимодействие соединения формулы
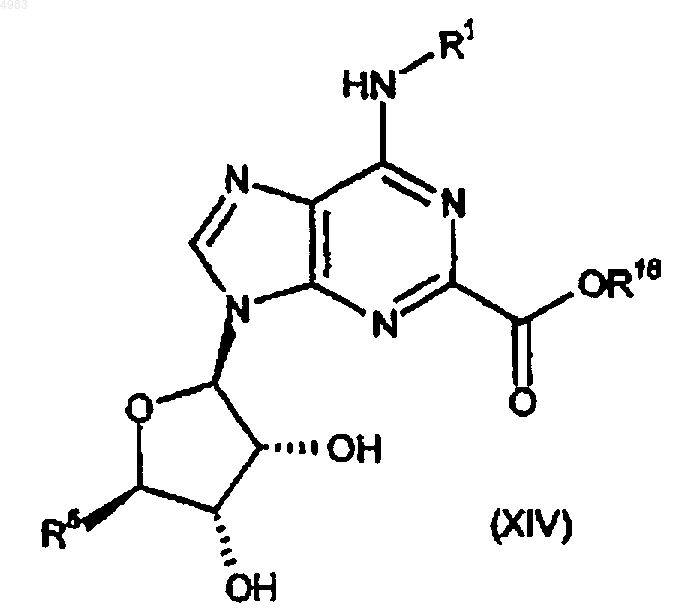
где R18 представляет собой группу, образующую сложный эфир, с амином формулы
R15NH-X-NR2-Y-NR3R4 (XVIII),
где R1, R2, R3, R4, R5, R15, X и Y являются такими, как определено в п.1,
при необязательном последующем преобразовании после любого из указанных способов соединения формулы (I) в его фармацевтически приемлемую соль.
67. Соединение формулы
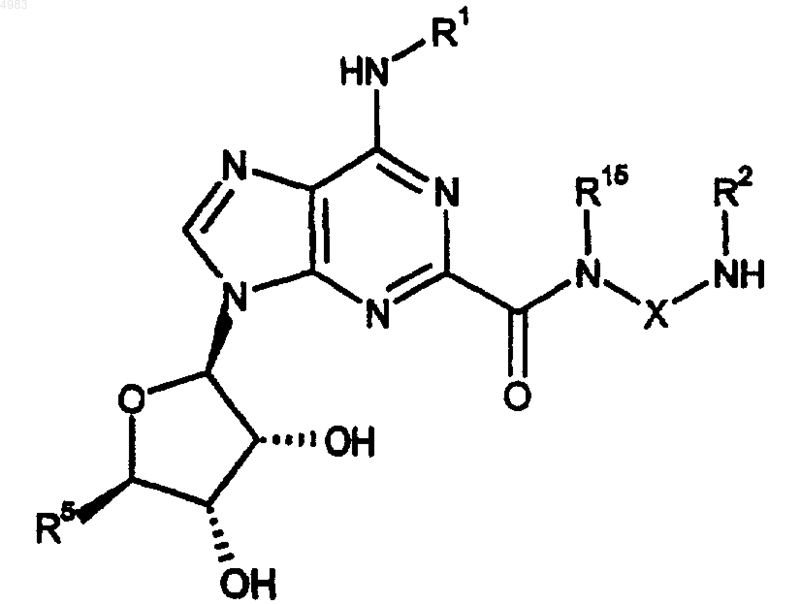 (II)
(II)
где R1, R2, R5, R15 и X являются такими, как определено в п.1.
68. Соединение формулы
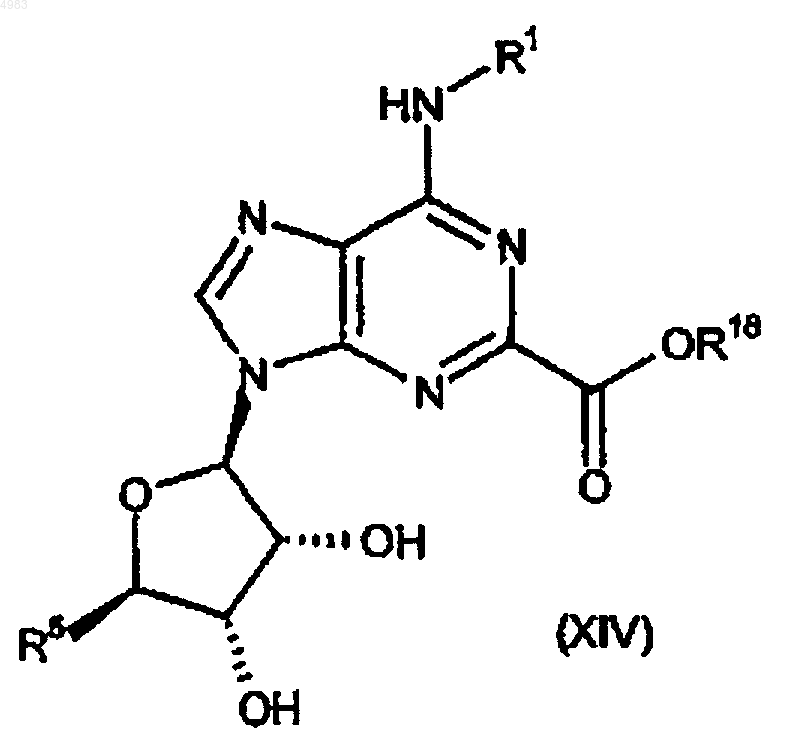
где R5 представляет собой CONR14R14, R18 представляет собой группу, образующую сложный эфир, и R1 и R14 являются такими, как определено в п.1.
69. Соединение формулы
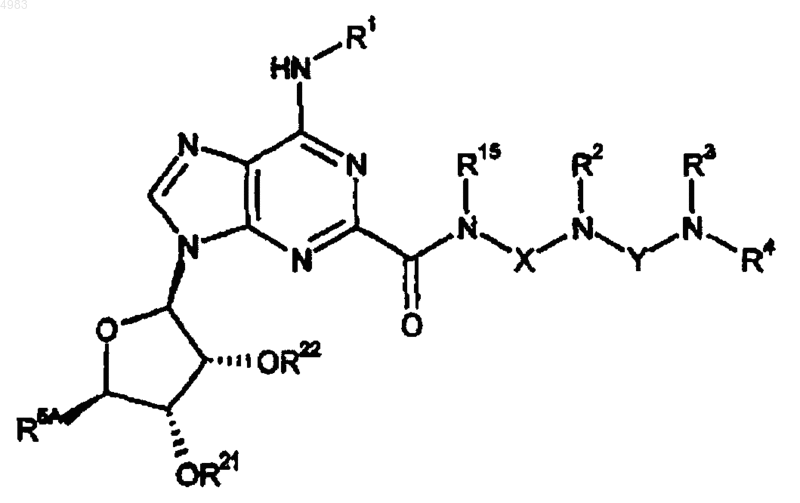 (XXI)
(XXI)
где либо каждый из R21 и R22 представляет собой защитную группу, либо взятые вместе они представляют собой защитную группу, R5A представляет собой CH2OH, CH2OR23 или CONR14R14, R23 представляет собой защитную группу и R1, R2, R3, R4, R14, R15, X и Y являются такими, как определено в п.1.
70. Соединение формулы
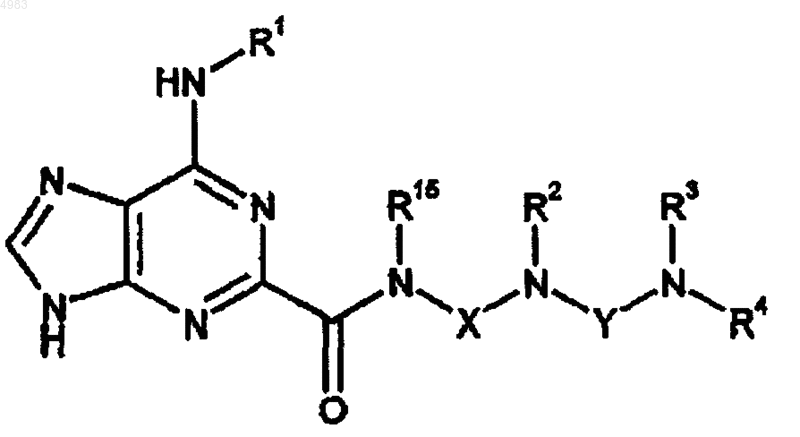 (XXII)
(XXII)
где R1, R2, R3, R4, R15, X и Y являются такими, как определено в п.1.
71. Соединение формулы
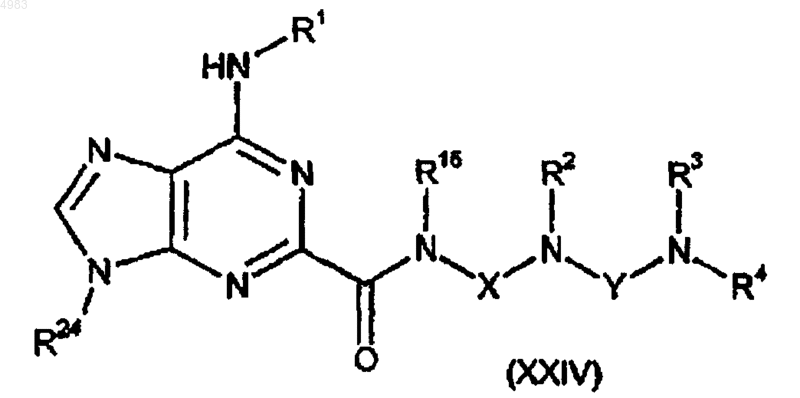
где R24 представляет собой защитную группу и R1, R2, R3, R4, R5, X и Y являются такими, как определено в п.1.
72. Соединение формулы
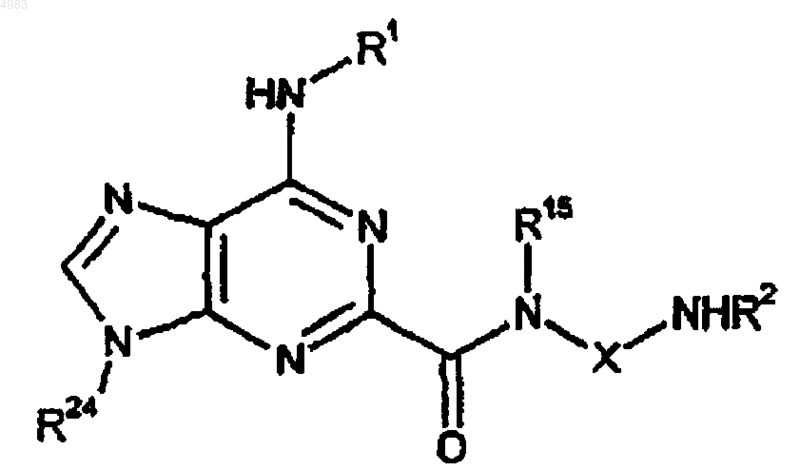 (XXV)
(XXV)
где R24 представляет собой защитную группу и R1, R2, R15 и X являются такими, как определено в п.1.
73. Соединение формулы
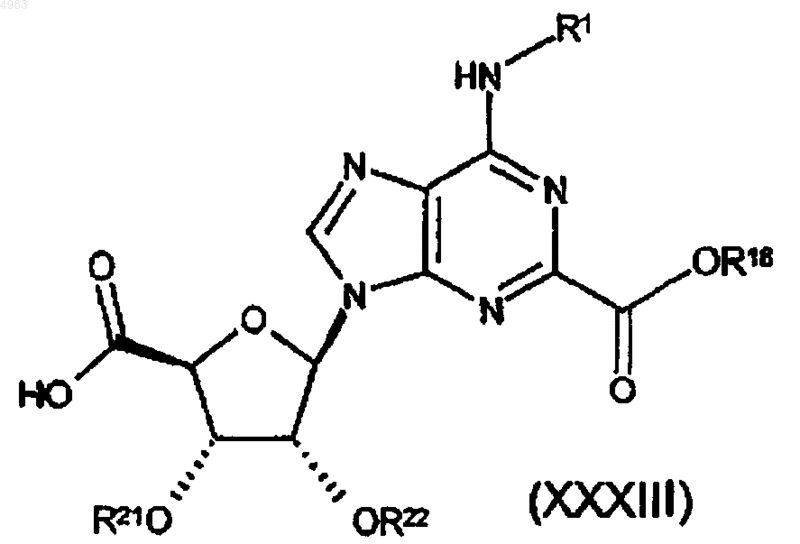
где R18 представляет собой группу, образующую сложный эфир, и либо каждый из R21 и R22 представляет собой защитную группу, либо взятые вместе они представляют собой защитную группу, и R1 является таким, как определено в п.1.
74. Соединение формулы
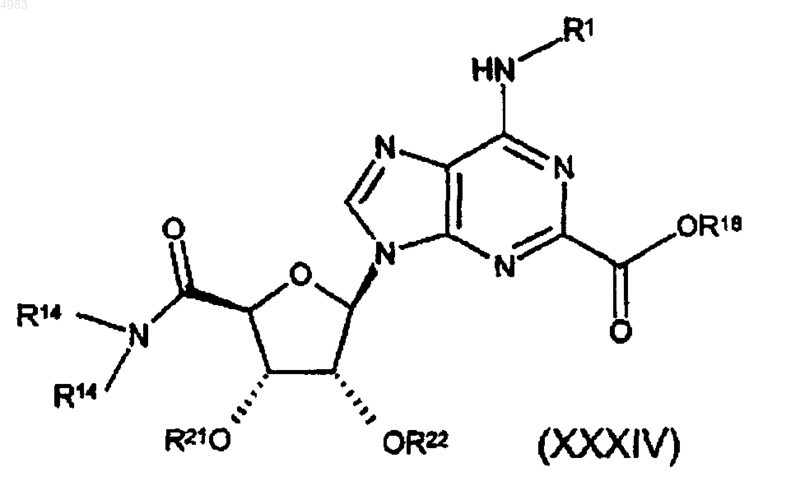
где R18 представляет собой группу, образующую сложный эфир, и либо каждый из R21 и R22 представляет собой защитную группу, либо взятые вместе они представляют собой защитную группу, и R1 и R14 являются такими, как определено в п.1.
75. Соединение формулы
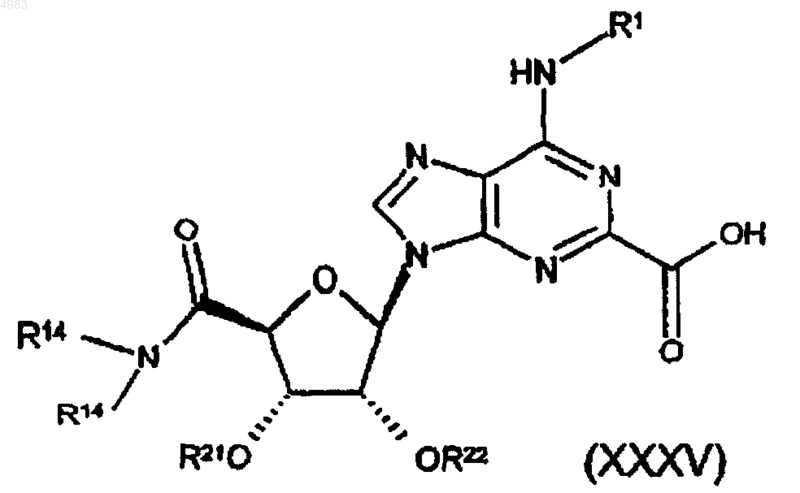
где либо каждый из R21 и R22 представляет собой защитную группу, либо взятые вместе они представляют собой защитную группу, и R1 и Rl4 являются такими, как определено в п.1.
76. Соединение формулы

где R18 представляет собой группу, образующую сложный эфир, и
R1 является таким, как определено в п.1.
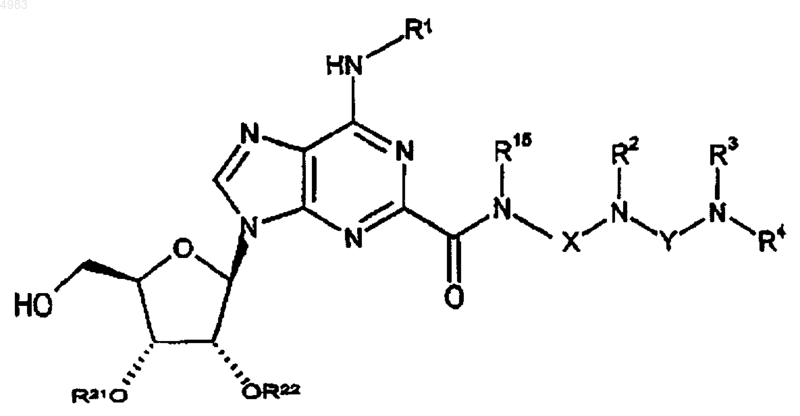
77. Соединение формулы
 (XXXIX)
(XXXIX)
где либо каждый из R21 и R22 представляет собой защитную группу, либо взятые вместе они представляют собой защитную группу, и R1, R2, R3, R4, R15, X и Y являются такими, как определено в п.1.
78. Соединение формулы
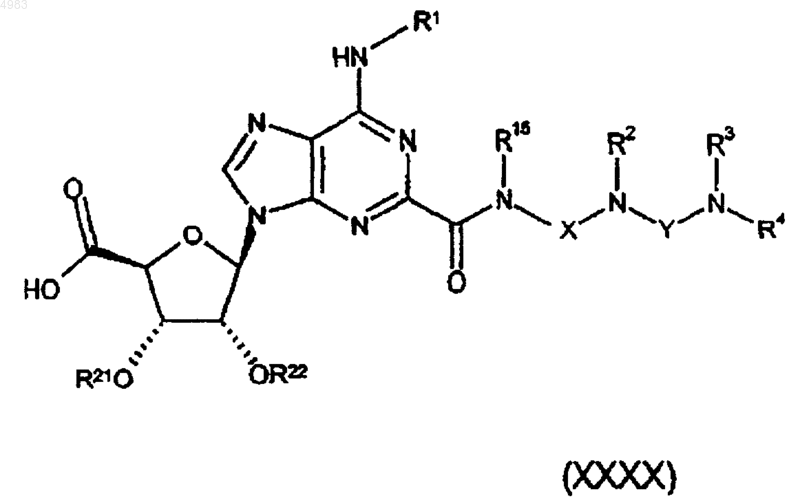
где либо каждый из R21 и R22 представляет собой защитную группу, либо взятые вместе они представляют собой защитную группу, и R1, R2, R3, R4, R15, X и Y являются такими, как определено в п.1.
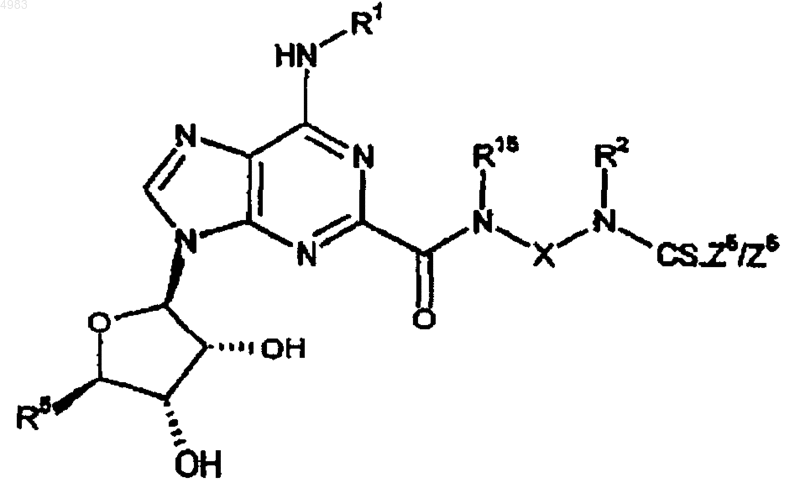
79. Соединение формулы
 (XXIVA)
(XXIVA)
где Z5/Z6 представляет собой уходящую группу и R1, R2, R5, R15 и X являются такими, как определено в п.1.
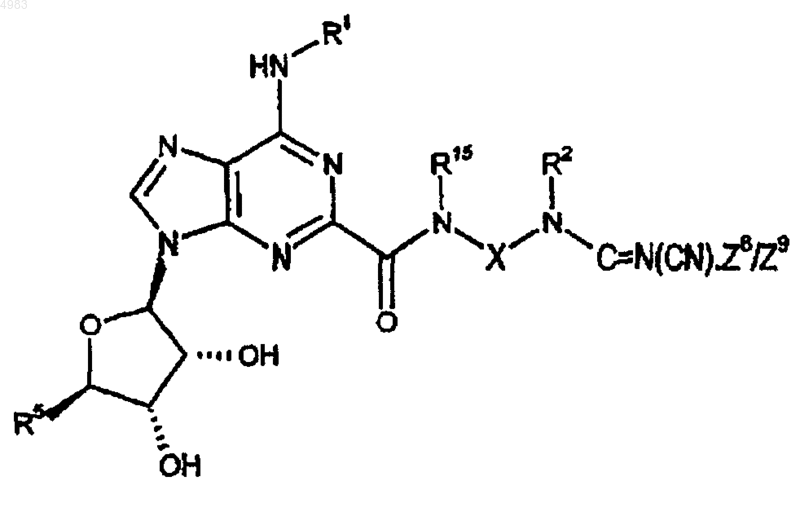
80. Соединение формулы
 (XXIVB)
(XXIVB)
где Z8/Z9 представляет собой уходящую группу и R1, R2, R5, R15 и X являются такими, как определено в п.1.
81. Соединение формулы (I), как определено в п.1, выбранное из
этил 6-[(2,2-дифенилэтил)амино]-9H-пурин-2-карбоксилата;
этил 9-{(2R,3R,4R,5R)-3,4-бис(ацетокси)-5-[(ацетилокси)метил]тетрагидро-2-фуранил}-6-[(2,2-дифенилэтил)амино]-9H-пурин-2-карбоксилата;
этил 9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-9H-пурин-2-карбоксилата;
этил 9-[(3aR,4R,6R,6aR)-6-(гидроксиметил)-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил]-6-[(2,2-дифенилэтил)амино]-9H-пурин-2-карбоксилата;
(3aS,4S,6R,6aR)-6-[6-[(2,2-дифенилэтил)амино]-2-(этоксикарбонил)-9H-пурин-9-ил]-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-карбоновой кислоты;
этил 9-{(3aR,4R,6S,6aS)-6-[(этиламино)карбонил]-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил}-6-[(2,2-дифенилэтил)амино]-9H-пурин-2-карбоксилата;
9-{(3aR,4R,6S,6aS)-6-[(этиламино)карбонил]-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил}-6-[(2,2-дифенилэтил)амино]-9H-пурин-2-карбоновой кислоты;
9-{(3aR,4R,6S,6aS)-6-[(этиламино)карбонил]-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил}-6-[(2,2-дифенилэтил)амино]-N-{2-[({[1-(2-пиридил)-4-пиперидинил]амино}карбонил)амино]этил}-9H-пурин-2-карбоксамида;
трет-бутил 2-[({[1-(2-пиридинил)-4-пиперидинил]амино}карбонил)амино]этилкарбамата;
дигидрохлорида N-(2-аминоэтил)-N'[1-(2-пиридинил)-4-пиперидинил]мочевшэы или
N-(2-аминоэтил)-N'[1-(2-пиридинил)-4-пиперидинил]мочевины.
82. Соединение формулы
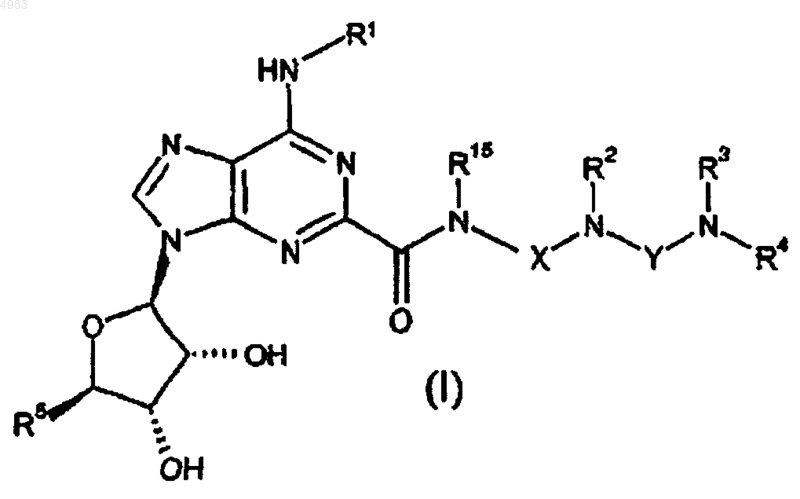
или его фармацевтически приемлемая соль или сольват, где R1 представляет собой H, C1-C6алкил или флуоренил, указанный C1-C6алкил необязательно является замещенным 1-2 заместителями, каждый из которых независимо выбран из фенила и нафтила, причем указанный фенил и нафтил необязательно являются замещенными C1-C6алкилом, C1-C6алкокси, галогеном или циано;
R2 представляет собой H или C1-C6алкил,
либо R3 и R4, взятые вместе с атомом азота, к которому они присоединены, представляют собой азетидинил, пирролидинил, пиперидинил, пиперазинил, гомопиперидинил или гомопиперазинил, каждый из которых необязательно является замещенным по кольцевому атому азота или атому углерода C1-C6алкилом или C3-C8циклоалкилом и необязательно замещен по кольцевому атому углерода, не смежному с атомом азота, группой NR6R7,
либо R3 представляет собой H, C1-C6алкил, C3-C8циклоалкил или бензил и R4 представляет собой
(a) азетидин-3-ил, пирролидин-3-ил, пиперидин-3-ил, пиперидин-4-ил, гомопиперидин-3-ил или гомопиперидин-4-ил, каждый из которых необязательно является замещенным C1-C6алкилом, C3-C8циклоалкилом, фенилом, бензилом или het, или
(b) -(C2-C6алкилен)-R8, или
(c) -(C1-C6алкилен)-R13,
R5 представляет собой CH2OH или CONR14R14;
R6 и R7 либо, каждый независимо, представляют собой H или C1-C6алкил, или взятые вместе с атомом азота, к которому они присоединены, представляют собой азетидинил, пирролидинил или пиперидинил, указанные азетидинил, пирролидинил или пиперидинил необязательно являются замещенными C1-C6алкилом;
R8 представляет собой
(i) азетидин-1-ил, пирролидин-1-ил, пиперидин-1-ил, морфолин-4-ил, пиперазин-1-ил, гомопиперидин-1-ил, гомопиперазин-1-ил или тетрагидроизохинолин-1-ил, каждый из которых необязательно является замещенным по кольцевому атому углерода C1-C6алкилом, C3-C8циклоалкилом, фенилом, C1-C6алкокси-(C1-C6)-алкилом, R9R9N-(C1-C6)-алкилом, фтор-(C1-C6)-алкилом,
-CONR9R9, -COOR9 или C2-C5алканоилом, и необязательно замещенным по кольцевому атому углерода, не смежному с атомом азота, фтор-(C1-C6)-алкокси, галогеном, -OR9, циано, -S(O)mR10, -NR9R9, -SO2NR9R9, -NR9COR10 или -NR9SO2R10, и указанный пиперазин-1-ил и гомопиперазин-1-ил необязательно являются замещенными по кольцевому атому азота, не связанному с C2-C6алкиленовой группой, C1-C6алкилом, фенилом, C1-C6алкокси-(C2-C6)-алкилом, R9R9N-(C2-C6)-алкилом, фтор-(C1-C6)-алкилом, C2-C5алканоилом, -COOR10, C3-C8циклоалкилом, -SO2R10, -SO2NR9R9 или -COR9R9, или
(ii) NR11R12;
R9 представляет собой H, C1-C6алкил, C3-C8циклоалкил или фенил;
R10 представляет собой C1-C6алкил, C3-C8циклоалкил или фенил;
R11 представляет собой H, C1-C6алкил, C3-C8циклоалкил или бензил;
R12 представляет собой H, C1-C6алкил, C3-C8циклоалкил, фенил, бензил, фтор-(C1-C6)-алкил, -CONR9R9, -COOR10, C2-C5алканоил или -SO2NR9R9;
R13 представляет собой фенил, пиридин-2-ил, пиридин-3-ил или пиридин-4-ил, каждый из которых необязательно является замещенным C1-C6алкилом, C1-C6алкокси, галогеном или циано;
R14 представляет собой H или C1-C6алкил, необязательно замещенный циклопропилом;
R15 представляет собой H или C1-C6алкил;
m равно 0, 1 или 2;
X представляет собой неразветвленный C2-C3алкилен, необязательно замещенный C1-C6алкилом или C3-C8циклоалкилом;
Y представляет собой CO, CS, SO2 или C=N(CN) и
"het", использованный при определении R4, представляет собой C-связанное, 4-6-членное кольцо, гетероцикл, имеющий либо 1-4 кольцевых гетероатома азота, либо 1-2 кольцевых гетероатома азота и 1 кольцевой гетероатом кислорода или серы, необязательно замещенный C1-C6алкилом, C3-C8циклоалкилом, C1-C6алкокси, C3-C8циклоалкокси, гидрокси, оксо или галогеном.
Текст
1 Данное изобретение относится к производным пурина. Более конкретно, данное изобретение относится к производным 2-аминокарбонил-9 Н-пурина и к способам их получения, к промежуточным соединениям, используемым при их получении, к содержащим их композициям и к применению таких производных. Такие производные являются селективными функциональными агонистами А 2 а аденозинового рецептора человека и могут использоваться в качестве противовоспалительных агентов при лечении, помимо прочего, заболеваний дыхательных путей. Аденозин представляет собой повсеместно распространенную молекулу, играющую центральную роль в промежуточном метаболизме млекопитающих. Независимо, аденозин действует на множество поверхностных рецепторов,обеспечивая большое число ответных реакций. Классификация аденозинового рецептора выявила присутствие по крайней мере четырех подтипов: А 1, А 2 а, А 2b и A3. Сообщалось, что стимуляция А 2 аденозиновых рецепторов на поверхности нейтрофильных лейкоцитов человека эффективно ингибирует ряд функций нейтрофилов. Активированные нейтрофилы могут повреждать ткань легких за счет высвобождения реакционноспособных разновидностей кислорода, например, суперсксидных анионных радикалов (О 2-), и гранулированных продуктов, например, эластазы нейтрофила человека (HNE),наряду с другими воспалительными медиаторами. Кроме того, активированные нейтрофилы осуществляют de novo как синтез, так и высвобождение арахидонатных продуктов, таких как лейкотриен В 4 (LTB4). LTB4 представляет собой эффективный химиоаттрактант, который привлекает дополнительные нейтрофилы к центру воспаления, поскольку высвобождающиеся O2 и HNE неблагоприятным образом воздействуют на легочный межклеточный матрикс. А 2 подтип рецептора, опосредующий множество подобных ответных реакций (O2-и LTB4/HNE высвобождение и адгезию клеток) установлен как А 2 а. Подтип А 2 (А 2 а или А 2b), опосредующий другие типы действия, все еще устанавливается. Селективная агонистическая активность в отношении А 2 рецептора рассматривается как предложение значительного терапевтического выигрыша по сравнению с применением неселективных агонистов аденозиновых рецепторов,поскольку взаимодействие с другими подтипами связано с неблагоприятным действием в легких, как показано на животных моделях и при исследовании ткани человека. Например, у астматиков, но не у неастматиков, наблюдается сужение бронхов при введении в организм для выработки антител аденозина в виде ингаляции. Такая ответная реакция по крайней мере частично связана с активацией А 1 подтипа рецептора. Активация А 1 рецепторов также промотирует хемотаксиз нейтрофилов и прилипание к 2 эндотелиальным клеткам, промотируя таким образом повреждение легкого. Кроме того, многим пациентам с заболеваниями дыхательных путей предписывают (2-агонисты, и на животных моделях продемонстрировано отрицательное взаимодействие между изопреналином и аденозиновыми рецепторами, отрицательно связанными с аденилатциклазой. Дегрануляция мастоцитов человека промотируется при активации А 2b аденозиновых рецепторов, таким образом селективность по отношению к А 2b рецептору также является благоприятной. Авторами данного изобретения неожиданно установлено, что настоящие производные пурина ингибируют функцию нейтрофилов и являются селективными агонистами А 2 а аденозинового рецептора. Они также могут обладать антагонистической активностью в отношенииA3 аденозинового рецептора. Настоящие соединения также можно использовать для лечения любого заболевания, при котором требуется агонист А 2 а рецептора. Их можно использовать для лечения заболевания, которое включает в себя лейкоцит (например, нейтрофил, эозинофил, базофил, лимфоцит, макрофаг) - индуцированное повреждение ткани. Их можно использовать в качестве противовоспалительных агентов при лечении заболеваний дыхательных путей,таких как синдром дыхательной недостаточности у взрослых (ARDS), бронхит, хронический бронхит, хроническое обструктивное заболевание легких, фиброзно-кистозная дегенерация,астма, эмфизема, бронхоэктаз, хронический синусит и ринит. Настоящие соединения также можно использовать при лечении септического шока, мужской эректильной дисфункции, мужского фактора бесплодия, женского фактора бесплодия, гипертензии (повышенного кровяного давления), инсульта, эпилепсии, церебральной ишемии, периферических сосудистых заболеваний, постишемического реперфузионного повреждения, диабета, ревматоидного артрита,рассеянного склероза, псориаза, дерматита, аллергического дерматита, экземы, язвенного колита, болезни Крона, воспалительного заболевания кишечника, вызванного Heliobacter pylori гастрита, вызванного не-Heliobacter pylori гастрита, повреждения желудочно-кишечного тракта или психотического заболевания, вызванного нестероидными противовоспалительными лекарственными средствами, или для заживления ран. Соответственно, в первом варианте осуществления настоящее изобретение относится к соединению формулы 3 или его фармацевтически приемлемой соли или сольвату, где R1 представляет собой Н, C1-C6 алкил или флуоренил, указанный C1-C6 алкил необязательно является замещенным 1-2 заместителями, каждый из которых независимо выбран из фенила и нафтила, указанный фенил и нафтил необязательно являются замещенными(A) R2 представляет собой Н или C1C6 алкил, R15 представляет собой Н или C1C6 алкил, и X представляет собой либо (i) неразветвленный С 2-С 3 алкилен, необязательно замещенный С 1-С 6 алкилом или С 3-С 8 циклоалкилом,либо (ii) группу формулы(B) R15 представляет собой Н или C1C6 алкил, и R2 и X, взятые вместе с атомом азота,к которому они присоединены, представляют азетидин-3-ил, пирролидин-3-ил, пиперидин-3 ил, пиперидин-4-ил, гомопиперидин-3-ил или гомопиперидин-4-ил, каждый из которых необязательно является замещенным C1-C6 алкилом,или(C) R2 представляет собой Н или C1C6 алкил, и R15 и X, взятые вместе с атомом азота, к которому они присоединены, представляют азетидин-3-ил, пирролидин-3-ил, пиперидин-3 ил, пиперидин-4-ил, гомопиперидин-3-ил или гомопиперидин-4-ил, каждый из которых необязательно является замещенным C1-C6 алкилом; либо R3 и R4, взятые вместе с атомом азота,к которому они присоединены, представляют собой азетидинил, пирролидинил, пиперидинил,пиперазинил, гомопиперидинил или гомопиперазинил, каждый из которых необязательно является замещенным по кольцевому атому азота или атому углерода C1-C6 алкилом или С 3-С 8 циклоалкилом и необязательно замещен по кольцевому атому углерода, не смежному с атомом азота, NR6R7,либо R3 представляет собой Н, C1-C6 алкил,С 3-С 8 циклоалкил или бензил, и R4 представляет собой(a) азетидин-3-ил, пирролидин-3-ил, пиперидин-3-ил, пиперидин-4-ил, гомопиперидин-3 ил или гомопиперидин-4-ил, каждый из которых необязательно является замещенным C1-C6 алкилом, С 3-C8 циклоалкилом, фенилом, бензилом или het, илиR5 представляет собой СН 2 ОН илиR6 и R7, либо каждый независимо, представляют собой Н или C1-C6 алкил, либо взятые вместе с атомом азота, к которому они присоединены, представляют собой азетидинил, пир 004983 4 ролидинил или пиперидинил, указанные азетидинил, пирролидинил или пиперидинил необязательно являются замещенными C1-C6 алкилом;R8 представляет собой (i) азетидин-1-ил,пирролидин-1-ил, пиперидин-1-ил, морфолин-4 ил, пиперазин-1-ил, гомопиперидин-1-ил, гомопиперазин-1-ил или тетрагидроизохинолин-1 ил, каждый из которых необязательно является замещенным по кольцевому атому углерода C1C6 алкилом, С 3-С 8 циклоалкилом, фенилом, C1C6 алкокси-(C1-C6)алкилом, R9R9N-(C1-C6)алкилом, фтор-(C1-C6)-алкилом, -CONR9R9, -COOR9 или С 2-С 5 алканоилом, и необязательно замещенным по кольцевому атому углерода, не смежному с атомом азота, фтор-(C1-C6)-алкокси,галогеном, -OR9, циано, -S(O)mR10, -NR9R9,SO2NR9R9, -NR9COR10 или -NR9SO2R10, и указанный пиперазин-1-ил и гомопиперазин-1-ил необязательно являются замещенными по кольцевому атому азота, не связанному с С 2 С 6 алкиленовой группой, C1-C6 алкилом, фенилом, C1-C6 алкокси-(С 2-С 6)алкилом, R9R9N-(С 2 С 6)алкилом, фтор- (C1-C6)-алкилом, С 2-С 5 алканоилом, -COOR10, С 3-С 8 циклоалкилом, -SO2R10,-SO2NR9R9 или -CONR9R9 илиR13 представляет (а) фенил, пиридин-2-ил,пиридин-3-ил или пиридин-4-ил, каждый из которых необязательно является замещенным C1C6 алкилом,C1-C6 алкокси,-(C1-С 3 алкилен)-(C1-C6 алкокси), галогеном, циано, -(C1-С 3 алкилен)-CN, СО 2 Н, -(C1-С 3 алкилен)-СО 2 Н, -CO2(C1C6 алкилом), -(C1-C3 алкилен)-СО 2 (C1-C6 алкилом), -(C1-С 3 алкилен)-NR14R14, -CONR14R14 или (C1-C3 алкилен)-CONR14R14, или (b) азетидин-2 ил, азетидин-3-ил, пирролидин-2-ил, пирролидин-3-ил, пиперидин-2-ил, пиперидин-3-ил, пиперидин-4-ил, гомопиперидин-2-ил, гомопиперидин-3-ил или гомопиперидин-4-ил, каждый из которых необязательно является замещеннымR4 и R13, представляет собой С-связанное, 4-6 членное кольцо, гетероцикл, имеющий либо 1-4 кольцевых гетероатома азота, либо 1-2 кольцевых гетероатома азота и 1 кольцевой гетероатомC1-C6 алкилом, С 3-C8 циклоалкилом, C1-C6 алкокси, С 3-C8 циклоалкокси, гидрокси, оксо или галогеном. Во втором варианте осуществления настоящее изобретение относится к соединению формулы или его фармацевтически приемлемой соли или сольвату, гдеR1 представляет собой Н, C1-C6 алкил или флуоренил, указанный C1-C6 алкил необязательно является замещенным 1-2 заместителями,каждый из которых независимо выбран из фенила и нафтила, указанный фенил и нафтил необязательно являются замещенными C1C6 алкилом, C1-C6 алкокси, галогеном или циано;R2 представляет собой Н или C1-C6 алкил,либо R3 и R4, взятые вместе с атомом азота,к которому они присоединены, представляют собой азетидинил, пирролидинил, пиперидинил,пиперазинил, гомопиперидинил или гомопиперазинил, каждый из которых необязательно является замещенным по кольцевому атому азота или атому углерода C1-C6 алкилом или С 3-С 8 циклоалкилом и необязательно замещен по кольцевому атому углерода, не смежному с атомом азота, группой NR6R7,либо R3 представляет собой Н, C1-C6 алкил,С 3-С 8 циклоалкил или бензил, и R4 представляет собой(a) азетидин-3-ил, пирролидин-3-ил, пиперидин-3-ил, пиперидин-4-ил, гомопиперидин-3 ил или гомопиперидин-4-ил, каждый из которых необязательно является замещенным C1-C6 алкилом, С 3-C8 циклоалкилом, фенилом, бензилом или het, или(c) - (C1-C6 алкилен)-R13,R5 представляет собой СН 2 ОН илиR6 и R7, либо каждый независимо, представляют собой Н или C1-C6 алкил или взятые вместе с атомом азота, к которому они присоединены, представляют собой азетидинил, пирролидинил или пиперидинил, указанные азетидинил, пирролидинил или пиперидинил необязательно являются замещенными C1-C6 алкилом;R8 представляет собой (i) азетидин-1-ил,пирролидин-1-ил, пиперидин-1-ил, морфолин-4 ил, пиперазин-1-ил, гомопиперидин-1-ил, гомопиперазин-1-ил или тетрагидроизохинолин-1 ил, каждый из которых необязательно является замещенным по кольцевому атому углерода C1C6 алкилом, С 3-С 8 циклоалкилом, фенилом, C1 004983C6 алкокси-(C1-C6)-алкилом, R9R9N-(C1-C6)-алкилом, фтор- (C1-C6)-алкилом,-CONR9R9, -COOR9 или С 2-С 5 алканоилом,и необязательно замещенным по кольцевому атому углерода, не смежному с атомом азота,фтор-(C1-C6)-алкокси, галогеном, -OR9, циано,-S(O)mR10, -NR9R9, -SО 2NR9R9, -NR9COR10 или-NR9SO2R10 и указанный пиперазин-1-ил и гомопиперазин-1-ил необязательно являются замещенными по кольцевому атому азота, не связанному с С 2-С 6 алкиленовой группой, C1-C6 алкилом, фенилом, C1-C6 алкокси-(С 2-С 6)-алкилом,R9R9N- (С 2-С 6)-алкилом, фтор-(C1-C6)-алкилом,C2-C5 алканоилом, -COOR10, С 3-С 8 циклоалкилом,-SO2R10, -SO2NR9R9 или -CONR9R9 илиR13 представляет собой фенил, пиридин-2 ил, пиридин-3-ил или пиридин-4-ил, каждый из которых необязательно является замещеннымX представляет собой неразветвленный С 2 С 3 алкилен, необязательно замещенный C1-C6 алкилом или С 3-C8 циклоалкилом;R4, представляет собой С-связанное, 4-6 членное кольцо, гетероцикл, имеющий либо 1-4 кольцевых гетероатома азота, либо 1-2 кольцевых гетероатома азота и 1 кольцевой гетероатом кислорода или серы, необязательно замещеннойC1-C6 алкилом, С 3-C8 циклоалкилом, C1-C6 алкокси, С 3-C8 циклоалкокси, гидрокси, оксо или галогеном. В указанных выше определениях галоген означает фтор, хлор, бром или иод, и алкильные,алкиленовые, алканоильные и алкоксигруппы,содержащие требуемое число атомов углерода,за исключением указанных случаев, могут иметь неразветвленную или разветвленную цепь. Примеры алкила включают метил, этил, нпропил, изопропил, н-бутил, изобутил, вторбутил и трет-бутил. Примеры алкокси включают метокси, этокси, н-пропокси, изопропокси, нбутокси, изобутокси, втор-бутокси и третбутокси. Примеры алканоила включают ацетил 7 и пропаноил. Примеры алкилена включают метилен, 1,1-этилен, 1,2-этилен, 1,3-пропилен и 1,2-пропилен. Примеры циклоалкила включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил (соответствующие примеры также относятся к циклоалкокси). Примеры циклоалкилена включают циклопентилен, циклогексилен и циклогептилен. Het может быть ароматическим или частично или полностью насыщенным, и С-связанный означает, что он присоединен к соседней группе через атом углерода. Примеры Het включают пирролил,имидазолил, триазолил, тиенил, фурил, тиазолил, оксазолил, тиадиазолил, оксидиазолил, пиридинил, пиримидинил, пиридазинил и пиразинил. Фармацевтически приемлемые соли соединений формулы (I) включают их аддитивные соли кислот и оснований. Подходящие кислотно-аддитивные соли получают из кислот, которые образуют нетоксичные соли, и примерами являются такие соли,как гидрохлорид, гидробромид, гидроиодид,сульфат, бисульфат, нитрат, фосфат, гидрофосфат, ацетат, малеат, малат, фумарат, лактат, тартрат, цитрат, глюконат, сукцинат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, памоат, адипат и ксинафоат (1-гидрокси-2-нафтоат). Подходящие соли оснований получают из оснований, которые образуют нетоксичные соли, и примерами являются соли натрия, калия,алюминия, кальция, магния цинка и диэтаноламина. Обзор подходящих солей см. Berge et al.,J.Pharm.Sci., 66, 1-19, 19. Фармацевтически приемлемые сольваты соединений формулы (I) и их солей включают гидраты. В объем соединений формулы (I) и их солей также включены их полиморфы и меченные радиоактивным изотопом производные. Соединение формулы (I) может содержать один или несколько дополнительных асимметрических атомов углерода и следовательно существовать в виде двух или более стереоизомерных форм. Настоящее изобретение включает в себя, наряду с их смесями, отдельные стереоизомеры соединений формулы (I) и, там, где это является подходящим, их индивидуальные таутомерные формы. Разделение диастереоизомеров может быть осуществлено обычными способами, например,с помощью дробной кристаллизации, хроматографии или ВЭЖХ стереоизомерной смеси соединения формулы (I) или его подходящей соли или производного. Индивидуальный энантиомер соединения формулы (I) также может быть получен из соответствующего оптически чистого промежуточного соединения или оптическим разделением, например, с использованием ВЭЖХ соответствующего рацемата с использо 004983 8 ванием подходящего хирального носителя или дробной кристаллизацией диастереоизомерных солей, полученных при взаимодействии соответствующего рацемата с подходящей оптически активной кислотой или основанием, где это является подходящим. Предпочтительно R1 представляет собойC1-C6 алкил, необязательно замещенный 1 или 2 фенильными заместителями, указанный фенил необязательно является замещенным C1C6 алкилом или галогеном. Предпочтительно R1 представляет собойC1-C6 алкил, необязательно замещенный 1 или 2 фенильными заместителями, указанный фенил необязательно является замещенным метилом или хлором. Предпочтительно R1 представляет собойC1-C6 алкил, замещенный 1 или 2 фенильными заместителями, указанный фенил необязательно является замещенным метилом или хлором. Предпочтительно R1 представляет собойC1-C6 алкил, замещенный 2 фенильными заместителями, указанный фенил необязательно является замещенным метилом или хлором. Предпочтительно, R1 представляет собойC1-C6 алкил, замещенный 2 заместителями, каждый из которых независимо выбран из фенила,3-метилфенила и 3-хлорфенила. Предпочтительно R1 представляет собойH, и R2 и X, взятые вместе с атомом азота, с которым они связаны, представляют собой 3 пирролидинил или 3- или 4-пиперидинил, каждый из которых необязательно замещен C1-C6 алкилом. Предпочтительно R15 представляет собой Н, и R2 и X, взятые вместе с атомом азота, с которым они связаны, представляют собой 3 пирролидинил или 4-пиперидинил, каждый из которых необязательно замещен C1-C6 алкилом. Предпочтительно R15 представляет собой Н, и R2 и X, взятые вместе с атомом азота, с которым они связаны, представляют собой 3 пирролидинил или 3- или 4-пиперидинил. Предпочтительно R15 представляет собой Н, и R2 и X, взятые вместе с атомом азота, с которым они связаны, представляют собой 3 пирролидинил или 4-пиперидинил. Предпочтительно R15 представляет собой Н, и R2 и X, взятые вместе с атомом азота, с которым они связаны, представляют собой (3R)пирролидинил или 4-пиперидинил. Предпочтительно R2 представляет собой Н, и R15 и X, взятые вместе с атомом азота, с которым они связаны, представляют собой 3 пирролидинил или 3- или 4-пиперидинил, каждый из которых необязательно замещен C1C6 алкилом. Предпочтительно R2 представляет собой Н, и R15 и X, взятые вместе с атомом азота, с которым они связаны, представляют собой 3 пирролидинил или 4-пиперидинил, каждый из которых необязательно замещен C1-C6 алкилом. Предпочтительно R2 представляет собойH, и R15 и X, взятые вместе с атомом азота, с которым они связаны, представляют собой (3R)пирролидинил, (3S)-пирролидинил или 4 пиперидинил. Предпочтительно R3 представляет собой Н. Предпочтительно R4 представляет собой пиперидин-3-ил или пиперидин-4-ил, каждый из которых необязательно замещен бензилом илиhet, как определено выше. Предпочтительно R4 представляет собой пиперидин-3-ил или пиперидин-4-ил, каждый из которых необязательно замещен бензилом, пиридин-2-илом, пиридин-3-илом или пиридин-4 илом, каждый из указанных пиридин-2-ила, пиридин-3-ила и пиридин-4-ила необязательно замещен C1-C6 алкилом, С 3-С 8 циклоалкилом, C1C6 алкокси, С 3-С 8 циклоалкокси, гидрокси, оксо или галогеном. Предпочтительно R4 представляет собой пиперидин-3-ил или пиперидин-4-ил, каждый из которых замещен бензилом, пиридин-2-илом,пиридин-3-илом или пиридин-4-илом. Предпочтительно R4 представляет собой пиперидин-3-ил или пиперидин-4-ил, каждый из которых замещен бензилом. Предпочтительно R4 представляет собой пиперидин-3-ил или пиперидин-4-ил, каждый из которых замещен пиридин-2-илом. Предпочтительно R4 представляет собой пиперидин-4-ил, замещенный пиридин-2-илом. Предпочтительно R4 представляет собой 1 бензилпиперидин-4-ил. Предпочтительно R4 представляет собой 1(пиридин-2-ил)пиперидин-4-ил. Предпочтительно R4 представляет собой-CONHCH2CH3. Предпочтительно R8 представляет собой (i) азетидин-1-ил, пирролидин-1-ил, пиперидин-1 ил, морфолин-4-ил, пиперазин-1-ил, гомопиперидин-1-ил, гомопиперазин-1-ил или тетрагидроизохинолин-1-ил, каждый из которых необязательно является замещенным по кольцевому 11 атому углерода C1-C6 алкилом, и указанные пиперазин-1-ил и гомопиперазин-1-ил необязательно являются замещенными по кольцевому атому азота, не связанному с С 2-С 6 алкиленовой группой, C1-C6 алкилом или (ii) представляет собой NR11R12. Предпочтительно R8 представляет собой пиперидин-1-ил или тетрагидроизохинолин-1 ил, каждый из которых необязательно является замещенным по кольцевому атому углерода C1C6 алкилом. Предпочтительно R8 представляет собой пиперидин-1-ил, необязательно замещенный по кольцевому атому углерода изопропилом. Предпочтительно R8 представляет собой пиперидин-1-ил,4-изопропилпиперидин-1-ил или тетрагидроизохинолин-1-ил. Предпочтительно R8 представляет собой 11 12C1-C6 алкил. Предпочтительно R11 представляет собой изопропил или н-бутил. Предпочтительно R12 представляет собой Н, C1-C6 алкил, С 3-С 8 циклоалкил или бензил. Предпочтительно R12 представляет собойC1-C6 алкил, С 3-С 8 циклоалкил или бензил. Предпочтительно R12 представляет собой изопропил, циклопентил, циклогексил или бензил. Предпочтительно R13 представляет собой либо фенил, необязательно замещенный -(С 1 С 3 алкилен)-NR14R14 или СО 2 Н, либо пиперидин 2-ил, пиперидин-3-ил или пиперидин-4-ил, каждый из которых необязательно замещен бензилом. Предпочтительно R13 представляет собой фенил,необязательно замещенный 14 Соединение формулы (I), где Y представляет собой СО, может быть получено взаимодействием соединения формулыR3R4NCOZ1 (III),1 где Z представляет собой подходящую уходящую группу, такую как хлор или 1 Н-имидазол 1-ил. В типичном способе соединения реагируют совместно в подходящем растворителе, таком как толуол, изопропанол или дихлорметан,или в любом их сочетании, необязательно при нагревании, например, при температуре кипения растворителя с обратным холодильником. Соединения формулы (III) могут быть получены обычными способами. Соединение формулы (II) может быть получено, как показано на схеме 1. Схема 1 В указанных выше предпочтительных группах, "Et" означает этил, "iPr" означает изопропил, "nBu" означает н-бутил и "Ph" означает фенил. Особенно предпочтительными вариантами соединения формулы (I) являются те, которые приведены ниже в разделе Примеры, в особенности приведенные в примерах 8 и 34, наряду с их фармацевтически приемлемыми солями и сольватами. Соединения формулы (I) могут быть получены обычными способами, как например, с использованием следующих иллюстративных способов, в которых R1, R2, R3, R4, R5, R15, X иY, если не указано другого, являются такими,как определено выше для соединения формулы 15 где R16 представляет собой C1-C4 алкил, R17 представляет собой подходящую защитную группу, такую как тетрагидро-2 Н-пиран-2-ил,R18 представляет собой подходящую образующую сложный эфир группу, такую как C1-C6 алкил или бензил, предпочтительно C1-C4 алкил,и R19 и R20 либо каждый представляет собой подходящую защитную группу, такую как ацетил или бензоил, либо, взятые вместе, представляют собой подходящую защитную группу, такую как C1-C6 алкилен, необязательно замещенный фенилом, например, 1,1-диметилметилен либо фенилметилен. При типичном способе, где R17 представляет собой тетрагидро-2 Н-пиран-2-ил, хлорпурин формулы (IV) является N-защищенным с помощью реакции с 3,4-дигидро-2 н-пираном,протекающей в присутствии подходящего кислотного катализатора, такого как п-толуолсульфоновая кислота (ПТСК), бензолсульфоновая кислота, камфорсульфоновая кислота, хлористоводородная кислота, серная кислота, метансульфоновая кислота или п-толуолсульфонат пиридиния, и в подходящем растворителе, таком как этилацетат, толуол, дихлорметан, диметилформамид (ДМФ), трет-бутилметиловый эфир, диизопропиловый эфир, тетрагидрофуран(ТГФ) или ацетонитрил, при температуре от 0 С до температуры кипения растворителя с обратным холодильником. Предпочтительно взаимодействие проводят в этилацетате в присутствии ПТСК при нагревании. Другие подходящие защитные группы R17 отмечены в указанной в данном описании ссылке на Greene et al. Полученное соединение формулы (V) может быть преобразовано в амин формулы (VI) взаимодействием с соединением формулы:R1NH (XVI). Соединения взаимодействуют в присутствии подходящего акцептора кислоты, например триэтиламина, 4-метилморфолина или N-этилдиизопропиламина, и в подходящем растворителе, таком как метанол, этанол или изопропанол, при температуре от комнатной температуры до температуры кипения растворителя с обратным холодильником. Предпочтительно используют N-этилдиизопропиламин и изопропанол в условиях кипячения с обратным холодильником. Амин формулы (VI) затем взаимодействует с тиоалкоксидом натрия или калия в подходящем растворителе, таком как диметилсульфоксид (ДМСО), ДМФ или 1-метил-2-пирролидинон, при температуре от комнатной температуры до температуры кипения растворителя с обратным холодильником. Предпочтительно в качестве условий реакции используют тиометоксид натрия или калия в ДМФ при 100 С. Полученный тиоэфир формулы (VII) затем окисляют в сульфон формулы (VIII) с использованием подходящего окислителя, такого как Оксон (Охоnе, торговая марка) (пероксимоно 004983 16 сульфат калия), диметилдиоксиран, м-хлорпербензойная кислота или перуксусная кислота,необязательно в присутствии подходящего основания, например, бикарбоната натрия, и в подходящем растворителе, таком как водный ацетон или дихлорметан, при температуре от комнатной температуры до 50 С. Предпочтительно используют Оксон (Охоnе, торговая марка) и бикарбонат натрия в водном ацетоне при комнатной температуре. Сульфон формулы (VIII) может быть преобразован в нитрил формулы (IX) взаимодействием с подходящим источником цианида, таким как цианид калия, цианид цинка, цианид натрия или цианид меди, и в подходящем растворителе,таком как ДМСО, ДМФ, 1-метил-2-пирролидинон, ТГФ или ацетонитрил, при температуре от комнатной температуры до температуры кипения растворителя с обратным холодильником. Предпочтительными условиями являются цианид калия в ДМФ при 120 С. Альтернативно, хлорпурин формулы (VI) может быть преобразован в нитрил формулы(IX) с использованием подходящего источника цианида, такого как цианид калия, цианид цинка, цианид натрия или цианид меди, в подходящем растворителе, например, ДМФ, ДМСО, 1 метил-2-пирролидинон, ТГФ или ацетонитрил,необязательно в присутствии подходящего палладиевого катализатора, например, тетракис(трифенилфосфин)палладия(0) или ацетата палладия(II) в сочетании с трифенилфосфином,три-о-толилфосфином, (R)- или (S)- или рацемическим 2,2'-бис(дифенилфосфино)-1,1'-бинафтилом или 1,1'-бис(дифенилфосфино)ферроценом, и необязательно в присутствии подходящего основания, например, триэтиламина, 4 метилморфолина или N-этилдиизопропиламина,при температуре от комнатной температуры до температуры кипения растворителя с обратным холодильником (необязательно под давлением). Альтернативно, взаимодействие может быть осуществлено взаимодействием хлорпурина формулы (VI) с цианидом натрия или калия в подходящем растворителе, таком как ДМСО, 1 метил-2-пирролидинон или ДМФ, при температуре от комнатной температуры до температуры кипения растворителя с обратным холодильником. Предпочтительно взаимодействие осуществляют с использованием цианида цинка, триэтиламина и тетракис(трифенилфосфин)палладия(0) в ДМФ при 80-85 С при повышенном давлении аргона. В нитриле формулы (IX) в обычных условиях может быть снята защитная группа с получением нитрила формулы (X). Например, когдаR17 представляет собой тетрагидро-2 Н-пиран-2 ил, снятие защитной группы может быть осуществлено в присутствии подходящей кислоты,такой как хлористо-водородная кислота, трифторуксусная кислота, серная кислота, трихлоруксусная кислота, фосфорная кислота, п 17 толуолсульфоновая кислота, бензолсульфоновая кислота, метансульфоновая кислота или камфорсульфоновая кислота, и в подходящем растворителе, таком как C1-C4 алканол, который необязательно может содержать воду, предпочтительно при повышенной температуре, такой как температура кипения растворителя с обратным холодильником. В процессе обработки рН может быть доведен до значения между рН 8 и рН 11 с помощью водного основания, такого как гидроксид натрия, гидрсксид калия, карбонат натрия или карбонат калия, для генерации свободного основания соединения формулы (X). Предпочтительными условиями являются использование 2 М водной хлористо-водородной кислоты в этаноле при комнатной температуре или использование трифторуксусной кислоты в водном изопропаноле в условиях кипения с обратным холодильником, с последующим доведением рН в процессе обработки до рН 9-10,5 водным раствором гидроксида натрия. Нитрил формулы (X) может быть преобразован в сложный эфир формулы (XII) взаимодействием с С 1-С 4 алкоксидом натрия или калия в соответствующем С 1-С 4 алканоле в качестве растворителя, необязательно при повышенной температуре, включая обработку кислотой во время обработки реакционной смеси. Предпочтительно взаимодействие осуществляют с использованием метоксида натрия в метаноле при температуре кипения с обратным холодильником с обработкой водной хлористо-водородной кислотой в процессе обработки реакционной смеси. Альтернативно, сложный эфир формулы(XII) может быть получен карбонилированием соединения формулы (VI) с соединением формулыR18 ОH с использованием монооксида углерода, необязательно под давлением, совместно с подходящим палладиевым катализатором в присутствии подходящего основания, например, основания третичного амина, и необязательно при повышенной температуре для получения соединения формулы Обычно используют каталитическое количество ацетата палладия(II) вместе с подходящим лигандом, таким как 1,1'-бис(дифенилфосфино)ферроцен, трифенилфосфин, три-о-толилфосфин или BINAP R)- или (S)- или рацемический 2, 2'-бис(дифенилфосфино)-1,1'-бинафтил),подходящий спирт формулы R18OH, например,метанол, этанол, 1-пропанол, изопропанол или 1-бутанол (используемый также как растворитель), и основание, такое как триэтиламин, основание Ханигса (Hunigs) (этилдиизопропила 004983 18 мин), 4-метилморфолин, карбонат натрия, гидрокарбонат натрия, карбонат калия или карбонат цезия, в присутствии монооксида углерода,необязательно под давлением 1-3000 КПа в герметично закрытом сосуде при 20-200 С. В соединение формулы (VIA) может быть снята защита, для получения соединения формулы (XII) при использовании подходящих условий снятия защиты, как, например, те, которые списаны для преобразования соединения формулы (IX) в соединение формулы (X). Сложный эфир формулы (XII) может быть подвергнут связыванию с соединением формулы где Z2 представляет собой подходящую уходящую группу, такую как ацетокси, бензоилокси,метокси или галоген, например, хлор, и R19 и R20 представляют собой подходящие защитные группы, как определено выше, в присутствии подходящей кислоты или кислоты Льюиса, например, триметилсилил трифторметансульфоната, предпочтительно с использованием их избытка. Взаимодействие может быть осуществлено с использованием соединения формулы(XI) в форме 2R- или 2S-диастереоизомера или в форме их эпимерной смеси. Взаимодействие обычно осуществляют в подходящем растворителе, например, 1,2-диметоксиэтане, дихлорметане, ацетонитриле, 1,1,1-трихлорэтане или толуоле, или в их смеси, предпочтительно с использованием предварительной обработки соединения формулы (XII) in situ подходящим силилирующим агентом, например, триметилсилил трифторметансульфонатом, N,O-бис(триметилсилил)ацетамидом, триметилсилилхлоридом или гексаметилдисилазаном, необязательно в присутствии основания третичного амина, например, N-метилморфолина, перед добавлением соединения формулы (XI). При взаимодействии можно использовать повышенную температуру. Предпочтительные условия включают первоначальную обработку соединения формулы (XII) N,O-бис(триметилсилил) ацетамидом в 1,1,1-трихлорэтане, нагревание реакционной смеси при кипячении с обратным холодильником, перед обработкой раствором соединения формулы (XI) и триметилсилил трифторметансульфоната в толуоле, а затем нагревание примерно при 100 С. Следует принять во внимание, что когда предполагается использовать соединение формулы (XI), где R5 представляет собой СН 2 ОН, гидроксильная группа может быть защищена подходящим образом для данной реакции (см. далее определение R5A),затем защитная группа может быть снята в по 19 следующем преобразовании для получения соединения формулы (XIV). Снятие защитных групп в соединении формулы может быть осуществлено с использованием обычных условий, например, когда каждый из R19 и R20 представляет собой ацетил или бензоил, в основных условиях, как, например, с использованием гидроксида натрия, гидроксида калия, гидроксида лития, карбоната натрия,карбоната калия или карбоната цезия в растворителе, таком как метанол, этанол, изопропанол,1,2-диметоксиэтан, ТГФ, ДМФ, ацетон, 2 бутанон или 4-метил-2-пентанон, также необязательно в присутствии воды при температуре от 0 до 80 С. Альтернативно можно использовать любое основание третичного амина, такое как триэтиламин, диизопропилэтиламин или 4 метилморфолин, в спиртовом растворителе, таком как метанол, этанол, изопропанол или 1 пропанол, при температуре от 0 до 80 С, или можно использовать С 1-С 4 алкоксид натрия или калия, например, метоксид или этоксид натрия в соответствующем С 1-С 4 спирте, например, метаноле или этаноле. Кроме того можно использовать амин, такой как аммиак, метиламин, этиламин, диметиламин, в подходящем растворителе,таком как метанол, этанол, изопропанол, ТГФ или дихлорметан, при температуре от 0 до 80 С. Предпочтительно используют карбонат натрия в метаноле при комнатной температуре. Сложный эфир формулы (XIV) может быть преобразован в амид формулы (II) взаимодействием с соединением формулыR15NH-X-NHR2 (XV) необязательно при повышенной температуре,необязательно в инертном растворителе, таком как 1,2-диметоксиэтан или 2-метоксиэтиловый простой эфир и необязательно под давлением. Предпочтительно взаимодействие осуществляют з отсутствие растворителя при температуре 100-120 С. Специалисту в данной области следует иметь в виду, что для достижения требуемой региоселективности в данной реакции можно использовать подходящую защитную группу(например, трифторацетильную), расположенную на выбранном атоме N в соединении формулы (XV), и впоследствии провести снятие защиты в полученном защищенном промежуточном соединении. Соединение формулы (II) также может быть получено реакцией аминокарбонилирования соединения формулы (XVII) с соединением формулы(XV) По способу, аналогичному описанному ниже для преобразования соединения формулы(XVII) в соединение формулы (I). Специалисту в данной области следует иметь в виду, что для достижения требуемой региоселективности в данной реакции можно использовать подходящую защитную группу (например, трифторацетильную), расположенную на выбранном атомеN в соединении формулы (XV) и впоследствии провести снятие защиты в полученном защищенном промежуточном соединении. Соединение формулы (XI) или (XV) могут быть получены обычными способами. 2. Соединения формулы (I), где Y представляет собой СО, могут быть получены реакцией аминокарбонилирования соединения формулы(XVII) где Z3 представляет собой подходящую уходящую группу, такую как бром, иод, -Sn(C1-C12 алкил)3 или CF3SO2O-, предпочтительно иод, с соединением формулыR15NH-X-NR2-Y-NR3R4 (XVIII) в присутствии монооксида углерода и подходящего катализатора конденсации (будет понятно,что данный путь также можно использовать для соединений формулы, где Y отличается от СО). Предпочтительно катализатор представляет собой палладиевый катализатор (II), более предпочтительно 1,1'-бис(дифенилфосфино)ферроцендихлорпалладий(II) (необязательно в виде комплекса 1:1 с дихлорметаном). Альтернативно, можно использовать ацетат палладия(II) в присутствии подходящего лиганда, такого как 1,1'-бис(дифенилфосфино)ферроцен, трифенилфосфин, три(о-толил)фосфин или (R)-,(S)- или рацемический 2,2'-бис(дифенилфосфино)-1,1'-бинафтил. В типичном способе взаимодействие осуществляют в герметично закрытом сосуде в присутствии монооксида углерода при повышенном давлении, например примерно 345 КПа(50 фт/кв.дюйм), при повышенной температуре,например примерно при 60 С, и в подходящем растворителе, например тетрагидрофуране, метаноле или этаноле. Необязательно может присутствовать подходящее органическое основание, такое как третичный амин, например триэтиламин, N-этилдиизопропиламин или 4 метилморфолин. Промежуточные соединения формулы(XVII) могут быть получены, как показано на схеме 2. Схема 2 где R5A является таким, как определено ниже, Z3 является таким, как определено выше для соединения формулы (XVII), и Ас представляет 21 собой ацетил (хотя следует принимать во внимание, что в преобразовании можно использовать альтернативные подходящие защитные группы, как проиллюстрировано в данном описании). В типичном способе соединение формулыR1NH2 (XVI) в присутствии подходящего акцептора кислоты,например триэтиламина, и в подходящем растворителе, например ацетонитриле, при необходимости при повышенной температуре. В полученном продукте (XX) защитные группы могут быть сняты гидролизом для получения соединения формулы (XVII) с помощью обычного способа, например с использованием подходящего неорганического основания, например карбоната натрия, гидроксида натрия, гидроксида калия,гидроксида лития, карбоната натрия, карбоната калия или карбоната цезия, в подходящем растворителе, например метаноле, этаноле, изопропаноле, 1,2-диметоксиэтане, тетрагидрофуране,диметилформамиде, ацетоне, 2-бутаноне или 4 метил-2-пентаноне, необязательно в водных условиях, при температуре от 0 С до температуры кипения растворителя с обратным холодильником, например, при комнатной температуре. Альтернативно, снятие защиты может быть осуществлено с использованием подходящего амина в качестве основания, такого как триэтиламин, диизопропилэтиламин, 4-метилморфолин, аммиак, метиламин, этиламин или диметиламин, в подходящем растворителе, таком как метанол, этанол, н-пропанол, изопропанол, тетрагидрофуран или дихлорметан, при температуре от 0 С до температуры кипения растворителя с обратным холодильником. Промежуточное соединение формулы(XIX) может быть получено обычным способом. Промежуточное соединение формулы(XVIII) может быть получено взаимодействием соединения формулы:R3R4COZ1 (III) в условиях, аналогичных описанным выше для преобразования соединений формул (II) и (III) в соединение формулы (I). Квалифицированному специалисту следует принять во внимание, что для достижения требуемой региоселективности в данной реакции необязательно можно использовать подходящую защитную группу (например, трифторацетильную), расположенную на выбранном атоме азота в соединении формулы(XV), с последующим ее снятием в полученном защищенном промежуточном соединении. 3. Соединение формулы (I), где Y представляет собой СО, может быть получено посредством снятия защитных групп в соединении формулы(XXI) где R21 и R22 либо каждый по отдельности представляет собой подходящую защитную группу,такую как ацетил или бензоил, либо, взятые вместе, представляют собой подходящую защитную группу, такую как C1-C6 алкилен, необязательно замещенный фенилом, например 1 диметилметилен или фенилметилен, R5A представляет собой СН 2 ОН, CH2OR23 или CONR14R14 и R23 представляет собой подходящую защитную группу, такую как ацетил или бензоил(принимая во внимание, что данный путь может также использоваться для соединений формулы(I), где Y отличен от СО). Можно использовать обычные условия снятия защиты, и они будут зависеть от природы удаляемых защитных групп R21, R22 и R23. Кроме того, специалисту будет понятно, что защитные группы R21, R22 и R23 могут быть удалены все вместе, по отдельности или в любом сочетании для получения соединения формулыCH2OR23, либо R21 и R22 могут быть удалены первоначально с последующим затем снятием защитной группы R23, либо наоборот. В типичном способе, где каждый из R21, R22 и R23 представляет собой ацетил, снятие защитных групп проводят с использованием подходящего неорганического основания, например, карбоната натрия, гидроксида натрия, гидроксида калия,гидроксида лития, карбоната натрия, карбоната калия или карбоната цезия, и в подходящем растворителе, например, метаноле, этаноле, изопропаноле, 1,2-диметоксиэтане, тетрагидрофуране, диметилформамиде, ацетоне, 2-бутаноне или 4-метил-2-пентаноне, необязательно в водных условиях при температуре от 0 С до температуры кипения растворителя с обратным холодильником, например, при комнатной температуре. Альтернативно, снятие защиты может быть осуществлено с использованием подходящего амина в качестве основания, такого как триэтиламин, диизопропилэтиламин, 4-метилморфолин, аммиак, метиламин, этиламин или диметиламин, в подходящем растворителе, таком как метанол, этанол, н-пропанол, изопропанол, тетрагидрофуран или дихлорметан, при температуре от 0 С до температуры кипения растворителя с обратным холодильником, или с использованием С 1-С 4 алкоксида натрия или калия, например, метоксида или этоксида натрия,в соответствующем С 1-С 4 алканоле, например,метаноле или этаноле. В типичном способе, где R21 и R22, взятые вместе, представляют собой 1,1-диметилметилен, в соединении формулы (XXI) защит 23 ные группы могут быть сняты обработкой подходящей кислотой, такой как хлористоводородная кислота, трифторуксусная кислота,серная кислота, фосфорная кислота, птолуолсульфонат пиридиния, п-толуолсульфоновая кислота, бензолсульфоновая кислота, метансульфоновая кислота, уксусная кислота или муравьиная кислота, или их смесью, или кислотной ионообменной смолой, необязательно в присутствии подходящего растворителя, например, этанола, и необязательно в водных условиях. Взаимодействие может быть осуществлено при повышенной температуре, такой как температура кипения растворителя с обратным холодильником. Снятие защитных групп в соединении формулы (XXI) для получения соединения формулы (I) также может быть выполнено in situ с последующим преобразованием соединения формулы (XXII) в соединение формулы (XXI),как описано ниже. В данном случае, где каждый из R21, R22 и R23 представляет собой ацетил,предпочтительным является способ снятия защиты с использованием неорганического основания, например, реакционную смесь, содержащую соединение формулы (XXI) обрабатывают водным раствором гидроксида натрия в 1,2 диметоксиэтане при температуре 5-20 С. Соединение формулы (XXI) может быть получено конденсацией соединения формулы 24 где R4 представляет собой подходящую уходящую группу, такую как тетрагидро-2 Н-пиран-2 ил. Кислота формулы (XXVI) может быть получена с использованием обычных способов,например, основным гидролизом соединения формулы (IX), например, с использованием водного раствора гидроксида натрия с последующим подкислением в процессе обработки. Соединение формулы (XXIII) может быть получено обычными способами. Соединение формулы (XXI), где R5A представляет собой CONR14R14 также может быть получено, как показано на схеме 4. Схема 4(ХХIII) где Z4 представляет собой подходящую уходящую группу, такую как ацетокси, бензоилокси,метокси или галоген, например, хлор, в условиях, аналогичных описанным выше для преобразования соединения формулы (XII) в (XIII). Соединение формулы (XXII) может быть получено с использованием обычных способов,как проиллюстрировано на схеме 3. Такие способы могут быть адаптированы, исходя из описанных выше в данном описании. Схема 3 При типичном способе соединение формулы (XII) взаимодействует с соединением формулы (XXIII), где R5A представляет собойCH2OR23 в условиях, аналогичных описанным выше для преобразования соединения формулы(XXX) защитные группы могут быть сняты в обычных условиях, например, где каждый R21-23 представляет собой ацетил, с использованием подходящего основания, такого как карбонат натрия, карбонат калия, этоксид натрия, метоксид натрия или третичный-бутоксид калия, в присутствии подходящего спиртового растворителя, например, этанола, необязательно в присутствии другого растворителя, такого как 1,2 диметоксиэтан, необязательно в присутствии воды и необязательно при повышенной температуре в течение вплоть до 24 ч, и также необязательно с непосредственным использованием неочищенной реакционной смеси с предшествующей стадии. Полученное соединение формулы (XXXI) может быть защищено с помощью подходящей защитной группы или подходящих защитных групп. Когда R21 и R22, взятые вместе, представляют собой 1,1-диметилметилен, это может быть осуществлено реакцией с ацетоном или кеталем ацетона, или с комбинацией обоих из них, в присутствии кислоты, такой как хлористо-водородная кислота, п-толуолсульфоновая кислота, метансульфоновая кислота, серная кислота, фосфорная кислота или трифторуксусная кислота, в растворителе, таком как ацетон, толуол, дихлорметан или тетрагидрофуран, необязательно при повышенной температуре. Предпочтительно взаимодействие осуществляют с использованием ацетона и 2,2-диметоксипропана в присутствии серной кислоты. Альтернативно, соединение формулы(XXX) можно непосредственно преобразовать в соединение формулы (XXXII) с помощью селективного ферментативного гидролиза, например, с использованием фермента липазы. Полученное соединение формулы (XXXII) может быть окислено до карбоновой кислоты формулы (XXXIII) либо в одну стадию посредством обработки подходящим окисляющим 26 агентом в подходящем растворителе, либо в две стадии посредством первоначальной обработки для генерирования соответствующего альдегида, а затем последующей обработки подходящим окисляющим агентом в подходящем растворителе. Типичные условия одностадийного способа включают в себя обработку первичного спирта окисляющим агентом, таким как хромовая кислота, периодат натрия, триоксид хрома,перманганат калия, хлорит натрия, гипохлорит натрия или кислород, в подходящем растворителе, таком как ацетонитрил, дихлорметан, толуол или этилацетат, необязательно в присутствии подходящего катализатора, такого как триоксид рутения, хлорид рутения, свободный радикал 2,2,6,6-тетраметилпиперидикил-1-окси или платина, необязательно в присутствии катализатора, такого как гипохлорит натрия, бромид натрия или бромид калия, необязательно в присутствии воды, необязательно в присутствии катализатора межфазного переноса, такого как бромид тетрабутиламмония, хлорид бензилтриэтиламмония или хлорид тетрабутиламмония,необязательно в присутствии неорганического основания, такого как карбонат натрия, гидрокарбонат натрия, карбонат калия или гидроксид натрия, и необязательно в присутствии дополнительных вспомогательных добавок, таких как хлорид натрия. Подходящие условия двухстадийного способа включают в себя первоначальную обработку окисляющим агентом, таким как реагент Сверна (Swern), перрутенат тетрапропиламмония, дихромат пиридиния, хлорхромат пиридиния, комплекс триоксид серы-пиридин или 1,1,1-триацетокси-1,1-дигидро-1,2-бензиодоксол-3(1 Н)-он, в подходящем растворителе и необязательно в присутствии дополнительного окислителя, такого как N-метилморфолин-Nоксид, а затем обработку промежуточного альдегида другим подходящим окисляющим агентом, таким как хромовая кислота, периодат натрия, триоксид хрома, перманганат калия, хлорит натрия, гипохлорит натрия или кислород, в подходящем растворителе, таком как ацетонитрил, дихлорметан, толуол или этилацетат, необязательно в присутствии подходящего катализатора, такого как триоксид рутения, хлорид рутения, свободный радикал 2,2,6,6-тетраметилпиперидинил-1-окси или платина, необязательно в присутствии дополнительного катализатора, такого как гипохлорит натрия, бромид натрия или бромид калия, необязательно в присутствии воды, необязательно в присутствии катализатора межфазного переноса, такого как бромид тетрабутиламмония, хлорид бензилтриэтиламмония или хлорид тетрабутиламмония,необязательно в присутствии неорганического основания, такого как карбонат натрия, гидрокарбонат натрия, карбонат калия или гидроксид натрия, и необязательно з присутствии дополнительных вспомогательных добавок, таких как хлорид натрия. Предпочтительные условия 27 включают обработку спирта формулы (XXXII) каталитическим количеством свободного радикала 2,2,6,6-тетраметилпиперидинил-1-окси в ацетонитриле в присутствии воды и дигидрофосфата натрия с последующим добавлением водного гипохлорита натрия (каталитическое количество) и водного хлорита натрия при повышенной температуре. Альтернативно, спирт формулы (XXXII) обрабатывают свободным радикалом 2,2,6,6-тетраметилпиперидинил-1 окси (каталитическое количество) и гипохлоритом натрия в дихлорметане в присутствии воды,бикарбоната натрия и каталитического количества бромида тетрабутиламмония. Полученная карбоновая кислота формулы(XXXIII) может быть преобразована в амид формулы (XXXIV) в обычных условиях конденсации, например, путем активации кислоты с использованием подходящего активирующего агента, необязательно в присутствии катализатора, а затем обработки избытком амина формулыHNR14R14 в подходящем растворителе. Типично, взаимодействие осуществляют путем обработки кислоты активирующим агентом, таким как N',N'карбонилдиимидазол, хлористый тионил, оксалилхлорид или оксихлорид фосфора, в растворителе, таком как ТГФ, ДМФ, этилацетат, ацетонитрил, толуол, ацетон или дихлорметан, при температуре от 0 до 100 С в течение 1-20 ч, с последующим добавлением амина или его кислотно-аддитивной соли, необязательно в присутствии в качестве акцептора кислоты третичного амина, такого как триэтиламин, этилдиизопропиламин или N-метилморфолин, при температуре от 0 до 100 С. Альтернативно, кислоту подвергают взаимодействию с гидрохлоридом 1-(3-диметиламинопропил)-3-этилкарбодиимида или N,N'-дициклогексилкарбодиимидом,затем 1-гидрокси-7-азабензотриазолом или гидратом 1-гидроксибензотриазола, после чего с амином в присутствии избытка 4-метилморфолина, триэтиламина или этилдиизопропиламина в ТГФ, ДМФ, этилацетате, ацетонитриле,толуоле, ацетоне или дихлорметане при комнатной температуре. Взаимодействие также может быть осуществлено путем взаимодействия кислоты с гексафторфосфатом бензотриазол-1 илокситрис(пирролидино)фосфония,гексафторфосфатом бром-трис-пирролидинофосфония или реагентом Мукаямы (Mukaiyama) (иодид 2 хлор-1-метилпиридиния) и амином в присутствии 4-метилмсрфолина, триэтиламина или этилдиизопропиламина в ТГФ, ДМФ, дихлорметане или этилацетате при комнатной температуре. Предпочтительно взаимодействие осуществляют путем первоначальной обработки кислотыN,N'-карбонилдиимидазолом в этилацетате с последующим добавлением амина в ТГФ. Полученное соединение формулы(XXXIV) может быть гидролизовано для полу 004983 28 чения карбоновой кислоты формулы (XXXV) в обычных условиях гидролиза сложного эфира,как например с использованием основания щелочного металла в подходящем растворителе в присутствии воды, необязательно при повышенной температуре, с последующей обработкой кислотой для получения карбоновой кислоты. В типичной реакции взаимодействие осуществляют с использованием гидроксида лития,гидроксида натрия или гидроксида калия в растворителе, таком как водный этанол, метанол,изопропанол, бутанол, промышленный метилированный спирт, тетрагидрофуран, ДМФ, 1,2 диметоксиэтан при температуре от 0 до 100 С. Предпочтительно взаимодействие осуществляют с использованием гидроксида натрия в смеси метанола и воды при 20-65 С. Полученная кислота формулы (XXXV) может быть преобразована в амид формулы(XXI) с использованием обычных условий конденсации, как, например, путем активации кислоты подходящим активирующим агентом,необязательно в присутствии катализатора, а затем обработки избытком амина формулыR15NH-X-NR2-Y-NR3R4 (XVIII) в подходящем растворителе. В типичном способе кислоту обрабатывают активирующим агентом, таким как N',N'-карбонилдиимидазол, хлористый тионил, оксалилхлорид или оксихлорид фосфора, в растворителе, таком как ТГФ, ДМФ,этилацетат, ацетонитрил, толуол, ацетон или дихлорметан, при температуре от 0 до 100 С, с последующим добавлением амина или его кислотно-аддитивной соли, необязательно в присутствии третичного амина, такого как триэтиламин,этилдиизопропиламин илиNметилморфолин, при температуре от 0 до 100 С. Альтернативно, кислоту подвергают взаимодействию с гидрохлоридом 1-(3-диметиламинопропил)-3-этилкарбодиимида или N,N'-дициклогексилкарбодимидом, затем 1-гидрокси-7-азабензотриазолом или гидратом 1-гидроксибензотриазола, после чего с амином в присутствии избытка 4-метилморфолина, триэтиламина или этилдиизопропиламина в ТГФ, ДМФ, этилацетате, ацетонитриле, толуоле, ацетоне или дихлорметане при комнатной температуре. Взаимодействие также может быть осуществлено путем взаимодействия кислоты с гексафторфосфатом бензотриазол-1-илокситрис(пирролидино)фосфония, гексафторфосфатом бром-триспирролидинофосфония или реагентом Мукаямы(Mukaiyama) (иодид 2-хлор-1-метилпиридиния) и амином в присутствии 4-метилморфолина,триэтиламина или этилдиизопропиламина в ТГФ, ДМФ, дихлорметане или этилацетате при комнатной температуре. Предпочтительно взаимодействие осуществляют путем первоначальной обработки кислоты N, N'-карбонилдиимидазолом в дихлорметане с последующим добавлением амина, необязательно в виде подходящей кислотно-аддитивной соли, такой как 29 гидрохлоридная соль, и в присутствии акцептора кислоты, такого как триэтиламин, при комнатной температуре. Соединение формулы (XXXIII) также может быть получено, как показано на схеме 5. Схема 5 Тиол формулы (XXXI) может быть селективно окислен для получения диола формулы(XXXVII), обычно с использованием селективного окисляющего агента, такого как гипохлорит натрия, в присутствии каталитического количества свободного радикала 2,2,6,6-тетраметилпиперидинил-1-окси и иона брома (обеспечиваемого в виде бромида натрия, бромида калия или бромида тетраалкиламмония), или с использованием кислорода в присутствии платинового катализатора, в подходящем растворителе, таком как вода, ацетонитрил, дихлорметан,толуол или этилацетат, или в смеси органического растворителя и воды вместе с катализатором межфазного переноса, таким как бромид тетрабутиламмония, хлорид тетрабутиламмония или хлорид бензилтриэтиламмония. Диол формулы (XXXVII) может быть защищен подходящей защитной группой или подходящими защитными группам. Когда защитная группа представляет собой 1,1-диметилметилен,это достигается взаимодействием с ацетоном или производным ацетона в присутствии кислотного реагента. В типичной реакции диол взаимодействует с ацетоном или кеталем ацетона, таким как 2,2-диметоксипропан, или с комбинацией обоих, в присутствии кислоты, такой как хлористо-водородная кислота,птолуолсульфоновая кислота, метансульфоновая кислота, серная кислота, фосфорная кислота или трифторуксусная кислота, и в растворителе,таком как ацетон, толуол, дихлорметан или тетрагидрофуран, необязательно при повышенной температуре. Соединение формулы (XXI), где R5A представляет собой CONR14R14 может быть также получено, как показано на схеме 6. В типичном способе в соединении формулы (XXI), где R5A представляет собой CH2OR23,где R21-23 представляют собой подходящие защитные группы, такие как ацетил, снимают защитные группы в обычных условиях, таких как обработка основанием, таким как гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, этоксид натрия, метоксид натрия или трет-бутоксид калия, в подходящем спиртовом растворителе, необязательного в присутствии другого растворителя, такого как 1,2 диметоксиэтан, необязательно в присутствии воды и необязательно при повышенной температуре. Полученное соединение формулы(XXXVIII) может быть селективно защищено в обычных условиях. Когда R21 и R22, взятые вместе, представляют собой 1,1-диметилметилен,это осуществляют взаимодействием тиола с ацетоном или кеталем ацетона, таким как 2,2 диметоксипропан, или сочетанием обоих из них,в присутствии кислоты, такой как хлористоводородная кислота, п-толуолсульфоновая кислота, метансульфоновая кислота, серная кислота,фосфорная кислота или трифторуксусная кислота, и в растворителе, таком как ацетон, толуол,дихлорметан или тетрагидрофуран, необязательно при повышенной температуре.(XXI) может быть непосредственно преобразовано в соединение формулы (XXXIX) селективным ферментативным гидролизом, например, с использованием подходящего липазного фермента. Спирт формулы (XXXIX) может быть окислен до кислоты формулы (ХХХХ) с использованием условий, аналогичных описанным выше для преобразования соединения формулы(XXXII) в (XXXIII). Кислота формулы (ХХХХ) может быть преобразована в амид формулы (XXI) с использованием условий, аналогичных описанным выше для преобразования соединения формулы(XXXIII) в (XXXIV). 4. Соединение формулы (I), где Y представляет собой CS, может быть получено взаимодействием соединения формулы:Z5CSZ6 5 где каждый из Z и Z6 представляет собой подходящую уходящую группу, с соединением формулы (II) с последующим взаимодействием полученного промежуточного соединения формулыZ и Z , которые могут быть одинаковыми или различными, обычно выбирают из -S(C1C6 алкила) или 1 Н-имидазол-1-ила. 5. Соединение формулы (I), где Y представляет собой SO2, может быть получено взаимодействием соединения формулыR3R4NSO2Z7 (XXVII) 7 где Z представляет собой уходящую группу, с соединением формулы (II), необязательно в присутствии акцептора кислоты. Соединение формулы (XXVII) может быть получено обычными способами активации из соединения формулы(XXVIII) может быть получено взаимодействием хлорсульфоновой кислоты с амином формулыR3R4NH. 6. Соединение формулы (I), где Y представляет собой C=N(CN) может быть получено взаимодействием соединения формулыZ8C=N(CN)Z9 (XXIX) где каждый из Z8 и Z9 представляет собой уходящую группу, с соединением формулы (II) с 5 32 последующим взаимодействием полученного промежуточного соединения формулыZ и Z могут быть одинаковыми или различными, например, -S(C1-C6 алкил), предпочтительно -SCH3. В типичном способе раствор соединения формулы (II) в подходящем растворителе, таком как этанол, обрабатывают диметилцианотиоимидокарбаматом,предпочтительно при комнатной температуре. Когда реакция по существу завершается, добавляют амин формулы R3R4NH и для получения требуемого продукта реакционную смесь нагревают, предпочтительно при кипении с обратным холодильником. 7. Любое соединение формулы (I) может быть получено взаимодействием сложного эфира формулы (XIV) с амином формулыR15NH-X-NR2-Y-NR3R4 (XVIII) необязательно при повышенной температуре,необязательно в инертном растворителе, таком как 1,2-диметоксиэтан или 2-метоксиэтиловый простой эфир, и необязательно под давлением. Предпочтительно взаимодействие проводят в отсутствие растворителя при температуре 100120 С. Все указанные выше реакции и получения новых исходных веществ с использованием предшествующих способов являются обычными, и подходящие реагенты и реакционные условия для их осуществления или получения, а также методы выделения целевых продуктов будут хорошо известны специалистам в данной области со ссылкой на литературные прецеденты и приведенные примеры и получения. В частности, подходящие методы введения и снятия защитных групп хорошо известны в данной области, например, как описано в Greene et al.,"Protective Groups in Organic Synthesis", ThirdEdition, John WileySons Ltd. Фармацевтически приемлемая соль соединения формулы (I) легко может быть получена смешиванием вместе растворов соединения формулы (I) и требуемой кислоты или основания, по необходимости. Соль может осаждаться из раствора и быть собрана фильтрованием, или она может быть выделена упариванием растворителя. Противовоспалительные свойства соединений формулы (I) продемонстрированы посредством их способности ингибировать функцию нейтрофила, что указывает на агонистическую активность в отношении А 2 а рецептора. Эту величину оценивают путем определения 5 33 профиля соединения в анализе, где измеряют продуцирование супероксида из активированных fMLP нейтрофилов. Нейтрофилы выделяли из периферической крови человека с использованием седиментации декстраном с последующим центрифугированием в Ficoll-Hypaque растворе. Любые загрязняющие эритроциты в шарике гранулоцита удаляли лизисом с использованием ледяной дистиллированной воды. Супероксидное продуцирование из нейтрофилов индуцировали fMLP в присутствии первичной концентрации цитохалазина В. В анализ включали аденозин деаминазу для удаления любого эндогенно продуцируемого аденозина, который мог бы подавлять продуцирование супероксида. Действие соединения на fMLP-индуцированную ответную реакцию контролировали колориметрически по восстановлению цитохрома С в буфере для анализа. Эффективность соединений оценивали по концентрации, дающей 50%-ное ингибирование (IC50) по сравнению с контрольной ответной реакцией на fMLP. Соединения формулы (I) можно вводить сами по себе, но обычно их будут вводить в смеси с подходящим фармацевтическим эксципиентом, разбавителем или носителем, выбранным с учетом предполагаемого пути введения и в соответствии со стандартной фармацевтической практикой. Например, соединения формулы (I) можно вводить перорально, буккально или сублингвально в форме таблеток, капсул, мультигранул, гелей, пленок, покрытых оболочкой шариков, эликсиров, растворов или суспензий, которые могут содержать ароматизаторы или красители, для применений с немедленным, замедленным, модифицированным, продолжительным, импульсным или контролируемым высвобождением. Соединения формулы (I) также можно вводить в виде быстро-диспергируемых или быстрорастворимых препаративных лекарственных форм или в форме с высокой энергией высвобождения или в виде покрытых оболочкой частиц. Подходящие составы соединений формулы (I) могут быть, по желанию, в виде покрытой оболочкой или не покрытой оболочкой формы. Такие твердые фармацевтические композиции, например таблетки, могут содержать эксципиенты, такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция, двухосновный фосфат кальция, глицин и крахмал (предпочтительно кукурузный, картофельный или маниоковый крахмал), дезинтегрирующие агенты, такие как натрийкрахмалгликолят, кроскармеллоза натрия и некоторые комплексные силикаты, и гранулирующие связующие вещества, такие как поливинилпирролидон,гидроксипропилметилцеллюлоза(НРМС), гидроксипропилцеллюлоза (НРС), сахароза, желатин и гуммиарабик. Дополнительно в состав могут быть включены смазочные аген 004983 34 ты, такие как стеарат магния, стеарилфумарат натрия, лаурилсульфат натрия, стеариновая кислота, глицерилбегенат и тальк. Общие примеры Состав таблетки типично может содержать от 0,01 мг до 500 мг активного соединения, тогда как масса наполнителя таблетки может колебаться от 50 мг до 1000 мг. Пример состава для 10 мг таблетки проиллюстрирован ниже: Ингредиент мас.%/мас.% Соединение формулы (I) или соль 10,000 Лактоза 64,125 Крахмал 21,375 Кроскармеллоза натрия 3,000 Стеарат магния 1,500 Количество отрегулировано в соответствии с активностью лекарственного средства. Таблетки могут быть получены обычными способами, например, прямым прессованием или способами влажного или сухого гранулирования. Сердцевина таблеток может быть покрыта подходящей оболочкой. Твердые композиции подобного типа также можно использовать в качестве наполнителей в желатиновых или НРМС капсулах. Предпочтительные эксципиенты в таком отношении включают лактозу, крахмал, целлюлозу, молочный сахар или высокомолекулярный полиэтиленгликоль. Для водных суспензий и/или эликсиров соединения формулы (I) можно комбинировать с различными подсластителями или вкусовыми агентами, пигментами или красителями,с эмульгирующими и/или суспендирующими агентами и с разбавителями, такими как вода,этанол, пропиленгликоль или глицерин и их сочетаниями. Соединения формулы (I) также можно вводить парентерально, например, внутривенно,внутриартериально, внутрибрюшинно, интратекально (подоболочечно), внутривентрикулярно(внутрь желудочка), внутриматочно, внутричерепно, внутримышечно или подкожно, или их можно вводить путем инфузии или безиголочными способами инъекции. Для такого парентерального введения их лучше всего использовать в форме стерильного водного раствора, который может содержать другие вещества, например,сорастворитель и/или достаточное количество соли или глюкозы для создания раствора изотонического с кровью. Водный раствор, при необходимости, должен быть забуференным подходящим образом (предпочтительно до рН от 3 до 9). Получение подходящих парентеральных составов в стерильных условиях легко осуществимо с использованием стандартных фармацевтических методов, хорошо известных специалистам в данной области. Для перорального и парентерального введения пациентам-людям, дневной уровень дозировки соединений формулы (I) обычно будет составлять от 0,00001 до 100 мг/кг, предпочти 35 тельно от 0,0001 до 100 мг/кг (в виде единичной или разделенных доз). Таким образом, таблетки или капсулы соединения формулы (I) могут содержать от 0,01 до 500 мг активного соединения для единичного введения или за два или более раз по обстановке. Лечащий врач в любом случае будет определять фактическую дозировку, которая будет наиболее подходящей для каждого индивидуального пациента и будет изменяться в соответствии с возрастом, массой и ответной реакцией конкретного пациента. Указанные выше дозировки являются иллюстративными для усредненного случая. Конечно возможны индивидуальные исключения, когда предписываются более высокие или более низкие диапазоны дозировок, и они также входят в объем данного изобретения. Соединения формулы (I) также можно вводить внутриназально или путем ингаляции и их легко производят в виде ингалятора сухого порошка или в виде устройства подачи аэрозольного спрея из контейнера под давлением,насоса, распылителя, пульверизатора (предпочтительно электрогидродинамического пульверизатора, дающего мелкий туман) или аэрозольного ингалятора, с использованием или без использования подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана,такого как 1,1,1,2-тетрафторэтан, (HFA 134A(Perflubron (торговая марка или другого подходящего газа. В случае аэрозоля под давлением единичная препаративная лекарственная форма может определяться с помощью клапана, подающего определенное количество. Контейнер под давлением, насос, распылитель, пульверизатор или аэрозольный ингалятор могут содержать раствор или суспензию активного соединения, например, с использованием смеси с этанолом (необязательно с водным этанолом) или подходящим агентом для диспергирования, солюбилизации или расходуемого высвобождения и пропеллента в качестве растворителя, который может дополнительно содержать смазочное вещество, например триолеат сорбита. Для применения в ингаляторе или аппарате для вдувания могут быть разработаны капсулы, блистеры(пузыри) и ампулы (полученные, например, из желатина или НРМС), содержащие порошкообразную смесь соединения формулы (I), подходящей порошкообразной основы, такой как лактоза или крахмал, и модификатора производительности, такого как 1-лейцин, маннит или стеарат магния. Подходящий состав раствора для применения в электрогидродинамическом пульверизаторе для получения мелкого тумана может со 004983(I) или его соли и действующий объем может изменяться от 1 до 100 мкл. Обычный состав может включать соединение формулы (I) или его соль, пропиленгликоль, стерильную воду,этанол и хлорид натрия. Аэрозоли или составы сухих порошков предпочтительно составляют таким образом,чтобы каждая отмеренная доза или выдуваемое облако содержало от 1 до 4000 мкг соединения формулы (I) для доставки пациенту. Суммарная дневная доза при использовании аэрозоля, которую можно вводить в течение дня в виде единичной дозы или, более обычно, в виде разделенных доз, будет колебаться от 1 мкг до 20 мг. Альтернативно, соединения формулы (I) можно вводить в виде суппозиториев или пессариев, или их можно использовать для наружного применения в виде лосьона, раствора, крема,мази или опудривающего средства. Соединения формулы (I) также можно вводить на поверхность кожи или чрескожно, например, при использовании пластыря для кожи. Также их можно вводить легочным, вагинальным или ректальным путями. Для наружного применения на коже соединения формулы (I) могут быть введены в состав подходящей мази, содержащей активное соединение, суспендированное или растворенное, например, в смеси с одним или несколькими, выбранными из минерального масла, жидкого вазелина, белого вазелина, пропиленгликоля,полиоксиэтилен-полиоксипропиленового соединения, эмульгирующего воска и воды. Альтернативно, они могут быть введены в состав подходящего лосьона или крема, суспендированные или растворенные, например, в смеси с одним или несколькими из следующего: минеральное масло, сорбитанмоностеарат, полиэтиленгликоль, жидкий парафин, полисорбат 60,цетиловые сложноэфирные воски, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и вода. Соединения формулы (I) также можно использовать в сочетании с циклодекстрином. Известно, что циклодекстрины образуют комплексы включения и не-включения с молекулами лекарственных средств. Образование комплекса лекарственное средство-циклодекстрин может модифицировать такие свойства молекулы лекарственного средства как растворимость, скорость растворения, биодоступность и /или стабильность. Комплексы лекарственное средствоциклодекстрин обычно используют для большинства препаративных лекарственных форм и путей введения. В качестве альтернативы непосредственному комплексообразованию с лекарственным средством циклодекстрин можно использовать в качестве вспомогательной добавки,например, в качестве носителя, разбавителя или солюбилизатора. Наиболее часто используют альфа-, бета- и гамма-циклодекстрины и подхо 37 дящие примеры описаны в WO-A-91/11172,WO-A-94/02518 и WO-A-98/55148. Следует понимать, что все приведенные в данном описании ссылки на лечение включают в себя лечебное, паллиативное и профилактическое лечение. Таким образом, изобретение относится к:(i) соединению формулы (I) или его фармацевтически приемлемой соли или сольвату;(ii) способу получения соединения формулы (I) или его фармацевтически приемлемой соли или сольвата;(iii) фармацевтической композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль или сольват,вместе с фармацевтически приемлемым эксципиентом, разбавителем или носителем;(iv) соединению формулы (I) или его фармацевтически приемлемой соли, сольвату или композиции для применения в качестве лекарственного средства;(v) применению соединения формулы (I) или его фармацевтически приемлемой соли,сольвата или композиции для получения лекарственного средства, обладающего агонистической активностью по отношению к А 2 а рецептору;(vi) применению соединения формулы (I) или его фармацевтически приемлемой соли,сольвата или композиции для получения противовоспалительного агента;(vii) применению соединения формулы (I) или его фармацевтически приемлемой соли,сольвата или композиции для получения лекарственного средства для лечения заболеваний дыхательных путей;(viii) применение аналогично (vii), где заболевание выбирают из группы, состоящей из синдрома дыхательной недостаточности у взрослых (ARDS), бронхита, хронического бронхита, хронического обструктивного заболевания легких, фиброзно-кистозной дегенерации,астмы, эмфиземы, бронхоэктаза, хронического синусита и ринита;(ix) применению соединения формулы (I) или его фармацевтически приемлемой соли,сольвата или композиции для получения лекарственного средства для лечения септического шока, мужской эректильной дисфункции, мужского фактора бесплодия, женского фактора бесплодия, гипертензии (повышенного кровяного давления), инсульта, эпилепсии, церебральной ишемии, периферических сосудистых заболеваний, постишемического реперфузионного повреждения, диабета, ревматоидного артрита,рассеянного склероза, псориаза, дерматита, аллергического дерматита, экземы, язвенного колита, болезни Крона, воспалительного заболевания кишечника, вызванного Heliobacter pylori гастрита, вызванного не-Heliobacter pylori гастрита, повреждения желудочно-кишечного тракта или психотического заболевания, вызванного 38 нестероидными противовоспалительными лекарственными средствами, или для заживления ран;(х) способу лечения млекопитающего,включая человека, агонистом А 2 а рецептора,включающий обработку указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой если, сольвата или композиции;(xi) способу лечения млекопитающего,включая человека, для лечения воспалительного заболевания, включающий обработку указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или композиции;(xii) способу лечения млекопитающего,включая человека, для лечения заболевания дыхательных путей, включающий обработку указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или композиции;(xiii) способу аналогично (xii), где заболевание выбирают из группы, состоящей из синдрома дыхательной недостаточности у ззрослых(ARDS), бронхита, хронического бронхита, хронического обструктивного заболевания легких,фиброзно-кистозной дегенерации, астмы, эмфиземы, бронхоэктаза, хронического синусита и ринита;(xiv) способу лечения млекопитающего,включая человека, для лечения септического шока, мужской эректильной дисфункции, мужского фактора бесплодия, женского фактора бесплодия, гипертензии (повышенного кровяного давления), инсульта, эпилепсии, церебральной ишемии, периферических сосудистых заболеваний, постишемического реперфузионного повреждения, диабета, ревматоидного артрита,рассеянного склероза, псориаза, дерматита, аллергического дерматита, экземы, язвенного колита, болезни Крона, воспалительного заболевания кишечника, вызванного Heliobacter pylori гастрита, вызванного нe-Heliobacter pylori гастрита, повреждения желудочно-кишечного тракта или психотического заболевания, вызванного нестероидными противовоспалительными лекарственными средствами, или для заживления ран, включающий обработку указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или композиции; и(xv) некоторым новым промежуточным соединениям, раскрытым в данном описании. 3 следующих далее примерах и получениях ТГФ означает терагидрофуран, ДМСО означает диметилсульфоксид и ТСХ означает тонкослойную хроматографию. Следующие примеры иллюстрируют получение соединений формулы (I):N-(2-Аминоэтил)-6-[(2,2-дифенилэтил) амино]-9-(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил-9 Нпурин-2-карбоксамид (получение 10) (90 мг,0,15 ммоль) и N-[2-(1-пиперидинил)этил]-1 Нимидазол-1-карбоксамид (получение 18) (36 мг,0,16 ммоль) растворяли в дихлорметане (3 мл). Добавляли толуол (4 мл) и изопропанол (1 мл) и дихлорметан удаляли упариванием при атмосферном давлении. Оставшийся раствор нагревали при кипении с обратным холодильником в течение четырех часов. ТСХ-анализ показал, что реакция не прошла полностью, поэтому дополнительно добавлялиN-[2-(1-пиперидинил) этил]-1 Н-имидазол-1-карбоксамид (25 мг, 0,11 ммоль) и нагревание продолжали в течение четырех часов. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметан : метанол : концентрированный водный аммиак (90:10:1, по объему). Фракции, содержащие продукт, упаривали и полученное твердое вещество растирали с диэтиловым эфиром, фильтровали и сушили, получая указанное в заголовке соединение в виде белого порошка (60 мг). 1 Н-ЯМР (400 МГц, CDCl3) : 8,20 (1 Н, с),7,35-7,20 (10 Н, м), 5,90 (1 Н, м), 4,90-4,60 (4 Н,м), 4,40 (2 Н, м), 3,60-3,00 (8 Н, м), 2,45-2,25 (6 Н,м) , 1,60-1,40 (6 Н, м), 1,00 (3 Н, т). 40 мг, 0,17 ммоль) растворяли в дихлорметане (3 мл). Добавляли толуол (4 мл) и изопропанол (1 мл) и дихлорметан удаляли упариванием при атмосферном давлении. Оставшийся раствор затем нагревали при кипении с обратным холодильником в течение четырех часов. ТСХанализ показал, что реакция прошла не полностью, поэтому дополнительно добавляли N-[2(диизопропиламино)этил]-1 Н-имидазол-1-карбоксамид (30 мг, 0,13 ммоль) и нагревание продолжали дополнительно в течение четырех часов. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметан : метанол : концентрированный водный аммиак (90:10:1, по объему), получая указанное в заголовке соединение в виде белого твердого вещества (60 мг). 1 Н-ЯМР (400 МГц, CDCl3+CD3OD) : 8,15N-(2-Аминоэтил)-9-[(2R,3R,4S,5R)-3,4 дигидрокси-5-(гидроксиметил)тетрагидро-2 фуранил]-6-[(2,2-дифенилэтил)амино]-9 Нпурин-2-карбоксамид (получение 17) (90 мг,0,17 ммоль) и N-[2-(1-пиперидинил)этил]-1 Нимидазол-1-карбоксамид (получение 18 ) (40 мг,0,18 ммоль) растворяли в смеси толуола (4 мл) и изопропанола (1 мл) и раствор нагревали при кипении с обратным холодильником в течение четырех часов. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметан : метанол : концентрированный водный аммиак (85:15:1,5, по объему). Фракции, содержащие продукт, упаривали и полученное твердое веществе растирали с диэтиловым эфиром, фильтровали и сушили, получая указанное в заголовке соединение в виде белого порошка (85 мг). 1 Н-ЯМР (400 МГц, CDCl3+CD3OD ) : 7,95N-(2-Аминоэтил)-9-[(2R,3R,4S,5R)-3,4 дигидрокси-5-(гидроксиметил)тетрагидро-2 фуранил]-6-[(2,2-дифенилэтил)амино]-9 Нпурин-2-карбоксамид (получение 17) (90 мг,0,17 ммоль) и N-[2-(диизопропиламино)этил]1 Н-имидазол-1-карбоксамид (получение 19) (50 мг, 0,19 ммоль) растворяли в смеси толуола (4 мл) и изопропанола (1 мл) и раствор нагревали при кипении с обратным холодильником в течение четырех часов. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметан : метанол : концентрированный водный аммиак (85:15:1,5, по объему). Фракции, содержащие продукт, упаривали и полученное твердое вещество растирали с диэтиловым эфиром, фильтровали и сушили, получая указанное в заголовке соединение в виде белого порошка (85 мг). 1LRMS (термораспыление): m/z [MH+] 778. Примеры 9-27. Соединения следующих приведенных в таблицах примеров были получены способом,аналогичным способу примера 1, с использованием подходящих амина и имидазолина в качестве исходных веществ. В табл. 1 приведены структуры соединений, а в табл. 2 - аналитические данные для каждого соединения. Термин "н-Bu" в табл. 1 означает н-бутил. Исходный имидазолид для примеров 13, 24 и 25 может быть получен способом, описанным в Monatsh. Chem., 88, 35 (1957). Исходный имидазолид для примеров 14 и 26 может быть получен так, как описано в J. Chem. Soc. Perkin Trans. 1, 11, 1205 (1996). Исходный имидазолид для примера 15 может быть получен так, как описано в Justus 48 получая целевое соединение в виде белого твердого вещества, (0,1 г, 35%). 1 Н-ЯМР (400 МГц, CD3OD) : 8,25 (1 Н, с),7,30-7,10 (10 Н, м) , 5,95 (1 Н, м), 4,70 (1 Н, м),4,45 (2 Н, м), 4,30-4,10 (4 Н, м), 3,70-3,40 (4 Н, м),3,30-3,00 (7 Н, м), 2,50 (2 Н, м), 2,20 (2 Н, м), 1,80(106 мг, 0,41 ммоль), гидрохлорида 1-(3 диметиламинопропил)-3-этилкарбодиимида (79 мг, 0,41 ммоль) и 1-гидроксибензотриазола (5 мг, 0,037 ммоль) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение 14 часов. Добавляли воду (1 мл) и отделяли органический слой. Водную фазу еще экстрагировали дихлорметаном (2 х 1 мл) и объединенные экстракты сушили над безводным сульфатом магния. Растворитель упаривали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, элюируя с использованием градиентной системы дихлорметан:метанол:концентрированный водный аммиак (90:10:1, по объему), заменяя на смесь дихлорметан : метанол : концентрированный водный аммиак (80:20:1, по объему). После упаривания подходящих фракций остаток растирали с диэтиловым эфиром, фильтровали и сушили, Получали из 6-[(2,2-дифенилэтил)амино]9-(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4 дигидрокситетрагидро-2-фуранил-9 Н-пурин-2 карбоновой кислоты (получение 39) и N-[2(диизопропиламино)этил]-N'-[(3S)-пирролидинил]мочевины (получение 45) с использованием такого же способа, как в примере 28. Указанное в заголовке соединение получали в виде белого порошка. 1 Н-ЯМР (400 МГц, CD3OD) : 8,25 (1 Н, с),7,30-7,10 (10 Н, м), 5,95 (1 Н, м), 4,70 (1 Н, м), 4,45(5 мл) подвергали карбонилированию при 60 С и 345 КПа в атмосфере монооксида углерода в течение 14 ч. ТСХ-анализ показал наличие це 49 левого продукта наряду с веществом, частично утратившим защитные группы. Для достижения полного удаления защитных бензоатных групп растворитель упаривали при пониженном давлении, остаток растворяли в метаноле (10 мл),добавляли карбонат натрия (10 мг) и смесь оставляли перемешиваться при комнатной температуре в течение 24 ч. Растворитель опять упаривали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, элюируя с использованием градиентной системы дихлорметан:метанол (90:10, по объему), изменяя на смесь дихлорметан :метанол: концентрированный водный аммиак (90:10:1, по объему). После упаривания подходящих фракций остаток растирали с диэтиловым эфиром,фильтровали и сушили, получая целевое соединение в виде белого твердого вещества, (0,11 г,61%). 1 Н-ЯМР (400 МГц, CD3OD) : 8,40 (1 Н, с),7,20-7,10 (6 Н, м), 6,95 (2 Н, м), 6,10 (1 Н, м), 4,454,35 (4 Н, м) , 3,55-3,00 (10 Н, м), 2,55 (2 Н, м),2,30 (6 Н, с), 1,10-0,90 (15 Н, м).N-(2-аминоэтил)-N'-[2-(диизопропиламино) этил]мочевины (получение 52) способом, аналогичным описанному в примере 30. Целевое соединение получали в виде белого твердого вещества. 1 Н-ЯМР (400 МГц, CD3OD) : 8,40 (1 Н, с),7,45-7,15 (6 Н, м) , 6,10 (1 Н, м), 4,50-4,40 (4 Н, м),3,60-3,20 (6 Н, м), 3,05 (2 Н, м), 2,90 (2 Н, м), 2,45N-(2-аминоэтил)-N'-[2-(1-пиперидинил)этил] мочевины (получение 53) способом, аналогичным описанному в примере 30. Целевое соединение получали в виде белого твердого вещества. 1 Н-ЯМР (400 МГц, CD3OD) : 8,40 (1 Н,ушир.с), 7,45-7,10 (8 Н, м), 6,10 (1 Н, д), 4,50-4,35N-(2-аминоэтил)-N'-[2-(1-пиперидинил)этил] мочевины (получение 53) способом, аналогичным описанному в примере 30. Целевое соединение получали в виде белого твердого вещества. 1 Н-ЯМР (400 МГц, CD3 ОD) : 8,40 (1 Н,ушир.с), 7,20-7,10 (6H, м), 6,95 (2 Н, м), 6,10 (1 Н,д), 4,45-4,30 (4 Н, м), 3,55-3,20 (8 Н, м), 2,80-2,60 Раствор бензил 4-[([(2-[(6-[(2,2-дифенилэтил)амино]-9-(2R,3R,4S,5S)-5-[(этиламино) карбонил]-3,4-дигидрокситетрагидро-2-фуранил-9 Н-пурин-2-ил)карбонил]аминоэтил) амино]карбониламино)метил]бензоата (получение 55) (150 мг, 0,18 ммоль) в этаноле (10 мл) гидрировали при комнатной температуре над 10% мас./мас., палладием-на-углероде (30 мг) в течение 28 ч при 414 КПа. Катализатор удаляли фильтрованием через арбоцель (Arbocel, торговая марка) и растворитель упаривали при пониженном давлении, получая указанное в заголовке соединение в виде белого порошка (26 мг). 1 Н-ЯМР (400 МГц, CD3OD) : 8,40 (1 Н, с),7,80 (2 Н, д), 7,40 (4 Н, м), 7,25 (6 Н, м), 7,15 (2 Н,м), 6,10 (1 Н, м), 4,80 (1 Н, м), 4,50-4,30 (5 Н, м),3,60-3,40 (4 Н, м), 3,40-3,20 (2 Н, м), 1,05 (3 Н, т).[3,4-d][1,3]диоксол-4-ил-6-[(2,2-дифенилэтил) амино]-N-2-[([1-(2-пиридинил)-4-пиперидинил]аминокарбонил)амино]этил-9 Н-пурин-2 карбоксамида (получение 71) (20,9 г, 0,0255 моль) в абсолютном этаноле (200 мл) добавляли водную хлористо-водородную кислоту (76,5 мл 1 М раствора, 0,0765 моль) и полученный раствор нагревали при 60-65 С в течение 24 ч. Реакционную смесь оставляли охлаждаться до температуры окружающей среды и осторожно добавляли насыщенный водный раствор бикарбоната натрия (200 мл). Полученную смесь затем концентрировали в вакууме и затем водную смесь экстрагировали этилацетатом (200 мл), а затем дихлорметаном (200 мл). Экстракты сушили над безводным сульфатом магния, который вызывал осаждение смолы, которую повторно растворяли путем добавления дихлорметана (100 мл) и метанола (20 мл). Полученный фиолетовый раствор затем концентрировали в вакууме, получая неочищенный продукт в виде пурпурной пены (20,86 г), которую очищали 52 флэш-хроматографией на силикагеле (600 г),элюируя с использованием градиентной системы, начиная от 6% об./об. метанола в дихлорметане, изменяя на 8% об./об. метанол в дихлорметане, изменяя на 10% об./об. метанол в дихлорметане, изменяя на 15% об./об. метанол в дихлорметане, получая указанное в заголовке соединение в нескольких фракциях с различной степенью чистоты. Основную фракцию (11,4 г) растворяли в дихлорметане (264 мл) и фильтровали для удаления нерастворившегося вещества. К данному раствору добавляли диэтиловый эфир (112 мл) и полученную мутную смесь перемешивали при температуре окружающей среды в течение 1 ч. Твердые вещества затем собирали фильтрованием и сушили в вакууме. Данное вещество затем измельчали с помощью пестика и ступки и сушили дополнительно в вакууме при 50, получая указанное в заголовке соединение (9,9 г) в виде тонкоизмельченного бесцветного порошка.LRMS (положительная химическая ионизация при атмосферном давлении): m/z [МН+] 778, 1 Н-ЯМР (600 МГц, d6-ДМСО, 30 С) : 8,80(1,8 Н, м), 7,84 (0,2 Н, ушир.с), 7,50-7,30 (5 Н, м),7,26 (4 Н, т), 7,14 (2 Н, т), 6,75 (1 Н, д), 6,56 (1 Н,дд), 6,11-5,82 (3 Н, м), 5,65 (1 Н, д), 5,57 (0,2 Н,ушир.с), 5,53 (0,8 Н, д), 4,72 (0,2 Н, ушир.с), 4,684,50 (2,2 Н, м), 4,36-4,21 (2,8 Н, м), 4,17 (0,8 Н,ушир.с), 4,04 (2 Н, ушир.д), 3,67-3,55 (1 Н, м),3,40-3,10 (6 Н, м (частично неясный за счет сигнала воды, 2,91 (0,4 Н, ушир.с), 2,81 (1,6 Н,ушир.т), 1,74 (2 Н, ушир. д), 1,30-1,16 (2 Н, м),0,98 (3 Н,т). Регистрация спектра 1 Н-ЯМР при 70 С приводит к исчезновению сигналов, присущих для наблюдавшимся при 30 С нескольким конформерам. В следующих получениях описан синтез некоторых промежуточных соединений, использованных в предшествующих примерах. Получение 1. 2,6-Дихлор-9-(тетрагидро 2 Н-пиран-2-ил)-9 Н-пурин. 2, 6-Дихлор-9 Н-пурин (20 г, 0,11 моль) и моногидрат 4-толуолсульфоновой кислоты (0,2 г) растворяли в этилацетате (300 мл), смесь нагревали до 50 С и медленно добавляли в течение 30 мин раствор 3,4-дигидро-2 Н-пирана (12,6 мл, 0,14 моль) в этилацетате (50 мл). Реакционную смесь охлаждали до комнатной температуры, добавляли воду (100 мл) и рН раствора доводили до 7 добавлением насыщенного водного раствора гидрокарбоната натрия. Органический слой отделяли, промывали последовательно водой и насыщенным раствором соли, сушили над безводным сульфатом магния, фильтровали 53 и растворитель удаляли при пониженном давлении. Остаток подвергали азеотропной отгонке с пентаном (х 2), получая указанное в заголовке соединение в виде слегка загрязненного белого твердого вещества (30,9 г). 1N-этил-N-изопропил-2 пропанамином (47,5 мл, 0,27 моль) и 2,2 дифенилэтиламином (24,8 г, 0,13 моль) и полученную смесь нагревали при кипении с обратным холодильником в течение 3 ч. Растворитель удаляли при пониженном давлении и остаток подвергали азеотропной отгонке с этилацетатом. Остаток очищали колоночной хроматографией на силикагеле, элюируя с использованием градиентной системы этилацетат : гексан (40:60,по объему), изменяя постепенно до смеси этилацетат:гексан (60:40, по объему), получая указанное в заголовке соединение в виде пены (49,7 г). 1 Н-ЯМР (400 МГц, CDCl3) : 7,95-7,75(получение 2) (49,7 г, 0,11 моль) в сухом N,Nдиметилформамиде (200 мл) обрабатывали тиометоксидом натрия (10 г, 0,14 моль) и полученную смесь нагревали в атмосфере азота при 100 С в течение 90 мин. Смесь перемешивали при комнатной температуре в течение 72 ч и затем нагревали дополнительно при 100 С в течение 2 ч. Реакционную смесь охлаждали и разбавляли водой (1000 мл). Образующуюся при этом суспензию экстрагировали диэтиловым 54 эфиром (х 2). Объединенные органические слои промывали последовательно водой и насыщенным раствором соли, сушили над безводным сульфатом магния, фильтровали и растворитель удаляли при пониженном давлении. Остаток подвергали азеотропной отгонке с диэтиловым эфиром, а затем с пентаном, получая указанное в заголовке соединение в виде пены (48,9 г). 1 Н-ЯМР (400 МГц, CDCl3) : 7,80 (1 Н, с),7,20-7,10 (10 Н, м), 5,70-5,55 (2 Н, д), 4,40-4,20(пероксимоносульфат калия) (44 г, 71,7 ммоль) в воде (200 мл) добавляли по каплям в течение 2 ч к растворуN(2,2-дифенилэтил)-2(метилсульфанил)-9-(тетрагидро-2 Н-пиран-2 ил)-9 Н-пурин-6-амина (получение 3) (25 г, 56,2 ммоль) и гидрокарбоната натрия (20 г, 238 ммоль) в ацетоне (1000 мл) и воде (250 мл). Полученную смесь перемешивали при комнатной температуре в течение 24 ч, фильтровали и остаток промывали ацетоном. Ацетон удаляли из фильтрата при пониженном давлении и полученный водный остаток экстрагировали этилацетатом и затем дихлорметаном. Объединенные органические слои промывали насыщенным раствором соли, сушили безводным сульфатом магния, фильтровали и растворитель удаляли при пониженном давлении. Остаток растирали с диэтиловым эфиром, фильтровали, промывали диэтиловым эфиром и пентаном и затем сушили, получая указанное в заголовке соединение в виде белого твердого вещества (20,32 г). 1 Н-ЯМР (400 МГц, CDCl3) : 8,00 (1 Н, с),7,35-7,15 (10 Н, м) , 6,05-5,95 (1 Н, ушир.с), 5,75 55 Раствор N-(2, 2-дифенилэтил)-2-(метилсульфонил)-9-(тетрагидро-2 Н-пиран-2-ил)-9 Нпурин-6-амина (получение 4) (20,1 г,- 42,1 ммоль) в сухом N,М-диметилформамиде (100 мл) обрабатывали цианидом калия (5,5 г, 84,6 ммоль) и смесь нагревали при 120 С в течение 24 ч в атмосфере азота. Смесь охлаждали до комнатной температуры, выливали в воду (1000 мл) и перемешивание продолжали дополнительно в течение 1 ч. Полученное твердое вещество отфильтровывали и промывали несколько раз водой. Затем твердые вещества растворяли в дихлорметане и раствор промывали водой, сушили безводным сульфатом магния, фильтровали и растворитель удаляли при пониженном давлении. Остаток подвергали азеотропной отгонке с диэтиловым эфиром (дважды). Получая указанное в заголовке соединение в виде масла Раствор 6-[(2,2-дифенилэтил)амино]-9(тетрагидро-2 Н-пиран-2-ил)-9 Н-пурин-2-карбонитрила (получение 5) (17 г, 40,1 ммоль) в этаноле (850 мл) обрабатывали 2 н. водной хлористо-водородной кислотой (50 мл) и смесь перемешивали при комнатной температуре в течение 24 ч. Растворитель удаляли при пониженном давлении, остаток растворяли в этаноле и растворитель опять удаляли при пониженном давлении. Остаток растирали с диэтиловым эфиром, фильтровали, промывали диэтиловым эфиром и пентаном и сушили, получая указанное в заголовке соединение в виде твердого вещества 56 метаноле (300 мл) нагревали при кипении с обратным холодильником в течение 24 ч. Дополнительно добавляли метоксид натрия (2,0 г, 37 ммоль) и метанол (100 мл) и нагревание продолжали дополнительно в течение 24 ч. Реакционную смесь оставляли охлаждаться и растворитель удаляли при пониженном давлении. Остаток растворяли в тетрагидрофуране (ТГФ)(375 мл), добавляли 2 н. водную хлористоводородную кислоту (125 мл) и смесь перемешивали при комнатной температуре в течение 24 ч. ТГФ удаляли при пониженном давлении и суспензию подщелачивали до рН 7 насыщенным водным раствором бикарбоната натрия. Добавляли этилацетат (100 мл) и белое твердое вещество, предсталяющее собой главным образом целевой продукт, отфильтровывали, промывали небольшим количеством воды и этилацетатом и сушили. Очистка колоночной хроматографией на силикагеле, при элюировании с использованием градиентной системы, начиная от смеси дихлорметан:метанол (90:10, по объему) и постепенно изменяя до смеси дихлорметан:метанол (75:25, по объему), давала указанное в заголовке соединение в виде белого твердого вещества, 1,25 г (25%). Упариванием этилацетатного фильтрата получали 2,6 г исходного вещества. 1 Н-ЯМР (400 МГц, CDC13) : 12,40 (1 Н,ушир.с), 8,05 (1 Н, с), 7,55 (1 Н, с), 7,30-7,20 (10 Н,м), 4,80 (2 Н, м), 4,75 (1 Н, м), 3,80 (3 Н, с) .(440 мг, 1,18 ммоль) в 1,1,1-трихлорэтане (25 мл) обрабатывали N,О-бис(триметилсилил)ацетамидом (1,7 мл, 6,95 ммоль). Смесь нагревали при кипении с обратным холодильником в течение одного часа. Раствор оставляли охлаждаться до комнатной температуры и растворитель удаляли при пониженном давлении. Остаток обрабатывали раствором (2S,3S,4R,5R)- и (2S,3S,4R,5S)-5-(ацетилокси)-4-(бензоилокси)-2-[(этиламино)карбонил]тетрагидро-3-фуранилбензоатом (получение 14) (620 мг, 1,4 ммоль) в безводном толуоле (25 мл) и затем триметилсилилтрифторметансульфонатом (0,26 мл, 1,42 57 ммоль). Полученный раствор затем нагревали при 110 С в атмосфере азота в течение 2,5 ч. Смесь охлаждали до комнатной температуры,разбавляли этилацетатом (200 мл) и промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой отделяли, сушили над безводным сульфатом магния, фильтровали и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, с использованием градиентного элюирования первоначально смесью дихлорметан : этилацетат (5:1, по объему), затем дихлорметан : этилацетат (1:1, по объему), получая указанное в заголовке соединение в виде пены (540 мг, 60%). 1 Н-ЯМР (400 МГц, CDC13) : 8,10 (3 Н, м),7,80 (2 Н, д), 7,60 (1 Н, м), 7,50-7,40 (4 Н, м), 7,357,20 (16 Н, м), 6,40 (1 Н, м), 6,20 (2 Н, м), 5,90 (1 Н, м), 4,90 (1 Н, д), 4,40 (3 Н, м), 4,00 (3 Н, с), 3,55 Раствор метил 9-(2R,3R,4R,5S)-3,4 бис(бензоилокси)-5-[(этиламино)карбонил]тетрагидро-2-фуранил-6-[(2,2-дифенилэтил)амино]-9 Н-пурин-2-карбоксилата (получение 8) (3,4 г, 4,5 ммоль) и карбоната натрия (50 мг) в сухом метаноле (60 мл) перемешивали при комнатной температуре в течение четырех часов. Растворитель удаляли при пониженном давлении и остаток помещали в смесь дихлорметан:метанол(95:5, по объему, 60 мл). Неорганические соли отфильтровывали и фильтрат упаривали при пониженном давлении. Остаток растирали с диэтиловым эфиром, фильтровали и сушили,получая указанное в заголовке соединение в виде белого твердого вещества, (2,4 г, 98%). 1 Н-ЯМР (400 МГц, ДМСО-d6) : 8,60 (1 Н,м), 8,15 (2 Н, ушир.с), 7,40-7,15 (10 Н, м), 6,00 Смесь метил 6-[(2, 2-дифенилэтил)амино]9-(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4 дигидрокситетрагидро-2-фуранил-9 Н-пурин-2 карбоксилата (получение 9) (1,1 г, 2 ммоль) и 1,2-этилендиамина (1,1 г, 18,3 ммоль) нагревали при 105 С в течение 2,5 ч. Смесь растворяли в небольшом количестве дихлорметана и очищали колоночной хроматографией на силикагеле,элюируя смесью дихлорметан : метанол : концентрированный водный аммиак (85:15:1,5, по объему). После упаривания подходящих фракций остаток растирали с диэтиловым эфиром,фильтровали и сушили, получая целевое соединение в виде белого твердого вещества, (0,99 г,86%). 1 Н-ЯМР (400 МГц, CDCl3) : 8,75 (1 Н,ушир.с), 8,60 (1 Н, ушир.с), 7,50 (1 Н, ушир.с),7,40-7,20 (10 Н, м), 6,90 (1 Н, д), 6,10 (1 Н,ушир.с), 5,05 (1H, с), 4,55 (1H, с), 4,45-4,20 (4H,м), 3,50-3,35 (4 Н, м), 2,95 (2 Н, т), 1,25 (3 Н, т).Amer. Chem. Soc, 80, 5168-5173 (1958 (23,30 г,107 ммоль) в безводном дихлорметане (120 мл) и N,N-диметилформамиде (2 капли) добавляли по каплям оксалилхлорид (14,0 мл, 160 ммоль) и смесь перемешивали при комнатной температуре в течение 3 ч до прекращения выделения газа. ТСХ-анализ показал, что некоторое количество исходного вещества все еще оставалось в реакционной смеси, поэтому добавляли дополнительно N,N-диметилформамид (2 капли) и перемешивание продолжали в течение 1 ч. Растворитель удаляли при пониженном давлении и остаток подвергали азеотропной отгонке с безводным дихлорметаном (х 2). Остаток растворяли в безводном дихлорметане (200 мл) и раствор обрабатывали по каплям этиламином (2 М раствор в тетрагидрофуране, 140 мл, 280 ммоль). Данный раствор оставляли на 48 ч при комнатной температуре. Добавляли диэтиловый эфир(250 мл) и смесь перемешивали в течение 15 мин. Смесь фильтровали и растворитель удаляли из фильтрата при пониженном давлении. Ос 59 таток очищали колоночной хроматографией на силикагеле, элюируя с использованием градиентной системы, начиная от дихлорметана и изменяя постепенно на смесь дихлорметан:этилацетат (44:66, по объему), получая указанное в заголовке соединение в виде желтого твердого вещества (24,70 г). 1 Н-ЯМР (400 МГц, CDCl3) : 6,53 (1H,ушир.м), 5,12 (1H, дд) , 5,07 (1H, д), 4,60 (1H, д),4,54 (1H, дд), 3,46 (3 Н, с), 3,32 (2 Н, м), 1,51 (3 Н,с), 1,34 (3 Н, с), 1,15(3 Н,т).(2,50 г, 10 ммоль) в метаноле (500 мл) нагревали при кипении с обратным холодильником в течение 18 ч. ЯМР анализ показал, что некоторое количество исходного вещества все еще оставалось в реакционной смеси и поэтому растворитель удаляли при пониженном давлении. Остаток растворяли в метаноле (500 мл) и нагревали при кипении с обратным холодильником в течение 8 ч. ЯМР анализ показал, что некоторое количество исходного вещества все еще оставалось в реакционной смеси и поэтому растворитель удаляли при пониженном давлении, остаток растворяли в метаноле (500 мл) и нагревание при кипении с обратным холодильником продолжали в течение 24 ч. Растворитель удаляли при пониженном давлении и остаток подвергали азеотропной отгонке с дихлорметаном Раствор хлористого бензоила (30,0 мл, 259 ммоль) в дихлорметане (100 мл) медленно добавляли к раствору (2S,3S,4R,5R)- и (2S,3S, 004983(20,50 г, 100 ммоль) и пиридина (33,0 мл, 409 ммоль) в дихлорметане (400 мл) и полученную смесь перемешивали при комнатной температуре в течение 18 ч. Растворитель удаляли при пониженном давлении и остаток распределяли между диэтиловым эфиром и водной хлористоводородной кислотой (1 М, 300 мл). Слои разделяли и водный слой повторно экстрагировали диэтиловым эфиром. Органические слои объединяли, промывали последовательно водой и насыщенным раствором соли, сушили над безводным сульфатом магния, фильтровали и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя с использованием градиентной системы дихлорметан:диэтиловый эфир (95:5, по объему), постепенно изменяя на смесь дихлорметан:диэтиловый эфир (80:20, по объему), получая указанное в заголовке соединение в виде масла и в виде смеси аномеров Раствор (2S,3S,4R,5R)- и (2S,3S,4R,5S)-4(бензоилокси)-2-[(этиламино)карбонил]-5 метокситетрагидро-3-фуранилбензоата (получение 13) (37,0 г, 89,6 ммоль) в смеси уксусной кислоты (330 мл, 5,07 моль) и уксусного ангидрида (67 мл, 709 ммоль) охлаждали до -10 С,затем обрабатывали по каплям водной хлористо-водородной кислотой (12 н., 7,0 мл, 132 ммоль). Смесь перемешивали в течение 18 ч,давая возможность нагреваться за это время до комнатной температуры. После охлаждения смеси до 0 С, к ней медленно добавляли воду(3 х 500 мл). Органические слои объединяли,промывали последовательно водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, затем сушили над безводным сульфатом магния, фильтровали и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя с использованием градиентной системы, начиная от смеси диэтиловый эфир : пентан (66:44, по объему), и изме
МПК / Метки
МПК: C07H 19/167, A61K 31/70
Метки: производные, 2-аминокарбонил-9h-пурина
Код ссылки
<a href="https://eas.patents.su/30-4983-proizvodnye-2-aminokarbonil-9h-purina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2-аминокарбонил-9h-пурина</a>
Предыдущий патент: Производные пиразоло [4,3-d]пиримидина
Следующий патент: Способ стереоселективного синтеза циклических аминокислот
Случайный патент: Применение ингибиторов cyp2d6 в комбинированных способах лечения












