Производные пурина
Формула / Реферат
1. Соединение формулы
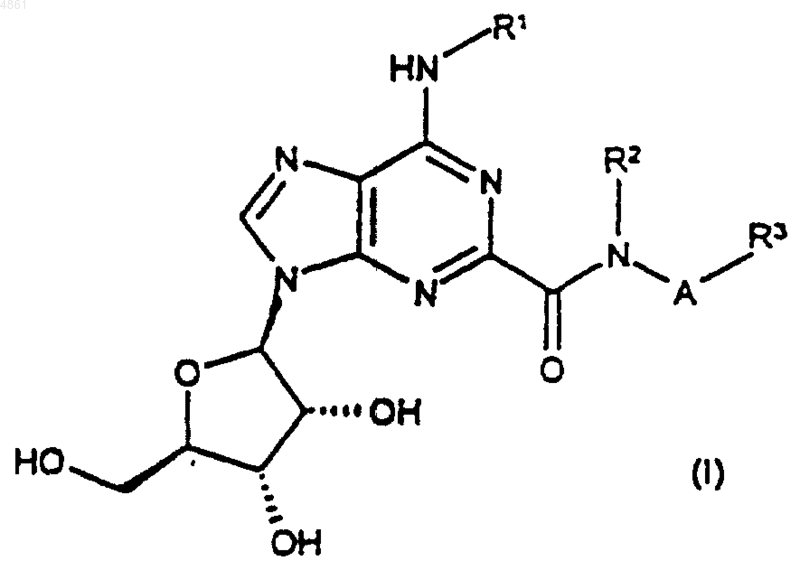
или его фармацевтически приемлемые соль или сольват,
где R1 представляет собой водород или C1-C6алкил, возможно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила, причем указанные фенил и нафтил возможно замещены C1-C6алкилом, C1-C6алкокси, галогено или циано;
R2 представляет собой H или C1-C6алкил;
A представляет собой C1-C6алкилен;
R3 представляет собой (1) водород, C1-C6алкил, -COOR4, -CN, -CONR4R4, C3-C8циклоалкил, фенил или нафтил, причем указанные C3-C8циклоалкил, фенил и нафтил возможно замещены C1-C6алкилом, фенилом, C1-C6алкокси(C1-C6)алкилом, R4R4N(C1-C6)алкилом, галогено(C1-C6)алкилом, фторо(C1-C6)алкокси, C2-C5алканоилом, галогено, -OR4, циано, -COOR4, C3-C8циклоалкилом, -S(O)mR5, -NR4R4, -SO2NR4R4, -CONR4R4, -NR4COR5 или -NR4SO2R5,
либо (2) если A представляет собой C2-C6алкилен, то -NR4R4, -OR4, -OCOR5, -SO2R5, -SO2NR4R4 или -NR4COR5,
либо (3) C-связанный 4-11-членный кольцевой моно- или бициклический гетероцикл, имеющий либо от 1 до 4 кольцевых атомов азота, либо 1 или 2 кольцевых атома азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы, причем указанный гетероцикл возможно C-замещен оксо, C1-C6алкокси(C1-C6)алкилом, R6R6N(C1-C6)алкилом, галогено(C1-C6)алкилом, фторо(C1-C6)алкокси, фторо(C2-C5)алканоилом, галогено, циано, -OR6, R7, -COR6, -NR6R6, -COOR6, -S(O)mR7, -SO2NR6R6, -CONR6R6, -NR6SO2R7 или -NR6COR7 и возможно N-замещен C1-C6алкокси(C1-C6)алкилом, R6R6N (C2-C6)алкилом, галогено(C1-C6)алкилом, фторо(C2-C5)алканоилом, R7, -COR6, -COOR7, -SO2R7, -SO2NR6R6 или -CONR6R6,
либо (4) если A представляет собой C2-C6алкилен, то N-связанный азетидинил, пирролидинил, пиперидинил, пиперазинил, гомопиперазинил или морфолинил, каждый из которых возможно C-замещен C1-C6алкилом, фенилом, C1-C6алкокси(C1-C6)алкилом, R4R4N(C1-C6)алкилом, галогено(C1-C6)алкилом, фторо(C1-C6)алкокси, C2-C5алканоилом, галогено, -OR4, циано, -COOR4, C3-C8циклоалкилом, -S(O)mR5, -NR4R4, -SO2NR4R4, -CONR4R4, -NR4COR5 или -NR4SO2R5, а указанные пиперазинил и гомопиперазинил возможно N-замещены C1-C6алкилом, фенилом, C1-C6алкокси(C2-C6)алкилом, R4R4N(C2-C6)алкилом, фторо(C1-C6)алкилом, C2-C5алканоилом, -COOR5, C3-C8циклоалкилом, -SO2R5, -SO2NR4R4 или -CONR4R4;
R4 представляет собой H, C1-C6алкил, C3-C8циклоалкил или фенил;
R5 представляет собой C1-C6алкил, C3-C8циклоалкил или фенил;
R6 представляет собой H, C1-C6алкил, C3-C8циклоалкил, фенил, нафтил или гет;
R7 представляет собой C1-C6алкил, C3-C8циклоалкил, фенил, нафтил или гет;
m равно 0, 1 или 2; и
"гет", используемый в определениях R6 и R7, обозначает C-связанный пирролил, имидазолил, триазолил, тиенил, фурил, тиазолил, оксазолил, тиадиазолил, оксадиазолил, пиридинил, пиримидинил, пиридазинил, пиразинил, индолил, изоиндолил, хинолинил, изохинолинил, бензимидазолил, хиназолинил, фталазинил, бензоксазолил или хиноксалинил, каждый из которых возможно замещен C1-C6алкилом, C1-C6алкокси, циано или галогено.
2. Соединение по п.1, где R1 представляет собой C1-C6алкил, возможно замещенный 1 или 2 фенильными заместителями.
3. Соединение по п.2, где R1 представляет собой 2,2-дифенилэтил.
4. Соединение по любому из пп.1-3, где R2 представляет собой H.
5. Соединение по любому из пп.1-4, где A представляет собой C1-C4алкилен.
6. Соединение по п.5, где A представляет собой метилен, 1,2-этилен или 1,3-пропилен.
7. Соединение по п.6, где A представляет собой 1,2-этилен.
8. Соединение по любому из пп.1-7, где R3 представляет собой фенил, возможно замещенный, как определено для этого определения в п.1; либо, если A представляет собой C2-C6алкилен, R3 представляет собой -NR4R4, где R4 такой, как определено в п.1; либо R3 представляет собой C-связанный 5-7-членный кольцевой моноциклический гетероцикл, имеющий либо от 1 до 4 кольцевых атомов азота, либо 1 или 2 кольцевых атома азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы, возможно замещенный, как определено для этого определения в п.1; либо, если A представляет собой C2-C6алкилен, R3 представляет собой N-связанный пирролидинил, пиперидинил или морфолинил, каждый из которых возможно C-замещен, как определено для этого определения в п.1.
9. Соединение по п.8, где R3 представляет собой фенил; либо, если A представляет собой C2-C6алкилен, R3 представляет собой -NR4R4, где R4 представляет собой C1-C6алкил; либо R3 представляет собой C-связанный 5- или 6-членный кольцевой моноциклический ароматический гетероцикл, имеющий от 1 до 4 кольцевых атомов азота, возможно замещенный, как определено для этого определения в п.1; либо, если A представляет собой C2-C6алкилен, R3 представляет собой N-связанный пирролидинил, пиперидинил или морфолинил, каждый из которых возможно C-замещен C1-C6алкилом или -OR4, где R4 такой, как ранее определено в п.1.
10. Соединение по п.9, где R3 представляет собой фенил; либо, если A представляет собой C2-C6алкилен, R3 представляет собой -N(CH3)2; либо R3 представляет собой C-связанный пиридинил, возможно замещенный -OR6, R7, C1-C6алкокси(C1-C6)алкилом, R6R6N(C1-C6)алкилом шыш -NR6R6, где R6 и R7 такие, как ранее определено в п.1; либо, если A представляет собой C2-C6алкилен, R3 представляет собой пирролидин-1-ил, пиперидин-1-ил, 4-изопропилпиперидин-1-ил или морфолин-4-ил.
11. Соединение по п.10, где R3 представляет собой фенил; либо, если A представляет собой C2-C6алкилен, R3 представляет собой -N(CH3)2; либо R3 представляет собой 2-пиридинил; либо, если A представляет собой C2-C6алкилен, R3 представляет собой пирролидин-1-ил, пиперидин-1-ил, 4-изопропилпиперидин-1-ил или морфолин-4-ил.
12. Соединение по п.11, где, если A представляет собой C2-C6алкилен, R3 представляет собой пиперидин-1-ил.
13. Соединение по любому из пп.1-4, где -A-R3 представляет собой фенетил, 2-(диметиламино)этил, 2-пиридинилметил, 2-(2-пиридинил)этил, 3-(1-пирролидинил)пропил, 2-(1-пиперидинил)этил, 2-(4-изопропил-1-пиперидинил)этил или 2-(4-морфолинил)этил.
14. Соединение по п.13, где -A-R3 представляет собой 2-(1-пиперидинил)этил.
15. Соединение по п.1, которое выбрано из группы, состоящей из
9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-[2-(1-пиперидинил) этил]-9H-пурин-2-карбоксамида,
9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-фенетил-9H-пурин-2-карбоксамида,
9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-[2-(4-изопропил-1-пиперидинил)этил]-9H-пурин-2-карбоксамида,
9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-[3-(1-пирролидинил)пропил]-9H-пурин-2-карбоксамида,
9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-[2-(4-морфолинил) этил]-9H-пурин-2-карбоксамида,
9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-(2-пиридинилметил)-9H-пурин-2-карбоксамида,
9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-[2-(2-пиридинил)этил]-9H-пурин-2-карбоксамида и
9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-N-[2-(диметиламино)этил]-6-[(2,2-дифенилэтил)амино]-9H-пурин-2-карбоксамида
и их фармацевтически приемлемых солей и сольватов.
16. Соединение по п.1, представляющее собой 9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-[2-(1-пиперидинил)этил]-9H-пурин-2-карбоксамид или его фармацевтически приемлемые соль или сольват.
17. Соединение по п.1, где
R1 представляет собой водород или C1-C6алкил, замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила;
R2 представляет собой водород или C1-C6алкил;
A представляет собой C1-C6алкилен; а
R3 представляет собой фенил, нафтил, C3-C8циклоалкил, азетидинил, пирролидинил, пиперидинил, амино, -NH(C1-C6алкил) или -N(C1-C6алкил)2, причем указанные фенил, нафтил, C3-C8циклоалкил, азетидинил, пирролидинил и пиперидинил возможно замещены одним или более чем одним заместителем, каждый из которых независимо выбран из C1-C6алкила, C1-C6алкокси, галогено(C1-C6)алкила, галогено и циано;
при условии, что если R3 представляет собой N-связанный возможно замещенный -азетидинил, -пирролидинил или -пиперидинил, либо представляет собой амино, -NH(C1-C6алкил) или -N(C1-C6алкил)2, то A представляет собой C2-C6алкилен.
18. Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемые соль или сольват по любому из пп.1-17 вместе с фармацевтически приемлемым эксципиентом, разбавителем или носителем.
19. Применение соединения формулы (I) или его фармацевтически приемлемой соли или сольвата по любому из пп.1-17 в качестве лекарственного средства.
20. Применение соединения формулы (I) или его фармацевтически приемлемых соли или сольвата по любому из пп.1-17 для производства лекарственного средства, обладающего агонистической активностью в отношении A2a рецепторов.
21. Применение соединения формулы (I) или его фармацевтически приемлемых соли или сольвата по любому из пп.1-17 для производства противовоспалительного агента.
22. Применение соединения формулы (I) или его фармацевтически приемлемых соли или сольвата по любому из пп.1-17 для производства лекарственного средства для лечения респираторного заболевания.
23. Применение по п.22, где заболевание выбрано из группы, состоящей из респираторного дистресс-синдрома взрослых (РДСВ), бронхита, хронического бронхита, хронической обструктивной болезни легких, муковисцидоза, астмы, эмфиземы, бронхоэктаза, хронического синусита и ринита.
24. Применение соединения формулы (I) или его фармацевтически приемлемых соли или сольвата по любому из пп.1-17, для производства лекарственного средства для лечения септического шока, мужской эректильной дисфункции, гипертензии, удара, эпилепсии, церебральной ишемии, заболевания периферических сосудов, постишемического реперфузионного повреждения, диабета, ревматоидного артрита, рассеянного склероза, псориаза, дерматита, аллергического дерматита, экземы, неспецифического язвенного колита, болезни Крона, воспалительного заболевания кишечника, гастрита, вызванного Heliobacter pylori, гастрита, не вызванного Heliobacter pylori, повреждения желудочно-кишечного тракта, индуцированного нестероидными противовоспалительными средствами, или психотического расстройства, либо для заживления ран.
25. Способ лечения млекопитающего, включая человека, с помощью агониста A2a рецепторов, при котором указанное млекопитающее подвергают воздействию эффективного количества соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или композиции по любому из пп.1-17 и 18, соответственно.
26. Способ лечения млекопитающего, включая человека, предназначенный для лечения воспалительного заболевания, при котором указанное млекопитающее подвергают воздействию эффективного количества соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или композиции по любому из пп.1-17 и 18, соответственно.
27. Способ лечения млекопитающего, включая человека, предназначенный для лечения респираторного заболевания, при котором указанное млекопитающее подвергают воздействию эффективного количества соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или композиции по любому из пп.1-17 и 18, соответственно.
28. Способ по п.27, где заболевание выбрано из группы, состоящей из респираторного дистресс-синдрома взрослых (РДСВ), бронхита, хронического бронхита, хронической обструктивной болезни легких, муковисцидоза, астмы, эмфиземы, бронхоэктаза, хронического синусита и ринита.
29. Способ лечения млекопитающего, включая человека, предназначенный для лечения септического шока, мужской эректильной дисфункции, гипертензии, удара, эпилепсии, церебральной ишемии, заболевания периферических сосудов, постишемического реперфузионного повреждения, диабета, ревматоидного артрита, рассеянного склероза, псориаза, дерматита, аллергического дерматита, экземы, неспецифического язвенного колита, болезни Крона, воспалительного заболевания кишечника, гастрита, вызванного Heliobacter pylori, гастрита, не вызванного Heliobacter pylori, повреждения желудочно-кишечного тракта, индуцированного нестероидными противовоспалительными средствами, или психотического расстройства, либо для заживления ран, при котором указанное млекопитающхх подвергают воздействию эффективного количества соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или композиции по любому из пп. 1-17 и 18, соответственно.
30. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли по п.1, при котором
осуществляют реакцию аминокарбонилирования соединения формулы

где R1 определен в п.1, а X представляет собой уходящую группу, такую как бромо, иодо, -Sn(C1-C12алкил)3 или CF3SO2O-, с соединением формулы
R2NH-A-R3 (III),
где A, R2 и R3 такие, как определено в п.1, в присутствии монооксида углерода и подходящего катализатора сочетания;
а затем возможно превращают в фармацевтически приемлемую соль.
31. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли по п.1, при котором
удаляют защиту с соединения формулы
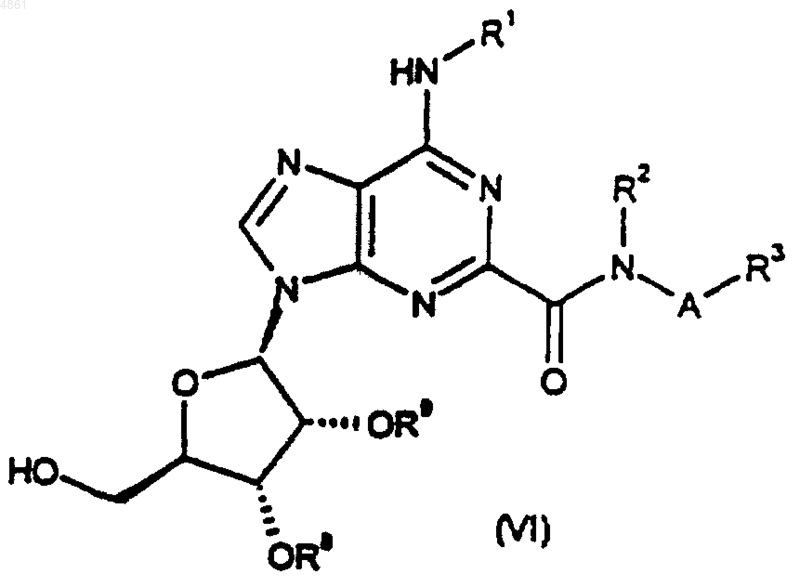
где A, R1, R2 и R3 такие, как определено в п.1, а R8 и R9, когда взяты по отдельности, представляют собой защитные группы, либо, когда взяты вместе, представляют собой защитную группу;
а затем возможно превращают в фармацевтически приемлемую соль.
32. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли по п.1, при котором
удаляют защиту с соединения формулы
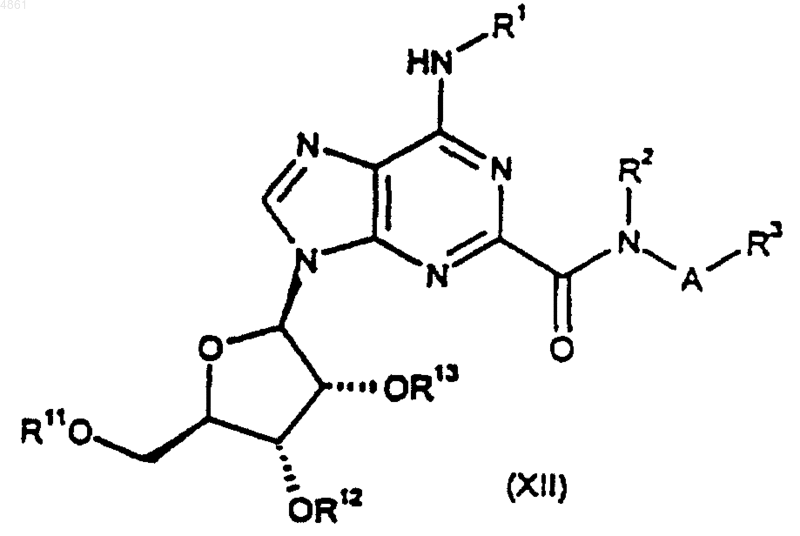
где A, R1, R2 и R3 такие, как определено в п.1, а R11, R12 и R13, взятые по отдельности, представляют собой защитные группы, либо R11 представляет собой защитную группу, а R12 и R13, взятые вместе, представляют собой защитную группу;
а затем возможно превращают в фармацевтически приемлемую соль.
33. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли по п.1, при котором
соединение формулы
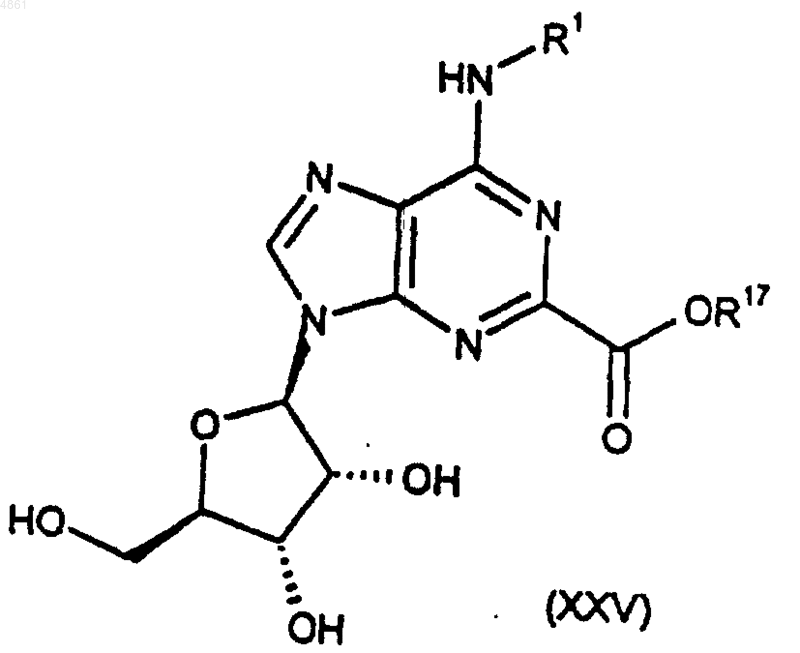
где R1 такой, как определено в п.1, а R17 представляет собой H или эфиробразующую группу, подвергают взаимодействию с соединением формулы
R2NH-A-R3 (III),
где A, R2 и R3 такие, как определено в п.1, и, если R17 представляет собой H, то в присутствии агента пептидного сочетания;
а затем возможно превращают в его фармацевтически приемлемую соль.
34. Соединение формулы
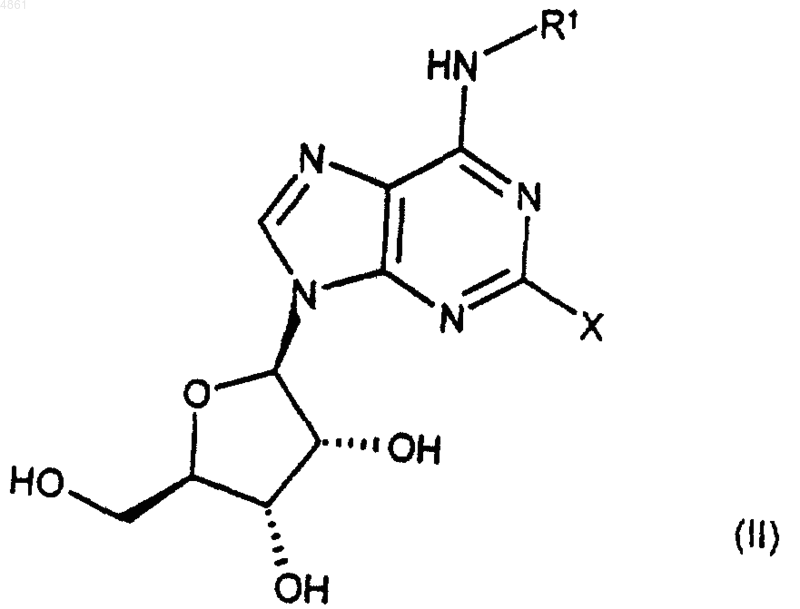
где X представляет собой уходящую группу, такую как бромо, иодо, -Sn(C1-C12алкил)3 или CF3SO2O-, а R1 такой, как определено в п.1, при условии, что если X представляет собой бромо или иодо, R1 не представляет собой H.
35. Соединение формулы
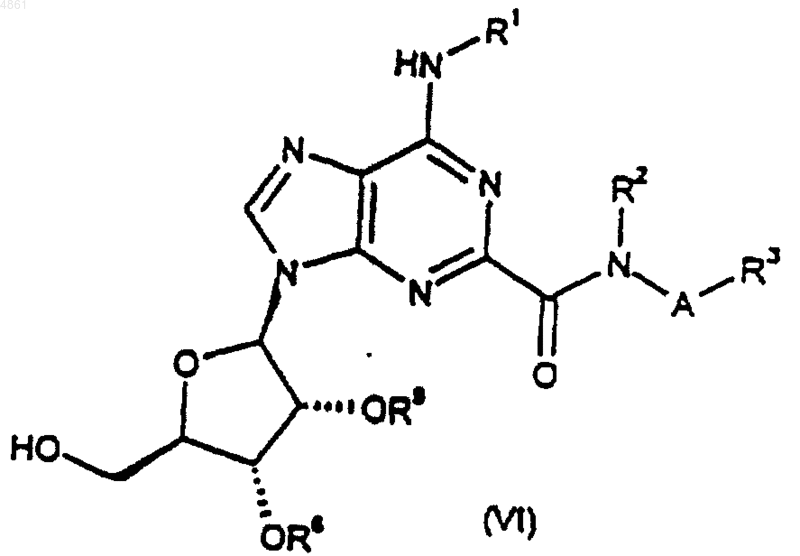
где R8 и R9, когда взяты по отдельности, представляют собой защитные группы, либо, когда взяты вместе, представляют собой защитную группу; а A, R1, R2 и R3 такие, как определено в п.1.
36. Соединение формулы
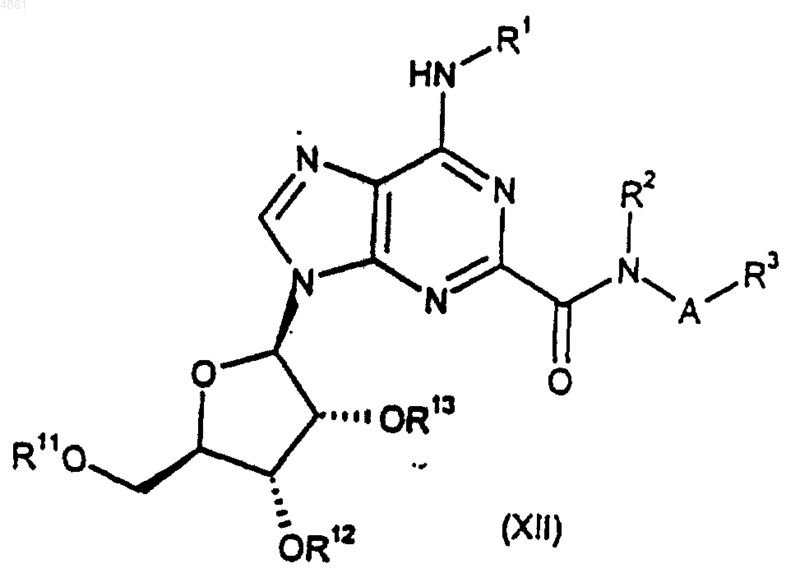
где R11, R12 и R13, взятые по отдельности, представляют собой защитные группы, либо R11 представляет собой защитную группу, а R12 и R13, взятые вместе, представляют собой защитную группу; а A, R1, R2 и R3 такие, как определено в п.1.
37. Соединение формулы

где R17 представляет собой H или эфир-образующую группу; а R1 представляет собой C1-C6алкил, возможно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила, причем указанные фенил и нафтил возможно замещены C1-C6алкилом, C1-C6алкокси, галогено или циано.
38. Соединение по любому из пп.34-37, где R1 представляет собой 2,2-дифенилэтил, R2 представляет собой H, и/или -A-R3 представляет собой 2-(1-пиперидинил)этил.
39. Соединение формулы (II) по п.34, где X представляет собой иодо.
40. Соединение формулы (VI) по п.35, где R8 и R9, когда взяты по отдельности, каждый представляет собой ацетил или бензоил, либо, когда взяты вместе, представляют собой 1,1-диметилметилен.
41. Соединение формулы (XII) по п.36, где R11, R12 и R13, когда взяты по отдельности, каждый представляет собой ацетил или бензоил, либо R12 и R13, когда взяты вместе, представляют собой 1,1-диметилметилен.
42. Соединение формулы (XXV) по п.37, где R17 представляет собой C1-C4алкил, предпочтительно метил или этил.
Текст
1 Данное изобретение относится к производным пурина. Более конкретно, данное изобретение относится к производным 9-(тетрагидро-2-фуранил)-9 Н-пурин-2-карбоксамида,способам их получения, промежуточным соединениям, используемым при их получении, композициям, содержащим их, и применению таких производных. Эти производные представляют собой селективные функциональные агонисты человеческого А 2 а аденозинового рецептора и могут быть использованы в качестве противовоспалительных агентов в лечении, в частности, заболеваний дыхательных путей. Аденозин представляет собой убиквитарную молекулу, играющую главную роль в промежуточном обмене млекопитающего. Независимо, аденозин действует на многочисленные поверхностные рецепторы, вызывая множество ответов. Классификация аденозиновых рецепторов выявила наличие по меньшей мере четырех подтипов: А 1, А 2 а, А 2b и A3. Сообщается, что стимуляция А 2 аденозиновых рецепторов на поверхности человеческих нейтрофилов сильно ингибирует ряд функций нейтрофилов. Активированные нейтрофилы могут повреждать легочную ткань путем высвобождения активных видов молекулы кислорода, например супероксидных анион-радикалов (O2-), и гранулярных продуктов, например эластазы человеческих нейтрофилов (ЭЧН), среди других медиаторов воспаления. Кроме того, активированные нейтрофилы осуществляют de novo как синтез, так и высвобождение продуктов арахидоновой кислоты, таких как лейкотриен В 4 (ЛТВ 4). ЛТВ 4 является сильнодействующим хемоатрактантом,который привлекает дополнительные нейтрофилы к очагу воспаления, в то время как высвобожденные O2- и ЭЧН неблагоприятно воздействуют на легочный внеклеточный матрикс. Установлено, что подтипом рецептора А 2, который опосредует многие из этих ответов (высвобождение O2- и ЛТВ 4/ЭЧН и клеточную адгезию), является А 2 а. Остается еще установить подтип А 2 (А 2 а или А 2b), который опосредует другие эффекты. Считается, что селективная агонистическая активность в отношении А 2 а рецептора дает большую терапевтическую пользу, чем применение неселективных агонистов аденозиновых рецепторов, поскольку взаимодействие с другими подтипами связано с вредными эффектами в легком в животных моделях и в исследованиях человеческих тканей. Например, у людей, страдающих астмой, но не людей, не страдающих астмой, происходит сужение просвета бронха, при воздействии вдыхаемого аденозина. Этот ответ, по меньшей мере частично, происходит вследствие активации подтипа рецептора А 1. Активация А 1 рецепторов также стимулирует хемотаксис нейтрофилов и прилипание к эндотелиальным клеткам, таким образом стиму 004861 2 лируя повреждение легких. Более того, многим пациентам с респираторным заболеванием должны быть одновременно прописаны 2 агонисты, и в исследованиях на животных было показано отрицательное взаимодействие между изопреналиновыми и аденозиновыми рецепторами, негативно связанными с аденилатциклазой. Дегрануляция тучных клеток человека стимулируется активацией А 2b аденозиновых рецепторов, таким образом, селективность относительно А 2b рецептора также является полезной. Авторы данного изобретения неожиданно обнаружили, что настоящие производные пурина ингибируют функцию нейтрофилов и являются селективными агонистами А 2 а аденозинового рецептора. Они могут также обладать антагонистической активностью в отношении A3 аденозинового рецептора. Соединения по настоящему изобретению могут быть использованы для лечения любого заболевания, для которого показан агонист А 2 а аденозинового рецептора. Они могут быть использованы для лечения заболевания, в которое вовлечено повреждение ткани, индуцированное лейкоцитами (например нейтрофилом, эозинофилом, базофилом, лимфоцитом, макрофагом). Они полезны в качестве противовоспалительных агентов в лечении заболеваний дыхательных путей, таких как респираторный дистресс-синдром взрослых (РДСВ),бронхит, хронический бронхит, хроническая обструктивная болезнь легких, муковисцидоз,астма, эмфизема, бронхоэктаз, хронический синусит и ринит. Соединения по настоящему изобретению могут также быть использованы в лечении септического шока, мужской эректильной дисфункции, гипертензии, удара, эпилепсии, церебральной ишемии, заболевания периферических сосудов, постишемического реперфузионного повреждения, диабета, ревматоидного артрита, рассеянного склероза, псориаза,дерматита, аллергического дерматита, экземы,неспецифического язвенного колита, болезни Крона, воспалительного заболевания кишечника, гастрита, вызванного Heliobacter pylori, гастрита, не вызванного Heliobacter pylori, повреждения желудочно-кишечного тракта, индуцированного нестероидными противовоспалительными средствами, или психотического расстройства, либо для заживления ран. Соответственно, согласно настоящему изобретению предложено соединение формулы или его фармацевтически приемлемые соль или сольват, 3 где R1 представляет собой водород или C1 С 6 алкил, возможно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила, причем указанные фенил и нафтил возможно замещены C1 С 6 алкилом, С 1-С 6 алкокси, галогено или циано;R3 представляет собой (1) водород, C1 С 6 алкил, -COOR4, -CN, -CONR4R4, С 3-С 8 циклоалкил, фенил или нафтил, причем указанные С 3 С 8 циклоалкил, фенил и нафтил возможно замещены C1-С 6 алкилом, фенилом, С 1-С 6 алкокси(С 1 С 6)алкилом, R4R4N(C1-C6)aлкилoм, галогено(С 1 С 6)алкилом, фторо(С 1-С 6)алкокси, С 2-С 5 алканоилом, галогено, -OR4, циано, -COOR4, С 3 С 8 циклоалкилом, -S(O)mR5, -NR4R4, -SO2NR4R4,-CONR4R4, -NR4COR5 или -NR4SO2R5,либо (2) если А представляет собой С 2 С 6 алкилен, то -NR4R4, -OR4, -OCOR5, -SO2R5,-SO2NR4R4 или -NR4COR5,либо (3) С-связанный 4-11-членный кольцевой моно- или бициклический гетероцикл,имеющий либо от 1 до 4 кольцевых атомов азота, либо 1 или 2 кольцевых атома азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы, причем указанный гетероцикл возможно С-замещен оксо, С 1-С 6 алкокси(С 1-С 6)алкилом,R6R6N(C1-C6)aлкилoм, галогено(С 1-С 6)алкилом,фторо(С 1-С 6)алкокси, фторо(С 2-С 5)алканоилом,галогено, циано, -OR6, R7, -COR6, -NR6R6,-COOR6, -S(O)mR7, -SO2NR6R6, -CONR6R6,-NR6SO2R7 или -NR6COR7 и возможно Nзамещен С 1-С 6 алкокси(С 1-С 6)алкилом, R6R6N(C2-С 6)алкилом, галогено(С 1-С 6)алкилом, фторо(С 2-С 5)алканоилом, R7, -COR6, -COOR7,-SO2R7, -SO2NR6R6 или -CONR6R6,либо (4) если А представляет собой С 2 С 6 алкилен, то N-связанный азетидинил, пирролидинил, пиперидинил, пиперазинил, гомопиперазинил или морфолинил, каждый из которых возможно С-замещен C1-С 6 алкилом, фенилом,С 1-С 6 алкокси(С 1-С 6)алкилом, R4R4N(C1-C6)алкилом, галогено(С 1-С 6)алкилом, фторо(С 1-С 6)алкокси, С 2-С 5 алканоилом, галогено, -OR4, циано,-COOR4, С 3-С 8 циклоалкилом, -S(O)mR5, -NR4R4,-SO2NR4R4,-CONR4R4,-NR4COR5 или 4 5R , обозначает С-связанный пирролил, имидазолил, триазолил, тиенил, фурил, тиазолил, оксазолил, тиадиазолил, оксадиазолил, пиридинил,пиримидинил, пиридазинил, пиразинил, индолил, изоиндолил, хинолинил, изохинолинил,бензимидазолил, хиназолинил, фталазинил, бензоксазолил или хиноксалинил, каждый из которых возможно замещен C1-С 6 алкилом, С 1 С 6 алкокси, циано или галогено. В вышеупомянутых определениях галогено обозначает фторо, хлоро, бромо или иодо, а алкильные, алкиленовые, алканоильные и алкоксигруппы, содержащие необходимое число атомов углерода, могут представлять собой неразветвленную или разветвленную цепь. Гетероцикл, как определено в R3, часть (3), выше,может быть ароматическим либо полностью или частично насыщенным. Выражение"Ссвязанный", используемое в определениях R3 и гет, означает, что данная группа связана с соседним атомом с помощью кольцевого атома углерода. Выражение "N-связанный", используемое в определении R3, означает, что данная группа связана с соседним атомом с помощью кольцевого атома азота. Примеры алкила включают в себя метил, этил, н-пропил, изопропил,н-бутил, изобутил, втор-бутил и трет-бутил. Примеры алкокси включают в себя метокси,этокси, н-пропокси, изопропокси, н-бутокси,изобутокси, втор-бутокси и трет-бутокси. Примеры алканоила включают в себя ацетил и пропаноил. Примеры алкилена включают в себя метилен, 1,1-этилен, 1,2-этилен, 1,3-пропилен и 1,2-пропилен. Примеры циклоалкила включают в себя циклопропил, циклобутил, циклопентил,циклогексил и циклогептил. Предпочтительными гетероциклами,включенными в объем определения "гетероцикл" для R3 (3), являются пирролил, имидазолил, триазолил, тиенил, фурил, тиазолил, оксазолил, тиадиазолил, оксадиазолил, пиридинил,пиримидинил, пиридазинил, пиразинил, индолил, изоиндолил, хинолинил, изохинолинил,бензимидазолил, хиназолинил, фталазинил, бензоксазолил и хиноксалинил, вместе с их частично или полностью насыщенными вариантами,такими как азетидинил, пирролидинил, пиперидинил, пиперазинил, гомопиперазинил и морфолинил. Во втором аспекте, согласно настоящему изобретению, предложено соединение формулы(I) или его фармацевтически приемлемые соль или сольват, гдеR1 представляет собой водород или С 1 С 6 алкил, замещенный 1 или 2 заместителями,каждый из которых независимо выбран из фенила и нафтила;R2 представляет собой водород или C1 С 6 алкил; А представляет собой С 1-С 6 алкилен; а 7R3 представляет собой фенил, нафтил, С 3 С 8 циклоалкил, азетидинил, пирролидинил, пиперидинил, амино, -NН(С 1-С 6 алкил) или -N(С 1 С 6 алкил)2, при этом указанные фенил, нафтил,С 3-С 8 циклоалкил, азетидинил, пирролидинил и пиперидинил возможно замещены одним или более чем одним заместителем, каждый из которых независимо выбран из С 1-С 6 алкила, C1 С 6 алкокси, галогено(С 1-С 6)алкила, галогено и циано,при условии, что если R3 представляет собой N-связанный возможно замещенный азетидинил, -пирролидинил или -пиперидинил,либо представляет собой амино, -NН(С 1 С 6 алкил) или -N(С 1-С 6 алкил)2, А представляет собой С 2-С 6 алкилен. Фармацевтически приемлемые соли соединений формулы (I) включают в себя соли присоединения кислот и соли с основаниями. Подходящие соли присоединения кислот образованы с кислотами, которые образуют нетоксичные соли, и примерами таких солей являются соли гидрохлорид, гидробромид, гидроиодид, сульфат, бисульфат, нитрат, фосфат,гидрофосфат, ацетат, малеат, фумарат, лактат,тартрат, цитрат, глюконат, сукцинат, сахарат,бензоат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат. Подходящие соли с основаниями образованы с основаниями, которые образуют нетоксичные соли, и примерами таких солей являются соли натрия, калия, алюминия, кальция, магния, цинка и диэтаноламина. Для обзора подходящих солей смотриBerge et al, J. Pharm. Sci, 66, 1-19, 1977. Фармацевтически приемлемые сольваты соединений формулы (I) включают в себя их гидраты. Также в объем соединений формулы (I) по настоящему изобретению включены их полиморфные модификации. Соединение формулы (I) может содержать один или более чем один дополнительный асимметрический атом углерода и, следовательно, может существовать в двух или более чем двух стереоизомерных формах. Настоящее изобретение включает в себя индивидуальные стереоизомеры соединений формулы (I) вместе с их смесями. Разделения диастереоизомеров можно достичь с помощью общепринятых методик, например с помощью фракционированной кристаллизации, хроматографии или ВЭЖХ (высокоэффективной жидкостной хроматографии) смеси стереоизомеров соединения формулы (I) или его подходящих соли или производного. Индивидуальный энантиомер соединения формулы (I) может также быть получен из соответствующего оптически чистого промежуточного соединения или путем разделения, как например с помощью ВЭЖХ соответствующего рацемата с использованием подходящего хирального но 004861 6 сителя либо путем фракционированной кристаллизации диастереоизомерных солей, образованных путем взаимодействия соответствующего рацемата с подходящими оптически активными кислотой или основанием, как подходит. Предпочтительно, R1 представляет собойC1-С 6 алкил, возможно замещенный 1 или 2 фенильными заместителями. Предпочтительно, R1 представляет собой С 1-С 6 алкил, замещенный 1 или 2 фенильными заместителями. Предпочтительно, R1 представляет собой С 1-С 4 алкил, замещенный 1 или 2 фенильными заместителями. Предпочтительно, R1 представляет собой С 1-С 2 алкил, замещенный 1 или 2 фенильными заместителями. Предпочтительно, R1 представляет собой фенилэтил или дифенилэтил. Предпочтительно,R1 представляет собой 2,2-дифенилэтил. Предпочтительно, R2 представляет собой Н. Предпочтительно, А представляет собой С 1C4 алкилен. Предпочтительно, А представляет собой неразветвленный С 1-С 4 алкилен. Предпочтительно, А представляет собой метилен, этилен или пропилен. Предпочтительно, А представляет собой метилен, 1,2-этилен или 1,3-пропилен. Предпочтительно, А представляет собой 1,2-этилен. Предпочтительно, R3 представляет собой фенил, возможно замещенный, как ранее определено для этого определения для соединения формулы (I). Предпочтительно, R3 представляет собой фенил. Предпочтительно, если А представляет собой С 2-С 6 алкилен, R3 представляет собой-N(СН 3)2. Предпочтительно, R3 представляет собой С-связанный 5-7-членный кольцевой моноциклический гетероцикл, имеющий либо от 1 до 4 кольцевых атомов азота, либо 1 или 2 кольцевых атома азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы, возможно замещенный, как ранее определено для этого определения для соединения формулы (I). Предпочтительно, R3 представляет собой С-связанный 5- или 6-членный кольцевой моноциклический ароматический гетероцикл, имеющий либо от 1 до 4 кольцевых атомов азота, либо 1 или 2 кольцевых атома азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы,возможно замещенный, как ранее определено для этого определения для соединения формулы(I). Предпочтительно, R3 представляет собой С-связанный 5- или 6-членный кольцевой моно 7 циклический ароматический гетероцикл, имеющий от 1 до 4 кольцевых атомов азота, возможно замещенный, как ранее определено для этого определения для соединения формулы (I). Предпочтительно, R3 представляет собой С-связанный пиридинил, возможно замещенный(С 1-С 6)алкилом или -NR6R6. Предпочтительно, R3 представляет собой 2-пиридинил. Предпочтительно, если А представляет собой С 2-С 6 алкилен, R3 представляет собой Nсвязанный пирролидинил, пиперидинил или морфолинил, каждый из которых возможно Сзамещен, как ранее определено для этого определения для соединения формулы (I). Предпочтительно, если А представляет собой С 2-С 6 алкилен, R3 представляет собой Nсвязанный пирролидинил, пиперидинил или морфолинил, каждый из которых возможно Сзамещен C1-С 6 алкилом либо -OR4. Предпочтительно, если А представляет собой С 2-С 6 алкилен, R3 представляет собой пирролидин-1-ил,пиперидин-1-ил,4-изопропилпиперидин-1-ил или морфолин-4-ил. Предпочтительно, если А представляет собой С 2-С 6 алкилен, R3 представляет собой пиперидин-1-ил. Предпочтительно, -A-R3 представляет собой фенетил, 2-(диметиламино)этил, 2-пиридинилметил, 2-(2-пиридинил)этил, 3-(1-пирролидинил)пропил, 2-(1-пиперидинил)этил, 2-(4-изопропил-1-пиперидинил)этил или 2-(4-морфолинил)этил. Предпочтительно, -A-R3 представляет собой 2-(1-пиперидинил)этил. Особенно предпочтительными примерами соединения формулы (I) являются 9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-[2-(1-пиперидинил)этил]-9 Нпурин-2-карбоксамид,9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-фенетил-9H-пурин-2-карбоксамид,9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-[2-(4-изопропил-1-пиперидинил)этил]-9H-пурин-2-карбоксамид,9-[(2R,3R,4S,5R)-3,4-дигидpoкcи-5-(гидpoкcимeтил)тeтpaгидpo-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-[3-(1-пирролидинил)пропил]9 Н-пурин-2-карбоксамид,9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-[2-(4-морфолинил) этил]-9Hпурин-2-карбоксамид,9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-(2-пиридинилметил)-9H-пурин-2-карбоксамид, 004861 8 9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-[2-(2-пиридинил)этил]-9Hпурин-2-карбоксамид и 9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-N-[2-(диметиламино)этил]-6-[(2,2-дифенилэтил)амино]9H-пурин-2-карбоксамид вместе с их фармацевтически приемлемыми солями и сольватами. Соединения формулы (I) могут быть получены с использованием общепринятых процедур, как, например, с помощью следующих иллюстративных способов, в которых R1, R2, R3 и А такие, как ранее определено для соединения формулы (I), если не указано иначе. 1. Все соединения формулы (I) могут быть получены с помощью реакции аминокарбонилирования соединения формулы где Х представляет собой подходящую уходящую группу, такую как бромо, иодо, -Sn(С 1 С 12 алкил)3 или CF3SO2O-, предпочтительно иодо, с соединением формулыR2NH-A-R3 в присутствии монооксида углерода и подходящего катализатора сочетания. Предпочтительно катализатор представляет собой палладиевый(II) (возможно в виде 1:1 комплекса с дихлорметаном). Альтернативно, можно использовать ацетат палладия (II) в присутствии подходящего лиганда, такого как 1,1'-бис(дифенилфосфино) ферроцен, трифенилфосфин, три(о-толил)фосфин либо (R)-, (S)- или рацемический 2,2'бис(дифенилфосфин)-1,1'-динафтил. В обычной процедуре взаимодействие осуществляют в герметичном сосуде в присутствии монооксида углерода при повышенном давлении, например примерно 345 кПа (50 фунт/кв. дюйм), при повышенной температуре,например примерно 60 С, и в подходящем растворителе, например тетрагидрофуране, метаноле или этаноле. Возможно, может присутствовать подходящее органическое основание,такое как третичный амин, например триэтиламин, N-этилдиизопропиламин или 4-метилморфолин. Промежуточные соединения формулы (II) могут быть получены, как показано на схеме 1.,где Х такой, как ранее определено для соединения формулы (II), а "Ас" обозначает ацетил. В обычной процедуре соединение формулы (IV) подвергают взаимодействию с амином формулы R1NH2 в присутствии подходящего акцептора кислоты, например триэтиламина, и в подходящем растворителе, например ацетонитриле, при повышенной температуре, если необходимо. С полученного продукта формулы (V) с помощью гидролиза может быть удалена защита с получением соединения формулы (II) с помощью общепринятой процедуры, такой как путем использования подходящего неорганического основания, например карбоната натрия, гидроксида натрия, гидроксида калия, гидроксида лития, карбоната натрия, карбоната калия или карбоната цезия, и в подходящем растворителе,например метаноле, этаноле, изопропаноле, 1,2 диметоксиэтане, тетрагидрофуране, диметилформамиде, ацетоне, 2-бутаноне или 4-метил-2 пентаноне, возможно в водных условиях, при температуре от 0 С до температуры дефлегмации растворителя, например при комнатной температуре. Альтернативно, удаление защиты может быть осуществлено с использованием подходящего аминного основания, такого как триэтиламин,диизопропилэтиламин,4 метилморфолин, аммиак, метиламин, этиламин или диметиламин, в подходящем растворителе,таком как метанол, этанол, н-пропанол, изопропанол, тетрагидрофуран или дихлорметан, при температуре от 0 С до температуры дефлегмации растворителя. Промежуточные соединения формулы (III) и (IV) либо представляют собой известные соединения, либо могут быть получены с помощью общепринятых процедур. 2. Все соединения формулы (I) могут быть получены путем удаления защиты с соединения формулы где R8 и R9, когда взяты по отдельности, представляют собой подходящие защитные группы,такие как ацетил или бензоил, либо, когда взяты вместе, представляют собой подходящую защитную группу, такую как C1-С 6 алкилен, например 1,1-диметилметилен. В обычной процедуре, где R8 и R9, взятые вместе, представляют собой 1,1-диметилмети 004861 10 лен, соединение формулы (VI) обрабатывают подходящей кислотой, такой как соляная кислота, трифторуксусная кислота, серная кислота, птолуолсульфоновая кислота, бензолсульфоновая кислота, метансульфоновая кислота, уксусная кислота или муравьиная кислота, или их смесью, возможно в присутствии подходящего растворителя, например этанола, и возможно в водных условиях. Взаимодействие можно осуществлять при повышенной температуре, такой как температура дефлегмации растворителя. Промежуточные соединения формулы (VI) могут быть получены, как показано на схеме 2. Схема 2,где R8 и R9 такие, как ранее определено для соединения формулы (VI), а R10 представляет собой подходящую защитную группу, такую как триалкилсилил, например трет-бутилдиметилсилил или трет-бутилдифенилсилил. В обычной процедуре соединение формулы (VII) (которое может быть получено с помощью общепринятой процедуры, например, где(XI) в присутствии подходящего растворителя, например метанола, этанола, ацетонитрила или изопропанола, возможно в присутствии дополнительного акцептора кислоты, например третичного амина, такого как триэтиламин, Nэтилдиизопропиламин или 4-метилморфолин. Взаимодействие предпочтительно осуществляют при повышенной температуре, такой как температура дефлегмации растворителя. Полученное соединение формулы (VIII) можно обрабатывать иодом в подходящем растворителе, таком как тетрагидрофуран или дихлорметан, при повышенной температуре, на 11 пример примерно 50 С, с получением иодированного соединения формулы (IX). Соединение формулы (IX) посредством аминокарбонилирования можно превратить в амид формулы (X) в присутствии амина формулы (III) и монооксида углерода в условиях,сходных с таковыми, описанными в способе 1 для получения соединения формулы (I) из соединения формулы (II). Селективное удаление группы R10 в подходящих условиях удаления защиты затем обеспечивает соединение формулы (VI). Когда R10 представляет собой трет-бутилдиметилсилил,взаимодействие можно осуществлять, используя подходящий источник фторида, такой как фторид тетра-н-бутиламмония или фтороводород/пиридин, и в подходящем растворителе,таком как ацетонитрил или тетрагидрофуран,при комнатной температуре. 3. Все соединения формулы (I) могут быть получены путем удаления защиты с соединения формулы где R11, R12 и R13 представляют собой подходящие защитные группы. Если R11, R12 и R13 взяты по отдельности, примеры включают в себя ацетил или бензоил. Альтернативно, R12 и R13 могут быть взяты вместе, и примеры включают в себя 1,1-диметилметилен. Могут быть использованы общепринятые условия удаления защиты, и они будут зависеть от природы защитных групп, которые должны быть удалены. В обычной процедуре, когда R11,R12 и R13 каждый представляет собой ацетил,удаления защиты можно достичь, используя условия, подобные тем, которые описаны для превращения соединения формулы (V) в соединение формулы (II). Удаление защиты с соединения формулы(XII) с получением соединения формулы (I) может также быть осуществлено in situ после превращения соединения формулы (XIII) в соединение формулы (XII), как описано ниже. Здесь,когда R11, R12 и R13 каждый представляет собой ацетил, способ удаления защиты с использованием неорганического основания предпочтителен, например, реакционную смесь, содержащую соединение формулы (XII), обрабатывают водным раствором гидроксида натрия в 1,2 диметоксиэтане при 5-20 С. Соединение формулы (XII) может быть получено, как показано на схеме 3. где R14 представляет собой подходящую защитную группу, например тетрагидро-2 Н-пиран-2 ил, а R15 и R16 каждый представляет собой С 1C4 алкил, например метил или этил. В соединение формулы (XIV) может быть введена защита с помощью подходящей защитной группы R14 в общепринятых условиях. Например, когда R14 представляет собой тетрагидро-2 Н-пиран-2-ил, это может быть осуществлено путем взаимодействия соединения формулы(XIV) с 2,3-дигидропираном в подходящем растворителе, таком как этилацетат, толуол, дихлорметан, диметилформамид, трет-бутилметиловый эфир, диизопропиловый эфир, тетра 13 гидрофуран или ацетонитрил, в присутствии подходящего кислого катализатора, такого как п-толуолсульфоновая кислота, бензолсульфоновая кислота, камфарсульфоновая кислота, соляная кислота, серная кислота, метансульфоновая кислота или п-толуолсульфонат пиридиния, при температуре от 0 С до температуры дефлегмации растворителя. Предпочтительно взаимодействие осуществляют в этилацетате, используя птолуолсульфоновую кислоту. Обработка соединения формулы (XV) соединением формулы(XI) в подходящем растворителе, таком как метанол,этанол или изопропанол, и в присутствии подходящего акцептора кислоты, такого как третичный амин, например триэтиламин, N-этилдиизопропиламин или 4-метилморфолин, при температуре, вплоть до температуры дефлегмации растворителя, дает соединение формулы(XVI). Соединение формулы (XVI) может быть превращено в тиоэфир формулы (XVIII) путем обработки С 1-С 4 тиоалкоксидом натрия или калия в подходящем растворителе, таком как диметилсульфоксид, диметилформамид или Nметилпирролидин-2-он, предпочтительно при повышенной температуре, например 100 С. Окисления тиоэфира формулы (XVIII) можно достичь с использованием подходящего окислителя, такого как Oxone (товарный знак)(пероксомоносульфат калия), диметилдиоксиран, м-хлорпербензойная кислота или перуксусная кислота, в подходящем растворителе, таком как вода, ацетон или дихлорметан либо их смесь, возможно в присутствии основания, такого как бикарбонат натрия. Полученный сульфон формулы (XIX) можно обработать подходящим источником цианида, таким как цианид калия, цианид цинка, цианид натрия или цианид меди, в подходящем растворителе, таком как диметилсульфоксид, диметилформамид, Nметилпирролидин-2-он, тетрагидрофуран или ацетонитрил, предпочтительно при повышенной температуре, с получением нитрила формулы(XVII). Прямое превращение соединения формулы(XVI) в нитрил формулы (XVII) может быть осуществлено путем обработки подходящим источником цианида, таким как цианид калия,цианид цинка, цианид натрия или цианид меди,в подходящем растворителе, таком как диметилсульфоксид, диметилформамид, N-метилпирролидин-2-он, тетрагидрофуран или ацетонитрил, в присутствии подходящего палладиевого катализатора,такого как тетракис(трифенилфосфин)палладий (0) или ацетат палладия (II), вместе с подходящим лигандом,таким как трифенилфосфин,три-отолилфосфин, 1,1'-бис(дифенилфосфино)ферроцен или (R)-, (S)- или рацемический 2,2'бис(дифенилфосфино)-1,1'-динафтил, а также в 14 присутствии подходящего основания, такого как третичный амин, например триэтиламин, Nэтилдиизопропиламин или 4-метилморфолин. Взаимодействие можно осуществлять при температуре вплоть до температуры дефлегмации растворителя и возможно под давлением инертного газа, например аргона. Взаимодействие можно также осуществлять, используя подходящий источник цианида, такой как цианид натрия или калия, в подходящем растворителе,таком как диметилсульфоксид, диметилформамид или N-метилпирролидин-2-он, при температуре от 20 до 120 С. С соединения формулы (XVII) может быть удалена защита с получением соединения формулы (XXIII), с использованием общепринятых условий в зависимости от защитной группы,которая должна быть удалена. Когда R14 представляет собой тетрагидро-2 Н-пиран-2-ил, удаления защиты можно достичь в кислых условиях, таких как условия, созданные путем использования подходящей кислоты, например соляной кислоты, трифторуксусной кислоты, серной кислоты, трихлоруксусной кислоты, фосфорной кислоты, п-толуолсульфоновой кислоты, бензолсульфоновой кислоты, метансульфоновой кислоты или камфарсульфоновой кислоты, и,предпочтительно, в спиртовом растворителе,например этаноле или изопропаноле, который может возможно содержать воду, обычно при температуре от комнатной температуры до температуры дефлегмации растворителя. Нитрил формулы (XXIII) можно гидролизовать до кислоты формулы (XXIV) в щелочных условиях, таких как условия, созданные путем использования неорганического основания, например гидроксида лития, гидроксида натрия или гидроксида калия, в водном С 1-С 4 спиртовом растворителе, таком как метанол, этанол, изопропанол или промышленно метилированные спирты. Кислота формулы (XXIV) может быть превращена в амид формулы (XIII) с использованием общепринятых условий пептидного сочетания, например путем активации кислоты с использованием подходящего реагента, возможно в присутствии катализатора, а затем путем обработки активированного промежуточного соединения амином формулы (III) в подходящем растворителе. Подходящие активирующие агенты включают в себя N,N'-карбонилдиимидазол,тионилхлорид, оксалилхлорид или оксихлорид фосфора, а подходящие растворители включают в себя тетрагидрофуран, диметилформамид,этилацетат, ацетонитрил, толуол, ацетон или дихлорметан. Альтернативно, кислоту можно активировать путем обработки гидрохлоридом 1-(3-диметиламинопропил)-3-этилкарбодиимида или дициклогексилкарбодиимидом и 1-гидрокси-7-азабензотриазолом или гидратом 1 гидроксибензотриазола, а затем путем обработки амином формулы (III) в присутствии акцеп 15 тора кислоты, такого как 4-метилморфолин,триэтиламин или N-этилдиизопропиламин в растворителе, таком как тетрагидрофуран, диметилформамид, этилацетат, ацетонитрил, толуол, ацетон или дихлорметан, с получением амида формулы (XIII). Альтернативно, кислоту можно обработать гексафторфосфатом бензотриазол-1-илокситрис (пирролидино)фосфония,гексафторфосфатом бром-трис-пирролидинофосфония или иодидом 2-хлор-1-метилпиридиния и амином формулы (III) в присутствии акцептора кислоты, такого как 4 метилморфолин, триэтиламин или N-этилдиизопропиламин, в растворителе, таком как тетрагидрофуран, диметилформамид, этилацетат или дихлорметан, с получением амида формулы (XIII). Соединение формулы (XIII) может быть превращено в соединение формулы (XII) путем взаимодействия с соединением формулы где Y представляет собой подходящую уходящую группу, такую как ацетокси, бензоилокси,метокси или галогено, например хлоро, a R11,R12 и R13 представляют собой подходящие защитные группы, как ранее определено для соединения формулы (XII), в присутствии подходящей кислоты или кислоты Льюиса, например триметилсилилтрифторметансульфоната. Взаимодействие можно осуществлять с использованием соединения формулы (XXVIII) в форме 2R- или 2S-диастереоизомера, либо в виде смеси их эпимеров. Взаимодействие обычно осуществляют в подходящем растворителе, например 1,2-диметоксиэтане, дихлорметане, ацетонитриле, 1,1,1-трихлорэтане или толуоле или их смеси, предпочтительно путем предварительной обработки соединения формулы (XIII) in situ подходящим силилирующим агентом, например триметилсилилтрифторметансульфонатом, N,Oбис(триметилсилил)ацетамидом,триметилсилилхлоридом или гексаметилдисилазаном, перед добавлением соединения формулы(XXVIII). При взаимодействии могут быть использованы повышенные температуры. Соединение формулы (XXVIII) может быть получено с помощью общепринятых процедур. Нитрил формулы (XVII) может быть превращен в эфир формулы (XX) путем обработки каталитическим или избыточным количеством соответствующего С 1-С 4 алкоксида натрия или калия, такого как метоксид или этоксид натрия или калия, в соответствующем С 1-С 4 спиртовом растворителе, таком как метанол или этанол, с последующей обработкой подходящей кислотой, такой как водная соляная кислота. Эфир формулы (XX) может быть превращен в амид формулы (XXI) путем обработки 16 амином формулы (III), возможно в подходящем растворителе, таком как 1,2-диметоксиэтан или 2-метоксиэтиловый эфир. Взаимодействие можно осуществлять при повышенных температуре и давлении. Амид формулы (XXI) может быть превращен в соединение формулы (XIII) в общепринятых условиях удаления защиты в зависимости от защитной группы, которая должна быть удалена. Когда R14 представляет собой тетрагидро 2H-пиран-2-ил, этого можно достичь в кислых условиях в подходящем растворителе, обычно используя кислоту, такую как соляная кислота,трифторуксусная кислота, серная кислота, трихлоруксусная кислота, фосфорная кислота, nтолуолсульфоновая кислота, бензолсульфоновая кислота, метансульфоновая кислота или камфарсульфоновая кислота, в спиртовом растворителе, например изопропаноле, который может возможно также содержать воду. При взаимодействии могут быть использованы повышенные температуры. Соединение формулы (XVII) может быть превращено в кислоту формулы (XXII) в щелочных условиях, например с использованием неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в водном С 1-С 4 спиртовом растворителе,таком как метанол, этанол, изопропанол или промышленно метилированные спирты. Взаимодействие предпочтительно осуществляют при повышенной температуре. Кислота формулы (XXII) может быть превращена в амид формулы (XXI) в условиях, подобных тем, которые используют для превращения соединения формулы (XXIV) в соединение формулы (ХIII). Эфир формулы (XX) может быть превращен в кислоту формулы (XXII) в щелочных условиях, например с использованием неорганического основания, такого как гидроксид лития,гидроксид натрия или гидроксид калия, в водном растворителе, содержащем этанол, метанол,изопропанол, бутанол, промышленно метилированные спирты, тетрагидрофуран, диметилформамид или 1,2-диметоксиэтан, возможно при повышенной температуре. Соединение формулы (XVI) может быть превращено в эфир формулы (XX) путем алкоксикарбонилирования с использованием монооксида углерода, С 1-С 4 спирта, подходящего палладиевого катализатора, возможно дополнительного подходящего растворителя и подходящего основания, такого как третичный амин. В обычной реакции используют каталитическое количество ацетата палладия (II) вместе с подходящим лигандом, таким как 1,1'-бис(дифенилфосфино)ферроцен, трифенилфосфин, три-отолилфосфин или (R)-, (S)- или рацемический 2,2'-бис(дифенилфосфино)-1,1'-динафтил, подходящим С 1-С 4 спиртом, таким как метанол, этанол, 1-пропанол, изопропанол или 1-бутанол, и 17 третичным аминным основанием, таким как триэтиламин, N-этилдиизопропиламин или 4 метилморфолин, в атмосфере монооксида углерода, при повышенных температуре и давлении. Соединение формулы (XVI) может быть превращено в кислоту формулы (XXII) путем гидроксикарбонилирования с использованием монооксида углерода, подходящего палладиевого катализатора и подходящего основания в водных условиях. В обычной процедуре используют каталитическое количество ацетата палладия (II) вместе с подходящим лигандом, таким как 1,1'-бис(дифенилфосфино)ферроцен, трифенилфосфин, три-о-толилфосфин или (R)-, (S)или рацемический 2,2'-бис(дифенилфосфино)1,1'-динафтил, основанием, таким как гидроксид щелочного металла, например гидроксид натрия, или третичный амин, и водой, возможно вместе с подходящим смешивающимся с водой растворителем, таким как метанол, этанол, 1 пропанол, тетрагидрофуран, 1,2-диметоксиэтан,диметилформамид или изопропанол, в атмосфере монооксида углерода, при повышенных температуре и давлении. Соединение формулы (XVI) может быть превращено в соединение формулы (XXI) путем аминокарбонилирования с использованием монооксида углерода, амина формулы (III), подходящего палладиевого катализатора и подходящего растворителя, возможно в присутствии подходящего основания. В обычной процедуре используют каталитическое количество ацетата палладия (II) вместе с подходящим лигандом,таким как 1,1'-бис(дифенилфосфино)ферроцен,трифенилфосфин, три-о-толилфосфин или (R)-,(S)- или рацемический 2,2'-бис(дифенилфосфино)-1,1'-динафтил, растворителем, таким как тетрагидрофуран, диметилформамид, 1,2-диметоксиэтан, этилацетат, N-метил-2-пирролидинон, трет-бутилметиловый эфир или диизопропиловый эфир, третичным аминным основанием, таким как триэтиламин, N-этилдиизопропиламин или 4-метилморфолин, в атмосфере монооксида углерода при повышенных температуре и давлении. 4. Все соединения формулы (I) могут быть получены путем взаимодействия соединения формулы где R17 представляет собой Н или подходящую эфир-образующую группу, такую как С 1 С 4 алкил или бензил, с амином формулы (III), и где R17 представляет собой Н, в присутствии подходящего агента пептидного сочетания, в общепринятых условиях. В обычной процедуре реагенты нагревают вместе, возможно в присут 004861 18 ствии подходящего растворителя, такого как 1,2-диметоксиэтан или 2-метоксиэтиловый эфир, при повышенной температуре, например от 60 до 120 С, и возможно под давлением. Соединение формулы (XXV) может быть получено, как показано на схеме 4. Схема 4 где R17 представляет собой подходящую эфиробразующую группу, такую как С 1-С 4 алкил или бензил, а R11, R12 и R13 представляют собой подходящие защитные группы, как ранее определено для соединения формулы (XXVIII). В обычной процедуре нитрил формулы(XXIII) превращают в эфир формулы (XXVII) в щелочных условиях, например используя С 1 С 4 алкоксид натрия или калия, такой как метоксид или этоксид натрия или калия, в соответствующем С 1-С 4 спиртовом растворителе, таком как метанол или этанол, при температуре от комнатной до температуры дефлегмации растворителя, с последующей обработкой подходящей кислотой, такой как водная соляная кислота. Эфир формулы (XXVII) может быть превращен в соединение формулы (XXVI) путем взаимодействия с соединением формулы(XXVIII) в условиях, подобных тем, которые используют для превращения соединения формулы (XIII) в соединение формулы (XII). Соединение формулы (XXVI) может быть превращено в соединение формулы (XXV) в условиях, подобных тем, которые используют для превращения соединения формулы (XII) в соединение формулы (I), как, например, путем использования карбоната натрия в метаноле, гдеR11, R12 и R13 каждый представляет собой ацетил. Кислота формулы (XXV) (R17 = Н) может быть получена из соответствующего эфира с помощью общепринятых процедур. Все вышеперечисленные взаимодействия и получения новых исходных веществ, используемых в предшествующих способах, являются общепринятыми, и соответствующие реагенты и условия реакций для их осуществления или получения, а также процедуры для выделения желаемых продуктов, хорошо известны специалистам в данной области со ссылкой на литературные источники и примеры и получения 19 здесь. В частности, подходящие процедуры введения и удаления защиты хорошо известны из уровня техники, например как описано в Greeneet al, "Protective Groups in Organic Synthesis",Third Edition, John WileySons Ltd. Фармацевтически приемлемая соль соединения формулы (I) может быть легко получена путем смешивания вместе растворов соединения формулы (I) и желаемых кислоты или основания, как подходит. Эта соль может осадиться из раствора, и ее можно собрать путем фильтрования или выделить путем выпаривания растворителя. Противовоспалительные свойства соединений формулы (I) демонстрируются их способностью ингибировать функцию нейтрофилов, что свидетельствует об агонистической активности в отношении А 2 а рецепторов. Их оценивают путем определения профиля соединений в анализе, в котором измеряли продукцию супероксида нейтрофилами, активированными fMLP (N-формил-L-метионил-L-лейцилL-фенилаланином). Нейтрофилы выделяли из периферической крови человека, используя осаждение с помощью декстрана, с последующим центрифугированием в растворе FicollHypaque. Любые контаминирующие эритроциты в капле гранулоцитов удаляли путем лизиса ледяной дистиллированной водой. Продукцию супероксида нейтрофилами индуцировали fMLP в присутствии примирующей концентрации цитохалазина В. Аденозиндезаминазу включали в анализ для удаления любого эндогенно продуцированного аденозина, который мог бы подавлять продукцию супероксида. Воздействие соединения на fMLP-индуцированный ответ контролировали колориметрически, исходя из восстановления цитохрома С в буфере для анализа. Эффективность соединений оценивали с помощью концентрации, обеспечивающей 50% ингибирование (ИК 50) по сравнению с контрольным ответом на fMLP. Соединения формулы (I) можно вводить отдельно, но обычно их будут вводить в смеси с подходящим фармацевтическим эксципиентом,разбавителем или носителем, выбранным с учетом предполагаемого пути введения и стандартной фармацевтической практики. Например, соединения формулы (I) можно вводить перорально, трансбуккально или сублингвально в форме таблеток, капсул, овулей,эликсиров, растворов или суспензий, которые могут содержать корригенты или красящие агенты, для применений с немедленным, замедленным, длительным, импульсным или регулируемым высвобождением. Такие таблетки могут содержать эксципиенты, такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция,гидрофосфат кальция и глицин, разрыхлители,такие как крахмал (предпочтительно кукурузный, картофельный или маниоковый крахмал), 004861 20 крахмал-гликолят натрия, натрий-кросскармеллоза и некоторые комплексные силикаты, и связывающие вещества для гранулирования, такие как поливинилпирролидон, гидроксипропилметилцеллюлоза (ГПМЦ), гидроксипропилцеллюлоза (ГПЦ), сахароза, желатин и аравийская камедь. Дополнительно, могут быть включены смазывающие агенты, такие как стеарат магния,стеариновая кислота, глицерилбегенат и тальк. Твердые композиции подобного типа могут также быть использованы как наполнители в желатиновых капсулах. Предпочтительные эксципиенты в этом отношении включают в себя лактозу, крахмал, целлюлозу, молочный сахар или высокомолекулярный полиэтиленгликоль. Для водных суспензий и/или эликсиров соединения формулы (I) могут быть объединены с различными подслащивающими агентами или корригентами, красящими веществами или красителями, с эмульгирующими и/или суспендирующими агентами, а также с разбавителями,такими как вода, этанол, пропиленгликоль или глицерин, и их комбинациями. Соединения формулы (I) можно также вводить парентерально, например внутривенно,внутриартериально, интраперитонеально, внутриоболочечно, интравентрикулярно, интрастернально, интракраниально, внутримышечно или подкожно, либо их можно вводить путем инфузионных методов. Их лучше всего использовать в форме стерильного водного раствора, который может содержать другие вещества, например достаточно солей или глюкозы, чтобы сделать раствор изотоничным относительно крови. Водные растворы должны быть подходящим образом забуферены (предпочтительно до рН от 3 до 9), если необходимо. Приготовление подходящих парентеральных препаратов в стерильных условиях легко осуществимо с помощью стандартных фармацевтических методик, хорошо известных специалистам в данной области техники. Для перорального и парентерального введения пациентам-людям уровень суточной дозировки соединений формулы (I) должен обычно составлять от 0,01 до 100 мг/кг, предпочтительно от 0,1 до 100 мг/кг (в виде однократных или разделенных доз). Таким образом, таблетки или капсулы соединения формулы (I) могут содержать от 5 до 500 мг активного соединения для введения однократно или два или более раз, как подходит. Врач в любом случае должен определить действительную дозировку, которая будет наиболее подходящей для каждого конкретного пациента и которая будет варьировать в зависимости от возраста, массы и ответа конкретного пациента. Вышеуказанные дозировки являются примером среднего случая. Могут существовать, конечно,отдельные случаи, когда оправданы более высокие или более низкие диапазоны дозировок, и 21 такие случаи входят в объем настоящего изобретения. Соединения формулы (I) можно также вводить интраназально или путем ингаляции, и их удобным образом доставляют в форме сухого порошкового ингалятора или представления аэрозоля из герметичного контейнера, насоса,разбрызгивателя, пульверизатора или распылителя, с применением подходящего пропеллента,например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана, такого как 1,1,1,2-тетрафторэтан (HFA 134A(товарный знак или 1,1,1,2,3,3,3-гептафторпропан (HFA 227EA (товарный знак, диоксида углерода или другого подходящего газа, или без него. В случае герметичного аэрозоля, единица дозировки может быть определена путем обеспечения клапана для доставки отмеренного количества. Герметичный контейнер, насос, разбрызгиватель, пульверизатор или распылитель может содержать раствор или суспензию активного соединения, например с использованием смеси этанола и пропеллента в качестве растворителя, который может дополнительно содержать смазывающее вещество, например сорбитантриолеат. Капсулы и картриджи (изготовленные, например, из желатина) для применения в ингаляторе или инсуффляторе могут быть приготовлены таким образом, чтобы содержать порошкообразную смесь соединения формулы(I) и подходящую порошкообразную основу,такую как лактоза или крахмал. Аэрозольные препараты или сухие порошковые препараты предпочтительно приготавливают так, чтобы каждая отмеренная доза или"пшик" содержала от 20 до 4000 мкг соединения формулы (I) для доставки пациенту. Общая суточная доза с использованием аэрозоля должна находиться в диапазоне от 20 мкг до 20 мг, которая может быть введена в виде однократной дозы или, более обычно, в виде разделенных доз в течение суток. Альтернативно, соединения формулы (I) могут быть введены в форме суппозитория или пессария, или они могут быть нанесены местно в форме лосьона, раствора, крема, мази или присыпки. Соединения формулы (I) можно также вводить трансдермально, например путем применения кожного пластыря. Для нанесения местно на кожу, соединения формулы (I) могут быть приготовлены в виде подходящей мази, содержащей активное соединение, суспендированное или растворенное,например, в смеси с одним или более чем одним из следующего: минеральное масло, вазелиновое масло, белый вазелин, пропиленгликоль,смесь полиоксиэтилена и полиоксипропилена,эмульгирующий воск и вода. Альтернативно,они могут быть приготовлены в виде подходящего лосьона или крема, суспендированного или растворенного, например, в смеси одного или более чем одного из следующего: мине 004861 22 ральное масло, сорбитанмоностеарат, полиэтиленгликоль, вазелиновое масло, полисорбат 60,воск из цетиловых эфиров, цетеариловый спирт,2-октилдодеканол, бензиловый спирт и вода. Соединения формулы (I) могут также быть использованы в комбинации с циклодекстрином. Известно, что циклодекстрины образуют комплексы включения и комплексы, не являющиеся комплексами включения, с молекулами лекарственного средства. Образование комплекса лекарственное средство - циклодекстрин может изменять растворимость, скорость растворения, биодоступность и/или свойство стабильности молекулы лекарственного средства. Комплексы лекарственное средство - циклодекстрин обычно полезны для большинства лекарственных форм и путей введения. В качестве альтернативы прямому комплексообразованию с лекарственным средством, циклодекстрин может быть использован в качестве вспомогательной добавки, например носителя, разбавителя или солюбилизатора. Альфа-, бета- и гаммациклодекстрины наиболее часто используются,и подходящие примеры описаны в WO-A91/11172, WO-A-94/02518 и WO-A-98/55148. Следует понимать, что здесь все ссылки на лечение включают в себя целебное, паллиативное и профилактическое лечение. Таким образом, согласно данному изобретению предложено(1) соединение формулы (I) или его фармацевтически приемлемые соль или сольват;(2) способ получения соединения формулы(I) или его фармацевтически приемлемых соли или сольвата;(3) фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемые соль или сольват вместе с фармацевтически приемлемым эксципиентом, разбавителем или носителем;(4) соединение формулы (I) или его фармацевтически приемлемые соль, сольват или композиция для применения в качестве лекарственного средства;(5) применение соединения формулы (I) или его фармацевтически приемлемых соли,сольвата или композиции для производства лекарственного средства, обладающего агонистической активностью в отношении А 2 а рецепторов;(6) применение соединения формулы (I) или его фармацевтически приемлемых соли,сольвата или композиции для производства противовоспалительного агента;(7) применение соединения формулы (I) или его фармацевтически приемлемых соли,сольвата или композиции для производства лекарственного средства для лечения респираторного заболевания;(8) применение как в (7), где заболевание выбрано из группы, состоящей из респираторного дистресс-синдрома взрослых (РДСВ), 23 бронхита, хронического бронхита, хронической обструктивной болезни легких, муковисцидоза,астмы, эмфиземы, бронхоэктаза, хронического синусита и ринита;(9) применение соединения формулы (I) или его фармацевтически приемлемых соли,сольвата или композиции для производства лекарственного средства для лечения септического шока, мужской эректильной дисфункции,гипертензии, удара, эпилепсии, церебральной ишемии, заболевания периферических сосудов,постишемического реперфузионного повреждения, диабета, ревматоидного артрита, рассеянного склероза, псориаза, дерматита, аллергического дерматита, экземы, неспецифического язвенного колита, болезни Крона, воспалительного заболевания кишечника, гастрита, вызванного Heliobacter pylori, гастрита, не вызванногоHeliobacter pylori, повреждения желудочнокишечного тракта, индуцированного нестероидными противовоспалительными средствами,или психотического расстройства, либо для заживления ран;(10) способ лечения млекопитающего,включая человека, с помощью агониста А 2 а рецепторов, при котором указанное млекопитающее подвергают воздействию эффективного количества соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или композиции;(11) способ лечения млекопитающего,включая человека, предназначенный для лечения воспалительного заболевания, при котором указанное млекопитающее подвергают воздействию эффективного количества соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или композиции;(12) способ лечения млекопитающего,включая человека, предназначенный для лечения респираторного заболевания, при котором указанное млекопитающее подвергают воздействию эффективного количества соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или композиции;(13) способ как в (12), где заболевание выбрано из группы, состоящей из респираторного дистресс-синдрома взрослых (РДСВ), бронхита,хронического бронхита, хронической обструктивной болезни легких, муковисцидоза, астмы,эмфиземы, бронхоэктаза, хронического синусита и ринита;(14) способ лечения млекопитающего,включая человека, предназначенный для лечения септического шока, мужской эректильной дисфункции, гипертензии, удара, эпилепсии,церебральной ишемии, заболевания периферических сосудов, постишемического реперфузионного повреждения, диабета, ревматоидного артрита, рассеянного склероза, псориаза, дерматита, аллергического дерматита, экземы, неспецифического язвенного колита, болезни Крона,воспалительного заболевания кишечника, гаст 004861 24 рита, вызванного Heliobacter pylori, гастрита, не вызванного Heliobacter pylori, повреждения желудочно-кишечного тракта, индуцированного нестероидными противовоспалительными средствами, или психотического расстройства, либо для заживления ран, при котором указанное млекопитающее подвергают воздействию эффективного количества соединения формулы (I) или его фармацевтически приемлемых соли,сольвата или композиции; и(15) некоторые новые промежуточные соединения, описанные здесь. Следующие примеры иллюстрируют получение соединений формулы (I). Пример 1. 9-[(2R,3R,4S,5R)-3,4-Дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6[(2,2-дифенилэтил)амино]-N-[2-(1-пиперидинил)этил]-9 Н-пурин-2-карбоксамид. Раствор (2R,3R,4S,5R)-2-6-[(2,2-дифенилэтил)амино]-2-иод-9 Н-пурин-9-ил-5-(гидроксиметил)тетрагидро-3,4-фурандиола (5 г, 8,7 ммоль) (получение 2), 1,1'-бис(дифенилфосфино)ферроцендихлорпалладия (II) (1:1 комплекс с дихлорметаном) (0,7 г, 0,9 ммоль) и 1-(2 аминоэтил)пиперидина (3,4 г, 26,5 ммоль) в безводном тетрагидрофуране (250 мл) нагревали при 60 С в атмосфере монооксида углерода при 345 кПа (50 фунт/кв. дюйм) в герметичном сосуде в течение 24 ч. Данную смесь охлаждали,фильтровали через подушку из Arbocel (товарный знак) и фильтрат разбавляли тетрагидрофураном (150 мл) и этилацетатом (400 мл). Полученный раствор промывали водой (3 х 300 мл) и органическую фазу экстрагировали 2 М водным раствором соляной кислоты (50 мл). Кислую водную фазу промывали этилацетатом (20 мл),затем рН доводили до рН 7 путем добавления 0,88 водного раствора аммиака. Добавляли этилацетат (100 мл) и смесь перемешивали в течение 10 мин, после чего образовывалось белое твердое вещество. Это твердое вещество фильтровали, промывали последовательно водой и этилацетатом и сушили при 70 С при пониженном давлении с получением соединения,указанного в заголовке, в виде белого твердого вещества (2,8 г). 1(0,5 мл) в смеси уксусной кислоты и воды (1:1,по объему, 25 мл) нагревали с обратным холодильником в течение 1 ч. Данную смесь затем охлаждали и подщелачивали до рН 8 насыщенным водным раствором гидрокарбоната натрия. Полученный осадок отфильтровывали с получением неочищенного продукта. Это твердое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя системой растворителей дихлорметан:метанол:0,88 аммиак(соотношение 90:10:1,5, по объему) с получением твердого вещества, которое растирали с диэтиловым эфиром, фильтровали и сушили с получением соединения, указанного в заголовке, в виде твердого вещества (186 мг). 1(получение 20) (100 мг, 0,6 ммоль) нагревали при 120 С в атмосфере азота в течение 75 мин. Реакционную смесь оставили охлаждаться до комнатной температуры и для осаждения неочищенного продукта добавили диэтиловый эфир (2 мл). Растворитель декантировали от смолы, которую затем растирали с этилацетатом(2 мл). Полученное белое твердое вещество отфильтровывали и сушили с получением соединения, указанного в заголовке (59 мг). 1 Смесь метил-9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)-тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-9 Н-пурин-2 карбоксилата (получение 18) (92 мг, 0,18 ммоль) и N-(3-аминопропил)пирролидина (0,25 мл, 1,95 ммоль) нагревали при 120 С в атмосфере азота в течение 75 мин. Реакционную смесь оставили охлаждаться до комнатной температуры и для осаждения неочищенного продукта добавляли диэтиловый эфир (2 мл). Растворитель декантировали от смолы, которую очищали с помощью колоночной хроматографии на силикагеле,элюируя смесью дихлорметан:метанол (соотношение 80:20, по объему). Растирание с диэтиловым эфиром обеспечило соединение, указанное в заголовке, в виде белого твердого вещества (34 мг). 1 Смесь метил-9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)-тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-9 Н-пурин-2 карбоксилата (получение 18) (92 мг, 0,18 ммоль) и N-(2-аминоэтил)морфолина (0,25 мл, 1,9 ммоль) нагревали при 120 С в атмосфере азота в течение 75 мин. Реакционную смесь оставили охлаждаться до комнатной температуры и добавили диэтиловый эфир (2 мл) для осаждения соединения, указанного в заголовке, в виде белого твердого вещества, которое отфильтровывали и сушили (68 мг). 1 Смесь метил-9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)-тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-9 Н-пурин-2 карбоксилата (получение 18) (92 мг, 0,18 ммоль) и 2-(аминометил)пиридина (0,25 мл, 2,4 ммоль) нагревали при 120 С в атмосфере азота в течение 75 мин. Реакционную смесь оставляли охлаждаться до комнатной температуры и для осаждения неочищенного продукта добавляли диэтиловый эфир (2 мл). Растворитель декантировали от смолы, которую затем растирали с этилацетатом (2 мл). Полученное белое твердое вещество отфильтровывали и сушили с получением соединения, указанного в заголовке (73 мг). 1 Смесь метил-9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)-тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-9 Н-пурин-2 карбоксилата (получение 18) (92 мг, 0,18 ммоль) и 2-(2-аминоэтил)пиридина (0,25 мл, 2,1 ммоль) нагревали при 120 С в атмосфере азота в течение 75 мин. Реакционную смесь оставляли охлаждаться до комнатной температуры и для осаждения неочищенного продукта добавляли диэтиловый эфир (2 мл). Растворитель декантировали от смолы, которую очищали с помощью колоночной хроматографии на силикагеле,элюируя смесью дихлорметан:метанол (соотношение 95:5, по объему). Растирание с диэтиловым эфиром обеспечило соединение, указанное в заголовке, в виде белого твердого вещества (49 мг). 1 Смесь метил-9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)-тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-9H-пурин-2 карбоксилата (получение 18) (92 мг, 0,18 ммоль) и N,N-диметилэтилендиамина (0,25 мл, 2,3 ммоль) нагревали при 120 С в атмосфере азота в течение 75 мин. Реакционную смесь оставляли охлаждаться до комнатной температуры и для осаждения неочищенного продукта добавляли 29 диэтиловый эфир (2 мл). Растворитель декантировали от смолы, которую очищали с помощью колоночной хроматографии на силикагеле,элюируя смесью дихлорметан:метанол: концентрированный водный аммиак (соотношение 90:10:1, по объему). Растирание с диэтиловым эфиром обеспечило соединение, указанное в заголовке, в виде белого твердого вещества (51 мг). 1 К перемешиваемому раствору 6-[(2,2 дифенилэтил)амино]-N-[2-(1-пиперидинил) этил]-9-(2,3,5-три-O-ацетилD-рибофуранозил)-9H-пурин-2-карбоксамида (предполагается,310 г, 0,426 моль) (получение 24) и 1,2 диметоксиэтана (1600 мл) добавили 5 М водный раствор гидроксида натрия (640 мл, 3,2 моль) в течение периода времени 45 мин при охлаждении на льду. Полученную смесь перемешивали при температуре окружающей среды в течение 3 ч, а затем эти слои разделяли. Перемешанную органическую фазу затем разбавляли деионизированной водой (1800 мл) при охлаждении. Когда добавление было завершено, полученную смесь нагревали до 50-55 С, после чего начиналась кристаллизация. К этой нагретой и перемешанной суспензии добавляли дополнительное количество деионизированной воды (1800 мл) в течение периода времени 50 мин. Когда добавление было завершено, полученную суспензию охладили до 10 С в течение периода 45 мин, и полученное твердое вещество затем собрали путем фильтрования. Твердое вещество промывали раствором 1,2-диметоксиэтана (400 мл) и деионизированной водой (800 мл), а затем сушили при 55 С при пониженном давлении с получением неочищенного соединения, указанного в заголовке, в виде коричневого твердого вещества (203 г). Это вещество объединяли с веществом,полученным способами, осуществляемыми в подобных условиях, и очищали следующим способом. К суспензии неочищенного соедине 004861 30 ния, указанного в заголовке (398 г, 0,661 моль),в изопропаноле (7050 мл) добавляли деионизированную воду (1760 мл) и полученную смесь перемешивали и нагревали до тех пор, пока не был получен прозрачный раствор. Этот раствор фильтровали и затем фильтрат перегоняли в атмосфере азота при атмосферном давлении с периодическим добавлением фильтрованного изопропанола для поддержания перегоняемого объема. В течение перегонки собирали суммарно 29100 мл дистиллята и суммарно добавляли 26100 мл фильтрованного изопропанола. К концу перегонки количество воды, присутствующее в дистилляте, измеренное с помощью анализа по Карлу Фишеру, составляло 0,5% по массе. Смесь затем оставляли охлаждаться до 40 С в течение времени 3,5 ч при перемешивании, в течение которого происходила кристаллизация. Полученную суспензию перемешивали при температуре окружающей среды в течение 12,5 ч, а затем охлаждали до 2 С на ледяной бане в течение 5,5 ч. Твердое вещество собирали путем фильтрования и осадок на фильтре промывали охлажденным фильтрованным изопропанолом(2 х 1500 мл). Осадок на фильтре сушили при 60 С при пониженном давлении с получением соединения, указанного в заголовке, в виде твердого вещества бледно-бежевого цвета (306 г), температура плавления (т. пл.) 182 С. МСНР (положительная химическая ионизация при атмосферном давлении): m/z [MH+] 602. 1(1 Н, m), 3.70-3.61 (1 Н, m), 3.60-3.50 (1 Н, m). 3.46-3.37 (2 Н, m), 2.50-2.44 (2 Н, m, частично перекрытый пиком ДМСО), 2.40-2.32 (4 Н, m),1.46-1.38 (4 Н, m), 1.36-1.28(2H, m).[]D25 (с=0,1 в метаноле): -30. Следующие получения описывают получение некоторых промежуточных соединений,используемых в предшествующих примерах. Получение 1. (2R,3R,4R,5R)-(Ацетилокси)2-[(ацетилокси)метил]-5-6-[(2,2-дифенилэтил) амино]-2-иод-9 Н-пурин-9-илтетрагидро-3 фуранилацетат.(200 мл) перемешивали при комнатной температуре в атмосфере азота в течение 24 ч с последующим нагреванием с обратным холодильником в течение 90 мин. Растворитель удаляли при пониженном давлении и остаток распределяли между дихлорметаном (500 мл) и водой (200 мл). Органическую фазу отделяли и растворитель удаляли при пониженном давлении с получением соединения, указанного в заголовке, в виде бледно-желтой пены (18,8 г). 1(2R,3R,4R,5R)-4-(Ацетилокси)-2-[(ацетилокси)метил]-5-6-[(2,2-дифенилэтил)амино]2-иод-9 Н-пурин-9-илтетрагидро-3-фуранилацетат (1,7 г, 2,43 ммоль) (получение 1) растворяли в смеси метанола и воды в соотношении 10:1, по объему (88 мл). Добавляли твердый карбонат натрия (1,5 г, 14,1 ммоль) и смесь перемешивали при комнатной температуре в течение 90 мин перед удалением метанола путем выпаривания при пониженном давлении. Оставшийся водный раствор разбавляли водой (50 мл) и экстрагировали этилацетатом (150 мл). Органическую фазу промывали последовательно водой и рассолом,сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении с получением соединения, указанного в заголовке, в виде белого твердого вещества (1,4 г). 1(350 мл) охлаждали до -50 С в атмосфере газа азота и обрабатывали н-бутиллитием (78 мл, 1,6 М раствор в гексанах, 125 ммоль) в течение 15 мин. Реакционную смесь затем охлаждали до 70 С и по каплям добавляли раствор 9[(3aR,4R,6R,6aR)-6-([трет-бутил(диметил) силил]оксиметил)-2,2-диметилтетрагидрофуро(150 мл), поддерживая температуру ниже -70 С. Реакционную смесь перемешивали в течение 30 мин. Затем к реакционной смеси добавляли хлорид три-н-бутилолова (40,7 г, 125 ммоль) и данную смесь перемешивали при -70 С в течение 30 мин. К реакционной среде добавляли насыщенный раствор хлорида аммония в воде (100 мл), которую затем нагревали до 0 С. Добавляли насыщенный водный раствор гидрокарбоната натрия (150 мл) и данную смесь экстрагировали этилацетатом (3 х 100 мл). Объединенные органические экстракты промывали рассолом, сушили над безводным сульфатом натрия, фильтровали и растворитель удаляли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентной системой гексан:этилацетат (95:5,по объему), постепенно заменяя смесью гексан:этилацетат (80:20, по объему), с получением соединения, указанного в заголовке (13,0 г). 1(3,56 г, 18,0 ммоль), триэтиламина (3,30 г, 33,0 ммоль) и ацетонитрила (50 мл) нагревали при 80 С в течение 18 ч. Затем добавляли дополнительное количество 2,2-дифенилэтиламина (0,75 г, 3,8 ммоль) и нагревание продолжали в течение 5 ч. Данную смесь охлаждали, выливали в воду и экстрагировали этилацетатом (3 х 50 мл). Объединенные органические экстракты промывали рассолом, сушили над безводным сульфатом натрия, фильтровали и растворитель удаляли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом гексан:этилацетат (соотношение 4:1, по объему), постепенно заменяя смесью гексан:этилацетат (2:1, по объему), с получением соединения, указанного в заголовке, в виде масла (10,3 г). 1(диметил)силил]оксиметил)-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил]-N-(2,2-дифенилэтил)-2-(трибутилстаннил)-9 Н-пурин-6-амина (1,0 г, 1,12 ммоль) (получение 4), иода (0,43 г, 1,68 ммоль) и тетрагидрофурана (30 мл) перемешивали при 50 С в течение 30 мин. Данную смесь охлаждали, растворяли в этилацетате и промывали последовательно насыщенным водным раствором тиосульфата натрия, а затем водой. Органическую фазу отделяли, сушили над безводным сульфатом натрия, фильтровали и растворитель удаляли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле,элюируя градиентной системой из гексана, постепенно заменяя смесью гексан:этила-цетат (50:50,по объему), с получением соединения, указанного в заголовке (1,05 г).(диметил)силил]оксиметил)-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил]-N-(2,2-дифенилэтил)-2-иод-9 Н-пурин-6-амина (1,0 г, 1,37 ммоль) (получение 5), 1,1'-бис(дифенилфосфино) ферроцендихлорпалладия (II) (1:1 комплекс с дихлорметаном) (0,1 г, 0,14 ммоль), фенетиламина (0,5 г, 4,1 ммоль) и тетрагидрофурана (30 мл) нагревали при 60 С в атмосфере монооксида углерода при 345 кПа (50 фунт/кв. дюйм) в герметичном сосуде в течение 18 ч. Данную смесь охлаждали и растворитель удаляли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентной системой гексан:этилацетат (2:1, по объему), постепенно заменяя смесью гексан:этилацетат (1:1, по объему), с получением соединения, указанного в заголовке, в виде пены (0,72 г). 1(диметил)силил]оксиметил)-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил]-6-[(2,2 дифенилэтил)амино]-N-фенетил-9 Н-пурин-2 карбоксамида (0,72 г, 0,96 ммоль) (получение 6) в ацетонитриле (10 мл) обрабатывали фторидом тетра-н-бутиламмония (1,44 мл, 1 М раствор в тетрагидрофуране, 1,4 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Данный раствор затем распределяли между этилацетатом и насыщенным водным раствором гидрокарбоната натрия. Органическую фазу отделяли, а водную фазу снова экстрагировали этилацетатом. Объединенные органические фазы затем промывали рассолом,сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентной системой из дихлорметана, постепенно заменяя смесью дихлорметан:метанол (95:5, по объему), с получением соединения, указанного в заголовке, в виде пены белого цвета с желтоватым оттенком (580 мг). 1 2,6-Дихлор-9H-пурин (20 г, 0,11 моль) и моногидрат 4-толуолсульфоновой кислоты (0,2 г) растворяли в этилацетате (300 мл), данную смесь нагревали до 50 С и в течение 30 мин медленно добавляли раствор 2,3-дигидропирана(12,6 мл, 0,14 моль) в этилацетате (50 мл). Реакционную смесь затем охлаждали до комнатной температуры, добавляли воду (100 мл) и рН раствора доводили до 7 путем добавления насыщенного водного раствора гидрокарбоната натрия. Органический слой отделяли, промывали последовательно водой и рассолом, сушили над безводным сульфатом магния, фильтровали и растворитель удаляли при пониженном давлении. Остаток дважды подвергали азеотропной перегонке с пентаном с получением слегка загрязненного соединения, указанного в заголовке, в виде белого твердого вещества (30,9 г). 1 Раствор 2,6-дихлор-(9-тетрагидро-2 Нпиран-2-ил)-9H-пурина (получение 8) (30,9 г,0,11 моль) в изопропиловом спирте (600 мл) обрабатывали N-этил-N-изопропил-2-пропанамином (47,5 мл, 0,27 моль) и 2,2-дифенилэтиламином (24,8 г, 0,13 моль) и полученную смесь нагревали с обратным холодильником в течение 3 ч. Растворитель удаляли при пониженном давлении, а остаток подвергали азеотропной перегонке с этилацетатом. Остаток затем очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентной системой этилацетат:гексан (40:60, по объему),постепенно заменяя смесью этилацетат:гексан Раствор 2-хлор-N-(2,2-дифенилэтил)-9-(тетрагидро-2 Н-пиран-2-ил)-9 Н-пурин-6-амина (получение 9) (49,7 г, 0,11 моль) и сухого N,Nдиметилформамида (200 мл) обрабатывали тиометоксидом натрия (10 г, 0,14 моль) и полученную смесь нагревали в атмосфере азота при 100 С в течение 90 мин. Данную смесь перемешивали при комнатной температуре в течение 72 ч и нагревали при 100 С в течение дополнительных 2 ч. Реакционную смесь охлаждали и разбавляли водой (1000 мл). Образовывалась суспензия, которую экстрагировали диэтиловым эфиром (2 х 500 мл). Объединенные органические слои промывали последовательно водой и рассолом, сушили над безводным сульфатом магния, фильтровали и растворитель удаляли при пониженном давлении. Остаток подвергали азеотропной перегонке с диэтиловым(пероксомоносульфат калия) (44 г, 71,7 ммоль) в воде (200 мл) добавляли по каплям в течение 2 ч к раствору N-(2,2-дифенилэтил)-2-(метилсульфанил)-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-6-амина (получение 10) (25 г, 56,2 ммоль),гидрокарбоната натрия (20 г, 238 ммоль), ацетона (1000 мл) и воды (250 мл). Полученную смесь перемешивали при комнатной температуре в течение 24 ч, фильтровали и остаток промывали ацетоном. Ацетон удаляли из фильтрата путем выпаривания при пониженном давлении и полученный водный остаток экстрагировали этилацетатом, а затем дихлорметаном. Объединенные органические слои промывали рассолом, сушили, используя безводный сульфат магния, фильтровали и растворитель удаляли при пониженном давлении. Остаток растирали с диэтиловым эфиром, фильтровали, промывали диэтиловым эфиром и пентаном, а затем сушили с получением соединения, указанного в заголовке, в виде белого твердого вещества (20,32 г). 1 38 ммоль) и сухого N,N-диметилформамида (100 мл) обрабатывали цианидом калия (5,5 г, 84,6 ммоль) и данную смесь нагревали при 120 С в течение 24 ч в атмосфере азота. Данную смесь охлаждали до комнатной температуры, выливали в воду (1000 мл) и перемешивание продолжали в течение дополнительного 1 ч. Полученное твердое вещество медленно отфильтровывали и несколько раз промывали водой. Твердое вещество растворяли в дихлорметане и данный раствор промывали водой, сушили с помощью безводного сульфата магния, фильтровали и растворитель удаляли при пониженном давлении. Остаток подвергали азеотропной перегонке с диэтиловым эфиром (дважды) с получением соединения, указанного в заголовке, в виде масла (17 г). 1(3 мл) нагревали в атмосфере азота при 100 С в течение 6 ч. Реакционную смесь оставляли охлаждаться и распределяли между этилацетатом(100 мл) и 2 М водным раствором гидроксида натрия (100 мл). Органический слой отделяли,сушили над безводным сульфатом магния и выпаривали при пониженном давлении. Полученную смесь 1:1 6-[(2,2-дифенилэтил)амино]-9(тетрагидро-2 Н-пиран-2-ил)-9 Н-пурин-2-карбонитрила и 6-[(2,2-дифенилэтил)амино]-9 Нпурин-2-карбонитрила (смотри получение 15) разделяли с помощью колоночной хроматографии на силикагеле, элюируя градиентной системой этилацетат:гексан (соотношение 40:60, по объему), постепенно заменяя смесью этилацетат:гексан (60:40, по объему), с получением соединения, указанного в заголовке, в виде белого твердого вещества (0,4 г). 1 Суспензию 6-[(2,2-дифенилэтил)амино]-9(тетрагидро-2 Н-пиран-2-ил)-9 Н-пурин-2-карбонитрила (получение 12 или 13) (1,00 г, 2,36 ммоль) в метаноле (20 мл) обрабатывали метоксидом натрия (0,14 г, 2,59 ммоль), и полученную смесь нагревали с обратным холодильником в атмосфере азота в течение 20 ч. Анализ с помощью ТСХ (тонкослойной хроматографии) показал, что некоторое количество исходного вещества еще осталось, и поэтому добавили дополнительное количество метоксида натрия(64 мг, 1,18 ммоль) и данную смесь нагревали с обратным холодильником в атмосфере азота в течение одного часа. Данную смесь охладили до комнатной температуры и растворитель удаляли при пониженном давлении. К остатку добавляли тетрагидрофуран (30 мл) и воду (10 мл) и рН доводили до 4 путем добавления ледяной уксусной кислоты (1 мл). Данную смесь нагревали с обратным холодильником в течение одного часа. Анализ с помощью ТСХ показал, что некоторое количество исходного вещества еще осталось, и поэтому добавили дополнительное количество уксусной кислоты (0,5 мл) и нагревание с обратным холодильником продолжали в течение 18 ч. Реакционную смесь охладили до комнатной температуры и распределили между этилацетатом и насыщенным водным раствором гидрокарбоната натрия. Органическую фазу отделяли, промывали рассолом, сушили над безводным сульфатом магния, фильтровали и растворитель удаляли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметана и метанола (в соотношении 98,5:1,5, по объему) с получением соединения,указанного в заголовке (521 г). 1 Раствор 6-[(2,2-дифенилэтил)амино]-9(тетрагидро-2H-пиран-2-ил)-9H-пурин-2-карбонитрила (получение 12 или 13) (17 г, 40,1 ммоль) и этанола (850 мл) обрабатывали 2 н. водным раствором соляной кислоты (50 мл) и данную смесь перемешивали при комнатной температуре в течение 24 ч. Растворитель удаляли при пониженном давлении, остаток растворяли в этаноле и растворитель снова удаляли при пониженном давлении. Остаток растирали с диэтиловым эфиром, фильтровали, промывали диэтиловым эфиром и пентаном и сушили с получением соединения, указанного в заголовке, в виде твердого вещества (13,6 г). 1 Раствор 6-[(2,2-дифенилэтил)амино]-9Hпурин-2-карбонитрила (получение 15) (5,0 г,14,7 ммоль) и метоксида натрия (4,0 г, 74,1 ммоль) в метаноле (300 мл) нагревали с обратным холодильником в течение 24 ч. Затем добавляли дополнительное количество метоксида натрия (2,0 г, 37 ммоль) и метанола (100 мл) и нагревание продолжали в течение дополнительных 24 ч. Реакционную смесь охлаждали и растворитель удаляли при пониженном давлении. Остаток растворяли в тетрагидрофуране (375 мл), добавляли 2 М водный раствор соляной кислоты (125 мл) и данную смесь перемешивали при комнатной температуре в течение 24 ч. Тетрагидрофуран удаляли при пониженном давлении и рН суспензии доводили до 7 с помощью насыщенного водного раствора бикарбоната натрия. Затем добавляли этилацетат (100 мл) и суспендированное белое твердое вещество отфильтровывали, промывали небольшим количеством воды, затем этилацетатом и сушили. Очистка с помощью колоночной хроматографии на силикагеле с элюированием градиентной системой дихлорметан:метанол (соотношение 90:10,по объему) с постепенной заменой на смесь дихлорметан:метанол (75:25, по объему) дала соединение, указанное в заголовке, в виде белого 41 твердого вещества (1,25 г) (N.B. выпаривание этилацетатного фильтрата дало 2,6 г исходного вещества). 1(1,5 г, 4,02 ммоль) в 1,1,1-трихлорэтане (40 мл) обрабатывали N,O-бис(триметилсилил)ацетамидом (4,8 мл, 19,6 ммоль). Данную смесь нагревали с обратным холодильником в течение 2 ч. Раствор оставляли охлаждаться до комнатной температуры и растворитель удаляли при пониженном давлении. Остаток растворяли в безводном толуоле (40 мл) и добавляли 1,2,3,5-тетра-OацетилD-рибофуранозу (1,65 г, 5,19 ммоль) и триметилсилилтрифторметансульфонат (0,98 мл,5,43 ммоль). Полученный раствор нагревали с обратным холодильником в атмосфере азота в течение 3 ч. Данную смесь охлаждали до комнатной температуры, разбавляли этилацетатом(200 мл) и промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой отделяли, сушили над безводным сульфатом магния, фильтровали и растворитель удаляли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле, используя градиентное элюирование смесью этилацетата и пентана (соотношение 70:30,по объему), затем смесью этилацетата и пентана(ацетилокси)-5-[(ацетилокси)метил]тетрагидро 2-фуранил-6-[(2,2-дифенилэтил)амино]-9H-пурин-2-карбоксилата (получение 17) (2,0 г, 3,17 ммоль), карбоната натрия (35 мг) и сухого метанола (40 мл) перемешивали при комнатной температуре в течение 3,5 ч. Растворитель удаляли при пониженном давлении и остаток очищали с помощью колоночной хроматографии на силикагеле, используя градиентное элюирование смесью дихлорметана и метанола (94:6, по объему), затем смесью дихлорметана и метанола Раствор 4-изопропилпиперидина (3,3 г,20,2 ммоль), 2-бромэтилфталимида (5,4 г, 21,3 ммоль), карбоната калия (5,9 г, 45,4 ммоль) и ацетонитрила (100 мл) нагревали с обратным холодильником в течение 2,5 ч, затем перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении и остаток распределяли между этилацетатом (100 мл) и водой (100 мл). Органический слой отделяли, а водный слой экстрагировали дополнительным количеством этилацетата(100 мл). Объединенные органические экстракты сушили (Na2SO4) и растворитель удаляли путем выпаривания при пониженном давлении. Полученное масло очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентной системой из дихлорметана, заменяя смесью дихлорметана и диэтилового эфира(50:50, по объему), а затем заменяя диэтиловым эфиром, с получением соединения, указанного в заголовке (3,3 г). 1(получение 19) (3,2 г, 10,6 ммоль) в 33% масс./масс. растворе метиламина в этаноле (60 мл) нагревали с обратным холодильником в течение 3 ч. Растворитель удаляли при пониженном давлении, добавляли дополнительное количество этанола (60 мл) и растворитель снова удаляли при пониженном давлении. Остаток суспендировали в дихлорметане (100 мл) и твердое вещество отфильтровывали. Его промывали дихлорметаном(100 мл). Фильтрат выпаривали при пониженном давлении и полученное масло очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметана, метанола и 0,88 водного раствора NН 3 (90:10:1, по объему) с получением бесцветного масла. Перегонка из колбы в колбу (150-160 С, 30 мм рт.ст. К суспензии 6-[(2,2-дифенилэтил)амино]9-тетрагидро-2 Н-пиран-2-ил-9 Н-пурин-2-карбонитрила (176 г, 0,415 моль) (получение 13) в промышленно метилированных спиртах (770 мл) добавили раствор гидроксида натрия (33,3 г,0,83 моль) в деионизированной воде (110 мл). Полученную суспензию нагревали с обратным холодильником в течение времени 2,5 ч, в течение которого образовывался прозрачный раствор. Смесь оставляли охлаждаться до температуры окружающей среды в течение 16 ч, в результате чего образовался осадок. Затем добавляли воду (200 мл) и данную смесь перегоняли при атмосферном давлении. Во время перегонки к данной смеси периодически добавляли воду(500 мл) и собирали в сумме 720 мл дистиллята. Полученную смесь оставляли медленно охлаж 004861 44 даться до температуры окружающей среды, при перемешивании, и образовывался плотный осадок. Суспензию охлаждали на ледяной бане и твердое вещество собирали путем фильтрования. Осадок на фильтре промывали раствором деионизированной воды (225 мл) и промышленно метилированных спиртов (25 мл). Влажный осадок на фильтре суспендировали в смеси деионизированной воды (965 мл) и дихлорметана(965 мл) и рН данной смеси доводили до рН 1,2 путем добавления концентрированной соляной кислоты. Фазы разделяли и водный слой экстрагировали дихлорметаном (300 мл). Органические фазы объединяли и растворитель перегоняли при атмосферном давлении до тех пор, пока не собирали 750 мл дистиллята. Добавляли этилацетат (1100 мл) и перегонку продолжали до тех пор, пока не собрали дополнительные 750 мл дистиллята и не образовался осадок белого цвета с желтоватым оттенком. Полученную суспензию оставляли охлаждаться до температуры окружающей среды и дополнительно охлаждали на ледяной бане. Твердое вещество собирали путем фильтрования и осадок на фильтре промывали охлажденным этилацетатом (2 х 350 мл). Полученное твердое вещество сушили в сушильном шкафу при 70 С при пониженном давлении с получением соединения, указанного в заголовке, в виде твердого вещества белого цвета с желтоватым оттенком (163 г), т.пл. 155 С (с разложением). МСНР (положительная химическая ионизация при атмосферном давлении) (термораспыление): m/z [MH+] 444. 1 К суспензии 6-[(2,2-дифенилэтил)амино]9-(тетрагидро-2 Н-пиран-2-ил)-9H-пурин-2-карбоновой кислоты (249 г, 0,561 моль) (получение 21) в безводном тетрагидрофуране (2500 мл) в течение 10 мин добавляли N,N'-карбонилдиимидазол (109 г, 0,672 моль) в виде двух порций. Полученную смесь перемешивали при температуре окружающей среды в атмосфере азота,вследствие чего твердое вещество постепенно растворялось с получением мутного бледнооранжевого раствора. После перемешивания в 45 течение 2,5 ч реакционную смесь охлаждали на ледяной бане и добавляли раствор 2-(1 пиперидинил)этиламина (86,4 г, 0,674 моль) в безводном тетрагидрофуране (100 мл) в течение периода времени 55 мин, в течение которого образовывался прозрачный оранжевый раствор. Реакционную смесь перемешивали при комнатной температуре в течение дополнительных 17,5 ч. Затем добавляли деионизированную воду (10 мл) и реакционную смесь затем перегоняли при атмосферном давлении до тех пор, пока не собирали примерно 2400 мл дистиллята. К полученному янтарному маслу добавляли изопропанол (2000 мл) и перегонку при атмосферном давлении продолжали до тех пор, пока не собирали примерно 50 мл дистиллята. Полученный темно-оранжевый раствор оставляли охлаждаться до температуры окружающей среды и добавляли дополнительное количество изопропанола (600 мл) с получением раствора соединения, указанного в заголовке, в изопропаноле,который мог быть использован непосредственно без дальнейшей очистки. Образец для анализа готовили следующим способом. Образец вышеупомянутого раствора соединения, указанного в заголовке, в изопропаноле концентрировали при пониженном давлении до масла. Масло растворяли в этилацетате и промывали последовательно водой и насыщенным водным раствором хлорида натрия. Органическую фазу затем сушили над сульфатом магния, а затем концентрировали при пониженном давлении с получением соединения,указанного в заголовке, в виде масла. При необходимости соединение, указанное в заголовке,можно было дополнительно очистить, используя препаративные хроматографические методы, например посредством флэш-хроматографии. МСНР (положительная химическая ионизация при атмосферном давлении): m/z [MH+] 554. 1(1320 мл) в течение периода 5 мин с образованием мутного бледно-янтарного раствора. К этой перемешиваемой смеси добавляли трифторуксусную кислоту (257 мл, 3,34 моль) в течение периода 30 мин, так, что рН реакционной смеси стал ниже 2. Полученную смесь затем нагревали с обратным холодильником в течение времени 1 часа, в течение которого образовывалась суспензия. Данную смесь оставляли охлаждаться до температуры окружающей среды и перемешивали в течение 16 ч. К перемешиваемой суспензии медленно добавляли водный раствор гидроксида натрия (317 мл 10 М раствора,3,17 моль) в течение периода 30 мин до тех пор,пока рН смеси не достиг 11. рН доводили до рН 10 путем добавления трифторуксусной кислоты(4 мл) и полученную суспензию нагревали до 78 С. Данную смесь охлаждали до температуры окружающей среды в течение периода 3 ч при перемешивании. Полученную суспензию фильтровали и осадок на фильтре промывали изопропанолом (2 х 350 мл). Влажный осадок на фильтре затем суспендировали в 1-пропаноле(5000 мл) и нагревали с обратным холодильником, причем во время нагревания образовывался раствор. Данную смесь перегоняли при атмосферном давлении до тех пор, пока не собирали 1800 мл дистиллята. К данной смеси добавляли дополнительное количество 1-пропанола (1800 мл) и перегонку продолжали до тех пор, пока не собирали 2200 мл дистиллята. Перегонку прекращали и данную смесь оставляли охлаждаться до температуры окружающей среды в течение времени 16 ч при перемешивании, в течение которого происходила кристаллизация. Полученную суспензию охлаждали до 8 С на ледяной бане и твердое вещество собирали путем фильтрования. Этот осадок на фильтре промывали 1-пропанолом (1000 мл) и затем сушили при 70 С при пониженном давлении с получением соединения, указанного в заголовке, в виде твердого вещества белого цвета с желтоватым оттенком (206 г), т.пл. 222 С. МСНР (положительная химическая ионизация при атмосферном давлении): m/z [MH+] 470. 1(800 мл) в атмосфере азота добавляли раствор триметилсилилтрифторметансульфоната (200 г,0,900 моль) в безводном 1,2-диметоксиэтане(200 мл) в течение периода 15 мин. Во время добавления все твердое вещество растворилось с получением темно-красного/янтарного раствора, а температура реакционной смеси поднялась с 20 С до 31,5 С. Полученную смесь нагревали до 55-60 С и в течение периода 40 мин добавляли раствор 1,2,3,5-тетра-O-ацетилDрибофуранозы (163 г, 0,512 моль) в безводном 1,2-диметоксиэтане (400 мл). Аппарат для добавления промывали в реакционную смесь безводным 1,2-диметок-сиэтаном (200 мл). Реакционную смесь нагревали при 60 С в течение 3 ч и оставляли ее охлаждаться до температуры окружающей среды. Этот неочищенный реакционный раствор выдерживали при температуре окружающей среды в течение 18 ч. Полученную смесь, содержащую соединение, указанное в заголовке, можно использовать непосредственно без дальнейшей очистки. Образец для анализа получали следующим способом. Образец вышеупомянутого раствора добавляли к насыщенному водному раствору бикарбоната натрия и данную смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и растворитель затем удаляли при пониженном давлении с получением светло-коричневой пены. Неочищенный продукт дополнительно очищали,используя препаративные хроматографические методы, например флэш-хроматографию на силикагеле с использованием градиента смеси 5:95, заменяя 15:85, по объему, метанол:дихлорметан в качестве подвижной фазы, с получением соединения, указанного в заголовке, в виде бесцветной пены. МСНР (положительная химическая ионизация при атмосферном давлении): m/z [MH+] 728. 1(получение 15) в смеси промышленно метилированных спиртов (80 мл) и деионизированной воды (35 мл) добавляли гидроксид натрия (1,2 г,0,13 моль) и полученную смесь нагревали с обратным холодильником в течение времени 17 ч,в течение которого образовывался прозрачный раствор. Данную смесь охлаждали до температуры окружающей среды и подкисляли путем добавления 1 М водного раствора соляной кислоты (105 мл) с получением суспензии. Твердое вещество собирали путем фильтрования и сушили при пониженном давлении при 50 С с получением соединения, указанного в заголовке, в виде бесцветного твердого вещества (13,5 г), т. пл. 241-249 С. МСНР (отрицательная химическая ионизация при атмосферном давлении): m/z [M-H] 358. 1 К суспензии 6-[(2,2-дифенилэтил)амино]9 Н-пурин-2-карбоновой кислоты (0,52 г, 1,45 ммоль) (получение 25) в N,N-диметилформамиде (20 мл) добавляли N,N'-карбонилдиимидазол (0,24 г, 1,48 ммоль) и полученную смесь перемешивали при температуре окружающей среды в течение 5 ч. К этой смеси добавляли 2-(1-пиперидинил)этиламин (0,206 мл,1,45 ммоль) и полученную смесь перемешивали при температуре окружающей среды в течение 20 ч. Данную реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением масла, которое распределяли между этилацетатом (30 мл) и насыщенным водным раствором бикарбоната натрия (20 мл). Слои затем разделяли и водную фазу экстрагировали этилацетатом (30 мл). Объединенные органические фазы затем промывали по 49 следовательно насыщенным водным раствором бикарбоната натрия (30 мл) и насыщенным водным раствором хлорида натрия (30 мл), а затем сушили (МgSO4). Растворитель удаляли при пониженном давлении с получением соединения, указанного в заголовке, в виде коричневого твердого вещества (0,10 г). При необходимости очистку этого вещества можно осуществлять путем перекристаллизации из 1-пропанола. МСНР (положительная химическая ионизация при атмосферном давлении): m/z [MH+] 470. 1(9,6 мл, 69 ммоль), ацетата палладия (II) (0,0103 г. 0,046 ммоль) и 1,1'-бис(дифенилфосфино) ферроцена (0,376 г, 0,69 ммоль) в этаноле (46 мл) нагревали при 120 С в атмосфере монооксида углерода при 1725 кПа (250 фунт/кв. дюйм) в течение 18 ч. Полученную суспензию охлаждали на ледяной бане в течение 2 ч и твердое вещество собирали путем фильтрования и промывали этанолом (20 мл). Это вещество затем сушили при пониженном давлении с получением твердого вещества белого цвета с желтоватым оттенком (9,5 г). Часть этого твердого вещества (8,5 г) суспендировали в этилацетате (170 мл) и полученную смесь перемешивали при температуре окружающей среды в течение 60 ч. Данную смесь фильтровали и осадок на фильтре промывали этилацетатом (20 мл). Фильтрат затем концентрировали при пониженном давлении с получением соединения, указанного в заголовке, в виде твердого вещества рыжевато-коричневого цвета (6,45 г). Часть этого вещества (0,7 г) подвергали кристаллизации из этанола (3 мл) с получением соединения, указанного в заголовке, в виде бесцветного твердого вещества (0,54 г), т. пл. 138-140 С. 1 50 МСНР (положительная химическая ионизация при атмосферном давлении): m/z [MH+] 472. Получение 28. 6-[(2,2-Дифенилэтил)амино]-9-(тетрагидро-2 Н-пиран-2-ил)-9 Н-пурин-2 карбоновая кислота. К суспензии этил-6-[(2,2-дифенилэтил) амино]-9-(тетрагидро-2H-пиран-2-ил)-9 Н-пурин-2-карбоксилата (0,55 г, 1,16 ммоль) (получение 27) в промышленно метилированных спиртах (2,2 мл) добавили деионизированную воду (0,08 мл) с последующим добавлением 10 М водного раствора гидроксида натрия (0,23 мл,2,3 ммоль). Полученную смесь перемешивали при 65 С в течение 30 мин, и затем при температуре окружающей среды в течение времени 18 ч, в течение которого образовывалась густая паста. К данной смеси добавляли дихлорметан(10 мл) и рН доводили до 2 путем добавления разбавленного водного раствора соляной кислоты. Фазы разделяли и водный слой экстрагировали дихлорметаном (10 мл). Объединенные органические фазы затем сушили (MgSO4) и растворитель удаляли при пониженном давлении с получением соединения, указанного в заголовке, в виде пены рыжевато-коричневого цвета (0,43 г), которое, как показали 1H-ЯМР,высокоэффективная жидкостная хроматография, масс-спектрометрия и тонкослойная хроматография, было идентично соединению, полученному в получении 21. Получение 29. 6-[(2,2-Дифенилэтил)амино]-9-(тетрагидро-2 Н-пиран-2-ил)-9 Н-пурин-2 карбоновая кислота.(0,87 г, 2 ммоль) (получение 9), ацетата палладия (II) (0,002 г, 0,009 ммоль), 1,1'-бис(дифенилфосфино)ферроцена (0,033 г, 0,06 ммоль), 10 М водного раствора гидроксида натрия (0,6 мл, 6 ммоль) и тетрагидрофурана (4 мл) нагревали при 140 С в атмосфере монооксида углерода при 1725 кПа (250 фунт/кв. дюйм) в течение 12 ч. Данную смесь оставляли охлаждаться и находиться при температуре окружающей среды в 51 течение времени 16 суток, в течение которого образовывалась суспензия. Твердое вещество собирали путем фильтрования и промывали тетрагидрофураном (10 мл). Этот вещество добавляли к смеси дихлорметана (35 мл) и воды(25 мл) и рН данной смеси доводили до 1 путем добавления разбавленного водного раствора соляной кислоты при перемешивании. Слои разделяли и водную фазу экстрагировали дихлорметаном (25 мл). Объединенные органические фазы сушили (MgSO4) и растворитель удаляли при пониженном давлении с получением соединения, указанного в заголовке, в виде янтарной пены (0,45 г), которое, как показали 1HЯМР, высокоэффективная жидкостная хроматография, масс-спектрометрия и тонкослойная хроматография, было идентично, соединению,полученному в получении 21. Фармакологическая активность Соединения из предшествующих примеров тестировали на противовоспалительную активность по их способности ингибировать функцию нейтрофилов (что свидетельствует об агонистической активности в отношении А 2 а рецепторов) с помощью способа, описанного на стр. 26-27, и все они имели ИК 50 меньше, чем 1 микромоль. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы: или его фармацевтически приемлемые соль или сольват,где R1 представляет собой водород или C1 С 6 алкил, возможно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила, причем указанные фенил и нафтил возможно замещены C1 С 6 алкилом, С 1-С 6 алкокси, галогено или циано;R3 представляет собой (1) водород, C1-С 6 алкил, -COOR4, -CN, -CONR4R4, С 3-С 8 циклоалкил, фенил или нафтил, причем указанные С 3-С 8 циклоалкил, фенил и нафтил возможно замещены C1-С 6 алкилом, фенилом, C1-С 6 алкокси(С 1-С 6) алкилом, R4R4N(C1-C6)aлкилoм, галогено(С 1-С 6) алкилом, фторо(С 1-С 6)алкокси, С 2-С 5 алканоилом, галогено, -OR4, циано, -COOR4, С 3-С 8 циклоалкилом, -S(O)mR5, -NR4R4, -SO2NR4R4,-CONR4R4, -NR4COR5 или -NR4SO2R5,либо (2) если А представляет собой С 2 С 6 алкилен, то -NR4R4, -OR4, -OCOR5, -SO2R5,-SO2NR4R4 или -NR4COR5, 004861 52 либо (3) С-связанный 4-11-членный кольцевой моно- или бициклический гетероцикл,имеющий либо от 1 до 4 кольцевых атомов азота, либо 1 или 2 кольцевых атома азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы, причем указанный гетероцикл возможно С-замещен оксо, C1-С 6 алкокси(С 1-С 6)алкилом,R6R6N(C1-C6)aлкилoм, галогено(С 1-С 6)алкилом,фторо(С 1-С 6)алкокси, фторо(С 2-С 5)алканоилом,галогено, циано, -OR6, R7, -COR6, -NR6R6,-COOR6, -S(O)mR7, -SO2NR6R6, -CONR6R6,-NR6SO2R7 или -NR6COR7 и возможно Nзамещен С 1-С 6 алкокси(С 1-С 6)алкилом, R6R6N(C2-С 6)алкилом, галогено(С 1-С 6)алкилом, фторо(С 2-С 5)алканоилом, R7, -COR6, -COOR7,-SO2R7, -SO2NR6R6 или -CONR6R6,либо (4) если А представляет собой С 2 С 6 алкилен, то N-связанный азетидинил, пирролидинил, пиперидинил, пиперазинил, гомопиперазинил или морфолинил, каждый из которых возможно С-замещен С 1-С 6 алкилом, фенилом,С 1-С 6 алкокси(С 1-С 6)алкилом, R4R4N(C1-C6)aлкилoм, галогено(С 1-С 6)алкилом, фторо(С 1-С 6)алкокси, С 2-С 5 алканоилом, галогено, -OR4, циано,-COOR4, С 3-С 8 циклоалкилом, -S(O)mR5, -NR4R4,-SO2NR4R4,-CONR4R4,-NR4COR5 или 4 5R , обозначает С-связанный пирролил, имидазолил, триазолил, тиенил, фурил, тиазолил, оксазолил, тиадиазолил, оксадиазолил, пиридинил,пиримидинил, пиридазинил, пиразинил, индолил, изоиндолил, хинолинил, изохинолинил,бензимидазолил, хиназолинил, фталазинил, бензоксазолил или хиноксалинил, каждый из которых возможно замещен C1-С 6 алкилом, С 1-С 6 алкокси, циано или галогено. 2. Соединение по п.1, где R1 представляет собой С 1-С 6 алкил, возможно замещенный 1 или 2 фенильными заместителями. 3. Соединение по п.2, где R1 представляет собой 2,2-дифенилэтил. 4. Соединение по любому из пп.1-3, где R2 представляет собой Н. 5. Соединение по любому из пп.1-4, где А представляет собой C1-С 4 алкилен. 6. Соединение по п.5, где А представляет собой метилен, 1,2-этилен или 1,3-пропилен. 53 7. Соединение по п.6, где А представляет собой 1,2-этилен. 8. Соединение по любому из пп.1-7, где R3 представляет собой фенил, возможно замещенный, как определено для этого определения в п.1; либо, если А представляет собой С 2 С 6 алкилен, R3 представляет собой -NR4R4, гдеR4 такой, как определено в п.1; либо R3 представляет собой С-связанный 5-7-членный кольцевой моноциклический гетероцикл, имеющий либо от 1 до 4 кольцевых атомов азота, либо 1 или 2 кольцевых атома азота и 1 кольцевой атом кислорода или 1 кольцевой атом серы, возможно замещенный, как определено для этого определения в п.1; либо, если А представляет собой С 2-С 6 алкилен, R3 представляет собой Nсвязанный пирролидинил, пиперидинил или морфолинил, каждый из которых возможно Сзамещен, как определено для этого определения в п.1. 9. Соединение по п.8, где R3 представляет собой фенил; либо, если А представляет собой С 2-С 6 алкилен, R3 представляет собой -NR4R4,где R4 представляет собой C1-С 6 алкил; либо R3 представляет собой С-связанный 5- или 6 членный кольцевой моноциклический ароматический гетероцикл, имеющий от 1 до 4 кольцевых атомов азота, возможно замещенный, как определено для этого определения в п.1; либо,если А представляет собой С 2-С 6 алкилен, R3 представляет собой N-связанный пирролидинил,пиперидинил или морфолинил, каждый из которых возможно С-замещен C1-С 6 алкилом или-OR4, где R4 такой, как ранее определено в п.1. 10. Соединение по п.9, где R3 представляет собой фенил; либо, если А представляет собой С 2-С 6 алкилен, R3 представляет собой -N(СН 3)2; либо R3 представляет собой С-связанный пиридинил, возможно замещенный -OR6, R7, С 1 С 6 алкокси(С 1-С 6)алкилом, R6R6N(C1-C6)алкилом или -NR6R6, где R6 и R7 такие, как ранее определено в п.1; либо, если А представляет собой С 2 С 6 алкилен, R3 представляет собой пирролидин 1-ил, пиперидин-1-ил, 4-изопропилпиперидин 1-ил или морфолин-4-ил. 11. Соединение по п.10, где R3 представляет собой фенил; либо, если А представляет собой С 2-С 6 алкилен, R3 представляет собой-N(СН 3)2; либо R3 представляет собой 2 пиридинил; либо, если А представляет собой C2 С 6 алкилен, R3 представляет собой пирролидин 1-ил, пиперидин-1-ил, 4-изопропилпиперидин 1-ил или морфолин-4-ил. 12. Соединение по п.11, где, если А представляет собой С 2-С 6 алкилен, R3 представляет собой пиперидин-1-ил. 13. Соединение по любому из пп.1-4, где 54 14. Соединение по п.13, где -A-R3 представляет собой 2-(1-пиперидинил)этил. 15. Соединение по п.1, которое выбрано из группы, состоящей из 9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-[2-(1-пиперидинил)этил]9H-пурин-2-карбоксамида,9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-фенетил-9H-пурин-2-карбоксамида,9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-[2-(4-изопропил-1-пиперидинил)этил]-9 Н-пурин-2-карбоксамида,9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-[3-(1-пирролидинил)пропил]-9H-пурин-2-карбоксамида,9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-[2-(4-морфолинил)этил]9 Н-пурин-2-карбоксамида,9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-(2-пиридинилметил)-9 Нпурин-2-карбоксамида,9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-[2-(2-пиридинил)этил]-9Hпурин-2-карбоксамида и 9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-N-[2-(диметиламино)этил]-6-[(2,2-дифенилэтил)амино]9H-пурин-2-карбоксамида и их фармацевтически приемлемых солей и сольватов. 16. Соединение по п.1, представляющее собой 9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидро-2-фуранил]-6-[(2,2-дифенилэтил)амино]-N-[2-(1-пиперидинил)этил]9H-пурин-2-карбоксамид или его фармацевтически приемлемые соль или сольват. 17. Соединение по п.1, гдеR1 представляет собой водород или C1 С 6 алкил, замещенный 1 или 2 заместителями,каждый из которых независимо выбран из фенила и нафтила;R2 представляет собой водород или C1 С 6 алкил; А представляет собой С 1-С 6 алкилен; аR3 представляет собой фенил, нафтил, С 3 С 8 циклоалкил, азетидинил, пирролидинил, пиперидинил, амино, -NH(С 1-С 6 алкил) или -N(С 1 С 6 алкил)2, причем указанные фенил, нафтил, С 3 С 8 циклоалкил, азетидинил, пирролидинил и пиперидинил возможно замещены одним или более чем одним заместителем, каждый из которых независимо выбран из C1-С 6 алкила, С 1 С 6 алкокси, галогено(С 1-С 6)алкила, галогено и циано;-азетидинил, -пирролидинил или -пиперидинил,либо представляет собой амино, -NH(C1 С 6 алкил) или -N(С 1-С 6 алкил)2, то А представляет собой С 2-С 6 алкилен. 18. Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемые соль или сольват по любому из пп.1-17 вместе с фармацевтически приемлемым эксципиентом, разбавителем или носителем. 19. Применение соединения формулы (I) или его фармацевтически приемлемой соли или сольвата по любому из пп.1-17 в качестве лекарственного средства. 20. Применение соединения формулы (I) или его фармацевтически приемлемых соли или сольвата по любому из пп.1-17 для производства лекарственного средства, обладающего агонистической активностью в отношении А 2 а рецепторов. 21. Применение соединения формулы (I) или его фармацевтически приемлемых соли или сольвата по любому из пп.1-17 для производства противовоспалительного агента. 22. Применение соединения формулы (I) или его фармацевтически приемлемых соли или сольвата по любому из пп.1-17 для производства лекарственного средства для лечения респираторного заболевания. 23. Применение по п.22, где заболевание выбрано из группы, состоящей из респираторного дистресс-синдрома взрослых (РДСВ),бронхита, хронического бронхита, хронической обструктивной болезни легких, муковисцидоза,астмы, эмфиземы, бронхоэктаза, хронического синусита и ринита. 24. Применение соединения формулы (I) или его фармацевтически приемлемых соли или сольвата по любому из пп.1-17, для производства лекарственного средства для лечения септического шока, мужской эректильной дисфункции, гипертензии, удара, эпилепсии, церебральной ишемии, заболевания периферических сосудов, постишемического реперфузионного повреждения, диабета, ревматоидного артрита,рассеянного склероза, псориаза, дерматита, аллергического дерматита, экземы, неспецифического язвенного колита, болезни Крона, воспалительного заболевания кишечника, гастрита,вызванного Heliobacter pylori, гастрита, не вызванного Heliobacter pylori, повреждения желудочно-кишечного тракта, индуцированного нестероидными противовоспалительными средствами, или психотического расстройства, либо для заживления ран. 25. Способ лечения млекопитающего,включая человека, с помощью агониста А 2 а рецепторов, при котором указанное млекопитающее подвергают воздействию эффективного количества соединения формулы (I) или его 56 фармацевтически приемлемых соли, сольвата или композиции по любому из пп.1-17 и 18, соответственно. 26. Способ лечения млекопитающего,включая человека, предназначенный для лечения воспалительного заболевания, при котором указанное млекопитающее подвергают воздействию эффективного количества соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или композиции по любому из пп.1-17 и 18, соответственно. 27. Способ лечения млекопитающего,включая человека, предназначенный для лечения респираторного заболевания, при котором указанное млекопитающее подвергают воздействию эффективного количества соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или композиции по любому из пп.1-17 и 18, соответственно. 28. Способ по п.27, где заболевание выбрано из группы, состоящей из респираторного дистресс-синдрома взрослых (РДСВ), бронхита,хронического бронхита, хронической обструктивной болезни легких, муковисцидоза, астмы,эмфиземы, бронхоэктаза, хронического синусита и ринита. 29. Способ лечения млекопитающего,включая человека, предназначенный для лечения септического шока, мужской эректильной дисфункции, гипертензии, удара, эпилепсии,церебральной ишемии, заболевания периферических сосудов, постишемического реперфузионного повреждения, диабета, ревматоидного артрита, рассеянного склероза, псориаза, дерматита, аллергического дерматита, экземы, неспецифического язвенного колита, болезни Крона,воспалительного заболевания кишечника, гастрита, вызванного Heliobacter pylori, гастрита, не вызванного Heliobacter pylori, повреждения желудочно-кишечного тракта, индуцированного нестероидными противовоспалительными средствами, или психотического расстройства, либо для заживления ран, при котором указанное млекопитающее подвергают воздействию эффективного количества соединения формулы (I) или его фармацевтически приемлемых соли,сольвата или композиции по любому из пп. 1-17 и 18, соответственно. 30. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли по п.1, при котором осуществляют реакцию аминокарбонилирования соединения формулы 57 где R1 определен в п.1, а X представляет собой уходящую группу, такую как бромо, иодо,-Sn(С 1-С 12 алкил)3 или CF3SO2O-, с соединением формулы(III),где А, R2 и R3 такие, как определено в п.1, в присутствии монооксида углерода и подходящего катализатора сочетания; а затем возможно превращают в фармацевтически приемлемую соль. 31. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли по п.1, при котором удаляют защиту с соединения формулыR8 и R9, когда взяты по отдельности, представляют собой защитные группы, либо, когда взяты вместе, представляют собой защитную группу; а затем возможно превращают в фармацевтически приемлемую соль. 32. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли по п.1, при котором удаляют защиту с соединения формулыR11, R12 и R13, взятые по отдельности, представляют собой защитные группы, либо R11 представляет собой защитную группу, а R12 и R13,взятые вместе, представляют собой защитную группу; а затем возможно превращают в фармацевтически приемлемую соль. 33. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли по п.1, при котором соединение формулы(III),где А, R2 и R3 такие, как определено в п.1, и,если R17 представляет собой Н, то в присутствии агента пептидного сочетания; а затем возможно превращают в его фармацевтически приемлемую соль. 34. Соединение формулы где Х представляет собой уходящую группу,такую как бромо, иодо, -Sn(С 1-С 12 алкил)3 илиCF3SO2O-, a R1 такой, как определено в п.1, при условии, что если Х представляет собой бромо или иодо, R1 не представляет собой Н. 35. Соединение формулы где R8 и R9, когда взяты по отдельности, представляют собой защитные группы, либо, когда взяты вместе, представляют собой защитную группу; а А, R1, R2 и R3 такие, как определено в п.1. 36. Соединение формулы где R11, R12 и R13, взятые по отдельности, представляют собой защитные группы, либо R11 представляет собой защитную группу, а R12 иR13, взятые вместе, представляют собой защитную группу; a A, R1, R2 и R3 такие, как определено в п.1. 37. Соединение формулы где R17 представляет собой Н или эфиробразующую группу; а R1 представляет собой C1 С 6 алкил, возможно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из фенила и нафтила, причем указанные фенил и нафтил возможно замещены C1 С 6 алкилом, C1-С 6 алкокси, галогено или циано. 38. Соединение по любому из пп.34-37, гдеR8 и R9, когда взяты по отдельности, каждый представляет собой ацетил или бензоил, либо,когда взяты вместе, представляют собой 1,1 диметилметилен. 41. Соединение формулы (XII) по п.36, гдеR11, R12 и R13, когда взяты по отдельности, каждый представляет собой ацетил или бензоил,либо R12 и R13, когда взяты вместе, представляют собой 1,1-диметилметилен. 42. Соединение формулы (XXV) по п.37,где R17 представляет собой C1-С 4 алкил, предпочтительно метил или этил.
МПК / Метки
МПК: C07H 19/16, C07D 473/34, A61P 11/00, A61K 31/70
Метки: производные, пурина
Код ссылки
<a href="https://eas.patents.su/30-4861-proizvodnye-purina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пурина</a>
Предыдущий патент: Ингибиторы обратного захвата моноаминов для лечения расстройств цнс
Следующий патент: Кальцийдикарбоксилатные эфиры, способы их получения, фармацевтические композиции и способ лечения
Случайный патент: Панелеобразный громкоговоритель











