Производные изотиазола, применимые в качестве противораковых агентов
Номер патента: 4935
Опубликовано: 28.10.2004
Авторы: Ное Марк Карл, Гант Томас Джордж, Ларсон Эрик Роберт
Формула / Реферат
1. Соединение формулы
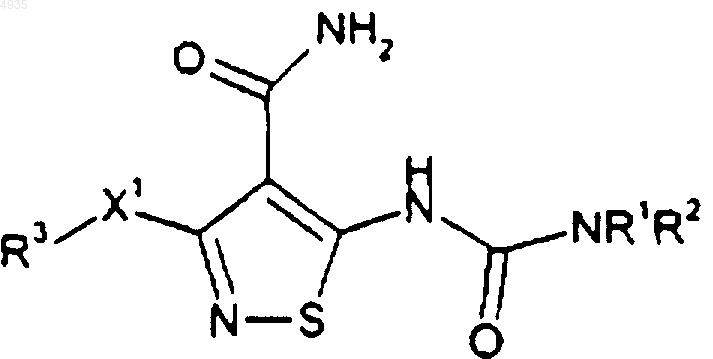
или его фармацевтически приемлемая соль, пролекарство и сольват, где
X1 обозначает O или S;
R1 обозначает -(CH2)t(4-5-членный гетероцикл), где t обозначает целое число от 0 до 5; указанный гетероцикл необязательно конденсирован с C6-C10-арильной группой, C3-C8-насыщенной циклической группой или 5-10-членной гетероциклической группой; и указанная группа R1, включающая необязательно конденсированные части указанной группы R1, необязательно замещена 1 или 2 группами, выбранными из C1-C4-алкил, гидрокси и гидроксиметил;
R2 обозначает H;
R3 обозначает H, C1-C10-алкил, C2-C10-алкенил, -(CH2)t(C6-C10-арил) или -(CH2)t(5-10-членный гетероцикл), где t обозначает целое число от 0 до 5; указанная алкильная группа необязательно включает в себя 1 или 2 гетерочасти, выбранные из O, S и -N(R6)-, при условии что два атома O, два атома S или атомы O и S не присоединены непосредственно друг к другу; указанные арильная и гетероциклическая группы R3 необязательно конденсированы с C6-C10-арильной группой, C5-C8-насыщенной циклической группой или 5-10-членной гетероциклической группой; 1 или 2 атома углерода в вышеуказанных гетероциклических частях молекулы необязательно замещены оксо (=O)-частью; -(CH2)t-части вышеуказанных групп R3 необязательно включают в себя двойную или тройную углерод-углеродную связь, когда t обозначает целое число от 2 до 5; и вышеуказанные группы R3, за исключением H, необязательно замещены 1-5 группами R4;
каждый R4 независимо выбран из C1-C10-алкила, C2-C10-алкенила, C2-C10-алкинила, галогена, циано, нитро, трифторметила, трифторметокси, азидо, -OR5, -C(O)R5, -C(O) OR5, -NR6C(O)OR5, -OC(O)R5, -NR6SO2R5, -SO2NR5R6, -NR6C(O)R5, -C(O)NR5R6, -NR5R6, -S(O)jR7, где j обозначает целое число от 0 до 2, -SO3H, -NR5(CR6R7)tOR6, - (CH2)t(C6-C10-арил), -SO2(CH2)t(C6-C10-арил), -S(CH2)t(C6-C10-арил), -O(CH2)t(C6-C10-арил), -(CH2)t (5-10-членный гетероцикл) и -(CR6R7)mOR6, где m обозначает целое число от 1 до 5 и t обозначает целое число от 0 до 5; указанная алкильная группа необязательно содержит 1 или 2 гетерочасти, выбранные из O, S и -N(R6)-, при условии, что два атома O, два атома S или атом O и S не присоединены непосредственно друг к другу; указанные арильная и гетероциклическая группы R4 необязательно конденсированы с C6-C10-арильной группой, C5-C8-насыщенной циклической группой или 5-10-членной гетероциклической группой; 1 или 2 атома углерода в вышеуказанных гетероциклических частях молекулы необязательно замещены оксо(=O)-частью; и алкильная, арильная и гетероциклическая части вышеуказанных групп R4 необязательно замещены 1-3 заместителями, независимо выбранными из галогена, циано, нитро, трифторметила, трифторметокси, азидо, -NR6SO2R5, -SO2NR5R6, -C(O)R5, -C (O) OR5, -OC(O)R5, -NR6C(O)R5, -C(O)NR5R6, -NR5R6, - (CR6R7)mOR6, где m обозначает целое число от 1 до 5, -OR5 и заместителей, перечисленных в определении R5;
каждый R5 независимо выбран из H, C1-C10-алкила, -(CH2)t(C6-C10-арил) и - (CH2)t(5-10-членный гетероцикл), где t обозначает целое число от 0 до 5; указанная алкильная группа необязательно включает в себя 1 или 2 гетерочасти, выбранные из O, S и -N(R6)-, при условии, что два атома O, два атома S или атом O и S не присоединены непосредственно друг к другу; указанные арильная и гетероциклическая группы R5 необязательно конденсированы с C6-C10-арильной группой, C5-C8-насыщенной циклической группой или 5-10-членной гетероциклической группой; и вышеуказанные заместители R5, за исключением H, необязательно замещены 1-3 заместителями, независимо выбранными из галогена, циано, нитро, трифторметила, трифторметокси, азидо, -C(O)R6, -C(O)OR6, -CO(O)R6, -NR6C(O)R7, -C(O)NR6R7, -NR6R7, гидрокси, C1-C6-алкила и C1-C6-алкокси; и каждый R6 и R7 обозначает независимо H или C1-C6-алкил.
2. Соединение по п.1, где R3 представляет собой -(CH2)t(6-10-членный арил), где t обозначает целое число от 0 до 3 и указанная R3 группа необязательно замещена группами R4 в количестве от 1 до 4.
3. Соединение по п.2, где R3 обозначает бензил, необязательно замещенный заместителями в количестве от 1 до 4, выбранными из галогена и C1-C4-алкила.
4. Соединение по п.3, где R3 обозначает бензил, необязательно замещенный заместителями в количестве от 1 до 4, выбранными из метила, фтора, хлора и брома.
5. Соединение по п.1, где R1 обозначает -(CH2)t(4-членный гетероцикл).
6. Соединение по п.1, где R1 обозначает -(CH2)t(5-членный гетероцикл).
7. Соединение по п.6, где 5-членный гетероцикл выбран из группы, состоящей из пирролидина, имидазола, фурана и тетразола.
8. Соединение по п.7, где 5-членный гетероцикл представляет собой пирролидин.
9. Соединение по п.1, выбранное из группы, включающей
мезилатную соль амида 3-(4-бром-2,6-дифторбензилокси)-5-[3-(4-пирролидин-1-илбутил)уреидо]изотиазол-4-карбоновой кислоты;
гидрохлоридную соль амида 3-(4-бром-2,6-дифторбензилокси)-5-[3-(4-пирролидин-1-илбутил)уреидо]изотиазол-4-карбоновой кислоты;
амид 3-(4-хлор-2,6-дифторбензилокси)-5-[3-(4-пирролидин-1-илбутил)уреидо]изотиазол-4-карбоновой кислоты;
амид 3-(4-хлор-2,6-дифторбензилокси)-5-{3-[(1-метилпирролидин-2-ил)этил]уреидо}изотиазол-4-карбоновой кислоты;
амид 3-(4-хлор-2,6-дифторбензилокси)-5-[3-(3-гидрокси-5-пирролидин-1-илпентил)уреидо]изотиазол-4-карбоновой кислоты;
амид 3-(2,5-дифтор-4-метилбензилокси)-5-{3-[4-(3,4-дигидроксипирролидин-1-ил)бутил]уреидо}изотиазол-4-карбоновой кислоты;
амид 3-(4-хлор-2,6-дифторбензилокси)-5-{3-[4-(3,4-дигидроксипирролидин-1-ил)бутил]уреидо}изотиазол-4-карбоновой кислоты;
амид 3-(2,5-дифтор-4-метилбензилокси)-5-{3-[4-(2-гидроксиметилпирролидин-1-ил)бутил]уреидо}изотиазол-4-карбоновой кислоты;
амид 3-(4-хлор-2,6-дифторбензилокси)-5-{3-[4-(2-гидроксиметилпирролидин-1-ил)бутил]уреидо}изотиазол-4-карбоновой кислоты;
амид 3-(2,5-дифтор-4-метилбензилокси)-5-{3-[4-(3-гидроксипирролидин-1-ил)бутил]уреидо}изотиазол-4-карбоновой кислоты;
амид 3-(4-бром-2,6-дифторбензилокси)-5-[3-(4-пирролидин-1-илбутил)уреидо]изотиазол-4-карбоновой кислоты;
амид 3-(2,6-дифтор-4-метилбензилокси)-5-[3-(3-гидрокси-5-пирролидин-1-илпентил)уреидо]изотиазол-4-карбонотющ кислоты;
амид 5-[3-(4-пирролидин-1-илбутил)уреидо]-3-(2,3,6-трифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты;
амид 5-[3-(3-гидрокси-5-пирролидин-1-илпентил)уреидо]-3-(2,3,6-трифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты;
амид 3-(4-хлор-2,3,6-трифторбензилокси)-5-{3-[2-(1-метилпирролидин-2-ил)этил]уреидо}изотиазол-4-карбоновой кислоты;
амид 3-(4-хлор-2,3,6-трифторбензилокси)-5-[3-(4-пирролидин-1-илбутил)уреидо]изотиазол-4-карбоновой кислоты;
амид 3-(4-хлор-2,3,6-трифторбензилокси)-5-{3-[4-(2-гидроксиметилпирролидин-1-ил)бутил]уреидо}изотиазол-4 -карбоновой кислоты;
амид 5-{3-[2-(1-метилпирролидин-2-ил)этил]уреидо}-3-(2,3,6-трифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты;
амид 5-[3-(3-пирролидин-1-илпропил)уреидо]-3-(2,3,6-трифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты;
амид 3-(4-хлор-2,6-дифторбензилокси)-5-[3-(4-имидазол-1-илбутил)уреидо]изотиазол-4-карбоновой кислоты;
амид 3-(4-хлор-2,3,6-трифторбензилокси)-5-[3-(3-гидрокси-5-пирролидин-1-илпентил)уреидо]изотиазол-4-карбоновой кислоты;
амид 3-(2,6-дифтор-4-метилбензилокси)-5-{3-[2-(1-метилпирролидин-2-ил)этил]уреидо}изотиазол-4-карбоновой кислоты;
амид 3-(4-бром-2,3,6-трифторбензилокси)-5-[3-(4-пирролидин-1-илбутил)уреидо]изотиазол-4-карбоновой кислоты;
амид 3-(4-хлор-2,3,6-трифторбензилокси)-5-[3-(4-имидазол-1-илбутил)уреидо]изотиазол-4-карбоновой кислоты;
амид 3-(2,6-дифтор-4-метилбензилокси)-5-[3-(3-пирролидин-1-илпропил)уреидо]изотиазол-4-карбоновой кислоты и
фармацевтически приемлемые соли, пролекарства и сольваты этих соединений.
10. Амид 3-(4-бром-2,6-дифторбензилокси)-5-[3-(4-пирролидин-1-илбутил)уреидо]изотиазол-4-карбоновой кислоты, фармацевтически приемлемая соль указанного соединения, пролекарство указанного соединения или указанная фармацевтически приемлемая соль указанного соединения.
11. Соединение по п.9, где указанным соединением является гидрохлоридная соль амида 3-(4-бром-2,6-дифторбензилокси)-5-[3-(4-пирролидин-1-илбутил)уреидо]изотиазол-4-карбоновой кислоты.
12. Соединение по п.9, где указанным соединением является мезилатная соль амида 3-(4-бром-2,6-дифторбензилокси)-5-[3-(4-пирролидин-1-илбутил)уреидо]изотиазол-4-карбоновой кислоты.
13. Фармацевтическая композиция для лечения гиперпролиферативного нарушения у млекопитающего, которая содержит терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель.
14. Фармацевтическая композиция по п.13, где указанное гиперпролиферативное нарушение представляет собой рак, выбранный из рака мозга, легкого, плоскоклеточного рака, рака мочевого пузыря, рака желудка, поджелудочной железы, молочной железы, головы, шеи, почки, яичника, простаты, колоректального рака, эзофагеального рака, гинекологического рака и рака щитовидной железы.
15. Фармацевтическая композиция по п.13, где указанное нарушение является нераковым гиперпролиферативным нарушением.
16. Фармацевтическая композиция по п.15, где указанное нарушение является доброкачественной гиперплазией кожи или простаты.
17. Фармацевтическая композиция по п.13, где указанным соединением является гидрохлоридная соль амида 3-(4-бром-2,6-дифторбензилокси)-5-[3-(4-пирролидин-1-илбутил)уреидо]изотиазол-4-карбоновой кислоты.
18. Фармацевтическая композиция по п.13, где указанным соединением является мезилатная соль амида 3-(4-бром-2,6-дифторбензилокси)-5-[3-(4-пирролидин-1-илбутил)уреидо]изотиазол-4-карбоновой кислоты.
19. Способ лечения гиперпролиферативного нарушения у млекопитающего, который включает введение указанному млекопитающему терапевтически эффективного количества соединения по п.1.
20. Способ по п.19, где указанный способ предназначен для лечения рака, выбранного из рака мозга, легкого, плоскоклеточного рака, рака мочевого пузыря, рака желудка, поджелудочной железы, молочной железы, головы, шеи, почки, яичника, простаты, колоректального рака, эзофагеального рака, гинекологического рака и рака щитовидной железы.
21. Способ по п.20, где указанный способ предназначен для лечения неракового гиперпролиферативного нарушения.
22. Способ по п.21, где указанный способ предназначен для лечения доброкачественной гиперплазии кожи или простаты.
23. Способ лечения гиперпролиферативного нарушения у млекопитающего, который предусматривает введение указанному млекопитающему терапевтически эффективного количества соединения по п.1 в комбинации с противоопухолевым агентом, выбранным из группы, состоящей из ингибиторов митоза, алкилирующих агентов, антиметаболитов, интеркалирующихся антибиотиков, ингибиторов факторов роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомераз, модификаторов биологического ответа, антигормонов, антагониста рецептора NK1, антагониста рецептора 5-HT3, ингибитора COX-2, ингибитора EGFR и антиандрогенов.
Текст
1 Предпосылки изобретения Данное изобретение относится к новым производным изотиазола, которые применимы в лечении гиперпролиферативных заболеваний,таких как рак, у млекопитающих. Данное изобретение относится также к способу применения таких соединений в лечении гиперпролиферативных заболеваний у млекопитающих, в частности людей, и к фармацевтическим композициям, содержащим такие соединения. Известно, что клетка может становиться злокачественной вследствие превращения части ее ДНК в онкоген (т.е. ген, который при активации приводит к образованию злокачественных опухолевых клеток). Многие онкогены кодируют белки, которые являются аберрантными тирозинкиназами, способными вызывать клеточную трансформацию. Альтернативно, сверхэкспрессия нормальной протоонкогенной тирозинкиназы может также приводить к пролиферативным нарушениям, приводя иногда к злокачественному фенотипу. Было также показано, что некоторые тирозинкиназы могут быть мутированы или сверхэкспрессированы в случае многих раковых опухолей человека, таких как рак мозга, легкого, плоскоклеточный (дермоидный) рак, рак мочевого пузыря, рак желудка, рак молочной железы, рак головы и шеи, рак пищевода, гинекологические раковые опухоли и раковые опухоли щитовидной железы. Кроме того, сверхэкспрессия лиганда для тирозинкиназного рецептора может приводить к увеличению состояния активации этого рецептора, приводя к пролиферации опухолевых клеток или эндотелиальных клеток. Таким образом, считается, что ингибиторы рецепторных тирозинкиназ, такие как соединения данного изобретения, применимы в качестве селективных ингибиторов роста раковых клеток млекопитающих. Известно, что полипептидые факторы роста, такие как фактор роста эндотелия сосудов(VEGF), имеющий высокую аффинность в отношении рецептора, содержащего доменвставку киназы человека (KDR), или рецептора киназы 1 фетальной мышиной печени (FLK-1),были связаны с пролиферацией эндотелиальных клеток и, более конкретно, новообразованием кровеносных сосудов (васкулогенезом) и развитием кровеносных сосудов (ангиогенезом). См. публикацию международной заявки РСТ с номером WO 95/21613 (опубликованную 17 августа 1995 года). Такие агенты, как соединения данного изобретения, которые способны связываться с рецептором KDR/FLK-1, могут быть использованы для лечения нарушений, связанных с новообразованием или развитием кровеносных сосудов, таких как диабет, диабетическая ретинопатия, гемангиома, глиома, метанома, саркома Капоши и рак яичников, молочной железы, легкого, поджелудочной железы, предстательной железы, ободочной кишки и эпидермоидный рак.FMC Corporation. Сущность изобретения Данное изобретение относится к соединениям формулы 1 и к их фармацевтически приемлемым солям,пролекарствам и сольватам, где-С(О)(СН 2)t(5-10-членный гетероцикл), где t обозначает целое число от 0 до 5; указанная алкильная группа необязательно включает в себя 1 или 2 гетерочасти, выбранные из О, S и -N(R6)-,при условии, что два атома О, два атома S или атом О и S не присоединены непосредственно друг к другу; указанные арильная и гетероциклическая группы R1 необязательно конденсированы с С 6-С 10-арильной группой, C5-C8-насыщенной циклической группой или 5-10-членной гетероциклической группой; 1 или 2 атома углерода в вышеуказанных гетероциклических частях молекулы необязательно замещены оксо(=О)-частью; -(СН 2)t- части вышеуказанных групп R1 необязательно включают в себя двойную или тройную углерод-углеродную связь,где t обозначает целое число от 2 до 5; и вышеуказанные группы R1, за исключением Н, необязательно замещены 1-3 группами R4;(CH2)t(С 6-С 10-арил), -SO2 (CH2)t(5-10-членный гетероцикл) и -OR5, t обозначает целое число от 0 до 5, -(СН 2)t-части вышеуказанных групп R2 необязательно включают в себя двойную или тройную углерод-углеродную связь, где t обозначает целое число от 2 до 5, и вышеуказанные группы R2 необязательно замещены 1-3 группами R4; или R1 и R2 взятые вместе с азотом, к которому каждый из них присоединен, могут образовывать 4-10-членное насыщенное моноциклическое или полициклическое кольцо или 5-10 членное гетероарильное кольцо, где указанные насыщенное и гетроарильное кольца необязательно включают в себя 1 или 2 гетероатома,выбранных из О, S и -N(R6)-, кроме азота, к которому присоединены R1 и R2, указанный-N(R6)- представляет собой необязательно =Nили -N=, где R1 и R2 взяты вместе в виде указанной гетероарильной группы, указанное насыщенное кольцо необязательно может быть частично ненасыщенным в результате включения 1 или 2 двойных углерод-углеродных связей и указанные насыщенные и гетероарильные 3 кольца, в том числе группа R6 указанногоR3 обозначает Н, C1-С 10-алкил, С 2-С 10 алкенил, С 2-С 10-алкинил, -(СН 2)t(С 6-С 10-арил) или -(СН 2)t (5-10-членный гетероцикл), где t обозначает целое число от 0 до 5; указанная алкильная группа необязательно включает в себя 1 или 2 гетерочасти, выбранные из О, S и -N(R6)-,при условии, что два атома О, два атома S или атом О и S не присоединены непосредственно друг к другу; указанные арильная и гетероциклическая группы R3 необязательно конденсированы с С 6-С 10-арильной группой, С 5-С 8-насыщенной циклической группой или 5-10 членной гетероциклической группой; 1 или 2 атома углерода в вышеуказанных гетероциклических частях молекулы необязательно замещены оксо(=O)-частью; -(СН 2)t-части вышеуказанных групп R3 необязательно включают в себя двойную или тройную углерод-углеродную связь, где t обозначает целое число от 2 до 5; и вышеуказанные группы R3, за исключением Н,необязательно замещены 1-5 группами R4; каждый R4 независимо выбран из C1-С 10 алкила, С 2-С 10-алкенила, С 2-С 10-алкинила, галогена, циано, нитро, трифторметила, трифторметокси, азидо, -OR5, -C(O)R5, -C(O)OR5,-NR6C(O)OR5,-OC(O)R5,-NR6SO2R5,5 6 6 5 5 6-SO2NR R , -NR C(O)R , -C(O)NR R , -NR5R6,-S(O)jR7, где j обозначает целое число от 0 до 2,-SO3H, -NR5(CR6R7)tOR6, -(СН 2)t(С 6-С 10-арил),-SO2(СН 2)t(С 6-С 10-арил),S(CH2)t(С 6-С 10-арил),-O(СН 2)t(С 6-С 10-арил), -(CH2)t(5-10-членный гетероцикл ) и -(CR6R7)mOR6, где m обозначает целое число от 1 до 5 и t обозначает целое число от 0 до 5; указанная алкильная группа необязательно содержит 1 или 2 гетерочасти, выбранные из О, S и -N(R6)-, при условии, что два атома О, два атома S или атом О и S не присоединены непосредственно друг к другу; указанные арильная и гетероциклическая группы R4 необязательно конденсированы с С 6-С 10-арильной группой, C5-С 8-насыщенной циклической группой или 5-10-членной гетероциклической группой; 1 или 2 атома углерода в вышеуказанных гетероциклических частях молекулы необязательно замещены оксо(=0)-частью; и алкильная,арильная и гетероциклическая части вышеуказанных групп R4 необязательно замещены 1-3 заместителями, независимо выбранными из галогена, циано, нитро, трифторметила, трифторметокси, азидо, -NR6SO2R5, -SO2NR5R6, -C(O)R5,-С(О)OR5, -OC(O)R5, -NR6C(O)R5, -C(O)NR5R6,-NR5R6, -(CR6R7)mOR6, где m обозначает целое число от 1 до 5, -OR5 и заместителей, перечисленных в определении R5; каждый R5 независимо выбран из Н, C1 С 10-алкила, -(СН 2)t(С 6-С 10-арил) и -(СН 2)t(5-10 членный гетероцикл), где t обозначает целое число от 0 до 5; указанная алкильная группа необязательно включает в себя 1 или 2 гетеро 004935 4 части, выбранные из О, S и -N(R6)-, при условии, что два атома О, два атома S или атом О иS не присоединены непосредственно друг к другу; указанные арильная и гетероциклическая группы R5 необязательно конденсированы с С 6 С 10-арильной группой, С 5-С 8-насыщенной циклической группой или 5-10-членной гетероциклической группой; и вышеуказанные заместители R5, за исключением Н, необязательно замещены 1-3 заместителями, независимо выбранными из галогена, циано, нитро, трифторметила,трифторметокси, азидо, -C(O)R6, -С(О)OR6,-CO(O)R6, -NR6C(O)R7, -C(O)NR6R7, -NR6R7,гидрокси, C1-С 6-алкила и C1-С 6-алкокси; и каждый R6 и R7 обозначает независимо Н или C1-С 6-алкил; при условии, что исключаются следующие соединения формулы 1: 1-метил-3-(4-карбамоил-3-этокси-5-изотиазолил)мочевина, 1,1-диметил-3-(4-карбамоил-3-этокси-5-изотиазолил) мочевина, 1-метил-3-(4-карбамоил-3-пропокси 5-изотиазолил)мочевина, 1-метил-3-(4-карбамоил-3-(метилтио)-5-изотиазолил)мочевина, 1-метил-3-(4-карбамоил-3-(этилтио)-5-изотиазолил) мочевина, 1,1-диметил-3-(4-карбамоил-3-(этилтио)-5-изотиазолил)мочевина, 1-метил-3-(4-карбамоил-3-(пропилтио)-5-изотиазолил)мочевина,1,1-диметил-3-(4-карбамоил-3-(пропилтио)-5 изотиазолил)мочевина или 1-метил-3-(4 карбамоил-3-(изопропилтио)-5-изотиазолил) мочевина. Предпочтительные соединения включают в себя соединения формулы 1, где R2 представляет собой Н и R1 представляет собой C1-С 10 алкил, необязательно замещенный 1 или 2 заместителями, независимо выбранными из-NR5R6, NR5 (CR6R7)tOR6 и -(СН 2)t(5-10-членный гетероцикл), где t обозначает целое число от 0 до 5. Характерные предпочтительные группы R1 включают в себя пропил, бутил, пентил и гексил, необязательно замещенные диметиламино,гидрокси, пирролидинилом, морфолино и этил(2-гидроксиэтил)амино. Другие предпочтительные соединения включают в себя соединения формулы 1, в которых R2 представляет собой Н и R1 представляет собой -(СН 2)t(5-10-членный гетероцикл), где t обозначает целое число от 0 до 5; указанная гетероциклическая группа необязательно конденсирована с С 6-С 10-арильной группой, C5-C8 насыщенной циклической группой или 5-10 членной гетероциклической группой; и указанная группа R1, в том числе необязательно конденсированные части указанной группы R1, необязательно замещены 1 или 2 заместителями,независимо выбранными из С 1-С 4-алкила, гидрокси и гидроксиметила. Характерными предпочтительными гетероциклическими группами указанной группы R1 являются морфолино,пирролидинил, имидазолил, пиперазинил, пиперидинил и 2,5-диазабицикло[2,2,1]гепт-2-ил,переменная t указанной группы R1 равна 2-5 и 5 указанные гетероциклические группы являются необязательно замещенными гидрокси, гидроксиметилом и метилом. Другие предпочтительные соединения включают в себя соединения формулы 1, в которых R3 представляет собой -(СН 2)t(С 6-С 10 арил), где t является целым числом от 1 до 3, и указанная группа R3 необязательно замещена 14 группами R4. Характерные предпочтительные группы R3 включают в себя бензил, необязательно замещенный 1-4 заместителями, независимо выбранными из галогена и С 1-С 4-алкила. Более конкретные предпочтительные группы R3 включают в себя бензил, замещенный 1-4 заместителями, независимо выбранными из метила,фтора, хлора и брома. Характерные варианты данного изобретения включают в себя следующие соединения: амид 5-3-[3-(4-метилпиперазин-1-ил)пропил]уреидо-3-(2,3,6-трифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты; амид 3-(4-хлор-2,6-дифторбензилокси)-5(3-4-[этил-(2-гидроксиэтил)амино]бутил уреидо)изотиазол-4-карбоновой кислоты; амид 3-(2-фтор-4-метилбензилокси)-5-3[3-(4-метилпиперазин-1-ил)пропил]уреидо изотиазол-4-карбоновой кислоты; амид 3-(2,5-дифтор-4-метилбензилокси)-5[3-4-[4-(2-гидроксиэтил)пиперазин-1-ил]бутилуреидо]изотиазол-4-карбоновой кислоты; амид 3-(2,5-дифтор-4-метилбензилокси)-5[3-(6-диметиламиногексил)уреидо]изотиазол-4 карбоновой кислоты; амид 3-(2-фтор-4-метилбензилокси)-5-[3(5-изопропиламино-пентил)уреидо]изотиазол-4 карбоновой кислоты; амид 3-(4-хлор-2,6-дифторбензилокси)-5[3-(4-пирролидин-1-илбутил)уреидо]изотиазол 4-карбоновой кислоты; амид 3-(4-хлор-2,6-дифторбензилокси)-53-[3-(4-метилпиперазин-1-ил)пропил]уреидо изотиазол-4-карбоновой кислоты; амид 3-(4-хлор-2,6-дифторбензилокси)-53-[(1-метилпирролидинил-2-ил)этил]уреидо изотиазол-4-карбоновой кислоты; амид 3-(2,6-дифтор-4-метилбензилокси)-5[3-(4-пирролидин-1-ил-бутил)уреидо]изотиазол 4-карбоновой кислоты; амид 3-(2,6-дифтор-4-метилбензилокси)-5[3-4-[4-(2-гидроксиэтил)пиперазин-1-ил]бутилуреидо]изотиазол-4-карбоновой кислоты; амид 3-(4-хлор-2,6-дифторбензилокси)-5[3-(3-гидрокси-5-пирролидин-1-илпентил) уреидо]изотиазол-4-карбоновой кислоты; амид 3-(2,5-дифтор-4-метилбензилокси)-53-[4-(3,4-дигидроксипирролидин-1-ил)бутил] уреидоизотиазол-4-карбоновой кислоты; амид 3-(4-хлор-2,6-дифторбензилокси)-53-[4-(3,4-дигидроксипирролидин-1-ил)бутил] уреидоизотиазол-4-карбоновой кислоты; 6 амид 3-(2,5-дифтор-4-метилбензилокси)-53-[4-(2-гидроксиметилпирролидин-1-ил)бутил] уреидоизотиазол-4-карбоновой кислоты; амид 3-(4-хлор-2,6-дифторбензилокси)-53-[4-(2-гидроксиметилпирролидин-1-ил)бутил] уреидоизотиазол-4-карбоновой кислоты; амид 3-(2,5-дифтор-4-метилбензилокси)-53-[4-(3-гидроксипирролидин-1-ил)бутил]уреидоизотиазол-4-карбоновой кислоты; амид 3-(4-бром-2,6-дифторбензилокси)-5[3-(4-пирролидин-1-илбутил)уреидо]изотиазол 4-карбоновой кислоты; мезилатную соль 3-(4-бром-2,6-дифторбензилокси)-5-[3-(4-пирролидин-1-илбутил)уреидо] изотиазол-4-карбоновой кислоты; амид 3-(2,6-дифтор-4-метилбензилокси)-5[3-(4-гидрокси-5-пиперидин-1-илпентил)уреидо]изотиазол-4-карбоновой кислоты; амид 3-(2,5-дифтор-4-метилбензилокси)-5[3-(4-(3-гидрокси-5-пиперидин-1-ил)пентил) уреидо]изотиазол-4-карбоновой кислоты; амид 3-(4-хлор-2,6-дифторбензилокси)-53-[4-(2-гидрокси-метилпиперидин-1-ил)бутил] уреидоизотиазол-4-карбоновой кислоты; амид 3-(2,5-дифтор-4-метилбензилокси)-5(3-4-[этил(2-гидроксиэтил)амино]бутилуреидо)изотиазол-4-карбоновой кислоты; амид 3-(4-хлор-2,6-дифторбензилокси)-5[3-(5-гидрокси-6-пиперидин-1-ил)гексилуреидо]изотиазол-4-карбоновой кислоты; амид 3-(4-бром-2,3,6-трифторбензилокси)5-3-[3-(4-метил-пиперазин-1-ил)пропил]уреидоизотиазол-4-карбоновой кислоты; амид 3-(2,6-дифтор-4-метилбензилокси)-53-[3-(4-метилпиперазин-1-ил)пропил]уреидо изотиазол-4-карбоновой кислоты; гидрохлоридную соль амида 3-(4-бром-2,6 дифторбензилокси)-5-[3-(4-пирролидин-1 илбутил)уреидоизотиазол-4-карбоновой кислоты; амид 3-(2,6-дифтор-4-метилбензилокси)-5[3-(3-гидрокси-5-пирролидин-1-илпентил)уреидо]изотиазол-4-карбоновой кислоты; амид 5-[3-(4-пирролидин-1-илбутил)уреидо]-3-(2,3,6-трифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты; амид 5-[3-(3-гидрокси-5-пирролидин-1 илпентил)уреидо]-3-(2,3,6-трифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты; амид 3-(4-хлор-2,6-дифторбензилокси)-53-[3-(5-метил-2,5-диазабицикло[2,2,1]гепт-2 ил)пропил]уреидо]изотиазол-4-карбоновой кислоты; амид 3-(4-хлор-2,3,6-трифторбензилокси)5-3-[3-(5-метил-2,5-диазабицикло[2,2,1]гепт-2 ил)пропил]уреидоизотиазол-4-карбоновой кислоты; амид 3-(4-хлор-2,3,6-трифторбензилокси)5-3-[2-(1-метилпирролидин-2-ил)этил]уреидо изотиазол-4-карбоновой кислоты; 8 амид 3-(4-хлор-2,3,6-трифторбензилокси)5-[3-(4-имидазол-1-илбутил)уреидо]изотиазол 4-карбоновой кислоты; амид 3-(4-хлор-2,6-дифторбензилокси)-5(3-3-[этил(2-гидроксиэтил)амино]пропил уреидо)изотиазол-4-карбоновой кислоты; амид 3-(4-хлор-2,3,6-трифторбензилокси)5-(3-3-[этил(2-гидроксиэтил)амино]пропил уреидо)изотиазол-4-карбоновой кислоты; амид 5-[3-(3-метиламинопропил)уреидо]3-(2,3,6-трифтор-4-метилбензилокси)изотиазол 4-карбоновой кислоты; амид 5-[3-(3-аминопропил)-3-метилуреидо]-3-(2,3,6-трифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты; амид 5-[3-(4-диэтиламинобутил)уреидо]-3(2,3,6-трифтор-4-метилбензилокси)изотиазол-4 карбоновой кислоты; амид 3-(2,6-дифтор-4-метилбензилокси)-5[3-(3-пирролидин-1-илпропил)уреидо]изотиазол-4-карбоновой кислоты; амид 3-(3-хлор-2,6-дифтор-4-метилбензилокси)-5-[3-(4-диметиламинобутил)уреидо] изотиазол-4-карбоновой кислоты; амид 5-(3-4-[бис-(2-гидроксиэтил)амино] бутилуреидо)-3-(2,6-дифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты; и фармацевтически приемлемые соли и гидраты вышеуказанных соединений. Данное изобретение относится также к фармацевтической композиции для лечения гиперпролиферативного нарушения у млекопитающего, которая содержит терапевтически эффективное количество соединения формулы 1 или его фармацевтически приемлемой соли или гидрата и фармацевтически приемлемый носитель. В одном варианте, данная фармацевтическая композиция предназначена для лечения рака, такого как рак мозга, легкого, плоскоклеточный (эпидермоидный) рак, рак мочевого пузыря, рак желудка, поджелудочной железы, молочной железы, головы, шеи, почки, предстательной железы, колоректальный рак, рак пищевода, гинекологический (например, рак яичника) рак или рак щитовидной железы. В другом варианте, указанная фармацевтическая композиция предназначена для лечения неракового гиперпролиферативного нарушения, такого как доброкачественная гиперплазия кожи (например, псориаз) или предстательной железы (например, доброкачественная гипертрофия предстательной железы (ВРН. Данное изобретение относится также к фармацевтической композиции для лечения панкреатита или заболеваний почек (в том числе пролиферативного гломерулонефрита и вызываемых диабетом заболеваний почек) у млекопитающего, которая содержит терапевтически эффективное количество соединения формулы 1 или его фармацевтически приемлемой соли или гидрата и фармацевтически приемлемый носитель. 9 Данное изобретение относится также к фармацевтической композиции для предупреждения имплантации бластоцитов у млекопитающего, которая содержит терапевтически эффективное количество соединения формулы 1 или его фармацевтически приемлемых соли или гидрата и фармацевтически приемлемой носитель. Данное изобретение относится также к фармацевтической композиции для лечения заболевания, связанного с новообразованием (васкулогенезом) или развитием (ангиогенезом) кровеносных сосудов у млекопитающего, которая содержит терапевтически эффективное количество соединения формулы 1 или его фармацевтически приемлемой соли или гидрата и фармацевтически приемлемый носитель. В одном варианте, указанная фармацевтическая композиция предназначена для лечения заболевания, выбранного из группы, состоящей из ангиогенеза опухоли, хронического воспалительного заболевания, такого как ревматоидный артрит, атеросклероза, кожных заболеваний,таких как псориаз, экзема и склеродермия, диабета, диабетической ретинопатии, ретинопатии при недоношенности, возрастной макулярной дегенерации, гемангиомы, глиомы, меланомы,саркомы Капоши и рака яичника, молочной железы, легкого, поджелудочной железы, предстательной железы, ободочной кишки и эпидермоидного рака.Данное изобретение относится также к способу лечения гиперпролиферативного нарушения у млекопитающего, который предусматривает введение указанному млекопитающему терапевтически эффективного количества соединения формулы 1 или его фармацевтически приемлемой соли или гидрата. В одном варианте, данный способ относится к лечению рака,такого как рак мозга, плоскоклеточный (эпидермоидный) рак, рак мочевого пузыря, рак желудка, поджелудочной железы, молочной железы, головы, шеи, рак пищевода, предстательной железы, колоректальный рак, рак легкого, рак почки, гинекологический (например, рак яичника) рак или рак щитовидной железы. В другом варианте, данный способ предназначен для лечения неракового гиперпролиферативного нарушения, такого как доброкачественная гиперплазия кожи (например, псориаз) или предстательной железы (например, доброкачественная гипертрофия предстательной железы (ВРН. Данное изобретение относится также к способу лечения гиперпролиферативного нарушения у млекопитающего, который предусматривает введение указанному млекопитающему терапевтически эффективного количества соединения формулы 1 или его фармацевтически приемлемой соли или гидрата, в комбинации с противоопухолевым агентом, выбранным из группы, состоящей из ингибиторов митоза, алкилирующих агентов, антиметаболитов, интер 004935 10 полирующих антибиотиков, ингибиторов факторов роста, ингибиторов клеточного цикла,ингибиторов топоизомераз, модификаторов биологического ответа, антигормонов и антиандрогенов. Данное изобретение относится также к способу лечения панкреатита или заболеваний почек у млекопитающего, который предусматривает введение указанному млекопитающему терапевтически эффективного количества соединения формулы 1 или его фармацевтически приемлемых соли или гидрата. Данное изобретение относится также к способу предупреждения имплантации бластоцитов у млекопитающего, который предусматривает введение указанному млекопитающему терапевтически эффективного количества соединения формулы 1 или его фармацевтически приемлемой соли или гидрата. Данное изобретение относится также к способу лечения заболеваний, связанных с новообразованием (васкулогенезом) или развитием (ангиогенезом) кровеносных сосудов у млекопитающего, который предусматривает введение указанному млекопитающему терапевтически эффективного количества соединения формулы 1 или его фармацевтически приемлемой соли или гидрата. В одном варианте, данный способ предназначен для лечения заболевания,выбранного из группы, состоящей из ангиогенеза опухоли, хронического воспалительного заболевания, такого как ревматоидный артрит,атеросклероза, кожных заболеваний, таких как псориаз, экзема и склеродермия, диабета, диабетической ретинопатии, ретинопатии при недоношенности, возрастной макулярной дегенерации, гемангиомы, глиомы, меланомы, саркомы Капоши и рака яичника, молочной железы, легкого, поджелудочной железы, предстательной железы, ободочной кишки и эпидермоидного рака. Кроме того, соединения данного изобретения могут быть использованы в качестве контрацептивов для млекопитающих. Пациенты, которых можно лечить соединениями формулы 1 и фармацевтически приемлемыми солями и гидратами указанных соединений в соответствии со способами данного изобретения, включают в себя, например, пациентов, которые диагностированы, как имеющие псориаз, ВРН, рак легкого, костный рак, рак поджелудочной железы, рак кожи, рак головы и шеи, кожную или внутриглазную меланому, рак матки, рак яичника, рак прямой кишки или рак анальной области, рак желудка, рак ободочной кишки, рак молочной железы, гинекологические опухоли (например, саркомы матки, карцинома фаллопиевых труб, карцинома эндометрия, карцинома шейки матки, карцинома вагины или карцинома вульвы), болезнь Ходжкина, рак пищевода, рак тонкой кишки, рак эндокринной системы (например, рак щитовидной железы, 11 паращитовидной железы или надпочечников),саркомы мягких тканей, рак мочеиспускательного канала, рак полового члена, рак предстательной железы, хронический или острый лейкоз, твердые опухоли у детей, лимфоцитарные лимфомы, рак мочевого пузыря, рак почки или мочеточника (например, почечно-клеточный рак, рак почечных лоханок) или неоплазмы центральной нервной системы (например, первичная лимфома ЦНС, опухоли позвоночника,глиомы ствола мозга или аденомы гипофиза). Данное изобретение относится также к промежуточным продуктам, выбранным из группы, состоящей из (2,6-дифтор-4-метилфенил)метанола, (2,3,6-трифтор-4-метилфенил) метанола, (4-бром-2,6-дифторфенил)метанола,(4-бром-2,3,6-трифторфенил)метанола, (4-хлор 2,6-дифторфенил)метанола, (3-хлор-2,6-дифторфенил)метанола и (4-хлор-2,3,6-трифторфенил) метанола. Данное изобретение относится также к промежуточному продукту, выбранному из группы, состоящей из Данное изобретение относится также к промежуточному продукту, выбранному из группы, состоящей из где R2 имеет описанные выше значения. Данное изобретение относится также к способу получения соединения формулы 1, который предусматривает либо (а) обработку соединения формулы 18 соединением формулы R3-X, где X обозначает галоген и R3 имеет указанные выше значения, и обработку полученного соединения соединени 004935 12 ем формулы R1R2NH, где R1 и R2 имеют указанные выше значения; либо(b) обработку соединения формулы 25 где R3 имеет описанные выше значения, с соединением формулы R1R2NH, где R1 и R2 имеют указанные выше значения. Термин "галоген", в применении здесь, если нет иных указаний, включает в себя фтор,хлор, бром или иод. Предпочтительными группами галогена являются фтор, хлор или бром. Термин "алкил", в применении здесь, если нет иных указаний, включает в себя насыщенные одновалентные углеводородные радикалы,имеющие прямые, циклические или разветвленные части молекулы. Понятно, что для циклических частей молекулы по меньшей мере три атома углерода требуются в указанной алкильной группе. Термин "алкенил", в применении здесь, если нет иных указаний, включает в себя одновалентные углеводородные радикалы, имеющие по меньшей мере одну двойную углеродуглерод связь и также имеющие прямые, циклические или разветвленные части молекулы, как описано в определении "алкила". Термин "алкинил", в применении здесь,если нет иных указаний, включает в себя одновалентные углеводородные радикалы, имеющие по меньшей мере одну тройную углеродуглеродную связь и также имеющие прямые,циклические или разветвленные части молекулы, как описано в определении "алкила". Термин "алкокси", в применении здесь, если нет иных указаний, включает в себя Оалкильные группы, где "алкил" имеет описанное выше значение. Термин "арил", в применении здесь, если нет иных указаний, включает в себя органический радикал, полученный из ароматического углеводорода удалением одного водорода, такой как фенил или нафтил. Термин "4-10-членный гетероцикл", в применении здесь, если нет иных указаний,включает в себя ароматические и неароматические гетероциклические группы, содержащие один или более гетероатомов, каждый из которых выбран из О, S и N, где каждая гетероциклическая группа имеет 4-10 атомов в ее циклической системе. Неароматические гетероциклические группы включают в себя группы, имеющие только 4 атома в их циклической системе,но ароматические гетероциклические группы должны иметь по меньшей мере 5 атомов в их циклической системе. Примером 4-членной гетероциклической группы является азетидинил(произведенный из азетидина). Примером 5 13 членной гетероциклической группы является тиазолил, а примером 10-членной гетероциклической группы является хинолинил. Примерами неароматических гетероциклических групп являются пирролидинил, тетрагидрофуранил, тетрагидротиенил, тетрагидропиранил, тетрагидротиопиранил, пиперидино, морфолино, тиоморфолино, тиоксанил, пиперазинил, азетидинил,оксетанил, тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил,1,2,3,6-тетрагидропиридинил,2 пирролинил, 3-пирролинил, индолинил, 2 Нпиранил, 4 Н-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, пиразолидинил, имидазолинил, имидазолидинил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил, 3 Н-индолил и хинолизинил. Примерами ароматических гетероциклических групп являются пиридинил, имидазолил,пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил,тиазолил, оксазолил, изотиазолил, пирролил,хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил,индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил. Вышеуказанные группы,производные перечисленных выше соединениий, могут быть присоединены к С или N, где это возможно. Например, группа, производная пиррола, может быть пиррол-1-илом (N-присоединенной) или пиррол-3-илом (С-присоединенной). Фраза "фармацевтически приемлемая соль(соли)", в применении здесь, если нет иных указаний, относится к солям кислотных или основных групп, которые могут присутствовать в соединениях формулы 1. Соединения формулы 1,которые являются щелочными по характеру,способны к образованию большого разнообразия солей с различными неорганическими и органическими кислотами. Кислотами, которые могут быть использованы для получения фармацевтически приемлемых кислотно-аддитивных солей таких основных соединений формулы 1, являются кислоты, которые образуют нетоксичные кислотно-аддитивные соли, т.е. соли,содержащие фармакологически приемлемые анионы, такие как гидрохлоридные, гидробромидные, гидроиодидные, нитратные, сульфатные, бисульфатные, фосфатные, кислые фосфатные, изоникотинатные, ацетатные, лактатные, салицилатные, цитратные, кислые цитратные, тартратные, пантотенатные, битартратные,аскорбатные, сукцинатные, малеатные, гентизинатные, фумаратные, глюконатные, глюкуронатные, сахаратные, формиатные, бензоатные,глутаматные, метансульфонатные, этансульфо 004935 14 натные, бензолсульфонатные, п-толуолсульфонатные и памоатные [т.е. 1,1-метилен-бис-(2 гидрокси-3-нафтоатные)]соли. Соединения формулы 1, которые являются кислотными по характеру, способны к образованию основных солей с различными фармакологически приемлемыми катионами. Примеры таких солей включают в себя соли щелочных металлов или щелочно-земельных металлов и, в частности, соли натрия и калия. Некоторые соединения формулы 1 могут иметь асимметричные центры и, следовательно,существует в различных энантиомерных формах. Данное изобретение относится к использованию всех оптических изомеров и стереоизомеров соединений формулы 1 и их смесей. Соединения формулы 1 могут также существовать в виде таутомеров. Данное изобретение относится к применению всех таких таутомеров и их смесей. Данное изобретение включает в себя также изотопно-меченые соединения и их фармацевтически приемлемые соли, которые идентичны солям, упомянутым в формуле 1, но отличающиеся тем, что один или несколько атомов заменены атомом, имеющим атомную массу или массовое число, отличающееся от атомной массы или массового числа, обычно обнаруживаемых в природе. Примеры изотопов, которые могут быть включены в соединения данного изобретения, включают в себя изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2 Н, 3 Н, 13 С, 14 С, 15N, 18O, 17O,35S, 18F и 36 Сl, соответственно. Соединения данного изобретения, их пролекарства и фармацевтически приемлемые соли указанных соединений или указанных пролекарств, которые содержат вышеуказанные изотопы и/или другие изотопы других атомов, находятся в сфере действия данного изобретения. Некоторые меченые изотопом, соединения данного изобретения,например, те, в которые включены радиоактивные изотопы, такие как 3 Н и 14 С, используются в лекарствах и/или в анализе распределения субстрата в тканях. Тритированные изотопы, т.е. 3 Н, и изотопы углерода-14, т.е. 14 С, особенно предпочтительны вследствие их легкого получения и детектируемости. Кроме того, замена более тяжелыми изотопами, такими как дейтерий, т.е. 2 Н, могут давать некоторые терапевтические преимущества, обусловленные их большей метаболической стабильностью, например,увеличенным периодом полураспада in vivo,или необходимостью пониженных доз, и, следовательно, могут быть предпочтительными в некоторых обстоятельствах. Меченые изотопом соединения формулы 1 данного изобретения и их пролекарства могут быть обычно получены проведением процедур, описанных ниже в схемах и/или в примерах и получениях, заменой легко доступным меченым изотопом реагентом не меченого изотопом реагента. 15 Данное изобретение охватывает также фармацевтические композиции, содержащие пролекарства соединений формулы 1, и способы лечения бактериальных инфекций посредством введения пролекарств соединений формулы 1. Соединения формулы 1, имеющие свободные амино, амидо, гидрокси или карбоксильные группы, могут быть превращены в пролекарства. Пролекарства включают в себя соединения, в которых аминокислотный остаток или полипептидная цепь из двух или нескольких (например,двух, трех или четырех) аминокислотных остатков ковалентно присоединена через амидную или сложноэфирную связь к свободной амино,гидрокси или карбоксильной группе соединений формулы 1. Аминокислотные остатки включают в себя, но не ограничиваются ими, 20 природно встречающихся аминокислот, обычно обозначаемых трехбуквенными символами, и также включают в себя 4-гидроксипролин, гидроксилизин, демозин, изодемозин, 3-метилгистидин, норзалин, бета-аланин, гамма-аминомасляную кислоту, цитрулин, гомоцистеин, гомосерин, орнитин и метионин сульфон. Дополнительные типы пролекарств также охватываются изобретением. Например, свободные карбоксильные группы могут быть дериватизованы в виде амидов или алкиловых эфиров. Амидная и сложноэфирная части молекул могут включать в себя группы, включающие в себя, но не ограничивающиеся ими, группы простого эфира, аминогруппы и карбоксильные группы. Свободные гидроксильные группы могут быть дериватизованы с использованием групп, включающих в себя, но не ограничивающихся ими, гемисукцинаты, фосфатные сложные эфиры, диметиламиноацетаты и фосфорилоксиметилоксикарбонилы, описанные вDelivery Reviews (1996) 19, 115. В изобретение включены также карбаматные пролекарства,имеющие гидрокси и аминогруппы, а также карбонатные пролекарства и сульфатные сложные эфиры гидроксигрупп. Дериватизация гидроксигрупп в виде (ацилокси)метиловых и (ацилокси)этиловых простых эфиров, в которых ацильная группа может быть алкиловым сложным эфиром, необязательно замещенным группами, включающими, но не ограничивающимися ими, эфирные, аминные и карбонокислотные фенкциональности, или в которых ацильная группа является сложным эфиром аминокислоты, как описано выше, также включена в данное изобретение. Пролекарства этого типа описаны в R.P. Robinson et al., J. Medicinal Chemistry(1996) 39, 10. Подробное описание изобретения Соединения формулы 1 и их фармацевтически приемлемые соли и сольваты могут быть получены, как описано ниже. Если нет иных указаний, R1, R2 и R3 имеют описанные выше значения. 18 Соединения данного изобретения легко получают согласно процедурам, раскрытым в приведенных выше схемах, и типичным процедурам синтеза, известным специалистам в данной области. Схема 1 иллюстрирует конденсацию малононитрила с изоцианатом, окисление серой, алкилирование R3-содержащим соединением и гидратацию нитрила с получением конечного соединения. На стадии 1 схемы 1, соединение формулы 4 может быть получено обработкой соединения формулы 3 и соединения формулы 2 (R1 и R2 не являются Н, а в остальном, как определено выше) с сильным в подходящей степени основанием, таким как алкоксидное основание, предпочтительно этоксид натрия, в протонном растворителе, таком как спирт, предпочтительно этанол, при температуре в пределах от -20 до 50 С, предпочтительно 0-25 С, на протяжении периода приблизительно 12-24 ч. На стадии 2 схемы 1, соединение формулы 5 может быть получено обработкой соединения формулы 4 серой (около 1 эквивалента до избытка) в полярном растворителе, таком как спиртовой растворитель, предпочтительно метанол, при температуре в пределах от 25 С до 80 С, предпочтительно около 65 С, в течение периода около 12-48 ч, предпочтительно около 24 ч. На стадии 3 схемы 1, соединение формулы 6 может быть получено обработкой соединения формулы 5 R3-содержащим электрофилом, таким как галогенид, предпочтительно хлорид,бромид или иодид, такого соединения, в полярном растворителе, предпочтительно тетрагидрофуране (ТГФ) или N,N-диметилформамиде(ДМФ), с использованием приблизительно 1-5 экв., предпочтительно немного больше 1 эквивалента, и основанием, таким как третичный амин, предпочтительно диизопропилэтиламин, в течение периода времени около 12-48 ч, предпочтительно около 24 ч, при температуре в пределах от 0 до 80 С, предпочтительно около 25 С. На стадии 4 схемы 1, соединение формулы 1 (в котором X1 является S) может быть получено обработкой соединения формулы 6 в сильно кислых условиях, таких как концентрированная серная кислота, в течение периода около 1-12 ч, предпочтительно около 1,5 ч, при температуре в пределах от 25 до 100 С, предпочтительно около 25 С, или в щелочных условиях, таких как водный гидроксид натрия (10%),в течение периода времени в пределах от 6 до 24 ч при температуре в пределах от 25 С до 120 С,предпочтительно около 100 С. Схема 2 иллюстрирует другой способ получения соединений формулы 1, в которой X1 является S. На стадии 1 схемы 2, соединение формулы 7 может быть получено конденсацией соединения формулы 3 с алкоксикарбонилизотиоцианатом, таким как этоксикарбонилизотиоцианат, в присутствии сильного основания, такого как алкоксидное основание, предпочтительно этоксид натрия, в полярном растворите 19 ле, таком как спиртовой растворитель, предпочтительно этанол, в течение периода времени от 12 до 24 ч, при температуре в пределах от приблизительно 0 до 30 С. На стадии 2 схемы 2,соединение формулы 8 может быть получено окислительной циклизацией соединения формулы 7 посредством обработки соединения 7 приблизительно 1 эквивалентом серы в спиртовом растворителе, таком как метанол, при температуре в пределах от 50 до 80 С, предпочтительно 65 С, в течение периода времени от 24 до 48 ч. На стадии 3 схемы 2, соединение формулы 9 может быть получено обработкой соединения формулы 8 R3-содержащим электрофилом, таким как галогенид, предпочтительно хлорид,бромид или иодид, такого соединения, в полярном растворителе, таком как ТГФ, при температуре в пределах от 25 до 40 С в течение периода времени в пределах от 12 до 24 ч. На стадии 4 схемы 2, соединение формулы 10 может быть получено гидролизом соединения формулы 9 сильной в подходящей степени кислотой, такой как концентрированная серная кислота, при температуре в пределах от 80 до 120 С в течение периода времени приблизительно 6-18 ч. На стадии 5 схемы 2, соединение формулы 11 (в которой Ph обозначает фенил) может быть получено обработкой соединения формулы 10 арил- или алкилхлорформиатом, таким как фенилхлорформиат, и подходящим по силе основанием, таким как пиридин, в полярном апротонном растворителе, предпочтительно ТГФ или CH2Cl2, при температуре в пределах от 25 С до 40 С в течение периода времени от 12 до 24 ч. На стадии 6 схемы 2, соединение формулы 1(в котором X1 является S) может быть получено обработкой соединения формулы 11 избытком(приблизительно 1,1-6 эквивалентов) первичного или вторичного амина формулы R1R2NH в полярном апротонном растворителе, таком как ТГФ или смесь ТГФ/ДМФ, при температуре в пределах от 23 до 60 С в течение периода времени от 6 до 24 ч. Схема 3 иллюстрирует способ получения соединений формулы 1, в которых X1 представляет О. Исходное соединение формулы 4 может быть получено, как описано выше в схеме 1. На стадии 1 схемы 3, раствор соли формулы 4 в инертном растворителе, содержащем воду, или,предпочтительно, только в воде, обрабатывают окисляющим реагентом, предпочтительно пероксидом водорода. Смесь выдерживают при температуре и времени, достаточных для осуществления растворения и циклизации, предпочтительно при нагревании с обратным холодильником в течение приблизительно 15 мин, и затем охлаждают с получением соединения формулы 12. На стадии 2 схемы 3, соединение формулы 12 добавляют к раствору кислоты,предпочтительно концентрированной серной кислоты, с последующим добавлением воды в количестве, достаточном для гидратации, пред 004935 20 почтительно около 10 эквивалентов, и перемешивают при температуре в пределах от -20 до 100 С, предпочтительно при температуре окружающей среды, в течение периода времени,достаточного для гидратации, предпочтительно в течение ночи. Затем эту смесь обрабатывают водой или, предпочтительно, льдом с получением соединения формулы 13. На стадии 3 схемы 3, соединение формулы 13 обрабатывают основанием, предпочтительно трет-бутоксидом калия, в инертном растворителе, предпочтительно ДМФ, при температуре в пределах от -78 до 100 С, предпочтительно при температуре окружающей среды. К этой смеси добавляют R3 содержащий элктрофил, такой как R3 содержащий алкилгалогенид или сульфонат,предпочтительно иодид или бромид такого соединения. Смесь перемешивают до завершения реакции, что оценивают ТСХ-анализом, с получением соединения формулы 1 (в котором X1 является О). Схема 4 иллюстрирует другой способ получения соединений формулы 1, в которых X1 представляет S. На стадии 1 схемы 4 используют процедуру, соответствующую синтетической процедуре, описанной в М. Yokoyama and К.Sato, Synthesis, 813 (1988). По этой процедуре,соединение формулы 3 обрабатывают алкилтиолом, таким как 4-метоксибензилмеркаптан, и сильным в подходящей степени основанием,таким как гидроксид натрия, в полярном растворителе, таком как смесь спирт/вода, предпочтительно 1:1 этанол/вода, при температуре в пределах от -10 до 30 С, предпочтительно около 0 С, в течение периода времени от 2 до 6 ч,предпочтительно около 3 ч, с получением соединения формулы 14. На стадии 2 схемы 4,соединение формулы 15 (Ph обозначает фенил) может быть получено обработкой соединения формулы 14 алкоксикарбонилизотиоцианатом,таким как феноксикарбонилизотиоцианат, в апротонном растворителе, таком как этилацетат,при приблизительно 0 С в течение приблизительно 12-36 ч. На стадии 3 схемы 4, соединение формулы 16 может быть получено обработкой соединения формулы 15 окислителем, таким как бром или иод, предпочтительно иод, и слабым основанием, таким как пиридин, в полярном растворителе, таком как ацетонитрил, в течение приблизительно 1 ч при приблизительно 0 С. На стадии 4 схемы 4 соединение формулы 17 может быть получено удалением защиты 4 метоксибензильной группы обработкой соединения формулы 16 ацетатом ртути, приблизительно 1 эквивалентом, в присутствии кислоты,предпочтительно трифторуксусной кислоты(ТФУ), с избытком анизола, предпочтительно 10 эквивалентов, при температуре в пределах от 0 С до температуры окружающей среды в течение периода времени от 10 до 24 ч. На стадии 5 схемы 4, соединение формулы 18 может быть получено гидратацией соединения формулы 17 21 подходящей сильной кислотой, такой как концентрированная серная кислота, при температуре в пределах от 15 С до 80 С, предпочтительно при температуре окружающей среды, в течение периода времени от 12 до 24 ч, предпочтительно 18 ч. На стадии 6 схемы 4, соединение формулы 1 может быть получено обработкой соединения формулы 18 R3-содержащим электрофилом, таким как галогенид, предпочтительно хлорид,бромид или иодид, такого соединения, и сильным в подходящей степени основанием, таким как диизопропилэтиламин, в полярном растворителе, таком как ДМФ, при температуре в пределах от 0 до 50 С, предпочтительно 25 С, в течение периода времени в пределах от 12 до 24 ч. Затем полученное соединение обрабатывают первичным или вторичным амином формулыR1R2NH (около 1,1-6 эквивалентов) в смеси ТГФ/ДМФ при температуре в пределах от 25 до 65 С в течение периода времени от 18 до 36 ч. Схема 5 иллюстрирует другой способ получения соединения формулы 1, в котором X1 представляет собой О. На стадии 1 схемы 5,смесь тиоцианатной соли, предпочтительно тиоцианата калия, в инертном растворителе,предпочтительно этилацетате, растирают, предпочтительно сильно, в инертной атмосфере в течение ночи для превращения соли в порошок. Затем эту смесь обрабатывают арилхлорформиатом формулы 19 (Рh обозначает фенил) и полученную смесь перемешивают при температуре в пределах от -40 С до температуры окружающей среды, предпочтительно около 5 С, в течение периода времени, достаточного для прохождения реакции, предпочтительно около 8 ч. Твердый побочный продукт отфильтровывают и этот продукт выдерживают на холоде,предпочтительно при температуре не выше температуры окружающей среды. Продукт перерастворяют в подходящем инертном растворителе,предпочтительно эфире, и удаляют дополнительный нерастворимый побочный продукт. После концентрирования, продукт опять повторно растворяют в подходящем инертном растворителе, предпочтительно гексане, и удаляют дополнительное количество нерастворимых побочных продуктов. Затем выделяют соединение формулы 20. На стадии 2 схемы 5 раствор кислоты, предпочтительно раствор НСl в эфире, обрабатывают соединением формулы 3. При растворении, этот раствор охлаждают,предпочтительно до 10 С, и обрабатывают спиртом, предпочтительно бензиловым спиртом. После дополнительного перемешивания смесь выдерживают при имеющейся температуре, предпочтительно около 5 С, в течение периода времени, достаточного для завершения реакции, в типичном случае около 4 дней, с получением соединения формулы 21. На стадии 3 схемы 5, раствор соединения формулы 21 в подходящем инертном растворителе, предпочтительно ацетонитриле, при температуре в преде 004935 22 лах от -40 С до температуры окружающей среды, предпочтительно около 0 С, обрабатывают раствором соединения формулы 20 в подходящем инертном растворителе, предпочтительно ацетонитриле. Реакцию выдерживают при температуре в пределах от 0 С до температуры окружающей среды, предпочтительно при температуре окружающей среды, для прохождения реакции. Затем смесь выдерживают при температуре, подходящей для увеличения отверждения продукта, предпочтительно около 5 С, в течение периода времени, достаточного для максимизации выхода, предпочтительно около 2 ч. Затем выделяют соединение формулы 22 (Вn обозначает бензил). На стадии 4 схемы 5, соединение формулы 22 помещают в инертный растворитель, предпочтительно ацетонитрил,при температуре в пределах от -40 С до 40 С,предпочтительно 0 С, и обрабатывают основанием, предпочтительно пиридином, и окислителем, предпочтительно раствором брома или иода в подходящем инертном растворителе, предпочтительно ацетонитриле. Затем смесь перемешивают при температуре, достаточной для прохождения реакции, предпочтительно при 0 С, в течение приблизительно 1 ч и затем еще одного часа при температуре окружающей среды. Затем смеси дают стоять при температуре,достаточной для увеличения отверждения,предпочтительно при 5 С, в течение достаточного периода времени, предпочтительно в течение ночи. Затем выделяют соединение формулы 23. На стадии 5 схемы 5, гидратацию и удаление защитных групп соединения формулы 23 выполняют обработкой кислотой, предпочтительно концентрированной серной кислотой. Если соединение формулы 23 является достаточно увлажненным водой из предыдущей стадии,дополнительной воды не добавляют. Если соединение формулы 23 является сухим, то добавляют дополнительное количество воды, предпочтительно около 10 эквивалентов. Реакцию проводят при температуре в пределах от -20 до 100 С, предпочтительно при температуре окружающей среды, в течение периода времени,достаточного для полного завершения реакции,в типичном случае отмечаемого по полному растворению и предпочтительно около 3 ч. После завершения реакции добавляют дополнительное количество серной кислоты для достижения полного превращения. Затем эту смесь обрабатывают водой или, предпочтительно,льдом. Затем выделяют соединение формулы 24. На стадии 6 схемы 5, соединение формулы 24 объединяют с трехвалентным фосфином,предпочтительно трифенилфосфином, и R3 содержащим спиртом и обрабатывают производным азодикарбоксилата, предпочтительно диизопропилазодикарбоксилатом, и перемешивание продолжают в течение периода по меньшей мере 1 мин. Затем выделяют соединение формулы 25. На стадии 7 схемы 5, смесь соеди 23 нения формулы 25 в подходящем инертном растворителе, предпочтительно ТГФ, обрабатывают желательным амином формулы R1R2NH и выдерживают при температуре, достаточной для прохождения реакции, обычно 0-100 С, предпочтительно 50-70 С, в течение периода времени от 1 до 48 ч, предпочтительно в течение ночи. Затем выделяют соединение формулы 1 (в котором X1 представляет О). Соединения данного изобретения могут иметь асимметричные атомы углерода. Такие смеси диастереомеров могут быть разделены на их индивидуальные диастереомеры на основе их физико-химических различий способами, известными специалистам с квалификацией в данной области, например, хроматографией или фракционированной кристаллизацией. Энантиомеры могут быть разделены превращением энантиомерной смеси в диастереомерную смесь реакцией с подходящим оптически активным соединением (например, спиртом), разделением этих диастереомеров и превращением (например, гидролизом) индивидуальных диастереомеров в соответствующие чистые энантиомеры. Все такие изомеры, в том числе смеси диастереомеров и чистые энантиомеры, рассматриваются как часть данного изобретения. Соединения формулы 1, которые являются основными по характеру, способны к образованию большого числа различных солей с различными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным,на практике часто является желательным сначала выделить соединение формулы 1 из реакционной смеси в виде фармацевтически неприемлемой соли и затем просто превратить последнюю опять в соединение, являющееся свободным основанием, обработкой щелочным реагентом и затем превратить это свободное основание в фармацевтически приемлемую кислотноаддитивную соль. Кислотно-аддитивные соли основных соединений данного изобретения легко получают обработкой основного соединения по существу эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. При осторожном выпаривании растворителя легко получают целевую твердую соль. Целевая соль кислоты может быть также осаждена из раствора свободного основания в органическом растворителе добавлением к этому раствору подходящей минеральной или органической кислоты. Соединения формулы 1, которые являются кислотными по характеру, способны образовывать основные соли с различными фармакологически приемлемыми катионами. Примеры таких солей включают в себя соли щелочных металлов и щелочно-земельных металлов и, в частности, соли натрия и калия. Все эти соли 24 получают общепринятыми способами. Химическими основаниями, которые используют в качестве реагентов для получения фармацевтически приемлемых основных солей данного изобретения, являются основания, которые образуют нетоксичные основные соли с кислотными соединениями формулы 1. Такие нетоксичные основные соли включают в себя соли, полученные из таких фармакологически приемлемых катионов, как натрий, калий, кальций и магний,и т.д. Эти соли могут быть легко получены обработкой соответствующих кислотных соединений водным раствором, содержащим желательные фармакологически приемлемые катионы, и затем упариванием полученного раствора досуха, предпочтительно при пониженном давлении. Альтернативно, они могут быть также получены смешиванием вместе растворов низших спиртов этих кислотных соединений и желательного алкоксида щелочного металла и затем упариванием полученного раствора досуха таким же образом. В любом случае, используют предпочтительно стехиометрические количества реагентов для гарантии полноты реакции и максимальных выходов целевого конечного продукта. В данное изобретение включены соединения, идентичные соединениям формулы 1, но отличающиеся тем, что один или несколько атомов водорода или углерода заменены их изотопами. Такие соединения полезны в качестве исследовательских и диагностических инструментов в фармакокинетических исследованиях метаболизма и в анализах связывания. Конкретные применения в исследовательской работе включают в себя тесты связывания радиолигандов, исследования с использованием авторадиографии и исследования связывания in vivo. Среди радиоактивно меченых форм соединений формулы 1 находятся их тритий- и 14 С-изотопы. Активность in vitro соединений формулы 1 в ингибировании рецептора KDR/VEGF может быть определена при помощи следующей процедуры. Способность соединений данного изобретения ингибировать тирозинкиназную активность может быть измерена с использованием рекомбинантного фермента в тесте, который измеряет способность соединений ингибировать фосфорилирование экзогенного субстрата,полиGluTyr (PGT, Sigma, 4:1). Киназный домен рецептора KDR/VEGF человека (аминокислоты 805-1350) экспрессируют в клетках Sf9 насекомых в виде слитого (химерного) белка глутатион-S-трансферазы с использованием бакуловирусной системы экспрессии. Этот белок очищают из лизатов этих клеток при помощи глутатион-агарозных аффинных колонок. Определение фермента проводят в 96-луночных планшетах, которые покрыты PGT-субстратом(0,625 мкг PGT на лунку). Испытуемые соединения разводят в диметилсульфоксиде (ДМСО) и затем добавляют в PGT-планшеты таким обра 25 зом, что концентрация ДМСО в анализе равна 1,6% (об/об). Рекомбинантный фермент разводят в буфере для фосфорилирования (50 мМHepes, pH 7,3, 125 мМ NaCl, 24 мМ МgСl2). Реакцию инициируют добавлением АТФ до конечной концентрации 10 мкМ. После 30 мин инкубации при комнатной температуре со взбалтыванием, реакционную смесь отсасывают и планшеты промывают промывным буферомLabs), проявляют пероксидазой ТМВ (ТМВ представляет собой 3,3',5,5'-тетраметилбензидин) и реакцию количественно измеряют на микропланшет-ридере BioRad при 450 нм. Ингибирование киназной ферментативной активности испытуемым соединением детектируют как пониженное поглощение, и концентрация соединения, которая требуется для ингибирования сигнала на 50%, сообщается как величина IС 50 для испытуемого соединения. Для измерения способности этих соединений ингибировать тирозинкиназную активностьKDR для полноразмерного белка, который существует в клеточном окружении, могут быть использованы аортальные эндотелиальные клетки свиньи (РАЕ), трансфицированные KDR человека (Waltenberger et al., J. Biol. Chem. 269:26988, 1994). Клетки высевают в чашки и присоединяют к 96-луночным планшетам в той же самой среде (F12 Ham) с 10% фетальной телячьей сывороткой (ФТС). Затем эти клетки промывают, повторно подают им бессывороточную среду, которая содержит 0,1% (об/об) бычьего сывороточного альбумина (БСА) и инкубируют в течение 24 ч. Сразу же перед добавлением дозы соединения клеткам подают свежую бессывороточную среду (без БСА). Испытуемые соединения, растворенные в ДМСО,разводят в этой среде (конечная концентрация ДМСО 0,5% (об/об. В конце двухчасовой инкубации к среде добавляют VEGF165 (конечная концентрация 50 нг/мл) в течение 8 мин инкубации. Клетки промывают и лизируют в буфере(фенилметилсульфонилфторид), 1 мкг/мл пепстатина, 1 мкг/мл лейпептина, 1 мкг/мл апротинина, 2 мМ пирофосат натрия, 2 мМ ортованадат натрия). Степень фосфорилирования KDR измеряют при помощи твердофазного иммуноферментного анализа ELISA. 96-луночные планшеты покрывают 1 мкг на лунку козьего антитела против кроличьих антител. Несвязанное антитело смывают с планшета и остаточные сайты блокируют буфером Superblock (Pierce) перед добавлением антитела анти-flk-l С-20 (0,5 мкг на планшет, Santa Cruz). Все несвязанное антитело смывают с планшетов перед добавлением клеточного лизата. После двухчасовой 26 инкубации лизатов с flk-1-антителом связанный с KDR фосфотирозин определяют количественно проявлением HRP-конъюгированным антителом PY-54 и ТМВ, как описано выше. Способность соединений ингибировать VEGF-стимулируемую реакцию автофосфорилирования на 50%, относительно VEGF-стимулируемых контролем, приводят в виде величины IC50 для испытуемого соединения. Способность соединений данного изобретения ингибировать митогенез в эндотелиальных клетках человека измеряют по их способности ингибировать включение 3 Н-тимидина в клетки HUVE (эндотелиальные клетки умбиликальной (пупочной) вены, Clonetics). Этот тест был хорошо описан в литературе (Waltenberger et al., J. Biol. Chem. 269:26988, 1994; CaoY et al., J. Biol. Chem. 271: 3154, 1996). Вкратце,104 клеток высевают в покрытые коллагеном 24 луночные планшеты и дают им прикрепиться. Клетки выдерживают в бессывороточной среде и спустя 24 ч их обрабатывают различными концентрациями соединения (приготовленного в ДМСО, конечная концентрация ДМСО в тесте равна 0,2% об/об) и 2-30 нг/мл VEGF165. Во время последних 3 из 24 ч обработки соединением,клетки пульс-метят (кратковременно метят) 3 Нтимидином (NEN, 1 мкКи на лунку). Затем среды удаляют и клетки интенсивно промывают охлажденным на льду сбалансированным солевым раствором Хенка и затем 2 раза охлажденной на льду трихлоруксусной кислотой (10% об/об). Клетки лизируют добавлением 0,2 мл 0,1 н. NaOH и лизаты переносят в сцинтилляционные флаконы. Затем лунки промывают 0,2 мл 0,1 н. НСl и эту промывку затем переносят в эти флаконы. Степень включения 3 Н-тимидина измеряют при помощи сцинтилляционного счета. Способность этих соединений ингибировать включение на 50%, относительно контроля, (обработка VEGF только ДМСО-носителем) сообщается в виде величины IC50 для испытуемого соединения. Активность соединений формулы 1 in vivo может быть определена величиной ингибирования роста опухоли тест-соединением относительно контроля. Ингибирующие рост опухоли активности различных соединений измеряют в соответствии со способами Corbett Т.Н. et al.,"Tumor Induction Relationship in Development of(Part 2)", 5, 169-186 (1975) с небольшими модификациями. Опухоли индуцируют в боку подкожной (s.c.) инъекцией 1 х 106 культивируемых опухолевых клеток в логарифмической фазе роста, суспендированных в 0,1-0,2 мл ЗФР. По истечении достаточного времени, для того чтобы опухоли стали прощупываемыми (5-6 мм в(приготовленным растворением в подходящем разбавителе, например, воде или 5% Gelucire 44/14 rn PBS), внутрибрюшинным (ip) или пероральным (ро) путями введения один раз или два раза в день в течение 5-10 последовательных дней. Для определения противоопухолевого действия опухоль измеряют в миллиметрах циркулем Vernier по двум диаметрам и объем опухоли (мм 3) рассчитывают по формуле: Вес опухоли = (длина х [ширина]2)/2, в соответствии со способами Geran, R.I., et al., "Protocols forAgainst Animal Tumors and Other Biological Systems", Thrid Edition, Cancer Chemother. Res., 3, 1104 (1972). Боковая сторона опухолевого имплантата обеспечивает воспроизводимые эффекты доза/ответ для множества химиотерапевтических агентов, и этот способ измерения(диаметра опухоли) является надежным способом оценки скоростей роста опухоли. Введение соединений данного изобретения(далее называемых "активными соединениями") может быть выполнено любым способом, который делает возможной доставку этих соединений к месту действия. Эти способы включают в себя пероральные пути, интрадуоденальные пути, парентеральную инъекцию (в том числе внутривенную, подкожную, внутримышечную,внутрисосудистую инъекцию или инфузию),местное и ректальное введение. Количество вводимого активного соединения будет зависеть от проходящего лечение субъекта, тяжести нарушения или состояния,скорости введения и оценки прописывающего лекарство врача. Однако, эффективная доза находится в диапазоне приблизительно 0,001 приблизительно 100 мг на кг веса тела в день,предпочтительно приблизительно 1 - приблизительно 35 мг/кг/день, в виде одной дозы или в виде разделенных доз. Для человека весом 70 кг это было бы количество приблизительно 0,05-7 г/день, предпочтительно приблизительно 0,2 приблизительно 2,5 г/день. В некоторых случаях, уровни доз ниже нижнего предела указанного выше диапазона могут быть более адекватными, тогда как в других случаях могут использоваться более высокие дозы без вызывания какого-либо вредного побочного действия, при условии, что такие более высокие дозы сначала делят на несколько небольших доз для введения на протяжении дня. Активное соединение может применяться в качестве единственной терапии или может включать в себя одно или несколько других противоопухолевых веществ, например, выбранных из митотических ингибиторов, например, винбластина; алкилирующих агентов, например, цис-платины, карбоплатины и циклофосфамида; антиметаболитов, например, 5 фторурацила, цитозинарабинозида и гидрокси 004935 28 мочевины, или, например, одного из предпочтительных антиметаболитов, описанных в Европейском патентной заявке 239362, такого как N(5-[N-(3,4-дигидро-2-метил-4-оксохиназолин-6 илметил)-N-метиламино]-2-теноил)-L-глутаминовая кислота; ингибиторов факторов роста; ингибиторов клеточного цикла; интерполирующихся антибиотиков, например, адриамицина и блеомицина; ферментов, например, интерферона; и антигормонов, например, антиэстрогенов,таких как Nolvadex (тамоксифен), или, например, антиандрогенов, таких как Casodex(4'-циано-3-(4-фторфенил-сульфонил)-2-гидрокси-2-метил-3-(трифторметил)пропионанилид). Такое объединенное лечение может быть достигнуто посредством одновременного, последовательного или раздельного введения доз индивидуальных компонентов данного лечения. Фармацевтическая композиция может быть, например, в форме, пригодной для перорального введения, такой как таблетка, капсула,пилюля, порошок, препараты пролонгированного действия, раствор, суспензия, для парентеральной инъекции в виде стерильного раствора,суспензии или эмульсии, для местного введения в виде мази или крема или для ректального введения в виде суппозитория. Фармацевтическая композиция может быть в унифицированных(стандартных) дозированных формах, пригодных для однократного введения точных доз. Фармацевтическая композиция будет включать в себя общепринятый фармацевтический носитель или эксципиент и соединение данного изобретения в качестве активного ингредиента. Кроме того, она может включать в себя другие лекарственные или фармацевтические агенты,носители, адъюванты и т.д. Примеры парентеральных форм введения включают в себя растворы или суспензии активных соединений в стерильных водных растворах, например, в водных растворах полипропиленгликоля или декстрозы. Такие дозированные формы могут быть подходящим образом забуферены, если это желательно. Подходящие фармацевтические носители включают в себя инретные разбавители или наполнители, воду и различные органические растворители. Фармацевтические композиции могут, если желательно, содержать дополнительные ингредиенты, такие как отдушки, связывающие вещества, эксципиенты и т.п. Так, для перорального введения таблетки, содержащие различные эксципиенты, такие как лимонная кислота, могут использоваться вместе с различными дезинтеграторами, такими как крахмал,альгиновая кислота и некоторые комплексные силикаты, и связывающими агентами, такими как сахароза, желатин и аравийская камедь. Кроме того, смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк,часто используются для целей таблетирования. Твердые композиции подобного типа могут 29 также применяться в мягких и твердых наполненных желатиновых капсулах. Таким образом,предпочтительные материалы включают в себя лактозу или молочный сахар и высокомолекулярные полиэтиленгликоли. Когда для перорального введения желательными являются водные суспензии или эликсиры, активное соединение в них может комбинироваться с различными подслащивающими или улучшающими вкус и запах агентами, красящими веществами или красителями и, если желательно,эмульгирующими агентами или суспендирующими агентами, вместе с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин или их комбинации. Способ получения различных фармацевтических композиций со конкретным количеством активного соединения являются известными или будут очевидными для специалистов с квалификацией в данной области. Примеры можно найти в "Remington's Pharmaceutical Sciences",Mack Publishing Company, Easton, Pa., 1985, 15thEdition (1975). Примеры и получения, описанные ниже,иллюстрируют дополнительно соединения данного изобретения и способы получения таких соединений. Должно быть понятно, что объем данного изобретения не ограничивается никаким образом объемом нижеследующих примеров и получений. Получение 1. Диметилкарбамоилизотиоцианат. Трехлитровую трехгорлую колбу, снабженную механической мешалкой, загружали диметилкарбамилхлоридом (250 мл, 2,70 моль) в безводном ацетонитриле (1,5 л) и нагревали с обратным холодильником. Затем добавляли тиоцианат калия (270 г, 2,8 моль, предварительно высушенный при 160 С под высоким вакуумом в течение 3 ч) порциями на протяжении 1 ч с осторожностью, так как реакция сильно кипит в начале каждого добавления. После конечного добавления смесь нагревали с обратным холодильником еще в течение 1 ч. Нагревательный кожух удаляли и смесь перемешивали при температуре окружающей среды еще в течение 2,5 ч и затем выдерживали в холодильнике в течение ночи. Смесь фильтровали для удаления нежелательного твердого материала и фильтрат концентрировали. К полученному маслу добавляли эфир (1 л) и твердое вещество и густой материал отбрасывали. Фильтрат опять концентрировали с получением целевого материала в виде тусклого оранжевого масла (204 г, 1,57 моль, 58%). 1 Н-ЯМР (400 МГц, CDCl3):2,90 (с,3H), 2,98 (с, 3H) м.д. 2,2-Дициано-1-(3,3-диметилуреидо)этентиолат натрия. К 1 М раствору этоксида натрия в этаноле(полученному обработкой 110 мл безводного этанола 2,5 г (0,11 моль) натрия) добавляли малононитрил (7,2 г, 0,11 моль) при 0 С. Добавля 004935 30 ли диметилкарбамоилизотиоцианат (14,3 г,0,110 моль) и полученной смеси давали нагреваться до температуры окружающей среды в течение ночи. Смесь концентрировали в вакууме. Остаток обрабатывали гексанами и концентрировали в вакууме до твердого вещества. Остаток растирали с гексанами, собирали фильтрованием и сушили в вакууме с получением 20 г(83%) 2,2-дициано-1-(3,3-диметилуреидо)этентиолата натрия в виде бесцветного твердого вещества: ЯМР (400 МГц, ДМСО-d6)8,40 (с,1 Н), 2,78 (с, 6 Н), м.д.; 13 С-ЯМР (100 МГц,ДМСО-d6)189,9, 154,3, 121,4, 118,7, 57,9, 36,5 м.д. 3-(4-Циано-3-меркаптоизотиазол-5-ил)-1,1 диметилмочевина. Смесь 2,2-дициано-1-(3,3-диметилуреидо) этектиолата натрия (5,0 г, 23 ммоль), серы(0,734 г, 23 ммоль) и 46 мл метанола перемешивали при нагревании с обратным холодильником в течение 24 ч. Смесь фильтровали и фильтрат концентрировали в вакууме. Остаток разбавляли водой и полученную смесь экстрагировали дважды в этилацетат. Водный слой подкисляли 1 М НСl (водной) и экстрагировали этилацетатом. Органический слой сушили надNa2SO4, фильтровали и концентрировали. Твердый остаток собирали и сушили в вакууме с получением 2,0 г (40%) 3-(4-циано-3-меркаптоизотиазол-5-ил)-1,1-диметилмочевины в виде желтого твердого вещества: 1 Н-ЯМР (400 МГц,CDCl3)2,97 (с, 6 Н) м.д.; MS(APCI, m/z): 227[М-Н]-. Общая процедура для алкилирования 3-(4 циано-3-меркаптоизотиазол-5-ил)-1,1-диметилмочевины. К смеси 3-(4-циано-3-меркаптоизотиазол 5-ил)-1,1-диметилмочевины (0,20 г, 0,88 ммоль),подходящего алкилхлорида, алкилбромида или алкилиодида (0,90 ммоль) и ТГФ или ДМФ добавляли диизопропилэтиламин (0,116 г, 0,90 ммоль). Полученную смесь перемешивали в течение 24 ч при температуре окружающей среды. Смесь распределяли между 1 м водной НСl и этилацетатом. Органический слой удаляли и водный слой экстрагировали три раза этилацетатом. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток фильтровали через небольшую подушку силикагеля, элюируя смесью этилацетат-гексаны (1:1), с получением алкилированного продукта. 3-(4-Циано-3-гексилсульфанилизотиазол 5-ил)-1,1-диметилмочевина. Согласно вышеописанной общей процедуре, с использованием иодгексана (0,19 г, 0,90 ммоль) в качестве алкилиодида получали 0,14 г(51%) 3-(4-циано-3-гексилсульфанилизотиазол 5-ил)-1,1-диметилмочевины в виде бесцветного твердого вещества: 1 Н-ЯМР (400 МГц, ацетонd6)9,82 (шс, 1 Н), 3,20 (т, 2 Н, J=7,2 Гц), 3,11 (с, 31 6 Н), 1,71 (п, 2 Н, J=7,2 Гц), 1,43 (м, 2 Н), 1,31 (м,4 Н), 0,88 (т, 3H, J=6,0 Гц) м.д.; MS(APCI, m/z): 313 [М+Н]+. Пример 1. Амид 5-(3,3-диметилуреидо)-3 гексилсульфанилизотиазол-4-карбоновой кислоты. Смесь 3-(4-циано-3-гексилсульфанилизотиазол-5-ил)-1,1-диметилмочевины (0,09 г, 0,29 ммоль) и концентрированной серной кислоты(0,18 мл) перемешивали при температуре окружающей среды в течение 1,5 ч. Смесь разбавляли ледяной водой, экстрагировали три раза этилацетатом. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением 0,076 г(78%) амида 5-(3,3-диметилуреидо)-3-гексилсульфанилизотиазол-4-карбоновой кислоты в виде бесцветного твердого вещества: 1 Н-ЯМР(300 МГц, ацетон-d6)7,08 (шс, 2 Н), 3,20 (т, 2 Н,J=7,2 Гц), 3,02 (с, 6 Н), 1,63 (п, 2 Н, J=7,2 Гц),1,35 (м, 2 Н), 1,23 (м, 4 Н), 0,78 (т, 3H, J=6,9 Гц) м.д.; MS(APCI, m/z): 331 [М+Н]+. Получение 2. 2,2-Дициано-1-этоксикарбониламиноэтентиолат натрия. Металлический натрий (1,01 г, 44 ммоль) растворяли в 40 мл этанола при температуре окружающей среды. Полученный раствор охлаждали на бане со льдом и добавляли малононитрил (2,91 г, 44 ммоль). Баню со льдом удаляли и смесь перемешивали при температуре окружающей среды в течение 30 мин. После охлаждения до 0 С добавляли этоксикарбонилизотиоцианат (5,77 г, 44 ммоль) и смеси давали нагреваться до температуры окружающей среды в течение ночи. Смесь концентрировали в вакууме и остаток отверждали при повторяющемся разбавлении гексаном и концентрировании в вакууме. Полученные желтые твердые вещества собирали и сушили в вакууме с получением 10,74 г (100%) 2,2-дициано-1-этоксикарбониламиноэтентиолата натрия в виде светложелтого твердого вещества, которое содержало 0,5 мол. 1 экв. этанола,как показала(0,48 г, 15 ммоль) и метанола (30 мл) нагревали с обратным холодильником в течение 24 ч. Смесь фильтровали и концентрировали в вакууме и смолистый остаток растирали дважды со смесью 10:1 эфир-этилацетат с получением 2,6 г (69%) 4-циано-5-этоксикарбониламиноизотиазол-3-тиолата натрия в виде желтого твердого вещества. Н-ЯМР (400 МГц, ДМСО-d4)3,99 (к, 2 Н,J=6,8 Гц), 1,16 (т, 2 Н, J=7,2 Гц) м.д.; MS(APCI,m/z): 228 [M-Na]-. Этиловый эфир (4-циано-3-пентилсульфанилизотиазол-5-ил)карбаминовой кислоты. Смесь 4-циано-5-этоксикарбониламиноизотиазол-3-тиолата натрия (5,0 г, 20 ммоль), 1 иодпентана (4,0 г, 20 ммоль) и тетрагидрофурана (20 мл) перемешивали при температуре окружающей среды в течение 16 ч. После концентрирования в вакууме остаток распределяли между этилацетатом и рассолом. Водный слой экстрагировали три раза этилацетатом и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток фильтровали через подушку силикагеля с использованием смеси 1:1 этилацетат-гексан в качестве элюента. Фильтрат концентрировали и остаток перекристаллизовывали из холодного водного метанола с получением 2,5 г (42%) этилового эфира (4-циано-3 пентилсульфанилизотиазол-5-ил)карбаминовой кислоты в виде бесцветного твердого вещества. Дополнительные 0,5 г (8,4%) получали концентрированием маточного раствора и очисткой радиальной хроматографией (чашка 4 мм, 4:1 гексан/этилацетат). 1 Н-ЯМР (400 МГц, ацетонd6)11,1 (шс, 1 Н), 4,32 (к, 2 Н, J=7,2 Гц), 3,21 (т,2 Н, J=7,2 Гц), 1,73 (п, 2 Н, J=6,8 Гц), 1,44-1,28(м, 7 Н), 0,90 (т, 3H, J=7,6 Гц) м.д.; MS (APCI,m/z): 312 [M+Na]+. Амид 5-амино-3-пентилсульфанилизотиазол-4-карбоновой кислоты. Смесь этилового эфира (4-циано-3-пентилсульфанилизотиазол-5-ил)карбаминовой кислоты (2,7 г, 9,0 ммоль) и концентрированной серной кислоты (5 мл) нагревали до 100 С в течение 6 ч. После охлаждения до температуры окружающей среды смесь разбавляли ледяной водой, экстрагировали три раза этилацетатом и объединенные органические слои сушили надNа 2SO4, фильтровали и концентрировали в вакууме с получением 2,2 г (100%) амида 5 амино-3-пентилсульфанилизотиазол-4-карбоновой кислоты в виде желтого масла. 1 Н-ЯМР (400 МГц, CDCl3)3,26 (т, 2 Н, J=7,2 Гц), 1,71 (м,2 Н), 1,43-1,19 (м, 4 Н), 0,88 (т, 3H, J=6,8 Гц) м.д. Фениловый эфир (4-карбамоил-3-пентилсульфанилизотиазол-5-ил)карбаминовой кислоты. К раствору амида 5-амино-3-пентилсульфанилизотиазол-4-карбоновой кислоты (2,2 г,9,0 ммоль) в 36 мл тетрагидрофурана добавляли пиридин (0,90 г, 11 ммоль) и фенилхлорформиат(1,7 г, 11 ммоль). После перемешивания в течение 3 ч добавляли дополнительные количества пиридина (0,15 г, 1,9 ммоль) и фенилхлорформиата (0,29 г, 1,9 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Смесь концентрировали в вакууме, разбавляли водой и экстрагировали 2 х СН 2 Сl2, 1 х 33 этилацетатом. Объединенные органические слои промывали рассолом, сушили над MgSO4,фильтровали и концентрировали в вакууме. Остаток растирали в течение 12 ч со смесью эфиргексан и полученные твердые вещества собирали и сушили в вакууме с получением 2,6 г (79%) фенилового эфира(4-карбамоил-3-пентилсульфанилизотиазол-5-ил)карбаминовой кислоты в виде бесцветного твердого вещества. 1HЯМР (300 МГц, CDCl3)7,41 (т, 2 Н, J=7,3 Гц),7,29-7,20 (м, 3H), 3,31 (т, 2 Н, J=7,3 Гц), 1,72 (м,2 Н), 1,50-1,30 (м, 4 Н), 0,90 (т, 3H, J=7,1 Гц) м.д.MS(APCI, m/z): 366 [М+Н]+. Пример 2. Амид 3-пентилсульфанил-5-[3(3-пирролидин-1-илпропил)уреидо]изотиазол-4 карбоновой кислоты. К смеси фенилового эфира (4-карбамоил 3-пентилсульфанилизотиазол-5-ил)карбаминовой кислоты (0,10 г, 0,27 ммоль) и 1 мл тетрагидрофурана добавляли N-3-аминопропилпирролидин (0,175 г, 1,4 ммоль). После перемешивания в течение 72 ч при температуре окружающей среды смесь выливали в 1 М NaOH,экстрагировали дважды этилацетатом и объединенные органические слои сушили над Na2SO4,фильтровали и концентрировали. Очистка остатка радиальной хроматографией (чашка 2 мм,смесь 3% этанол-CH2Cl2 - 30% этанол-СН 2 Сl2,содержащая 0,5% NH4OH) с последующим концентрированием и растиранием остатка со смесью эфир-гексан давали 0,076 г (78%) амида 3 пентилсульфанил-5-[3-(3-пирролидин-1-илпропил)уреидо]изотиазол-4-карбоновой кислоты в виде бесцветного твердого вещества. 1 Н-ЯМР(400 МГц, CDCl3)7,57 (шс, 1 Н), 7,06 (шс, 2 Н),3,35 (м, 2 Н), 3,26 (м, 2 Н), 2,53 (т, 2 Н, J=6,8 Гц),2,47 (м, 4 Н), 1,73 (м, 8 Н), 1,4-1,2 (м, 4 Н), 0,88 (т,3H, J=7,2 Гц) м.д.; MS(APCI, m/z): 400 [М+Н]+. Получение 3. Натриевая соль 3-(4-циано-3 гидроксиизотиазол-5-ил)-1,1-диметилмочевины. Раствор натриевой соли 3-(2,2-дициано-1 меркаптовинил)-1,1-диметилмочевины (30 г,137 ммоль) в воде (300 мл) обрабатывали при температуре окружающей среды пероксидом водорода (14 мл 10 М раствора). Реакционную смесь нагревали и сгущали с образованием твердого вещества и обрабатывали дополнительным количеством воды (100 мл). Смесь нагревали с обратным холодильником в течение 15 мин до полного растворения и затем охлаждали до температуры окружающей среды. Спустя 1 час, при температуре окружающей среды смесь концентрировали до постоянного веса (35 г, 100% вследствие потери воды) и использовали сразу же на следующей стадии. Амид 5-(3,3-диметилуреидо)-3-гидроксиизотиазол-4-карбоновой кислоты. Твердое вещество, полученное в предыдущей стадии (35 г), добавляли к концентрированной серной кислоте (150 мл) с последующим добавлением воды (5 мл) и перемешивали при 34 температуре окружающей среды в течение ночи. Смесь обрабатывали льдом (500 г) и перемешивали в течение 2 ч. Смесь фильтровали и пропускали воздух через фильтровальный осадок в течение ночи. Твердое вещество измельчали с использованием ступки и пестика и выдерживали под высоким вакуумом до постоянного веса(200 мг, 0,87 ммоль) в ДМФ (5 мл) обрабатывали KOtBu (107 мг, 0,96 ммоль) при температуре окружающей среды до полного растворения. Затем добавляли 1-иодгептан (1 мл) и реакцию перемешивали при температуре окружающей среды до полного исчезновения исходных материалов, согласно измерению при помощи ТСХ с использованием смеси гексан/этилацетат/метанол/уксусная кислота (48/48/2/2) в качестве элюента. Затем реакционную смесь концентрировали роторным испарением под высоким вакуумом, остаток растворяли в этилацетате и метаноле и затем очищали радиальной хроматографией (чашка 2 мм) с использованием того же самого элюента, что и для ТСХ, с получением двух компонентов. Более полярный материал идентифицировали как N-алкилированный аддукт (102 мг, 0,311 ммоль, 36%). 1 Н-ЯМР (400 МГц, CDCl3)0,86 (т, J=6,7 Гц, 3H), 1,25-1,31(м, 8 Н), 1,64-1,70 (м, 2 Н), 3,07 (с, 3H), 3,68 (т,J=7,2 Гц, 2 Н), 5,40 (с, 1 Н), 8,86 (с, 1 Н), 12,1 (с,1 Н) м.д.; 13 С-ЯМР (101 МГц, CDCl3)13,94,22,45, 26,48, 28,74, 29,52, 31,52, 36,11, 42,54,166,99 м.д.; MS(APCI, m/z): 329 [М+н]+. Менее полярный материал был О-алкилированным аддуктом (134 мг, 0,408 ммоль, 48%). 1 Н-ЯМР(т, J=6,7 Гц, 2H), 5,42 (с, 1 Н), 7,25 (с, 1 Н, повидимому, наложившийся на пик CDCl3), 11,6(с, 1 Н) м.д.; 13 С-ЯМР (101 МГц, CDCl3)13,94,22,45, 25,86, 28,83, 31,60, 36,11, 68,69, 97,69,154,15, 162,27, 166, 20, 169,45 м.д.; MS(APCI,m/z): 329 [М+Н]+. Получение 4. 4-Метоксибензиловый эфир 2-цианотиоацетимидокислоты. К раствору гидроксида натрия (13 г, 0,32 ммоль) в 750 мл смеси 1:1 этанол-вода при 0 С добавляли 4-метоксибензилмеркаптан (50 г,0,324 моль) и малононитрил (21 г, 0,324 моль). После перемешивания в течение 3 ч при 0 С смесь разбавляли 500 мл насыщенного водногоNH4Cl, разбавленного 4 л воды, и фильтровали. Твердые вещества промывали эфиром и фильтрат разбавляли равным объемом гексана и фильтровали. Объединенные твердые вещества сушили в вакууме с получением 43 г (60%) 4 метоксибензилового эфира 2-цианотиоацетимидокислоты в виде бесцветного твердого вещест 35 ва. 1 Н-ЯМР (400 МГц, CDCl3)7,22 (д, 2 Н,J=7,6 Гц), 6,84 (д, 2 Н, J=8,8 Гц), 4,74 (шс, 4 Н),3,98 (с, 2 Н), 3,78 (с, 3H) м.д.; MS(APCI, m/z): 221 [М+Н]+. 4-Метоксибензиловый эфир 2-циано-3 меркапто-3-феноксикарбониламинотиоакрилимидокислоты. К раствору 4-метоксибензилового эфира 2 цианотиоацетимидокислоты (42 г, 0,19 моль) в 191 мл этилацетата при 0 С добавляли феноксикарбонилизотиоцианат (34 г, 0,19 моль) и смесь перемешивали при 0 С в течение 24 ч. Смесь разбавляли эфиром и фильтровали. Твердые вещества промывали эфиром, собирали и сушили в вакууме с получением 56 г (73%) 4-метоксибензилового эфира 2-циано-3-меркапто-3 феноксикарбониламинотиоакрилимидокислоты в виде желтого твердого вещества. 1 Н-ЯМР (400 МГц, CDCl3)12,81 (с, 1 Н), 9,01 (с, 1 Н), 8,68 (с,1 Н), 7,28-6,99 (м, 7 Н), 6,69 (д, 2 Н, J=8,8 Гц), 4,17(4,4 г, 55 ммоль). Добавляли по каплям раствор иода (7,0 г, 28 ммоль) в 350 мл этилацетата на протяжении 1 ч. Полученную суспензию перемешивали в течение 1 ч, обрабатывали 200 мл 1 М НСl и фильтровали с получением 7,0 г (64%) фенилового эфира[4-циано-3-(4-метоксибензилсульфанил)изотиазол-5-ил]карбаминовой кислоты в виде бесцветного твердого вещества. Фильтрат экстрагировали 1 л этилацетата и органическую фазу промывали водным NаНСО 3,сушили над Na2SO4, фильтровали и концентрировали с получением еще 2,8 г (26%) фенилового эфира [4-циано-3-(4-метоксибензилсульфанил) изотиазол-5-ил] карбаминовой кислоты. 1 Н-ЯМР (400 МГц, CDCl3)11,95 (с, 1 Н), 7,35(т, 2 Н, J=8,4 Гц), 7,20 (м, 3H), 7,13 (д, 2 Н, J=8,0 Гц), 6,78 (т, 2 Н, J=8,6 Гц), 4,34 (с, 2 Н) , 3,73 (с,3H) м.д.; MS(APCI, m/z): 398 [М+Н]+. Фениловый эфир (4-циано-3-меркаптоизотиазол-5-ил)карбаминовой кислоты. К смеси фенилового эфира [4-циано-3-(4 метоксибензилсульфанил)изотиазол-5-ил]карбаминовой кислоты (1,0 г, 2,5 ммоль), трифторуксусной кислоты (26 мл) и анизола (2,7 г, 25 ммоль) при 0 С добавляли ацетат ртути (0,80 г,2,4 ммоль). Смеси давали нагреваться до комнатной температуры в течение ночи. После концентрирования в вакууме смесь разбавляли 100 мл воды и 100 мл этилацетата. Сероводород барботировали медленно до полного осаждения солей ртути. Смесь разбавляли рассолом, экстрагировали 3 х 200 мл этилацетата и объеди 004935 36 ненные органические слои фильтровали через целит, сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением 0,70 г(100%) фенилового эфира (4-циано-3-меркаптоизотиазол-5-ил)карбаминовой кислоты в виде бесцветного твердого вещества. 1 Н-ЯМР (400 МГц, ацетон-d6)7,47 (т, 2 Н, J=7,6 Гц), 7,357,30 (м, 3H) м.д. MS(APCI, m/z): 276 [М-Н]-. Фениловый эфир (4-карбамоил-3-меркаптоизотиазол-5-ил)карбаминовой кислоты. Смесь фенилового эфира (4-циано-3-меркаптоизотиазол-5-ил)карбаминовой кислоты(0,70 г, 2,5 ммоль), 2,6 ди-трет-бутил-4-метилфенола (ВНТ) (один кристалл) и концентрированной серной кислоты (3 мл) перемешивали в течение 18 ч при комнатной температуре. Смесь разбавляли ледяной водой, экстрагировали 3 х этилацетатом и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток растворяли в 10 мл этанола при 0 С и обрабатывали 0,096 г(2,5 ммоль) NaBH4. После перемешивания в течение 30 мин смесь подкисляли 1 М НСl, экстрагировали этилацетатом, сушили над Na2SO4,фильтровали и концентрировали в вакууме с получением 0,60 г (81%) фенилового эфира (4 карбамоил-3-меркаптоизотиазол-5-ил)карбаминовой кислоты в виде желтого твердого вещества. 1 Н-ЯМР (400 МГц, ацетон-d6)13,0 (с, 1 Н),11,0-10,9 (шс, 1 Н), 10,3 (с, 1 Н), 7,47 (т, 2 Н,J=6,8 Гц), 7,37-7,30 (м, 4 Н) м.д.;MS(APCI, m/z): 296 [M+H]+. Пример 4. Амид 5-[3-(3-хлор-4-фторбензил)уреидо]-3-(4-метилбензилсульфанил) изотиазол-4-карбоновой кислоты. К смеси фенилового эфира (4-карбамоил 3-меркаптоизотиазол-5-ил)карбаминовой кислоты (0,075 г, 0,25 ммоль) в 0,5 мл ДМФ добавляли 4-метилбензилхлорид (0,036 г, 0,25 ммоль) с последующим добавлением N,N-диизопропилэтиламина (0,033 г, 0,25 ммоль). После перемешивания в течение 18 ч при температуре окружающей среды добавляли тетрагидрофуран (1 мл) с последующим добавлением 3-хлор-4 фторбензиламина (0,081 г, 0,51 ммоль). После перемешивания в течение 24 ч при 45 С смесь разбавляли 1 М НСl, экстрагировали 3 раза этилацетатом и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали радиальной хроматографией на силикагеле, элюируя смесью этилацетат-гексан, с получением 2 6 мг амида 5-[3-(3-хлор-4-фторбензил)уреидо]-3(4-метилбензилсульфанил)изотиазол-4-карбоновой кислоты в виде бесцветного твердого вещества. Время удерживания ВЭЖХ: 4,9 мин. 1 НЯМР (400 МГц, ацетон-d6)7,95 (шс, 1 Н), 7,54 37 Получение 5. Бензиловый эфир 2-цианоацетимидокислоты. К раствору раствора НСl в эфире (4,00 л,4,00 моль) добавляли подогретый (ожиженный) малононитрил (252 мл, 4,00 моль). При растворении раствор охлаждался до 10 С. Затем добавляли бензиловый спирт (414 мл, 4,00 моль) и смесь перемешивали при 10 С в течение 0,5 ч. Реакционную колбу помещали в холодильник и давали стоять при 5 С в течение 4 дней. Полученное твердое вещество фильтровали в холодном состоянии, промывали холодным эфиром(1,5 л) и сушили в вакууме (40 мм рт. ст.) в течение 1 ч с получением 545 г (2,59 моль, 65%) аддукта Пиннера в виде белого твердого вещества. Нейтрализацию этой HCl-соли проводили следующим образом. Готовили раствор карбоната калия (359 г, 2,59 моль) в воде (700 мл) и охлаждали до 5 С. Полученный раствор добавляли в делительную воронку вместе с эфиром(2 л) и ТГФ (500 мл). Всю делительную воронку помещали на баню со льдом и держали в ней,пока температура экстрагирующего раствора не становилась 5 С. Затем аддукт Пиннера (545 г,2,59 моль) добавляли в делительную воронку и ее встряхивали сильно в течение 5 мин. Водный слой отбрасывали, а органический слой собирали после отфильтровывания суспендированных частиц. Органический слой помещали опять в делительную воронку, встряхивали с рассолом и давали отстояться полностью, чтобы сделать возможным фактически полное удаление солевого слоя. Органический слой концентрировали на роторном испарителе и нестабильный продукт (327 г, 1,88 ммоль, 73%) использовали сразу же в следующей стадии. Феноксикарбонилизотиоцианат. Суспензию KSCN (80 г, 823 ммоль, из свежей, ранее не открываемой бутыли) в этилацетате (2 л, сухом) перемешивали энергично в течение ночи в атмосфере азота для превращения в порошок KSCN. Затем суспензию мелкоизмельченного порошка обрабатывали по каплям фенилхлорформиатом (100 мл, 800 ммоль) на протяжении 1 ч. Реакционную смесь перемешивали в течение ночи при температуре окружающей среды и затем перемешивали при 5 С в течение 8 ч. Полученный КСl отфильтровывали и растворитель удаляли роторным испарением, следя за тем, чтобы продукт не нагревался выше температуры окружающей среды. Продукт повторно растворяли в эфире (2 л),дополнительный осадок удаляли фильтрованием и отбрасывали, а эфирный раствор продукта опять концентрировали при пониженном давлении, следя за тем, чтобы продукт не нагревался выше температуры окружающей среды. Продукт повторно растворяли в гексане (2 л), дополнительный осадок удаляли фильтрованием и отбрасывали, а раствор в гексане продукта опять концентрировали при пониженном давлении, следя за тем, чтобы продукт не нагревался 38 выше температуры окружающей среды. Полученный таким образом продукт (101 г, 564 ммоль, 68%) имел высокую чистоту и мог храниться при -5 С в течение нескольких дней или при комнатной температуре в течение нескольких часов, но обычно его использовали быстро,как в настоящем примере. 1 Н-ЯМР (400 МГц,CDC13)7,10-7,21 (м, 2 Н), 7,21-7,31 (м, 1 Н),7,31-7,45 (м, 2 Н) м.д.; 13 С-ЯМР (101 МГц,CDCl3)120,75, 126,77, 129,65, 150,46 м.д.; ИК(неразбавл.) 1190, 1232, 1491, 1590, 1751, 1960 см-1. Бензиловый эфир 2-циано-3-меркапто-3 феноксикарбониламиноакрилимидокислоты. К перемешиваемому при 0 С раствору бензилового эфира 2-цианоацетимидокислоты(327 г, 1,88 моль) в ацетонитриле (1 л) добавляли охлажденный до 0 С раствор феноксикарбонилизотиоцианата (353 г, 1,97 моль) в ацетонитриле (1 л). Реакции давали нагреваться до температуры окружающей среды и перемешивали в течение ночи. Затем смесь помещали в холодильник и выдерживали при 5 С еще в течение 48 ч. Твердый продукт фильтровали, прессовали и промывали 20 С ацетонитрилом (3 х 200 мл). Затем пропускали воздух хотя относительно стабильное твердое вещество подвергалось дальнейшей сушке под высоким вакуумом с получением желтого твердого вещества (282 г,798 ммоль, 42%). 1 Н-ЯМР (400 МГц, ДМСО)7,11-7,19 (м, 2 Н), 7,20-7,24 (м, 1H), 7,36-7,46 (м,7 Н), 10,23 (шс, 1 Н), 10,67 (с, 1 Н), 12,19 (шс, 1 Н) м.д.; MS(APCI, m/z): 354 [М+Н]+. Фениловый эфир (3-бензилокси-4-цианоизотиазол-5-ил)карбаминовой кислоты. К суспензии 0 С аддукта бензилового эфира 2-циано-3-меркапто-3-феноксикарбониламиноакрилимидокислоты (282 г, 798 ммоль) в ацетонитриле (2 л) добавляли пиридин (129 мл,1,60 моль). Затем добавляли раствор брома (41,1 мл, 798 ммоль) в ацетонитриле (200 мл) на протяжении 15 мин. Реакцию перемешивали при 0 С в течение еще одного часа и затем при температуре окружающей среды в течение 2 ч. Смесь помещали в холодильник и выдерживали при 5 С в течение ночи. Твердый продукт фильтровали и промывали эфиром 0 С (1 л),сушили в той же самой воронке, пропуская воздух через твердое вещество в течение 4 ч. Твердое вещество добавляли к воде (1 л), энергично перемешивали в течение 1 ч, фильтровали и сушили в той же самой воронке, пропуская воздух через твердое вещество в течение ночи, с получением белого твердого вещества (320 г чистого продукта, хотя все еще содержащего некоторое количество воды), которое использовали сразу же на следующей стадии. 1 Н-ЯМР 39 Фениловый эфир (4-карбамоил-3-гидроксиизотиазол-5-ил)карбаминовой кислоты. Влажное твердое вещество фениловый эфир (3-бензилокси-4-цианоизотиазол-5-ил)карбаминовой кислоты (320 г) добавляли медленно к концентрированной серной кислоте (650 мл) на протяжении 1,5 ч. Добавляли дополнительное количество концентрированной серной кислоты (100 мл) и смесь перемешивали еще в течение 3 ч. Вязкий раствор разбавляли медленным добавлением льда (2000 г) с последующим сильным перемешиванием еще в течение 2 ч. Кислоту частично удаляли распределением суспензии в восемь резервуаров, которые помещали в центрифугу, откручивали при 3000 об/мин,в течение 45 мин при 21 С. Водный слой отбрасывали, добавляли дополнительное количество чистой воды, осадок ресуспендировали и этот процесс повторяли. После семи циклов разбавления/центрифугирования/повторного разбавления рН водного слоя увеличивался до 4 и полученное твердое вещество собирали и сушили, пропуская воздух через фильтровальный осадок в воронке в течение 2 дней. Менее увлажненное твердое вещество измельчали, помещали опять на фильтр, пропускали опять воздух через твердое вещество в течение второго дня. Этот процесс повторяли до тех пор, пока твердое вещество не становилось сухим, с получением рыжевато-коричневого твердого вещества (234 г, 105% в двух стадиях, небольшие присутствующие примеси не мешали заметным образом последующим стадиям). 1 Н-ЯМР (400 МГц, ДМСО)7,00 (шс, 1 Н), 7,27-7,31 (м, 3H) ,7,40-7,45 (м, 2 Н), 7,89 (с, 1 Н), 8,08 (с, 1 Н), 11,92(с, 1 Н); MS(APCI, m/z): 184 [М-(Н и PhOH)]. Фениловый эфир [4-карбамоил-3-(2,6 дифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты. К суспензии фенилового эфира (4-карбамоил-3-гидроксиизотиазол-5-ил)карбаминовой кислоты (1,77 г, 6,23 ммоль), трифенилфосфина(DIAD, 1,4 9 мл, 7,59 ммоль) немного быстрее,чем каплями. Реакционная смесь нагревалась и становилась прозрачной. После перемешивания в течение 15 мин большую часть ТГФ удаляли роторным испарением и неочищенную смесь очищали на силикагеле с использованием смеси хлороформ/ацетон/уксусная кислота (98,5/0,75/ 0,75) в качестве элюента с получением белого твердого вещества (802 мг, 1,91 ммоль, 30%). Пример 5. Амид 3-(2,6-дифтор-4-метилбензилокси)-5-3-[3-(4-метилпиперазин-1-ил) пропил]уреидоизотиазол-4-карбоновой кислоты. К суспензии фенилового эфира [4-карбамоил-3-(2,6-дифтор-4-метилбензилокси) изотиазол-5-ил]карбаминовой кислоты (125 мг, 0,298 ммоль) в ТГФ (1 мл) добавляли 1-(3-амино 004935 40 пропил)-4-метилпиперазин (70 мг, 0,45 ммоль). Смесь встряхивали при 50 С в течение ночи,охлаждали до температуры окружающей среды и помещали непосредственно в радиальный хроматограф с последующим элюированием смесью хлороформ/метанол/концентрированный гидроксид аммония (50/5/1) с получением белого твердого вещества (121 мг, 0,251 ммоль,84%). 1H-ЯМР (400 МГц, CDCl3)1,72 (т,J=5,81 Гц, 2H), 2,20-2,85 (м, 10 Н), 2,28 (с, 3H,наложений на мультиплет от 2,20-2,85), 2,35 (с,3H, наложенный на мультиплет от 2,20-2,85),3,39 (т, J=5,4 Гц, 2 Н), 5,51 (с, 2 Н), 5,74 (шс, 1 Н),6,74 (д, J=8,3 Гц, 2 Н), 7,05 (с, 1 Н), 7,58 (шс, 1 Н),11,01 (шс, 1 Н) м.д.; MS(APCI, m/z): 483 [М+Н]+. Синтез характерных производных фтортолуола(208 г, 2,54 моль) в эфире (300 мл) обрабатывали газообразным водородом (50 psi = 344737,85 Па) в шейкере Парра в течение 2 дней. Смесь фильтровали через целит и органический раствор промывали три раза насыщенным водным раствором бикарбоната натрия. Водные слои промывали эфиром и объединенные органические слои сушили (MgSO4), фильтровали и частично концентрировали упариванием с использованием холодной водяной бани. Летучий продукт получали в виде смеси с эфиром и соотношение (3:2, эфир:продукт, г:г) рассчитывали на основании интегрирования 1 Н-ЯМР для определения истинного выхода (45,5 г, 0,355 моль,98%) продукта для масштабирования реагентов в последующей реакции. 1H-ЯМР (400 МГц,CDCl3)2,25 (с, 3H), 6,51-6,56 (м, 1 Н), 6,58-6,60(м, 2 Н) м.д. 1,2,5-Трифтор-3-метилбензол (G=F). Указанное в заголовке соединение получали из 1-бромметил-2,3,5-трифторбензола по процедуре, аналогичной процедуре для 3,5 дифтортолуола, описанной выше. 1 Н-ЯМР (400 МГц, CDCl3)м.д.; MS(APCI, m/z): [М+Н]+. Синтез характерных бензиловых спиртов для превращения в R3-78 С в атмосфере азота и обрабатывали по каплям нВuLi (142 мл, 2,5 М раствора в гексанах,0,355 моль). Раствор перемешивали еще в тече 41 ние 25 мин и затем обрабатывали ДМФ (27,5 мл,0,355 моль). После перемешивания в течение дополнительных 45 мин раствор обрабатывали уксусной кислотой (40,6 мл, 0,71 моль) и колбу удаляли из бани -78 С. Смесь перемешивали при температуре окружающей среды в течение 2 ч и затем обрабатывали последовательно водой(300 мл) и МеОН (300 мл). Затем добавляли порциями NaBH4 (26,8 г, 0,71 моль) с последующим перемешиванием в течение 1 ч. Колбу охлаждали на бане со льдом и смесь обрабатывали 6 н. НСl до рН 5. Смесь концентрировали роторным испарением для удаления ТГФ и МеОН и продукт экстрагировали эфиром и промывали несколько раз небольшими объемами воды и один раз рассолом. Эфирный слой сушили(MgSO4), фильтровали и концентрировали с получением масла (45 г, 0,285 моль, 80%), которое отверждалось при охлаждении в холодильнике. 1 Н-ЯМР (400 МГц, CDCl3)1,75 (т,J=6,5 Гц, 1H), 2,32 (с, 3H), 4,72 (д, J=6,4 Гц, 2H),6,69 (д, J=7,9 Гц, 2H) м.д.(G=F, G'=Me, G"=F). Указанное в заголовке соединение получали из 1,2,5-трифтор-3-метилбензола по процедуре, аналогичной процедуре для (2,6-дифтор-4 метилфенил)метанола, описанной выше. 1 НЯМР (400 МГц, CDCl3)1,87 (шс, 1 Н), 2,28 (д,J=1,9 Гц, 3H), 4,74 (с, 2 Н), 6,68-6,72 (м, 1 Н) м.д.(4-Бром-2,6-дифторфенил)метанол (G=H,G'=Br, G"=F). Указанное в заголовке соединение получали из 1-бром-3,5-дифторбензола по процедуре,аналогичной процедуре для (2,6-дифтор-4-метилфенил)метанола, описанной выше, со следующим исключением: вместо нВuLi использовали диизопропиламид лития (LDA) и время депротонирования было увеличено до 45 мин. 1 Н-ЯМР (400 МГц, CDCl3)1,91 (т, J=6,5 Гц,1H), 4,71 (д, J=6,4 Гц, 2 Н), 7,06-7,12 (м, 2 Н) м.д.(G=F, G'=Br, G"=F). Указанное в заголовке соединение получали из 1-хлор-2,3,5-трифторбензола по процедуре, аналогичной процедуре для (2,6-дифтор-4 метилфенил)метанола, описанной выше, со следующим исключением: вместо нВuLi использовали диизопропиламид лития (LDA) и время депротонирования было увеличено до 45 мин. 1 Н-ЯМР (400 МГц, CDCl3)1,89 (т, J=6,5 Гц,1H), 4,75 (Д, J=6,4 Гц, 2 Н), 7,11-7,15 (м, 1 Н) м.д.(3-Хлор-2,6-дифторфенил)метанол (G=Cl,G'=H, G"=F). Указанное в заголовке соединение получали из 1-хлор-2,4-дифторбензола по процедуре,аналогичной процедуре для (2,6-дифтор-4 метилфенил)метанола, описанной выше. 1 НЯМР (400 МГц, CDCl3)1,90 (т, J=6,4 Гц, 1 Н),4,78 (д, J=6,4 Гц, 2 Н), 6,87 (приб. дт, J=1,8, 8,9 Гц, 1 Н), 7,32 (приб. дт, J=5,8, 2,8 Гц, 1 Н) м.д.(68,2 мл 1,3 М раствора в циклогексане, 88,6 ммоль). Полученный желтый раствор перемешивали в течение 20 мин при -78 С и затем обрабатывали раствором 1-фтор-3,5-диметилбензола (10,0 г, 80,5 ммоль) в ТГФ (56 мл). Смесь перемешивали в течение 1 ч при -78 С и затем обрабатывали раствором ДМФ (6,86 мл,88,6 ммоль) в ТГФ (26 мл). Красноватокоричневую смесь перемешивали еще в течение 1 ч и затем обрабатывали HОАс (10 мл) и водой(200 мл). Смесь нагревали до температуры окружающей среды, экстрагировали эфиром (500 мл) и водный слой экстрагировали дополнительным количеством эфира (2 х 300 мл). Объединенные органические экстракты объединяли и промывали последовательно 0,2 М НСl (2 х 200 мл), водой (500 мл) и рассолом (300 мл). Органический слой сушили (MgSO4) и концентрировали с получением альдегида в виде прозрачного масла (11,9 г, 78,2 ммоль, 97%). Затем этот альдегид растворяли в ТГФ (100 мл), МеОН (100 мл) и воде (100 мл) и обрабатывали порциями NaBH4 (2,96 г, 78,2 ммоль). Смесь перемешивали при температуре окружающей среды в течение 1 ч и затем концентрировали при пониженном давлении для удаления ТГФ и МеОН. Остающийся водный слой экстрагировали дважды эфиром (600 мл и 200 мл) и объединенные органические слои промывали последовательно 0,1 М НСl (300 мл), водой (300 мл) и рассолом (300 мл). Органический слой сушили(G=H,G'=Me, G"=H). Раствор 4-бром-3-фтортолуола (12,2 г, 64,7 ммоль) в ТГФ (170 мл) охлаждали до -78 С и обрабатывали по каплям н-BuLi (25,9 мл 2,5 М раствора в гексанах, 65 ммоль). После перемешивания в течение 1 ч раствор обрабатывалиN,N-диметилформамидом (ДМФ) (5,5 мл, 71 ммоль) и перемешивали еще 30 мин с последующим добавлением уксусной кислоты (12 мл). Колбу удаляли из охладительной бани и давали ей нагреваться до температуры окружающей среды. Затем добавляли воду и продукт экстрагировали эфиром. Органический слой промывали последовательно разбавленной НСl и рассолом и затем сушили (MgSO4) и концентрировали. Эту процедуру повторяли (с использованием 11,8 г 4-бром-3-фтортолуола) и объединенный материал подвергали следующей реакции. Альдегид (17,6 г, 127 ммоль) растворяли в ТГФ (165 мл), МеОН (165 мл) и воде (165 мл). Затем добавляли NaBH4 (5,3 г, 14 0 ммоль) пор 43 циями на протяжении нескольких минут (реакция с кипением, экзотермическая) и перемешивание продолжали в течение 2 ч. Реакцию разбавляли большим объемом эфира и обрабатывали разбавленной НСl для гашения. Слои разделяли и органический слой сушили (MgSO4) и концентрировали с получением продукта в виде масла (17,0 г, 121 ммоль, 95%). 1 Н-ЯМР (400 МГц, CDCl3)2,33 (с, 3H), 4,69 (с, 2 Н), 6,86 (д,J=11,2 Гц, 1H), 6,93 (д, J=7,9 Гц, 1 Н), 7,24-7,28(75 мл) и триметилбората (26 мл, 230 ммоль) добавляли комплекс боранметилсульфид (86 мл,86 ммоль, 10 М раствор в DMS) и смесь перемешивали в течение 18 ч при температуре окружающей среды. Добавляли дополнительное количество комплекса боранметилсульфид (2,47 мл, 24,7 ммоль) для доведения реакции до завершения. Смесь выливали в 1 М водный NaOH,экстрагировали 3 х эфиром и объединенные органические слои сушили над безводным MgSO4,фильтровали и концентрировали в вакууме. Растирание твердого остатка со смесью эфиргексан давало 14 г(4-хлор-2,5 дифторфенил)метанола в виде бесцветного твердого вещества. 1 Н-ЯМР (400 МГц, СDСl3)7,26 (дд, 1 Н, J=6, 8,8 Гц), 7,11 (дд, 1 Н, J=6, 9,2 Гц), 4,71 (д, 2 Н, J=6,0 Гц), 1,80 (т, 1 Н, J=6,0 Гц) м.д. трет-Бутил-(2,3-дифторбензилокси)диметилсилан. К раствору (2,3-дифторфенил)метанола(5,0 г, 35 ммоль), имидазола (4,9 г, 72 ммоль) и ДМФ (40 мл) добавляли трет-бутилдиметилхлорсилан (5,4 г, 36 ммоль). После перемешивания при температуре окружающей среды в течение 24 ч смесь распределяли между 400 мл эфира и 100 мл воды. Органический слой дважды промывали водой, сушили над MgSO4,фильтровали и концентрировали в вакууме с получением 6,8 г трет-бутил(2,3-дифторбензилокси) диметилсилана в виде бесцветного масла. 1 Н-ЯМР (400 МГц, CDCl3)7,22 (м, 1 Н),7,04 (м, 2 Н), 4,79 (с, 2 Н), 0,91 (с, 9 Н), 0,12 (с,6 Н) м.д. трет-Бутил-(2,3-дифтор-4-метилбензилокси)диметилсилан. К раствору TMEDA (3,9 мл, 3,0 г, 26 ммоль) в ТГФ (33 мл) при -78 С добавляли втор-бутиллитий (20 мл, 1,3 М в гексане, 26 ммоль). После перемешивания в течение 20 мин по каплям добавляли раствор трет-бутил(2,3 дифторбензилокси)диметилсилана (6,0 г, 23 ммоль) в 17 мл ТГФ. После перемешивания в течение 1 ч этот раствор добавляли по каплям к раствору метилиодида (8 мл) в ТГФ (40 мл) при-20 С. После перемешивания в течение 18 ч смесь гасили насыщенным водным NH4Cl, экст 004935 44 рагировали 3 х эфиром и объединенные органические слои сушили над MgSO4, фильтровали и концентрировали в вакууме с получением 6,6 г трет-бутил-(2,3-дифтор-4-метилбензилокси) диметилсилана в виде светло-желтого масла. 1HHMP (400 МГц, CDCl3)7,07 (приб. т, 1K, J=7,2 Гц), 6,89 (приб. т, 1 Н, J=7,3 Гц), 4,74 (с, 2 Н),2,26 (д, 3H, J=1,9 Гц), 0,87 (с, 9 Н), 0,07 (с, 6 Н) м.д.(2,3-Дифтор-4-метилфенил)метанол. К раствору трет-бутил(2,3-дифтор-4-метилбензилокси)диметилсилана (6,5 г, 24 ммоль) в ТГФ (24 мл) добавляли тетрабутиламмонийфторид (24 мл 1 М раствора в ТГФ, 24 ммоль). После перемешивания при температуре окружающей среды в течение 1 ч смесь выливали в воду, подкисляли 1 М водной НСl, экстрагировали 3 раза этилацетатом и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле (10:1-2:1 гексанэтилацетат) с получением (2,3-дифтор-4 метилфенил)метанола в виде светло-желтого масла. 1-Бром-2,5-дифтор-4-метилбензол. Смесь 2,5-дифтортолуола (25 г, 0,20 моль) и порошкообразного железа (11 г, 0,2 моль) охлаждали до -5 С. Добавляли по каплям бром таким образом, чтобы внутренняя температура не повышалась выше 0 С. После перемешивания в течение 3 ч смесь разбавляли эфиром,фильтровали и промывали водным раствором тиосульфата натрия. Водный слой экстрагировали эфиром и объединенные органические слои сушили над MgSO4, фильтровали и концентрировали в вакууме. Отгонка при атмосферном давлении давала 34 г 1-бром-2,5 дифтор-4-метилбензола в виде бесцветного масла (т. кип.180 С). 1H-ЯМР (300 МГц, CDCl3)7,20 (дд, 1 Н, J=6,0, 8,5 Гц), 6,93 (м, 1 Н), 2,23 (с,3H) м.д.-78 С и добавляли по каплям раствор нбутиллития в гексане (5,4 мл, 2,5 М, 13,5 ммоль). После перемешивания в течение 1 ч добавляли диметилформамид (1,1 мл, 14 ммоль) и смесь перемешивали в течение 1 ч. Смесь обрабатывали 1 М НСl и водой, нагревали до температуры окружающей среды и экстрагировали 3 раза эфиром. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток разбавляли тетрагидрофураном (50 мл) и смесь обрабатывали боргидридом натрия (0,50 г, 13,5 ммоль) и этанолом (2 мл). После перемешивания в течение 30 мин смесь разбавляли осторожно 0,5 М водной НСl, экстрагировали 3 раза этилацетатом и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в 45 вакууме. Перекристаллизация остатка из гексана давала 1,24 г (54%) (2,5-дифтор-4-метилфенил)метанола в виде бесцветного твердого вещества. 1 Н-ЯМР (400 МГц, CDCl3) 7,05 (дд, 1 Н,J=6,0, 9,2 Гц), 6,84 (дд, 1 Н, J=6,4, 10 Гц) , 4,68(5-хлор-2-фтор-4-метилфенил)метанол получали аналогично получению (2,5-дифтор-4 метилфенил)метанола с использованием 2-хлор 5-фтортолуола в качестве исходного материала. 1 Н-ЯМР (400 МГц, CDCl3)7,38 (д, 1 Н, J=6,8 Гц), 6,92 (д, 1 Н, J=10 Гц), 4,69 (с, 2 Н), 2,34 (с,3H) м.д. 4-Хлор-2,6-дифторбензальдегид. К раствору 3,5-дифтор-1-хлорбензола (5,0 г, 34 ммоль) в тетрагидрофуране (70 мл) при(5,2 мл, 67 ммоль) и смесь перемешивали в течение 1,5 ч. Смесь нагревали до температуры окружающей среды, разбавляли эфиром и выливали в 150 мл 0,5 М водной НСl. Водную фазу экстрагировали 3 раза эфиром и объединенные органические слои сушили над MgSO4, фильтровали и концентрировали в вакууме с получением 5,72 г (96%) 4-хлор-2,6-дифторбензальдегида в виде бесцветного твердого вещества. 1 Н-ЯМР (400 МГц, CDCl3)10,27 (с, 1H), 7,04(1,2 г, 32 ммоль) при 0 С. Смесь перемешивали в течение 30 мин, нагревали до температуры окружающей среды и добавляли дополнительное количество боргидрида натрия (0,40 г, 11 ммоль) для доведения реакции до полного завершения (ТСХ). Смесь концентрировали в вакууме, разбавляли эфиром и обрабатывали осторожно 1 М водной НСl. Водную фазу экстрагировали 3 раза эфиром и объединенные органические слои сушили над MgSO4, фильтровали и концентрировали. Растирание остатка с пентаном давало 4,8 г (83%) (4-хлор-2,6-дифторфенил)метанола в виде бесцветного твердого вещества. 1 Н-ЯМР (300 МГц, CDCl3)7,04 (д, 2 Н,J=7,1 Гц), 4,73 (с, 2 Н) м.д. Общая процедура получения изотиазолфенилкарбаматов Фениловый эфир [4-карбамоил-3-(2,5-дифтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты. К смеси фенилового эфира (4-карбамоил 3-гидроксиизотиазол-5-ил)карбаминовой кислоты (2,1 г, 7,6 ммоль), (2,5-дифтор-4-метилфенил)метанола (1,2 г, 7,6 ммоль), трифенилфосфина (2,1 г, 8,0 ммоль) и тетрагидрофурана (19 46 мл) добавляли диэтилазодикарбоксилат (1,3 мл,8,0 ммоль). После перемешивания в течение 16 ч при температуре окружающей среды добавляли дополнительные количества (2,5-дифтор-4 метилфенил)метанола (0,24 г, 1,5 ммоль), трифенилфосфина (0,42 г, 1,6 ммоль) и диэтилазодикарбоксилата (0,30 мл, 1,8 ммоль) и эту смесь перемешивали в течение 1 ч. После концентрирования в вакууме смесь очищали хроматографией на силикагеле, элюируя смесью ацетонуксусная кислота-метиленхлорид (0,5%, 0,5%,99%), с получением после растирания со смесью эфир-гексан 1,1 г (35%) фенилового эфира [4 карбамоил-3-(2,5-дифтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты в виде бесцветного твердого вещества. Время удерживания ВЭЖХ: 4,8 мин. 1H-ЯМР (400 МГц, CD3OD)7,40 (т, 2 Н, J=8,0 Гц), 7,27 (т,1 Н, J=7,2 Гц), 7,20 (д, 2 Н, J=8,4 Гц), 7,17 (дд,1 Н, J=6,0, 9,2 Гц), 7,0 (дд, 1 Н, J=6,4, 10,7 Гц),5,49 (с, 2 Н), 2,24 (с, 3H) м.д. Фениловый эфир [4-карбамоил-3-(2,3-дифтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты. Получение указанного в заголовке соединения, как описано для примера 3, с использованием(2,3-дифтор-4-метилфенил)метанола давало 1,7 г (57%) фенилового эфира [4-карбамоил-3-(2,3-дифтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты в виде бесцветного твердого вещества. Время удерживания ВЭЖХ: 4,8 мин. 1 Н-ЯМР (400 МГц, CDCl3)11,38 (с, 1 Н), 7,40 (т, 2 Н, J=8,0 Гц), 7,26 (т, 1 Н,J=7,2 Гц), 7,20 (д, 1 Н, J=8,4 Гц), 7,14 (ш, 1 Н),7,11 (т, 1 Н, J=7,6 Гц), 6,94 (т, 1 Н, J=7,2 Гц), 5,6(ш, 1 Н), 5,52 (с, 2 Н), 2,31 (д, 3H, J=1,7 Гц) м.д. Фениловый эфир [4-карбамоил-3-(2,5 дифтор-4-хлорбензилокси)изотиазол-5-ил]карбаминовой кислоты. Получение указанного в заголовке соединения, как описано для примера 3, с использованием (2,5-дифтор-4-хлорфенил)метанола давало 0,86 г (26%) фенилового эфира [4-карбамоил-3-(2,5-дифтор-4-хлорбензилокси)изотиазол-5-ил]карбаминовой кислоты в виде бесцветного твердого вещества. Время удерживания ВЭЖХ: 4,8 мин. 1H-ЯМР (400 МГц, ДМСО-d6)11,73 (с, 1 Н), 8,04 (с, 1 Н), 7,77 (м, 2 Н), 7,51 (м,2 Н), 7,36 (м, 3H), 7,23 (с, 1 Н), 5,51 (с, 2 Н) м.д. Фениловый эфир [4-карбамоил-3-(2,6-дифтор-4-хлорбензилокси)изотиазол-5-ил]карбаминовой кислоты. Получение указанного в заголовке соединения, как описано для примера 3, с использованием (2,6-дифтор-4-хлорфенил)метанола давало 0,86 г (26%) фенилового эфира [4 карбамоил-3-(2,6-дифтор-4-хлорбензилокси) изотиазол-5-ил]карбаминовой кислоты в виде бесцветного твердого вещества. Время удерживания ВЭЖХ: 4,5 мин. 1 Н-ЯМР (400 МГц,CDCl3,CD3OD)7,31 (т, 2 Н, J=8,4 Гц), 7,18 (т, 47 1 Н, J=7,6 Гц), 7,10 (д, 2 Н, J=7, 6 Гц), 6,92 (д, 2 Н,J=7,2 Гц), 5,45 (с, 2 Н) м.д. Общая процедура получения изотиазолмочевин Пример 6. Амид 3-(2,5-дифтор-4-метилбензилокси)-5-[3-(4-пирролидин-1-илбутил) уреидо]изотиазол-4-карбоновой кислоты. Смесь фенилового эфира [4-карбамоил-3(2,5-дифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты (0,34 г, 0,81 ммоль), 4 пирролидинобутиламина (0,12 г, 0,81 ммоль) и тетрагидрофурана (2,8 мл) встряхивали при 4550 С в течение 24 ч. Смесь концентрировали и очищали радиальной хроматографией (чашка 4 мм, CH3OH-CHCl3-NH4OH (10:89:1)- (15:84:1 с получением 0,31 г указанного в заголовке соединения в виде бесцветного твердого вещества. Этот материал растворяли в приблизительно 10 мл смеси 4:1 метанол-хлороформ при -10 С и обрабатывали раствором метансульфоновой кислоты (0,043 мл в 0,5 мл СН 3 ОН). После перемешивания в течение 5 мин смесь концентрировали в вакууме и остаток растирали со смесью метанол-эфир с получением 0,35 г указанного в заголовке соединения (82%) в виде бесцветного твердого вещества. Время удерживания ВЭЖХ: 3,3 мин. 1 Н-ЯМР (400 МГц, D2O)6,74 (дд, 1 Н,J=6,0, 9,6 Гц) , 6,63 (дд, 1 Н, J=6,4, 10,4 Гц), 4,61MS(APCI, m/z): 468 [М+Н]+. Пример 7. Амид 3-(2,5-дифтор-4-метилбензилокси)-5-[3-(4-гидрокси-5-пиперидин-1 илпентил)уреидо]изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,5 дифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и 5-амино-1-пиперидин 1-илпентан-2-ола по процедуре, аналогичной примеру 6. Время удерживания ВЭЖХ: 3,3 мин. 1 Н-ЯМР (400 МГц, CD3OD)7,18 (дд, 1 Н, J=6,0,9,2 Гц), 7,05 (дд, 1 Н, J=6,0, 10 Гц), 5,47 (с, 2 Н),3,80 (м, 1 Н), 3,23 (т, 2 Н, J=6,4 Гц), 2,7-2,4 (м,7 Н), 2,25 (с, 3H), 1,8-1,4 (м, nН) м.д.; MS(APCI,m/z): 512 [М+Н]+. Пример 8. Амид (R)-3-(2,5-дифтор-4 метилбензилокси)-5-3-[4-(3-гидроксипирролидин-1-ил)бутил]уреидоизотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,5 дифтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты и (R)-1-(4-аминобутил) пирролидин-3-ола по процедуре, аналогичной примеру 6. Время удерживания ВЭЖХ: 3,2 мин. 1MS(APCI, m/z): 484 [М+Н]+. Пример 9. Амид 3-(2,5-дифтор-4-метилбензилокси)-5-[3-(6-диметиламиногексил)уреидо]изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,5 дифтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты и N1,N1-диметилгексан-1,6 диамина по процедуре, аналогичной примеру 6. Время удерживания ВЭЖХ: 3,4 мин. 1 Н-ЯМРMS(APCI, m/z): 470 [М+Н]+. Пример 10. Амид 3-(2,5-дифтор-4 метилбензилокси)-5-3-[4-(2-гидроксиметилпирролидин-1-ил)бутил]уреидоизотиазол-4 карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,5 дифтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты и (S)-[1-(4-аминобутил) пирролидин-2-ил]метанола по процедуре, аналогичной примеру 6. Время удерживания ВЭЖХ: 3,2 мин. 1 Н-ЯМР (400 МГц, CD3OD)7,18 (дд, 1 Н, J=6,0, 9,2 Гц), 7,04 (дд, 1 Н, J=6,4,10 Гц), 5,45 (с, 2 Н), 3,62-3,56 (м, 2 Н), 3,29-3,23[М+Н]+. Пример 11. Амид 3-(2,5-дифтор-4-метилбензилокси)-5-3-[4-(3-гидроксипиперидин-1 ил)бутил]уреидоизотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,5-дифтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты и 1-(4-аминобутил)пиперидин-3-ола по процедуре, аналогичной примеру 6. Время удерживания ВЭЖХ: 3,3 мин. 1 Н-ЯМРMS(APCI, m/z): 498 [М+Н]+. Пример 12. Амид 3-(2,5-дифтор-4-метилбензилокси)-5-[3-(5-изопропиламинопентил) уреидо]изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,5-дифтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты и N1-изопропилпентан-1,5 диамина по процедуре, аналогичной примеру 6. Время удерживания ВЭЖХ: 3,4 мин. 1H-ЯМР(300 МГц, CD3OD)7,20 (дд, 1 Н, J=5,7, 9,0 Гц),7,06 (дд, 1 Н, J=6,3, 10 Гц), 5,47 (с, 2 Н), 3,23 (т,2 Н, J=6,6 Гц), 2,93 (с, 1 Н, J=6,3 Гц), 2,70 (м, 2 Н), 49 2,27 (д, 3H, J=1,8 Гц), 1,7-1,5 (м, 4 Н), 1,5-1,3 (м,2 Н) 1,11 (д, 6 Н, J=6,6 Гц) м.д. MS(APCI, m/z): 470 [М+Н]+. Пример 13. Амид 3-(2,3-дифтор-4-метилбензилокси)-5-3-[4-(3,4-дигидроксипирролидин-1-ил)бутил]уреидоизотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,5 дифтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты и 1-(4-аминобутил)пирролидин-3,4-диола по процедуре, аналогичной примеру 6. Время удерживания ВЭЖХ: 3,1 мин. 1 Н-ЯМР (400 МГц, CD3OD)7,17 (т, 1 Н, J=7,6 Гц), 7,03 (т, 1 Н, J=7,3 Гц), 5,49 (с, 2 Н) 4,01 (с,2 Н), 3,21 (с, 2 Н), 2,93 (м, 2 Н), 2,48 (м, 4 Н), 2,29[М+Н]+. Пример 14. Метансульфонатная соль амида 3-(4-хлор-2,6-дифторбензилокси)-5-[3-(3 гидрокси-5-пирролидин-1-илпентил)уреидо] изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,5 дифтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты и 1-амино-5-пирролидин-1 илпентан-3-ола по процедуре, аналогичной примеру 6. Время удерживания ВЭЖХ: 3,1 мин. 1[М+Н]+. Пример 15. Метансульфонатная соль амида 3-(4-хлор-2,6-дифторбензилокси)-5-[3-(3 гидрокси-5-пирролидин-1-илпентил)уреидо] изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,5 дифтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты и 1-амино-5-пирролидин-1 илпентан-3-ола по процедуре, аналогичной примеру 6. Время удерживания ВЭЖХ: 3,3 мин. 1 Н-ЯМР (400 МГц, CD3OD)7,17 (д, 2 Н,J=6,4 Гц), 5,51 (с, 2 Н), 3,64 (шм, 1 Н), 3,24 (т, 2 Н,J=6,0 Гц), 2,92 (м, 1 Н), 2,72 (м, 1 Н), 2,39 (м, 2 Н),1,98 (м, 1 Н), 1,87 (м, 2 Н), 1,75 (м, 1 Н), 1,54 (м,4 Н), 1,22 (м, 2 Н) м.д. MS(APCI, m/z): 517[М+Н]+. Пример 16. Метансульфонатная соль амида 3-(4-хлор-2,6-дифторбензилокси)-5-[3-(3 гидрокси-5-пирролидин-1-илпентил)уреидо] изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,5 дифтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты и 1-амино-5-пирролидин-1 илпентан-3-ола по процедуре, аналогичной примеру 6. Время удерживания ВЗЖХ: 3,3 мин. 1 Н-ЯМР (400 МГц, CD3OD)7,17 (д, 2 Н, J=6,4 Гц), 5,51 (с, 2 Н), 3,64 (шм, 1 Н), 3,24 (т, 2 Н, J=6,0(м, 1 Н), 1,87 (м, 2 Н), 1,75 (м, 1 Н), 1,54 (м, 4 Н),1,22 (м, 2 Н) м.д. MS(APCI, m/z): 517 [М+Н]+. Пример 17. Амид 5-(3-4-[бис-(2-гидроксиэтил)амино]бутилуреидо)-3-(2,5-дифтор-4 метилбензилокси)изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,5 дифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и 2-[(4-аминобутил)-(2 гидроксиэтил)амино]этанола по процедуре, аналогичной примеру 6. Время удерживания ВЭЖХ: 3,1 мин. 1 Н-ЯМР (400 МГц, CD3OD)7,20 (дд, 1 Н, J=6,0, 9,2 Гц), 7,04 (дд, 1 Н, J=6,8,9,6 Гц), 5,45 (с, 2 Н), 3,63 (т, 4 Н, J=5,6 Гц), 3,28[М+Н]+. Пример 18. Амид 3-(2,5-дифтор-4-метилбензилокси)-5-3-[4-(3,4-дигидроксипирролидин-1-ил)бутил]уреидоизотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,5 дифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и 1-(4-аминобутил)пирролидин-3,4-диола по процедуре, аналогичной примеру 8. Время удерживания ВЭЖХ: 3,3 мин. 1 Н-ЯМР (400 МГц, CD3OD)7,20 (дд, 1 Н, J=6,0,9,2 Гц), 7,04 (дд, 1 Н, J=6,8, 9,6 Гц), 5,45 (с, 2 Н),3,63 (т, 4 Н, J=5,6 Гц), 3,28 (м), 2,74 (м, 4 Н), 2,68(м, 2 Н), 2,25 (д, 3H, J=2,0 Гц), 1,56 (м, 4 Н) м.д. Пример 19. Амид 5-[3-(4-трет-бутиламино 3-гидроксибутил)уреидо]-3-(2,5-дифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,5 дифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и 4-амино-1-третбутиламинобутан-2-ола по процедуре, аналогичной примеру 6. Время удерживания ВЭЖХ: 3,3 мин. 1 Н-ЯМР (400 МГц, CD3OD)7,18 (дд, 1 Н, J=6,8,9, 6 Гц), 7,04 (дд, 1 Н, J=6,4, 10 Гц), 5,45 (с, 2 Н) ,3,66 (м, 1 Н), 3,34 (т, 2 Н, J=7,6 Гц), 2,58 (м, 2 Н),2,25 (с, 3H), 1,69-1,60 (м, 2 Н), 1,12 (с, 9 Н) м.д.;MS(APCI, m/z): 486 [М+Н]+. Пример 20. Гидрохлоридная соль амида 3(4-хлор-2,6-дифторбензилокси)-5-3-[3-(4-метилпиперазин-1-ил)пропил]уреидоизотиазол-4 карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,6 дифтор-4-хлорбензилокси)изотиазол-5-ил]карбаминовой кислоты и 3-(4-метилпиперазин-1 ил)пропиламина по процедуре, аналогичной примеру 6. 1 Н-ЯМР (400 МГц, D2O)6,86 (шм,2 Н), 5,20 (с, 2 Н), 3,4-2,6 (шм, 8 Н), 3,10 (ш, 5 Н),2,63 (ш, 5 Н), 1,67 (м, 2 Н) м.д. MS(APCI, m/z): 503 [М+Н]+. 51 Пример 21. Амид 3-(4-хлор-2,6-дифторбензилокси)-5-[3-(3-гидрокси-5-изопропиламинопентил)уреидо]изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,6 дифтор-4-хлорбензилокси)изотиазол-5-ил]карбаминовой кислоты и 1-амино-5-изопропиламинопентан-3-ола по процедуре, аналогичной примеру 6. Время удерживания ВЭЖХ: 3,2 мин. 1 Н-ЯМР (400 МГц, CD3OD)7,17, (д, 1H, J=7,6 Гц), 5,52 (с, 2 Н), 3,69 (м, 1 Н), 3,34 (т, 2 Н, J=6,4 Гц), 2,80 (с, 1 Н, J=6,0 Гц), 2,73 (м, 2 Н), 1,68-1,58(м, 4 Н), 1,06 (д, 6 Н, J=6,0 Гц) м.д.; MS (APCI,m/z): 506 [М+Н]+. Пример 22. Амид 3-(4-хлор-2,6-дифторбензилокси)-5-[3-(3-гидрокси-5-изопропиламинопентил)уреидо]изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,6 дифтор-4-хлорбензилокси)изотиазол-5-ил]карбаминовой кислоты и 1-амино-5-изопропиламинопентан-3-ола по процедуре, аналогичной примеру 6. Время удерживания ВЭЖХ: 3,2 мин. 1 Н-ЯМР (400 МГц, CD3OD)7,17 (д, 1 Н, J=7,6 Гц), 5,52 (с, 2 Н), 3,69 (м, 1 Н), 3,34 (т, 2 Н, J=6,4 Гц), 2,80 (с, 1 Н, J=6,0 Гц), 2,73 (м, 2 Н), 1,68-1,58(м, 4 Н), 1,06 (д, 6 Н, J=6,0 Гц) м.д.; MS(APCI,m/z): 506 [М+Н]+. Пример 23. Амид 3-(2,5-дифтор-4-метилбензилокси)-5-(3-6-[4-(2-гидроксиэтил)пиперазин-1-ил]гексилуреидо)изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,5 дифтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты и 2-[4-(6-аминогексил)пиперазин-1-ил]этанола по процедуре, аналогичной примеру 6. Время удерживания ВЭЖХ: 3,0 мин. 1 Н-ЯМР (400 МГц, CD3OD)7,17 (д, 1 Н,J=6,4, 9,6 Гц), 7,01 (м, 1 Н), 5,44 (с, 2 Н), 3,64 (т,2 Н, J=5,6 Гц), 3,18 (т, 2 Н, J=6,8 Гц), 2,7-2,4 (шм,8H), 2,50 (т, 2 Н, J=6,0 Гц), 2,33 (м, 2 Н), 2,23 (с,3H), 1,50 (м, 4 Н), 1,35 (м, 4H) м.д.; MS(APCI,m/z): 555 [М+Н]+. Пример 24. Амид 3-(4-хлор-2,5-дифторбензилокси)-5-[3-(6-диметиламиногексил)уреидо]изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,5 дифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и 2-[4-(6-аминогексил) пиперазин-1-ил]этанола по процедуре, аналогичной примеру 6. Время удерживания ВЭЖХ: 3,0 мин. 1 Н-ЯМР (400 МГц, CD3OD)7,17 (д,1 Н, J=6,4, 9,6 Гц), 7,01 (м, 1 Н), 5,44 (с, 2 Н), 3,64 52 Пример 25. Амид 5-3-[3-(4-метилпиперазин-1-ил)пропил]уреидо-3-(2,3,6-трифтор-4 метилбензилокси)изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,3,6 трифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и 3-(4-метилпиперазин 1-ил)пропиламина по процедуре, аналогичной примеру 1. MS(APCI, m/z): 501 [М+Н]+. Пример 26. Амид 3-(2-фтор-4-метилбензилокси)-5-3-[3-(4-метилпиперазин-1-ил) пропил]уреидоизотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2 фтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты и 3-(4-метилпиперазин-1 ил)пропиламина по процедуре, аналогичной примеру 1. MS(APCI, m/z): 465 [М+Н]+. Пример 27. Амид 3-(2-фтор-4-метилбензилокси)-5-[3-(5-изопропиламинопентил) уреидо]изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2 фтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты и N-изопропилпентан-1,5 диамина по процедуре, аналогичной примеру 1.MS(APCI, m/z): 452 [М+Н]+. Пример 28. Амид 3-(2,6-дифтор-4-метилбензилокси)-5-[3-(4-пирролидин-1-илбутил) уреидо]изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,6 дифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и 4-пирролидин-1 илбутиламина по процедуре, аналогичной примеру 1. 1H-ЯМР (400 МГц, CDCl3)1,63 (шс,4 Н), 1,83 (шс, 4 Н), 2,34 (с, 3H), 2,46-2,52 (м, 6 Н),3,28 (с, 2 Н), 5,40 (с, 1 Н), 5,50 (с, 2 Н), 6,74 (д,J=8,3 Гц, 2H), 6,98 (с, 1 Н), 7,94 (шс, 1 Н), 10,83(шс, 1 Н) м.д.; MS(APCI, m/z): 468 [М+Н]+. Пример 29. Амид 3-(2,6-дифтор-4-метилбензилокси)-5-(3-4-[4-(2-гидроксиэтил)пиперазин-1-ил]бутилуреидо)изотиазол-4 карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,6 дифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и 2-[4-(4-аминобутил) пиперазин-1-ил] этанола по процедуре, аналогичной примеру 1. MS(APCI, m/z): 527 [М+Н]+. Пример 30. Амид 3-(4-бром-2,6-дифторбензилокси)-5-[3-(4-пирролидин-1-илбутил) уреидо]изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [3-(4-бром-2,6-дифторбензилокси)-4-карбамоилизотиазол-5-ил]карбаминовой кислоты и 4-пирролидин-1-илбутиламина по процедуре, аналогичной примеру 1. 53 Пример 31. Амид 3-(2,6-дифтор-4-метилбензилокси)-5-[3-(4-гидрокси-5-пиперазин-1 илпентил)уреидо]изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,6 дифтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты и 5-амино-1-пиперидин-1 илпентан-2-ола по процедуре, аналогичной примеру 1. MS(APCI, m/z): 512 [М+Н]+. Пример 32. Амид 3-(4-бром-2,3,6-трифторбензилокси)-5-3-[3-(4-метилпиперазин-1-ил) пропил]уреидоизотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [3-(4-бром-2,3,6-трифторбензилокси)-4-карбамоилизотиазол-5-ил] карбаминовой кислоты и 3-(4-метилпиперазин 1-ил)пропиламина по процедуре, аналогичной примеру 1. MS(APCI, m/z): 565 и 567 [М+Н]+. Пример 33. Амид 3-(2,6-дифтор-4-метилбензилокси)-5-3-[3-(4-метилпиперазин-1 ил)пропил]уреидоизотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,6 дифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и 3-(4-метилпиперазин 1-ил)пропиламина по процедуре, аналогичной примеру 1. MS(APCI, m/z): 483 [М+Н]+. Пример 34. Амид 3-(2,6-дифтор-4-метилбензилокси)-5-[3-(3-гидрокси-5-пирролидин-1 илпентил)уреидо]изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,6 дифтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты и 1-амино-5-пирролидин-1 илпентан-3-ола по процедуре, аналогичной примеру 1. MS(APCI, m/z): 498 [М+Н]+. Пример 35. Амид 5-[3-(4-пирролидин-1 илбутил)уреидо]-3-(2,3,6-трифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,3,6 трифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и 4-пирролидин-1-илбутиламина по процедуре, аналогичной примеру 1. MS(APCI, m/z): 486 [М+Н]+. Пример 36. Амид 5-[3-(3-гидрокси-5 пирролидин-1-илпентил)уреидо]-3-(2,3,6-трифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,3,6 трифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и 1-амино-5-пирролидин-1-илпентан-3-ола по процедуре, аналогичной примеру 1. MS(APCI, m/z) : 516 [М+Н]+. Пример 37. Амид 5-3-[2-(1-метилпирролидин-2-ил)этил]уреидо-3-(2,3,6-трифтор-4 004935 54 метилбензилокси)изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,3,6 трифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и 2-(1-метилпирролидин-2-ил)этиламина по процедуре, аналогичной примеру 1. MS(APCI, m/z): 472 [М+Н]+. Пример 38. Амид 5-[3-(4-диметиламинобутил)уреидо]-3-(2,3,6-трифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,3,6 трифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и N,N-диметилбутан 1,4-диамина по процедуре, аналогичной примеру 1. MS(APCI, m/z): 460 [М+Н]+. Пример 39. Амид 5-[3-(3-диметиламинопропил)уреидо]-3-(2,3,6-трифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,3,6 трифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и N,N-диметилпропан 1,3-диамина по процедуре, аналогичной примеру 1. MS(APCI, m/z): 446 [М+Н]+. Пример 40. Амид 5-[3-(3-гидрокси-5-изопропиламинопентил)уреидо]-3-(2,3,6-трифтор 4-метилбензилокси)изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,3,6 трифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и 1-амино-5-изопропиламинопентан-3-ола по процедуре, аналогичной примеру 1. MS(APCI, m/z): 504 [М+Н]+. Пример 41. Амид 5-[3-(3-изопропиламинопропил)уреидо]-3-(2,3,6-трифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,3,6 трифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и N-изопропилпропан 1,3-диамина по процедуре, аналогичной примеру 1. MS(APCI, m/z): 460 [М+Н]+. Пример 42. Амид 5-3-[4-(4-метилпиперазин-1-ил)бутил]уреидо-3-(2,3,6-трифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,3,6 трифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и 4-(4-метилпиперазин 1-ил)бутиламина по процедуре, аналогичной примеру 1. MS(APCI, m/z): 515 [М+Н]+. Пример 43. Амид 5-(3-4-[4-(2-гидроксиэтил)пиперазин-1-ил]бутилуреидо)-3-(2,3,6 трифтор-4-метилбензилокси)изотиазол-4 карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,3,6 трифтор-4-метилбензилокси)изотиазол-5-ил] 55 карбаминовой кислоты и 2-[4-(4-аминобутил) пиперазин-1-ил]этанола по процедуре, аналогичной примеру 1. MS(APCI, m/z): 545 [М+Н]+. Пример 44. Амид 5-[3-(3-пирролидин-1 илпропил)уреидо]-3-(2,3,6-трифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,3,6 трифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и 3-пирролидин-1 илпропиламина по процедуре, аналогичной примеру 1. MS(APCI, m/z): 472 [М+Н]+. Пример 45. Амид 5-[3-(4-гидрокси-5-пиперидин-1-илпентил)уреидо]-3-(2,3,6-трифтор-4 метилбензилокси)изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,3,6 трифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и 5-амино-1-пиперидин 1-илпентан-2-ола по процедуре, аналогичной примеру 1. MS(APCI, m/z): 530 [М+Н]+. Пример 46. Амид 5-(3-4-[этил-(2-гидроксиэтил)амино]бутилуреидо)-3-(2,3,6-трифтор 4-метилбензилокси)изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,3,6 трифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и 2-[(4-аминобутил) этиламино]этанола по процедуре, аналогичной примеру 1. MS(APCI, m/z): 504 [М+Н]+. Пример 47. Амид 3-(4-бром-2,6-дифторбензилокси)-5-3-[3-(4-метилпиперазин-1-ил) пропил]уреидоизотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [3-(4-бром-2,6-дифторбензилокси)-4-карбамоилизотиазол-5-ил]карбаминовой кислоты и 3-(4-метилпиперазин-1 ил)пропиламина по процедуре, аналогичной примеру 1. MS(APCI, m/z): 547 и 549 [М+Н]+. Пример 48. Амид 3-(2,6-дифтор-4 метилбензилокси)-5-3-[2-(1-метилпирролидин 2-ил)этил]уреидоизотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,6 дифтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты и 2-(1-метилпирролидин-2 ил)этиламина по процедуре, аналогичной примеру 1. MS(APCI, m/z): 454 [М+Н]+. Пример 49. Амид 3-(2,6-дифтор-4-метилбензилокси)-5-[3-(4-диметиламинобутил)уреидо]изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,6 дифтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты и N,N-диметилбутан-1,4 диамина по процедуре, аналогичной примеру 1. 56 Пример 50. Амид 3-(2,6-дифтор-4-метилбензилокси)-5-[3-(3-диметиламинопропил) уреидо]изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,6 дифтор-4-метилбензилокси)изотиазол-5-ил]карбаминовой кислоты и N,N-диметилпропан-1,3 диамина по процедуре, аналогичной примеру 1.MS(APCI, m/z): 428 [М+Н]+. Пример 51. Амид 3-(4-бром-2,3,6-трифторбензилокси)-5-[3-(4-пирролидин-1-илбутил)уреидо]изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [3-(4-бром-2,3,6-трифторбензилокси)-4-карбамоилизотиазол-5-ил] карбаминовой кислоты и 4-пирролидин-1 илбутиламина по процедуре, аналогичной примеру 1. MS(APCI, m/z): 550 и 552 [М+Н]+. Пример 52. Амид 5-[3-(3-метиламинопропил)уреидо]-3-(2,3,6-трифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,3,6 трифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и N-метилпропан-1,3 диамина по процедуре, аналогичной примеру 1.MS(APCI, m/z): 432 [М+Н]+. Пример 53. Амид 5-[3-(3-аминопропил)-3 метилуреидо]-3-(2,3,6-трифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,3,6 трифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и N-метилпропан-1,3 диамина по процедуре, аналогичной примеру 1.MS(APCI, m/z): 432 [М+Н]+. Пример 54. Амид 5-[3-(4-диэтиламинобутил)уреидо]-3-(2,3,6-трифтор-4-метилбензилокси)изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,3,6 трифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и N,N-диэтилбутан-1,4 диамина по процедуре, аналогичной примеру 1.MS(APCI, m/z): 488 [М+Н]+. Пример 55. Амид 3-(2,6-дифтор-4-метилбензилокси)-5-[3-(3-пирролидин-1-илпропил) уреидо]изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,6 дифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и 3-пирролидин-1-илпропиламина по процедуре, аналогичной примеру 1. MS(APCI, m/z): 454 [М+Н]+. Пример 56. Амид 3-(3-хлор-2,6-дифтор-4 метилбензилокси)-5-[3-(4-диметиламинобутил) уреидо]изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(3 хлор-2,6-дифтор-4-метилбензилокси)изотиазол 5-ил]карбаминовой кислоты и N,N-диэтилбу 57 тан-1,4-диамина по процедуре, аналогичной примеру 1. MS(APCI, m/z): 476 [М+Н]+. Пример 57. Амид 5-(3-4-[бис-(2-гидроксиэтил)амино]бутилуреидо)-3-(2,6-дифтор-4 метилбензилокси)изотиазол-4-карбоновой кислоты. Указанное в заголовке соединение получали из фенилового эфира [4-карбамоил-3-(2,6 дифтор-4-метилбензилокси)изотиазол-5-ил] карбаминовой кислоты и 2-[(4-аминобутил)(2 гидроксиэтил)амино]этанола по процедуре, аналогичной примеру 1. MS(APCI, m/z): 502[М+Н]+. Следующие характерные соединения получали с использованием общих синтетических процедур, описанных выше со ссылками на схемы 1-5, и конкретных синтетических процедур, описанных в приведенных выше получениях и примерах.
МПК / Метки
МПК: C07D 487/08, A61K 31/425, A61P 35/00, C07D 275/03
Метки: применимые, качестве, агентов, противораковых, производные, изотиазола
Код ссылки
<a href="https://eas.patents.su/30-4935-proizvodnye-izotiazola-primenimye-v-kachestve-protivorakovyh-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные изотиазола, применимые в качестве противораковых агентов</a>
Предыдущий патент: Асимметрический синтез прегабалина
Следующий патент: Препаративная форма галантамина с регулируемым выделением
Случайный патент: Новый способ синтеза и новая кристаллическая форма агомелатина и фармацевтические композиции, которые её содержат


































