Производные мононитрата изосорбида и их использование в качестве сосудорасширяющих агентов с пониженной толерантностью
Номер патента: 3360
Опубликовано: 24.04.2003
Авторы: Пубиль Кой Франсиско, Кабеса Льоренте Лидия, Серда Риудаветс Хуан Антонио, Негрье Рофес Кристина, Мартинес Боннин Хуан, Репольес Молинер Хосе, Феррер Сисо Алисия, Салас Перес-Расилья Эдуардо, Карбо Банус Марсель.Ли, Радомски Марек В.
Формула / Реферат
1. Соединения, которые являются производными мононитрата изосорбида и его фармацевтически приемлемых солей, соответствующие следующей общей формуле (I)
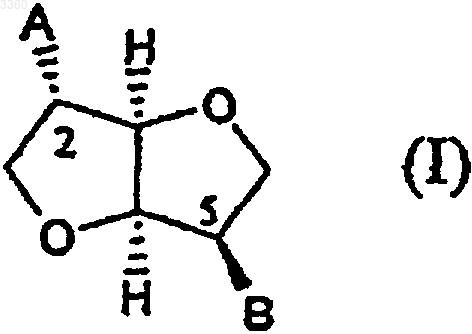
в которой A и B, каждый независимо, представляет любую из групп
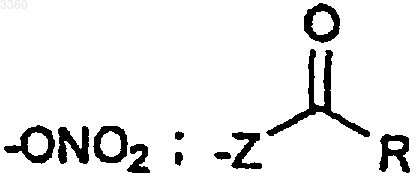
где Z представляет атом кислорода или атом серы и R представляет C1-C4-алкильную группу, арильную группу или аралкильную группу, иногда замещенную, или группу
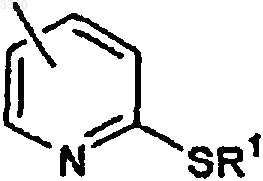
в которой R1 представляет водород или C1-C4-алкильную группу, арильную группу или аралкильную группу, иногда замещенную;
при условии, что
(a) один из A и B всегда представляет -ONO2, но никогда оба из них не являются данной группой одновременно;
(b) когда Z представляет атом серы, R представляет C1-C4-алкильную группу, арильную группу или аралкильную группу, иногда замещенную; и
(c) когда Z представляет атом кислорода, R представляет группу
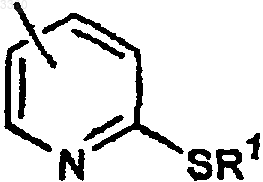
в которой R1 представляет группы, указанные выше.
2. Соединения по п.1, отличающиеся тем, что, когда Z представляет атом серы, R представляет C1-C4-алкильную группу с короткой цепью и, когда Z представляет атом кислорода, R1 представляет атом водорода или C1-C4-алкильную группу с короткой цепью.
3. Соединения по п.1 или 2, отличающиеся тем, что, В представляет группу -ONO2.
4. Соединение 5-мононитрат 2-(2'-этилтио)никотината изосорбида и его фармацевтически приемлемые соли.
5. Соединение 2-мононитрат 5-(2'-этилтио)никотината изосорбида и его фармацевтически приемлемые соли.
6. Соединение 5-мононитрат 2-(2'-меркапто)никотината изосорбида и его фармацевтически приемлемые соли.
7. Соединение 2-мононитрат 5-(2'-меркапто)никотината изосорбида и его фармацевтически приемлемые соли.
8. Соединение 5-мононитрат 2-ацетилмеркаптоизосорбида.
9. Применение соединений по любому из пп.1-8 для производства лекарственных средств с сосудорасширяющим действием для лечения дисфункций циркуляторной системы.
10. Применение по п.9 соединений по любому из пп.1-8 для производства лекарственных средств для лечения сердечно-сосудистой и коронарной дисфункций.
Текст
1 Область изобретения Настоящее изобретение относится к новым производным мононитрата изосорбида, которые обладают сильной сосудорасширяющей активностью и которые, в то же самое время, обладают значительно пониженной толерантностью. Предпосылки создания изобретения Образованные азотной кислотой эфиры органических соединений, обычно известные как нитрованные органические соединения, известны и используются в качестве сосудорасширяющих агентов. При этом хорошо известна полезность моно- и динитрованного изосорбида и, кроме того, были описаны соединения с сосудистой и коронарной активностью, основанные на реакциях замещения свободной гидроксильной группы мононитрата изосорбида. Например, в патенте США US-A-4891373 описываются производные аминопропанола, соответствующие формулам для лечения стенокардии и системной и легочной гипертензии. В патенте США US-A-5665766 описывается 2-ацетилсалицилат 5-мононитрата изосорбида формулы а также его антиагрегирующая активность в отношении тромбоцитов. Одна из основных проблем нитрованных органических соединений, упомянутых выше,заключается в том, что они очень чувствительны по отношению к явлениям, известным как тахифилатаксия или толерантность, что связано с тем, что их действие на организм снижается в процессе пролонгированного лечения, и тогда требуется ощутимо повысить вводимые дозы постепенным образом или иначе решить проблему фармакологическим способом. Известно также, что один из путей уменьшения толерантности нитрованных органических соединений состоит во введении в молекулу тиольной группы, например, с использованием содержащих серу аминокислот. В европейском патенте ЕР-В-0362575 описываются нитрованные органические соединения с введенными молекулами цистеина и, главным образом,метионина. В заявке на патент WO-A-92/04337 описываются органические нитрованные производные 2 кольца тиазолидина с сосудорасширяющей активностью и пониженной толерантностью. В заявке на патент WO-A-93/03037 описывается огромное количество различных нитрованных органических сосудорасширяющих соединений с пониженной толерантностью весьма различных структур. В их число включаются в общем, т.е. без конкретизации и без описания какого-либо конкретного продукта, производные мононитрата изосорбида со следующей структурой в которой R5 представляет атом водорода, C1-С 6 алкильную группу, фенил и др. Сами по себе нитрованные органические соединения, описанные в упомянутых выше документах, не решают проблем, связанных с толерантностью нитрованных органических соединений, поскольку они все еще имеют проблемы, связанные с низкой сосудорасширяющей активностью, высокой толерантностью и др. Соответственно существует все еще необходимость разработки новых нитрованных органических соединений, которые обладали бы высокой сосудорасширяющей активностью в сочетании с более пониженным и постоянно поддерживаемым уровнем толерантности. Краткое изложение сущности изобретения Объектом данного изобретения является новый тип соединений, производных мононитрата изосорбида, которые способны оказывать сильное сосудорасширяющее действие и которые в то же время проявляют незначительный или нулевой эффект толерантности. Следующий объем настоящего изобретения относится к применению новых производных мононитрата изосорбида для производства медикаментов или лекарственных средств для лечения нарушений, связанных с дисфункциями циркуляторной системы, в частности, на уровне коронарной системы. Подробное описание изобретения Новые производные мононитрата изосорбида и его фармацевтически приемлемые соли,которые являются предметом изобретения, соответствуют следующей общей формуле (I) в которой А и В, каждый независимо, представляет любую из групп где Z представляет атом кислорода или атом серы и R представляет С 1-С 4-алкильную группу,арильную группу или аралкильную группу, иногда замещенную, или группу в которой R1 представляет водород или С 1-С 4 алкильную группу, арильную группу или аралкильную группу, иногда замещенную. Все это с условием, что:-ОNО 2, но никогда оба из них не являются данной группой одновременно;(b) когда Z представляет атом серы, R представляет C1-C4-алкильную группу, арильную группу или аралкильную группу, иногда замещенную; и в которой R1 представляет группы, указанные выше. В числе новых производных изобретения предпочтительно, чтобы, когда Z представляет атом серы, R представлял C1-C4-алкильную группу с короткой цепью, и когда Z представляет атом кислорода, R1 представлял атом водорода или С 1-С 4-алкильную группу с короткой цепью. Более предпочтительно в пределах вышеуказанных критериев, чтобы В представлял группу -ONO2, т.е. предпочтительны соединения, у которых нитратный эфир находится в положении 5 циклической системы изосорбида. Упомянутые выше предпочтения не должны никоим образом рассматриваться как ограничивающие объем настоящего изобретения. В случае, когда R1 представляет водород,соединения изобретения могут быть представлены в виде любого из двух его таутомеров 5-мононитрат 2-(2'-метилтио)никотината изосорбида формулы и обе из таутомерных структур должны рассматриваться как охватываемые рамками объекта изобретения. Примерами конкретных соединений в пределах изобретения могут быть следующие соединения: 5-мононитрат 2-(2'-этилтио)никотината изосорбида формулы а также их фармацевтически приемлемые соли,особенно их хлоргидраты. Особенно предпочтительными являются соединение 1 и его хлоргидрат и соединение 5. Соединения настоящего изобретения можно получить с помощью приемов сложной этерификации с использованием известных или доступных исходных продуктов, описанных в литературе по основной органической химии,известной специалисту в данной области, например, в публикациях Chemical Abstracts Service, Beilstein Encyclopedia of organic products или в любой другой соответствующей публикации,доступной в университетских библиотеках. Например, когда Z представляет атом кислорода, соединения можно получить из изосорбида или соответствующего мононитрата изосорбида по реакции этерификации указанных соединений соответствующей карбоновой кислотой или ее активированным производным,например, хлорангидридом кислоты, ангидридом или активным эфиром и т.д. Если исходным продуктом является изосорбид, необходимо заканчивать синтез дополнительной стадией,состоящей в нитровании свободной гидроксильной группы изосорбида, стадией, которая не обязательна, если исходят из любого из мононитратов изосорбидов в положении 5 или в положении 2 циклической структуры указанного соединения. Когда R1 представляет водород, данные соединения имеют тиольную группу, которая может непреднамеренно окисляться, давая димеры с двумя атомами серы. В этом случае димеры могут превращаться обратно в соответствующие мономеры по реакции с трифенилфосфином в воде, как описано в R. Humphrey(1964), Analytical Chem., 36, 1812, и L.E. Overman (1974), Synthesis, 59. Когда Z представляет атом серы, ситуация очень сходна, поскольку достаточно начать синтез из соответствующей тиокарбоновой кислоты вместо карбоновой кислоты, упомянутой выше,и использовать приемы, хорошо известные специалисту для образования сложной тиоэфирной связи. С другой стороны, если любая из реакций включает эпимеризацию хирального центра, в качестве исходного соединения можно использовать адекватный энантиомер изосорбида, например, изоманид. Проведенные испытания показывают, что новые производные мононитрата изосорбида изобретения проявляют сосудорасширяющую активность, сравнимую, как минимум, с активностью самого мононитрата изосорбида, а в не 003360 6 которых случаях значительно превосходящую. Кроме того, они проявляют значительно меньшую толерантность по сравнению с толерантностью, наблюдаемой с указанным соединением, и в некоторых случаях она достигает практически нулевого значения. Следовательно, соединения изобретения могут очень эффективно использоваться для изготовления лекарственных средств с сосудорасширяющим действием для лечения дисфункций циркуляторной системы, в частности, на сердечно-сосудистом и коронарном уровне. Соответственно, соединения общей формулы (I), а также их фармацевтически приемлемые соли могут использоваться с помощью общепринятых фармацевтических приемов в производстве лекарственных средств, которые можно вводить различными путями. Например, их можно вводить перорально в форме фармацевтических препаратов, таких как таблетки, капсулы, сиропы и суспензии, парентерально в форме растворов или эмульсий и т.д. Их можно вводить также местно в форме кремов, помад, бальзамов и т.д. и чрескожно,например, с помощью использования пластырей или повязок. Их можно также применять непосредственно в прямой кишке в виде суппозиториев. Препараты могут включать физиологически приемлемые носители, наполнители или эксципиенты, активаторы, хелатирующие агенты, стабилизаторы и т.д. В случае инъекций могут вводиться физиологически приемлемые буферы, солюбилизирующие агенты или изотонические агенты. Суточная доза может варьировать в зависимости от конкретных симптомов,возраста, массы тела пациентов, конкретного способа введения и т.д., и суточная стандартная доза для взрослого человека может быть между 1 и 500 мг, ее можно вводить в виде только одной дозы или разделять на несколько доз, вводимых в течение дня. В рабочих примерах, представленных здесь ниже, подробно описываются подходящие способы получения различных соединений, соответствующих общей формуле (I). Принимая во внимание эти примеры, на основании общих знаний специалисты в данной области смогут получить соединения, не приведенные здесь в качестве подробных примеров, с помощью подходящих видоизменений указанных здесь рабочих примеров. Следовательно, приведенные здесь рабочие примеры должны толковаться не как ограничивающие объем изобретения, а единственно в качестве дополнительных подробных пояснений, которые смогут дать специалисту более глубокое понимание изобретения. Примеры Соединения, полученные в приведенных ниже примерах, идентифицируют при помощи их данных инфракрасной спектроскопии (ИК) и/или спектроскопии ядерного магнитного ре 7 зонанса протона (1 Н NMR) и углерода 13 (13 СPERKIN-ELMER FTIR Model 1700. Положения наиболее значительных пиков указаны в см-1. Спектры ядерного магнитного резонанса регистрировали на приборе Varian Gemini-200. В спектрах 1H NMR указывается рабочая частота и растворитель, используемый для регистрации спектра. Положение сигналов указывается в(м.д.) с использованием в качестве стандарта сигнала протонов растворителя. Значения стандарта составляют 7,24 м.д. для дейтерированного хлороформа и 2,49 м.д. для дейтерированного диметилсульфоксида. В скобках указывается число протонов, соответствующее каждому сигналу, измеренному по электронной интеграции, и тип сигнала указывают с использованием следующих сокращений: s (синглет), dD2O (исчезает во время регистрации спектра после добавления нескольких капель дейтерированной воды). В спектрах 13 С NMR указываются рабочая частота и растворитель на каждом спектре. Положение сигналов указывается в(м.д.) с использованием в качестве стандарта сигнала протонов растворителя. Значения стандарта составляют 77,00 м.д. для дейтерированного хлороформа и 39,50 м.д. для дейтерированного диметилсульфоксида. Кроме того, были проведены эксперименты магнитного ядерного резонанса с использованием анализа присоединенных протонов(APT). В экспериментальной части примеров используют следующие сокращения:EtOEt диэтиловый эфир Пример 1. Получение хлоргидрата 5 мононитрата 2-(2'-этилтио)никотината изосорбида. 8 275,6 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 3,5 ч. После этого смесь охлаждают и избыток тионилхлорида удаляют при пониженном давлении при добавлении порций толуола. После сушки при пониженном давлении добавляют 4,67 г твердого желтоватого продукта, соответствующего представляющему интерес хлорангидриду кислоты. Выход: 100%. Стадия 2. В 50 мл стеклянной колбе, снабженной магнитной мешалкой и обратным холодильником, 4,67 г (23,2 ммоль) хлорангидрида кислоты, полученного на вышеуказанной стадии, растворяют в атмосфере Аr в 25 мл пиридина. Раствор охлаждают на ледяной бане и добавляют 4,44 г (23,2 ммоль) 5-мононитрата изосорбида. Реакционную смесь перемешивают при комнатной температуре в атмосфере Аr в течение 19 ч. После этого растворитель удаляют при пониженном давлении. Остаток растворяют в 50 мл СНСl3 и промывают сначала 50 мл воды,затем 50 мл 5% водного раствора НСl и еще раз 50 мл воды. Органическую фазу сушат над безводным MgSO4, фильтруют и растворитель удаляют при пониженном давлении. После сушки при пониженном давлении получают 7,25 г представляющего интерес продукта. Выход: 88%. Стадия 3. В 250 мл трехгорлой стеклянной колбе, снабженной обратным холодильником,закрытым трубкой с CaCl2, и снабженной магнитной мешалкой и воронкой с компенсированным давлением, растворяют 6,0 г (16,85 ммоль) продукта, полученного на предыдущей стадии в 150 мл EtOEt. Раствор перемешивают при комнатной температуре и добавляют по каплям 30 мл раствора EtOEt, насыщенного НСl (раствор предварительно получают барботированием газообразного НСl непосредственно в EtOEt до достижения насыщения), получая белый твердый осадок. Твердое вещество отфильтровывают и промывают избытком EtOEt и сушат при пониженном давлении. Получают 6,55 г представляющего интерес продукта. Выход: 99%. 1 Стадия 1. Используют тот же способ, что на стадии 2 примера 1, применяя в качестве исходного продукта 2-мононитрат изосорбида. Представляющий интерес продукт получают с химическим выходом 88%. Стадия 2. В 500 мл трехгорлой стеклянной колбе, снабженной обратным холодильником,закрытым трубкой с CaCl2, и магнитной мешалкой и капельной воронкой с компенсированным давлением, растворяют 7,0 г (19,66 ммоль) продукта, полученного на предыдущей стадии в смеси 200 мл EtOEt + 100 мл СН 2 Сl2. Раствор перемешивают при комнатной температуре и добавляют по каплям 30 мл раствора EtOEt, насыщенного НСl (раствор предварительно получают барботированием газообразного НСl непосредственно вEtOEt до достижения насыщения), получая белый твердый осадок. Твердое вещество отфильтровывают и промывают избытком EtOEt и сушат при пониженном давлении. Получают 7,05 г представляющего интерес продукта. Выход: 91%. 1 10 кипячения с обратным холодильником в течение 2 ч, наблюдая растворение твердого вещества в течение данного периода. Смесь охлаждают и избыток тионилхлорида удаляют при пониженном давлении при добавлении порциями толуола. После сушки при пониженном давлении получают 3,35 г твердого желтооранжевого вещества, соответствующего представляющему интерес хлорангидриду кислоты. Выход: 100%. Стадия 2. В 250 мл стеклянной колбе,снабженной обратным холодильником и магнитной мешалкой, 3,0 г (17,29 ммоль) полученного на предыдущей стадии хлорангидрида кислоты суспендируют в атмосфере Аr в 75 мл пиридина. Суспензию охлаждают на ледяной бане и добавляют 3,30 г (17,29 ммоль) 5 мононитрата изосорбида. Реакционную смесь перемешивают при комнатной температуре в атмосфере Аr в течение 19 ч периода времени, в течение которого смесь становится темной. После окончания реакции растворитель удаляют при пониженном давлении. Остаток растворяют в 250 мл СНСl3 и промывают: сначала 250 мл воды, затем 250 мл 5% водного раствора НСl и еще раз 250 мл воды. Органическую фазу сушат над безводным МgSO4, фильтруют и растворитель удаляют при пониженном давлении. После сушки при пониженном давлении получают 5,45 г желтого твердого вещества, которое перекристаллизовывают в изопропаноле с получением 4,83 г белого твердого вещества, которое подвергают взаимодействию в кислотной среде в течение 20 мин с трифенилфосфином (1:1,25,мол./мол.) в метаноле с 10% воды. Растворитель удаляют при пониженном давлении и остаток растворяют в AcOEt, раствор промывают некоторым количеством воды. Органическую фазу сушат и растворитель удаляют при пониженном давлении, выделяя представляющий интерес продукт с помощью препаративной хроматографии. Выход: 35,7%. 1 В 250 мл стеклянной колбе, снабженной обратным холодильником и магнитной мешал 11 кой, 3,0 г (17,29 ммоль) хлорангидрида кислоты,полученного на стадии 1 примера 3, суспендируют в атмосфере Аr в смеси 50 мл пиридина и 25 мл СНСl3. Суспензию охлаждают на ледяной бане и добавляют 3,30 г (17,29 ммоль) 2 мононитрата изосорбида. Реакционную смесь оставляют перемешиваться при комнатной температуре в атмосфере Аr в течение 19-часового периода времени, во время которого смесь становится темной. После окончания реакции растворитель удаляют при пониженном давлении. Остаток растворяют в 300 мл СНСl3 и промывают сначала 300 мл воды, затем 300 мл 5% водного раствора НСl и еще раз 300 мл воды. Органическую фазу сушат над безводным МgSO4, фильтруют и растворитель удаляют при пониженном давлении. После сушки при пониженном давлении получают 5,10 г желтоватобелого твердого вещества, которое перекристаллизовывают в изопропаноле с получением 4,55 г белого твердого вещества, которое подвергают взаимодействию в кислотной среде в течение 20 мин с трифенилфосфином (1:1,25,мол./мол.) в метаноле с 10% воды. Растворитель удаляют при пониженном давлении и остаток растворяют в AcOEt, раствор промывают некоторым количеством воды. Органическую фазу сушат и растворитель удаляют при пониженном давлении, выделяя представляющий интерес продукт препаративной хроматографией. Выход: 37,6%. 1 Стадия 1. В 1 л стеклянной колбе, снабженной обратным холодильником, капельной воронкой с компенсированным давлением и магнитной мешалкой, смешивают 60 г (411 ммоль) изоманида, 88 г (461 ммоль) паратолуолсульфонилхлорида, 296 мл ССl4, 33 мл CH2Cl2 и 247 мл Н 2 О. В колбе создают атмосферу Аr и по каплям добавляют раствор 29,9 г (453 ммоль) 85% КОН, поддерживая температуру реакции при 5 С. Период времени добавления составляет 12 1 ч 20 мин. Получаемую смесь перемешивают при 5 С в течение 7 ч. Твердое вещество отфильтровывают, промывают 2125 мл порциями Н 2 О и сушат при пониженном давлении. Полученное твердое вещество перекристаллизовывают в 1200 мл ССl4, фильтруют в горячем состоянии и фильтрат оставляют для охлаждения. Полученные кристаллы отфильтровывают и промывают, получая 54,5 г фракции А представляющего интерес продукта, монотозилата изоманида. Твердое вещество, полученное при фильтровании, перекристаллизовывают в 1000 мл ССl4, получая 29,5 г фракции В представляющего интерес продукта. Стадия 2. В 500 мл стеклянной колбе,снабженной обратным холодильником и магнитной мешалкой, 22,7 г (76 ммоль) монотозилата изоманида и 13,0 г (113 ммоль) тиоацетата калия смешивают в 113 мл н-бутанола. В колбе создают атмосферу Аr и реакционную смесь кипятят с обратным холодильником в течение 1 ч. Смесь охлаждают, фильтруют и промывают 200 мл этанола и растворители удаляют при пониженном давлении. Получают 20 г твердого вещества. Анализ тонкослойной хроматографии с отдельным образцом показывает, что представляющий интерес продукт не является основной частью неочищенного продукта. Полученный неочищенный продукт обрабатывают 300 мл н-бутанола и 40 мл тиоуксусной кислоты и кипятят с обратным холодильником в течение 1 ч. Смесь оставляют для охлаждения и фильтруют через слой SiO2. Растворители фильтрата выпаривают при пониженном давлении и получают неочищенный продукт,который подвергают флэш-хроматографии. Для хроматографического разделения в качестве элюента используют смесьCHCl3/AcOEt, 4:1. Получают фракцию 4,14 г 2 ацетилмеркаптоизосорбида, достаточно чистую,чтобы его можно было использовать на следующей стадии синтеза. Получают различные фракции представляющего интерес продукта с очень большим содержанием примеси. Данные последние фракции подвергают препаративной хроматографии с обращенной фазой, достигая очистки требуемого продукта. Стадия 3. Получают нитрующую смесь добавлением, медленно и осторожно, 2,4 мл 60% НNО 3 в смесь 10 мл уксусного ангидрида и 10 мл уксусной кислоты. Смесь получают при 0 С. В 100 мл стеклянной колбе, снабженной обратным холодильником и магнитной мешалкой, 2,51 г (12,3 ммоль) продукта, полученного на предыдущей стадии, растворяют при 0 С в 14,5 мл уксусной кислоты и после перемешивания в течение некоторого времени добавляют по каплям ранее полученную нитрующую смесь в течение 20 мин при поддержании температуры при 0 С. Реакционную смесь перемешивают в 13 течение 2 ч при 0 С, неочищенный продукт выливают в 200 мл воды и получаемую смесь экстрагируют 3200 мл порциями AcOEt. Каждую из трех порций промывают по отдельности 2220 мл порциями насыщенного раствораNaHCO3 и 200 мл воды. Полученный раствор сушат над Na2SO4, фильтруют и растворители удаляют при пониженном давлении. Получают 2,4 г неочищенного продукта, который подвергают флэш-хроматографии с использованием в качестве элюента смеси CHCl3/AcOEt, 25:1. Получают 2,08 г представляющего интерес продукта. Выход: 68%. 1 В 50 мл стеклянной колбе, снабженной магнитной мешалкой и обратным холодильником, 2,00 г (10,7 ммоль) хлорангидрида 2 метилтионикотиновой кислоты суспендируют в атмосфере Аr в 12 мл пиридина. Смесь охлаждают на ледяной бане и добавляют 2,04 г (10,7 ммоль) 5-мононитрата изосорбида. Реакционную смесь перемешивают при комнатной температуре в атмосфере Аr в течение 15 ч. По истечении указанного периода растворитель удаляют при пониженном давлении. Остаток растворяют в 50 мл СНСl3 и промывают: сначала 50 мл воды, затем 50 мл 5% водного раствора НСl и еще раз 50 мл воды. Органическую фазу сушат над безводным МgSO4, фильтруют и растворитель удаляют при пониженном давлении. После сушки при пониженном давлении получают 2,80 г представляющего интерес продукта. Выход: 77%. 1 В 50 мл стеклянной колбе, снабженной магнитной мешалкой и обратным холодильником, 2,00 г (10,7 ммоль) хлорангидрида 2 метилтионикотиновой кислоты суспендируют в атмосфере Аr в 12 мл пиридина. Смесь охлаждают на ледяной бане и добавляют 2,04 г (10,7 ммоль) 5-мононитрата изосорбида. Реакционную смесь перемешивают при комнатной температуре в атмосфере Аr в течение 15 ч. По истечении указанного периода растворитель удаляют при пониженном давлении. Остаток растворяют в 50 мл СНСl3 и промывают сначала 50 мл воды, затем 50 мл 5% водного раствора НСl и еще раз 50 мл воды. Органическую фазу сушат над безводным MgSO4, фильтруют и растворитель удаляют при пониженном давлении. После сушки при пониженном давлении получают 2,75 г представляющего интерес продукта. Выход: 75%. 1(CHar), 121,92 (Car-S), 118,87 (CHar). 86,56 (CHONO2), 84,05 (СН), 80,69 (СН), 74,41 (СН-OСО), 70,69 (СН 2), 70,61 (СН 2), 13,37 (СН 3). Пример 8. Испытание на расширение кровеносных сосудов. Используемый в данных анализах способ является по существу таким же, как способ,описанный в следующих ссылках:Salas E., et al. Eur. J. Pharmacol. 1994; 258:47-55. Различные соединения испытывают при 5 различных концентрациях в диапазоне концентраций от 0,001 до 10 мМ с использованием от 6 до 9 артериальных кругов для каждого соединения. Полученные результаты сравнивают с результатами 5-мононитрата изосорбида, который используют в качестве эталонного продукта. Результаты представлены в приведенной ниже табл. 1 и даны в виде СЕ 50 (эффективная концентрация 50), которая представляет концентрацию каждого из испытуемых соединений,при которой происходит 50% расширение кровеносных сосудов артериального круга, предварительно сокращенного с помощью 1 мкМ норэпинефрина. Таблица 1 Испытание на расширение кровеносных сосудов СЕ 50, мМ Соединение Как можно видеть в таблице, два испытанных соединения обладают сильной сосудорасширяющей активностью, по меньшей мере,сходной с активностью эталонного продукта, а соединение 1 имеет сосудорасширяющую активность, превосходящую активность эталонного продукта. Пример 9. Анализ толерантности. Различные испытуемые соединения вводят подкожным способом крысам в дозе 10 мг/кг в 16 течение трех дней, каждые восемь часов, и затем проводят анализ ex vivo для испытания способности расширять кровеносные сосуды артериальных сегментов крыс после подкожного введения соединения. Применяемый способ по существу такой же, как описан в следующих ссылках:Keith R.A., et al. 3. Pharmacol. Exp. Ther. 1982; 221:525-531. Различные соединения испытывают при 5 различных концентрациях в диапазоне концентраций от 0,001 до 10 мМ с использованием от 6 до 9 артериальных кругов для каждого соединения. Полученные результаты сравнивают с результатами 5-мононитрата изосорбида, который используют в качестве эталонного продукта, и с результатами, полученными на животных, которым не вводили никакого соединения. Полученные результаты, также представлены в виде CE50, приводятся в табл. 2. Испытание толерантности Животные без какого-либо соединения, вводимого в течение трех дней Должно быть понятно, что соединение проявляет толерантность, когда СЕ 50 продукта в сосудистых кольцах животных, которым вводили соединения, как описано выше, превосходит СЕ 50 соединения в сосудистых кольцах животных, которым не вводили соединения. СЕ 50 5-мононитрата изосорбида в группе животных, которым вводили указанное соединение, являются превосходящими в 7 раз по сравнению с CE50 необработанных животных. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения, которые являются производными мононитрата изосорбида и его фармацевтически приемлемых солей, соответствующие следующей общей формуле (I) в которой А и В, каждый независимо, представляет любую из групп что указывает на сильное проявление толерантности в случае эталонного продукта. В противоположность этому, в случае двух испытуемых соединений 1 и 5, которые составляют часть объекта изобретения, величины CE50, полученные для обоих из них, значительно ниже, что указывает на развитие толерантности, более низкой по сравнению с эталонным продуктом. Кроме того, для соединения 5 проявление толерантности практически составляет нуль при указанных условиях испытания. где Z представляет атом кислорода или атом серы и R представляет С 1-С 4-алкильную группу,арильную группу или аралкильную группу, иногда замещенную, или группу в которой R1 представляет водород или С 1-С 4 алкильную группу, арильную группу или аралкильную группу, иногда замещенную;-ONO2, но никогда оба из них не являются данной группой одновременно;(b) когда Z представляет атом серы, R представляет C1-C4-алкильную группу, арильную группу или аралкильную группу, иногда замещенную; и в которой R1 представляет группы, указанные выше. 2. Соединения по п.1, отличающиеся тем,что, когда Z представляет атом серы, R представляет C1-C4-алкильную группу с короткой цепью и когда Z представляет атом кислорода,R1 представляет атом водорода или С 1-С 4 алкильную группу с короткой цепью. 3. Соединения по п.1 или 2, отличающиеся тем, что В представляет группу -ONO2. 18 4. Соединение 5-мононитрат 2-(2'-этилтио) никотината изосорбида и его фармацевтически приемлемые соли. 5. Соединение 2-мононитрат 5-(2'-этилтио) никотината изосорбида и его фармацевтически приемлемые соли. 6. Соединение 5-мононитрат 2-(2'меркапто)никотината изосорбида и его фармацевтически приемлемые соли. 7. Соединение 2-мононитрат 5-(2'меркапто)никотината изосорбида и его фармацевтически приемлемые соли. 8. Соединение 5-мононитрат 2-ацетилмеркаптоизосорбида. 9. Применение соединений по любому из пп.1-8 для производства лекарственных средств с сосудорасширяющим действием для лечения дисфункций циркуляторной системы. 10. Применение по п.9 соединений по любому из пп.1-8 для производства лекарственных средств для лечения сердечно-сосудистой и коронарной дисфункций.
МПК / Метки
МПК: C07D 493/04, A61K 31/34, A61P 9/00, C07D 213/80
Метки: агентов, толерантностью, производные, изосорбида, пониженной, качестве, сосудорасширяющих, использование, мононитрата
Код ссылки
<a href="https://eas.patents.su/10-3360-proizvodnye-mononitrata-izosorbida-i-ih-ispolzovanie-v-kachestve-sosudorasshiryayushhih-agentov-s-ponizhennojj-tolerantnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">Производные мононитрата изосорбида и их использование в качестве сосудорасширяющих агентов с пониженной толерантностью</a>
Предыдущий патент: Микрокапсулы с инициируемым кислотой высвобождением активного ингредиента
Следующий патент: Новые соединения 7-оксо-2,3,7,14-тетрагидро-1h-бензо[b]-пирано [3,2-h]акридинкарбоксилата и содержащие их фармацевтические композиции
Случайный патент: Ранозаживляющий, противовоспалительный и противоинфекционный лекарственный препарат












