Производные 2-(пурин-9-ил)-тетрагидрофуран-3,4-диола, способы их получения, фармацевтическая композиция и способ лечения или профилактики воспалительных заболеваний с их применением
Номер патента: 3194
Опубликовано: 27.02.2003
Авторы: Чен Чуэн, Казинз Ричард Питер Чарлз, Кокс Брайан
Формула / Реферат
1. Производное 2-(пурин-9-ил)-тетрагидрофуран-3,4-диола формулы (I)
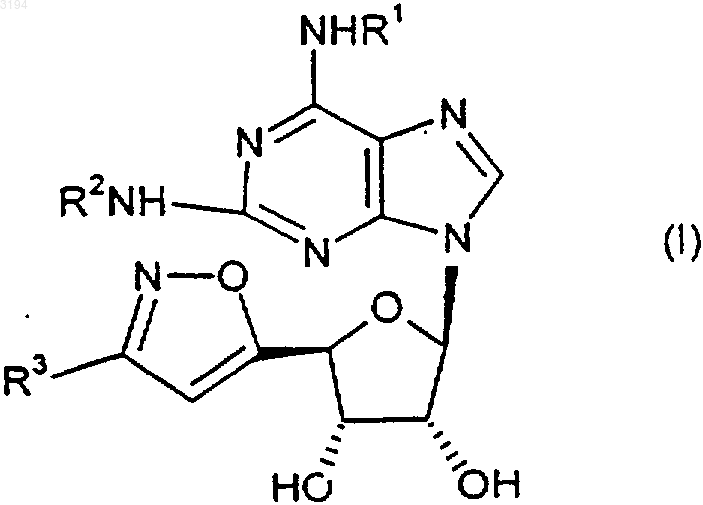
где R1 и R2 независимо представляют собой группу, выбранную из
(1) C3-8циклоалкил-;
(2) водород;
(3) арил2CHCH2-;
(4) C3-8циклоалкилC1-6алкил-;
(5) C1-8алкил-;
(6) арилC1-6алкил-;
(7) R4R5N-C1-6алкил-;
(8) C1-6алкил-CH(CH2OH)-;
(9) арилC1-5алкил-CH(CH2OH)-;
(10) C3-8циклоалкил, независимо замещенный одной или более чем одной группой -(CH2)pR6;
(11) H2NC(=NH)NHC1-6алкил-;
(12) группа формулы
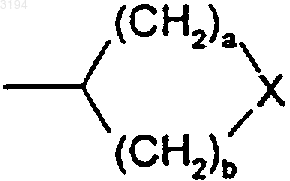
или такая группа, в которой один атом углерода метилена, соседний с X, или оба, если таковые существуют, замещены метилом;
(13) -C1-6алкил-OH;
(14) арил; и
(15) -(CH2)fSO2NHg(C1-4алкил-)2-g или -(CH2)fSO2NHg(арилC1-4алкил-)2-g;
R3 представляет собой метил, этил, н-пропил, -CH(OH)CH3, -(CH2)qгалоген, -(CH2)hY(CH2)iH, -(CH2)kZ или -(CH2)kC((CH2)uH)=NO(CH2)vH;
Y представляет собой O, S или N(CH2)jH;
Z представляет собой -COO(CH2)lH;
a и b независимо представляют собой целое число от 0 до 4 при условии, что a+b находится в пределах от 3 до 5;
f представляет собой 2 или 3, а g представляет собой целое число от 0 до 2;
p представляет собой 0 или 1;
q представляет собой целое число от 0 до 3;
h представляет собой целое число от 0 до 2;
i представляет собой такое целое число от 0 до 2, что h+i находится в пределах от 0 до 3;
j представляет собой такое целое число от 0 до 2, что h+i+j находится в пределах от 0 до 3;
k представляет собой 0 или 1;
l представляет собой такое число 1 или 2, что k+l находится в пределах от 1 до 2;
u и v независимо представляют собой такое число 0 или 1, что k+u+v находится в пределах от 0 до 1;
R4 и R5 независимо представляют собой водород, C1-6алкил, арил, арилC1-6алкил- или NR4R5 вместе может представлять собой пиридинил, пирролидинил, пиперидинил, морфолинил или 2-(1-метил-1H-имидазол-4-ил)-;
R6 представляет собой -NH2 или -NHCOCH3;
R7 представляет собой водород, -C1-6алкил, -C1-6алкиларил или -COC1-6алкил;
X представляет собой NR7, O, S, SO или SO2;
и его соли и сольваты.
2. Соединение формулы (I) по п.1, где R3 представляет собой метил, этил или н-пропил, а R7 представляет собой водород, -C1-6алкил, -C1-6алкиларил или -COCH3.
3. Соединение формулы (I) по п.1 или 2, где R1 и R2 оба не представляют собой водород.
4. Соединение формулы (I) по любому из пп.1-3, где R1 представляет собой C3-8циклоалкил-, арил2CHCH2-, арилC1-6алкил-, C1-8алкил-, арил, -(CH2)fSO2NHg(C1-4алкил)2-g, тетрагидропиран-n-ил или тетрагидротиопиран-n-ил, где n является числом 3 или 4, C3-8циклоалкилC1-6алкил-, водород или R4R5N-C1-6алкил-, где NR4R5 вместе представляет собой пиперидинил или морфолинил.
5. Соединение формулы (I) по любому из пп.1-3, где R1 представляет собой C1-6алкил-CH(CH2OH)-, 1,1-диоксогексагидро-1.l .6-тиопиран-4-ил, N-ацетилпиперидин-4-ил, 1S-гидроксиметил-2-фенилэтил, пиперидин-4-ил и 1-оксогексагидро-1.l .4-тиопиран-4-ил.
6. Соединение формулы (I) по любому из пп.1-3, где R1 представляет собой -CH2CHPh2, -CH(Et)2 или фенилэтил.
7. Соединение формулы (I) по любому из пп.1-6, где R2 представляет собой -C1-6алкил-OH, H2NC(=NH)NHC1-6алкил-, R4R5NC1-6алкил-, где NR4R5 вместе представляет собой пиридинил, пиперидинил, морфолинил или 2-(1-метил-1H-имидазол-4-ил), арилC1-5алкилCH(CH2OH)-, арил, C3-8циклоалкилC1-6алкил-, тетрагидро-1,1-диоксид тиофен-3-ил, C3-8циклоалкил, C1-6алкил-CH(CH2OH)-, арилC1-6алкил-, пирролидин-3-ил, 2-оксопирролидин-4-ил, 2-оксопирролидин-5-ил, пиперидин-3-ил, арилC1-6алкил, C3-8циклоалкил, независимо замещенный одной или более чем одной группой -(CH2)pR6, или пиперидин-4-ил, в котором кольцевой атом азота возможно замещен C1-6алкилом.
8. Соединение формулы (I) по любому из пп.1-6, где R2 представляет собой C1-8алкил или R4R5NC1-6алкил-, где R4 и R5 независимо представляют собой водород или арил, либо R4R5N вместе представляет собой пирролидинил.
9. Соединение формулы (I) по любому из пп.1-6, где R2 представляет собой пиперидин-1-илэтил или 2-(1-метил-1H-имидазол-4-ил)этил.
10. Соединение формулы (I) по любому из пп.1 и 3-9, где R3 представляет собой -CH=NOH, -COOCH3, -COOCH2CH3, -CH2OH, -CH(OH)CH3 или галоген.
11. Соединение формулы (I) по любому из пп.1-9, где R3 представляет собой метил, этил или н-пропил.
12. Соединение формулы (I) по любому из пп.1 и 3-9, где R3 представляет собой этил или -CH2OH.
13. Соединение формулы (I) по любому из пп.1-9, где R3 представляет собой этил.
14. Соединение формулы (I) по любому из пп.1-13, где R4 и R5 независимо представляют собой водород, C1-6алкил, арил, арилC1-6алкил-, либо NR4R5 вместе может представлять собой пирролидинил, пиперидинил или морфолинил.
15. Соединение формулы (I) по любому из пп.1-13, где R4 и R5 независимо представляют собой водород, C1-6алкил или арил, либо NR4R5 вместе представляет собой пирролидинил, пиперидинил или морфолинил.
16. Соединение формулы (I), которое представляет собой (2R,3R,4S,5S)-2-[6-(2,2-дифенилэтиламино)-2-(2-пиперидин-1-илэтиламино)-пурин-9-ил]-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол или его соль или сольват.
17. Соединение формулы (I), которое представляет собой (2R,3R,4S,5S)-2-(3-этилизоксазол-5-ил)-5-[6-фенэтиламино-2-(2-пиперидин-1-илэтиламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол или его соль или сольват.
18. Соединение формулы (I), которое представляет собой (2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[6-(1-этилпропиламино)-2-(2-пиперидин-1-илэтиламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол или его соль или сольват.
19. Соединение формулы (I), которое представляет собой (2R,3R,4S,5S)-2-{6-(1-этилпропиламино)-2-[2-(1-метил-1H-имидазол-4-ил)-этиламино]-пурин-9-ил}-5-(3-гидроксиметилизоксазол-5-ил)-тетрагидрофуран-3,4-диол или его соль или сольват.
20. Соединение формулы (I), которое представляет собой
(2R,3R,4S,5S)-2-[6-(2,2-дифенилэтиламино)-2-(2-морфолин-4-илэтиламино)-пурин-9-ил]-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-[6-(2,2-дифенилэтиламино)-2-(2-гидроксиэтиламино)-пурин-9-ил]-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-{6-(1-этилпропиламино)-2-[2-(1-метил-1H-имидазол-4-ил)-этиламино]-пурин-9-ил}-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-{6-(3,3-диметилбутиламино)-2-[2-(1-метил-1H-имидазол-4-ил)-этиламино]-пурин-9-ил}-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[6-(циклопентиламино)-2-(2-пиперидин-1-илэтиламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
N-{2-[9-[5S-(3-этилизоксазол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-6-(тетрагидротиопиран-4-иламино)-9H-пурин-2-иламино]-этил}-гуанидин;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[6-(3-фтор-4-гидроксифениламино)-2-(2-пиперидин-1-илэтиламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
2-[9-[5S-(3-этилизоксазол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-2-(2-пиперидин-1-илэтиламино)-9Н-пурин-6-иламино]-этансульфоновой кислоты метиламид;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[2-(2-пиперидин-1-илэтиламино)-6-(тетрагидротиопиран-4-иламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[2-(2-пиридин-2-илэтиламино)-6-(тетрагидропиран-4-иламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[2-(2-пиперидин-1-илэтиламино)-6-(тетрагидропиран-4-иламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[2-(1S-гидроксиметил-2-фенилэтиламино)-6-(тетрагидропиран-4-иламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-{6-(2,2-дифенилэтиламино)-2-[2-(пиридин-2-иламино)-этиламино]-пурин-9-ил}-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-[6-(2,2-дифенилэтиламино)-2-(1S-гидроксиметил-2-фенилэтиламино)-пурин-9-ил]-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
4-(2-{6-амино-9-[5S-(3-этилизоксазол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-9H-пурин-2-иламино}-этил)-бензолсульфонамид;
(2R,3R,4S,5S)-2-[2-(транс-4-аминоциклогексиламино)-6-(2,2-дифенилэтиламино)-пурин-9-ил]-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-{6-(3-иодбензиламино)-2-[2-(1-метил-1H-имидазол-4-ил)-этиламино]-пурин-9-ил}-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-{6-(2-циклогексилэтиламино)-2-[2-(1-метил-1Н-имидазол-4-ил)-этиламино]-пурин-9-ил}-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-[6-(2-циклогексилэтиламино)-2-(1S-гидроксиметил-2-фенилэтиламино)-пурин-9-ил]-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
N-(2-{6-(2,2-дифенилэтиламино)-9-[5S-(3-этилизоксазол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-9H-пурин-2-иламино}-этил)-гуанидин;
N-(4-{6-(2,2-дифенилэтиламино)-9-[5S-(3-этилизоксазол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-9H-пурин-2-иламино}-циклогексил)-ацетамид;
2-[9-[5S-(3-этилизоксазол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-2-(2-гуанидиноэтиламино)-9H-пурин-6-иламино]-этансульфоновой кислоты метиламид;
N-(2-{6-(1,1-диоксогексагидро-1.l .6-тиопиран-4-иламино)-9-[5S-(3-этилизоксазол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-9H-пурин-2-иламино}-этил)-гуанидин;
2-[9-[5S-(3-этилизоксазол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-2-(1S-гидроксиметил-2-фенилэтиламино)-9H-пурин-6-иламино]-этансульфоновой кислоты метиламид;
1-{4-[9-[5S-(3-этилизоксазол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-2-(1S-гидроксиметил-2-фенилэтиламино)-9H-пурин-6-иламино]-пиперидин-1-ил}-этанон;
1-(4-{2-(транс-4-аминоциклогексиламино)-9-[5S-(3-этилизоксазол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-9H-пурин-6-иламино}-пиперидин-1-ил)-этанон;
(2R,3R,4S,5S)-2-(3-этилизоксазол-5-ил)-5-[2-(2-пиридин-2-илэтиламино)-6-(тетрагидротиопиран-4-иламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-[6-(1,1-диоксогексагидро-1.l .6-тиопиран-4-иламино)-2-(2-пиперидин-1-илэтиламино)-пурин-9-ил]-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-[2-(транс-4-аминоциклогексиламино)-6-(1,1-диоксогексагидро-1.l .6-тиопиран-4-иламино)-пурин-9-ил]-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
N-(2-{6-(1-ацетилпиперидин-4-иламино)-9-[5S-(3-этилизоксазол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-9H-пурин-2-иламино}-этил)-гуанидин;
N-{2-[9-[5S-(3-этилизоксазол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-6-(пиперидин-4-иламино)-9H-пурин-2-иламино]-этил}-гуанидин;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[2-(1S-гидроксиметил-2-фенилэтиламино)-6-(тетрагидротиопиран-4-иламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[2-(1S-гидроксиметил-2-фенилэтиламино)-6-(1-оксо-гексагидро-1.l .4-тиопиран-4-иламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[6-(1-этилпропиламино)-2-(1S-гидроксиметил-2-фенилэтиламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[6-(1-этилпропиламино)-2-(пирролидин-3R-иламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[6-(1-этилпропиламино)-2-(2-пиридин-2-илэтиламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[6-(1-этилпропиламино)-2-(2-морфолин-4-илэтиламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-[2-(транс-4-аминоциклогексиламино)-6-(1-этилпропиламино)-пурин-9-ил]-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
N-{2-[9-[5S-(3-этилизоксазол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-6-(1-этилпропиламино)-9H-пурин-2-иламино]-этил)-гуанидин;
(2R,3R,4S,5S)-2-[6-(3,3-диметилбутиламино)-2-(2-пиперидин-1-илэтиламино)-пурин-9-ил]-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-[6-(3,3-диметилбутиламино)-2-(2-морфолин-4-илэтиламино)-пурин-9-ил]-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-{6-бензиламино-2-[2-(1-метил-1H-имидазол-4-ил)-этиламино]-пурин-9-ил}-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-[6-бензиламино-2-(2-пиперидин-1-илэтиламино)-пурин-9-ил]-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[6-(1S-гидроксиметил-2-фенилэтиламино)-2-(2-пиперидин-1-илэтиламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-[2-(циклопентиламино)-6-(1-этилпропиламино)-пурин-9-ил]-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-[2-(3,4-диметоксифенилэтиламино)-6-(1-этилпропиламино)-пурин-9-ил]-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-[2-(4-тетрагидропираниламино)-6-(1-этилпропиламино)-пурин-9-ил]-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-[2-(1-бензилпирролидин-3S-1-иламино)-6-(1-этилпропиламино)-пурин-9-ил]-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
5-(5R-{6-(1-этилпропиламино)-2-[2-(1-метил-1H-имидазол-4-ил)-этиламино]-пурин-9-ил}-3S,4R-дигидрокситетрагидрофуран-2S-ил)-изоксазол-3-карбальдегидоксим;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[6-(1S-гидроксиметил-2-фенилэтиламино)-2-(2-морфолин-4-илэтиламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[6-бензиламино-2-(2-пиридин-2-илэтиламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-{6-(1-этилпропиламино)-2-[2-(пиридин-2-иламино)-этиламино]-пурин-9-ил}-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-[6-(1-этилпропиламино)-2-(2-пиперидин-1-илэтиламино)-пурин-9-ил]-5-[3-(1-гидроксиэтил)-изоксазол-5-ил]-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-[6-(1-этилпропиламино)-2-(2-пиперидин-1-илэтиламино)-пурин-9-ил]-5-(3-метилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-[6-(1-этилпропиламино)-2-(2-пиперидин-1-илэтиламино)-пурин-9-ил]-5-(3-пропилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-[6-(1-этилпропиламино)-2-(2-пиперидин-1-илэтиламино)-пурин-9-ил]-5-(3-гидроксиметилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-{6-(1-этилпропиламино)-2-[2-(1-метил-1H-имидазол-4-ил)-этиламино]-пурин-9-ил}-5-[3-(1-гидроксиэтил)-изоксазол-5-ил]-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-{6-(1-этилпропиламино)-2-[2-(1-метил-1H-имидазол-4-ил)-этиламино]-пурин-9-ил}-5-(3-метил-изоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-{6-(1-этилпропиламино)-2-[2-(1-метил-1H-имидазол-4-ил)-этиламино]-пурин-9-ил}-5-(3-пропилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-{6-(1S-гидроксиметил-2-фенилэтиламино)-2-[2-(пиридин-2-иламино)-этиламино]-пурин-9-ил}-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[6-(1S-гидроксиметил-2-фенилэтиламино)-2-(2-пирролидин-1-илэтиламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-[2-(2-аминоэтиламино)-6-(1S-гидроксиметил-2-фенилэтиламино)-пурин-9-ил]-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[6-(3-иодбензиламино)-2-(2-пиперидин-1-илэтиламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
(2R,3R,4S,5S)-2-[2-этиламино-6-(3-иодбензиламино)-пурин-9-ил]-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-бромизоксазол-5-ил)-5-[6-(1-этилпропиламино)-2-(2-пиперидин-1-илэтиламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
5-(5R-{6-(1-этилпропиламино)-2-[2-(1-метил-1H-имидазол-4-ил)-этиламино]-пурин-9-ил}-3S,4R-дигидрокситетрагидрофуран-2S-ил)-изоксазол-3-карбоновой кислоты этиловый эфир;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[6-(1S-гидроксиметил-2-метилпропиламино)-2-(2-пирролидин-1-илэтиламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-[6-(1S-гидроксиметил-2-метилпропиламино)-2-(2-пиперидин-1-илэтиламино)-пурин-9-ил]-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-{6-(1S-гидроксиметил-2-метилпропиламино)-2-[2-(пиридин-2-иламино)-этиламино]-пурин-9-ил}-тетрагидрофуран-3,4-диол;
(2S,3S,4R,5R)-2-(3-этилизоксазол-5-ил)-5-{6-(1S-гидроксиметил-2-метилпропиламино)-2-(1S-гидроксиметил-2-фенилэтиламино)-пурин-9-ил}-тетрагидро-фуран-3,4-диол;
либо соль или сольват любого из них.
21. Фармацевтическая композиция, содержащая соединение формулы (I), как оно определено в любом из пп.1-20, или его фармацевтически приемлемую соль или сольват в смеси с одним или более чем одним физиологически приемлемым разбавителем или носителем.
22. Соединение формулы (I), как оно определено в любом из пп.1-20, или его фармацевтически приемлемая соль или сольват для применения в качестве фармацевтического средства.
23. Применение соединения формулы (I), как оно определено в любом из пп.1-20, или его фармацевтически приемлемой соли или сольвата в производстве лекарства для лечения воспалительных заболеваний, например астмы или хронического обструктивного легочного заболевания (ХОЛЗ).
24. Способ лечения или профилактики воспалительных заболеваний, например астмы или хронического обструктивного легочного заболевания (ХОЛЗ), при котором пациенту вводят эффективное количество соединения формулы (I), как оно определено в любом из пп.1-20, или его фармацевтически приемлемой соли или сольвата.
25. Способ получения соединения формулы (I), как оно определено в любом из пп.1-20, при котором подвергают взаимодействию соответствующее соединение формулы (II)

где R1 является таким, как определено в любом из пп.1, 3-6 и 16-20, R3 является таким, как определено в любом из пп.1, 2, 10-13 и 16-20, a L представляет собой уходящую группу, или его защищенное производное с соединением формулы R2NH2 или его защищенным производным, где R2 является таким, как определено в любом из пп.1, 3, 7-9 и 16-20, с последующим удалением любой из защитных групп, и, если желательно или необходимо, превращают соединение формулы (I) или его соль в другую его соль.
26. Способ получения соединения формулы (I), как оно определено в любом из пп.1-20, при котором подвергают взаимодействию соответствующее соединение формулы (III)
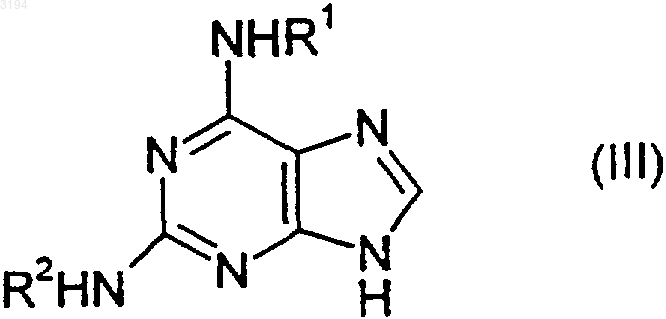
где R1 является таким, как определено в любом из пп.1, 3-6 и 16-20, а R2 является таким, как определено в любом из пп.1, 3, 7-9 и 16-20, с соединением формулы (IV)
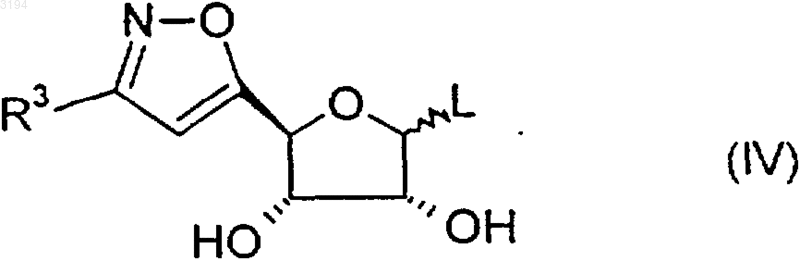
где R3 является таким, как определено в любом из пп.1, 2, 10-13 и 16-20, a L представляет собой уходящую группу, или его защищенным производным, с последующим удалением любой из защитных групп, и, если желательно или необходимо, превращают соединение формулы (I) или его соль в другую его соль.
27. Способ получения соединений формулы (I), как оно определено в любом из пп.1-20, при котором подвергают взаимодействию соответствующее соединение формулы (IIа)
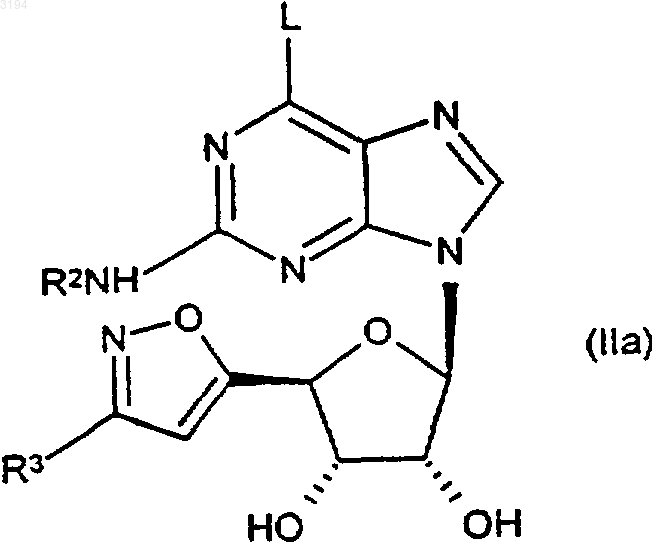
где R2 является таким, как определено в любом из пп.1, 3, 7-9 и 16-20, R3 является таким, как определено в любом из пп.1, 2, 10-13 и 16-20, а L представляет собой уходящую группу, или его защищенное производное с соединением формулы R1NH2 или его защищенным производным, где R1 является таким, как определено в любом из пп.1, 3-6 и 16-20.
28. Соединение формулы (II)
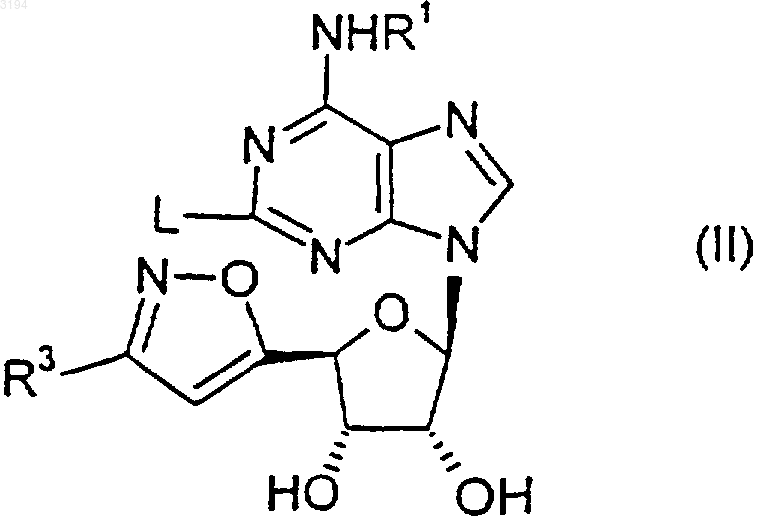
где R1 является таким, как определено в любом из пп.1, 3-6 и 16-20, R3 является таким, как определено в любом из пп.1, 2, 10-13 и 16-20, a L представляет собой уходящую группу, или его защищенное производное.
29. Соединение формулы (IIа)
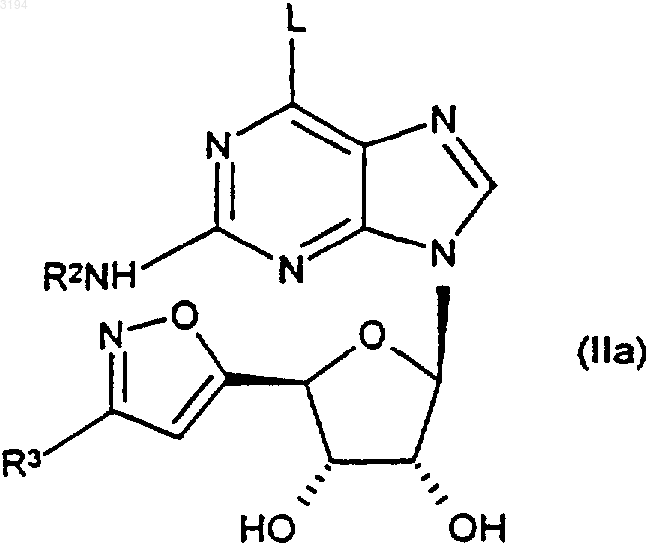
где R2 является таким, как определено в любом из пп.1, 3, 7-9 и 16-20, R3 является таким, как определено в любом из пп.1, 2, 10-13 и 16-20, а L представляет собой уходящую группу, или его защищенное производное.
30. Соединение формулы (IV)
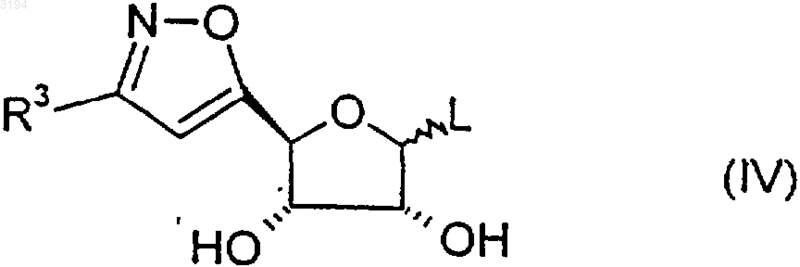
где R3 является таким, как определено в любом из пп.1, 2, 10-13 и 16-20, a L представляет собой уходящую группу, или его защищенное производное.
31. Соединение формулы (V)
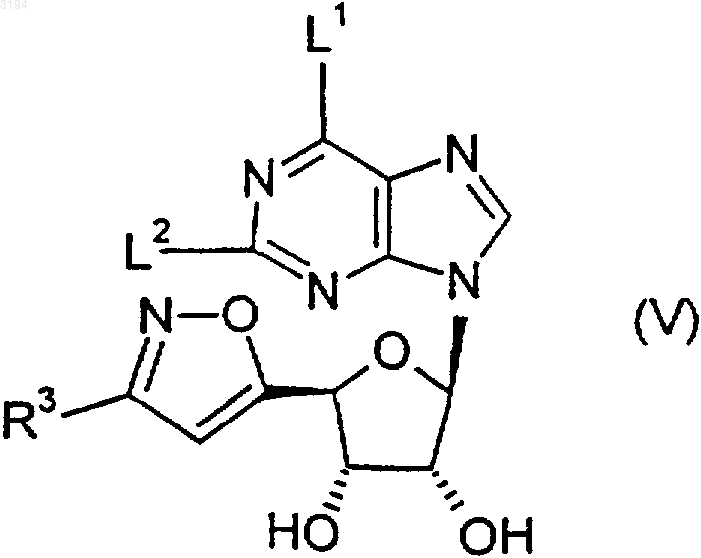
где R3 является таким, как определено в любом из пп.1, 2, 10-13 и 16-20, а L1 и L2 независимо представляют собой уходящую группу, или его защищенное производное.
32. Соединение формулы (VIII)1
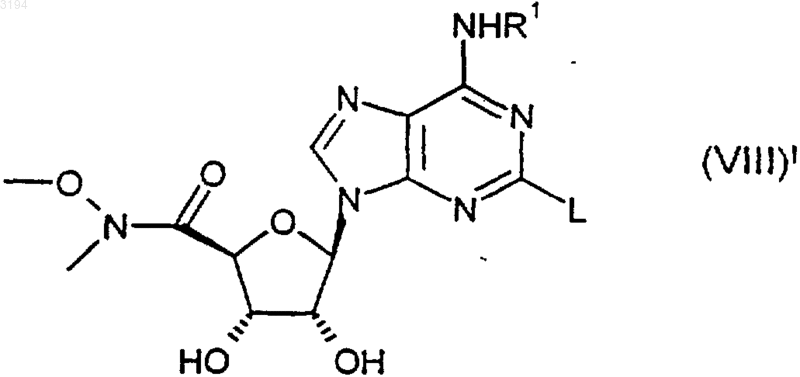
где R1 является таким, как определено в любом из пп.1, 3-6 и 16-20, a L представляет собой уходящую группу, или его защищенное производное.
33. Соединение формулы (IX)1
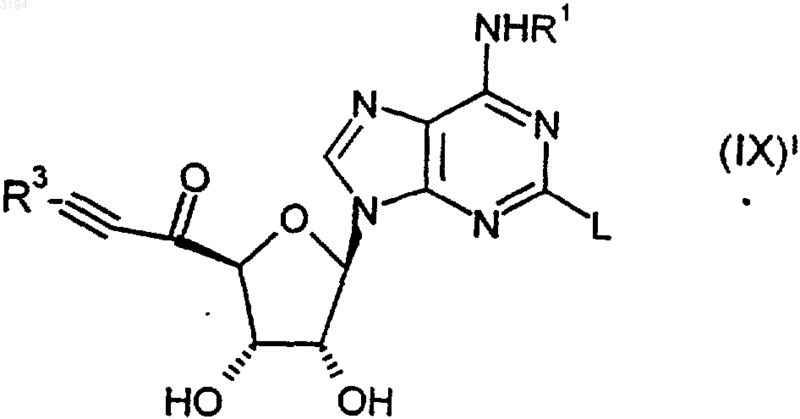
где R1 является таким, как определено в любом из пп.1, 3-6 и 16-20, R3 является таким, как определено в любом из пп.1, 2, 10-13 и 16-20, а L представляет собой уходящую группу, или его защищенное производное.
34. Соединение формулы (X)1
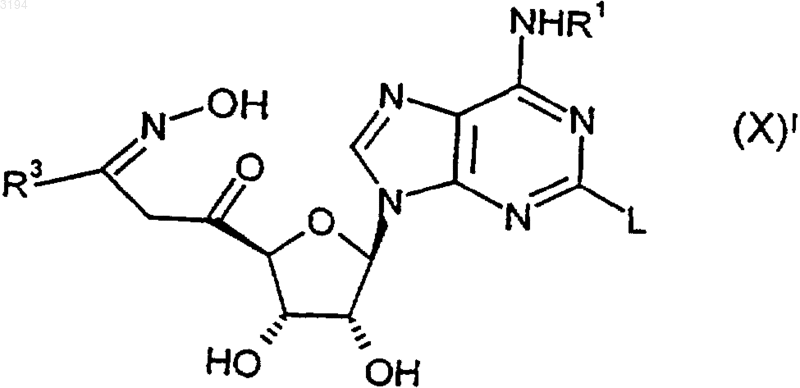
где R1 является таким, как определено в любом из пп.1, 3-6 и 16-20, R3 является таким, как определено в любом из пп.1, 2, 10-13 и 16-20, a L представляет собой уходящую группу, или его защищенное производное.
Текст
1 Данное изобретение относится к новым химическим соединениям, способам их получения, содержащим их фармацевтическим препаратам и к их применению в терапии. Воспаление представляет собой первичную реакцию на повреждение ткани или микробную инвазию и характеризуется адгезией лейкоцитов к эндотелию, диапедезом и активацией внутри ткани. Активация лейкоцитов может приводить к образованию токсичных форм кислорода (таких как анион пероксид) и к высвобождению продуктов гранул (таких как пероксидазы и протеазы). Циркулирующие лейкоциты включают в себя нейтрофилы, эозинофилы, базофилы, моноциты и лимфоциты. В разные формы воспаления вовлечены разные типы инфильтрирующих лейкоцитов, причем конкретный профиль регулируется профилем адгезионной молекулы, цитокина и экспрессии хемотаксического фактора внутри ткани. Первичная функция лейкоцитов состоит в защите хозяина от инвазивных организмов, таких как бактерии и паразиты. Как только ткань повреждается или инфицируется, происходит серия событий, которая вызывает рекрутмент лейкоцитов из кровообращения в пораженную ткань. Регуляция рекрутмента лейкоцитов дает возможность упорядоченного разрушения и фагоцитоза инородных или мертвых клеток с последующей репарацией ткани и рассасыванием воспалительного инфильтрата. Однако при хронических воспалительных состояниях рекрутмент часто является несоответствующим, рассасывание адекватно не регулируется, и воспалительная реакция вызывает разрушение ткани. Имеются данные исследований как in vitro так и in vivo, позволяющие предполагать, что соединения, активные по отношению к рецептору А 2 а аденозина, будут обладать противовоспалительным действием. Обзор в данной области был сделан Cronstein (1994). Исследования на изолированных нейтрофилах показывают опосредованное рецептором А 2 ингибирование образования пероксида, дегрануляции, агрегации и адгезии (Cronstein et al, 1983 и 1985; Burkey andWebster, 1993; Richter, 1992; Skubitz et al, 1988). При использовании агентов, более избирательных в отношении рецептора А 2 а, чем в отношении рецептора А 2b (например CGS21680), профиль ингибирования согласуется с действием на рецепторы А 2 а подтипа (Dianzani, 1994). Агонисты аденозина могут также регулировать по нисходящей другие классы лейкоцитов (Elliotand Leonard, 1989; Peachell et al., 1989). Исследования на целостных животных показали, что противовоспалительные эффекты метотрексата опосредованы через аденозин и активацию рецептора А 2 (Asako et al, 1993; Cronstein et al,1993 и 1994). Сам аденозин или соединения,которые повышают уровни циркулирующего аденозина, проявляют также противовоспалительные эффекты in vivo (Green et al, 1991; Ro 003194sengren et al, 1995). Кроме того, повышенные уровни циркулирующего аденозина у человека(Hirschom, 1993). Некоторые замещенные производные 4'карбоксамидо- и 4'-тиоамидоаденозина, которые полезны для лечения воспалительных заболеваний, описаны в международных патентных заявках WO 94/17090, WO 96/02553, WO 96/02543(Glaxo Group). Замещенные производные 4'карбоксамидоаденозина, полезные при лечении деменции, описаны в AU 8771946 (Hoechst Japan). Замещенные производные 4'-гидроксиметиладенозина, которые полезны для лечения расстройств желудочно-кишечной перистальтики, описаны в ЕР-А-423776 и в ЕР-А-423777(Searle). Замещенные производные 4'-гидроксиметиладенозина, которые полезны в качестве ингибиторов агрегации тромбоцитов, описаны в ВЕ-768925 (Takeda). Производные 4'-гидроксиметиладенозина и их 4'-эфиры, которые полезны в качестве гипотензивных агентов или обладают другой сердечно-сосудистой активностью, описаны в US 4663313, ЕР 139358 и US 4767747 (Warner Lambert), US 4985409 (NipponZoki) и US 5043325 (Whitby Research). Производные 4'-гидроксиметиладенозина, полезные при лечении аутоиммунных расстройств, описаны в US 5106837 (Scripps Research Institute). Производные 4'-гидроксиметиладенозина, полезные в качестве противоаллергических агентов, описаны в US 4704381 (Boehringer Mannheim). Некоторые производные 4'-тетразолилалкиладенозина, которые полезны при лечении сердечных расстройств и расстройств кровообращения, в общем описаны в DT-A-2621470(Pharma-Waldhof). Другие производные 4'карбоксамидоаденозина, полезные при лечении сердечно-сосудистых состояний, описаны в US 5219840, GB 2203149 и GB 2199036 (Sandoz),WO 94/02497 (US Dept. Health), US 4968697 и ЕР 277917 (Clba Geigy), US 5424297 (Univ. Virginia) и ЕР 232813 (Warner Lambert). Другие производные 4'-карбоксамидоаденозина без замещения на пуриновом кольце в положении 2, описаны в DT 2317770, DT 2213180, US 4167565, US 3864483 и US 3966917UPSA). Производные 4'-гидроксиметиладенозина без замещения на пуриновом кольце в положении 2, описаны в WO 95/11904 (Univ. Florida). 4'-Замещенные производные аденозина,полезные в качестве ингибиторов аденозинкиназы, описаны в WO 94/18215 (Gensia). 3 Другие производные 4'-галометил-, метил-,тиоалкилметил- или алкоксиметиладенозина описаны в ЕР 161128 и ЕР 181129 (Warner Lambert) и US 3983104 (Schering). Другие производные 4'-карбоксамидоаденозина описаны в US 7577528 (NIH), WO 91/13082 (Whitby Research) и WO 95/02604 (US Dept. Health). Некоторые тетразолсодержащие дезоксинуклеотиды, которые, как было обнаружено, не обладают противоинфекционной активностью,описаны в Baker et al., (1974) Tetrahedron 30,2939-2942. Другие тетразолсодержащие производные аденозина, которые проявляют активность как ингибиторы агрегации тромбоцитов,описаны в Mester and Mester (1972) PathologieBiologie, 20 (Suppl) 11-14. Некоторые нитрилсодержащие производные рибозы описаны в Schmidt et al., (1974) Liebigs. Ann. Chem., 1856-1863. Описания, опубликованные после самой ранней приоритетной даты данной заявки,включают в себя: WO 98/28319 (Glaxo GroupNordisk A/S), в которой описаны производные аденозина для лечения миокардиальной и церебральной ишемии и эпилепсии; WO 98/01426(Rhone-Poulenc Rorer Pharmaceuticals Inc.), которая относится к производным аденозина, обладающим гипотензивным, кардиопротекторным,антиишемическим и антилиполитическим свойствами; и WO 98/01459 (Novo Nordisk A/S), в которой описаны N,9-дизамещенные производные аденина, которые замещены в положении 4' незамещенным оксазолилом или изоксазолилом,и применение таких соединений для лечения расстройств, в которые вовлечены цитокины, у людей. Теперь авторы изобретения обнаружили новую группу соединений с широким кругом противовоспалительных свойств, которые ингибируют рекрутмент и активацию лейкоцитов и которые являются агонистами рецептора 2 а аденозина. Эти соединения, следовательно, имеют потенциальную терапевтическую пользу в обеспечении защиты от индуцированного лейкоцитами повреждения ткани при заболеваниях, при которых лейкоциты вовлечены в место воспаления. Эти соединения по изобретению при лечении воспалительных заболеваний могут представлять собой также более безопасную альтернативу кортикостероидам, применение которых может быть ограничено профилями их побочных эффектов. Более конкретно, соединения по данному изобретению могут демонстрировать улучшенный профиль по сравнению с известными А 2 аизбирательными агонистами в том, что у них,как правило, отсутствует агонистическая активность по человеческому рецептору A3. Они могут даже обладать антагонистической активно 003194 4 стью к человеческому рецептору A3. Данный профиль можно считать преимуществом, поскольку рецепторы A3 также обнаружены на лейкоцитах (например эозинофилах) и других воспалительных клетках (например тучных клетках), и активация этих рецепторов может иметь про-воспалительные эффекты (Kohno etal, 1996; Van Schaick et al, 1996). Считается даже, что бронхоконстрикторные эффекты аденозина у астматиков могут быть опосредованы через рецептор A3 аденозина (Kohno et al, 1996). Таким образом, согласно изобретению авторы предлагают соединения формулы (I) где R1 и R2 независимо представляют собой группу, выбранную из(10) С 3-8 циклоалкил, независимо замещенный одной или более чем одной (например 1, 2 или 3) группой -(CH2)pR6; или такая группа, в которой один атом углерода метилена, соседний с X, или оба, если таковые существуют, замещены метилом;Z представляет собой -СОО(СН 2)lН; а и b независимо представляют собой целое число от 0 до 4 при условии, что а+b находится в пределах от 3 до 5;f представляет собой 2 или 3, a g представляет собой целое число от 0 до 2; р представляет собой 0 или 1;q представляет собой целое число от 0 до 3;h представляет собой целое число от 0 до 2;i представляет собой такое целое число от 0 до 2, что h+i находится в пределах от 0 до 3;j представляет собой такое целое число от 0 до 2, что h+i+j находится в пределах от 0 до 3;l представляет собой такое число 1 или 2,что k+l находится в пределах от 1 до 2;u и v независимо представляют собой такое число 0 или 1, что k+u+v находится в пределах от 0 до 1;R4 и R5 независимо представляют собой водород, C1-6 алкил, арил, арилС 1-6 алкил-, илиNR4R5 вместе может представлять собой пиридинил,пирролидинил, пиперидинил, морфолинил или 2-(1-метил-1 Н-имидазол-4-ил)-;SO2; и его соли и сольваты. Ссылки на C1-6 алкил включают в себя ссылки на алифатическую углеводородную группировку, содержащую от 1 до 6 атомов углерода, которая может быть нормальной или разветвленной и может быть насыщенной или ненасыщенной. Ссылки на С 1-4 алкил, С 1-5 алкил и С 1-8 алкил можно интерпретировать подобным образом. Ссылки на алкокси также можно интерпретировать подобным образом. Предпочтительно эти группы должны быть насыщенными. Ссылки на арил включают в себя ссылки на моно- и бициклические карбоциклические ароматические кольца (например фенил, нафтил) и гетероциклические ароматические кольца, содержащие 1-3 гетероатома, выбранные изN, О и S (например пиридинил, пиримидинил,тиофенил, имидазолил, хинолинил, фуранил,пирролил, оксазолил), причем все они могут быть возможно замещенными, например С 1-6 алкилом, галогеном, гидрокси, нитро, C1-6 алкокси, циано, амино, SO2NH2 или -СН 2 ОН. Примеры С 3-8 циклоалкила для R1 и R2 включают в себя моноциклические алкильные группы (например циклопентил, циклогексил) и бициклические алкильные группы (например норборнил, такой как экзонорборн-2-ил). Примеры (арил)2 СНСН 2- для R1 и R2 включают в себя Ph2CHCH2- или такую группу, в которой одна или более чем одна из фенильных группировок замещена, например, галогеном или С 1-4 алкилом. Примеры С 3-8 циклоалкилС 1-6 алкила- для R1 2 и R включают в себя этилциклогексил. Примеры С 1-8 алкила для R1 и R2 включают в себя-(СН 2)2 С(Ме)3,-C(Et)2 и СН 2=С(Ме)СН 2 СН 2-. Примеры арилС 1-6 алкила- для R1 и R2 включают в себя группу -(CH2)2Ph, -CH2Ph или любую из них, в которой Ph замещен (один или более чем один раз) галогеном (например фтором, иодом), амино, метокси, гидрокси, -СН 2 ОНR2 включают в себя Ме 2 СНСН(СН 2OН)-. Примеры группы арилС 1-5 алкилСН(СН 2OН)- для R1 и R2 включают в себя РhСН 2 СН(СН 2OН)-, в частности Примеры С 3-8 циклоалкила, независимо замещенного одной или более чем одной группой для R1 и R2 включают в себя пирролидин-3-ил,пиперидин-3-ил, пиперидин-4-ил, тетрагидро 1,1-диоксид тиофен-3-ил, тетрагидропиран-4-ил,тетрагидротиопиран-4-ил,1-оксо-гексагидро 14-тиопиран-4-ил и 1,1-диоксо-гексагидро 16-тиопиран-4-ил, либо производное, в котором кольцевой атом азота замещен C1-6 алкилом(например метилом), C1-6 алкилацилом (например ацетилом), арилС 1-6 алкилом- или бензилом. Примеры групп -C1-6 алкил-ОН для R1 и R2 включают в себя -CH2CH2OH. Примеры арила для R1 и R2 включают в себя фенил, возможно замещенный галогеном (например фтором, в частности 4-фтором). Примером группы -(CH2)fSO2NHg(C1-4 алкил)2-g для R1 и R2 является -(CH2)2SO2NHMe,а примером группы -(СН 2)fSO2NНg(арилС 1-4 алкил)2-g для R1 и R2 является -(CH2)2SO2NHCH2Ph. Примеры C1-6 алкила для R7 включают в себя метил, примеры C1-6 алкиларила для R7 включают в себя бензил, а примеры для СОС 1-6 алкила для R7 включают в себя СОСН 3. Авторы изобретения предпочитают, чтобыR1 и R2 оба не представляли собой водород. Авторы изобретения предпочитают, чтобыR1 представлял собой С 3-8 циклоалкил, арил 2 СНСН 2-, арилС 1-6 алкил-, С 1-8 алкил-, арил,-(СН 2)fSO2NНg(С 1-4 алкил)2-g, тетрагидропиран-nил или тетрагидротиопиран-n-ил, где n является числом 3 или 4, С 3-8 циклоалкилС 1-6 алкил-, водо 7 род или R4R5N-С 1-6 алкил-, где NR4R5 вместе представляет собой пиперидинил или морфолинил. Авторы изобретения также предпочитают,чтобы R1 представлял собой С 1-6 алкил-СН 1,1-диоксогексагидро-16-тиопи(СН 2OН)-,ран-4-ил, N-ацетилпиперидин-4-ил, 1S-гидроксиметил-2-фенилэтил, пиперидин-4-ил и 1-оксогексагидро-14-тиопиран-4-ил. Авторы изобретения предпочитают, чтобы(=NН)NНС 1-6 алкил-, R4R5NС 1-6 алкил-, где NR4R5 вместе представляет собой пиридинил, пиперидинил, морфолинил или 2-(1-метил-1 Н-имидазол-4-ил), арилС 1-5 алкилСН(СН 2OН)-, арил, С 3-8 циклоалкилС 1-6 алкил-, тетрагидро-1,1-диоксид тиофен-3-ил,С 3-8 циклоалкил,C1-6 алкилСН(СН 2OН)-, арилС 1-6 алкил-, пирролидин-3-ил,пиперидин-3-ил, арилС 1-6 алкил (например бензил), С 3-8 циклоалкил, независимо замещенный одной или более чем одной (например 1, 2 или 3) группой -(CH2)pR6, либо пиперидин-4-ил, в котором кольцевой атом азота возможно замещен C1-6 алкилом. Авторы изобретения также предпочитают,чтобы R2 представлял собой С 1-8 алкил илиR4R5NС 1-6 алкил-, где R4 и R5 независимо представляют собой водород или арил, либо R4R5N вместе представляет собой пирролидинил. Когда R3 представляет собой галоген, авторы изобретения предпочитают, чтобы он представлял собой бром или хлор, особенно бром. Авторы изобретения предпочитают, чтобыR3 представлял собой метил, этил или н-пропил. Авторы изобретения также предпочитают,чтобы R3 представлял собой -CH=NOH,-СООСН 3, -СООСН 2 СН 3, -СН 2 ОН, -СН(ОН)СН 3 или галоген. Более предпочтительно R3 представляет собой метил, этил, н-пропил, -СН 2OН,-СН(ОН)СН 3, -CH=NOH или галоген. Авторы изобретения в частности предпочитают, чтобы R3 представлял собой метил,этил, -CH2OH или -СН(ОН)СН 3, особенно метил, этил или -СН 2 ОН, в особенности этил или-СН 2OН, наиболее предпочтительно этил. Авторы изобретения в частности предпочитают, чтобы R4 и R5 независимо представляли собой водород, С 1-6 алкил, арил, арилС 1-6 алкил-,либо NR4R5 вместе мог представлять собой пирролидинил, пиперидинил, морфолинил. Авторы изобретения более конкретно предпочитают, чтобы R4 и R5 независимо представляли собой водород, С 1-6 алкил или арил,либо NR4R5 вместе представлял собой пирролидинил, пиперидинил, морфолинил. Авторы изобретения предпочитают, чтобы р представлял собой 0. Авторы изобретения предпочитают, чтобы R6 представлял собой-СООСН 3. Авторы изобретения предпочитают,чтобы группа -(CH2)hY(CH2)iH представляла собой -(CH2)1-2OH. Авторы изобретения предпочитают, чтобы k представляло собой 0. Авторы изобретения предпочитают, чтобы u и v представляли собой 0. Авторы изобретения предпочитают, чтобы 1 представляло собой 1. Авторы изобретения предпочитают, чтобы а и b оба представляли собой 2. Авторы изобретения предпочитают, чтобы Х представлял собой NR7, О, S или SO2, особенно О или S. Авторы изобретения предпочитают, чтобыR3 представлял собой метил, этил или н-пропил,а R7 представлял собой водород, -С 1-6 алкил, -C1-6 алкиларил или -СОСН 3. Авторы изобретения особенно предпочитают, чтобы R1 представлял собой С 4-7 циклоалкил- (в частности циклопентил), Ph2CHCH2-,РhСН 2 СН 2-, С 4-7 алкил, в частности -(СН 2)2 С(например фтором) (например 3-фтор-4 гидроксифенил), -(CH2)2SO2NHMe, либо тетрагидропиран-n-ил или тетрагидротиопиран-n-ил,где n является числом 4. Авторы изобретения также в частности предпочитают, чтобы R1 представлял собой водород, 1S-гидроксиметил-2-метилпропил, 3 иодфенилметил, циклогексилэтил-, бензил, 1,1 диоксогексагидро-16-тиопиран-4-ил, N-ацетилпиперидин-4-ил, 1S-гидроксиметил-2-фенилэтил, пиперидин-4-ил и 1-оксогексагидро-14 тиопиран-4-ил. Наиболее предпочтительный R1 представляет собой -CH2CHPh2, -CH(Et)2 или фенилэтил. Авторы изобретения особенно предпочитают, чтобы R2 представлял собой -С 2-4 алкилОН, Н 2NС(=NН)NНС 2-4 алкил или R4R5N-C2-4 алкил-, где NR4R5 вместе представляет собой пиридинил, пиперидинил, морфолинил или 2-(1 метил-1 Н-имидазол-4-ил). Авторы изобретения особенно предпочитают, чтобы R2 представлял собой 2-(1-метил 1 Н-имидазол-4-ил)этил, пиридин-2-илэтил, 1Sгидроксиметил-2-фенилэтил, пиридин-2-ил-NН(СН 2)2-, 4-(Н 2NSO2)-фенилэтил, транс-4-аминоциклогексил, транс-4-(СН 3 СОNН)-циклогексил,пирролидин-3-ил, 3,4-диметоксифенилэтил, Nбензил-пирролидин-3-ил-,пирролидин-1 илэтил, аминоэтил или этил. Авторы изобретения особенно предпочитают, чтобы R2 представлял собой пиперидин-1 9 илэтил, морфолин-1-илэтил, -(СН 2)2OН, 2-(1 метил-1 Н-имидазол-4-ил)этил, Н 2NС(=NН)NН этил, пиридин-2-илэтил, 1S-гидроксиметил-2 фенилэтил,пиридин-2-ил-NН(СН 2)2-,4(Н 2NSO2)фенилэтил, транс-4-аминоциклогексил,транс-4-(СН 3 СОNН)-циклогексил, пирролидин 3-ил, 3,4-диметоксифенилэтил, N-бензилпирролидин-3-ил-, пирролидин-1-илэтил, аминоэтил или этил. Наиболее предпочтительный R2 представляет собой пиперидин-1-илэтил или 2-(1-метил 1 Н-имидазол-4-ил)этил. Наиболее предпочтительными соединениями формулы (I) являются (2R,3R,4S,5S)-2-[6(2,2-дифенилэтиламино)-2-(2-пиперидин-1-илэтиламино)пурин-9-ил]-5-(3-этилизоксазол-5 ил)тетрагидрофуран-3,4-диол;(2R,3R,4S,5S)-2-6-(1-этилпропиламино)2-[2-(1-метил-1 Н-имидазол-4-ил)этиламино]пурин-9-ил-5-(3-гидроксиметил-изоксазол-5 ил)тетрагидрофуран-3,4-диол; и их соли и сольваты. На изображении формулы (I) указана абсолютная стереохимическая конфигурация. Когда боковые цепи содержат хиральные центры,изобретение распространяется на смеси энантиомеров (включая рацемические смеси) и диастереоизомеры, а также индивидуальные энантиомеры. Как правило, предпочтительно использовать соединение формулы (I) в форме очищенного единственного энантиомера. Авторы изобретения также предлагают способ получения соединения формулы (I), при котором подвергают взаимодействию соответствующее соединение формулы (II) где L представляет собой уходящую группу,например галоген, в частности хлор, или его защищенное производное, с соединением формулы R2NH2 или его защищенным производным, с последующим удалением любой из за 003194 10 щитных групп, и, если желательно или необходимо, превращают соединение формулы (I) или его соль в другую его соль. Реакцию данного способа, как правило,следует проводить при нагревании реагентов до температуры 50-150 С в присутствии инертного растворителя, такого как ДМСО. Соединение формулы (II), как правило, следует использовать в форме, в которой две гидроксильные группы защищены, например, ацетильными группами. Авторы изобретения также предлагают способ получения соединений формулы (I), при котором подвергают взаимодействию соответствующее соединение формулы (IIа) где L представляет собой уходящую группу,например галоген, в частности хлор, или его защищенное производное, с соединением формулы R1NH2 или его защищенным производным. Эта реакция может быть проведена в условиях, аналогичных условиям, описанным выше для предыдущего способа. Авторы изобретения также предлагают еще один способ получения соединения формулы (I), при котором подвергают взаимодействию соответствующее соединение формулы (III) где L представляет собой уходящую группу, или его защищенным производным, с последующим удалением любой из защитных групп, и, если желательно или необходимо, превращают соединение формулы (I) или его соль в другую его соль. В данном способе авторы изобретения предпочитают использовать соединение формулы (IV), когда 2- и 3-гидроксильные группы рибозы защищены, например ацетилом. Уходящая группа L может представлять собой ОН, но предпочтительно должна представлять собойC1-6 алкокси (например метокси или этокси),эфирную группировку (например ацетилокси или бензоилокси) или галоген. Предпочтительной группой L является ацетилокси. Реакционная смесь может быть образована путем объединения реагентов в инертном растворителе,таком как МеСN, в присутствии кислоты Льюиса (например ТМСТФС) и ДБУ. 11 Примеры защитных групп и способов их удаления можно найти в T.W.Greene ProtectiveSons,1991). Подходящие защитные группы гидроксила включают в себя алкил (например метил), ацеталь (например ацетонид) и ацил (например ацетил или бензоил), которые можно удалить путем гидролиза, и арилалкил (например бензил), который можно удалить путем каталитического гидрогенолиза. Подходящие защитные группы амина включают в себя сульфонил (например тозил), ацил (например бензилоксикарбонил или трeт-бутоксикарбонил) и арилалкил (например бензил), которые можно удалить путем гидролиза или гидрогенолиза,где как подходит. Подходящие соли соединений формулы (I) включают в себя физиологически приемлемые соли, такие как соли присоединения кислот,производные от неорганических или органических кислот, например гидрохлориды, гидробромиды, сульфаты, фосфаты, ацетаты, бензоаты, цитраты, сукцинаты, лактаты, тартраты, фумараты, малеаты, 1-гидроксинатаноат, метансульфонат, и, если это подходит, соли неорганических оснований, такие как соли щелочных металлов, например натриевые соли. Другие соли соединений формулы (I) включают в себя соли, которые не являются физиологически приемлемыми, но могут быть полезны в получении соединений формулы (I) и их физиологически приемлемых солей. Примеры таких солей включают в себя трифторацетаты и формиаты. Примеры подходящих сольватов соединений формулы (I) включают в себя гидраты. Соли присоединения кислот соединений формулы (I) можно получить путем обработки свободного основания формулы (I) соответствующей кислотой. Соединения формулы II можно получить способом, при котором подвергают взаимодействию соединение формулы V где L1 и L2 независимо представляют собой уходящую группу, в частности галоген (например хлор), или его защищенное производное, с соединением формулы R1NH2. Данную реакцию предпочтительно проводить в присутствии основания, такого как аминное основание (например диизопропилэтиламин) в растворителе, таком как ДМФ или спирт(например изопропанол) при повышенной температуре (например 50 С). Соединения формулы V можно получить способом, при котором подвергают взаимодействию соединение формулы (IV) с производным пурина, таким как дигалопурин, в частности 2,6 003194 12 дихлорпурин, в условиях, аналогичных условиям, описанным выше в способе (б). Соединения формулы II также можно получить путем, аналогичным способу (б). Соединения формулы (IV) или их защищенные производные можно получить из соединения формулы (VI) способом, при котором это соединение формулы (VI) обрабатывают трифторуксусной кислотой в воде, а затем уксусным ангидридом в растворителе, таком как пиридин, Et3N, ДХМ или их комбинация. Соединения формулы (IV), в которых L представляет собой галоген, можно получить из соответствующего 5-спирта или 5-эфира, такого как ацетат. Реакция, как правило, будет протекать при обработке безводной НСl или НВr. 5 Иодиды можно получить непосредственно при обработке триметилсилилиодидом, а 5-фториды можно получить при обработке ДАСТ. Инертный растворитель, например диэтиловый эфир,ДХМ, ТГФ или CCl4, как правило, будет подходящим. Соединение формулы (VI) можно получить, следуя схеме 1. Схема 1 Общие условия для стадий 1-5 должны быть известны специалистам в данной области. Понятно также, что реагенты и условия, указанные на схеме 1, представляют собой примерные условия, и специалистам в данной области могут быть известны альтернативные реагенты и альтернативные условия для достижения того же химического превращения, в которое вовлечена модификация защитных групп. Например,на стадии 1 можно использовать альтернативный спирт, например С 1-6 алкиловый спирт, с образованием иной уходящей группы С 1-6 алкокси в соединениях формулы (VI). Некоторые соединения формулы (VI), в которых L представляет собой ОМе, можно также получить, следуя схеме 1 А: Схема 1 А 13 Когда R3 представляет собой -СН 2 ОН,подходящие условия для стадии (б) включают в себя обработку подходящим литиевым реагентом, таким как HBuLi/HC ССН 2 ОТГП, а затем ВF3Et2 О в присутствии инертного растворителя,например ТГФ, при низких температурах(обычно -78 С). Когда R3 представляет собой алкил, в частности этил, превращение может быть осуществлено с использованием реактива Гриньяра, например МgВrСС-СН 2 СН 3 в инертном растворителе, например ТГФ, с последующей обработкой. Соединения формулы (III) можно получить, например, следуя схеме 2: Схема 2 Предпочтительной уходящей группой L является галоген, особенно хлор. Общие условия для стадий 1-4 должны быть известны специалистам в данной области. Понятно также,что реагенты и условия, указанные на схеме 2,представляют собой примерные условия, и специалистам в данной области могут быть известны альтернативные реагенты и альтернативные условия для достижения того же химического превращения, в которое вовлечена модификация(или отсутствие) защитных групп. Условия стадий 1-4 схемы 3 могут быть также подходящими для образования замещенного изоксазолильного кольца соединений формулы (IV), (V) и (VI). Соединения формулы (II) можно также получить способом, при котором подвергают взаимодействию соединение формулы (XI) где L представляет собой уходящую группу,такую как галоген, особенно хлор, или его замещенное производное; с нитрилоксидом, производным от соединения формулы R3 СН 2NО 2. Подходящие условия описаны выше для схемы 1, стадия 5. Авторы изобретения предпочитают использовать соединение формулы (XI) в виде производного,в котором обе гидроксигруппы защищены в виде ацетилового эфира. Соединения формулы (XI) (особенно те, в которых L представляет собой хлор) можно получить из соответствующих дихлорпуриновых производных, которые, в свою очередь, можно получить из соединения, которое является продуктом схемы 1, стадия 4, используя общепринятые способы или способы, описанные здесь. Соединения формулы (II) можно также получить способом, при котором соединение формулы (XI) или его защищенное производное подвергают взаимодействию с соединением формулы (XII) где Hal представляет собой галоген, например хлор или бром. Эта реакция может быть проведена при объединении реагентов в присутствии слабого основания, например NаНСО 3 или триэтиламина, в присутствии системы полярных органических растворителей, такой как этилацетат/вода,или ДМФ. Соединения формулы (II), в которых R3 представляет собой СН(ОН)СН 3, можно получить путем восстановления соответствующего метилкетона (используя традиционные реагенты, такие как NaBH4). Соответствующий метилкетон можно получить из производного соединения формулы (XII), в котором R3 представляет собой СОСН 3. Соединения формулы (IIа) можно получить путем взаимодействия соединения формулы (XIII) с соединением формулы (IV) в условиях, аналогичных условиям, описанным для основного способа (б) выше. Соединения формулы (XIII), в которых L представляет собой хлор, можно получить путем взаимодействия 2-бромксантина с R2NH2, а затем с РОСl3. Производные соединений формулы (XIII), содержащие иную уходящую группу L, можно получить аналогичным способом.R3 СН 2NО 2 либо известны, либо их можно получить традиционными способами, которые известны per se. Соединения формулы (VII) можно получить, следуя способам, описанным в Международной патентной заявке WO 94/17090. Соединения формулы R2 - - МgСl можно получить традиционными способами, известными специалистам в данной области. Например, их можно получить путем взаимодействия метилмагнийхлорида с конечным ацетиленовым соединением при 0-25 С в ТГФ. Соединения формулы (XII) либо известны,либо их можно получить традиционными способами, которые известны per se. Как указано выше, некоторые промежуточные соединения могут быть использованы в защищенной форме, и примеры таких защитных групп и способов удаления защиты описаны в основном способе (г) выше. Способность соединений формулы (I) интбировать функции лейкоцитов можно продемонстрировать, например, по их способности ингибировать генерирование пероксида (O2-) из нейтрофилов, стимулированных хемоаттрактантами, такими как N-формилметионил-лейцилфенилаланин (фМЛФ). Соответственно, соединения формулы (I) обладают потенциальной терапевтической пользой при обеспечении защиты от индуцированного лейкоцитами повреждения ткани при заболеваниях, где лейкоциты вовлечены в место воспаления. Примеры болезненных состояний, при которых соединения по изобретению обладают потенциально полезными противовоспалительными эффектами, включают в себя заболевания дыхательных путей, такие как респираторный дистресс-синдром взрослых (РДСВ), бронхит(включая хронический бронхит), муковисцидоз,астма (в том числе аллерген-индуцированные астматические реакции), эмфизема, ринит и септический шок. Другие релевантные болезненные состояния включают в себя заболевания желудочно-кишечного тракта, такие как кишечные воспалительные заболевания, включая воспалительное заболевание кишечника (например болезнь Крона или язвенный колит), гастрит,вызванный Helicobacter pylori и кишечные воспалительные заболевания, вторичные по отношению к воздействию облучения или воздействию аллергена, а также гастропатию, вызванную нестероидными противовоспалительными лекарственными средствами. Кроме того, соединения по изобретению можно применять для лечения кожных заболеваний, таких как псориаз, аллергический дерматит и аллергические реакции, и заболеваний центральной нервной системы, которые имеют воспалительный компонент, например болезни Альцгеймера и рассеянного склероза. 16 Дополнительные примеры болезненных состояний, при которых соединения по изобретению обладают потенциально полезными эффектами, включают в себя сердечные состояния,такие как заболевание периферических сосудов,постишемическое реперфузионное повреждение и идиопатический гиперэозинофилический синдром. Соединения по изобретению, которые ингибируют функцию лейкоцитов, могут быть полезны в качестве иммуносупрессивных агентов и, следовательно, могут иметь применение при лечении аутоиммунных заболеваний, таких как ревматоидный артрит и диабет. Соединения по изобретению могут быть полезны в ингибировании метастаза и могут способствовать заживлению раны. Специалистам в данной области должно быть понятно, что здесь ссылка на лечение распространяется как на профилактику, так и на лечение установленных состояний. Как упомянуто выше, соединения формулы (I) полезны в медицине или ветеринарии, в частности в качестве противовоспалительных агентов. Таким образом, в следующем аспекте изобретения предложено соединение формулы (I) или его физиологически приемлемая соль или сольват для применения в медицине или ветеринарии, в частности при лечении пациентов с воспалительными состояниями, которые подвержены индуцированному лейкоцитами повреждению ткани. Согласно другому аспекту изобретения предложено применение соединения формулы(I) или его физиологически приемлемой соли или сольвата для производства лекарства для лечения пациентов с воспалительными состояниями, которые подвержены индуцированному лейкоцитами повреждению ткани. В следующем или альтернативном аспекте предложен способ лечения субъекта человека или животного с воспалительным состоянием,который подвержен индуцированному лейкоцитами повреждению ткани, при котором указанному субъекту человека или животного вводят эффективное количество соединения формулы(I) или его физиологически приемлемой соли или сольвата. Соединения по изобретению могут быть приготовлены в виде препаратов для введения любым удобным путем, и поэтому в объем изобретения входят фармацевтические композиции для применения в противовоспалительной терапии, содержащие соединение формулы (I) или его физиологически приемлемую соль или сольват, при желании вместе с одним или более чем одним физиологически приемлемым носителем или эксципиентом. Предложен также способ получения такого фармацевтического препарата, при котором смешивают данные ингредиенты. 17 Соединения по изобретению могут быть приготовлены, например, в виде препарата для перорального, трансбуккального, парентерального, местного или ректального введения, предпочтительно для парентерального или местного(например посредством аэрозоля) введения. Наиболее предпочтительным является путь местного введения в легкое (например посредством аэрозоля или сухой порошкообразной композиции). Таблетки и капсулы для перорального введения могут содержать традиционные эксципиенты, такие как связывающие агенты, например сироп, аравийская камедь, желатин, сорбит, трагакант, растительный клей из крахмала, целлюлоза или поливинилпирролидон; наполнители,например лактоза, микрокристаллическая целлюлоза, сахар, кукурузный крахмал, фосфат кальция или сорбит; смазывающие агенты, например стеарат магния, стеариновая кислота,тальк, полиэтиленгликоль или силикагель; разрыхлители, например картофельный крахмал,кроскармеллозанатрий или крахмальный гликолят натрия; или увлажняющие агенты, такие как лаурилсульфат натрия. Таблетки могут быть покрыты оболочкой согласно способам, хорошо известным в данной области. Пероральные жидкие препараты могут быть в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или могут быть представлены в виде сухого продукта для разведения водой или другим подходящим носителем перед употреблением. Такие жидкие препараты могут содержать традиционные добавки, такие как суспендирующие агенты, например сироп сорбита, метилцеллюлозу, сироп глюкоза/сахар, желатин, гидроксиметилцеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия или гидрогенированные пищевые жиры; эмульгирующие агенты, например лецитин, сорбитана моноолеат или аравийскую камедь; неводные носители (которые могут включать в себя пищевые масла), например миндальное масло, фракционированное кокосовое масло, эфирные масла, пропиленгликоль или этиловый спирт; или консерванты, например метилили пропил-п-гидроксибензоаты или сорбиновую кислоту. Эти препараты могут также содержать буферные соли, корригенты, красящие и/или подслащивающие агенты (например маннит), где как подходит. Для трансбуккального введения эти композиции могут принимать форму таблеток или лепешек, приготовленных традиционным способом. Соединения могут быть приготовлены также в виде суппозиториев, например содержащих традиционные суппозиторные основы,такие как масло какао или другие глицериды. Соединения по изобретению могут быть приготовлены также в виде препаратов для парентерального введения посредством болюсной 18 инъекции или непрерывной инфузии, и они могут быть представлены в стандартной лекарственной форме, например в виде ампул, флаконов, инфузий малого объема или предварительно наполненных шприцов, либо в мультидозовых контейнерах с добавленным консервантом. Композиции могут принимать такие формы, как растворы, суспензии или эмульсии в водных или неводных носителях, а также могут содержать агенты для включения в препараты, такие как антиоксиданты, буферы, противомикробные агенты и/или агенты, регулирующие тонус. Альтернативно, активный ингредиент может быть в форме порошка для разведения подходящим носителем, например стерильной, апирогенной водой, перед использованием. Сухой твердый препарат можно приготовить путем заполнения индивидуальных стерильных контейнеров стерильным порошком в асептических условиях, либо путем заполнения стерильным раствором каждого контейнера в асептических условиях и лиофилизации. В термин местное введение, используемый здесь, авторы изобретения включают введение путем инсуффляции или ингаляции. Примеры различных типов препарата для местного введения включают в себя мази, кремы, лосьоны, порошки, пессарии, спреи, аэрозоли, капсулы или картриджи для использования в ингаляторе или инсуффляторе, растворы для распыления или капли (например глазные капли или капли в нос). Мази и кремы могут, например, быть приготовлены с использованием водной или масляной основы с добавлением подходящих загустителей и/или гелеобразующих агентов и/или растворителей. Такие основы, таким образом, могут включать в себя воду и/или масло, такое как жидкий парафин или растительное масло, такое как арахисовое масло или касторовое масло,либо растворитель, такой как полиэтиленгликоль. Загустители, которые можно использовать, включают в себя мягкий парафин, стеарат алюминия, цетостеариловый спирт, полиэтиленгликоли, микрокристаллический воск и пчелиный воск. Лосьоны могут быть приготовлены на водной или масляной основе, и, как правило, они будут также содержать один или более чем один эмульгирующий агент, стабилизирующий агент,диспергирующий агент, суспендирующий агент или загуститель. Порошки для наружного применения можно изготовлены с использованием любой подходящей порошковой основы, например талька,лактозы или крахмала. Капли могут быть приготовлены на водной или неводной основе, содержащей также один или более чем один диспергирующий агент, солюбилизирующий агент или суспендирующий агент. Композиции спрея могут быть приготовлены, например, в виде водных растворов или 19 суспензий, либо в виде аэрозолей, подаваемых из упаковок под давлением, с использованием подходящего пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана,1,1,1,2,3,3,3-гептафторпропана,1,1,1,2-тетрафторэтана, диоксида углерода или другого подходящего газа. Интраназальные спреи могут быть приготовлены с использованием водных или неводных носителей с добавлением агентов, таких как загустители, буферные соли, либо кислота или щелочь для регулирования рН, агенты, регулирующие изотоничность, или антиоксиданты. Капсулы или картриджи, например из желатина, или блистеры, например из ламинированной алюминиевой фольги для использования в ингаляторе или инсуффляторе могут быть приготовлены в виде препаратов, содержащих порошкообразную смесь соединения по изобретению и подходящей порошковой основы, такой как лактоза или крахмал. Растворы для ингаляции с помощью распылителя могут быть приготовлены с использованием водного носителя с добавлением агентов, таких как кислота или щелочь, буферные соли, агенты, регулирующие изотоничность,или противомикробные агенты. Они могут быть стерилизованы фильтрацией или нагреванием в автоклаве, либо представлены в виде нестерильного продукта. Фармацевтические композиции по изобретению можно также применять в сочетании с другими терапевтическими агентами, например с противовоспалительными агентами (такими как кортикостероиды (например флутиказона пропионат, беклометазона дипропионат, мометазона фуроат, триамцинолона ацетонид или будесонид) или НСПВЛС (например натрия хромогликат или с бета-адренергическими агентами (такими как сальметерол, сальбутамол,формотерол, фенотерол или тербуталин и их соли), либо с противоинфекционными агентами(например антибиотиками, противовирусными средствами). Таким образом, в следующем аспекте изобретения предложена комбинация, содержащая соединение формулы (I) или его физиологически приемлемую соль или сольват вместе с другим терапевтически активным агентом, например противовоспалительным агентом, таким как кортикостероид или НСПВЛС. Комбинация, на которую ссылаются выше,может быть удобно представлена для использования в форме фармацевтического препарата, и,таким образом, фармацевтические препараты,содержащие комбинацию, как она определена выше, вместе с ее фармацевтически приемлемым носителем, представляют собой следующий аспект изобретения. Индивидуальные компоненты таких комбинаций можно вводить либо последовательно,либо одновременно по отдельности или в ком 003194 20 бинированных фармацевтических препаратах. Подходящие дозы известных терапевтических агентов легко будут определены специалистами в данной области. Соединения по изобретению можно удобно вводить в количествах например от 0,01 до 500 мг/кг массы тела, предпочтительно от 0,01 до 100 мг/кг массы тела, от 1 до 4 раз в сутки. Точная доза будет, конечно, зависеть от возраста и состояния пациента и от конкретного выбранного пути введения. Некоторые промежуточные соединения,описанные здесь, являются новыми, и они также предложены в качестве аспекта изобретения. Соединения по изобретению имеют преимущество в том, что они могут быть более эффективными, проявлять более высокую избирательность, обладать меньшими побочными эффектами, иметь более длительную продолжительность действия, быть более биодоступными при предпочтительном пути введения, проявлять меньшую системную активность при введении посредством ингаляции или обладать другими более желательными свойствами по сравнению с подобными известными соединениями. В частности, соединения по изобретению имеют преимущество в том, что они могут проявлять более высокую избирательность к подтипу 2 а рецептора аденозина, чем к другим подтипам рецептора аденозина (особенно А 1 и A3 подтипам рецептора), чем известные до настоящего времени соединения. Соединения по изобретению могут быть испытаны на биологическую активность in vitro и in vivo в соответствии со следующими методами скрининга:(1) Агонистическая активность по отношению к подтипам рецепторов аденозина 2 а, 1 и 3. Агонистическую избирательность соединений по сравнению с другими человеческими рецепторами аденозина определяют, используя клетки яичника китайского хомячка (СНО),трансфецированные геном соответствующего человеческого рецептора аденозина, следуя способу на основе способа Castanton и Spevak,1994. Клетки СНО также трансфецируют геном секретируемой плацентарной щелочной фосфатазы (СПЩФ) под промотором элементов циклоАМФ ответа (Wood, 1995). Эффект тестируемых соединений можно определить по их воздействиям на базальные уровни цАМФ (А 2 а) или на усиленную форсколином цАМФ (А 1 иA3), что отражается на изменениях в уровнях СПЩФ. Значения ЕС 50 для соединений можно затем определить как отношение к значениямEC50 не избирательного агониста N-этилкарбоксамидаденозина (NЭKA). 21 Морским свинкам, сенсибилизированным овальбумином, вводят дозу мепирамина (1 мг/кг в.б.) для защиты от анафилактического бронхоспазма. Затем дают соединение по изобретению ингаляционным путем (30 мин вдыхания аэрозоля соединения) непосредственно перед овальбуминовой провокацией (30 мин вдыхания аэрозоля, образованного из 50 мкг/мл раствора овальбумина). Через двадцать четыре часа после провокации морских свинок убивают и проводят лаваж легких. Затем для жидкости бронхоальвеолярного лаважа получают общий и дифференциальный счет лейкоцитов и определяют дозу тестируемого соединения, дающую 50% снижение аккумуляции эозинофилов (ED50)Wood KV (1995) Curr. Opinion Biotechnology 6, pp. 50-58. Изобретение иллюстрируется следующими примерами. 22 Примеры Общие экспериментальные детали Если продукты очищали колоночной хроматографией, флэш-диоксид кремния означает силикагель для хроматографии, от 0,040 до 0,063 мм меш (например Merck Art. 9385), где элюирование колонки ускоряли, применяя давление азота до 5 фунт/кв.дюйм (34,47380 кПа).Biotage означает использование системы Biotage Flash 40, использующей предварительно нормальнофазные упакованные силикагелем колонки, где элюирование колонки ускоряли,применяя давление азота до 20 фунт/кв.дюйм(137,89520 кПа). Если использовали тонкослойную хроматографию (ТСХ), то она относится к ТСХ на силикагеле с использованием силикагелевой пластинки 60 F254 5 х 10 см (например MerckArt. 5719). Если продукты очищали препаративной ВЭЖХ, то ее осуществляли на колонке с обратной фазой С 18 (1" Dynamax), элюируя градиентом ацетонитрила (содержащего 0,1% трифторуксусной кислоты) в воде (содержащей 0,1% трифторуксусной кислоты), и соединения выделяли в виде их солей трифторацетатов, если не указано иначе. Стандартная автоматизированная препаративная колонка ВЭЖХ,. условия и элюент Автоматизированную препаративную высокоэффективную жидкостную хроматографию(автопреп. ВЭЖХ) проводили, используя колонку Supelco ABZ+ 5 мкМ 100 мм х 22 мм внутренний диаметр, элюируемую смесью растворителей, состоящей из 1) 0,1% муравьиной кислоты в воде и 2) 0,05% муравьиной кислоты в ацетонитриле, причем элюент выражали в виде процента (2) в смеси растворителей, при скорости потока 4 мл в минуту. Если не указано иначе, элюент использовали в виде градиента 595% за период 20 мин. Система ЖХ/МС Использовали системы жидкостной хроматографии - масс-спектроскопии (ЖХ/МС): Система ЖХ/МС А - колонка A SupelcoABZ+ 3,3 см х 4,6 мм внутренний диаметр,элюирование растворителями: А - 0,05% об./об. муравьиная кислота + 0,077% мас./об. ацетат аммония в воде и Б - 95:5 ацетонитрил:вода + 0,05% об./об. муравьиная кислота. Использовали следующий протокол градиента: 100% А в течение 0,7 мин; смеси А+Б, профиль градиента 0-100% Б за период 3,5 мин; выдерживали при 100% Б в течение 3,5 мин; возвращались к 0% Б за период 0,3 мин. Применяли положительную и отрицательную электрораспылительную ионизацию. Система ЖХ/МС Б - колонка А Supelco 23 0,05% об./об. муравьиная кислота. Использовали следующий протокол градиента: 0-100% Б за период 3,5 мин; выдерживали при 100% Б в течение 1,50 мин; возвращались к 0% Б за период 0,50 мин. Применяли положительную и отрицательную электрораспылительную ионизацию. Система ЖХ/МС В - колонка А SupelcoABZ+ 3,3 см х 4,6 мм внутренний диаметр,элюирование растворителями: А - 0,1% об./об. муравьиная кислота + 10 ммоль ацетат аммония в воде и Б - 95:5 ацетонитрил:вода + 0,05% об./об. муравьиная кислота. Использовали следующий протокол градиента: 100% А в течение 0,7 мин; смеси А+Б, профиль градиента 0-100% Б за период 3,7 мин; выдерживали при 100% Б в течение 0,9 мин; возвращались к 0% Б за период 0,2 мин. Применяли положительную и отрицательную электрораспылительную ионизацию. Промежуточные соединения Промежуточное соединение 1. 3-Этил-5(6R-метокси-2,2-диметилтетрагидро-(3 аR,6 аR)фуро[3,4-d][1,3]диоксол-4S-ил)изоксазол. К перемешиваемой смеси 4R-этинил-6Rметокси-2,2-диметилтетрагидро-(3 аR,6 аR)фуро[3,4-d][1,3]диоксола [соединение, известное в литературе; ссылка Helv. Chim. Aсta 1980,63, 1181-1189] (0,271 г; 1,37 ммоль) и фенилизоцианата (0,328 мл; 3,01 ммоль) в сухом толуоле (1,5 мл) в атмосфере азота по каплям добавляли смесь 1-нитропропана (0,134 мл; 1,51 ммоль) и триэтиламина (0,038 мл; 0,27 ммоль) в сухом толуоле (1 мл) в течение 5 мин. Осадок медленно образовывался в процессе добавления. Полученную смесь нагревали при 73-82 С в течение 18 ч. Охлажденную реакционную смесь фильтровали через 3 дюйма (7,5 см) силикагеля,хорошо промывали эфиром, а затем смесью 40% этилацетата - циклогексан. Удалением растворителя в вакууме получали светло-коричневое твердое вещество (0,487 г), которое подвергали колоночной флэш-хроматографии (смесями 20%, 25%, затем 30% этилацетата - циклогексан) с получением соединения, указанного в заголовке, в виде прозрачного масла (0,329 г). ТСХ (40% этилацетата - циклогексан, визуализировали в кювете с парами иода) Rf = 0,49. Промежуточное соединение 2 Промежуточное соединение 2 а. Уксусной кислоты 4R,5S-диацетокси-2S-(3-этилизоксазол-5-ил)тетрагидрофуран-3R-иловый эфир. Промежуточное соединение 2 б. Уксусной кислоты 4R,5R-диацетокси-2S-(3-этилизоксазол-5-ил)-тетрагидрофуран-3R-иловый эфир. Раствор промежуточного соединения 1(0,355 г; 1,32 ммоль) в смеси трифторуксусной кислоты (5 мл) и воды (0,05 мл) перемешивали при комнатной температуре в течение 27 ч, а затем выпаривали в вакууме. Получали азеотропную смесь остатка с толуолом (3 х) и растворяли в сухом дихлорметане (10 мл) в атмосфере азота, а затем охлаждали до 0 С. Добавляли 4-(N,N-диметиламино)пиридин (0,048 г; 24 0,4 ммоль), триэтиламин (8,3 мл; 60 ммоль), а затем уксусный ангидрид (2,49 мл; 26,4 ммоль). Смесь перемешивали при температуре от 0 С до комнатной температуры в течение ночи. Полученную смесь выпаривали в вакууме до коричневой жидкости (1,34 г). Колоночной флэшхроматографией (20%, 30%, затем 40% этилацетата - циклогексан) получали промежуточное соединение 2 а (0,192 г) в виде светлокоричневого масла, ТСХ (40% этилацетата циклогексан, визуализировали окрашивающим реагентом молибдатом аммония) Rf = 0,28, и промежуточное соединение 2 б (0,16 г) в виде светло-коричневого масла, ТСХ (40% этилацетата - циклогексан, визуализировали окрашивающим реагентом молибдатом аммония) Rf = 0,22. Промежуточное соединение 3. Уксусной кислоты 4R-ацетокси-2R-(2,6-дихлор-пурин-9 ил)-5S-(3-этилизоксазол-5-ил)тетрагидрофуран 3R-иловый эфир. К смеси промежуточного соединения 2 а и промежуточного соединения 2 б (0,909 г; 2,67 ммоль) в сухом ацетонитриле (5 мл) при 0 С в атмосфере азота добавляли 2,6-дихлорпурин(0,779 г; 4,0 ммоль), ДБУ (0,692 мл; 4,53 ммоль),а затем триметилсилилтрифлат (0,99 мл; 5,06 ммоль). Эту реакционную смесь перемешивали при комнатной температуре в течение 20 ч, гасили насыщенным водным раствором бикарбоната натрия (30 мл). Экстракцией этилацетатом(3 х 40 мл) получали коричневую жидкость (3,54 г). Очисткой колоночной флэш-хроматографией(40%, затем 50% этилацетата - циклогексан) получали соединение, указанное в заголовке, в виде кремово-белой пены (0,798 г). ТСХ (60% этилацетата - циклогексан, визуализировали окрашивающим реагентом молибдатом аммония или под УФ лампой) Rf = 0,25. Промежуточное соединение 4. (3 аS,4S,6R,6 аR)-6-[2-Хлор-6-(2,2-дифенилэтиламино)пурин-9-ил]-2,2-диметил(тетрагидрофуро[3,4-d][1,3]диоксол-4-карбоновой кислоты (полученной путем выполнения способа получение 4 в Международной патентной заявке WO 94/ 17090) (6,015 г; 11,23 ммоль) в сухом дихлорметане (30 мл) в атмосфере азота добавляли карбонилдиимидазол (2,37 г; 14,6 ммоль). Смесь перемешивали в течение 1 ч. Добавляли дихлорметановый раствор N,O-диметилгидроксиламина (25,8 ммоль; получен путем подщелачивания 10 мл водного раствора 2,57 г соответствующего гидрохлорида при 0 С водным гидроксидом натрия с последующей экстракцией 3 х 5 мл дихлорметана и сушкой над сульфатом натрия). Смесь перемешивали при комнатной температуре в течение 60 ч, гасили водной лимон 25 ной кислотой (10% мас./об., 40 мл). Органический раствор отделяли, промывали водным бикарбонатом натрия (8% мас./об., 40 мл), высушивали (сульфат натрия) и фильтровали. Удалением растворителя в вакууме получали соединение, указанное в заголовке, в виде кремово-белой пены (6,66 г). ТСХ (100% этилацетат,визуализировали под УФ лампой) Rf = 0,51. Промежуточное соединение 5. 1-6R-[2 Хлор-6-(2,2-дифенилэтиламино)пурин-9-ил]2,2-диметилтетрагидро-(3 аS,6 аR)-фуро[3,4-d][1,3]диоксол-4S-ил-пент-2-ин-1-он. Тетрагидрофурановый раствор хлористого магния этилацетилида получали путем перемешивания смеси этилацетилена (примерно 10 мл) и метилмагния хлорида (3 М в тетрагидрофуране, 8,7 мл; 26 ммоль) в атмосфере азота при температуре от 0 С до комнатной температуры в течение ночи. К этой полученной серой желатинообразной смеси, охлажденной до 0 С, в атмосфере азота добавляли раствор промежуточного соединения 4 (5,012 г; 8,66 ммоль) в сухом тетрагидрофуране (40 мл). Смесь перемешивали при 0 С в течение 4 ч, гасили насыщенным водным раствором хлорида аммония(50 мл). Эту полученную смесь экстрагировали этилацетатом (3 х 50 мл), высушивали над сульфатом магния и выпаривали в вакууме с получением соединения, указанного в заголовке, в виде кремово-белой пены (4,91 г). ТСХ (7:3 этилацетат : циклогексан, визуализировали под УФ лампой) Rf = 0,54. Промежуточное соединение 6. 1-6R-[2 Хлор-6-(2,2-дифенилэтиламино)пурин-9-ил]2,2-диметилтетрагидро-(3 аS,6 аR)-фуро[3,4-d][1,3]диоксол-4S-илпентан-1,3-диона 3-оксим. К перемешиваемому раствору промежуточного соединения 5 (0,116 г; 0,203 ммоль) в этаноле (0,5 мл) при комнатной температуре добавляли водный раствор гидроксиламина(50% мас./мас. в воде, 0,019 мл, 0,304 ммоль). После перемешивания в течение 19 ч смесь выпаривали в вакууме. Полученный остаток распределяли в соляной кислоте (0,1 М; 5 мл) и этилацетате (10 мл). Водный раствор экстрагировали этилацетатом (2 х 5 мл). Объединенные этилацетатные экстракты высушивали над сульфатом магния и выпаривали в вакууме с получением соединения, указанного в заголовке, в виде смолистого твердого вещества (0,121 г). ЖХ/МС система A Rt = 4,78 мин, m/z 605(МH+ для C31H3335ClN6O5). Промежуточное соединение 7. (2R,3R,4S,5S)-2-[2-Хлор-6-(2,2-дифенилэтиламино)пурин 9-ил]-5-(3-этилизоксазол-5-ил)тетрагидрофуран 3,4-диол. Раствор промежуточного соединения 6(8 мл) и воды (1 мл) нагревали при 100 С в течение 4,5 ч. Охлажденную реакционную смесь выпаривали в вакууме с получением коричневого 26 смолистого остатка. Очисткой колоночной флэш-хроматографией (50%, затем 70% этилацетата - циклогексан) получали соединение,указанное в заголовке, в виде прозрачного смолистого твердого вещества (0,073 г). ТСХ (100% этилацетат, визуализировали под УФ лампой)Rf = 0,43. Промежуточное соединение 8. Уксусной кислоты 4R-ацетокси-2R-[2-хлор-6-(1-этилпропиламино)пурин-9-ил]-5S-(3-этилизоксазол-5 ил)-тетрагидрофуран-3R-иловый эфир. Промежуточное соединение 3 (0,518 г; 1,10 ммоль), диизопропилэтиламин (0,29 мл; 1,65 ммоль) и 1-этилпропиламин (0,14 мл; 1,21 ммоль) перемешивали в изопропаноле при 50 С в течение 21 ч. Растворитель удаляли в вакууме,оставляя соединение, указанное в заголовке, в виде коричневой смолы (0,528 г). ТСХ SiO2(циклогексан, этилацетат, 1:1) Rf= 0,19. Промежуточное соединение 9. 2-Хлор-N(1-этилпропил)аденозин. Смесь 2,6-дихлор-9-(2,3,5-три-O-ацетил-D-рибофуранозил)-9 Н-пурина (10,1 г; 22,6 мМ), изопропанола (300 мл), К 2 СО 3 (5 г) и 1 этилпропиламина (2,17 г; 24,84 мМ) перемешивали при 20 С в течение 24 ч. Эту реакционную смесь нагревали при 54 С в течение 73 ч. Растворитель удаляли в вакууме, добавляли воду[1,3]диоксол-4R-илметанол. Промежуточное соединение 9 (9,300 г; 22,6 моль), 2,2-диметоксипропан (35 мл) и паратолуолсульфоновую кислоту (8,100 г) в ацетоне (250 мл) перемешивали при 20 С в течение 22 ч. Растворитель удаляли в вакууме, добавляли этилацетат (200 мл), промывали водным насыщенным NaHCO3 (3 х 70 мл). Объединенные органические вещества экстрагировали этилацетатом(50 мл), и эти объединенные органические вещества высушивали (MgSO4), и растворитель удаляли в вакууме. Очисткой с использованием колоночной флэш-хроматографии на диоксиде кремния, элюируя 50, 60 и 70% этилацетатом в циклогексане, получали соединение, указанное в заголовке, в виде белой пены (5,67 г). ТСХ[1,3]диоксол-4-карбоновая кислота. К энергично перемешиваемому раствору промежуточного соединения 10 (2,02 г; 4,9 ммоль) в смеси этилацетата (76 мл) и насыщен 27 ного водного NаНСО 3 (51 мл) при 0 С (предварительно охлажденному в течение 30 мин), содержащему КВr (0,059 г) и ТЕМПО (0,004 г), в течение 10 мин по каплям добавляли раствор,свежеприготовленный из NаНСО 3 (0,156 г),водного NaOCl (2,7 мл; 13% активного хлора) и воды (примерно 0,5 мл). Через 30 мин и через 2 ч добавляли еще реагенты (некоторые количества КВr, ТЕМПО, NаНСО 3 и NaOCl в Н 2 О). Реакционную смесь наливали на смесь воды (100 мл) и этилацетата (50 мл), содержащую Nа 2SО 3 (10 г). Водный основной слой охлаждали до 0 С,подкисляли до рН 2 и экстрагировали этилацетатом (2 х 100 мл), и объединенные экстракты высушивали (MgSO4). Первоначальный органический слой отделяли и промывали водой(2 х 100 мл). Полученную водную промывку подкисляли до рН 3, экстрагировали этилацетатом(2 х 50 мл), и объединенные экстракты высушивали (MgSO4). Объединенные высушенные органические экстракты выпаривали в вакууме с получением соединения. указанного в заголовке, в виде белой пены (1,309 г). ЖХ/МС система Б Rt = 3,25 мин, m/z = 426 MH+. Промежуточное соединение 12. (3 аS,4S,6R,6 аR)-6-[2-Хлор-6-(1-этилпропиламино)пурин-9-ил]-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-карбоновой кислоты метоксиметиламид. К перемешиваемому раствору промежуточного соединения 11 (0,700 г; 1,65 ммоль) в дихлорметане (10 мл) при 20 С в атмосфере азота добавляли карбонилдиимидазол (0,348 г; 2,15 ммоль). Через 2 ч добавляли N,O-диметилгидроксиламин (3,8 ммоль; полученный путем экстракции водного раствора соответствующего гидрохлорида, подщелаченного водным 2 н. гидроксидом натрия, дихлорметаном (3 х 1,5 мл),высушенный над Na2SO4) в дихлорметане (4,5 мл + 0,5 мл промывки). Смесь перемешивали при 20 С в течение 3 суток. Реакционную смесь разбавляли дихлорметаном (40 мл), промывали водной лимонной кислотой (40 мл, 10% мас./об.), насыщенным водным NаНСО 3 (40 мл),высушивали (MgSO4), и растворитель удаляли в вакууме с получением соединения, указанного в заголовке, в виде белой пены (0,624 г). ТСХSiO2 (чистый этилацетат, визуализировали УФ светом) Rf = 0,40. Промежуточное соединение 13. 1-6R-[2 Хлор-6-(1-этилпропиламино)пурин-9-ил]-2,2 диметилтетрагидро-(3 аS,6 аR)-фуро[3,4-d][1,3] диоксол-4S-илпент-2-ин-1-он. Метилмагния хлорид (1,9 мл; 5,69 ммоль; 3 молярный в ТГФ) добавляли к избытку этилацетилена (примерно 3 мл), конденсированного в колбу, содержащую сухой ТГФ (1 мл) при -78 С в атмосфере азота. Этой смеси давали нагреться до 0 С и перемешивали в течение 6 ч. К этой реакционной смеси при 0 С канюлировали промежуточное соединение 12 (0,533 г; 1,14 ммоль) в сухом ТГФ (6 мл). Через 1 ч при 0 С добавля 003194 28 ли насыщенный водный хлорид аммония (10 мл), экстрагировали этилацетатом (3 х 10 мл),высушивали (MgSO4), и растворитель удаляли в вакууме с получением соединения, указанного в заголовке, в виде светло-коричневой смолы(0,577 г). ТСХ SiO2 (50% этилацетат в циклогексане, визуализировали УФ светом) Rf = 0,33. Промежуточное соединение 14: (2R,3R,4S,5S)-2[2-Хлор-6-(1-этил-пропиламино)пурин-9-ил]-5(3-этилизоксазол-5-ил)тетрагидрофуран-3,4 диол. Смесь промежуточного соединения 13(3 мл) перемешивали при 20 С в течение 6 ч и оставляли стоять при 20 С в течение 3 суток. Растворитель удаляли в вакууме и заменяли уксусной кислотой (24 мл) и водой (3 мл), и нагревали до флегмообразования в течение 2 ч, а затем при 100 С в течение 3 ч. Охлажденную реакционную смесь выпаривали до сухости и подвергали азеотропной перегонке с толуолом (2 х). Очисткой с использованием колоночной хроматографии на флэш-диоксиде кремния, элюируемом 50, 60 и 70% этилацетатом в циклогексане,получали соединение, указанное в заголовке, в виде светло-коричневой смолы (0,413 г). ТСХChim. Acta 1980, 63, 1181-1189] (0,104 г; 0,53 ммоль) перемешивали в смеси воды (0,2 мл) и трифторуксусной кислоты (1,8 мл) в течение 1 ч при комнатной температуре. Удалением летучих веществ в вакууме получали остаток. Этот остаток перемешивали с уксусным ангидридом(0,5 мл; 5,25 ммоль), триэтиламином (1,65 мл; 11,8 ммоль) и 4-диметиламинопиридином (0,019 г; 0,16 ммоль) в сухом дихлорметане (5 мл) при комнатной температуре в течение 19,5 ч. Смесь выпаривали в вакууме, а затем подвергали азеотропной перегонке с толуолом (2 х). Полученный темно-коричневый остаток подвергали хроматографии на колонке с SiO2 и элюировали смесью 20%, а затем 30% EtOAc - циклогексан с получением промежуточного соединения 15 а в виде прозрачной смолы (0,039 г): ТСХ (50%EtOAc - циклогексан, визуализировали окрашивающим раствором молибдата аммония) Rf = 0,43, и промежуточного соединения 15 б в виде прозрачной смолы (0,038 г), которая затвердевала с образованием восковых игл при стоянии при комнатной температуре: ТСХ (50% EtOAc29 циклогексан, визуализировали окрашивающим раствором молибдата аммония) Rf = 0,36. Промежуточное соединение 16. Уксусной кислоты 4R-ацетокси-2R-(2,6-дихлорпурин-9 ил)-5R-этинилтетрагидрофуран-3R-иловый эфир. Смесь промежуточного соединения 15 а и 15 б (0,098 г; 0,36 ммоль), 2,6-дихлорпурина(0,106 г; 0,55 ммоль) и ДБУ (0,094 мл; 0,62 ммоль) в ацетонитриле (0,7 мл) в атмосфере N2 охлаждали до 0 С. По каплям добавляли триметилсилилтрифлат (0,135 мл; 0,69 ммоль). Смеси давали нагреться до комнатной температуры и перемешивали в течение 18,5 ч. Реакционную смесь гасили насыщенным водным NаНСО 3 (5 мл), экстрагировали EtOAc (3 х 5 мл), высушивали (МgSO4) и выпаривали. Полученный коричневый остаток подвергали колоночной флэшхроматографии (SiO2/50% EtOAc - циклогексан) с получением соединения, указанного в заголовке, в виде белого твердого вещества (0,096 г). ТСХ (50% EtOAc - циклогексан, визуализировали окрашивающим раствором молибдата аммония) Rf = 0,25. Промежуточное соединение 17. Уксусной кислоты 4R-ацетокси-2R-[2-хлор-6-(1-этилпропиламино)пурин-9-ил]-5R-этинилтетрагидрофуран-3R-иловый эфир. Смесь промежуточного соединения 16(1,111 г; 2,78 ммоль), 1-этилпропиламина (0,34 мл; 2,92 ммоль) и диизопропилэтиламина (0,534 мл; 3,06 ммоль) в ДМФ (10 мл) нагревали при 50 С в течение 17,5 ч. Большую часть ДМФ удаляли выпариванием на роторном испарителе в вакууме. Полученный остаток разбавляли насыщенным водным NаНСО 3 (30 мл). Экстракцией EtOAc (50 мл, затем 2 х 25 мл) получали коричневую пену (1,249 г). Очисткой с использованием картриджа Varian Mega Bonded Elut (10 г(0,2 мл) энергично перемешивали с твердым бикарбонатом натрия (0,11 г; 1,26 ммоль) в течение 89 ч при комнатной температуре. Добавляли еще дибромформальдоксима (0,035 г; 0,17 ммоль), твердого бикарбоната натрия (0,11 г; 1,26 ммоль) и воды (0,2 мл). Еще через 21 ч эту реакционную смесь разбавляли водой (5 мл),экстрагировали этилацетатом (3 х 5 мл). Объединенный органический раствор выпаривали в вакууме с получением сырого продукта, который растворяли в толуоле (2 мл). Этот раствор 30 наносили на картридж Varian Mega Bonded Elut(5 г Si, размер 20 мл) и элюировали смесями 30,40, 50, 60%, затем 70% этилацетатациклогексан. Фракции, содержащие продукт,объединяли и выпаривали с получением соединения, указанного в заголовке, в виде светлокоричневой смолы (0,043 г). ЖХ/МС система БC21H2479Br35ClN6O6. Промежуточное соединение 19. Уксусной кислоты 4R-ацетокси-5S-(3-ацетилизоксазол-5 ил)-2R-[2-хлор-6-(1-этилпропиламино)пурин-9 ил]тетрагидрофуран-3R-иловый эфир. Промежуточное соединение 19 получали аналогично промежуточному соединению 18,используя N-гидрокси-2-оксопропионимидоилхлорид (0,021 г; 0,17 ммоль). Дополнительные количества реагентов добавляли на 89-й час [Nгидрокси-2-оксопропионимидоилхлорид (0,021 г; 0,17 ммоль), твердый бикарбонат натрия (0,11 г; 1,26 ммоль) и воду (0,2 мл)], на 132-й час [Nгидрокси-2-оксопропионимидоилхлорид (0,05 г; 0,41 ммоль) и твердый бикарбонат натрия (0,11 г; 1,26 ммоль)] и на 180-й час [N-гидрокси-2 оксопропионимидоила хлорид (0,075 г; 0,62 ммоль) и твердый бикарбонат натрия (0,16 г; 1,26 ммоль)]. Еще через 24 ч при к.т. выделяли продукт, указанный в заголовке, в виде коричневой смолы (0,043 г). ЖХ/МС система Б Rt = 3,51 мин, m/z = 535 MH+ для C23H2735ClN6O7. Промежуточное соединение 20. Уксусной кислоты 4R-ацетокси-2R-[2-хлор-6-(1-этилпропиламино)пурин-9-ил]-5S-(3-метилизоксазол-5 ил)тетрагидрофуран-3R-иловый эфир. К перемешиваемой смеси промежуточного соединения 17 (0,1 г; 0,22 ммоль), триэтиламина(0,031 мл; 0,22 ммоль) и фенилизоцианата (0,063 мл; 0,58 ммоль) в сухом толуоле (1 мл) в атмосфере N2 добавляли раствор нитроэтана (0,021 мл; 0,29 ммоль) в сухом толуоле (1 мл). Смесь нагревали при 80 С в течение 21 ч. Эту охлажденную реакционную смесь наносили на картридж Varian Mega Bonded Elut (5 г Si, размер 20 мл) и элюировали смесями 30-60% этилацетатациклогексан. Фракции, содержащие продукт, собирали вместе и выпаривали в вакууме. Полученный материал растворяли в толуоле (2 мл), фильтровали через ватный тампон и непосредственно наносили на другой картридж Varian Mega Bonded Elut (5 г Si, размер 20 мл). Элюированием смесями 20% ЕtOАсциклогексан (200 мл), 30% ЕtOАс-циклогексан 31 Промежуточное соединение 21 получали аналогично промежуточному соединению 20,используя нитробутан (0,031 мл; 0,29 ммоль). Через 21 ч добавляли еще фенилизоцианата(0,063 мл; 0,58 ммоль) и нитробутана (0,031 мл; 0,29 ммоль) в сухом толуоле (0,5 мл). Еще после 23 ч при 80 С выделяли продукт, указанный в заголовке, в виде кремово-белой пены (0,093 г). ЖХ/МС система Б Rt = 3,68 мин, m/z = 535 MH+ для C24H3135ClN6O6. Промежуточное соединение 22. Уксусной кислоты 4R-ацетокси-2R-[2-хлор-6-(1-этилпропиламино)пурин-9-ил]-5S-[3-(тетрагидропиран 2-илоксиметил)изоксазол-5-ил]тетрагидрофуран-3R-иловый эфир. Промежуточное соединение 22 получали аналогично промежуточному соединению 20,используя 2-(2-нитроэтокси)тетрагидропиран(0,045 мл; 0,29 ммоль). Дополнительные количества реагентов фенилизоцианата (0,063 мл; 0,58 ммоль) и 2-(2-нитроэтокси)тетрагидропирана (0,045 мл; 0,29 ммоль) в сухом толуоле(0,5 мл) добавляли через 21 ч. Еще после 120 ч при 80 С выделяли продукт, указанный в заголовке, в виде светло-коричневой пены (0,113 г). ЖХ/МС система Б Rt = 3,64 мин, m/z = 607 МH+ для C27H3535ClN6O8. Промежуточное соединение 23. (2R,3R,4S,5S)-2-[2-Хлор-6-(1-этилпропиламино)пурин-9 ил]-5-[3-(1-гидроксиэтил)изоксазол-5-ил]тетрагидрофуран-3,4-диол. К перемешиваемому раствору промежуточного соединения 19 (42 мг; 0,08 ммоль) в метаноле (1 мл) при 0 С в атмосфере азота добавляли борогидрид натрия (12 мг; 0,31 ммоль). Через 4 ч реакционную смесь выпаривали с получением продукта, указанного в заголовке, в виде светло-коричневого твердого вещества(0,057 г) в изомерном соотношении 2:1. ЖХ/МС система A Rt = 4,12 и 4,23 мин в соотношении 2:1 соответственно, m/z = 453 МH+ для С 19 Н 2535ClN6 О 5. Промежуточное соединение 24. (2R,3R,4S,5S)-2-[2-Хлор-6-(1-этилпропиламино)пурин 9-ил]-5-(3-гидроксиметилизоксазол-5-ил)тетрагидрофуран-3,4-диола трифторацетат. Смесь промежуточного соединения 22(0,061 г; 0,1 ммоль) и метилата натрия (25 мас.% в метаноле, 0,01 мл) в метаноле (2 мл) перемешивали при комнатной температуре в течение 19 ч. Добавляли уксусную кислоту (0,1 мл). Смесь выпаривали в вакууме. Полученный остаток растворяли в смеси ТФУ (0,9 мл) и воды(0,1 мл) при 0 С в течение 6 ч. Удалением летучих веществ получали продукт, указанный в заголовке, в виде коричневого остатка (0,1 г). ЖХ/МС система A Rt = 4,05 мин, m/z = 439 MH+ для С 18 Н 2335 Сl6 О 5. Промежуточное соединение 24 (альтернативное получение). (2R,3R,4S,5S)-2-[2-Хлор-6(1-этилпропиламино)пурин-9-ил]-5-(3-гидрокси 003194 32 метилизоксазол-5-ил)тетрагидрофуран-3,4 диола трифторацетат. К раствору промежуточного соединения 34(0,1 мл) и перемешивали в течение 30 мин. Добавляли уксусную кислоту (0,1 мл) и выпаривали до сухости. К остатку добавляли трифторуксусную кислоту (1,8 мл) и воду (0,2 мл). Эту смесь перемешивали при 0 С в течение 2 ч, затем выпаривали до сухости с получением соединения, указанного в заголовке, в виде коричневого твердого вещества (0,082 г). ЖХ/МС система В Rt = 2,83 мин, m/z = 439 МН+. Промежуточное соединение 25. (2R,3R,4S,5S)-2-[2-Xлop-6-(3-иодбензиламино)пурин-9 ил]-5-(3-этилизоксазол-5-ил)тетрагидрофуран 3,4-диола ацетат. Смесь м-иодбензиламина гидрохлорида(0,050 г; 0,11 ммоль) в изопропаноле (2 мл) нагревали до 50 С в течение 24 ч. Делали дополнительное добавление м-иодбензиламина гидрохлорида (0,032 г; 0,12 ммоль), диизопропилэтиламина (0,22 мл), и эту смесь нагревали до 50 С в течение 8 ч. Растворитель удаляли в вакууме, а остаток растворяли в безводном метаноле (2 мл) и обрабатывали метилатом натрия(25 мас.% раствор в метаноле, 0,25 мл) с перемешиванием при 20 С в течение 1 ч, добавляли уксусную кислоту (1 мл), и растворитель удаляли в вакууме. Очисткой с использованием колоночной хроматографии на флэш-диоксиде кремния,элюируемом 50% циклогексаном в этилацетате,получали соединение, указанное в заголовке, в виде белого твердого вещества после титрования метанолом (0,035 г). ТСХ SiO2 (50% этилацетат в циклогексане) Rf = 0,17. Промежуточное соединение 26. (2R,3R,4S,5S)-2-[2-Xлop-6-(1S-гидроксиметил-2-фенилэтиламино)-пурин-9-ил]-5-(3-этилизоксазол-5 ил)тетрагидрофуран-3,4-диола ацетат. Смесь 3-(S)-(-)2-амино-3-фенилпропанола(2 мл) нагревали до 50 С в течение 17 ч. Растворитель удаляли в вакууме, а остаток растворяли в безводном метаноле (2 мл) и обрабатывали метилатом натрия (25 мас.% раствор в метаноле,0,25 мл) с перемешиванием при 20 С в течение 1 ч, добавляли уксусную кислоту (0,5 мл), и растворитель удаляли в вакууме. Очисткой с использованием колоночной хроматографии на флэш-диоксиде кремния, элюируемом этилацетатом, получали соединение, указанное в заголовке, в виде хрустящей белой пены (0,112 г). ТСХ SiO2 (чистый этилацетат) Rf = 0,26. Промежуточное соединение 27. 2-(Пиридин-2-иламино)этиламин. 33 2-Бромпиридин (10,00 г; 63,3 ммоль) добавляли по каплям к 1,2-диаминоэтану (76,00 г; 126,6 ммоль) в атмосфере азота при 20 С с перемешиванием. Эту реакционную смесь перемешивали при 20 С в течение 4 ч, а затем при флегмообразовании в течение 24 ч. Эту реакционную смесь концентрировали в вакууме и очищали колоночной хроматографией на флэшдиоксиде кремния, элюируя дихлорметаном,этанолом и аммиаком (30:8:1) с получением соединения, указанного в заголовке, в виде красного масла (1,23 г). ТСХ SiO2 (дихлорметан,этанол, аммоний; 30:8:1) Rf =0,14. Масс-спектрm/z 138 (МH+ для С 7 Н 11N3). Промежуточное соединение 28. (2R,3R,4S,5R)-2-6-(1-Этилпропиламино)-2-[2-(1-метил 1 Н-имидазол-4-ил)этиламино]пурин-9-ил-5 этинилтетрагидрофуран-3,4-диол. Смесь промежуточного соединения 17(0,45 г; 1,0 ммоль), 1-метилгистамина (6,97 ммоль; получен из 1,38 г соответствующего бисгидрохлорида путем нейтрализации 0,48 г твердого гидроксида натрия в 5 мл метанола,профильтрованного, и выпаривания в вакууме) и дисизопропилэтиламина (1 мл) в сухом ДМСО(3 мл) нагревали при 95 С в течение 114 ч, а затем при 110 С в течение 71 ч в атмосфере азота в круглодонной колбе. Добавляли еще 1 метилгистамина (6,97 ммоль; получен из 1,38 г соответствующего бисгидрохлорида, как описано выше). Еще через 24 ч эту охлажденную реакционную смесь разбавляли СН 2 Сl2, наносили на картридж Varian Mega Bonded Elut (10 г Si,размер 50 мл). Этот картридж элюировали под разряжением СН 2 Сl2 (50 мл), этилацетатом(2 х 50 мл), смесями 5, 10%, а затем 20% метанола-этилацетат (2 х 50 мл для каждого дискретного приращения). Элюаты от CH2Cl2 до 10% метанола-этилацетат объединяли и выпаривали до масла. Остаточный ДМСО удаляли в высоком вакууме. Полученный коричневый остаток растворяли в CH2Cl2 (30 мл) и фильтровали через другой картридж Varian Mega Bonded Elut (10 гSi, размер 50 мл). Элюированием 50 мл каждой смеси от 50 до 90% этилацетата-циклогексан с 10% дискретным приращением, 100% этилацетатом, а затем смесями 10% метанолаэтилацетат (4 х 50 мл), 15% метанола-этилацетат(25 мас.% раствор в метаноле, 0,25 мл) с перемешиванием при 20 С в течение 1,5 ч, добавляли уксусную кислоту (1 мл), и растворитель удаляли в вакууме. Очисткой с использованием колоночной хроматографии на флэш-диоксиде кремния, элюируемом этилацетатом, а затем 10% метанолом в этилацетате, получали соединение, указанное в заголовке, в виде пены кремового цвета (0,126 г). ТСХ SiO2 (чистый этилацетат) Rf = 0,21. Промежуточное соединение 30. (3 аS,4S,6R,6 аR)-6-Метокси-2,2-диметилтетрагидрофуро(3 аS,4S,6R,6 аR)-метокси-2,2-диметилтетрагидрофуро[3,4-d][1,3]диoкcoл-4-кapбoнoвoй кислоте, полученной путем выполнения способа для промежуточного соединения 1 в Международной патентной заявкеWO 98/28319, (5,0 г; 22,9 ммоль) в ДХМ (100 мл) при комнатной температуре в атмосфере азота порциями добавляли карбонилдиимидазол (4,83 г; 29,8 ммоль) в ДХМ (50 мл) и перемешивали в течение 1 ч. N,O-диметилгидроксиламина гидрохлорид (4,47 г; 45,8 ммоль) растворяли в 2,0 М растворе гидроксида натрия (100 мл) и экстрагировали ДХМ (2 х 50 мл). Органические экстракты объединяли, добавляли к исходной реакционной смеси и перемешивали в течение 24 ч. Растворитель выпаривали в вакууме, а полученный остаток, перенесенный в этилацетат (150 мл), промывали насыщенной лимонной кислотой (50 мл), насыщенным бикарбонатом натрия[3,4-d][1,3]диоксол-4S-ил)-4-(тетрагидропиран 2-илокси)бут-2-ин-1-он. К ТГФ раствору (20 мл) тетрагидро-2-(2 пропанилокси)-2 Н-пирана (1,609 г; 11,48 ммоль) добавляли н-бутиллитий 1,6 М в гексанах (7,7 мл; 11,48 ммоль) при -78 С в атмосфере азота и перемешивали в течение 20 мин. Добавляли диэтилэфират трифторида бора (1,79 г; 12,61 ммоль), и этот раствор перемешивали в течение 30 мин. Добавляли раствор промежуточного соединения 30 (1,0 г; 3,82 ммоль) в безводном ТГФ (2 мл), и эту смесь перемешивали при-78 С в атмосфере азота в течение 3 ч. Эту реакционную смесь гасили насыщенным раствором хлорида аммония (100 мл) и экстрагировали этилацетатом (3 х 100 мл). Объединенные органические слои высушивали (МgSO4), и растворитель удаляли в вакууме с получением сырого продукта в виде коричневого масла (2,52 г). Часть этого сырого продукта (0,5 г) очищали, 35 используя колоночную флэш-хроматографию(Biotage; предварительно упакована 40 г SiO2),элюируя 10% этилацетатом в циклогексане с получением соединения, указанного в заголовке, в виде бесцветного масла (0,182 г). Массспектр m/z = 341 (МH+ для С 17H24 О 7). Промежуточное соединение 32. Уксусной кислоты 4R-ацетокси-2S-(3-ацетоксиметилизоксазол-5-ил)-5R-метокситетрагидрофуран-3Rиловый эфир. К раствору промежуточного соединения 31(3,18 г; 9,34 ммоль) в метаноле (30 мл) добавляли 50 мас.% гидроксиламин в воде (1,15 мл; 18,6 ммоль), и эту смесь перемешивали в атмосфере азота при комнатной температуре в течение 16 ч. Растворитель удаляли выпариванием с получением желтого масла (3,4 г). Часть (1 г) этого промежуточного соединения растворяли в метаноле (30 мл), подкисляли 37% раствором соляной кислоты (1 мл) и перемешивали в атмосфере азота в течение 24 ч при 50 С и еще 16 ч при флегмообразовании. Эту реакцию охлаждали,разбавляли метанолом (30 мл), 50% растворителя удаляли выпариванием и заменяли пиридином (2 мл) и толуолом (30 мл). Эту смесь выпаривали до сухости с получением темно-коричневого/черного вязкого масла. К этому остатку добавляли пиридин (20 мл), 4-N,N-диметиламинопиридин и уксусный ангидрид (4 мл). Эту смесь перемешивали в течение 3 ч, растворитель удаляли выпариванием, остаток, перенесенный в ДХМ (150 мл), промывали насыщенным раствором лимонной кислоты (50 мл), 8% раствором бикарбоната натрия (100 мл), рассолом (100 мл) и высушивали (MgSO4). Растворитель удаляли в вакууме, а остаток очищали, используя колоночную флэш-хроматографию (Biotage; предварительно упакована 40 г SiO2),элюируя этилацетатом, циклогексаном (2:1) с получением соединения, указанного в заголовке, в виде желтого масла (0,841 г). ТСХ SiO2(чистый этилацетат) Rf = 0,66. Промежуточное соединение 33. Уксусной кислоты 4R-ацетокси-5S-(3-ацетоксиметилизоксазол-5-ил)-2R-(2,6-дихлорпурин-9-ил)-тетрагидрофуран-3R-иловый эфир. К 2,6-дихлорпурину (0,158 г; 0,84 ммоль) добавляли ГМДС (5 мл), и смесь перемешивали в атмосфере азота в течение 16 ч при 100 С. Реакционную смесь охлаждали, растворитель удаляли выпариванием, подвергали азеотропной перегонке с безводным толуолом (5 мл) и выпаривали до сухости с получением белого аморфного твердого вещества. К этому твердому веществу добавляли раствор промежуточного соединения 32 (0,100 г; 0,279 ммоль) в безводном ацетонитриле (1,35 мл) и дополнительный безводный ацетонитрил (2 мл). Эту смесь охлаждали до 0 С и добавляли ТМСТФС (0,165 мл; 0,92 ммоль) при перемешивании. Этой смеси давали нагреться до комнатной температуры в течение 20 мин и нагревали с перемешиванием при 80 С 36 в течение 20 ч. Реакционную смесь охлаждали и вливали в 8% раствор бикарбоната натрия (20 мл), экстрагировали этилацетатом (2 х 30 мл),высушивали (MgSO4) и выпаривали с получением коричневой смолы. Очисткой с использованием колоночной флэш-хроматографии (Biotage; предварительно упакована 8 г SiO2), элюируя смесью 1:1 этилацетата и циклогексана, получали соединение, указанное в заголовке, в виде белого кристаллического твердого вещества (0,140 г). ТСХ SiO2 (чистый этилацетат) Rf = 0,55. Промежуточное соединение 34. Уксусной кислоты 4R-ацетокси-5S-(3-ацетоксиметилизоксазол-5-ил)-2R-[2-хлор-6-(1-этилпропиламино) пурин-9-ил]тетрагидрофуран-3R-иловый эфир. К раствору промежуточного соединения 33(5 мл) добавляли 1-этилпропиламин (0,025 г; 0,29 ммоль) и N,N-диизопропилэтиламин (0,033 г; 0,252 ммоль). Эту смесь нагревали с перемешиванием при 50 С в течение 16 ч, и растворитель удаляли выпариванием с получением соединения, указанного в заголовке, в виде желтой смолы (0,104 г). ЖХ/МС система В Rt = 3,50 мин, m/z = 565 MH+ . Промежуточное соединение 35. 1-(6RМетокси-2,2-диметилтетрагидро-(3 аS,6 аR)-фуро[3,4-d][1,3]диоксол-4S-ил)-пент-2-ин-1-он. 1-Бутин (примерно 20 мл) конденсировали в колбу при -78 С в атмосфере азота и добавляли к нему ТГФ (140 мл), а затем в течение 10 мин добавляли метилмагния хлорид (25 мл; 75 моль; 3 молярный в ТГФ). Этой смеси давали нагреться до температуры окружающей среды и перемешивали в течение 5 ч. Этот раствор охлаждали до 0-5 С и добавляли промежуточное соединение 30 (21,07 г; 80,73 ммоль) в ТГФ (40 мл) в течение 20 мин. Этот раствор перемешивали в течение 1 ч при 0-5 С, а затем оставляли стоять в течение ночи при 4 С. К перемешиваемому раствору при 0-5 С добавляли 30% хлорид аммония (200 мл), а затем 2 М соляную кислоту(150 мл) с последующей экстракцией этилацетатом (2 х 200 мл). Объединенные органические слои высушивали (Na2SO4), растворитель удаляли в вакууме, и очисткой с использованием колоночной хроматографии на флэш-диоксиде кремния, элюируемого смесью гексана и этилацетата (4:1), получали соединение, указанное в заголовке, в виде белого твердого вещества 37 полученное белое твердое вещество переносили в этилацетат (500 мл), промывали водой (100 мл) и рассолом (100 мл), высушивали (Na2SO4) и растворитель удаляли в вакууме, оставляя в остатке соединение, указанное в заголовке, в виде белого твердого вещества, высушенного в течение ночи под высоким вакуумом (15,81 г). ТСХSiO2 (диэтиловый эфир, гексан) Rf =0,10. Промежуточное соединение 37. 2-(2 Пиперидин-1-ил-этиламино)-1,9-дигидропурин 6-он. Смесь 2-бромгипоксантина (6 г; 28 ммоль) и 2-пиперидиноэтиламина (7 мл; 56 ммоль) в 2 метоксиэтаноле (30 мл) нагревали до флегмообразования в течение ночи. Эту смесь охлаждали до температуры окружающей среды с образованием желтого осадка. Дополнительный осадок образовывался при добавлении воды (50 мл). После перемешивания в течение 1 ч эту суспензию фильтровали, и полученное твердое вещество промывали водой и высушивали в вакууме с получением соединения, указанного в заголовке (5,6 г). ЖХ/МС система В Rt = 0,82 мин,m/z = 263 MH+ . Промежуточное соединение 38. (6-Хлор 9 Н-пурин-2-ил)-(2-пиперидин-1-ил-этил)амин. Смесь N,N-диметиламина (4 мл; 31 ммоль) и оксихлорида фосфора (30 мл; 314 ммоль) перемешивали при температуре окружающей среды в течение 10 мин, после чего порциями добавляли промежуточное соединение 37 (5,5 г; 20 ммоль), а затем кипятили с обратным холодильником в течение 15 мин. После охлаждения оксихлорид фосфора выпаривали в вакууме, полученный остаток подвергали азеотропной перегонке с толуолом(90 г SiO2), элюируя смесью 10% метанола / хлороформом / 1% аммиака, получали соединение, указанное в заголовке, в виде бледножелтого твердого вещества (4,980 г). ЖХ/МС система В Rt = 1,61 мин, m/z = 281 MH+. Промежуточное соединение 39. N6-(2,2 Дифенилэтил)-N2-(2-пиперидин-1-илэтил)-9 Нпурин-2,6-диамин. Смесь промежуточного соединения 38(100 мл) нагревали до флегмообразования в течение ночи. После охлаждения растворитель удаляли в вакууме, а остаток очищали, используя колоночную флэш-хроматографию на колонке Biotage (90 г SiO2), элюируя смесью 5% метанола/хлороформом/1% аммиака, с получением соединения, указанного в заголовке, в виде не совсем белого твердого вещества (4,500 г). ЖХ/МС система В Rt = 2,47 мин, m/z = 442 38 ил)-5R-метокситетрагидрофуран-3R-иловый эфир. Промежуточное соединение 36 (15,76 г; 54,91 ммоль) в метаноле (400 мл) обрабатывали концентрированной соляной кислотой (25 мл) и нагревали до флегмообразования в течение 22 ч. Этот раствор концентрировали при пониженном давлении и совместно выпаривали с метанолом/толуолом (2 х). Остаток растворяли в ДХМ(200 мл) и обрабатывали пиридином (100 мл),уксусным ангидридом (30 мл; 318 ммоль) и ДМАП (0,064 г) и перемешивали при температуре окружающей среды в течение 16 ч. Эту реакционную смесь разбавляли ДХМ (200 мл) и промывали 8% бикарбонатом натрия (400 мл), 2 М соляной кислотой (3 х 300 мл). Водный слой экстрагировали ДХМ (100 мл), и объединенные органические слои высушивали (Na2SO4), и растворитель удаляли в вакууме, оставляя коричневый остаток. Очисткой с использованием колоночной хроматографии на флэш-диоксиде кремния, элюируемом смесью гексана и этилацетата (1:1), получали соединение, указанное в заголовке, в виде масла оранжевого цвета (5,710 г). ТСХ SiO2 (50% этилацетат в гексане) Rf = 0,38. Промежуточное соединение 41. Уксусной кислоты 4S-ацетокси-5S-[6-(2,2-дифенилэтиламино)-2R-(2-пиперидин-1-ил-этиламино)пурин-9-ил]-2-(3-этилизоксазол-5-ил)тетрагидрофуран-3R-иловый эфир. Суспензию промежуточного соединения 39 (0,500 г; 1 ммоль) в ГМДС (5 мл) нагревали до флегмообразования в течение 3,5 ч, после чего растворитель удаляли в вакууме. Полученный остаток подвергали азеотропной перегонке с безводным толуолом (3 х 5 мл). К остатку в ацетонитриле (2 мл) добавляли промежуточное соединение 40 (0,420 г; 1,3 ммоль) и 1,8 диазабицикло[5.5.0]ундец-7-ен (0,16 мл; 1 ммоль). Эту смесь охлаждали до 0 С и добавляли ТМСТФС (0,6 мл; 3,3 ммоль). Этой смеси давали нагреться до комнатной температуры, а затем нагревали до флегмообразования в течение ночи. После охлаждения эту смесь вливали в насыщенный раствор бикарбоната натрия (10 мл) и экстрагировали этилацетатом (3 х 15 мл). Объединенные органические слои промывали водой (10 мл), высушивали (МgSO4), и растворитель удаляли в вакууме. Очисткой с использованием колоночной флэш-хроматографии на колонке Biotage (8 г SiO2), элюируя смесью 5% метанола / хлороформом / 1% аммиака, получали соединение, указанное в заголовке, в виде светло-коричневого твердого вещества (0,198 г). ЖХ/МС система В Rt = 2,89 мин, m/z = 722 МH+. Примеры Пример 1. (2R,3R,4S,5S)-2-[6-(2,2-Дифенилэтиламино)-2-(2-пиперидин-1-илэтиламино) пурин-9-ил]-5-(3-этилизоксазол-5-ил)тетрагидрофуран-3,4-диола диформат. 39 Смесь промежуточного соединения 3 (0,02 г; 0,043 ммоль), 2,2-дифенилэтиламина (0,1 ммоль/мл в изопропаноле, 0,581 мл; 0,058 ммоль) и диизопропилэтиламина (0,2 ммоль/мл в изопропаноле, 0,345 мл; 0,069 ммоль) в герметично закрытом сосуде (например Reacti-vial) нагревали при 53 С в течение 16 ч. Летучие вещества выдували под струй азота. К полученному остатку добавляли 2-пиперидин-1-илэтиламин (0,044 г; 0,344 ммоль) и ДМСО (0,2 мл). Смесь нагревали при 92 С в течение 4 суток. Полученный сырой продукт очищали автопреп. ВЭЖХ с получением соединения, указанного в заголовке, после лиофилизации в виде бледно-коричневого твердого вещества (0,0029 г). ЖХ/МС система Б Rt = 4,24 мин, m/z = 639MH+. Авторы изобретения рассматривают альтернативный способ получения соединения примера 1 при котором промежуточное соединение 7 подвергают взаимодействию с 2 пиперидин-1-ил-этиламином в ДМСО при повышенной температуре. Пример 1 (альтернативное получение). 2R[6-(2,2-Дифенилэтиламино)-2-(2-пиперидин-1 илэтиламино)пурин-9-ил]-5S-(3-этилизоксазол 5-ил)-тетрагидрофуран-3R,4S-диола трифторацетат. Раствор промежуточного соединения 41(0,125 г; 0,1 ммоль) в 10% растворе аммиака в метаноле (5 мл) перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали в вакууме, и очисткой остатка препаративной ВЭЖХ (градиент 5-95% ацетонитрила) получали соединение, указанное в заголовке(0,100 г). ЖХ/МС система В Rt = 2,77 мин, m/z = 639 MH+. Пример 2. (2R,3R,4S,5S)-2-[6-(2,2-Дифенилэтиламино)-2-(2-морфолин-4-илэтиламино) пурин-9-ил]-5-(3-этил-изоксазол-5-ил)тетрагидрофуран-3,4-диола диформиат. Соединение примера 1 получали аналогично примеру 1, используя 2-(морфолин-4-ил)этиламин (0,045 г; 0,344 ммоль). Соединение,указанное в заголовке, получали после лиофилизации в виде коричневого твердого вещества(0,01 г). ЖХ/МС система Б Rt = 4,07 мин, m/z = 641 MH+. Пример 3. (2R,3R,4S,5S)-2-(3-Этилизоксазол-5-ил)-5-[6-фенетиламино-2-(2-пиперидин-1 илэтиламино)пурин-9-ил]тетрагидрофуран-3,4 диола диформиат. Соединение примера 3 получали аналогично примеру 1, используя фенетиламин (0,1 ммоль/мл в изопропаноле, 0,581 мл; 0,058 ммоль) и 2-(2-пиперидин-1-ил)-этиламин (0,045 г; 0,344 ммоль). Смесь промежуточного соединения 3 (0,02 г; 0,043 ммоль), фенетиламина (0,1 ммоль/мл в изопропаноле, 0,581 мл; 0,058 ммоль) и диизопропилэтиламина (0,2 ммоль/мл в изопропаноле, 0,345 мл; 0,069 ммоль) в герме 003194 тично закрытом сосуде (например Reacti-vial) нагревали при 53 С в течение 16 ч. Летучие вещества выдували под струй азота. К полученному остатку добавляли 2-пиперидин-1-илэтиламин (0,045 г; 0,344 ммоль) и ДМСО (0,2 мл). Смесь нагревали при 92 С в течение 4 суток. Полученный сырой продукт очищали автопреп. ВЭЖХ с получением соединения, указанного в заголовке, после лиофилизации в виде коричневого твердого вещества (0,004 г). ЖХ/МС система Б Rt = 3,90 мин, m/z =563 МH+. Пример 4. (2R,3R,4S,5S)-2-[6-(2,2-Дифенилэтиламино)-2-(2-гидроксиэтиламино)пурин 9-ил]-5-(3-этилизоксазол-5-ил)тетрагидрофуран 3,4-диола формат. Смесь промежуточного соединения 3(0,044 г/мл; 0,5 мл; 0,047 ммоль), 2,2-дифенилэтиламина (0,011 г; 0,056 ммоль) и диизопропилэтиламина (0,013 мл; 0,074 ммоль) нагревали в герметично закрытом сосуде (например Reactivial) при 53 С в течение 16 ч. Летучие вещества выдували струй азота. Добавляли этаноламин (0,017 г; 0,28 ммоль). К остатку добавляли ДМСО (0,1 мл). Смесь нагревали при 90 С в течение 5 суток. Полученный сырой продукт очищали автопреп. ВЭЖХ с получением соединения, указанного в заголовке, после лиофилизации в виде коричневого твердого вещества(0,007 г). ЖХ/МС система Б Rt = 2,98 мин, m/z = 572 MH+. Пример 5. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-6-(1-этилпропиламино)-2-[2-(1-метил-1 Н-имидазол-4-ил)этиламино]пурин-9-ил тетрагидрофуран-3,4-диола диформиат. Соединение примера 5 получали аналогично примеру 4, используя 1-этилпропиламин(0,005 г; 0,056 ммоль) и 2-(1-метил-1 Нимидазол-4-ил)этиламин (0,035 г; 0,28 ммоль; получен из соответствующего бисгидрохлорида путем нейтрализации небольшим недостатком твердого гидроксида натрия в метаноле и выпаривания любых летучих веществ под струй азота), при 90 С в течение 5 суток. Соединение,указанное в заголовке, получали после лиофилизации в виде бледно-коричневого твердого вещества (0,009 г). ЖХ/МС система A Rt = 3,61 мин, m/z = 526 МH+ . Пример 6. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-[6-(1-этилпропиламино)-2-(2-пиперидин-1-илэтиламино)пурин-9-ил]тетрагидрофуран-3,4-диола диформиат. Соединение примера 6 получали аналогично примеру 4, используя 1-этилпропиламин(0,005 г; 0,056 ммоль) и 2-(2-пиперидин-1-ил)этиламин (0,036 г; 0,28 ммоль) при 90 С в течение 5 суток. Смесь промежуточного соединения 3 (0,044 г/мл; 0,5 мл; 0,047 ммоль), 1 этилпропиламина (0,005 г; 0,056 ммоль) и диизопропилэтиламина (0,013 мл; 0,074 ммоль) нагревали в герметично закрытом сосуде (например Reacti-vial) при 53 С в течение 16 ч. Летучие вещества выдували струй азота. К остат 41 ку добавляли 2-пиперидин-1-илэтиламин (0,036 г; 0,28 ммоль) и ДМСО (0,1 мл). Эту смесь нагревали при 90 С в течение 5 суток. Полученный сырой продукт очищали автопреп. ВЭЖХ с получением соединения, указанного в заголовке, после лиофилизации в виде коричневого твердого вещества (0,004 г). ЖХ/МС система ARt = 3,76 мин, m/z = 529 MH+ Пример 7. (2R,3R,4S,5S)-2-6-(3,3-Диметилбутиламино)-2-[2-(1-метил-1 Н-имидазол-4 ил)этиламино]пурин-9-ил-5-(3-этилизоксазол 5-ил)тетрагидрофуран-3,4-диола диформиат. Соединение примера 7 получали аналогично примеру 4, используя 3,3-диметилбутиламин (0,006 г; 0,056 ммоль) и 2-(1-метил-1 Нимидазол-4-ил)этиламин (0,035 г; 0,28 ммоль; получен как в примере 5) при 90 С в течение 5 суток. Соединение, указанное в заголовке, получали после лиофилизации в виде коричневого твердого вещества (0,007 г). ЖХ/МС система ARt = 3,80 мин, m/z = 540 MH+. Пример 8. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-[6-(циклопентиламино)-2-(2-пиперидин-1-илэтиламино)пурин-9-ил]тетрагидрофуран-3,4-диола диформиат. Соединение примера 8 получали аналогично примеру 4, используя циклопентиламин(0,005 г; 0,056 ммоль) и 2-пиперидин-1-илэтиламин (0,036 г; 0,28 ммоль) при 90 С в течение 5 суток. Соединение, указанное в заголовке,получали после лиофилизации в виде коричневого твердого вещества (0,003 г). ЖХ/МС система A Rt = 3,44 мин, m/z = 527MH+. Пример 9. N-2-[9-[5S-(3-Этилизоксазол-5 ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]6-(тетрагидротиопиран-4-иламино)-9 Н-пурин-2 иламино]этилгуанидина диформиат. Смесь промежуточного соединения 3 (0,15 г; 0,32 ммоль), тетрагидротиопиран-4-иламина(0,139 мл; 0,8 ммоль) в изопропаноле (2,5 мл) нагревали в герметично закрытом сосуде (например Reacti-vial) при 50 С в течение 19 ч. Летучие вещества выдували струй азота. Полученный остаток растворяли в ДМСО (0,6 мл). Одну шестую объема этого раствора переносили в другой герметично закрытый сосуд и добавляли этилендиамин (0,021 мл; 0,32 ммоль). Эту смесь нагревали при 90-92 С в течение 3 суток,охлаждали до комнатной температуры и разбавляли 50% водным этанолом. Добавляли 1 Нпиразолкарбоксамидина гидрохлорид (0,016 г; 0,11 ммоль) и имидазол (0,007 г; 0,11 ммоль). Смесь нагревали при 60 С в течение 4 суток. Добавляли еще 1 Н-пиразолкарбоксамидина гидрохлорида (0,016 г; 0,11 ммоль) и имидазола(0,007 г; 0,11 ммоль). Нагревание продолжали еще 4 суток. Летучие вещества выдували струй азота. Полученный сырой продукт очищали автопреп. ВЭЖХ с получением соединения, указанного в заголовке, после лиофилизации в виде 42 светло-коричневого твердого вещества (0,003 г). ЖХ/МС система Б Rt = 2,47 мин, m/z = 533 МН+. Пример 10. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-[6-(3-фтор-4-гидроксифениламино)-2-(2-пиперидин-1-илэтиламино)пурин-9 ил]тетрагидрофуран-3,4-диола диформиат. Смесь промежуточного соединения 3 (0,15 г; 0,32 ммоль), 3-фтор-4-гидроксианилина (0,045 г; 0,35 ммоль) и диизопропилэтиламина (0,139 мл; 0,8 ммоль) в изопропаноле (2,5 мл) нагревали в герметично закрытом сосуде (напримерReacti-vial) при 50 С в течение 19 ч. Летучие вещества выдували струй азота. Полученный остаток растворяли в ДМСО (0,6 мл). Одну шестую объема этого раствора переносили в другой герметично закрытый сосуд и добавляли 2 пиперидин-1-илэтиламин (0,041 г; 0,32 ммоль). Эту смесь нагревали при 90-92 С в течение 4 суток. Полученный сырой продукт очищали автопреп. ВЭЖХ с получением соединения, указанного в заголовке, после лиофилизации в виде белесоватого светло-коричневого твердого вещества (0,01 г). ЖХ/МС система A Rt = 3,53 мин, m/z = 569 МН+. Пример 11. 2-[9-[5S-(3-Этилизоксазол-5 ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]2-(2-пиперидин-1-илэтиламино)-9 Н-пурин-6 иламино]этансульфоновой кислоты метиламида диформиат. Соединение примера 11 получали аналогично примеру 10, используя 2-аминоэтилсульфоновой кислоты метиламид (0,048 г; 0,35 ммоль) и 2-пиперидин-1-илэтиламин (0,041 г; 0,32 ммоль) при 90 С в течение 4 суток. Соединение, указанное в заголовке, получали после лиофилизации в виде беловато-коричневого твердого вещества (0,011 г). ЖХ/МС система ARt = 3,41 мин, m/z = 580 МH+. Пример 12. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-[2-(2-пиперидин-1-илэтиламино)6-(тетрагидротиопиран-4-иламино)пурин-9-ил] тетрагидрофуран-3,4-диола диформиат. Соединение примера 12 получали аналогично примеру 10, используя тетрагидротиопиран-4-иламин (0,041 г; 0,35 ммоль) и 2 пиперидин-1-илэтиламин (0,041 г; 0,32 ммоль) при 90 С в течение 3 суток. Соединение, указанное в заголовке, получали после лиофилизации в виде беловато-коричневого твердого вещества (0,011 г). ЖХ/МС система Б Rt = 2,33 мин, m/z = 559 МH+. Пример 13. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-[2-(2-пиридин-2-илэтиламино)-6(тетрагидропиран-4-иламино)пурин-9-ил]тетрагидрофуран-3,4-диола диформиат. Соединение примера 13 получали аналогично примеру 10, используя тетрагидропиран 4-иламин (0,035 г; 0,35 ммоль) и 2-пиридин-2 илэтиламин (0,039 г; 0,32 ммоль) при 90 С в течение 10 суток. Соединение, указанное в заголовке, получали после лиофилизации в виде 43 коричневого твердого вещества (0,013 г). ЖХ/МС система Б Rt = 2,21 мин, m/z = 537 MH+. Пример 14. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-[2-(2-пиперидин-1-илэтиламино)6-(тетрагидропиран-4-иламино)пурин-9-ил]тетрагидрофуран-3,4-диола диформиат. Соединение примера 14 получали аналогично примеру 10, используя тетрагидропиран 4-иламин (0,035 г; 0,35 ммоль) и 2-пиперидин-1 ил-этиламин (0,041 г; 0,32 ммоль) при 90 С в течение 3 суток. Соединение, указанное в заголовке, получали после лиофилизации в виде коричневого твердого вещества (0,004 г). ЖХ/ МС система Б Rt = 2,17 мин, m/z = 543 MH+. Пример 15. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-[2-(1S-гидроксиметил-2-фенилэтиламино)-6-(тетрагидропиран-4-иламино)пурин-9-ил]тетрагидрофуран-3,4-диола формат. Соединение примера 15 получали аналогично примеру 10, используя тетрагидропиран 4-иламин (0,035 г; 0,35 ммоль) и (S)-(-)-2-амино 3-фенил-1-пропанол (0,048 г; 0,32 ммоль) при 90 С в течение 12 суток. Соединение, указанное в заголовке, получали после лиофилизации в виде желтоватого коричневого твердого вещества (0,015 г). ЖХ/МС система Б Rt = 2,64 мин,m/z =566 MH+. Пример 16. (2R,3R,4S,5S)-2-6-(2,2-Дифенилэтиламино)-2-[2-(пиридин-2-иламино)этиламино]пурин-9-ил-5-(3-этидизоксазол-5-ил) тетрагидрофуран-3,4-диола диформиат. Соединение примера 16 получали аналогично примеру 1, используя 2-(пиридин-2 иламино)-этиламин (0,047 г; 0,344 ммоль) при 92 С в течение 4 суток. Соединение, указанное в заголовке, получали после лиофилизации в виде коричневого твердого вещества (0,004 г). ЖХ/МС система Б Rt = 4,27 мин, m/z = 648 МН+. Пример 17. (2R,3R,4S,5S)-2-[6-(2,2-Дифенилэтиламино)-2-(1S-гидроксиметил-2-фенилэтиламино)пурин-9-ил]-5-(3-этилизоксазол-5 ил)-тетрагидрофуран-3,4-диола формиат. Соединение примера 17 получали аналогично примеру 1, используя (S)-(-)-2-амино-3 фенил-1-пропанол (0,104 г; 0,688 ммоль) при 92 С в течение 9 суток. Соединение, указанное в заголовке, получали после лиофилизации в виде коричневого твердого вещества (0,0054 г). ЖХ/МС система Б Rt = 4,67 мин, m/z = 662 МH+. Пример 18. 4-(2-6-Амино-9-[5S-(3-этилизоксазол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-9 Н-пурин-2-иламиноэтил)бензолсульфонамида формиат. К перемешиваемому раствору промежуточного соединения 3 (0,13 г; 0,28 ммоль) в тетрагидрофуране (10 мл) при -78 С в атмосфере азота газообразный аммоний (примерно 20 мл) конденсировали в эту реакционную смесь. Реакционную смесь перемешивали при комнатной температуре в течение ночи, выпаривали в вакууме до желтой пены (0,153 г). Одну шестую этого материала (0,0255 г) нагревали с 4-(2 003194 44 аминоэтил)бензолсульфонамидом (0,069 г; 0,344 ммоль) в ДМСО (0,2 мл) при 92 С в течение 4 суток. Полученный сырой продукт очищали автопреп. ВЭЖХ с получением соединения, указанного в заголовке, после лиофилизации в виде бледно-коричневого твердого вещества (0,002 г). ЖХ/МС система Б Rt = 3,47 мин, m/z = 531 МН+. Пример 19. (2R,3R,4S,5S)-2-[2-(транс-4 Аминоциклогексиламино)-6-(2,2-дифенилэтиламино)пурин-9-ил]-5-(3-этилизоксазол-5-ил)тетрагидрофуран-3,4-диола диформиат. Соединение примера 19 получали аналогично примеру 4, используя транс-циклогексан 1,4-диамин (0,032 г; 0,28 ммоль) при 90 С в течение 5 суток. Соединение, указанное в заголовке, получали после лиофилизации в виде бледно-коричневого твердого вещества (0,005 г). ЖХ/МС система Б Rt = 2,62 мин, m/z = 625 МH+. Пример 20. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-6-(3-иодбензиламино)-2-[2-(1 метил-1 Н-имидазол-4-ил)этиламино]пурин-9 илтетрагидрофуран-3,4-диола диформиат. Соединение примера 20 получали аналогично примеру 4, используя 3-иодбензиламин(0,013 г; 0,056 ммоль) и 2-(1-метил-1 Нимидазол-4-ил)этиламин (0,035 г; 0,28 ммоль; образован из соответствующего бисгидрохлорида путем нейтрализации небольшим недостатком твердого гидроксида натрия в метаноле и выпаривания любых летучих веществ под струй азота) при 90 С в течение 5 суток. Соединение, указанное в заголовке, получали после лиофилизации в виде бледно-коричневого твердого вещества (0,011 г). ЖХ/МС система ARt = 3,64 мин, m/z = 672 МН+. Пример 21. (2R,3R,4S,5S)-2-6-(2-Циклогексилэтиламино)-2-[2-(1-метил-1 Н-имидазол-4 ил)этиламино]пурин-9-ил-5-(3-этилизоксазол 5-ил)тетрагидрофуран-3,4-диола диформиат. Соединение примера 21 получали аналогично примеру 4, используя 2-циклогексилэтиламин (0,007 г; 0,056 ммоль) и 2-(1-метил 1 Н-имидазол-4-ил)этиламин (0,035 г; 0,28 ммоль; образован из соответствующего бисгидрохлорида путем нейтрализации небольшим недостатком твердого гидроксида натрия в метаноле и выпаривания любых летучих веществ под струй азота) при 90 С в течение 5 суток. Соединение, указанное в заголовке, получали после лиофилизации в виде бледно-коричневого твердого вещества (0,009 г). ЖХ/МС система ARt = 3,70 мин, m/z = 566 МН+. Пример 22. (2R,3R,4S,5S)-2-[6-(2-Циклогексилэтиламино)-2-(1S-гидроксиметил-2-фенилэтиламино)пурин-9-ил]-5-(3-этилизоксазол 5-ил)тетрагидрофуран-3,4-диола формиат. Соединение примера 22 получали аналогично примеру 4, используя 2-циклогексилэтиламин (0,007 г; 0,056 ммоль) и (S)-(-)-2 амино-3-фенил-1-пропанол (0,113 г; 0,75 ммоль) 45 при 90 С в течение 9 суток, а затем при 100 С в течение 3 суток. Соединение, указанное в заголовке, получали после лиофилизации в виде бледно-коричневого твердого вещества (0,006 г). ЖХ/МС система A Rt = 4,53 мин, m/z = 592(2R,3R,4S,5S)-2-[2-(2-Аминоэтиламино)-6(2,2-дифенилэтиламино)пурин-9-ил]-5-(3-этилизоксазол-5-ил)тетрагидрофуран-3,4-диола диформиат в виде бледно-коричневого твердого вещества (0,009 г) после лиофилизации получали аналогично примеру 4, используя этилен-1,2 диамин (0,017 г; 0,28 ммоль) при 90 С в течение 2 суток. ЖХ/МС система A Rt = 2,61 мин, m/z = 571 МH+. Этот амин нагревали с имидазолом (0,002 г; 0,03 ммоль) и 1 Н-пиразолкарбоксамидина гидрохлоридом (5 мг; 0,03 ммоль) в смеси воды(0,25 мл) и этанола (0,25 мл) при 62 С в течение 24 ч. Удалением растворителя получали остаток, который очищали автопреп. ВЭЖХ с получением соединения, указанного в заголовке,после лиофилизации в виде бледно-коричневого твердого вещества (0,001 г). ЖХ/МС система ARt = 3,84 мин, m/z = 613 MH+. Пример 24. N-(4-6-(2,2-Дифенилэтиламино)-9-[5S-(3-этилизоксазол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-9 Н-пурин-2 иламиноциклогексил)ацетамида формиат. Соединение примера 24 выделяли как побочный продукт примера 19. Соединение, указанное в заголовке, получали после лиофилизации в виде бледно-коричневого твердого вещества (0,003 г). ЖХ/МС система Б Rt = 3,02 мин,m/z = 667 MH+. Пример 25. 2-[9-[5S-(3-Этилизоксазол-5 ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]2-(2-гуанидиноэтиламино)-9 Н-пурин-6-иламино]этансульфоновой кислоты метиламида диформиат. Соединение примера 25 получали аналогично примеру 9, используя 2-аминоэтилсульфоновой кислоты метиламид (0,041 г; 0,35 ммоль). Соединение, указанное в заголовке, получали после лиофилизации в виде гигроскопичного коричневого твердого вещества (0,013 г). ЖХ/МС система A Rt = 3,38 мин, m/z = 554 МH+. Пример 26. N-(2-6-(1,1-Диоксогексагидро-1.лямбда.6-тиопиран-4-иламино)-9-[5S-(3 этилизоксазол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-9 Н-пурин-2-иламиноэтил) гуанидина диформиат. Соединение примера 26 получали аналогично примеру 9, используя 1,1-диоксогексагидро-1.лямбда.6-тиопиран-4-иламин (0,052 г; 0,35 ммоль) при 50 С в течение 4 суток, а затем с этилендиамином (0,021 мл; 0,32 ммоль) при 46 90 С в течение 5 суток. Соединение, указанное в заголовке, получали после лиофилизации в виде оранжево-коричневого твердого вещества(0,002 г). ЖХ/МС система Б Rt = 2,31 мин, m/z = 565 MH+. Пример 27. 2-[9-[5S-(3-Этилизоксазол-5 ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]2-(1S-гидроксиметил-2-фенилэтиламино)-9 Нпурин-6-иламино]этансульфоновой кислоты метиламида формиат. Соединение примера 27 получали аналогично примеру 10, используя 2-аминоэтилсульфоновой кислоты метиламид (0,048 г; 0,35 ммоль) и большой избыток (S)-(-)-2-амино-3 фенил-1-пропанола при 90 С в течение 12 суток. Соединение, указанное в заголовке, получали после лиофилизации в виде желтоватого коричневого твердого вещества (0,014 г). ЖХ/МС система A Rt = 3,88 мин, m/z = 603 МH+. Пример 28. 1-4-[9-[5S-(3-Этилизоксазол 5-ил)-3R,4S-дигидрокситетрагидрофуран-2Rил]-2-(1S-гидроксиметил-2-фенилэтиламино)9 Н-пурин-6-иламино]пиперидин-1-илэтанона формиат. Соединение примера 28 получали аналогично примеру 10, используя 1-(4-аминопиперидин-1-ил)этанон (0,050 г; 0,35 ммоль) и большой избыток(S)-(-)-2-амино-3-фенил-1-пропанола при 90 С в течение 12 суток. Соединение,указанное в заголовке, получали после лиофилизации в виде гигроскопичного коричневого твердого вещества (0,022 г). ЖХ/МС система БRt = 2,57 мин, m/z =607 MH+. Пример 29. 1-2-(транс-4-Аминоциклогексиламино)-9-[5S-(3-этилизоксазол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-9 Нпурин-6-иламинопиперидин-1-ил)этанона диформиат. Соединение примера 29 получали аналогично примеру 10, используя 1-(4-аминопиперидин-1-ил)этанон (0,050 г; 0,35 ммоль) и трансциклогексан-1,4-диамин (0,037 г; 0,32 ммоль) при 90 С в течение 3 суток. Соединение, указанное в заголовке, получали после лиофилизации в виде коричневого твердого вещества(0,013 г). ЖХ/МС система Б Rt = 2,09 мин, m/z = 570 MH+. Пример 30. (2R,3R,4S,5S)-2-(3-Этилизоксазол-5-ил)-5-[2-(2-пиридин-2-илэтиламино)-6(тетрагидротиопиран-4-иламино)пурин-9-ил] тетрагидрофуран-3,4-диола диформиат. Соединение примера 30 получали аналогично примеру 10, используя тетрагидротиопиран-4-иламин (0,037 г; 0,35 ммоль) и 2 пиридин-2-ил-этиламин (0,039 г; 0,32 ммоль),при 90 С в течение 7 суток. Соединение, указанное в заголовке, получали после лиофилизации в виде темно-коричневого твердого вещества (0,01 г). ЖХ/МС система Б Rt = 2,41 мин, m/z= 553 MH+. Пример 31. (2R,3R,4S,5S)-2-[6-(1,1-Диоксогексагидро-1.лямбда.6-тиопиран-4-иламино) 47 2-(2-пиперидин-1-илэтиламино)пурин-9-ил]-5(3-этилизоксазол-5-ил)тетрагидрофуран-3,4 диола диформиат. Соединение примера 31 получали аналогично примеру 10, используя 1,1-диоксогексагидро-1.лямбда.6-тиопиран-4-иламин(0,052 г; 0,35 ммоль) при 50 С в течение 4 суток и 2-пиперидин-1-ил-этиламин (0,041 г; 0,32 ммоль) при 90 С в течение 5 суток. Соединение,указанное в заголовке, получали после лиофилизации в виде светло-коричневого твердого вещества (0,006 г). ЖХ/МС система Б Rt = 2,17 мин, m/z = 591 MH+. Пример 32. (2R,3R,4S,5S)-2-[2-(транс-4 Аминоциклогексиламино)-6-(1,1-диоксогексагидро-1.дямбда.6-тиопиран-4-иламино)пурин-9 ил]-5-(3-этилизоксазол-5-ил)тетрагидрофуран 3,4-диола диформиат. Соединение примера 32 получали аналогично примеру 10, используя 1,1-диоксогексагидро-1.лямбда.6-тиопиран-4-иламин(0,052 г; 0,35 ммоль) при 50 С в течение 4 суток и транс-циклогексан-1,4-диамин (0,037 г; 0,32 ммоль) при 90 С в течение 5 суток. Соединение,указанное в заголовке, получали после лиофилизации в виде светло-коричневого твердого вещества (0,008 г). ЖХ/МС система Б Rt = 2,12 мин, m/z = 577 МH+. Примеры 33 А и Б. N-(2-6-(1-Ацетилпиперидин-4-иламино)-9-[5S-(3-этилизоксазол-5 ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]9 Н-пурин-2-иламиноэтил)гуанидин в смеси 1:1 с N-2-[9-[5S-(3-этилизоксазол-5-ил)-3R,4S-дигидрокситетрагидрофуран-2R-ил]-6-(пиперидин-4-иламино)-9 Н-пурин-2-иламино]этил гуанидинадиформиатом. Соединение примера 33 получали аналогично примеру 9, используя 1-(4-аминопиперидин-1-ил)этанон (0,050 г; 0,35 ммоль). Соединения, указанные в заголовке, в соотношении примерно 1:1 получали после лиофилизации в виде светло-коричневого твердого вещества(0,003 г). ЖХ/МС система Б Rt = 2,25 и 2,13 мин,m/z = 558 и 516 МН+. Примеры 34 А и Б. (2S,3S,4R,5R)-2-(3 Этилизоксазол-5-ил)-5-[2-(1S-гидроксиметил-2 фенилэтиламино)-6-(тетрагидротиопиран-4 иламино)пурин-9-ил]тетрагидрофуран-3,4-диол в смеси 1:1 с (2S,3S,4R,5R)-2-(3-этилизоксазол 5-ил)-5-[2-(1S-гидроксиметил-2-фенилэтиламино)-6-(1-оксо-гексагидро-1.лямбда.4-тиопиран 4-иламино)-пурин-9-ил]тетрагидрофуран-3,4 диола формиатом. Соединение примера 34 получали аналогично примеру 10, используя тетрагидротиопиран-4-иламин (0,052 г; 0,35 ммоль) и большой избыток (S)-(-)-2-амино-3-фенил-1 пропанола при 90 С в течение 12 суток. Соединения, указанные в заголовке, в смеси 1:1 получали после лиофилизации в виде оранжевокоричневого твердого вещества (0,008 г).(например Reacti-vial) при 90 С в течение 177,5 ч. Добавляли еще 3-(S)-(-)-2-амино-3 фенилпропанола (0,130 г; 0,89 ммоль) и нагревали при 90 С в течение 67 ч. Эту реакционную смесь разбавляли до объема 2 мл смесью 1:1 ацетонитрила и воды, содержащей 0,1% муравьиной кислоты, и очищали с использованием автопреп. ВЭЖХ с получением соединения, указанного в заголовке, после лиофилизации в виде твердого вещества кремового цвета (0,017 г). ЖХ/МС система Б Rt = 2,91 мин, m/z = 552 МH+. Пример 36. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-[6-(1-этилпропиламино)-2-(пирролидин-3R-иламино)пурин-9-ил]тетрагидрофуран-3,4-диола диформиат. Соединение примера 36 получали аналогично примеру 35, используя (3R)-(+)-3 аминопирролидин (0,117 г; 0,89 ммоль) при нагревании при 90 С в течение 177,5 ч с получением соединения, указанного в заголовке, после лиофилизации в виде твердого вещества бежевого цвета (0,020 г). ЖХ/МС система Б Rt = 2,35 мин, m/z = 487 МН+. Пример 37.(2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-[6-(1-этилпропиламино)-2-(2 пиридин-2-ил-этилиламино)пурин-9-ил]тетрагидрофуран-3,4-диола диформиат. Соединение примера 37 получали аналогично примеру 36 с использованием 2-(2 аминоэтил)пиридина (0,110 г; 0,89 ммоль) при нагревании при 90 С в течение 177,5 ч с получением соединения, указанного в заголовке. после лиофилизации в виде твердого вещества бежевого цвета (0,020 г). ЖХ/МС система Б Rt = 2,44 мин, m/z = 523 МН+. Пример 38. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-[6-(1-этилпропиламино)-2-(2 морфолин-4-ил-этиламино)пурин-9-ил]тетрагидрофуран-3,4-диола диформиат. Промежуточное соединение 14 (0,020 г; 0,045 ммоль) и 2-этиламиноморфолин (0,060 г; 0,46 ммоль) в ДМСО (0,5 мл) нагревали при 90 С в герметично закрытом сосуде (напримерReacti-vial) в течение 19 ч. Эту реакционную смесь разбавляли до объема 2 мл смесью 1:1 ацетонитрила и воды, содержащей 0,1% муравьиной кислоты, и очищали с использованием автопреп. ВЭЖХ с получением соединения, указанного в заголовке, после лиофилизации в виде твердого вещества бежевого цвета (0,017 г). ЖХ/МС система A Rt = 3,57 мин, m/z = 531 49 Пример 39. (2R,3R,4S,5S)-2-[2-(транс-4 Аминоциклогексиламино)-6-(1-этилпропиламино)пурин-9-ил]-5-(3-этилизоксазол-5-ил)тетрагидрофуран-3,4-диола диформиат. Соединение примера 39 получали аналогично примеру 35, используя транс-1,4 диаминоциклогексан (0,101 г; 0,89 ммоль) при нагревании при 90 С в течение 177,5 ч. Дополнительным добавлением транс-1,4-диаминоциклогексана (0,101 г; 0,89 ммоль) с дальнейшим нагреванием при 90 С в течение 67 ч получали соединение, указанное в заголовке, после лиофилизации в виде твердого вещества коричневого цвета (0,017 г). ЖХ/МС система Б Rt = 2,21 мин, m/z =515 MH+. Пример 40. N-2-[9-[5S-(3-Этилизоксазол 5-ил)-3R,4S-дигидрокситетрагидрофуран-2Rил]-6-(1-этилпропиламино)-9 Н-пурин-2-иламино]этилгуанидина диформиат. Соединение примера 40 получали аналогично примеру 35, используя этилендиамин(0,054 г; 0,89 ммоль) при нагревании при 90 С в течение 86,5 ч. К этой реакционной смеси добавляли имидазол (0,061 г; 0,89 ммоль) и 1 Нпиразолкарбоксамидина гидрохлорид (0,132 г; 0,89 ммоль) и нагревали ее при 90 С в течение 18 ч с получением соединения, указанного в заголовке, после лиофилизации в виде твердого вещества кремового цвета (0,015 г). ЖХ/МС система A Rt = 3,45 мин, m/z = 503 MH+. Пример 41. (2R,3R,4S,5S)-2-[6-(3,3-Диметилбутиламино)-2-(2-пиперидин-1-илэтиламино)пурин-9-ил]-5-(3-этилизоксазол-5-ил)тетрагидрофуран-3,4-диола диформиат. Промежуточное соединение 3 (0,025 г),3,3-диметилбутиламин (0,005 г), N,N-диизопропилэтиламин (0,007 г) в изопропаноле (0,7 мл) оставляли стоять при комнатной температуре в течение 16 ч. Растворитель удаляли, добавляли 2-пиперидиноэтиламин (0,05 мл) и диметилсульфоксид (0,05 мл), и эту смесь нагревали в герметично закрытом сосуде (например Reacti-vial) при 90 С в течение 32 ч. Добавляли 2-пиперидиноэтиламин (0,05 мл), и эту смесь нагревали при 110 С еще 16 ч. Очисткой автопреп. ВЭЖХ с последующей лиофилизацией получали соединение, указанное в заголовке, в виде желтого твердого вещества (0,005 г). ЖХ/МС система A Rt = 3,52 мин, m/z = 543 МН+. Пример 42. (2R,3R,4S,5S)-2-[6-(3,3-диметилбутиламино)-2-(2-морфолин-4-илэтиламино) пурин-9-ил]-5-(3-этил-изоксазол-5-ил)тетрагидрофуран-3,4-диола диформиат. Соединение примера 42 получали аналогично примеру 41, используя 4-(2-аминоэтил) морфолин (0,05 мл) при 90 С в течение 32 ч. Добавляли еще 4-(2-аминоэтил)морфолина (0,05 мл), и эту смесь нагревали при 110 С в течение 16 ч. Соединение, указанное в заголовке, получали после лиофилизации в виде бледно 003194 50 коричневого твердого вещества (0,004 г). ЖХ/МС система Б Rt = 2,48 мин, m/z = 545 МН+. Пример 43. (2R,3R,4S,5S)-2-6-Бензиламино-2-[2-(1-метил-1 Н-имидазол-4-ил)этиламино]пурин-9-ил-5-(3-этилизоксазол-5-ил)тетрагидрофуран-3,4-диола диформиат. Соединение примера 43 получали аналогично примеру 41, используя бензиламин (0,006 г) при комнатной температуре в течение 16 ч,затем 2-(1-метил-1 Н-имидазол-4-ил)этиламин(0,033 г), и эту смесь нагревали при 110 С в течение 16 ч. Соединение, указанное в заголовке,получали после лиофилизации в виде твердого вещества кремового цвета (0,009 г). ЖХ/МС система A Rt = 3,43 мин, m/z = 546 MH+. Пример 44. (2R,3R,4S,5S)-2-[6-Бензиламино-2-(2-пиперидин-1-ил-этиламино)пурин-9 ил]-5-(3-этилизоксазол-5-ил)тетрагидрофуран 3,4-диола диформиат. Соединение примера 44 получали аналогично примеру 41, используя бензиламин (0,006 г) при комнатной температуре в течение 16 ч,затем 2-пиперидиноэтиламин (0,05 мл) при 90 С в течение 32 ч. Добавляли еще 2-пиперидиноэтиламина (0,05 мл), и эту смесь нагревали при 110 С в течение 16 ч. Соединение, указанное в заголовке, получали после лиофилизации в виде бледно-желтого твердого вещества (0,005 г). ЖХ/МС система Б Rt = 2,48 мин, m/z = 549 МH+. Пример 45. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-[6-(1S-гидроксиметил-2-фенилэтиламино)-2-(2-пиперидин-1-илэтиламино)пурин-9-ил]тетрагидрофуран-3,4-диола диформиат. Соединение примера 45 получали аналогично примеру 41, используя (S)-(-)-2-амино-3 фенил-1-пропанол (0,008 г) при комнатной температуре в течение 16 ч, затем 2-пиперидиноэтиламин (0,05 мл) при 90 С в течение 32 ч. Добавляли еще 2-пиперидиноэтиламина (0,05 мл), и эту смесь нагревали при 110 С в течение 16 ч. Соединение, указанное в заголовке, получали после лиофилизации в виде бледножелтого твердого вещества (0,006 г). ЖХ/МС система Б Rt = 2,40 мин, m/z = 593 МH+. Пример 46. (2R,3R,4S,5S)-2-[2-(Циклопентиламино)-6-(1-этилпропиламино)пурин-9-ил]5-(3-этилизоксазол-5-ил)тетрагидрофуран-3,4 диола формиат. Промежуточное соединение 14 (0,206 г; 0,471 ммоль) растворяли в сухом ДМСО (2,2 мл). Аликвоту этого раствора (0,1 мл; 0,021 ммоль) добавляли к циклопентиламину (0,011 г; 0,126 ммоль) в герметично закрытом сосуде емкостью 1 мл (например Reacti-vial). Смесь нагревали при 90 С в течение 114,75 ч. Полученный сырой продукт очищали автопреп. ВЭЖХ с получением соединения, указанного в заголовке, после лиофилизации в виде белогоRt = 3,07 мин, m/z = 486 МН+. Пример 47. (2R,3R,4S,5S)-2-[2-(3,4-Диметоксифенилэтиламино)-6-(1-этилпропиламино) пурин-9-ил]-5-(3-этилизоксазол-5-ил)тетрагидрофуран-3,4-диола формиат. Соединение примера 47 получали аналогично примеру 46, используя 3,4-диметоксифенилэтиламин (0,023 г; 0,126 ммоль) при 90 С в течение 73,5 ч. Соединение, указанное в заголовке, получали после лиофилизации в виде белого твердого вещества (0,003 г). ЖХ/МС система A Rt = 4,28 мин, m/z = 582 MH+. Пример 48. (2R,3R,4S,5S)-2-[2-(4-Тетрагидропираниламино)-6-(1-этилпропиламино) пурин-9-ил]-5-(3-этилизоксазол-5-ил)тетрагидрофуран-3,4-диола формиат. Соединение примера 48 получали аналогично примеру 46, используя тетрагидропиран 4-иламин (0,013 г; 0,126 ммоль) при 90 С в течение 204,75 ч. Добавляли еще тетрагидропиран-4-иламина (0,013 г; 0,126 ммоль). Смесь нагревали при 110 С еще 67 ч. Соединение, указанное в заголовке, получали после лиофилизации в виде светло-коричневого твердого вещества (0,001 г). ЖХ/МС система Б Rt = 2,73 мин, m/z = 502MH+. Пример 49. (2R,3R,4S,5S)-2-[2-(1-Бензилпирролидин-3S-1-иламино)-6-(1-этилпропиламино)пурин-9-ил]-5-(3-этилизоксазол-5-ил) тетрагидрофуран-3,4-диола формат. Соединение примера 49 получали аналогично примеру 46, используя (3S)-(+)-1-бензил 3-аминопирролидин (0,022 г; 0,126 ммоль) при 90 С в течение 204,75 ч. Соединение, указанное в заголовке, получали после лиофилизации в виде светло-коричневого твердого вещества(0,081 г; 0,96 ммоль) при комнатной температуре. Дополнительное количество реагентов [Nгидрокси-2-гидроксииминоацетимидоилхлорида(0,032 г; 0,26 ммоль), твердого бикарбоната натрия (0,162 г; 1,92 ммоль) и воды (0,1 мл)] добавляли на 169,5 ч и следующие 4 суток. После следующих 20 ч эту реакционную смесь разбавляли водой (5 мл), экстрагировали этилацетатом(2 х 3 мл). Объединенный органический раствор выпаривали до коричневой смолы. Полученный сырой продукт очищали автопреп. ВЭЖХ с получением соединения, указанного в заголовке, 003194Rt = 2,25 мин, m/z = 541 МH+. Пример 51. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-[6-(1S-гидроксиметил-2-фенилэтиламино)-2-(2-морфолин-4-илэтиламино)пурин-9-ил]тетрагидрофуран-3,4-диола диформиат. Промежуточное соединение 3 (0,025 г),(S)-(-)-2-амино-3-фенил-1-пропанол (0,008 г),N,N-диизопропилэтиламин (0,007 г) в изопропаноле (0,7 мл) оставляли стоять при комнатной температуре в течение 16 ч. Растворитель удаляли в вакууме, добавляли 4-(2-аминоэтил) морфолин (0,05 мл) и ДМСО (0,05 мл), и эту смесь нагревали в герметично закрытом сосуде(например Reacti-vial) при 90 С в течение 32 ч. Добавляли 4-(2-аминоэтил)морфолин (0,05 мл), и эту смесь нагревали при 110 С еще 16 ч. Очисткой автопреп. ВЭЖХ с последующей лиофилизацией получали соединение, указанное в заголовке, в виде белого твердого вещества(0,004 г). ЖХ/МС система Б Rt = 2,40 мин, m/z = 595 MH+. Пример 52. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-[6-бензиламино-2-(2-пиридин-2 илэтиламино)пурин-9-ил]тетрагидрофуран-3,4 диола формиат. Промежуточное соединение 3 (0,025 г),бензиламин (0,006 г), N,N-диизопропилэтиламин (0,007 г) в изопропаноле (0,7 мл) оставляли стоять при комнатной температуре в течение 16 ч. Растворитель удаляли в вакууме,добавляли 2-(2-аминоэтил)пиридин (0,05 мл) и диметилсульфоксид (0,05 мл), и эту смесь нагревали в герметично закрытом сосуде (например Reacti-vial) при 90 С в течение 32 ч. Добавляли 4-(2-аминоэтил)морфолин (0,05 мл), и эту смесь нагревали при 110 С еще 16 ч. Очисткой автопреп. ВЭЖХ с последующей лиофилизацией получали соединение, указанное в заголовке, в виде твердого вещества кремового цвета (0,002 г). ЖХ/МС система Б Rt = 2,56 мин,m/z = 543 МH+. Пример 53. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-6-(1-этилпропиламино)-2-[2(пиридин-2-иламино)этиламино]пурин-9-ил тетрагидрофуран-3,4-диола диформиат. Соединение примера 53 получали аналогично примеру 46, используя 2-(пиридин-2 иламино)этиламин (0,017 г; 0,126 ммоль) при 90 С в течение 73,5 ч. Соединение, указанное в заголовке, получали после лиофилизации в виде белого твердого вещества (0,005 г). ЖХ/МС система A Rt = 3,41 мин, m/z = 538 МН+. Пример 54. (2R,3R,4S,5S)-2-[6-(1-Этилпропиламино)-2-(2-пиперидин-1-илэтиламино)пурин-9-ил]-5-[3-(1-гидроксиэтил)изоксазол-5-ил]тетрагидрофуран-3,4-диола диформиат. Соединение примера 54 получали аналогично примеру 67, используя промежуточное соединение 23 (0,022 г; 0,04 ммоль). Соедине 53 ние, указанное в заголовке, получали после лиофилизации в виде светло-коричневого твердого вещества (0,004 г). ЖХ/МС система A Rt = 3,25 мин, m/z = 545 МН+. Пример 55. (2R,3R,4S,5S)-2-[6-(1-Этилпропиламино)-2-(2-пиперидин-1-илэтиламино) пурин-9-ил]-5-(3-метилизоксазол-5-ил)тетрагидрофуран-3,4-диола диформиат. Соединение примера 55 получали аналогично примеру 67, используя промежуточное соединение 20 (0,022 г; 0,045 ммоль) при 9095 С в течение 57 ч. Соединение, указанное в заголовке, получали после лиофилизации в виде кремово-белого твердого вещества (0,008 г). ЖХ/МС система A Rt = 3,38 мин, m/z =515 MH+. Пример 56. (2R,3R,4S,5S)-2-[6-(1-Этилпропиламино)-2-(2-пиперидин-1-илэтиламино)пурин-9-ил]-5-(3-пропилизоксазол-5-ил)тетрагидрофуран-3,4-диола диформиат. Соединение примера 56 получали аналогично примеру 67, используя промежуточное соединение 21 (0,027 г; 0,045 ммоль) при 9095 С в течение 57 ч. Соединение, указанное в заголовке, получали после лиофилизации в виде кремово-белого твердого вещества (0,01 г). ЖХ/МС система A Rt = 3,60 мин, m/z = 543 МH+. Пример 57. (2R,3R,4S,5S)-2-[6-(1-Этилпропиламино)-2-(2-пиперидин-1-ил-этиламино) пурин-9-ил]-5-(3-гидроксиметилизоксазол-5 ил)тетрагидрофуран-3,4-диола диформиат. Соединение примера 57 получали аналогично примеру 67, используя промежуточное соединение 24 (0,028 г; 0,051 ммоль) при 95 С в течение 16,5 ч. Соединение, указанное в заголовке, получали после лиофилизации в виде коричневого твердого вещества (0,002 г). ЖХ/МС система A Rt = 3,21 мин, m/z = 531 МH+. Пример 58. (2R,3R,4S,5S)-2-6-(1-Этилпропиламино)-2-[2-(1-метил-1 Н-имидазол-4 ил)этиламино]пурин-9-ил-5-[3-(1-гидроксиэтил)изоксазол-5-ил]тетрагидрофуран-3,4-диола диформиат. Смесь промежуточного соединения 23(0,022 г; 0,04 ммоль) и 2-(1-метил-1 Н-имидазол 4-ил)этиламина (0,038 г; 0,3 ммоль; получен из соответствующего бисгидрохлорида путем нейтрализации небольшим недостатком твердого гидроксида натрия в метаноле и выпаривания любых летучих веществ под струй азота) растворяли в сухом ДМСО (0,1 мл) в герметично закрытом сосуде (например Reacti-vial). Смесь нагревали при 110 С в течение 28,5 ч. Полученный сырой продукт очищали автопреп. ВЭЖХ с получением соединения, указанного в заголовке, после лиофилизации в виде светло-коричневого твердого вещества (0,001 г). ЖХ/МС система A Rt = 3,17 мин, m/z = 542 МH+. Пример 59. (2R,3R,4S,5S)-2-6-(1-Этилпропиламино)-2-[2-(1-метил-1 Н-имидазол-4-ил) 54 этиламино]пурин-9-ил-5-(3-метилизоксазол-5 ил)тетрагидрофуран-3,4-диола диформиат. Соединение примера 59 получали аналогично примеру 58, используя промежуточное соединение 20 (0,022 г; 0,045 ммоль) при 110 С в течение 28,5 ч. Соединение, указанное в заголовке, получали после лиофилизации в виде коричневого твердого вещества (0,019 г). ЖХ/МС система A Rt = 3,23 мин, m/z = 512MH+. Пример 60. (2R,3R,4S,5S)-2-6-(1-Этилпропиламино)-2-[2-(1-метил-1 Н-имидазол-4-ил) этиламино]пурин-9-ил-5-(3-пропилизоксазол 5-ил)тетрагидрофуран-3,4-диола диформиат. Соединение примера 60 получали аналогично примеру 58, используя промежуточное соединение 21 (0,027 г; 0,045 ммоль) при 110 С в течение 28,5 ч. Соединение, указанное в заголовке, получали после лиофилизации в виде кремово-белого твердого вещества (0,011 г). ЖХ/МС система A Rt = 3,42 мин, m/z = 540MH+. Пример 61. (2R,3R,4S,5S)-2-6-(1-Этилпропиламино)-2-[2-(1-метил-1 Н-имидазол-4-ил) этиламино]пурин-9-ил-5-(3-гидроксиметилизоксазол-5-ил)тетрагидрофуран-3,4-диола диформиат. Соединение примера 61 получали аналогично примеру 58, используя промежуточное соединение 24 (0,028 г; 0,051 ммоль) при 110 С в течение 16,5 ч. Смесь промежуточного соединения 24 (0,028 г; 0,051 ммоль) и 2-(1-метил-1 Нимидазол-4-ил)этиламина (0,038 г; 0,3 ммоль; получен из соответствующего бисгидрохлорида путем нейтрализации небольшим недостатком твердого гидроксида натрия в метаноле и выпаривания любых летучих веществ под струй азота) растворяли в сухом ДМСО (0,1 мл) в герметично закрытом сосуде (например Reactivial). Эту смесь нагревали при 110 С в течение 16,5 ч. Полученный сырой продукт очищали автопреп. ВЭЖХ с получением соединения, указанного в заголовке, после лиофилизации в виде коричневого твердого вещества (0,007 г). ЖХ/МС система A Rt = 3,12 мин, m/z = 528 МН+. Пример 62. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-6-(1S-гидроксиметил-2-фенилэтиламино)-2-[2-(пиридин-2-иламино)этиламино]пурин-9-илтетрагидрофуран-3,4-диола диформиат. Промежуточное соединение 26 (0,110 г; 0,22 ммоль) растворяли в сухом ДМСО (2,5 мл). Аликвоту этого раствора (0,5 мл; 0,44 ммоль) добавляли к промежуточному соединению 27(0,060 г; 0,44 ммоль) в герметично закрытом сосуде (например Reacti-vial). Смесь нагревали при 90 С в течение 80 ч. Очисткой с использованием автопреп. ВЭЖХ получали соединение, указанное в заголовке, после лиофилизации 55 в виде беловатого твердого вещества (0,016 г). ЖХ/МС система A Rt = 3,52 мин, m/z = 602 МН+. Пример 63. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-[6-(1S-гидроксиметил-2-фенилэтиламино)-2-(2-пирролидин-1-илэтиламино)пурин 9-ил]тетрагидрофуран-3,4-диола диформиат. Соединение примера 63 получали аналогично примеру 62, используя 1-(2-аминоэтил) пирролидин (0,050 г; 0,44 ммоль) при 90 С в течение 80 ч. Соединение, указанное в заголовке, получали после лиофилизации в виде белого твердого вещества (0,024 г). ЖХ/МС система ARt = 3,43 мин, m/z = 579 MH+. Пример 64. (2R,3R,4S,5S)-2-[2-(2-Аминоэтиламино)-6-(1S-гидроксиметил-2-фенилэтиламино)пурин-9-ил]-5-(3-этилизоксазол-5-ил) тетрагидрофуран-3,4-диола диформиат. Соединение примера 64 получали аналогично примеру 62, используя этилендиамин(0,026 г; 0,44 ммоль) при 90 С в течение 20 ч. Соединение, указанное в заголовке, получали после лиофилизации в виде беловатого твердого вещества (0,018 г). ЖХ/МС система A Rt = 3,36 мин, m/z = 525 МН+. Пример 65. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-[6-(3-иодбензиламино)-2-(2-пиперидин-1-илэтиламино)пурин-9-ил]тетрагидрофуран-3,4-диола диформиат. Промежуточное соединение 25 (0,015 г; 0,026 ммоль), растворенное в сухом ДМСО (1,0 мл), добавляли к 2-пиперидиноэтиламину (0,016 г; 0,13 ммоль) в герметично закрытом сосуде(например Reacti-vial). Смесь нагревали при 90 С в течение 76 ч. Очисткой с использованием автопреп. ВЭЖХ получали соединение, указанное в заголовке, после лиофилизации в виде не совсем белого твердого вещества (0,003 г). ЖХ/МС система A Rt = 4,56 мин, m/z = 592 МH+. Пример 66. (2R,3R,4S,5S)-2-[2-Этиламино 6-(3-иодбензиламино)пурин-9-ил]-5-(3-этилизоксазол-5-ил)-тетрагидрофуран-3,4-диола формиат. Соединение примера 66 получали аналогично примеру 65, используя этиламин (0,017 г; 0,44 ммоль, 70 мас.% раствор в воде) при 90 С в течение 76 ч. Соединение, указанное в заголовке, получали после лиофилизации в виде беловатого твердого вещества (0,004 г). ЖХ/МС система A Rt = 3,64 мин, m/z = 675 МH+. Пример 67. (2S,3S,4R,5R)-2-(3-Бромизоксазол-5-ил)-5-[6-(1-этилпропиламино)-2-(2-пиперидин-1-илэтиламино)пурин-9-ил]тетрагидрофуран-3,4-диола диформиат. Смесь промежуточного соединения 18(0,021 г; 0,037 ммоль) и пиперидин-1-ил-2 этиламина (0,038 г; 0,3 ммоль) растворяли в сухом ДМСО (0,1 мл) в герметично закрытом сосуде (например Reacti-vial). Смесь нагревали при 90 С в течение 28,5 ч. Полученный сырой 56 продукт очищали автопреп. ВЭЖХ с получением соединения, указанного в заголовке, после лиофилизации в виде кремово-белого твердого вещества (0,003 г). ЖХ/МС система A Rt = 3,48 мин, m/z = 579 MH+ для C24H3579BrN8O4. Пример 68. 5-(5R-6-(1-Этилпропиламино)-2-[2-(1-метил-1 Н-имидазол-4-ил)этиламино] пурин-9-ил-3S,4R-дигидрокситетрагидрофуран-2S-ил)изоксазол-3-карбоновой кислоты этилового эфира диформиат. Соединение примера 68 получали аналогично примеру 50, используя хлоргидроксииминоуксусной кислоты этиловый эфир (0,02 г; 0,13 ммоль) и твердый бикарбонат натрия (0,081 г; 0,96 ммоль). Дополнительные реагенты [хлоргидроксииминоуксусной кислоты этиловый эфир (0,128 г; 0,845 ммоль), твердый бикарбонат натрия (0,322 г; 3,83 ммоль) и воду (0,1 мл)] добавляли на 169,5 ч и дополнительные реагенты [хлоргидроксииминоуксусной кислоты этиловый эфир (0,04 г; 0,26 ммоль) и твердый бикарбонат натрия (0,162 г; 1,92 ммоль)] добавляли в следующие 4 дня. Соединение, указанное в заголовке, получали после лиофилизации в виде светло-коричневого твердого вещества (0,002 г). ЖХ/МС система В Rt = 2,39 мин, m/z = 570 МH+. Пример 69. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-[6-(1S-гидроксиметил-2-метилпропиламино)-2-(2-пирролидин-1-ил-этиламино)пурин-9-ил]тетрагидрофуран-3,4-диола диформиат. Промежуточное соединение 29 (0,113 г; 0,25 ммоль) растворяли в сухом ДМСО (7 мл). Аликвоту этого раствора (1 мл; 0,036 ммоль) добавляли к 1-(2-аминоэтил)пирролидину (0,041 г; 0,36 ммоль) в герметично закрытом сосуде(например Reacti-vial). Смесь нагревали при 90 С в течение 90 ч. Очисткой с использованием автопреп. ВЭЖХ получали соединение, указанное в заголовке, после лиофилизации в виде коричневой смолы (0,005 г). ЖХ/МС система ВRt = 2,20 мин, m/z = 531 MH+. Пример 70. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-[6-(1S-гидроксиметил-2-метилпропиламино)-2-(2-пиперидин-1-илэтиламино) пурин-9-ил]тетрагидрофуран-3,4-диола диформиат. Соединение примера 70 получали аналогично примеру 69, используя 2-пиперидиноэтиламин (0,044 г; 0,36 ммоль) при 90 С в течение 90 ч. Соединение, указанное в заголовке,получали после лиофилизации в виде коричневой смолы (0,009 г). ЖХ/МС система В Rt = 3,39 мин, m/z = 545 MH+. Пример 71: (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-6-(1S-гидроксиметил-2-метилпропиламино)-2-[2-(пиридин-2-иламино)этиламино]пурин-9-илтетрагидрофуран-3,4-диола диформиат. Соединение примера 71 получали аналогично примеру 69, используя промежуточное 57 соединение 27 (0,049 г; 0,36 ммоль) при 90 С в течение 159 ч. Соединение, указанное в заголовке, получали после лиофилизации в виде бледно-коричневой пены (0,011 г). ЖХ/МС система В Rt = 3,39 мин, m/z = 554 MH+. Пример 72. (2S,3S,4R,5R)-2-(3-Этилизоксазол-5-ил)-5-6-(1S-гидроксиметил-2-метилпропиламино)-2-(1S-гидроксиметил-2-фенилэтиламино)пурин-9-илтетрагидрофуран-3,4 диола диформиат. Соединение примера 72 получали аналогично примеру 69, используя 3-S-(-)-2-амино-3 фенил-пропанол (0,054 г; 0,36 ммоль) при 90 С в течение 159 ч. Соединение, указанное в заголовке, получали после лиофилизации в виде желтой пены(0,006 г). ЖХ/МС система В Rt = 2,79 мин, m/z = 568 МH+. Биологические данные Соединения примеров тестировали в скрининге (1) (агонистическая активность против подтипов рецепторов), и полученные результаты были следующие: ПримерА 2 а 58 37 2,65 207 136,56 38 5,29 737 44,1 39 2,12 85 86,8 40 3,38 88 70,53 41 27,39 395 2907,96 42 41,06 395 1369,08 43 3,53 335 672,4 44 10,3 221 725,4 45 1,93 189 54,04 46 20,06 518 148,72 47 10,42 363 148,34 48 11,48 363 177,71 49 7,79 350 28,28 50 7,26 113 6188 51 4,86 340 22,53 52 21,63 340 1359,98 53 2,11 229 128,9 54 0,066 350 10,18 55 0,175 353 155,3 56 5,19 525 101,31 57 0,79 525 80,76 58 0,244 525 812,2 59 0,13 385 194,3 60 4,53 155,86 248,4 61 0,09 314 38,58 62 1,03 303 21,37 63 10,57 262 148,43 64 16,03 262 44,21 65 4,74 262 128,27 66 8,32 262 189,98 67 2,59 238 219,1 68 30,23 113 60,30 69 23,73 180 298,75 70 27,39 184 149,86 71 12,75 184 79,51 72 5,39 158 23,79 Значения, приведенные в таблице, представляют собой значения EC50 в виде отношения к значению EC50 NЭKA. ТМСТФС ТГП ТМС ТФУ ДМФ ГМДСNЭKA ДМАП ТЕМПО ТМСТФС ДБУ БСА ДХМ ДАСТPh КДИ НСПВЛС ТГФ Ас Сокращения Триметилсилилтрифторметилсульфонат Тетрагидропиран Триметилсилил Трифторуксусная кислотаN-Этилкарбоксамидаденозин 4-Диметиламинопиридин 2,2,6,6-Тетраметил-1-пиперидинилокси, свободный радикал Триметилсилилтрифторметилсульфонат 1,8-Диазабицикло[5.4.0]ундец-7-ен Бистриметилсилилацетамид Дихлорметан Диэтиламиносератрифторид Фенил Карбонилдиимидазол Нестероидное противовоспалительное лекарственное средство Тетрагидрофуран Ацетил (СН 3 СО) Метил Этил Диметилсульфоксид где R1 и R2 независимо представляют собой группу, выбранную из(10) С 3-8 циклоалкил, независимо замещенный одной или более чем одной группой или такая группа, в которой один атом углерода метилена, соседний с X, или оба, если таковые существуют, замещены метилом;Z представляет собой -COO(CH2)lH; а и b независимо представляют собой целое число от 0 до 4 при условии, что а+b находится в пределах от 3 до 5;f представляет собой 2 или 3, а g представляет собой целое число от 0 до 2; р представляет собой 0 или 1;q представляет собой целое число от 0 до 3;h представляет собой целое число от 0 до 2;i представляет собой такое целое число от 0 до 2, что h+i находится в пределах от 0 до 3;j представляет собой такое целое число от 0 до 2, что h+i+j находится в пределах от 0 до 3;l представляет собой такое число 1 или 2,что k+l находится в пределах от 1 до 2;u и v независимо представляют собой такое число 0 или 1, что k+u+v находится в пределах от 0 до 1;R4 и R5 независимо представляют собой водород, C1-6 алкил, арил, арилС 1-6 алкил- илиNR4R5 вместе может представлять собой пири 003194R7 представляет собой водород, -C1-6 алкил, -C1-6 алкиларил или -СОСН 3. 3. Соединение формулы (I) по п.1 или 2,где R1 и R2 оба не представляют собой водород. 4. Соединение формулы (I) по любому из пп.1-3, где R1 представляет собой С 3-8 циклоалкил-, арил 2 СНСН 2-, арилС 1-6 алкил-, C1-8 алкил-,арил, -(СН 2)fSO2NНg(С 1-4 алкил)2-g, тетрагидропиран-n-ил или тетрагидротиопиран-n-ил, где n является числом 3 или 4, С 3-8 циклоалкилС 1-6 алкил-, водород или R4R5N-С 1-6 алкил-, где NR4R5 вместе представляет собой пиперидинил или морфолинил. 5. Соединение формулы (I) по любому из пп.1-3, где R1 представляет собой С 1-6 алкилСН(СН 2OН)-, 1,1-диоксогексагидро-16-тиопиран-4-ил,N-ацетилпиперидин-4-ил,1Sгидроксиметил-2-фенилэтил, пиперидин-4-ил и 1-оксогексагидро-14-тиопиран-4-ил. 6. Соединение формулы (I) по любому из пп.1-3, где R1 представляет собой -СН 2 СНРh2,-CH(Et)2 или фенилэтил. 7. Соединение формулы (I) по любому из пп.1-6, где R2 представляет собой -C1-6 алкилОН, Н 2NС(=NН)NНС 1-6 алкил-, R4R5NС 1-6 алкил-,где NR4R5 вместе представляет собой пиридинил, пиперидинил, морфолинил или 2-(1-метил 1 Н-имидазол-4-ил), арилС 1-5 алкилСН(СН 2 ОН)-,арил, С 3-8 циклоалкилС 1-6 алкил-, тетрагидро-1,1 диоксид тиофен-3-ил, С 3-8 циклоалкил, С 1-6 алкил-СН(СН 2OН)-, арилС 1-6 алкил-, пирролидин 3-ил, 2-оксопирролидин-4-ил, 2-оксопирролидин-5-ил, пиперидин-3-ил, арилС 1-6 алкил, С 3-8 циклоалкил, независимо замещенный одной или более чем одной группой -(CH2)pR6, или пиперидин-4-ил, в котором кольцевой атом азота возможно замещен C1-6 алкилом. 8. Соединение формулы (I) по любому из пп.1-6, где R2 представляет собой С 1-8 алкил илиR4R5NС 1-6 алкил-, где R4 и R5 независимо представляют собой водород или арил, либо R4R5N вместе представляет собой пирролидинил. 9. Соединение формулы (I) по любому из пп.1-6, где R2 представляет собой пиперидин-1 илэтил или 2-(1-метил-1 Н-имидазол-4-ил)этил. 10. Соединение формулы (I) по любому из пп.1 и 3-9, где R3 представляет собой -CH=NOH,-СООСН 3, -СООСН 2 СН 3, -СН 2OН, -СН(ОН)СН 3 или галоген.
МПК / Метки
МПК: A61P 29/00, A61K 31/52, C07H 19/167, C07D 473/32
Метки: заболеваний, 2-(пурин-9-ил)-тетрагидрофуран-3,4-диола, производные, композиция, фармацевтическая, способы, способ, профилактики, воспалительных, лечения, получения, применением
Код ссылки
<a href="https://eas.patents.su/30-3194-proizvodnye-2-purin-9-il-tetragidrofuran-34-diola-sposoby-ih-polucheniya-farmacevticheskaya-kompoziciya-i-sposob-lecheniya-ili-profilaktiki-vospalitelnyh-zabolevanijj-s-ih-primenen.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2-(пурин-9-ил)-тетрагидрофуран-3,4-диола, способы их получения, фармацевтическая композиция и способ лечения или профилактики воспалительных заболеваний с их применением</a>












