Азотсодержащие гетероароматические соединения в качестве ингибиторов фактора ха, фармацевтическая композиция и способ лечения
Номер патента: 3056
Опубликовано: 26.12.2002
Авторы: Хан Кви, Пинто Дональд Джозеф Филлип, Росси Карен Анита, Каччиола Джозеф, Пруитт Джеймс Рассел, Февиг Джон Мэттью, Кван Мими Лайфен, Орват Майкл Джеймс
Формула / Реферат
1. Соединение формулы I
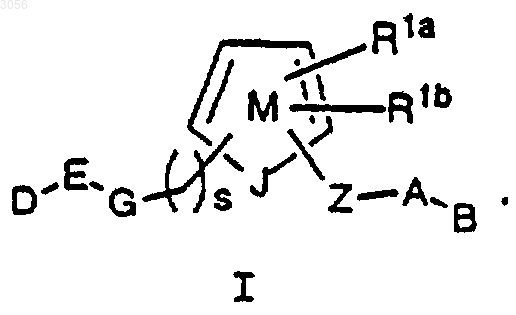
или его стереоизомер или фармацевтически приемлемая соль, где кольцо М содержит, кроме J, 0-3 атома N, при условии, что если М содержит 2 атома N, тогда R1b отсутствует, и если М содержит 3 атома N, тогда R1a и R1b отсутствуют;
J представляет собой N или NH;
D выбран из CN, C(=NR8)NR7R9, NHC(=NR8)NR7R9, NR8CH(=NR7), C(O)NR7R8 и (CR8R9)tNR7R8, при условии, что D присоединен к Е в мета- или пара-положении относительно G,
Е выбран из фенила, пиридила, пиримидила, пиразинила, пиридазинила и пиперидинила, замещенных 1 R;
альтернативно, D-E-G вместе представляют пиридил, замещенный 1 R;
R выбран из Н, галогена, (CH2)tOR3, C1-4 алкила, ОСF3 и СF3;
G отсутствует или выбран из NHCH2, ОСН2 и SCH2, при условии, что, когда s равно 0, тогда G присоединен к атому углерода кольца М;
Z выбран из C1-4 алкилена, (CH2)rO(CH2)r, (CH2)rNR3(CH2)r, (CH2)rC(O)(CH2)r, (CH2)rC(O)О(СН2)r, (СН2)rОС(О)(СН2)r, (CH2)rC(O)NR3(CH2)r, (CH2)rNR3C(О)(СН2)r, (СН2)rОС(О)О(СН2)r, (СН2)rОС(О)NR3(CH2)r, (CH2)rNR3C(О)О(СН2)r, (CH2)rNR3C(O)NR3(CH2)r, (CH2)rS(О)p(CH2)r, (CH2)rSO2NR3(CH2)r, (CH2)rNR3SO2(CH2)r и (CH2)rNR3SO2NR3(CH2)r, при условии, что Z не образует N-N, N-O, N-S, NCH2N, NCH2O или NCH2S связь с кольцом М или группой А;
R1a и R1b независимо отсутствуют или выбраны из -(CH2)r-R1', NCH2R1", OCH2R1", SCH2R1", N(CH2)2(CH2)tR1', O(CH2)2(CH2)tR1' и S(CH2)2(CH2)tR1' или соединены с образованием 5-8-членного насыщенного, частично насыщенного или ненасыщенного кольца, замещенного 0-2 R4 и содержащего 0-2 гетероатома, выбранных из группы, состоящей из N, О и S;
R1' выбран из Н, C1-3 алкила, галогена, (СF2)rСF3, OR2, NR2R2a, С(O)R2c, OC(O)R2, (CF2)rCO2R2c, S(O)pR2b, NR2(CH2)rOR2, NR2C(O)R2b, NR2C(O)NHR2b, NR2C(О)2R2a, OC(O)NR2b, С(О)NR2R2a, SO2NR2R2a, NR2SO2R2b, С3-6карбоциклического остатка, замещенного 0-2 R4, и 5-10-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, О и S, и замещенной 0-2 R4;
R1" выбран из Н, С(O)R2b, C(O)NR2R2a, S(O)R2b, S(O)2R2b и SO2NR2R2a;
R2 в каждом случае выбран из Н, СF3, C1-6 алкила, бензила, С3-6 карбоциклического остатка, замещенного 0-2 R4b, и 5-6-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, О и S, и замещенной 0-2 R4b;
R2a в каждом случае выбран из Н, СF3, C1-6 алкила, бензила, С3-6 карбоциклического остатка, замещенного 0-2 R4b, и 5-6-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, О и S, и замещенной 0-2 R4b;
R2b в каждом случае выбран из СF3, C1-4 алкокси, C1-6 алкила, бензила, С3-6 карбоциклического остатка, замещенного 0-2 R4b, и 5-6-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, О и S, и замещенной 0-2 R4b;
R2c в каждом случае выбран из СF3, ОН, C1-4 алкокси, C1-6 алкила, бензила, С3-6 карбоциклического остатка, замещенного 0-2 R4b, и 5-6-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, О и S, и замещенной 0-2 R4b;
альтернативно, R2 и R2a соединены с образованием 5- или 6-членного насыщенного, частично насыщенного или ненасыщенного кольца, замещенного 0-2 R4b, которое содержит 0-1 дополнительный гетероатом, выбранный из группы, состоящей из N, О и S;
R3 в каждом случае выбран из Н, C1-4 алкила и фенила;
R3a в каждом случае выбран из Н, C1-4 алкила и фенила;
А выбран из
С3-10 карбоциклического остатка, замещенного 0-2 R4, и 5-10-членной гетероциклической системы, включающей 1-4 гетероатома, выбранных из группы, состоящей из N, О и S, и замещенной 0-2 R4;
В выбран из
X-Y, NR2R2a, C(=NR2)NR2R2a, NR2C(=NR2)NR2R2a, С3-10 карбоциклического остатка, замещенного 0-2 R4a, и
5-10-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, О и S, и замещенной 0-2 R4a;
X выбран из C1-4 алкилена, -CR2(CR2R2b)(СН2)t-, -С(О)-, -C(=NR)-, -CR2(NR2R2a)-, CR2(NR1''R2)-, -CR2(OR2)-, -CR2(SR2)-, -С(О)CR2R2a-, -CR2R2aC(O), -S(O)p-, -S(O)pCR2R2a-, -CR2R2aS(O)p-, -S(O)2NR2-, -NR2S(O)2-, -NR2S(O)2CR2R2a-, -CR2R2aS(O)2NR2-, -NR2S(O)2NR2-, -C(O)NR2-, -NR2C(O)-, -C(O)NR2CR2R2a-, -NR2C(O)CR2R2a-, -CR2R2aC(O)NR2-, -CR2R2aNR2C(O)-, -NR2C(O)O-, -OC(O)NR2-, -NR2C(O)NR2-, -NR2-, -NR2CR2R2a-, -CR2R2aNR2-, O, -CR2R2aO- и -OCR2R2a-;
Y выбран из
(CH2)tNR2R2a, при условии, что X-Y не образует N-N, O-N или S-N связи, С3-10 карбоциклического остатка, замещенного 0-2 R4a, и 5-10-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N, О и S, и замещенэющ 0-2 R4a;
R4 в каждом случае выбран из =O, (СН2)rОR2, галогена, C1-4 алкила, -CN, NO2, (СН2)rNR2R2a, (СН2)rС(О)R2b, NR2C(O)R2b, С(О)NR2R2a, NR2C(О)NR2R2a, С(=NR2)NR2R2a, NHC(=NR2)NR2R2a, SO2NR2R2a, NR2SO2NR2R2a, NR2SO2-C1-4 алкила, NR2SO2R5, S(O)pR5, (СF2)rСF3, NCH2R1", OCH2R1", SCH2R1", N(CH2)2(CH2)tR1', O(CH2)2(CH2)tR1' и S(CH2)2(CH2)tR1,
альтернативно, один R4 представляет 5-6-членный ароматический гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, состоящей из N, О и S;
R4a в каждом случае выбран из =О, (CH2)rOR2, галогена, C1-4 алкила, -CN, NO2, (CH2)rNR2R2a, (CH2)rС(О)R2b, NR2C(O)R2b, C(O)NR2R2a, NR2C(O)NR2R2a, С(=NR2)NR2R2a, NHC(=NR2)NR2R2a, SO2NR2R2a, NR2SO2NR2R2a, NR2SO2-C1-4 алкила, NR2SO2R5, S(O)pR5 и (CF2)rCF3,
альтернативно, один R4a представляет 5-6-членный ароматический гетероцикл, содержащий 1-4 гетероатома, выбранных из группы, состоящей из N, О и S, и замещенной 0-1 R5;
R4b в каждом случае выбран из =O, (CH2)rOR3, галогена, C1-4 алкила, -CN, NO2, (СН2)rNR3R3a, (CH2)rC(О)R3, NR3C(O)R3a, C(O)NR3R3a, NR3C(O)NR3R3a, C(=NR3)NR3R3a, NH3C(=NR3)NR3R3a, SO2NR3R3a, NR3SO2NR3R3a, NR3SO2-C1-4 алкила, NR3SO2CF3, NR3SO2-фенила, S(O)pСF3, S(O)p-C1-4 алкила, S(O)p-фенила и (СF2)rСF3;
R5 в каждом случае выбран из СF3, C1-6 алкила, фенила, замещенного 0-2 R6, и бензила, замещенного 0-2 R6;
R6 в каждом случае выбран из Н, ОН, (CH2)rOR2, галогена, C1-4 алкила, -CN, NO2, (CH2)rNR2R2a, (CH2)rC(O)R2b, NR2C(O)R2b, NR2C(O)NR2R2a, C(=NH)NH2, NHC(=NH)NH2, SO2NR2R2a, NR2SO2NR2R2a и NR2SO2C1-4 алкила;
R7 в каждом случае выбран из Н, ОН, C1-6 алкила, C1-6 алкилкарбонила, C1-6 алкокси, С1-4 алкоксикарбонила, (СН2)n-фенила, С6-10 арилокси, С6-10 арилоксикарбонила, С6-10 арилметилкарбонила, C1-4 алкилкарбонилокси C1-4 алкоксикарбонила, С6-10 арилкарбонилокси C1-4 алкоксикарбонила, C1-6 алкиламинокарбонила, фениламинокарбонила и фенил C1-4 алкоксикарбонила;
R8 в каждом случае выбран из Н, C1-6 алкила и (СН2)n-фенила;
альтернативно, R7 и R8 соединены с образованием 5- или 6-членного насыщенного кольца, которое содержит 0-1 дополнительный гетероатом, выбранный из группы, состоящей из N, О и S;
R9 в каждом случае выбран из Н, С1-6 алкила и (СН2)n- фенила;
n в каждом случае выбран из 0, 1, 2 и 3;
m в каждом случае выбран из 0, 1 и 2;
р в каждом случае выбран из 0, 1 и 2;
r в каждом случае выбран из 0, 1, 2 и 3;
s в каждом случае выбран из 0, 1 и 2 и
t в каждом случае выбран из 0 и 1;
при условии, что обе группы D-E-G-(СН2)s- и -Z-А-В не образуют замещенной или незамещенной бифенилметиленовой группы.
2. Соединение по п.1, где соединение представляет собой соединение формул Ia-Ih

где группы D-E и Z-A-B присоединены к соседним атомам кольца;
Z выбран из CH2O, ОСН2, CH2NH, NHCH2, С(О), СН2С(O), C(O)CH2, NHC(O), C(O)NH, CH2S(O)2, S(O)2(CH2), SO2NH и NHSO2, при условии, что Z не образует N-N, N-O, NCH2N или NCH2O связь с кольцом М или группой А;
А выбран из одной из следующих карбоциклических и гетероциклических систем, замещенных 0-2 R4: фенил, пиперидинил, пиперазинил, пиридил, пиримидил, фуранил, морфолинил, тиофенил, пирролил, пирролидинил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, имидазолил, оксадиазолил, тиадиазолил, триазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил, бензофуранил, бензотиофуранил, индолил, бензимидазолил, бензоксазолил, бензтиазолил, индазолил, бензизоксазолил, бензизотиазолил и изоиндазолил;
В выбран из Y, X-Y, NR2R2a, С(=NR2)NR2R2a и NR2C(=NR2)NR2R2a;
Х выбран из C1-4 алкилена, -С(О)-, -C(=NR)-, -CR2(NR2R2a)-, -C(O)CR2R2a-, -CR2R2aC(O), -C(O)NR2-, -NR2C(O)-, -С(О)NR2CR2R2a-, -NR2C(О)CR2R2a-, -CR2R2aC(О)NR2-, -CR2R2aNR2C(O)-, -NR2C(O)NR2-, -NR2-, -NR2CR2R2a-, -CR2R2aNR2-, О, - CR2R2aO- и -OCR2R2a-;
Y представляет NR2R2a, при условии, что X-Y не образуют N-N или O-N связи;
альтернативно, Y выбран из одной из следующих карбоциклических и гетероциклических систем, замещенных 0-2 R4a: циклопропил, циклопентил, циклогексил, фенил, пиперидинил, пиперазинил, пиридил, пиримидил, фуранил, морфолинил, тиофенил, пирролил, пирролидинил, оксазолил, изоксазолил, изоксазолинил, тиазолил, изотиазолил, пиразолил, имидазолил, оксадиазолил, тиадиазолил, триазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил, бензофуранил, бензотиофуранил, индолил, бензимидазолил, бензоксазолил, бензтиазолил, индазолил, бензизоксазолил, бензизотиазолил и изоиндазолил;
альтернативно, Y выбран из следующих бицикличесъшх гетероарильных кольцевых систем
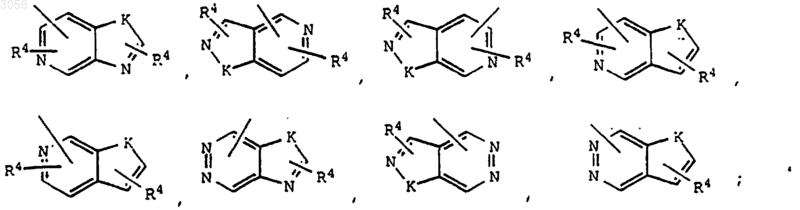
K выбран из О, S, NH и N.
3. Соединение по п.2, где соединение представляет собой соединение формул IIa-IIf
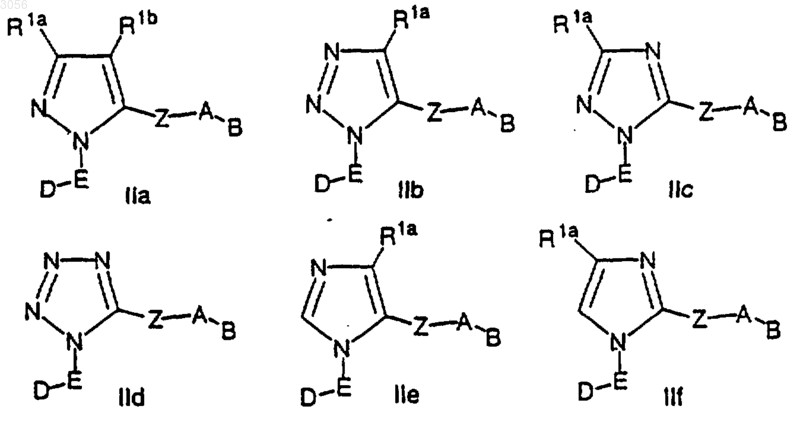
где Z выбран из С(О), СН2С(О), С(O)СН2, NHC(O), C(O)NH, CH2S(O)2, S(O)2(CH2), SO2NH и NHSO2, при условии, что Z не образует N-N или NCH2N связи с кольцом М или группой А.
4. Соединение по п.3, где Е представляет фенил, замещенный R, или 2-пиридил, замещенный R;
D выбран из NH2, C(O)NH2, C(=NH)NH2, CH2NH2, СН2NНСН3, СН(СН3)NН2 и С(СН3)2NН2, при условии, что D присоединен к кольцу Е в мета- или пара-положении относительно М; и R выбран из Н, ОСН3, Сl и F.
5. Соединение по п.4, где D-E выбран из 3-аминофенила, 3-амидинофенила, 3-аминометилфенила, 3-аминокарбонилфенила, 3-(метиламинометил)фенила, 3-(1-аминоэтил)фенила, 3-(2-амино-2-пропил)фенила, 4-хлор-3-аминофенила, 4-хлор-3-амидинофенила, 4-хлор-3-аминометилфенила, 4-хлор-3-(метиламинометил)фенила, 4-фтор-3-аминофенила, 4-фтор-3-амидинофенила, 4-фтор-3-аминометилфенила, 4-фтор-3-(метиламинометил)фенила, 6-аминопирид-2-ила, 6-амидинопирид-2-ила, 6-аминометилпирид-2-ила, 6-аминокарбонилпирид-2-ила, 6-(метиламинометил)пирид-2-ила, 6-(1-аминоэтил)пирид-2-ила и 6-(2-амино-2-пропил)пирид-2-ила.
6. Соединение по п.3, где Z представляет С(O)СН2 и CONH, при условии, что Z не образует N-N- связи с группой А;
А выбран из фенила, пиридила и пиримидила и замещен 0-2 R4 и
В выбран из X-Y, фенила, пирролидино, морфолино, 1,2,3-триазолила и имидазолила и замещен 0-1 R4a;
R4 в каждом случае выбран из ОН, (CH2)rOR2, галогена, C1-4 алкила, (CH2)rNR2R2a и (CF2)rCF3;
R4a выбран из C1-4алкила, СF3, S(O)pR5, SO2NR2R2a и 1-СF3-тетразол-2-ила;
R5 в каждом случае выбран из СF3, C1-6 алкила, фенила и бензила;
Х представляет СН2 или С(О) и
Y выбран из пирролидино и морфолино.
7. Соединение по п.6, где А выбран из группы, включающей фенил, 2-пиридил, 3-пиридил, 2-пиримидил, 2-Сl-фенил, 3-Сl-фенил, 2-F-фенил, 3-F-фенил, 2-метилфенил, 2-аминофенил и 2 метоксифенил, и
В выбран из группы, включающей: 2-СF3-фенил, 2-(аминосульфонил)фенил, 2-(метиламиносульфонил)фенил, 2-(диметиламиносульфонил)фенил, 1-пирролидинокарбонил, 2-(метилсульфонил) фенил, 4-морфолино, 2-(1'-СF3-тетразол-2-ил)фенил, 4-морфолинокарбонил, 2-метил-1-имидазолил, 5-метил-1-имидазолил, 2-метилсульфонил-1-имидазолил и 5-метил-1,2,3-триазолил.
8. Соединение по п.3, где Е представляет фенил, замещенный R, или 2-пиридил, замещенный R;
D выбран из NH2, C(O)NH2, C(=NH)NH2, CH2NH2, CH2NHCH3, CH(CH3)NH2 и С(СН3)2NH2, при условии, что D присоединен к кольцу Е в мета- или пара-положении относительно М, и
R выбран из Н, ОСН3, Сl и F;
Z представляет С(O)СН2 и CONH, при условии, что Z не образует N-N связи с группой А;
А выбран из фенила, пиридила и пиримидила и замещен 0-2 R4 и
В выбран из X-Y, фенила, пирролидино, морфолино, 1,2,3-триазолила и имидазолила и замещен 0-1 R4a;
R4 в каждом случае выбран из ОН, (СН2)rОR2, галогена, C1-4 алкила, (CH2)rNR2R2a и (СF2)rСF3;
R4a выбран из C1-4 алкила, СF3, S(O)pR5, SO2NR2R2a и 1-СF3-тетразол-2-ила;
R5 в каждом случае выбран из СF3, C1-6 алкила, фенила и бензила;
Х представляет СН2 или С(О) и
Y выбран из пирролидино и морфолино.
9. Соединение по п. 8, где группа D-E выбрана из 3-аминофенила, 3-амидинофенила, 3-аминометилфенила, 3-аминокарбонилфенила, 3-(метиламинометил)фенила, 3-(1-аминоэтил)фенила, 3-(2-амино-2-пропил)фенила, 4-хлор-3-аминофенила, 4-хлор-3-амидинофенила, 4-хлор-3-аминометилфенила, 4-хлор-3-(метиламинометил)фенила, 4-фтор-3-аминофенила, 4-фтор-3-амидинофенила, 4-фтор-3-аминометилфенила, 4-фтор-3-(метиламинометил)фенила, 6-аминопирид-2-ила, 6-амидинопирид-2-ила, 6-аминометилпирид-2-ила, 6-аминокарбонилпирид-2-ила, 6-(метиламинометил)пирид-2-ила, 6-(1-аминоэтил)пирид-2-ила, 6-(2-амино-2-пропил)пирид-2-ила;
А выбран из группы, включающей фенил, 2-пиридил, 3-пиридил, 2-пиримидил, 2-Сl-фенил, 3-Сl-фенил, 2-F-фенил, 3-F-фенил, 2-метилфенил, 2-аминофенил и 2 метоксифенил, и
В выбран из группы, включающей: 2-СF3-фенил, 2-(аминосульфонил)фенил, 2-(метиламиносульфонил)фенил, 2-(диметиламиносульфонил)фенил, 1-пирролидинокарбонил, 2-(метилсульфонил)фенил, 4-морфолино, 2-(1'-СF3-тетразол-2-ил)фенил, 4-морфолинокарбонил, 2-метил-1-имидазолил, 5-метил-1-имидазолил, 2-метилсульфонил-1-имидазолил и 5-метил-1,2,3-триазолил.
10. Соединение по п.9, где соединение представляет собой соединение формулы IIа.
11. Соединение по п.9, где соединение представляет собой соединение формулы IIb.
12. Соединение по п.9, где соединение представляет собой соединение формулы IIс.
13. Соединение по п.9, где соединение представляет собой соединение формулы IId.
14. Соединение по п.9, где соединение представляет собой соединение формулы IIе.
15. Соединение по п.9, где соединение представляет собой соединение формулы IIf.
16. Соединение по п.3, где
D выбран из C(=NR8)NR7R9, C(O)NR7R8, NR7R8 и CH2NR7R8, при условии, что D присоединен к кольцу Е в мета- или пара-положении относительно М;
Е представляет фенил, замещенный R, или пиридил, замещенный R;
R выбран из Н, Cl, F, OR3, СН3, СН2СН3, ОСF3 и СF3;
Z выбран из С(О), СН2С(О), С(O)СН2, NHC(O) и C(O)NH, при условии, что Z не образует N-N связи с кольцом М или группой А;
R1a и R1b независимо отсутствуют, или выбраны из -(CH2)r-R1', NCH2R1", OCH2R1", SCH2R1", N(СН2)2(СН2)tR1', О(СН2)2(СН2)tR1' и S(CH2)2(CH2)tR1', или соединены с образованием 5-8-членного насыщенного, частично насыщенного или ненасыщенного кольца, замещенного 0-2 R4, и которое содержит 0-2 гетероатома, выбранных из группы, состоящей из N, О и S;
R1' в каждом случае выбран из Н, C1-3 алкила, галогена, (СF2)rСF3, OR2, NR2R2a, C(O)R2c, (CF2)rCO2R2c, S(O)pR2b, NR2(CH2)rOR2, NR2C(O)R2b, NR2C(O)2R2b, C(O)NR2R2a, SO2NR2R2a и NR2SO2R2b;
А выбран из следующих карбоциклических и гетероциклических систем, замещенных 0-2 R4: фенил, пиперидинил, пиперазинил, пиридил, пиримидил, фураншы, морфолинил, тиофенил, пирролил, пирролидинил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил и имидазолил;
В выбран из Y, X-Y, NR2R2a, С(=NR2)NR2R2a и NR2C(=NR2)NR2R2a;
Х выбран из СН2, -С(О)-, -C(=NR)-, -CH(NR2R2a)-, -C(O)NR2-, -NR2C(O)-, -NR2C(О)NR2-, -NR2- и O;
Y представляет NR2R2a, при условии, что X-Y не образуют N-N или O-N связи;
альтернативно, Y выбран из следующих карбоциклических и гетероциклических систем, замещенных 0-2 R4a: фенил, пиперидинил, пиперазинил, пиридил, пиримидил, фуранил, морфолинил, тиофенил, пирролил, пирролидинил, оксазолил, изоксазолил, изоксазолинил, тиазолил, изотиазолил, пиразолил, имидазолил, оксадиазолил, тиадиазолил, триазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1, 3,4-тиадиазолил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил и 1,3,4-триазолил;
R4 в каждом случае выбран из =O, ОН, Cl, F, C1-4 алкила, (CH2)rNR2R2a, (CH2)rC(O)R2b, NR2C(O)R2b, C(O)NR2R2a, C(=NH)NH2, NHC(=NH)NH2, SO2NR2R2a, NR2SO2-C1-4 алкила, NR2SO2R5, S(O)pR5 и (СF2)rСF3;
R4a в каждом случае выбран из =O, ОН, Cl, F, C1-4 алкила, (CH2)rNR2R2a, (CH2)rC(O)R2b, NR2C(O)R2b, C(O)NR2R2a, С(=NН)NН2, NHC(=NH)NH2, SO2NR2R2a, NR2SO2-C1-4 алкила, NR2SO2R5, S(O)pR5, (СF2)rСF3 и 1-СF3-тетразол-2-ила;
R5 в каждом случае выбран из СF3, C1-6 алкила, фенила, замещенного 0-2 R6, и бензила, замещенного 0-2 R6;
R6 в каждом случае выбран из Н, ОН, OR2, Cl, F, СН3, CN, NO2, (CH2)rNR2R2a, (CH2)rC(O)R2b, NR2C(O)R2b, C(=NH)NH2, NHC(=NH)NH2 и SO2NR2R2a;
R7 в каждом случае выбран из Н, ОН, C1-6 алкила, C1-6 алкилкарбонила, C1-6 алкокси, C1-4 алкоксикарбонила, бензила, С6-10 арилокси, С6-10 арилоксикарбонила, C6-10 арилметилкарбонила, C1-4 алкилкарбонилокси C1-4 алкоксикарбонила, С6-10 арилкарбонилокси C1-4 алкоксикарбонила, C1-6 алкиламинокарбонила, фениламинокарбонила и фенил C1-4 алкоксикарбонила;
R8 в каждом случае выбран из Н, C1-6 алкила и бензила; и
альтернативно, R7 и R8 соединены с образованием морфолиногруппы; и
R9 в каждом случае выбран из Н, C1-6 алкила и бензила.
17. Соединение по п.16, где Е представляет фенил, замещенный R, или 2-пиридил, замещенный R;
R выбран из Н, Cl, F, ОСН3, СН3, ОСF3 и СF3;
Z выбран из С(O)СН2 и C(O)NH, при условии, что Z не образует N-N связи с группой А;
R1a выбран из Н, СН3, СН2СН3, Cl, F, СF3, ОСН3, NR2R2a, S(O)pR2b, CH2S(O)pR2b, С(O)R2c, CH2C(O)R2c, C(O)NR2R2a и SO2NR2R2a или отсутствует;
R1b выбран из Н, СН3, СН2СН3, Cl, F, СF3, ОСН3, NR2R2a, S(O)pR2b, CH2S(O)pR2b, CH2NR2S(O)pR2b, С(O)R2c, СН2С(O)R2c, C(O)NR2R2a и SO2NR2R2a или отсутствует;
А выбран из следующих карбоциклических и гетероциклических систем, замещенных 0-2 R4: фенил, пиридил, пиримидил, фуранил, тиофенил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил и имидазолил;
В выбран из Y и X-Y;
Х выбран из CH2, -CR2(CR2R2b)-, -С(О)-, -C(=NR)-, -CH(NR2R2a)-, -C(O)NR2-, -NR2C(O)-, -NR2C(O)NR2-, -NR2- и О;
Y представляет NR2R2a, при условии, что X-Y не образуют N-N или O-N связи;
альтернативно, Y выбран из следующих карбоциклических и гетероциклических систем, замещенных 0-2 R4a: фенил, пиперидинил, пиперазинил, пиридил, пиримидил, фуранил, морфолинил, тиофенил, пирролил, пирролидинил, оксазолил, изоксазолил, изоксазолинил, тиазолил, изотиазолил, пиразолил, имидазолил, оксадиазолил, тиадиазолил, триазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил и 1,3,4-триазолил;
R2 в каждом случае выбран из Н, СF3, СН3, бензила и фенила;
R2a в каждом случае выбран из Н, СF3, СН3, бензила и фенила;
R2b в каждом случае выбран из СF3, ОСН3, СН3, бензила и фенила;
R2c в каждом случае выбран из СF3, ОН, ОСН3, СН3, бензила и фенила;
альтернативно, R2 и R2a соединены с образованием 5 или 6-членного насыщенного, частично ненасыщенного или ненасыщенного кольца, которое содержит 0-1 дополнительных гетероатомов, выбранных из группы, состоящей из N, О и S;
R3 в каждом случае выбран из Н, СН3, СН2СН3 и фенила;
R3a в каждом случае выбран из Н, СН3, СН2СН3 и фенила;
R4 в каждом случае выбран из ОН, Cl, F, СН3, СН2СН3, NR2R2a, CH2NR2R2a, С(O)R2b, NR2C(O)R2b, C(O)NR2R2a и СF3;
R4a в каждом случае выбран из ОН, Cl, F, СН3, СН2СН3, NR2R2a, CH2NR2R2a, С(O)R2b, C(O)NR2R2a, SO2NR2R2a, S(O)pR5, СF3 и 1-СF3-тетразол-2-ила;
R5 в каждом случае выбран из СF3, C1-6 алкила, фенила, замещенного 0-2 R6, и бензила, замещенного 1 R6;
R6 в каждом случае выбран из Н, ОН, ОСН3, Cl, F, СН3, CN, NO2, NR2R2a, CH2NR2R2a и SO2NR2R2a;
R7 в каждом случае выбран из Н, ОН, C1-3 алкила, C1-3 алкилкарбонила, C1-3 алкокси, C1-4 алкоксикарбонила, бензила, фенокси, феноксикарбонила, бензилкарбонила, C1-4 алкилкарбонилокси C1-4 алкоксикарбонила, фенилкарбонилокси C1-4 алкоксикарбонила, C1-6 алкиламинокарбонила, фениламинокарбонила и фенил C1-4 алкоксикарбонила;
R8 в каждом случае выбран из Н, СН3 и бензила; и
альтернативно, R7 и R8 соединены с образованием морфолиногруппы,
R9 в каждом случае выбран из Н, СН3 и бензила.
18. Соединение по п.17, где
R1a отсутствует или выбран из Н, СН3, СН2СН3, Cl, F, СF3, ОСН3, NR2R2a, S(O)pR2b, C(O)NR2R2a, СН2S(O)pR2b, CH2NR2S(O)pR2b, C(O)R2c, CH2C(O)R2c и SO2NR2R2a;
R1b отсутствует или выбран из Н, СН3, СН2СН3, Сl, F, СF3, ОСН3, NR2R2a, S(O)pR2b, C(O)NR2R2a, CH2S(O)pR2b, CH2NR2S(О)pR2b, С(O)R2b, CH2C(O)R2b и SO2NR2R2a;
А выбран из следующих карбоциклических и гетероциклических систем, замещенных 0-2 R4: фенил, пиридил и пиримидил,
В выбран из Y и X-Y;
Х представляет собой -С(O)-;
Y представляет NR2R2a, при условии, что X-Y не образуют O-N связь;
альтернативно, Y выбран из следующих карбоциклических и гетероциклических систем, замещенных 0-2 R4: фенил, пиперазинил, пиридил, пиримидил, морфолинил, пирролидинил, имидазолил и 1,2,3-триазолил;
R2 в каждом случае выбран из Н, СF3, СН3, бензила и фенила;
R2a в каждом случае выбран из Н, СF3, СН3, бензила и фенила;
R2b в каждом случае выбран из СF3, ОСН3, СН3, бензила и фенила;
R2c в каждом случае выбран из СF3, ОН, ОСН3, СН3, бензила и фенила;
альтернативно, R2 и R2a соединены с образованием кольцевой системы, выбранной из пирролидинила, пиперазинила и морфолино;
R4 в каждом случае выбран из Сl, F, СН3, NR2R2a и СF3;
R4a в каждом случае выбран из Сl, F, СН3, SО2NR2R2a, S(O)pR5 и СF3; и
R5 в каждом случае выбран из СF3 и СН3.
19. Соединение по п.1, выбранное из группы, включающей
1-(3-амидинофенил)-2-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиррол;
1-(3-амидинофенил)-2-[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиррол;
1-(3-амидинофенил)-2-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-4-бромпиррол;
1-(3-амидинофенил)-2-[[5-(2'-аминосульфонилфен-1-ил)пиридин-2-ил] аминокарбонил]пиррол;
1-бензил-3-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-4-(3-амидинофенил)пиррол;
1-бензил-3-[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил]-4-(3-амидинофенил)пиррол;
1-(3-амидинофенил)-4-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]имидазол;
1-(3-амидинофенил)-4-[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил]имидазол;
1-(3-амидинофенил)-2-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]имидазол;
1-(3-амидинофенил)-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)карбониламино]пиразол;
1-(3-амидинофенил)-3-метил-5-((2'-(5"-СF3-тетразолил)-[1,1']-дифен-4-ил)аминокарбонил)пиразол;
1-(3-амидинофенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-4-хлор-3-метилпиразол;
1-(3-амидинофенил)-5-((2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил)-3-трифторметилпиразол;
1-(3-амидинофенил)-4-метокси-5-((2'-aминocyльфoнил-[1,1']-дифен-4-ил)аминокарбонил)-3-трифторметилпиразол;
1-(3-амидинофенил)-3-метил-5-(4'-(имидазол-1-илфенил)аминокарбонил) пиразол;
1-(3-амидинофенил)-3-метил-5-[(4'-(2"-сульфонилметил)феноксифенил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)метилкарбонил]пиразол;
1-(3-амидинофенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-1,2,3-триазол;
1-(3-амидинофенил)-5-((2'-трифторметил-[1,1']-дифен-4-ил)аминокарбонил)тетразол;
1-(3-амидинофенил)-5-((2'-аминосульфонил-3-хлор-[1,1']-дифен-4-ил)метилтио)тетразол;
1-(3-амидинофенил)-5-[(2'-аминосульфонил-3-хлор-[1,1']-дифен-4-ил)метилсульфоксид]тетразол;
1-(3-амидинофенил)-5-[(2'-аминосульфонил-3-хлор-[1,1']-дифен-4-ил)метилсульфонил]тетразол;
1-(3-амидинофенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]тетразол;
1-(3-амидинофенил)-3-метил-2-[[5-(2'-аминосульфонилфенил-1-ил)пиридин-2-ил]аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-2-[[5-(2'-аминосульфонилфенил-1-ил)пиримидин-2-ил]аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(2'-аминосульфонил-2-хлор-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(2'-аминосульфонил-2-фтор-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(2'-аминосульфонил-4'-фтор-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(2'-трифторметил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(3-хлор-2'-трифторметил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(3-фтор-2'-трифторметил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-2-[[5-(2'-трифторметилфенил-1-ил)пиридин-2-ил]аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(2'-фтор-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(3-хлор-2'-фтор-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)(N'-метил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-н-бутил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-н-бутил-5-[((2'-аминосульфонилфенил-1-ил)пиридин-2-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-н-бутил-5-[((2'-трифторметилфенил-1-ил)пиридин-2-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-5-[(2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-трифторметилпиразол;
1-(3-амидинофенил)-5-[(2'-трифторметил-[1,1']-дифен-4-ил)аминокарбонил]-3-трифторметилпиразол;
1-(3-амидинофенил)-4-метокси-5-[(2'-трифторметил-[1,1']-дифен-4-ил)аминокарбонил]-3-трифторметилпиразол;
1-(3-амидинофенил)-3-метил-5-[(4-трифторметилфенил)аминокарбонил]пиразол;
1-(3-амидинофенил)-4-метил-5-[(2'-aминocyльфoнил-[1,1']-дифен-4-ил)аминокарбонил]имидазол;
1-(3-амидинофенил)-5-[(2'-аминосульфонилфенил-1-ил-пиридин-2-ил)аминокарбонил]-1,2,3-триазол;
1-(3-амидинофенил)-5-[(2'-трифторметил-[1,1']-дифен-4-ил)аминокарбонил]-1,2,3-триазол;
1-(3-амидинофенил)-5-[(2'-aминocyльфoнил-[1,1']-дифен-4-ил)аминокарбонил]-3-трифторметил-1,2,4-триазол;
3-метил-1-(3-амидинофенил)-5-((4'-(4"-хлорфенил)тиазол-2'-ил)аминокарбонил)пиразол;
1-(3-амидино)фенил-3-метил-5-[(2'-трифторметилсульфид-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидино)фенил-3-метил-5-[(2'-трифторметилсульфоксид-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидино)фенил-3-метил-5-[(2'-тpифтopмeтилcyльфoнил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
[1-(3-амидино)фенил-3-метил-5-[4'-(карбоксиметил)фениламинокарбонил]пиразол];
[1-(3-амидино)фенил-3-метил-5-[4'-(N,N-диметиламинокарбонил)фениламинокарбонил]пиразол];
1-(3-амидино)фенил-3-метил-5-[4'-(карбоксиметил)фениламинокарбонил]пиразол;
[1-(3-амидино)фенил-3-метил-5-[(4'-трет-бутиламиносульфонилфенил)аминокарбонил]пиразол];
(3-амидино)фенил-3-метил-5-[(4'-сульфонилфенил)аминокарбонил]пиразол;
[1-(3-амидино)фенил-3-метил-5-[(4'-трифторметилфенил)аминокарбонил]пиразол;
1-(3-амидино)фенил-3-метил-5-[4'-(N,N-диметиламинокарбонил)фениламинокарбонил]пиразол;
1-(3-амидино)фенил-3-метил-5-[4'-(N,N-диметиламиносульфонил)фениламинокарбонил]пиразол;
1-(3-амидино)фенил-3-метил-5-[(4'-трет-бутиламиносульфонилфенил)аминокарбонил]пиразол;
1-(3-амидино)фенил-3-метил-5-[(4'-аминосульфонилфенил)аминокарбонил]пиразол;
1-(3-амидино)фенил-3-метил-5-[(4'-трифторметилфенил)аминокарбонил]пиразол;
1-(3-амидино)фенил-3-метил-5-[(4'-бензилсульфонилпиперидил)аминокарбонил]пиразол;
1-(3-амидинофенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)-N-метиламинокарбонил]-3-метилпиразол;
1-(3-амидинофенил)-5-[(4'-фтор-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-амидинофенил)-5-[[5-(2'-аминосульфонилфенил)пиридин-2-ил]аминокарбонил]-3-метилпиразол;
1-(3-цианофенил)-5-[[5-(2'-аминосульфонилфенил)пиридин-2-ил]аминокарбонил]-3-метилпиразол;
1-(3-амидинофенил)-5-[(2'-трифторметил-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-аминокарбонилфенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-амидинофенил)-5-[(2'-aминocyльфoнил-3-xлop-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол
или его фармацевтически приемлемая соль.
20. Соединение по п.1, выбранное из группы, включающей
1-(3-амидинофенил)-5-[(2'-трифторметил-3-хлор-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-амидинофенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-н-бутилпиразол;
1-(3-амидинофенил)-5-[(2'-трифторметил-[1,1']-дифен-4-ил)аминокарбонил]-3-н-бутилпиразол;
1-(3-амидинофенил)-5-[[5-(2'-аминосульфонилфенил)пиридин-2-ил]аминокарбонил]-3-н-бутилпиразол;
1-(3-амидинофенил)-5-[(2'-трифторметил-[1,1']-дифен-4-ил)аминокарбонил]-3-трифторметил-4-метоксипиразол;
1-(3-амидинофенил)-5-[(2'-трифторметил-[1,1']-дифен-4-ил)аминокарбонил]-3-трифторметилпиразол;
1-(3-амидинофенил)-5-[(2'-сульфонилметил-[1,1']-дифен-4-ил)аминокарбонил]-3-трифторметилпиразол;
1-(3-амидинофенил)-5-[(2'-аминосульфонил-3-бром-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-аминокарбонилфенил)-5-[(2'-аминосульфонил-3-бром-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-амидинофенил)-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)метилкарбонил]пиразол;
1-(3-аминокарбонилфенил)-5-[5-[(2'-аминосульфонилфен-1-ил)пиридин-2-ил]аминокарбонил]-3-метилпиразол;
1-(3-амидинофенил)-5-[[(2'-трет-бутиламиносульфонилфенил)пиримидин-2-ил]аминокарбонил]-3-трифторметилпиразол;
1-(3-амидинофенил)-5-[[5-(2'-аминосульфонилфенил)пиримидин-2-ил]аминокарбонил]-3-трифторметилпиразол;
1-(3-аминокарбонилфенил)-5-[[5-(2'-аминосульфонилфенил)пиримидин-2-ил]аминокарбонил]-3-трифторметилпиразол;
1-(3-цианофенил)-5-[(4'-(имидазол-1-ил)фенил)аминокарбонил]-3-трифторметилпиразол;
1-(3-амидинофенил)-5-[(4'-(морфолин-1-ил)фенил)аминокарбонил]-3-трифторметилпиразол;
1-(3-аминокарбонилфенил)-5-[(4'-(морфолин-1-ил)фенил)аминокарбонил]-3-трифторметилпиразол;
1-(3-амидинофенил)-5-[[5-(2'-аминосульфонилфенил)пиридин-2-ил]аминокарбонил]-3-трифторметилпиразол;
1-(3-аминокарбонилфенил)-5-[[5-(2'-аминосульфонилфенил)пиридин-2-ил]аминокарбонил]-3-трифторметилпиразол;
1-(3-амидинофенил)-5-[(4'-(3-метилтетразол-1-ил)фенил)аминокарбонил]-3-трифторметилпиразол;
1-(3-амидинофенил)-5-(2'-нафтиламиносульфонил)-3-метилпиразол;
1-(3-амидинофенил)-5-[(4-бромфенил)аминосульфонил]-3-метилпиразол;
1-(3-аминометилфенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-аминометилфенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-трифторметилпиразол;
1-(3-амидинофенил)-3-метил-5-[((2'-трифторметилфенил)пирид-2-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[((2'-аминосульфонил-1-ил)пиримид-5-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(2'-фтор-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[3-хлор-(2'-фтор-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(3-фтор-2'-фтор-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(3-фтор-2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[[5-(2'-фторфен-1-ил)пирид-2-ил]аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[[5-(2'-трет-бутиламиносульфонилфенил)пиримид-2-ил]аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[[5-(2'-аминосульфонилфенил)-[1,6]-дигидропиримид-2-ил]аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(4-(пирид-3'-ил)фен-1-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[[2-(2'-пиридил)этил]аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(3-фенилпропил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[4-(пирид-2'-ил)фен-1-иламинокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(4-(изопропилокси)фенил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(5-(2'-трифторметилфенил)пиримидин-2-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(4-(пиперидиносульфонил)фенил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(4-(пиперидинокарбонил)фенил)аминокарбонил]пиразол;
1-(3-амидино-4-фторфенил)-3-метил-5-[(2'-aминocyльфoнил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-аминокарбонил-4-фторфенил)-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-метил-3-(3-амидино)фенил-4-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[[4-(пиразол-4'-ил)фен-1-ил]аминокарбонил]пиразол
или его фармацевтически приемлемая соль.
21. Соединение по п. 1, выбранное из группы, включающей
1-(3-амидинофенил)-3-метил-5-([5-(2'-метилсульфонилфенил)пирид-2-ил]аминокарбонил)пиразол;
1-(3-амидинофенил)-3-метил-5-([5-(2-метилсульфонилфенил)пиримид-2-ил]аминокарбонил)пиразол;
1-(3-цианофенил)-3-метил-5-([5-(2'-метилсульфонилфенил)пиримид-2-ил]аминокарбонил)пиразол;
1-(3-аминокарбонилфенил)-3-метил-5-([5-(2'-метилсульфонилфенил)пиримид-2-ил]аминокарбонил)пиразол;
1-(3-(N-аминоамидино)фенил)-3-метил-5-[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-(N-аминоамидино)фенил)-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-(N-метил-N-гидроксиамидино)фенил)-3-метил-5-[(4'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-(N-метиламидино)фенил)-3-метил-5-[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-(N-метиламидино)фенил)-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-5-[[(2'-аминосульфонилфенил)пиридин-2-ил]аминокарбонил]тетразол;
1-(3-аминокарбонилфенил)-5-{[5-(2'-аминосульфонилфенил)пиридин-2-ил]аминокарбонил}тетразол;
1-(3-амидинофенил)-5-{[5-(2'-тpифтopмeтилфeн-1-ил)пиpидин-2-ил]аминокарбонил}тетразол;
1-(3-амидинофенил)-5-[(4'-бромфен-1-ил)аминокарбонил]тетразол;
1-(3-аминокарбонилфенил)-5-{[5-(2'-трифторметилфен-1-ил)пиридин-2-ил]аминокарбонил}тетразол;
5-(3-амидинофенил)-1-[(2'-трифторметил-[1,1']-дифен-4-ил)метил]тетразол;
1-[(3-амидинофенил)метил]-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-[(4-амидинофенил)метил]-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-2-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]имидазол;
1-(3-амидинофенил)-4-метил-2-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]имидазол;
1-(3-амидинофенил)-5-хлор-4-метил-2-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]имидазол;
5-(3-амидинофенил)-2-метил-4-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]имидазол;
1-(3-амидинофенил)-3-метил-5-[(4'-(бензимидазол-1-ил)фен-1-ил)аминокарбонил]пиразол;
1-(3-аминокарбонилфенил)-3-метил-5-[(4'-(бензимидазол-1-ил)фен-1-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(4'-(2-метилимидазол-1-ил)фенил)аминокарбонил]пиразол;
1-(3-аминокарбонилфенил)-3-метил-5-[(4'-(2-метилимидазол-1-ил)фенил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[[4'-(1,2,4-триазол-2-ил)фенил]аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-((4'-циклогексилфенил)аминокарбонил)пиразол;
1-(3-амидинофенил)-3-метил-5-[[1,1']-дифен-4-иламинокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-((4'-морфолинофенил)аминокарбонил)пиразол;
1-(3-амидинофенил)-3-метил-5-[(4'-((2-трифторметил)тетразол-1-ил)фенил)аминокарбонил]пиразол;
1-(3-аминометилфенил)-3-метил-5-[(4'-((2-трифторметил)тетразол-1-ил)фенил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[((4'-(N,N-диметиламино)карбониламино)фен-1'-ил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(4'-(N,N-диэтиламино)фенил)аминокарбонил]пиразол;
1-(3-аминокарбонилфенил)-3-метил-5-[((4'-N,N-диэтиламино)фенил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(4'-(1-тетразолил)фенил)аминокарбонил]пиразол;
1-(3-аминокарбонилфенил)-3-метил-5-((4'-(1-тетразолил)фенил)аминокарбонил)пиразол;
1-(3-амидинофенил)-3-метил-5-[(4'-(N-ацетилпиперизин-1-ил)фенил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(4'-(N-трет-бутилоксикарбонилпиперизин-1-ил)фенил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-((4'-пиперизин-1-илфенил)аминокарбонил)пиразол;
1-(3-амидинофенил)-3-трифторметил-5-((4'-циклогексилфенил)аминокарбонил)пиразол;
1-(3-амидинофенил)-3-метил-5-[(4'-(N-морфолино)-3'-хлорфенил)аминокарбонил]пиразол;
1-(3-амидинофенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-(метилтио)пиразол;
1-(3-амидинофенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-(метилсульфинил)пиразол;
1-(3-амидинофенил)-5-[(2'-aминocyльфoнил-[1,1']-дифен-4-ил)аминокарбонил]-3-(метилсульфонил)пиразол;
1-(3-аминокарбонилфенил)-5-[(2'-трифторметил-[1,1']-дифен-4-ил)метил]тетразол;
1-(3-аминокарбонилфенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)метил]тетразол;
1-(3-амидинофенил)-5-[(4'-циклопентилоксифенил)аминокарбонил]-3-метилпиразол;
1-(3-амидинофенил)-5-[(3-((пирид-2-ил)метиламино)фенил)аминокарбонил]-3-метилпиразол;
1-(3-амидинофенил)-3-метил-5-[(4'-(N-имидазолил)фенил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-трифторметил-5-[(4'-(N-морфолино)-3-хлорфенил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(4'-(N-пирролидинокарбонил)-3'-хлорфенил)аминокарбонил]пиразол;
1-(3-амидинофенил)-3-метил-5-[(4'-(N-морфолинокарбонил)-3-хлорфенил)аминокарбонил]пиразол;
1-(3-цианофенил)-5-[(4'-(N-имидазолил)фенил)аминокарбонил]-3-трифторметилпиразол;
1-(3-амидинофенил)-5-[(4'-(N-имидазолил)фенил)аминокарбонил]-3-трифторметилпиразол;
1-(3-амидинофенил)-5-[(4'-(N-метилтетразолон-1-ил)фенил)аминокарбонил]-3-трифторметилпиразол;
1-(3'-аминокарбонилфенил)-5-[(2'-аминосульфонилфенил-[1,1']-дифен-4-ил)метилкарбонил]-3-метилпиразол,
или его фармацевтически приемлемая соль.
22. Соединение по п. 1, выбранное из группы, включающей
1-(3-амидинофенил)-5-[(4'-(пирролидинометил)фенил)аминокарбонил]-3-метилпиразол;
1-(3-аминофенил)-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(2'-aминoфeнил)-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амино-4'-хлорфенил)-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амино-4'-фторфенил)-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амино-4'-метоксифенил)-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амино-4'-хлорфенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]тетразол;
1-(3-амино-4'-хлорфенил)-5-{[(2'-аминосульфонилфенил)пиридин-2-ил]аминокарбонил}тетразол;
1-(3-амино-4'-метоксифенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]тетразол;
1-(3-аминометилфенил)-5-[(2'-(аминосульфонилфенил)пирид-2-ил)аминокарбонил]-3-метилпиразол;
1-(3-аминометил-4'-метилфенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-аминометил-4'-фторфенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-аминометилфенил)-5-[(4'-(N-пирролидинокарбонил)фенил)аминокарбонил]-3-трифторметилпиразол;
1-(3-этилкарбоксиамидинофенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-(1'-имино-1'-(N-морфолино)метил)фенил)-5-[(2'-тpeт-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-(1'-имино-1'-(N-морфолино)метил)фенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол;
1-[3-[N-((5-метил-2-оксо-1,3-диоксол-4-ил)метоксикарбонил)амидино]фенил]-5-((2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил)-3-метилпиразол;
1-(пирид-2-ил)-3-метил-5-[(3-фтop-2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(6-бромпиридин-2-ил)-3-метил-5-[(3-фтор-2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-амино-4-хлорфенил)-5-[(2'-аминосульфонил-3-хлор-[1,1']-дифен-4-ил)аминокарбонил]тетразол;
1-(3-амино-4-хлорфенил)-5-[(4'-(1-пирролидинокарбонил)фенил)аминокарбонил]тетразол;
1-(3-аминометилфенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]тетразол;
1-(3-аминометилфенил)-5-[(2'-аминосульфонил-3-фтор-[1,1']-дифен-4-ил)аминокарбонил]тетразол;
1-(3-аминометилфенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]имидазол;
1-(3-аминометилфенил)-5-[(2'-метилсульфонилметил-[1,1']-дифен-4-ил)аминокарбонил]имидазол;
1-(3-амидинофенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]имидазол;
1-[3-(метиламинометил)фенил]-5-[(2'-аминосульфонил-3-фтор-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол;
1-[3-(метиламинометил)фенил]-5-[(2'-метилсульфонил-3-фтор-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-аминометилфенил)-5-[(2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]-4-метокси-3-трифтометилпиразол;
1-(3-аминометилфенил)-5-[(2-фтор-4-(N-пирролидинокарбонил)фенил)аминокарбонил]-3-трифторметилпиразол;
1-(3-аминометилфенил)-5-[(3-фтор-4-(N-пирролидинокарбонил)фенил)аминокарбонил]-3-трифторметилпиразол;
1-(3-аминометилфенил)-5-[(2'-сульфонилметил-[1,1']-дифен-4-ил)аминокарбонил]-3-трифторметилпиразол;
1-(3-аминометилфенил)-5-[(2'-аминосульфонил-3-фтор-[1,1']-дифен-4-ил)аминокарбонил]-3-трифторметилпиразол;
1-(3-аминометилфенил)-5-[(5-(2'-аминосульфонилфенил)-[1,6-дигидро]пиримид-2-ил)аминокарбонил]-3-трифторметилпиразол;
1-(3-аминометилфенил)-5-[(5-(2'-аминосульфонилфенил)пиримид-2-ил)аминокарбонил]-3-трифторметилпиразол;
1-[3-2'-этиламинофенил]-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-трифторметилпиразол;
1-[3-(1-(N-морфолино)имино)фенил]-5-[(2'-аминосульфонил-3-фтор-[1,1']-дифен-4-ил)аминокарбонил]-3-трифторметилпиразол;
1-(3-аминометилфенил)-5-[2-(2'-аминосульфонил-[1,1']-дифен-4-ил)-1-гидроксиэтил]-3-трифторметилпиразол;
1-(3-аминометилфенил)-5-[(3-фтор-2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-трифторметилпиразол;
1-(3-аминометилфенил)-5-[(5-(2'-метилсульфонилфенил)пиримид-2-ил)аминокарбонил]-3-трифторметилпиразол;
1-[3-амидинофенил]-5-[(3-фтор-2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-трифторметилпиразол;
1-[3-амидинофенил]-5-[(3-фтор-2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-трифторметилпиразол,
или его фармацевтически приемлемая соль.
23. Соединение по п.1, выбранное из группы, включающей
1-(3-аминометил)фенил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)карбонилметил]-3-трифторметилпиразол;
1-(3-аминометил)фенил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-(метилсульфонилметил)пиразол;
1-(3-амидино)фенил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-(метиламиносульфонилметил)пиразол;
1-(3-аминометилфенил)-5-[(2'-аминосульфонил-3-фтор-[1,1']-дифен-4-ил)аминокарбонил]-3-(метиламиносульфонилметил)пиразол;
1-(3-(N-карбоксиметил)амидинофенил)-5-[(5-(2'-аминосульфонилфенил)пиримид-2-ил)аминокарбонил]-3-метилпиразол;
1-(3-аминометилфенил)-5-[(2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-аминометилфенил)-5-[(2'-аминосульфонил-3-метил-[1,1']-дифен-4-ил)аминокарбонил]-3-трифторметилпиразол;
1-(3-аминометилфенил)-5-[(3-фтор-2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]-1,2,3-триазол;
1-(3-аминометил-4-метил)фенил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-аминометил-4-фтор)фенил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-аминометил-4-хлор)фенил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-аминометил-4-фтор)фенил-5-[(2'-аминосульфонил-3-фтор-[1,1']-дифен-4-ил)аминокарбонил]-3-трифторметилпиразол;
1-(3-аминометил)фенил-5-[(2'-аминосульфонил-3-фтор-[1,1']-дифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-аминометил)фенил-5-[(3-фтор-2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-трифторметилпиразол;
1-(3-амидинофенил)-3-метил-5-[(3-фтор-4-(N-морфолино)фенил)аминокарбонил]пиразол;
1-(3-аминометилфенил)-3-метил-5-[(3-фтор-4-(N-морфолино)фенил)аминокарбонил]пиразол;
1-(3-аминометилфенил)-3-трифторметил-5-((3-фтор-4-(2-метилимидазол-1-ил)фенил)аминокарбонил)пиразол;
1-(3-цианофенил)-3-трифторметил-5-(([1,1']-дифен-4-ил)оксиметил)пиразол;
1-(3-амидинофенил)-3-трифторметил-5-[([1,1']-дифен-4-ил)оксиметил]пиразол;
1-(3-карбоксамидофенил)-3-трифторметил-5-(([1,1']-дифен-4-ил)оксиметил)пиразол;
1-(3-амидинофенил)-3-трифторметил-5-((2-фтор-4-(N-морфолино)фенил)аминокарбонил)пиразол;
1-(3-карбоксамидофенил)-3-трифторметил-5-((2-фтор-4-(N-морфолино)фенил)аминокарбонил)пиразол;
1-(3-аминометилфенил)-3-трифторметил-5-((3-трифторметил-4-(N-морфолино)фенил)аминокарбонил)пиразол;
1-(3-аминометилфенил)-3-этил-5-[(3-фтор-2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-аминометилфенил)-3-этил-5-[(3-фтор-2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-аминометилфенил)-3-этил-5-[(2-фтор-4-(2-метилсульфонилимидазол-1-ил)фенил)аминокарбонил]пиразол;
1-[(6-(аминометил)пирид-2-ил)]-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-[(6-(N-гидроксиамидино)пирид-2-ил)]-3-метил-5-[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-[(6-амидинопирид-2-ил)]-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-[6-амидинопирид-2-ил]-3-метил-5-[3-фтор-(2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
1-(3-аминометилфенил)-3-метил-5-((2-меткоси-4-(N-морфолино)фенил)аминокарбонил)пиразол;
1-(3-аминометилфенил)-3-метил-5-[(4'-(3"-метил-5"-оксо-3"-пиpaзoлин-2''-ил)фенил)аминокарбонил]пиразол;
1-[3-(аминометил)фенил]-5-[(2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-(метилтио)пиразол;
1-(3-аминометил-4-фторфенил)-3-трифторметил-5-[(3-фтор-2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
этил 1-[3-(аминометил)фенил]-5-[(3-фтор-2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол-3-карбоксилат;
1-[3-(аминометил)фенил]-5-[(3-фтор-2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол-3-карбоновая кислота;
1-[3-(аминометил)фенил]-3-[аминокарбонил]-5-[3-фтор-(2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол;
этил 1-[3-(аминометил)фенил]-3-трифторметил-5-[(3-фтор-2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол-4-карбоксилат;
1-[3-(аминометил)фенил]-5-[(3-фтор-2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-(метилтио)пиразол;
1-[3-(аминометил)фенил]-5-[(3-фтор-2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-(метилсульфонил)пиразол;
1-[3-(аминометил)фенил]-5-[(4-(5-(метоксиаминокарбонил)имидазол-1-ил)фен-1-ил)аминокарбонил]-3-трифторметилпиразол;
1-(3-аминометилфенил)-5-[(4-(5-метил-1,2,3-триазол-1-ил)фен-1-ил)аминокарбонил]-3-трифторметилпиразол,
или его фармацевтически приемлемая соль.
24. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по любому из пп.1-23 или его фармацевтически приемлемой соли.
25. Способ лечения или профилактики тромбоэмболических осложнений, связанных с нарушением фактора Ха, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по любому из пп.1-23 или его фармацевтически приемлемой соли.
26. Соединение, выбранное из группы, включающей
1-(3-амидино)фенил-3-метил-5-[4'-(карбоксиметил)фениламинокарбонил]пиразол;
1-(3-амидино)фенил-3-метил-5-[4'-(N,N-диметиламинокарбонил)-фениламинокарбонил]пиразол;
1-(3-амидино)фенил-3-метил-5-[(4'-трет-бутиламиносульфонилфенил)аминокарбонил]пиразол;
1-(3-амидино)фенил-3-метил-5-[(4'-аминосульфонилфенил)аминокарбонил]пиразол; и
1-(3-амидино)фенил-3-метил-5-[(4'-трифторметилфенил)аминокарбонил]пиразол;
или его фармацевтически приемлемые соли.
27. Соединение по п.1, выбранное из группы, включающей
1-(3-аминометилфенил)-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-аминометилфенил)-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]-3-трифторметилпиразол;
1-(3-аминометилфенил)-5-[((2'-аминосульфонилфенил)пирид-2-ил)аминокарбонил]-3-метилпиразол;
1-(3-аминометилфенил)-5-[(4'-(N-пирролидинокарбонил)фенил)аминокарбонил]-3-трифторметилпиразол;
1-(3-аминометилфенил)-5-[(2-фтор-4(N-пирролидинокарбонил)фенил)аминокарбонил]-3-трифторметилпиразол;
1-(3-аминометилфенил)-5-[(2'-сульфонилметил-[1,1']-бифен-4-ил)аминокарбонил]-3-трифторметилпиразол;
1-(3-аминометилфенил)-5-[(2'-аминосульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]-3-трифторметилпиразол;
1-(3-аминометилфенил)5-[(3-фтор-2'-метилсульфонил-[1,1']-бифен-4-ил)аминокарбонил]-3-трифторметилпиразол;
1-(3-аминометил)фенил-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)карбонилметил]-3-трифторметилпиразол;
1-(3-аминометилфенил)-5-[(2'-метилсульфонил-[1,1']-бифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-аминометифенил)-5-[(2'-аминосульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]-3-метилпиразол;
1-(3-аминометилфенил)-3-метил-5-[(3-фтор-4-(N-морфолино)фенил)аминокарбонил]пиразол и
1-(3-аминометилфенил)-3-трифторметил-5-((3-фтор-4-(2-метилимидазол-1-ил)фенил)аминокарбонил)пиразол;
или его фармацевтически приемлемая соль.
28. Соединение по п.27, представляющее собой 1-(3-аминометилфенил)-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]-3-метилпиразол, или его фармацевтически приемлемая соль.
29. Соединение по п.27, представляющее собой 1-(3-аминометилфенил)-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)аминокарбонил]-3-трифторметилпиразол, или его фармацевтически приемлемая соль.
30. Соединение по п.27, представляющее собой 1-(3-аминометилфенил)-5-[(2'(аминосульфонилфенил)пирид-2-ил)аминокарбонил]-3-метилпиразол, или его фармацевтически приемлемая соль.
31. Соединение по п.27, представляющее собой 1-(3-аминометилфенил)-5-[(4'-(N-пирролидинокарбонил)фенил)аминокарбонил]-3-трифторметилпиразол, или его фармацевтически приемлемая соль.
32. Соединение по п.27, представляющее собой 1-(3-аминометилфенил)-5-[(2-фтор-4-(N-пирролидинокарбонил)фенил)аминокарбонил]-3-трифторметилпиразол, или его фармацевтически приемлемая соль.
33. Соединение по п.27, представляющее собой 1-(3-аминометилфенил)-5-[(2'-сульфонилметил-[1,1']-бифен-4-ил)аминокарбонил]-3-трифторметилпиразол, или его фармацевтически приемлемая соль.
34. Соединение яю п.27, представляющее собой 1-(3-аминометилфенил)-5-[(2'-аминосульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]-3-трифторметилпиразол, или его фармацевтически приемлемая соль.
35. Соединение по п.27, представляющее собой 1-(3-аминометилфенил)-5-[(3-фтор-2'-метилсульфонил-[1,1']-бифен-4-ил)аминокарбонил]-3-трифторметилпиразол, или его фармацевтически приемлемая соль.
36. Соединение по п.27, представляющее собой 1-(3-аминометилфенил)-5-[(2'-аминосульфонил-[1,1']-бифен-4-ил)карбонилметил]-3-трифторметилпиразол, или его фармацевтически приемлемая соль.
37. Соединение по п.27, представляющее собой 1-(3-аминометилфенил)-5-[(2'-метилсульфонил-[1,1']-бифен-4-ил)аминокарбонил]-3-метилпиразол, или его фармацевтически приемлемая соль.
38. Соединение по п.27, представляющее собой 1-(3-аминометилфенил)-5-[(2'-аминосульфонил-3-фтор-[1,1']-бифен-4-ил)аминокарбонил]-3-метилпиразол, или его фармацевтически приемлемая соль.
39. Соединение по п.27, представляющее собой 1-(3-аминометилфенил)-5-[(3-фтор-2'-метилсульфонил-[1,1']-бифен-4-ил)аминокарбонил]-3-трифторметилпиразол, или его фармацевтически приемлемая соль.
40. Соединение по п.27, представляющее собой 1-(3-аминометилфенил)-3-метил-5-[(3-фтор-4-(N-морфолино)фенил)аминокарбонил]пиразол, или его фармацевтически приемлемая соль.
41. Соединение по п.27, представляющее собой 1-(3-аминометилфенил)-3-трифторметил-5-[(3-фтор-4-(2-метилимидазол-1-ил)фенил)аминокарбонил]пиразол, или его фармацевтически приемлемая соль.
42. Соединение по п.27, где фармацевтически приемлемая соль выбрана из соли соляной кислоты, бромисто-водородной кислоты, серной кислоты, фосфорной кислоты, уксусной кислоты, янтарной кислоты, гликолевой кислоты, стеариновой кислоты, молочной кислоты, яблочной кислоты, винной кислоты, лимонной кислоты, аскорбиновой кислоты, малеиновой кислоты, фумаровой кислоты, толуолсульфоновой кислоты, метансульфоновой кислоты, щавелевой кислоты.
43. Соединение по п.42, где фармацевтически приемлемая соль представляет собой соль соляной кислоты.
44. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по любому из пп.27-43 или его фармацевтически приемлемой соли.
45. Способ лечения или профилактики тромбоэмболических заболеваний, связанных с нарушением фактора Ха, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количество соединения по любому из пп.27-43 или его фармацевтически приемлемой соли.
Текст
1 Техническая область изобретения Данное изобретение в широком смысле относится к азотсодержащим гетероароматическим соединениям, которые являются ингибиторами трипсиноподобных ферментов протеазы серина, в частности, фактора Ха, к фармацевтическим композициям, содержащим эти соединения, и способам их применения в качестве антикоагулянтных средств для лечения и профилактики тромбоэмболических осложнений. Описание предшествующего уровня В публикации WO 95/18111 описываются антагонисты рецепторов фибриногена, содержащие основные и кислотные концевые группы,формулы где R1 представляет собой основные концевые группы, U - связывающая группа, представляющая собой алкилен или гетероатом, V может представлять собой гетероцикл и правая часть молекулы содержит кислотные концевые группы. Заявленные в данном изобретении соединения не содержат кислотных концевых групп,приведенных в публикации WO 95/18111. В патенте США 5463071 (Himmelsbachet al.) описываются ингибиторы клеточной агрегации, которые представляют собой 5-членные гетероциклы формулы где гетероцикл может представлять собой ароматический цикл и группы А-В-С и F-E-D присоединяются к кольцевой системе. А-В-С может представлять собой широкий спектр заместителей, включая основные группы, присоединенные к ароматическому кольцу. Однако F-E-Dгруппа, как оказалось, должна представлять собой кислотную функциональность, что является отличием от данного изобретения. Кроме того,применение этих соединений в качестве ингибиторов фактора Ха не описывается. В патенте США 5317103 (Baker et al.) обсуждаются 5-HT1 агонисты, которые представляют собой индолзамещенные пятичленные гетероароматические соединения формулы где R1 может представлять собой пирролидин или пиперидин и А может представлять собой основную группу, включающую амино и амидино. Однако Baker et al. не указывают, что А может представлять собой замещенную кольцевую систему, подобную системе, которая со 003056 2 держится в заявленных в данном изобретении гетероароматических соединениях. В публикации WO 94/02477 (Baker et al.) обсуждаются 5-HT1 агонисты, которые представляют собой имидазолы, триазолы или тетразолы формулы где R1 представляет собой азотсодержащую кольцевую систему или азотсодержащий замещенный циклобутан и А может представлять собой основную группу, включающую амино и амидино. Однако Baker et al. не указывают, что А может представлять собой замещенную кольцевую систему, подобную системе, которая содержится в заявленных в данном изобретении гетероароматических соединениях. В публикации J. Med. Chem. 1978, 21(7),613-623 (Tidwell et аl.) описывается ряд диариламидин-производных, содержащих 3,5-бис(4 амидинофенил)пиррол. Этот ряд соединений испытывали по действию на тромбин, трипсин и панкреатический калликреин. Рассматриваемое в настоящее время изобретение не включает соединения этих типов. Активированный фактор Ха, главная практическая роль которого состоит в генерировании тромбина посредством ограниченного протеолиза протромбина, занимает центральное положение, которое связывает внутренний и внешний механизмы активации в конечном обычном ходе коагуляции крови. Генерация тромбина, конечной серин протеазы в ходе генерации фибринового сгустка из его предшественника усиливается посредством образования протромбиназного комплекса (фактор Ха, фактор V, Са 2+ и фосфолипид). Поскольку подсчитано, что одна молекула фактора Ха может генерировать 138 молекул тромбина (Elodi, S.,Vardi, К.: Optimization of conditions for the catalytic effect of the IXa-factor VIII Complex: Probable role of the complex in the amplification ofblood coagulation. Thromb Res. 1979, 15, 617629), ингибирование фактора Ха может быть более эффективным способом, чем инактивация тромбина при прерывании системы коагуляции крови. Следовательно, эффективные и специфичные ингибиторы фактора Ха являются необходимыми в качестве потенциально ценных терапевтических средств для лечения тромбоэмболических осложнений. Следовательно, желательно открытие новых ингибиторов фактора Ха. Краткое описание изобретения Таким образом, предметом данного изобретения являются новые азотсодержащие ароматические гетероциклы, которые полезны в 3 качестве ингибиторов фактора Ха, или их фармацевтически приемлемые соли или пролекарства. Другим предметом данного изобретения являются фармацевтические композиции, включающие фармацевтически приемлемый носитель и терапевтически эффективное количество,по меньшей мере, одного из соединений данного изобретения или его фармацевтически приемлемой соли или пролекарственной формы. Еще одним предметом данного изобретения является способ лечения тромбоэмболических осложнений, включающий введение в организм, нуждающийся в таком лечении, терапевтически эффективного количества, по меньшей мере, одного из соединений данного изобретения или его фармацевтически приемлемой соли или пролекарственной формы. Эти и другие предметы, которые станут очевидными из приведенного далее подробного описания, были достигнуты при помощи открытия авторов данного изобретения того, что соединения формулы (I) или их фармацевтически приемлемая соль или пролекарственные формы, где А, В, D, Е, G, J,M, R1a, R1b, s и m/z определены ниже, являются эффективными ингибиторами фактора Ха. Подробное описание предпочтительных воплощений[1] Таким образом, в первом воплощении данное изобретение предоставляет новые соединения формулы I или его стереоизомер или фармацевтически приемлемую соль, где кольцо М содержит, кроме J, 0-3 атома N, при условии, что если М содержит 2 атома N, тогда R1b отсутствует, и если М содержит 3 атома N, тогда R1a и R1b отсутствуют;G отсутствует или выбран из NHCH2,OCH2 и SСН 2, при условии, что когда s равно 0,тогда G присоединен к атому углерода кольца М;R1a и R1b независимо отсутствуют или выбраны из -(CH2)r-R1', NCH2R1, OCH2R1,SCH2R1, N(CH2)2(CH2)tR1', О(СН 2)2(СН 2)tR1' иS(СН 2)2(СН 2)tR1', или соединены с образованием 5-8-членного насыщенного, частично насыщенного или ненасыщенного кольца, замещенного 0-2 R4 и содержащего 0-2 гетероатома, выбранных из группы, состоящей из N, О и S;R2 в каждом случае выбран из Н, СF3,C1-6 алкила, бензила, С 3-6 карбоциклического остатка, замещенного 0-2 R4b, и 5-6-членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из N,O и S, и замещенной 0-2 R4b;R2a в каждом случае выбран из Н, СF3, C1-6 алкила, бензила, С 3-6 карбоциклического остатка,замещенного 0-2 R4b, и 5-6-членной гетероциклической системы, содержащей 1-4 гетероатома,выбранных из группы, состоящей из N, О и S, и замещенной 0-2 R4b;R2b в каждом случае выбран из СF3, C1-4 алкокси, C1-6 алкила, бензила, С 3-6 карбоциклического остатка, замещенного 0-2 R4b, и 5-6 членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы,состоящей из N, О и S и замещенной 0-2 R4b;R2c в каждом случае выбран из СF3, ОН,C1-4 алкокси, C1-6 алкила, бензила, С 3-6 карбоциклического остатка, замещенного 0-2 R4b, и 5-6 членной гетероциклической системы, содержащей 1-4 гетероатома, выбранных из группы,состоящей из N, О и S, и замещенной 0-2 R4b; альтернативно, R2 и R2a соединены с образованием 5- или 6-членного насыщенного, частично насыщенного или ненасыщенного кольца, 5 замещенного 0-2 R4b, которое содержит 0-1 дополнительный гетероатом, выбранный из группы, состоящей из N, О и S;R3 в каждом случае выбран из Н, C1-4 алкила и фенила;R3a в каждом случае выбран из Н, C1-4 алкила и фенила; А выбран из С 3-10 карбоциклического остатка, замещенного 0-2 R4, и 5-10-членной гетероциклической системы, включающей 1-4 гетероатома, выбранных из группы, состоящей из N, О и S, и замещенной 0-2 R4; В выбран изR4 в каждом случае выбран из =O,(CH2)rOR2, галогена, C1-4 алкила, -CN, NO2,(CH2)rNR2R2a,(СН 2)rC(O)R2b,NR2C(O)R2b,2 2a 2 2 2a С(О)NR R , NR C(О)NR R , CH(=NR2)NR2R2a,NHC(=NR2)NR2R2a, SO2NR2R2a, NR2SO2NR2R2a,NR2SO2-C1-4 алкила,NR2SO2R5,S(O)pR5,1 1R4a в каждом случае выбран из =O,(CH2)rOR2, галогена, C1-4 алкила, -CN, NO2,(СН 2)rNR2R2a,(СН 2)rС(О)R2b,NR2(O)R2b,2 2a 2 2 2aR4b в каждом случае выбран из =O,(CH2)rOR3, галогена, C1-4 алкила, -CN, NO2,(CH2)rNR3R3a,(CH2)rC(О)R3,NR3C(O)R3a,3 3a 3 3 3a С(О)NR R , NR C(О)NR R , CH(=NR3)NR3R3a,NH3C(=NR3)NR3R3a, SO2NR3R3a, NR3SO2NR3R3a,NR3SO2-C1-4 алкила, NR3SO2CF3, NR3SO2 фенила,S(O)pСF3, S(O)p-C1-4 алкила, S(O)pфенила иR5 в каждом случае выбран из CF3, C1-6 алкила, фенила, замещенного 0-2 R6; и бензила,замещенного 0-2 R6;R6 в каждом случае выбран из Н, ОН,(CH2)rOR2, галогена, C1-4 алкила, -CN, NO2,(CH2)rNR2R2a,(CH2)rC(О)R2b,NR2C(O)R2b,2 2 2aR7 в каждом случае выбран из Н, ОН, C1-6 алкила, C1-6 алкилкарбонила, C1-6 алкокси, C1-4 алкоксикарбонила, (CH2)nфенила, С 6-10 арилокси, С 6-10 арилоксикарбонила, С 6-10 арилметилкарбонила, C1-4 алкилкарбонилокси C1-4 алкоксикарбонила, С 6-10 арилкарбонилокси C1-4 алкоксикарбонила, C1-6 алкиламинокарбонила, фениламинокарбонила и фенил C1-4 алкоксикарбонила;R8 в каждом случае выбран из Н, C1-6 алкила и (СН 2)nфенила; альтернативно, R7 и R8 соединены с образованием 5- или 6-членного насыщенного кольца, которое содержит 0-1 дополнительный гетероатом, выбранный из группы, состоящей из N,О и S;R9 в каждом случае выбран из Н, C1-6 алкила и (СН 2)nфенила;n в каждом случае выбран из 0, 1, 2 и 3;m в каждом случае выбран из 0, 1 и 2; р в каждом случае выбран из 0, 1 и 2;r в каждом случае выбран из 0, 1, 2 и 3;s в каждом случае выбран из 0, 1 и 2; иt в каждом случае выбран из 0 и 1; при условии, что обе группы D-E-G-(СН 2)sи -Z-A-B не являются бензамидинами.[2] В предпочтительном воплощении данное изобретение предоставляет новые соединения формул Ia-IhNCH2O связь с кольцом М или группой А; А выбран из одной из следующих карбоциклических и гетероциклических систем, замещенных 0-2 R4; фенил, пиперидинил, пиперазинил, пиридил, пиримидил, фуранил, морфолинил, тиофенил, пирролил, пирролидинил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил,имидазолил, оксадиазолил, тиадиазолил, триазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил,1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2,3 тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, 1,2,3-триазолил, 1,2,4 триазолил, 1,2,5-триазолил, 1,3,4-триазолил,бензофуранил, бензотиофуранил, индолил, бензимидазолил, бензоксазолил, бензтиазолил, индазолил, бензизоксазолил, бензизотиазолил и изоиндазолил; В выбран из: Y, X-Y, NR2R2a,С(=NR2)NR2R2a и NR2C(=NR2)NR2R2a;X-Y не образуют N-N или O-N связи; альтернативно, Y выбран из одной из следующих карбоциклических и гетероциклических систем, замещенных 0-2 R4a; циклопропил, циклопентил, циклогексил,фенил, пиперидинил, пиперазинил, пиридил,пиримидил, фуранил, морфолинил, тиофенил,пирролил, пирролидинил, оксазолил, изоксазолил, изоксазолинил, тиазолил, изотиазолил, пиразолил, имидазолил, оксадиазолил, тиадиазолил, триазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5 тиадиазолил, 1,3,4-тиадиазолил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4 триазолил, бензофуранил, бензотиофуранил,индолил, бензимидазолил, бензоксазолил, бензтиазолил, индазолил, бензизоксазолил, бензизотиазолил и изоиндазолил; альтернативно, Y выбран из следующих бициклических гетероарильных кольцевых систем[3] В более предпочтительном воплощении данное изобретение предоставляет новые соединения формул IIa-IIf[4] В другом еще более предпочтительном воплощении данное изобретение предоставляет новые соединения формул IIa-IIf, где Е представляет фенил, замещенный R, или 2-пиридил,замещенный R;[5] В еще одном более предпочтительном воплощении данное изобретение предоставляет новые соединения формул IIa-IIf, где D-E выбран из 3-аминофенила, 3-амидинофенила, 3 аминометилфенила, 3-аминокарбонилфенила, 3(метиламинометил)фенила,3-(1-аминоэтил) фенила, 3-(2-амино-2-пропил)фенила, 4-хлор-3 аминофенила, 4-хлор-3-амидинофенила, 4-хлор 3-аминометилфенила,4-хлор-3-(метиламинометил)фенила, 4-фтор-3-аминофенила, 4-фтор 3-амидинофенила, 4-фтор-3-аминометилфенила,4-фтор-3-(метиламинометил)фенила, 6-аминопирид-2-ила, 6-амидинопирид-2-ила, 6-аминометилпирид-2-ила,6-аминокарбонилпирид-2 ила, 6-(метиламинометил)пирид-2-ила, 6-(1 аминоэтил)пирид-2-ила и 6-(2-амино-2-пропил) пирид-2-ила.[6] В другом еще более предпочтительном воплощении данное изобретение предоставляет новые соединения формул IIa-IIf, где Z представляет С(О)CH2 и CONH, при условии, что Z не образует N-N-связи с группой А; А выбран из фенила, пиридила и пиримидила и замещен 0-2 R4; и В выбран из X-Y, фенила, пирролидино,морфолино, 1,2,3-триазолила и имидазолила и замещен 0-1 R4a;R4 в каждом случае выбран из ОН,(CH2)rOR2, галогена, C1-4 алкила, (CH2)rNR2R2a иR5 в каждом случае выбран из CF3, C1-6 алкила, фенила и бензила; Х представляет CH2 или С(О); иY выбран из пирролидино и морфолино.[7] В другом более предпочтительном воплощении данное изобретение предоставляет новые соединения формул IIa-IIf, где А выбран из группы, включающей: фенил, 2-пиридил, 3 пиридил, 2-пиримидил, 2-Сl-фенил, 3-Сl-фенил,2-F-фенил, 3-F-фенил, 2-метилфенил, 2-аминофенил и 2 метоксифенил; и В выбран из группы, включающей: 2-СF3 фенил, 2-(аминосульфонил)фенил, 2-(метиламиносульфонил)фенил, 2-(диметиламиносульфонил)фенил, 1-пирролидинокарбонил, 2-(метилсульфонил)фенил,4-морфолино,2-(1'-СF3 тетразол-2-ил)фенил, 4-морфолинокарбонил, 2 метил-1-имидазолил, 5-метил-1-имидазолил, 2 метилсульфонил-1-имидазолил и 5-метил-1,2,3 триазолил.[8] В другом более предпочтительном воплощении данное изобретение предоставляет новые соединения формул IIa-IIf, где Е представляет фенил, замещенный R, или 2-пиридил, замещенный R;R4 в каждом случае выбран из ОН,(CH2)rOR2, галогена, C1-4 алкила, (CH2)rNR2R2a иR5 в каждом случае выбран из СF3, C1-6 алкила, фенила и бензила; Х представляет СН 2 или С(О); иY выбран из пирролидино и морфолино.[9] В другом более предпочтительном воплощении данное изобретение предоставляет новые соединения формул IIa-IIf, где[10] В еще более предпочтительном воплощении данное изобретение предоставляет новое соединение формулы IIа.[11] В другом еще более предпочтительном воплощении данное изобретение предоставляет новое соединение формулы IIb.[12] В другом еще более предпочтительном воплощении данное изобретение предоставляет новое соединение формулы IIc.[13] В другом еще более предпочтительном воплощении данное изобретение предоставляет новое соединение формулы IId.[14] В другом еще более предпочтительном воплощении данное изобретение предоставляет новое соединение формулы IIе.[15] В другом еще более предпочтительном воплощении данное изобретение предоставляет новое соединение формулы IIf.[16] В другом еще более предпочтительном воплощении данное изобретение предоставляет новые соединения формулы IIа-IIf, гдеR1a и R1b независимо отсутствуют или выбраны из -(СН 2)r-R1', NCH2R1, OCH2R1,SCH2R1, N(CH2)2(CH2)tR1', O(CH2)2(CH2)tR1' иS(CH2)2(CH2)tR1' или соединены с образованием 5-8-членного насыщенного, частично насыщенного или ненасыщенного кольца, замещенного 0-2 R4, и которое содержит 0-2 гетероатома, выбранных из группы, состоящей из N, О и S;R1' в каждом случае выбран из Н, С 1-3 алкила, галогена, (CF2)rCF3, OR2, NR2R2a,С(O)R2c, (CF2)rCO2R2c, S(O)pR2b, NR2(CH2)rOR2,NR2C(O)R2b,NR2C(O)2R2b,C(O)NR2R2a,2 2a 2 2bSO2NR R и NR SO2R ; А выбран из следующих карбоциклических и гетероциклических систем, замещенных 0-2 R4;X-Y не образуют N-N или O-N связи; альтернативно, Y выбран из следующих карбоциклических и гетероциклических систем,замещенных 0-2 R4a; фенил, пиперидинил, пиперазинил, пиридил, пиримидил, фуранил, морфолинил, тиофенил, пирролил, пирролидинил, оксазолил, изоксазолил, изоксазолинил, тиазолил, изотиазолил, пиразолил, имидазолил, оксадиазолил, тиадиазолил, триазолил, 1,2,3-оксадиазолил, 1,2,4 оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил,1,2,5-тиадиазолил, 1,3,4-тиадиазолил, 1,2,3 триазолил, 1,2,4-триазолил, 1,2,5-триазолил и 1,3,4-триазолил;R4 в каждом случае выбран из =O, ОН, Cl,F, C1-4 алкила, (CH2)rNR2R2a, (CH2)rC(O)R2b,NR2C(O)R2b,C(O)NR2R2a,CH(=NH)NH2,NHC(=NH)NH2, SO2NR2R2a, NR2SO2-C1-4 алкила,NR2SO2R5, S(O)pR5 и (CF2)rCF3;R4a в каждом случае выбран из =O, ОН, Cl,F, C1-4 алкила, (CH2)rNR2R2a, (СН 2)rС(O)R2b,NR2C(O)R2b,C(O)NR2R2a,СН(=NН)NН 2,NHC(=NH)NH2, SO2NR2R2a, NR2SO2-C1-4 алкила,NR2SO2R5, S(O)pR5, (CF2)rCF3 и 1-СF3-тетразол 2-ила;R5 в каждом случае выбран из СF3, C1-6 алкила, фенила, замещенного 0-2 R6, и бензила,замещенного 0-2 R6;R6 в каждом случае выбран из Н, =O, ОН,2R7 в каждом случае выбран из Н, ОН, C1-6 алкила, C1-6 алкилкарбонила, C1-6 алкокси, C1-4 алкоксикарбонила, бензила, С 6-10 арилокси, С 6-10 арилоксикарбонила, С 6-10 арилметилкарбонила,C1-4 алкилкарбонилокси C1-4 алкоксикарбонила,С 6-10 арилкарбонилокси C1-4 алкоксикарбонила,C1-6 алкиламинокарбонила, фениламинокарбонила и фенил C1-4 алкоксикарбонила;R8 в каждом случае выбран из Н, C1-6 алкила и бензила; и альтернативно, R7 и R8 соединены с образованием морфолиногруппы; иR9 в каждом случае выбран из Н, C1-6 алкила и бензила.[17] В другом еще более предпочтительном воплощении данное изобретение предоставляет новые соединения формулы IIa-IIf, где ЕC(O)NR R и SO2NR R ; А выбран из следующих карбоциклических и гетероциклических систем, замещенных 0-2 R4; фенил, пиридил, пиримидил, фуранил,тиофенил, пирролил, оксазолил, изоксазолил,тиазолил, изотиазолил, пиразолил и имидазолил; В выбран из Y и X-Y; Х выбран из СН 2, -CR2(CR2R2b)-, -С(О)-,-C(=NR)-, -СН(NR2R2a)-, -C(O)NR2-, -NR2C(O)-,-NR2C(O)NR2-, -NR2- и О;X-Y не образуют N-N или O-N связи; альтернативно, Y выбран из следующих карбоциклических и гетероциклических систем,замещенных 0-2 R4a; фенил, пиперидинил, пиперазинил, пиридил, пиримидил, фуранил, морфолинил, тиофенил, пирролил, пирролидинил, оксазолил, изоксазолил, изоксазолинил, тиазолил, изотиазолил, пиразолил, имидазолил, оксадиазолил, тиадиазолил, триазолил, 1,2,3-оксадиазолил, 1,2,4 оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил,1,2,5-тиадиазолил, 1,3,4-тиадиазолил, 1,2,3 триазолил, 1,2,4-триазолил, 1,2,5-триазолил и 1,3,4-триазолил;R2 в каждом случае выбран из Н, CF3, СН 3,бензила и фенила;R2a в каждом случае выбран из Н, СF3,СН 3, бензила и фенила;R2b в каждом случае выбран из СF3, ОСН 3,СН 3, бензила и фенила;R2c в каждом случае выбран из СF3, ОН,ОСН 3, СН 3, бензила и фенила; альтернативно, R2 и R2a соединены с образованием 5 или 6-членного насыщенного, частично ненасыщенного или ненасыщенного кольца, которое содержит 0-1 дополнительных гетероатомов, выбранных из группы, состоящей из N, О и S;R3 в каждом случае выбран из Н, СН 3,СН 2 СН 3 и фенила;R3a в каждом случае выбран из Н, СН 3,СН 2 СН 3 и фенила;R4 в каждом случае выбран из ОН, Cl, F,СН 3, СН 2 СН 3, NR2R2a, CH2NR2R2a, С(O)R2b,NR2C(O)R2b, C(O)NR2R2a и СF3;R4a в каждом случае выбран из ОН, Cl, F,СН 3, СН 2 СН 3, NR2R2a, CH2NR2R2a, С(O)R2b,C(O)NR2R2a, SO2NR2R2a, S(O)pR5, СF3 и 1-СF3 тетразол-2-ила;R5 в каждом случае выбран из СF3, C1-6 алкила, фенила, замещенного 0-2 R6, и бензила,замещенного 1 R6;R6 в каждом случае выбран из Н, ОН,ОСН 3, Cl, F, СН 3, CN, NO2, NR2R2a, CH2NR2R2a иR7 в каждом случае выбран из Н, ОН, C1-3 алкила, C1-3 алкилкарбонила, C1-3 алкокси, C1-4 алкоксикарбонила, бензила, фенокси, феноксикарбонила, бензилкарбонила, C1-4 алкилкарбонилокси C1-4 алкоксикарбонила, фенилкарбонилокси C1-4 алкоксикарбонила, C1-6 алкиламинокарбонила, фениламинокарбонила и фенил C1-4 алкоксикарбонила;R8 в каждом случае выбран из Н, СН 3 и бензила; и альтернативно, R7 и R8 соединены с образованием морфолиногруппы;R9 в каждом случае выбран из Н, СН 3 и бензила.[18] В еще одном более предпочтительном воплощении данное изобретение предоставляет новые соединения формулы IIa-IIf, где R1a отсутствует или выбран из Н, СН 3, СH2 СН 3, Cl, F,СF3, ОСН 3, NR2R2a, S(O)pR2b, C(O)NR2R2a,CH2S(O)pR2b,CH2NR2S(O)pR2b,C(O)R2c,2c 2 2aR1b отсутствует или выбран из Н, СН 3,СН 2 СН 3, Cl, F, СF3, ОСН 3, NR2R2a, S(O)pR2b,C(O)NR2R2a, CH2S(O)pR2b, CH2NR2S(O)pR2b,C(O)R2b, CH2C(O)R2b и SO2NR2R2a; А выбран из следующих карбоциклических и гетероциклических систем, замещенных 0-2 R4: фенил, пиридил и пиримидил; В выбран из Y и X-Y; Х выбран из -С(О) и О;X-Y не образуют O-N связь; альтернативно, Y выбран из следующих карбоциклических и гетероциклических систем,замещенных 0-2 R4: фенил, пиперазинил, пиридил, пиримидил,морфолинил, пирролидинил, имидазолил и 1,2,3-триазолил;R2 в каждом случае выбран из Н, СF3, СН 3,бензила и фенила;R2a в каждом случае выбран из Н, СF3,СН 3, бензила и фенила;R2b в каждом случае выбран из СF3, ОСН 3,СН 3, бензила и фенила;R2c в каждом случае выбран из СF3, ОН,ОСН 3, СН 3, бензила и фенила; альтернативно, R2 и R2a соединены с образованием кольцевой системы, выбранной из пирролидинила, пиперазинила и морфолино;R4 в каждом случае выбран из Cl, F, СН 3,2 2aR4a в каждом случае выбран из Cl, F, СН 3,SO2NR2R2a, S(O)pR5 и СF3; иR5 в каждом случае выбран из СF3 и СН 3.[19] Особенно предпочтительные соединения данного изобретения выбраны из группы,включающей следующие соединения: 1-(3-амидинофенил)-2-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиррол; 1-(3-амидинофенил)-2-[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил] пиррол; 1-(3-амидинофенил)-2-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-4-бромпиррол; 1-(3-амидинофенил)-2-5-(2'-аминосульфонилфен-1-ил)пиридин-2-ил]аминокарбонил] пиррол; 1-бензил-3-[(2'-аминосульфонил-[1,1']дифен-4-ил)аминокарбонил]-4-(3-амидинофенил)пиррол; 1-бензил-3-[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил]-4-(3 амидинофенил)пиррол; 1-(3-амидинофенил)-4-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]имидазол; 1-(3-амидинофенил)-4-[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил] имидазол; 1-(3-амидинофенил)-2-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]имидазол; 1-(3-амидинофенил)-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил] пиразол; 1-(3-амидинофенил)-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)карбониламино] пиразол; 1-(3-амидинофенил)-3-метил-5-2'-(5CF3-тeтpaзoлил)-[1,1']-дифен-4-ил)аминокарбонил)пиразол; 1-(3-амидинофенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-4-хлор-3 метилпиразол; 1-(3-амидинофенил)-5-([2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил)-3-трифторметилпиразол; 1-(3-амидинофенил)-4-метокси-5-2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил)-3-трифторметилпиразол; 1-(3-амидинофенил)-3-метил-5-(4'-(имидазол-1-илфенил)аминокарбонил)пиразол; 1-(3-амидинофенил)-3-метил-5-[(4'-(2cyльфoнилмeтил)феноксифенил)аминокарбонил]пиразол; 1-(3-амидинофенил)-3-метил-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)метилкарбонил] пиразол; 1-(3-амидинофенил)-5-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-1,2,3 триазол; 1-(3-амидинофенил)-5-2'-трифторметил[1,1']-дифен-4-ил)аминокарбонил)тетразол; 25 1-[(6-(N-гидроксиамидино)пирид-2-ил)]-3 метил-5-[(2'-трет-бутиламиносульфонил-[1,1']дифен-4-ил)аминокарбонил]пиразол; 1-[(6-амидинопирид-2-ил)]-3-метил-5-[(2'аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол; 1-[6-амидинопирид-2-ил]-3-метил-5-[3 фтор-(2'-метилсульфонил-[1,1']-дифен-4-ил) аминокарбонил]пиразол; 1-(3-аминометилфенил)-3-метил-5-2 метокси-4-(N-морфолино)фенил)аминокарбонил)пиразол; 1-(3-аминометилфенил)-3-метил-5-[4'-(3 метил-5-оксо-3"-пиразолин-2-ил)фенил) аминокарбонил]пиразол; 1-[3-(аминометил)фенил]-5-[(2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3(метилтио)пиразол; 1-(3-аминометил-4-фторфенил)-3-трифторметил-5-[(3-фтор-2'-метилсульфонил-[1,1']дифен-4-ил)аминокарбонил]пиразол; этил 1-[3-(аминометил)фенил]-5-[(3-фтор 2'-метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол-3-карбоксилат; 1-[3-(аминометил)фенил]-5-[(3-фтор-2'метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиразол-3-карбоновая кислота; 1-[3-(аминометил)фенил]-3-[аминокарбонил]-5-[3-фтор-(2'-метилсульфонил-[1,1']дифен-4-ил)аминокарбонил]пиразол; этил 1-[3-(аминометил)фенил]-3-трифторметил-5-[(3-фтор-2'-метилсульфонил-[1,1']дифен-4-ил)аминокарбонил]пиразол-4-карбоксилат; 1-[3-(аминометил)фенил]-5-[(3-фтор-2'метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-(метилтио)пиразол; 1-[3-(аминометил)фенил]-5-[(3-фтор-2'метилсульфонил-[1,1']-дифен-4-ил)аминокарбонил]-3-(метилсульфонил)пиразол; 1-[3-(аминометил)фенил]-5-[(4-(5-(метоксиаминокарбонил)имидазол-1-ил)фен-1-ил) аминокарбонил]-3-трифторметилпиразол; 1-(3-аминометилфенил)-5-[(4-(5-метил 1,2,3-триазол-1-ил)фен-1-ил)аминокарбонил]-3 трифторметилпиразол; и их фармацевтически приемлемые соли. Во втором воплощении данное изобретение предоставляет фармацевтические композиции, включающие фармацевтически приемлемый носитель и терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли. В третьем воплощении данное изобретение предоставляет новый способ лечения или профилактики тромбоэмболического осложнения,включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. 26 Определения Соединения, описанные в данном изобретении, имеют асимметрические центры. Соединения данного изобретения, содержащие асимметрически замещенный атом, могут быть выделены в оптически активной или рацемической формах. Хорошо известно, как получают оптически активные формы, например, разделением рацемических форм или синтезом из оптически активных исходных материалов. Большое количество геометрических изомеров олефинов,C=N двойных связей и т.п. также могут присутствовать в описанных в данном изобретении соединениях, и все такие стабильные изомеры рассматриваются в данном изобретении. Цис- и транс-геометрические изомеры соединений данного изобретения описываются и могут быть выделены в виде смеси изомеров или в виде отдельных изомерных форм. Все хиральные,диастереомерные, рацемические формы и все геометрические изомерные формы структуры подразумеваются, если конкретно не указана специфическая стереохимия или изомерная форма. Термин "замещенный", используемый в данном описании, означает, что любой один или большее количество атомов водорода на указанном атоме заменены заместителем, выбранным из указанной группы, при условии, что обычная валентность указанного атома не превышена, и что замещение приводит к стабильному соединению. Когда заместитель представляет собой кетогруппу (т.е. =O), то заменяются два атома водорода на одном атоме. Когда любой изменяемый заместитель (например, R6) встречается более одного раза в любой составляющей или формуле соединения, его определение в каждом случае является независимым от его определения в каждом другом случае. Таким образом, например, если группа,как показано, является замещенной от 0 до 2 R6,то указанная группа может необязательно содержать в качестве заместителя до двух группR6, и каждый из R6 имеет значения, независимо выбранные из определения R6. Кроме того, сочетание заместителей и/или переменных допускаются только в том случае, если такие сочетания приводят к стабильным соединениям. Когда связь с заместителем, как показано,перекрывает связь, соединяющую два атома в кольце, то такой заместитель может находиться в любом положении кольца (связан с любым атомом кольца). Когда заместитель показан без указания атома, через который такой заместитель связан с остальной частью соединения данной формулы, то такой заместитель может быть связан через любой атом, находящийся в таком заместителе. Сочетания заместителей и/или переменных допустимы только в том случае, если такие сочетания приводят к стабильным соединениям. 27 Термин "C1-6 алкил", используемый в данном описании, как подразумевается, включает как разветвленные, так и прямые насыщенные алифатические углеводородные группы, содержащие конкретное количество атомов углерода,примеры которых включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, нбутил, изобутил, втор-бутил, трет-бутил, пентил и гексил; термин "алкенил", как подразумевается, включает углеводородные формы с прямой или разветвленной цепью и с одной или большим количеством ненасыщенных углеродуглеродных связей, которые могут встречаться в любой стабильной точке вдоль цепи, например,этенил, пропенил и т.п. Термин "галоген", используемый в данном описании, относится к фтору, хлору, брому или иоду; и термин "противоион" используется для обозначения небольшой отрицательно заряженной частицы, такой как хлорид, бромид, гидроксид, ацетат, сульфат и т.п. Термин "карбоцикл" или "карбоциклический остаток", используемый в данном описании, означает любой стабильный 3-7-членный моноциклический или бициклический или 7-13 членный бициклический или трициклический остаток, любой из которых может быть насыщенным, частично ненасыщенным или ароматическим. Примеры таких карбоциклов включают, но не ограничиваются ими, циклопропил,циклобутил, циклопентил, циклогексил, циклогептил, адамантил, циклооктил, [3.3.0]бициклооктан, [4.3.0]бициклононан, [4.4.0]бициклодекан(декалин), [2.2.2]бициклооктан, флуоренил, фенил, нафтил, инданил, адамантил или тетрагидронафтил (тетралин). Термин "гетероцикл" или "гетероциклическая система", используемый в данном описании, как подразумевают, означает стабильное 57-членное моно- или бициклическое или 7-10 членное бициклическое гетероциклическое кольцо, которое является насыщенным, частично ненасыщенным или ненасыщенным (ароматическим), и состоящее из атома углерода и 1-4 гетероатомов, независимо выбранных из группы, содержащей N, О и S, и включающее любую бициклическую группу, в которой любые, определенные выше гетероциклические кольца конденсированы с бензольным кольцом. N и S гетероатомы необязательно могут быть окисленными. Гетероциклическое кольцо может быть присоединено к этой боковой группе через любой гетероатом или атом углерода, который приводит к получению стабильной структуры. Гетероциклические кольца, описанные здесь, могут быть замещенными у атома углерода или азота,если образующееся соединение является стабильным. Если не указано специально, азот в гетероцикле может быть необязательно кватернизованным. Предпочтительно, когда общее количество атомов S и О в гетероцикле свыше 1, эти гете 003056 28 роатомы не являлись бы соседними по отношению друг к другу. Предпочтительно, чтобы общее количество атомов S и О в гетероцикле составляло не более 1. Термин "ароматическая гетероциклическая система", как подразумевается, относится к стабильному 5-7-членному моно- или бициклическому или 7-10-членному бициклическому гетероциклическому ароматическому кольцу, состоящему из атомов углерода и 1-4 гетероатомов, независимо выбранных изN, О и S. Предпочтительно, чтобы общее количество S и О атомов в ароматическом гетероцикле составляло не более 1. Примеры гетероциклов включают, но не ограничиваются ими, 1 Н-индазол, 2-пирролидонил, 2 Н,6 Н-1,5,2-дитиазинил, 2 Н-пирролил, 3 Ниндолил, 4-пиперидонил, 4 аН-карбазол, 4 Нхинолизинил, 6 Н-1,2,5-тиадиазинил, акридинил,азоцинил, бензимидазолил, бензофуранил, бензотиофуранил, бензотиофенил, бензоксазолил,бензтиазолил, бензтриазолил, бензтетразолил,бензизоксазолил, бензизотиазолил, бензимидазолил, карбазолил, 4 аН-карбазолил, -карболинил, хроманил, хроменил, циннолинил, декагидрохинолинил, 2H,6 Н-1,5,2-дитиазинил, дигидрофуро[2,3-b]тетрагидрофуран,фуранил,фуразанил, имидазолидинил, имидазолинил,имидазолил, 1H-индазолил, индоленил, индолинил, индолизинил, индолил, изобензофуранил,изохроманил, изоиндазолил, изоиндолинил,изоиндолил, изохинолинил, изотиазолил, изоксазолил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил,1,3,4-оксадиазолил, оксазолидинил, оксазолил,оксазолидинилперимидинил, фенантридинил,фенантролинил, фенарсазинил, феназинил, фенотиазинил, феноксатиинил, феноксазинил,фталазинил, пиперазинил, пиперидинил, птеридинил, пиперидонил, 4-пиперидонил, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол,пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, пирролил, хиназолинил,хинолинил, 4H-хинолизинил, хиноксалинил,хинуклидинил, карболинил, тетрагидрофуранил,тетрагидроизохинолинил,тетрагидрохинолинил, 6 Н-1,2,5-тиадиазинил, 1,2,3-тиадиазолил,1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4 тиадиазолил, тиантренил, тиазолил, тиенил,тиенотиазолил, тиенооксазолил, тиеноимидазолил, тиофенил, триазинил, 1,2,3-триазолил,1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил, ксантенил. Предпочтительные гетероциклы включают, но не ограничиваются ими, пиридинил, фуранил, тиенил, пирролил, пиразолил,имидазолил, индолил, бензимидазолил, 1Hиндазолил, оксазолидинил, бензотриазолил,бензизоксазолил, оксиндолил, бензоксазолинил или изатиноил (isatinoyl). В этот перечень включаются также конденсированные кольцевые и 29 спиро-соединения, содержащие, например, указанные гетероциклы. Фраза фармацевтически приемлемый" используется в данном изобретении для ссылки на те соединения, материалы, композиции и/или лекарственные формы, которые в узком медицинском смысле пригодны для применения в контакте с тканями человека и животных без избыточной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения при соразмерном приемлемом соотношении польза/риск. Термин "фармацевтически приемлемые соли", используемый в данном описании, относится к производным заявленных соединений, в которых исходное соединение модифицировано посредством получения его кислотных или основных солей. Примеры фармацевтически приемлемых солей включают, но не ограничиваются ими, основные остатки солей минеральных или органических кислот, таких как амины; кислотные остатки щелочных или органических солей, таких как карбоновые кислоты и т.п. Фармацевтически приемлемые соли включают традиционные нетоксичные соли или четвертичные аммониевые соли исходного соединения, образованные, например, с нетоксичными неорганическими или органическими кислотами. Например, такие традиционные нетоксичные соли включают соли, полученные из неорганических кислот, таких как соляная, бромисто-водородная, серная, сульфаминовая, фосфорная, азотная и т.п.; и соли, полученные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая,молочная, яблочная, винная, лимонная, аскорбиновая, памоиновая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная,салициловая,сульфаниловая,2 ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая,щавелевая, изэтионовая кислоты и т.п. Фармацевтически приемлемые соли данного изобретения могут быть синтезированы из исходного соединения, которое содержит основной или кислотный фрагмент, традиционными химическими способами. Обычно, такие соли могут быть получены взаимодействием свободной кислоты или основной формы этих соединений со стехиометрическим количеством подходящего основания или кислоты в воде или в органическом растворителе или в их смеси; обычно предпочтительна неводная среда, например, простой эфир, этилацетат, этанол, изопропанол или ацетонитрил. Перечень подходящих солей находится в публикации Remington'sCompany, Easton, PA, 1985, p. 1418, содержание которой введено в описание в качестве ссылки. Термин "пролекарства", как подразумевают, включает любые, ковалентно связанные носители, которые высвобождают активное ис 003056 30 ходное лекарственное средство согласно формуле (I) in vivo, когда такое пролекарство вводят млекопитающему субъекту. Пролекарства соединения формулы (I) получают модификацией функциональных групп, присутствующих в указанном соединении, таким образом, чтобы эти модификации расщеплялись по установленным процедурам или in vivo с получением исходного соединения. Пролекарства включают соединения формулы (I), в которых гидроксильная, амино- или сульфгидрильная группа связана с любой группой, которая при введении пролекарства или соединения формулы (I) млекопитающему субъекту расщепляется с образованием свободной гидроксильной, свободной амино- или свободной сульфгидрильной группы соответственно. Примеры пролекарств включают, но не ограничиваются ими, ацетат-, формиат- и бензоатпроизводные спиртовых и аминофункциональных групп в соединениях формулы(I) и т.п. Предпочтительные пролекарства представляют собой амидиновые пролекарства, в которых D представляет C(=NR7)NH2 или его таутомер C(=NH)NHR7, и R7 выбран из группы,включающей ОН, C1-4 алкокси, С 6-10 арилокси,C1-4 алкоксикарбонил,С 6-10 арилоксикарбонил,С 6-10 арилметилкарбонил, C1-4 алкилкарбонилоксиC1-4 алкоксикарбонил. Более предпочтительными пролекарствами являются пролекарства, в которых R7 представляет ОН, метокси, этокси, бензилоксикарбонил, метоксикарбонил и метилкарбонилоксиметоксикарбонил. Термины "стабильное соединение" и "стабильная структура" используются для обозначения соединения, которое является достаточно устойчивым, чтобы сохраниться до полезной степени чистоты в реакционной смеси и затем в приготовлении лекарственного средства. Синтез Соединения данного изобретения могут быть получены рядом способов, известных квалифицированному специалисту в области органического синтеза. Соединения данного изобретения могут быть синтезированы с использованием способов, описанных ниже, в сочетании со способами синтеза, известными в области химии органического синтеза, или посредством их видоизменений, как оценено квалифицированными специалистами. Предпочтительные способы включают, но не ограничиваются ими,способы, описанные ниже. Реакции проводят в растворителе, подходящем для используемых реагентов и материалов и приемлемом для проводимых превращений. Квалифицированному специалисту в области органического синтеза будет ясно, что функциональность, присутствующая в молекуле, должна согласовываться с предложенными превращениями. Иногда необходимо ограничение для изменения порядка стадий синтеза или для выбора среди прочих одной конкретной схемы процесса для получе 31 ния требуемого соединения по изобретению. Также будет понятно, что другим основным вопросом при планировании любого пути синтеза в этой области является разумный выбор защитной группы, используемой для защиты реакционноспособных функциональных групп,присутствующих в соединениях, описанных в данном изобретении. Солидный обзор, описывающий большое количество вариантов для практикующего врача, представляет собойSynthesis, Wiley and Sons, 1991). Все приведенные здесь публикации введены во всей полноте в качестве ссылки. Соединения формулы I, в которых кольцо М представляет пиррол, могут быть получены по методикам, приведенным на схемах 1-9. Схема 1 На схеме 1 показано получение пирролов,в которых группа Q-Е присоединена к азоту пиррола, где Q представляет функциональность,которая может быть превращена в D формулы I,Re представляет функциональность, которая может быть превращена в Z-A-B формулы I, иRf представляет или может быть превращена вR1a формулы I. Окисление фурана бромом в уксусной кислоте может приводить к получению 2,5-диацетоксидигидрофурана, который может взаимодействовать с амином Q-E-NH2 с получением пиррола. Формилирование ВильсмейераХаака (Vilsmeier-Haack) с оксихлоридом фосфора и ДМФ предпочтительно можно проводить с ацилатом в положении С-2 пиррольного кольца. Окисление образовавшегося альдегида может давать карбоновую кислоту. Карбоновая кислота затем может быть превращена в аминпроизводные с использованием разложения Хофмана (Hofmann) полученного первичного амида (Huisgen et al. Chem. Ber. 1960, 93, 65) или перегруппировки Куртиуса (Curtius) полученного ацилазида (J. Prakt. Chem. 1909, 42,477). Производные, которые содержат атом серы, присоединенный к пиррольному кольцу,могут быть получены прямым сульфированием при использовании комплекса пиридинтриоксид серы с получением сульфоновых кислот или обработкой тиоцианатом меди(II) (J.Het. Chem. 1988, 25, 431) с последующим восстановлением промежуточного тиоцианата боргидридом натрия с получением меркаптана.Rf и Rg совместно представляют собой водород или группу, которая может быть превращена вR1a и R1b формулы I. Синтез пиррола по методу Хантца (Hantzsch) представляет собой универсальную реакцию, заключающуюся в циклизации соответствующего сложного -кетоэфира с-галогенкетоном или альдегидом в присутствии первичного амина (Ber. Dtsch. Chem. Ges. 1980, 23, 1474). Сложные -кетоэфиры могут быть получены из хлорангидридов кислот (X = Сl) путем добавления магниевого аниона алкилмалоната калия с последующим декарбоксилированием (Synthesis 1993, 290). Альтернативно, сложные -кетоэфиры могут быть получены из соответствующего альдегида (R = Н) реакцией Реформатски (Reformatsky) с -бромацетатом с последующим окислением. Циклизация с галогенкетоном или альдегидом в присутствии первичного амина может привести к получению пирролов. Кислотный гидролиз 3-карбоалкоксипиррола может привести к получению карбоновых кислот. Пирролы, которые содержат 3 аминозаместитель, могут быть получены из кислот обработкой фосфорилазидом и триэтиламином для выполнения перегруппировки Куртиуса с получением изоцианатов (J. Med. Chem. 1981, 24, 33), которые в результате гидролиза могут давать 3-аминопирролы. Пирролы, которые содержат атом серы в положении С-3, могут быть получены из кислот при применении методики Хунсдикера (Hunsdiecker) с получением 3-бром-производных. Замена атома галогена на атом металла при низкой температуре алкиллитиевым реагентом может привести к 3-литийпроизводному, которое может быть погашено различными электрофилами, такими как S8, с получением тиолов непосредственно или при взаимодействии с Cu(SCN)2 с получением тиоцианата, который может быть восстановлен боргидридом натрия. Тиолы могут быть далее окислены до производных сульфоновой кислоты окислителем, таким как KMnO4. На схеме 3 показано получение пирролов,в которых Q-E присоединена в положении 3. Эта схема реализует экстремально универсальный синтез пирролов по методу Кнорра (Knorr),который заключается в конденсации -аминокетонов со сложными -кетоэфирами. -Аминокетоны могут быть получены из сложных кетоэфиров (схема 2) нитрозированием с последующим восстановлением восстановителем цинк/уксусная кислота. Конденсация -аминокетонов с подходящими сложными -кетоэфирами может с хорошими выходами приводить к получению пирролов. Эти промежуточные продукты являются достаточно универсальными и могут быть превращены в пирролы с большим набором различных заместителей с изменяющимися структурами замещения. Для случаев, в которых Re (Z-A-B прекурсор (предшественник находится в положении 2, кислотный гидролиз может селективно гидролизовать сложный С-3 эфир. Последующее нагревание должно приводить к декарбоксилированию. Гидролиз 2-карбоновой кислоты может быть осуществлен в основных условиях. Перегруппировка кислоты Куртиуса, как описано выше,может приводить к получению аминопроизводных. Для получения соединений с атомом серы,присоединенным в положении С-2, основной гидролиз и декарбоксилирование может привести к получению С-2-незамещенных пирролов. Эти пирролы можно подвергать электрофильному замещению для получения тиолов(комплекс пиридин -SO3 или хлорсульфоновая кислота). Группа R1a, которая содержится в формуле I, может быть получена либо из оставшегося сложного эфира, либо из Rf. Альтернативно, тиол и производные сульфоновой кислоты могут также быть получены из С-2 кислот превращением группы карбоновой кислоты,которое описано ранее. На схеме 4 показано получение пирролов,в которых Q-E присоединена в положении 3. Циклизация -аминокетонов со сложными кетоэфирами, как описано ранее, может приводить к получению пирролов. Гидролиз в основных условиях может селективно гидролизовать С-2 сложный эфир, который в результате нагревания должен подвергаться декарбоксилированию с получением 2-незамещенных пирролов. Сложный С-3 эфир после этого может быть гидролизован в кислотных условиях с получением 3-карбоксипирролов. Перегруппировка Куртиуса в условиях, описанных ранее, может приводить к получению 3-аминопирролов. Карбоновые кислоты могут использоваться для получения 3-меркаптопроизводных и производных 3 сульфоновых кислот. Методика Хунсдикера может использоваться для получения 3 бромпирролов. Замена атома галогена на атом металла с использованием трет-BuLi при низкой температуре с последующим гашением изоцианатом меди должна приводить к введению изоцианатной группы в положение С-3. Этот промежуточный продукт может быть восстановлен боргидридом натрия с получением 3 меркаптопирролов. Альтернативно, карбоновые кислоты могут быть декарбоксилированы с получением пирролов, которые могут быть Nзащищены объемной защитной группой, такой как триизопропилсилил (TIPS). Эта объемная группа направляет электрофильное замещение в С-3 положение пиррольного кольца. Таким образом, взаимодействие с изоцианатом меди с последующим восстановлением боргидридом натрия с последующим снятием защитной TIPS группы фторидом может привести к получению 3-меркаптопирролов. СульфированиеNзащищенного пиррола комплексом пиридин триоксид серы может снова быть направлено в положение С-3 пиррола с получением после снятия TIPS защиты 3-сульфоновых кислот. Другой общий способ синтеза пирролов,который может быть использован для получения соединений данного изобретения, представлен на схеме 5. В этом способе (Cushman et al. J.-аминоальдегиды, которые легко могут быть получены из -аминокислот, через общепринятое получение N-метокси-N-метиламидов с последующим добавлением алкильного реактива Гриньяра (для получения кетонов) или восстановлением гидридным восстановителем, таким как алюмогидрид лития или диизобутилалюминийгидрид. Эти альдегиды и кетоны могут быть подвергнуты взаимодействию с енолятами дополнительных кетонов с получением промежуточных продуктов альдольного присоединения,которые в кислотных условиях циклизуются до образования пирролов. Взаимодействующие реагенты в этом способе могут быть широкого диапазона и могут быть выбраны так, чтобы квалифицированный специалист в данной области мог получить различные пирролы. Схема 6 Другим общим способом синтеза пирролов, полезным для получения соединений данного изобретения, является реакция ПаалаКнорра (Paal-Knorr), показанная на схеме 6. Эта реакция включает взаимодействие 1,4 дикетонов или 1,4-кетоальдегидов с первичными аминами с образованием пирролов. Исходные 1,4-дикетоны и 1,4-кетоальдегиды могут быть получены с использованием стандартной химии енолятов или с помощью других методик, которые известны квалифицированным специалистам в области органического синтеза. Реакция имеет широкий диапазон и исходные материалы могут быть подобраны так, чтобы можно было получить различные пирролы. На схеме 7 показано, как соединения схем 1-6, где Re представляет группу сложного эфира карбоновой кислоты, могут быть превращены в соединения, содержащие Z-A-B-остаток. При наличии амидной связующей группы (формулаI, Z = -CONH-), когда Re = карбоалкокси, она может быть гидролизована до кислоты в основных или кислотных условиях в зависимости от структуры заместителя, как описано ранее. Образование хлорангидрида кислоты с тионилхлоридом с последующим добавлением соответствующего амина H2N-A-B может привести к получению соединений, содержащих связующую амидогруппу. Альтернативно, кислота может быть соединена с амином H2N-A-B в присутствии подходящего пептидного связующего вещества, такого как ВОР-Сl, HBTU или DCC. В другом способе сложный эфир может быть непосредственно связан с алюминиевым реагентом,полученным при добавлении триметилалюминия к амину H2N-A-B. Для получения соединений формулы (I),включающих простое эфирное или простое тиоэфирное связывание (Z = -CH2O-, -CH2S-), кислота может быть восстановлена до спирта. Предпочтительными методиками этого превращения являются восстановление комплексом боран-ТГФ или методика, заключающаяся в восстановлении смешанного ангидрида с боргидридом натрия (IBCF = изобутилхлорформиат и МММ = N-метилморфолин). Окончание образования соединений, включающих простое эфирное или простое тиоэфирное связывание,может быть легко осуществлено по методике Митсонобу (Mitsonobu) соответствующим фенолом, тиофенолом или гидрокси- или меркаптогетероциклом НХ-А-В (X = О, S) (формула I,А = арил или гетероарил). Другие простые эфиры или тиоэфиры (X = О, S) могут быть получены последующим общепринятым превращением исходного спирта в подходящую удаляемую 37 группу, такую как тозилат. Когда Х = S, простые тиоэфиры могут быть окислены далее с получением сульфонов (формулы I, Z =-CH2SO2-). Для получения соединений формулы I,включающих аминосвязывание, (Z = -CH2NH-),спирт может быть окислен до альдегида рядом методик, двумя предпочтительными из которых являются окисление Сверна (Swern) и окисление пиридинийхлорхроматом (pyridinium hlorochromate (PCC. Альтернативно, альдегид может быть получен непосредственно прямым формилированием пиррольного кольца по методике Вильсмейера-Хаака в определенных случаях,как показано на предыдущих схемах. Восстановительное аминирование альдегида подходящим амином H2N-A-B и цианоборгидридом натрия может затем привести к получению аминосвязанных соединений. Альдегид также может быть использован для получения соединений формулы I, включающих кетосвязывание (Z = -COCH2-). Обработка соединением металлоорганического ряда может привести к получению спирта. Металлоорганические соединения (где М = магний или цинк) могут быть получены предпочтительно из соответствующего галогенида обработкой металлическим магнием или цинком. Эти реагенты должны легко взаимодействовать с альдегидами с получением спиртов. Окисление спирта по любой из перечисленных методик, таких как окисление Сверна или РСС-окисление, может привести к получению соединений, включающих кетосвязывание. Схема 8 Дополнительные соединения формулы I, в которых связующая группа m/z содержит атом азота, соединенный с кольцом М, могут быть получены по методикам, приведенным на схеме 8. Амины могут быть превращены в сульфонамиды (формула I, m/z-NHSO2-) обработкой соответствующим сульфонилхлоридом B-A-SO2Cl в присутствии основания, такого как триэтиламин. Амины могут быть превращены в амиды(формула I, Z = -NHCO-) обработкой соответствующим хлорангидридом кислоты Сl-СО-А-В в присутствии основания или обработкой соответствующей карбоновой кислотой НО-СО-А-В в присутствии подходящего пептидного связующего вещества, такого как DCC, HBTU или ВОР. Амины также могут быть превращены в соединения, включающие аминосвязывание Дополнительные соединения формулы I, в которых связующая группа Z содержит атом серы, соединенный с кольцом М, могут быть получены по методикам, приведенным на схеме 9. Обработка сульфоновых кислот пентахлоридом фосфора с последующей обработкой подходящим амином H2N-A-B, может привести к получению соединений, включающих сульфонамидное связывание (формула I, Z = -SO2NH-). Тиолы могут быть алкилированы подходящим алкилирующим реагентом в присутствии основания с получением простых тиоэфиров (формула I, Z = -SCH2-). Эти соединения могут быть дополнительно окислены различными реагентами с получением соединений, включающих сульфоновое связывание (формула I, Z = Соединения формулы I, в которых кольцо М представляет имидазол, могут быть получены с использованием методик, приведенных на схемах 10-16. N-Замещенные производные имидазола могут быть получены по общей методике, представленной на схеме 10, где V представляет V или предшественник группы(CH2)nV, V представляет нитро, амино, тио, гидрокси, сульфоновую кислотную группу, сложный эфир сульфоновой кислотной группы,сульфонилхлорид, сложноэфирную группу, кислотную группу или галоген, n равно 0 или 1 иPG представляет или водород, или защитную группу. Замещение может быть осуществлено связыванием имидазола с галогенсодержащим фрагментом Q-E-G-Hal в присутствии катализатора, такого как основание, Cu/CuBr/основание или Pd/основание, с последующим превращением V в (CH2)nV. Затем Q может быть превращено в D и, наконец, V может быть превращено вZ-A-B в соответствии с методиками, представленными на схемах 7-9. Альтернативно, V может быть превращено в Z-A-B с последующим удалением защитной группы у атома N. Этот продукт далее может быть подвергнут реакции сочетания, как описано выше, с получением целевого имидазола. Один из путей получения амидинофенилимидазольных производных показан на схеме 11. 4-Имидазолкарбоновая кислота может быть обработана тионилхлоридом и затем подвергнута реакции сочетания с H2N-A-B в присутствии основания, а затем нагрета с 3-фторбензонитрилом в присутствии основания. Реакция Пиннера(Pinner) с использованием стандартных методик,известных специалистам данной области, может быть применена для образования амидиногруппы. Схема 12 1,2-Дизамещенные и 1,5-дизамещенные производные имидазола могут быть получены по общим методикам, приведенным на схеме 12,где R1b представляет водород или алкильную группу, U представляет альдегидную группу,группу сложного эфира, кислотную группу,амидо-, амино-, тиольную, гидрокси, сульфоновую кислотную группу, сложный эфир сульфоновой кислотной группы, сульфонилхлорид или метиленгалогенид. Стадия заключается в реакции сочетания в присутствии катализатора, такого как основание, Cu/CuBr/основание, илиPd/основание. Когда R1b представляет водород,он может быть удален депротонированием литиевым основанием и захвачен формиатом,формамидом, диоксидом углерода, сульфонилхлоридом (диоксид серы и затем хлор) или изоцианатом с получением 1,2-дизамещенных имидазолов (маршрут b1). Также в маршруте b1,когда R1b представляет СН 3, он может быть окислен с использованием SeO2, MnO2,NаIO4/кат. RhCl3 или NBS с образованием U. Когда R1b представляет водород, последовательное депротонирование и гашение литиевым основанием и триметилсилилхлоридом с после 003056 40 дующим повторным депротонированием литиевым основанием и гашением формиатом, формамидом, диоксидом углерода, сульфонилхлоридом (диоксид серы и затем хлор) или изоцианатом может привести к получению 1,5 дизамещенных имидазолов (маршрут b2). Когда 1b не является водородом, методика маршрутаb2 может быть снова использована для получения 1,5-дизамещенных имидазолов (маршрут Предпочтительный способ получения 1,2 дизамещенных и 1,5-дизамещенных производных имидазола представлен на схеме 13. Имидазол может быть нагрет с 3-фторбензонитрилом в присутствии основания. Продукт реакции сочетания может затем быть обработан алкиллитиевым основанием и погашен ClCO2Me с получением 1,2-дизамещенного соединения. Дополнительная обработка раствором, полученным изH2N-A-B в триметилалюминии, может привести к получению амида, который далее может быть модифицирован реакцией Пиннера с образованием требуемого соединения. 1,5-Дизамещенные соединения могут быть получены с использованием этой же методики с тем отличием, что исходный анион защищают и получают второй анион, который затем гасят, как описано выше. Дополнительные модификации могут быть проведены в соответствии с методиками, которые использовались для 1,2-дизамещенных соединений. Схема 14 Другой способ получения 1,2-дизамещенных производных имидазола приведен на схеме 14. Путем взаимодействия N-замещенного имидазола с цианатом может быть получен амид. Этот амид затем может быть подвергнут сочетанию с группой В, как будет описано ниже. Схема 15 Другой способ получения 1,5-дизамещенных производных имидазола приведен на схеме 15. Алкилирование 2-бромэтилацетатом с по 41 следующим взаимодействием с золотосодержащим реактивом в присутствии основания, такого как NaOMe или LDA, может привести к образованию сложных эфирных замещенных имидазолов, которые могут быть далее модифицированы, как описано выше. Схема 16 Общая методика получения 2,4,5 тризамещенных или 4,5-дизамещенных производных имидазола показана на схеме 16. После замены атома металла на атом галогена фрагмента Q-E-G его можно подвергнуть взаимодействию с показанным амидом, бромировать NBS и циклизовать с избытком NН 3 и R1aCO2H с получением имидазола. Имидазол может быть далее модифицирован, как показано выше. Схема 17 Общая методика получения 4,5-дизамещенных производных триазола показана на схеме 17. Этилпропионат может быть замещен в присутствии CuI/Pd и затем подвергнут взаимодействию с NaN3 с образованием триазола. Триазол может быть преобразован далее, как показано выше. Схема 18 Тетразольные соединения данного изобретения, где Z представляет -CONH-, могут быть получены как показано на схеме 18. Соответственно замещенный амин может быть ацилирован этилоксалилхлоридом. Образовавшийся амид может быть преобразован в тетразол методами, описанными в публикации Duncia (J. Org.Chem. 1991, 2395-2400) или в публикации Thomas (Synthesis 1993, 767-768). Амид может быть преобразован сначала в иминоилхлорид и подвергнут взаимодействию с NaN3 с образованием 5-карбоэтокситетразола (J. Оrg. Chem. 1993, 58,32-35 и Bioorg.Med. Chem. Lett. 1996, 6, 10151020). 5-Карбоэтокситетразол может быть затем 42 дополнительно модифицирован как показано на схеме 7. Тетразольные соединения данного изобретения, где Z представляет -СО-, могут также быть получены через иминоилхлорид (Chem. Вег. 1961, 94, 1116 и J. Org. Chem. 1976, 41,1073) с использованием соответственно замещенного ацилхлорида в качестве исходного материала. Связующая кетогруппа может быть восстановлена с получением соединений, в которых Z представляет алкил. Схема 19 Способы, приведенные на схеме 18, могут также быть использованы для синтеза соединений, в которых E-Q связана с атомом углерода тетразола, как показано на схеме 19. 5 Замещенный тетразол может быть затем алкилирован или ацилирован с получением целевых продуктов. Схема 20 Тетразольные соединения данного изобретения, в которых Z представляет -SO2NH-, -S-,-S(O)-, SO2-, могут быть получены из тиола,полученного как показано на схеме 20. Соответственно замещенный тиоизоцианат может быть подвергнут взаимодействию с азидом натрия с получением 5-тиотетразола (J. Org. Chem. 1967,32, 3580-3592). Тиосоединение может быть модифицировано, как показано на схеме 9. Тетразольные соединения данного изобретения, в которых Z представляет -О-, могут быть получены тем же способом, который приведен на схеме 20, с использованием в качестве исходного материала соответственно замещенного изоцианата. Гидроксисоединение может быть модифицировано аналогично тиолам, показанным на схеме 9. Схема 21 Тетразольные соединения данного изобретения, в которых Z представляет NH-, -NHCO-,-NНSO2-, могут быть получены из 5 аминотетразола, который может быть получен в результате перегруппировки Смайла (SmilesRearrangement), как показано на схеме 21. Тио 43 соединение, полученное как показно на схеме 20, может быть алкилировано 2-хлорацетамидом. Образовавшееся соединение может быть затем подвергнуто кипячению с обратным холодильником в этанольном гидроксиде натрия с получением соответствующего 5 аминотетразола (Chem. Pharm. Bull. 1991, 39,3331-3334), Образовавшийся 5-аминотетразол может быть затем алкилирован или ацилирован с образованием целевых продуктов. Схема 22 Пиразолы формулы I (такие как пиразолы,показанные на схеме 22) могут быть получены конденсацией соответственно замещенного гидразина с различными сложными дикетоэфирами. Конденсации этого типа обычно приводят к получению смеси региоизомеров пиразола, которые могут быть эффективно разделены колоночной хроматографией на силикагеле. Сложные эфиры могут быть превращены в Z-A-B как описано ранее. Альтернативно, если в схеме 22 исходный дикетон содержит СН 3 вместо CO2Et, то образовавшийся метилпиразол может быть выделен и окислен в соответствии с маршрутом b1 на схеме 12 с образованием пиразолкарбоновой кислоты. Схема 23 Когда кетоимидаты используются для конденсации с гидразинами, получают соответствующие сложные пиразоламиноэфиры (схема 23). Превращение этих промежуточных продуктов в целевые соединения формулы I может быть затем осуществлено защитой функциональной аминогруппы подходящей защитной группой или получением производного (например, сульфонамида) и последующей модификацией сложного эфира, как описано выше. Схема 24 Как показано на схеме 24, пиразолы, в которых заместитель находится в положении 4,могут быть получены бромированием (бромом 44 или NBS или в дихлорметане, или в уксусной кислоте) исходного пиразола. Превращение 4 бромпиразола в 4-пиразолкарбоновую кислоту может быть осуществлено рядом способов,обычно известных квалифицированным специалистам в области органического синтеза. Дальнейшие превращения, как описано выше, могут привести к получению пиразолов данного изобретения. Схема 25 Пиразолы могут быть получены также согласно способу, приведенному на схеме 25. Бромпиразолы получают, как показано на схеме 24. QE затем может быть связано с использованием поперечного связывания по методу Сузуки в присутствии палладиевого катализатора. Дальнейшую модификацию осуществляют, как описано выше. Схема 26 5-Замещенные фенилпиразолы могут быть получены методом, приведенным на схеме 26. Превращение 5-гидроксипиразола в его трифлат(ангидрид трифторметансульфокислоты, лутидин в дихлорметане) или бромид (РОВr3) с последующим поперечным связыванием по методу Сузуки с использованием палладиевого катализатора с соответственно замещенной фенилбороновой кислотой должно приводить к получению 5-замещенных пиразолов. Превращение этого промежуточного продукта в 4-бромпроизводное с последующим карбонилированием, как показано на схеме 24, должно приводить к получению соответствующего сложного эфира,который далее может привести к получению соединений формулы I. Схема 27 1-Замещенные 1,2,3-триазолы данного изобретения могут быть получены обработкой соответственно замещенного азида различными 45 диполярофилами (dipolarophiles) (Tetrahedron 1971, 27, 845 и J. Amer. Chem. Soc. 1951, 73,1207), как показано на схеме 27. Обычно получают смесь региоизомеров, которую легко можно разделить и превратить в триазолкарбоновые кислоты. Дальнейшие превращения, как описано ранее, могут затем приводить к соединениям данного изобретения. Схема 28 1,2,4-Триазолы данного изобретения могут быть получены по методике Хайсгена и соавторов (Huisgen et al) (Liebigs Ann. Chem. 1962, 653,105) путем циклоприсоединения нитрилиминийпроизводных (полученных в результате обработки триэтиламином и хлоргидразоном) и соответствующего нитрильного диполярофила(схема 28). Эта методика обеспечивает широкий диапазон 1,2,4-триазолов с заместителями различной структуры в положениях 1, 3 и 5. Схема 29 1,2,4-Триазолы могут быть получены также по методике Зечи и соавторов (Zecchi et al.)-E-D(Q) находится в положении 5 триазольного кольца, могут быть получены, как показано на схеме 30. Схема 31 1,3,4-Триазолы данного изобретения могут быть получены по методу Модерхака и соавторов (Moderhack et al.) (J. Prakt. Chem. 1996, 338,169). Как показано на схеме 31, эта реакция включает конденсацию карбазида с соответственно замещенным коммерчески доступным 46 тиоизоцианатом с образованием циклического производного тиомочевины. Реакции алкилирования или нуклеофильного замещения на тиономочевинном промежуточном продукте могут затем привести к тиоалкил- или арильному промежуточному продукту, который может быть подвергнут гидролизу, окислению и декарбоксилированию в промежуточный 5-Н 2 тиотриазол, который можно превратить в соединения данного изобретения. Альтернативно,тиономочевинный промежуточный продукт можно окислить непосредственно в 2 Н-триазол,который можно затем превратить в сложный эфир и модифицировать, как описано ранее. Тиономочевинный промежуточный продукт может быть также окислен до сульфонилхлорида способами, показанными ранее. Схема 32 Имидазольное ядро, показанное на схеме 32, может быть получено конденсацией 3 цианоанилина и н-бутилглиоксилата с получением имина, который затем может быть обработан TosylMIC в основном метаноле с получением целевого имидазольного соединения. Связывание сложного эфира в стандартных условиях после этого приводит в различным аналогам,которые могут быть подвергнуты дополнительным превращениям с получением, например,бензиламина или бензамидинов. Схема 33 Соединения данного изобретения, в которых АВ представляет дифениламин или аналогичный амин, могут быть получены, как показано на схеме 33. 4-Броманилин может быть защищен в виде Вос-производного и соединен с фенилбороновой кислотой в условиях реакции Сузуки (Suzuki) (Bioorg. Med. Chem. Lett. 1984,189) . После удаления защитной группы с использованием ТФУ получают аминодифенильное соединение. Другие подобные амины, в которых А и/или В являются гетероциклами, могут быть получены таким же способом с использованием соответственно замещенных бо 47 роновых кислот и арилбромида. Броманилин можно также сначала присоединять к кольцевым структурам ядра, как описано выше, а затем подвергать реакции Сузуки с получением целевого продукта. Схема 34 Соединения данного изобретения, в которых А-В представляет A-X-Y, могут быть получены так же, как производное пиперазина, представленное на схеме 34. Схема 35 На схеме 35 показано, как могут сочетаться циклические группы, в которых Х представляет NH, О или S. Когда В определен как X-Y, используют следующее описание. Группы А и В доступны либо из коммерческих источников, известных в литературе, либо могут быть легко синтезированы с использованием стандартных методик,известных специалистам в области органического синтеза. Необходимые реакционноспособные функциональные группы, прилагаемые к аналогам А и В, также доступны либо из коммерческих источников, известных в литературе,либо могут быть легко синтезированы с помощью стандартных методик, известных специалистам в области органического синтеза. В таблицах, которые следуют далее, описана химия,необходимая для осуществления связывания А с В. Таблица А Получение амидного, сложноэфирного, мочевинного, сульфонамидного и сульфамидного связывания между А и В Химическая реакция для групп, указанных в табл. А, может осуществляться в апротонных растворителях, таких как хлоруглерод, пиридин,бензол или толуол при температурах в интервале от -20 С до температуры дефлегмации растворителя с добавлением или без добавления триалкиламинного основания. Таблица В Получение кетонных связываний между А и В Химическая реакция связывания для групп табл. В может осуществляться различными способами. Реактив Гриньяра, необходимый для Y,получают из галогенного аналога Y в сухом эфире, диметоксиэтане или тетрагидрофуране при температуре в диапазоне от 0 С до температуры дефлегмации растворителя. Этот реактив Гриньяра может взаимодействовать непосредственно при строго контролируемых условиях, т.е. при низкой температуре (-20 С или ниже) и с большим избытком хлорангидрида или с каталитическим или стехиометрическим количеством комплекса бромид меди-диметилсульфид в диметилсульфиде в качестве растворителя или с его вариантом. Другие доступные способы включают превращение реактива Гриньяра в кадмиевый реагент и сочетание в соответствии с методикой Карсона и Проута (Carson and Prout)(Fiandanese et al (Tetrahedron Lett., (1984) 4805,сочетание, проводимое с помощью марганцевого(II) катализатора (Cahiez and Laboue, Tetrahedron Lett., 33(31), (1992) 4437). Таблица С Получение простых эфирных и тиоэфирных связываний между А и В для получения следующего продукта A-X-Y: Простые эфирные и тиоэфирные связывания табл. С могут быть получены взаимодействием двух компонентов в полярном апротонном растворителе, таком как ацетон, диметилформамид или диметилсульфоксид, в присутствии основания, такого как карбонат калия, гидрид натрия или трет-бутоксид калия, при температуре в диапазоне от комнатной до температуры дефлегмации используемого растворителя. Таблица D Получение -SO и -SO2-связываний из простых тиоэфиров таблицы 3 и окисленный и окисленный м-хлорпербензойоксидом алюминой кислотой Если исходный ния(влаж.)/оксон Простые тиоэфиры табл. С служат удобным исходным материалом для получения сульфоксидных и сульфоновых аналогов табл.D. Сочетание влажного оксида алюминия и оксона может обеспечить надежный реагент для окисления простого тиоэфира в сульфоксид, в то время как окисление м-хлорпербензойной кислотой будет приводить к получению сульфона. Таблица Е Методы получения группы Е В табл. Е показаны некоторые способы превращения функциональной группы Q в группу D формулы I. В то время как перечислены не все возможные функциональные группы для Q и D и предложенные методы синтеза не являются всеохватывающими, табл. Е, как предполагается, поясняет стратегии и превращения, доступные для специалиста в области органического синтеза для получения соединений формулы I. В реакции 1 табл. Е показано превращение нитрила в амидин по методу Пиннера; в реакции 2 показано прямое восстановление нитрила гидридным восстановителем в метиленамин. В реакции 3 показано применение карбоновой кислоты, которая может быть легко 50 получена из сложного эфира или нитрила, если это необходимо, при получении метиленамина. Этот путь синтеза является исключительно гибким, поскольку несколько полученных стабильных промежуточных продуктов приводят к целевому продукту. Как показано, образование активированного аналога, такого как смешанный ангидрид, дает возможность мягкого восстановления кислоты в метилен спирт, который может быть, в свою очередь, превращен в удаляемую группу сульфированием или галогенированием, или защищен подходящей защитной группой, которая впоследствии синтеза подвергается превращению, в соответствии с требованиями химической реакции. Замещение один раз активированного таким образом метилен спирта эффективным азотсодержащим нуклеофилом, таким как азид-анион, может снова обеспечить получение другого соответственно стабильного аналога - метиленазида, который может быть использован в форме защищенного метиленамина или превращен непосредственно в метиленаминную группу восстановлением. Реакция 4 относится к проблеме присоединения аминной функциональности непосредственно через связь к группе Е формулы I. Данная карбоновая кислота еще раз дает возможность удобного входа в этот выбор для группы D. Здесь показана хорошо известная перегруппировка Куртиса; активированный кислотный аналог может быть использован для образования ацилазида, который в процессе термического разложения перегруппировывается в соответствующий изоцианат. Изоцианатный промежуточный продукт после этого может быть фиксирован в виде стабильного карбамата добавлением подходящего спирта и дополнительного нагрева. Этот карбамат может быть использован как стабильная защитная группа для амина или расщеплен непосредственно с получением требуемого D. Альтернативно, можно удобно гасить изоцианатный промежуточный продукт водой с прямым получением амина. Другие отличительные признаки изобретения станут понятными из приведенных далее описаний типичных воплощений, которые даны для пояснения изобретения и не предназначены для его ограничения. Примеры Фторметилсульфоновый промежуточный продукт 4-aминo-3-фтop-2'-метилсульфонил[1,1']-дифенил гидрохлорид Часть А. Получение 4-бром-N-третбутоксикарбонил-2-фторанилина. Гидрид натрия (1,16 г, 60%, 29 ммоль) добавляют к охлажденному до 0 С раствору 4 бром-2-фторанилина (5,01 г, 26 ммоль) в сухом ДМФ (75 мл). Ледяную баню удаляют и реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Добавляют ди-третбутилдикарбонат (6,33 г, 29 ммоль), реакционную смесь нагревают до 65 С в течение 17 ч. 51 Реакцию гасят, добавляют по каплям H2O, затем четыре раза экстрагируют H2O. Первых два водных экстракта объединяют и дважды экстрагируют EtOAc. Органические экстракты объединяют, сушат над Na2SO4, фильтруют и упаривают. Сырой продукт переносят в смесь CH2Cl2,СНСl3 и EtOAc и фильтруют для удаления примеси пурпурного цвета, затем упаривают и хроматографируют на силикагеле (30% СН 2 Сl2/ гексаны), получая твердое вещество оранжевого цвета (4,76 г, 62%). 1(180 мл) дважды под непродолжительным высоким вакуумом откачивают газ, заполняют ее аргоном, содержимое нагревают при температуре кипения с обратным холодильником в течение 5 ч. После охлаждения до комнатной температуры фракции разделяют и водный слой экстрагируют EtOAc. Органические экстракты объединяют, сушат над Na2SO4, фильтруют и упаривают. Сырой продукт хроматографируют на силикагеле (0-30% EtOAc/гексаны), получая требуемый продукт (6,50 г, 88%). 1(с, 3 Н), 1,54 (с, 9 Н) млн. д. Часть С. Получение 4-(трет-бутоксикарбониламино)-3-фтор-2'-метилсульфонил-[1,1']дифенила. 4-(трет-Бутоксикарбониламино)-3-фтор-2'метилтио-[1,1']-дифенил (6,50 г, 19,5 ммоль) растворяют в CH2Cl2 (150 мл) и охлаждают до 0 С. Добавляют м-СРВА (14,8 г, 57-86%) и реакционную смесь перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь экстрагируют насыщенным раствором сульфита натрия и водный слой экстрагируют CH2Cl2. Органические экстракты объединяют, сушат надNa2SO4, фильтруют и упаривают. Сырой продукт хроматографируют на силикагеле (20-30% 52 Часть D. Получение 4-амино-3-фтор-2'метилсульфонил-[1,1']-дифенил гидрохлорида. 4-(трет-Бутоксикарбониламино)-3-фтор-2'метилсульфонил-[1,1']-дифенил (1,04 г, 2,8 ммоль) растворяют в смеси HCl/диоксан (4,0 М,10 мл) и перемешивают 19 ч. Твердый осадок растирают с Et2O и фильтруют, получая твердое белое вещество (813 мг, 95%). 1(пример 1) и 1-(3-амидинофенил)-2-[(2'-третбутиламиносульфонил-[1,1']-дифен-4-ил) аминокарбонил]пиррол соль трифторуксусной кислоты (пример 2). Часть А. Получение 1-(3-цианофенил) пиррола. 3-Аминобензонитрил (47,45 г, 0,401 моль) и 58,4 г (0,441 моль, 59,5 мл) 2,5-диметокситетрагидрофурана растворяют в 200 мл уксусной кислоты и кипятят с обратным холодильником в течение ночи. Раствору дают охладиться до комнатной температуры и разбавляют его 250 мл этилацетата, промывают 3 раза рассолом(200 мл) и затем насыщенным водным раствором карбоната натрия (200 мл). Органические слои сушат над сульфатом магния и фильтруют через пробку силикагеля. Летучие компоненты удаляют в вакууме и остаток перекристаллизовывают из метанола, получая указанное в заголовке соединение в виде твердого вещества бежевого цвета (62,82 г, 93%), MS (H2O-CI) 169(М+Н)+. Часть В. Получение 1-(3-цианофенил) пиррол-2-карбоксальдегида. Оксихлорид фосфора в течение 15 мин добавляют в диметилформамид (14,02 г, 191,84 ммоль, 14,1 мл) при 0 С. Смесь нагревают до комнатной температуры и перемешивают в течение 15 мин; раствор снова охлаждают до 0 С с последующим добавлением 100 мл 1,2 дихлорэтана. Раствор 1-(3-цианофенил)пиррола(29,33 г, 191,84 ммоль) в 250 мл 1,2-дихлорэтана медленно добавляют через капельную воронку и смесь нагревают до кипения с обратным холодильником в течение 15 мин. Раствор охлаждают до комнатной температуры, добавляют 86,55 г (1,05 моль) ацетата натрия и нагревают до кипения с обратным холодильником в течение 15 мин. Раствор разбавляют 250 мл этилацетата,органические фракции промывают рассолом,затем насыщенным водным раствором карбоната натрия (250 мл). Органические фракции сушат над сульфатом магния, фильтруют через пробку силикагеля и летучие фракции удаляют в вакууме. Продукт перекристаллизовывают из этилацетата, получая 28,4 г (83%) указанного в(M+NH4)+. Часть С. Получение 1-(3-цианофенил) пиррол-2-карбоновой кислоты. К охлажденному (0 С) раствору 1-(3 цианофенил)пиррол-2-карбоксальдегида (5,14 г,26,20 ммоль) в 300 мл смеси ацетон/вода (1:1) в течение 15 мин добавляют перманганат калия(12,42 г, 78,60 ммоль), реакционной смеси дают нагреться до комнатной температуры. После расходования исходного материала добавляют 10,90 г (104,8 ммоль) бисульфита натрия и раствор подкисляют 10% НСl. Раствор фильтруют через пробку целита, разбавляют этилацетатом и промывают 200 мл рассола. Органические фракции сушат над сульфатом магния, фильтруют и сушат в вакууме. Органический остаток перекристаллизовывают из метанола, получая указанное в заголовке соединение (4,11 г, 74%) в виде твердого тускло-белого вещества. MS(ESI) 211,2 (М-Н)-. Часть D. Получение 1-(3-цианофенил)-2[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4 ил)аминокарбонил]пиррола. К раствору 1-(3-цианофенил)пиррол-2 карбоновой кислоты (2,77 г, 13,05 ммоль) в 50 мл безводного ДМФ добавляют триэтиламин(8,66 г, 19,58 ммоль) и (2'-N-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)амин (6,03 г, 19,84 ммоль), смесь нагревают до 50 С в течение ночи. Раствор разбавляют этилацетатом и промывают дважды рассолом. Органический слой сушат над сульфатом магния, летучие компоненты удаляют в вакууме. Остаток очищают флэшхроматографией (элюент смесь гексан/этилацетат, 3:2), летучие растворители удаляют в вакууме, получая 1,9 г (29%) указанного в заголовке соединения. MS (NH3-CI) 516 (M+NH4)+. Часть Е. Получение соли трифторуксусной кислоты 1-(3-амидинофенил)-2-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиррола (пример 1) и соли трифторуксусной кислоты 1-(3-амидинофенил)-2-[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил] пиррола (пример 2). 1-(3-Цианофенил)-2-[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил] пиррола (0,37 г, 0,74 ммоль) добавляют в раствор 60 мл безводного метилацетата и безводного метанола (0,30 мл, 7,4 ммоль) и охлаждают на водно-ледяной бане. Газообразный НСl барботируют в течение 15 мин, раствор закупоривают и перемешивают его в течение ночи при комнатной температуре. Летучие компоненты удаляют в вакууме. Остаток сушат под высоким вакуумом в течение 1 ч. Остаток растворяют в 100 мл безводного метанола, объединяют с 0,43 г (4,45 ммоль) карбоната аммония и перемешивают при комнатной температуре в течение ночи. Летучие компоненты удаляют в вакууме и 54 остаток очищают препаративной ВЭЖХ с обращенной фазой (колонка, С 18, элюирование градиентом, смесь Н 2 О/СН 3 СN с 0,5% ТФУ),получая 1-(3-амидинофенил)-2-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]пиррол соль трифторуксусной кислоты (пример 1) в виде твердого белого вещества после лиофилизации. MS (ESI) 460,3 (М+Н)+; выделяют также соль трифторуксусной кислоты 1-(3-амидинофенил)-2-[(2'-трет-бутиламиносульфонил-[1,1']дифен-4-ил)аминокарбонил]пиррола (пример 2).MS (ESI) 516,4 (М+Н)+. Пример 3. 1-(3-Амидинофенил)-2-[(2'аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-4-бромпиррол соль трифторуксусной кислоты. Часть А. Получение 1-(3-цианофенил)-2 формил-4-бромпиррола. 1-(3-Цианофенил)пиррол-2-карбоксальдегид примера 1, часть В (6,06 г, 30,89 ммоль) объединяют с 6,60 г (37,06 ммоль) Nбромсукцинимида в 150 мл безводного ТГФ и перемешивают при комнатной температуре в течение ночи. Остаток нагревают в ССl4 и фильтруют. Остаток растворяют в CHCl3/EtOAc,фильтруют через пробку силикагеля и летучие компоненты удаляют. Остаток перекристаллизовывают из этилацетата, получая указанное в заголовке соединение в виде светлокоричневого твердого вещества (4,49 г, 53%).MS (NH3-CI) 292 (M+NH4)+. Часть В. Получение соли трифторуксусной кислоты 1-(3-амидинофенил)-2-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]-4 бромпиррола. Следуя методикам, описанным в примере 1(части С-Е), 1-(2-цианофенил)-2-формил-4 бромпиррол превращают в указанное в заголовке соединение после очистки ВЭЖХ в виде белого порошка. MS (ESI) 538,2 (М+Н)+. Пример 4. 1-(3-Амидинофенил)-2-(5-(2'аминосульфонилфенил)-1-ил)пиридин-2-ил] аминокарбонил]пиррол соль трифторуксусной кислоты. Часть А. Получение 1-(3-цианофенил)-2(5-(2'-трет-бутиламиносульфонилфенил)-1-ил) пиридин-2-ил]аминокарбонил]пиррола. 1-(3-Цианофенил)пиррол-2-карбоновую кислоту примера 1, часть С (1,00 г, 4,7 ммоль),оксалилхлорид (0,61 мл, 7,06 ммоль) и 3 капли ДМФ объединяют при комнатной температуре в 50 мл безводного CH2Cl2 и перемешивают в течение 4 ч. Летучие компоненты удаляют в вакууме и остаток сушат под высоким вакуумом в течение 1 ч. Остаток растворяют в 50 мл CH2Cl2 с последующим добавлением 4-диметиламинопиридина (1,15 г, 9,4 ммоль), раствор перемешивают при комнатной температуре в течение 5 мин, затем добавляют [(5-(2'-аминосульфонилфенил)-1-ил) пиридин-2-ил]амин (1,44 г, 4,7 ммоль) и перемешивают при комнатной температуре в течение ночи. Раствор фильтруют через 55 силикагельную пробку и летучие компоненты удаляют. Остаток очищают флэшхроматографией (1:2 гексан/EtOAc), получая 0,84 г (36%) указанного в заголовке соединения в виде твердого вещества желтоватокоричневого цвета. MS (ESI) 500,3 (М+Н)+. Часть В. Получение соли трифторуксусной кислоты 1-(3-амидинофенил)-2-(5-(2'-аминосульфонилфенил)-1-ил)пиридин-2-ил]аминокарбонил]пиррола. Следуя методикам, описанным в примере 1(часть Е),1-(3-цианофенил)-2-(5-(2'-третбутиламиносульфонилфенил)-1-ил)пиридин-2 ил]аминокарбонил]пиррол превращают в указанное в заголовке соединение после очистки ВЭЖХ в виде белого порошка. MS (ESI) 461,3(М+Н)+. Примеры 5 и 6. 1-Бензил-3-[(2'амидиносульфонил-[1,1']-дифен-4-ил)аминокарбонил]-4-(3-аминофенил)пиррол соль трифторуксусной кислоты (пример 5) и 1-бензил-3-[(2'трет-бутиламиносульфонил-[1,1']-дифен-4-ил) аминокарбонил]-4-(3-амидинофенил)пиррол соль трифторуксусной кислоты (пример 6). Часть А. Получение этил 3-(3-цианофенил)пропиолата. К раствору этилпропиолата (25,0 г, 0,25 моль) в 750 мл тетрагидрофурана при -78 С по каплям добавляют н-бутиллитий (102 мл 2,5 М раствор в гексане, 0,25 моль). После перемешивания при этой же температуре в течение 1 ч добавляют хлорид цинка (104,2 г, 0,76 моль) в 90 мл тетрагидрофурана. Смеси дают медленно нагреться до комнатной температуры в течение 1 ч. К этому раствору добавляют 3 иодбензонитрил (29,2 г, 0,13 моль) и хлорид бис-трифенилфосфинпалладия(II) (4,56 г, 6,5 ммоль) и образовавшуюся смесь перемешивают при 50 С в течение ночи. К смеси добавляют 150 мл воды и 150 мл простого эфира и смесь фильтруют через подушку целита. Фильтрат экстрагируют 3 раза эфиром и объединенные экстракты промывают рассолом, сушат (MgSO4) и фильтруют через толстую подушку силикагеля. Растворители удаляют в вакууме и остаток перекристаллизовывают из смеси гексан/этилацетат, получая 8,8 г (35%) указанного в заголовке соединения в виде твердого вещества желтовато-коричневого цвета. 1 Н-ЯМР (СDСl3) : 7,85 (с, 1 Н), 7,8 (д, 1 Н),7,72 (д, 1 Н), 7,52 (т, 1 Н), 4,30 (кв., 2 Н), 1,37 (т,3 Н). Часть В. Получение 1-бензил-3-карбоэтокси-4-(3-цианофенил)-3-пирролина. К раствору метилового эфира N-бензил-N(триметилсилилметил)аминометила (12,25 г,51,2 ммоль) в 400 мл метиленхлорида при 0 С добавляют этил 3-(3-цианофенил)пропиолат(6,79 г, 34,1 ммоль) и затем трифторуксусную кислоту (0,20 мл, 2,6 ммоль). Смеси дают нагреться до комнатной температуры и перемеши 003056 56 вают в течение 16 ч. Реакционную смесь промывают насыщенным водным раствором NaHCO3 и рассолом, сушат над К 2 СО 3, фильтруют через большую подушку силикагеля и концентрируют в вакууме. Остаток очищают флэшхроматографией (элюирование: 5:1 гексаны/этилацетат), получая 3,2 г (28%) указанного в заголовке соединения. MS (ESI) 333,4 (М+Н)+. Часть С. Получение 1-бензил-3-[(2'-тpeтбyтилaминocyльфoнил-[1,1']-дифен-4-ил)аминокарбонил]-4-(3-цианофенил)-3-пирролина. К раствору (2'-трет-бутиламиносульфонил[1,1']-дифен-4-ил)амина (1,10 г, 3,6 ммоль) в 50 мл метиленхлорида при комнатной температуре по каплям добавляют триметилалюминий (6,6 мл, 2,0 М раствор в толуоле, 13,2 ммоль). Раствор перемешивают (30 мин) до тех пор, пока не прекратится выделение газа, затем добавляют 1 бензил-3-карбоэтокси-4-(3-цианофенил)-3-пирролин (1,0 г, 3,0 ммоль) в 5 мл метиленхлорида. Образовавшийся раствор перемешивают при 40 С в течение 2 ч, охлаждают до комнатной температуры и гасят насыщенным водным раствором NH4Cl. Смесь разбавляют этилацетатом,промывают водой и рассолом, сушат (МgSO4) и концентрируют в вакууме. Остаток очищают флэш-хроматографией(M+H)+. Часть D. Получение 1-бензил-3-[(2'-третбутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил]-4-(3-цианофенил)пиррола. К раствору 1-бензил-3-[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил]-4-(3-цианофенил)-3-пирролина (0,47 г, 0,8 ммоль) в 20 мл бензола добавляют 2,3-дихлор 5,6-дициано-1,4-бензохинон (DDQ) (0,27 г, 1,2 ммоль) и образовавшуюся смесь перемешивают при 70 С в течение 16 ч. Смесь охлаждают,фильтруют и концентрируют в вакууме. Остаток очищают флэш-хроматографией (элюирование: гексан/этилацетат, 5:1), получая 0,25 г(ESI) 589,6 (М+Н)+. Часть Е. Получение соли трифторуксусной кислоты 1-бензил-3-[(2'-аминосульфонил-[1,1']дифен-4-ил)аминокарбонил]-4-(3-амидинофенил)пиррола (пример 5) и соли трифторуксусной кислоты 1-бензил-3-[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил]-4(3-амидинофенил)пиррола (пример 6). Раствор 1-бензил-3-[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил]-4(3-цианофенил)пиррола (0,25 г, 0,42 ммоль) в 50 мл безводного метанола охлаждают до 0 С. Безводный газообразный НСl барботируют через раствор в течение приблизительно 30 мин (до получения насыщенного раствора). Колбу герметично закрывают и оставляют на 16 ч при температуре 0 С. Реакционную 57 смесь концентрируют в вакууме. Образовавшееся твердое вещество растворяют в 20 мл безводного метанола, добавляют карбонат аммония(0,20 г, 2,1 ммоль), смесь перемешивают при комнатной температуре в течение 24 ч. Реакционную смесь концентрируют в вакууме и очищают препаративной ВЭЖХ с обращенной фазой (колонка С 18, элюирование градиентом,H2O/CH3CN с 0,5% ТФУ), после лиофилизации получают 120 мг (40%) соли трифторуксусной кислоты 1-бензил-3-[(2'-аминосульфонил-[1,1']дифен-4-ил)аминокарбонил]-4-(3-амидинофенил)пиррола (пример 5) в виде белого порошка.MS (ESI) 550,3 (М+Н)+. Также после лиофилизации получают 40 мг (13%) соли трифторуксусной кислоты 1-бензил-3-[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил]-4-(3-амидинофенил)пиррола (пример 6) в виде белого порошка. MS (ESI) 606,5 (М+Н)+. Примеры 7 и 8. 1-(3-Амидинофенил)-4-[(2'аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]имидазол (пример 7) и 1-(3-амидинофенил)-4-[(2'-трет-бутиламиносульфонил-[1,1']дифен-4-ил)аминокарбонил]имидазол (пример 8). Часть А. Получение 4-[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил]имидазола. К суспензии 4-имидазолкарбоновой кислоты (168 мг, 1,5 ммоль) в СН 3 СN (30 мл) добавляют тионилхлорид (714 мг, 6 ммоль) и полученную смесь нагревают при 80 С в течение 2 ч. После удаления летучих компонентов желтый остаток подвергают взаимодействию с 4-[(oSO2-трет-Вu)фенил]анилином (304 мг, 1 ммоль) в пиридине (10 мл) при комнатной температуре в течение 24 ч. Выпаривание пиридина приводит к получению остатка, который растворяют вEtOAc и промывают водой, рассолом и сушат над MgSO4. Концентрирование и очистка сырого продукта колоночной хроматографией приводит к получению указанного в заголовке соединения (378 мг, 95% выход). 1 58 Гц, 2 Н), 7,88-7,79 (м, 2 Н), 7,65 (тд, J = 7,3 Гц, J = 1,5 Гц, 1 Н), 7,56 (дд, J = 7,7 Гц, J = 1,5 Гц, 1 Н),7,50 (д, J = 8,4 Гц, 2 Н), 7,38 (дд, J = 8,4 Гц, J = 1,5 Гц, 1 Н), 2,80 (с, 1 Н), 1,03 (с, 9 Н); LRMS: 500,1 (М+Н)+. Часть С. Получение 1-(3-амидинофенил)-4[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]имидазола (пример 7) и 1-(3-амидинофенил)-4-[(2'-трет-бутиламиносульфонил-[1,1']дифен-4-ил)аминокарбонил]имидазола (пример 8). 1-(3-Цианофенил)-4-[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил] имидазол подвергают далее реакции Пиннера по стандартным методикам примеров 7 (309 мг,62% выход) и 8 (67 мг, 12% выход). Для примера 7: 1H-ЯМР (СD3OD) : 8,32ESMS: 461,3 (M+H)+; HRMS: 461,1387 (найдено), 461,1396 (вычислено). Для примера 8: 1H-ЯМР (CD3OD) : 8,33 (с,2 Н) , 8,12 (с, 1 Н), 8,10 (дд, J = 8,4 Гц, J = 1,5 Гц,1 Н), 8,05 (дд, J = 8,1 Гц, J = 2,2 Гц, 1H), 7,887,80 (м, 3 Н), 7,79 (д, J = 8,4 Гц, 2 Н), 7,61 (тд, J = 7,7 Гц, J = 1,5 Гц, 1H), 7,53 (тд, J = 7,7 Гц, J = 1,2 Гц, 1H), 7,47 (д, J = 8,4 Гц, 2 Н), 7,35 (дд, J = 7,3 Гц, J = 1,5 Гц, 1H), 1,02 (с, 9 Н); 13 С-ЯМР (СD3OD) : 167,58, 162,57, 143,51,141,65, 139,02, 138,68, 138,68, 137,30, 133,89,133,05, 132,44, 131,64, 131,52, 128,72, 129,53,128,77, 128,50, 127,65, 122,96, 122,12, 120,99,55,06, 30,11; ESMS: 517,4 (M+H)+; HRMS: 517,2025 (найдено), 517,2022 (вычислено). Анализ: (С 27 Н 28N6O3S1 + 1,35 ТФУ + 0,17 НСl + 0,6 Н 2 О) С, Н, N, S, F, Cl. Пример 9. 1-(3-Амидинофенил)-2-[(2'аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]имидазол. Часть А. Получение 1-(3-цианофенил) имидазола. 3-Фторбензонитрил (4,84 г, 40 ммоль) нагревают с имидазолом (2,72 г, 40 ммоль) в присутствии К 2 СО 3 в ДМФ при 100 С в течение 8 ч,получая с количественным выходом указанное в заголовке соединение в виде белого порошка. 1H-ЯМР (CDCl3) : 7,89 (с, 1H), 7,70 (д, J = 0,8 Гц, 1H), 7,68-7,58 (м, 3H), 7,30 (д, J = 1,0 Гц,1H), 7,26 (с 1H); LRMS: 170 (М+Н)+. Часть В. Получение метил 1-(3-цианофенил)имидазол-2-ил карбоксилата. 1-(3-Цианофенил)имидазол (1,52 г, 9 ммоль) медленно обрабатывают н-BuLi (1,6 М, 59 6,3 мл) в ТГФ (60 мл) при -78 С в течение 40 мин и затем медленно гасят хлорметилформиатом (942 мг, 10 ммоль) при этой температуре. Образовавшуюся смесь перемешивают при-78 С и в течение 2 ч нагревают до комнатной температуры, затем выливают в воду и этилацетат. Органический слой отделяют, промывают водой, рассолом и сушат над МgSO4. После удаления этилацетата остаток очищают колоночной хроматографией с использованием смеси этилацетат:метиленхлорид (1:1), получая указанное в заголовке соединение (1,33 г, 65%) в виде твердого белого вещества. 1H-ЯМР (CDCl3) : 7,80-7,77 (м, 1H), 7,657,61 (м, 3 Н), 7,33 (с, 1H), 7,20 (с, 1H); LRMS: 228 (M+H)+. Часть С. Получение 1-(3-цианофенил)-2[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4 ил)аминокарбонил]имидазола. К раствору 4-[(о-SO2-трет-Вu)фенил]анилина (304 мг, 1 ммоль) в CH2Cl2 (20 мл) при перемешивании медленно добавляют триметилалюминий (2 М раствор в гексане, 1 мл) при 0 С и образовавшуюся смесь нагревают до комнатной температуры в течение 15 мин. После этого добавляют раствор метил 1-(3-цианофенил) имидазол-2-илкарбоксилата в СH2 Сl2 (5 мл) и образовавшуюся смесь кипятят с обратным холодильником в течение 2 ч. Смесь гасят водой,разбавляют этилацетатом и фильтруют через целит. Органический слой отделяют, промывают водой и рассолом и сушат над МgSO4. После удаления этилацетата остаток очищают колоночной хроматографией с использованием смеси этилацетат:метиленхлорид (1:1), получая указанное в заголовке соединение (260 мг, 52%) в виде твердого белого вещества. 1 Н-ЯМР (CDCl3) : 9,41 (с, 1H), 8,15 (дд, J= 0,8 Гц, 1H), 7,22 (д, J = 0,8 Гц, 1H), 3,64 (с,1H), 0,99 (с, 9 Н); LRMS: 500,1 (М+Н)+. Часть D. Получение 1-(3-амидинофенил)2-[(2'-аминосульфонил-[1,1']-дифен-4-ил)аминокарбонил]имидазола. 1-(3-Цианофенил)-2-[(2'-трет-бутиламиносульфонил-[1,1']-дифен-4-ил)аминокарбонил] имидазол подвергают реакции Пиннера для получения указанного в заголовке соединения (120 мг, 50%): 1(Fischer et al. Synthesis 1991, 83). Реакционную смесь кипятят с обратным холодильником в течение 48 ч, охлаждают и концентрируют. Остаток растворяют в этилацетате (100 мл), промывают НСl (1N, 50 мл), рассолом (50 мл) и сушат(сульфат магния). Упаривание приводит к получению масла, после очистки которого колоночной хроматографией на силикагеле (гексан:этилацетат, 6:1) получают этил 1-(3 бромфенил)-5-метилпиразол-3-илкарбоксилат(3,73 г) и этил 1-(3-бромфенил)-3-метилпиразол 5-илкарбоксилат (3,65 г) в виде чистых соединений. Пиразолкарбоксилат, полученный таким способом, используют непосредственно в части В. Часть В. Получение этил 1-(3-цианофенил)-3-метилпиразол-5-илкарбоксилата. Этил 1-(3'-бромфенил)-3-метилпиразол-5 илкарбоксилат (2,3 г) растворяют в Nметилпирролидиноне (4 мл) и к этому раствору добавляют CuCN (1 г). Реакционную смесь кипятят с обратным холодильником в течение 2 ч,затем перемешивают при комнатной температуре в течение ночи. Смесь гасят водой (100 мл),органику экстрагируют этилацетатом (2100 мл) и сушат (сульфат магния). Очистка колоночной хроматографией на силикагеле (гексан:этилацетат, 3:1) приводит к получению указанного в заголовке соединения (0,59 г). 1 Н-ЯМР (CDCl3) : 7,76 (т, 1 Н), 7,70 (дд,1 Н), 7,58 (т, 1 Н), 6,86 (с, 1 Н), 4,3 (кв., 2 Н), 2,36(с, 3 Н), 1,31 (т, 3H), млн. д.; ИК (чистый) 2230,1728, 1586, 1540, 1494, 1438, 1298, 1242, 1106,1046, 760, 682 см-1. Химический ионизационный масс-спектр m/z (отн. интенсивность) 256 (М+Н,100). Часть С. Получение 1-(3-цианофенил)-3 метилпиразол-5-илкарбоновой кислоты. Этил 1-(3-цианофенил)-3-метилпиразол-5 илкарбоксилат (0,55 г) растворяют в ТГФ (20 мл) и к этой смеси добавляют LiOH (0,5 М, 5,6 мл). Реакционную смесь перемешивают при комнатной температуре в течение 18 ч, затем гасят водой (50 мл). Непрореагировавшие органические вещества экстрагируют этилацетатом(250 мл). Водный слой подкисляют и экстрагируют этилацетатом (250 мл), сушат (сульфат магния) и упаривают, получая чистую кислоту. 1
МПК / Метки
МПК: A61P 7/02, A61K 31/41, C07D 207/34
Метки: фактора, ха, соединения, ингибиторов, гетероароматические, азотсодержащие, качестве, фармацевтическая, лечения, способ, композиция
Код ссылки
<a href="https://eas.patents.su/30-3056-azotsoderzhashhie-geteroaromaticheskie-soedineniya-v-kachestve-ingibitorov-faktora-ha-farmacevticheskaya-kompoziciya-i-sposob-lecheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Азотсодержащие гетероароматические соединения в качестве ингибиторов фактора ха, фармацевтическая композиция и способ лечения</a>
Предыдущий патент: Способ лечения легочной гипертензии
Следующий патент: Способ получения 5-цианофталида
Случайный патент: Способ получения поверхностного антигена вируса гепатита b и содержащие его вакцинные композиции


































