Способ получения 5-цианофталида
Формула / Реферат
1. Способ получения 5-цианофталида из 5-карбоксифталида, включающий
а) преобразование 5-карбоксифталида в амид формулы IV

где R представляет собой водород или C1-6алкил, и
b) последующее взаимодействие амида формулы IV с дегидратирующим агентом с получением 5-цианофталида

2. Способ по п.1, где преобразование 5-карбоксифталида в амид формулы IV осуществляют через сложный эфир формулы VI

где R1 представляет собой C1-6алкил или фенил, путем обработки 5-карбоксифталида спиртом R1OH в присутствии кислоты и с последующим амидированием сложного эфира формулы VI аммиаком или C1-6 алкиламином.
3. Способ по п.1, где преобразование 5-карбоксифталида в амид формулы IV осуществляют через хлорангидрид формулы VII
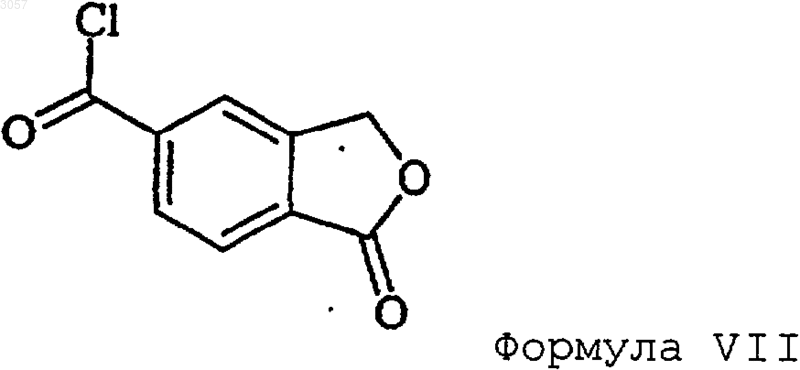
путем обработки 5-карбоксифталида РОСl3, РСl3 или SОСl3 с последующим амидированием хлорангидрида формулы VII аммиаком или C1-6алкиламином.
4. Способ по п.1, где преобразование 5-карбоксифталида в амид формулы IV осуществляют через хлорангидрид формулы VII и сложный эфир формулы VI
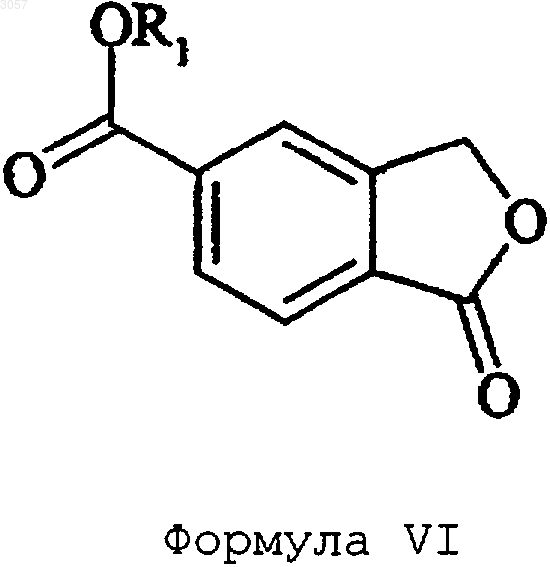
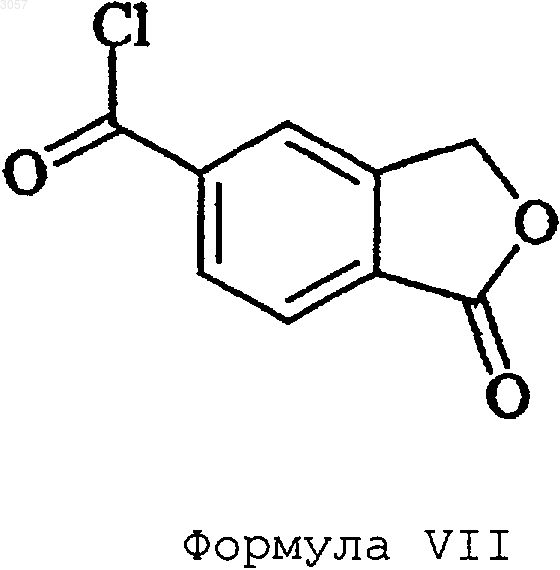
где R1 представляет собой C1-6алкил или фенил, путем обработки 5-карбоксифталида РОСl3, РСl3 или SОСl3 с последующим взаимодействием полученного таким образом хлорангидрида формулы VII со спиртом R1OH и амидированием сложного эфира формулы VI аммиаком или C1-6алкиламином.
5. Способ по п.2, где используемой кислотой является минеральная кислота или кислота Льюиса и предпочтительно НСl, Н2SO4, РОСl3, РСl3 или SОСl3.
6. Способ по п.2, 4 или 5, где R1 представляет собой метил или этил.
7. Способ по любому из пп.1-6, где указанным дегидратирующим агентом, используемым на стадии b), является SОСl3, РОСl3 и РСl3 и предпочтительно SОСl3.
8. Способ по любому из пп.1-7, где взаимодействие на стадии b) проводят в чистом виде или в подходящем растворителе, таком как толуол, сульфолан или ацетонитрил, и предпочтительно в толуоле.
9. Способ по п.8, где указанным дегидратирующим агентом, используемым на стадии b), является SOCl2, и указанное взаимодействие осуществляют в толуоле, содержащем каталитическое количество N,N-диметилформамида.
10. Способ по любому из пп.1-9, где R представляет собой Н или трет-бутил.
11. Способ по п.2, где 5-карбоксифталид формулы III подвергают взаимодействию со спиртом R1OH, предпочтительно с этанолом или метанолом, в присутствии РОСl3, с получением сложного эфира формулы VI, который затем подвергают взаимодействию с аммиаком с получением 5-карбамоилфталида, который, в свою очередь, подвергают взаимодействию с SOCl2 с получением 5-цианофталида.
12. Способ по п.11, где 5-карбоксифталид формулы III подвергают взаимодействию с этанолом в присутствии РОСl3 с получением этилового сложного эфира формулы VI, который затем подвергают взаимодействию с аммиаком в метаноле с получением 5-карбамоилфталида, который, в свою очередь, подвергают взаимодействию с SOCl2 с получением 5-цианофталида.
Текст
1 Настоящее изобретение относится к новому способу получения 5-цианофталида, который является промежуточным соединением, используемым для получения хорошо известного антидепрессантного лекарственного средства циталопрама, 1-[3-(диметиламино)пропил]-1-(4-фторфенил)-1,3-дигидро-5-изобензофуранкарбонитрила. Предпосылки создания изобретения Циталопрам представляет собой хорошо известное антидепрессантное лекарственное средство, которое существует в продаже уже в течение нескольких лет и которое имеет следующую структуру: Циталопрам является селективным, воздействующим на центральную нервную систему ингибитором вторичного поглощения серотонина (5-гидрокситриптамина; 5-НТ), обладающим антидепрессантной активностью. Об антидепрессантной активности данного соединения сообщалось в ряде публикаций, например, J.Psychiat, 1982, 6, 277-295 и A. Gravem, Acta Psychiatr. Scand., 1987, 75, 478-486. Циталопрам был получен способом, описанным в патенте США 4650884, согласно которому 5-цианофталимид подвергают двум последовательным реакциям Гриньяра, т.е. реакциям с галогенидом 4-фторфенилмагния и галогенидом N,N-диметиламинопропилмагния,соответственно, и полученное соединение формулы 2 Способ получения 5-цианофталида был ранее описан в Bull. Soc.Sci.Bretagne, 26, 1951,35 и LevyStephen, J. Chem. Soc. 1931, 867. В соответствии с этим способом 5-аминофталид преобразуют в соответствующий 5-цианофталид путем диазотирования с последующим взаимодействием с CuCN. 5-Аминофталид был получен из 4-аминофталимида путем двухстадийного восстановления. Синтез некоторых алкил- и фенилнитрилов из хлорангидридов описан в Tetrahedron Letters,1982, 23, 14, 1505-1508 и в Tetrahedron, 1998, 54,9281. Несмотря на неэффективность ряда других методов, было обнаружено, что 5-цианофталимид может быть получен с высокими выходами из 5-карбоксифталида удобным и экономически выгодным способом. Описание изобретения Таким образом, настоящее изобретение относится к новому способу получения 5-цианофталида из 5-карбоксифталида, включающему а) преобразование 5-карбоксифталида в амид формулы IV где R представляет собой водород или C1-6 алкил, иb) последующее взаимодействие амида формулы IV с дегидратирующим агентом с получением 5-цианофталида Преобразование 5-карбоксифталида в амид формулы IV может быть осуществлено через сложный эфир формулы VI или хлорангидрид формулы VII, либо через сложный эфир или хлорангидрид подвергают реакции замыкания кольца путем дегидратациии в присутствии сильной серной кислоты. Энантиомеры циталопрама могут быть получены способом, описанным в патенте США 4943590, то есть путем разделения энантиомеров промежуточного соединения формулы II и осуществления энантиоселективного замыкания кольца с получением нужного энантиомера. Таким образом, 5-цианофталид является важным промежуточным соединеним для получения циталопрама и важным соединением для получения указанного продукта требуемого качества удобным и экономически выгодным способом. где R1 представляет C1-6 алкил или фенил. Хлорангидрид обычно получают путем обработки 5 карбоксифталида чистыми РОСl3, РСl3 или 3 как толуол или толуол, содержащий каталитическое количества N,N-диметилформамида. Сложный эфир получают путем обработки 5 карбоксифталида спиртом R1OH, где R1 определен выше, в присутствии кислоты, предпочтительно, минеральной кислоты или кислоты Льюиса, такой как НСl, Н 2SO4, РОСl3, РСl3 илиSОСl3. Альтернативно, сложный эфир может быть получен из хлорангидрида реакцией взаимодействия со спиртом. Затем сложный эфир формулы VI или хлорангидрид формулы VII преобразуют в амид формулы IV путем амидирования аммиаком или C1-6 алкиламином и предпочтительно трет-бутиламином. В настоящем описании и формуле изобретения C1-6 алкил означает разветвленную или неразветвленную алкильную группу, имеющую от одного до шести атомов углерода включительно такую как метил, этил, 1-пропил, 2 пропил, 1-бутил, 2-бутил, 2-метил-2-пропил,2,2-диметил-1-этил и 2-метил-1-пропил. Дегидратирующим агентом, используемым на стадии b), может быть любой подходящий дегидратирующий агент, и оптимальный агент может быть легко выбран специалистом. Примерами подходящих дегидратирующих агентов являются SОСl3, РОСl3 и РСl3 и предпочтительно SОСl3. Реакцию на стадии b) осуществляют либо без растворителя, либо в подходящем растворителе, таком как толуол, сульфолан или обычно ацетонитрил. Если данную реакцию осуществляют в растворителе, то используют 1,0-1,5, а предпочтительно 1,0-1,2 эквивалентов дегидратирующего агента на эквивалент амида формулы V. Кроме того, если используют растворитель, то может оказаться необходимым использовать каталитическое количествоN,Nдиметилформамида, в частности, если дегидратирующим агентом является SОСl2. В качестве растворителя предпочтительно используют толуол и, если это необходимо, в присутствии каталитического количества N,N-диметилформамида. Реакцию на стадии b) осуществляют при повышенной температуре и предпочтительно при температуре кипения растворителя. Время реакции не имеет решающего значения и может быть легко определено специалистом. 5-Цианофталид может быть выделен обычным способом, например добавлением воды, фильтрацией и последующей промывкой кристаллов. Последующая очистка, если это необходимо, может быть осуществлена путем перекристаллизации. В предпочтительном варианте осуществления изобретения R в формуле IV представляет собой Н или трет-бутил. Если реакцию на стадии а) осуществляют через сложный эфир, то R1 предпочтительно представляет собой метил или этил. 4 В особенно предпочтительном варианте осуществления изобретения 5-карбоксифталид формулы III подвергают взаимодействию со спиртом R1OH, предпочтительно с этанолом, в присутствии РОСl3 с получением соответствующего сложного эфира формулы VI, который затем подвергают взаимодействию с аммиаком с получением 5-карбамоилфталида, который, в свою очередь, подвергают взаимодействию сSОСl3 в толуоле, содержащем каталитическое количество N,N-диметилформамида. Неожиданно было обнаружено, что реакция у лактонового кольца обычно не происходит. В соответствии со способом настоящего изобретения 5-цианофталид получают с высокими выходами, и указанный способ является гораздо более эффективным, чем известный способ, и позволяет использовать более подходящие и более дешевые реагенты и в более подходящих условиях. 5-Карбоксифталид, используемый в качестве исходного соединения, может быть получен методами, описанными в патенте США 3607884 или в патенте Германии 2630927,то есть путем взаимодействия концентрированного раствора терефталевой кислоты с формальдегидом в жидком SО 3 или путем электрохимического гидрирования тримеллитовой кислоты. Примеры Настоящее изобретение дополнительно проиллюстрировано следующими примерами. Пример 1. Получение 5-цианофталида. 5-Хлоркарбонилфталид. 5-Карбоксифталид (53 г, 0,3 моль) суспендируют в толуоле (200 мл) и тионилхлориде (44 г,0,6 моль). Затем добавляют N,N-диметилформамид (ДМФ)(1 мл) и смесь кипятят с обратным холодильником в течение 3 ч. Полученную смесь охлаждают до комнатной температуры и добавляют н-гептан (200 мл). Образованные кристаллы собирают и промывают гептаном(2 Н, с), 8,06 (1 Н, д, J=7,5 Гц), 8,28 (1 Н, д, J=7,5 Гц), 8,3 (1 Н, с). 13 С-ЯМР (СDСl3, 125 МГц): 69,4; 125,1; 126,1; 131,1; 131,6; 137,8; 146,6; 167,4; 169,0. 5-трет-Бутилкарбамилфталид. Метод А) 5-Карбоксифталид (36 г, 0,2 моль) суспендируют в тионилхлориде (100 мл). Затем добавляют ДМФ (1,5 мл) и смесь кипятят с обратным холодильником в течение 1 ч. Затем добавляют толуол (200 мл) и растворители выпаривают в вакууме. Остаток растворяют в тетрагидрофуране (ТГФ) (200 мл) и добавляют в раствор третбутиламина (31 г, 0,42 моль) в ТГФ (200 мл) при 5 С. Смесь оставляют для нагревания до комнатной температуры и перемешивают в течение ночи. Затем реакционную смесь выливают в 5 ледяную воду (400 мл) и выпавшие кристаллы отфильтровывают. Полученные кристаллы промывают водой (100 мл). Выход: 41 г, 87%. Начальная температура ДСК: 189,5 С. Метод В) Раствор 5-хлоркарбонилфталида (39 г, 0,2 моль) в ТГФ (200 мл) добавляют к раствору третбутиламина (19 г, 0,25 моль) и триэтиламина (26 г,0,25 моль) в ТГФ (200 мл) при комнатной температуре. Смесь перемешивают в течение 1 ч. Затем реакционную смесь выливают в ледяную воду(500 мл). Образовавшийся кристаллический продукт собирают и промывают водой (100 мл). Выход: 42,5 г, 91%. Начальная температура ДСК: 192 С. Чистота: 99,5% (ВЭЖХ, площадь пика). 1 НЯМР (ДМСО-d6, 500 МГц): 1,4 (9 Н, с), 5,46 (2 Н, с),7,88 (1 Н, д, J=7,5 Гц), 7,95 (1 Н, д, J=7,5 Гц), 8,04(1 Н,с). 13 С-ЯМР (ДМСО-d6, 125 МГц): 28,5; 51,2; 70,0; 122,0; 124,6; 126,6; 128,2; 141,3; 147,2; 165,5; 170,1. 5-Этоксикарбонилфталид. Метод А) 5-Карбоксифталид (37 г, 0,2 моль) суспендируют в этаноле (400 мл). Затем по каплям добавляют РОСl3 (10 г, 0,07 моль) и реакционную смесь кипятят с обратным холодильником в течение 5 ч. После охлаждения до комнатной температуры указанное в заголовке соединение кристаллизовалось. Кристаллы отфильтровывают и промывают этанолом (50 мл). Выход: 35 г,87%. Начальная температура ДСК: 151 С. 1HЯМР (ДМСО-d6, 250 МГц): 1,36 (3 Н, т, J=7 Гц),4,38 (2 Н, кв., J=7 Гц), 5,48 (2 Н, с), 7,95 (1 Н, д,J=7,5 Гц), 8,12 (1 Н, д, J=7,5 Гц). 13 С-ЯМР(ДМСО-d6, 62,5 МГц): 14,5; 61,5; 70,1; 124,0; 125,2; 128,8; 129,6; 134,8; 147,6; 164,9; 169,8. Метод В) 5-Хлоркарбонилфталид (39 г, 0,2 моль) суспендируют в этаноле (200 мл). Смесь кипятят с обратным холодильником в течение 15 мин. После охлаждения образовавшееся кристаллическое вещество отфильтровывают и промывают этанолом (50 мл). Выход: 36 г, 88%. Начальная температура ДСК: 151 С. 5-Карбамилфталид. Метод А) 5-Этоксикарбонилфталид (41 г, 0,2 моль) суспендируют в аммиаке (10 М раствор в метаноле, 200 мл) в реакторе под давлением. Реакционную температуру поддерживают при 80 С в течение 20 ч. После охлаждения реакционную смесь выливают на лед (250 г) и рН доводят до 1 с использованием концентрированной соляной кислоты. Смесь перемешивают в течение 2 ч. Образовавшиеся кристаллы отфильтровывают,промывают водой (4 х 100 мл) и сушат в вакууме. Выход: 33 г, 93%. Начальная температура ДСК: 237 С. 1H-ЯМР (ДМСО-d6, 250 МГц): 5,47 6 122,2, 124,9, 127,2, 128,2, 139,7, 147,4, 167,1,170,1. Метод В): 5-Хлоркарбонилфталид (20 г, 0,1 моль) растворяют в ТГФ (100 мл) и добавляют к гидроксиду аммония (50 мл) в ледяной воде (300 мл). Смесь перемешивают в течение 30 мин и осажденные кристаллы отфильтровывают. Кристаллы промывают водой (100 мл) и сушат в вакууме. Выход: 17,1 г, 97%. Начальная температура ДСК: 237 С. 5-Цианофталид. Метод А) Сухой 5-карбамилфталид (36 г, 0,2 моль) суспендируют в толуоле (600 мл) и добавляют тионилхлорид (36 г, 0,3 моль). Затем добавляют ДМФ (2 мл). Реакционную смесь нагревают при 75 С в течение 6 ч. Толуол (100 мл) удаляют путем дистилляции и оставшийся раствор охлаждают до комнатной температуры. Образовавшиеся кристаллы отфильтровывают и промывают толуолом (150 мл) и водой (100 мл). Полученный продукт перекристаллизовывают из толуола. Выход: 22 г, 80%. Начальная температура ДСК: 203 С. Метод В) Трет-бутилкарбамилфталид (23,3 г, 0,1 моль) суспендируют в тионилхлориде (100 мл). Смесь кипятят с обратным холодильником в течение 30 мин. Затем добавляют толуол (100 мл) и растворители удаляют в вакууме. Указанный в заголовке продукт кристаллизуют из уксусной кислоты или толуола. Выход: 15,5 г, 93% из толуола. Начальная температура ДСК: 203 С. Чистота: 98% (ВЭЖХ, площадь пика). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения 5-цианофталида из 5 карбоксифталида, включающий а) преобразование 5-карбоксифталида в амид формулы IV где R представляет собой водород или C1-6 алкил, иb) последующее взаимодействие амида формулы IV с дегидратирующим агентом с получением 5-цианофталида 2. Способ по п.1, где преобразование 5 карбоксифталида в амид формулы IV осуществляют через сложный эфир формулы VIR1OH в присутствии кислоты и с последующим амидированием сложного эфира формулы VI аммиаком или C1-6 алкиламином. 3. Способ по п.1, где преобразование 5 карбоксифталида в амид формулы IV осуществляют через хлорангидрид формулы VII путем обработки 5-карбоксифталида РОСl3, РСl3 или SОСl3 с последующим амидированием хлорангидрида формулы VII аммиаком или C1-6 алкиламином. 4. Способ по п.1, где преобразование 5 карбоксифталида в амид формулы IV осуществляют через хлорангидрид формулы VII и сложный эфир формулы VI где R1 представляет собой C1-6 алкил или фенил,путем обработки 5-карбоксифталида РОСl3, РСl3 или SОСl3 с последующим взаимодействием полученного таким образом хлорангидрида формулы VII со спиртом R1OH и амидировани 8 ем сложного эфира формулы VI аммиаком илиC1-6 алкиламином. 5. Способ по п.2, где используемой кислотой является минеральная кислота или кислота Льюиса и предпочтительно НСl, Н 2SO4, РОСl3,РСl3 или SОСl3. 6. Способ по п.2, 4 или 5, где R1 представляет собой метил или этил. 7. Способ по любому из пп.1-6, где указанным дегидратирующим агентом, используемым на стадии b), является SОСl3, РОСl3 и РСl3 и предпочтительно SОСl3. 8. Способ по любому из пп.1-7, где взаимодействие на стадии b) проводят в чистом виде или в подходящем растворителе, таком как толуол, сульфолан или ацетонитрил, и предпочтительно в толуоле. 9. Способ по п.8, где указанным дегидратирующим агентом, используемым на стадии b),является SOCl2, и указанное взаимодействие осуществляют в толуоле, содержащем каталитическое количество N,N-диметилформамида. 10. Способ по любому из пп.1-9, где R представляет собой Н или трет-бутил. 11. Способ по п.2, где 5-карбоксифталид формулы III подвергают взаимодействию со спиртом R1OH, предпочтительно с этанолом или метанолом, в присутствии РОСl3, с получением сложного эфира формулы VI, который затем подвергают взаимодействию с аммиаком с получением 5-карбамоилфталида, который, в свою очередь, подвергают взаимодействию с SOCl2 с получением 5-цианофталида. 12. Способ по п.11, где 5-карбоксифталид формулы III подвергают взаимодействию с этанолом в присутствии РОСl3 с получением этилового сложного эфира формулы VI, который затем подвергают взаимодействию с аммиаком в метаноле с получением 5-карбамоилфталида,который, в свою очередь, подвергают взаимодействию с SOCl2 с получением 5-цианофталида.
МПК / Метки
МПК: C07D 307/87
Метки: способ, 5-цианофталида, получения
Код ссылки
<a href="https://eas.patents.su/5-3057-sposob-polucheniya-5-cianoftalida.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 5-цианофталида</a>









