Производные 6-фенилпиридил-2-амина, полезные в качестве ингибиторов nos
Формула / Реферат
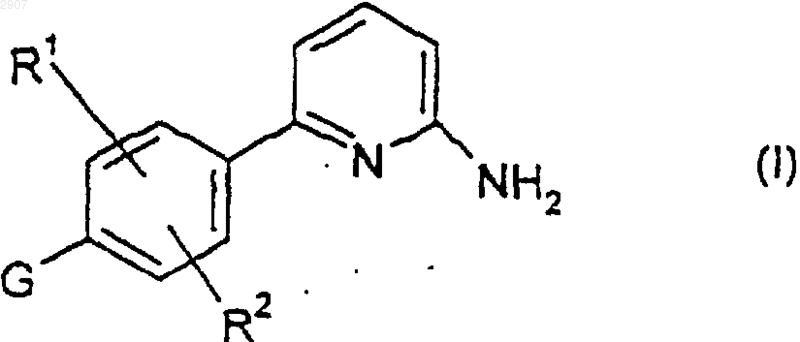
1. Соединение формулы
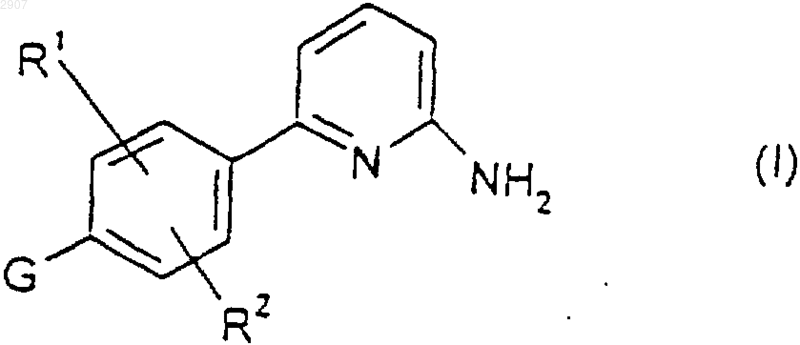
где R1 и R2 независимо выбраны из водорода, гидрокси, метила и метокси; и G является группой формулы
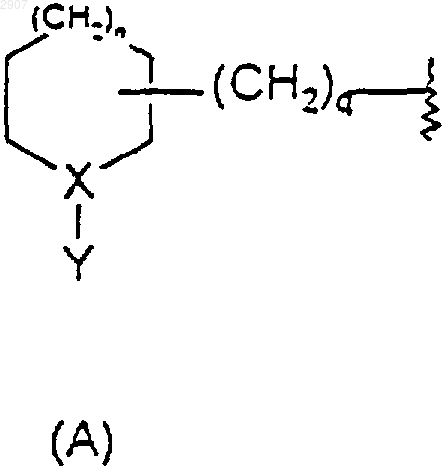
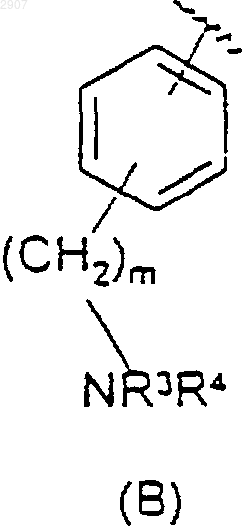
где n равно нулю или единице;
Y представляет собой NR3R4, (С1-С6)алкил или аралкил, где арильная группировка указанного аралкила является фенилом или нафтилом, а алкильная группировка является нормальной или разветвленной и содержит от 1 до 6 атомов углерода и где указанный (С1-С6)алкил и арильная группировка указанного аралкила могут быть замещены заместителями в количестве от нуля до трех, которые независимо выбраны из гало, нитро, гидрокси, циано, амино, (С1-С4)алкокси и (С1-С4)алкиламино;
Х представляет собой N, когда Y является (С1-С6)алкилом, аралкилом или замещенным (С1-С6)алкилом, и Х представляет собой СН, когда Y является NR3R4;
q равно нулю, единице или двум;
m равно нулю, единице или двум; и
R3 и R4 независимо выбраны из (С1-С6)алкила, тетрагидронафталина и аралкила, где арильная группировка указанного аралкила является фенилом или нафтилом, а алкильная группировка является нормальной или разветвленной и содержит от 1 до 6 атомов углерода и где указанный (С1-С6)алкил и указанный тетрагидронафталин и арильная группировка указанного аралкила могут быть замещены заместителями в количестве от нуля до трех, которые независимо выбраны из гало, нитро, гидрокси, циано, амино, (С1-С4)алкокси и (С1-С4)алкиламино;
или R3 и R4 вместе с азотом, к которому они присоединены, образуют возможно замещенное пиперазиновое, возможно замещенное пиперидиновое или возможно замещенное пирролидиновое кольцо или азабициклическое кольцо, содержащее от 6 до 14 кольцевых членов, от 1 до 3 из которых являются азотом, а остальные являются углеродом;
или фармацевтически приемлемая соль такого соединения.
2. Соединение по п.1, где q равно нулю или единице.
3. Соединение по п.1, где NR3R4 является пиперидиновым, пиперазиновым или пирролидиновым кольцом или 3-аза-бицикло[3.1.0]гекс-6-иламинным кольцом
и где указанные пиперазиновое, пиперидиновое и пирролидиновое кольца возможно могут быть замещены одним или более чем одним заместителями, которые независимо выбраны из амино, (С1-С6)алкиламино, [ди-(С1-С6)алкил]амино, замещенных фенилом 5-6-членных гетероциклических колец, содержащих от 1 до 4 кольцевых атомов азота, бензоила, бензоилметила, бензилкарбонила, фениламинокарбонила, фенилэтила и феноксикарбонила, и где указанные фенильные группировки любого из вышеуказанных заместителей возможно могут быть замещены одним или более чем одним заместителями, которые независимо выбраны из гало, (С1-С3)алкила, (С1-С3)алкокси, нитро, амино, циано, CF3 и OCF3,
и фармацевтически приемлемые соли таких соединений.
4. Соединение по п.3, где указанные пиперазиновое, пиперидиновое и пирролидиновое NR3R4 кольца замещены заместителями в количестве от нуля до двух и где фенильные группировки любого из указанных заместителей замещены заместителями в количестве от нуля до двух.
5. Соединение по п.1, где NR3R4 является 4-фенилэтилпиперазин-1-илом, 4-метилпиперазин-1-илом, фенетиламино или 3-аза-бицикло[3.2.1]гекс-6-иламином.
6. Соединение по п.1, где NR3R4 является группой формулы
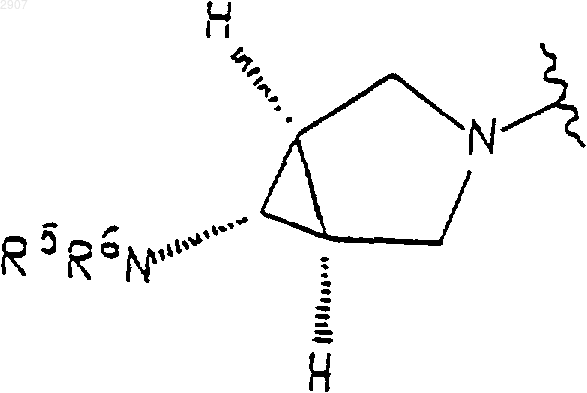
где NR5R6 представляет собой NН2.
7. Соединение по п.1, где (С1-С6)алкильные и арильные группы Y и (С1-С6)алкильные, арильные и тетрагидронафталиновые группы R3 и R4, каждая независимо, замещены заместителями в количестве от нуля до двух, выбранными независимо из хлоро, фторо, бромо, иодо, нитро, гидрокси, циано, амино, (С1-С6)алкокси и (С1-С4)алкиламино.
8. Соединение, выбранное из группы, состоящей из
6-[4-((2-(фенетил)-[2.2.1]бициклогепт-1-ил)метил)фенил]пиридин-2-иламина;
6-[4-((2-(3-аза-бицикло[3.1.0]гекс-6-иламино)-[2.2.1]бициклогепт-1-ил)метил)фенил]пиридин-2-иламина;
6-[((2-(N-фенетиламино)-5-фенилциклогексилметил)метил)фенил]пиридин-2-иламина;
6-[4-((2-(фенетил)-[2.2.1]бициклогепт-1-ил)метил)фенил]пиридин-2-иламина;
6-[((2-(3-аза-бицикло[3.1.0]гекс-6-иламино)-5-фенилциклогексилметил)метил)фенил]пиридин-2-иламина;
N-метил-(2-аминопирид-6-ил-бензилиден)oксиндола;
N-мeтил-(2-aминoпиpид-6-ил-бeнзил)oкcиндoлa;
N-(2-диметиламиноэтил)-(2-аминопирид-6-ил-бензилиден)oксиндола;
N-(2-диметиламиноэтил)-(2-аминопирид-6-ил-бензил)оксиндола;
6-[(N-5-изоксазолилметил)-4-(пиперидин-4-ил)фенил]пиридин-2-иламина;
6-[(N-ацетамидо)-4-(пиперидин-4-ил)фенил]пиридин-2-иламина;
6-[(N-бензоилметил)-4-(пиперидин-4-ил)фенил]пиридин-2-иламина;
6-[(N-3,4-метилендиоксибензил)-4-(пиперидин-4-ил)фенил]пиридин-2-иламина;
6-[(N-(2-фурил)метил)-4-(пиперидин-4-ил)фенил]пиридин-2-иламина;
6-[(N-(5-изoтиaзoлил)мeтил)-4-(пипepидин-4-ил)фeнил]пиpидин-2-иламина;
6-[(N-(5-тиaзoлил)мeтил)-4-(пипepидин-4-ил)фeнил]пиpидин-2-илaминa;
6-[(N-(2-пиpидил)мeтил)-4-(пипepидин-4-ил)фeнил]пиpидин-2-илaминa;
6-[(N-(3-пиридил)метил)-4-(пиперидин-4-ил)фенил]пиридин-2-иламина;
6-[(N-(2-имидазолил)метил)-4-(пиперидин-4-ил)фенил]пиридин-2-иламина;
6-[(N-(4-имидазолил)метил)-4-(пиперидин-4-ил)фенил]пиридин-2-иламина;
6-[(N-(4-пиридил)метил)-4-(пиперидин-4-ил)фенил]пиридин-2-иламина;
6-[(N-(2-фурил)метил)-4-(пирролидин-3-ил)фенил]пиридин-2-иламина;
8-[4-(6-аминопиридин-2-ил)фенил]-3-изобутил-3-аза-бицикло[3.2.1]октан-8-ола;
8-[4-(6-аминопиридин-2-ил)фенил]-3-фуран-2-илметил-3-аза-бицикло[3.2.1]октан-8-ола; и
8-[4-(6-аминопиридин-2-ил)фенил]-3-бензил-3-аза-бицикло[3.2.1]октан-8-ола.
9. Соединение формулы
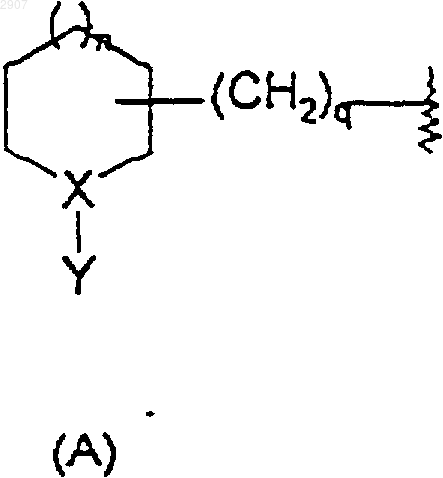
где R1 и R2 независимо выбраны из водорода, гидрокси, метила и метокси;
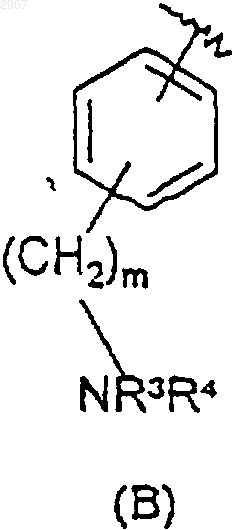
G выбран из [2.2.1]бициклогепт-6-илметила, замещенного NR3R4; [2.2.1]бициклогепт-1-илметила, замещенного NR3R4; 3-азабицикло[3.2.1]октан-8-ола, 3N-замещенного изопропилом, бензилом или фуранилметилом; (5-фенилциклогексилметила), замещенного NR3R4; оксиндолилметила или оксиндолилметилена, N-замещенных метилом или 2-диметиламиноэтилом; и группы формулы
или
где n равно нулю или единице;
Y представляет собой водород, NR3R4, (С1-С6)алкил или аралкил, где арильная группировка указанного аралкила является фенилом, нафтилом, изоксазолилом, метилендиоксибензилом, имидазолилом, пиридилом, фурилом, тиазолилом или изотиазолилом, а алкильная группировка является нормальной или разветвленной и содержит от 1 до 6 атомов углерода и где указанный (C1-С6)алкил и арильная группировка указанного аралкила могут быть замещены заместителями в количестве от одного до трех, предпочтительно заместителями в количестве от нуля до двух, которые независимо выбраны из фенила, -C(O)NH2, -С(O)фенила, гало (например, хлоро, фторо, бромо или иодо), нитро, гидрокси, циано, амино, (С1-С4)алкоъёш и (С1-С4)алкиламино;
Х представляет собой N, когда Y является (С1-С6)алкилом, аралкилом или замещенным (С1-С6)алкилом, и Х представляет собой СН, когда Y является NR3R4;
q равно нулю, единице или двум;
m равно нулю, единице или двум; и
R3 и R4 независимо выбраны из водорода, (С1-С6)алкила, -C(O)(C1-С5)алкила, циклогексила, тетрагидронафталина и аралкила, где арильная группировка указанного аралкила является фенилом или нафтилом, а алкильная группировка является нормальной или разветвленной и содержит от 1 до 6 атомов углерода и где указанный (С1-С6)алкил или -С(O)(С1-С5)алкил и указанный тетрагидронафталин и арильная группировка указанного аралкила могут быть замещены заместителями в количестве от одного до трех, предпочтительно заместителями в количестве от нуля до двух, которые независимо выбраны из фенила, гало (например, хлоро, фторо, бромо или иодо), нитро, гидрокси, циано, амино, (С1-С4)алкокси и (С1-С4)алкиламино;
или R3 и R4 вместе с азотом, к которому они присоединены, образуют пиперазиновое, пиперидиновое или пирролидиновое кольцо или азабициклическое кольцо, содержащее от 6 до 14 кольцевых членов, от 1 до 3 из которых являются азотом, а остальные являются углеродом;
и где указанные пиперазиновое, пирролидиновое и азабициклическое кольца, образованные R3 и R4, возможно могут быть замещены одним или более чем одним заместителями, предпочтительно заместителями в количестве от нуля до двух, которые независимо выбраны из (С1-С6)алкила, амино, (С1-С6)алкиламино, [ди-(С1-С6)алкил]амино, (С1-С6)алкилацетамидо, замещенных фенилом 5-6-членных гетероциклических колец, содержащих от 1 до 4 кольцевых атомов азота, бензоила, бензоилметила, бензилкарбонила, фениламинокарбонила, фенилэтила и феноксикарбонила, и где фенильные группировки любого из вышеуказанных заместителей возможно могут быть замещены одним или более чем одним заместителями, предпочтительно заместителями в количестве от нуля до двух, которые независимо выбраны из гало, (С1-С6)алкила, (С1-С6)алкокси, нитро, амино, циано, СF3 и OCF3;
или фармацевтически приемлемая соль такого соединения.
10. Соединение, выбранное из группы, состоящей из
6-[(N-(5-изотиазолил)метил)-4-(пиперидин-4-ил)фенил]пиридин-2-иламина;
6-[(N-(5-тиазолил)метил)-4-(пиперидин-4-ил)фенил]пиридин-2-иламина;
6-[(N-(2-фурил)метил)-4-(пирролидин-3-ил)фенил]пиридин-2-иламина;
6-[(N-(2-метил)пропил)-4-(пирролидин-3-ил)фенил]пиридин-2-иламина.
11. Фармацевтическая композиция для лечения или предупреждения состояния, выбранного из группы, состоящей из мигрени, воспалительных заболеваний, удара, острой и хронической боли, гиповолемического шока, травматического шока, реперфузионного повреждения, болезни Крона, язвенного колита, септического шока, рассеянного склероза, связанной со СПИДом деменции, нейродегенеративных заболеваний, нейрональной интоксикации, болезни Альцгеймера, химических зависимостей и аддикций, рвоты, эпилепсии, тревоги, психоза, травмы головы, респираторного дистресс-синдрома взрослых (РДСВ), индуцированных морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической невропатии, диабетической нефропатии и рака у млекопитающего, содержащая количество соединения по пп.1, 8 или 9, которое является эффективным при лечении или предупреждении такого состояния, и фармацевтически приемлемый носитель.
12. Способ лечения или предупреждения состояния, выбранного из группы, состоящей из мигрени, воспалительных заболеваний, удара, острой и хронической боли, гиповолемического шока, травматического шока, реперфузионного повреждения, болезни Крона, язвенного колита, септического шока, рассеянного склероза, связанной со СПИДом деменции, нейродегенеративных заболеваний, нейрональной интоксикации, болезни Альцгеймера, химических зависимостей и аддикций, рвоты, эпилепсии, тревоги, психоза, травмы головы, респираторного дистресс-синдрома взрослых (РДСВ), индуцированных морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической невропатии, диабетической нефропатии и рака у млекопитающего, при котором указанному млекопитающему вводят количество соединения по пп.1, 8 или 9, которое является эффективным при лечении или предупреждении такого состояния.
13. Фармацевтическая композиция для ингибирования синтазы оксида азота (NOS) у млекопитающего, содержащая эффективное для ингибирования NOS количество соединения по пп.1, 8 или 9 и фармацевтически приемлемый носитель.
14. Способ ингибирования NOS у млекопитающего, при котором указанному млекопитающему вводят эффективное для ингибирования NOS количество соединения по пп.1, 8 или 9.
15. Фармацевтическая композиция для лечения или предупреждения состояния, выбранного из группы, состоящей из мигрени, воспалительных заболеваний, удара, острой и хронической боли, гиповолемического шока, травматического шока, реперфузионного повреждения, болезни Крона, язвенного колита, септического шока, рассеянного склероза, связанной со СПИДом деменции, нейродегенеративных заболеваний, нейрональной интоксикации, болезни Альцгеймера, химических зависимостей и аддикций, рвоты, эпилепсии, тревоги, психоза, травмы головы, респираторного дистресс-синдрома взрослых (РДСВ), индуцированных морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической невропатии, диабетической нефропатии и рака у млекопитающего, содержащая эффективное для ингибирования NOS количество соединения по пп.1, 8 или 9 и фармацевтически приемлемый носитель.
16. Способ лечения или предупреждения состояния, выбранного из группы, состоящей из мигрени, воспалительных заболеваний, удара, острой и хронической боли, гиповолемического шока, травматического шока, реперфузионного повреждения, болезни Крона, язвенного колита, септического шока, рассеянного склероза, связанной со СПИДом деменции, нейродегенеративных заболеваний, нейрональной интоксикации, болезни Альцгеймера, химических зависимостей и аддикций, рвоты, эпилепсии, тревоги, психоза, травмы головы, респираторного дистресс-синдрома взрослых (РДСВ), индуцированных морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической невропатии, диабетической нефропатии и рака у млекопитающего, при котором указанному млекопитающему вводят эффективное для ингибирования NOS количество соединения по пп.1, 8 или 9.
Текст
1 Настоящее изобретение относится к некоторым производным 6-фенилпиридил-2-амина,которые проявляют активность как ингибиторы синтазы оксида азота (NOS), к содержащим их фармацевтическим композициям и к их применению при лечении и предупреждении расстройств центральной нервной системы, воспалительных расстройств, септического шока и других расстройств. Существует три известных изоформы NOS индуцибельная форма (I-NOS) и две конститутивные формы, называемые нейрональная NOS(N-NOS) и эндотелиальная NOS (E-NOS) соответственно. Каждый из этих ферментов осуществляет превращение аргинина в цитруллин, в то же время продуцируя молекулу оксида азота(NO) в ответ на различные стимулы. Считают,что продуцирование избытка оксида азота (NO) синтазой оксида азота играет роль в патологии ряда расстройств и состояний у млекопитающих. Например, считают, что NO, продуцируемый I-NOS, играет роль в заболеваниях, которые включают в себя системную гипертензию,таких как токсический шок и терапия некоторыми цитокинами. Было показано, что раковые пациенты, которых лечили цитокинами, такими как интерлейкин 1 (ИЛ-1), интерлейкин 2 (ИЛ 2) или фактор некроза опухоли (ФНО), страдают от индуцированного цитокинами шока и гипертензии из-за NO, продуцируемого макрофагами, т.е. индуцируемого NOS (I-NOS) [Chemical and Engineering News, Dec.20, p. 33, (1993)]. Ингибиторы I-NOS могут изменить это. Считают также, что I-NOS играет роль в патологии заболеваний центральной нервной системы, таких как ишемия. Например, показано, что ингибирование I-NOS уменьшает интенсивность церебрального ишемического повреждения у крыс[Eur. J. Pharmacol., 273, р. 15-24 (1995)] о супрессии индуцированного адъювантом артрита посредством селективного ингибирования INOS. Считают, что NO, продуцируемый N-NOS,играет роль в заболеваниях, таких как церебральная ишемия, боль и опиатная толерантность. Например, ингибирование N-NOS уменьшает объем инфаркта после проксимальной закупорки средней мозговой артерии у крыс(1994)]. Показано также, что ингибирование NNOS является эффективным при антиципации,как доказано активностью в поздней фазе индуцированного формалином лизания задней лапы и тестами на индуцированную формалином абдономальную констрикцию [Br. J. Pharmacol.,110, р. 219-224 (1993)]. Наконец, известно [Neuropsychopharmacol., 13, р. 269-293 (1995)], что синдром опиодной абстиненции у грызунов уменьшается посредством ингибирования NNOS. 2 Сущность изобретения Это изобретение относится к соединениям формулы где R1 и R2 независимо выбраны из водорода,гидрокси, метила и метокси; a G является группой формулы где n равно нулю или единице;Y представляет собой NR3R4, (С 1-С 6)алкил или аралкил, где арильная группировка указанного аралкила является фенилом или нафтилом,а алкильная группировка является нормальной или разветвленной и содержит от 1 до 6 атомов углерода, и где указанный (С 1-С 6)алкил и арильная группировка указанного аралкила могут быть замещены заместителями в количестве от одного до трех, предпочтительно от нуля до двух, которые выбраны независимо из галогеноR3 и R4 независимо выбраны из (С 1 С 6)алкила, тетрагидронафталина и аралкила, где арильная группировка указанного аралкила является фенилом или нафтилом, а алкильная группировка является нормальной или разветвленной и содержит от 1 до 6 атомов углерода, и где указанный (C1-С 6)алкил и указанный тетрагидронафталин и арильная группировка указанного аралкила могут быть возможно замещены заместителями в количестве от одного до трех,предпочтительно от нуля до двух, которые независимо выбраны из галогено (например хлоро,фторо, бромо или иодо), нитро, гидрокси, циано,амино, (С 1-С 4)алкокси и (С 1-С 4)алкиламино; или R3 и R4 вместе с азотом, к которому они присоединены, образуют пиперазиновое,пиперидиновое или пирролидиновое кольцо или 3 азабициклическое кольцо, содержащее от 6 до 14 кольцевых членов, от 1 до 3 из которых являются азотом, а остальные являются углеродом, где примером указанных азабициклических колец является 3-аза-бицикло[3.1.0]гекс-6 иламинное кольцо; и где указанные пиперазиновое, пиперидиновое и пирролидиновое кольца возможно могут быть замещены одним или более чем одним заместителем, предпочтительно заместителями в количестве от нуля до двух, которые выбраны независимо из амино, (С 1-С 6)алкиламино,[ди(С 1-С 6)алкил]амино, замещенных фенилом 56-членных гетероциклических колец, содержащих от 1 до 4 кольцевых атомов азота, бензоила,бензоилметила, бензилкарбонила, фениламинокарбонила, фенилэтила и феноксикарбонила, и где указанные фенильные группировки любого из вышеуказанных заместителей возможно могут быть замещены одним или более чем одним заместителем, предпочтительно заместителями в количестве от одного до двух, которые независимо выбраны из гало, (С 1-С 3)алкила, (С 1 С 3)алкокси, нитро, амино, циано, CF3 и ОСF3; и фармацевтически приемлемым солям таких соединений. Настоящее изобретение также относится к фармацевтически приемлемым солям присоединения кислот соединений формулы I. Кислоты,которые используют для получения фармацевтически приемлемых солей присоединения кислот вышеуказанных соединений-оснований по изобретению, являются кислотами, которые образуют нетоксичные соли присоединения кислот, т.е. соли, содержащие фармацевтически приемлемые анионы, такие как гидрохлоридные, гидробромидные, гидроиодидные, нитратные, сульфатные, бисульфатные, фосфатные,кислые фосфатные, ацетатные, лактатные, цитратные, кислые цитратные, тартратные, битартратные, сукцинатные, малеатные, фумаратные,глюконатные, сахаратные, бензоатные, метансульфонатные, этансульфонатные, бензолсульфонатные, п-толуолсульфонатные и памоатные[т.е. 1,1-метилен-бис-(2-гидрокси-3-нафтоатные)] соли. Используемый здесь термин "алкил", если не указано иначе, включает в себя насыщенные одновалентные углеводородные радикалы,имеющие нормальные, разветвленные или циклические группировки или их комбинации. Используемый здесь термин "один или более чем один заместитель" относится к количеству заместителей, которое равно от одного до максимального числа заместителей, возможного в расчете на число доступных сайтов связывания. Используемый здесь термин "гало", если не указано иначе, включает в себя хлоро, фторо,бромо и иодо. Примерами предпочтительных соединений по настоящему изобретению являются соедине 002907 4 ния формулы I и их фармацевтически приемлемые соли, где NR3R4 является 4-фенилэтилпиперазин-1-илом; 4-метилпиперазин-1-илом; фенетиламино или 3-аза-бицикло[3.1.0]гекс-6-иламином. Другими предпочтительными соединениями по настоящему изобретению являются соединения формулы I и их фармацевтически приемлемые соли, где NR3R4 является группой формулы где NR5R6 представляет собой NH2. Другими предпочтительными соединениями по данному изобретению являются соединения формулы I, где G является группой формулы А, Х является азотом и q равно нулю. Другие воплощения этого изобретения относятся к соединениям формулы I, где q равно нулю или единице. Другие воплощения этого изобретения относятся к соединениям формулы I, где G является группой формулы В, a NR3R4 не образует циклическую группировку. Другие воплощения этого изобретения относятся к соединениям формулы I, где G является группой формулы В, m равно двум, aNR3R4 не образует циклическую группировку(т.е. где N, R3 и R4 являются частью одной и той же кольцевой структуры). Другие воплощения этого изобретения относятся к соединениям формулы I, где G является группой формулы В, m равно единице, aNR3R4 не образует циклическую группировку. Другие воплощения этого изобретения относятся к соединениям формулы I, где G является группой формулы В, m равно нулю, aNR3R4 не образует циклическую группировку. Другие воплощения этого изобретения относятся к соединениям формулы I, где G является группой формулы В и m равно нулю. Другие воплощения этого изобретения относятся к соединениям формулы I, где G является группой формулы А, а р и n оба равны нулю. Другие воплощения этого изобретения относятся к соединениям формулы I, где G является группой формулы А, р равно единице, q равно нулю и n равно единице. Другие воплощения этого изобретения относятся к соединениям формулы I, где G является группой формулы В и m равно единице. Другие воплощения этого изобретения относятся к соединениям формулы I, где G является группой формулы А и р равно единице. Настоящее изобретение также относится к фармацевтической композиции для лечения или 5 предупреждения состояния, выбранного из группы, состоящей из мигрени, воспалительных заболеваний (например, астмы), удара, острой и хронической боли, гиповолемического шока,травматического шока, реперфузионного повреждения, болезни Крона, язвенного колита,септического шока, рассеянного склероза, связанной со СПИДом деменции, нейродегенеративных заболеваний, нейрональной интоксикации, болезни Альцгеймера, химических зависимостей и аддикций, рвоты, эпилепсии, тревоги,психоза, травмы головы, респираторного дистресс-синдрома взрослых (РДСВ), индуцированных морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита,овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической невропатии,диабетической нефропатии и рака у млекопитающего, в том числе человека, содержащей количество соединения формулы I или его фармацевтически приемлемой cоли, которое является эффективным при лечении или предупреждении такого состояния, и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу лечения или предупреждения состояния, выбранного из группы, состоящей из мигрени, воспалительных заболеваний (например,астмы), удара, острой и хронической боли, гиповолемического шока, травматического шока,реперфузионного повреждения, болезни Крона,язвенного колита, септического шока, рассеянного склероза, связанной со СПИДом деменции,нейродегенеративных заболеваний, нейрональной интоксикации, болезни Альцгеймера, химических зависимостей и аддикций, рвоты, эпилепсии, тревоги, психоза, травмы головы, респираторного дистресс-синдрома взрослых(РДСВ), индуцированных морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита,ревматоидного артрита, овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической невропатии, диабетической нефропатии и рака у млекопитающего, в том числе человека, при котором указанному млекопитающему вводят количество соединения формулы I или его фармацевтически приемлемой соли, которое является эффективным при лечении или предупреждении такого состояния. Настоящее изобретение также относится к фармацевтической композиции для ингибирования синтазы оксида азота (NOS) у млекопитающего, в том числе человека, содержащей эффективное для ингибирования NOS количество соединения формулы I или его фармацевти 002907 6 чески приемлемой соли и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу ингибирования NOS у млекопитающего, в том числе человека, при котором указанному млекопитающему вводят эффективное для ингибирования NOS количество соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также относится к фармацевтической композиции для лечения или предупреждения состояния, выбранного из группы, состоящей из мигрени, воспалительных заболеваний (например астмы), удара, острой и хронической боли, гиповолемического шока,травматического шока, реперфузионного повреждения, болезни Крона, язвенного колита,септического шока, рассеянного склероза, связанной со СПИДом деменции, нейродегенеративных заболеваний, нейрональной интоксикации, болезни Альцгеймера, химических зависимостей и аддикций, рвоты, эпилепсии, тревоги,психоза, травмы головы, респираторного дистресс-синдрома взрослых (РДСВ), индуцированных морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита,овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической невропатии,диабетической нефропатии и рака у млекопитающего, в том числе человека, содержащей эффективное для ингибирования NOS количество соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также относится к способу лечения или предупреждения состояния, выбранного из группы, состоящей из мигрени, воспалительных заболеваний (например,астмы), удара, острой и хронической боли, гиповолемического шока, травматического шока,реперфузионного повреждения, болезни Крона,язвенного колита, септического шока, рассеянного склероза, связанной со СПИДом деменции,нейродегенеративных заболеваний, нейрональной интоксикации, болезни Альцгеймера, химических зависимостей и аддикций, рвоты, эпилепсии, тревоги, психоза, травмы головы, респираторного дистресс-синдрома взрослых(РДСВ), индуцированных морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита,ревматоидного артрита, овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической невропатии, диабетической нефропатии и рака у млекопитающего, в том числе человека, при котором указанному млекопитающему вводят эффективное для ингибирова 7 ния NOS количество соединения формулы II или его фармацевтически приемлемой соли. Соединения формулы I имеют хиральные центры и, следовательно, могут существовать в разных энантиомерных и диастереомерных формах. Это изобретение относится ко всем оптическим изомерам и всем стереомерам соединений формулы I и их смесям и ко всем фармацевтическим композициям и способам лечения, определенным выше, которые содержат или используют их соответственно. Вышеуказанная формула I включает в себя соединения, идентичные описанным соединениям, за исключением того, что один или более чем один атом водорода, атом углерода или другие атомы заменены на их изотопы. Такие соединения могут быть полезны в качестве средств для исследований и диагностики при фармакокинетическом исследовании метаболизма и в тестах на связывание. Подробное описание изобретения Соединения формулы I могут быть получены, как описано на последующих реакционных схемах и в обсуждении. Если не указано иначе, R1, R2, R3, R4, R5, R6, R7, R8 и R9 и структурная формула I на реакционных схемах и в последующем обсуждении определены, как указано выше. Схема 1 Исходные материалы, используемые в процедурах схем 1-5, либо коммерчески доступны, известны в данной области техники, либо легко могут быть получены из известных соединений с использованием способов, которые очевидны специалистам. Согласно схеме 1 соединение II получают взаимодействием 1,4-дибромбензола с литийорганическим реагентом, предпочтительно бутиллитием, при температуре от -100 С до приблизительно 0 С с последующим добавлением к 2(2,5-диметилпирролил)пиридину при температуре от приблизительно 0 С до приблизительно 50 С в эфирном растворителе, предпочтительно диэтиловом эфире, в течение приблизительно от 1 до 24 ч. Соединение III получают взаимодействием II с производным бороновой кислоты формулы (n-OHC(CH2)m-2(C6H3R1R2)B(OH)2 в растворителе, состоящем из спирта, предпочтительно этанола, возможно смешанного с водой,и галогенированного углеводорода, при температуре от приблизительно 25 С до приблизительно 150 С в течение приблизительно от 1 до 24 ч с использованием катализатора на основе палладия, палладия в состоянии окисления либо ноль, либо два, обычно с фосфиновыми лигандами, предпочтительно тетракистрифенилфосфинпалладия. Соединение IV получают взаимодействиемIII с тозилметилизоцианидом в присутствии трет-бутоксида калия и этанола в эфирном растворителе, таком как 1,2-диметоксиэтан, при температуре от приблизительно -100 С до приблизительно 100 С, в течение приблизительно от 1 до 24 ч. Соединение V получают из IV основным гидролизом нитрила с использованием гидроксида щелочного металла в водном рас 002907 10 творителе на основе спирта, таком как водный этанол, при температуре от приблизительно 25 С до приблизительно 125 С в течение приблизительно от 30 мин до 48 ч. Соединение VI получают из V дегидратирующим сочетанием с аммиаком, первичным или вторичным амином формулы R3R4NH, осуществляемым с использованием дегидратирующего агента, такого как карбодиимид, например, N-этил-N-(диметиламинопропил)карбодиимид, в растворителе,который является галогенированным углеводородом или N,N-диалкиламидом, таким как диметилформамид, при температуре от приблизительно 0 С до приблизительно 100 С в течение приблизительно от 1 до 48 ч. Соединение VII получают из VI деблокированием с использованием гидроксиламина гидрохлорида в водном или спиртовом растворителе, предпочтительно водном этаноле, при температуре от приблизительно 25 С до приблизительно 100 С в течение приблизительно от 1 до 48 ч и может включать в себя деблокирование защитной группы, такой как трет-бутоксикарбонильная группа, взаимодействием с трифторуксусной кислотой или родственной полигалогенированной уксусной кислотой или газообразным галогеноводородом,таким как HCl, в галогенированном углеводороде, эфирном растворителе или этилацетате при температуре от приблизительно -70 С до приблизительно 100 С в течение приблизительно от 10 мин до 24 ч. Конечное соединение на схеме 1, IB, гдеG=B, получают восстановлением VII бораном,триалкилбораном, аланом или алюмогидридом лития в эфирном растворителе, таком как этиловый эфир или тетрагидрофуран, при температуре от приблизительно -100 С до приблизительно 100 С в течение приблизительно от 30 мин до 24 ч, и возможно используя фторид цезия и карбонат щелочного металла или щелочно-земельного металла в водном спиртовом растворителе при температуре от приблизительно 25 до приблизительно 125 С в течение от 1 до 72 ч. Согласно схеме 2 соединение VIII получают из II взаимодействием с 3-пиридилбороновой кислотой и катализатором на основе палладия, причем палладия в состоянии окисления либо ноль, либо два, с лигандами, обычно состоящими из триалкил- или триарилфосфинов,таким как тетракистрифенилфосфинпалладий, в водном спиртовом растворителе при температуре от приблизительно 25 до приблизительно 125 С в течение приблизительно от 1 до 48 ч. Соединение IX получают из VIII алкилированием алкил- или аралкилгалогенидом или-сульфонатом в эфирном спиртовом, водном спиртовом растворителе или растворителе на основе диалкиламина, таком как диметилформамид, при температуре от приблизительно 0 до приблизительно 125 С в течение приблизительно от 30 мин до 72 ч с последующим восстанов 11 лением реагентом на основе боргидрида или алюмогидрида, таким как боргидрид натрия, в эфирном, спиртовом, или водно-спиртовом растворителе, обычно метаноле, при температуре от приблизительно 0 до приблизительно 125 С в течение приблизительно от 1 до 72 ч. Конечное соединение на схеме 2, соединение IА-а, гдеG=A, n=1 и q=0, получают из IX деблокированием с использованием гидроксиламина гидрохлорида в спиртовом или водно-спиртовом растворителе, обычно водном этаноле, при температуре от приблизительно 25 до приблизительно 125 С в течение от приблизительно 1 до 72 ч. В способе согласно схеме 2 предпочтительным значением Y в формулах IX и IА-а является бензил. Соединения формулы IА-а, где Y является бензилом, могут быть превращены в соответствующие соединения, где Y является иным чем бензил, дебензилированием с использованием водорода или формиата аммония в присутствии катализатора на основе благородного металла, такого как палладий, в эфирном,галогенированном углеводородном, спиртовом или водном спиртовом растворителе при температуре от 0 до 100 С в течение приблизительно от 30 мин до 24 ч с последующим восстановительным аминированием алкил- или аралкилальдегидом в присутствии реагента на основе боргидрида, такого как цианоборгидрид натрия или триацетоборгидрид натрия, в эфирном, галогенированном углеводородном, спиртовом или водно-спиртовом растворителе, при температуре от 0 до 100 С в течение от 1 до 72 ч. Согласно схеме 3 соединение Х получают восстановительным аминированием 2-(4-бромфенилметил)пиперидина с использованием бензальдегида и реагента на основе боргидрида,такого как цианоборгидрид натрия или триацетоксиборгидрид натрия, в эфирном, галогенированном углеводородном, спиртовом или водноспиртовом растворителе, при температуре от приблизительно 0 до приблизительно 100 С в течение приблизительно от 1 до 72 ч. Соединение XI получают из соединения X взаимодействием соединения Х с литийорганическим реагентом, обычно бутиллитием, с последующим добавлением полученного литийорганического реагента к 2-(2,5-диметилпирролил)пиридину в эфирном растворителе, таком как этиловый эфир, при температуре от приблизительно -70 до приблизительно 100 С в течение приблизительно от 30 мин до 48 ч. Конечное соединение на схеме 3, IA-b, где G=A, n=1, q=1 и Y является бензилом, получают из соединения XI деблокированием с использованием гидроксиламина гидрохлорида в спиртовом или водно-спиртовом растворителе, обычно водном этаноле, при температуре от приблизительно 25 до приблизительно 125 С в течение приблизительно от 1 до 72 ч. Соединения формулы IA-b могут быть превращены в соответствующие соединения, 002907 12 где Y является иным чем бензил, используя процедуру, описанную выше для превращения соединений формулы IА-а в аналогичные соединения, где Y является иным чем бензил. Согласно схеме 4 соединение XII получают из 6-бром-2-(2,5-диметилпирролил)пиридина и 4-формилфенилбороновой кислоты в присутствии катализатора на основе палладия, причем палладия в состоянии окисления либо ноль,либо два, с лигандами, обычно состоящими из триалкил- или триарилфосфинов, такого как тетракистрифенилфосфинпалладий, в водном спиртовом растворителе, при температуре от приблизительно 25 до приблизительно 125 С в течение приблизительно от 1 до 48 ч. Соединение XIII затем получают из XII взаимодействием XII с енамином кетона или альдегида, обычно морфолиновым или пирролидиновым енамином, в ароматическом углеводородном, углеводородном или галогенированном углеводородном растворителе, предпочтительно толуоле,при температуре от приблизительно 25 до приблизительно 150 С в течение приблизительно от 1 до 72 ч с последующей стадией водного гидролиза, обычно с использованием водной соляной кислоты, а затем восстановлением водородом или формиатом аммония в присутствии катализатора на основе благородного металла,такого как палладий, в эфирном, галогенированном углеводородном, спиртовом или водном спиртовом растворителе, при температуре от приблизительно 0 до приблизительно 100 С в течение приблизительно от 30 мин до 24 ч. Конечное соединение по схеме 4, IA, где G=A, q=1,X=CH и Y=NR3R4, получают восстановительным аминированием соединения XIII аммиаком,первичным амином или вторичным амином в присутствии реагента на основе боргидрида,такого как цианоборгидрид натрия или триацетоксиборгидрид натрия, в эфирном, галогенированном углеводородном, спиртовом или водноспиртовом растворителе, при температуре от приблизительно 0 до приблизительно 100 С в течение приблизительно от 1 до 72 ч с последующим деблокированием с использованием гидроксиламина гидрохлорида в спиртовом или водно-спиртовом растворителе, обычно водном этаноле, при температуре от приблизительно 25 до 125 С в течение приблизительно от 1 до 72 ч. Согласно схеме 5 соединение XIV получают из 3-(4-бромфенил)глутаровой кислоты дегидратацией с использованием уксусного ангидрида или подобного дегидратирующего реагента, с последующим взаимодействием с бензиламином в углеводородном, ароматическом углеводородном или галогенированном углеводородном растворителе при температуре от приблизительно 25 до приблизительно 180 С в течение приблизительно от 1 до 48 ч, с последующей дегидратацией с использованием уксусного ангидрида или подобного дегидратирующего реагента при температуре от прибли 13 зительно 25 С до приблизительно температуры дефлегмации в течение приблизительно от 1 до 48 ч. Соединение XV получают восстановлением XIV бораном, боранметилсульфидом, аланом или алюмогидридом лития в эфирном или углеводородном растворителе при температуре от приблизительно 0 до приблизительно 100 С в течение приблизительно от 30 мин до 48 ч. Соединение XVI получают из соединения XV взаимодействием соединения XV с литийорганическим реагентом, обычно бутиллитием, с последующим добавлением полученного литийорганического реагента к 2-(2,5-диметилпирролил)пиридину в эфирном растворителе, таком как этиловый эфир, при температуре от приблизительно -70 до приблизительно 100 С в течение приблизительно от 30 мин до 48 ч. Конечное соединение на схеме 5, IA-d, где G=A, Y=H,q=0 и X=N, получают дебензилированием соединения XVI с использованием водорода или формиата аммония в присутствии катализатора на основе благородного металла, такого как палладий, в эфирном, галогенированном углеводородном, спиртовом или водном спиртовом растворителе при температуре от 0 до 100 С в течение периода времени от 30 мин до 24 ч с последующим деблокированием с использованием гидроксиламина гидрохлорида в спиртовом или водно-спиртовом растворителе, обычно водном этаноле, при температуре от приблизительно 25 до приблизительно 125 С в течение от 1 до 72 ч. Соединения формулы IA-d, которые получают с использованием процедур согласно схеме 5, могут быть превращены в аналогичные соединения, где Y является алкилом или аралкилом, восстановительным аминированием с использованием алкил- или аралкилальдегида в присутствии реагента на основе боргидрида,такого как цианоборгидрид натрия или триацетоксиборгидрид натрия, в эфирном, галогенированном углеводородном, спиртовом или водноспиртовом растворителе при температуре от 0 до 100 С в течение времени от 1 до 72 ч. Получение других соединений формулы I,не описанное специально в предыдущем экспериментальном разделе, может быть осуществлено с использованием комбинаций реакций,описанных выше, которые очевидны специалистам. В каждой из реакций, которые обсуждены или проиллюстрированы выше, давление не является критическим, если не указано иначе. Давление от приблизительно 0,5 до приблизительно 5 атмосфер обычно является приемлемым, а давление окружающей среды, т.е. около 1 атмосферы, является предпочтительным с точки зрения удобства. Соединения формулы I ("активные соединения по данному изобретению"), которые являются основными по природе, способны образовывать множество различных солей с различ 002907 14 ными неорганическими и органическими "кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, часто на практике желательно сначала выделить соединение формулы I из реакционной смеси в форме фармацевтически неприемлемой соли, а затем просто превратить последнюю обратно в соединение-свободное основание путем обработки щелочным реагентом, а после этого превратить последнее свободное основание в фармацевтически приемлемую соль присоединения кислоты. Соли присоединения кислоты активных основных соединений по данному изобретению легко получают путем обработки соединения-основания практически эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. После осторожного выпаривания растворителя легко получают желаемую твердую соль. Активные соединения по этому изобретению и их фармацевтически приемлемые соли полезны в качестве ингибиторов NOS, т.е. они обладают способностью ингибировать NOSфермент у млекопитающих, и, следовательно,они способны функционировать как терапевтические агенты при лечении ранее упомянутых расстройств и заболеваний у больного млекопитающего. Активные соединения по данному изобретению и их фармацевтически приемлемые соли могут быть введены пероральным, парентаральным или местным путем. Как правило, эти соединения наиболее желательно вводить при дозировке в интервале от приблизительно 0,01 до приблизительно 250 мг в сутки в однократной или разделенных дозах (т.е. от 1 до 4 доз в день), хотя обязательно будут иметь место отклонения в зависимости от вида, веса и состояния субъекта, которого лечат, и конкретного выбранного способа введения. Однако уровень дозировки, который находится в интервале от приблизительно 0,07 до приблизительно 21 мг на кг веса тела в сутки, использовать наиболее желательно. Отклонения могут тем не менее иметь место в зависимости от вида животного,которого лечат, и его индивидуального ответа на указанное лекарство, а также от типа выбранного фармацевтического препарата и периода времени и интервала, в котором осуществляют такое введение. В некоторых случаях уровни дозировки ниже нижнего предела вышеуказанного интервала могут в большей степени отвечать требованиям, в то время как в других случаях дозы выше верхнего предела могут быть использованы, не вызывая какого-либо вредного побочного эффекта, при условии, что такие большие дозы сначала разделены на несколько небольших доз для введения в течение дня. 15 Активные соединения по изобретению можно вводить сами по себе или в комбинации с фармацевтически приемлемыми носителями или разбавителями любым из трех ранее указанных путей, и такое введение может быть осуществлено в однократной или многократных дозах. Более конкретно, новые терапевтические агенты по изобретению можно вводить во множестве различных лекарственных форм, т.е. они могут быть объединены с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, лепешек, пастилок, леденцов, порошков, спреев, пен, бальзамов, суппозиториев, желе, гелей, паст, лосьонов,мазей, водных суспензий, растворов для инъекций, эликсиров, сиропов и тому подобное. Такие носители включают в себя твердые разбавители или наполнители, стерильную водную среду и различные нетоксичные органические растворители и т.д. Более того, пероральные фармацевтические композиции могут быть подходящим образом подслащены и/или корригированы. Как правило, терапевтически эффективные соединения по изобретению присутствуют в таких лекарственных формах при уровнях концентрации в интервале от приблизительно 5,0 до приблизительно 70 мас.%. Для перорального введения таблетки, содержащие различные эксципиенты, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, двукальциевый фосфат и глицин, можно использовать вместе с различными разрыхлителями, такими как крахмал (и предпочтительно кукурузный, картофельный или тапиока), альгиновая кислота и некоторые сложные силикаты, вместе со связывающими веществами для гранулирования, такими как поливинилпирролидон, сахароза, желатин и аравийская камедь. Кроме того, смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк, часто очень полезны в целях таблетирования. Твердые композиции подобного типа могут также быть использованы как наполнители в желатиновых капсулах; предпочтительные материалы в этой связи также включают в себя лактозу или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Когда для перорального введения желательны водные суспензии и/или эликсиры, активный ингредиент может быть объединен с различными подслащивающими агентами или корригентами, окрашивающими веществами или красителями, и, при желании, эмульгирующими агентами и/или суспензирующими агентами, вместе с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и их различные подобные комбинации. Для парентерального введения могут быть использованы растворы активного соединения по настоящему изобретению либо в кунжутном,либо арахисовом масле или в водном пропиленгликоле. Водные растворы должны быть 16 подходящим образом забуферены (предпочтительно рН больше 8), при необходимости, а жидкий разбавитель сначала сделан изотоническим. Эти водные растворы пригодны в целях внутривенной инъекции. Масляные растворы пригодны в целях внутрисуставной, внутримышечной и подкожной инъекции. Получение всех этих растворов в стерильных условиях легко достигается с помощью стандартных фармацевтических технических приемов, хорошо известных специалистам. Кроме того, возможно также введение активных соединений по настоящему изобретению местно при лечении воспалительных состояний кожи, и это может быть сделано с помощью пен, желе, гелей, паст, пластырей, мазей и т.п. в соответствии с обычной фармацевтической практикой. Способность соединений формулы I ингибировать NOS может быть определена по методикам, описанным в литературе. Способность соединений формулы I ингибировать эндотелиальную NOS может быть определена с использованием методик, описанных Schmidt et al. вProc.Natl. Acad. Sci. USA, 88, pp. 365-369 (1991) и Pollock et al. в Proc. Natl. Acad. Sci. USA, 88,pp. 10480-10484 (1991). Способность соединений формулы I ингибировать индуцибельнуюNOS может быть определена с использованием методик, описанных Schmidt et al. в Proc. Natl.(1994). Способность соединений формул I ингибировать нейрональную NOS может быть определена с использованием методик, описанныхBredt and Snyder в Proc. Natl. Acad. Sci. USA, 87,682-685 (1990). Из 100 соединений формулы I, которые были испытаны, все проявили IC50 50 мкМ в отношении ингибирования индуцибельной или нейрональной NOS. Настоящее изобретение иллюстрируется следующими примерами. Должно быть понятно,однако, что данное изобретение не ограничивается конкретными деталями этих примеров. Точки плавления не откорректированы. Протонные спектры ядерного магнитного резонанса(1H ЯМР) и С 13 спектры ядерного магнитного резонанса были измерены для растворов в дейтерохлороформе (CDCl3), или в CD3OD, илиCD3SOCD3, и положения пиков выражены в частях на миллион (млн-1) по нисходящей от тетраметилсилана (ТМС). Формы пиков обозначены следующим образом: s, синглет; d, дублет; 17 В трехгорлую круглодонную колбу емкостью 100 мл, снабженную мембраной и впускным патрубком для азота (N2), добавляли 3,54 грамма (г) (15 ммоль) 1,4-дибромбензола и 15 мл сухого эфира. Раствор охлаждали до -70 С и по каплям добавляли 6,25 мл (10 ммоль) 1,6 М раствора бутиллития в тетрагидрофуране в течение 5 мин. Реакционную смесь перемешивали 5 мин при -70 С, затем нагревали до комнатной температуры за период времени 15 мин. К полученному раствору добавляли раствор 1,72 г (10 ммоль) 2-(2,5-диметилпирролил)пиридина в 5 мл эфира, получая темно-красную окраску, и реакционную смесь перемешивали в течение 3 ч при комнатной температуре. Затем ее гасили водным раствором хлорида аммония, переносили в этилацетат и промывали водным хлоридом аммония и рассолом, сушили над сульфатом натрия и выпаривали. Остаток хроматографировали на силикагеле, используя гексан/ этилацетат в качестве элюента, с получением 820 мг (25%) масла. 1 Н-ЯМР (, СDСl3): 2,30 (s, 6 Н), 6,03 (s,2H), 7,20 (dd, J=1,8, 1H), 7.64 (m, 2H), 7,73 (dd,J=1,8, 1H), 7,90 (dt, J=1,8, 1H), 8,00 (m, 2H). 13(100/98, Вr79/Вr81, исходный+1). Б. 2-(2,5-Диметилпирролил)-6-(4-(4-формилфенил)фенил)пиридин. В круглодонную колбу емкостью 100 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 630 мг (1,93 ммоль) 2(2,5-диметилпирролил)-6-(4-бромфенил)пиридина, 289 мг (1,93 ммоль) 4-формилфенилбороновой кислоты, 817 мг (7,17 ммоль) карбоната натрия, 112 мг (0,096 ммоль) тетракистрифенилфосфинпалладия, 9 мл этанола и 1 мл воды. Смесь нагревали при температуре дефлегмации в течение 14 ч, охлаждали, вливали в воду и экстрагировали этилацетатом. Органический слой промывали рассолом, сушили и выпаривали и остаток хроматографировали на силикагеле, используя 25% этилацетата в гексане в качестве элюента, с получением 540 мг (80%) продукта. 1 Н-ЯМР (, CDCl3): 2,23 (s, 6 Н), 5,94 (s,2H), 7,17 ( J=8, 1H), 7,74 (m, 2H), 7,80 (m, 3 Н),7,90 (t, J=8, 1H), 7,96 (m, 2H), 8,19 (m, 2H), 10,05(s, 1H). 13 С-ЯМР (, CDCl3): 13,5, 107,1, 118,4,120,2, 127,6, 127,7, 130,3, 138,7, 140,5, 146,4,156,0, 191,9. МС (%): 353 (100, исходный+1). В. 2-(2,5-Диметилпирролил)-6-(4-(4-(цианометил)фенил)фенил)пиридин. В круглодонную колбу емкостью 100 мл,снабженную мембраной и впускным патрубком для N2, добавляли 354 мг (3,16 ммоль) трет 002907(СНCl3/СО 2) и по каплям добавляли раствор 317 мг (1,62 ммоль) тозилметилизоцианида в 5 мл сухого 1,2-диметоксиэтана. Через несколько минут по каплям добавляли раствор 540 мг (1,53 ммоль) 2-(2,5-диметилпирролил)-6-(4-(4-формилфенил)фенил)пиридина в 10 мл сухого 1,2 диметоксиэтана и продолжали перемешивание при -60 С в течение 50 мин. Затем добавляли 5 мл этанола, реакционную смесь нагревали, а затем кипятили с обратным конденсатором в течение 15 мин. Реакционную смесь охлаждали и выпаривали и остаток переносили в воду с 0,5 мл уксусной кислоты и метиленхлорид. Водный слой реэкстрагировали метиленхлоридом, а объединенный органический слой промывали водным раствором бикарбоната натрия, сушили над сульфатом натрия и выпаривали. Остаток хроматографировали на силикагеле, используя 25% этилацетата в гексане в качестве элюента, с получением 220 мг (40%) продукта. 1H-ЯМР (, CDCl3): 2,26 (s, 6H), 3,78 (s,2 Н), 5,98 (s, 2H), 7,17 (, J=8, 1H), 7,41 (m, 2H),7,6-7,7 (m, 4H), 7,79 (, J=8, 1H), 7.89 (t, J=8,1H), 8,17 (m, 2H). 13 С-ЯМР (, CDCl3): 13,6, 23,3, 107,1, 118,3,120,0, 127,4, 127,5, 127,8, 128,5, 128,7, 129,3,137,6, 138,7, 140,3, 141,0, 151,8, 156,3. МС (%): 364 (100, исходный+1). Побочный продукт, элюирующийся после продукта, был охарактеризован как оксазол, 40 мг (7%). Г. 2-(2,5-Диметилпирролил)-6-(4-(4-(карбоксиметил)фенил)фенил)пиридин. В круглодонную колбу емкостью 100 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 220 мг (0,606 ммоль) 2-(2,5-диметилпирролил)-6-(4-(4-(цианометил) фенил)фенил)пиридина и 7 мл этанола с образованием раствора при температуре дефлегмации. Медленно по каплям добавляли 10% раствор гидроксида натрия в воде при температуре дефлегмации для поддержания раствора, что требует 30-60 мин для 15 мл (и еще немного этанола). Дефлегмацию поддерживали в целом в течение 2,5 ч. Реакционную смесь охлаждали до 0 С, рН доводили до 1 с использованием 6 н. соляной кислоты и реакционную смесь экстрагировали в этилацетат. Органический слой промывали рассолом, сушили над сульфатом натрия и выпаривали с получением продукта в виде масла, которое использовали непосредственно на следующей стадии. 1 Н-ЯМР (, CDCl3): 2,24 (s, 6H), 3,70 (s,2H), 5,95 (s, 2H), 7,14 ( J=8, 1H), 7,38 (m, 2H),7,61 (m, 2H), 7,68 (m, 2H), 7,77 ( J=8, 1H), 7,87 19 МС (%): 383 (100, исходный+1). Д. 2-(2,5-Диметилпирролил)-6-(4-(4-(6 трет-бутилкарбоксамидо-3-аза-бицикло[3.1.0] гекс-3-илкарбоксамидометил)фенил)фенил) пиридин. В круглодонную колбу емкостью 100 мл,снабженную впускным патрубком для N2, добавляли 420 мг (1,099 ммоль) 2-(2,5 диметилпирролил)-6-(4-(4-(карбоксиметил)фенил)фенил)пиридина, 218 (1,099 ммоль) 3-азабицикло[3.1.0]гекс-3-иламина трет-бутилкарбамата, 211 мг (1,099 ммоль) EDAC (N-этил-N(диметиламинопропил)карбодиимида), 10 мг НОВТ, 7 мл сухого ацетонитрила и 337 мкл(2,42 ммоль) триэтиламина. Реакционную смесь перемешивали при комнатной температуре в течение 20 ч, выпаривали и остаток хроматографировали на силикагеле, используя 5% метанола в метиленхлориде в качестве элюента, с получением продукта, 280 мг (45%). 1E. 2-3-[4'-(6-Аминопиридин-2-ил)-бифенил-4-ил]-3-аза-бицикло[3.1.0]гекс-6-иламина ацетамид. В круглодонную колбу емкостью 100 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 280 мг (0,498 ммоль) 2-(2,5-диметилпирролил)-6-(4-(4-(6-трет-бутилкарбоксамидо-3-аза-бицикло[3.1.0]гекс-3-илкарбоксамидометил)фенил)фенил)пиридина, 173 мг(2,49 ммоль) гидроксиламина гидрохлорида, 1 мл воды и 5 мл этанола. Реакционную смесь нагревали при температуре дефлегмации в течение 40 ч, добавляли дополнительно 173 мг гидроксиламина гидрохлорида и 5 мл этанола и нагревание при температуре дефлегмации продолжали в течение 24 ч. Реакционную смесь охлаждали, вливали в водный раствор бикарбоната натрия и экстрагировали смесью этилацетата и метанола из-за ограниченной растворимости продукта в этилацетате. Органический слой сушили над сульфатом натрия и выпаривали. Остаток переносили в 6 мл сухого метиленхлорида и обрабатывали 1,5 мл трифторуксусной кислоты при комнатной температуре в течение 1,5 ч. Реакционную смесь выпаривали,переносили в 1 н. соляную кислоту, промывали этилацетатом, затем рН доводили до 10 с использованием 1 н. раствора гидроксида натрия и экстрагировали смесью этилацетата и метанола. Органический слой сушили над сульфатом на 002907 20 трия и выпаривали с получением 160 мг (84%) продукта в виде низкоплавкого твердого вещества. 1H-ЯМР (, CDCl3): 1,39 (bs, 2 Н), 1,78 (bs,1H), 3,2-3,6 (мультиплеты, 2 Н), 3,41 (bs, 2H),4,90 (bs, 1H), 6,30 (, J=8, 1H), 6,83 (, J=7,5,1H), 7,06 (m, 2H), 7,29 (t, J=8, 1 Н), 7,38 (m, 2H),7,44 (m, 2H), 7,69 (m, 2H). 13 С-ЯМР (, CDCl3): 25,0, 25,3, 34,9, 41,5,107,6, 110,7, 126,8, 127,0, 127,1, 129,1, 133,2,138,5, 139,0, 140,5, 155,3, 158,8, 170,6. МС (%): 385 (100, исходный+1). Ж. 3-2-[-4'-(6-Аминопиридин-2-ил)бифенил-4-ил]этил-3-аза-бицикло[3.1.0]гекс-6-иламин. В круглодонную колбу емкостью 100 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 160 мг (0,417 ммоль) 3-2-[4'-(6-аминопиридин-2-ил]бифенил-4-ил]3-аза-бицикло[3.1.0]гекс-6-иламина ацетамида,5 мл сухого тетрагидрофурана и 0,625 мл 2 М раствора боранметилсульфида в тетрагидрофуране. Реакционную смесь нагревали при температуре дефлегмации в течение 12 ч, добавляли дополнительную порцию боранметилсульфида 0,625 мл вместе с несколькими мл тетрагидрофурана, и нагревание при температуре дефлегмации продолжали в течение 12 ч (из-за ограниченной растворимости исходного вещества в тетрагидрофуране). Реакционную смесь охлаждали и выпаривали, добавляли 20 мл этанола, 1 г карбоната натрия и 1 г фторида цезия, смесь нагревали при температуре дефлегмации в течение 14 ч. Реакционную смесь охлаждали и выпаривали, переносили в воду и этилацетат/метанол, органический слой отделяли, сушили над сульфатом натрия и выпаривали. Полученное твердое вещество, 80 мг (52%), переносили в метиленхлорид/метанол/эфир и осаждали с использованием 1 н. HCl в эфире, затем выпаривали. Остаток растирали с тетрагидрофураном с получением 48 мг (24%) белого твердого вещества, т.пл. 205 С (разлагается выше этой точки). 1 Н-ЯМР (, CDCl3): 1,33 (bs, 2H), 1,63 (bs,1 Н), 2,60 (m, 2H), 2,71 (m, 2H), 3,05 (m, 2H), 3,59 21 В круглодонную колбу емкостью 100 мл,снабженную впускным патрубком для N2, добавляли 176 мг (0,50 ммоль) 2-(2,5-диметилпирролил)-6-[4-(4'-формилбифенил-4-ил)]пиридина (пример 1 Б), 105 мг (0,55 ммоль) 2 фенилэтилпиперазина, 7 мл метанола, 30 мкл(0,50 ммоль) уксусной кислоты и 38 мг (0,60 ммоль) цианоборгидрида натрия. Реакционную смесь перемешивали при комнатной температуре в течение 12 ч, вливали в водный раствор бикарбоната натрия и экстрагировали этилацетатом. Органический слой промывали водой и рассолом, сушили над сульфатом натрия и выпаривали. Остаток хроматографировали на силикагеле, используя метанол/метиленхлорид в качестве элюента, с получением 190 мг (72%) масла. 1(m, 2H), 7,72 (m, 2H), 7,79 (, J=8, 1H), 7,87 (t,J=8, 1H), 8,16 (m, 2H). 13 С-ЯМР (, CDCl3): 13,6, 33,7, 53,1, 53,2,60,6, 62,8, 107,0, 118,2, 119,8, 126,1, 126,9, 127,4,128,4, 128,7, 128,8, 129,8, 137,2, 137,7, 138,6,139,3, 140,3, 141,9, 151,7, 156,5. МС (%): 527 (исходный+1, 100). Б. 6-[4'-(4-Фенетилпиперазин-1-илметил) бифенил-4-ил]пиридин-2-иламин. В круглодонную колбу емкостью 100 мл,снабженную впускным патрубком для N2, добавляли 190 мг (0,361 ммоль) 2-(2,5-диметилпирролил)-6-[4'-(4-фенетилпиперазин-1-илметил)бифенил-4-ил]пиридина, 126 мг (1,81 ммоль) гидроксиламина гидрохлорида, 1 мл воды и 5 мл этанола. Реакционную смесь нагревали при температуре дефлегмации в течение 36 ч с последующей обработкой дополнительными 50 мг гидроксиламина гидрохлорида и нагреванием при температуре дефлегмации в течение 24 ч. Реакционную смесь охлаждали, вливали в разбавленную водную соляную кислоту и промывали этилацетатом. Водный слой доводили до рН 10 с использованием 1 н. раствора гидроксида натрия и экстрагировали этилацетатом. Органический слой промывали рассолом, сушили над сульфатом натрия и выпаривали. Остаток превращали в гидрохлоридную соль, используя 1 н. HCl в эфире, с получением 110 мг (55%) твердого вещества, т. пл. 267-269 С. 1 22 Анализ. Вычислено для С 30 Н 32N43 НCl 3/2 Н 2 О: С 61,59, Н 6,55, N 9,58. Найдено: С 61,64, Н 6,31, N 9,51. Пример 3. 3-[4'-(6-Аминопиридин-2-ил) бифенил-4-илметил]-3-аза-бицикло[3.1,0]гекс-6 иламин. Получали как в примере 2, используя 3 аза-бицикло[3.1.0]гекс-6-иламина трет-бутилкарбамат на стадии восстановительного аминирования (2 А), с 67% выходом в виде масла: 1H-ЯМР: (, CDCl3): 1,46 (s, 9H), 1,52 (bs,2H), 2,26 (s, 6H), 2,43 и 3,11 (мультиплеты, 4 Н),2,94 (m, 1H), 3,61 (s, 2H), 5,97 (s, 2H), 7,14 (dd,J=1,8, 1H), 7,34 (m, 2H), 7,57 (m, 2H), 7,70 (m,2H), 7,78 (, J=7, 1H), 7,87 (t, J=8, 1H), 8,16 (m,2H). 13 С-ЯМР (, СDСl3): 13,6, 24,6, 28,4, 30,6,54,2, 58,6, 107,0, 118,2, 119,8, 126,8, 127,1, 127,3,127,5, 128,7, 128,9, 132,1, 137,1, 138,6, 138,9,142,0, 151,7, 156,5. МС (%): 535 (исходный+1, 100) с последующим удалением защитных групп с использованием гидроксиламина гидрохлорида в водном этаноле (как в примере 2 Б) и обработкой трифторуксусной кислотой в метиленхлориде при комнатной температуре в течение 3 ч с получением 65% общего выхода трифторацетатной соли, растертой с тетрагидрофураном,т.пл. 112-119 С. 1 Н-ЯМР (, ТФУ-соль в CDCl3): 2,33 (bs,2H), 2,99 (bs, 1H), 3,29 (m, 2H), 3,70 (m, 2H),4,41 (s, 2H), 6,98 (, J=8, 1H), 7,20 (, J=7,5, 1H),7,60 (m, 2H), 7,78 (m, 2H), 7,88 (m, 2H), 7,98 (t,J=8, 1 Н). 13 С-ЯМР (, ТФУ-соль в CDCl3): 23,7, 27,5,57,1, 60,1, 6,9, 113,1, 113,9, 129,9, 130,0, 130,1,132,7, 133,4, 133,6, 143,5, 145,1, 146,7, 149,1,157,9. МС (%): 357 (исходный+1, 100). Анализ. Вычислено для С 23 Н 24N4 3(С 2F3O2 Н)1/2 Н 2O: С 49,23, Н 3,99, N 7,92. Получено: С 49,14, Н 3,90, N 7,80. Пример 4. 3-[4'-(6-Аминопиридин-2-ил) бифенил-3-илметил]-3-азабицикло[3.1.0]гекс-6 иламин. А. 2-(2,5-Диметилпирролил)-6-(4-(3-толил) фенил)пиридин. Получали как в примере 1 Б, используя 3 толилбороновую кислоту, в виде масла с 39% выходом. 1 23 Б. 2-Фталимидо-6-(4-(3-толил)фенил) пиридин. В круглодонную колбу емкостью 100 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 200 мг (0,592 ммоль) 2-(2,5-диметилпирролил)-6-(4-(3-толил)фенил пиридина, 206 мг (2,96 ммоль) гидроксиламина гидрохлорида, 4 мл этанола и 1 мл воды. Реакционную смесь нагревали при температуре дефлегмации в течение 36 ч, охлаждали и вливали в разбавленный водный раствор бикарбоната натрия и экстрагировали этилацетатом. Органический слой отделяли, промывали рассолом и сушили. Остаток в виде коричневого масла, 138 мг (90%), переносили в 10 мл сухого толуола и обрабатывали 116 мг (0,531 ммоль) Nкарбэтоксифталимида. Полученный раствор нагревали при температуре дефлегмации в течение 20 ч, охлаждали и выпаривали. Остаток хроматографировали на силикагеле, используя гексан/этилацетат в качестве элюента, с получением 130 мг (56% общий) масла. 1 Н-ЯМР: (, CDCl3): 2,40 (s, 3 Н), 7,15 (m,1 Н), 7,34 (m, 2H), 7,42 (m, 2H), 7,65 (m, 2H), 7,79(m, 3 Н), 7,92 (m, 3 Н), 8,07 (m, 2H). 13 С-ЯМР (, CDCl3): 21,6, 119,9, 120,1,123,5, 123,9, 124,2, 122,2, 122,4, 127,5, 127,9,128,3, 128,7, 131,9, 133,7, 134,2, 134,5, 135,3,138,4, 139,0, 157,3, 166,8. МС (%): 391 (исходный+1, 100). В. 3-[4'-(6-Фталимидопиридин-2-ил)бифенил-3-илметил]-3-аза-бицикло[3.1.0]гекс-6-иламина трет-бутилкарбамат. В круглодонную колбу емкостью 100 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 130 мг (0,333 ммоль) 2-фталимидо-6-(4-(3-толил)фенил)пиридина, 59 мг (0,333 ммоль) N-бромсукцинимида, 10 мг диазо-бис(1-цианоциклогексана) и 10 мл четыреххлористого углерода. Реакционную смесь нагревали при температуре дефлегмации в течение 1 ч, добавляли дополнительные 10 мг диазобис(1-цианоциклогексана) и нагревание при температуре дефлегмации продолжали в течение 1 ч. Реакционную смесь затем охлаждали,фильтровали и выпаривали. Остаток переносили в 10 мл сухого ацетонитрила и обрабатывали 66 мг (0,333 ммоль) 3 азабицикло[3.1.0]гекс-6-иламина и 28 мг (0,333 ммоль) бикарбоната натрия. Реакционную смесь нагревали при температуре дефлегмации в течение 12 ч, охлаждали и выпаривали. Остаток переносили в этилацетат и воду и органический слой отделяли, промывали рассолом, сушили над сульфатом натрия и выпаривали. Остаток хроматографировали на силикагеле, используя метанол/метиленхлорид в качестве элюента, с получением 130 мг (67%) масла. 1 Н-ЯМР: (, CDCl3): 1,38 (s, 9H), 1,6-1,8 (m,2H), 3,2-3,5 (m, 5H), 3,57 (m, 2 Н), 7,15 (dd, J=1,8, 002907 1H), 7,2-7,5 (m, 4H), 7,65 (m, 3H), 7,78 (m, 3H),7,92 (m, 2H), 8,05 (m, 2H). 13 С-ЯМР (, СDСl3): 28,3, 47,6, 50,5, 54,1,62,1, 116,5, 118,8, 119,9, 120,1, 123,9, 126,5,127,3, 127,4, 127,5, 128,8, 129,2, 131,8, 134,5,136,4, 136,8, 138,9, 155,1, 157,2, 165,6, 166,7,169,6, 169,8. МС (%): 587 (исходный+1, 100). Г. 3-[4'-(6-Аминопиридин-2-ил)бифенил-3 илметил]-3-аза-бицикло[3.1.0]гекс-6-иламин. В круглодонную колбу емкостью 100 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 130 мг (0,222 ммоль) 3-[4'-(6-фталимидопиридин-3-ил)-бифенил-3-илметил]-3-аза-бицикло[3.1.0]гекс-6-иламина трет-бутилкарбамата, 20 мл метанола и 3 мл гидразина. Реакционную смесь нагревали при 50 С в течение 2,5 ч, охлаждали и выпаривали. Остаток переносили в этилацетат и промывали 0,2 н. раствором гидроксида натрия, водой и рассолом, сушили над сульфатом натрия и выпаривали. Остаток, 110 мг, переносили в 6 мл сухого метиленхлорида и обрабатывали 1,5 мл трифторуксусной кислоты при комнатной температуре в течение 2 ч. Реакционную смесь выпаривали и переносили в этилацетат/0,3 н. соляную кислоту. Водный слой отделяли, доводили рН до 10 с использованием 6 н. раствора гидроксида натрия и экстрагировали этилацетатом. Органический слой промывали рассолом, сушили над сульфатом натрия и выпаривали. Полученное масло превращали в гидрохлорид с использованием 1 н. HCl в эфире и растирали с тетрагидрофураном с получением 21 мг (20%) твердого вещества, т.пл. 184-196 С. 1 Н-ЯМР: (, CDCl3): 1,37 (bs, 2H), 1,51 (bs,1H), 2,46 и 3,02 (мультиплеты, 4 Н), 3,64, (s, 2H),4,60 (bs, 2H), 6,46 (, J=8, 1H), 7,13 (, J=7,5,1H), 7,2-7,6 (m, 5H), 8,00 (m, 2H). 13 С-ЯМР (, CDCl3): 14,0, 38,7, 54,5, 59,2,107,1, 110,8, 115,1, 125,7, 126,8, 127,1, 127,3,127,7, 128,6, 138,3, 138,5, 139,1, 140,6, 141,3,155,7, 158,3. МС (%): 357 (исходный+1, 100). Пример 5. 2-Амино-N-[4'-(6-аминопиридин-2-ил)бифенил-3-ил]пропионамид. А. 2-(2,5-Диметилпирролил)-6-(4-(3-нитрофенил)фенил)пиридин. Получали как в примере 1 Б в виде масла с 66% выходом, используя 3-нитрофенилбороновую кислоту. 1 Н-ЯМР: (, CDCl3): 2,24 (s, 6 Н), 5,96 (s,2H), 7,15 (, J=8, 1H), 7,54 (t, J=8, 1H), 7,67 (m,2H), 7,76 (m, 1H), 7,88 (m, 2H), 8,15 (m, 3 Н), 8,42 25 Б. 2-(2,5-Диметилпирролил)-6-(4-(3-аминофенил)фенил)пиридин. В круглодонную колбу емкостью 100 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 520 мг (1,41 ммоль) 2(2,5-диметилпирролил)-6-(4-(3-нитрофенил)фенил)пиридина, 445 мг (7,05 ммоль) формиата аммония, 10 мл этанола и 80 мг 10% палладия на угле (несколько мл 1,2-дихлорэтана добавляли для растворения нитросоединения). Реакционную смесь нагревали при температуре дефлегмации в течение 40 мин, охлаждали и фильтровали с использованием этанола черезCelite. Фильтрат выпаривали, переносили в этилацетат/разбавленный раствор гидроксида натрия, и органический слой отделяли и промывали рассолом, сушили над сульфатом натрия и выпаривали до масла, 400 мг (84%). 1B. 2-(трет-Бутилкарбамоиламино)-N-[4'-(6(2,5-диметилпирролил)пиридин-2-ил)бифенил 3-ил]пропионамид. В круглодонную колбу емкостью 100 мл,снабженную впускным патрубком для N2, добавляли 200 мг (0,590 ммоль) 2-(2,5-диметилпирролил)-6-(4-(3-аминофенил)фенил)пиридина, 117 мг (0,590 ммоль) N-трет-бутоксикарбонилаланина, 113 мг (0,590 ммоль) EDAC,159 мг (1,30 ммоль) 4-диметиламинопиридина и 10 мл сухого ацетонитрила. Реакционную смесь перемешивали при комнатной температуре в течение 12 ч, выпаривали и остаток хроматографировали на силикагеле, используя метанол/метиленхлорид в качестве элюента, с получением 230 мг (76%) масла. 1(m, 1H), 7,57 (m, 2 Н), 7,69 (m, 1H), 7,81 (m, 2H),8,05 (m, 2H). 13 С-ЯМР (, CDCl3): 13,5, 18,0, 28,3, 50,9,80,4, 106,9, 118,2, 118,9, 119,7, 122,6, 127,1,127,3, 128,6, 129,2, 137,2, 138,5, 138,6, 140,9,141,4, 151,6, 156,3, 171,8. МС (%): 511 (исходный+1, 100). Г. 2-Амино-N-[4'-(6-аминопиридин-2-ил) бифенил-3-ил]пропионамид. В круглодонную колбу емкостью 100 мл,снабженную впускным патрубком для N2, добавляли 230 мг (0,451 ммоль) 2-(трет-бутилкарбамоиламино)-N-[4'-(6-(2,5-диметилпирролил)пиридин-2-ил)бифенил-3-ил]пропионамида 26 и 25 мл этилацетата. Раствор охлаждали до 0 С и насыщали HCl, затем перемешивали при 0 С в течение 30 мин и в течение 1 ч при комнатной температуре. Полученный осадок собирали и растворяли в 20 мл метанола, обрабатывали 1 мл воды и 157 мг (2,255 ммоль) гидроксиламина гидрохлорида и нагревали при температуре дефлегмации в течение 2 дней. Реакционную смесь охлаждали, выпаривали и переносили в этилацетат/разбавленную соляную кислоту. Водный слой отделяли, рН доводили до 10 с использованием 6 н. раствора гидроксида натрия и экстрагировали этилацетатом. Органический слой промывали рассолом, сушили над сульфатом натрия и выпаривали. Масло переносили в метиленхлорид, обрабатывали обесцвечивающим углем, фильтровали через Celite и выпаривали. Полученное масло (90 мг) превращали в гидрохлоридную соль, используя 1 н. HCl в эфире, с получением твердого вещества, 73 мгH-ЯМР: (, СDСl3): 2,81 и 3,37 (мультиплеты, 2H), 3,74 (dd, J=4,9, 1H), 4,62 (bs, 2H),6,43 (, J=8, 1H), 7,10 (, J=7,5, 1H), 7,2-7,4 (m,8H), 7,47 (t, J=8, 1H), 7,65 (m, 3H), 7,97 (m, 2H),9,53 (bs, 1H). 13 С-ЯМР (, CDCl3): 40,6, 56,8, 107,2, 110,8,118,0, 118,5, 122,8, 126,9, 127,0, 127,1, 127,2,128,8, 129,2, 129,4, 137,6, 138,1, 138,4, 138,6,140,7, 141,4, 155,4, 158,2, 172,4. МС (%): 409 (исходный+1, 100). Пример 7. 6-[4-(1-Бензил-1,2,5,6-тетрагидропиридин-3-ил)фенил]пиридин-2-иламин. А. 2-(2,5-Диметилпирролил)-6-[4-(пирид-3 ил)фенил]пиридин. В круглодонную колбу емкостью 100 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 271 мг (2,20 ммоль) 3 пиридилбороновой кислоты (Rec. Trav. Chim.,93, 21 (1974, 720 мг (2,20 ммоль) 2-(2,5 диметилпирролил)-6-(4-бромфенил)пиридина,933 мг (8,81 ммоль) карбоната натрия, 128 мг 27 при температуре дефлегмации в течение 20 ч,добавляли 100 мг 3-пиридилбороновой кислоты и нагревание при температуре дефлегмации продолжали в течение 2 ч. Реакционную смесь затем охлаждали, вливали в воду и экстрагировали в этилацетат. Органический слой промывали рассолом, сушили над сульфатом натрия и выпаривали. Остаток хроматографировали на силикагеле, используя метанол/метиленхлорид в качестве элюента, с получением продукта в виде масла, 350 мг (49%). 1(m, 2H), 7,74 (, J=8, 1H), 7,83 (m, 2H), 8,16 (m,2H), 8,59 (m, 1H), 8,90 (m, 1H). 13 С-ЯМР (, СDСl3): 13,6, 107,2, 118,3,120,1, 123,7, 127,4, 127,6, 128,1, 128,6, 129,1,134,2, 135,9, 138,6, 138,8, 148,2, 148,5, 128,8,151,8, 156,0 МС (%): 326 (исходный+1, 100). Б. 2-(2,5-Диметилпирролил)-6-[4-(1-бензил-1,2,5,6-тетрагидропиридин-3-ил)фенил]пиридин. В круглодонную колбу емкостью 100 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 350 мг (1,077 ммоль) 2-(2,5-диметилпирролил)-6-[4-(пирид-3-ил) фенил]пиридина, 10 мл сухого ацетонитрила и 128 мкл (1,077 ммоль) бензилбромида. Реакционную смесь нагревали при 70 С в течение 14 ч,охлаждали, выпаривали и остаток переносили в 5 мл этанола и 4 мл воды и обрабатывали 140 мг(2,37 ммоль) цианоборгидрида натрия (несколько мл дихлорметана добавляли для улучшения растворимости). Реакционную смесь перемешивали при комнатной температуре в течение 20 ч,вливали в разбавленный водный раствор бикарбоната натрия и экстрагировали этилацетатом. Органический слой промывали рассолом, сушили над сульфатом натрия и выпаривали. Остаток хроматографировали на силикагеле, используя метанол/метиленхлорид в качестве элюента, с получением двух продуктовых фракций: 2-(2,5-диметилпирролил)-6-[4-(1-бензил 1,2,5,6-тетрагидропиридин-3-ил)фенил]пиридина в виде масла, 135 мг (30%); 1 5,95 (s, 2H), 7,12 (, J=8, 1H), 7,2-7,5 (m, 7H),7,73 (, J=8, 1H), 7,86 (, J=8, 1H), 8,01 (m, 2H). 13 С-ЯМР (, СDСl3): 13,6, 25,2, 31,3, 42,3,53,5, 60,3, 63,2, 107,0, 118,2, 119,7, 127,1, 127,6,127,7, 128,4, 128,5, 128,7, 129,5, 129,9, 133,3,136,7, 138,7, 151,6, 156,7. МС (%): 420 (исходный+1, 100). В. 6-[4-(1-Бензил-1,2,5,6-тетрагидропиридин-3-ил)фенил]пиридин-2-иламин. В круглодонную колбу емкостью 100 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 135 мг (0,322 ммоль) 2-(2,5-диметилпирролил)-6-[4-(1-бензил-1,2,5,6 тетрагидропиридин-3-ил)фенил]пиридина, 112 мг (1,61 ммоль) гидроксиламина гидрохлорида,5 мл этанола и 1 мл воды. Реакционную смесь нагревали при температуре дефлегмации в течение 40 ч, охлаждали и полученный осадок, 6-[4(1-бензил-1,2,5,6-тетрагидропиридин-3-ил)фенил]пиридин-2-иламина дигидрохлорид, фильтровали и сушили, получая 22 мг (16,5%), т.пл. 270-272 С. Дополнительное вещество было выделено из фильтрата, 60 мг (55%) свободного основания в виде масла. 1(bs, 1H), 6,40 (, J=8, 1H), 7,04 (, J=7,5, 1H), 7,27,4 (m, 7H), 7,45 (t, J=8, 1H), 7,84 (m, 2H). 13 С-ЯМР (, СDСl3): 26,5, 49,1, 54,6, 62,8,107,1, 110,7, 122,9, 125,0, 126,7, 126,8, 127,1,128,3, 129,3, 134,9, 138,1, 138,2, 138,3, 138,4,155,8. МС (%): 342 (исходный+1, 100). Анализ. Вычислено для С 23H23N32 НСl 1/2 Н 2O: С 65,25, Н 6,19, N 9,92. Получено: С 65,62, Н 6,42, N 9,93. Пример 8. 6-[4-(1-Бензилпиперидин-3-ил) фенил]пиридин-2-иламин. Получали как в примере 7 В, используя промежуточный продукт из примера 7 Б, с получением 50 мг (30%) твердого вещества, т.пл. 5570 С. 1 Н-ЯМР (, СDСl3): 1,75 (m, 2H), 2,0 (m,2H), 2,62 (m, 1H), 2,8-3,0 (m, 4H), 3,55 (s, 2H),4,58 (bs, 2H), 6,40 (, J=8, 1H), 7,05 (, J=8, 1H),7,2-7,4 (m, 7H), 7,44 (t, J=8, 1H), 7,82 (m, 2H). 13 С-ЯМР (, СDСl3): 25,7, 31,7, 42,7, 53,7,61,0, 63,6, 106,9, 110,7, 126,8, 127,0, 127,5, 128,2,128,3, 129,2, 129,3, 133,8, 137,1, 138,3, 145,7,156,1, 158,3. МС (%): 344 (исходный+1, 100). Пример 9. 6-[4-(1-Бензилпиперидин-2 илметил)фенил]пиридин-2-иламин. А. N-Бензил-2-(4-бромбензил)пиперидин. В круглодонную колбу емкостью 100 мл,снабженную впускным патрубком для N2, добавляли 250 мг (0,984 ммоль) 2-(4-бромбензил) пиперидина (полученного как описано в Tetrahedron Letters, 7, 631 (1977, 110 мкл (1,08 ммоль) бензальдегида, 7 мл метанола, 74 мг(1.18 ммоль) цианоборгидрида натрия и не 29 сколько капель уксусной кислоты. Реакционную смесь перемешивали при комнатной температуре с последующим добавлением дополнительно бензальдегида, цианоборгидрида натрия и уксусной кислоты, в общем в течение 16 ч, затем вливали в разбавленный водный раствор бикарбоната натрия и экстрагировали этилацетатом. Органический слой промывали рассолом, сушили над сульфатом натрия и выпаривали. Остаток хроматографировали на силикагеле, используя метанол/метиленхлорид в качестве элюента, и продукт далее очищали посредством превращения в гидрохлоридную соль в эфире с последующим превращением в основание с использованием водного раствора гидроксида натрия с получением 175 мг (52%) масла. 1 Н-ЯМР (, СDСl3): 1,29 (m, 2H), 1.53 (m,3 Н), 1,6 (m, 1H), 2,26 и 2,79 (multiplets, 2H), 2,60(m, 2H), 3,15 (dd, J=3,12, 1H), 3,77 (Abq, J=13,5,Dn = 41, 2H), 7,00 (m, 1H), 7,2-7,4 (m, 8H). 13 С-ЯМР (, СDСl3): 22,4, 24,9, 28,9, 36,0,51,0, 58,2, 61,5, 127,0, 127,2, 127,6, 128,3, 128,5,129,2, 131,1, 131,4, 139,0, 140,9. МС (%): 344/346 (исходный+1, Br79/Br81,100). Б. 2-(2,5-Диметилпирролил)-6-[4-(1-бензилпиперидин-2-илметил)фенил]пиридин. В круглодонную колбу емкостью 100 мл,снабженную мембраной и впускным патрубком для N2, добавляли 175 мг (0,509 ммоль) Nбензил-2-(4-бромбензил)пиперидина и 7 мл сухого эфира. Раствор охлаждали до -70 С и за 1 мин по каплям добавляли 0,38 мл (0,610 ммоль) 1,6 М раствора бутиллития в гексане. Реакционную смесь перемешивали при -70 С в течение 5 мин, затем нагревали до комнатной температуры за период времени 20 мин. К перемешиваемой реакционной смеси затем добавляли раствор 105 мг (0,610 ммоль) 2-(2,5-диметилпирролил)пиридина в 5 мл сухого эфира и реакционную смесь, ставшую темно-оранжевой,перемешивали при комнатной температуре в течение 4 ч, затем гасили водным раствором хлорида аммония. После экстрагирования в этилацетат органический слой промывали рассолом, сушили над сульфатом натрия в течение 16 ч для осуществления окисления на воздухе до пиридина и выпаривали. Остаток хроматографировали на силикагеле, используя метанол/метиленхлорид в качестве элюента, с получением 36 мг (16%) масла. 1 30 МС (%): 436 (исходный+1, 100). В. 6-[4-(1-Бензилпиперидин-2-илметил) фенил]пиридин-2-иламин. В круглодонную колбу емкостью 100 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 36 мг (0,0827 ммоль) 2-(2,5-диметилпирролил)-6-[4-(1-бензилпиперидин-2-илметил)фенил]пиридина, 29 мг (0,414 ммоль) гидроксиламина гидрохлорида, 4 мл этанола и 1 мл воды. Реакционную смесь нагревали при температуре дефлегмации в течение 84 ч (для завершения реакции использовали дополнительный гидрохлорид гидроксиламина),охлаждали, вливали в разбавленную соляную кислоту и промывали этилацетатом. Водный слой доводили до рН 10 с использованием 6 н. раствора гидроксида натрия и экстрагировали этилацетатом. Органический слой промывали рассолом, сушили над сульфатом натрия и выпаривали. Полученное масло превращали в гидрохлоридную соль, используя 1 н. HCl в эфире, с получением твердого вещества, 17 мг (48%),т.пл. 70-85 С. 1(t, J=8, 1H), 7,81 (m, 2H). 13 С-ЯМР (, CDCl3): 22,4, 23,8, 25,3, 36,2,38,7, 50,9, 61,8, 106,8, 110,8, 126,7, 126,8, 128,2,128,8, 128,9, 129,0, 129,6, 131,1, 131,3, 138,3,141,0, 156,2, 158,6. МС (%): 358 (исходный+1, 100). Анализ. Вычислено для С 24 Н 27N32 НСl 3 Н 2O: С 59,50, Н 7,28, N 8,67. Найдено: С 59,54,Н 6,98, N 7,32. Пример 10. 6-4-[1-(2,2-Дифенилэтил) пиперидин-2-илметил]фенилпиридин-2-иламин. Получали как в примере 9, используя дифенилацетальдегид на стадии, аналогичной 9 А,с 59% выходом, с последующим 33% выходом на стадии добавления литийорганического соединения и 31% выходом на стадии деблокирования, с получением продукта в виде дигидрохлоридной соли, т.пл. 168-180 С. 1(m, 10 Н), 7,47 (t, J=8, 1H), 7,79 (m, 2H). 13 С-ЯМР (, CDCl3): 23,0, 23,8, 29,7, 38,7,49,5, 50,5, 59,6, 61,6, 106,8, 110,8, 126,2, 126,7,128,3, 129,5, 130,9, 138,4, 141,9, 144,0, 156,0,158,2. МС (%): 448 (исходный+1, 100). Пример 11. 6-[3-(2-Диметиламиноциклопентилметил)фенил]пиридин-2-иламин. А. 2-(4-2-(2,5-Диметилпирролилпирид 6-ил)бензилиден)циклопентанон. В круглодонную колбу емкостью 100 мл,снабженную ловушкой Дина-Старка с укреп 31 ленными сверху конденсатором и впускным патрубком для N2, добавляли 552 мг (2,0 ммоль) 2-(2,5-диметилпирролил)-6-(4-формилфенил) пиридина, 20 мл бензола, 0,384 мл (2,4 ммоль) 4-морфолино-1-циклогексена и 10 мг камфорсульфоновой кислоты. Раствор нагревали при температуре дефлегмации с удалением в течение 13 ч, охлаждали и добавляли 25 мл 3 н. соляной кислоты. Смесь перемешивали при комнатной температуре в течение 1 ч, затем разбавляли этилацетатом и водой. Органический слой отделяли, промывали водным раствором бикарбоната натрия и рассолом, сушили над сульфатом натрия и выпаривали. Неочищенное масло затвердевало при стоянии, 460 мг (100%), и его использовали непосредственно на следующей стадии. 1 Н-ЯМР (, СDСl3): 1,95 (m, 2H), 2,195 (s,6 Н), 2,33 (t, J=8, 2H), 2,91 (m, 2H), 5,91 (s, 2H),7,09 (, J=8, 1 Н), 7,36 (bs, 1H), 7,55 (m, 2H), 7,71(, J=8, 1H), 7,81 (t, J=8, 1H), 8,07 (m, 2H). 13 С-ЯМР (, CDCl3): 13,5, 20,0, 29,3, 37,6,107,1, 118,4, 120,1, 127,0, 128,2, 128,1, 130,8,131,2, 136,4, 136,7, 138,8, 151,7, 155,6. МС (%): 343 (исходный+1,100). Б. 2-(4-2,5-Диметилпирролил)пирид-6 ил)бензил)циклопентанон. В круглодонную колбу емкостью 100 мл,снабженную конденсатором и впускным патрубком для N2, добавляли неочищенное вещество из вышеуказанной стадии (2 ммоль) и 4 мл 1,2-дихлорэтана. После растворения добавляли 25 мл этанола с последующим добавлением 631 мг (10 ммоль) формиата аммония и 100 мг 10% палладия-на-угле. Смесь нагревали при температуре дефлегмации в течение 1 ч, затем ее обрабатывали дополнительным формиатом аммония и палладием-на-угле (Pd-C) и нагревали при температуре дефлегмации в течение 1 ч. Реакционную смесь затем охлаждали и фильтровали через Celite с использование этанола и метиленхлорида. Фильтрат выпаривали, переносили в этилацетат и водный раствор бикарбоната натрия, органический слой отделяли, промывали рассолом, сушили над сульфатом натрия и выпаривали. Остаток хроматографировали на силикагеле, используя этилацетат/гексан в качестве элюента, с получением 410 мг (60% общий) пены. 1 32 В. 2-(2,5-Диметилпирролил)-6-[3-(диметиламиноциклопентилметил)фенил]пиридин. В круглодонную колбу емкостью 100 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 205 мг (0,596 ммоль) 2-(4-2,5-диметилпирролил)пирид-6-ил)бензил)циклопентанона, 10 мл метанола, 486 мг(0,715 ммоль) уксусной кислоты. Реакционную смесь нагревали при 50 С в течение 40 ч, охлаждали и вливали в водный раствор бикарбоната натрия. Смесь экстрагировали этилацетатом и органический слой промывали рассолом, сушили над сульфатом натрия и выпаривали. Остаток хроматографировали на силикагеле, используя метанол/метиленхлорид (с небольшим количеством триэтиламина) в качестве элюента, с получением обоих диастереомеров в виде масла. Менее полярный диастереомер, 140 мгH-ЯМР (, CDCl3): 1,5-1,8 (s, 6H), 2,20 (s,6H), 2,32 (s, 6H), 2,45 (dd, J=10,14, 1H), 2,60 (m,2H), 2,95 (dd, J=5,13,5,1H), 5,91 (s, 2H), 7,10 (,J=8, 1H), 7,27 (m, 2H), 7,71 (, J=8, 1H), 7,84 (t,J=8, 1H), 7,97 (m, 2H). 13 С-ЯМР (, CDCl3): 13,4, 23,5, 27,5, 30,85,41,0, 42,3, 43,3, 72,1, 106,8, 118,0, 119,5, 126,8,128,6, 129,4, 136,0, 138,4, 142,7, 151,5, 156,7. МС (%): 374 (исходный+1,100). Г. 6-[3-(2-Диметиламиноциклопентилметил)фенил]пиридин-2-иламин. В круглодонную колбу емкостью 100 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 140 мг (0,375 ммоль) 2-(2,5-диметилпирролил)-6-[3-(2-диметиламиноциклопентилметил)фенил]пиридина, 9 мл этанола, 1 мл воды и 261 мг (3,75 ммоль) гидроксиламина гидрохлорида. Реакционную смесь нагревали при температуре дефлегмации в течение 24 ч, обрабатывали дополнительным гидроксиламином гидрохлоридом и нагревали при температуре дефлегмации еще 12 ч. Затем ее охлаждали, вливали в разбавленную водную соляную кислоту и промывали этилацетатом. Водный слой доводили до рН 10 с использованием 6 н. раствора гидроксида натрия и экстрагировали двумя порциями этилацетата. Объединенный органический слой промывали рассолом, сушили над сульфатом натрия и выпаривали. Полученное масло (109(m, 1 Н), 2,94 (, J=9,6, 1 Н), 4,57 (bs, 2H), 6,38 (,J=8, 1H), 7,02 (, J=8, 1H), 7,20 (m, 2H), 7,43 (t,J=8, 1H), 7,80 (m, 2H). 13 С-ЯМР (, CDCl3): 20,3, 27,3, 28,2, 32,3,42,8, 45,3, 71,9, 106,7, 110,6, 126,6, 129,2, 137,1,138,2, 142,8, 156,2, 158,2. МС (%): 296 (исходный+1, 100). Пример 12. 6-[3-(2-(4-Метилпиперазин-1 ил)циклопентилметил)фенил]пиридин-2-иламин. Получали как в примере 11, используя Nметилпиперазин, с 64% выходом продукта как смеси диастереомеров в виде гидрохлоридной соли, т.пл. 212-224 С. 1(m, 2H), 7,40 (t, J=8, 1H), 7,77 (m, 2H). 13 С-ЯМР (, CDCl3): 20,1, 27,3, 27,4, 32,5,42,1, 46,0, 52,7, 55,1, 70,0, 106,7, 110,5, 126,6,129,1, 137,0, 138,2, 142,8, 156,1, 158,2. МС (%): 351 (исходный+1, 100). Пример 13. 6-[4-(Пиперидин-4-ил)фенил] пиридин-2-иламин. А. N-Бензил-4-(4-бромфенил)пиперидин. В круглодонную колбу емкостью 250 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 4,77 (17,72 ммоль) 3(4-бромфенил)глутарового ангидрида (полученного как описано в J. Org. Chem., 21, 704(1956, 1,90 г (17,72 ммоль), бензиламина и 80 мл толуола. Реакционную смесь нагревали при температуре дефлегмации в течение 1,5 ч, охлаждали и концентрировали. Остаток переносили в 80 мл уксусного ангидрида и нагревали при 100 С в течение 16 ч, затем охлаждали и выпаривали несколько раз с использованием толуола для удаления избытка уксусного ангидрида. Остаток растворяли в 80 мл сухого тетрагидрофурана и обрабатывали 40 мл (80 ммоль) 2 н. раствора боранметилсульфида в тетрагидрофуране. Реакционную смесь нагревали при температуре дефлегмации в течение 18 ч, охлаждали и выпаривали, затем растворяли в 80 мл этанола и обрабатывали 3,5 мг карбоната натрия и 3,5 фторида цезия. Реакционную смесь нагревали при температуре дефлегмации в течение 16 ч, охлаждали и концентрировали. Остаток переносили в воду и этилацетат. Органический слой отделяли, промывали рассолом, сушили над сульфатом натрия и выпаривали. Остаток хроматографировали на силикагеле, используя этилацетат/гексан в качестве элюента, с получением 2,94 г (50%) масла.(d, J=8, 1H), 7,2-7,4 (m, 5H), 7,41 (d, J=8, 2H). 13 С-ЯМР (, СDСl3): 33,4, 42,2, 54,1, 63,5,119,7, 127,0, 128,2, 128,7, 129,2, 131,4, 138,4,145,5. МС (%): 328/330 (исходный, Br79/Br81,15/19), 91 (100). Б. N-Бензил-4-(4-(2-(2,5-диметилпирролил) пирид-6-ил)фенил)пиперидин. В трехгорлую круглодонную колбу емкостью 125 мл, снабженную мембраной и впускным патрубком для N2, добавляли 2,93 г (8,88 ммоль) N-бензил-4-(4-бромфенил)пиперидина и 30 мл сухого эфира. Раствор охлаждали до-70 С и в течение 5 мин по каплям добавляли 6,66 мл (10, 65 ммоль) 1,6 н. раствора бутиллития в гексане. После перемешивания в течение еще 5 мин при -70 С раствор медленно нагревали до комнатной температуры в течение 25 мин. Затем в течение 5 мин по каплям добавляли раствор 1,83 г (10,65 ммоль) 2-(2,5-диметилпирролил)пиридина в 10 мл сухого эфира, и реакционную смесь, которая медленно становилась темно-красной, перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь гасили водным раствором хлорида аммония,распределяли между этилацетатом и водой, отделяли органический слой, промывали рассолом и сушили над сульфатом натрия, оставляя ее стоять в течение ночи для осуществления переароматизации пиридинового кольца. После выпаривания растворителя остаток хроматографировали на силикагеле, используя этилацетат/гексан и далее метанол/метиленхлорид в качестве элюента, с получением 1.21 г (32%) масла. 1(s, 2H), 5,95 (s, 2H), 7,12 (d, J=8, 1H), 7,2-7,4 (m,7H), 7,73 (d, J=7, 1H), 7,85 (t, J=8, 1H), 8,03 (m,2H). 13 С-ЯМР (, CDCl3): 13,5, 33,4, 42,5, 54,2,63,5, 106,9, 118,1, 119,6, 127,1, 127,3, 128,2,128,7, 129,3, 131,4, 136,3, 138,3, 138,5, 148,0,151,7, 156,8. МС (%): 422 (исходный+1, 26), 91 (100). В. 4-(4-(2-(2,5-Диметилпирролил)пирид-6 ил)фенил)пиперидин. В круглодонную колбу емкостью 100 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 1,21 г (2,87 ммоль) Nбензил-4-(4-(2-(2,5-диметилпирролил)пирид-6 ил)фенил)пиперидина, 30 мл этанола, 0,90 г(14,37 ммоль) формиата аммония и 140 мг 10% палладия-на-угле (Pd-C). Реакционную смесь нагревали при температуре дефлегмации в течение 1 ч, обрабатывали дополительным количеством формиата аммония и Pd-C и нагревали при температуре дефлегмации в течение 3 ч. Затем ее охлаждали и фильтровали через Celite с 35 использованием этанола и метиленхлорида. Фильтрат выпаривали, переносили в этилацетат и водный раствор бикарбоната натрия, и органический слой отделяли, промывали рассолом,сушили над сульфатом натрия и выпаривали с получением 734 мг (77%) масла. 1(bs, 1H), 5,92 (s, 2H), 7,10 (d, J=8, 1H), 7,32 (m,2H), 7,71 (d, J=8, 1H), 7,84 (t, J=8, 1H), 8,01 (m,2H). 13 С-ЯМР (, СDСl3): 13,5, 33,7, 42,5, 46,7,106,9, 118,1, 119,6, 127,2, 128,5, 128,7, 136,4,138,5, 147,7, 151,7, 156,8. МС (%): 332 (исходный+1, 100). Г. 6-[4-(Пиперидин-4-ил)фенил]пиридин 2-иламин. В круглодонную колбу емкостью 100 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 100 мг (0,302 ммоль) 4-(4-(2-(2,5-диметилпирролил)пирид-6-ил)фенил)пиперидина, 10 мл этанола, 1 мл воды и 417 мг (6,04 ммоль) гидроксиламина гидрохлорида. Реакционную смесь нагревали при температуре дефлегмации в течение 20 ч, охлаждали и вливали в разбавленную водную соляную кислоту,затем промывали этилацетатом. Водный слой доводили до рН до 10 с использованием 6 н. раствора гидроксида натрия и дважды экстрагировали этилацетатом. Объединенный органический слой промывали рассолом, сушили над сульфатом натрия и выпаривали. Полученное масло (77 мг, 100%) превращали в гидрохлоридную соль, используя HCl в эфире, с получением желто-коричневого твердого вещества, 32 мг (32%), т.пл. разл. выше 150 С. 1 37 Анализ. Вычислено для C25H29N22HCl 3/2H2O: С 63,69, Н 7,27, N 8,91. Найдено: С 63,80, Н 7,41, N 8,53. Пример 18. 6-[3-(2-(4-Метилпиперазин-1 ил)циклогексилметил)фенил]пиридин-2-иламин. Получали как в примере 11, используя Nметилпиперазин, с 96% выходом продукта как смеси диастереомеров в виде гидрохлоридной соли, т.пл. 195-208 С. 1(m, 3 Н), 2,27 (s, 3 Н), 2,4-2,7 (m, 8H), 2,90 (m,1H), 4,53 (широкий s, 2H, NH2), 6,40 (d, J=8, 1H),7,02 (d, J=8, 1H), 7,18 (m, 2H), 7,45 (t, J=8, 1H),7,79 (m, 2H). 13 С-ЯМР (, CDCl3): 13,8, 24,5, 25,7, 26,9,30,5, 37,2, 45,9, 50,1, 55,5, 65,8, 106,7, 110,6,126,6, 129,1, 137,0, 138,2, 143,1, 156,2, 158,1. МС (%): 365 (исходный+1, 100). Анализ. Вычислено для С 23 Н 32N43 НСl 5/2 Н 2O.2/3(С 4 Н 10 О): С 57,26, Н 8,11, N 10,41. Найдено: С 57,15, Н 7,81, N 10,11. Пример 19. 6-[3-(2-(N-Бензиламино) циклогексилметил)фенил]пиридин-2-иламин. Получали как в примере 11, используя бензиламин, с 72% выходом продукта как смеси диастереомеров в виде гидрохлоридной соли,т.пл. 170-185 С. 1 Н-ЯМР (, CDCl3): 1,3-1,4 (m, 4H), 1,6-1,8(m, 1H), 3,77 (dd, J=9,38, 2H), 4,58 (широкий s,2H, NH2), 6,40 (d, J=8, 1H), 7,05 (d, J=8, 1H), 7,27,4 (m, 7H), 7,46 (t, J=8, 1H), 7,82 (m, 2H). 13 С-ЯМР (, СDСl3): 25,2, 25,6, 27,0, 28,6,39,0, 50,8, 51,3, 56,1, 60,1, 106,7, 110,6, 126,5,126,6, 128,1, 128,3, 129,5, 137,1, 138,3, 141,2,141,9, 142,5, 156,2, 158,2. МС (%): 372 (исходный+1, 100). Анализ. Вычислено для C25H29N32HCl 3/2H2O: С 63,69, Н 7,27, N 8,91. Найдено: С 64,03, Н 7,25, N 8,90. Пример 20. 6-4-[2-(2-Этоксиэтиламино) циклогексилметил]фенилпиридин-2-иламин. Получали как в примере 11, используя 2 этоксиэтиламин, со 100% выходом продукта как смеси диастереомеров в виде гидрохлоридной соли, т.пл. 70-90 С. 1 Н-ЯМР (, CDCl3): 1,21 (t, J=8, 3H), 1,2-1,7 38 Получали как в примере 11, используя Nбензилпиперазин, с 67% выходом продукта как смеси диастереомеров в виде гидрохлоридной соли, т.пл. 205-215 С. 1 Н-ЯМР (, СDСl3): 1,0-1,8 (m, 8H), 1,8-1,9(m, 3 Н), 2,4-2,6 (m, 8H), 2,92 (m, 1 Н), 3,51 (синглеты, 2 Н), 4,53 (bs, 2 Н, NH2), 6,40 (d, J=8, 1H),7,03 (d, J=7, 1H), 7,1-7,3 (m, 7 Н), 7,45 (t, J=7,5,1H), 7,79 (m, 2H). 13 С-ЯМР (, СDСl3): 19,8, 24,5, 25,7, 26,9,30,5, 37,2, 50,1, 53,0, 53,5, 63,1, 65,9, 106,7,110,6, 126,6, 126,9, 128,1, 129,1, 129,2, 137,0,138,0, 138,2, 143,1, 156,2, 158.1. МС (%): 441 (исходный+1, 100). Анализ. Вычислено для С 29 Н 36N43 НСl 3/2 Н 2O: С 60,36, Н 7,34, N 9,71. Получено: С 60,53, Н 7,35, N 8,97. Пример 22. 6-[4-(2-(4-(N-Изопропилацетамидо)пиперазин-1-ил)циклогексилметил)фенил]пиридин-2-иламин. Получали как в примере 11, используя N(N-изопропилацетамидо)пиперазин, с 94% выходом продукта как смеси диастереомеров в виде гидрохлоридной соли, т.пл. 180-200 С 39 Пример 24. 6-[4-2-(3-Азабицикло[3.1.0] гекс-6-иламино)[2.2.1]бициклогепт-1-ил)метил) фенил]пиридин-2-иламин. Получали как в примере 11, используя 3 азабицикло[3.1.0]гекс-6-иламин, с 78% выходом продукта как смеси диастереомеров в виде гидрохлоридной соли, т.пл. 248-260 С (разл). 1(dd, J=4,13, 1H, определен как транс-стереомер),3,02 (m, 4H), 4,55 (широкий s, 2H, NH2), 6,39 (d,J=8, 1H), 7,02 (d, J=7,5, 1H), 7,19 (m, 2H), 7,44 (t,J=8, 1H), 7,79 (m, 2H). 13 С-ЯМР (, CDCl3): 22,4, 25,5, 25,6, 27,35,32,5, 36,3, 36,8, 38,3, 41,3, 49,5, 52,6, 53,6, 106,8,110,6, 126,7, 128,9, 137,1, 138,3, 142,5, 156,2,158,3. МС (%): 375 (исходный+1, 100). Анализ. Вычислено для C24H30N43HCl 1/2H2O1/2(C4H10O): С 58,92, Н 7,42, N 10,57. Найдено: С 59,02, Н 7,50, N 10,64. Пример 25. 6-[2-(N-Фенетиламино)-5 фенилциклогексилметил)метил)фенил]пиридин 2-иламин. Получали как в примере 11, используя Nфенетиламин, с 77,5% выходом продукта как смеси диастереомеров в виде гидрохлоридной соли, т.пл. 178-192 С (разл.). 1(мультиплеты, 2H). 13 С-ЯМР (, CDCl3): 25,3, 26,1, 30,9, 32,9,34,6, 37,1, 39,9, 53,0, 64,9, 66,5, 106,8, 107,2,110,8, 110,9, 125,9, 126,8, 127,0, 127,1, 128,3,129,2, 138,4, 138,5, 156,2, 158,2. МС (%): 439 (исходный+1, 100). Пример 28. N-Метил-(2-аминопирид-6-илбензилиден)оксиндол. Получали как в примере 11, используя Nметилоксиндол, со 100% выходом продукта как смеси диастереомеров в виде гидрохлоридной соли, т.пл. 170-175 С (разл). 1 Н-ЯМР (, CDCl3): 3,26 (s, 3H), 4,60 (широкий s, 2H, NH2), 6,47 (d, J=8, 1H), 6,80 (d, J=8,1H), 6,86 (t, J=8, 1H), 7,12 (d, J=8, 1H), 7,24 (m,1H), 7,50 (t, J=8, 1H), 7,70 (m, 2H), 7,85 (s, 1H),8,02 (m, 2H). 13 С-ЯМР (, CDCl3): 26,1, 107,7, 108,1,110,9, 121,1, 121,7, 122,8, 126,8, 127,1, 129,7,132,3, 135,0, 136,7, 138,4, 140,6, 144,1, 154,9,158,3, 168,45. МС (%): 328 (исходный+1, 100). Анализ. Вычислено для C21H17N3O1/4H2O: С 76,00, Н 5,31, N 12,66. Найдено: С 75,93, Н 5,30, N 11,87. Пример 29. N-Метил-2-(2-аминопирид-6 илбензил)оксиндол. Получали восстановлением соединения примера 28 с 60% выходом продукта как смеси диастереомеров в виде гидрохлоридной соли,т.пл. 45-55 С (разл). 1 41 продукта как смеси диастереомеров в виде гидрохлоридной соли, т.пл. 165-190 С (разл). 1(m, 2H), 7,85 (s, 1H), 8,02 (m, 2H). 13 С-ЯМР (, CDCl3): 37,6, 45,1, 55,6, 107,0,107,7, 110,4, 121,1, 122,4, 125,9, 126,2, 129,1,131,7, 136,3, 137,8, 157,6. Не все атомы углерода были видимыми в этом сканировании из-за ограниченной растворимости соединения. МС (%): 385 (исходный+1, 100). Анализ. Вычислено для C24H24N4O2HCl 2H2O: С 60,63, Н 5,94, N 11,78. Найдено: С 60,61, Н 6,13, N 10,12. Пример 31. N-(2-Диметиламиноэтил)-(2 аминопирид-6-илбензил)оксиндол. Получали восстановлением соединения примера 30 с использованием катализированного палладием формиата аммония с 97% выходом продукта как смеси диастереомеров в виде гидрохлоридной соли, т.пл. 120-135 С (разл). 1 Н-ЯМР (, СDСl3): 2,25 (s, 6H), 2,39 (9m,2H), 2,95 (dd, J=9,14, 1H), 3,48 (dd, J=4,14, 1H),3,7-3,9 (m, 3H), 4,47 (широкий s, 2H, NH2), 6,42(m, 1H), 7,46 (t, J=8, 1H), 7,79 (m, 2H). 13 С-ЯМР (, CDCl3): 36,5, 38,2, 45,6, 46,9,55,9, 107,0, 108,1, 110,7, 122,0, 124,7, 126,6,127,9, 128,4, 129,7, 130,9, 138,0, 138,3, 143,5,155, 8, 158,2, 176,8. МС (%): 387 (исходный+1, 100). Пример 32. 6-[(N-5-Изоксазолилметил)-4(пиперидин-4-ил)фенил]пиридин-2-иламин. Получали из соединения примера 13, используя 5-бромметилизоксазол для алкилирования 6-[4-(пиперидин-4-ил)фенил]пиридин-2 иламина в этилацетате, с 90% выходом, т.пл. 122-127 С. 1H-ЯМР (, СDСl3): 1,81 (m, 4 Н), 2,18 (m,2 Н), 2,485 (m, 1H), 3,00 (m, 2H), 3,735 (s, 2H),4,57 (широкий s, 2H, NH2), 6,17 (d, J=1,5, 1H),6,38 (d, J=8, 1H), 7,01 (d, J=8, 1H), 7,24 (m, 2H),7,43 (t, J=8, 1H), 7,81 (m, 2H), 8,18 (d, J=1,7, 1H). 13 С-ЯМР (, CDCl3): 33,2, 41,8, 53,4, 53,9,102,4, 106,8, 110,6, 126,8, 126,9, 137,7, 138,2,146,4, 150,1, 155,9, 158,2, 168,9. МС (%): 335 (исходный+1, 100). Анализ. Вычислено для С 20 Н 22N4O 1/4(С 4 Н 8O2): С 70,76, Н 6,79, N 15,72. Найдено: С 70,83, Н 6,62, N 15,73. Пример 33. 6-[(N-Ацетамидо)-4-(пиперидин-4-ил)фенил]пиридин-2-иламин. Получали из соединения примера 13, используя иодацетамид для алкилирования 6-[4(пиперидин-4-ил)фенил]пиридин-2-иламина, с 55% выходом, т.пл.224-227 С.(m, 1H), 2,51 (m, 2H), 2,88 (s, 2H), 2,91 (m, 4H),5,94 (d, J=4,5, 1H), 6,39 (d, J=8, 1H), 7,01 (d, J=7,1H), 7,19 (m, 1H), 7,30 (m, 2H), 7,44 (t, J=8, 1H),7,90 (m, 2H). 13 С-ЯМР (, ДМСО-d6): 33,0, 41,1, 54,0,61,7, 106,7, 108,0 126,3, 126,8, 137,3, 137,9,146,5, 154,3, 159,4, 172,0. МС (%): 311 (исходный+1, 100). Анализ. Вычислено для C18H22N4O1/2H2O: С 67,69, Н 7,26, N 17,54. Найдено: С 67,96, Н 7,03, N 17,37. Пример 34. 6-[(N-Бензоилметил)-4-(пиперидин-4-ил)фенил]пиридин-2-иламин. Получали из соединения примера 13, используя фенацилбромид для алкилирования 6[4-(пиперидин-4-ил)фенил]пиридин-2-иламина,с 75% выходом, т.пл. 180-200 С, в виде гидрохлоридной соли. 1(d, J=7,5, 1H), 7,28 (m, 2H), 7,45 (m, 3H), 7,55 (t,J=7,5, 1H), 7,83 (m, 2H), 8,01 (m, 2H). 13 С-ЯМР (, CDCl3): 33,2, 42,0, 54,6, 64,8,106,8, 110,6, 126,8, 127,0, 128,1, 128,5, 133,1,136,1, 137,6, 138,3, 146,7, 155,9, 158,1, 196,7. МС (%): 372 (исходный+1, 100). Анализ. Вычислено для C24H25N3O2HCl 3/4H2O: С 62,95, Н 6,27, N 9,18. Найдено: С 63,13, Н 6,38, N 9,07. Пример 35. 6-[N-(3,4-Диметоксибензил)-4(пиперидин-4-ил)фенил]пиридин-2-иламин. Получали из соединения примера 13, используя 3,4-диметоксибензилбромид для алкилирования 6-[4-(пиперидин-4-ил)фенил]пиридин-2-иламина, с 89% выходом, т.пл. 150-165 С,в виде гидрохлоридной соли. 1(m, 2H). 13 С-ЯМР (, СDСl3): 32,9, 42,2, 53,8, 55,91,55,935, 60,4, 62,8, 106,9, 110,7, 110,8, 112,6,121,7, 126,9, 127,1, 137,7, 138,3, 146,6, 148,3,156,1, 158,3. МС (%): 404 (исходный, 100). Анализ. Вычислено для С 25 Н 29N3O22 НСl 7/4 Н 2O: С 59,11, Н 6,85, N 8,27. Найдено: С 59,19, Н 6,92, N 8,21. Пример 36. 6-[N-(3,4-Метилендиоксибензил)-4-(пиперидин-4-ил)фенил]пиридин-2-иламин. Получали из соединения примера 13, используя 3,4-метилендиоксибензилбромид для алкилирования 6-[4-(пиперидин-4-ил)фенил] пиридин-2-иламина, с 82% выходом, т.пл. 150165 С, в виде гидрохлоридной соли.(s, 2H), 6,41 (d, J=8, 1H), 6,76 (m, 2H), 6,86 (s,1H), 7,02 (d, J=7,5, 1H), 7,27 (m, 2H), 7,46 (t, J=8,1H), 7,83 (m, 2H). 13 С-ЯМР (, CDCl3): 33,0, 42,2, 53,8, 62,8,100,9, 106,9, 107,9, 109,8, 110,7, 122,6, 126,9,127,1, 131,4, 137,7, 138,4, 146,7, 147,6, 156,1,158,3. МС (%): 388 (исходный+1, 100). Анализ. Вычислено для C24H25N3O2 3/2 Н 2O2 НСl: С 59,14, Н 6,20, N 8,62. Найдено: Н 6,32, N 8,53. Пример 37. 6-[(N-(2-Фурил)метил)-4-(пиперидин-4-ил)фенил]пиридин-2-иламин. Получали из соединения примера 1, используя фурфурилбромид для алкилирования 6[4-(пиперидин-4-ил)фенил]пиридин-2-иламина,со 100% выходом, т.пл. 75-95 С, в виде гидрохлоридной соли. 1(m, 2H), 2,49 (m, 1H), 3,02 (m, 2H), 3,56 (s, 2H),4,6 (широкий s, 2H, NH2), 6,21 (m, 1H), 6,30 (m,1H), 6,38 (d, J=8, 1H), 7,00 (d, J=7,5, 1H), 7,25 (m,2H), 7,37 (m, 1H), 7,43 (t, J=7,5, 1H), 7,80 (m,2H). 13 С-ЯМР (, СDСl3): 33,1, 42,1, 53,8, 55,0,136,8, 128,8, 110,0, 110,6, 126,8, 127,0, 137,6,138,2, 142,1, 146,7, 151,6, 156,0, 158,2. МС (%): 334 (исходный+1, 100). Анализ. Вычислено для C12H23N3O2HCl 3/4H2O: С 57,60, Н 6,56, N 9,60. Найдено: С 57,66, Н 6,69, N 9,47. Пример 38. N-[4'-(6-Аминопиридин-2-ил) бифенил-4-илметил]-5,6-диметокси-1,2,3,4 тетрагидроизохинолин. Получали как в примере 2, используя 5,6 диметокси-1,2,3,4-тетрагидроизохинолин на стадии восстановительного аминирования, с 88% выходом на стадии конечного деблокирования, т.пл. 205-209 С. 1(m, 3 Н), 7,5-7,5 (m, 4H), 7,85 (m, 2H). 13 С-ЯМР (, CDCl3): 28,2, 50,6, 55,4, 55,8,62,2, 107,5, 139,5, 110,9, 111,4, 125,9, 126,1,126,9, 127,0, 127,3, 129,9, 136,7, 138,5, 138,6,140,9, 147,2, 147,5, 155,5, 158,6. МС (%): 452 (исходный+1, 100). Анализ. Вычислено для C29H29N3O2 1/2H2O: С 75,63, Н 6,57, N 9,12. Найдено: С 75,75, Н 6,37, N 9,20. Пример 39. 6-[(N-(5-Изотиазолил)метил)4-(пиперидин-4-ил)фенил]пиридин-2-иламин. Получали из соединения примера 13, используя 5-изотиазолилбромид для алкилирования 6-[4-(пиперидин-4-ил)фенил]пиридин-2-иламина, с 95% выходом, т.пл. 140-145 С.H-ЯМР (, CDCl3): 1,795 (m, 4H), 2,16 (m,2H), 2,49 (m, 1H), 3,02 (m, 4H), 3,835 (s, 2H),6,385 (d, J=8, 1H), 6,96 (d, J=7,5, 1H), 7,06 (s,1H), 7,24 (m, 2H), 7,42 (t, J=8, 1H), 7,75 (m, 2H),8,35 (s, 1H). 13 С-ЯМР (, CDCl3): 33,1, 41,9, 54,1, 55,4,107,1, 110,75, 122,2, 126,9, 127,0, 1337,6, 138,4,146,5, 155,9, 157,4, 158,3, 166,6. МС (%): 351 (исходный+1, 100). Анализ. Вычислено для C20H22N4S1/2H2O: С 66,82, Н 6,45, N 15,58. Найдено: С 67,08, Н 6,51, N 15,23. Пример 40. 6-[(N-(5-Тиазолил)метил)-4(пиперидин-4-ил)фенил]пиридин-2-иламин. Получали из соединения примера 13, используя 5-тиазолилбромид для алкилирования 6-[4-(пиперидин-4-ил)фенил]пиридин-2-иламин,с 99% выходом, т.пл.151-154 С. 1(широкий s, 2H, NH2), 6,39 (d, J=8, 1H), 7,01 (d,J=7, 1H), 7,25 (m, 2H), 7,44 (t, J=8, 1H), 7,70 (s,1H), 7,81 (m, 2H), 8,74 (s, 1H). 13 С-ЯМР (, CDCl3): 33,2, 42,1, 53,8, 54,3,106,8, 110,6, 126,8, 127,0, 136,4, 137,6, 138,3,141,7, 146,6, 153,3, 156,0, 158,2. МС (%): 351 (исходный+1, 100). Анализ. Вычислено для C20H22N4S: С 68,54, Н 6,33, N 15,99. Найдено: С 68,21, Н 6,49,N 15,63. Пример 41. 6-[(N-(2-Пиридил)метил)-4(пиперидин-4-ил)фенил]пиридин-2-иламин. Получали из соединения примера 13, используя 2-пиридилбромид для алкилирования 6[-4-(пиперидин-4-ил)фенил]пиридин-2-иламина,с 97% выходом, т.пл. 180-190 С, в виде гидрохлоридной соли. 1(широкий s, 2H, NH2), 6,38 (d, J=8, 1H), 7,02 (d,J=7,5, 1H), 7,14 (m, 1H), 7,26 (m, 2H), 7,43 (m,2H), 7,64 (t, J=8, 1H), 7,81 (m, 2H), 8,55 (m, 1H). 13 С-ЯМР (, CDCl3): 33,2, 42,2, 54,4, 64,9,106,8, 110,6, 121,9, 123,2, 126,8, 127,0, 136,3,137,6, 138,2, 146,8, 149,1, 156,0, 158,2, 158,7. МС (%): 345 (исходный+1, 100). Анализ. Вычислено для C22H24N42HCl 7/4H2O: С 58,86, Н 6,62, N 12,48. Найдено С 58,99, Н 6,66, N 12,24. Пример 42. 6-[(N-(3-Пиридил)метил)-4(пиперидин-4-ил)фенил]пиридин-2-иламин. Получали из соединения примера 13, используя 3-пиридилбромид для алкилирования 6[4-(пиперидин-4-ил)фенил]пиридин-2-иламина,с 86% выходом, т.пл. 202-215 С, в виде гидрохлоридной соли. 1 7,69 (m, 1H), 7,82 (m, 2H), 8,49 (m, 1H), 8,54 (m,1H). 13 С-ЯМР (, CDCl3): 33,1, 42,1, 54,1, 60,4,106,8, 110,6, 123,3, 126,8, 127,0, 133,7, 136,8,137,6, 146,6, 148,4, 150,3, 155,9, 158,2. МС (%): 345 (исходный+1, 100). Анализ. Вычислено для С 22 Н 24N43 НСl 3/2 Н 2O: С 54,95, Н 6,29, N 11,65. Найдено: С 54,93, Н 6,51, N 11.31. Пример 43. 6-[(N-(2-Имидазолил)метил)-4(пиперидин-4-ил)фенил]пиридин-2-иламин. Получали из соединения примера 13, используя 2-имидазолилальдегид для восстановительного аминирования 6-[4-(пиперидин-4-ил) фенил]пиридин-2-иламина, с 88% выходом,т.пл. 160-163 С. 1 Н-ЯМР (, CDCl3): 1,81 (m, 4H), 2,28 (m,2H), 2,54 (m, 1H), 3,00 (m, 2H), 3,75 (широкий s,2H), 6,395 (d, J=8, 1H), 6,94 (m, 1H), 7,00 (d,J=7,5, 1H), 7,20 (m, 2H), 7,43 (t, J=8, 1H), 7,79(m, 2H). 13 С-ЯМР (, CDCl3): 32,6, 41,6, 54,0, 55,7,107,0, 110,7, 127,0, 137,9, 138,4, 146,0, 155,9,158,3. МС (%): 334 (исходный+1, 100). Анализ. Вычислено для С 20 Н 23N5 1/2 Н 2 СО 3: С 67,56, Н 6,64, N 19,22. Найдено: С 67,48, Н 6,89, N 18,91. Пример 44. 6-[(N-(4-Имидазолил)метил)-4(пиперидин-4-ил)фенил]пиридин-2-иламин. Получали из соединения примера 13, используя 4-имидазолилальдегид для восстановительного аминирования 6-[4-(пиперидин-4-ил) фенил]пиридин-2-иламина, с 92% выходом,т.пл. 210 С (разл.), в виде гидрохлоридной соли. 1C20H33N5 1/2H2CO3: С 67,56, Н 6,64, N 19,22. Найдено: С 67,99, Н 6,72, N 19,07. Пример 45. 6-[(N-(4-Пиридил)метил)-4(пиперидин-4-ил)фенил]пиридин-2-иламин. Получали из соединения примера 13, используя 4-пиридинкарбоксальдегид для восстановительного аминирования 6-[(пиперидин-4 ил)фенил]пиридин-2-иламина, с 74% выходом, в виде гидрохлоридной соли. 1 С-ЯМР (, CDCl3): 33,4, 42,2, 54,4, 62,1,106,9, 110,7, 123,9, 126,9, 127,1, 137,7, 138,3,146,7, 148,1, 149,7, 156,0, 158,3. МС (%): 345 (исходный+1, 100). Анализ. Вычислено для C22H24N45/4H2O: С 72,00, Н 7,28, N 15,27. Найдено: С 72,23, Н 6,97,N 15,47. Пример 46. 6-[(N-(2-Фурил)метил)-4-(пирролидин-3-ил)фенил]пиридин-2-иламин. А. Диэтил-4-[2-(2,5-диметилпирролил)-6 пиридил]бензилиденмалонат. В круглодонную колбу емкостью 125 мл,снабженную впускным патрубком для N2, добавляли 3,3 г (11,96 ммоль) 2-(2,5-диметилпирролил)-6-(4-(4'-формилбифенил-4-илпиридина (пример 1 Б), 1,9 г (11,96 ммоль) диэтилмалоната, 60 мл бензола, 51 мг (0,6 ммоль) пиперидина и 10 мг бензойной кислоты. Реакционную смесь нагревали при температуре дефлегмации в течение ночи, охлаждали и вливали в воду и этилацетат. Органический слой промывали 1 н. соляной кислотой, водным раствором бикарбоната натрия и рассолом, сушили над сульфатом натрия и выпаривали. Остаток хроматографировали на силикагеле, используя метиленхлорид/этилацетат, с получением продукта в виде желтого масла, 4,32 г (86,5%). 1H-ЯМР (, CDCl3): 1,31 (t, J=7, 3H), 1,34 (t,J=7, 3H), 2,21 (s, 6H), 4,33 (q, J=7, 2H), 4,35 (q,J=7, 2H), 5,93 (s, 2H), 7,17 (d, J=8, 1H), 7,55 (m,2H), 7,77 (m, 2H), 7,87 (t, J=8, 1H), 8,09 (m, 2H). 13 С-ЯМР (, CDCl3): 13,5, 14,0, 14,2, 61,7,61,8, 106,1, 118,5, 120,5, 126,7, 127,2, 128,6,129,9, 130,1, 133,7, 138,8, 140,2, 141,3, 151,8,155,6, 164,1, 166,7. ИК (чистый, см-1): 1727 (С=O). МС (%): 419 (исходный+1, 100). Б. Этил-3-[2-(2,5-диметилпирролил)-6 пиридил]фенил-3-цианопропионат. В круглодонную колбу емкостью 250 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 4,32 г (10,33 ммоль) диэтил-4-[2-(2,5-диметилпирролил)-6-пиридил] бензилиденмалоната и 100 мл этанола. К перемешиваемому раствору добавляли раствор 672 мг (10,33 ммоль) цианида калия в 2,6 мл воды и реакционную смесь нагревали при 60 С в течение ночи. Реакционную смесь охлаждали и гасили разбавленной соляной кислотой, затем переносили в этилацетат и промывали кислотой и рассолом, сушили над сульфатом натрия и выпаривали. Остаток хроматографировали на силикагеле, используя метиленхлорид/этилацетат в качестве элюента, с получением 3,00 г (78%) масла. 1 Н-ЯМР (, CDCl3): 2,21 (s, 6H), 2,96 (m,2H), 3,71 (s, 3H), 4,355 (t, J=7, 1H), 5,93 (s, 2H),7,17 (d, J=8, 1H), 7,47 (m, 2H), 7,74 (d, J=8, 1 Н),7,89 (t, J=8, 1H), 8,09 (m, 2H). С-ЯМР (, CDCl3): 13,5, 32,9, 39,7, 52,4,107,1, 118,4, 113,75, 120,3, 127,8, 128,6, 135,4,138,8, 151,8, 155,8, 169,5. ИК (чистый, см-1): 2244 (CN), 1739 (С=O). МС (%): 374 (исходный+1, 100). В. 2-(2,5-Диметилпирролил)-6-[4-(2-оксопирролидин-3-ил)фенил]пиридин. В круглодонную колбу емкостью 125 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 2,84 г (7,61 ммоль) этил-3-[2-(2,5-диметилпирролил)-6-пиридил] фенил-3-цианопропионата, 50 мл этанола и 1 мл концентрированной соляной кислоты. Раствор нагревали после добавления 700 мг 10% палладия-на-угле и 2,4 г (38,07 ммоль) формиата аммония и реакционную смесь нагревали при 80 С в течение 4,75 ч с добавлением дополнительных количеств катализатора и формиата аммония с промежутками в 1 ч. Реакционную смесь охлаждали и фильтровали через Celite и фильтрат выпаривали. Остаток переносили в этилацетат,промывали водным раствором гидроксида натрия, сушили над сульфатом натрия и выпаривали. Остаток переносили в 50 мл сухого толуола, обрабатывали 5 мл триэтиламина и нагревали при температуре дефлегмации в течение 1 ч. Реакционную смесь затем охлаждали, промывали разбавленной водной соляной кислотой и рассолом, сушили над сульфатом натрия и выпаривали. Остаток хроматографировали на силикагеле, используя метиленхлорид/метанол в качестве элюента, с получением 204,5 мг (8,1%) масла. 1 Н-ЯМР (, CDCl3): 2,21 (s, 6H), 2,64 (AB,J=8,5, 17, Dn=94, 2H), 3,43 (dd, J=7,9, 1H), 3,73(m, 1H), 3,80 (m, 1H), 5,92 (s, 2H), 7,02 (bs, 1H),7,13 (d, J=8, 1H), 7,34 (m, 2H), 7,72 (d, J=8, 1H),7,86 (t, J=8, 1H), 8,04 (m, 2H). 13 С-ЯМР (, СDСl3): 13,5, 38,0, 40,0, 49,5,107,0 118,2, 119,9 127,2, 127,4, 128,7, 137,3,138,7, 143,5, 151,7, 156,3, 177,8. ИК (чистый, cм-1): 1708 и 1685 (С=O). МС (%): 332 (исходный+1, 100). Г. 2-(2,5-Диметилпирролил)-6-[4-(пирролидин-3-ил)фенил]пиридин. В круглодонную колбу емкостью 125 мл,снабженную конденсатором и впускным патрубком для N2, добавляли 230 мг (1,73 ммоль) хлорида алюминия и 8 мл сухого тетрагидрофурана. Раствор охлаждали до 0 С и добавляли 4,04 мл (4,04 ммоль) 1,0 М раствора алюмогидрида лития в тетрагидрофуране. Реакционную смесь перемешивали 20 мин при комнатной температуре и охлаждали до -70 С. Реакционную смесь обрабатывали раствором 191 мг(0,577 ммоль) 2-(2,5-диметилпирролил)-6-[4(пирролидин-3-ил)фенил]пиридина в 2 мл сухого тетрагидрофурана и перемешивали 1 ч при-70 С и в течение 14 ч при комнатной температуре. Реакционную смесь осторожно гасили разбавленной соляной кислотой, затем перено 002907 48 сили в метиленхлорид и водный раствор гидроксида натрия и объединенный органический слой промывали водой, сушили над сульфатом натрия и выпаривали с получением 145 (79%) масла. 1H-ЯМР (, CDCl3): 1,90 (m, 1H), 2,21 (s,6H), 2,27 (m, 1H), 2,89 (dd, J=8,10, 1H), 3,11 (m,1H), 3,19 (m, 1H), 3,28 (t, J=8, 1H), 3,40 (dd,J=8,10, 1H), 3,5 (bs, 1H), 5,92 (s, 2H), 7,10 (d, J=8,1H), 7,33 (m, 2H), 7,70 (d, J=8, 1H), 7,83 (t, J=8,1H), 8,00 (m, 2H). 13 С-ЯМР (, CDCl3): 13,5, 34,4, 45,3, 47,2,54,8, 106,9, 118,1, 119,7, 125,5, 127,1, 127,2,127,4, 127,6, 128,6, 136,5, 138,6, 145,3, 151,6,156,6. МС (%): 318 (исходный+1, 100). Д. 2-(2,5-Диметилпирролил)-6-[(N-(-2 фурил)метил)-4-(пирролидин-3-ил)фенил] пиридин. Получали, используя процедуру примера 43 для проведения восстановительного аминирования с использованием фурфурола, с 65% выходом в виде масла. 1H-ЯМР (, CDCl3): 1,90 (m, 1H), 2,34 (m,1 Н), 2,51 (t, J=9, 1H), 2,70 (m, 1H), 2,93 (m, 1H),3,13 (t, J=9, 1H), 3,65 (m, 1H), 3,69 (Abq, J=14,Dn=21, 2H), 4,55 (bs, 2H, NH2), 6,19 (d, J=3, 1H),6,30 (dd, J=2,3, 1H), 6,40 (d, J=8, 1H), 7,02 (d,J=7, 1H), 7,29 (m, 2H), 7,36 (m, 1H), 7,45 (t, J=8,1H), 7,81 (m, 2H). 13 С-ЯМР (, CDCl3): 33,1, 43,1, 52,0, 54,2,61,75, 106,8, 107,7, 110,0, 110,6, 126,8, 127,1,127,4, 167,6, 138,3, 141,9, 145,5, 152,6, 155,9,158,2. МС (%): (исходный+1, 100). Анализ. Вычислено для С 20H21N3 О 2 НСl 5/3 Н 2O: С 56,88, Н 6,28, N 9,95. Найдено: С 56,67, Н 6,11, N 10,15. Пример 47. 6-[(N-(2-Метил)пропил)-4(пирролидин-3-ил)фенил]пиридин-2-иламин. Получали как в примере 46, используя изобутиральдегид, с 73% выходом на конечной стадии деблокирования с получением продукта в виде твердого вещества, т.пл. 55-70 С.(m, 1H), 1,87 (m, 1H), 2,2-2,4 (m, 3H), 2,49 (dd,J=8,9, 1H), 2,64 (m, 1H), 2,76 (m, 1H), 2,98 (t,J=9, 1H), 3,37 (h, J=7, 1H), 4,56 (bs, 2H, NH2),6,40 (d, J=8, 1H), 7,03 (d, J=7,5, 1H), 7,32 (m, 2H),7,45 (t, J=8, 1H), 7,81 (m, 2H). 13 С-ЯМР (, CDCl3): 21,0, 27,4, 33,2, 43,0,54,9, 62,4, 64,9, 106,8, 110,7, 126,8, 127,5, 137,5,138,3, 146,4, 156,0, 158,2. МС (%): 296 (исходный+1, 100). Анализ. Вычислено для C19H25N32HCl 2H2O: С 56,43, Н 7,73, N 10,39. Найдено: С 56,13, Н 7,52, N 10,40. Пример 48. 8-[4-(6-Аминопиридин-2-ил) фенил]-3-изобутил-3-азабицикло[3.2.1]октан-8 ол. А. 8-[4-(6-(2,5-Диметилпирролил)пиридин 2-ил)фенил]-3-бензил-3-азабицикло[3.2.1]октан-8-ол. В 3-горлую круглодонную колбу емкостью 125 мл, снабженную мембраной и впускным патрубком для N2, добавляли 1,86 г (5,70 ммоль) 6-бром-2-(2,5-диметилпирролил)пиридина и 40 мл сухого тетрагидрофурана. Раствор охлаждали до -60 С и по каплям добавляли 2,73 мл (6,84 ммоль) 2,5 М раствора бутиллития в гексане и раствор перемешивали 10 мин при -60 С. Затем по каплям добавляли раствор 1,47 г (6,84 ммоль) 3-бензил-3-аза-бицикло[3.2.1]октан-8-она в 15 мл сухого тетрагидрофурана, и реакционную смесь перемешивали при -60 С в течение 10 мин, а затем при комнатной температуре в течение 3 ч. Реакционную смесь гасили водным раствором хлорида аммония и переносили в этилацетат. Органический слой отделяли и промывали дополнительно водным раствором хлорида аммония и рассолом, сушили над сульфатом натрия и выпаривали. Остаток хроматографировали на силикагеле, используя метанол и метиленхлорид, с получением 413 мг (16%) желтого масла, которое затвердело, т.пл. 58-68 С. 1(m, 2H). 13 С-ЯМР (, CDCl3): 20,8, 25,15, 25,6, 41,5,54,4, 65,6, 78,45, 107,4, 111,1, 125,6, 127,0, 138,6,138,8, 155,7, 158,4. МС (%): 352 (исходный=1, 100). Анализ. Вычислено для С 22 Н 29N3 О 2 НСl Н 2O: С 57,64, Н 7,26, N 9,17. Найдено: С 57,60,Н 7,34, N 8,84. Пример 49. 8-[4-(6-Аминопиридин-2-ил) фенил]-3-фуран-2-илметил-3-аза-бицикло[3.2.1] октан-8-ол. Получали как в примере 48, используя фурфурол, с 33% выходом на конечной стадии деблокирования с получением продукта в виде твердого вещества, т.пл. 187-202 С. 1 Н-ЯМР (, CDCl3): 1,41 (m, 2H), 1,78 (m,2 Н), 2,435 (m, 2H), 2,65 (m, 2H), 3,00 (m, 2H),3,68 (s, 2H), 4,52 (bs, 2H, NH2), 6,24 (d, J=3, 1H),6,32 (dd, J=2,3, 1H), 6,415 (d, J=8, 1H), 7,03 (d,J=7,5, 1H), 7,37 (d, J=2, 1H), 7,46 (t, J=8, 1H),7,50 (m, 2H), 7,84 (m, 2H). 13 С-ЯМР (, CDCl3): 25,1, 41,5, 53,6, 53,8,78,5, 107,3, 108,6, 110,1, 111,0 125,6, 127,0,138,4, 139,0, 141,9, 145,1, 155,6, 158,3. МС (%): 376 (исходный+1, 100). Анализ. Вычислено для С 23 Н 25N3O22HСl 51 Получали как в примере 46, деблокируя после стадии А, с получением продукта в виде твердого вещества, т.пл. 185-200 С (разл.). 1 где R1 и R2 независимо выбраны из водорода,гидрокси, метила и метокси; и G является группой формулы где n равно нулю или единице;Y представляет собой NR3R4, (С 1-С 6)алкил или аралкил, где арильная группировка указанного аралкила является фенилом или нафтилом,а алкильная группировка является нормальной или разветвленной и содержит от 1 до 6 атомов углерода и где указанный (С 1-С 6)алкил и арильная группировка указанного аралкила могут быть замещены заместителями в количестве от нуля до трех, которые независимо выбраны из гало, нитро, гидрокси, циано, амино, (С 1 С 4)алкокси и (С 1-С 4)алкиламино; Х представляет собой N, когда Y являетсяR3 и R4 независимо выбраны из (С 1 С 6)алкила, тетрагидронафталина и аралкила, где арильная группировка указанного аралкила является фенилом или нафтилом, а алкильная группировка является нормальной или разветвленной и содержит от 1 до 6 атомов углерода и где указанный (С 1-С 6)алкил и указанный тетрагидронафталин и арильная группировка указанного аралкила могут быть замещены заместителями в количестве от нуля до трех, которые независимо выбраны из гало, нитро, гидрокси,циано, амино, (С 1-С 4)алкокси и (С 1-С 4)алкиламино; или R3 и R4 вместе с азотом, к которому они присоединены, образуют возможно замещенное пиперазиновое, возможно замещенное пиперидиновое или возможно замещенное пирролидиновое кольцо или азабициклическое кольцо, содержащее от 6 до 14 кольцевых членов, от 1 до 3 из которых являются азотом, а остальные являются углеродом; или фармацевтически приемлемая соль такого соединения. 2. Соединение по п.1, где q равно нулю или единице. 3. Соединение по п.1, где NR3R4 является пиперидиновым, пиперазиновым или пирролидиновым кольцом или 3-аза-бицикло[3.1.0]гекс 6-иламинным кольцом и где указанные пиперазиновое, пиперидиновое и пирролидиновое кольца возможно могут быть замещены одним или более чем одним заместителями, которые независимо выбраны из амино, (С 1-С 6)алкиламино, [ди-(С 1 С 6)алкил]амино, замещенных фенилом 5-6 членных гетероциклических колец, содержащих от 1 до 4 кольцевых атомов азота, бензоила,бензоилметила, бензилкарбонила, фениламинокарбонила, фенилэтила и феноксикарбонила, и где указанные фенильные группировки любого из вышеуказанных заместителей возможно могут быть замещены одним или более чем одним заместителями, которые независимо выбраны из гало, (С 1-С 3)алкила, (С 1-С 3)алкокси, нитро, амино, циано, CF3 и OCF3,и фармацевтически приемлемые соли таких соединений. 4. Соединение по п.3, где указанные пиперазиновое, пиперидиновое и пирролидиновоеNR3R4 кольца замещены заместителями в количестве от нуля до двух и где фенильные группировки любого из указанных заместителей замещены заместителями в количестве от нуля до двух. 5. Соединение по п.1, где NR3R4 является 4-фенилэтилпиперазин-1-илом, 4-метилпиперазин-1-илом, фенетиламино или 3-аза-бицикло где NR5R6 представляет собой NН 2. 7. Соединение по п.1, где (С 1-С 6)алкильные и арильные группы Y и (С 1-С 6)алкильные,арильные и тетрагидронафталиновые группы R3 и R4, каждая независимо, замещены заместителями в количестве от нуля до двух, выбранными независимо из хлоро, фторо, бромо, иодо, нитро,гидрокси, циано, амино, (С 1-С 6)алкокси и (С 1 С 4)алкиламино. 8. Соединение, выбранное из группы, состоящей из 6-[4-2-(фенетил)-[2.2.1]бициклогепт-1 ил)метил)фенил]пиридин-2-иламина; 6-[4-2-(3-аза-бицикло[3.1.0]гекс-6-иламино)-[2.2.1]бициклогепт-1-ил)метил)фенил] пиридин-2-иламина; 6-[2-(N-фенетиламино)-5-фенилциклогексилметил)метил)фенил]пиридин-2-иламина; 6-[4-2-(фенетил)-[2.2.1]бициклогепт-1 ил)метил)фенил]пиридин-2-иламина; 6-[2-(3-аза-бицикло[3.1.0]гекс-6-иламино)-5-фенилциклогексилметил)метил)фенил] пиридин-2-иламина; где R1 и R2 независимо выбраны из водорода,гидрокси, метила и метокси; где n равно нулю или единице;Y представляет собой водород, NR3R4, (С 1 С 6)алкил или аралкил, где арильная группировка указанного аралкила является фенилом, нафтилом, изоксазолилом, метилендиоксибензилом,имидазолилом, пиридилом, фурилом, тиазолилом или изотиазолилом, а алкильная группировка является нормальной или разветвленной и содержит от 1 до 6 атомов углерода и где указанный (C1-С 6)алкил и арильная группировка указанного аралкила могут быть замещены заместителями в количестве от одного до трех,предпочтительно заместителями в количестве от нуля до двух, которые независимо выбраны из фенила,-C(O)NH2,-С(O)фенила,галоR3 и R4 независимо выбраны из водорода,(С 1-С 6)алкила, -C(O)(C1-С 5)алкила, циклогексила, тетрагидронафталина и аралкила, где арильная группировка указанного аралкила является фенилом или нафтилом, а алкильная группировка является нормальной или разветвленной и содержит от 1 до 6 атомов углерода и где указанный (С 1-С 6)алкил или -С(O)(С 1-С 5)алкил и указанный тетрагидронафталин и арильная группировка указанного аралкила могут быть замещены заместителями в количестве от одного до трех, предпочтительно заместителями в количестве от нуля до двух, которые независимо выбраны из фенила, гало (например, хлоро,фторо, бромо или иодо), нитро, гидрокси, циано,амино, (С 1-С 4)алкокси и (С 1-С 4)алкиламино; или R3 и R4 вместе с азотом, к которому они присоединены, образуют пиперазиновое,пиперидиновое или пирролидиновое кольцо или азабициклическое кольцо, содержащее от 6 до 14 кольцевых членов, от 1 до 3 из которых являются азотом, а остальные являются углеродом; и где указанные пиперазиновое, пирролидиновое и азабициклическое кольца, образованные R3 и R4, возможно могут быть замещены одним или более чем одним заместителями,предпочтительно заместителями в количестве от нуля до двух, которые независимо выбраны из(С 1-С 6)алкила, амино, (С 1-С 6)алкиламино, [ди(С 1-С 6)алкил]амино,(С 1-С 6)алкилацетамидо,замещенных фенилом 5-6-членных гетероциклических колец, содержащих от 1 до 4 кольцевых атомов азота, бензоила, бензоилметила,бензилкарбонила, фениламинокарбонила, фенилэтила и феноксикарбонила, и где фенильные группировки любого из вышеуказанных заместителей возможно могут быть замещены одним или более чем одним заместителями, предпочтительно заместителями в количестве от нуля до двух, которые независимо выбраны из гало, (С 1 С 6)алкила, (С 1-С 6)алкокси, нитро, амино, циано,СF3 и OCF3; или фармацевтически приемлемая соль такого соединения. 10. Соединение, выбранное из группы, состоящей из 6-[(N-(5-изотиазолил)метил)-4-(пиперидин-4-ил)фенил]пиридин-2-иламина; 6-[(N-(5-тиазолил)метил)-4-(пиперидин-4 ил)фенил]пиридин-2-иламина; 6-[(N-(2-фурил)метил)-4-(пирролидин-3 ил)фенил]пиридин-2-иламина; 6-[(N-(2-метил)пропил)-4-(пирролидин-3 ил)фенил]пиридин-2-иламина. 11. Фармацевтическая композиция для лечения или предупреждения состояния, выбранного из группы, состоящей из мигрени, воспа 002907 56 лительных заболеваний, удара, острой и хронической боли, гиповолемического шока, травматического шока, реперфузионного повреждения,болезни Крона, язвенного колита, септического шока, рассеянного склероза, связанной со СПИДом деменции, нейродегенеративных заболеваний, нейрональной интоксикации, болезни Альцгеймера, химических зависимостей и аддикций, рвоты, эпилепсии, тревоги, психоза,травмы головы, респираторного дистресссиндрома взрослых (РДСВ), индуцированных морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона,болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической невропатии, диабетической нефропатии и рака у млекопитающего,содержащая количество соединения по пп.1, 8 или 9, которое является эффективным при лечении или предупреждении такого состояния, и фармацевтически приемлемый носитель. 12. Способ лечения или предупреждения состояния, выбранного из группы, состоящей из мигрени, воспалительных заболеваний, удара,острой и хронической боли, гиповолемического шока, травматического шока, реперфузионного повреждения, болезни Крона, язвенного колита,септического шока, рассеянного склероза, связанной со СПИДом деменции, нейродегенеративных заболеваний, нейрональной интоксикации, болезни Альцгеймера, химических зависимостей и аддикций, рвоты, эпилепсии, тревоги,психоза, травмы головы, респираторного дистресс-синдрома взрослых (РДСВ), индуцированных морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита,овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической невропатии,диабетической нефропатии и рака у млекопитающего, при котором указанному млекопитающему вводят количество соединения по пп.1, 8 или 9, которое является эффективным при лечении или предупреждении такого состояния. 13. Фармацевтическая композиция для ингибирования синтазы оксида азота (NOS) у млекопитающего, содержащая эффективное для ингибирования NOS количество соединения по пп.1, 8 или 9 и фармацевтически приемлемый носитель. 14. Способ ингибирования NOS у млекопитающего, при котором указанному млекопитающему вводят эффективное для ингибирования NOS количество соединения по пп.1, 8 или 9. 15. Фармацевтическая композиция для лечения или предупреждения состояния, выбран 57 ного из группы, состоящей из мигрени, воспалительных заболеваний, удара, острой и хронической боли, гиповолемического шока, травматического шока, реперфузионного повреждения,болезни Крона, язвенного колита, септического шока, рассеянного склероза, связанной со СПИДом деменции, нейродегенеративных заболеваний, нейрональной интоксикации, болезни Альцгеймера, химических зависимостей и аддикций, рвоты, эпилепсии, тревоги, психоза,травмы головы, респираторного дистресссиндрома взрослых (РДСВ), индуцированных морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона,болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической невропатии, диабетической нефропатии и рака у млекопитающего,содержащая эффективное для ингибированияNOS количество соединения по пп.1, 8 или 9 и фармацевтически приемлемый носитель. 16. Способ лечения или предупреждения состояния, выбранного из группы, состоящей из 58 мигрени, воспалительных заболеваний, удара,острой и хронической боли, гиповолемического шока, травматического шока, реперфузионного повреждения, болезни Крона, язвенного колита,септического шока, рассеянного склероза, связанной со СПИДом деменции, нейродегенеративных заболеваний, нейрональной интоксикации, болезни Альцгеймера, химических зависимостей и аддикций, рвоты, эпилепсии, тревоги,психоза, травмы головы, респираторного дистресс-синдрома взрослых (РДСВ), индуцированных морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита,овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической невропатии,диабетической нефропатии и рака у млекопитающего, при котором указанному млекопитающему вводят эффективное для ингибирования NOS количество соединения по пп.1, 8 или 9.
МПК / Метки
МПК: A61P 11/06, A61K 31/4418, C07D 213/73
Метки: ингибиторов, полезные, производные, качестве, 6-фенилпиридил-2-амина
Код ссылки
<a href="https://eas.patents.su/30-2907-proizvodnye-6-fenilpiridil-2-amina-poleznye-v-kachestve-ingibitorov-nos.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 6-фенилпиридил-2-амина, полезные в качестве ингибиторов nos</a>
Предыдущий патент: Производные трифторметилалкиламинотриазолопиримидина, способ их получения, фунгицидная композиция, применение и способ подавления грибов в локусе
Следующий патент: Фармацевтические композиции на основе тизоксанида и нитазоксанида
Случайный патент: Электрохимический элемент с намотанной сердцевиной


































