Производные 6-фенилпиридил-2-амина
Формула / Реферат
1. Соединение формулы
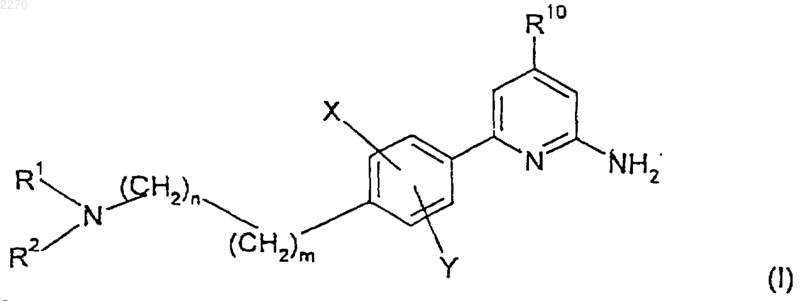
и его фармацевтически приемлемые соли, где
R1 и R2 образуют вместе с азотом, к которому они присоединены, азабициклическое кольцо, содержащее от 6 до 14 членов кольца, из которых от 1 до 3 являются азотом, а остальные являются углеродом;
n обозначает 0, 1 или 2; и каждый углерод указанной (CH2)n возможно может быть замещен заместителем R8;
m обозначает 0, 1 или 2; и каждый углерод указанной (СН2)m возможно может быть замещен заместителем R9;
каждый R8 и каждый R9 независимо выбран из (С1-С4)алкила, арил(С1-С4)алкила, причем указанный арил выбран из фенила и нафтила; аллила и феналлила;
Х и Y независимо выбраны из группы, содержащей метил, метокси-, гидрокси-, и водород; и
R10 обозначает водород или (С1-С6)алкил;
при условии, что R8 отсутствует, когда n равно 0, и R9 отсутствует, когда m равно 0,
или фармацевтически приемлемая соль такого соединения.
2. Соединение по п.1, где R1 и R2 вместе с азотом, к которому они присоединены, образуют азабициклическое кольцо, выбранное из следующих:
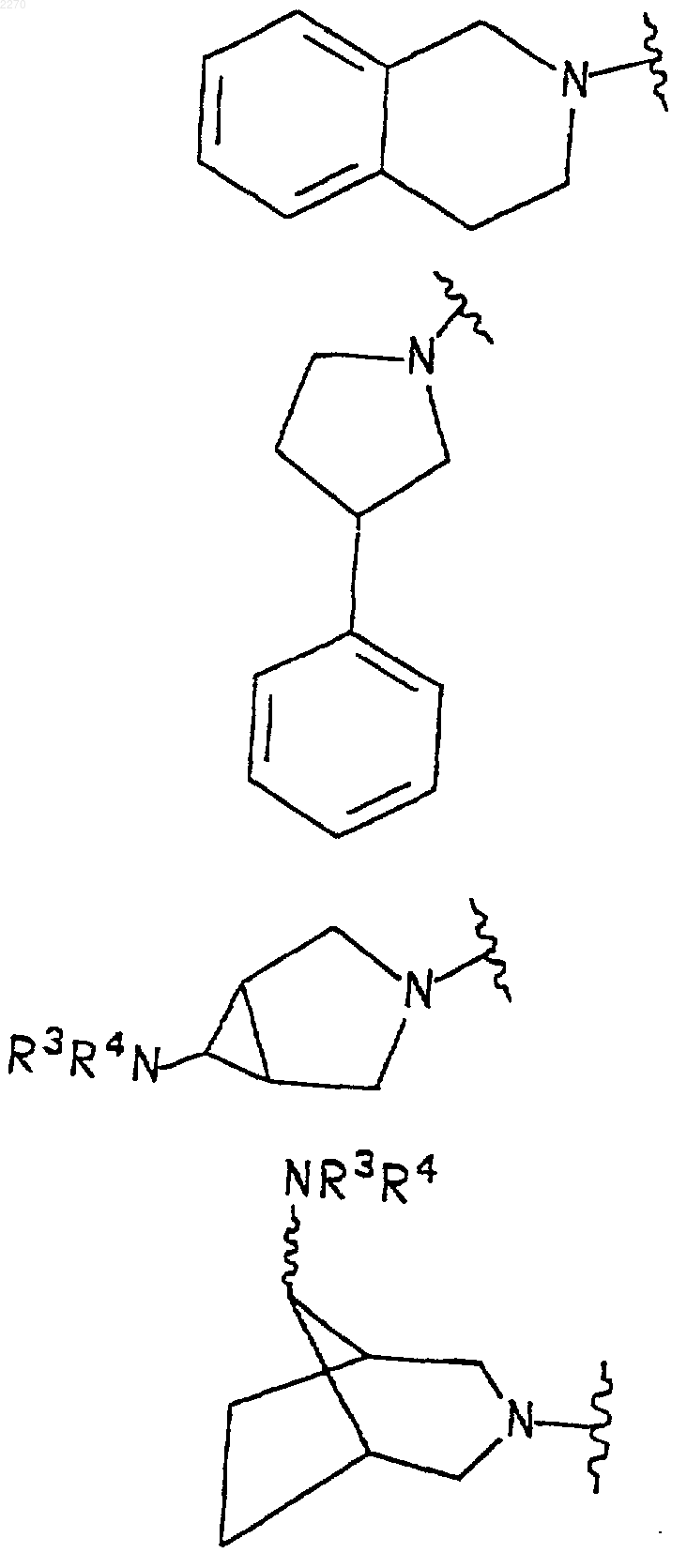
и

где R3 и R4 выбраны из группы, содержащей водород, (С1-С6)алкил, фенил, нафтил, (С1-С6)алкил-С(=O), НС(=O), (С1-С6)алкокси(С=O)-, фенил-С(=O)-, нафтил-С(=O)- и (R7)2NC(=O)-, где каждый R7 независимо выбран из водорода и (С1-С6)алкила; и
R5 выбран из группы, содержащей водород, (С1-С6)алкил, фенил, нафтил, фенил(С1-С6) алкил- и нафтил(С1-С6)алкил-.
3. Соединение, выбранное из следующих:
6-{4-[2-(4-фенетилпиперазин-1-ил)этил]фенил}пиридин-2-иламин;
6-((2-(6-(трет-бутоксикарбониламино)-3-азабицикло[3.1.0]гекс-3-ил)этил)фенил)пиридин-2-иламин;
3-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-3-азабицикло[3.1.0]гекс-6-иламин;
фениламид 4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-карбоновой кислоты;
1-(4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-ил)-2-фенилэтанон;
1-(4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-ил)-2-(4-фторфенил)этанон;
6-{4-[2-(3,4-дигидро-1Н-изохинолин-2-ил)этил]фенил}пиридин-2-иламин;
(4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-ил)фуран-2-ил-метанон;
6-{4-[(2-(4-m-толил)пиперазин-1-ил)этил]фенил}пиридин-2-иламин;
6-(4-{2-[4-(3-трифторметилфенил)пиперазин-1-ил]этил}фенил)пиридин-2-иламин;
1-(4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-ил)этанон;
1-(4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-ил)-2-метоксиэтанон;
1-(4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-ил)-2-феноксиэтанон;
(4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-ил)-циклопентилметанон;
6-{4-[2-(5-метил-2,5-диазабицикло[2.2.1]гепт-2-ил)этил]фенил}пиридин-2-иламин;
6-(4-{2-[4-(4-фенилтиазол-2-ил)пиперазин-1-ил]этил}фенил)пиридин-2-иламин;
2-(4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-ил)-1-фенилэтанон;
6-{4-[2-(4-изобутилпиперазин-1-ил)этил]фенил}пиридин-2-иламин;
6-{4-[2-(1,2,3,4-тетрагидронафталин-2-иламино)этил]фенил}пиридин-2-иламин;
6-{[(дибензиламино)этил]фенил}пиридин-2-иламин;
6-{4-[2-(8-азаспиро[4.5]дец-8-ил)этил]фенил}пиридин-2-иламин;
6-{4-[2-(4-диметиламинопиперидин-1-ил)этил]фенил}пиридин-2-иламин;
6-{4-[2-(1,3-дигидроизоиндол-2-ил)этил]фенил}пиридин-2-иламин;
2-(4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-ил)-N-изопропилацетамид;
этиловый эфир (4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-ил)уксусной кислоты;
(4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-ил)фенилметанон;
6-{4-[2-(3-фенилпирролидин-1-ил)-этил]фенил}пиридин-2-иламин;
6-(4-{2-[4-(1-фенил-1Н-тетразол-5-ил)пиперазин-1-ил]этил}фенил)пиридин-2-иламин;
2-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-1,2,3,4-тетрагидроизохинолин-3-карбоновая кислота;
(4-хлорфенил)-амид 4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-карбоновой кислоты;
паратолиламид 4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-карбоновой кислоты;
(4-метоксифенил)амид 4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-карбоновой кислоты;
циклогексиламид 4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-карбоновой кислоты;
фениловый эфир 4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-карбоновой кислоты;
6-(4-{2-[4-(1-фенил-1Н-имидазол-2-ил)пиперазин-1-ил]этил}фенил)пиридин-2-иламин;
6-[4-(2-фенетиламиноэтил)фенил]пиридин-2-иламин;
1-(3-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-3-азабицикло[3.1.0]гекс-6-ил)-3-фенилмочевина;
(3-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-3-азабицикло[3.1.0]гекс-6-ил)диметиламин;
N-(3-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-3-азабицикло[3.1.0]гекс-6-ил)-2-(4-фторфенил)ацетамид;
6-(4-{2-[4-(3-фенилаллил)пиперазин-1-ил]этил}фенил)пиридин-2-иламин;
6-(4-{2-[4-(3-фенилпропил)пиперазин-1-ил]этил}фенил)пиридин-2-иламин;
(3,4-диметилфенил)амид 4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-карбоновой кислоты;
1-(4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-ил)-2-(4-хлорфенил)этанон;
8-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-3-бензил-1,3,8-триазаспиро[4.5]декан-2,4-дион;
3-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-3-азабицикло[3.2.1]окт-8-иламин;
m-толиламид 4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-карбоновой кислоты;
(3-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-3-азабицикло[3.1.0]гекс-6-ил)фенетиламин;
бензиламид 4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-карбоновой кислоты;
6-[4-(2-{4-[1-(4-фторфенил)-1Н-тетразол-5-ил]пиперазин-1-ил}этил)фенил]пиридин-2-иламин;
6-(4-{2-[4-цис-(4-фенилциклогексил)пиперазин-1-ил]этил}фенил)пиридин-2-иламин;
6-(4-{2-[4-транс-(4-фенилциклогексил)пиперазин-1-ил]этил}фенил)пиридин-2-иламин;
гидрохлорид (3-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-3-азабицикло[3.1.0]гекс-6-ил)(3-фенилпропил)амина;
2-(3-{2-[4-(6-аминопиридин-2-ил)-фенил]этил}-3-азабицикло[3.1.0]гекс-6-иламино)ацетамид;
6-[4-(2-{4-[2-(4-фторфенил)этил]пиперазин-1-ил}этил)фенил]пиридин-2-иламин;
6-(4-{2-[4-(1-метил-2-фенилэтил)пиперазин-1-ил]этил}фенил)пиридин-2-иламин;
6-(4-{2-[4-(1,2,3,4-тетрагидронафталин-2-ил)пиперазин-1-ил]этил}фенил)пиридин-2-иламин;
N-(1-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пирролидин-3-ил)-2-(4-фторфенил)ацетамид;
8-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-3-фенетил-1,3,8-триазаспиро[4.5]декан-2,4-дион;
8-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-8-азабицикло[3.2.1]окт-3-иламин;
бензиламид 4-амино-1-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперидин-4-карбоновой кислоты;
6-(4-{2-[4-(2-аминоэтил)пиперазин-1-ил]этил}фенил)пиридин-2-иламин;
2-амино-1-(4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-ил)-3-фенилпропан-1-он;
{2-[4-(6-аминопиридин-2-ил)фенил]этил}(8-бензил-8-азабицикло[3.2.1]окт-3-ил)амин;
1-(1-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперидин-4-ил)-3-фенилмочевина;
1-(1-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперидин-4-ил)-3-бензилмочевина;
N-(1-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперидин-4-ил)-2-(4-фторфенил)ацетамид;
{2-[4-(6-аминопиридин-2-ил)фенил]этил}(8-азабицикло[3.2.1]окт-3-ил)амин;
6-{4-[2-(4-аминопиперидин-1-ил)этил]фенил}пиридин-2-иламин;
морфолинамид 4-амино-1-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперидин-4-карбоновой кислоты;
пирролидинаьшф 4-амино-1-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперидин-4-карбоновой кислоты;
6-{4-[2-(3-аминопирролидин-1-ил)этил]фенил}пиридин-2-иламин;
1-(3-{2-[4-(6-аминопиридин-2-ил)фенил]этиламино}-8-азабицикло[3.2.1]окт-8-ил)-2-(4-фторфенил)этанон;
1-(1-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пирролидин-3-ил)-3-фенилмочевина;
1-(1-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пирролидин-3-ил)-3-бензилмочевина;
1-(1-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пирролидин-3-ил)-3-циклогексилмочевина;
{2-[4-(6-аминопиридин-2ил)фенил]этил}(8-метил-8-азабицикло[3.2.1]окт-3-ил)амин;
{2-[4-(6-аминопиридин-2-ил)фенил]этил}(3-бензил-3-азабицикло[3.1.0]гекс-6-ил)амин;
{2-[4-(6-аминопиридин-2-ил)фенил]этил}[8-(4-фторбензил)-8-азабицикло[3.2.1]окт-3-ил]амин;
{2-[4-(6-аминопиридин-2-ил)фенил]этил}[8-(4-хлорбензил)-8-азабицикло[3.2.1]окт-3-ил]амин;
фенетиламид 4-амино-1-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперидин-4-карбоновой кислоты;
фениламид 3-{2-[4-(6-аминопиридин-2-ил)фенил]этиламино}пирролидин-1-карбоновой кислоты;
(3-{2-[4-(6-аминопиридин-2-ил)фенил]этиламино}пирролидин-1-ил)фенилметанон;
6-{4-[2-(1-бензилпирролидин-3-иламино)этил]фенил}пиридин-2-иламин;
N-(8-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-8-азабицикло[3.2.1]окт-3-ил)бензамид;
{2-[4-(6-аминопиридин-2-ил)фенил]этил}[3-бензил-3-азабицикло[3.3.1]нон-9-ил]амин;
N-(8-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-8-азабицикло[3.2.1]окт-3-ил)-2-(4-фторфенил)ацетамид;
6-{4-[2-(3-аминопиперидин-1-ил)этил]фенил}пиридин-2-иламин;
N-(3-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-3-азабицикло[3.3.1]нон-9-ил)бензамид (антиизомер);
N-(3-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-3-азабицикло[3.3.1]нон-9-ил)бензамид (син-изомер);
6-{4-[2-(4-бензгидрилпиперазин-1-ил)этил]фенил}пиридин-2-иламин;
6-{4-[2-(4-бензгидрилпиперидин-1-ил)этил]фенил}пиридин-2-иламин;
3-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-3-азабицикло[3.3.1]нон-9-иламин;
этиловый эфир 3-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-3-азабицикло[3.1.0]гексан-6-карбоновой кислоты;
3-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-3-азабицикло[3.1.0]гексан-6-карбоновая кислота;
трет-бутиловый эфир 3-{2-[4-(6-аминопиридин-2-ил)фенил]этиламино}пиперидин-1-карбоновой кислоты;
6-{4-[2-(пиперидин-3-иламино)этил]фенил}пиридин-2-иламин;
6-{4-[2-(1-бензилпиперидин-4-иламино)этил]фенил}пиридин-2-иламин;
3-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-3-азабицикло[3.1.0]гекс-6-иламин (антиизомер);
6-{4-[2-(пиперидин-4-иламино)этил]фенил}пиридин-2-иламин;
6-(4-{2-[(пиперидин-4-илметил)амино]этил}фенил)пиридин-2-иламин;
(3-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-3-азабицикло[3.1.0]гекс-6-ил)-(4-метилпиперазин-1-ил)метанон;
{2-[4-(6-аминопиридин-2-ил)фенил]этил}(9-бензил-3-окса-9-азабицикло[3.3.1]нон-7-ил)амин (более полярный диастереоизомер);
{2-[4-(6-аминопиридин-2-ил)фенил]этил}(9-бензил-3-окса-9-азабицикло[3.3.1]нон-7-ил)амин (менее полярный диастереоизомер);
2-(4-{2-[4-(6-аминопиридин-2-ил)фенил]этил}пиперазин-1-ил)-1-фенилэтанол;
{2-[4-(6-аминопиридин-2-ил)фенил]этил}(3-окса-9-азабицикло[3.3.1]нон-7-ил)амин;
6-(4-{2-[4-(2-амино-2-фенилэтил)пиперазин-1-ил]этил}фенил)пиридин-2-иламин;
9-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-3-окса-9-азабицикло[3.3.1]нон-7-иламин;
{2-[4-(6-аминопиридин-2-ил)фенил]этил}(3-окса-9-азабицикло[3.3.1]нон-7-ил)амин;
6-{4-[2-(4-амино-2,6-диметилпиперидин-1-ил)этил]фенил}пиридин-2-иламин (цис-диастереоизомер);
6-{4-[2-(4-метилпиперазин-1-ил)этил]фенил}пиридин-2-иламин;
6-{4-[2-(4-бензолсульфонилпиперазин-1-ил)этил]фенил}пиридин-2-иламин;
6-{4-[2-(4-метансульфонилпиперазин-1-ил)этил]фенил}пиридин-2-иламин;
6-{4-[2-(2,6-диметилпиперазин-1-ил)этил]фенил}пиридин-2-иламин;
6-{4-[2-(2,6-диметил-4-метиламинопиперидин-1-ил)этил]фенил}пиридин-2-иламин;
6-{4-[2-(4-циклогексилпиперазин-1-ил)этил]фенил}пиридин-2-иламин;
6-[4-(2-аминоэтил)фенил]пиридин-2-иламин;
6-{4-[2-(бис-пиридин-3-илметиламино)этил]фенил}пиридин-2-иламин;
6-{4-[2-(бис-пиридин-4-илметиламино)этил]фенил}пиридин-2-иламин;
N-{2-[4-(6-аминопиридин-2-ил)фенил]этил}-N-(1-бензилпиперидин-4-ил)ацетамид;
6-[4-(4-метилпиперазин-1-илметил)фенил]пиридин-2-иламин;
3-[4-(6-аминопиридин-2-ил)бензил]-3-азабицикло[3.1.0]гекс-6-иламин;
6-{4-[2-(бис-циклогексилметиламино)этил]фенил}пиридин-2-иламин;
6-{4-[2-(4-фенилбутиламино)этил]фенил}пиридин-2-иламин;
6-{4-[2-(5-фенилпентиламино)этил]фенил}пиридин-2-иламин;
6-{4-[3-(1,2,3,4-тетрагидронафталин-2-иламино)пропил]фенил}пиридин-2-иламин;
6-{4-[2-(4-фенэтилпиперазин-1-ил)этил]фенил}-4-метилпиридин-2-иламин;
6-{4-[3-(4-фенетилпиперазин-1-ил)пропил]фенил}пиридин-2-иламин;
6-{3-[2-(4-фенетилпиперазин-1-ил)этил]фенил}пиридин-2-иламин;
6-{4-[2-(4-амино-2,6-диметилпиперидин-1-ил)этил]фенил}пиридин-2-иламин (цис-диастереоизомер);
6-{4-[2-(4-амино-2,6-диизопропилпиперидин-1-ил)этил]фенил}пиридин-2-иламин (цис-диастереоизомер);
6-{4-[2-(4-изобутилпиперазин-1-ил)-1-метилэтил]фенил}пиридин-2-иламин;
6-{4-[1-бензил-2-(4-изобутилпиперазин-1-ил)этил]фенил}пиридин-2-иламин;
6-[4-(фенэтиламинометил)фенил]пиридин-2-иламин;
6-{4-[(циклогексилметиламино)метил]фенил}пиридин-2-иламин;
6-[4-(4-аминопиперидин-1-илметил)фенил]пиридин-2-иламин;
6-(4-пиперидин-1-илметилфенил)пиридин-2-иламин;
6-{4-[(2-тиофен-2-ил-этиламино)метил]фенил}пиридин-2-иламин;
6-[2-метокси-4-(фенетиламинометил)фенил]пиридин-2-иламин;
6-{4-[(циклогексилметиламино)метил]-2-метоксифенил}пиридин-2-иламин;
6-{4-[1-циннамил-2-(4-изобутилпиперазин-1-ил)этил]фенил}пиридин-2-иламин;
6-{4-[(циклогексилметиламино)метил]-2-фторфенил}пиридин-2-иламин;
6-[4-((N-фенетил-N-метил)аминометил)фенил]пиридин-2-иламин;
или их фармацевтически приемлемая соль.
4. Фармацевтическая композиция для лечения или профилактики состояния, выбранного из группы, которая состоит из мигрени, воспалительных заболеваний, удара, острой и хронической боли, гиповолемического шока, травматического шока, реперфузионного повреждения, болезни Крона, язвенного колита, септического шока, рассеянного склероза, связанного со СПИДом слабоумия, нейродегенеративных заболеваний, нейрональной интоксикации, болезни Альцгеймера, зависимостей от химикатов и пристрастий к ним, рвоты, эпилепсии, тревожности, психоза, травмы головы, респираторного дистресс синдрома у взрослых (РДСВ), индуцированных морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической нейропатии, диабетической нефропатии и рака, у млекопитающего, содержащая такое количество соединения по п.1, которое эффективно в лечении или профилактике этого состояния, и фармацевтически приемлемый носитель.
5. Способ лечения или профилактики состояния, выбранного из группы, которая состоит из мигрени, воспалительных заболеваний, удара, острой и хронической боли, гиповолемического шока, травматического шока, реперфузионного повреждения, болезни Крона, язвенного колита, септического шока, рассеянного склероза, связанного со СПИДом слабоумия, нейродегенеративных заболеваний, нейрональной интоксикации, болезни Альцгeймера, зависимостей от химикатов и пристрастий к ним, рвоты, эпилепсии, тревожности, психоза, травмы головы, респираторного дистресс синдрома у взрослых (РДСВ), индуцированных морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической нейропатии, диабетической нефропатии и рака, у млекопитающего, при котором указанному млекопитающему вводят такое количество соединения по п.1, котоЁюх эффективно в лечении или профилактике этого состояния.
6. Фармацевтическая композиция, содержащая эффективное в ингибировании СОА количество соединения по п.1 и фармацевтически приемлемый носитель.
7. Способ ингибирования СОА у млекопитающего, при котором указанному млекопитающему вводят эффективное в ингибировании СОА количество соединения по п.1.
8. Способ по п.7, где млекопитающее страдает от состояния, выбранного из группы, которая состоит из мигрени, воспалительных заболеваний, удара, острой и хронической боли, гиповолемического шока, травматического шока, реперфузионного повреждения, болезни Крона, язвенного колита, септического шока, рассеянного склероза, связанного со СПИДом слабоумия, нейродегенеративных заболеваний, нейрональной интоксикации, болезни Альцгeймера, зависимостей от химикатов и пристрастий к ним, рвоты, эпилепсии, тревожности, психоза, травмы головы, респираторного дистресс синдрома у взрослых (РДСВ), индуцированных морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической нейропатии, диабетической нефропатии и рака.
9. Фармацевтическая композиция для лечения или профилактики состояния, выбранного из группы, которая состоит из мигрени, воспалительных заболеваний, удара, острой и хронической боли, гиповолемического шока, травматического шока, реперфузионного повреждения, болезни Крона, язвенного колита, септического шока, рассеянного склероза, связанного со СПИДом слабоумия, нейродегенеративных заболеваний, нейрональной интоксикации, болезни Альцгеймера, зависимостей от химикатов и пристрастий к ним, рвоты, эпилепсии, тревожности, психоза, травмы головы, респираторного дистресс синдрома у взрослых (РДСВ), индуцированных морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической нейропатии, диабетической нефропатии и рака, у млекопитающего, содержащая эффективное в ингибировании СОА количество соединения по п.1 и фармацевтически приемлемый носитель.
Текст
1 Данное изобретение относится к некоторым производным 6-фенилпиридил-2-амина,которые проявляют активность как ингибиторы синтетазы оксида азота (СОА), к фармацевтическим композициям, которые их содержат, и к их применению для лечения и профилактики некоторых нарушений центральной нервной системы, воспалительных нарушений, септического шока и других нарушений. Известны три изоформы СОА - индуцибельная форма (и-СОА) и две конститутивные формы, которые обозначаются как нейрональная СОА (н-СОА) и эндотелиальная СОА (эСОА), соответственно. Каждый из этих ферментов в ответ на разные стимулы осуществляет превращение аргинина в цитруллин, при этом образуя молекулу оксида азота (NO). Считается,что избыточное образование оксида азота (NO) посредством СОА играет роль в патологии многих нарушений и состояний млекопитающих. Например полагают, что NO, образуемый посредством и-СОА, играет роль в заболеваниях,которые сопряжены с системной гипотензией,(такие как септический шок) и с лечением некоторыми цитокинами. Показано, что больные раком, которых лечили цитокинами, такими как интерлейкин 1 (ИЛ-1), интерлейкин-2 (ИЛ-2) или фактор некроза опухолей (ФНО), страдают от индуцированных цитокинами шока и гипотензии из-за NO, продуцируемого макрофагами,т.е. индуцибельной СОА (см. ChemicalEngineering News, Dec. 20, р. 33, (1993). Ингибиторы и-СОА могут обращать эти явления. Считается также, что и-СОА играет роль в патологии заболеваний центральной нервной системе, таких как ишемия. Например показано, что ингибирование и-СОА ослабляет ишемические повреждения мозга у крыс (см. Am. J. Physiol., 268 р.R286 (1995. В другом источнике (Eur. J. Pharmacol., 273, р. 15-24 (1995 сообщалось о том,что селективное ингибирование и-СОА подавляет индуцированный адъювантами артрит. Считается, что NO, продуцируемый посредством н-СОА, играет роль в таких заболеваниях, как церебральная ишемия, боль, толерантность к опиатам. Например, ингибирование н-СОА снижает объем инфарктной области после окклюзии проксимального участка средней мозговой артерии у крыс (см. J. Cerebr. Blood Flow Metab.,14, р. 924-929 (1994. Также было показано, что ингибирование н-СОА эффективно в антиноцицепции, о чем свидетельствует его активность в поздней фазе испытаний на индуцированном формалином лизании задней лапы и индуцированной уксусной кислотой абдоминальной констрикции (см. Br. J. Pharmacol., 110, р. 219-224(1993. Наконец, сообщалось о том, что опиоидная абстиненция у грызунов снижается ингибированием н-СОА (см. Neuropsychopharmacol.,13, р. 269-293 (1995. 2 Резюме изобретения Данное изобретение относится к соединениям формулы и его фармацевтически приемлемым солям, гдеR1 и R2 образуют вместе с азотом, к которому они присоединены, азабициклическое кольцо, содержащее от 6 до 14 членов кольца,из которых от 1 до 3 являются атомами азота, а остальные являются атомами углерода, причем примерами названного азабициклического кольца являются: где выбор для R3 и R4 составляют водород, (С 1 С 6)алкил, фенил, нафтил, (С 1-С 6)алкил-С(=O)-,НС(=O)-, (С 1-С 6)алкокси-С(=O)-, фенил-С(=O)-,нафтил-С(=O)- и (R7)2NC(=O)-, причем выбор для R7 составляет, независимо, водород и (С 1 С 6)алкил; выбор для R5 составляют водород, (С 1 С 6)алкил, фенил, нафтил, фенил-(С 1-С 6)алкил- и нафтил-(С 1-С 6)алкил-;n обозначает 0, 1 или 2; и каждый углерод указанной (CH2)n возможно может быть замещен заместителем R8;m обозначает 0, 1 или 2; и каждый углерод указанной (СН 2)m, возможно может быть замещен заместителем R9; выбор для каждого R8 и R9 составляют, независимо, (С 1-С 4)алкил, арил-(С 1-С 4)алкил, причем выбор для названного арила составляют фенил и нафтил; аллил и феналлил; выбор для Х и Y составляют, независимо,метил, метокси-, гидрокси-, и водород; иR10 обозначает водород или (С 1-С 6)алкил; при условии, что R8 отсутствует, когда n равно 0, и R9 отсутствует, когда m равно 0. Данное изобретение также относится к фармацевтически приемлемым солям соединения формулы I, полученным присоединением 3 кислот. Кислотами, которые используют для приготовления фармацевтически приемлемых полученных присоединением кислот солей вышеуказанных основных соединений по изобретению, являются такие, которые образуют нетоксичные соли присоединения кислот, то есть соли, содержащие фармакологически приемлемые анионы, такие как соли гидрохлорида, гидробромида, гидройодида, нитрата, сульфата,бисульфата, фосфата, кислого фосфата, ацетата,лактата, цитрата, кислого цитрата, тартрата,битартрата, сукцината, малеата, фумарата, глюконата, сахарата, бензоата, метансульфоната,этансульфоната, бензолсульфоната, п-толуолсульфоната и памоата [т.е. 1,1-метилен-бис-(2 гидрокси-3-нафтоата)]. Термин алкил включает, при использовании здесь и если это не оговорено иначе, насыщенные моновалентные углеводородные радикалы с линейными, разветвленными или циклическими оставляющими или их комбинациями. Термин один или более чем один заместитель относится, при использовании здесь, к числу заместителей от одного до максимального числа заместителей, основанного на числе доступных положений связывания. Термин галогено- включает, при использовании здесь и если это не оговорено иначе,хлор(о)-, фтор(о)-, бром(о)- и йод(о)-. Другими предпочтительными соединениями по данному изобретению являются соединения формулы I и их фармацевтически приемлемые соли, где NR1R2 обозначает группу формулы где NR3R4 означает NH2. Другими предпочтительными соединениями по данному изобретению являются соединения формулы I и их фармацевтически приемлемые соли, где NR1R2 обозначает группу формулы где R5 обозначает аралкил, например бензил. Конкретные предпочтительные соединения по данному изобретению включают следующие: 6-4-[2-(4-фенетилпиперазин-1-ил)этил] фенилпиридин-2-иламин; 9 6-4-[1-бензил-2-(4-изобутилпиперазин-1 ил)этил]фенилпиридин-2-иламин; 6-[4-(фенэтиламинометил)фенил]пиридин 2-иламин; 6-4-[(циклогексилметиламино)метил]фенилпиридин-2-иламин; 6-[4-(4-аминопиперидин-1-илметил)фенил] пиридин-2-иламин; 6-(4-пиперидин-1-илметилфенил)пиридин-2-иламин; 6-4-[(2-тиофен-2-ил-этиламино)метил] фенилпиридин-2-иламин; 6-[2-метокси-4-(фенетиламинометил)фенил]пиридин-2-иламин; 6-4-[(циклогексилметиламино)метил]-2 метоксифенилпиридин-2-иламин; 6-4-[1-циннамил-2-(4-изобутилпиперазин 1-ил)этил]фенилпиридин-2-иламин; 6-4-[(циклогексилметиламино)метил]-2 фторфенилпиридин-2-иламин; 6-[4-N-фенетил-N-метил)аминометил) фенил]пиридин-2-иламин; или их фармацевтически приемлемую соль. Данное изобретение также относится к фармацевтической композиции для лечения или профилактики состояния, выбранного из группы, которая состоит из мигрени, воспалительных заболеваний (например астмы), удара, острой и хронической боли, гиповолемического шока, травматического шока, реперфузионного повреждения, болезни Крона, язвенного колита,септического шока, рассеянного склероза, связанного со СПИДом слабоумия, нейродегенеративных заболеваний, нейрональной интоксикации, болезни Альцгеймера, зависимостей от химикатов и пристрастий к ним (например, зависимости от наркотиков, алкоголя и никотина),рвоты, эпилепсии, тревожности, психоза, травмы головы, респираторного дистресс синдрома у взрослых (РДСВ), индуцированной морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической нейропатии, диабетической нефропатии и рака у млекопитающего, в том числе человека, включающей такое количество соединения формулы I или его фармацевтически приемлемой соли, которое эффективно в лечении или профилактике этого состояния, и фармацевтически приемлемый носитель. Данное изобретение также относится к способу лечения или профилактики состояния,выбранного из группы, которая состоит из мигрени, воспалительных заболеваний (например астмы), удара, острой и хронической боли, гиповолемического шока, травматического шока,реперфузионного повреждения, болезни Крона,язвенного колита, септического шока, рассеянного склероза, связанного со СПИДом слабо 002270(например зависимости от наркотиков, алкоголя и никотина), рвоты, эпилепсии, тревожности,психоза, травмы головы, респираторного дистресс синдрома у взрослых (РДСВ), индуцированной морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита,овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической нейропатии,диабетической нефропатии и рака у млекопитающего, в том числе человека, включающего введение названному млекопитающему такого количества соединения формулы I или его фармацевтически приемлемой соли, которое эффективно в лечении или профилактике указанного состояния. Настоящее изобретение также относится к фармацевтической композиции, включающей эффективное в ингибировании СОА количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу ингибирования СОА у млекопитающего, в том числе человека, включающему введение названному млекопитающему эффективного в ингибировании СОА количества соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также относится к фармацевтической композиции для лечения или профилактики состояния, выбранного из группы, которая состоит из мигрени, воспалительных заболеваний (например астмы), удара, острой и хронической боли, гиповолемического шока, травматического шока, реперфузионного повреждения, болезни Крона, язвенного колита,септического шока, рассеянного склероза, связанного со СПИДом слабоумия, нейродегенеративных заболеваний, нейрональной интоксикации, болезни Альцгеймера, зависимостей от химикатов и пристрастий к ним (например зависимости от наркотиков, алкоголя и никотина),рвоты, эпилепсии, тревожности, психоза, травмы головы, респираторного дистресс синдрома у взрослых (РДСВ), индуцированной морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита, овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической нейропатии, диабетической нефропатии и рака у млекопитающего, в том числе человека, включающей эффективное в ингибировании СОА количество соединения формулы I или его фармацевтически приемле 11 мой соли и фармацевтически приемлемый носитель. Данное изобретение также относится к способу лечения или профилактики состояния,выбранного из группы, которая состоит из мигрени, воспалительных заболеваний (например астмы), удара, острой и хронической боли, гиповолемического шока, травматического шока,реперфузионного повреждения, болезни Крона,язвенного колита, септического шока, рассеянного склероза, связанного со СПИДом слабоумия, нейродегенеративных заболеваний, нейрональной интоксикации, болезни Альцгеймера,зависимостей от химикатов и пристрастий к ним(например зависимости от наркотиков, алкоголя и никотина), рвоты, эпилепсии, тревожности,психоза, травмы головы, респираторного дистресc синдрома у взрослых (РДСВ), индуцированной морфином толерантности и симптомов абстиненции, воспалительного заболевания кишечника, остеоартрита, ревматоидного артрита,овуляции, дилатационной кардиомиопатии, острой травмы спинного мозга, болезни Хантингтона, болезни Паркинсона, глаукомы, макулярной дегенерации, диабетической нейропатии,диабетической нефропатии и рака у млекопитающего, в том числе человека, включающего введение названному млекопитающему эффективного в ингибировании СОА количества соединения формулы I или его фармацевтически приемлемой соли. Соединения формулы I имеют хиральные центры и поэтому могут существовать в разных энантиомерных и диастереоизомерных формах. Данное изобретение относится ко всем оптическим изомерам и всем стереоизомерам соединений формулы I и их смесям и ко всем определенным выше фармацевтическим композициям и способам лечения, которые содержат или используют их, соответственно. Приведенные выше формулы I и II включают соединения, идентичные тем, что были описаны, не считая того, что один или более чем один атом водорода, углерода или другой заменены их изотопами. Такие соединения могут быть полезными в качестве исследовательских или диагностических средств в исследованиях метаболической фармакокинетики и в анализах определения связывания. Детальное описание изобретения Соединения формулы I могут быть приготовлены, как описано в нижеприведенных схемах реакций и в обсуждении. Если это не оговорено иначе, R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 и структурная формула I в нижеприведенных схемах реакций и обсуждении определены так же, как и выше. Исходные материалы, используемые в процедуре cхемы 1, либо доступны в продаже и известны в данной области, либо их легко получают из известных соединений способами, которые станут ясными для специалистов. Что касается cхемы 1, то превращение соединения формулы II в соединение формулы III можно осуществить, сначала превратив соединение формулы II в соответствующее 2-аминосоединение в реакции с аммиаком в полярном гидроксильном или полярном негидроксильном растворителе при температуре от приблизительно 100 С до приблизительно 250 С и давлении от приблизительно 345 кПа (50 фунтов на кв. 14 дюйм) до приблизительно 3447 кПа (500 фунтов на кв. дюйм) в течение времени приблизительно от 1 до 24 ч, предпочтительно используя автоклав из нержавеющей стали. После этого присоединяют пиррольную группу с помощью гексан-2,5-диона, либо неразбавленного, либо в неполярном растворителе, таком как толуол, в присутствии кислотного катализатора, такого как уксусная кислота или соляная кислота, при температуре от приблизительно комнатной до приблизительно температуры флегмообразования, предпочтительно при последней, в течение времени приблизительно от часа до 72 ч. Превращение соединения формулы III, образованного в вышеописанной реакции, в соединение формулы IV осуществляют с помощью опосредованной переходными металлами реакции сочетания с должным образом замещенным арилйодидом или -бромидом. Конкретней, литиевое производное соединения формулы III получают в эфирном или углеводородном растворителе при температуре от приблизительно -100 С до приблизительно комнатной, предпочтительно при -78 С, с помощью алкиллития,такого как бутиллитий, в течение времени приблизительно от 10 до 120 мин с последующим добавлением каталитического металлического реактива, такого как хлорид цинка, и нагреванием до комнатной температуры для проведения переметаллирования. За этим следует добавление арилйодида(например 1-йодо-4-(2 хлорэтил)бензола) или арилбромида и переходного металла, такого как палладий в форме тетракис-трифенилфосфин палладия, с последующим нагреванием до температуры от приблизительно 30 С до приблизительно 100 С, в типичном случае до приблизительно температуры дефлегмации растворителя в течение времени приблизительно от 1 до 24 ч. Превращение соединения формулы IV в желаемое соединение формулы I осуществляют сначала удалением пиррольной защитной группы, используя в типичном случае гидроксиламин или гидрохлорид гидроксиламина в полярном протонном растворителе, таком как спирт,при температуре от приблизительно комнатной до приблизительно 150 С, обычно около температуры дефлегмации растворителя, в течение времени примерно от 1 до 72 ч. За этим следует введение подходящей группы типа NR1R2 путем замещения хлоро-группы амином формулыHNR1R2 с использованием полярного апротонного или полярного протонного растворителя,такого как спирт, диметилформамид (ДМФ),метилизобутилкетон или N-метилпирролидон(МП), возможно в присутствии катализатора,такого как йодид натрия, при температуре от приблизительно комнатной до приблизительно 200 С, в типичном случае при температуре дефлегмации растворителя или около 140 С в случаях диметилформамида и М-метилпирроли 15 дона, в течение приблизительно 100 ч, обычно приблизительно от 12 до 24 ч. Что касается cхемы 2, соединение VI готовят в реакции соединения V с параформилбензолборной кислотой в растворителе, состоящем из спирта, предпочтительно этанола, возможно смешанного с водой галогенированного углеводорода, при температуре от 25 С до 150 С, продолжительностью от 1 до 24 ч, с использованием катализатора на основе палладия со степенью окисления либо палладий-ноль, либо палладий-два, в типичном случае с фосфиновыми лигандами, предпочтительно - тетракистрифенилфосфинпалладия. Соединение VII готовят в реакции VI с тозилметилизоцианидом в присутствии трет-бутоксида калия и этанола, в эфирном растворителе, таком как 1,2 диметоксиэтан, при температуре от -100 до 100 С, продолжительностью от 1 до 24 ч. Соединение VIII готовят из соединения VII щелочным гидролизом нитрила с использованием гидроксида щелочного металла в растворителе на основе водного спирта, таком как водный этанол, при температуре от 25 до 125 С, продолжительностью от 30 мин до 48 ч. Соединение IX готовят из соединения VIII взаимодействием (при дегидратации) с аммонием, первичным амином или вторичным амином, которое осуществляют дегидратирующим агентом, таким как карбодиимид, например N-этил-N(диметиламинопропил)-карбодиимид, в растворителе, выбранном из галогенированного углеводорода или N,N-диалкиламида, такого как диметилформамид, при температуре от 0 до 100 С, продолжительностью от 1 до 48 ч. Соединение Х готовят из соединения IX деблокированием, используя гидрохлорид гидроксиламина, в водном или спиртовом растворителе,предпочтительно водном этаноле, при температуре от 25 до 100 С, продолжительностью от 1 до 48 ч, и это может включать деблокирование защитной группы, такой как трет-бутоксикарбонильная группа, в реакции с трифторуксусной кислотой или сходной полигалогенированной уксусной кислотой или газообразным водородным галогенилом, таким как HCl, в галогенированном углеводороде, эфирном растворителе или этилацетате, при температуре от -70 С до 100 С, длительностью от 10 мин до 24 ч. Конечное соединение cхемы 2, а именно I, готовят восстановлением соединения Х с помощью борана, триалкилборана, алана или литийалюминийгидрида в эфирном растворителе, таком как этиловый эфир или тетрагидрофуран,при температуре от -100 до 100 С, длительностью от 30 мин до 24 ч, возможно с использованием фторида цезия и щелочного металла или карбоната щелочно-земельного металла в водном спиртовом растворителе, при температуре от 25 до 125 С, длительностью от 1 до 72 ч. Что касается cхемы 3, то соединение XI готовят дегидратирующим взаимодействием N 002270 16 фенетилпиперазина с 4-бромфенилуксусной кислотой с использованием дегидратирующего агента на основе карбодиимида, такого как Nэтил, N-(диметиламинопропил)-карбодиимид, в растворителе, таком как галогенированный углеводород или растворитель на основе диалкиламида, такого как диметилформамид, при температуре от 0 до 100 С, длительностью от 1 до 48 ч. Соединение XI превращали в соединениеXII восстановлением посредством борана, триалкилборана, алана, или литий-алюминийгидрида в эфирном растворителе, таком как этиловый эфир или тетрагидрофуран, при температуре от -100 до 100 С, длительностью от 30 мин до 24 ч, с возможным использованием фторида цезия и щелочного металла или карбоната щелочно-земельного металла в водном спиртовом растворителе, при температуре от 25 до 125 С, длительностью от 1 до 72 ч. Затем соединение XII превращают в органолитиевое производное в присутствии органолитиевого реагента, такого как бутиллитий, и добавляют к 4-метил-2-(2,5-диметилпирролил)-пиридину в эфирном растворителе, таком как этиловый эфир, при температуре от -70 до 70 С, в течение времени от 30 мин до 24 ч. Конечное соединение cхемы 3, а именно соединение I, готовят деблокированием, используя гидрохлорид гидроксиламина, в водном или спиртовом растворителе, предпочтительно водном этаноле, при температуре от 25 до 100 С, длительностью от 1 до 48 ч. Что касается cхемы 4, то соединение XIV готовят дегидратирующим взаимодействием дибензиламина с 4-бромфенилуксусной кислотой, осуществляемым с помощью дегидратирующего агента, такого как карбодиимид, например N-этил-N-(диметиламинопропил)-карбодиимид, в растворителе из галогенированного углеводорода или N,N-диалкиламида, такого как диметилформамид, при температуре от 0 до 100 С, длительностью от 1 до 48 ч. СоединениеXIV превращают в соединение XV восстановлением с помощью борана, триалкилборана, алана или литий-алюминийгидрида в эфирном растворителе, таком как этиловый эфир или тетрагидрофуран, при температуре от -100 до 100 С,длительностью от 30 мин до 24 ч, возможно с использованием фторида цезия и щелочного металла или карбоната щелочно-земельного металла в водном спиртовом растворителе, при температуре от 25 до 125 С, длительностью от 1 до 72 ч. Затем соединение XV превращают в органолитиевое производное в присутствии органолитиевого реагента, такого как бутиллитий,и добавляют к 2-(2,5-диметилпирролил)пиридину в эфирном растворителе, таком как этиловый эфир, при температуре от -70 до 70 С, в течение времени от 30 мин до 24 ч, чтобы получить соединение XVI. Затем из соединения XVI готовят соединение XVII гидрогенолизом с помощью водорода или формиата аммония, с бла 17 городным металлом, таким как палладий, в качестве катализатора, в эфире, галогенированном углеводороде, спирте, или водном спирте в качестве растворителя, при температуре от 0 С до 100 С, длительностью от 30 мин до 24 ч. Затем из соединения XVII готовят соединение XVIII восстановительным аминированием с помощью альдегида или кетона в присутствии реагента на основе боргидрида, такого как цианоборгидрид натрия или триацетоксиборгидрид натрия, в эфире, галогенированном углеводороде, спирте или водном спирте в качестве растворителя, при температуре от 0 до 100 С, длительностью от 1 до 72 ч. Превращение соединения XVIII в соединение I осуществляют деблокированием,используя гидрохлорид гидроксиламина, в водном или спиртовом растворителе, предпочтительно водном этаноле, при температуре от 25 до 100 С, длительностью от 1 до 48 ч. Что касается cхемы 5, то соединение XIX готовят в реакции известного по ЕР 470794 А 1(см. Chem. Abs., 116:193935) 2-бром-5 метиланизола с алкиллитием, в типичном случае бутиллитием, в эфирном или углеводородном растворителе, при температуре от -100 до 0 С, длительностью от 1 мин до 24 ч, с последующим добавлением эфира алкил- или арилбората, в типичном случае триэтилбората, при температуре от -100 до 0 С и перемешиванием во время доведения температуры от 0 С до температуры дефлегмации растворителя, в типичном случае 65 С, длительностью от 1 до 48 ч. Соединение XIX превращают в соединение XX в реакции с 6-бром-2-(2,5-диметилпирролил)-пиридином и карбонатом щелочного металла в растворителе, состоящем из спирта,предпочтительно этанола, возможно смешанном с водой галогенированного углеводорода, при температуре от 25 до 150 С, длительностью от 1 до 24 ч, используя катализатор на основе палладия со степенью окисления либо палладий-ноль,либо палладий-два, в типичном случае с фосфиновыми лигандами, предпочтительно тетракистрифенилфосфинпалладием. Соединение XXI готовили из соединения XX сначала деблокированием, используя гидрохлорид гидроксиламина в водном или спиртовом растворителе, предпочтительно водном этаноле, при температуре от 25 до 100 С, длительностью от 1 до 48 ч, за которым следовала реакция с N-карбэтоксифталимидом в углеводородном растворителе при температуре от комнатной до температуры дефлегмации растворителя или 180 С, в типичном случае 110 С, длительностью от 1 до 48 ч. Превращение соединения XXI в соединение XXII осуществляли в реакции с N-бромсукцинимидом в хлорированном углеводороде в качестве растворителя, в типичном случае в тетрахлориде углерода, с каталитическим количеством инициатора свободных радикалов, такого как азо-бисизобутиронитрил, при температуре от комнатной до 100 С, длительностью от 10 мин до 24 ч. 18 Затем соединение XXII превращали в соединение XXIII в реакции с амином, таким как фенетиламин, в углеводороде, галогенированном углеводороде, эфире в качестве растворителя или в полярном апротонном растворителе, таком как ацетонитрил, с карбонатом щелочного металла в качестве основания, при температуре от комнатной до 100 С, длительностью от 10 мин до 48 ч. Затем соединение XXIII превращали в конечный продукт cхемы 5, а именно I, деблокированием с помощью гидразина в спиртовом, водном или эфирном растворителе, при температуре от комнатной до 150 С, длительностью от 1 до 72 ч. Приготовление других соединений формулы I, не описанное в дальнейшем экспериментальном разделе конкретно, можно осуществить с помощью комбинаций вышеописанных реакций, которые будут очевидны специалистам. В каждой из реакций, которые были обсуждены и проиллюстрированы выше, давление не является критическим, если это не оговорено иначе. Обычно приемлемы уровни давления от примерно 0,5 атмосфер до примерно 5 атмосфер, а давление окружающей среды, то есть около 1 атмосферы, предпочтительно из соображений удобства. Соединения формулы I, активные соединения по данному изобретению, которые по природе являются основными, способны к образованию множества разных солей с различными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, на практике часто бывает желательным выделить соединение формулы I из реакционной смеси в виде фармацевтически неприемлемой соли, а затем просто превратить последнюю обратно в свободное основание обработкой щелочным реагентом и затем превратить последнее свободное основание в фармацевтически приемлемую соль присоединения кислоты. Такая соль присоединения кислоты активного основного соединения по изобретению готовится легко путeм обработки основного соединения с по существу эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. После тщательного выпаривания растворителя легко получают желаемую твердую соль. Активные соединения по данному изобретению и их фармацевтически приемлемые соли полезны в качестве ингибиторов СОА, то есть они обладают способностью ингибировать фермент СОА у млекопитающих, и поэтому они способны функционировать как терапевтические агенты в лечении вышеуказанных расстройств и заболеваний у страдающего ими млекопитающего. 19 Активные соединения по данному изобретению и их фармацевтически приемлемые соли можно вводить как пероральным, так и парентеральным и местным путем. В общем, эти соединения желательней всего вводить в дозировках в диапазоне от примерно 0,01 до примерно 250 мг в день, едиными или дробными дозами (то есть от 1 до 4 доз в день), хотя по необходимости имеют место вариации, зависящие от биологического вида, веса и состояния объекта воздействия и конкретного выбранного пути введения. Однако желательней всего применять уровень дозировки, который находится в диапазоне от примерно 0,07 мг до примерно 21 мг на кг веса тела в день. Тем не менее, имеют место вариации, зависящие от вида животного, подлежащего воздействию, и его индивидуальной реакции на названный медикамент, также как и от типа выбранной фармацевтической рецептуры и периода времени и интервала для осуществления введения. В некоторых случаях более, чем адекватными, могут быть уровни дозировки ниже нижней границы вышеуказанного диапазона,тогда как в других случаях можно применять и еще большие дозы без оказания какого-либо вредного побочного действия - при условии, что такие увеличенные дозы сначала делятся на несколько малых доз для введения на протяжении дня. Активные соединения по данному изобретению можно вводить изолированно или в комбинации с фармацевтически приемлемыми носителями или разбавителями любым из трех путей, указанных ранее, и такое введение можно осуществлять одной или многими дозами. Конкретней, новые терапевтические агенты по данному изобретению можно вводить в широком множестве разных дозировочных форм, то есть их можно комбинировать с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, лепешек, пастилок, леденцов, порошков, аэрозолей, кремов,мазей, суппозиториев, желе, гелей, паст, лосьонов, линиментов, водных суспензий, инъекционных растворов, эликсиров, сиропов и тому подобного. Такие носители включают твердые разбавители или наполнители, стерильные водные среды, различные нетоксические органические растворители и т.д. Более того, пероральные фармацевтические композиции можно подходящим образом подслащать и/или можно вводить в них вкусовые и/или ароматические добавки. В общем, терапевтически эффективные соединения по данному изобретению присутствуют в таких дозировочных формах при уровнях концентрации от примерно 5,0% до примерно 70% по весу. Для перорального введения можно применять таблетки, содержащие различные эксципиенты, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, фосфат дикальция и глицин, наряду с различными де 002270 20 зинтегрантами, такими как крахмал (и предпочтительно кукурузный, картофельный или тапиоковый крахмал), альгиновая кислота и определенные сложные силикаты вместе с гранулирующими вяжущими агентами типа поливинилпирролидона, сахарозы, желатина и гуммиарабика. Кроме того, для целей таблетирования часто очень полезны смазывающие агенты (лубриканты), такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции подобного типа можно также применять как наполнители в желатиновых капсулах; предпочтительные в этой связи материалы также включают лактозу или молочный сахар, так же как высокомолекулярные полиэтиленгликоли. Когда для перорального введения желательны водные суспензии и/или эликсиры, активный ингредиент можно комбинировать с различными подслащающими агентами и корригентами,окрашивающими веществами или красителями и, если это желательно, также и эмульгирующими или суспензирующими агентами вместе с такими разбавителями как вода, этанол, пропиленгликоль, глицерин и разные подобные комбинации таковых. Для парентерального введения можно использовать растворы активного соединения по данному изобретению как в кунжутном или арахисовом масле, так и в водном пропиленгликоле. Водные растворы при необходимости следует подходящим образом забуферить (рН предпочтительно выше чем 8), а жидкий разбавитель сначала сделать изотоническим. Эти водные растворы подходят для целей внутривенного введения. Масляные растворы подходят для целей внутрисуставного, внутримышечного и подкожного введения. Приготовление всех этих растворов в стерильных условиях легко осуществить с помощью стандартных фармацевтических методик, хорошо известных специалистам. Дополнительно, активные соединения по данному изобретению можно вводить еще и местно при лечении воспалительных состояний кожи, и делают это посредством кремов, желе,гелей, паст, пластырей, линиментов и тому подобного в соответствии со стандартной фармацевтической практикой. Способность соединений формулы I ингибировать СОА можно определить, пользуясь процедурами, описанными в литературе. Способность соединений формулы I ингибировать эндотелиальную СОА можно определить, пользуясь процедурами, которые описали Schmidt etU.S.A., 88, pp. 10480-10484 (1991). Способность соединений формулы I ингибировать индуцибельную СОА можно определить, пользуясь процедурами, которые описали Schmidt et al. в 21 формулы I ингибировать нейрональную СОА можно определить, пользуясь процедурой, которую описали Bredt and Synder в Proc. Natl.Acad. Sci. U.S.A., 87, pp. 682-685 (1990). Из 100 соединений формулы I, которые были тестированы, все проявляли IС 5010 мкМ при ингибировании как индуцируемой, так и нейрональной СОА. Настоящее изобретение проиллюстрировано нижеследующими примерами. Однако будет понятно, что данное изобретение не ограничено конкретными деталями этих примеров. Температуры плавления не скорректированы. Спектры протонного ядерного магнитного резонанса(1 Н ЯМР) и 13 С ядерного магнитного резонанса определяли для растворов дейтерохлороформа(СDСl3) или в CD3OD или CD3SOCD3, а положения пиков выражали в частях на миллион(ррm) относительно тетраметилсилана (TMS). Формы пиков определяли так: s синглетный, d дублетный, t триплетный, q квартетный, m мультиплетный, b широкий. Пример 1. 6-4-[2-(-Фенетилпиперазин-1 ил)-этил]-фенил-пиридин-2-иламин. А. 2-Амино-6-бромпиридин. В баллон на 300 мл помещали 40 г (168 ммоль) 2,6-дибромпиридина и 125 мл 30% водного гидроксида аммония, баллон герметизировали и нагревали при 170 С и давлении 2757 кПа (400 фунтов на кв.дюйм) в течение 3 ч. После охлаждения содержимое экстрагировали этилацетатом, промывали соляным раствором и сушили над сульфатом натрия. Затем растворитель выпаривали. Остаток хроматографировали на силикагеле, используя 2% метанол в хлориде метилена в качестве элюента, с получением 19,5 г (67%) светло-желтого твердого вещества. 1MS (%): 173/175 (parent, B79/Br81, 100/98). Б. 2-Бром-6-(2,5-диметилпиррол-1-ил)пиридин. В круглодонную колбу на 1 л, снабженную ловушкой Дина-Старка, конденсатором и впускным отверстием для азота, добавляли 21,3 г(123 ммоль) 2-амино-6-бромпиридина, 400 мл толуола, 14,1 г (123 ммоль) ацетонилацетона и 20 капель уксусной кислоты. Реакционную смесь нагревали при дефлегмации в течение 5 дней (после ТСХ в 1/1 этилацетат/гексане: у продукта Rf=0,8; у исходного материала Rf=0,5),охлаждали, выливали в этилацетат, промывали насыщенным водным раствором бикарбоната натрия и соляным раствором, сушили над сульфатом натрия и упаривали. Остаток хроматографировали на силикагеле, используя 5%-ный метанол в хлориде метилена, с получением 14,4 г (47%) продукта в виде желтого твердого вещества с низкой температурой плавления. 1MS (%): 251/235 (parent, В 79/Вr81, 100/98). В. 2-(4-Йодфенил)этанол). В круглодонную трехгорлую колбу на 500 мл, снабженную капельной воронкой и впускным отверстием для азота, добавляли 20,5 г (150 ммоль) 2-(4-аминофенил)этанола и 100 мл горячей воды с получением раствора. По каплям добавляли раствор 3,5 мл концентрированной серной кислоты в 10 мл воды и полученный раствор охлаждали до 4 С. По каплям добавляли раствор 13,5 мл концентрированной серной кислоты в 50 мл воды, поддерживая температуру в пределах от 0 до 5 С, затем при той же температуре по каплям добавляли раствор 13 г(188 ммоль) нитрита натрия в 50 мл воды. После перемешивания в течение 30 мин при 0-5 С по каплям добавляли раствор 85 г (512 ммоль) йодида калия в 100 мл воды, давали нагреться реакционной смеси до комнатной температуры и перемешивали 2 ч. Затем реакционную смесь нагревали до 60 С в течение 30 мин, охлаждали до комнатной температуры и экстрагировали этилацетатом (2 х 250 мл). Слой этилацетата промывали водным раствором тиосульфата натрия и соляным раствором, сушили над сульфатом натрия и упаривали. Остаток хроматографировали на силикагеле, используя 20 и 50% этилацетат в гексане в качестве элюента, с получением 30,7 г (82,5%) продукта в виде светложелтого твердого вещества. 1 Н-ЯМР (CDCl3, ): 2,74 (m, 2H), 3.79 (m,2H), 6, 93 (m, 2H), 7, 57 (m, 2H). 13 С-ЯМР (СDСl3, ): 38.6, 63.3, 91.7, 131.1,137.6, 138.3.MS (%): 247 (parent, 23). Г. 2-(4-Йодфенил)этилхлорид. В круглодонную колбу на 500 мл, снабженную капельной воронкой, конденсатором и впускным отверстием для N2, добавляли 307 г(124 ммоль) 2-(4-йодфенил)этанола, 200 мл хлороформа и 10,0 мл (124 ммоль) пиридина. По каплям в течение 15 мин добавляли раствор 13,5 мл (186 ммоль) тионилхлорида в 50 мл хлороформа и затем реакционную смесь нагревали с дефлегмацией в течение 2 ч. Реакционную смесь охлаждали, растворитель выпаривали, а остаток собирали в этилацетат, промывали 1 н. соляной кислотой, насыщенным водным раствором бикарбоната и соляным раствором, сушили и упаривали. Получаемое маслянистое вещество хроматографировали на силикагеле, используя 20% этилацетат в гексане в качестве элюента, с получением 32,6 г (99%) продукта в виде маслянистого вещества. 1 Н-ЯМР (CDCl3, ): 3.00 (t, J=7, 2 Н), 3.68 (t,J=7, 2H), 6.99 (m, 2H), 763 (m, 2H). 13 С-ЯМР (CDCl3, ): 38.6, 44.6, 92.3, 128.8,130.9, 137.7. 13 23 Д. 2-(2,5-Диметилпиррол-1-ил)-6-(4-(2 хлорэтилфенил)пиридин. В трехгорлую круглодонную колбу на 1 л,снабженную капельной воронкой и впускным отверстием для азота, добавляли 10,0 г (40 ммоль) 2-бром-6-(2,5-диметилпиррол-1-ил)пиридина и 200 мл сухого тетрагидрофурана. Полученный раствор охлаждали при -78 С и по каплям в течение 10 мин добавляли 1,6 М раствор бутиллития в гексане (25 мл: 40 ммоль). Реакционную смесь перемешивали при -78 С в течение 20 мин и затем по каплям в течение 40 мин добавляли 1,0 М раствор хлорида цинка в эфире (100 мл: 100 ммоль), поддерживая температуру на уровне -70 С. Затем давали реакционной смеси нагреться до комнатной температуры и добавляли 11,0 г (40 ммоль) 2-(4-йодфенил)этилхлорида, а затем добавляли 200 мг тетракис-трифенилфосфинового палладия. Затем реакционную смесь нагревали при дефлегмации 3 ч, охлаждали и фильтровали через целит. Фильтрат упаривали, а остаток собирали этилацетатом, промывали соляным раствором, сушили над сульфатом натрия и упаривали. Остаток фильтровали через силикагель с хлоридом метилена, концентрировали и хроматографировали на силикагеле, используя 1% этилацетат в гексане в качестве элюента, с получением 7,3 гMS (%): 311 (parent+1, 100). Е. Гидрохлорид 6-(4-(2-хлорэтил)-фенил)пиридин-2-иламина. В круглодонную колбу на 500 мл, снабженную конденсатором и впускным отверстием для азота, добавляли 9,0 г (29,0 ммоль) 2-(2,5 диметилпиррол-1-ил)-6-(4-(2-хлорэтил)фенил)пиридина, 250 мл этанола, 50 мл воды и гидрохлорид гидроксиламина в количестве 10,1 г (145 ммоль). Реакционную смесь оставляли с дефлегмацией в течение 36 ч, охлаждали ее и выпаривали растворитель. Остаток собирали этилацетатом, промывали насыщенным водным раствором бикарбоната натрия и соляным раствором, сушили над сульфатом натрия и упаривали. Остаток хроматографировали на силикагеле,используя 2% метанол в хлориде метилена в качестве элюента, с получением 7,8 г (88%) продукта в виде светло-коричневого твердого вещества. 1 24 Ж. 6-4-[2-(4-Фенетилпиперазин-1-ил)этил]фенилпиридин-2-иламин. В круглодонную колбу на 50 мл, снабженную конденсатором и впускным отверстием для(0,65 ммоль), 125 мг (0,98 ммоль) диизопропилэтиламина, 208 мг (1,9 ммоль) карбоната натрия и 5 мл сухого диметилформамида. Эту реакционную смесь нагревали при дефлегмации в течение 18 ч, охлаждали, и выливали в воду,после чего экстрагировали этилацетатом. Органический слой экстрагировали 1 н. соляной кислотой, после чего водный слой промывали свежим этилацетатом, подщелачивали 1 н. водным раствором гидроксида натрия и затем экстрагировали этилацетатом. Органический слой промывали соляным раствором, сушили над сульфатом натрия и упаривали. Остаток хроматографировали на силикагеле, используя 2 и 5% метанол в хлориде метилена в качестве элюента,с получением 71 мг (28%) продукта в виде желто-коричневого твердого вещества с темп. плавл. 111-113 С. 1(6-(трет-бутоксикарбониламино)-3 азабицикло[3.1.0]гексана, с выходом 48% в виде коричневого маслянистого вещества. 1MS (%): 395 (parent, 100). 3-2-[4-(6-Аминопиридин-2-ил)-фенил]этил-3-аза-бицикло[3.1.0]гекс-6-иламин. В круглодонную колбу на 25 мл, снабженную впускным отверстием для азота, добавляли 135 мг (0,342 ммоль) 6-2-(6-(трет-бутоксикарбониламино)-3-азабицикло[3.1.0]гекс-3-ил)этил)-фенил)-пиридин-2-иламина, 10 мл хлорида метилена и 3 мл трифторуксусной кислоты. После перемешивания в течение 30 мин при 25 комнатной температуре реакционную смесь упаривали, а остаток перетирали с тетрагидрофураном и этиловым эфиром с получением 195 мг (76%) желтоватого твердого вещества с температурой плавления 187-190 С. 1C18H22N4 3(C2HF3O2): С 45.29, Н 3.96, N 8.80. Найдено: С 45.30, Н 3.93, N 8.80. Пример 3. 1-(4-2-[4-(6-Аминопиридин-2 ил)-фенил]-этил-пиперазин-1-ил)-2-фенилэтанон. А. 6-2-(4-(трет-Бутоксикарбонил)пиперазин-1-ил)этил)фенил)пиридин-2-иламин. Заглавное соединение готовили, применяя описанную в 1 Ж процедуру с использованием трет-бутоксикарбонилпиперазина, с выходом 57,7% в виде светло-коричневого твердого вещества, при использовании метилизобутилкетона в качестве растворителя и кипячении с дефлегмацией в течение 5 дней. 1 Н-ЯМР (CDCl3, ): 1.45 (s, 9H), 2.46 (m,4H), 2.61 (m, 2H), 2.84 (m, 2H), 3.45 (m, 4H) 4.48MS (%): 283 (parent, 100). В. 1-(4-2-[4-(6-Аминопиридин-2-ил)фенил]этилпиперазин-1-ил)-2-фенилэтанон. В круглодонную колбу на 50 мл, снабженную впускным отверстием для азота, добавляли 150 мг (0,53 ммоль) 6-2-(пиперазин-1-ил)этил)фенил)пиридин-2-иламина, 15 мл хлорида метилена, 0,070 мл (0,53 ммоль) триэтиламина и 0,070 мл (0,53 ммоль) фенилацетилхлорида. Реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Остаток хромато 002270MS (%): 401 (parent +1, 100). Анализ. Рассчитано для C25H28N41/4H2O: С 74.17, Н 7.04, N 13.83. Найдено: С 74.48, Н 7.05, N 13.86. Пример 4. Фениламид 4-2-[4-(6-аминопиридин-2-ил)фенил]этилпиперазин-1-карбоновой кислоты. В круглодонную колбу на 50 мл, снабженную впускным отверстием для азота, добавляли 150 мг (0,53 ммоль) 6-2-(пиперазин-1-ил)этил)-фенил)-пиридин-2-иламина, 60 мкл (0,53 ммоль) фенилизоцианата,10 мл 1,2 дихлорэтана, 10 мл этилацетата и 64 мг (0,53 моль) 4-метиламинопиридина. Реакционную смесь перемешивали при комнатной температуре в течение 14 ч, упаривали и хроматографировали на силикагеле, используя 5% метанол в хлориде метилена в качестве элюента, с получением 205 мг (96%) продукта в виде пенистого вещества, темп. плавл. 60 С. 1 Н-ЯМР (CDCl3, ): 2.55 (m, 4H), 2.68 (m,2H), 2.85 (m, 2H), 3.52 (m, 4H), 4.49 (broad s,2H), 6.39 (s, 1 Н), 6.42 (d, J=8, 1H), 7.0-7.4 (m,7H), 7.48 (t, J=8, 1H), 7.86 (m, 2H). 13 С-ЯМР (CDCl3, ): 33.3, 44.1, 52.8, 60.1,106.9, 110.8, 119.9, 123.1, 126.9, 128.9, 137.7,138.4, 139.0, 140.6, 155.0, 156.0, 158.2.MS (%): 402 (parent +1, 100). Анализ. Рассчитано для C24H27N5O1/2H2O: С 70.22, Н 6.88, N 17.06. Найдено: С 70.27, Н 6.60, N 17.22. Пример 5. 1-(4-2-[4-(6-Аминопиридин-2 ил)фенил]этилпиперазин-1-ил)-2-(4-фторфенил)этанон. В круглодонную колбу на 50 мл, снабженную впускным отверстием для азота, добавляли 200 мг (0,71 ммоль) 6-2-(пиперазин-1-ил)этил)фенилпиридин-2-иламина, 10 мл сухого диметилформамида, 109 мг (0,71 ммоль) 4 фторфенилуксусной кислоты, 204 мг (1,1 моль) этил-(3-диметиламинопропил)карбодиимида и 0,36 мл (2,1 ммоль) диизопропилэтиламина. Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, выливали в воду и экстрагировали этилацетатом. Органический слой экстрагировали 1 н. соляной кислотой, водный слой промывали свежим этилацетатом,подщелачивали 1 н. водным раствором гидро 27 ксида натрия и экстрагировали этилацетатом. Органический слой промывали соляным раствором, сушили над сульфатом натрия и упаривали. Остаток хроматографировали на силикагеле с 3% метанолом в метиленхлориде, с получением 100 мг (34%) продукта в виде желтовато-коричневого твердого вещества, темп. плавл. 134-135 С. 1(m, 8H), 2.6 (m, 2H), 2.75 (m, 2H), 2.96 (s, 2H),4.07 (hp, J=6, 1 Н), 4.52 (bs, 2H, NH), 6.42 (d, J=8,1H), 6.92 (m, 1H), 7.03 (d, J=7, 1H), 7.24 (m, 2H),7.46 (t, J=8, 1H), 7.82 (m, 2H). 13 С-ЯМР (CDCl3, ): 22.8, 33.4, 40.7, 53.2,53.4, 60.2, 61.6, 106.9, 110.7, 126.9, 128.9, 137.7,138.3, 140.7, 156.0, 158.2, 169.1. МС (%): 382 (parent+1, 100), 198 (75). Анализ. Рассчитано для С 23 Н 31N5 О: С 69.26, Н 8.19, N 18.36. Найдено: С 68.97, Н 8.36,N 18.58. Пример 24. Этиловый эфир (4-2-[4-6 аминопиридин-2-ил)фенил]этилпиперазин-1 ил)уксусной кислоты. Приготовлено как в примере 1, с использованием 4-(N-карбоэтоксиметил)пиперазина, с выходом 16%, в виде твердого вещества с низкой температурой плавления. 1(70), 119 (38). МС высокого разрешения (%): 369.23070 (parent+1, 100, рассчитано 369.22905). Пример 25. (4-2-[4-(6-Аминопиридин-2 ил-фенил]этилпиперазин-1-ил)фенилметанон. Приготовлено как в примере 1, с использованием N-бензоилпиперазина, с выходом 43%,темп. плавл. 125-127 С. 1H-ЯМР в виде гидрохлорида (МеOD, ): 2.2-2.6 (m, 2H), 3.2-3.4 (m, 5H), 3.5-3.7 (m, 2 Н),3.7-4.0 (m, 2H). 6.99 (d, J=8, 1H), 7.17 (d, J=7,1H), 7.3-7.5 (m, 5 Н), 7.59 (m, 2H), 7.83 (m, 2H),7.97 (t, J=8, 1H). 13 С-ЯМР (CDCl3, ): (алифатический и некоторые из ароматических углеродов продублированы, возможно, из-за ограниченного вращения) 31.9, 32.7, 32.8, 34.2, 55.0, 56.5, 56.9. 57.5,60.6. 60.9. 111.9, 112.9, 128.4, 128.6, 128.7, 128.9,130.0, 131.2. 131.9, 139.8, 140.8, 141.6, 145.9,147.8, 156.8. МС (%): 344 (parent+1, 100), 197 (26), 160H2O: С 61.77, Н 6.66, N 10.29. Найдено: С 61.49,Н 6.67. N 10.35. Пример 36. 1-(3-2-[4-(6-Аминопиридин-2 ил)фенил]этил-3-азабицикло[3.1.0]гекс-6-ил)3-фенилмочевина. Готовили из конечного соединения примера 2, используя фенилизоцианат, с выходом 67%, темп. плавл. 192-194 С. 1(81), 127 (63). Анализ. Рассчитано для C25H27N5O: С 72.61, Н 6.58, N 16.94. Найдено: С 72.34, Н 6.24,N 17.00. Пример 37. (3-2-[4-(6-Аминопиридин-2 ил)фенил]этил-3-азабицикло[3.1.0]гекс-6-ил) диметиламин. Готовили из конечного соединения примера 2, используя формальдегид в муравьиной кислоте при 80 С в течение 2,5 ч, с выходом 56.5%, в виде аморфного твердого вещества. 1 Н-ЯМР (CDCl3, ): 1.47 (m, 2H), 1.89 (m,1H), 2.31 (s, 6H), 2.41 (m, 2H), 2.66 (m, 2H), 2.74C20H26N4 3HClH2O: С 53.40, Н 6.45, N 12.45. Найдено: С 53.44, Н 7.03, N 12.32. Пример 38. N-(3-2-[4-(6-Аминопиридин 2-ил)-фенил]-этил-3-азабицикло[3.1.0]гекс-6 ил)-2-(4-фторфенил)-ацетамид. Готовили из конечного соединения примера 2, используя присоединение 4-фторфенилуксусной кислоты, опосредованное N-этил, N-(3 37 диметиламинопропил)-карбодииидом, с выходом 38%, темп. плавл. 161-163 С. 1(60), 197 (95). Анализ. Рассчитано для С 25 Н 29N5 О: С 72.26, Н 7.03, N 16.85. Найдено: С 72.08, Н 7.08,N 16.74. Пример 46. (3-2-[4-(6-Аминопиридин-2 ил)-фенил]-этил-3-азабицикло[3.1.0]гекс-6-ил)фенетиламин. Готовили, используя конечный продукт примера 2, в реакции с фенилацетальдегидом и цианоборгидридом натрия в метаноле, с выходом 41%, темп. плавл. 165 С (с разложением, в виде гидрохлорида). 1(d, J=7, 1H), 7.1-7.3 (m, 7H), 7.43 (t, J=8, 1H),7.82 (m, 2H). 13 С-ЯМР (CDCl3, ): 24.4, 35.0, 36.1, 39.0,50.6, 55.0, 57.3, 106.9, 110.7, 126.1, 126.8, 128.5,128.7, 128.9, 137.6, 138.35, 140.0, 140.7, 156.0,158.2. МС высокого разрешения (%): Рассчитано для С 26 Н 30N4: 399.2549. Найдено: 399.2534. Пример 47. Бензиламид 4-2-[4-(6-аминопиридин-2-ил)фенил]этилпиперазин-1-карбоновой кислоты. Готовили как в примере 3, используя бензилизоцианат, с выходом 60%, темп. плавл. 172175 С.[3.1.0]гекс-6-ил)-(3-фенилпропил)амина. Готовили из конечного соединения примера 2, используя 3-фенилпропиональдегид, через восстановительное аминирование с помощью цианобромида натрия в метаноле, с выходом 27%, темп. плавл. 160-163 С, в виде гидрохлорида из дихлорэтана. 1(66), 91 (100). Анализ. Рассчитано для С 27 Н 32N42 НСl 2 Н 2O1/2 С 2 Н 4 Сl2: С 58.90, Н 7.06, N 9.81. Найдено: С 59.19, Н 7.18, N 9.46. Пример 52. 2-(3-2-[4-(6-Аминопиридин-2 ил)фенил]этил-3-азабицикло[3.1.0]гекс-6 иламино)ацетамид. Готовили из конечного соединения примера 2, используя йодацетамид, с выходом 39.5%,темп. плавл. 140 С (с разложением). 1 Н-ЯМР (CDCl3, ): 1.51 (m, 2H), 2.41 (m,1H), 2.50 (m, 2H), 2.65 (m, 2H), 2.75 (m, 2H), 3.05(m, 2H). 13 С-ЯМР (CDCl3, ): 25.3, 35.7, 40.6, 56.1,58.6, 60.1, 108.5, 111.1, 128.0, 129.8, 139.2, 139.7,141.9, 157,1, 161.0, 177.0. МС высокого разрешения (%): 352(100), 338 (75), 332 (55). Анализ. Рассчитано для C28H31N5O2 1/2H2O: С 70.27, Н 6.74, N 14.63. Найдено: С 70.16, Н 6.65, N 14.85. Пример 58. 8-2-[4-(6-Аминопиридин-2 ил)-фенил]-этил-8-азабицикло[3.2.1]окт-3 иламин. Готовили как в примере 1, используя 8 азабицикло[3.2.1]-окт-3-иламин, с последующим снятием защиты с помощью трифторуксусной кислоты, с выходом 67%, темп. плавл. 300 С, в виде гидрохлорида. 1 Н-ЯМР (CDCl3, ): 1.45 (m, 4 Н), 1.54 (m,2 Н), 1.68 (m, 2H), 1.91 (m, 2H), 2.63 (m, 2H), 2.78(962). Анализ. Рассчитано для С 26 Н 31N5OНСl 4/5 Н 2O-СН 2 Сl2: С 56.55, Н 6.42, N 12.21. Найдено: С 56.88, Н 6.84, N 12.09. Пример 60. 6-(4-2-[4-(2-Аминоэтил)пиперазин-1-ил]этилфенил)пиридин-2-иламин. Готовили как в примере 1, используя (2 аминоэтил)пиперазин в виде трет-бутилкарбамата с последующим снятием защиты с помощью трифторуксусной кислоты в хлориде метилена, с 90% выходом трифторацетата, в виде гигроскопичного твердого вещества. 1C19H27N5: 326.2345. Найдено: 326.2340. Пример 61. 2-Амино-1-(4-2-[4-(6-аминопиридин-2-ил)фенил]этилпиперазин-1-ил)-3 фенилпропан-1-он. Готовили из заглавного соединения примера 3 Б, используя присоединение трет-ВОС к фенилаланину, опосредованное N-этил, N-(3 диметиламинопропионил)карбодиимидом,с выходом 68%, с последующим снятием защиты с помощью трифторуксусной кислоты в хлориде метилена, с выходом 78%, темп. плавл. 230 С (с разложением), в виде гидрохлорида из этилового эфира. 1(100), 103 (61). Анализ. Рассчитано для С 26 Н 39N4OFНСl 3/4 Н 2O: С 60.17, Н 6.31, N 10.80. Найдено: С 60.56, Н 6.24, N 10.75. Пример 66. 2-[4-(6-Аминопиридин-2-ил)фенил]этил(8-азабицикло[3.2.1]окт-3-ил)амин. Готовили как в примере 1, используя Nбензил-(8-азабицикло[3.2.1]окт-3-ил)амин с последующим дебензилирование с помощью формиата аммония и 10% палладия на углероде в этаноле, с выходом 71%, темп. плавл. 170 С (с разложением), в виде гидрохлорида. 1(81), 110 (100). Анализ. Рассчитано для C20H26N42HCl 2H2O1/4CH2Cl2: С 53.73, Н 7.24, N 12.38. Найдено: С 53.48, Н 7.23, N 12.04. Пример 67. 6-4-[2-(4-Аминопиперидин-1 ил)этил]фенилпиридин-2-иламин. Готовили как в примере 1, используя 4(трет-бутоксикарбониламино)пиперидин, с последующим деблокированием с помощью трифторуксусной кислоты в хлориде метилена при комнатной температуре, с выходом 100%, темп. плавл. 190-195 С, в виде трифторацетата. 1(m, 2H), 2.79 (m, 2H), 2.8-2.9 (m, 4H), 3.5-3.7 (m,8H), 4.48 (bs, 2H), 6.41 (d, J=8, 1H), 7.04 (d, J=7,1H), 7.24 (m, 2H), 7.46 (t, J=8, 1H), 7.81 (m, 2H). 13 С-ЯМР (CDCl3, ): 33.4, 34.0, 37.0, 56.4,49.9, 60.3, 61.3, 67.1, 106.9, 110.7, 126.8, 128.9,137.0, 138.3, 156.0, 158.2 (карбонильный углерод на этом скане не виден). МС (%): 410 (parent+1, 12), 242 (100). Анализ. Рассчитано для C25H29N5O 2HCl1/2H2O3/4CH2Cl2: С 55.11, Н 6.02, N 12.48. Найдено: С 55.34, Н 6.05, N 12.14. Пример 69. Пирролидинамид 4-амино-12-[4-(6-аминопиридин-2-ил)фенил]этилпиперидин-4-карбоновой кислоты. Готовили как в примере 1, используя пирролидинамид 4-аминопиперидин-4-карбоновой кислоты, с выходом 39%, темп. плавл. 220 С (с разложением), в виде гидрохлорида. 1FAB-MC (%): 394 (parent+1, 28), 197 (38),149 (63), 133 (100). Анализ. Рассчитано для С 23 Н 31N5OНСl 1/4 Н 2O-СН 2 Сl2: С 55.50, Н 6.64, N 13.48. Найдено: С 55.79, Н 6.85, N 13.10. Пример 70. 6-4-[2-(3-Аминопирролидин 1-ил)этил]фенилпиридин-2-иламин. Готовили как в примере 1, используя 3(трет-бутоксикарбониламино)пирролидин с последующим снятием защиты с помощью трифторуксусной кислоты в хлориде метилена при комнатной температуре, с выходом 92%, темп. плавл. 135 С (с разложением), в виде гидрохлорида. 1 Н-ЯМР (CDCl3, ): 1.4-1.5 (m, 3 Н), 2.16(100), 109 (30). Анализ. Рассчитано для C28H31N4OF2HCl 3/4H2O: С 61.70, Н 6.38, N 10.28. Найдено: С 61.82, Н 6.43, N 10.11. Пример 72. 1-(1-2-[4-(6-Аминопиридин-2 ил)-фенил]-этил-пирролидин-3-ил)-3-фенилмочевина. Готовили из примера 73, используя фенилизоцианат, с выходом 53.5%, темп. плавл. 130 С (с разложением), в виде гидрохлорида из хлорида метилена/эфира. 1 Н-ЯМР (CDCl3, ): 1.64 (m, 1 Н), 2.22 (m,2 Н), 2.46 (m, 1 Н), 2.69 (m, 2 Н), 2.79 (m, 4 Н), 2.97(48), 133 (100), 119 (78), 103 (48). Анализ. Рассчитано для C24H27N5OHCl 1/2C4H10O1/2CH2Cl2: С 57.46, Н 6.37, N 12.64. Найдено: С 57.74, Н 6.35, N 12.44. Пример 73. 1-(1-2-[4-(6-Аминопиридин-2 ил)фенил]этилпирролидин-3-ил)-3 бензилмочевина. Готовили из примера 73, используя бензилизоцианат, с выходом 42%, темп. плавл. 90 С(с разложением), в виде гидрохлорида из хлорида метилена/эфира. 1(63), 119 (55), 91 (65). Анализ. Рассчитано для C21H29N5OHCl 1/2C4H10O1/2CH2Cl21/2H2O: С 57.25, Н 6.64, N 12.14. Найдено: С 56.93, Н 6.64, N 11.74. Пример 74. 1-(1-2-[4-(6-Аминопиридин-2 ил)фенил]этилпирролидин-3-ил)-3 циклогексилмочевина. Готовили из примера 73, используя циклогексилизоцианат, с выходом 27%, темп. плавл. 120 С (с разложением), в виде гидрохлорида из хлорида метилена/эфира. 1 Н-ЯМР (CDCl3, ): 1.02 (m, 3 Н), 1.26 (m,3 Н), 1.50 (m, 1H), 1.60 (m, 3 Н), 1.83 (m, 2H), 2.56(100), 133 (61). Анализ. Рассчитано для С 24 Н 33N5O2 НСl1/2 С 4 Н 10 О 5/4 Н 2O: С 54.64, Н 7.53, N 12.02. Найдено: С 54.52, Н 7.28, N 12.00. Пример 75. 2-[4-(6-Аминопиридин-2 ил)фенил]этил(8-метил-8-азабицикло[3.2.1]окт-3 ил)амин. Готовили как в примере 1, используя (8 метил-8-азабицикло[3.2.1]окт-3-ил)-амин, с выходом 27%, темп. плавл. 98 С (с разложением),в виде гидрохлорида из эфира. 1(100). Анализ. Рассчитано для С 27 Н 33N5O3 НСl: С 58.65, Н 6.56, N 12.66. Найдено: С 58.29, Н 6.97,N 12.28. Пример 80. Фениламид 3-2-[4-(6-аминопиридин-2-ил)фенил]этиламинопирролидин-1 карбоновой кислоты. Готовили как в примере 1, используя фениламид 3-аминопирролидинкарбоновой кислоты, с выходом 8%, темп. плавл. 130 С (с разложением), в виде гидрохлорида из этилового эфира. 1 Н-ЯМР (CDCl3, ): 1.64 (m, 1H), 2.20 (m,2H), 2.46 (dd, J=3.7, 1H), 2.66 (m, 2H), 2.78 (m,4H), 2.97 (m, 1H). 4.25 (bs, 1H, NH), 4.53 (bs, 2H,NH), 5.85 (d, J=7, 1H), 6.40 (d, J=8, 1H), 6.9-7.0H2OC4H10O: С 59.36, Н 7.29, N 12.36. Найдено: С 59.34, Н 6.69, N 12.59. Пример 81. (3-2-[4-(6-Аминопиридин-2 ил)фенил]этиламинопирролидин-1-ил)-фенилметанон. Готовили как в примере 1, используя 3 аминопирролидин-1-ил-фенилметанон, с выходом 10%, темп. плавл. 130 С (с разложением), в виде гидрохлорида из этилового эфира. 1(31), 103 (36). Анализ. Рассчитано для C28H31N4FO2HCl 1/2H2O: С 62.22, Н 6.34, N 10.37. Найдено: С 61.99, Н 6.50, N 10.01. Пример 86. 6-4-[2-(3-Аминопиперидин-1 ил)этил]фенилпиридин-2-иламин. Готовили как в примере 1, используя 3(трет-бутоксикарбониламино)пиперидин, с выходом 100%, с последующей конденсацией с 6 аминопиридин-2-ил)фенил]-2-хлорэтаном и деблокированием с помощью трифторуксусной кислоты в хлориде метилена, темп. плавл. 150 С 54 Пример 88. N-(3-2-[4-(6-Аминопиридин 2-ил)фенил]этил-3-азабицикло[3.3.1]нон-9-ил) бензамид, син-изомер. Готовили как в примере 1, используя 3 азабицикло[3.3.1]нон-9-ил-бензамид, син-изомер, с выходом 9%, в виде гидрохлорида, в виде гигроскопичного твердого вещества. 1 55 Пример 91. 3-2-[4-(6-Аминопиридин-2 ил)фенил]этил-3-азабицикло[3.3.1]нон-9 иламин. Готовили как в примере 1, используя третбутилкарбамат 3-азабицикло[3.3.1]нон-9-иламина с последующим снятием защиты с помощью трифторуксусной кислоты в хлориде метилена,с выходом 85%, в виде твердого вещества с низкой температурой плавления, в виде гидрохлорида. 1 Н-ЯМР (CDCl3, ): 1.28 (m, 1H), 1.48 (m,2H), 1.61 (bs, 2H), 1.82 (m, 2H), 2.26 (m, 2H),2.35 (m, 1H), 2.46 (t, J=7, 2H), 2.78 (m, 3 Н), 3.02[3.1.0]гексан-6-карбоновой кислоты. Готовили как в примере 1, используя этиловый эфир 3-азабицикло[3.1.0]гексан-6-карбоновой кислоты, с выходом 18%, в виде твердого вещества с низкой температурой плавления, в виде гидрохлорида. 1(100), 113 (20). Анализ. Рассчитано для C21H25N3O22HCl: С, Н, N. Найдено: С, Н, N. Пример 93. 3-2-[4-(6-Аминопиридин-2 ил)фенил]этил-3-азабицикло[3.1.0]гексан-6 карбоновая кислота. Готовили гидролизом примера 92 с помощью 2 н. соляной кислоты при 70 С в течение 8 ч, с выходом 83%, в виде твердого вещества с низкой температурой плавления, в виде гидрохлорида. 1 56 МС высокого разрешения. Рассчитано для С 19 Н 22N3O2 (parent+1): 324.1712. Найдено: 324.1717. Пример 94. трет-Бутиловый эфир 3-2-[4(6-аминопиридин-2-ил)фенил]этиламинопиперидин-1-карбоновой кислоты. Готовили как в примере 1, используя третбутиловый эфир пиперидин-1-карбоновой кислоты, с выходом 29%, в виде пенистого вещества. 1C23H33N4O2 (parent+1): 97.26035. Найдено: С 397.2581. Пример 95. 6-4-[2-(2-Пиперидин-3-иламино)этил]фенилпиридин-2-иламин. Приготовлено снятием защиты с примера 94 с помощью трифторуксусной кислоты в хлориде метилена с выходом 92%, в виде гидрохлорида из этилового эфира. 1(очистку осуществляли через образование третбутилкарбаматного производного с последующей хроматографией и снятием защиты с помощью трифторуксусной кислоты в хлориде метилена), в виде гидрохлорида. 1 Н-ЯМР (CDCl3, ): 1.38 (m, 2H), 1.80 (m,2H), 1.99 (m, 2H), 2.46 (m, 1H), 2.83 (m, 4H), 2.90FAB-MS (%): 387 (parent+1, 47), 174 (31),149 (100), 119 (97), 103 (52). МС высокого раз 57 решения. Рассчитано для С 35 Н 3N4: 387.2548. Найдено: 387.2582. Пример 97. 3-2-[4-(6-Аминопиридин-2 ил)фенил]этил-3-азабицикло[3.1.0]гекс-6 иламин (анти-изомер). Готовили как в примере 1, используя третбутилкарбамат 3-азабицикло[3.1.0]гекс-6-иламина (анти-изомер) с последующим снятием защиты с помощью трифторуксусной кислоты в хлориде метилена, с выходом 79%, в виде гидрохлорида из этилового эфира. 1FAB-MC (%): 295 (parent+1, 3), 279 (10),167 (20), 149 (100), 129 (6), 113 (25). Анализ. Рассчитано для C18H22N4-2HCl1/4CH2Cl2-1/2(C4H10O)-5/4H2O: С 54.27, Н 7.20,N 12.50. Найдено: С 53.92, Н 6.83, N 12.19. Пример 98. 6-4-[2-(Пиперидин-4-иламино)этил]фенилпиридин-2-иламин. Готовили, деблокируя пример 96 с помощью формиата аммония и 10% палладия на углероде в кипящем при дефлегмации этаноле, с выходом 67.5%, в виде гидрохлорида из этилового эфира. 1(100), 119 (30). Анализ. Рассчитано для C18H24N43HCl 1/4H2O1/2(C4H10O): С 53.70, Н 7.32, N 12.52. Найдено: С 53.61, Н 6.99, N 12.18. Пример 99. 6-(4-2-[(Пиперидин-4-илметил)амино]этилфенил)пиридин-2-иламин. Готовили как в примере 1, используя 4 аминометилпиперидин-1-трет-бутилкарбамат с последующим снятием защиты с помощью трифторуксусной кислоты в хлориде метилена,с выходом 80.5%, в виде гидрохлорида. 1(100). Анализ. Рассчитано для С 27 Н 32N4O3 НСl Н 2O: С 58.33, Н 6.71, N 10.08. Найдено: С 58.30,Н 6.78, N 9.92. Пример 103. 2-(4-2-[4-(6-Аминопиридин 2-ил)фенил]этилпиперазин-1-ил)-1-фенилэтанол. Готовили из примера 16, используя боргидрид натрия в метаноле при комнатной температуре в течение 2 ч, с выходом 98.5%, темп. плавл. 235 С (с разложением), в виде гидрохлорида. 1(41), 197 (76), 113 (35), 97 (89). Анализ. Рассчитано для С 25 Н 30N4O3 НСl 1/2 Н 2O: С 57.64, Н 6.58, N 10.76. Найдено: С 57.66, Н 6.45, N 10.77. Пример 104. 2-[4-(6-Аминопиридин-2 ил)фенил]этил(3-окса-9-азабицикло[3.3.1]нон 7-ил)амин. Готовили из примера 101, используя формиат аммония и палладий на углероде в кипящем при дефлегмации этаноле, с выходом 81%,темп. плавл. 100 С (с разложением), в виде гидрохлорида. 1C20H27N4O (parent+1): 339.2184. Найдено: 339.2164. Пример 105. 6-(4-2-[4-(2-Амино-2-фенилэтил)пиперазин-1-ил]этилфенил)пиридин-2 иламин. Готовили из примера 16 через образование оксима метилового эфира с O-метилгидроксиламином в кипящем при дефлегмации метаноле с последующим восстановлением с помощью метилсульфида борана в кипящем при дефлегмации тетрагидрофуране, с выходом 54%, в виде гидрохлорида. 1(Parent+1): 402.2658. Найдено: 402.2657. Пример 106. 9-2-[4-(6-Аминопиридин-2 ил)-фенил]-этил-3-окса-9-азабицикло[3.3.1] нон-7-иламин. Готовили как в примере 1, используя N-трет-бутоксикарбонил-3-окса-9-азабицикло[3.3.1]нон-7-иламин с выходом 9,5%, с последующим удалением трет-бутоксикарбонильной группы с помощью трифторуксусной кислоты в хлориде метилена при комнатной температуре, с выходом 88%, в виде гидрохлорида. 1C20H27N4O (parent+1): 339.2184. Найдено: 339.2155. Пример 107. 2-[4-(6-Аминопиридин-2 ил)фенил]этил(3 окса-9-азабицикло[3.3.]нон-7 ил)амин. Готовили как в примере 107, используя формиат аммония и палладий на углероде в кипящем при дефлегмации этаноле, с выходом 87%, темп. плавл. 170 С (с разложением), в виде гидрохлорида. 1H-ЯМР (CDCl3, ): 1.36 (m, 2H), 2.09 (m,2H), 2.79 (m, 2H), 2.91 (m, 4H), 3.7-3.9 (m, 5H),4.56 (bs, 2H), 6.36 (d, J=8, 1H), 7.01 (d, J=7, 1H),7.23 (m, 2H), 7.42 (t, J=8, 1H), 7.81 (m, 2H). 13 С-ЯМР (CDCl3, ): 36.4, 39.2, 47.7, 48.9,50.5, 71.7, 106.9, 110.6, 126.9, 128.9, 137.7, 138.3,140.6, 155.9, 158.3. МС (%): 339 (parent+1), 167 (21), 149 (100),129 (12), 113 (31). Анализ. Рассчитано для С 20 Н 26N4O3 НСl 3/2 Н 2O: С 51.62, Н 7.29, N 10.94. Найдено: С 51.65, Н 7.24, N 10.95. Пример 108. 6-4-[2-(4-Амино-2,6-диметилпиперидин-1-ил)этил]фенилпиридин-2 иламин (цис-диастереоизомер). А. N-Бензил-2,6-диметилпиперидин-4-он. К круглодонной колбе на 100 мл, снабженной конденсатором и впускным отверстием дляN2, добавляли 40 г (0,28 моль) 1,3-ацетондикарбоновой кислоты, 24,8 г (0,64 моль) ацетальдегида и 60 мл воды. К полученной смеси медленно, в течение 30 мин, добавляли 20 мл (0,28 моль) бензиламина, рН доводили до 4-5 и реакционную смесь перемешивали в течение ночи
МПК / Метки
МПК: A61K 31/44, A61P 29/00, C07D 213/73
Метки: 6-фенилпиридил-2-амина, производные
Код ссылки
<a href="https://eas.patents.su/30-2270-proizvodnye-6-fenilpiridil-2-amina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 6-фенилпиридил-2-амина</a>
Предыдущий патент: Косметическая композиция, содержащая акриловый анионный полимер и оксиалкилированный силикон
Случайный патент: Рукоятка для пакетов и сумок с поворотной накладкой












