1-пиразолил-3-(4-((2-анилинопиримидин-4-ил)окси)нафталин-1-ил)мочевины как ингибиторы p38 map-киназы
Номер патента: 23650
Опубликовано: 30.06.2016
Авторы: Кинг-Андервуд Джон, Онионз Стюарт Томас, Ито Кадзухиро, Филлье Вальтер, Копманс Алекс, Лонгшо Алистер Йен, Чаррон Кэтрин Элизабет, Брукс Руди
Формула / Реферат
1. Соединение формулы (I)
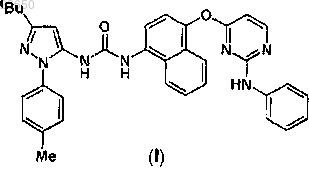
или его фармацевтически приемлемая соль или таутомеры.
2. Соединение по п.1 в виде свободного основания.
3. Соединение по п.2 в виде безводного свободного основания в твердой кристаллической форме.
4. Соединение по п.3, где соединение формулы (I) в виде безводного свободного основания в твердой кристаллической форме характеризуется порошковой дифракционной рентгенограммой, как показано на фиг. 1 (форма А).
5. Соединение по п.3, где соединение формулы (I) в виде безводного свободного основания в твердой кристаллической форме характеризуется порошковой дифракционной рентгенограммой, имеющей один, два, три, четыре, пять, шесть или семь пиков, выбранных из (±0,2) 10,3, 15,2, 17,5, 23,1, 24,6, 26,7 и 27,4° 2-тета.
6. Соединение по п.3, где соединение формулы (I) в виде безводного свободного основания в твердой кристаллической форме характеризуется порошковой дифракционной рентгенограммой, как показано на фиг. 2 (форма В).
7. Соединение по п.3, где соединение формулы (I) в виде безводного свободного основания в твердой кристаллической форме характеризуется порошковой дифракционной рентгенограммой, имеющей один, два, три, четыре, пять, шесть, семь или восемь пиков, выбранных из (±0,2) 3,9, 6,1, 11,8, 14,3, 16,7, 18,3, 18,7 и 28,9° 2-тета.
8. Фармацевтическая композиция, содержащая соединение по любому из пп.1-7 в сочетании с одним или более фармацевтически приемлемыми растворителями или носителями.
9. Применение соединения формулы (I) по любому из пп.1-7 для лечения или профилактики обострений у пациентов с хроническими заболеваниями дыхательных путей.
10. Применение соединения формулы (I) по любому из пп.1-7 для лечения или профилактики состояний, выбранных из группы: ХОБЛ, астма, кистозный фиброз, саркоидоз, идиопатический легочный фиброз, ринит, синусит, конъюнктивит, аллергический дерматит, контактный дерматит, псориаз, неспецифический язвенный колит, воспаление суставов, вторичное по отношению к ревматоидному артриту или к остеоартриту, ревматоидный артрит, панкреатит, кахексия и ингибирование роста и метастаз опухолей.
11. Применение соединения формулы (I) по любому из пп.1-7 для изготовления лекарственного средства для лечения или профилактики состояний, выбранных из группы: ХОБЛ, астма, кистозный фиброз, саркоидоз, идиопатический легочный фиброз, ринит, синусит, легочная гипертензия, конъюнктивит, аллергический дерматит, контактный дерматит, псориаз, неспецифический язвенный колит, воспаление суставов, вторичное по отношению к ревматоидному артриту или к остеоартриту, ревматоидный артрит, панкреатит, кахексия и ингибирование роста и метастаз опухолей.
12. Способ лечения состояния, выбранного из группы: ХОБЛ астма, кистозный фиброз, саркоидоз, идиопатический легочный фиброз, ринит, синусит, конъюнктивит, аллергический дерматит, контактный дерматит, псориаз, неспецифический язвенный колит, воспаление суставов, вторичное по отношению к ревматоидному артриту или к остеоартриту, ревматоидный артрит, панкреатит, кахексия и ингибирование роста и метастаз опухолей, который включает введение пациенту эффективного количества соединения формулы (I) по любому из пп.1-7.
13. Применение соединения формулы (I) по п.10 или 11, где ХОБЛ выбирают из хронического бронхита и эмфиземы, астмой является бронхиальная астма у детей, ринитом является аллергический ренит, конъюнктивитом является аллергический конъюнктивит и опухоли выбраны из немелкоклеточной карциномы легкого, карциномы молочной железы, карциномы желудка, колоректальной карциномы и злокачественной карциномы.
14. Способ по п.12, где ХОБЛ выбирают из хронического бронхита и эмфиземы, астмой является бронхиальная астма у детей, ринитом является аллергический ринит, конъюнктивитом является аллергический конъюнктивит и опухоли выбраны из немелкоклеточной карциномы легкого, карциномы молочной железы, карциномы желудка, колоректальной карциномы и злокачественной карциномы.
15. Применение соединения формулы (I) по любому из пп.1-7 для лечения или профилактики респираторных вирусных инфекций у пациентов с хроническими состояниями или у иммунокомпрометированных пациентов.
16. Применение соединения формулы (I) по п.15, где хроническое состояние выбрано из застойной сердечной недостаточности, диабета или рака и пациентом является иммунокомпрометированный пациент после трансплантации органа.
Текст
Изобретение относится к соединению, которое является ингибитором семейства р 38 митогенактивируемых протеинкиназных ферментов, и к его применению в лечении, в том числе в фармацевтических комбинациях, особенно в лечении воспалительных заболеваний, в том числе воспалительных заболеваний легких, таких как астма и ХОБЛ. Ито Кадзухиро, Чаррон Кэтрин Элизабет, Кинг-Андервуд Джон,Онионз Стюарт Томас, Лонгшо Алистер Йен (GB), Брукс Руди,Филлье Вальтер, Копманс Алекс (BE) Медведев В.Н. (RU) Область техники Настоящее изобретение относится к соединениям, которые являются ингибиторами семейства р 38 митоген-активируемых протеинкиназных ферментов (упоминаемых в данном документе как р 38 MAP ингибиторы киназы), например альфа- и гамма-киназ их подтипов, и Syk киназ, и Src семейства тирозинкиназ, и их применению в терапии, в том числе в фармацевтических комбинациях, особенно при лечении воспалительных заболеваний, в частности воспалительных заболеваний легких, таких как астма и ХОБЛ,так же как и воспалительных заболеваний желудочно-кишечного тракта, таких как неспецифический язвенный колит и болезнь Крона, и глаза, такого как увеит. Уровень техники Для четырех р 38 MAPK изоформ (альфа-, бета-, гамма- и дельта- соответственно) было определено,что каждая отображает различные модели тканевой экспрессии у человека. p38 MAPK-альфа и бетаизоформы обнаружены повсеместно в теле, присутствуют во многих различных типах клеток. Альфаизоформа хорошо описана с точки зрения ее роли в воспалении. Хотя исследования с применением химико-генетического подхода на мышах показали, что р 38 MAPK-бета-изоформа не играет роли в воспалении (O'Keefe, S.J. et al., J. Biol. Chem., 2007, 282(48):34663-71), она может быть вовлечена в болевые механизмы посредством регуляции экспрессии СОХ 2 (Fitzsimmons, B.L. et al., Neuroreport, 2010,21(4):313-7). Эти изоформы ингибируются рядом ранее описанных низкомолекулярных соединений. Ранние классы ингибиторов являлись высокотоксичными вследствие широкого распределения в тканях этих изоформ, что приводило к множественным побочным эффектам от этих соединений. Кроме того,разработка значительного числа ингибиторов была прекращена в связи с неприемлемыми профилями безопасности в клинических исследованиях (Pettus, L.H. and Wurz, R.P., Curr. Top. Med. Chem., 2008,8(16):1452-67). Все эти неблагоприятные эффекты зависят от хемотипа, и соединения имеют различные модели киназной селективности, наблюдаемые токичности могут быть больше связаны со структурой,чем основаны на механизме р 38. Меньше известно о р 38 MAPK-гамма и -дельта-изоформах, которые, в отличие от альфа- и бетаизоферментов, экспрессируются в конкретных тканях и клетках. р 38 MAPK-дельта изоформа экспрессируется более сильно в поджелудочной железе, яичках, легком, тонкой кишке и почке. Она также присутствует в изобилии в макрофагах и определяется в нейтрофилах, CD4+ Т-клетках и в эндотелиальных клетках (Shmueli, О. et al., Comptes Rendus Biologies, 2003, 326(10-11):1067-1072; Smith, S.J. Br. J.Chem., 1997, 272(38):23668-23674) Очень мало известно о распределении р 38 MAPK-гамма, хотя она экспрессируется более сильно в головном мозге, скелетных мышцах и сердце, а также в лимфоцитах и макрофагах (Shmueli, О. et al., Comptes Rendus Biologies, 2003, 326(10-11):1067-1072; Hale, K.K., J.al., FEBS Lett., 1996, 383(3):273-6). Селективные низкомолекулярные ингибиторы р 38 MAPK-гамма и р 38 MAPK-дельта в настоящее время отсутствуют, хотя одно ранее открытое соединение, BIRB 796, как известно, обладает панизоформной ингибирующей активностью. Ингибирование р 38 MAPK-гамма и -дельта-изоформ наблюдается при более высоких концентрациях этого соединения, чем требуемых для ингибирования р 38MAPK-альфа и р 38-бета (Kuma, Y., J. Biol. Chem., 2005, 280:19472-19479). В дополнение, BIRB 796 также нарушал фосфорилирование р 38 МАР-киназ или JN-киназ вышестоящей киназой MKK6 или MKK4. Кума обсуждал возможность того, что конформационное изменение, вызванное связыванием ингибитора с MAPK-белком, может влиять на структуру и сайта фосфорилирования, и сайта докинга для вышестоящего активатора, тем самым ухудшая фосфорилирование р 38 МАР-киназ или JN-киназ. р 38 МАР-киназы, как полагают, играют ключевую роль во многих сигнальных путях, которые вовлечены в инициирование и поддержание хронического, постоянного воспаления при болезни человека,например, при тяжелой астме и ХОБЛ (Chung, F., Chest, 2011, 139(6):1470-1479). В настоящее время в изобилии существует литература, которая показывает, что р 38 МАР-киназу активирует ряд провоспалительных цитокинов и что ее активация приводит к увеличению числа и высвобождению дополнительных провоспалительных цитокинов. Действительно, данные некоторых клинических исследований демонстрируют положительные изменения в активности заболевания у пациентов во время лечения ингибиторами р 38 МАР-киназы. Например, Smith описывает ингибирующий эффект ингибиторов р 38 МАР-киназы на TNF-альфа (но не IL-8), высвобожденных из МКПК человека. Применение ингибиторов р 38 МАР-киназы для лечения хронической обструктивной болезни легких (ХОБЛ) также было предложено. Низкомолекулярные ингибиторы, ориентированные на р 38 MAPKальфа/бета, доказали эффективность в снижении различных параметров воспаления в клетках и в тканях,полученных от пациентов с ХОБЛ, которые большей частью невосприимчивы к кортикостероидам(Underwood, D.C. et al., Am. J. Physiol., 2000, 279:L895-902; Nath, P. et al., Eur. J. Pharmacol., 2006,544:160-167). Irusen и его коллеги также предложили возможную вовлеченность р 38 MAPK-альфа/бета в кортикостероидную невосприимчивость посредством снижения сродства глюкокортикоидного рецептора(Lee, M.R. and Dominguez, С., Current Med. Chem., 2005, 12:2979-2994). ХОБЛ представляет собой состояние, при котором основное воспаление, как сообщается, является существенно устойчивым к противовоспалительному действию ингаляционных кортикостероидов. Следовательно, лучшей стратегией для лечения ХОБЛ будет разработка вмешательства, которое имеет как присущее противовоспалительное действие, так и способность увеличивать чувствительность ткани легких больных ХОБЛ к ингаляционным кортикостероидам. В недавней публикации Mercado (Mercado, N.,et al., Mol. Pharmacol., 2011, 80 (6):1128-1135) показано, что заглушение р 38 MAPK- имеет потенциал,чтобы восстановить восприимчивость к кортикостероидам. Следовательно, может быть двойная выгода для пациентов при применении ингибитора р 38 МАР-киназы для лечения ХОБЛ и тяжелой формы астмы. Тем не менее, основным препятствием на пути использования ингибиторов р 38 МАР-киназы при лечении хронических воспалительных заболеваний человека была острая токсичность, наблюдаемая у пациентов, что привело к выводу из клинического исследования многих соединений, включая все те,специально упомянутые выше. Многие пациенты с диагнозом астма или ХОБЛ продолжают страдать от неконтролируемых симптомов и от обострений их медицинского состояния, что может привести к госпитализации. Это происходит несмотря на применение самых передовых, имеющихся в настоящее время схем лечения, включающих комбинированные продукты из ингаляционных кортикостероидов и -агонистов длительного действия. Данные, накопленные за последнее десятилетие, показывают, что неспособность эффективно управлять основным компонентом воспалительного заболевания в легких является наиболее вероятной причиной, которая вызывает обострения. Учитывая установленную эффективность кортикостероидов в качестве противовоспалительных агентов и, в частности, ингаляционных кортикостероидов при лечении астмы, эти полученные данные спровоцировали интенсивное изучение. Полученные исследования показали, что некоторые неблагоприятные факторы окружающей среды вызывают кортикостероидоневосприимчивые воспалительные изменения в легких пациентов. Примером может служить ответная реакция, проистекающая из вирусно-опосредованных инфекций верхних дыхательных путей (ИВДП),которая имеет особое значение в увеличении заболеваемости, связанной с астмой и ХОБЛ. Эпидемиологические исследования выявили тесную связь между вирусными инфекциями верхних дыхательных путей и значительной частью обострений, перенесенных пациентами с уже диагностированными хроническими заболеваниями органов дыхания. Некоторые из наиболее убедительных данных в этом отношении выводятся из продольных исследований детей, страдающих от астмы(Papadopoulos, N.G., Papi, A., Psarras, S. and Johnston, S.L., Paediatr. Respir. Rev., 2004, 5(3):255-260). Разнообразие дополнительных исследований подтверждает вывод, что вирусная инфекция может ускорить обострения и увеличить тяжесть заболевания. Например, экспериментальные клинические инфицирования риновирусом, как сообщалось, вызывали бронхиальную гиперреактивность к гистамину у астматиков, которая не отвечает на лечение кортикостероидами (Grunberg, K., Sharon, R.F., et al., Am. J. Respir.Crit. Care Med., 2001, 164(10):1816-1822). Еще одно свидетельство происходит от связи, наблюдаемой между обострениями заболевания у пациентов с кистозным фиброзом и РВЧ-инфекциями (Wat, D.,Gelder, С., et al., J. Cyst. Fibros, 2008, 7:320-328). Также согласующимся с этим массивом данных является обнаружение того, что респираторные вирусные инфекции, в том числе риновирус, представляют собой независимый фактор риска, что отрицательно коррелирует с 12-месячным коэффициентом выживаемости в педиатрии, у реципиентов трансплантата легкого (Liu, M., Worley, S., et al., Transpl. Infect. Dis. 2009, 11(4):304-312). Клинические исследования показывают, что вирусная нагрузка пропорциональна наблюдаемым симптомам и осложнениям и, косвенно, тяжести воспаления. Например, после экспериментального инфицирования риновирусом симптомы нижних дыхательных путей и бронхиальная гиперреактивность значительно коррелируют с вирусной нагрузкой (Message, S.D., Laza-Stanca, V., et al., PNAS, 2008; 105(36):13562-13567). Аналогичным образом, в отсутствие других вирусных агентов риновирусные инфекции были обычно связаны с инфекциями нижних дыхательных путей и свистящего дыхания, когда вирусная нагрузка была высокой у иммунокомпетентных педиатрических пациентов (Gerna, G.,Piralla, A., et al., J. Med. Virol., 2009, 81(8):1498-1507). Интересно, недавно было сообщено, что предшествующее воздействие на риновирус снижало цитокиновый ответ, вызванный бактериальными продуктами в альвеолярных макрофагах человека(Oliver, В.G., Lim, S., et al., Thorax, 2008, 63:519-525). Кроме того, инфицирование носовых эпителиальных клеток риновирусом, как было задокументировано, способствует адгезии бактерий, в том числеS.aureus и Н.influenzae (Wang, J.H., Kwon, H.J. and Yong, J.J., The Laryngoscope, 2009, 119(7):1406-1411). Такие клеточные эффекты могут способствовать увеличению вероятности пациентов, страдающих от инфекции нижних дыхательных путей, следующей за инфекцией в верхних дыхательных путях. Соответственно, терапевтически обоснованно сосредоточить внимание на способности новых вмешательств для снижения вирусной нагрузки в различных in vitro системах, в качестве суррогатного прогностического фактора их пользы в клинических условиях. Группы высокого риска, для которых риновирусная инфекция в верхних дыхательных путях может привести к серьезным вторичным осложнениям, не ограничена пациентами с хроническими респираторными заболеваниями. Они включают в себя, например, иммунокомпрометированных, склонных к инфекции нижних дыхательных путей, а также пациентов, перенесших химиотерапию, которые сталкиваются с острой, угрожающей жизни лихорадкой. Кроме того, было предположено, что другие хронические заболевания, такие как диабет, связаны с компрометированной иммунозащитной реакцией. Это увеличивает как вероятность приобретения инфекции респираторного тракта, так и госпитализации в результате (Peleg, A.Y., Weerarathna, Т., et al., Diabetes Metab. Res. Rev., 2007, 23(1):3-13; Kornum, J.В., Reimar, W., et al., Diabetes Care, 2008, 31(8):1541-1545). В то время как вирусные инфекции верхних дыхательных путей являются причиной значительной заболеваемости и смертности у пациентов с основным заболеванием или другими факторами риска, они также представляют собой значительное бремя здравоохранения в общей популяции и являются основной причиной пропущенных дней в школе и потерянного времени на рабочем месте (Rollinger, J.M. andSchmidtke, M., Med. Res. Rev., 2010, Doi 10.1002/med.20176). Эти соображения дают понять, что новые лекарственные средства, которые обладают повышенной эффективностью по сравнению с современными терапиями, срочно требуются для профилактики и лечения риновирус-опосредованных инфекций верхних дыхательных путей. В целом, стратегии, принятые для открытия улучшенных антивирусных агентов, ориентированы на различные белки, продуцируемые вирусом, в качестве точки терапевтического вмешательства. Тем не менее, широкий спектр риновирусных серотипов вынуждает продолжать этот чрезвычайно сложный подход и может объяснить, почему в настоящее время лекарственное средство для профилактики и лечения риновирусных инфекций до сих пор не одобрено каким-либо регулирующим органом. Вход вируса в клетку-хозяина связан с активацией ряда внутриклеточных сигнальных путей, которые, как полагается, играют важную роль в инициировании воспалительных процессов (обзор Ludwig, S.,2007; Signal Transduction, 7:81-88) и вирусного распространения и последующего высвобождения. Одним из таких механизмов, как было определено, играющей роль в распространении вируса гриппа in vitro,является активация фосфоинозитид-3-киназы/Akt пути. Сообщалось, что этот сигнальный путь активируется NS1-белком вируса (Shin, Y.K., Liu, Q. et al., J. Gen. Virol., 2007, 88:13-18) и что его ингибирование снижает титры потомства вируса (Ehrhardt, С., Marjuki, H. et al., Cell Microbiol, 2006, 8:1336-1348). Кроме того, MEK-ингибитор U0126, как было задокументировано, ингибирует вирусное распространение, не вызывая появления резистентных вариантов вируса (Ludwig, S., Wolff, Т. et al., FEBS Lett.,2004, 561 (1-3): 37-43). Совсем недавно исследования, направленные на ингибирование Syk-киназы, продемонстрировали, что фермент играет важную роль в обеспечении входа риновируса в клетки, а также вирус-индуцированном воспалительном ответе, в том числе повышении ICAM-1 (Sanderson, M.P.,Lau, C.W. et al., Inflamm. Allergy Drug Targets, 2009, 8:87-95). Активность Syk, как сообщается, контролируется c-Src в качестве вышестоящей киназы при РВЧ-инфекции (Lau, С. et al., J. Immunol., 2008,180(2):870-880). Небольшое количество исследований показало, что связывает активацию клеточной Src(Src1 или р 60-Src) или семейства киназ Src с инфицированием вирусами. Они включают в себя доклад о том, что аденовирус вызывает PI3-киназную опосредованную активацию Akt через c-Src-зависимый механизм. Кроме того, было предположено, что индуцирование риновирусом-39 продукции IL-8 в эпителиальных клетках зависит от активации Src-киназы (Bentley, J.K., Newcomb, D.C., J. Virol., 2007, 81:11861194). Наконец, было предложено, что активация Src-киназы вовлечена в индукцию продукции муцина риновирусом-14 в эпителиальных клетках и подслизистых железах (Inoue, D. и Yamaya, M., Respir.Physiol. Neurobiol., 2006, 154(3):484-499). Ранее было открыто, что соединения, которые ингибируют активности обеих c-Src и Syk-киназ, являются эффективными средствами против репликации риновирусов (Charron, C.E. et al.,WO 2011/158042) и что соединения, которые ингибируют р 59-HCK, эффективны против репликации вируса гриппа (Charron, C.E. et al., WO 2011/070369). По причинам, изложенным выше, соединения, предназначенные для лечения хронических респираторных заболеваний, которые сочетают эти неотъемлемые свойства с ингибированием р 38 MAPK, как ожидается, будут особенно эффективны. Некоторые ингибиторы р 38 MAPK также были описаны в качестве ингибиторов репликации респираторно-синцитиального вируса (Cass, L. et al., WO 2011/158039). Кроме того, следует отметить, что ингибитор р 38 MAPK, как было установлено, обеспечивает преимущество для пациентов с ВЗК после одной недели лечения, которое не было устойчивым в течение четырех недель курса лечения (Schreiber, S. et al., Clin. Gastro. Hepatology, 2006, 4:325-334). В дополнение к выполнению ключевой роли в сигнальных событиях клетки, которые контролируют активность провоспалительных путей, киназные ферменты в настоящее время также признаны регулирующими активность ряда клеточных функций. Среди тех, которые обсуждались в последнее время,присутствуют поддержание целостности ДНК (Shilo, Y. Nature Reviews Cancer, 2003, 31155-168) и координация сложных процессов клеточного деления. Иллюстрацией последних данных является публикация, описывающая влияние набора ингибиторов, действующих на так называемые "киназы Олахарски",на частоту образования микроядер in vitro (Olaharsky, A.J. et al., PLoS Comput. Biol., 2009, 5(7):е 1000446). Формирование микроядер вовлечено в или связано с нарушением митотических процессов, и поэтому нежелательно проявление потенциальной токсичности. Ингибирование гликоген синтазы киназы 3 (GSK3), как было обнаружено, является чрезвычайно важным фактором, который увеличивает вероятность ингибитора киназы способствовать образованию микроядер. Недавно также сообщалось, что ингибирование киназы GSK3 РНК-интерференцией способствует формированию микроядер (Tighe, A. et al., ВМС Cell Biology, 2007, 8:34). Может быть возможным смягчить негативные последствия, проистекающие от взаимодействий лекарственных средств с киназами Олахарски, такими как GSK3, путем оптимизации дозы и/или путем изменения способа введения. Тем не менее, было бы более выгодно определить терапевтически полезные молекулы, которые демонстрируют низкую или не обнаружимую активность в отношении этих побочных ферментов и, следовательно, вызывают малые или вообще не вызывают нарушения митотических процессов, как было измерено при анализе митоза. Как видно из обсуждения литературы, цитированной выше в данном документе, остается необходимость определить и разработать новые ингибиторы р 38 МАР-киназы, которые имеют улучшенный терапевтический потенциал по сравнению с доступными в настоящее время методами лечения. Желательными являются соединения, которые проявляют превосходный терапевтический индекс, оказывая,по меньшей мере, тот же действенный эффект, что и у предыдущих агентов, но в одном или нескольких аспектах являются менее токсичными при соответствующей терапевтической дозе. Целью настоящего изобретения, следовательно, является предоставление таких новых соединений, которые ингибируют ферментативную активность р 38 МАР-киназы, например, с некоторыми особенностями подтипа вместе сSyk-киназой и тирозинкиназами в пределах семейства Src (в частности, c-Src), посредством этого обладающими хорошими противовоспалительными свойствами, и являются подходящими для применения в терапии. Соединение (I) проявляет большую продолжительность действия и/или стойкость действия по сравнению с ранее открытым аллостерическим ингибитором р 38 МАР-киназы BIRB 796 (Pargellis, С. etal., Nature Struct. Biol., 2002, 9(4): 268-272). Дополнительный вариант осуществления предоставляет такое новое соединение в одной или нескольких твердых кристаллических формах, которые обладают высокой химической и физической стабильностью, подходящей для приготовления в виде ингаляционных лекарственных средств. Сущность изобретения Таким образом, в одном аспекте изобретения предлагается соединение формулы (I) или его фармацевтически приемлемая соль или сольват, включая все его стереоизомеры и таутомеры."Соединение формулы (I)" также может упоминаться в данном документе как "соединение (I)". В другом аспекте настоящего изобретения предоставляется соединение (I), как определено выше, в виде свободного основания. В другом аспекте настоящего изобретения предоставляется соединение (I), как определено выше, в виде безводного свободного основания. В другом аспекте настоящего изобретения предоставляется соединение (I), как определено выше, в виде безводного свободного основания в твердой кристаллической форме. В еще одном аспекте настоящего изобретения предоставляется соединение (I), как определено выше, в виде безводного свободного основания в твердой кристаллической полиморфной форме А. В еще одном аспекте настоящего изобретения предоставляется соединение (I), как определено выше, в виде безводного свободного основания в твердой кристаллической полиморфной форме В. Краткое описание чертежей Фиг. 1 показывает спектр порошковой рентгеновской дифракции (ПРД), полученный от образца соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме А. Фиг. 2 отображает спектр ПРД, полученный от образца соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В после микронизации. Фиг. 3 выявляет результаты термогравиметрического анализа образца соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В после микронизации. Фиг. 4 представляет графики изотермы динамической сорбции паров (ДСП), полученный от образца соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В после микронизации. Фиг. 5 представляет результаты эксперимента по определению гистерезиса, проведенного над образцом соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В после микронизации, для того чтобы определить степень и скорость абсобции/десорбции влаги со временем против изменений в относительной влажности. Фиг. 6 представляет собой инфракрасный (ИК) спектр, полученный от образца соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В после микронизации. Фиг. 7 показывает термический анализ образца соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В (микронизированный) путем дифференциальной сканирующей калориметрии (ДСК). Подробное описание изобретения Соединение формулы (I), раскрытое в настоящем описании, представляет собой 1-(3-трет-бутил-1 п-толил-1 Н-пиразол-5-ил)-3-(4-(2-(фениламино)пиримидин-4-илокси)нафталин-1-ил)мочевину. Примеры солей соединения (I) включают все фармацевтически приемлемые соли, такие как, без ограничения, кислотно-аддитивные соли сильных минеральных кислот, таких как соли HCl и HBr, и аддитивные соли сильных органических кислот, таких как метансульфоновая кислота. В качестве используемого в данном документе ниже определение соединения формулы (I) предназначено для включения солей, сольватов и всех таутомеров указанного соединения, если контекст специально не указывает иное. Примеры сольватов включают гидраты. Изобретение, представленное в данном документе, распространяется на пролекарства по соединению формулы (I), т.е. соединения, которые разрушаются и/или метаболизируются in vivo, чтобы предоставить активное соединение формулы (I). Общие примеры пролекарств включают простые сложные эфиры и другие сложные эфиры, такие как смешанные карбонатные сложные эфиры, карбаматы, гликозиды,простые эфиры, ацетали и кетали. Изобретение охватывает все изотопные производные соединения (I). Таким образом, изобретение охватывает соединения, которые являются соединениями по соединению (I), имеющие один или более атомов, которые были замещены атомом, имеющим атомную массу или массовое число, отличающиеся от атомной массы или массового числа наиболее часто встречающихся в природе, или в котором доля атома, имеющего атомную массу или массовое число, встречающиеся менее часто в природе, была увеличена (последняя концепция называется "изотопным обогащением"). Таким образом, соединения по настоящему изобретению включают те, в которых определенный атом является встречающимся в природе или не встречающимся в природе изотопом. В одном варианте осуществления изотоп представляет собой стабильный изотоп. Таким образом, соединения по настоящему изобретению, включают, например, соединения, содержащие дейтерий и т.п. Таким образом, в одном варианте осуществления по изобретению соединение (I) содержит обогащенный уровень дейтерия в одном или более атомов водорода(например, для данного атома водорода уровень изотопа дейтерия превышает 20, 50, 75, 90, 95 или 99% от числа). Примеры других изотопов, которые могут быть включены в соединение (I) или обогащены в соединении (I), включают изотопы водорода, углерода, азота, кислорода, фтора, йода и хлора, такие как 3 Н, 11 С, 13 С, 14 С, 15N, 18F, 123I или 125I, которые могут являться встречающимися в природе или не встречающимися в природе изотопами. В еще одном аспекте настоящего изобретения предоставлен один или более метаболитов соединения формулы (I), в частности метаболит, который сохраняет одно или более терапевтических действий соединения формулы (I). Метаболит, как используется в настоящем описании, представляет собой соединение, которое продуцируется in vivo в результате метаболизма соединения формулы (I), такие как,без ограничения, окислительные метаболиты и/или метаболиты, полученные, например, в результате О-деалкилирования. Настоящее изобретение также распространяется на все полиморфные формы соединений, определенных в данном документе. Путь, подходящий для получения соединения формулы (I), показан ниже (схема 1). Защитные группы могут быть необходимы, чтобы защитить химически чувствительные группы в течение одной или нескольких из реакций, описанных выше, чтобы обеспечить, что процесс может быть проведен и/или является результативным. Таким образом, если желательно или необходимо, промежуточные соединения могут быть защищены использованием обычных защитных групп. Защитные группы и средства для их удаления описаны в "Protective Groups in Organic Synthesis" авторов Theodora W.Greene и Peter G.M. Wuts, опубликовано John WileySons Inc; 4th Rev Ed., 2006, ISBN-10: 0471697540. Подробное получение соединения (I) предоставлено в примере 1. Новые промежуточные соединения, как описано в настоящем описании, составляют аспект настоящего изобретения. В другом аспекте настоящего изобретения предоставлено соединение (I) в виде безводного свободного основания в твердой кристаллической форме. В еще одном аспекте настоящего изобретения предоставлено соединение (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме А, которое может быть получено, например, путем кристаллизации соединения (I) из изопропилацетата. В отдельном аспекте настоящего изобретения предоставлено соединение (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В, которое может быть получено, например, путем кристаллизации соединения (I) из ацетона и воды. Типичное соотношение ацетона и воды, подходящее для этого процесса, находится между 5:1 и 200:1, например около 10:1. Кроме того,форма В может быть получена путем кристаллизации соединения (I) из одного ацетона. Подробное получение соединения (I) в виде безводного свободного основания в твердых кристаллических полиморфных формах А и В предоставлены в примерах 1 и 3 Экспериментального раздела соответственно. В еще одном аспекте настоящего изобретения свойства твердого состояния соединения (I) могут быть улучшены путем последующих стадий суспендирования или перекристаллизации для получения,например, материала с улучшенной морфологией и/или содержащего пониженный уровень остаточного растворителя. Например, остаточный растворитель может быть удален из соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В путем суспендирования соединения (I) в полиморфной форме В в воде или в качестве альтернативы путем дальнейшей перекристаллизации из ацетона. Подробное описание примерной процедуры суспендирования предоставлено в примере 3 а Экспериментального раздела. В одном варианте осуществления предоставлена твердая кристаллическая полиморфная форма А соединения (I) в виде безводного свободного основания, имеющая спектр ПРД, по существу, как показано на фиг. 1. Метод получения данных ПРД описан в Аналитических методах, и эти данные обсуждены в примере 5. Таким образом, предоставлено соединение (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме А, имеющее спектр ПРД по меньшей мере с одним (например,одним, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью, десятью, одиннадцатью, двенадцатью, тринадцатью, четырнадцатью, пятнадцатью или всеми шестнадцатью) пиком(ами) при 7,8; 8,7; 10,3; 11,2; 12,4; 15,2; 16,2; 17,5; 19,7; 20,8; 22,6; 23,1; 24,6; 25,5; 26,7; 27,4 (0,2, 2-тета значения),эти пики являются характеристикой твердой кристаллической полиморфной формы А. Пики при 10,3; 15,2; 17,5; 23,1; 24,6; 26,7 и 27,4 особенно характерны для твердой кристаллической полиморфной формы А и, следовательно, является предпочтительным, чтобы по меньшей мере один (например, один, два,три, четыре, пять, шесть или все семь) из этих пиков наблюдался в спектре ПРД. В другом варианте осуществления предоставлена твердая кристаллическая полиморфная форма В соединения (I) в виде безводного свободного основания (микронизированного), имеющая спектр ПРД, по существу, как показано на фиг. 2. Способ микронизации описан в примере 4, и способ получения данных ПРД описан в Аналитических методах, и эти данные обсуждены в примере 5. Таким образом, здесь предоставлено соединение (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В (микронизированного), имеющее порошковую дифракционную рентгенограмму по меньшей мере с одним (например, одним, двумя, тремя, четырьмя, пятью,шестью, семью, восемью, девятью, десятью, одиннадцатью, двенадцатью, тринадцатью, четырнадцатью,пятнадцатью, шестнадцатью, семнадцатью или всеми восемнадцатью) пиком(ами) при 3,9; 6,1; 7,7; 8,6; 10,9; 11,8; 12,7; 14,3; 15,9; 16,7; 18,3; 18,7; 19,9; 20,9; 22,0; 22,6; 25,2; 28,9 (0,2, 2-тета значения), эти пики являются характеристикой твердой кристаллической полиморфной формы В. Пики при 3,9; 6,1; 11,8; 14,3; 16,7; 18,3; 18,7 и 28,9 особенно характерны для твердой кристаллической полиморфной формы В и, следовательно, является предпочтительным, чтобы по меньшей мере один (например, один, два,три, четыре, пять, шесть, семь или все восемь) из этих пиков наблюдался в спектре ПРД. Температуры плавления соединения (I) в виде безводного свободного основания в твердых кристаллических полиморфных формах А и В были определены с применением метода дифференциальной сканирующей калориметрии, как описано в примере 6. Соединение (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме А, как было обнаружено, имеет температуру плавления 191,6 С, а соединение (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В, как было обнаружено, имеет температуру плавления 214 С. Полиморфная форма В, как было также установлено, имеет более высокую теплоту плавления, чем полиморфная форма А. Как объяснено в примере 6, эти результаты предполагают, что полиморфная форма В термодинамически более стабильна, чем полиморфная форма А. Физическая и химическая стабильности соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В были исследованы, результаты которых раскрыты в данном документе. Для того чтобы оценить физическую стабильность, соединение (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В было микронизировано по методике, описанной в примере 4, и образцы полученного материала хранили в открытых контейнерах и подвергали различным температурам и относительным влажностям окружающей среды. Физические свойства и стабильности образцов были исследованы с помощью методов ТГА, ДСК, ДПС, ИК-спектроскопии и ПРД. Полные экспериментальные методики приведены в разделе "Общие методики", и результаты приведены в примере 7 (табл. 8). Как обсуждалось в примере 7, соединение (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В (микронизированное), как было установлено,обладает хорошей физической стабильностью. Те же экспериментальные методики были также проведены с применением соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В в немикронизированной форме, и результаты оказались, по существу, аналогичны тем, которые были получены для микронизированного материала, т.е. соединение (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В и в микронизированной, и в немикронизированной форме, как было установлено, обладает хорошей физической стабильностью. Для того чтобы оценить химическую стабильность, соединение (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В было микронизировано по методике, описанной в примере 4. Микронизированные образцы хранили в открытых контейнерах и подвергали различным температурам и относительным влажностям окружающей среды. Химические стабильности образцов анализировали методом ВЭЖХ. Результаты приведены в примере 8 (табл. 9), где указано, что соединение (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В после микронизации, как было обнаружено, химически стабильно, хотя некоторая чувствительность к свету было замечена. В результате исследований твердого состояния, описанных в данном документе, можно заключить,что соединение (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В может быть микронизировано и что полученный в результате материал имеет хорошую физическую и химическую стабильность. Соединение формулы (I) является ингибитором р 38 МАР-киназы (особенно альфа-подтипа), и в одном аспекте это соединение полезно при лечении воспалительных заболеваний, например ХОБЛ и/или астма. Неожиданно оказалось, что это соединение проявляет большую продолжительность действия и/или стойкость действия по сравнению с ранее описанным ингибитором р 38 МАР-киназы BIRB796. Стойкость действия в данном контексте относится к скорости диссоциации или константе диссоциации соединения от мишени (такой как рецептор). Низкая скорость диссоциации может привести к стойкости. Низкая скорость диссоциации в сочетании с высокой скоростью ассоциации, как правило, предоставляет сильнодействующие терапевтические объекты. Соединение формулы (I), как ожидается, будет сильнодействующим in vivo. Как правило, соединения предшествующего уровня техники, разработанные на сегодняшний день,были предназначены для перорального введения. Эта стратегия включает оптимизацию соединений, которые достигают своей продолжительности действия соответствующим фармакокинетическим профилем, тем самым обеспечивая то, что достаточно высокая концентрация лекарственного средства устанавливается и поддерживается между дозами, чтобы предоставить клиническое преимущество. Неизбежным следствием такого подхода является то, что все ткани тела, а особенно печень и кишечник, подвергаются сверхтерапевтическим активным концентрациям препарата, в любом случае они подвергаются неблагоприятному действию при заболевании, которое лечат. Альтернативная стратегия заключается в разработке парадигм лечения, в которых препарат подается непосредственно к воспаленному органу (местная терапия). Хотя такой подход не подходит для лечения всех хронических воспалительных заболеваний, он был широко использован при легочных заболеваниях (астма, ХОБЛ), кожных заболеваниях (атопический дерматит и псориаз), заболеваниях носа (аллергический ринит) и желудочно-кишечных расстройствах (неспецифический язвенный колит). При местной терапии эффективность может быть достигнута либо путем обеспечения того, что лекарственное средство имеет устойчивую продолжительность действия и сохраняется в соответствующем органе, чтобы минимизировать риски системной токсичности, либо путем получения состава, который создает "резервуар" активного лекарственного средства, который способен сохранять его желаемые эффекты. Первый подход подтвержден примером антихолинергического лекарственного средства тиотропия (Спирива). Это соединение вводят местно в легкие для лечения ХОБЛ, и оно имеет исключительно высокое сродство к своему рецептору-мишени, что приводит к очень медленной скорости диссоциации,и, следовательно, устойчивой продолжительности действия. В одном аспекте настоящего изобретения соединение формулы (I) особенно подходит для местной доставки, такой как местная доставка в легкие, в частности, для лечения респираторных заболеваний,например хронических респираторных заболеваний, таких как ХОБЛ и/или астма. В одном варианте осуществления соединение формулы (I) является подходящим для сенсибилизации пациентов к лечению кортикостероидами, которые стали невосприимчивы к таким схемам лечения. Соединение формулы (I) также может быть полезно для лечения ревматоидного артрита. Соединение формулы (I) может обладать противовирусными свойствами, например способностью предотвращать инфицирование клеток (например, респираторных эпителиальных клеток) пикорнавирусами, в частности риновирусами, гриппом или респираторно-синцитиальным вирусом. Таким образом, соединение, как полагают, представляет собой противовирусное средство, в частности, подходящее для профилактики, лечения или облегчения пикорнавирусных инфекций, таких как риновирусная инфекция, грипп или респираторно-синцитиальный вирус. В одном варианте осуществления соединение формулы (I) способно уменьшать воспаление, индуцированное вирусной инфекцией, такой как риновирусная инфекция, в особенности вирусные инфекции,которые приводят к высвобождению цитокинов, таких как IL-8, особенно in vivo. Эта активность может,например, быть испытана in vitro, используя анализ риновирус-индуцированного IL-8, как описано в примерах в данном документе. В одном варианте осуществления соединение формулы (I) способно уменьшить экспрессиюICAM-1, индуцированную риновирусом, особенно in vivo. ICAM-1 представляет собой рецепторный механизм, применяемый так называемой большой бороздкой риновирусных серотипов для инфицирования клеток. Эта активность может быть измерена, например, способом, описанным в примерах в данном документе. Ожидается, что указанные выше свойства делают соединение формулы (I) особенно подходящим для применения при лечении и/или профилактике обострений воспалительных заболеваний, в частности вирусных обострений у пациентов с одним или несколькими из следующих хронических заболеваний,таких как застойная сердечная недостаточность, ХОБЛ, астма, диабет, рак и/или у иммуносупрессированных пациентов, например, после трансплантации органа. В частности, соединение формулы (I) может быть полезно при лечении одного или более нарушений дыхательных функций, в том числе ХОБЛ (включая хронический бронхит и эмфизему), астмы, педиатрической астмы, кистозного фиброза, саркоидоза, идиопатического фиброза легких, аллергического ринита, ринита, синусита, особенно астмы и ХОБЛ (включая хронический бронхит и эмфизему). Соединение формулы (I) также может быть полезно при лечении одного или более состояний, которые можно лечить путем местной или локальной терапии, включая аллергический конъюнктивит,конъюнктивит, аллергический дерматит, контактный дерматит, псориаз, неспецифический язвенный колит, воспаление суставов, вторичное по отношению к ревматоидному артриту или к остеоартриту. Кроме того, ожидается, что соединение формулы (I) может быть полезно при лечении некоторых других состояний, включая ревматоидный артрит, панкреатит, кахексию, ингибирование роста и метастаз опухолей, включая немелкоклеточную карциному легкого, карциному молочной железы, карциному желудка, колоректальные карциномы и злокачественную меланому. Соединение формулы (I) может быть полезно при лечении глазных заболеваний или расстройств, в том числе аллергического конъюнктивита, конъюнктивита, диабетической ретинопатии, макулярного отека (включая влажный макулярный отек и сухой макулярный отек), послеоперационного воспаления катаракты или, в частности, увеита (в том числе задний, передний и панувеит). Соединение формулы (I) может быть полезно при лечении желудочно-кишечных заболеваний или расстройств, включая неспецифический язвенный колит или болезнь Крона. Соединение формулы (I) может также повторно сенсибилизировать состояние пациента для лечения кортикостероидами, когда состояние пациента стало невосприимчивым к ним. Кроме того, настоящее изобретение предоставляет фармацевтическую композицию, содержащую соединение в соответствии с настоящим изобретением, необязательно в сочетании с одним или более фармацевтически приемлемыми разбавителями или носителями. Настоящее изобретение также предоставляет способ получения такой фармацевтической композиции, которая содержит смешивание ингредиентов. Разбавители и носители могут включать те, что пригодны для парентерального, перорального, местного, через слизистые оболочки и ректального введения. Как упоминалось выше, такие композиции могут быть получены, например, для парентерального,подкожного, внутримышечного, внутривенного, интраартикулярного или периартикулярного введения, в частности в форме жидких растворов или суспензий; для перорального введения, в частности в форме таблеток или капсул; для местного, например, легочного или интраназального введения, в частности в виде порошков, носовых капель или аэрозолей, и трансдермального введения; для введения через слизистую оболочку, например буккального, сублингвального или через слизистую оболочку влагалища, и для ректального введения, например в виде суппозиториев. Композиции могут быть удобным образом введены в единичной дозированной форме и могут быть получены любым из способов, хорошо известных в фармацевтической области, например, как описано вRemington's Pharmaceutical Sciences, 17-е изд., Mack Publishing Company, Easton, PA., (1985). Составы для парентерального введения могут содержать в качестве вспомогательных веществ воду или физиологический раствор, алкиленгликоли, такие как пропиленгликоль, полиалкиленгликоли, такие как полиэтиленгликоль, масла растительного происхождения, гидрогенизированные нафталины и им подобные. Композиции для назального введения могут быть твердыми и могут содержать вспомогательные вещества, например лактозу или декстран, или могут представлять собой водные или масляные растворы для использования в форме назальных капель или дозированных спреев. Для буккального введения типичные вспомогательные вещества включают сахара, стеарат кальция, стеарат магния, прежелатинизированный крахмал и им подобные. Композиции, пригодные для перорального введения, могут содержать один или более физиологически совместимых носителей и/или вспомогательных веществ и могут быть в твердой или жидкой форме. Таблетки и капсулы могут быть приготовлены со связующими агентами, например сиропом, гуммиарабиком, желатином, сорбитом, трагакантом или поливинилпирролидоном; наполнителями, такими как лактоза, сахароза, кукурузный крахмал, фосфат кальция, сорбит или глицин; смазывающими веществами, такими как стеарат магния, тальк, полиэтиленгликоль или диоксид кремния; и поверхностноактивными веществами, такими как лаурилсульфат натрия. Жидкие композиции могут содержать обычные добавки, такие как суспендирующие агенты, например сироп сорбита, метилцеллюлозу, сироп сахара, желатин, карбоксиметилцеллюлозу или пищевые жиры; эмульгаторы, такие как лецитин или гуммиарабик; растительные масла, такие как миндальное масло, кокосовое масло, масло печени трески или арахисовое масло; консерванты, такие как бутилированный гидроксианизол (ВНА) и бутилированный гидрокситолуол (ВНТ). Жидкие композиции могут быть заключены, например, в желатиновые капсулы,чтобы предоставить единичную дозированную лекарственную форму. Твердые пероральные дозированные формы включают таблетки, капсулы с твердыми двустворчатыми оболочками и мягкие эластичные желатиновые (SEG) капсулы. Сухой состав оболочки обычно содержит приблизительно 40-60%-ную массовую концентрацию желатина, приблизительно 20-30%-ную концентрацию пластификатора (таких как глицерин, сорбит или пропиленгликоль) и приблизительно 30-40%-ную концентрацию воды. Другие материалы, такие как консерванты, красители, замутнители и ароматизаторы, также могут присутствовать. Жидкий наполнительный материал включает твердое лекарственное средство, которое было растворено, солюбилизировано или диспергировано (с суспендирующими агентами, такими как пчелиный воск, гидрогенизированное касторовое масло или полиэтиленгликоль 4000) или жидкое лекарственное средство в средах или комбинациях сред, таких как минеральное масло, растительные масла,триглицериды, гликоли, полиолы и поверхностно-активные вещества. Соответственно, соединение формулы (I) вводят местно в легкие. Поэтому авторы изобретения предоставили в соответствии с изобретением фармацевтическую композицию, содержащую соединение(I) по изобретению, необязательно в сочетании с одним или более приемлемыми для местного применения разбавителями или носителями. Местное введение в легкие может быть достигнуто путем использования аэрозольного состава. Аэрозольные составы обычно содержат активный ингредиент, суспендированный или растворенный в подходящем аэрозольном пропелленте, таком как хлорфторуглерод (CFC) или гидрофторуглерод (HFC). Подходящие CFC-пропелленты включают трихлормонофторметан (про-9 023650 пеллент 11), дихлоротетрафторметан (пропеллент 114) и дихлордифторметан (пропеллент 12). Подходящие HFC-пропелленты включают тетрафторэтан (HFC-134a) и гептафторпропан (HFC-227). Пропеллент обычно содержит 40-99,5%, например 40-90 мас.% от общей композиции для ингаляции. Состав может содержать наполнители, включая сорастворители (например, этанол) и поверхностно-активные вещества(например, лецитин, сорбитантриолеат и т.п.). Аэрозольные составы упакованы в баллоны, и подходящая доза доставляется посредством дозирующего клапана (например, предложенным Bespak, Valois или 3 М). Местное введение в легкие может быть также достигнуто путем применения состава не под давлением, такого как водный раствор или суспензия. Его можно вводить с помощью небулайзера. Небулайзеры могут быть портативными или не портативными. Местное введение в легкие также может быть достигнуто путем применения сухого порошкового состава. Сухой порошковый состав будет содержать соединение по изобретению в тонкоизмельченной форме, как правило, с масс-медианным аэродинамическим диаметром (ММАД) 1-10 мкм. Состав обычно содержит приемлемый для местного введения разбавитель, такой как лактоза, обычно большего размера частиц, например ММАД 50 мкм или более, например 100 мкм или более. Альтернативным приемлемым для местного введения разбавителем является маннит. Примеры систем доставки сухого порошка включают SPINHALER, DISKHALER, TURBOHALER, DISKUS и CLICKHALER. Другие примеры систем сухих порошковых ингаляционных систем включают ECLIPSE, ROTAHALER, HANDIHALER, AEROLISER, CYCLOHALER, REEZHALER/NEOHALER, FLOWCAPS, TWINCAPS, X-CAPS, TURBOSPIN,ELPENHALER, TURBUHALER, MIATHALER, TWISTHALER, NOVOLIZER, SKYEHALER, сухой порошковый ингалятор ORIEL, MICRODOSE, ACCUHALER, PULVINAL, EASYHALER, ULTRAHALER,TAIFUN, PULMOJET, OMNIHALER, GYROHALER, TAPER, CONIX, XCELOVAIR и PROHALER. Один аспект изобретения относится к сухому порошковому фармацевтическому составу для ингаляции, содержащему: которое представляет собой 1-(3-трет-бутил-1-п-толил-1 Н-пиразол-5-ил)-3-(4-(2(фениламино)пиримидин-4-илокси)нафталин-1-ил)мочевину или его фармацевтически приемлемую соль, включая все его стереоизомеры и таутомеры, в конкретной форме (например, твердая кристаллическая форма В) в качестве активного ингредиента;(iii) микрочастицы металлической соли стеариновой кислоты, такой как магния стеарат. Изобретение также предоставляет ингаляционное устройство, содержащее одну или более доз указанного состава. Соединение формулы (I) имеет терапевтическую активность. В еще одном аспекте настоящее изобретение предоставляет соединение по изобретению для применения в качестве лекарственного средства. Таким образом, в еще одном аспекте настоящее изобретение предоставляет соединение, как описано в данном документе, для применения в лечении одного или более из указанных выше состояний. В еще одном аспекте настоящее изобретение предоставляет применение соединения (I), как описано в данном документе, для изготовления лекарственного средства для лечения одного или более из указанных выше состояний. В еще одном аспекте настоящее изобретение предоставляет способ лечения одного или более из указанных выше состояний, который включает введение субъекту эффективного количества соединения(I) по настоящему изобретению или фармацевтической композиции, содержащей это соединение. Термин "лечение" предназначено для охвата как профилактики, так и терапевтического лечения. Соединение (I) по настоящему изобретению также может быть введено в сочетании с одним или более другими активными ингредиентами, например активными ингредиентами, подходящими для лечения указанных выше состояний. Например, возможные комбинации для лечения нарушений дыхательных функций включают комбинации со стероидами (например, будезонидом, беклометазона дипропионатом, флутиказона пропионата, мометазона фуроата, флутиказон фуроата), бета агонистами (например,тербуталином, сальбутамолом, сальметеролом, формотеролом) и/или ксантинами (например, теофиллином). Другие подходящие активные ингредиенты включают антихолинергические средства, такие как тиотропий, и противовирусные агенты, такие как, но не ограничиваясь ими, занамивир или озельтамивир, например, в виде фосфата. Другие противовирусные средства включают перамивир и ланинамивир. Другие возможные комбинации для лечения нарушений дыхательных функций включают комбинации со стероидами, такими как флунизолид, циклезонид и триамцинолон; бета-агонистами, такими как бамбутерол, левалбутерол, кленбутерол, фенотерол, броксатерол, индакатерол, репротерол, прокатерол и вилантерол; мускариновыми антагонистами (например, ипратропием, тиотропием, окситропием, гликопир- 10023650 ронием, гликопирролатом, аклидинием, троспием) и антагонистами лейкотриенов (например, зафирлукастом, пранлукастом, зилеутоном, монтелукастом). Следует понимать, что любой из вышеупомянутых активных ингредиентов может быть использован в форме фармацевтически приемлемой соли. В одном варианте осуществления соединение формулы (I) и другой активный ингредиент(ы) скомбинированы в одном и том же фармацевтическом составе. В другом варианте осуществления другой активный ингредиент(ы) вводят в один или более отдельных фармацевтических составов. Таким образом, еще один аспект настоящего изобретения предоставляет комбинированный продукт, содержащий:(A) соединение по настоящему изобретению (т.е. соединение формулы (I), как определено выше,или его фармацевтически приемлемую соль);(B) другое терапевтическое средство,в котором каждый из компонентов (А) и (В) приготавливается в смеси с фармацевтически приемлемым разбавителем или носителем. В этом аспекте настоящего изобретения комбинированный продукт может представлять собой как одиночный (комбинация) фармацевтический состав или набор из компонентов. Таким образом, этот аспект настоящего изобретения охватывает фармацевтический состав, содержащий соединение по настоящему изобретению и другое терапевтическое средство в смеси с фармацевтически приемлемым разбавителем или носителем (этот состав далее в данном документе упоминается как "комбинированный препарат"). Он также включает в себя набор компонентов, содержащих компоненты:(i) фармацевтический состав, содержащий соединение по настоящему изобретению в смеси с фармацевтически приемлемым разбавителем или носителем; и(ii) фармацевтический состав, содержащий другое терапевтическое средство, в смеси с фармацевтически приемлемым разбавителем или носителем,где каждый из компонентов (i) и (ii) предоставлен в форме, подходящей для введения в сочетании с другим. Компонент (i) из набора компонентов представляет собой, таким образом, компонент (А), указанный выше, в смеси с фармацевтически приемлемым разбавителем или носителем. Аналогичным образом,компонент (ii) представляет собой компонент (В), указанный выше, в смеси с фармацевтически приемлемым разбавителем или носителем. Другое терапевтическое средство (т.е. компонент (В), указанный выше) может представлять собой,например, любой из активных ингредиентов, указанных выше, для лечения нарушений дыхательных функций. Данные, представленные ниже, относительно антивирусных свойств соединения формулы (I) свидетельствуют о том, что другие противовирусные терапии в сочетании с соединением формулы (I),были бы полезны при лечении или профилактике вирусно-индуцированных обострений (например, респираторных вирусных инфекций), от которых страдают пациенты с заболеваниями дыхательных путей,такими как ХОБЛ и/или астма и/или одним или более показаниями, перечисленными выше. Таким образом, в одном аспекте предоставляется применение соединения (I) в сочетании с антивирусной терапией,такой как, но не ограничиваясь ими, занамивир или озельтамивир (например, озельтамивира фосфат) при лечении или профилактике респираторных вирусных инфекций, от которых страдают пациенты с заболеваниями дыхательных путей, такими как ХОБЛ и/или астма. Авторы настоящего изобретения также полагают, что другие противовирусные терапии в сочетании с соединением (I) могли бы быть полезны для лечения или профилактики вирусно-индуцированных обострений (например, респираторных вирусных инфекций) у пациентов с хроническими состояниями, отличными от заболеваний дыхательных путей, например, такими состояниями, как застойная сердечная недостаточность, диабет, рак, или состояниями, от которых страдают иммуносупрессированные пациенты, например, после трансплантации органа. Таким образом, в другом аспекте предоставлено применение соединения по изобретению в комбинации с противовирусной терапией, такой как, но не ограничиваясь ими, занамивир или озельтамивир (например, озельтамивира фосфат), при лечении или профилактике респираторных вирусных инфекций у больных с хроническими состояниями, такими как застойная сердечная недостаточность, диабет, рак, или состояниями, от которых страдают иммуносупрессированные пациенты, например, после трансплантации органа. Экспериментальный раздел Сокращения, применяемые в настоящем описании, определены ниже (табл. 1). Любые не определенные аббревиатуры предназначены для передачи их общепринятого значения. Таблица 1 Сокращения Общие методики. Все исходные вещества и растворители были получены либо из коммерческих источников, либо приготовлены в соответствии с цитируемой литературой. Если не указано иное, все реакционные смеси перемешивали. Органические растворы обычно сушили над безводным сульфатом магния. Гидрирование проводили в проточном реакторе Thales H-cube при указанных условиях. Колоночную хроматографию проводили на предварительно наполненными силикагелем (230-400 меш, 40-63 мкм) картриджах с применением указанного количества. SCX был приобретен у Supelco и обработан 1 М соляной кислотой перед использованием. Если не указано иное, реакционную смесь для очистки сначала разбавляли MeOH и подкисляли несколькими каплями АсОН. Этот раствор загружали непосредственно в SCX и промывалиMeOH. Желаемый продукт затем элюировали промыванием 1%-ным NH3 в MeOH. Препаративная обращенно-фазовая высокоэффективная жидкостная хроматография: колонкаH2O-5% MeCN; 8,0-10,0 мин; держали при 95% H2O-5% MeCN. Аналитические методы. Обращенно-фазовая высокоэффективная жидкостная хроматография (способ 1). Колонка Agilent Scalar C18, 5 мкм (4,650 мм) или Waters Xbridge C18, 5 мкм (4,650 мм), скорость потока 2,5 мл/мин, элюированная градиентом H2O-MeCN, содержащим 0,1 об.% муравьиной кислотыMeCN до 5% H2O-95% MeCN; 5,0-5,5 мин, держали при 5% H2O-95% MeCN; 5,5-5,6 мин, держали при 5% H2O-95% MeCN, скорость потока увеличили до 3,5 мл/мин; 5,6-6,6 мин, держали при 5% H2O-95%MeCN, скорость потока 3,5 мл/мин; 6,6-6,75 мин, вернули к 95% H2O-5% MeCN, скорость потока 3,5 мл/мин; 6,75-6,9 мин, держали при 95% H2O-5% MeCN, скорость потока 3,5 мл/мин; 6,9-7,0 мин, держали при 95% H2O-5% MeCN, скорость потока уменьшили до 2,5 мл/мин. Обращенно-фазовая высокоэффективная жидкостная хроматография (способ 2). Колонка Agilent Scalar C18, 1,8 мкм (4,630 мм) при 40 С; скорость потока 2,5-4,5 мл/мин, элюированная градиентом H2O-MeCN, содержащим 0,1 об.% муравьиной кислоты в течение 4 мин, применяя УФ-детектирование при 254 нм. Информация о градиенте: 0-3,00 мин, изменили с 95% H2O-5% MeCN до 5% H2O-95% MeCN; 3,003,01 мин, держали при 5% H2O-95% MeCN, скорость потока увеличили до 4,5 мл/мин; 3,01-3,50 мин,держали при 5% H2O-95% MeCN; 3,50-3,60 мин, вернули к 95% H2O-5% MeCN, скорость потока уменьшили до 3,5 мл/мин; 3,60-3,90 мин, держали при 95% Н 2 О-5% MeCN; 3,90-4,00 мин, держали при 95%H2O-5% MeCN, скорость потока уменьшили до 2,5 мл/мин. 1 Н ЯМР-спектроскопия: Спектры были получены на спектрометре Bruker Avance III на частоте 400 МГц, применяя остаточный недейтерированный растворитель в качестве образца. Динамическая паровая сорбция. Графики были получены с применением систем поверхностных измерений динамической паровой сорбции модели DVS-1, используя около 10 мг образца. Изменение массы записали с учетом влажности воздуха при 25 С и определили, применяя следующие параметры: сушка: 60 мин под сухим азотом; равновесие: 60 мин/шаг; интервал данных: 0,05% или 2,0 мин. Точки измерения относительной влажности[RH %] были следующими: первый набор: 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 95, 90, 80, 70, 60, 50, 40, 30, 20, 10, 5; второй набор: 10, 20, 30, 40, 50, 60, 70, 80, 90, 95, 90, 80, 70, 60, 50, 40, 30, 20, 10, 5, 0. Порошковая рентгеновская дифракция. Графики были получены на дифрактометре PANalytical (Philips) X'PertPRO MPD, оснащенном CuLFF рентгеновской трубкой (45 кВ, 40 мА; Брэгг-Брентано; вращательная установка), и были получены с применением CuK излучения при следующих условиях измерения: режим сканирования: непрерывный; диапазон сканирования: от 3 до 50 2; размер шага: 0,02/шаг; время подсчета: 30 с/шаг; время поворота вращателя: 1 с; путь падения луча: программная расходимость щели: 15 мм; щель Соллера: 0,04 рад; лучевой шаблон: 15 мм; промежуточная щель: 1; ножевой луч: +; дифрагированный путь луча: длинный промежуточный щит: +; щель Соллера: 0,04 рад;Ni фильтр: +; детектор: X'Celerator. Образцы готовили путем нанесения на держатель образца с нулевым фоном. Инфракрасная спектроскопия. Микрозатухающее общее отражение (microATR) было использовано и образец анализировали,применяя подходящее microATR-комплектующее и следующие условия измерения: аппарат: Thermo Nexus 670 FTIR спектрометр; число сканирований: 32; разрешение: 1 см-1; диапазон длин волн: 4000-400 см-1; детектор: DTGS с окнами из KBr; лучерасщепитель: Ge на KBr; микро-ATR-комплектующее: Harrick Split Pea с кристаллом Si. Дифференциальная сканирующая калориметрия. Данные были собраны на TA-Instruments Q1000 MTDSC, оборудованном блоком охлаждения RCS. Как правило, 3 мг каждого соединения в стандартной алюминиевой ТА-Instrument кювете для образцов нагревали при 10 С/мин от 25 до 300 С. Продувку азотом при 50 мл/мин поддерживали над образцом. Термогравиметрический анализ. Данные были собраны на термогравиметре TA-Instruments Q500. Как правило, 10 мг каждого образца переносили в предварительно взвешенную алюминиевую кювету и нагревали при 20 С/мин от окружающей температуры до 300 С или 80% [мас./мас.], если не указано иное. Химическая стабильность с помощью ВЭЖХ. Анализы были выполнены на колонке Waters Xbridge C18 (3,0150 мм; 3,5 мкм), применяя следующие условия работы: температура колонки: 40 С; температура образца: 5 С; скорость потока: 0,45 мл/мин; объем впрыска: 7 мкл; УФ-детектирование при 260 нм; состав подвижной фазы, содержащий фазу А: 10 мМ ацетат аммония + 0,1 об.% трифторуксусная кислота в воде и фазу В: ацетонитрил, применяя градиент, определенный параметрами ниже (табл. 2). Таблица 2 Условия градиента для изучения химической стабильности с помощью ВЭЖХ Экспериментальные методы для биологического испытания. Анализы ингибирования ферментов. Связывающие активности фермента киназы с соединениями, раскрытыми в данном документе, были определены с применением патентованного анализа, который измеряет направленное на активный сайт конкурентное связывание с иммобилизованным лигандом (Fabian, M.A. et al., Nature Biotechnol.,2005, 23:329-336). Эти анализы были проведены DiscoverX (formerly Ambit; San Diego, CA). Значение Kd(значение константы диссоциации) рассчитывали как индекс сродства этих соединений к каждой киназе. Анализы ингибирования ферментов. Активности по ингибированию ферментов у соединений, раскрытых в данном документе, были определены ФРПЭ с применением синтетических пептидов, помеченных как донорными, так и акцепторными флуорофорами (Z-LYTE, Invitrogen Ltd., Paisley, UK). Ингибирование фермента р 38 MAPK. Ингибирующие активности испытуемых соединений против р 38 MAPK-изоформы (MAPK14: Invitrogen) были оценены косвенно, путем определения уровня активации/фосфорилирования нижестоящей молекулы, MAPKAP-K2. Белок р 38 MAPK (80 нг/мл, 2,5 мкл) смешивали с испытуемым соединением (2,5 мкл на каждый 4, 0,4, 0,04 или 0,004 мкг/мл) в течение 2 ч при комнатной температуре. Смешанный раствор (2,5 мкл) р 38 неактивной мишени MAPKAP-K2 (Invitrogen, 600 нг/мл) и белка ФРПЭ(8 мкМ, мишень фосфорилирования для MAPKAP-K2) затем добавили и киназную реакцию инициировали добавлением АТФ (40 мкМ, 2,5 мкл). Смесь инкубировали в течение 1 ч при комнатной температуре. Проявляющий реагент (протеаза, 5 мкл) добавили за 1 ч до детекции во флуоресцентном микропланшетном ридере (Varioskan Flash, ThermoFisher Scientific). Ингибирование фермента р 38 MAPK-. Ингибирующие активности соединений по изобретению против р 38 MAPK- (MAPK12: Invitrogen),были оценены аналогичным образом тому, как описано выше в данном документе. Фермент (8 00 нг/мл,2,5 мкл) инкубировали с истыпуемым соединением (2,5 мкл на каждый 4 мкг/мл, 0,4 мкг/мл, 0,04 мкг/мл или 0,004 мкг/мл) в течение 2 ч при комнатной температуре. Белки ФРПЭ (8 мкМ, 2,5 мкл), и соответствующий раствор АТФ (2,5 мкл, 400 мкМ) затем добавили к ферментам/смесям соединений и инкубировали в течение 1 ч. Проявляющий реагент (протеаза, 5 мкл) добавили за 1 ч до детекции во флуоресцентном микропланшетном ридере (Varioskan Flash, ThermoFisher Scientific). Ингибирование ферментов c-Src и Syk. Ингибирующие активности соединений по изобретению против c-Src и Syk ферментов (Invitrogen) были оценены аналогичным образом тому, как описано выше в данном документе. Соответствующий фермент (3000 или 2000 нг/мл, соответственно, 2,5 мкл) инкубировали с испытуемым соединением (либо 4, 0,4, 0,04 или 0,004 мкг/мл, 2,5 мкл каждый) в течение 2 ч при комнатной температуре. Белки ФРПЭ(8 мкМ, 2,5 мкл) и соответствующие растворы АТФ (2,5 мкл, 800 мкМ для c-Src и 60 мкМ АТФ для Syk) затем добавили к ферментам/смесям соединений и инкубировали в течение 1 ч. Проявляющий реагент(протеаза, 5 мкл) добавили за 1 ч до детекции во флуоресцентном микропланшетном ридере (VarioskanFlash, ThermoFisher Scientific). Ингибирование фермента GSK3. Ингибирующие активности испытуемых соединений против фермента GSK3-изоформы(Invitrogen) были оценены путем определения уровня активации/фосфорилирования белка-мишени. Белок GSK3 (500 нг/мл, 2,5 мкл) смешивали с тестируемым соединением (2,5 мкл на каждый 4, 0,4, 0,04 или 0,004 мкг/мл) в течение 2 ч при комнатной температуре. Белок ФРПЭ (8 мкМ, 2,5 мкл), который является мишенью фосфорилирования для GSK3, и АТФ (40 мкМ, 2,5 мкл) затем добавили к ферменту/смеси соединений и полученную смесь инкубировали в течение 1 ч. Проявляющий реагент (протеаза,5 мкл) добавили за 1 ч до детекции во флуоресцентном микропланшетном ридере (Varioskan Flash,ThermoFisher Scientific). Во всех случаях сайт-специфическая протеаза расщепляет только нефосфорилированный пептид и устраняет сигнал ФРПЭ. Уровни фосфорилирования каждой реакции рассчитали, применяя отношение эмиссии кумарина (донор) к эмиссии флуоресцеина (акцептор), для которых низкие отношения указывают на высокий уровень фосфорилирования, а высокие отношения указывают на низкие уровни фосфорилирования. Процентное ингибирование каждой реакции вычисляли по отношению к не- 16023650 ингибированному контролю и 50%-ной ингибирующей концентрации (значение IC50), затем рассчитали из кривой концентрация-ответ. Клеточные анализы. ЛПС-индуцированное TNF/IL-8 высвобождение в d-U937 клетках.U937 клетки, моноцитарную линию клеток человека, дифференцировали в клетки типа макрофагов путем инкубации с РМА (100 нг/мл) в течение 48-72 ч. Клетки предварительно инкубировали с конечными концентрациями испытуемого соединения в течение 2 ч, а затем стимулировали ЛПС (0,1 мкг/мл; из E.coli: 0111:B4, Sigma) в течение 4 ч. Супернатант собирали для определения концентраций TNF иIL-8 методом сэндвич-ELISA (Duo-set, RD systems). Ингибирование продукции TNF рассчитывали как процент от того, что достигнуто 10 мкг/мл BIRB796 при каждой концентрации испытуемого соединения, по сравнению с контролем-носителем. Относительную 50%-ную эффективную концентрациюIL-8 было рассчитано при каждой концентрации испытуемого соединения по сравнению с контролемносителем. 50%-ную ингибирующую концентрацию (IC50) определяли по полученной в результате кривой концентрация-ответ. ЛПС-индуцированное TNF высвобождение в ТНР-1 клетках. ТНР-1 клетки, моноцитарную линию клеток человека, стимулировали 3 мкг/мл ЛПС (из E.coli: 0111:В 4, Sigma) в течение 4 ч, и супернатант собирали для определения концентрации TNF методом сэндвич-ELISA (Duo-set, RD systems). Ингибирование продукции TNF рассчитывали при каждой концентрации испытуемого соединения, по сравнению с контролем-носителем. 50%-ную ингибирующую концентрацию (IC50) определяли по полученной в результате кривой концентрация-ответ.Poly I:C был использован в этих исследованиях в качестве простой имитации вирусной РНК.Diego, CA и Invitrogen, Carlsbad, CA соответственно) трансфицировали в клетки BEAS2B (клетки бронхиального эпителия человека, АТСС). Клетки предварительно инкубировали с конечными концентрациями испытуемых соединений в течение 2 ч и уровень экспрессии ICAM-1 на клеточной поверхности был определен методом клеточного ELISA. В момент времени 18 ч после трансфекции Poly I:C клетки фиксировали 4% формальдегида в PBS (100 мкл), а затем эндогенную пероксидазу подавляли путем добавления промывного буфера (100 мкл, 0,05% Tween в PBS: PBS-Tween), содержащего 0,1%-ный азид натрия и 1%-ную перекись водорода. Клетки промывали промывным буфером (3200 мкл) и после блокировки ячеек 5%-ным молоком в PBS-Tween (100 мкл) в течение 1 ч клетки инкубировали с античеловеческим ICAM-1 антителом (50 мкл; Cell Signaling Technology, Danvers, MA) в 1%-ным БСА PBS в течение ночи при 4 С. Клетки промывали PBS-Tween (3200 мкл) и инкубировали со вторичным антителом (100 мкл;HRP-конъюгированный антикроличий IgG, Dako, Ltd., Glostrup, Дания). Клетки затем инкубировали с подложки (50 мкл) в течение 2-20 мин с последующим добавлением стоп-раствора (50 мкл, 1 н. H2SO4). Сигнал ICAM-1 был детектирован путем считывания и считывания поглощения при 450 нм против контрольной длины волны 655 нм, применяя спектрофотометр. Клетки затем промыли PBS-Tween(3200 мкл) и общее число клеток в каждой лунке определили путем считывания поглощенния при 595 нм после окрашивания кристаллическим фиолетовым (50 мкл 2%-ного раствора в PBS) и элюирования 1%-ным раствором SDS (100 мкл) в дистиллированной воде. Измеренные OD450-655 показания были скорректированы для числа клеток путем деления показания OD595 в каждой лунке. Ингибирование экспрессии ICAM-1 рассчитывали при каждой концентрации испытуемого соединения по сравнению с контролем-носителем. 50%-ную ингибирующую концентрацию (IC50) определяли по полученной в результате кривой концентрация-ответ. Анализ клеточного митоза. Мононуклеарные клетки периферической крови (МКПК) от здоровых субъектов отделили от цельной крови (Quintiles, London, UK), используя градиент плотности (Histopaque-1077, Sigma-Aldrich,Poole, UK). МКПК (3 млн клеток на образец) затем последовательно обработали 2% ФГА (Sigma-Aldrich,Poole, UK) в течение 48 ч с последующим 20-часовым воздействием различными концентрациями испытуемых соединений. За 2 ч до сбора МНПК обработали демеколцином (0,1 мкг/мл; Invitrogen, Paisley,UK), чтобы остановить клетки в метафазе. Для наблюдения митотических клеток МНПК пермеабилизировали и фиксировали добавлением Intraprep (50 мкл; Beckman Coulter, France), окрашивали антифосфогистоном 3 (0,26 нг/л; 9701; Cell Signalling, Danvers, MA) и пропидия йодидом (1 мг/мл; Sigma-Aldrich,Poole, UK), как ранее описано (Muehlbauer P.A. and Schuler M.J., Mutation Research, 2003, 537:117-130). Флуоресценцию наблюдали, используя проточный цитометр ATTUNE (Invitrogen, Paisley, UK), выделяя окна для лимфоцитов. Процентное ингибирования митоза рассчитывали для каждой обработки относительно обработки носителем (0,5% DMSO). Индуцированное риновирусом высвобождение IL-8 и экспрессия ICAM-1. Риновирус человека РВЧ 16 был получен из американской коллекции типовых культур (Manassas,VA). Исходные вирусные материалы получили путем инфицирования клеток Hela риновирусом человека, пока 80% клеток не подверглось цитопатическому воздействию. Клетки BEAS2B инфицировали риновирусом человека при 5 MOI и инкубировали в течение 2 ч при 33 С при осторожном встряхивании для того, чтобы способствовать абсорбции. Затем клетки промылиPBS, добавили свежую среду и клетки инкубировали еще в течение 72 ч. Супернатант собирали для количественного определения концентрации IL-8, применяя исследовательский комплект DuoSet ELISA(RD systems, Minneapolis, MN). Уровень экспрессии ICAM-1 на клеточной поверхности был определен методом клеточного ELISA. При 72 ч после заражения клетки фиксировали 4%-ным формальдегидом в PBS. После подавления эндогенной пероксидазы добавлением 0,1%-ного азида натрия и 1%-ной перекиси водорода лунки промыли промывным буфером (0,05% Tween в PBS: PBS-Tween). После блокировки лунки 5%-ным молоком в(HRP-конъюгированный антикроличий IgG, Dako, Ltd). Сигнал ICAM-1 был детектирован путем добавления субстрата и считывания при 450 нм против контрольной длины волны 655 нм, применяя спектрофотометр. Затем лунки промыли PBS-Tween и общее число клеток в каждой лунке определили путем считывания поглощения при 595 нм после окрашивания кристаллическим фиолетовым и элюирования 1%-ным раствором SDS. Измеренные OD595 показания были скорректированы для числа клеток путем деления показания OD595 в каждой лунке. Соединения были добавлены за 2 ч до инфицирования РВЧ и 2 ч после инфицирования, когда неинфицированный РВЧ отмыли. Оценка РВЧ 16-индуцированной СРЕ в MRC5 клетках. Клетки MRC-5 инфицировали РВЧ 16 при 1 MOI в DMEM, содержащей 5% ФТС и 1,5 мМ MgCl2, с последующей инкубацией в течение 1 ч при 33 С для того, чтобы способствовать абсорбции. Супернатанты откачали, а затем добавили свежую среду с последующей инкубацией в течение 4 дней. Где было нужно, клетки предварительно инкубировали с соединением или DMSO в течение 2 ч и соединения иDMSO добавили еще раз после отмывания вируса. Супернатанты откачали и инкубировали с раствором метиленового синего (100 мкл, 2% формальдегида, 10% метанола и 0,175% метиленового синего) в течение 2 ч при комнатной температуре. После промывки 1%-ный SDS в дистиллированной воде (100 мкл) добавляли в каждую лунку и планшеты слегка встряхивали за 1-2 ч до считывания поглощения при 660 нм. Рассчитали процент ингибирования для каждой лунки. Значение IC50 определяли по кривой концентрация-ответ, созданной серийными разбавлениями испытуемых соединений.In vitro РСВ-вирусная нагрузка в первичных клетках бронхиального эпителия. Нормальные человеческие клетки эпителия бронхов (НЧКЭБ), выращенные в 96-луночных планшетах, затем инфицировали РСВ А 2 (Strain А 2, НРА, Salisbury, UK) при MOI 0,001 в среде LHC8:RPM11640 (50:50), содержащей 15 мМ хлорид магния, и инкубировали 1 ч при 37 С для абсорбции. Затем клетки промыли PBS (3200 мкл), добавили свежую среду (200 мкл) и инкубирование продолжили в течение 4 дней. Где было нужно, клетки предварительно инкубировали с соединением или DMSO в течение 2 ч и затем добавляли снова после отмывания вируса. Клетки фиксировали 4%-ным формальдегидом в растворе PBS (50 мкл) в течение 20 мин, промывали промывочным буфером (3200 мкл; PBS включает 0,5%-ный БСА и 0,05%-ный Tween-20) и инкубировали с блокирующим раствором (5%-ное конденсированное молоко в PBS) в течение 1 ч. Затем клетки промыли промывным буфером (3200 мкл) и инкубировали в течение 1 ч при комнатной температуре с анти-РСВ (2F7) F-синтезированного белка антителом (40 мкл; мышиные моноклональные, lot 798760,Cat. No. ab43812, Abcam) в 5%-ном БСА в PBS-Tween). После промывки клетки инкубировали сHRP-конъюгированным раствором вторичных антител (50 мкл) в 5%-ном БСА в PBS-Tween(lot 00053170, Cat.No. P0447, Dako), а затем субстрат ТМВ (50 мкл; упаковка субстратного реагента,lot 269472, Cat. No. DY999, RD Systems, Inc) был добавлен. Эту реакцию остановили добавлением 2 н.H2SO4 (50 мкл) и полученный сигнал был определен колориметрически (оптическая плотность: 450 нм длина волны по сравнению с 655 нм) в микропланшетном ридере (Varioskan Flash, ThermoFisherScientific). Затем клетки промыли и 2,5%-ный раствор кристаллического фиолетового (50 мкл; lot 8656,Cat. No. PL7000, Pro-Lab Diagnostics) использовали в течение 30 мин. После промывки промывочным буфером 1%-ный SDS в дистиллированной воде (100 мкл) добавляли в каждую лунку и планшеты слегка встряхивали на шейкере за 1 ч до считывания поглощения при 595 нм. Измеренные OD450-655 показания были скорректированы для числа клеток путем деления показания OD450-655 на показания OD595. Процентное ингибирование для каждой лунки митоза рассчитали и значение IC50 рассчитали по кривой концентрация-ответ, созданной серийными разбавлениями испытуемых соединений. Влияние испытуемых соединений на жизнеспособность клеток: МТТ анализ. Дифференцированные клетки U937 предварительно инкубировали с каждым испытуемым соединением (конечная концентрация 1 или 10 мкг/мл в 200 мкл среды, указанной ниже), по двум протоколам: первый в течение 4 ч в 5%-ной ФТС RPMI1640 среде и второй в 10%-ной ФТС RPMI1640 среде в течение 24 ч. Супернатант заменили новой средой (200 мкл) и исходный раствор МТТ (10 мкл, 5 мг/мл) добавили в каждую лунку. После инкубации в течение 1 ч среду удалили, DMSO (200 мкл) добавили в каждую лунку и планшеты слегка встряхивали в течение 1 ч до считывания поглощения при 550 нм. Процентное отношение потери жизнеспособности клеток рассчитали для каждой лунки по отношению к обработке носителем (0,5% DMSO). Следовательно, заметное увеличение жизнеспособности клеток благодаря лекарственной обработке по отношению к носителю приведено в таблице в виде отрицательного процентного отношения. Продукция цитокинов у макрофагов в мокроте при ХОБЛ. Пациентам с ХОБЛ делали ингаляцию с небулизированным раствором 3%-ного (мас./об.) гипертонического солевого раствора с помощью ультразвукового небулайзера (Devilbiss, Carthage, МО) с количеством воздуха, обмениваемым за одно дыхание, в течение 5 мин. Эту процедуру повторяли максимум три раза, пока достаточно мокроты не было получено. Образцы мокроты гомогенизировали и энергично перемешивали с помощью вихревой мешалки в 0,02%-ном по объему растворе дитиотреитола (DTT). Образцы ресуспендировали в PBS (40 мл) с последующим центрифугированием при 1500 об/мин при 4 С в течение 10 мин, чтобы получить осадки клеток мокроты. Осадки дважды промывали PBS (40 мл). Клетки мокроты затем ресуспендировали в макрофагальной бессывороточной среде (macrophage-SFM,Life technologies, Paisley, UK; для получения 2106/лунку в 24-луночном планшете), содержащей 20 Ед/мл пенициллина, 0,02 мг/мл стрептомицина и 5 мкг/мл амфотерицина В, и высевали на верхней границе 96-луночного планшета с последующей инкубацией в течение 2 ч при 37 С и 5% СО 2, чтобы позволить макрофагам прикрепиться к нижней части планшета. Клетки на планшете промыли свежейmacrophage-SFM (200 мкл/лунку), чтобы удалить нейтрофилы и другие контаминированные клетки. Закрепленные клетки (в основном макрофаги мокроты) на планшете использовали для дальнейшего анализа. Индукция и изоляция мокроты были проведены в Quintiles Drug Research Unit в Guys Hospital, и одобрение комиссии по этике и письменное информированное согласие было получено Quintiles. В случае необходимости, 1 мкл раствора, содержащего либо испытуемое соединение, либо соответствующее вещество в указанных концентрациях, или в качестве альтернативы 1 мкл DMSO в качестве контроля-носителя был добавлен в каждую лунку (200 мкл в среде) и клетки инкубировали в течение 2 ч. Клетки стимулировали с помощью раствора ЛПС (50 мкл, конечная концентрация: 1 мкг/мл) и инкубировали в течение 4 ч при 37 С и 5% СО 2. Затем супернатант собирали и хранили при -80 С. КомплектыMillipore Luminex использовали для измерения четырех аналитов. После разморозки супернатанта магнитные шарики, покрытые антителами, мультиплексировали и инкубировали в 96-ячеичном планшете со стандартом, основным раствором или соответствующим объемом образца, в течение ночи при встряхивании при 4 С. После двукратной промывки 200 мкл промывочного буфера, предоставленного в комплекте, на лунку, применяя промыватель с помощью магнитных частиц, шарики инкубировали в течение 1 ч при комнатной температуре с 25 мкл конъюгированного с биотином раствора антител, предоставленным в комплекте, при встряхивании. Раствор стрептавидина добавляли в течение 30 мин при встряхивании при комнатной температуре. После промывки 200 мкл промывочного буфера на лунку шарики ресуспендировали в проточной жидкости (150 мкл) и немедленно анализировали. Уровень каждого аналита в супернатанте рассчитали с использованием программного обеспечения Xcel Fit с помощью уравнения с 4 или 5 параметрами, применяя для каждого стандартную кривую. Ингибирования каждой продукции цитокинов были рассчитаны при каждой концентрации по сравнению с контролем-носителем. ЗначенияIC50 определили по кривым концентрация-ответ, применяя XL-Fit (idbs, Guildford, UK). Продукция цитокинов в первичных клетках бронхиального эпителия при ХОБЛ. Первичные клетки эпителия дыхательных путей, полученные от пациентов с ХОБЛ, приобрели уAsterand (Royston, UK) и поддерживали в среде для роста клеток бронхиального эпителия, которую приготовили путем смешивания LHC8 (Invitrogen) (500 мл) с LHC9 (Invitrogen) (500 мл) и 3 мкл раствора ретиноевой кислоты (5 мг/мл в чистом DMSO). Среду удалили путем аспирации и свежий BEGM(200 мкл) добавили в каждую лунку. Где необходимо, добавили 1 мкл раствора испытуемого соединения в указанных концентрациях или 1 мкл DMSO в качестве контроля-носителя добавили, клетки инкубировали в течение 2 ч. Клетки стимулировали TNF (50 мкл; конечная концентрация 50 нг/мл) и затем инкубировали в течение 4 ч при 37 С и 5% СО 2. Супернатант затем собирали и хранили при -20 С. Уровни IL-6 и IL-8 определяли методом ELISA, применяя RD Systems человеческий IL-6 и IL-8DuoSet наборы для ELISA. Ингибирование продукции IL-6 и IL-8 рассчитали при каждой концентрации по сравнению с контролем-носителем. 50%-ную ингибирующую концентрацию (IC50) определили по кривым концентрация-ответ, применяя XL-Fit (idbs, Guildford, UK).In vivo скрининг: фармакодинамика и противовоспалительная активность. ЛПС-индуцированное накопление нейтрофилов у мышей. Неголодавшим мышам линии BALB/C вводили дозу по интратрахеальному пути либо с носителем,либо с испытуемым веществом в указанные моменты времени (в пределах 2-8 ч) до стимуляции воспалительного ответа путем приложения ЛПС. При Т=0 мышей поместили в затравочную камеру и подвергли ЛПС (7,0 мл, раствор 0,5 мг/мл в PBS) в течение 30 мин. Еще через 8 ч животных анестезировали, их трахеи канюлировали и ЖБАЛ экстрагировали путем инфузии, а затем извлекли из их легких 1,0 мл PBS через трахеальный катетер. Общий и дифференциальный подсчеты белых клеток в ЖБАЛ измерили с помощью гемоцитометра Neubaur. Мазки-цитоспины образцов ЖБАЛ получили путем центрифугирования при 200 об/мин в течение 5 мин при комнатной температуре и окрасили, применяя систему окраскиDiffQuik (Dade Behring). Клетки подсчитывали, используя масляную иммерсионную микроскопию. Данные по численности нейтрофилов в ЖБАЛ показаны как среднее значениеS.E.M. (стандартная ошибка среднего). Процент ингибирования накопления нейтрофилов был рассчитан для каждой обработки по отношению к обработке носителем. Модель сигаретного дыма. Мышей линии A/J (самцы, возраст 5 недель) подвергли воздействию сигаретного дыма (4%-ный сигаретный дым, разбавленный воздухом) в течение 30 мин/день в течение 11 дней, используя экспериментальную систему ингаляции табачного дыма для мелких животных (модель SIS-CS; Sibata ScientificTechnology, Tokyo, Japan). Испытуемые вещества вводили интраназально (35 мкл раствора в 50%DMSO/PBS) один раз в день в течение 3 дней после окончательного воздействия сигаретного дыма. На 12-й час после последней дозы каждое из животных анестезировали, его трахею канюлировали и ЖБАЛ собирали. Числа альвеолярных макрофагов и нейтрофилов определили с помощью анализа FACS(EPICS ALTRA II, Beckman Coulter, Inc., Fullerton, CA, USA), используя антимышиное МОМА 2 антитело (макрофаг) или антимышиное 7/4 антитело (нейтрофил). ЖБАЛ центрифугировали и супернатант собирали. Уровень кератиноцитового хемоаттрактанта (KC; CXCL1) в ЖБАЛ определили количественно, используя комплект Quentikine для мышей KC ELISA (RD systems, Inc, Minneapolis, MN, USA). Пример 1. Получение соединения (I). Следующие промежуточные соединения, применяемые для получения соединения (I) по настоящему изобретению, были описаны ранее и были получены с применением методик, содержащихся в ссылках, приведенных ниже (табл. 3). Таблица 3 Ранее описанные промежуточные соединения К продуваемому азотом раствору смеси промежуточного соединения В (50,0 г, 184 ммоль) и анилина (42,0 мл, 460 ммоль) в THF (200 мл) добавили pTSA (17,5 г, 92,0 ммоль) в одной порции. Реакционную смесь нагревали до 70 С в течение 1,5 ч, в течение которых она образовала осадок. Смесь охладили до комнатной температуры и разбавили THF (200 мл). Осадок собрали фильтрованием, промыли THF(2100 мл), а затем суспендировали в гетерогенной смеси DCM (600 мл) и водн. NaOH (2 М, 200 мл) и интенсивно перемешивали в течение 1 ч, в течение которого суспендированные твердые частицы растворились. Слои разделили и водный слой экстрагировали DCM (200 мл). Экстракты DCM объединили, высушили и упарили в вакууме. Остаток растирали с эфиром (150 мл) и полученное в результате твердое вещество промывали эфиром (250 мл) для получения промежуточного соединения С в виде грязно-белого твердого вещества (26 г, 43%). Гетерогенную смесь раствора Na2CO3 (3,84 г, 36 ммоль) в воде (42 мл) и промежуточного соединения А (10,5 г, 45,7 ммоль) в изопропилацетате (130 мл, 1,082 моль) энергично перемешивали при комнатной температуре в течение 5 мин и затем обработали фенилкарбонохлоридатом (5,77 мл, 45,7 ммоль). Перемешивание смеси продолжали в течение еще 4 ч, после чего слои разделили. Органическую фазу добавили к раствору промежуточного соединения С (10,0 г, 30,5 ммоль) и триэтиламина (423 мкл,3,05 ммоль) в изопропилацетате (60 мл, 511 ммоль). Реакционную смесь нагревали до 48 С в течение 1 ч,затем разбавили изопропилацетатом (190 мл) и охлаждали до комнатной температуры в течение еще 18 ч, в течение которых образовался осадок. Осадок отделили фильтрованием, промыли изопропилацетатом, а затем сушили в вакууме при 40 С для получения указанного в заголовке соединения (I) в виде белого твердого вещества (безводное свободное основание, полиморфная форма А) (16,5 г, 92%).(1 Н, д), 8,10 (1 Н, д), 8,40 (1 Н, д), 8,77 (1 Н, с), 9,16 (1H, уш.с), 9,50 (1H, уш.с). Пример 2. Краткое изложение результатов скрининга in vitro и in vivo.In vitro профиль соединения (I), описанного в данном документе, как определено с использованием протоколов, описанных выше, представлены ниже (табл. 4a-4f) по сравнению со структурно родственным Эталонным соединением, которое представляет собой N-(4-(4-(3-(3-трет-бутил-1-п-толил-1 Нпиразол-5-ил)уреидо)нафталин-1-илокси)пиридин-2-ил)-2-метоксиацетамид, который ранее был описан как мощный противовоспалительный агент с противовирусной активностью (Ito, K. et al.,WO 2010/112936, PCT/GB2010/050575, 7 октября 2010 г. and Ito, K. et al., WO 2010/067130,PCT/GB2009/051702, 17 июня 2010 г.). Соединение по настоящему изобретению демонстрирует очень похожий профиль ингибирования относительно эталонного соединения в диапазоне анализов киназных ферментов с заметным исключением ингибирующей активности соединения (I) в отношении фермента GSKS, что значительно слабее,чем у эталонного соединения (табл. 4 а). Таблица 4 а р 38 MAPK, c-Src, Syk и GSK3 ферментные профили соединения (I) Профиль связывания киназы соединения (I) по настоящему изобретению также сравнивали с профилем эталонного соединения против р 38 MAPK, HCK, c-Src, Syk и GSK3/. Соединение (I) показало очень разный фенотип, демонстрируя глубокое ингибирование связывания с р 38 MAPK, HCK, c-SRC иSyk киназами, без существенного эффекта в отношении GSK3 (табл. 4b). Таблица 4b Сравнение профиля связывания фермента соединения (I) с эталонным соединением Соединение по настоящему изобретению демонстрирует профиль, сходный с профилем эталонного соединения при клеточных анализах, которые обнаруживают противовоспалительные свойства против эндотоксинов опосредованного высвобождения как TNF, так и IL-8 (табл. 4 с). Профили соединений также подобны в клеточных системах, измеряющих их воздействия на репликацию респираторного вируса (РВЧ-индуцированный ICAM-1 и СРЕ-экспрессия и РСВ-стимулированная экспрессия F-белка), так же как и вирус-индуцированное воспаление (РВЧ вызвал высвобождение IL-8; табл. 4d). Таблица 4 с Ингибирование ЛПС-индуцированного высвобождения Таблица 4d Влияние соединения (I) на распространение РВЧ-16 (СРЕ) и воспаление (экспрессия ICAM-1 и высвобождение IL-8) и на распространение РСВ (экспрессия F-белка) Соединение по настоящему изобретению демонстрировало более высокую эффективность при провоспалительной продукции цитокинов в макрофагах мокроты и клетках бронхиального эпителия, полученных от пациентов с ХОБЛ, которые были в значительной степени не восприимчивы к флутиказон пропионату, кортикостероиду (табл. 4 е). Таблица 4 е Влияние соединения (I) и флутиказона пропионата на провоспалительное высвобождение цитокинов в макрофагах мокроты и клетке бронхиального эпителия, полученных от пациентов с ХОБЛ Тем не менее, преимущественно соединение (I) показывает заметно меньшую активность в анализируемых системах, которые измеряют его воздействие на жизнеспособность клеток и клеточное деление(митоз), что указывает на то, что это соединение вероятно обладает превосходящим терапевтическим индексом по сравнению с эталонным соединением (табл. 4f). Таблица 4f Влияние соединения (I) на жизнеспособность клеток и клеточное деление 1 Исследование жизнеспособности клеток: -ve и +ve указывают значение, находящееся ниже и выше соответственно, никакого существенного порогового эффекта, определенного как 30%-ное ингибирование при 1 мкг/мл в момент времени, не указано. Воздействие на мышей соединением (I), как было обнаружено, вызывает дозозависимое ингибирование ЛПС-индуцированного накопления нейтрофилов, и время протекания эксперимента показало, что лекарственное средство имело большую продолжительность действия (табл. 5). Таблица 5 Влияние воздействия соединения (I) на ЛПС-индуцированную нейтрофилию дыхательных путей у мышей Результат воздействия соединения (I) на накопление макрофагов и нейтрофилов в ЖБАЛ на модели сигаретного дыма с мышами был исследован (табл. 6 а). Модель сигаретного дыма, применявшаяся для этого исследования, как сообщается, представляет собой не восприимчивую к кортикостероидам систему(Medicherla S. et al., J. Pharmacol. Exp. Ther., 2008, 324(3):921-9), и было подтверждено, что флутиказона пропионат не ингибирует накопление ни нейтрофилов, ни макрофагов в дыхательных путях при 1,75 мкг/мышь (35 мкг, дважды в день, интраназально), при той же дозе, при которой произведено 80%-ное ингибирование ЛПС-индуцированное накопление нейтрофилов. Воздействие на мышей соединением (I), как было обнаружено, вызывает дозозависимое ингибирование накопления как макрофагов, так и нейтрофилов в ЖБАЛ, индуцированного сигаретным дымом. Таблица 6 а Влияние воздействия соединения (I) в модели табачного дыма на мышах Данные для чисел клеток показаны как среднееSEM, N=5. Воздействие на мышей соединением (I) также ингибирует индуцированную сигаретным дымом продукцию CXCL1 (KC) в ЖБАЛ дозозависимым образом (табл. 6b). Таблица 6b Влияние воздействия соединения (I) на высвобождение CXCL1 (KC) в ЖБАЛ в модели табачного дыма на мышах Данные для уровня CXCL показаны как среднееSEM, N=5. Таким образом, эти результаты показывают, что соединение (I) обладает противовоспалительными свойствами, аналогичными эталонному соединению, описанному выше, и преимущественно связанными с превосходящим терапевтическим индексом. Пример 3. Получение соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В. Соединение (I) (398 г, в полиморфной форме А) растворили в ацетоне (3,98 л) и раствор нагрели до 50 С. NORIT A SUPRA (19,9 г, активированный уголь) и диатомит, флюсованный-прокаленный (3,98 г; фильтрующий агент), затем добавили и смесь нагревали с обратным холодильником (56 С) в течение 15 мин. Смесь фильтровали и полученное в результате твердое вещество промывали ацетоном (100 мл). Объединенные фильтрат и промывной ацетон нагревали с обратным холодильником (56 С) и 900 мл растворителя удалили перегонкой при атмосферном давлении при 56 С. Смесь охладили до 50 С и воду(398 мл) затем добавили в течение 1 ч, пока температура поддерживалась на уровне 50 С. После дополнительных 30 мин при 50 С гетерогенную смесь охладили до 20 С в течение 6 ч и затем перемешивали при 20 С в течение 10 ч. Полученный в результате продукт фильтровали и осадок промыли ацетоном(318 мл). Продукт сушили в вакууме при 45 С в течение 20 ч для получения соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В (240,9 г, выход 60,5%). Указанный выше способ может быть дополнительно адаптирован, чтобы способствовать кристаллизации с затравкой. Пример 3 а. Получение соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В, содержащего уменьшенный остаточный растворитель. Дополнительно, соединение (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В, полученное в соответствии с процедурой, описанной выше (пример 3), или подобным методом, может быть ресуспендировано из воды, чтобы уменьшить остаточный растворитель,- 24023650 следующим образом. Соединение (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В (230 г, полученное в соответствии с примером 3) суспендировали в деионизированной воде(2,30 л) и перемешивали при 20 С в течение 4 ч. Смесь фильтровали и продукт промывали деионизированной водой (2115 мл), а затем сушили при 45 С в вакууме для получения соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В, содержащего уменьшенный остаточный растворитель (227 г, 98,7%). Пример 4. Микронизация соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В. Микронизированную кристаллическую полиморфную форму В соединения (I) в виде безводного свободного основания получали с помощью микронизирующего устройства струйной мельницы (1,5 бар с применением ручной подачи с давлением форсунки 1,5 бар) (производства Hosokawa Alpine). Распределение частиц по размерам измеряли с помощью лазерной дифракции (Malvern Mastersizer 2000S инструмент). Распределения частиц по размерам могут быть представлены с применением D10, D50 и D90 значений. Медианное значение D50 распределения частиц по размерам определяется как размер частицы в микронах, который делит распределение пополам. Измерение, полученное методом лазерной дифракции,более точно охарактеризовано как объемное распределение, и, следовательно, значение D50, полученное с помощью этой процедуры, более значимо относительно упоминаемого значение Dv50 (медиана для объемного распределения). Используемые в данном документе значения Dv относятся к распределениям частиц по размеру, измеренным с помощью лазерной дифракции. Аналогичным образом, значения D10 иD90, используемые в контексте лазерной дифракции, подразумеваются как значения Dv10 и Dv90 и относятся к размеру частиц, в результате чего 10% распределения лежит ниже значения D10 и 90% распределения лежит ниже значения D90 соответственно. Микронизированная кристаллическая полиморфная форма В соединения (I) в виде безводного свободного основания обладала следующим распределением частиц по размерам: D10 по 0,850 мкм; D50 по 1,941 мкм и D90 по 4,563 мкм. Пример 5. ПРД анализ соединения (I) в виде безводного свободного основания в твердых кристаллических полиморфных формах А и В. ПРД анализ соединения (I) в виде безводного свободного основания в твердых кристаллических полиморфных формах А и В (полиморфную форму В микронизировали, следуя методике примера 4) был проведен с применением способа, описанного в разделе "Общие методики". Полученные дифракционные рентгенограммы показаны на фиг. 1 и 2 соответственно. Обе дифракционные рентгенограммы показали пики дифракции без присутствия галогена, тем самым указывая, что оба материала являются кристаллическими. Пики и их интенсивности перечислены ниже (табл. 7 а и 7b). Таблица 7 а Характеристические ПРД пики и их интенсивности для соединения (I) в виде безводного свободного основания в твердой кристаллической форме А Таблица 7b Характеристические ПРД пики для соединения (I) в виде безводного свободного основания в твердой кристаллической форме В после микронизации Пример 6. Определение точки плавления соединения (I) в виде безводного свободного основания в твердых кристаллических полиморфных формах А и В. Точки плавления соединения (I) в виде безводного свободного основания в твердых кристаллических полиморфных формах А и В (последнее после микронизации) были получены с применением дифференциальной сканирующей калориметрии (ДСК), как описано в разделе "Общие методики". Полиморфная форма А плавилась при 191,6 С, а полиморфная форма В плавилась при 214,0 С. Из данных ДСК было подсчитано, что форма В обладала большей теплотой плавления, чем форма А. Так как форма В также обладала более высокой температурой плавления, чем форма А, это указывает, что полиморфные формы А и В монотропно связаны, это означает, что более высоко плавящаяся полиморфная форма В будет более стабильной, чем более ниже плавящаяся полиморфная форма А, при всех температурах. Таким образом, можно ожидать, что полиморфная форма В является термодинамически более стабильной, чем полиморфная форма А. Пример 7. Термический анализ соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В после микронизации. Термический анализ соединения (I) в виде безводного свободного основания в кристаллической полиморфной форме В (микронизированного) проводили с применением анализов ТГА, ДСП, ПРД,ИК-спектроскопии и ДСК, как описано в разделе "Общие методики". В случае необходимости, образец при температуре окружающей среды и относительной влажности (эталонный образец/"0 дней") сравнивали с образцами, хранившимися при различных температурах и относительных влажностях (сравнительные образцы). Термогравиметрический анализ. Эталонный образец (t=0) и сравнительные образцы, которые были подвержены до анализа различным условиям хранения, нагревали со скоростью 20 С/мин от комнатной температуры до 300 С. Кривая ТГА для контрольного образца (t=0) иллюстрируется на фиг. 3, и результаты для всех образцов приведены ниже (табл. 8). Как видно на фиг. 3, потеря массы на 0,6% наблюдалась в диапазоне температур от комнатной до 180 С, что было обусловлено испарением растворителя. Потеря массы, случившаяся выше 180 С, была обусловлена испарением и разложением продукта. При сравнении этого профиля потери массы с профилями сравнительных образцов в табл. 8 не наблюдалось никаких существенных различий. Динамическая сорбция паров. Участок изотермы ДСП для микронизированного эталонного образца показан на фиг. 4, и изменение ДСП в участке массы для микронизированного эталонного образца показано на фиг. 5. В ходе начальной стадии сушки потери массы не было зарегистрировано, и продукт не показал гигроскопичного поведения. Продукт адсорбировал до 0,4% влаги в зависимости от влажности воздуха. Продукт, как было обнаружено, полностью высыхает и остается в том же кристаллическом твердом состоянии (форма В) во время испытания, как свидетельствуют ИК-спектр, и спектр ПРД, представляет собой, по существу, тот же самый продукт до и после анализа ДСП. ПРД анализ и ИК-спектроскопия. Дифракционная рентгенограмма эталонного образца (t=0) показана на фиг. 2, а ИК-след показан на фиг. 6. Дифракционную рентгенограмму и ИК-след сравнивали с теми же для сравнительных образцов(подвергнутых воздействию различных условий хранения), и результаты приведены в табл. 8. Дифракционная рентгенограмма и ИК-след были идентичны для всех образцов. Дифференциальная сканирующая калориметрия. Эталонный образец (t=0) и сравнительные образцы, предварительно подвергнутые воздействию различных условий хранения, нагревали со скоростью 10 С/мин от 25 до 300 С. Кривая ДСК эталонного образца показана на фиг. 7, и результаты для всех образцов приведены ниже (табл. 8). Из фиг. 7 видно,что эталонный образец плавится с разложением при 214,0 С. Таблица 8 Термический анализ соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В после микронизацииRef: спектр идентичен эталонному образцу; 3 Таким образом, очевидно, что соединение (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В имеет хорошую физическую стабильность. Пример 8. ВЭЖХ анализ соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В после микронизации. Химическую стабильность соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В после микронизации определяли путем сравнения образца, содержавшегося при температуре окружающей среды и относительной влажности (эталонный образец) сравнивали с образцами, хранившимися при различных температурах и относительных влажностях, как изложено выше в данном документе (сравнительные образцы, табл. 8). Эталонный и сравнительные образцы затем анализировали методом ВЭЖХ, применяя способ, описанный в разделе "Общие методики", и по визуальному контролю. Результаты этого исследования (данные приведены в табл. 9) показывают, что соединение (I), полученное в виде безводного свободного основания в твердой кристаллической полиморфной форме В является химически стабильным, хотя наблюдалась некоторая чувствительность к свету. Таблица 9 Химическая стабильность соединения (I) в виде безводного свободного основания в твердой кристаллической полиморфной форме В после микронизации Пример 9. Получение фармацевтических составов. Примерный фармацевтический состав по изобретению будет состоять из 0,4 мас.% соединения (I) (в виде безводного свободного основания в твердой кристаллической полиморфной форме В), 98,6 мас.% лактозы моногидрата (ингаляционный сорт) и 1,0 мас.% магния стеарата, в котором мас.% всех компонентов основан на массе сухого фармацевтического состава. В описании и формуле изобретения, которые следуют, если контекст не требует иного, слово "содержать" и его вариации, такие как "содержит" и "содержащий в себе", следует понимать как значение включения указанного целого числа, стадии, группы целых чисел или группы стадий, но не исключения любого другого целого числа, стадии, группы целых чисел или группы стадий. Все патенты и патентные заявки, упомянутые в данном документе, включены путем ссылки во всей их полноте. или его фармацевтически приемлемая соль или таутомеры. 2. Соединение по п.1 в виде свободного основания. 3. Соединение по п.2 в виде безводного свободного основания в твердой кристаллической форме. 4. Соединение по п.3, где соединение формулы (I) в виде безводного свободного основания в твердой кристаллической форме характеризуется порошковой дифракционной рентгенограммой, как показано на фиг. 1 (форма А). 5. Соединение по п.3, где соединение формулы (I) в виде безводного свободного основания в твердой кристаллической форме характеризуется порошковой дифракционной рентгенограммой, имеющей один, два, три, четыре, пять, шесть или семь пиков, выбранных из (0,2) 10,3, 15,2, 17,5, 23,1, 24,6, 26,7 и 27,4 2-тета. 6. Соединение по п.3, где соединение формулы (I) в виде безводного свободного основания в твердой кристаллической форме характеризуется порошковой дифракционной рентгенограммой, как показано на фиг. 2 (форма В). 7. Соединение по п.3, где соединение формулы (I) в виде безводного свободного основания в твердой кристаллической форме характеризуется порошковой дифракционной рентгенограммой, имеющей один, два, три, четыре, пять, шесть, семь или восемь пиков, выбранных из (0,2) 3,9, 6,1, 11,8, 14,3, 16,7,18,3, 18,7 и 28,9 2-тета. 8. Фармацевтическая композиция, содержащая соединение по любому из пп.1-7 в сочетании с одним или более фармацевтически приемлемыми растворителями или носителями. 9. Применение соединения формулы (I) по любому из пп.1-7 для лечения или профилактики обострений у пациентов с хроническими заболеваниями дыхательных путей. 10. Применение соединения формулы (I) по любому из пп.1-7 для лечения или профилактики состояний, выбранных из группы: ХОБЛ, астма, кистозный фиброз, саркоидоз, идиопатический легочный фиброз, ринит, синусит, конъюнктивит, аллергический дерматит, контактный дерматит, псориаз, неспецифический язвенный колит, воспаление суставов, вторичное по отношению к ревматоидному артриту или к остеоартриту, ревматоидный артрит, панкреатит, кахексия и ингибирование роста и метастаз опухолей. 11. Применение соединения формулы (I) по любому из пп.1-7 для изготовления лекарственного средства для лечения или профилактики состояний, выбранных из группы: ХОБЛ, астма, кистозный фиброз, саркоидоз, идиопатический легочный фиброз, ринит, синусит, легочная гипертензия, конъюнктивит, аллергический дерматит, контактный дерматит, псориаз, неспецифический язвенный колит, воспаление суставов, вторичное по отношению к ревматоидному артриту или к остеоартриту, ревматоидный артрит, панкреатит, кахексия и ингибирование роста и метастаз опухолей. 12. Способ лечения состояния, выбранного из группы: ХОБЛ астма, кистозный фиброз, саркоидоз,идиопатический легочный фиброз, ринит, синусит, конъюнктивит, аллергический дерматит, контактный дерматит, псориаз, неспецифический язвенный колит, воспаление суставов, вторичное по отношению к ревматоидному артриту или к остеоартриту, ревматоидный артрит, панкреатит, кахексия и ингибирование роста и метастаз опухолей, который включает введение пациенту эффективного количества соединения формулы (I) по любому из пп.1-7. 13. Применение соединения формулы (I) по п.10 или 11, где ХОБЛ выбирают из хронического бронхита и эмфиземы, астмой является бронхиальная астма у детей, ринитом является аллергический ренит, конъюнктивитом является аллергический конъюнктивит и опухоли выбраны из немелкоклеточной карциномы легкого, карциномы молочной железы, карциномы желудка, колоректальной карциномы и злокачественной карциномы. 14. Способ по п.12, где ХОБЛ выбирают из хронического бронхита и эмфиземы, астмой является бронхиальная астма у детей, ринитом является аллергический ринит, конъюнктивитом является аллергический конъюнктивит и опухоли выбраны из немелкоклеточной карциномы легкого, карциномы молочной железы, карциномы желудка, колоректальной карциномы и злокачественной карциномы. 15. Применение соединения формулы (I) по любому из пп.1-7 для лечения или профилактики респираторных вирусных инфекций у пациентов с хроническими состояниями или у иммунокомпрометированных пациентов.
МПК / Метки
МПК: A61K 31/4155, C07D 491/10, C07D 403/12, A61K 31/506
Метки: 1-пиразолил-3-(4-((2-анилинопиримидин-4-ил)окси)нафталин-1-ил)мочевины, ингибиторы, map-киназы
Код ссылки
<a href="https://eas.patents.su/30-23650-1-pirazolil-3-4-2-anilinopirimidin-4-iloksinaftalin-1-ilmocheviny-kak-ingibitory-p38-map-kinazy.html" rel="bookmark" title="База патентов Евразийского Союза">1-пиразолил-3-(4-((2-анилинопиримидин-4-ил)окси)нафталин-1-ил)мочевины как ингибиторы p38 map-киназы</a>